Изобретение относится к области медицины, в частности к клинической иммунологии, и касается способа оценки цитотоксической активности (ЦА) лимфоцитов натуральных киллеров, (НК)-лимфоцитов, в периферической крови больных и здоровых, основанного на подсчете числа недеградированных клеток-мишеней К-562 после их контакта с НК-лимфоцитами на автоматическом счетчике и анализаторе клеток. Изобретение может быть использовано в медицинской иммунодиагностике при комплексном обследовании больных с целью выявления у них изменений цитотоксической активности лимфоцитов натуральных киллеров; его применение также возможно в лечебной практике с целью коррекции выявленных изменений этого звена иммунитета у больных с психопатологической симптоматикой и при различных соматических заболеваниях, в первую очередь злокачественных новообразованиях и заболеваниях инфекционной природы.
Известен колориметрический способ оценки ЦА НК-лимфоцитов в периферической крови, основанный на окрашивании мертвых клеток-мишеней трипановым синим или аламаром синим в результате повышения проницаемости их мембраны после контакта в цитотоксическом тесте с НК-лимфоцитами (Анфалова Т.В., Казанский Д.Б., Хромых Л.М. Бюллетень экспериментальной биологии и медицины. 2003; (9):3 56-360). Этот способ является неточным, так как при подсчете окрашенных клеток могут учитываться вместе с клетками-мишенями и погибшие клетки крови.
Известен также радиоактивный способ оценки, который основан на измерении количества радиоактивной Н-РНК в клетках-мишенях, оставшихся недеградированными после контакта в цитотоксическом тесте с НК-лимфоцитами. В качестве клеток-мишеней, адаптированных к НК, используют клетки миелолейкоза человека линии К-562, которые перед постановкой цитотоксического теста обрабатывают 3H-уридином (Рыкова М.П., Спиранде И.В., Зедгенидзе М.С. и др. Иммунология. 1981; 3: 88-90, прототип). Сущность этого способа заключается в том, что при постановке цитотоксического теста к мононуклеарным клеткам, выделенным из периферический крови больных и здоровых и состоящим из моноцитов и пула лимфоцитов, 10-15% от которого составляют НК-лимфоциты, добавляют клетки-мишени К-562, которые предварительно метят в течение часа радиоактивной меткой по 3Н-уридиному и еще в течение часа трижды отмывают от невключившейся радиоактивной метки большими объемами среды 199. После инкубации в течение 16-18 часов взвесь клеток осаждают с помощью вакуумного насоса и харвестера, предназначенного для сбора клеток методом фильтрации на фильтрах, на специальные стекловолокнистые фильтры. Фильтры высушивают в течение 6-18 часов, затем переносят во флаконы со сцинтилляционной жидкостью и оставляют еще на 6-18 часов для выхода β-частиц в жидкость. После этого подсчитывают уровень радиоактивности проб на β-счетчике.
Недостатком этого способа является длительность и сложность его проведения, а также опасность для здоровья исполнителя. А именно, оценка ЦА НК является многоэтапной, занимает по продолжительности 2-3 дня и требует применения большого количества дорогостоящих приборов и специфических материалов, таких как харвестр, вакуумный насос, β-счетчик, сцинтилляционные флаконы, стекловолокнистые фильтры, а также связана с использованием вредных для организма веществ, таких как сцинтилляционная жидкость и радиоактивная метка, для работы с которыми необходимо использование вытяжного шкафа. Кроме того, для работы с радиоактивностью необходимо разрешение санэпидстанции на оборудование специального радиоактивного блока, состоящего из отдельного помещения с вытяжным шкафом, холодильником и сейфом для хранения радиоизотопов.
Целью изобретения является упрощение способа оценки ЦА НК-лимфоцитов, а именно, уменьшение времени оценки, его стоимости и трудоемкости, а также возможность сделать его безопасным для исследователя, так как в этом случае исключается применение сцинтилляционной жидкости и радиоактивных компонентов. Отсутствие радиоактивной метки исключает также необходимость получения разрешения санэпидстанции для работы с радиоактивными веществами.
Это достигается тем, что, во-первых, в отличие от известного способа в предлагаемом способе в цитотоксическом тесте к мононуклеарным клеткам добавляют клетки-мишени К-562, не обработанные 3H-уридином и РНКазой. Во-вторых, для оценки ЦА НК-лимфоцитов используется вместо нескольких приборов только один прибор - автоматический счетчик и анализатор клеток, настроенный на выявление клеток, диаметр которых находится в диапазоне от 15 до 40 мкм. Это соответствует диаметру клеток-мишеней К-562, который превышает диаметр самых крупных клеток крови - моноцитов, диаметр которых не достигает 15 мкм. С помощью этого прибора оценивают уровень ЦА НК-лимфоцитов по числу клеток-мишеней К-562, недеградированных после контакта с НК-лимфоцитами. В-третьих, этап оценки цитотоксической активности НК занимает всего 10-15 минут вместо 2-3 дней при оценке известным способом. В-четвертых, предлагаемый способ оценки цитотоксической активности НК-лимфоцитов полностью исключает применение опасной для здоровья исследователя радиоактивной метки, в связи с чем исчезает необходимость оборудования специального радиоактивного блока.
Способ оценки цитотоксической активности НК-лимфоцитов по прототипу заключается в следующем.
1) Для постановки цитотоксического теста в качестве клеток-мишеней для НК лимфоцитов используют клетки миелолейкоза человека линии К-562 (Институт вирусологии им. Д.И. Ивановского, РАМН), поддерживаемые ин витро в среде RPMI-1640 (ФГУП «ПИПВЭ имени М.П. Чумакова РАМН), с добавлением 10% фетальной сыворотки (Defined Fetal Bovine Serum фирмы Hyclone, USA) и 10% глютамина.
2) Перед постановкой цитотоксического теста 3 мл взвеси клеток-мишеней К-562 в концентрации 1-4×106 в 1 мл среды 199 помещают в центрифужную пробирку, добавляют 0,3 мл рабочего раствора 3Н-уридина (3 мкКи/мл, удельная радиоактивность 24 Ки/мМ, Институт молекулярной генетики РАН). Клетки помещают в термостат при 37°С на один час. По истечении этого времени клетки трижды отмывают от не включившейся в них радиоактивной метки большими объемами среды 199 с помощью центрифугирования при 1100-1200 об/мин и 4°С в течение 10 мин; затем разводят до концентрации 105/мл. По времени эта процедура занимает еще один час.
3) Для деградации не включившегося в клетки-мишени К-562 3H-уридина к ним добавляют панкреатическую рибонуклеазу А (РНКазу, РЕАХИМ НПО «Биолар), которая разрезает 3'-конец неспаренных цитидиловых и уридиловых нуклеотидов, катализируя их деградацию^
4) Мононуклеарные клетки, в состав которых входят моноциты и общий пул лимфоцитов, 10-15% от которого составляют НК-лимфоциты, выделяют из периферической крови больных в градиенте плотности фиколл-верографина с уд. пл. 1,077, разводят их средой 199 (ФГУП «ПИПВЭ имени М.П. Чумакова РАМН) до концентрации 4×106/мл.
5) Постановку цитотоксического теста осуществляют в специальных 96-луночных круглодонных полистироловых планшетах, у которых объем лунки составляет 0,25 мл (завод «Медполимер», Санкт-Петербург); в лунки с опытными пробами вносят 0,05 мл среды 199, 0,05 мл полной среды 199, обогащенной 10% эмбриональной телячьей сывороткой и 10% раствором глютамина, затем добавляют в соотношении 20:1 0,05 мл взвеси мононуклеарных клеток и 0,1 мл обработанных 3H-уридином и РНКазой клеток-мишеней К-562. В лунки с контрольными пробами вместо мононуклеарных клеток добавляют 0,05 мл среды 199. Каждую опытную и контрольную пробы ставят в 2-х или 3-х параллелях.
6) Планшеты инкубируют в термостате в течение 16-18 часов при температуре 37°С и 5% СО2.
7) После инкубации клетки переносят с помощью многоканального харвестера, прибора, предназначенного для сбора клеток методом фильтрации на фильтрах (Combi cell Harvester Skatron, England), и вакуумного насоса (фирма Millipore) из планшетов на специальные стекловолокнистые фильтры (Skatron, Filter Mat for 12 well Cell Harvesters, England) и отмывают натрий-фосфатным буфером от невключившейся метки.
8) Фильтры высушивают на воздухе в течение 6-18 часов, после чего помещают в сцинтилляционные флаконы (Beckman, USA). В вытяжном шкафу с помощью диспенсера (Brinkmann, Germany) наливают в каждый флакон по 3 мл сцинтилляционной жидкости ЖС-8 (Институт монокристалл, Украина) и оставляют еще на 6-18 часов для выхода β-частиц в сцинтилляционную жидкость.
9) После этого сцинтилляционные флаконы помещают в жидкостной сцинтилляционный счетчик β-частиц (MicroBeta trilux, PerkinElmer Inc.) и подсчитывают число радиоактивных импульсов в каждом флаконе.
10) В формулу для расчета цитотоксической активности НК-лимфоцитов вносят значения радиоактивности, полученные во флаконах с опытными и контрольными образцами, и выражают результат в виде индекса цитотоксичности (ИЦ) в %, который рассчитывают по формуле:
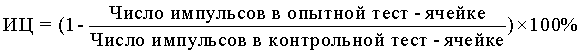
Предлагаемый способ. Оценку цитотоксической активности НК-лимфоцитов на автоматическом счетчике и анализаторе клеток с помощью подсчета числа недеградированных после контакта с НК клеток-мишеней К-562, осуществляли следующим образом.
1) Для постановки цитотоксического теста в качестве клеток-мишеней для НК-лимфоцитов использовали клетки миелолейкоза человека линии К-562 (Институт вирусологии им. Д.И. Ивановского, РАМН), поддерживаемые ин витро на среде RPMI-1640 (ФГУП «ПИПВЭ имени М.П. Чумакова РАМН), с добавлением 10% фетальной сыворотки (Defined Fetal Bovine Serum фирмы Hyclone, USA) и 10% глютамина.
2) Клетки-мишени перед постановкой цитотоксического теста не метили Н-уридином, вследствие чего исчезала необходимость обработки их РНКазой; отмывали один раз большим количеством среды 199 (ФГУП «ПИПВЭ имени М.П. Чумакова РАМН) с помощью центрифугирования при 1100-1200 об/мин и 4°С в течение 10 мин и разводили до концентрации 1х10 /мл средой 199.
3) Мононуклеарные клетки, в состав которых входили моноциты и общий пул лимфоцитов, 10-15% от которого составляют НК-лимфоциты, выделяли из периферической крови больных в градиенте плотности фиколл-верографина с уд. пл. 1,077, разводили средой 199 до концентрации 4×106/мл.
4) Постановку цитотоксического теста осуществляли в специальных 96-луночных круглодонных полистироловых планшетах с объемом лунки 0,25 мл (завод «Медполимер», Санкт-Петербург). В лунки с опытными пробами к 0,05 мл среды 199 добавляли 0,05 мл полной среды 199, обогащенной 10% эмбриональной телячьей сывороткой и 10% раствором глютамина; затем в соотношении 20:1 добавляли 0,05 мл взвеси мононуклеарных клеток и 0,1 мл не обработанных 3H-уридином и РНКазой клеток-мишеней К-562. В лунки с контрольными пробами вместо мононуклеарных клеток добавляли 0,05 мл среды 199. Каждую опытную и контрольную пробы ставили в 2-х или 3-х параллелях.
5) Планшеты инкубировали в термостате в течение 16-18 часов при температуре 37°С и 5% СО2.
6) После инкубации содержимое лунок двух или трех параллелей каждой пробы с помощью автоматической пипетки переносили из планшета для культивирования в пластиковые пробирки типа "Ependorf" и тщательно перемешивали.
7) Из каждой пробирки отбирали 100 мкл клеточной взвеси и разводили в 10 мл жидкости для разведения проб в специальных акуветах объемом 20 мл (акуветы и жидкость для разведения проб поставляются с прибором).
8) Акуветы помещали в автоматический счетчик и анализатор клеток (Beckman Coulter, USA), с помощью которого подсчитывали число недеградированных после контакта с НК-лимфоцитами клеток-мишеней К-562.
9) При анализе подсчитанных клеток учитывали только те клетки, диаметр которых находился в диапазоне от 15 до 40 мкм. Так как диаметр самых крупных мононуклеарных клеток крови, а именно моноцитов, не более 15 мкм, а диаметр клеток-мишеней К-562 более 15 мкм, то клетки, подсчитанные на приборе в диапазоне от 15 до 40 мкм, относили именно к клеткам К-562.
10) В формулу для расчета ЦА НК вносили значения, полученные на приборе, то есть, число клеток-мишеней в пробах с опытными и контрольными образцами, и выражали результат также в виде индекса цитотоксичности (ИЦ) в %, который рассчитывали по формуле:
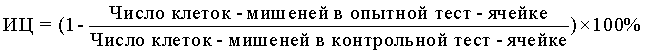
Процедура оценки ЦА НК на приборе является менее трудоемкой, экономичной и безопасной для здоровья исследователя, так как занимает по продолжительности 10-15 минут, не требует применения большого количества приборов, радиоактивных веществ и сцинтилляционной жидкости, как в прототипе.
Субъекты и параметры исследований.
У 16 больных шизофренией с первым приступом эндогенного психоза в возрасте от 18 до 25 лет (средний возраст - 20,8±0,4) проводили сравнительный анализ двух способов оценки цитотоксической активности НК-лимфоцитов: по измерению уровня 3H-уридина в клетках-мишенях К-562, то есть по прототипу, и по числу клеток-мишеней К-562, как в предлагаемом способе. Всех больных обследовали один раз до назначения им психотропной терапии. Исследования проводили на мононуклеарных клетках, выделенных из периферической венозной крови больных в градиенте плотности фиколл-верографина с плотностью 1,077 и состоящих из моноцитов и пула лимфоцитов, 10-15% от которых составляют НК-лимфоциты.
Поскольку оба способа оценки ЦА НК-лимфоцитов связаны с клетками-мишенями К-562, оставшимися недеградированными в результате цитолитического действия на них НК-лимфоцитов, целью исследования было продемонстрировать, что результаты, полученные с помощью предлагаемого способа, аналогичны результатам, полученным с помощью известного способа. Для подтверждения идентичности полученных результатов цитотоксический тест при обоих способах оценки ЦА НК-лимфоцитов ставили в разных вариантах: в культуре клеток в общей группе больных и в подгруппах больных с низким и высоким уровнем активности НК; в культуре клеток без моноцитов, которые удаляли с помощью адгезии в пластиковых чашках в течение одного часа при 37°С и 5% СО2; в культуре клеток с добавлением серотонина в концентрации 10-6 и 10-7 М.
Статистические вычисления
Все статистические исследования проводили, используя StatSoft (USA), версию 6. При сравнении различных групп использовали критерий U Манна-Уитни. Корреляционный анализ проводили с использованием критерия Spearman Rank R.
Примеры.
Пример 1 (по прототипу).
Пример 2 (предлагаемый способ).
Пример 3.
Аналогично примерам 1 и 2, но с добавлением перед постановкой цитотоксического теста серотонина в концентрации 10-6 М к взвеси клеток-мишеней К-562 и мононуклеарных клеток больных в общей группе.
Пример 4
Аналогично примерам 1 и 2, но с добавлением перед постановкой цитотоксического теста серотонина в концентрации 10-7 М к взвеси клеток-мишеней К-562 и мононуклеарных клеток больных в общей группе.
Пример 5
Аналогично примерам 1 и 2, но с удалением моноцитов из взвеси мононуклеарных клеток больных в общей группе перед постановкой цитотоксического теста.
Пример 6
Аналогично примерам 1 и 2, но с оценкой ЦА НК в подгруппе больных с высоким уровнем ЦА НК.
Пример 7
Аналогично примеру 6, но с добавлением перед постановкой цитотоксического теста серотонина в концентрации 10-6 М к взвеси клеток-мишеней К-562 и мононуклеарных клеток в подгруппе больных с высоким уровнем ЦА НК.
Пример 8
Аналогично примеру 6, но с добавлением перед постановкой цитотоксического теста серотонина в концентрации 10-7 М к взвеси клеток-мишеней К-562 и мононуклеарных клеток в подгруппе больных с высоким уровнем ЦА НК.
Пример 9
Аналогично примерам 1 и 2, но с оценкой ЦА НК в подгруппе больных с низким уровнем ЦА НК.
Пример 10
Аналогично примеру 9, но с добавлением перед постановкой цитотоксического теста серотонина в концентрации 10-6 М к взвеси клеток-мишеней К-562 и мононуклеарных клеток в подгруппе больных с низким уровнем ЦА НК.
Пример 11
Аналогично примеру 9, но с добавлением перед постановкой цитотоксического теста серотонина в концентрации 10-7 М к взвеси клеток-мишеней К-562 и мононуклеарных клеток в подгруппе больных с низким уровнем ЦА НК.
Пример 12
Аналогично примеру 9, но с удалением перед постановкой цитотоксического теста моноцитов из взвеси мононуклеарных клеток в подгруппе больных с низким уровнем ЦА НК.
Краткое описание чертежей.
В таблице 1 представлены данные сравнительного анализа двух способов оценки цитотоксической активности НК-лимфоцитов в общей группе больных. Можно видеть, что значения уровня цитотоксической активности НК, определяемого радиоактивным способом, как в примере 1, и подсчетом числа клеток-мишеней К-562 на анализаторе, как в примере 2, представляют собой практически одинаковые величины. При статистической обработке результатов эти данные были полностью подтверждены, то есть значимые различия между средними значениями определяемых показателей обнаружены не были (p>0,05). Подтверждением правильности полученных результатов служило выявление статистически значимых позитивных корреляций между уровнем цитотоксической активности НК-лимфоцитов, определяемым в недеградированных мишенях К-562 радиоактивным способом, с одной стороны, и их числом (Spearman r=0,6; p<0,05), с другой стороны.
В таблице 2 представлены данные сравнительного анализа двух способов оценки цитотоксической активности НК в общей группе больных с добавлением в культуры клеток перед постановкой цитотоксического теста серотонина в концентрации 10-6 и 10-7 М и удалением перед постановкой цитотоксического теста моноцитов из взвеси мононуклеарных клеток. Из таблицы видно, что значения ЦА НК-лимфоцитов, определяемой по уровню радиоактивности в недеградированных клетках-мишенях К-562 на β-счетчике и подсчетом их числа на анализаторе, практически одинаковы во всех вариантах постановки цитотоксического теста. Статистическая обработка результатов полностью подтвердила эти данные, то есть значимые различия между средними значениями определяемых показателей выявлены не были (p>0,05). Корреляционный анализ также подтвердил схожесть результатов, полученных с помощью оценки ЦА НК радиоактивным способом и на анализаторе в разных вариантах постановки цитотоксического теста. А именно, был выявлен высокий уровень позитивной корреляционной связи между результатами, полученными двумя способами в культурах клеток с добавлением серотонина в концентрации 10-6 и 10-7 М (Spearman r=0,81; p<0,001) и с удалением из взвеси мононуклеарных клеток моноцитов (r=0,95; p<0,001).
В Таблице 3 представлены результаты сравнительного анализа двух способов оценки ЦА НК-лимфоцитов в подгруппах больных с высоким и низким уровнем этой активности, а также при добавлении перед постановкой цитотоксического теста серотонина в концентрации 10-6 и 10-7 М в культуры клеток больных в каждой подгруппе и удалении перед постановкой цитотоксического теста моноцитов из взвеси мононуклеарных клеток больных с низким уровнем ЦА НК. Из таблицы видно, что значения уровня ЦА НК-лимфоцитов, определяемого радиоактивным способом на β-счетчике и подсчетом их числа на анализаторе, практически одинаковы во всех вариантах постановки цитотоксического теста. Статистическая обработка результатов также подтвердила эти данные, то есть значимые различия между средними значениями показателей, определяемых радиоактивным способом и на анализаторе, в разных вариантах постановки цитотоксического теста выявлены не были (p>0,05). При этом выявлялся высокий уровень позитивных корреляционных связей между значениями цитотоксической активности НК, полученными с помощью оценки по уровню 3H-уридина в недеградированных мишенях и на анализаторе по числу оставшихся мишеней (Spearman r=0,81; p<0,001).
Таким образом, предложен новый безопасный и экономичный по времени и по затратам способ оценки цитотоксической активности НК-лимфоцитов. Сравнительный анализ двух способов оценки цитотоксической активности НК-лимфоцитов в общей группе больных с помощью подсчета уровня радиоактивности в недеградированных клетках-мишенях К-562 и подсчета их числа на автоматическом счетчике и анализаторе клеток выявил полную идентичность полученных результатов, которая подтверждалась во всех вариантах постановки цитотоксического теста. При этом предлагаемый способ является более простым и коротким в исполнении, так как требует использования всего одного прибора вместо нескольких и занимает по времени 10-15 минут против 2-х-3-х дней, необходимых для оценки цитотоксической активности НК радиоактивным способом. Важным преимуществом предлагаемого способа оценки является также безопасность для здоровья исследователя, так как ее проведение не требует использования радиоактивной метки и сцинтилляционной жидкости. Известно, что НК-лимфоциты являются первой линией защиты организма человека и животных от разного рода чужеродных воздействий, к которым относятся инфекционные агенты и собственные трансформированные клетки. Основываясь на этом, можно предположить, что использование простого и безопасного способа оценки ЦА НК-лимфоцитов найдет широкое применение в качестве тест-системы для выявления снижения активности этого важного звена естественного иммунитета у больных с психопатологической симптоматикой и различными соматическими заболеваниями, в первую очередь злокачественными новообразованиями и заболеваниями инфекционной природы, а также при проведении скрининговых обследований с целью выявления среди населения групп людей с риском развития этих заболеваний.
10-6 М
10-7 М
10-6 М
10-7 М
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТОРНОЙ НЕДОСТАТОЧНОСТИ ЦИТОТОКСИЧЕСКИХ КЛЕТОК ПО УВЕЛИЧЕНИЮ КОНЦЕНТРАЦИЙ В КРОВИ МОЛЕКУЛ SCD54, SCD56, SCD71 | 2023 |
|
RU2811001C1 |
| СПОСОБ КОРРЕКЦИИ НАРУШЕННОГО ИММУННОГО ГОМЕОСТАЗА И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1998 |
|
RU2168335C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЕСТЕСТВЕННОЙ КИЛЛЕРНОЙ АКТИВНОСТИ ЛИМФОЦИТОВ ЧЕЛОВЕКА В УСЛОВИЯХ ГИПЕРБАРИИ | 1994 |
|
RU2109288C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СПОНТАННОЙ КЛЕТОЧНОЙ ЦИТОТОКСИЧНОСТИ | 2001 |
|
RU2208786C1 |
| Способ дифференциальной диагностики стволового и полушарного ишемического инсульта при нарушении мозгового кровообращения | 1986 |
|
SU1455317A1 |
| СПОСОБ ПОЛУЧЕНИЯ ДЕПОНИРОВАННЫХ ЛИМФОКИН-АКТИВИРОВАННЫХ КИЛЛЕРОВ | 2009 |
|
RU2400238C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ПОВЫШЕННОЙ КЛЕТОЧНО-ОПОСРЕДОВАННОЙ ЦИТОТОКСИЧНОСТИ ЛИМФОЦИТОВ У ЛЮДЕЙ В УСЛОВИЯХ АРКТИКИ | 2020 |
|
RU2753693C1 |
| Способ определения индивидуальной чувствительности к иммуномодулятору | 1988 |
|
SU1658094A1 |
| СПОСОБ ОЦЕНКИ ПРОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТИ МОНОЦИТОВ | 2021 |
|
RU2755493C1 |
| АЛЛОФЕРОНЫ-ИММУНОМОДУЛИРУЮЩИЕ ПЕПТИДЫ | 1999 |
|
RU2172322C1 |
Изобретение относится медицине, а именно к клинической иммунологии, и может быть использовано для оценки цитотоксической активности лимфоцитов натуральных киллеров (НК) по клеткам-мишеням К-562, оставшимся недеградированными после контакта с НК лимфоцитами. Для этого выделяют НК лимфоциты в составе мононуклеарных клеток из периферической крови пациентов. Проводят постановку цитотоксического теста, основанного на инкубации НК лимфоцитов и клеток-мишеней К-562. При этом клетки-мишени К-562 не метят 3Н-уридином. Оценивают цитотоксическую активность НК лимфоцитов с помощью подсчета количества оставшихся недеградированными клеток-мишеней на автоматическом счетчике и анализаторе клеток, настроенном на выявление клеток диаметром от 15 до 40 мкм. После чего рассчитывают индекс цитотоксичности по формуле
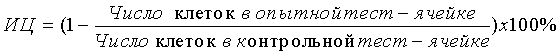 . Изобретение обеспечивает безопасность для здоровья исследователя, а также укорочение времени исследования. 3 табл., 12 пр.
. Изобретение обеспечивает безопасность для здоровья исследователя, а также укорочение времени исследования. 3 табл., 12 пр.
Способ оценки цитотоксической активности лимфоцитов натуральных киллеров осуществляют по клеткам-мишеням К-562, оставшимся недеградированными после контакта с НК-лимфоцитами, включает выделение НК-лимфоцитов в составе мононуклеарных клеток из периферической крови пациентов, постановку цитотоксического теста, основанного на инкубации НК-лимфоцитов и клеток-мишеней К-562, отличающийся тем, что используют клетки-мишени К-562, которые не метят 3H-уридином, и цитотоксическую активность НК-лимфоцитов оценивают с помощью подсчета числа оставшихся недеградироваными клеток-мишеней на автоматическом счетчике и анализаторе клеток, настроенном на выявление клеток диаметром от 15 до 40 мкм, после чего рассчитывают индекс цитотоксичности (ИЦ), в %, по формуле:
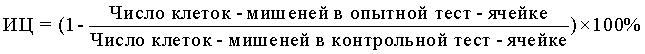
| РЫКОВА М.П | |||
| и др | |||
| Иммунология, 1981; 3: 88-90 | |||
| Способ определения активности киллеров | 1990 |
|
SU1727078A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СПОНТАННОЙ КЛЕТОЧНОЙ ЦИТОТОКСИЧНОСТИ | 2001 |
|
RU2208786C1 |
| Способ дифференциальной диагностики стволового и полушарного ишемического инсульта при нарушении мозгового кровообращения | 1986 |
|
SU1455317A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЕСТЕСТВЕННОЙ КИЛЛЕРНОЙ АКТИВНОСТИ ЛИМФОЦИТОВ ЧЕЛОВЕКА В УСЛОВИЯХ ГИПЕРБАРИИ | 1994 |
|
RU2109288C1 |
| JP 4712289 B2, 29.06.2011 | |||
| DITTAMI GM, et al Determination of mammalian cell counts, cell size and cell health using the Moxi Z mini automated cell counter // J Vis Exp | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
Авторы
Даты
2014-04-27—Публикация
2012-06-06—Подача