ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способам, наборам и системам для измерения количества клеток в образце.
УРОВЕНЬ ТЕХНИКИ
Далее приведен список источников, которые можно рассматривать как относящиеся к описанию существующего уровня техники в данной области.
(1) Международная заявка, номер публикации WO 06/065350 (Kimberly Clark Worldwide Inc.).
(2) Заявка на европейский патент номер 0612850 (Ninon Millipore Kogyo KK).
(3) Патент США номер 5,258,285 (Foss Electric Holding AS).
(4) Заявка на патент США, номер публикации 2008014607.
(5) Международная заявка, номер публикации WO 92/02632 (Sierra Cytometry).
(6) Jones, D.L., M.A. Brailsford, and J.-L. Drocourt. 1999. Solid-phase, laser-scanning cytometry: a new two-hour method for the enumeration of microorganisms in pharmaceutical water. Pharmacop. Forum 25:7626-7645.
УРОВЕНЬ ТЕХНИКИ
Количественное измерение биологических объектов в образцах, особенно в жидких образцах, важно для определения степени контаминации, инфекций, состояния заболеваний и т.д. Например, в области микробиологии мерой количества бактерий или грибков служат колониеобразующие единицы (КОЕ/мл).
Так как микроорганизмы могут находиться в виде спор, неактивных (некультивируемых) и способных размножаться микроорганизмов, важно иметь возможность количественного анализа лишь способных размножаться микроорганизмов. Например, количественный анализ способных размножаться микроорганизмов представляет собой одну из главных задач в процессах контроля качества производства продовольствия и напитков, производства изделий, которые контактируют с потребителем, таких как лекарственные средства и средства личной гигиены, защиты от неблагоприятного воздействия водных систем, таких как реки, озера и океаны, общественной безопасности (например, бактериологического контроля систем городского водоснабжения, колодцев, воды для рекреационного пользования, такой как, например, плавательных бассейнов, СПА-комплексов и пляжей, и т.д.), различных производственных процессов, внутрибольничных инфекций и предоставления медицинского обслуживания.
Количественный анализ делящихся (культивируемых) микроорганизмов обычно представляет собой специализированную методику лабораторных исследований, основанную на выращивании бактериальных культур. Нужно поддерживать определенные условия для микробного роста на твердых и жидких средах на протяжении длительного периода инкубации, по окончании которой определяют КОЕ (КОЕ/мл). В условиях лаборатории, КОЕ обычно рассчитывают путем нормирования суммарного количества подсчитанных колоний согласно количеству разведений и объему образца. Эта методика требует наличия лабораторного оборудования, квалифицированного персонала и длительных периодов времени, которые могут продолжаться от одного дня до одного месяца. Несмотря на то, что их определение связано с трудоемкой и требующей больших затрат времени работой, КОЕ представляют собой существующий стандарт, принятый регулирующими органами для определения количества микроорганизмов.
В данной области техники предусмотрены различные способы обнаружения микроорганизмов в исследуемых образцах, в которых, в качестве альтернативы подсчету клеток, используют включение цветной или флуоресцентной метки.
Например, в заявке на международный патент, номер публикации WO 06/065350 (Kimberly Clark Worldwide Inc.), предусмотрен способ полуколичественного или количественного обнаружения присутствия микроорганизма в образце. В данном способе используют тестовый краситель, который претерпевает детектируемое изменение цвета в присутствии одного или нескольких микроорганизмов. Например, тестовый краситель представляет собой сольватохромный краситель (например, краситель Райхардта), который реагирует на различия в полярности между компонентами микроорганизма (например, клеточная мембрана, цитоплазма и т.д.) и окружающей клетку среды.
В европейском патенте номер EP 0612850 описан способ определения количества жизнеспособных микробных клеток в исследуемом растворе, включающий фильтрование исследуемого раствора через фильтрующую мембрану, имеющую гидрофобные свойства, чтобы задержать микроорганизмы гидрофобными барьерами; нанесение на нее высокодисперсным распылением экстрагирующего АТФ реагента, чтобы экстрагировать люминесцентный ингредиент из микроорганизмов; нанесение на нее высокодисперсным распылением другого вызывающего люминесценцию жидкого реагента, чтобы позволить экстрагированному люминесцентному ингредиенту испускать люминесценцию; и измерение уровня люминесценции с применением надлежащих средств для измерения уровня люминесценции.
В патенте США номер 5,258,285 описан способ определения количества бактерий в популяции клеток, содержащей бактерии и соматические клетки.
В заявке на патент США, номер публикации US 2008/014607, описан основанный на биолюминесценции способ обнаружения и подсчета жизнеспособных клеток данного вида, потенциально присутствующих в жидком образце, включающий измерение суммарного содержания свободных внутриклеточных аденилнуклеотидов (AH) в виде АТФ в жизнеспособных клетках данного не относящегося к вирусам вида.
В заявке на международный патент, номер публикации WO 92/202632, описан процесс обнаружения, идентифицирования и/или подсчета жизнеспособных клеток в коровьем молоке, в котором жизнеспособные клетки избирательно метят флуоресцентным красителем (например, красителями, зависящими от действия эстеразы; красителями, связывающими нуклеиновые кислоты, и красителями, которые выявляют внутриклеточную окислительную активность), а затем идентифицируют и/или подсчитывают.
В патенте США номер 7,312,073 описан способ определения количества жизнеспособных клеток, в котором золь-гелевый жидкий исходный реагент, который включает маркер, фиксируют в виде тонкослойного покрытия на предметном стекле. Предметное стекло приводят во взаимодействие в течение периода инкубирования с фильтром, содержащим микроорганизмы, которые были отделены от исследуемого образца. Во время инкубации происходит поглощение маркера/маркеров микроорганизмами. Предметное стекло затем облучают и определяют сигнал, испускаемый маркерами, включенными в микроорганизмы, чтобы получить изображение для обнаружения и подсчета микроорганизмов.
Дополнительно в работе Jones, и др. (Pharmacop. Forum 1999, 25, 7626-7645) описан способ подсчета микроорганизмов в течение двух часов в фармацевтической воде.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на использовании динамических свойств клеточной мембраны, благодаря которым в культивируемых (делящихся) клетках непрерывно происходит мембранный транспорт. Авторы настоящего изобретения в ходе данной работы обнаружили, что в культивируемых микробных клетках клеточная мембрана интернализуется, сливается с внутренним мембранным компартментом, а затем снова объединяется с мембраной с гораздо более высокой скоростью, чем в неделящихся клетках.
Настоящее изобретение, в частности, основано на обнаружении того, что окрашивание микробных клеток флуоресцентным красителем, который может связываться с мембраной и интернализоваться во внутриклеточный компартмент микробной клетки, приводит к накоплению указанного красителя внутри клетки. Этот процесс интернализации имеет характеристический профиль, где после первого периода времени, T1, накопление достигает уровня плато, и накопленное количество остается постоянным на этом плато на протяжении характерного второго периода времени, T2.
Дополнительно, настоящее изобретение основано на обнаружении того, что для данного типа микробных клеток или группы микробных клеток, первый период времени T1 и второй период времени T2 представляют собой характерные признаки типа клетки (клеток). Другими словами, T1 и T2 будут оставаться по существу постоянными для данного типа клеток (или группы клеток) при измерении при тех же предварительно заданных условиях.
Таким образом, настоящее изобретение обеспечивает, согласно одному из его аспектов, способ определения количественного значения, указывающего на количество культивируемых микробных клеток в исследуемом образце, включающий:
(i) приведение во взаимодействие исследуемого образца, который может содержать культивируемые микробные клетки, с по меньшей мере одним испускающим сигнал ("signal emitting", далее, сигнальным) агентом, способным связываться с мембраной микробной клетки, указанное приведение во взаимодействие производится в течение предварительно определенного первого периода времени (T1), достаточного для интернализации сигнального агента в микробную клетку до такого уровня, при котором сигнал, испускаемый образцом, по существу достигает плато;
(ii) удаление из указанного исследуемого образца неинтернализованного сигнального агента;
(iii) в течение второго периода времени (T2), следующего за указанным первым периодом времени (T1), на протяжении которого указанный сигнал по существу сохраняется на уровне указанного плато, обнаружение среди сигнальных объектов в указанном образце сигнальных культивируемых клеток, основанное на параметрах отбора, предварительно определенных для указанных культивируемых клеток; и
(iv) определение, на основании указанных выбранных сигнальных объектов, количественного значения, указывающего на количество культивируемых клеток в исследуемом образце.
Настоящее изобретение также обеспечивает набор для определения количественного значения, эквивалентного количеству культивируемых микробных клеток в исследуемом образце, включающий:
(i) по меньшей мере один сигнальный агент, способный связываться с мембраной микробной клетки,
(ii) инструкции для приведения во взаимодействие указанного по меньшей мере одного сигнального агента с образцом в течение первого периода времени (T1), достаточного для интернализации сигнального агента в микробную клетку до такого уровня, при котором сигнал, испускаемый образцом, по существу достигает плато;
(iii) инструкции для удаления из указанного образца не связанного сигнального агента;
(iv) инструкции для обнаружения и отбора из сигнальных объектов в указанном образце сигнальных культивируемых клеток, основанное на параметрах отбора, предварительно определенных для указанных культивируемых клеток, указанное обнаружение и отбор осуществляют в течение второго периода времени (T2), следующего за указанным T1, на протяжении которого указанный сигнал по существу сохраняется на уровне указанного плато;
(v) инструкции для применения указанных выбранных сигнальных объектов для определения с их помощью количественного значения, указывающего на количество культивируемых клеток в исследуемом образце.
Дополнительно, настоящее изобретение обеспечивает систему для определения количества культивируемых микробных клеток в исследуемом образце, включающую:
(i) носитель для удерживания указанного образца, позволяющий приведение во взаимодействие образца с одним или несколькими сигнальными агентами;
(ii) детектор для обнаружения сигнальных объектов в образце и выведения результатов, соответствующих им;
(iii) запоминающее устройство, включающее базу данных с предварительно определенными параметрами отбора и множеством предварительно определенных коэффициентов нормировки, при этом каждый параметр отбора и каждый коэффициент нормировки специфичен для микробной клетки или для группы микробных клеток;
(iv) устройство обработки данных для получения выходных результатов с детектора, одного или нескольких указанных параметров и указанного коэффициента нормировки с указанного запоминающего устройства и обработки указанных выходных результатов с указанными параметрами и указанным коэффициентом нормировки для определения указанного количественного значения, указывающего на количество указанных культивируемых микробных клеток в указанном образце.
Дополнительно настоящее изобретение обеспечивает запоминающее устройство для хранения программ, считываемых компьютером, практически реализующее программу инструкций, выполняемую компьютером, для осуществления способа определения количественного значения, указывающего на количество культивируемых микробных клеток в исследуемом образце, включающий:
(i) приведение во взаимодействие указанного исследуемого образца, который может содержать культивируемые микробные клетки, с по меньшей мере одним сигнальным агентом, способным связываться с мембраной микробной клетки, указанное приведение во взаимодействие производится в течение предварительно определенного первого периода времени (T1), достаточного для интернализации сигнального агента в микробную клетку до такого уровня, при котором сигнал, испускаемый образцом, по существу достигает плато;
(ii) удаление из указанного исследуемого образца неинтернализованного сигнального агента;
(iii) в течение второго периода времени (T2), следующего за указанным первым периодом времени (T1), на протяжении которого указанный сигнал по существу сохраняется на уровне указанного плато, обнаружение и отбор из сигнальных объектов в указанном образце сигнальных культивируемых клеток, основанное на параметрах отбора, предварительно определенных для указанных культивируемых клеток; и
(iv) определение, на основании указанных отобранных сигнальных объектов, количественного значения, указывающего на количество культивируемых клеток в исследуемом образце.
Кроме того, обеспечена компьютерная программа, включающая средства программного кода для выполнения всех этапов согласно настоящему изобретению, при запуске указанной программы на компьютере, при этом указанная компьютерная программа находится в запоминающем устройстве для хранения программ.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Для лучшего понимания настоящего изобретения и демонстрации возможности его осуществления на практике, далее описаны варианты реализации, исключительно в виде неограничивающих примеров, со ссылкой на сопровождающие описание фигуры, где:
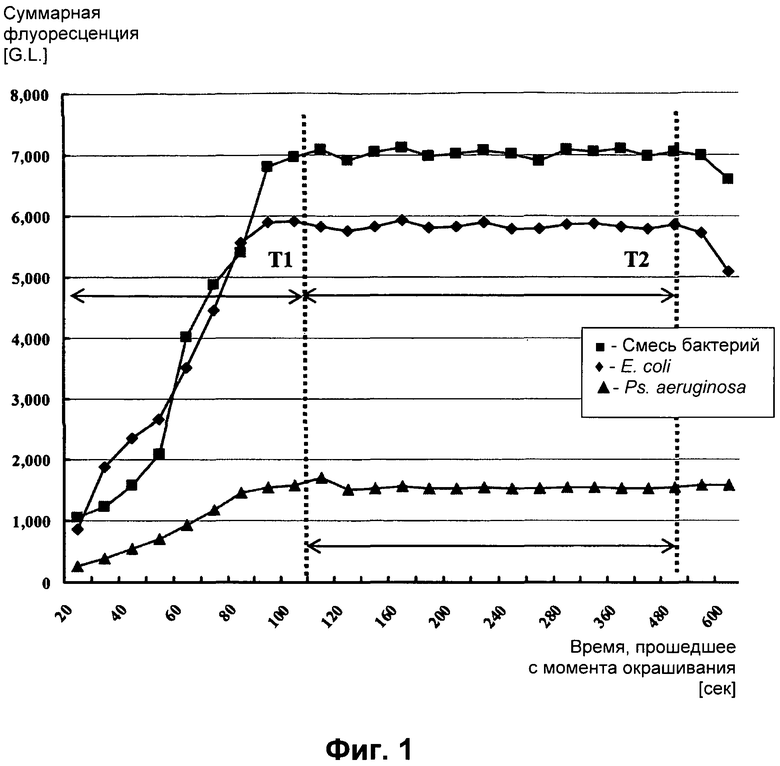
Фигура 1 представляет собой график, показывающий интенсивность флуоресценции, как функцию от времени, образцов, содержащих смесь бактериальных клеток, полученных из воды для городского потребления (-■-), выделенных Е.coli (-♦-) и Ps. aeruginosa (-•*•-), окрашенных флуоресцентным красителем FM1-43.
Фигура 2 представляет собой график, на который нанесено количество микробных клеток в образце (в КОЕ/мл) по сравнению с количественным измерением микробных клеток в том же образце, полученном способом согласно настоящему изобретению.
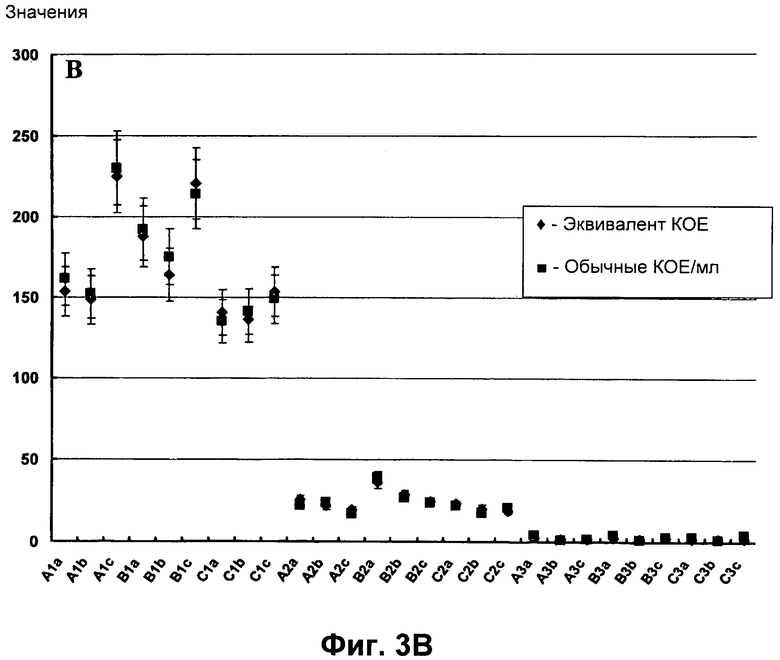
Фигуры 3A-3B представляют собой графики, показывающие корреляцию между определением количества КОЕ/мл, полученного обычным способом (стандартное определение КОЕ/мл), и эквивалентом КОЕ, вычисленным в соответствии с вариантом реализации настоящего изобретения (Фиг.3A), а также корреляцию между каждым значением (эквивалент КОЕ и обычные КОЕ/мл) в исследуемых образцах (Фиг.3B).
Результаты, представленные в Таблице 2, также были нанесены на график, представленный в виде Фигуры 3A (♦ обозначает эквивалент КОЕ, ■ обозначает стандартные КОЕ), при этом корреляция между эквивалентом КОЕ и стандартными КОЕ представлена на Фигуре 3B.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В общем смысле, настоящее изобретение обеспечивает способы, наборы и системы для измерения количества культивируемых микробных клеток в образце, обычно в жидком образце, в течение нескольких минут после того, как образец был окрашен обычным сигнальным агентом.
Обычные методики подсчета микробных клеток, такие как гетеротропное определение их количества путем посева на чашках Петри (HPC), описанное ниже, обычно требуют культивирования микробных клеток в течение многих часов, чтобы провести различие между мертвыми клетками и культивируемыми микробными клетками и подсчитать только культивируемые клетки. Некоторые культивируемые микробные клетки идентифицируют в виде колониеобразующих единиц (КОЕ/мл). В противоположность этому, настоящее изобретение позволяет за несколько минут подсчитать только культивируемые микробные клетки, с получением количественного значения, которое эквивалентно КОЕ. Настоящее изобретение, таким образом, предусматривает эквивалент КОЕ, при этом снижая необходимые временные затраты и стоимость по сравнению с обычными способами. Хотя эквивалент КОЕ согласно настоящему изобретению коррелирует с обычными измерениями колониеобразующих единиц (такими как HPC), может существовать некоторое отклонение, и любое такое отклонение не будет превышать 30%, предпочтительно не будет превышать 10% и более предпочтительно, не будет превышать 5%.
В контексте настоящего изобретения термин "культивируемая микробная клетка" или "культивируемая клетка" используется для обозначения любой клетки (например, родительской клетки) микроскопического или ультрамикроскопического размера, которая при помещении ее на подходящие и регулируемые среды может поделиться на две (дочерние) клетки. Соответственно, термин "некультивируемая микробная клетка" обозначает клетки, даже если они жизнеспособны, которые при помещении их в условия культивирования не делятся и не могут поделиться на дочерние клетки.
Микробные клетки могут включать, но не ограничены перечисленными, бактерии, такие как колиформные бактерии (E.coli), энтеробактерии (сальмонелла, листерия, шигелла), псевдомонады (pseudomonas auriginosa, pseudomonas fluorescensa), стафилококки (staphilococus aureus, streptococcus fecalis), стрептококки и метанобактерии, и т.д.; плесневые грибы, такие как Aspergillus niger, пенициллы и т.д.; дрожжи, такие как кандида, сахаромицеты, и т.д.; простейшие, такие как криптоспоридии, лямблии, амебы и т.д.; водоросли, такие как зеленые водоросли и т.д.; ацидофильные бактерии (TAB); легионеллы; виды вибриона; и другие.
Настоящее изобретение может иметь различные применения, предпочтительно, но не исключительно, в случае когда существует потребность в по существу немедленной идентификации и количественном анализе микробной контаминации в образцах, например, вызывающими заболевания (патогенными) агентами. В качестве примера, способ согласно настоящему изобретению можно применять для измерения количества микробных клеток в питьевой воде. Некоторые другие применения могут быть связаны с промышленной микробиологией (например, для обнаружения клеток, присутствующих в пище или напитках, средствах личной гигиены, инфекций, связанных с производственными процессами и учреждениями здравоохранения), водными системами (питьевая вода, техническая вода, сточная вода, природные источники воды, вода для рекреационного пользования, такого как бассейны, СПА-комплексы и пляжи, и т.д.), медицинской микробиологией (плазма, слюна, моча, образец из горла, жидкости желудочно-кишечного тракта), микробиологией окружающей среды (почва, воздушное пространство) и т.д.
Согласно настоящей заявке, решение, предложенное в настоящем изобретении для определения количества культивируемых микробных клеток в образце практически в реальном времени, основано на использовании мембранного транспорта, или движения клеточной мембраны во внутриклеточный компартмент, которое происходит в культивируемых клетках в степени, превышающей в 1.5, 3, 6, 12 и даже до 20 раз таковую в хотя и жизнеспособных, но некультивируемых клетках. Некультивируемые клетки могут включать, например, споры, дремлющие клетки и т.д. В связи с этим, авторы настоящего изобретения, таким образом, предположили, что если можно окрасить мембрану клетки сигнальным агентом, который связывается с мембраной, и происходит мембранный транспорт, тогда сигнальный агент будет накапливаться в большей степени в культивируемых клетках по сравнению с некультивируемыми клетками и, в связи с этим, будет источником более сильного сигнала от данных культивируемых клеток.
Термины "по существу немедленно", или "немедленно", или "практически в реальном времени" означают временное окно в менее чем 20 минут, предпочтительно, менее чем 15 минут, более предпочтительно, менее чем 10 минут с момента начала способа согласно настоящему изобретению до момента получения по меньшей мере одного изображения исследуемого образца, по которому можно установить эквивалент КОЕ согласно настоящему изобретению (обычно и предпочтительно путем обработки изображения), что более подробно описано ниже. Другими словами, способ согласно настоящему изобретению настолько быстрый, что он не требуют длительного (в течение многих часов) культивирования клеток для определения количества культивируемых клеток в исследуемом образце.
Таким образом, в соответствии с первым аспектом, настоящее изобретение обеспечивает способ определения количественного значения, указывающего на количество культивируемых микробных клеток в исследуемом образце, включающий:
(i) приведение во взаимодействие исследуемого образца, который может содержать культивируемые микробные клетки, с по меньшей мере одним сигнальным агентом, способным связываться с мембраной микробной клетки, указанное приведение во взаимодействие производится в течение предварительно определенного первого периода времени (T1), достаточного для интернализации сигнального агента в микробную клетку до такого уровня, при котором сигнал, испускаемый образцом, по существу достигает плато;
(ii) удаление из указанного исследуемого образца неинтернализованного сигнального агента;
(iii) в течение второго периода времени (T2), следующего за указанным первым периодом времени (T1), на протяжении которого указанный сигнал по существу сохраняется на уровне указанного плато, обнаружение среди сигнальных объектов в указанном образце сигнальных культивируемых клеток, основанное на параметрах отбора, предварительно определенных для культивируемых клеток; и
(iv) определение, на основании указанных отобранных сигнальных объектов, количественного значения, указывающего на количество культивируемых микробных клеток в исследуемом образце.
Способ согласно настоящему изобретению включает обеспечение образца, который может содержать культивируемые микробные клетки, вместе с условиями, которые позволяют культивирование указанных клеток. Данные условия могут легко определить специалисты в данной области техники на основании известного уровня техники, и такие условия обычно будут зависеть от типа микробных клеток или группы микробных клеток, присутствие которых предполагают в образце. Указанные условия могут, например, быть похожими или идентичными таковым, необходимым для HPC.
Исследуемый образец может быть жидким, полужидким, а также сухим. Когда образец представляет собой жидкий образец, его можно высушить перед началом анализа на определение клеток. Образец не обязательно полностью высушивать, но нужно удалить из него по меньшей мере часть жидкости, чтобы сконцентрировать клетки в образце для получения концентрата клеток.
Концентрирование микробных клеток в жидких образцах может осуществляться с применением любых средств, доступных в биологических лабораториях. Данные средства включают, но не ограничены перечисленными, фильтрование образца через подходящие фильтры, центрифугирование и другие методики высушивания.
Образец (либо в том виде, в котором его получили, либо после удаления из него по меньшей мере части жидкости) окрашивают одним или несколькими сигнальными агентами. Термин "сигнальный агент" в данной заявке обозначает любое химическое вещество, которое при подходящих условиях испускает детектируемый сигнал. Сигнальный агент может представлять собой светоизлучающий агент, например, колориметрические агенты, или испускающий люминесцентное свечение агент, при этом люминесцентное свечение представляет собой, например, фотолюминесценцию (включая флуоресценцию или фосфоресценцию), хемолюминесценцию, радиолюминесценцию, термолюминесценцию; или любой другой сигнальный агент, известный в области техники для мечения клеток.
Примеры испускающих люминесценцию молекул, которые можно применять в соответствии с настоящим изобретением, включают, но не ограничены перечисленными, биолюминесцентные агенты, включая основанные на люциферине агенты (например, 6-O-бета-галактопиранозил-люциферин), флуоресцентные агенты, включая члены семейства Alexa Fluor (Invitrogen), красители PromoFluor (PromoKine), HiLyte Fluors (AnaSpec), DyLight Fluors (Pierce, Thermo Fisher Scientific) и серию красителей ATTO (ATTO-TEC и Sigma-Aldrich). Для специалистов в данной области техники должно быть очевидно, что существует большое разнообразие флуоресцентных или других люминесцентных агентов, которые можно применять в соответствии с настоящим изобретением.
В одном варианте реализации, указанный агент включает люминесцентную, предпочтительно, флуоресцентную молекулу, конъюгированную с липофильным линкером, позволяющим связывание, например, включение по меньшей мере части данного агента в мембрану культивируемых клеток, благодаря чему происходит интернализация агента в клетку в результате мембранного транспорта.
Связывание сигнального агента с клеточной мембраной культивируемых клеток обычно неспецифично и происходит в результате липофильности данного агента (например, вследствие связывания люминесцентной молекулы с липофильным линкером). Таким образом, неспецифичный сигнальный агент обычно используют для определения суммарного количества культивируемых бактериальных клеток (TCBC).
Настоящее изобретение также позволяет определить количество определенного типа культивируемых микробных клеток в образце, даже если в нем находится смесь микроорганизмов. Это можно осуществить, применяя различные специфичные сигнальные агенты, либо отдельно, либо в комбинации с неспецифичным сигнальным агентом.
Термин "специфичный" или специфичность" в контексте термина "специфичный сигнальный агент" используется для обозначения того, что указанный агент обладает аффинностью и/или избирательно связывается с мембраной или с внутриклеточным компонентом конкретного типа клеток (клеток, обнаружение которых в образце представляется желательным).
Специфичный сигнальный агент может включать нацеливающую молекулу, т.е. лиганд, обладающий специфичностью связывания с внеклеточным компонентом клетки. В одном варианте реализации, нацеленный сигнальный агент представляет собой такой агент, который может интернализоваться в культивируемую клетку, тем самым позволяя детектирование только таких клеток, которые интернализовали указанный сигнальный агент.
В другом варианте реализации, нацеленный (специфичный) сигнальный агент не интернализуется в клетку, на которую он нацелен, и обнаружение таких клеток осуществляют путем использования комбинации этого специфичного сигнального агента с неспецифичным сигнальным агентом. При этом неспецифичный сигнальный агент обеспечивает определение суммарного количества культивируемых бактериальных клеток, а специфичный сигнальный агент обеспечивает определение суммарного количества определенного типа клеток (с которыми сигнал специфично связывается). Испускаемые сигналы, полученные в виде изображений, для двух сигнальных агентов затем накладывают друг на друга, чтобы установить те клетки, которые испускают оба сигнала, т.е. которые удовлетворяют обоим критериям: культивируемости и способности связывать специфичный агент.
Специфичности сигнального агента также можно достигнуть с помощью ферментативных молекул (например, когда фермент активирует внутриклеточные реакции, специфичные для данного типа клеток). Такие ферменты могут включать, но не ограничиваются перечисленными, ферменты, которые действуют на орто-нитрофенил-бета-D-галактопиранозид с получением сигнального продукта деградации. Это может помочь идентифицировать конкретную популяцию клеток в образце, имеющих специфичный фермент, который образует сигнальный продукт деградации.
В дополнительном примере, специфичности (нацеливания) можно достигнуть, применяя специфичное к клетке антитело (моноклональное, а также поликлональное). Примеры антител могут включать антитела против липополисахарида (LPS) сальмонеллы, антитела против CD 18, антитела против LPS E.coli (например, антитела против LPS J5 E.coli), антитела против жгутикового антигена сальмонеллы, антитела против фактора прикрепления K99 E.coli. В качестве дополнительного примера, антитело может представлять собой иммунолипосому (антитело, связанное с липосомами).
В другом дополнительном примере, специфичности можно достигнуть с помощью бактериофагов (например, флуоресцентных бактериофагов). Так как способ согласно настоящему изобретению позволяет получить количественное значение в течение нескольких минут, можно завершить анализ перед тем, как флуоресцентный бактериофаг повредит клетки. В качестве примера, можно обнаружить и определить количество E.Coli с помощью бактериофага колифага лямбда 1 (LCI).
Примерами комбинации неспецифичных и специфичных сигнальных агентов могут служить, но не ограничены перечисленными, люминесцентная молекула, конъюгированная со связывающим В токсин холеры белком, для обнаружения видов холеры, и люминесцентная молекула, связанная со специфичным мембранным липополисахаридом E.coli, с помощью которой можно определить количество E.Coli, каждую из которых применяют в комбинации с неспецифичным сигнальным агентом, таким как FM1-43, используемый в Примерах.
Стоит отметить, что агент может постоянно испускать сигнал, или сигнал может возникать в результате стимулов, таких как ферментативный процесс, происходящий во внутриклеточном компартменте, ферментативная реакция, действующая на агент таким образом, что он испускает сигнал, или продукт ферментативной деградации испускает сигнал (как было описано выше), в результате радиационных стимулов и т.д.
Во время стадии приведения во взаимодействие, сигнальный агент связывается с мембранами клеток. В контексте настоящего изобретения термин "связывание" обозначает любой тип взаимодействия агента с мембранами клеток; включая, но не ограничиваясь перечисленными, образование электростатической связи, образование ионной связи, образование ковалентной связи, включение по меньшей мере части маркера в мембраны клеток, образование связи антиген-антитело, образование связи рецептор-лиганд, и тому подобных. В контексте настоящего изобретения термин "связывание" также включает любой сигнальный агент, который уже интернализовался в клетку.
Приведение во взаимодействие образца, который может содержать культивируемые микробные клетки, осуществляют на протяжении периода времени, достаточного для интернализации сигнального агента в клетку и достаточного для накопления внутри клетки сигнального агента. Авторы настоящего изобретения обнаружили, что вследствие мембранного транспорта, происходящего в культивируемых клетках в большей степени, чем в некультивируемых клетках, культивируемые микробные клетки накапливают большее количество агента внутри клетки. Различие между некультивируемой и культивируемой клеткой может иметь порядок 1.5, 3, 6, 12 и даже до 20 раз в отношении количества накопленного агента при данных условиях. Авторы настоящего изобретения дополнительно обнаружили, что накопление агента внутри клетки достигает плато.
Время, необходимое для достижения агентом плато, определено в данной заявке как "T1". Время T1 представляет собой свойство типа клеток, и его определяют заранее. Предварительное определение T1 можно осуществить путем окрашивания выбранного типа клеток сигнальным агентом и обнаружения изменения со временем интенсивности сигнала до тех пор, пока интенсивность сигнала по существу не перестанет изменяться. Момент времени, начиная с которого не происходит видимого изменения интенсивности сигнала, определяют как время, при котором достигается плато. Термин "плато" в данной заявке обозначает уровень накопленного внутри клетки сигнального агента, который остается постоянным в течение по меньшей мере 50, 250 и даже до 900 секунд.
С целью иллюстрирования, приводятся ссылки на примеры, приведенные в данной заявке, в которых показано, что для окрашивания образца, содержащего выделенные E.coli, неспецифичным сигнальным агентом FM1-43 (производства Molecular probes) необходимо время T1 приблизительно от 90 до 110 секунд пока уровень уловленного сигнала не достигнет постоянного уровня; тогда как для образца, включающего выделенные Ps.aeruginosa, также окрашенного FM1-43, требовалось время T1, составляющее приблизительно от 70 до 100 секунд, для достижения постоянного уровня.
Так как T1 заранее определено для клеток (или группы клеток), которые могут присутствовать в исследуемом образце, можно определить момент времени, подходящий для вымывания несвязанного и предпочтительно неинтернализованного сигнального агента (агентов). Вымывание агента можно осуществить с помощью любого способа, известного в данной области техники. Такие способы могут включать, но не ограничены перечисленными, фильтрацию (например, через обычный микробный фильтр), центрифугирование (например, свыше 4500 об/мин) и любой другой способ, который позволяет отделение клеток от несвязанного агента (агентов), растворенного или суспендированного в жидкости образца.
Клетки, с которыми связан сигнальный агент, детектируют как сигнальные объекты. Должно быть очевидно, тем не менее, что сигнальный агент также может связываться с компонентами клетки или с другими артефактами в образце, которые не являются интактными культивируемыми клетками и могут давать ложный сигнал. Аналогично, сигнал может идти от агрегированного сигнального агента (т.е. от агента, который недостаточно хорошо растворен в образце). Таким образом, способ обеспечивает средство для обнаружения и отбора только таких сигнальных объектов, которые происходят из клеток, содержащих связанный с ними и интернализованный в них агент. В контексте настоящего изобретения термин "сигнальный объект" обозначает любое оптическое пятно в исследуемом образце, которое испускает сигнал. Сигнальный объект не обязательно имеет размер клетки, и, в действительности, может быть больше, вследствие возникновения гало вокруг клетки, образованного сигналом, испускаемым клеткой, особенно когда отображенная клетка находится не в фокусе ("круг нерезкости"). Это возникает в результате того, что конус световых лучей от объектива не образует идеальный фокус при визуализации сигнальной клетки. Детектирование и отбор осуществляют после того, как сигнал достигнет плато, во второй период времени T2. Этот период времени T2 представляет собой временное окно, во время которого сигнал, испускаемый сигнальным объектом, остается на уровне плато в по существу неизменном состоянии.
За время T2 определяют несколько параметров сигнала. Данные параметры включают интенсивность сигнала, испускаемого сигнальным объектом, размер сигнального объекта в исследуемом образце, морфологию сигнального объекта.
Критерии отбора требуют, чтобы для микробной клетки или группы микробных клеток интенсивность сигнала, испускаемого детектируемыми объектами, была по меньшей мере ниже предварительно определенного верхнего порога и, в некоторых вариантах реализации, в рамках предварительно определенного диапазона интенсивности. Таким образом, интенсивность сигнала, которая ниже предварительно определенного минимального уровня, например, сигнал, испускаемый фрагментами клеток (мертвыми и поврежденными клетками), или интенсивность сигнала, которая выше предварительно определенного максимального уровня (верхний порог), например, сигнал, испускаемый агрегатами агента или неклеточными включениями в образце, исключают из анализа.
Критерии отбора также требуют, чтобы сигнальные объекты имели предварительно определенный диапазон размеров. По таким критериям исключают из анализа объекты ниже минимального порога (например, относящиеся к фрагментам клеток) или выше максимального порога (например, от больших включений в образце).
Дополнительно, критерии отбора могут требовать, чтобы сигнальные объекты имели заранее определенную морфологию. Должно быть очевидно, что морфология клетки, как правило, представляет собой свойство данного вида бактерий, и такие клетки имеют множество разнообразных морфологии. Морфологии могут включать по существу округлые (например, у кокков), по существу вытянутые (например, у бацилл), палочковидные морфологии и т.д. Сигнальный объект, как правило, будет иметь форму, соответствующую (похожую) таковой для клетки, которая испускает данный сигнал. Например, вытянутый сигнальный объект, как правило, будет представлять собой вытянутую микробную клетку. Определение формы объекта позволяет не только исключить из анализа немикробные сигнальные объекты (т.е. артефакты), но также может способствовать идентификации типа клетки, от которой исходит сигнал.
В одном варианте реализации, по меньшей мере параметр интенсивности и параметр размера должны быть удовлетворены для обнаружения и отбора сигнальных объектов.
Стоит отметить, что параметры отбора могут быть разными для разных областей применения. Например, для анализа питьевой воды диапазоны, пороги и выбранные формы могут отличаться от предварительно определенных для анализа качества воды, например, в озерах.
В следующих неограничивающих примерах показано, что для смеси микроорганизмов, включающей по меньшей мере E.coli и Ps.aeruginosa, определен диапазон размеров в виде диаметра 0.8-2 мкм и определен параметр интенсивности ниже 254 уровней яркости (GL) (лежащий в диапазоне 60-254 GL, не показано в примерах).
В одном варианте реализации, по меньшей мере два параметра, предпочтительно параметр интенсивности и параметр размера, должны быть удовлетворены для идентификации сигнальных объектов. Как только сигнальные объекты, которые удовлетворяют предварительно определенным критериям отбора, идентифицируют, данные объекты отбирают и устанавливают для них количественное значение. В одном варианте реализации, их среднеквадратическое значение интенсивности суммируют; эту суммированную интенсивность предпочтительно нормируют на предварительно определенный коэффициент нормировки (например, используя заданное уравнение (см. ниже в разделе Материалы и методы)) с получением количества культивируемых микробных клеток в образце (т.е. эквивалента КОЕ). Указанный коэффициент нормировки специфичен для типа клеток или для группы клеток, для типа исследуемого образца (т.е. для применения), и его определяют на основании количества клеток в исследуемых образцах, заранее измеренного при контролируемых условиях для данного применения. Например, коэффициент нормировки единожды определяют для питьевой воды в данном географическом местоположении при контролируемых условиях, путем сопоставления значений, полученных с помощью уловленных изображений, как описано выше, с количествами клеток, полученными с помощью обычных способов, таких как НРС (КОЕ/мл). Этот коэффициент нормировки затем можно использовать для последующего определения качества питьевой воды в данном географическом местоположении (см. раздел Материалы и методы).
В соответствии с одним вариантом реализации настоящего изобретения, коэффициент нормировки (нормирующее уравнение) 0.025x+0.3375 (где x представляет собой логарифмический масштаб суммарной флуоресценции) определили для исследуемого образца, содержащего смесь E.coli и Ps.aeruginosa.
Настоящее изобретение также обеспечивает набор для определения количественного значения, эквивалентного количеству культивируемых микробных клеток в исследуемом образце, включающий:
- по меньшей мере один сигнальный агент, способный связываться с мембраной клетки, инструкции для приведения во взаимодействие указанного по меньшей мере одного сигнального агента с образцом в течение первого периода времени (T1), достаточного для интернализации сигнального агента в указанную клетку до такого уровня, при котором сигнал, испускаемый образцом, по существу достигает плато;
- инструкции для удаления из указанного образца не связанного сигнального агента;
- инструкции для обнаружения и отбора из сигнальных объектов в указанном образце сигнальных культивируемых клеток, основанное на параметрах отбора, предварительно определенных для указанных культивируемых микробных клеток, при этом обнаружение и отбор осуществляют в течение второго периода времени (T2), следующего за T1, на протяжении которого сигнал по существу сохраняется на уровне указанного плато;
- инструкции для применения указанных отобранных сигнальных объектов для определения с их помощью количества культивируемых микробных клеток в исследуемом образце.
Указанный набор также может включать инструкции для удаления из указанного образца по меньшей мере части жидкости перед окрашиванием образца указанным сигнальным агентом.
В соответствии с одним вариантом реализации настоящего изобретения, указанный набор включает множество сигнальных агентов. При этом множество агентов характерно для данного применения, т.е. набор, предназначенный для анализа качества воды систем городского водоснабжения для использования в домашних условиях, следовательно, будет включать агенты, специфичные для микробных клеток, которые обычно обнаруживают в воде систем городского водоснабжения.
В одном варианте реализации, инструкции включают рекомендации для отбора клеток или группы клеток, которые нужно обнаружить, а также включают верхний порог интенсивности сигнала и/или диапазон интенсивности сигнала, предварительно определенный для указанных клеток или группы клеток, диапазон размеров для объектов, которые нужно обнаружить, предварительно определенные морфологии сигнальных объектов и инструкции для отбора таких объектов, которые удовлетворяют рекомендациям.
Дополнительно, в соответствии с этим конкретным аспектом, указанный набор может включать одно или несколько предварительно определенных специфичных для клетки нормирующих уравнений, каждое из которых специфично для типа бактериальной клетки, типа грибковой или другой микробной клетки, и инструкции для использования указанного предварительно определенного уравнения для получения с его помощью эквивалентного КОЕ количественного значения.
Настоящее изобретение также обеспечивает систему для определения количества культивируемых микробных клеток в исследуемом образце, включающую:
- носитель для удерживания образца, позволяющий приведение во взаимодействие указанного образца с одним или несколькими сигнальными агентами;
- детектор для обнаружения сигнальных объектов в образце и выведения результатов, соответствующих им;
- запоминающее устройство, включающее базу данных с предварительно определенными параметрами отбора и одним или несколькими предварительно определенными специфичными для данной клетки коэффициентами нормировки, при этом каждый параметр отбора и каждый коэффициент нормировки специфичен для микробной клетки или для группы микробных клеток;
- устройство обработки данных для получения выходных результатов с детектора, и для получения с указанного запоминающего устройства параметров отбора и указанных коэффициентов нормировки, специфичных для микробной клетки или для группы микробных клеток, и обработки указанных выходных результатов с указанными параметрами и указанным коэффициентом нормировки для определения с их помощью указанного количественного значения, эквивалентного количеству указанных культивируемых микробных клеток в образце.
Носитель может представлять собой любой держатель, который способен держать биологические клетки. В одном варианте реализации, носитель включает фильтр для отфильтровывания по меньшей мере части жидкости из указанного образца и удерживания полувысушенного или высушенного образца.
Детектор в соответствии с настоящим изобретением обычно включает систему визуализации люминесценции, такую как камера, способная улавливать одно или несколько изображений люминесцентных сигналов, испускаемых исследуемым образцом. Неограничивающие примеры камер, которые можно применять в соответствии с настоящим изобретением, включают прибор с зарядовой связью (ПЗС), КМОП-детектор, светодиодный детектор (СД), фотоэлектронный умножитель (ФЭУ), гамма счетчики, сцинтилляционные счетчики или любое другое улавливающее сигнал устройство, известное в области визуализации люминесцентных объектов.
Устройство обработки изображений сконфигурировано таким образом, что оно получает одно или несколько изображений, испускаемых исследуемым образцом, и определяет по ним, на основании параметров отбора сигнальных объектов, количество культивируемых клеток в образце.
В данной заявке термин "устройство обработки" обозначает любое приспособление для обработки и анализа данных, запрограммированное на сбор параметров измеренного сигнала от сигнальных объектов в образце и осуществление анализа данных, состоящего в отборе параметров сигнала согласно предварительно определенным условиям и выводе количественного значения на основании выбранных параметров отбора. Для этой цели, устройство обработки данных содержит компьютерную программу, сконфигурированную необходимым образом для осуществления данного анализа.
В одном варианте реализации, устройство обработки изображений сконфигурировано таким образом, чтобы оно позволяло отбирать среди всех сигнальных объектов такие объекты, которые имеют интенсивность сигнала в рамках предварительно определенного диапазона, размер в рамках предварительно определенного диапазона и предварительно определенную морфологию; и определять для выбранных сигнальных объектов среднеквадратическое значение интенсивности. Устройство обработки дополнительно сконфигурировано таким образом, чтобы оно выводило количественное значение на основании среднеквадратического значения интенсивности, испускаемой выбранными объектами.
В еще одном дополнительном варианте реализации, устройство обработки изображений сконфигурировано таким образом, чтобы оно нормировало количественное значение с помощью коэффициента нормировки, извлеченного из базы данных, с получением нормированного значения, которое эквивалентно определению количества с помощью КОЕ/мл.
Настоящее изобретение было описано наглядным способом, и должно быть очевидно, что характер использованной терминологии предполагают скорее описательный, чем ограничивающий. Очевидно, что возможно множество модификаций и вариантов настоящего изобретения в свете описанной выше идеи. Следовательно, должно быть очевидно, что в рамках прилагаемой формулы изобретения настоящее изобретение можно осуществить иным способом, чем конкретный описанный в настоящей заявке способ.
В настоящем описании и формуле изобретения формы единственного и множественного числа включают ссылку как на единственное, так и на множественное число, если не указано иное. Например, термин "параметр сигнала" включает один или несколько параметров.
Дополнительно, используемый в настоящей заявке термин "включающий" означает, что способы, наборы и системы включают перечисленные элементы, но не исключают другие элементы. Аналогично, формулировку "по существу состоящий из" используют для определения способов, наборов и систем, включающих перечисленные элементы, но исключающих другие элементы, которые могут существенно повлиять на осуществление настоящего изобретения. Термин "состоящий из" должен означать исключение более чем следовых количеств других элементов. Варианты реализации, определенные с помощью каждого из данных переходных терминов, входят в объем настоящего изобретения.
Дополнительно, все численные значения, например, концентрация или доза, или их диапазоны, представляют собой приближенные значения, которые могут отличаться в положительную или отрицательную сторону на величину до 20%, иногда на величину до 10%, от указанных значений. Должно быть очевидно, даже если это не всегда четко обозначено, что численные значения следует понимать, как если бы перед ними стоял термин "приблизительно". Также должно быть очевидно, хотя это не всегда четко обозначено, что реагенты, описанные в настоящей заявке, представляют собой всего лишь типичные реагенты, и что их эквиваленты известны в данной области техники.
ОПИСАНИЕ НЕОГРАНИЧИВАЮЩИХ
ТИПИЧНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ
Общие положения
В следующем неограничивающем примере, образцы, включающие воду для городского потребления (водопроводную воду), смешанную с предварительно определенными концентрациями бактерий, использовали для определения эффективности способа согласно настоящему изобретению.
В каждом образце определяли количество жизнеспособных репродуцирущих микроорганизмов способом согласно настоящему изобретению, а также с помощью стандартного определения количества в виде КОЕ (Standard Methods for Examination of Water & Wastewater (Lenore S. Clescerl (редактор), Arnold E. Greenberg (редактор), Andrew D. Eaton (редактор). 18-ое издание, 2002 г.). Результаты сравнили, и эффективность способа согласно настоящему изобретению имела коэффициент корреляции R2=0.997 со способом КОЕ.
Материалы и методы
Микробные клетки:
Были предусмотрены три исходных препарата микробных клеток:
Нативные формы E.coli (1ый препарат) и Ps.aeruginosa (2ой препарат) были выделены из водопроводной воды с помощью среды ТВХ (триптон, желчь, X-глюкуронид) для E.coli (производства Promega) и агара с цетримидом для Ps.aeruginosa (производства Promega). 3ий препарат включал обычную водопроводную воду и назывался препаратом с микробной смесью (так как водопроводная вода обычно содержит смесь микробов).
Культивированные и выделенные препараты E.coli и Ps.aeruginosa из водопроводной воды переносили в бульонные питательные среды и инкубировали при встряхивании, используя среду LB (лизогенный бульон) (Promega, номер в каталоге 7290A).
Условия инкубирования для трех указанных препаратов:
E.coli - 35°C в течение 18 ч.;
Ps.aeruginosa - 30°C в течение 40 ч.;
Вода со смесью микробных клеток - 30°C в течение 72 ч.
Культивированные препараты трижды промывали путем центрифугирования (6,000 об/мин в течение 5 мин), используя изонормальный ФБР. На этой стадии концентрации микробов, определенные с помощью фильтрации микробов и подсчета КОЕ, определили как приблизительно:
1010 КОЕ/мл для E.coli;
109 КОЕ/мл для Ps.aeruginosa; и
108 КОЕ/мл для смеси микробных клеток из воды.
Затем, микробные препараты (E.coli и Ps.aeruginosa) разбавляли стерильным ФБР, тогда как препарат смеси бактерий из водопроводной воды использовали в исходном виде или разбавляли стерилизованной водопроводной водой (которую получали путем фильтрации водопроводной воды через 0.22 мкм микробные фильтры (производства Milipore)). Гетеротропное определение количества клеток путем посева на чашках Петри (HPC) осуществляли, применяя процедуру фильтрования микробов (0.45 мкм фильтры) (Standard Methods for Examination of Water & Wastewater / Lenore S. Clescerl (редактор), Arnold E. Greenberg (редактор), Andrew D. Eaton (редактор). 18-ое издание, 2002 г.), при этом исследуемые объемы суспензий составляли от 0.01 мл до 1 литра. Фильтры инкубировали в среде PCA (Promega, номер в каталоге 7157A) при следующих условиях:
E.coli - 35°C в течение 24 ч.;
Ps.aeruginosa - 30°C в течение 48 ч.;
Смесь бактерий - 30°C в течение 72 ч.
Результаты подсчета КОЕ нормировали на 1 литр исследуемого объема.
Флуоресцентный краситель:
В следующих экспериментах использовали стириловый краситель FM1-43 (Nishikawa S. Sasaki F. Internalization of styryl dye FM1-43 in the hair cells of lateral line organs in Xenopus larvae, Histochem Cytochem, 1996 44(7):733-41) при концентрации 1 мкг/мл в ФБР.
Способ окрашивания:
Флуоресцентное окрашивание препаратов микробных клеток осуществляли при комнатной температуре (приблизительно 25°C), применяя стириловый краситель FM1-43. Время окрашивания и рабочее временное окно определяли, используя монослойный препарат клеток, и определили, что необходимо 2 минуты для достижения сигналом плато (T1, см. Определение T2 и T2, ниже) и плато оставалось в неизменном состоянии на протяжении периода времени, равного приблизительно 600 секунд (T2, см. Определение T1 и T2, ниже). По окончании окрашивания культуры трижды промывали изонормальным ФБР. Стоит отметить, что один и тот же способ окрашивания использовали как для адгерентных культур на поверхности фильтров, так и для суспендированных культур (т.е. он не ограничен монослойными препаратами).
Визуализация флуоресценции:
Флуоресцентные изображения сигнальных образцов получали, используя микроскоп Axiovert 200 (Karl Zeiss), объектив 1.3NA Plan Neofluor X10 (фильтр возбуждения BP 450-490 (возбуждение: 450-490 нм; светоделитель: FT 510 нм; испускание: 515-565 нм; Karl Zeiss).
Улавливание изображения:
Изображения улавливали с использованием стандартного ПЗС 512×512 Sensicam qe (Cooke Corp.).
Обработка изображения:
Обработку изображения и сбор данных осуществляли, применяя программное обеспечение ImagePro+ (2002).
Определение T1 и T2:
Для определения T1, из исходных препаратов получали три образца, т.е. образец водопроводной воды, содержащей смесь бактерий, обычно присутствующих в водопроводной воде (после культивирования на культуральной среде и промывки в ФБР, как описано выше); второй образец выделенных E.coli (после культивирования и промывки в ФБР, как описано выше) и третий образец выделенных Ps.aeruginosa (после культивирования и промывки в ФБР, как описано выше).
Образец из каждого исходного препарата анализировали с помощью методики HPC, с получением соответствующих обычных КОЕ/мл.
Каждый образец затем разбавляли ФБР с получением образцов с концентрацией приблизительно по 1000 КОЕ/мл. Каждый образец затем окрашивали FM1-43 и получали изображения монослоя (как описано выше) каждые 10 секунд до тех пор, пока сигнал, испускаемый монослоем, не достиг плато. Момент времени, в который сигнал достиг плато, назвали T1.
Определение T2
В дополнительном наборе трех таких образцов (разбавленных трех препаратов), приблизительно через 110 секунд после окрашивания образцов, образцы промывали ФБР и получали изображение монослоя с интервалами времени 10 секунд, до тех пор, пока сигнал не начал исчезать. Момент времени, в который сигнал начал исчезать, назвали T2.
Описанную выше процедуру повторяли три раза. Интенсивность сигнала, уловленного во время измерения, наносили на график, результаты представлены на Фигуре 1.
Определение эквивалента КОЕ:
Для определения эквивалента КОЕ (т.е. для калибровки измерения согласно настоящему изобретению в соответствии с определением количества с помощью стандартных КОЕ/мл), собирали и использовали три образца водопроводной воды из трех различных географических местоположений (A, B и C). Препараты из каждого местоположения получали, как описано выше для определения T1, для получения изолированных образцов E.coli и Ps.aeruginosa и образца смеси бактерий. Для каждого местоположения концентрацию каждых бактериальных клеток или суммарное количество бактерий для каждого препарата заранее определяли на основании методики HPC (т.е. чтобы получить TBC перед разведением), а затем образцы препаратов смеси бактерий (т.е. из каждого местоположения, всего из 3х) разбавляли стерилизованной водой, чтобы получить четыре приблизительные концентрации, 1000 КОЕ/мл, 100 КОЕ/мл, 10 КОЕ/мл и 1 КОЕ/мл, т.е. всего 12 образцов.
Каждый из 12 образцов анализировали согласно методике HPC, а также с помощью способа согласно настоящему изобретению. В последнем случае, каждый образец окрашивали FM1-43, как описано выше, промывали через 120 секунд стерилизованной водой (т.е. в начале плато) и немедленно получали изображение (через приблизительно 150-180 секунд). Изображение обрабатывали согласно параметрам отбора сигналов. В частности, как только изображение было уловлено, объекты, удовлетворяющие параметрам отбора, пересчитывали и определяли среднеквадратическое значение интенсивности. Результаты отбора приведены в Таблицах 1A-1B ниже.
E.coli и Ps.aeruginosa, выделенные из образцов, полученных, как описано выше, обрабатывали также, как и образец смеси бактерий. Заметили, что динамика изменений была аналогична таковой для смеси бактерий, и что не было существенных изменений в сигналах, полученных от образца смеси бактерий с похожими концентрациями (результаты не представлены).
Подтверждение способа согласно настоящему изобретению
Всего 48 исследуемых микробных образцов получили из трех различных местоположений, как описано выше (4 образца из каждого местоположения, каждый образец в трех повторностях). В частности, препараты из каждого местоположения (с неизвестной концентрацией клеток) либо разбавляли стерилизованной водой в 10 раз, в 100 раз, либо не разбавляли. Также, один образец исходного препарата из каждого местоположения стерилизовали путем фильтрации через 0.22 мкм сетчатый фильтр (нитроцеллюлоза, производства Milipore).
Каждый исследуемый образец затем окрашивали FM1-43, промывали стерилизованной водой и анализировали, применяя обычный способ HPC или способ согласно настоящему изобретению, как описано выше. Результаты представлены в Таблице 2, ниже.
Измерение флуоресценции
Все измерения флуоресценции и соответствующий подсчет КОЕ осуществляли при комнатной температуре (~25°C).
Визуализация и обработка сигнала
С целью анализа изображения, микробный сигнальный объект (т.е. объект, который нужно сосчитать) определили как имеющий размеры 0.8-1.5 мкм при визуализации с помощью светового микроскопа, что соответствовало 12-28 пикселям (при конкретной настройке, используемой в данных неограничивающих примерах). Эти параметры представляли собой критерии отбора.
В неограничивающих примерах, приведенных в настоящей заявке, если не указано иначе, изображения образцов получали через 150-180 секунд после окрашивания (т.е. непосредственно через 2 минуты после окрашивания). Дополнительно, время экспонирования было откалибровано таким образом, чтобы максимальная интенсивность флуоресценции "микробных объектов" достигала 254 уровней яркости (или между 60-254 GL). Время экспонирования скорректировали до 0.8 секунд.
Вычисление средних значений и стандартное отклонение (в процентах) использовали для определения количественных значений.
Результаты
Настоящее изобретение основано на понимании того, что репродуцирущие (культивируемые) микробные клетки могут интернализовать липидные фракции внешней клеточной стенки и концентрировать их внутри клетки на протяжении некоторого периода времени (быстрее по сравнению с некультивируемыми микробными клетками). Скорость мембранного транспорта и уровень внутриклеточной концентрации липидных фракций представляет собой функцию от активности клетки, и она очень высока в способных размножаться микроорганизмах. Таким образом, авторы настоящего изобретения обнаружили, что этот феномен можно использовать, чтобы различить и определить количество жизнеспособных, способных размножаться клеток в образце.
Определение T1 и T2:
На Фигуре 1 показано, что накопление FM1-43 до тех пор, пока сигнал не достиг плато, продолжалось приблизительно 120 секунд после окрашивания. Этот момент времени, таким образом, назвали T1.
Стабильное накопление красителя внутри клетки сохранялось на постоянном уровне во временном окне от 115 до 550 секунд с момента начала плато. Другими словами, накопление флуоресцентного красителя во внутриклеточном компартменте клеток в смеси клеток стабилизировалось через 115 секунд и оставалось таковым по меньшей мере до момента времени 550 секунд. Таким образом, определили, что для количественного определения E.coli и/или Ps.aeruginosa в жидком образце, временное окно от приблизительно 115 до приблизительно 550 секунд представляет собой эффективное окно измерения T2.
Определение эквивалента КОЕ:
Изображения для 12 микробных образцов, использованных для определения эквивалента КОЕ, как описано выше, обрабатывали, чтобы выбрать из них объекты, удовлетворяющие предварительно определенным критериям отбора (т.е. размеры 0.8-1.5 мкм при визуализации с помощью светового микроскопа, что соответствовало 12-28 пикселям, максимальная интенсивность составляла 254 уровня яркости).
Определенные среднеквадратические значения интенсивности для выбранных объектов включены в Таблицы 1A-1B вместе с определением количества КОЕ/мл, полученным с помощью обычной методики HPC. Приблизительную концентрацию определяли на основании определения количества КОЕ/мл, полученных для исходных препаратов. Различные образцы идентифицируют по местоположению (A, B или C) и номеру образца в данном местоположении (X1, X2 или X3).
Результаты, приведенные в Таблице 1A, также представлены на Фигуре 2, на которой показана корреляция между значениями КОЕ/мл, полученными с помощью стандартного способа HPC, и количественными значениями, полученными с помощью способа согласно настоящему изобретению. На Фигуре 2, в частности, показано, что корреляция между двумя способами измерения может быть представлена следующим уравнением: y=0.025x+0.3375.
Это уравнение, таким образом, определили как нормировочный множитель для определения количества микробов в смеси микробов в образцах водопроводной воды из системы городского водоснабжения.
Подтверждение способа, эквивалентного КОЕ.
Чтобы подтвердить точность указанного выше уравнения применительно к неизвестным образцам водопроводной воды, осуществляли дополнительный анализ образцов воды для городского потребления из различных местоположений, как описано выше, однако, не определяя заранее концентрацию бактерий. Из каждого местоположения брали три образца. Все образцы разбавляли, как описано в разделе Материалы и методы (препараты для этапа подтверждения), и исследовали параллельно для определения эквивалента определению количества KOE в соответствием со способом согласно настоящему изобретению с использованием определенного выше нормирующего уравнения, и стандартного определения количества КОЕ. Стоит отметить, что образцы идентифицировали по их местоположению, разведению и номеру образца из набора трех повторностей, т.е. для каждого местоположения A, B или C, и для каждого разведения, например, A1, A2, A3, A4, использовали три повторности: A1a, A1b, A1c. Таким образом, например, образец A1a обозначает один из трех образцов из местоположения 1, без разведения.
Результаты представлены в Таблице 2, что позволяет сравнить эквивалент определению количества КОЕ (способ согласно настоящему изобретению) и стандартное определение количества КОЕ в различных жидких образцах.
Показано, что различие между количественным значением, полученным с помощью способа согласно настоящему изобретению, т.е. эквивалентом КОЕ, и значением, полученным с помощью обычного способа HPC, составляло менее 10% для всех исследуемых образцов. Коэффициент корреляции составлял R2=0.9978, что подтверждает тот факт, что эквивалент определению количества КОЕ согласно способу согласно настоящему изобретению можно применять для надежного определения количества КОЕ практически в реальном времени.
Результаты, представленные в Таблице 2, также наносили на график, приведенный на Фигуре 3A (♦ обозначает эквивалент КОЕ, ■ обозначает стандартные КОЕ), при этом корреляция между эквивалентом КОЕ и стандартными КОЕ представлена на Фигуре 3B.
Сравнение стандартного определения количества КОЕ и определения эквивалента КОЕ для количественного анализа способных размножаться микроорганизмов.
Эквивалент КОЕ согласно настоящему изобретению обеспечивает средство быстрого, практически в реальном времени, количественного анализа микроорганизмов в жидком образце. Эквивалент КОЕ не только требует меньших затрат времени по сравнению со стандартными способами определения количества КОЕ, но и время получения результатов приближается к реальному времени (от 5 до 10 минут, по сравнению с днями при применении стандартного определения количества КОЕ).
Более того, определение количества с помощью эквивалента КОЕ будет менее затратным, может представлять собой автоматизированный процесс, оно не требует больших рабочих пространств и может осуществляться рядом с исследуемой областью. Результаты сравнения показаны на Фигуре 3A и на Фигуре 3B. В частности, на Фигуре 3A показано, что существует практически линейная корреляция между двумя описанными методиками измерения, т.е. R2=0.9978, и на Фигуре 3B показано, что для каждого образца значения, полученные с помощью каждого способа (HPC или способ согласно настоящему изобретению) практически совмещаются. Таким образом, пришли к заключению, что способ согласно настоящему изобретению может надежно обеспечивать эквивалентное КОЕ значение.


Настоящее изобретение относится к области микробиологии. Группа изобретений включает способ и систему для определения количества культивируемых микробных клеток, таких как E.coli, Ps.aeroginosa, или смеси микробных клеток (например, для определения суммарного количества микробов) в исследуемом образце. При этом указанный способ включает (i) приведение во взаимодействие исследуемого образца, который может содержать культивируемые микробные клетки, с по меньшей мере одним сигнальным агентом, способным связываться с мембраной микробной клетки, указанное приведение во взаимодействие производится в течение предварительно определенного первого периода времени (T1), достаточного для интернализации сигнального агента в микробную клетку до такого уровня, при котором сигнал, испускаемый образцом, по существу достигает плато; (ii) удаление из указанного исследуемого образца неинтернализованного сигнального агента; (iii) в течение второго периода времени (T2), следующего за указанным первым периодом времени (T1), на протяжении которого указанный сигнал по существу сохраняется на уровне указанного плато, обнаружение среди сигнальных объектов в указанном образце сигнальных культивируемых клеток, основанное на параметрах отбора, предварительно определенных для указанных культивируемых клеток; и (iv) определение на основании указанных выбранных сигнальных объектов количественного значения, указывающего на количество культивируемых клеток в исследуемом образце. Группа изобретений позволяет, практически в реальном времени, получить высокоточное количественное значение, отражающее содержание микробных клеток в образце, которое может быть эквивалентом КОЕ. 2 н. и 37 з.п. ф-лы, 4 ил., 3 табл.
1. Способ определения количественного значения, указывающего на количество культивируемых микробных клеток в исследуемом образце, включающий:
(i) приведение во взаимодействие исследуемого образца, который может содержать культивируемые микробные клетки, с по меньшей мере одним сигнальным агентом, способным связываться с мембраной микробной клетки, причем указанное приведение во взаимодействие проводят в течение предварительно заданного первого периода времени (T1), достаточного для интернализации сигнального агента в микробную клетку до такого уровня, при котором сигнал, испускаемый образцом, по существу достигает плато;
(ii) удаление из указанного исследуемого образца неинтернализованного сигнального агента;
(iii) в течение второго периода времени (T2), следующего за указанным первым периодом времени (T1), на протяжении которого указанный сигнал по существу сохраняется на уровне указанного плато, обнаружение среди сигнальных объектов в указанном образце сигнальных культивируемых клеток, при этом указанное обнаружение основано на параметрах отбора, предварительно заданных для указанных культивируемых клеток; и
(iv) определение на основании указанных отобранных сигнальных объектов количественного значения, указывающего на количество культивируемых клеток в исследуемом образце.
2. Способ по п.1, включающий удаление по меньшей мере части жидкости из указанного исследуемого образца перед окрашиванием образца указанным сигнальным агентом.
3. Способ по п.2, отличающийся тем, что удаление жидкости осуществляют путем одной или нескольких фильтраций или центрифугирований.
4. Способ по любому из пп.1-3, отличающийся тем, что указанный образец включает один или несколько типов микробных клеток.
5. Способ по любому из пп.1-3, отличающийся тем, что сигнальный агент представляет собой люминесцентный агент или светоизлучающий агент.
6. Способ по любому из пп.1-3, включающий приведение во взаимодействие указанного образца с по меньшей мере одним дополнительным сигнальным агентом, который обладает специфичностью к выбранной микробной клетке, наличие которой предполагают в указанном образце.
7. Способ по п.6, включающий обнаружение сигнала, испускаемого каждым сигнальным агентом в указанном образце, и определение на основании данного сигнала количественного значения, указывающего на количество определенных культивируемых микробных клеток в образце.
8. Способ по п.6 для определения множества количественных значений, в котором каждое значение указывает на количество определенных микробных клеток или микробных клеток определенной группы в образце.
9. Способ по любому из пп.1-3 или 8, отличающийся тем, что указанные параметры отбора включают два или несколько параметров, выбранных из интенсивности сигнала, испускаемого сигнальным объектом, размера сигнального объекта, морфологии сигнального объекта.
10. Способ по п.9, отличающийся тем, что определяют только сигнальные объекты, обладающие по меньшей мере интенсивностью сигнала ниже предварительно заданного верхнего порога и размером в рамках диапазона размеров объекта.
11. Способ по п.9, отличающийся тем, что определяют только сигнальные объекты, обладающие по меньшей мере интенсивностью сигнала в рамках предварительно заданного диапазона интенсивности и размером объекта в рамках определенного диапазона.
12. Способ по п.9, включающий вычисление для указанных выбранных объектов указанного количественного значения.
13. Способ по п.12, отличающийся тем, что указанное количественное значение включает среднеквадратическое значение интенсивности указанных выбранных объектов.
14. Способ по п.12 или 13, отличающийся тем, что указанное количественное значение нормируют в соответствии с колониеобразующими единицами (КОЕ), причем указанное нормированное количественное значение представляет собой эквивалент КОЕ.
15. Способ по п.14, отличающийся тем, что нормирование включает умножение указанного количественного значения на предварительно определенный для конкретной клетки коэффициент нормировки с получением указанного эквивалента КОЕ.
16. Способ по п.1 отличающийся тем, что указанный исследуемый образец представляет собой жидкий, полужидкий или сухой образец питьевой воды, пищевого продукта, напитка, фармацевтического продукта, средства личной гигиены, образец воды из системы городского водоснабжения, колодца, воды на хозяйственно-питьевые нужды, сточной воды, природного источника воды, воды для рекреационного пользования, почвы, воздушной среды, образец плазмы, образец слюны, образец мочи, образец из горла или образец жидкости желудочно-кишечного тракта.
17. Способ по п.1, отличающийся тем, что указанные культивируемые микробные клетки включают бактерии, плесневые грибы, дрожжи, простейшие, водоросли, ацидофильные бактерии, легионеллы или виды вибриона.
18. Способ по п.17, отличающийся тем, что указанные бактерии включают колиформные бактерии, энтеробактерии, такие как сальмонелла, листерия и шигелла; псевдомонады, стафилококки и метанобактерии.
19. Способ по п.17, отличающийся тем, что указанные плесневые грибы включают Aspergillus niger и пенициллы.
20. Способ по п.17, отличающийся тем, что указанные плесневые грибы включают кандиды и сахаромицеты.
21. Способ по п.17, отличающийся тем, что указанные простейшие включают криптоспоридии и лямблии.
22. Способ по п.9, отличающийся тем, что размер сигнального объекта составляет от 0,8 до 2,0 мкм, интенсивность сигнала, испускаемого сигнальным объектом, находится в диапазоне от 60 до 254 GL, и морфология сигнального объекта представляет собой округлую, вытянутую или палочковидную форму.
23. Способ по п.1, отличающийся тем, что T1 составляет от 70 до 110 секунд.
24. Способ по п.1, отличающийся тем, что плато составляет от 50 до 900 секунд.
25. Способ по п.1, отличающийся тем, что T2 составляет 600 секунд.
26. Способ по п.1, отличающийся тем, что сигнал, испускаемый культивируемыми клетками в образце, в 1,5-20 раз превышает сигнал, испускаемый жизнеспособными некультивируемыми клетками.
27. Способ по п.1, отличающийся тем, что указанный сигнальный агент представляет собой испускающий флуоресценцию агент, испускающий фосфоресценцию агент, испускающий хемилюминесценцию агент, испускающий радиолюминесценцию агент, испускающий термолюминесценцию агент, биолюминесцентный агент или агент, включающий флуоресцентный фрагмент, конъюгированный с липофильным линкером.
28. Способ по п.6, отличающийся тем, что указанный дополнительный сигнальный агент представляет собой агент, включающий лиганд, обладающий специфичностью к внеклеточному компоненту клетки микроорганизма, ферментативной молекуле, специфичному к клетке антителу или бактериофагу.
29. Система для определения количественного значения, указывающего на количество культивируемых микробных клеток в исследуемом образце, включающая:
(i) носитель для удерживания указанного образца, позволяющий приведение образца во взаимодействие с одним или несколькими сигнальными агентами;
(ii) детектор для обнаружения сигнальных объектов в образце и выведения результатов, соответствующих им;
(iii) запоминающее устройство, включающее базу данных с предварительно определенными параметрами отбора и множеством предварительно определенных коэффициентов нормировки, при этом каждый параметр отбора и каждый коэффициент нормировки специфичен для микробной клетки или для группы микробных клеток;
(iv) устройство обработки данных для получения выходных результатов с детектора, одного или нескольких указанных параметров и указанного коэффициента нормировки с указанного запоминающего устройства и обработки указанных выходных результатов с указанными параметрами и указанным коэффициентом нормировки для определения указанного количественного значения, указывающего на количество указанных культивируемых микробных клеток в указанном образце.
30. Система по п.29, отличающаяся тем, что указанный носитель включает фильтр для отфильтровывания по меньшей мере части жидкости из указанного образца.
31. Система по п.29, отличающаяся тем, что указанный детектор включает камеру для получения изображения сигнальных объектов в указанном исследуемом образце.
32. Система по п.31, отличающаяся тем, что указанное устройство обработки данных сконфигурировано таким образом, что оно определяет по результатам, полученным с указанного детектора, для каждого обнаруженного сигнального объекта интенсивность сигнала, размер сигнального объекта, морфологию сигнального объекта.
33. Система по любому из пп.29-32, отличающаяся тем, что указанное устройство обработки данных сконфигурировано таким образом, что оно отбирает сигнальные объекты, обладающие интенсивностью сигнала ниже предварительно определенного порога интенсивности и размером в рамках предварительно определенного диапазона.
34. Система по любому из пп.29-32, отличающаяся тем, что указанное устройство обработки данных сконфигурировано таким образом, что оно отбирает сигнальные объекты, обладающие интенсивностью сигнала в рамках предварительно определенного диапазона интенсивности и размером в рамках предварительно определенного диапазона.
35. Система по п.33, отличающаяся тем, что указанное устройство обработки данных сконфигурировано таким образом, что оно выводит количественное значение на основании среднеквадратического значения интенсивности, испускаемой отобранными сигнальными объектами.
36. Система по любому из пп.29-32, отличающаяся тем, что указанное устройство обработки данных сконфигурировано таким образом, что оно нормирует количественное значение с коэффициентом нормировки, извлеченным из указанной базы данных.
37. Система по любому из пп.29-32, включающая кассету одного или нескольких сигнальных агентов, при этом указанная система заранее запрограммирована таким образом, что она позволяет указанной кассете высвобождать указанный один или несколько сигнальных агентов в указанный носитель и позволяет осуществлять контактирование указанного одного или нескольких сигнальных агентов с исследуемым образцом в указанном носителе.
38. Система по любому из пп.29-32, включающая совокупность кассет, каждая из которых содержит сигнальный агент, при этом указанная система заранее запрограммирована таким образом, что она позволяет высвобождение в носитель одного или нескольких сигнальных агентов из указанной совокупности кассет.
39. Система по п.29, отличающаяся тем, что указанный сигнальный агент представляет собой испускающий флуоресценцию агент, испускающий фосфоресценцию агент, испускающий хемилюминесценцию агент, испускающий радиолюминесценцию агент, испускающий термолюминесценцию агент, биолюминесцентный агент или агент, включающий флуоресцентный фрагмент, конъюгированный с липофильным линкером.
| US 6673568 B1, 06.01.2004 | |||
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИБИОТИКОВ, СОДЕРЖАЩИХ β-ЛАКТАМНЫЙ ЦИКЛ, В ЖИДКОСТИ БИОЛОГИЧЕСКОГО ПРОИСХОЖДЕНИЯ И АНАЛИТИЧЕСКИЙ НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1999 |
|
RU2213973C2 |
Авторы
Даты
2014-05-27—Публикация
2009-07-09—Подача