Изобретение относится к способам получения полифторарил(триметил)силанов, в частности полифторарил(триметил)силанов и перфторарилен-бис-(триметил)силанов, содержащих во фторированом ароматическом ядре также атомы водорода, и алкильные заместители.
Фторарил(триметил)силаны являются универсальными реагентами для введения фторароматических фрагментов в различные классы органических и элементоорганических соединений. Соединения, содержащие фторароматические фрагменты, находят применение в электронике при создании диодов (Adv.Mater., 2004, v.16, 2001), жидкокристаллических дисплеев (J. Mater. Chem., 1999, v.9, p.2755), в полиграфии (Патент США 5744273, 1999) и других областях современной техники.
Известен двухстадийный способ полученения пентафторфенил(триметил)силана взаимодействием реактивов Гриньяра, полученных из пентафторбром- или пентафторхлорбензолов с триметилхлорсиланом в диэтиловом эфире или в тетрагидрофуране. Выходы пентафторфенил(триметил)силана в эфире и тетрагидрофуране достигают 42% (Angewandte Chemie, v.76, (1964), p.953) и 85% (Journal of Organometallic Chemistry, v.25(1970), p.273-276) соответственно.
Также известно получение фторарил(триметил)силанов взаимодействием литиевых производных, полученных из соответствующих фторированных бензолов с триметилхлорсиланом (Journal of Organometallic Chemistry, v.19, (1969), p.17-27, Journal of Organometallic Chemistry, v.13, (1968), p.73, 77, 78). Во всех этих методах используют эфирные растворители и инертную атмосферу, что делает их внедрение в производство сложным и опасным.
Также известен способ получения фторарил(триметил)силанов взаимодействием полифторарилбромидов или иодидов с триметилхлорсиланом в присутствии трисдиалкиламинофосфинов (Журнал Общей Химии, 1992, т.62, с.2342-2349; Изв. АН СССР Сер.хим., 1997, с.813-817). Выходы силанов в пентане, гексане и хлористом метилене достигают 63-68%. Существенным недостатком этого способа является необходимость использования трисдиалкиламинофосфинов, высокотоксичных и канцерогенных веществ, требующих также при работе инертной атмосферы.
Известен способ получения пентафторфенил(триметил)силана взаимодействием пентафторбензоил хлорида с гексаметилдисиланом при катализе комплексом палладия PdCl2(PhCN)2 в присутствии триэтилфосфита. Реакция проходит при кипячении смеси в толуоле в атмосфере аргона в течение 5 дней, выход продукта достигает 85% (Organometallics, 2006, v.25, p.4648-4652). Этот способ также требует инертной атмосферы, а также применения значительных количеств дорогостоящего катализатора.
Была показана возможность получения пентафторфенил(триметил)силана электрохимически (Электрохимия, 2000, т.36, с.210-218). Однако этот метод требует сложного специального оборудования.
Задачей, на решение которой направлено предлагаемое изобретение, является создание нового способа получения полифторарил(триметил)силанов, простого в технологическом отношении, позволяющего получать разнообразные полифторарил(триметил)силаны с высокими выходами из доступных исходных веществ, выпускаемых промышленностью.
Поставленная задача решается заявляемым способом получения полифторарил(триметил)силанов формулы (I):
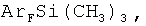
где 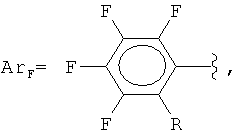
R = F, H, Si(CH3)3, CH3,
из фторароматических кислот, заключающимся в том, что полифторароматическую моно- или дикислоту подвергают взаимодействию с триметилхлорсиланом (ТМХС) при соотношении кислоты и ТМХС 1:1-6 в интервале температур 60-70°C, при этом из монокарбоновой кислоты образуется моно(триметил)силиловый эфир, а из дикислоты образуется моно- или бис-(триметил)силиловый эфир в зависимости от соотношения реагентов. После отгонки непрореагировавшего ТМХС к образовавшемуся (триметил)силиловому эфиру кислоты добавляют апротонный растворитель, такой как диметилформамид, диметилацетамид, N-метилпирролидон или сульфолан, и галогенид щелочного металла MX (где M=Na, K, Cs, а Х=Cl, F, Br), взятый в мольном соотношении (0,01-1):1 к (триметил)силиловому эфиру, и нагревают реакционную смесь при температуре 70-130°C, получая целевой продукт, который выделяют известными методами.
Способ осуществляется следующим образом: вначале взаимодействием ароматической фторированной кислоты с триметилхлорсиланом при нагревании до 60-70°C получают соответствующий (триметил)силиловый эфир, причем из дикарбоновых ароматических кислот получают как моно-, так и бис-(триметил)силиловые эфиры, в зависимости от количества взятого для реакции триметилхлорсилана. При мольном соотношении дикарбоновой кислоты и ТМХС 1:1 получают моно(триметил)силиловые эфиры, а при соотношении кислоты к ТМХС 1:2-6 и более длительном нагревании - бис-(триметил)силиловые эфиры дикарбоновых кислот. Затем при необходимости избыток триметилхлорсилана отгоняют, добавляют к полученному (триметил)силиловому эфиру апротонный полярный растворитель и нагревают раствор в присутствии галогенида щелочного металла MX (где M=Na, K, Cs, a X=Cl, F, Br), взятого в мольном соотношении 0,01-1:1 к (триметил)силиловому эфиру, до температуры 70°C, выдерживают при этой температуре около часа, затем нагревают до 110°C и выдерживают до прекращения газовыделения, в результате чего образуется соответствующий полифторарил(триметил)силан (I), который выделяют, выливая реакционную смесь в воду и отделяя нижний органический слой, который затем сушат над сульфатом магния и перегоняют. Выходы продуктов составляют 75-91% от теории в расчете на исходную кислоту. Обе стадии осуществляются последовательно в одном реакторе.
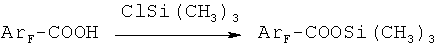
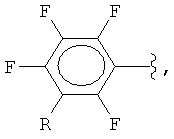
где 


R = F, H, CH3, COOH, COOSi(CH3)3,
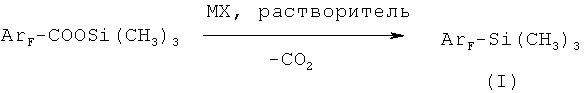
М = Na, К, Cs,
Х = F, Cl, Br,
растворитель = ДМФА, ДМАА, сульфолан, N-метилпирролидон.
Преимуществами заявляемого способа являются:
- использование в качестве исходных соединений фторароматических кислот, которые производятся в промышленных масштабах;
- использование в способе простых в аппаратурном оформлении реакций, не требующих ни инертной атмосферы, ни специального оборудования.
Технический результат изобретения состоит в создании нового способа получения полифторфенил(триметил)силанов из доступного в промышленности сырья и простого в аппаратурном оформлении, где весь производственный цикл проводится в одном реакторе.
Изобретение иллюстрируется приведенными ниже примерами
Пример 1
(i) К 150 г триметилхлорсилана добавляют при перемешивании 100 г пентафторбензойной кислоты. Реакционную смесь постепенно нагревают до 70°C, по завершении газовыделения отгоняют избыток триметилхлорсилана. Получают 133 г (триметил)-силилового эфира пентафторбензойной кислоты. 19F ЯМР (от CFCl3):-140 м. (2F), -152 м. (1F), -163 м. (2F).
(ii) К полученному (триметил)силиловому эфиру пентафторбензойной кислоты добавляют при перемешивании 100 мл ДМФА и 0,3 г фтористого калия, нагревают до 70°C, выдерживают 1 час, затем нагревают до 110°C и перемешивают при этой температуре до окончания газовыделения, после чего раствор охлаждают до комнатной температуры и выливают в воду. Нижний слой отделяют, сушат над сульфатом магния, фильтруют, перегоняют. Получают 95 г пентафторфенил(триметил)силана в виде бесцветной прозрачной жидкости. Т.кип. 60-61°C/20 мм рт.ст., 19F ЯМР (от CFCl3)-128 м. (2F), -152 м. (1F), -162 м. (2F), что соответствует лит. данным (Organometallics, 2006, v.25(19), p.4648-4652). Выход 84%.
Пример 2
(i) К 140 г триметилхлорсилана добавляют при перемешивании 100 г тетрафтортерефталевой кислоты, реакционную смесь постепенно нагревают до 70°C, по завершении газовыделения отгоняют избыток триметилхлорсилана. Получают 160 г бис-(триметил)силилового эфира тетрафтортерефталевой кислоты. 19F ЯМР (CDCl3), (от CFCl3) - 141 м (4F), 1Н ЯМР (CDCl3) 0,78 с.
(ii) К полученному бис(триметил)силиловому эфиру тетрафтортерефталевой кислоты при перемешивании добавляют 100 мл ДМФА и 0,18 г фтористого калия, нагревают до 70°C, выдерживают 1 час, затем нагревают до 110°C и перемешивают при этой температуре до окончания газовыделения, после чего раствор охлаждают до комнатной температуры и выливают в воду. Нижний слой отделяют, сушат над сульфатом магния, фильтруют, перегоняют. Получают 102 г (перфтор-1,4-фенилен)-бис(триметилсилана) в виде белого порошка. Т.пл. 52°C, 19F ЯМР (CDCl3), (от CFCl3) -129 м (4F). Характеристики продукта согласуются с литературными данными (Organometallics, 2006, v.25 (19), p.4648-4652). Выход 83%.
Пример 3
(i) К 150 г триметилхлорсилана добавляют при перемешивании 91 г 2,3,4,5-тетрафторбензойной кислоты, реакционную смесь постепенно нагревают до 70°C, по завершении газовыделения отгоняют избыток триметилхлорсилана. Получают 125 г (триметил)силилового эфира 2,3,4,5-тетрафторбензойной кислоты.
(ii) К полученному (триметил)силиловому эфиру 2,3,4,5-тетрафторбензойной кислоты добавляют при перемешивании 100 мл ДМФА и 0,27 г фтористого калия, нагревают до 70°C, выдерживают 1 час, затем нагревают до 110°C и перемешивают при этой температуре до окончания газовыделения, после чего раствор охлаждают до комнатной температуры, выливают в воду. Нижний слой отделяют, сушат сульфатом магния, фильтруют, перегоняют. Получают 86 г 2,3,4,5-тетрафторфенил(триметил)силана в виде бесцветной прозрачной жидкости. Т.кип 66-67°C/15 мм рт.ст. 19F ЯМР (CDCl3), (от CFCl3): - 137,4 м. (1F), - 141,0 м. (1F), - 151,7 м. (1F), - 157,4 м (1F). Выход 75%.
Пример 4
(ii) К 133 г (триметил)силилового эфира пентафторбензойной кислоты, полученного как в примере 1, при перемешивании добавляют 100 мл ДМАА и 0,3 г фтористого калия, нагревают до 70°C, выдерживают 1 час, затем нагревают до 110°С и перемешивают при этой температуре до окончания газовыделения, после чего раствор охлаждают до комнатной температуры и выливают в воду. Нижний слой отделяют, сушат над сульфатом магния, фильтруют, перегоняют. Получают 90 г пентафторфенил-(триметил)силана в виде бесцветной прозрачной жидкости. Характеристики совпадают с описанными в примере 1. Выход 80%.
Пример 5
(ii) К 133 г (триметил)силилового эфира пентафторбензойной кислоты, полученного как в примере 1, при перемешивании добавляют 100 мл N-метилпирролидона и 0,3 г фтористого калия, нагревают до 70°C, выдерживают 1 час, затем нагревают до 110°C и перемешивают при этой температуре до окончания газовыделения, после чего раствор охлаждают до комнатной температуры, выливают в воду. Нижний слой отделяют, сушат над сульфатом магния, фильтруют, перегоняют. Получают 99 г пентафторфенил(триметил)силана в виде бесцветной прозрачной жидкости. Характеристики совпадают с описанными в примере 1. Выход 88%.
Пример 6
(i) К 48 г тетрафтортерефталевой кислоты добавляют 22 г ТМХС, реакционную смесь нагревают до кипения и кипятят до прекращения газовыделения. После охлаждения получают 53 г (триметил)силилового эфира терефталевой кислоты 19F ЯМР (CDCl3), (от CFCl3) - 138 м(.(2F), -140 м(.(2F). 1H ЯМР (CDCl3) 0,78 с. (9Н), 13 с. (1Н).
(ii) К полученному (триметил)силиловому эфиру тетрафтортерефталевой кислоты добавляют 100 мл ДМФА и 1,1 г KF и нагревают до 70°C, выдерживают 1 час, затем нагревают до 110°C и перемешивают при этой температуре до окончания газовыделения. После обычной обработки получают 37 г 2,3,5,6-тетрафторфенил(триметил)силана в виде бесцветной прозрачной жидкости. Т.кип 65°C/15 мм рт.ст. 19F ЯМР (CDCl3), (от CFCl3), -129,0 м. (2F), - 141,7 м. (2F). Лит.данные: Т.кип. (температура бани) 80-85°C/20 мм рт.ст. 19F ЯМР (CDCl3), (от CFCl3), -128 м. (2F), -139 м. (2F). (Tetrahedron, 1988, v.44(13), 4135-4145). Выход из тетрафтортерефталевой кислоты 83%.
Пример 7
(i) К 75 г ТМХС добавляют при перемешивании 45 г 2,3,4,5-тетрафторбензойной кислоты, реакционную смесь постепенно нагревают до 70°C и перемешивают до завершения газовыделения. Получают 63 г (триметил)силилового эфира 2,3,4,5-тетрафторбензойной кислоты.
(ii) К полученному (триметил)силиловому эфиру 2,3,4,5-тетрафторбензойной кислоты добавляют 50 мл ДМФА и 0,78 г CsF, нагревают до 70°C, выдерживают 1 час при этой температуре, затем нагревают до 110°C и перемешивают до окончания газовыделения. После обычной обработки получают 45 г 2,3,4,5-тетрафторфенил-(триметил)силана. Характеристики совпадают с описанными в примере 3. Выход из 2,3,4,5-тетрафторбензойной кислоты 87%.
Пример 8
(ii) К (триметил)силиловому эфиру 2,3,4,5-тетрафторбензойной кислоты, полученному как в примере 7, добавляют 50 мл ДМФА и 0,61 г KBr, нагревают до 70°C, выдерживают час при этой температуре, затем нагревают до 110°C и перемешивают окончания газовыделения. После обычной обработки получают 38 г 2,3,4,5-тетрафторфенил(триметил)силана, характеристики совпадают с описанными в примере 3. Выход из 2,3,4,5-тетрафторбензойной кислоты 73%.
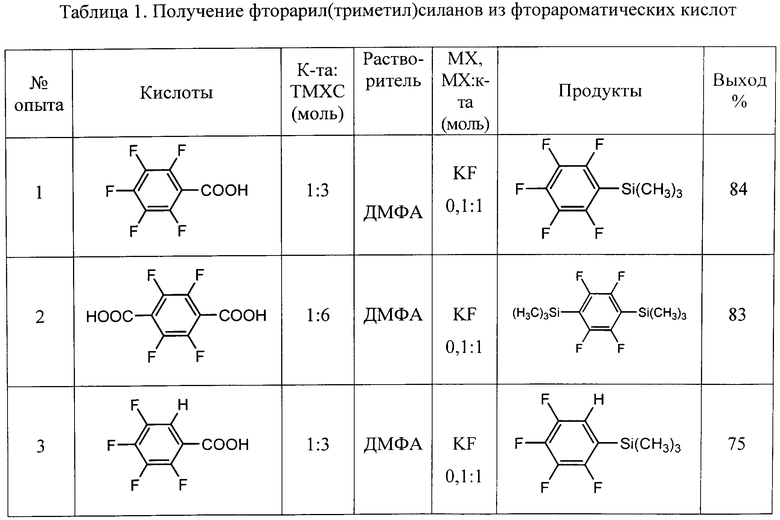
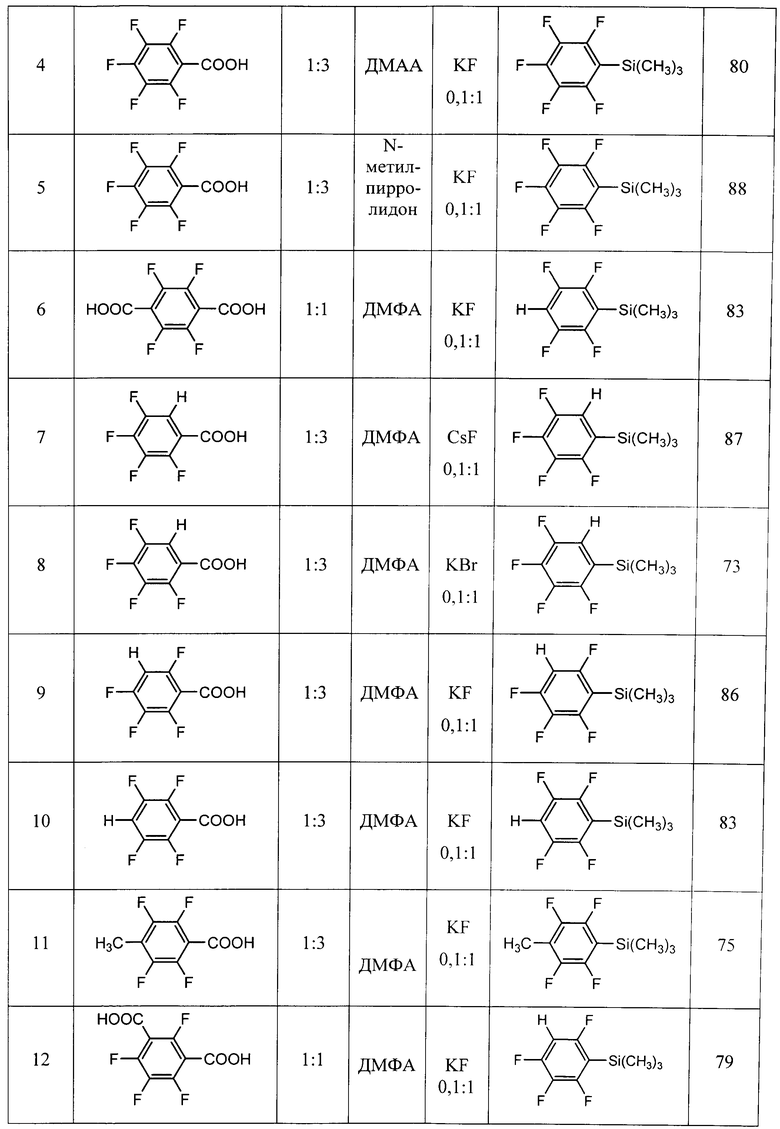
Другие примеры осуществления способа (примеры 9-18) приводятся в таблице 1.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МОНО- И ДИГИДРОКСИПОЛИФТОРБЕНЗОЛОВ | 2013 |
|
RU2536872C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРИМЕТИЛ(ТРИФТОРМЕТИЛ)СИЛАНА | 2014 |
|
RU2550139C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРФТОРАЛКИЛЙОДИДОВ | 2020 |
|
RU2748928C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГАЛОГЕНПОЛИФТОРБЕНЗОЛОВ | 2018 |
|
RU2687554C1 |
| СПОСОБ ПОЛУЧЕНИЯ БРОМДИФТОРМЕТИЛ(ТРИМЕТИЛ)СИЛАНА | 2013 |
|
RU2528427C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЧАСТИЧНО ФТОРИРОВАННЫХ БЕНЗОЙНЫХ КИСЛОТ | 1999 |
|
RU2155185C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИФТОРАЛКИЛМЕТИЛКЕТОНОВ | 2023 |
|
RU2809284C1 |
| Способ получения метилхлорсиланов | 1989 |
|
SU1733435A1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРИМЕТИЛСИЛИЛЬНЫХ ПРОИЗВОДНЫХ АЗОТ- И КИСЛОРОДСОДЕРЖАЩИХ СОЕДИНЕНИЙ | 2023 |
|
RU2829137C1 |
| РЕАГЕНТ ДЛЯ ВВЕДЕНИЯ ПЕРФТОР-ТРЕТ-БУТИЛЬНОЙ ГРУППЫ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ПРИМЕНЕНИЯ ДЛЯ ПОЛУЧЕНИЯ ПЕРФТОР-ТРЕТ-БУТИЛ-ЗАМЕЩЕННЫХ СОЕДИНЕНИЙ | 2015 |
|
RU2602240C1 |
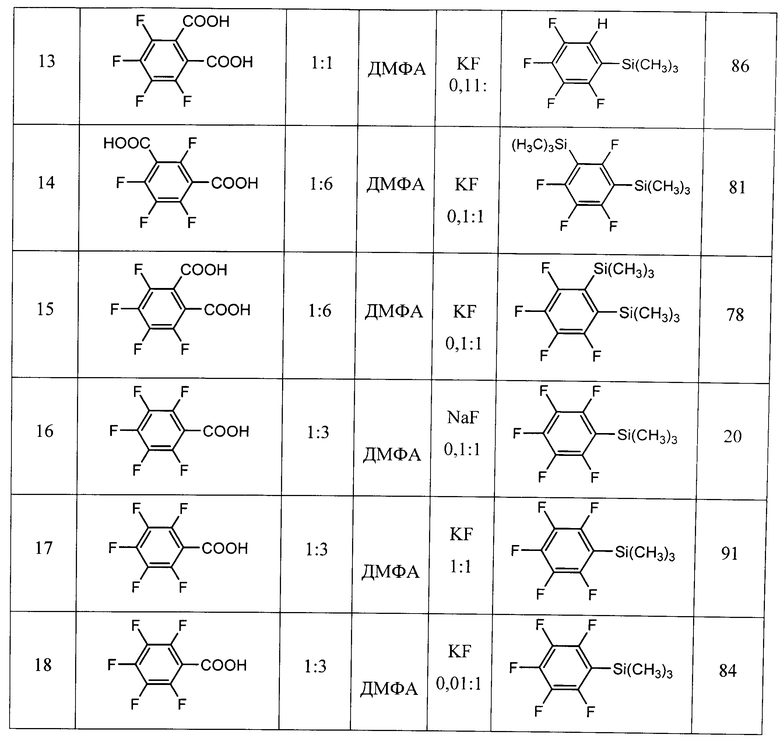
Изобретение относится к способам получения фторированных ароматических силанов. Предложен способ получения полифторарил(триметил)силанов формулы (I):
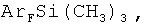
где 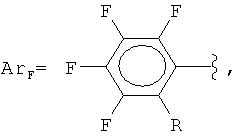

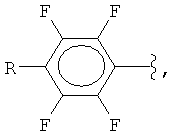
R = F, H, Si(CH3)3, CH3,
взаимодействием фторированных ароматических кислот с триметилхлорсиланом с получением соответствующих силиловых эфиров и последующим нагреванием этих эфиров с галогенидами щелочных металлов в полярных апротонных растворителях с получением фторарил(триметил)силанов и выделением их известными методами. Технический результат: предложенный способ прост в технологическом отношении и позволяет получать разнообразные полифторарил(триметил)силаны с высокими выходами (75-91%) из доступных промышленно выпускаемых исходных веществ. 2 з.п. ф-лы, 1 табл., 18 пр.
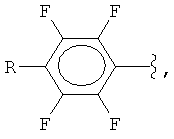
Способ получения полифторарил(трифторметил)силанов формулы (I):
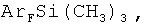
где 


R = F, H, Si(CH3)3, CH3,
заключающийся в том, что полифторароматическую моно- или дикислоту подвергают взаимодействию с триметилхлорсиланом (ТМХС) при соотношении кислоты и ТМХС 1:(1-6) в интервале температур 60-70°C; после удаления непрореагировавшего ТМХС к образовавшемуся (триметил)силиловому эфиру кислоты добавляют апротонный растворитель, такой как диметилформамид, диметилацетамид, N-метилпирролидон или сульфолан, и галогенид щелочного металла MX, (где M=Na, K, Cs, а X=Cl, F, Br), взятый в мольном соотношении (0,01-1):1 к (триметил)силиловому эфиру и нагревают реакционную смесь при температуре 70-130°C, получая целевой продукт, который выделяют известными методами.
2. Способ по п.1, в котором при мольном соотношении реагентов дикислоты и триметилхлорсилана 1:1 получают полифторарил(триметил)силаны формулы (I), где R=F, Н, CH3.
3. Способ по п.1, в котором при мольном соотношении дикислоты и триметилхлорсилана 1:(2-6) получают соответствующие полифторарил-(трифторметил) силаны формулы (I), где где R=Si(CH3)3.
| Степанов А.А | |||
| и др | |||
| Электрохимическое силилирование ненасыщенных фторорганических соединений | |||
| Электрохимия, 2000, т.36, N 2, с.210-213 | |||
| Taigo Kashiwabara, Masato Tanaka | |||
| Decarbonylative Coupling of Fluorobenzoyl Chlorides with Hexamethyldisilane in the Presence of a Palladium Complex Catalyst: Extremely Facile Decarbonylation of Pentafluorobenzoyl |
Авторы
Даты
2014-06-27—Публикация
2013-03-18—Подача