Введение
Изобретение относится к фармацевтическим препаратам, а именно к новому сокристаллу фенбуфена, пригодному для фармацевтических препаратов.
Уровень техники
γ-оксо-(1,1'-бифенил)-4-бутанольная кислота, именуемая также фенбуфеном,
является известным нестероидным противовоспалительным лекарственным средством, используемым для лечения воспалительных процессов при остеоартрозе, анкилозирующем спондилите и тендините [Kerwar S.S. Pharmacologic properties of fenbufen // Am. J. Med. - 1983 - P.62-69].
Фенбуфен является производным пропионовой кислоты и принципиально отличается от других препаратов данной группы. Это препарат-предшественник. Сам по себе он неактивен, главным активным метаболитом его является 4-бифенилуксусная кислота [Dhaneshwar S.S., Sharma M. Preliminary studies on gastro-protective chimeric derivative of biphenyl acetic acid for rheumatoid arthritis // Int. J. Pharm. Pharm. Sci. - 2011 - 4(1) - P.162-168]. Соединение отличается длительным периодом полужизни, что позволяет применять его однократно или 2 раза в день.
Фенбуфен хорошо всасывается в желудке. Максимальный уровень самого препарата в плазме достигается за 1 ч, а период его полужизни в плазме составляет 10 ч. Максимальный уровень в плазме главного активного метаболита фенбуфена - 4-бифенилуксусной кислоты - достигается через 7 ч; период полужизни этого метаболита в плазме также составляет 10 ч.
Фенбуфен подвергается интенсивному метаболизму, продукты которого выводятся главным образом с мочой.
Чаще всего встречаются побочные явления со стороны желудочно-кишечного тракта [Brogden R.N., Heel R.C., Speight T.M. Avery G.S. Fenbufen: a review of its pharmacological properties and therapeutic use in rheumatic disease and acute pain // Drugs - 1981 - 21(1) - P.1-22]. Сыпь появляется несколько чаще, чем при лечении другими противовоспалительными препаратами; она может быть причиной отказа от дальнейшего применения этого препарата. Симптомы со стороны пищеварительного тракта (боли в животе, тошнота, рвота, понос). Наблюдали также рост активности печеночных ферментов, особенно при длительном применении препарата. В отдельных случаях фиксировалась анемия, лейкопения, тромбоцитопения и эозинофилия, а также аллергические реакции. Исключительно редко, но фиксировалась полиморфная эритема - синдром Лайеля, требующий немедленного прекращения применения лекарства.
Было установлено, что фенбуфен эффективен при ревматоидном артрите, остеоартрите и других хронических ревматических заболеваниях. Большинство исследований проводилось при приеме препарата 2 раза в сутки, хотя для поддерживающего лечения было достаточно однократного приема. По эффективности фенбуфен сопоставим с другими противовоспалительными препаратами. Его испытывали так же, как простое аналгезирующее средство; однократная доза 600 мг оказалась сопоставимой с такой же дозой ацетилсалициловой кислоты; доза 900 мг существенно более эффективна.
Терапевтическое применение фенбуфена и некоторых других нестероидных противовоспалительных лекарственных соединений описано в литературе [Champion G.D. Therapeutic usage of the non-steroidal anti-inflammatory drugs // Med. J. Australia. - 1988 - 149(4) - P.203-213]. Но не менее важными критериями эффективности препарата являются фармакокинетические показатели и физико-химические свойства различных структурных модификаций таких, например, как аморфная форма, соль, сокристалл, полиморфные модификации. Они имеют различные физические и химические свойства, что сказывается на фармацевтических параметрах API, таких как стабильность при хранении, сжимаемость и другие. Определяющими факторами биодоступности являются растворимость и кинетические показатели растворения. Низкая растворимость лекарственного соединения в биологических жидкостях приводит к низкой эффективности лекарственного препарата. Поэтому увеличение уровня растворимости и скорости растворения препарата является актуальной технической задачей.
Задачей повышения растворимости занимаются уже давно, поэтому в настоящий момент известно большое количество методов, решающих эту проблему:
- тонкое измельчение для создания большей площади поверхности растворяемого соединения [Chaumeil J. С.Micronisation: a method of improving the Bioavailability of poorly soluble drugs // Methods Find. Exp.Clin. Pharmcol. - 1998 - 20(3) - P.211-215],
- использование солей исследуемых объектов с улучшенной растворимостью [Agharkar S., Lindenbaum S., Higuchi T. Enhancement of solubility of drug salts by hydrophilic counter-ions: properties of organic salts of an anti-malarial drug // J. Pharm. Sci. - 1976-65(5) - P.747-749],
- растворение в сложных [Amin К., Dannenfelser R.-M., Zielinski J., Wang B. Lyophilization of polyethylene glycol mixtures // J. Pharm. Sci. - 2004 - 93(9) - P.2244-2249] и мицеллярных растворителях [Torchillin V.Р. Micellar nanocarriers: pharmaceutical perspectives // Pharm. Res. - 2007 - 24(1) - P.1-16],
- образование супрамолекулярных комплексов с циклодекстринами [Rajewski R.A., Stella V.J. Pharmaceutical applications of cyclodextrins. 2. In vivo drug delivery // J. Pharm. Sci. - 1996 - 85(11) - P.1142-1169],
- использование фосфолипидных везикул, наполненных липофильными соединениями [Humberstone A.J., Charman W.N. Lipid-based vehicles for the oral delivery of poorly soluble drugs // Adv. Drug Deliv. Rev. - 1997 - 25(1) - P.103-128].
Однако известные способы нельзя характеризовать как универсальные методы. Так, несмотря на то, что тонкое измельчение вещества увеличивает скорость растворения лекарственного средства, однако оно не увеличивает равновесную растворимость вещества. Поскольку возрастание ван-дер-ваальсовых взаимодействий и электростатического притяжения между мелкими частицами ведут к уменьшению эффективной площади растворения и, таким образом, ограничивают предел биологической активности.
Повышение растворимости путем получения солей неприемлемо, так как в фармацевтике используются в основном слабо ионизируемые и нейтральные молекулы, а соли в данный класс соединений не входят.
Использование сложных и мицеллярных растворителей предполагает приемлемую растворимость и совместимость молекул лекарственного соединения с растворителем, что не всегда достижимо.
Повышение растворимости путем образования комплексов с циклодекстринами, а также использование фосфолипидных везикул применимо лишь для лекарственных соединений пролонгированного действия, однако нередко требуются лекарства быстрого действия, например, нестероидные противовоспалительные средства.
Несмотря на относительно высокую по сравнению с другими нестероидными противовоспалительными лекарственными соединениями растворимость, фенбуфен все-таки растворяется достаточно слабо [Chiarini A., Tartarini A., Fini A. pH-Solubility relationship and partitioning coefficients for some anti-inflammatory arylaliphatic acids // Arch. Pharm. - 1984 - 317 - P.268-273]. По настоящее время ведутся работы, направленные на повышение растворимости и/или сокращение побочных эффектов фенбуфена, такие как:
- иммобилизация фенбуфена в мезопористом наноразмерном оксиде кремния [Carriazo D., Del Arco M., Femandez A., Martin С., Rives V. Inclusion and release of fenbufen in mesoporous silica // J. Pharm. Sci. - 2010 - 99(8) - P.3372-3380],
- создание комплексов с циклодекстринами [Bratu I., Gavira-Vallejo J.M., Hemanz A. 1H-NMR Study of the inclusion processes for α- and γ-cyclodextrin with fenbufen // Biopolymers - 2005 - 77 - P.361-367],
- получение комплексов фенбуфен/поли(винилпирролидон) [Gashi Z., Censi R., Malaj L., Gobetto R., Mozzicafreddo M., Angeletti M., Masic A., Di Martino P. Differences in the interaction between aryl propionic acid derivatives and poly(vinylpyrrolidone) K30: A multi-methodological approach // J. Pharm. Sci. - 2009 - 98(11) - P.4216-4228],
- и др.
Создание фенбуфена, иммобилизованного в наноразмерном оксиде кремния, хотя позволяет повысить кинетические характеристики НСПВС, однако не повышает общий уровень растворимости. Комплексы с поли(винилпирролидоном) несущественно повышают растворимость фенбуфена, к тому же использование данного метода не приветствуется, потому что поливинипирролидон является вредной пищевой добавкой.
Известно также, что повысить растворимость можно путем образования сокристальной формы API с компонентом, способствующим увеличению растворения. Сокристаллы - это супрамолекулярные системы, где одним из компонентов является плохо растворимый API, т.е. молекула лекарственного соединения, а вторым компонентом (коформером) выступает молекула хорошо растворимого соединения, которая лучше усваивается организмом и участвует в ферментативных процессах [Lara-Ochoa F. and Espinosa-Pérez G. Cocrystals definitions // Supramolecular Chemistry. - 2007 - 19 (8) - P.553-557].
Сокристаллы, использующиеся в фармацевтической индустрии, привлекательны тем, что дают возможность получения новых кристаллических форм API со специальными свойствами, такими как улучшенная растворимость, термическая стабильность, улучшенные механические свойства и др. Более того, благодаря возможности подбора коформера для сокристалла, можно провести, так сказать, «точную настройку» физических свойств сокристалла.
Из литературы известен лишь один случай получения сокристалла фенбуфена с никотинамидом [Berry D.J., Seaton С.С., Clegg W., Harrington R.W., Coles S.J., Horton P.N., Hursthouse M.B., Storey R., Jones W., Friscic Т., Blagden N. Applying hot-stage microscopy to co-crystal screening: a study of nicotinamide with seven active pharmaceutical ingredients // Cryst. Growth Des. - 2008 - 8 (5) - P.1697-1712]. Впрочем, в представленной работе не обсуждаются характеристики растворения.
Сущность изобретения
Техническая задача изобретения состояла в поиске сокристаллической формы фенбуфена, имеющей более высокие скорость и уровень растворимости и пригодной для использования в фармацевтической промышленности.
Сущность изобретения состоит в следующем:
Сокристаллическая форма фенбуфена с пиразинамидом, где молярное соотношение фенбуфена с пиразинамидом составляет 1:1, имеющая эндотермический пик от 148 до 152°С по данным измерений при помощи дифференциальной сканирующей калориметрии и пики при 2θ(°) 7.38, 10.43, 11.04, 21.67 по данным измерения дифрации рентгеновского излучения поликристалла.
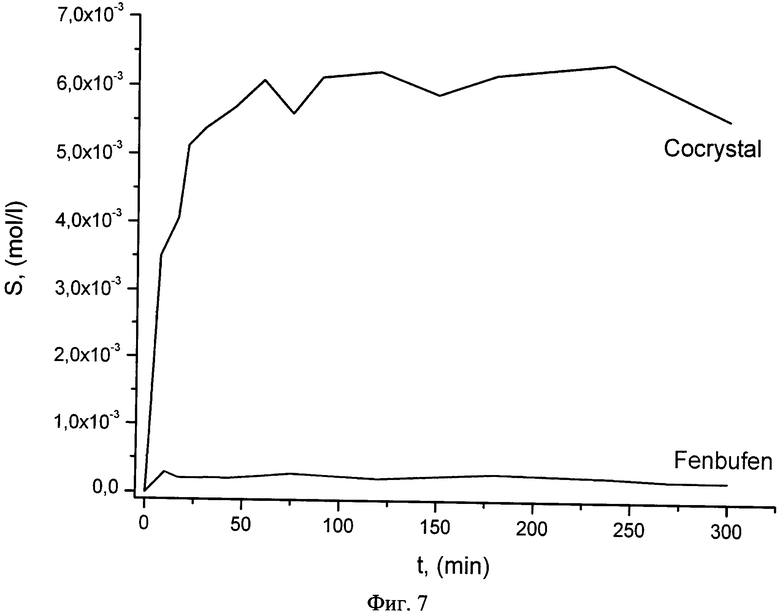
Заявленное изобретение позволяет получить следующее преимущество - повышение растворимости в воде примерно в 25 раз по сравнению с показателями растворимости фенбуфена в чистом виде. Это важно, поскольку при наличии воспалительных процессов в организме человека необходимо эффективное действие лекарственного средства именно в начальный период времени, что и обеспечивается сокристальной формой.
Дальнейшая оценка кинетики растворения показывает на любом временном промежутке растворимость сокристальной формы фенбуфена выше, чем соединения в чистом виде. Повышенная равновесная растворимость фенбуфена в сокристальной форме позволяет повысить эффективность как пролонгированного действия лекарственного средства, так и в начальный период.
Данные по растворимости были получены для водного раствора при комнатной температуре на установке для измерения растворимости твердых соединений методом изотермического насыщения. Пробы отбирали в точках примерно 0.12, 0.25, 0.35, 0.5, 0.75, 1, 1.25, 1.5, 2, 2.5, 3, 4, 5, 24 часа и анализировали при помощи спектрофотометра VARIAN CARY 50 в ультрафиолетовой области спектра, рабочий диапазон длин волн λ=190÷400 нм.
Заявленный новый сокристалл - твердое кристаллическое стабильное вещество, не распадается, не подвержен воздействию влаги и удобен для приготовления стабильных фармацевтических препаратов. Заявленный сокристалл фенбуфена может использоваться для производства средства для лечения воспалительных процессов при остеоартрозе, анкилозирующем спондилите и тендините. Кроме того, за счет присутствия пиразинамида полученный сокристалл обладает возможностью профилактики деструктивного туберкулеза, казеозного лимфаденита, туберкулома и казеозно-пневмонических процессов.
Структура заявленного сокристалла доказана двумя методами, в совокупности достаточными для утверждения об образовании нового соединения:
- дифракция в рентгеновских лучах поликристалла
- дифференциальная сканирующая калориметрия (DSC).
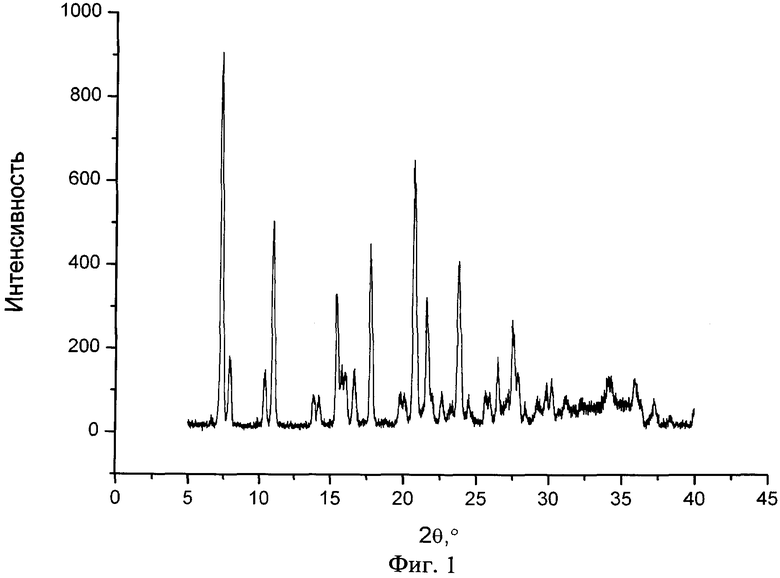
На фиг.1 представлен типичный профиль XPRD сокристалла фенбуфен:пиразинамид (1:1) в соответствии с одним из вариантов изобретения.
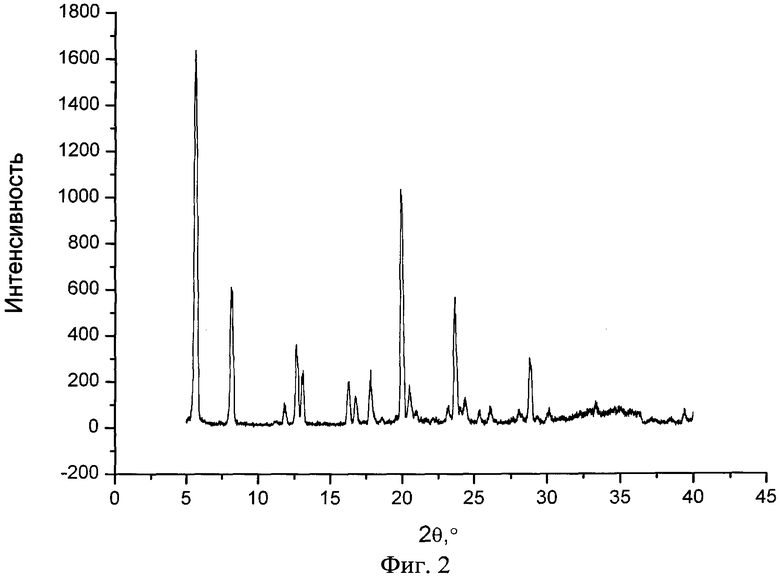
На фиг.2 представлен типичный профиль XPRD фенбуфена в чистом виде.
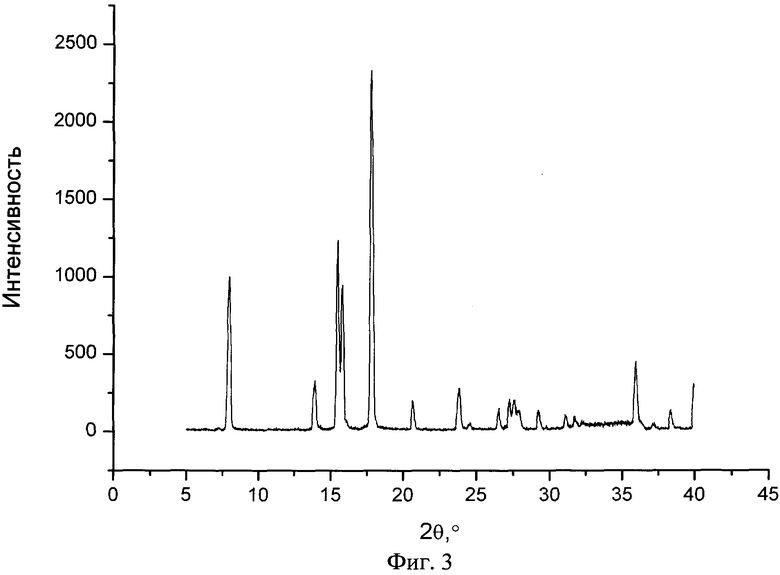
На фиг.3 представлен типичный профиль XPRD пиразинамида в чистом виде.
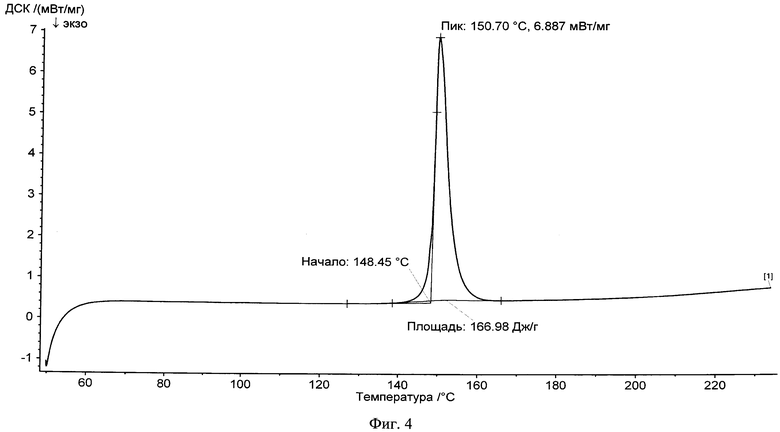
На фиг.4 представлена типичная термограмма DSC сокристалла фенбуфен:пиразинамид (1:1) в соответствии с одним из вариантов изобретения.
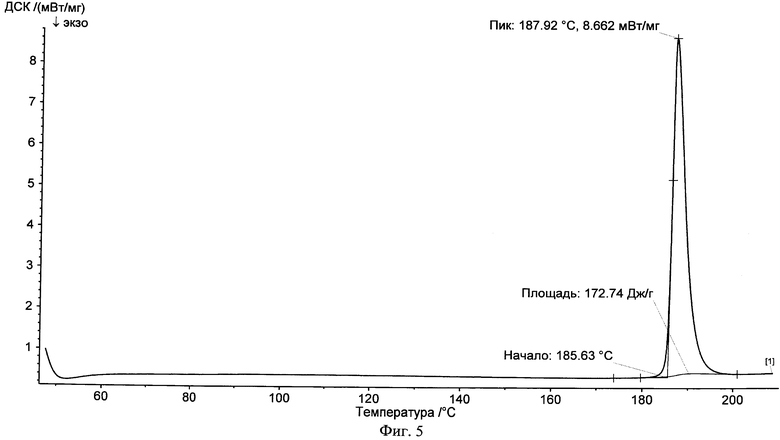
На фиг.5 представлена типичная термограмма DSC фенбуфена в чистом виде.
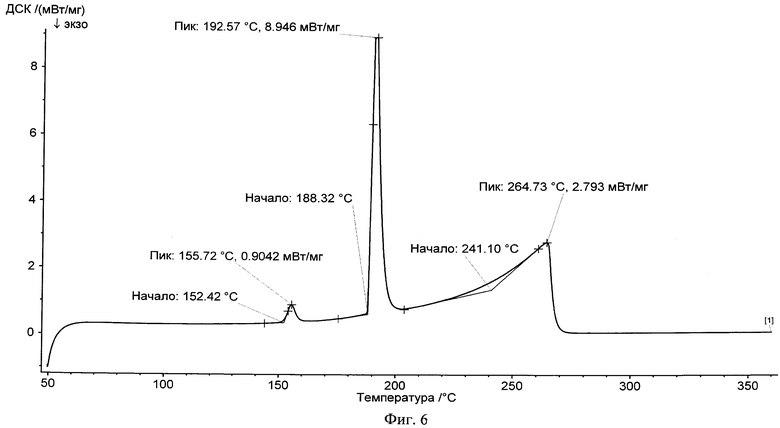
На фиг.6 представлена типичная термограмма DSC пиразинамида в чистом виде.
На фиг.7 представлены данные по растворимости для сокристалла фенбуфен:пиразинамид (1:1) и фенбуфена в чистом виде.
Сведения, подтверждающие возможность воспроизведения изобретения
Для получения заявленного сокристалла использовали следующие вещества.
- фенбуфен - фирма производитель «Sigma», CAS 36330-85-5, чистота ≥98%.
- пиразинамид - фирма производитель «Acros Organics», lot А0296139 CAS 98-96-4, чистота 99%.
- этанол - Спирт марки «Люкс» ГОСТ Р51652-2000 2001-07-01 «Спирт этиловый рективированный из пищевого сырья. ТУ».
Новый сокристалл фенбуфена в существенной степени характеризуется результатами рентгеноструктурного анализа, показанными на фиг.1, 2, 3, и в существенной степени описывается данными термограммы DSC, представленными на фиг.4, 5, 6.
Получить заявленный сокристалл можно и в твердой фазе и в растворе.
Пример 1
Смесь 51 мг (0,2 ммоль) фенбуфена и 24,2 мг (0,2 ммоль) пиразинамида помещают в агатовые ячейки для перемола в планетарной микромельнице. В ячейку помещают 10 агатовых шариков диаметром 3 мм. Процесс перемолки на скорости 600 об/мин продолжают дважды по полчаса с перерывом 5 минут. Оставшийся порошок представляет собой сокристалл фенбуфен:пиразинамид (1:1), что подтверждается данными XPRD и DSC. Полученный профиль XPRD конечного продукта в существенной степени соответствует тому, что показан на Фиг.1. Полученная термограмма DSC конечного продукта в существенной степени соответствует тому, что показана на Фиг.4.
Пример 2
Смесь 51 мг (0,2 ммоль) фенбуфена и 24,2 мг (0,2 ммоль) пиразинамида растворяют в 2 мл этанола до полного растворения. Полученный прозрачный раствор оставляют в вытяжном шкафу до полного испарения растворителя. Оставшийся порошок представляет собой сокристалл фенбуфен:пиразинамид (1:1), что подтверждено данными DSC, термограмма которого полностью совпадает с термограммой DSC конечного продукта, полученного по Примеру 1.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОКРИСТАЛЛИЧЕСКАЯ ФОРМА БИКАЛУТАМИДА | 2012 |
|
RU2510392C1 |
| СОКРИСТАЛЛИЧЕСКАЯ ФОРМА ТЕОФИЛЛИНА С ДИФЛУНИСАЛОМ ИЛИ ДИКЛОФЕНАКОМ | 2013 |
|
RU2542100C1 |
| СОКРИСТАЛЛИЧЕСКАЯ ФОРМА 2-ГИДРОКСИБЕНЗАМИДА С САЛИЦИЛОВОЙ КИСЛОТОЙ | 2013 |
|
RU2539350C1 |
| СОКРИСТАЛЛИЧЕСКАЯ ФОРМА 2-ГИДРОКСИБЕНЗАМИДА С 4-АМИНОБЕНЗОЙНОЙ КИСЛОТОЙ | 2012 |
|
RU2497804C1 |
| СОКРИСТАЛЛИЧЕСКАЯ ФОРМА НИФЛУМОВОЙ КИСЛОТЫ С ИЗОНИКОТИНАМИДОМ ИЛИ КОФЕИНОМ | 2013 |
|
RU2536484C1 |
| СОКРИСТАЛЛИЧЕСКАЯ ФОРМА ДИФЛУНИСАЛА | 2016 |
|
RU2617849C1 |
| СОКРИСТАЛЛИЧЕСКАЯ ФОРМА ИЗОНИАЗИДА | 2016 |
|
RU2630957C1 |
| СО-КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ТЕОФИЛЛИНА | 2022 |
|
RU2805752C2 |
| СО-КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ТЕОБРОМИНА | 2022 |
|
RU2805751C2 |
| СОКРИСТАЛЛИЧЕСКАЯ ФОРМА 1-[(5-ПАРА-МЕТИЛ-МЕТА-ХЛОР-ФЕНИЛАМИНО)-1,2,4-ТИАДИАЗОЛ-3-ИЛ]-ПРОПАН-2-ОЛА | 2019 |
|
RU2721335C1 |
Изобретение относится к фармацевтическим препаратам, а именно к новому сокристаллу фенбуфена. Заявлена сокристаллическая форма фенбуфена с пиразинамидом, где молярное соотношение фенбуфена с пиразинамидом составляет 1:1, имеющая эндотермический пик от 148 до 152°C по данным измерений при помощи дифференциальной сканирующей калориметрии и пики при 2θ(°) 7.38, 10.43, 11.04, 21.67 по данным измерения дифракции рентгеновского излучения поликристалла. Технический результат заключается в повышении скорости и уровня растворимости сокристаллической формы фенбуфена и пригодности ее для использования в фармацевтической промышленности. 2 пр., 7 ил.
Сокристаллическая форма фенбуфена с пиразинамидом, где молярное соотношение фенбуфена с пиразинамидом составляет 1:1, имеющая эндотермический пик от 148 до 152°C по данным измерений при помощи дифференциальной сканирующей калориметрии и пики при 2θ(°) 7.38, 10.43, 11.04, 21.67 по данным измерения дифракции рентгеновского излучения поликристалла.
| David J | |||
| Berry et al | |||
| "Applying Hot-Stage Microscopy to Co-Crystal Screening: А Study of Nicotinamide with Seven Active Pharmaceutical Ingredients" Cryst | |||
| Growth Des., 2008, 8(5), pp | |||
| Мерная линейка для определения в десятинах площадей нанесенных на планы участков, имеющих форму прямоугольников трапеций или треугольников | 1916 |
|
SU1697A1 |
| Norman Chieng et al | |||
| "An overview of recent studies on the analysis of pharmaceutical polymorphs" Journal of Pharmaceutical and Biomedical Analysis, Volume | |||
Авторы
Даты
2014-06-27—Публикация
2012-12-21—Подача