Изобретение относится к биотехнологии, в частности к генной инженерии и микробиологической промышленности, и касается нового рекомбинантного штамма бактерий Escherichia coli (E.coli), который может быть использован для получения высокоактивного препарата эндонуклеазы рестрикции BpuN4I, узнающей и расщепляющей последовательность ДНК 5'-G^GNNCC-3' после первого гуанина на обеих цепях.
Главными биотехнологически значимыми параметрами эндонуклеаз рестрикции (рестриктаз) являются узнаваемая последовательность, позиция гидролиза относительно этой последовательности и активность препарата фермента, выделенного из соответствующего штамма-продуцента.
Наиболее близким к заявляемому штамму - прототипом, является штамм Neisseria lactamica, продуцирующий рестриктазу NlaIV, которая узнает последовательность нуклеотидов 5'-GGN^NCC-3' и расщепляет ее после центрального нуклеотида N с образованием «тупых» концов [1].
Недостатком известного штамма является то, что продуцируемая им сайт-специфическая эндонуклеаза не расщепляет узнаваемую последовательность после первого гуанина и не обеспечивает появления четырехнуклеотидных 5'-выступающих липких концов. Это свойство оказывается существенно важным при проведении генно-инженерных манипуляций, когда необходимо с помощью рестриктаз разной специфичности получить сходные липкие концы.
В настоящее время не описаны штаммы бактерий, являющиеся продуцентами сайт-специфических эндонуклеаз, узнающих и расщепляющих последовательность ДНК 5'-G^GNNCC-3' после первого гуанина на обеих цепях.
Задачей изобретения является получение рекомбинантного штамма E.coli, продуцирующего сайт-специфическую эндонуклеазу, которая узнает и расщепляет обе цепи нуклеотидной последовательности ДНК 5'-G^GNNCC-3'/3'-CCNNG^G-5'.
Поставленная задача решается путем получения штамма бактерий E.coli N41 (pBpuN4/MR) - продуцента сайт-специфической эндонуклеазы рестрикции, узнающей и расщепляющей последовательность нуклеотидов:
5'-G↓GNNC С-3'
3'-С CNNG↑G-5',
где стрелками указаны позиции расщепления ДНК.
Технический результат: получение рекомбинантного штамма бактерий E.coli, продуцирующего рестриктазу заданной специфичности с более высоким выходом по сравнению с исходным природным штаммом.
Предлагаемый штамм-продуцент получен трансформацией ДНК плазмиды pBpuN4/MR N41 клеток E.coli ER2267. Плазмида pBpuN4/MR N41 получена в результате клонирования в E.coli участка хромосомной ДНК штамма Bacillus pumilus N4, являющегося продуцентом рестриктазы BpuN4I, который выделен из природного материала (почвы) в результате целенаправленного систематического поиска, но не является высокопродуктивным (активность препарата фермента, выделенного из него, составляет 1000 е.а./мл).
Плазмида pBpuN4/MR N41 является рекомбинантной, содержит ген, кодирующий ДНК-метилтрасферазу M.BpuN4I, метилирующую один из цитозинов в положении С5 в последовательности 5'-GGNNCC-3', а также ген рестриктазы BpuN4I.
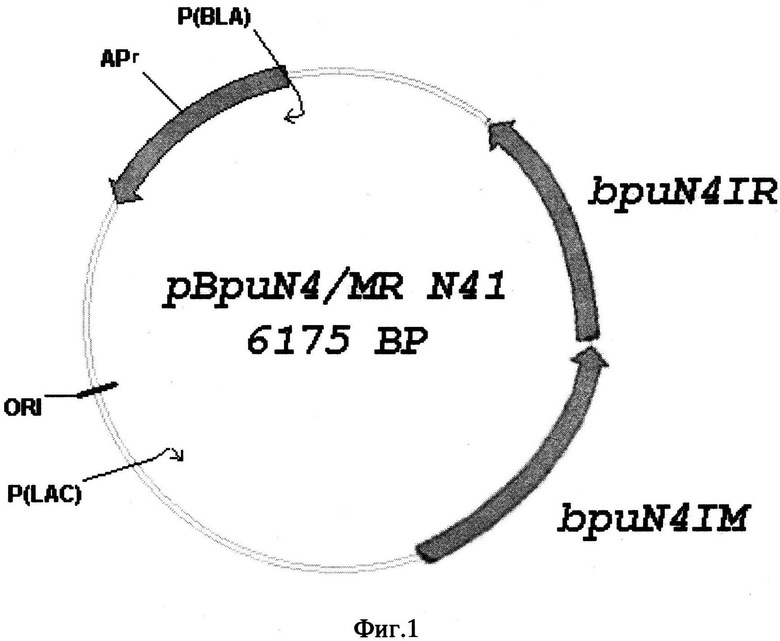
На фигуре 1 представлена физическая карта плазмиды pBpuN4/MR N41, где
ORI - точка начала репликации плазмиды pBpuN4/MR;
Apr - ген BLA, обеспечивающий устойчивость к ампициллину;
P(BLA) - промотор гена BLA;
P(LAC) - промотор гена lacZ;
bpuN4IR - ген, кодирующий эндонуклеазу рестрикции BpuN4I;
bpuN4IM - ген, кодирующий ДНК-метилтрансферазу BpuN4I.
Сконструированной плазмидой pBpuN4/MR N41 трансформируют клетки E.coli штамма ER2267. Трансформантов отбирают на селективной агаризованной питательной среде, содержащей 100 мкг/мл ампициллина, по резистентности к антибиотику, т.е. способности к росту в его присутствии. Содержание рекомбинантной рестриктазы BpuN4I составляет не менее 25000 е.а./г влажной биомассы.
Преимуществом заявляемого штамма по сравнению с наиболее близким аналогом является то, что при расщеплении ДНК продуцируемой им рестриктазой BpuN4I образуются четырехнуклеотидные 5'-выступающие липкие концы, сходные с концами, получающимися при расщеплении ДНК такими эндонуклеазами рестрикции, как, например, XhoII и BstX2I (сайт узнавания 5'-R^GATCY-3'), Acc65I (5'-G^GTACC-3'), AccB1I (5'-G^GYRCC-3'), BamHI (5'-G^GATCC-3'), а также рядом других рестриктаз [2], что позволяет эффективно применять фермент BpuN4I в разнообразных генно-инженерных манипуляциях.
Штамм E.coli N41 (pBpuN4/MR) имеет следующие характеристики.
Культурально-морфологические признаки.
Клетки мелкие палочковидной формы, грамотрицательные, 1×3,5 мкм, подвижные. Штамм хорошо растет на обычных питательных средах (МПА, МПБ, LB-бульон, LB-arap, минимальная среда с глюкозой). При росте на агаризованной среде LB колонии круглые, гладкие, полупрозрачные, блестящие, серые. Край ровный, диаметр колоний 1-3 мм, консистенция пастообразная. Рост в жидких средах (LB, минимальная среда с глюкозой) характеризуется ровным помутнением, осадок легко седиментирует.
Физиолого-биохимические признаки.
Клетки растут при 4-42°C, оптимум рН 6,8-7,6. В качестве источника азота используют как минеральные соли аммония, так и органические соединения: аминокислоты, пептон, триптон, дрожжевой экстракт.В качестве источника углерода при росте на минимальной среде используют глицерин, углеводы, аминокислоты.
Генетические признаки, устойчивость к антибиотикам.
Штамм-хозяин Escherichia coli ER2267 (F' proA+В+ lacIq Δ(lacZ)M15 zzf::mini-Tn10 (KanR)/ Δ(argF-lacZ)U169 glnV44 e14-(McrA-) Δ(mcrC-mrr)). Проявляет устойчивость к канамицину (до 25 мкг/мл).
Штамм E.coli N41 (pBpuN4/MR) дополнительно проявляет устойчивость к ампициллину (до 300 мкг/мл), обусловленную наличием гена устойчивости в ДНК рекомбинантной плазмиды pBpuN4/MR N41.
Условия хранения штамма.
Штамм E.coli N41 (pBpuN4/MR) хранят на агаризованной среде LB со 100 мкг/мл ампициллина на чашках Петри или в стеклянных пробирках со скошенным агаром при 4°C. Пересевы на свежие среды делают один раз в месяц. Может храниться не менее года в среде LB, содержащей 30% глицерин, при -50-70°C.
Длительное хранение штамма осуществляют в лиофильно высушенном состоянии или в растворе 30% глицерина при температуре -70°C.
Для культивирования штамма применяют среду следующего состава (г/л): пептон - 10, дрожжевой экстракт - 5, NaCl - 5, ампициллин 0,0001. Культивирование проводят при 37°C с аэрацией до достижения стационарной стадии роста. Выход препарата фермента составляет ~0,433 мл/г сырой биомассы с концентрацией 16000 е.а./мл.
Продуцируемая новым рекомбинантным штаммом рестриктаза BpuN4I характеризуется следующими свойствами:
1. Узнает и расщепляет последовательность 5'-GGNNCC-3' на обеих цепях ДНК после первого гуанина.
3. Не расщепляет вышеприведенную последовательность, если внутренние цитозины на обеих цепях метилированы.
4. Оптимальная температура реакции 37°С.
5. Фермент проявляет высокую активность в буфере следующего состава: 33 мМ Трис-ацетат (рН 7,9 при 25°C), 10 мМ магния ацетат, 66 мМ калия ацетат, 1 мМ ДТТ.
Определяющим отличием предлагаемого штамма от всех известных в настоящее время штаммов-продуцентов сайт-специфических эндонуклеаз является то, что он позволяет получать коммерчески доступный препарат, не имеющей аналогов рестриктазы BpuN4I, которая узнает и расщепляет обе цепи последовательности 5'-G^GNNCC-3' после первого гуанина.
Новая сайт-специфическая ДНК-эндонуклеаза BpuN4I является неошизомером рестриктазы NlaIV, то есть узнает ту же последовательность ДНК, но расщепляет ее в другой позиции. Все описанные до последнего времени изошизомеры NlaIV, расщепляют узнаваемый сайт 5'-GGN^NCC-3' посередине (между центральными нуклеотидами), давая «тупые» концы.
Поскольку предлагаемый штамм получен впервые и для выделения сайт-специфической эндонуклеазы, узнающей и расщепляющей вышеназванную последовательность нуклеотидов, в указанной позиции никогда не использовался, можно сделать вывод о соответствии предлагаемого штамма критериям изобретения «новизна» и «изобретательский уровень».
Изобретение иллюстрируется примерами конкретного выполнения.
Пример 1. Конструирование рекомбинантной плазмиды pBpuN4/MR N41
Получение библиотеки клонов E.coli.
Хромосомную ДНК Bacillus pumilus N4 гидролизовали отдельно рестриктазами MfeI (5'-C^AATTG-3') и EcoRI (5'-G^AATTC-3'). Гидролиз проводили в пробирках типа «Eppendorf» объемом 1,5 мл. Объем реакционной смеси составлял 200 мкл, из них 20 мкл - десятикратный реакционный буфер для эндонуклеазы рестрикции, 30 мкл - раствор ДНК Bacillus pumilus N4, 150 мкл бидистиллированной воды, а также 2 мкл препарата соответствующей эндонуклеазы рестрикции. Смесь инкубировали в термостате при +37°C в течение 1 часа. Затем гидролизаты ДНК очищали экстракцией фенолом-хлороформом, переосаждали этанолом согласно методике [3] и растворяли в 25 мкл воды. Параллельно готовили гидролизат вектора: ДНК плазмиды pUC19 [4] линеаризовали эндонуклеазой рестрикции EcoRI (подходит для сшивки с EcoRI- и MfeI-гидролизатами ДНК Bacillus pumilus N4, поскольку в результате расщепления этими ферментами образуются одинаковые 5'-выступающие концы 5'-^ААТТ-3').
Гидролиз векторной плазмиды проводили в 400 мкл реакционной смеси, содержащей по 40 мкл реакционного буфера, 20 мкл препарата плазмиды pUC19 с концентрацией 0,5 мг/мл, 340 мкл воды, а также 5 мкл препарата рестриктазы EcoRI. Смесь инкубировали в термостате при +37°C в течение 1,5 часов. После чего в смесь добавляли по 2 мкл препарата щелочной фосфатазы из кишечника теленка и инкубировали еще 30 мин при той же температуре. Обработка концов вектора фосфатазой вела к удалению 5'-концевых фосфатных групп, что позволяло избежать самолигирования концов вектора и существенно повышало эффективность сшивки вектора с фрагментами хромосомной ДНК штамма Bacillus pumilus N4. Далее гидролизованную плазмиду очищали экстракцией фенолом-хлороформом, переосаждали этанолом и растворяли в 20 мкл буфера ТЕ (10 мМ Трис-HCl, (рН 8,0), 1 мМ ЭДТА).
На следующем этапе осуществляли лигирование вектора pUC19/EcoRI со смесью гидролизатов ДНК Bacillus pumilus N4 ферментами EcoRI и MfeI. Процедуры лигазной сшивки, а также дальнейшей трансформации клеток Е. coli осуществляли на основе методик из [3].
Для получения библиотеки клонов, несущих рекомбинантные плазмиды, проводили сшивку фрагментов вектора и хромосомной ДНК в 30 мкл реакционной смеси. Лигазная смесь содержала 3 мкл десятикратного буфера для лигирования, 3 мкл вектора pUC19/EcoRI, 15 мкл гидролизата ДНК Bacillus pumilus N4 ферментом EcoRI и 9 мкл гидролизата ДНК Bacillus pumilus N4 ферментом MfeI. К смеси добавляли 1 мкл высокоактивной Т4-ДНК-лигазы и смесь инкубировали в течение ночи при +4°C. Затем ДНК осаждали этанолом и растворяли в 12 мкл воды.
Полученной таким образом лигазной смесью трансформировали клетки E.coli штамма ER2267 путем электропорации на приборе «Easyject Prima» («EquiBio», UK) по инструкции производителя. После обработки импульсом к суспензии клеток добавляли по 1 мл нагретого до +37°С бульона LB и подращивали клетки в термостате при +37°С в течение 1 часа. После чего отбирали 1/100 часть культуры и высевали на чашку Петри с агаризованной средой LB, содержащей 100 мкг/мл ампициллина. Чашку выдерживали в термостате при +37°C, после чего подсчитывали количество выросших клонов с целью определения титра клонов E.coli в библиотеке, который составил 30 тысяч колоний на 1 мкг ДНК. Основную часть культуры помещали во флакон со 100 мл среды LB с добавлением 100 мкг/мл ампициллина и выращивали в течение ночи на термостатированной воздушной качалке при +37°С и 140 об/мин. В результате была получена библиотека клонов E.coli, содержащих рекомбинантные плазмиды, включающие статистический набор различных фрагментов ДНК Bacillus pumilus: E.coli ∑pBpuN4/MR (общее количество клонов - 20 тыс.).
Селекция клонов с целью выявления продуцента рекомбинантной рестриктазы BpuN4I.
Селекцию целевых клонов, содержащих активность рестриктазы BpuN4I, проводили путем последовательного деления (разведения) геномной библиотеки. Для этого все 20 тысяч клонов E.coli, содержащих геномную библиотеку В. pumilus N4, подращивали во флаконе со 100 мл среды LB с добавлением 100 мкг/мл ампициллина в течение ночи при 37°С со встряхиванием 140 об/мин. Культура достигала оптической плотности 2,5 единицы при 540 нм и имела титр 3×108 к.о.е./мл (колоний образующих единиц в 1 мл). Культуру разбавляли до 105 к.о.е./мл в ТМ-буфере (10 мМ Трис-HC1 (рН 7,5), 10 мМ MgSO4, 0,2 мг/мл желатин) и раскапывали в чашки Петри по 10 мкл на 30 секторов LB-arapa с ампициллином так, чтобы из 10 мкл выросло примерно 1000 клеток. Чашки инкубировали 2 дня при 22°C. Каждую смесь колоний из сектора переносили петлей в ячейку планшета со 100 мкл буфера для музея, содержащего 25% глицерин, 40 мМ NaCl и 10 мМ Трис-HCl (рН 7,6), и хранили при -18°C .Из полученных суспензий отбирали по 2 мкл в лизирующий буфер (10 мМ Трис-HCl (рН 7,6), 50 мМ NaCl, 1 мМ ЭДТА с добавлением 0,2 мг/мл лизоцима и 0,1% Тритона Х-100) и тестировали активность рестриктазы в лизате на ДНК фага λ в SE-буфере «Y» (33 мМ Трис-ацетат (рН 7,9 при 25°C), 10 мМ магния ацетат, 66 мМ калия ацетат, 1 мМ ДТТ) согласно методу, описанному ранее [5]. Смесь клонов из 2-3×108 к.о.е./100 мкл, в которой выявлялась активность рестриктазы, снова разводили в ТМ-буфере и раскапывали по 100 к.о.е./10 мкл на 30 секторов LB-агара с ампициллином. Выращивали, переносили в музей и тестировали. Таким же образом сотню делили на десятки. Смесь клеток из 10 клонов, содержащую целевую активность, рассевали до отдельных колоний. Из них 30 колоний пересевали на чашку и выращивали при 37°C в течение 20 часов. После чего анализировали активность рестриктазы BpuN4I в лизатах индивидуальных клонов.
В результате был отобран клон E.coli N41 (pBpuN4/MR), который проявлял активность рестриктазы BpuN4I в лизате. Для плазмиды из этого клона, названной pBpuN4/MR N41 была определена нуклеотидная последовательность встроенного фрагмента по методу Сэнгера на автоматическом секвенаторе ABI PRISM 310 («Applied Biosystems», США). Было показано, что pBpuN4/MR N41 содержит MfeI-фрагмент ДНК Bacillus pumilus N4, встроенный в вектор pUC19/EcoRI. Длина фрагмента составила 3495 пар нуклеотидов. Встроенный фрагмент включает гены ДНК-метилтрансферазы и эндонуклеазы рестрикции BpuN4I. Позиции открытых рамок считывания (направлены по комплементу): 624-1646 - ген bpuN4IR, 1695-3023 - ген bpuN4IM. Нуклеотидная последовательность встроенного фрагмента была депонирована в базе данных Международного банка данных последовательностей GenBank (.gov/genbank/): BpuN4I_RM.sqn BpuN4I_RM KF150199.
Пример 2. Выращивание штамма и выделение рекомбинантной рестриктазы BpuN4I.
Получение биомассы клеток штамма-продуцента.
Для получения биомассы клетки штамма-продуцента E.coli N41 (pBpuN4/MR) переносили на агаризованную среду LB с ампициллином в чашку Петри и инкубировали в течение ночи при 37°С. Свежевыращенные колонии переносили в две колбы объемом 500 мл, содержащих по 300 мл бульона (1% триптон («Organotechnie», Франция), 0,5% дрожжевой экстракт («Organotechnie», Франция), 0,5% NaCl, 0,05% MgCl2 и 0,001% тиамин, (рН 7,0), и 50 мкг/мл ампициллина) и подращивали при +30°С в течение 18 часов без встряхивания. Затем культура рассевалась по 10 мл по 20 колбам, содержащим по 300 мл бульона. Колбы встряхивали при 130 об/мин в инкубаторе «New Brunswick)) (США) при +30°С в течение 18 часов. Для измерения в клетках активности BpuN4I из культуры отбирались по две пробы по 1 мл в пробирки «Eppendorf», клетки осаждали в настольной центрифуге «5416 Eppendorf» (“Eppendorf GmbH”, Германия) при 12000 об/мин 3 минуты, супернатанты убирали, а клетки замораживали при -18°C. Биомассы культур осаждали на центрифуге J2-21 («Весктап», США) в течение 30 минут в роторе JA-10 при 8000 об/мин, замораживали и хранили при -20°C. Получали 12 г замороженных клеток, что составляло 2 г/л бульона. Содержание рекомбинантной рестриктазы BpuN4I составляло 25000 е.а./г влажной биомассы
Выделение фермента и используемые буферы.
Выделение проводили при +4°С с использованием следующих растворов:
Буфер А - 10 мМ Трис-HCl, (рН 7,5), 0,1 мМ ЭДТА и 7 мМ β-меркаптоэтанол;
Буфер Б - 20 мМ Трис-HCl, (рН 7,5), 1,5 М сульфат аммония, 0,1 мМ ЭДТА и 7 мМ β-меркаптоэтанол.
Экстрагирование. 12 г биомассы суспендировали в 50 мл буфера А с 0,2 М NaCl, 0,1 мМ фенилметилсульфонилфторида, 0,3 мг/мл лизоцима, 0,1% Тритона Х-100 и инкубировали в течение 1 ч при постоянном перемешивании. Клетки разрушали ультразвуком на «Soniprep 150» («MSE», Англия) с диаметром адаптера 2 см. Обработка проводилась при амплитуде 20 мкм 6 раз по 0,5 мин с интервалами по 1,5 мин с охлаждением суспензии в ледяной бане. Экстракт осветляли центрифугированием при 15000 об/мин в течение 45 мин в роторе JA-20 на центрифуге «J-2-21» («Весктап», США). Супернатант разбавляли в 2 раза буфером А.
Хроматография на фосфоцеллюлозе.
Супернатант пропускали через колонку с фосфоцеллюлозой Р-11 («Whatman», Англия) объемом 20 мл, предварительно уравновешенной буфером А, содержащим 0,1 М NaCl, затем белок элюировался линейным градиентом NaCl (0,1 М - 0,5 М) в буфере А объемом 500 мл. В результате собирали 50 фракций объемом по 10 мл. Активные фракции (№22-29) объединяли.
Хроматография на фенил-сефарозе.
В объединенные активные фракции (суммарный объем 80 мл) добавляли буфер Tris-HCl, рН 7,5 до концентрации 20 мМ и сульфат аммония до концентрации 1,5 М. Белок наносили на колонку с фенилсефарозой (объемом 3 мл), уравновешенной 15 мл буфера Б. Далее осуществляли элюцию фермента линейным градиентом сульфата аммония (1,5 М - 0,1 М) в буфере Б объемом 150 мл. В ходе хроматографии собирали 60 фракций объемом по 2,5 мл. Активные фракции (№28-35) объединяли.
Хроматография на гепарин-сефарозе.
Объединенные активные фракции диализовали против 1 л буфера А в течение 3 часов и наносили на колонку с гепарин-сефарозой объемом 3 мл, уравновешенной 15 мл буфера А с 50 мМ NaCl. Элюцию фермента проводили линейным градиентом NaCl (0,05 М - 0,5 М) в буфере А объемом 100 мл. Из полученных 40 фракций объемом 2,5 мл отбирали активные фракции (№21-26), в которые добавляли БСА до концентрации 50 мкг/мл.
Концентрирование и хранение препарата. Объединенные фракции диализовали в течение 16 часов против 200 мл буфера, содержащего 10 мМ Трис-HCl, рН 7,5, 0,1 мМ ЭДТА, 7 мМ β-меркаптоэтанол, 0,05 М NaCl, 50% глицерин. Препарат BpuN4I хранили при -20°C.
Суммарный выход фермента в препарате составил ~6900 е.а./г сырой биомассы, что примерно в 50 раз выше по сравнению с соответствующим диким штаммом.
Пример 3. Сайт-специфический гидролиз субстратных ДНК рекомбинантной рестриктазой BpuN4I
Расщепление ДНК рекомбинантной рестриктазой BpuN4I проводили в оптимальных условиях (температура 37°C, реакционный буфер - SE-буфер «Y» 33 мМ Трис-ацетат (рН 7.9 при 25°C), 10 мМ магния ацетат, 66 мМ калия ацетат, 1 мМ ДТТ) в течение 60 мин. Продукты расщепления ДНК разделяли путем электрофореза в 1% агарозном геле.
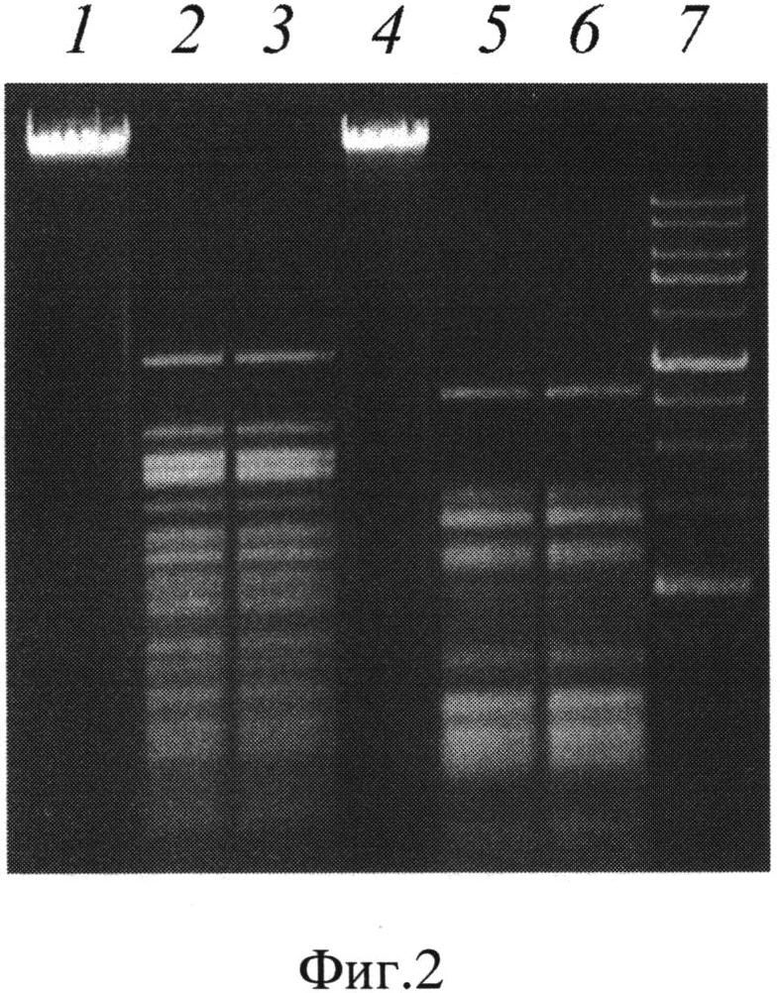
В качестве субстратов для выявления специфичности расщепления использовали ДНК фагов λ и Т7. На фиг.2 представлена электрофореграмма продуктов расщепления ДНК фагов λ и Т7 рестриктазой BpuN4I, где дорожки:
- ДНК фага λ;
- ДНК фага λ, обработанная рестриктазой PspN4I;
- ДНК фага λ, обработанная рестриктазой BpuN4I;
- ДНК фага Т7;
- ДНК фага Т7, обработанная рестриктазой PspN4I;
- ДНК фага Т7, обработанная рестриктазой BpuN4I;
7 - маркер молекулярного веса ДНК 1 kb (производства ООО «СибЭнзайм»).
Как видно из фиг.2, картины гидролиза ДНК фагов X и Т7 рестриктазами PspN4I и BpuN4I совпадают, что подтверждает идентичность последовательности (5'-GGNNCC-3'), узнаваемой этими ферментами.
Пример 4. Определение позиции гидролиза ДНК рестриктазой BpuN4I.
Для подтверждения правильности установленной последовательности узнавания BpuN4I и определения позиции расщепления ДНК авторы проводили гидролиз синтетического олигонуклеотидного дуплекса, образованного из комплементарных олигонуклеотидов KpnI-1 и KpnI-2. Узнаваемая BpuN4I последовательность выделена рамочкой.

Определение места гидролиза ДНК BpuN4I осуществляли путем сравнения длин фрагментов, образуемых при расщеплении эндонуклеазой рестрикции BpuN4I с позициями гидролиза эндонуклеазы PspN4I, расщепляющей сайт узнавания 5'-GGNNCC-3' между центральными нуклеотидами N, и Acc65I, расщепляющей сайт узнавания 5'-ССТАСС-3'после первого гуанина. В качестве маркера длин фрагментов использовали продукты частичного расщепления этого же дуплекса экзонуклеазой ExoIII из E.coli. На фиг.3 приведен радиоавтограф электрофореграммы продуктов расщепления радиоактивно меченного дуплекса KpnI-1*/KpnI-2 в 20% ПААГ с 7М мочевиной, где дорожки:
1 - дуплекс KpnI-1*/KpnI-2;
2 -дуплекс KpnI-1*/KpnI-2, обработанный рестриктазой PspN4I;
3 - дуплекс KpnI-1*/KpnI-2, обработанный рестриктазой BpuN4I;
4 - дуплекс KpnI-1*/KpnI-2, обработанный ExoIII;
5 - дуплекс KpnI-1*/KpnI-2, обработанный рестриктазой Асс651.
Как видно из фиг.3, фрагменты ДНК, образованные в результате гидролиза ферментами BpuN4I и Асс651 дуплекса KpnI-1*/KpnI-2, имеют одинаковую длину, что говорит об идентичности позиций гидролиза узнаваемой последовательности этих рестриктаз. В то же время длина Р32-меченого фрагмента, образованного после гидролиза рестриктазой PspN4I, на два нуклеотида больше. Таким образом, BpuN4I узнает последовательность ДНК 5'-GGNNCC-3' и расщепляет ее после первого гуанина на обеих цепях ДНК, образуя 5'-выступающие четырехнуклеотидные липкие концы.
Использование предлагаемого изобретения позволит расширить ассортимент высокопродуктивных штаммов-продуцентов, позволяющих получать высокоактивный препарат рестриктазы BpuN4I с активностью не менее 16000 е.а./мл. Продуцируемая новым рекомбинантным штаммом рестриктаза BpuN4I узнает и расщепляет последовательность ДНК 5'-GGNNCC-3' между двумя гуанинами, давая в результате 5'-выступающий липкий конец: 5'-G^GNNCC-3'
Источники информации
1. Qiang B.Q. et al. Two unique restriction endonucleases from Neisseria lactamica. // Nucleic Acids Res. - 1986. - V.14. - P. 373-375.
2. Roberts R.J., Vineze Т., Posfai J., Macelis D. REBASE - restriction enzymes and methylases. // Nucl. Acids Res. - 2003. - V.31. - P. 418-420.
3. Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. / Мир, 1984. - 479 с.
4. Yanisch-Perron С., Vieira J., Messing J. Improved M13 phage cloning vectors and host strains: nucleotide sequences of the M13mp18 and pUC19 vectors. // Gene - 1985. - V.33. - P. 103-119.
5. Дедков В.С, Дегтярев С.Х. Определение эндонуклеаз рестрикции в колониях микроорганизмов Streptomyces и Nocardia. // Прикладная биохимия и микробиология. - 1992. - Т.28. - С.309-313.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАТНАЯ ПЛАЗМИДНАЯ ДНК PECO29KI, ОПРЕДЕЛЯЮЩАЯ СИНТЕЗ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ ECO29KI И ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ ECO29KI | 1992 |
|
RU2054037C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК ECO 1831KI, ОПРЕДЕЛЯЮЩАЯ СИНТЕЗ ЭНДОНУКЛЕАЗЫ РЕСТРИКАЦИИ ECO 1831KI, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ ECO 1831KI | 1992 |
|
RU2054042C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ БАКТЕРИЙ Escherichia coli N42 (pElmI) - ПРОДУЦЕНТ МЕТИЛЗАВИСИМОЙ САЙТ-СПЕЦИФИЧЕСКОЙ ЭНДОНУКЛЕАЗЫ ElmI | 2015 |
|
RU2597987C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ БАКТЕРИЙ Escherichia coli N106 (pM.AgsI) - ПРОДУЦЕНТ ДНК-МЕТИЛТРАНСФЕРАЗЫ M.AgsI | 2015 |
|
RU2593368C1 |
| ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ CFRBI | 1992 |
|
RU2038382C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ БАКТЕРИЙ ESCHERICHIA COLI N16 (PM.ALUBI) - ПРОДУЦЕНТ ДНК-МЕТИЛТРАНСФЕРАЗЫ M.ALUBI | 2015 |
|
RU2603086C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PGGF 8, КОДИРУЮЩАЯ ПОЛИПЕПТИД СО СВОЙСТВАМИ ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА И ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ПОЛИПЕПТИДА СО СВОЙСТВАМИ ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА | 1996 |
|
RU2113483C1 |
| Рекомбинантная плазмидная ДНК @ -1 @ 1-13, кодирующая синтез фибробластного интерферона ( @ I) человека, способ ее конструирования, штамм бактерий ЕSснеRIснIа coLI - продуцент @ I-интерферона человека | 1987 |
|
SU1703692A1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PLT 9, КОДИРУЮЩАЯ ПОЛИПЕПТИД СО СВОЙСТВАМИ ЛИМФОТОКСИНА ЧЕЛОВЕКА, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PLT 16, ИСПОЛЬЗУЕМАЯ ДЛЯ КОНСТРУИРОВАНИЯ ДНК PLT 9, И ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ПОЛИПЕПТИДА СО СВОЙСТВАМИ ЛИМФОТОКСИНА ЧЕЛОВЕКА | 1988 |
|
SU1561510A1 |
| ФРАГМЕНТ ДНК НС365, ПОЛИПЕПТИД, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ПОЛИПЕПТИДА, ОБЛАДАЮЩЕГО СПОСОБНОСТЬЮ СВЯЗЫВАТЬ АНТИТЕЛА К ВИРУСУ ГЕПАТИТА C | 1993 |
|
RU2041949C1 |

Изобретение относится к биотехнологии и представляет собой рекомбинантный штамм бактерий Escherichia coli N41 (pBpuN4/MR), который получен путем трансформации штамма Escherichia coli ER2267 плазмидой pBpuN4/MR N41, полученной на основе плазмиды pUC19 и содержащей ген, кодирующий ДНК-метилтрансферазу M.BpuN4I, метилирующую один из цитозинов в положении С5 в последовательности 5'-GGNNCC-3', и ген рестриктазы BpuN4I. Настоящий рекомбинантный штамм бактерий Escherichia coli N41 (pBpuN4/MR) является продуцентом сайт-специфической эндонуклеазы рестрикции BpuN4I, узнающей последовательность ДНК 5'-G^GNNCC-3'/3'-CCNNG^G-5' и расщепляющей обе её цепи после первого гуанина с образованием 5'-выступающих четырёхнуклеотидных липких концов. Настоящее изобретение позволяет получить рестриктазу заданной специфичности с высоким выходом. 3 ил., 4 пр.
Рекомбинантный штамм бактерий Escherichia coli N41 (pBpuN4/MR) - продуцент сайт-специфической эндонуклеазы рестрикции BpuN4I, узнающей последовательность ДНК 5'-G^GNNCC-3'/3'-CCNNG^G-5' и расщепляющей обе её цепи после первого гуанина с образованием 5'-выступающих четырёхнуклеотидных липких концов, который получен путем трансформации штамма Escherichia coli ER2267 плазмидой pBpuN4/MR N41, полученной на основе плазмиды pUC19 и содержащей ген, кодирующий ДНК-метилтрансферазу M.BpuN4I, метилирующую один из цитозинов в положении С5 в последовательности 5'-GGNNCC-3', и ген рестриктазы BpuN4I.
| ШТАММ БАКТЕРИЙ ESCHERICHIA COLI-ПРОДУЦЕНТ ФРАГМЕНТА КЛЕНОВА | 1987 |
|
RU1602055C |
| ЧЕРНУХИН В.А | |||
| и др., Новая сайт-специфическая эндонуклеаза рестрикции BpuN4I узнает и расщепляет последовательность ДНК 5’-G^GNNCC-3’, Вестник биотехнологии и физико-химической биологии имени Ю.А | |||
| Овчинникова, 27.06.2013, Т.9, No.2, с.5-8 | |||
| US 20110207139 A1, 25.08.2011 | |||
Авторы
Даты
2014-09-27—Публикация
2013-08-13—Подача