Область техники
Изобретение относится к области медицины, в частности к онкологии, и предназначено для проведения высокотехнологичного персонифицированного противоопухолевого лечения рака и других злокачественных новообразований у человека или другого млекопитающего.
Уровень техники
Проблема лечения онкологических заболеваний до настоящего времени остается крайне трудной и практически не решаемой задачей, поэтому поиск и разработка новых противоопухолевых препаратов является очень актуальной медицинской и социально значимой общественно-экономической проблемой. Несмотря на значительные достижения в разработке и создании противоопухолевых препаратов в современной онкологии, выживаемость больных со злокачественными опухолями остается крайне низкой. Медиана выживаемости онкологических пациентов с возвратными и рефрактерными злокачественными опухолями зависит от степени пролиферативности неопластического процесса и находится на уровне 1,5-3-х лет. Лишь при небольшом количестве отдельных возвратных форм рака выживаемость составляет более 5 лет.
Эволюционные и революционные стратегии терапии опухолей в современной онкологии используют самые разнообразные методологические подходы, начиная от эмпирической медицины (травы, кровопускания, яды и т.д.) до применения самых современных высокотехнологичных инновационных методик лечения рака. В настоящее время в онкологии можно выделить ряд научно-обоснованных лечебных стратегий современной противоопухолевой терапии: ампутационная стратегия (удаление части или всего органа или органокомплекса, пораженного опухолью), гомеопатическая стратегия (лечение «подобного подобным»), фармакологическая химиотерапевтическая стратегия (противоопухолевые антибиотики и лекарственные химиопрепараты, противогрибковая терапия), иммунотерапевтическая стратегия (иммуносупрессия и иммунокоррекция, терапия моноклональными антителами), иммуновакцинационная стратегия (создание противоопухолевых вакцин, иммунопрепаратов), трансплантационная стратегия (пересадка органа и ткани взамен патологического неопластически измененного, создание и имплантация искусственных тканево-инженерных органов и тканей, трансплантация костного мозга), реконструктивно-восстановительная стратегия (заместительная пластическая микрохирургия, эндовидео- и рентгенохирургия, тканевая инженерия, имплантируемые биополимеры и биокомпозиты), молекулярная стратегия (генная, белковая и пептидная инженерия, терапия тканеспецифическими белками и факторами роста и нейротрофинами), индукционная стратегия (волновая терапия, биорезонансная терапия, гипертермия, наномедицина, рентгенотерапия, фотодинамика, борнейтронзахватная терапия, радиотерапия и радиохирургия, электростимуляция и магнитостимуляция), таргетная стратегия и направленный транспорт лекарственных веществ (воздействие на цели и мишени в патологической клетке молекулами сигнальных белков, РНК, ДНК, иРНК, антителами, генно-инженерными конструкциями, индуцированными плюрипотентными стволовыми клетками (СК) и внутриклеточный трансфер фармакологических препаратов) и другие.
Общим, объединяющим началом и сущностью всех этих известных и ультрасовременных методов и стратегий терапии опухолей является настойчивое стремление врачей любым путем уничтожить в организме пациента все опухолевые клетки (ОК): отравить их (цитотоксические методы), разрушить компартаменты ОК и приостановить их рост и развитие (цитостатические методы), удалить ОК путем хирургической резекции клеточной массы опухоли или иммунной элиминации (циторедукционные методы). Однако пока все инновационные терапевтические и хирургические подходы, направленные на уничтожение ОК, не смогли обеспечить нужную эффективность лечения и достаточную выживаемость большинства онкологических пациентов. Несмотря на постоянный поиск и обнаружение новых мишеней и целей для уничтожения ОК все еще не получено убедительных результатов от таргетной (целенаправленной) терапии, на которую возлагались большие надежды в онкологии начала этого века.
Авторы настоящего изобретения полагают, что это связано с тем, что в ОК нет (да и не может быть) перманентных и (или) универсальных мишеней для терапии. Различные канцерогенные воздействия и агрессивные факторы среды трансформируют компартменты соматической клетки и их функции очень индивидуально и разнообразно. В каждой ОК формируются уникальные механизмы повреждения и мутаций ДНК, которые создают специфические морфо-функциональные комбинации эпигенетических и генетических изменений внутриклеточных и мембранных белков. Даже при всей внешней схожести и однотипности клинических проявлений, одинаковой топической локализации процесса в органе и кажущейся однородности гистоморфологических изменений в клетках, диагностируемых визуально микроскопически, они всегда абсолютно разные по молекулярной структуре. Сегодня очевидно, что на уровне внутренней белковой ультраструктуры клетки (генома, транскриптома, протеома, метаболома и секретома) эти клетки значительно отличаются друг от друга и возможности их регуляции полностью зависят от этих эпигенетических и собственно генетических индивидуальных внутриклеточных трансформаций и метаморфоз молекулярной неопластической мимикрии их генома и протеома. Соответственно терапевтическая коррекция и регуляция поврежденных клеток требует строго индивидуального и персонифицированного подхода с учетом всего спектра возникших многоуровневых белковых нарушений.
К сожалению, современная таргетная терапия всегда будет «запаздывать» по отношению к адаптационным процессам внутриклеточных молекулярных перестроек белков, т.к. она направлена на постоянно изменяющиеся во времени и месте цели и мишени на путях внутриклеточной трансдукции в ОК, которые модифицируются на каждом новом этапе проводимого противоопухолевого лечения и естественного приспособления опухолевой клетки к изменяющимся агрессивным условиям среды, микроокружения и характера терапевтического воздействия. Это эволюционное адаптационное преимущество соматической клетки крайне необходимо для ее выживания и оно будет реализовано соматической клеткой даже при наличии необратимых мутаций ее генома, неопластического извращения протеома и необратимого нарушения секретома и метаболома.
Низкая эффективность терапии рака и опухолей путем уничтожения ОК является закономерным и эволюционно детерминированным исходом данного методологического подхода к лечению. Следовательно, крайне низкая эффективность терапии опухолей не является негативным качеством опухолевой ткани, а свидетельствует только о том, что в организме эукариот имеется высокоэффективный, надежный и закономерный способ выживания соматических клеток в неблагоприятных условиях и стрессе даже при наличии грубого генетического дефекта. Это великое эволюционное приобретение и завоевание биологии развития человека и животных. Поэтому, несмотря на все полученные знания о молекулярных внутриклеточных механизмах и старание исправить эти нарушения, целенаправленная терапия, действующая на единые мишени, всегда будем опаздывать в соревновании с природой, в постоянной борьбе с ее прогрессивными эволюционными системными механизмами адаптации и приспособления.
Поэтому парадигма противоопухолевого лечения, направленного только на уничтожение ОК, не состоятельна в принципе и нуждается в замене. И альтернатива данной парадигме уже существует - это парадигма отказа от тотального уничтожения клеток опухоли и строгий контроль их минимально допустимого количества в организме пациента, регуляция их пролиферативных свойств, управление ростом и эффекторными функциями ОК. Это конечно не позволит полностью излечить больного от онкологического заболевания в классическом смысле, но этот подход позволит обеспечить перевод острого фатального онкологического процесса в несмертельную и хроническую болезнь и может значительно продлить время выживания и качество жизни онкологических пациентов.
Конвенциональная теория канцерогенеза, основанная на происхождении рака (опухоли) из одной трансформированной дифференцированной клетки и дальнейшего опухолевого роста в результате ее клональной селекции, оказалась несостоятельной. Нужна принципиально новая концепция происхождения и методология лечения рака и злокачественных опухолей, соответствующий биотехнологический инструментарий, основанный на иной теории возникновения и развития рака. Авторы настоящего изобретения считают, что этим теоретическим обоснованием могут стать современные представления о СК человека вообще и раковой стволовой клетке (РСК), в частности.
В последние годы знания о природе СК бурно развивались, благодаря накоплению большого количества новых знаний о биологии эмбриональных СК и соматических или регионарных взрослых постнатальных СК. Фундаментальное представление о канцерогенезе рака и других опухолей в онкологии начала 21 века кардинально изменилось именно с появлением новых научных фактов о роли СК млекопитающих в эмбриогенезе и онтогенезе человека. Сегодня взрослые тканеспецифичные СК обнаружены во всех органах человека. Рак и злокачественные опухоли различной локализации рассматриваются учеными как «генетическое заболевание ядра взрослой соматической СК» [1].
Сформулирована и общепризнана на мировом уровне концепция РСК, согласно которой в основе молекулярных событий и клеточных процессов, определяющих инициацию и развитие рака и опухолей, лежат явления, связанные с возникновением и существованием РСК. Рак (злокачественная опухоль) развивается из конкретной РСК и эта РСК в ней постоянно присутствует. Возникает РСК в результате накопления мутаций во взрослых соматических СК и их последующих неопластических трансформаций или приобретения стволовости отдельными соматическими клетками с большим количеством мутаций в их геноме и соответственно анеуплоидий в кариотипе.
Концепция РСК сразу же стала основной методологической платформой для стратегии уничтожения РСК в опухоли и были отмечены первые успехи в этом новом направлении противоопухолевой терапии с использованием различных фармакологических препаратов. Однако, демонстрируя возможности уничтожения РСК, ученые пришли в печальному выводу, что РСК способна выжить даже в самых тяжелых и крайне неблагоприятных условиях. На каждую новую агрессию РСК и ОК реагируют формированием лекарственной резистентности. На самом деле, степень лекарственной резистентности РСК и ОК демонстрирует лишь уровень эволюционной приспособляемости соматической клетки к выживанию и степени адаптируемости ОК и РСК в условиях стресса и неблагоприятных воздействий.
Возникает резонный вопрос - а действительно ли нужно уничтожать все ОК и РСК в организме онкологического пациента и не будет ли этим нанесен вред нормальным клеткам и здоровым СК организма пациента? Весь опыт современной онкологии свидетельствует о том, что методологический подход, направленный на уничтожение клеток, пока еще не принес ожидаемых результатов. По-видимому невозможно, да и не нужно, уничтожать все ОК и РСК, так как они имеют огромный адаптационный потенциал и уникальные ресурсы для приспособляемости.
Следует учитывать, что СК вообще, и по-видимому и РСК в частности, это универсальная форма выживания соматических клеточных систем у млекопитающих, аналогичная «споре» у растений, и СК и РСК способны выжить даже в самых экстремальных и неблагоприятных условиях. Поэтому таргетная химиотерапия и лучевая терапия, убивающие ОК, практически не действуют на постнатальные СК и РСК, но при этом могут привести к повреждению и необратимым мутациям нормальных регионарных тканеспецифичных СК у онкологического пациента и формированию новых пулов РСК.
Доказано, что у здорового человека в норме существует до 500 тысяч (55) раковых клеток, у больного с предраком их до 1 миллиарда (109), а у больного раком их больше 1 миллиарда. Поэтому даже у здорового человека имеются РСК, но они находятся под жестким регуляторным контролем естественных противоопухолевых регуляторных систем. Проблема рака в этом аспекте представляется отчасти проблемой потери контроля, проблемой неуправляемого роста ОК и неконтролируемого увеличения количества РСК и их потомков ОК, способных к неограниченной пролиферации. При этом крайне важно, что ОК и РСК становятся неуправляемыми только для обычных рост-регулирующих механизмов организма (СК, макрофагов, регуляторных клеток и т.д.), но остаются чувствительными к сверхсильным регуляторным воздействиям [2].
Возникает резонный вопрос. Быть может, не стоит пытаться уничтожать все ОК? Может быть, необходимо попытаться направить все усилия на регуляцию и контроль опухолевого роста и контроль количества ОК и РСК, а также на управление их эффекторными функциями? Возможно, человек сможет жить с определенным количеством РСК и ОК (до 1 миллиарда), если их специфичное функционирование, пролиферативный потенциал и эффекторные функции будут жестко регламентированы и контролированы. По-видимому, если научиться управлять пролиферативным потенциалом и количеством ОК и РСК, то можно перевести онкологическое заболевание из острого и фатального в курабельное, несмертельное и хроническое и значительно увеличить выживаемость этого контингента пациентов.
Можно ли, непосредственно воздействуя на ОК или РСК, управлять ими? Скорее всего, обычными фармакологическими способами и терапевтическими методами это невозможно, так как эти клетки уже генетически измененные, мутировавшие соматические клетки. Они практически не реагирует на стандартные сигналы межклеточного взаимодействия. Они малочувствительны к индукции апоптоза, обладают неограниченной способностью к пролиферации и способностью индуцировать ангиогенез. Но поскольку установлено, что ОК и РСК способны ответить на сверхсильные направленные сигнальные межклеточные воздействия, есть возможность для их регуляции здоровыми и хорошо управляемыми клеточными системами СК. Механизм обнаружения собственными СК патологических ОК и РСК известен, это миграция и хоуминг СК в опухоль по градиенту концентрации воспаления в ней, равномерное распределение в опухоли, клеточная адгезия к ОК и РСК, регуляторное воздействие СК на РСК и ОК по механизму "by stander effect" (эффект рядом стоящего). Именно этот известный научный факт открывает реальные возможности для активной биорегуляции РСК и адекватного контроля количества этих патологических клеток в организме пациента собственными СК и прогениторными клетками (ПК). При этом необходимо лишь обеспечить СК управляющим противоопухолевым потенциалом регуляторного воздействия.
В живой природе такое сверхсильное управляющее воздействие на СК реализуется путем направленной клеточной индукции, возникающей, например, в массе клеток «предымплантационной» бластоцисты, что и предопределяет основные пути и вехи эмбриогенеза млекопитающего и человека. Именно путем клеточной индукции организм эукариот удаляет патологически измененные РСК или ОК, а также излишние клетки, образующиеся в результате ошибок и сбоев в процессе эмбриогенеза и онтогенеза. Поэтому клеточная индукция может рассматриваться в качестве современного инструмента противоопухолевой регуляции и биоуправления ОК и РСК.
Однако при этом возникает ряд резонных вопросов. Индукция каких клеточных систем может выполнять регуляторную противоопухолевую защиту? Какие системы организма человека участвуют в системной (общеорганизменной) и местной (органной, тканевой) противоопухолевой регуляции? Какие клетки способны встроиться в существующие ниши РСК?
Давно известно, что основные противоопухолевые функции во всем организме выполняет иммунная система. Регуляторные клетки иммунной системы являются фундаментальным приобретением эукариот в борьбе с инфекционными агентами и неопластическими трансформациями соматических клеток. Иммунная система выполняет функции базового инструмента противоопухолевого саногенеза, удаляя излишние ОК и РСК из организма человека. В основе системной противоопухолевой иерархии клеток иммунной системы лежат гемопоэтические стволовые клетки (ГСК), являющиеся родоначальницами всех ее регуляторных клеток. Как показали предыдущие исследования, ГСК и их прогенеторы сами способны по градиенту воспаления найти в организме РСК, встроиться в ниши РСК, прикрепиться к РСК путем клеточной адгезии и по механизму "by stander effect" оказать регуляторное воздействие на РСК. Но при наличии злокачественной опухоли ГСК имеют достаточно ограниченные возможности противоопухолевого управления и регуляции.
Другим локальным противоопухолевым механизмом в тканях органов и систем являются регионарные (органные) тканеспецифические мультипотентные СК и прогенеторные (нейральные, мезенхимальные, зародышевые и т.д.) клетки (ПК), способные к специфическому сигнальному воздействию на ОК. Исследования последних лет показали, что трансплантируемые мультипотентные СК способны создать в патологической зоне новое микроокружение (нишу) вокруг РСК и активно влиять на ее активность и продуктивность путем направленного межклеточного сигналинга [3]. Также были экспериментально показаны некоторые возможности регуляции (активации и ингибирования) опухолевого роста глиомы С6 у крыс с использованием нативных и индуцированных нейральных СК (НСК), ГСК и прогенеторных клеток [4]. Постнатальные НСК и ГСК человека, введенные в глиальную опухоль крысы, препятствовали росту новообразования, замедляли его распространение и метастазирование. А индуцированные на апоптоз СК, трансплантированные в опухоль, наоборот, стимулировали рост опухоли, хотя в экспериментах in vitro было показано, что эти клетки в течение 7 дней способны подавить 50% роста клеток опухоли, индуцируя апоптоз в близлежащих клетках опухоли.
Противоопухолевые свойства регионарных СК и их потомков - клеток-предшественников в настоящее время практически не вызывает сомнения у большинства исследователей. Ученые (G. Kempermann) Берлинского университета Шарите (Charite University Medicine Berlin) экспериментально доказали эффективность противоопухолевого воздействия НСК и нейральных предшественников на мультиформную глиобластому головного мозга.
Однако возникают следующие вопросы. Если собственные постнатальные СК обладают способностью оказывать регуляторный противоопухолевый эффект на ОК и РСК, то почему они не препятствуют развитию злокачественной опухоли, приводящей к смерти организма? Быть может, их количества становится недостаточно для борьбы с опухолью или их противоопухолевые способности подавлены? Быть может, они действуют только на ОК, но не способны влиять на РСК? Почему в определенных условиях их межклеточный сигнал перестает быть управляющим для ОК и РСК?
Показано, что с возрастом значительно снижается количество регионарных СК, что нарушает локальный противоопухолевый иммунитет и это способствует возникновению неопластического процесса. Но в то же время почему-то нарушаются системные механизмы противоопухолевого иммунитета, при которых количество ГСК достаточное. Именно нарушение системных взаимоотношений между различными клеточными системами и приводит к формированию неуправляемых клеточных пролиферативных или апоптотических процессов.
На самом деле, на уровне клеточной биологии при терапии рака и опухолей авторы настоящего изобретения столкнулись с задачей регуляции и управления различных клеточных систем (СК, ПК, РСК, ОК). Для управленческой задачи подобного уровня во многих технических областях уже давно были найдены оптимальные решения. Так главный постулат междисциплинарной научной теории управления систем формулируется следующим образом: управляющим во взаимоотношениях различных систем является самая медленная фаза одного из процессов этих взаимодействующих систем.
При наличии злокачественной опухоли (рака) имеются три клеточные системы, непосредственно взаимодействующие между собой в организме онкологического пациента. Во-первых, это иммунная система пациента, все клетки которой берут начало от ГСК и все потомки ГСК (специализированные дифференцированные клетки) выполняют основные функции иммунитета организма и системной противомикробной и противоопухолевой защиты (Т-киллеры, Т-супрессоры, Т-хелперы, В-лейкоциты и т.д.). Второй противоопухолевой клеточной системой является система регионарных взрослых тканеспецифичных СК органа, пораженного опухолью, которая также выполняет функции местной противоопухолевой защиты. Компоненты этой системы - орган-специфические клетки различной степени дифференцировки, берущие свое начало от регионарной СК (нейральной, мезенхимальной и т.д.). Третья клеточная система это собственно сама система клеток опухоли, берущая свое начало от РСК. Все клеточные популяции опухоли (ОК различной степени дифференцированности) являются потомками этой РСК. Взаимоотношения между этими тремя клеточными системами и определяют клеточное равновесие в ткани в норме и при патологии.
В здоровой ткани системное клеточное равновесие в ней на уровне всего организма обеспечивается нормальными ГСК, так как они обладают самым медленным темпом пролиферации среди всех здоровых клеток организма. Математическое моделирование оценило скорость деления ГСК как одно деление за 1-2 года [5], а в промежутке между делениями ГСК пребывают в состоянии пролиферативного покоя. В экспериментальных условиях с использованием бромдиоксиуридина длительность клеточного цикла ГСК мелких грызунов примерно 30 дней. Ежедневно пролиферирует только 8% клеточной популяции. Исследования популяционной кинетики ГСК у кошек показали, что ГСК вступают в пролиферацию 1 раз в 10 недель. У высших приматов частота пула СК оценивается примерно 1 раз в год. При этом первая фаза пролиферации от ГСК до первого предшественника составляет 21 день. Поэтому в здоровом организме ГСК являются основными управляющими клеточными системами и их потомки выполняют фундаментальные регуляторные функции (регуляторные клетки иммунной системы с маркерами CD4+, CD25+). Аналогичное время (20-21 день) формирования первого предшественника у взрослых ИСК. А время формирования первого предшественника, например при глиобластоме, от начала пролиферации РСК составляет 28 дней. И хотя общее время популяционной кинетики глиобластомной опухоли значительно меньше (60 дней), чем у ГСК, очевидно, что РСК глиомной опухоли доминируют в новых системных межклеточных отношениях. Поэтому, в соответствии с теорией управления систем, при наличии в организме злокачественной опухоли управляющим становится онкологический процесс и все противоопухолевые системы перестают выполнять свои противоопухолевые функции, так как находятся в прямой зависимости от управляющего онкологического процесса и управляются им. Этим объясняется то, что все другие клетки способствуют развитию опухоли и ее метастазированию. Например, известно, что при метастазировании опухоли собственные фибробласты пациента прокладывают дорогу ОК и РСК в неповрежденных тканях органов к новым зонам метастазирования. Поэтому при наличии злокачественной опухоли у пациента его РСК и ее потомки не могут быть уничтожены системными и локальными механизмами противоопухолевой защиты организма пациента. Более того, собственные СК часто сами способствуют прогрессированию онкологического процесса. Этот факт уже давно нашел свое экспериментальное подтверждения в целом ряде научных публикаций. Поэтому, хотя собственные регионарные СК и ГСК способны оказывать ингибирующее воздействие на рост и пролиферацию злокачественной опухоли, их применение недостаточно эффективно для регуляции ОК и РСК [6].
Один из научно обоснованных методологических подходов к решению проблемы регуляции ОК и РСК учеными уже в основном намечен. Это искусственное перепрограммирование (репрограммирование) соматических клеток, обеспечивающее восстановление естественных и функциональных системных отношений между всеми клеточными системами организма онкологического пациента. В подобном биохимическом процессе ключевую роль могут играть ингибиторы и активаторы клеточного цикла и дифференцировки [7].
С позиций теории управления систем целью перепрограммирования собственных СК должно быть строго индивидуальное (персонифицированное) переформатирование клеточного цикла СК в сторону увеличения сроков образования их первых и вторых предшественников. Это теоретически возможно за счет целенаправленного персонифицированного биохимического воздействия на здоровую СК. Персонифицированное перепрограммирование СК должно быть проведено с учетом ряда важных клеточных параметров: а) времени формирования первых и вторых предшественников ГСК в норме, в регионарных СК пораженного опухолью органа и конкретной опухоли или опухолей при наличии двух и более новообразований, б) скорости пролиферативных процессов во всех трех взаимодействующих клеточных системах, в) изменения экспрессии генов СК при перепрограммировании должно быть в пределах физиологической нормы и оно не должно сопровождаться модифицикацией или трансформацией генома этих клеток. Моделирование взаимоотношений этих параметров позволит оценить эффективность проводимого перепрограммирования.
На современном уровне развития науки искусственное репрограммирование соматических клеток может быть осуществлено тремя известными принципиальными путями:
1) эпигенетическое перепрограммирование генома транскрипционными факторами цитоплазмы ооцита;
2) эндогенетическое перепрограммирование путем встраивания новых генов;
3) эндогенетическое и эпигенетическое перепрограммирование путем создания клеточных гибридов.
Все вышеперечисленные пути репрограммирования соматических клеток имеют один большой недостаток - во всех трех случаях необратимо модифицируется геном соматической клетки и поэтому имеется высокий риск появления новых ранее неизвестных генетических болезней, возможность неконтролируемого изменения и трансформации генофонда населения и возможность необратимых нарушений витальных функций пациентов.
Как правило, целью генно-инженерных манипуляций является его направленная модификация для выработки геномом определенных транскриптов и микроРНК, способных так модифицировать протеом соматической клетки, чтобы он мог секретировать определенный требуемый белок, способный выполнять нужную функцию. В этой связи было бы целесообразно попытаться манипулировать уже известными и четко описанными программами клеточного цикла с их хорошо прогнозируемыми эффекторными функциями, не допуская модификаций генома в репрограммируемой соматической клетке. Но в этом случае необходимо жестко ограничить объем манипуляций с репрограммируемой клеткой до уровня изменения экспрессии генов в пределах их физиологических концентраций, экспрессирующих специфичные белки. То есть необходимо управлять программами клеточного цикла на эпигенетическом уровне, не допуская любой даже самой незначительной трансформации генома СК или его декомпенсации.
Иллюстрацией практической возможности эпигенетической модификации транскриптомного, протемного и секретомного профилей постнатальных СК и ПК эукариот могут быть работы японских исследователей, см. статью [8]. В указанной статье показано, что путем специфичной химической обработки ретиноевой кислотой, фактором роста фибробластов и диметилсульфоксидом (ДМСО), направленной в сторону нейральной дифференцировки in vitro в стромальных СК костного мозга, можно существенно изменить транскриптомный профиль генной экспрессии генетически здоровых СК с таргетным увеличением экспрессии пяти нейронассоциированных генов, значительно снизить экспрессию генов, связанных с формированием мезенхимальных клеток, что было подтверждено на уровне микроматричного анализа и ПЦР-РВ (реакция преципитации в реальном режиме времени). Более того, микроматричный анализ и ПЦР-РВ показали, что стромальные СК костного мозга с нейрально-модифицированным фенотипом экспрессируют белки определенных факторов роста, включая NGF-b и BDNF, что указывает на их терапевтическую роль в защите повреждений центральной нервной системы. Полученные результаты позволили предположить авторам указанной статьи, что по крайней мере СК костного мозга обладают мультипотентностью и потенциалом к изменению профиля генной экспрессии в ответ на воздействие окружающей среды, способны секретировать нейротрофические и нейропротекторные факторы. Таким образом, японские исследователи показали, что ремоделирование профиля экспрессии генов мультипотентной СК методами химической индукции без генной модификации реально и позволяет обеспечить необходимый регуляторный протемный профиль и создать требуемый секретом СК. Они трактовали полученные факты изменения профиля экспрессии СК костного мозга как недостаточную способность этих клеточных систем к нейральной дифференцировке, но на самом деле, анализируя их результаты с позиций теории систем, очевидно, что они продемонстрировали новую технологию ремоделирования фенотипа СК путем модификации транскриптомного профиля и получения требуемого протеомного профиля этих СК, что приводит к получению индуцированных клеточных систем с заданными свойствами. Программный алгоритм этих новых клеточных морфологических и функциональных свойств заложен в изменении экспрессии профиля генов, без генно-инженерных модификаций их генома. Японские исследователи практически показали и реализовали в эксперименте методику эпигенетического ремоделирования фенотипа и протеомного профиля СК костного мозга через модификацию их транскриптома. Их работы доказали, что, зная полный транскиптомный профиль здоровых СК пациента, можно методом химической индукции различными низкомолекулярными веществами и белками добиться нужного изменения транскриптомного профиля здоровых СК и тем самым получить требуемый вариант транскриптомного профиля, который в нужном направлении модифицирует протемный профиль этих СК или ПК пациента, способных секретировать нужные регуляторные белки, микроРНК и т.д.
Вышеизложенное позволяет сделать вывод о том, что имеется как насущная необходимость, так и практическая возможность создания персонифицированных противоопухолевых клеточных систем с неизмененным геномом, но модифицированным протеомом, способным продуцировать необходимый регуляторный секретом, который в свою очередь способен оказывать сверхсильное регуляторное и управляющее воздействие на РСК и ингибировать ее пролиферативные, ресторативные и репродуктивные эффекторные функции. Указанная возможность реализована в настоящем изобретении.
В качестве наиболее близкого аналога предлагаемого изобретения принят препарат стволовых клеток, описанный в патенте RU 2428475 (опубликован 10.09.2011) на "Препарат стволовых клеток с репрограммированным клеточным сигналингом, способ получения этого препарата и его применение". Раскрытый в указанном патенте способ терапии опухолей с применением известного препарата выполняется путем предобработки или имплантации в СК различных сигнальных белков или фармацевтических препаратов, инкасулированных в наноконтейнеры с биодеградируемой оболочкой. Направленное сигнальное воздействие осуществляется перепрограммированными СК путем выхода сигнального белка (индуктора апоптоза, активатора клеточного цикла и т.д.) или фармацевтического препарата в ее цитоплазму, вызывая в ней индукцию в заданном терапевтическом направлении (апоптоз, пролиферация или дифференцировка), что приводит к индукции определенных эффекторных функций клетки и запуску системных регуляторных межклеточных процессов. Однако оказалось, что применение известного препарата имеет ряд серьезных недостатков, являясь недифференцированной системной терапией новообразований. Применение известного препарата не учитывает индивидуальных особенностей неопластического изменения и последующих трансформаций генома, протеома, секретома и метаболома РСК и ОК различной стадии дифференцировки под воздействием этого препарата, не учитывает структурных отличий РСК от здоровой СК, а также не обеспечивает оптимальных условий регуляторного управляющего избирательного воздействия на РСК опухоли, что значительно ограничивает возможности применения известного препарата.
Задачей настоящего изобретения является получение противоопухолевого препарата, предназначенного для лечения конкретной опухоли конкретного пациента, т.е. получение персонифицированного противоопухолевого препарата, учитывающего все индивидуальные особенности модификаций генома и протеома пациента и обладающего заданным регуляторным воздействием на его РСК и ОК.
Сущность изобретения
Решение указанной задачи достигается в настоящем изобретении тем, что предложен способ получения противоопухолевого индивидуального протеом-основанного таргетного клеточного препарата (ПИПОТКП), представляющего собой химически индуцированную транскриптом-модифицированную клеточную систему для персонализированной терапии злокачественных новообразований у человека или животного, включающий в себя:
забор, выделение и изоляцию постнатальных (взрослых) мультипотентных тканеспецифичных аутологичных стволовых клеток (АСК) и/или аутологичных прогениторных клеток (АПК) для их последующих протеомного и полнотранскриптомного исследований, причем тип указанных АСК и/или АПК выбирают в соответствии с диагностированной у пациента нозологией онкологического заболевания и преимущественной органной локализацией опухоли;
забор, выделение и изоляцию постнатальных мультипотентных тканеспецифичных АСК и/или АПК и/или мультипотентных аллогенных HLA-гаплоидентичных стволовых клеток для последующего ремоделирования их протеомного профиля, причем тип этих клеток выбирают в соответствии с диагностированной у пациента нозологией онкологического заболевания и преимущественной органной локализацией опухоли;
забор, выделение и изоляцию стволовых клеток (РСК) из опухоли пациента по соответствующим специфическим маркерам клеточной поверхности;
проведение протеомного анализа лизатов АСК и/или АПК, выделенных для анализа, и указанных РСК с картированием и получением протеомных профилей сигнальной интенсивности белков этих клеток;
проведение полнотранскриптомного анализа экспрессии генов изолированных АСК и/или АПК и РСК с картированием и получением полнотранскриптомных профилей нормализованной сигнальной интенсивности экспрессии генов этих клеток;
инвентаризация и определение набора белков, каждый из которых содержится в полученных протеомных профилях как АСК и/или АПК, выделенных для анализа, так и указанных РСК;
проведение сравнительного биоинформационного анализа ранее определенного набора белков АСК (АПК) и РСК для идентификации в указанных РСК одного или нескольких внутриклеточных сигнальных путей (ВКСП), не подвергшихся неопластической трансформации в результате канцерогенеза, и определения одного или нескольких белков-мишеней, являющихся мембранными акцепторами идентифицированных сигнальных путей;
проведение биоинформационного анализа полнотраснкриптомного профиля экспрессии генов РСК и подтверждение сохранности и функциональной значимости основных структурных компонентов идентифицированных сигнальных путей в РСК;
определение белков-лигандов, способных активировать белки-мишени диагностированных функционально сохранных ВКСП РСК;
проведение сравнительного анализа ранее полученных транскриптомных профилей изолированных АСК и/или АПК с транскриптомными профилями, содержащимися в известных международных базах данных транскриптомов, для определения одного или нескольких пертурбогенов, способных модифицировать профиль экспрессии генов стволовых клеток, выделенных для дальнейшего ремоделирования их протеомного профиля, в направлении секреции ранее определенных белков-лигандов, способных регуляторно воздействовать на ВКСП;
ремоделирование протеомного профиля выделенных для этого стволовых клеток ранее определенными пертурбогенами с получением в результате этого модифицированного транскриптомного профиля различных клеточных систем (стволовых клеток, прогенеторов, иммунокомпетентных клеток и т.д.), способных оказывать регуляторное воздействие на РСК пациента.
В способе получения ПИПОТКП по настоящему изобретению белки-лиганды определяют с использованием известных баз данных белок-белковых взаимодействий. Сравнительный анализ транскриптомных профилей проводят с использованием метода распознавания образов. В качестве пертурбогенов используют фармацевтические препараты, белковые препараты, антитела к белкам, микроРНК, матричные РНК, низкомолекулярные химические вещества, цитокины, факторы роста, нейротрофины, гормоны. Ремоделирование протеомного профиля выделенных для этого стволовых клеток осуществляется за счет направленной модификации транскриптомного профиля экспрессии генов и проводят путем добавления ранее определенных пертурбогенов в культуру ремоделируемых клеток, выдержки пертурбогенов в культуре и последующей отмывки ремоделированных клеток от пертурбогенов. В качестве указанных АСК и/или АПК и/или HLA-CK используют гемопоэтические, нейральные или мезенхимальные стволовые клетки.
Кроме того, согласно настоящему изобретению предложен противоопухолевый индивидуальный протеом-основанный таргетный клеточный препарат, содержащий постнатальные тканеспецифичные мультипотентные аутологичные стволовые клетки и/или аутологичные прогениторные клетки и/или мультипотентные аллогенные HLA-гаплоидентичные стволовые клетки с ремоделированным протеомным профилем, полученные вышеописанным способом по настоящему изобретению.
В качестве одного из объектов настоящего изобретения предложено также применение противоопухолевого индивидуального протеом-основанного таргетного клеточного препарата, полученного способом по настоящему изобретению, для персонализированной терапии злокачественных новообразований у человека или другого млекопитающего.
Перечень чертежей
На фиг.1А и 1В дано графическое представление структурной иерархии базовых белков в нормальной СК и РСК соответственно;
на фиг.2 - схема последовательности этапов осуществления способа получения ПИПОТКП по настоящему изобретению;
на фиг.3 - пример автоматизированного поиска транскриптомного профиля по изменению экспрессии генов СК костного мозга под действием основного фактора роста фибропластов, ДМСО и ретиноевой кислоты (механизм модификации траснкриптомного профиля экспрессии генов стромальной СК - ингибирования белка, отвечающего за эпигенетический контроль) в процессе осуществления способа по настоящему изобретению.
на фиг.4 - динамика МРТ пациента Г. с глиобластомой после применения ПИПОТКП по настоящему изобретению (см. далее Пример 4): а) август 2006 г., b) ноябрь 2006 г., с) август 2007 г.
Подробное описание изобретения
Авторы настоящего изобретения предположили, что если обнаружить на поверхности РСК белки-мишени, являющиеся акцепторами сохранившихся и нетрансформированных опухолевым процессом внутриклеточных сигнальных путей (ВКСП), то целенаправленным (таргетным) воздействием на них белков-лигандов (белков-партнеров), секретируемых терапевтической клеточной системой ПИПОТКП, можно добиться регуляторного воздействия на гены-мишени в РСК и дестабилизировать ее репродуктивные и пролиферативные функции, добившись тем самым ее репродуктивного молчания. Поэтому главными методологическими целями разработки способа получения ПИПОТКП по настоящему изобретению явились определение основных акцепторных белков-мишеней на мембране РСК и отработка методов получения секреции белков-лигандов из собственных постнатальных СК (стволовоподобных) и ПК пациента.
Как следует из вышеизложенного в разделе "Уровень техники", ПИПОТКП по настоящему изобретению должна обеспечить ремоделирование фенотипа СК и ПК пациента и соответственно целенаправленную модификацию транскриптомного профиля его терапевтических соматических клеток. Однако необходимо так аккуратно индуцировать тонкие эпигенетические механизмы здоровых СК, чтобы никак не модифицировать структуру их генома и в то же время сделать их способными своими эффекторными функциями воздействовать на требуемые системные межклеточные процессы и регулировать РСК и ОК конкретной опухоли. То есть, с одной стороны, следует обеспечить необходимое и достаточное регуляторное воздействие ПИПОТКП на акцепторные белки-мишени ВКСП РСК в опухоли пациента, а с другой стороны, нельзя ремоделированием фенотипа модифицировать ДНК- структуру и мультипотентность профиля экспрессии генов СК, а также нельзя допустить включения и активации генов, обеспечивающих плюрипотентность СК. Включение этих факторов может стать причиной еще большей устойчивости генома РСК и неустойчивости ОК и соответственно прогрессирования опухоли. Поэтому ремоделирование фенотипа и соответственно протеома СК должно быть очень тонким и крайне аккуратным биотехнологическим процессом, находящимся под жестким контролем объективных параметров мониторинга.
Это накладывает ряд ограничений на СК и ПК, которые могут быть использованы для получения ПИПОТКП по настоящему изобретению. Во-первых, в качестве таких клеток могут использоваться только генетически здоровые постнатальные мультипотентные СК и ПК без генетических мутаций. По возможности, целесообразно провести полногеномное исследование применяемых клеточных систем, а при сомнениях и секвенирование вызывающих сомнения генов этих клеток. Это могут быть мультипотентные регионарные СК, уже получившие базовый вектор дифференцировки, такие как НСК, ГСК и мезенхимальные СК (МСК). Во-вторых, это должны быть аутологичные (собственные) мультипотентные СК и ПК (АСК и АПК) или алогенные HLA-гаплоидентичные СК (HLA-CK), полученные от близкородственного донора (матери, отца, брата, сестры) для исключения или уменьшения иммунного конфликта "трансплантат против хозяина". В-третьих, указанные АСК и/или АПК и/или HLA-CK должны быть строго индивидуальны для определенного пациента, т.е. активны только в отношении РСК и ОК конкретной опухоли у пациента с учетом ее индивидуальной гистогенетической и морфологической структуры и выступать основным регулятором иммунной реакции "трансплантат против опухоли". Поэтому конкретный тип (ГСК, МСК или НСК) указанных АСК, АПК и HLA-CK следует выбирать в соответствии с диагностированной у пациента нозологией онкологического заболевания, т.е. согласно гистогенетическому и иммунногистохимическому типу диагностированной опухоли. Например, в случае опухоли головного или спинного мозга используют НСК из обонятельной выстилки, в случае солидной опухоли внутренних органов - МСК из костного мозга или жировой ткани, а при онкологическом заболевании крови и лимфы используют ГСК и т.д.
Общая концепция применения и основной механизм противоопухолевого регуляторного действия ПИПОТКП по настоящему изобретению могут проявляться на двух информационных уровнях - общем (системном) и локальном (органном или тканевом). На системном уровне терапия злокачественных опухолей с применением ПИПОТКП по настоящему изобретению может быть осуществлена путем трансплантации ПИПОТКП в периферическую кровь традиционным способом после завершения 1-й - 2-й линии химиотерапии пациента и окончания курса лучевой терапии. Персонифицированное ремоделирование протеомного профиля в аутологичных или аллогенных ГСК путем модификации ее траснкриптомного профиля должно быть осуществлено сугубо индивидуализировано, для конкретной опухоли, таким образом, чтобы ГСК и их потомки (Т-регуляторные клетки) стали управляющими для РСК опухоли в уже существующем формате взаимоотношений клеточных систем организма онкологического пациента. Локальное регуляторное воздействие на РСК в ткани опухоли может быть оказано протеом-основанными траснкриптом-модифицированными тканеспецифическими (НСК, МСК и т.д.) ПИПОТКП путем селективного их подведения к неопластически пораженному органу (введение ПИПОТКП в ликвор при опухолях мозга, введение в ближайшие к солидной опухоли лимфатические узлы, рентгенохирургическое внутриартериальное введение, эндоскопическое введение в ткань опухоли и т.д).
Следует отметить один важный терминологический аспект. В современной научной литературе перепрограммированные соматические клетки, т.е. клетки с заданными свойствами и модифицированным геномом, называются индуцированными плюрипотентными (iPSC) или генно-модифицированными СК. Поэтому для исключения путаницы и для обозначения АСК и/или АПК и/или HLA-CK, имеющих ремоделированный протеомный профиль и модифицированный транскриптомный профиль без генетических модификаций для получения ПИПОТКП по настоящему изобретению, авторы изобретения считают неправильным использование термина "индуцированные плюрипотентные", хотя они и получаются методом химической индукции. В них путем индукции изменяется только фенотип клетки или, другими словами, модифицируется протеомный профиль. Поэтому можно называть химически индуцированные транскриптом-модифицированные клеточные системы, полученные по настоящему изобретению, индуцированными мультипотентными СК (iMSC), но правильнее ПИПОТКП.
Ниже представлено более подробное обоснование операций и приемов способа получения ПИПОТКП по настоящему изобретению в связи с основным молекулярным противоопухолевым механизмом действия предлагаемой ПИПОТКП. В процессе получения ПИПОТКП всю информацию о протемном профиле белков АСК и/или АПК, представляющую видовую норму пациента, сравнивают с аналогичной информацией о протеомном профиле РСК, выделенной из опухоли пациента. Это единственно объективная и стандартизированная биологическая информация, позволяющая сравнивать постнатальные СК с РСК, так как эти клетки микроскопически практически неотличимы и визуальная информация, полученная с использованием современной микроскопической техники, для сравнительного анализа тканеспецифичных СК и РСК пациента малозначима. С биохимической точки зрения информация о протемном и транскриптомном профиле белков, полученная в результате постгеномного анализа живых клеточных систем, отражает эпигенетические межклеточные и внутриклеточные сигнальные пути РСК и нормальной СК и точки их приложения (акцепторы) в виде маркеров и рецепторов клеточной поверхности, состоящие из набора определенных белковых соединений. В таблице 1 представлены основные известные в настоящее время маркеры клеточной поверхности, отличающие РСК от нормальных постнатальных СК. Поэтому возможно иммунохимическое дифференцирование и отделение РСК от здоровых СК. Используя технологии иммуносорбции, можно легко осуществить разделение этих клеток и их изоляцию по маркерам клеточной поверхности, а для протеомного анализа количество клеток может быть дополнительно увеличено путем культивирования.
Colins А.Т. и др., 2006
(суспензионная культура)
Маркерами здоровых постнатальных НСК являются белки CD133+, маркерами МСК - белки CD44+,CD90+,CD73+,CD29+,CD105+, CD34-, C-kit- (CD117-), a маркерами ГСК - CD34+, CD45+,CD 133+ и другие.
Регуляция молекулярных механизмов, лежащих в основе стимуляции процессов пролиферации и дифференцировки в РСК, находится под контролем тех же ВКСП, что и в нормальных СК - Hedgehog (Hh), Notch и Wnt (см. Таблицу 2). Эти сигнальные пути играют ключевую роль в канцерогенезе многих солидных опухолей.
Все компартменты соматической клетки (ядро, цитоплазма, органеллы, клеточные мембраны) и сигнальные пути в нормальной СК и в РСК представляют собой набор определенных белков на различных схематичных уровнях функционирования клетки -генома, транскриптома, протеома, секретома и метаболома клетки. На уровне генома выявляются гены, экспрессирующие специфичные белки, расположенные на определенных сайтах хромосом ядра клетки. На уровне транскриптома сигнальные пути проявляются транскрипционными белковыми комплексами, формируемыми белками определенных семейств в цитоплазме СК для передачи сигнала в ядро клетки. На уровне протеома это белки сигнальных систем СК, осуществляющие специализированные функции.
Белки сигнального пути Hh: Shh, Ihh, Dhh, SMOH, SUFU, Glil, Gl 2, Gli 3 и др.
Белки сигнального пути Notch: белки рецепторов Notch и лиганды Delta, Serata, Lag-23.
Белки сигнального пути Wnt: 19 гликопротеинов, взаимодействующих с рецепторторным белком Frizzled и корецептором LRP5/6.
На уровне секретома это функциональные белковые соединения в виде сигнальных и регуляторных молекул биологически активных веществ соматической клетки (гормоны, цитокины, факторы роста, нейротрофины и т.д.) для межклеточного взаимодействия или внутриорганной регуляции (инсулин, дофамин и т.д.). На уровне метаболома это белки метаболизма, энергентики и жизнедеятельности соматической клетки.
Соотношения белков транскриптома, протеома, метаболома и секретома в здоровой постнатальной СК генетически жестко заданы (фиг.1А), но при формировании РСК и ОК эти соотношения протеинов персонифицировано изменяются за счет существенного увеличения и качественного изменения белков протеома (фиг.1В), что приводит к нарушению транскрипции белков, нарушениям секреторных функций клетки и ее метаболитов, появлению новых онкоспецифических белков. Накопление мутаций в геноме приводит к его модификации в РСК и, как следствие, к необратимым нарушениям в транскриптоме и соответственно серьезному дисбалансу в протеоме, секретоме и метаболоме.
Поэтому, чтобы осуществить целенаправленное регуляторное воздействие на конкретные мишени ядра РСК и ОК и получить адекватный ответ от генома РСК, необходимо найти в этих клетках «ахиллесову пяту», через которую можно добиться адекватного ответа РСК на целенаправленное регуляторное воздействие. Этой ахиллесовой пятой могут быть только те пути сигнальной трансдукции в РСК, которые пока еще не изменены неопластическим процессом на всех этапах этих путей (мембране, цитоплазме, органелах, ядре) и будут способны донести регуляторный сигнал с рецепторов поверхности РСК до конкретных геномных мишеней в ядре этой мутировавшей клетки.
Таким образом, в способе получения ПИПОТКП по настоящему изобретению белки-мишени определяют только в тех ВКСП, которые пока еще не подверглись неопластической трансформации онкоспецифическими белками, продуцируемыми онкогенами в РСК. Как только будут диагностированы (идентифицированы) все существующие неподвергшиеся опухолевым трансформациям сигнальные пути, по которым еще возможно систематичное поступление информации внутрь клетки и далее к геному РСК, из этих сигнальных путей необходимо выбрать наиболее значимые пути сигнальной трансдукции для функционирования мутировавшей клетки. Выявив основные функционально значимые сохранившиеся ВКСП в РСК, мы получаем основные белки-мишени для таргетного регуляторного воздействия на РСК. Такими мишенями в первую очередь будут расположенные на мембране этих клеток белки или белковые комплексы (рецепторы, иммуноглобулины), являющиеся акцепторами (принимающими устройствами) диагностированного сигнального пути. Выявив основные мишени ВКСП на мембране РСК, можно осуществить системное регуляторное воздействие на РСК определенными белками-лигандами (белками-партнерами). Понятие «лиганд» (от лат.ligare - связывать) применяется в биохимии для обозначения агентов (атомов, ионов, молекул, белков), соединяющихся с биологическими акцепторами (рецепторами, иммуноглобулинами), а также в химии комплексных соединений для обозначения присоединенных к одному или нескольким центральным (комплексообразующим) атомам металла частицам. Взаимодействие белка-лиганда (белка-партнера) с белком-акцептором способно активировать все компоненты ВКСП, изменить эффекторные функции РСК или просто декомпенсировать ее генетическую устойчивость путем формирования динамических сдвигов нормализованной сигнальной интенсивности (НСИ) экспрессии генов транскриптомного профиля РСК, что приведет к нарушению репродуктивных и репаративных функций РСК. Поиск белка-лиганда, способного воздействовать на эти мишени-акцепторы сигнального пути и активировать выбранные сигнальные пути, является достаточно несложной информационной задачей. Используя современные базы данных белок-белковых взаимодействий, возможно выявить целый набор белков-лигандов, способных активно взаимодействовать с белками-мишенями на мембранной поверхности РСК.
Далее необходимо обеспечить секретирование или экскретирование белка-лиганда в СК пациента для оказания регуляторного противоопухолевого воздействия на его РСК. Для этого необходимо ремоделировать (модифицировать) протеомный профиль АСК и/или АПК и/или HLA-CK, чтобы направить эти клетки по пути пролиферации и дифференцировки с изменением их фенотипа, который будет способен обеспечить выработку требуемого секретома клетки, а именно необходимого белка-лиганда. Поиск химических ремоделирующих агентов, называемых в данном описании пертурбогенами, которые способны ремоделировать протеомный профиль АСК и/или АПК и/или HLA-CK, изменить в нужном направлении экспрессию генов транскриптомного профиля постнатальных СК и ПК пациента и обеспечить продукцию этими клетками белка-лиганда, можно осуществить с использованием стандартных баз транскриптомных профилей, предоставляемых биотехнологической компанией Affimetrix (UK). В результате проведенного информационного поиска по этим базам данных можно определить индивидуальный пертурбоген (или несколько пертурбогенов), способный изменить транскриптомный профиль СК и ПК пациента в профиль требуемой конфигурации с необходимыми уровнями НСИ. Дальнейшая обработка и определенная экспозиция пертурбогена с АСК и/или АПК и/или HLA-CK при их стандартном культивировании приведет к требуемой модификации (ремоделированию) протемного профиля этих клеток, а также соответствующую модификацию их траснкриптомного профиля и обеспечит выработку этими клетками необходимого регуляторного белка-лиганда, способного воздействовать на акцепторные белки-мишени ВКСП в РСК.
Практическая реализация поиска пертурбогена путем выполнения вышеописанного диагностического алгоритма стала возможной сегодня благодаря работе специалистов Национального института здоровья в США (National Institute of Health, USA), которые предложили в 2005 г. всем специалистам-культуральщикам США и Европы вносить в единую базу данных транскриптомов полученную в результате исследований информацию, касающуюся изменений и модификаций транскриптомных профилей клеточных культур после обработки их различными низкомолекулярными химическими соединениями, белками и различными агентами. Поэтому сегодня поиск белка-лиганда для активации белка-мишени (акцептора сигнального пути) на мембране РСК и получение данных о химических соединениях (пертурбогенах), способных изменить и количественно модифицировать имеющийся транскриптомный профиль АСК и/или АПК и/или HLA-CK (без морфо-структурного изменения генома) в необходимый транскриптомный профиль, обеспечивающий выработку требуемого белка-лиганда, становится рутинной задачей для специалистов по биоинформационнным технологиям и инженеров-программистов.
Обобщая вышеизложенное, следует отметить, что основной задачей в процессе получения ПИПОТКП по настоящему изобретению является поиск нетрансформированных неопластическим процессом путей сигнальной трансдукции в РСК, выделенной из опухоли пациента. Этот поиск должен быть основан на сравнительном анализе протемных профилей постнатальных АСК и/или АПК с протемным профилем РСК. Обработка информационного массива всех картированных белков АСК и/или АПК и РСК должна быть направлена на выделение набора идентичных белков, присутствующих во всех этих типах клеток, т.е. белков, каждый из которых содержится в полученных протеомных профилях как АСК и/или АПК, так и РСК. Перечень таких белков с указанием их сигнальной интенсивности, в частности НСИ, в данном описании называется "матрицей подобия белков" (МПБ). Затем с использованием приемов математического моделирования необходимо выявить основные сигнальные пути, не подвергшиеся неопластической трансформации в результате канцерогенеза в РСК, а также основные белки-мишени (белки-акцепторы) этих путей.
Основным лечебным фактором ПИПОТКП по настоящему изобретению является секретом клеток, входящих в состав клеточных систем ПИПОТКП, при этом противоопухолевый регуляторный механизм действия ПИПОТКП основан на таргетном белок-белковом взаимодействии белков-интерологов (пары белков, эволюционно сохранивших способность взаимодействовать друг с другом), секретируемых АСК и/или АПК и/или HLA-CK с ремоделированным протеомным профилем, т.е. белков-лигандов с белками-мишенями клеточной поверхности РСК, являющимися акцепторами сигнальных путей РСК, неизмененных в результате неопластической трансформации и мутаций генов этой клетки. Это таргетное регуляторное воздействие на РСК с помощью белков-лигандов, продуцируемых клетками ПИПОТКП, в результате обеспечивает активацию требуемых ВКСП в РСК и направленное систематическое регуляторное воздействие на гены-мишени РСК, что приводит к повышенной экспрессия белков этих генов, декомпенсации устойчивости генома РСК и, как следствие, к временному или полному прекращению пролиферативных и репродуктивных процессов в РСК. В результате данного таргетного механизма действия ПИПОТКП оказывает регуляторное и управляющее действие на РСК и следовательно является высокоспецифичным, индивидуальным, эффективным, обратимым ингибитором пролиферации РСК и селективным блокатором опухолевого роста и репродукции злокачественного неопластического образования у конкретного пациента. Как следствие, это приводит к увеличению общей выживаемости и улучшению качества и продолжительности жизни конкретного онкологического пациента.
Способ получения ПИПОТКП по настоящему изобретению осуществляют следующим образом. Используемая далее нумерация стадий способа соответствует фиг.2.
Забор и выделение АСК и/или АПК и/или HLA-CK (стадии 1, 2)
Для целей проведения протеомного и транскриптомного анализов при осуществлении способа получения ПИПОТКП по настоящему изобретению следует использовать СК только самого пациента, т.е. аутологичные СК (АСК и/или АПК), а для ремоделирования протеомного профиля, помимо АСК и/или АПК, можно использовать также и HLA-CK.
При наличии возможности забора и выделения достаточного количества аутологичных клеток (АСК и/или АПК), одну часть культуры этих клеток используют для последующего протеомного и транскриптомного анализов (стадии 4 и 5), а другую часть подвергают ремоделированию протеомного профиля для получения ПИПОТКП по настоящему изобретению (стадия 11). Если невозможно выделить АСК и/или АПК (без примеси ОК) в количестве, достаточном для получения из них ПИПОТКП путем ремоделирования протеомного профиля, то ПИПОТКП можно получать из HLA-CK или из смеси HLA-CK с АСК и/или АПК. При необходимости увеличения клеточной массы для целей последующего протеомного и транскриптомного анализа АСК и/или АПК или ремоделирования протеомного профиля путем экспозиции АСК и/или АПК и/или HLA-CK с пертурбогеном осуществляют культивирование соответствующих клеточных культур.
Как ранее отмечено, в качестве АСК, АПК и HLA-CK используют ГСК, НСК, МСК.
Процесс приготовления первичного базового состава клеточного препарата мобилизованных ГСК подробно описан в [9]. Процесс получения препарата ГСК и клеток предшественников гемопоэза описан также в [6], с.541-553.
Сбор, стандартизация и сертификация препарата ГСК пациента завершается последующим культивированием, выделением и иммуносепарацией клеток с маркером клеточной поверхности CD34+CD45+.
Методики получения препаратов НСК описаны во многих источниках информации, см., например, [10], [11].
МСК получают из костного мозга или жировой ткани пациента или донора с использованием традиционных протоколов получения МСК, описанных во многих источниках информации, см. например [12], [13].
Забор и выделение РСК (стадия 3)
Для выделения РСК из опухоли пациента следует получить образец опухоли (не менее 0,5 г - примерно 3-4 кусочка ткани размером 5×5×5 мм) путем радикального или паллиативного хирургического удаления опухоли или ее биопсии. Кусочки большего размера аккуратно разрезают ножницами, поскольку образец больше чем 5×5×5 мм не пропитается культуральной средой и произойдет гибель клеток. Кусочки ткани не должны подсыхать во избежание гибели клеток. С соблюдением максимальной стерильности кусочки помещают в одноразовую стерильную пробирку 15 мл со средой для культивирования клеток DMEMF 12 и сразу же охлаждают до +4°С. Обязательно проводят патоморфологическое исследование образца опухоли для определения ее гистологического типа. Лучше всего забирать кусочки для выделения РСК рядом с местом опухоли, откуда взят образец для патоморфологии. Охлажденную пробирку как можно быстрее доставляют в культуральную лабораторию. Одну часть полученной ткани опухоли отправляют на гистологическое и цитологическое исследование, а другую часть ресуспендируют с использованием трипсина и культивируют в соответствии с традиционными протоколами для получения стволоподобных клеток со специфичными маркерами. Осуществляют стандартизацию и сертификацию этих клеток. После этого осуществляют иммуномагнитосепарацию РСК из культуры клеток с использованием магнитных шариков с антителами к белкам клеточной поверхности, специфичным для определенного типа опухолей.
Методика получения препарата РСК из глиобластомы описана в [6], с.553-555.
Получение лизатов АСК и/или АПК (ГСК, НСК, МСК) и РСК
Для последующего проведения протеомного анализа лизатов АСК и/или АПК и РСК эти лизаты можно получить по методике фирмы «RnD systems» (США) в соответствии с инструкцией «Получение образцов клеточных лизатов из человеческих плюропотентных и мультипотентных стволовых клеток (RnD systems)», для чего используют следующие реактивы и приборы: лизирующий буфер RnD systems (Lysis Buffer 16 #895935, 2-8°C, 1 виала, 21 мл), aprotinin (Sigma, Catalog # A6279), leupeptin (Sigma, Catalog # L8511), pepstatin (Sigma, Catalog # P4265), пипетки и наконечники к ним, роторный шейкер, микроцентрифуга, перчатки. Для приготовления Lysis Buffer 16 к необходимому объему буфера добавляли протеазные ингибиторы (10 мкг/мл Aprotinin, 10 мкг/мл Leupeptin и 10 мкг/мл Pepstatin). Раствор готовили непосредственно перед проведением лизирования клеток. Промывали клетки от среды, осадок ресуспендировали в 2 мл фосфатного буфера (PBS), центрифугировали при 1,5-3×1000 rpm. Повторили 2 раза. Удаляли надосадочную жидкость, добавляли к клеткам (1×107 клеток/мл) Lysis Buffer 16 с протеазными ингибиторами. Перемешивали пепитированием. Лизаты инкубировали с покачиванием в шейкере при 2-8°С в течение 30 минут. Центрифугировали при скорости 14,000 g в течение 5 минут. Разбавляли. Измеряли концентрацию белка в лизатах клеток (метод определения белка по Бредфорду). Клеточные лизаты использовали немедленно или их аликвотировали и хранили при минус 70°С.
Протеомный анализ лизатов АСК и/или АПК (ГСК, НСК, МСК) и РСК (стадия 4)
Лизаты очищали от низкомолекулярных соединений. Образец вносили в концентратор и центрифугировали при 2000 g до того момента, как в резервуаре останется 200 мкл жидкости. Добавляли в концентратор 4 мл воды (MiliQ) и снова центрифугировали. Такую промывку производили трижды. Полученные 200 мкл образца отбирали. Дополнительно образец смывался с концентратора дважды по 200 мкл воды (MiliQ). Полученные в итоге 600 мкл образца использовали для дальнейшего исследования. Протоколы проведения протеомного анализа клеточных препаратов описаны в [6], с.557-571.
Информацию об общей сигнальной интенсивности и нормализованной сигнальной интенсивности (НСИ) выявленных белков по результатам протеомного картирования АСК, АПК и РСК переводили в цифровой формат и передавали в лабораторию информационной обработки.
Транскриптомный анализ АСК и/или АПК (ГСК, НСК, МСК) и РСК (стадия 5)
Этот анализ проводят на основе описанных в литературе протоколов с использованием известного оборудования, см., например, протокол проведения транскриптомного анализа в [6], с.571-575.
Определение набора белков, содержащихся в протеомных профилях как АСК и/или АПК, так и РСК (стадия 6)
При проведении сравнительного биоинформационного анализа протеомных картограмм и профилей диагностированных белков в РСК и постнатальных АСК и/или АПК из общего количества белков выбирают те белки, которые содержатся как в протеомном профиле АСК и/или АПК, так и в протеомном профиле РСК. Эти белки составляют набор белков, которые анализируют на следующих стадиях способа получения ПИПОТКП по настоящему изобретению.
Перечень белков этого набора с указанием НСИ белков АСК и/или АПК и РСК, отношения НСИ белков АСК и/или АПК к НСИ белков РСК, а также идентификаторов (ID) белков называется в данном описании матрицей подобия белков (МПБ). Примерный вид такой МПБ приведен далее в Примере 1.
Идентификация в РСК внутриклеточных сигнальных путей, не подвергшихся неопластической трансформации в результате канцерогенеза (стадия 7)
Авторы настоящего изобретения полагают, что только глобально значимые отличия НСИ белков анализируемых клеточных систем отражают базовые регуляторные тенденции. Поэтому в процессе биоинформационного анализа белков МПБ с целью идентификации ВКСП, не пострадавших в результате канцерогенеза, из дальнейшего рассмотрения исключают все белки, полная сигнальная интенсивность которых в АСК и/или АПК отличается от полной сигнальной интенсивности в РСК менее чем в два раза. Используя известные базы данных, определяют и также исключают из дальнейшего анализа белки, участвующие в канцерогенезе, функционально малозначимые белки (митохондриальные белки и белки, ассоциированные с метаболомом АСК и/или АПК и РСК) и белки клеточного каркаса.
Также с использованием известных баз данных проводят аннотирование ВКСП, в которых участвуют окончательно отобранные для дальнейшего анализа белки, и идентифицируют ВКСП, не подвергшиеся трансформации в результате канцерогенеза. Более подробно процесс идентификации ВКСП описан далее в Примере 1.
Определение белков-мишеней (стадия 8)
По идентифицированным ВКСП определяют мембранные белки-мишени (белки-акцепторы), способные к активации этих ненарушенных канцерогенезом ВКСП. Определение белков-лигандов (стадия 9)
Белки-лиганды (белки-партнеры), способные активировать белки-мишени, определенные на стадии 8, и тем самым оказать регуляторное воздействие на идентифицированный ВКСП РСК, определяют с помощью известных баз данных белок-белковых взаимодействий. Такие современные базы данных содержат информацию о сотнях тысяч взаимодействий, образованных несколькими тысячами белков у десятков биологических видов. Так, например, база данных BioGRID (Biological General Repository for Interaction Datasets) в настоящее время содержит информацию примерно о 198 тысячах взаимодействий для шести биологических видов. Такие базы данных содержат информацию о взаимодействующих парах белков, полученную либо с помощью экспериментальных методов, либо на основании гомологии между аминокислотными последовательностями, либо предсказанную с использованием компьютерных методов. Целью таких баз данных как DIP (Database of Interacting Proteins), BIND (Biomolecular Interaction Network Database) и INTERACT является интегрирование огромного количества экспериментальных данных, обеспечение легкого доступа к ним и возможности их визуализации. Эти базы данных снабжены также инструментами для оценки достоверности экспериментально полученных результатов. Они широко используются для конструирования и анализа белковых сетей, составляющих основу функционирования живой клетки.
В настоящее время такие базы данных не только содержат информацию о взаимодействующих белках-партнерах, но также позволяют производить детальный структурный анализ участков, ответственных за взаимодействие. Например, база данных SCOWLP (Structural Characterization Of Water, Ligands and Proteins) содержит информацию об аминокислотных остатках и группах атомов, участвующих во взаимодействиях. Благодаря этому она обеспечивает осуществление детального анализа взаимодействий между белками, доменами и пептидными мотивами разных белков, а также их взаимодействий с растворителем. Другим примером является глобальная интерактомная карта PSIMAP (Protein Structural Interactome Map), построенная с использованием данных о домен-доменных взаимодействиях с участием всех белков, для которых экспериментально установлена пространственная (3D) структура, представленная в базе данных PDB (Protein Data Bank). С помощью алгоритма PSIMAP можно рассчитать эвклидовы расстояния между аминокислотными остатками двух взаимодействующих доменов в составе разных белков. Два домена считаются взаимодействующими, если, по крайней мере, пять аминокислотных остатков находятся на расстоянии менее 5А (правило 5-5). Данный алгоритм позволяет осуществлять предсказание взаимодействующих партнеров на основании гомологии первичных аминокислотных последовательностей белков и их структурных доменов. Информация о взаимодействующих партнерах содержится в базе данных PSIbase.
Таким образом, используя современные базы данных белок-белковых взаимодействий, достаточно несложно определить белок-лиганд, способный взаимодействовать с акцептором идентифицированного ВКСП, т.е. с белком-мишенью, и активировать этот ВКСП в РСК.
Определение пертурбогенов (стадия 10)
На основе сравнительного анализа полученных на стадии 5 транскриптомных профилей АСК и/или АПК, выделенных для анализа, с транскриптомными профилями, содержащимися в известных базах данных транскриптомов, с использованием широкого известного метода распознавания образов определяют один или нескольких пертурбогенов, способных ремоделировать профиль экспрессии генов СК, выделенных для дальнейшего ремоделирования их протеомного профиля, в направлении секреции белков-лигандов, определенных на стадии 9. Более подробно определение пертурбогенов описано в Примерах 2 и 3.
Ремоделирование протеомного профиля АСК и/или АПК (ГСК, НСК, МСК) (стадия 11)
Определенные на стадии 10 пертурбогены добавляют в культуру ремоделируемых клеток и выдерживают пертурбогены в культуре в течение некоторого времени. Время экспозиции (выдержки) и концентрацию раствора пертурбогена определяют на основании рекомендаций по результатам проведенного сравнительного биоинформационного микроматричного анализа транскриптомных профилей АСК и/или АПК. Затем клетки отмывают от пертурбогенов центрифугированием в физиологическом растворе с получением ПИПОТКП по настоящему изобретению. Полученную массу ПИПОТКП разделяют на аликвоты в количестве 5×106 в пластиковой пробирке и стандартно криоконсервируют с 10% раствором ДМСО в жидком азоте при температуре минус 196°С градусов для дальнейшего клинического использования. Перед применением пациенту ПИПОТКП размораживают на водяной бане и 2-кратным центрифугированием отмывают от ДМСО с помощью 0,9% физиологического раствора NaCl.
Применение полученной по настоящему изобретению ПИПОТКП проводят больному после полного курса комплексного традиционного противоопухолевого (циторедуктивного, цитостатического и цитоксического) лечения и иммунотерапии или при подозрении на рецидив или метастазирование злокачественной опухоли. Применение ПИПОТКП осуществляют парентерально путем ее трансфузии (инфузии или трансплантации) в соответствующие биологические жидкости (кровь, лимфу, ликвор) онкологического пациента, омывающие или соприкасающиеся с опухолью или непосредственно в ткань опухоли путем хирургической операции или манипуляции, т.е. путем внутривенного, внутриартериального, внутрилимфатического, интратекального или интратуморального введения. Показано, что ПИПОТКП мигрирует в опухоль, накапливается и распределяется в ней, адгезирует на поверхности РСК и ОК по механизму «рядом стоящего» (by stander effect), оказывая целенаправленное регуляторное антипролиферативное и антирепродуктивное воздействие на РСК и ОК.
Эффективность проведенного ремоделирования протеомного профиля АСК и/или АПК и/или HLA-CK с заданной модификацией их траснкриптомного профиля для получением ПИПОТКП по настоящему изобретению оценивалась полнотраснкриптомным микроматричным анализом и ПЦР-РВ по наличию наступивших в этих клетках изменений (требуемой модификации) профиля генной экспрессии (транскриптомного профиля), но не приводящих к модификации или трансформации их генома. Биологическая эффективность воздействия ПИПОТКП на ОК и РСК оценивалась in vitro при совместном культивировании ПИПОТКП с культурой опухоли данного пациента на биочипах для кокультивирования различных клеточных культур отечественной биотехнологической платформой Гомункулус (Россия), созданной в рамках Федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технического комплекса России на 2007-2013 г.» Министерства образования и науки РФ. Регуляция ПИПОТКП на ОК и РСК оценивалась по следующим критериям: а) ингибирование пролиферативных эффекторных функций (подавление инвазии, ангиогенеза, митоза и т.д.) в ОК, б) снижение общего количества ОК в культуре (уменьшение ОК за счет апоптоза или их дифференцировки), в) уменьшение количества клеток с маркерами клеточной поверхности, соответствующими РСК и ОК.
Клиническое применение ПИПОТКП для лечения опухолей различного происхождения позволило регулировать численность ОК и РСК в опухоли и ее объем, добиться увеличения общей выживаемости и улучшения качества жизни пациентов с рецидивными и рефрактерными к стандартной терапии злокачественными опухолями, перевести злокачественное онкологическое заболевание из фатального и скоротечного в хроническое, доброкачественное.
Настоящее изобретение поясняется далее на конкретных примерах.
Пример 1.
Этот пример иллюстрирует типичный вариант идентификации (диагностирования, поиска) ВКСП, не пострадавших в результате канцерогенеза в РСК, выделенных из культуры глиобластомы человека линии U87. В качестве АСК использовали НСК (маркер CD133+) и МСК (маркеры CD44+, CD90+, CD73+, CD34-) больного К. Эти АСК были взяты из базы данных Банка костного мозга ФГБУ РОНЦ РАМН им Н.Н. Блохина.
Для протеомного анализа были получены три замороженных маркированных образца клеток в пластиковых пробирках. Образец 1 - НСК из обонятельного эпителия человека, диссоциированные из нейросфер, селекция на бессывороточной среде. Образец 2 - РСК линии глиобластомы человека U87. Образец 3 - МСК.
Для профилирования протеомов НСК, МСК, а также РСК клеток линии глиобластомы человека U87 использовали комбинацию высокоэффективной жидкостной хроматографии и масс-спектрометрии (ВЭЖХ-МС). Использование двухмерной хроматографии позволяет идентифицировать порядка 1000 белков в образце, поэтому была выбрана методика двухмерного разделения триптических пептидов на катионообменной, а затем обращенно-фазовой колонке. Для оценки изменения экспрессии уровней белков использовали метод label-free, так как он не требует проведения дополнительных стадий мечения пептидов и дает корректные количественные результаты для СК.
После разморозки клетки всех Образцов 1-3 подвергли лизированию при помощи Mammalian Cell Lysis Kit (Sigma, США) по методике производителя. Все процедуры выполнялись при 4°С. К клеткам добавляли 1 мл лизирующего буфера. Инкубировали в течение 15 минут в охлаждаемом шейкере Eppendorf Thermomixer Comfort (Eppendorf, Германия). Центрифугировали в течение 1 часа в охлаждаемой центрифуге Eppendorf Centrifuge 5415F (Eppendorf). Супернатант отбирали для дальнейшего исследования.
Полученные в результате лизиса образцы очищали от низкомолекулярных соединений при помощи спин-концентраторов Agilent Spin Concentrators for Proteins 5 kDa (Agilent, США). Образец вносили в концентратор и центрифугировали при 2000 g до того момента, как в резервуаре останется 200 мкл жидкости. Добавляли в концентратор 4 мл воды (MilliQ) и снова центрифугировали. Такую промывку производили трижды. Полученные 200 мкл образца отбирали. Дополнительно образец смывался с концентратора дважды по 200 мкл воды (MilliQ). Полученные в итоге 600 мкл образца использовали для дальнейшего исследования и измеряли в них общий белок на спектрофотометре NanoDrop ND-1000 (Thermo, США) по методу Бредфорд. Рассчитывали количество лизата, в котором содержится 300 мкг белка, и упаривали досуха при 60°С в вакуумном испарителе CentriVap (Labconco, США).
К высушенным лизатам добавляли по 25 мкл 2,2,2-трифторэтанола (Sigma), по 25 мкл 100 мМ водного раствора NH4HCO3 (Fluka, Германия) и по 2 мкл свежеприготовленного 50 мМ водного раствора трис-(2-карбоксиэтил)фосфина (ТСЕР) (Fluka). Реакционную смесь выдерживали 1 час при 60°С, затем охлаждали до 25°С, добавляли по 1 мкл свежеприготовленного 84 мМ водного раствора иодацетамида (Sigma) и выдерживали 30 минут при 25°С, после чего добавляли по 100 мкл 100 мМ раствора NH4HCO3, по 300 мкл воды и раствор трипсина (proteomics grade, Sigma) в 1 мМ соляной кислоте (концентрация трипсина 100 нг/мкл, соотношение трипсин:белок 1:50 по весу) и выдерживали 18 часов при 37°С. По 3 мкл растворов анализировали масс-спектрометрически для контроля проведения трипсинолиза. По окончании реакции содержимое пробирок упаривали досуха при 60°С в вакуумном испарителе CentriVap.
Триптические пептиды растворяли в 60 мкл фазы А (30% ацетонитрила (Lab-Scan, Польша), 70% воды, 0,1% муравьиной кислоты (Merck, Германия), рН 2,7) и разделяли на хроматографе Dionex Ultimate 3000 (Dionex, Нидерланды), снабженном коллектором фракций, на катионообменной колонке MIC-10-CP (материал Poros 10S, 1 мм × 10 см, Dionex). Объем инжектируемой пробы 20 мкл, поток растворителя 30 мкл/мин, температура колонки 25°С, детекция по УФ-поглощению при длине волны 214 нм. Растворители: мобильная фаза А - 30% ацетонитрила (ACN), 70% воды, 0,1% муравьиной кислоты (FA), мобильная фаза В - мобильная фаза А+500 мМ КС1 (Химмед, Россия). Градиент: 0-10 мин - 0% В, 10-100 мин - 0-30% В, 100-114 мин - 30-100% В, 114-119 мин - 100% В, затем уравновешивание колонки в течение 35 минут на фазе А. Собирали 20 фракций со 2 по 122 минуту через равные промежутки времени в 6 минут. Полученные фракции упаривали до 100 мкл при 60°С на центрифужном испарителе Eppendorf Concentrator 5301 (Eppendorf).
Анализ триптических пептидов проводили на нанопроточном хроматографе Dionex Ultimate 3000 (Dionex) в сочетании с масс-спектрометром LTQ Orbitrap XL (Thermo) с источником ионизации NSI. Разделение пептидов осуществляли на колонке Acclaim С18 РерМар100 (75 мкм × 150 мм, размер зерна 3 мкм, Dionex), снабженной предколонкой. Образец (20 мкл) загружали на предколонку 1 мин в 99% воды/1% ACN/ 0,1% FA, затем отмывали от соли 4 минуты 0,05% раствором трифторуксусной кислоты в воде, и еще 1 минуту уравновешивали 99% воды/1% ACN/0,1% FA, поток 20 мкл/мин. Условия хроматографирования: поток 0,3 мкл/мин, мобильная фаза А - 98% воды/2% ACN/0,1% FA, мобильная фаза В - 20% воды/80% ACN/0,08% FA. Градиент: 0-6 мин -0% В, 6-120 мин - 0-50% В, 120-150 мин - 50-100% В, 150-165 мин - 100% В, 165-170 мин - 100-0% В, полное время анализа 175 мин. Масс-спектры регистрировали в режиме положительных ионов в диапазоне m/z 300-2000 Да, напряжение на игле 1,7 кВ, температура источника 200°С, напряжение на капилляре 43 В, на линзе 165 В. МС спектры регистрировали в орбитальной ловушке в режиме FT (разрешение 60000, число накапливаемых ионов 1·106, максимальное время накопления 700 мс, 1 микроскан), МС/МС спектры получали при ионизации, обусловленной соударениями (CID) в линейной ловушке (режим сканирования Enhanced, число накапливаемых ионов 50000, максимальное время накопления 500 мс, 3 микроскана, энергия соударений 35% от максимальной). МС/МС спектры регистрировались для 7 самых интенсивных ионов. Динамическое исключение включалось после регистрации 1 спектра, время исключения 1 мин. Вторичной фрагментации подвергали ионы с зарядом больше +1.
Для идентификации белков масс-спектры конвертировали программой Proteome Discoverer 1.0 (Thermo) в mgf-файлы с помощью программного шаблона WF_Spectrum_Export_MGF с настройками по умолчанию за исключением диапазона масс (от 300 до 10000 Да) и времен удерживания (0-180 минут). Поиск белков проводили на локальном сервере с помощью программы Mascot Server 2.3.02 (Matrix Science, Великобритания). Параметры поиска: база данных NCBInr (версия от 25 января 2012 г.), вид - Homo Sapience, энзим - трипсин, число пропущенных разрывов 2, фиксированные модификации - карбамидометилирование цистеинов, возможные модификации - ацетилирование N-конца белка и окисленный метионин, остальные модификации проверялись с помощью метода error tolerant search. Точность масс родительского иона 10 ррт, фрагментов 0,8 Да, прибор Ion Trap.Идентифицированные белки сортировали по MudPIT score (score=-log(P), где P - вероятность ложноположительной идентификации, т.е. чем выше скор, тем достовернее идентифицирован пептид), отображали пептиды на уровне значимости р<0,05. Полученные списки идентифицированных белков вместе с хромато-масс-спектрами загружали в программу Skyline 1.2.0.3303 (University of Washington, https://skvline.gs.washington.edu/labkey/proiect/home/software/Skyline), со следующими настройками: фиксированные модификации - карбамидометилирование цистеинов, возможные модификации - ацетилирование N-конца и окисленный метионин, прибор - Orbitrap, использовать три изотопных иона. Получали площади пиков пептидов в каждой пробе, из которых брали только те пики, для которых параметр IsotopeDotProduct был больше 0,99. Затем суммировали площади всех пиков идентифицированных пептидов каждого белка и нормализовывали относительно полной площади всех идентифицированных белков в пробе.
После проведения лизиса количество общего белка в лизатах составило:
Образец 1 - 2032±85 мкг/мл;
Образец 2 - 2150±360 мкг/мл;
Образец 3 - 3198±281 мкг/мл.
Для проведения трипсинолиза брали по 150 мкл лизатов из Образцов 1 и 2 и 100 мкл из Образца 3, трипсин добавляли в соотношении 1:50 по массе, т.е. Образец 1 -305 мкг белка, 61 мкл раствора трипсина; Образец 2 - 323 мкг белка, 64,5 мкл раствора трипсина; Образец 3 - 320 мкг белка, 64 мкл раствора трипсина.
Полноту проведения трипсинолиза контролировали масс-спектрометрически по наличию пиков триптических пептидов, а также по площадям пиков с m/z 842,51 Да и 421,76 Да. Триптические пептиды разделяли на катионообменной колонке SCX, для разделения использовали по 50 мкг триптических пептидов. Далее анализировали по 20 катионоообменных фракций каждого Образца.
Обработка данных ВЭЖХ-МС с помощью программы Mascot Server позволила идентифицировать во всех Образцах всего 1664 белка. В результате дальнейшей обработки данных программой Skyline были определены уровни:
в Образце 1 - 1447 белков по 11176 пептидам (диапазон молекулярных весов белков от 3,53 до 3908,10 кДа);
в Образце 2 - 1225 белков по 13674 пептидам (диапазон молекулярных весов белков от 4,60 до 3908,10 кДа);
в Образце 3 - 842 белка по 10932 пептидам (диапазон молекулярных весов белков от 5,02 до 1017,07 кДа).
Динамический диапазон для идентифицированных белков составил 7 порядков (от 4,8-10-7% до 5,3%), что позволило выявить регуляторные низкокопийные белки, такие как интерлейкины 25 и 36, рецепторы ростовых факторов и т.д. Также идентифицированы специфические маркеры МСК (CD44, интегрины α-V и β-1) и НСК (нестин).
Протеомные профили НСИ белков РСК, выделенных из глиобластомы клеточной линии U87 в сравнении с протеомным профилем МСК, представлены на сайте . В связи с большим объемом данных, представляющих эти профили НСИ, они в настоящем описании не приводятся.
Из общего числа 1664 идентифицированных белков для дальнейшего анализа был определен набор из 1052 белков, каждый из которых содержался в протеомных профилях как НСК, так и РСК (МПБ №1, Таблица 3), а также набор из 607 белков, каждый из которых содержался в протеомных профилях как МСК, так и РСК (МПБ №2, Таблица 4). Полученные результаты в МПБ №1 (63,2% идентичных белков от общего числа белков) отражают близость морфофункциональных фенотипов НСК и глиомасфер, как клеток имеющих нейральноподобную дифференцировку и локализацию в центральной нервной системе. В то же время в МПБ №2 содержится только 36,48% идентичных белков от общего числа белков. Несмотря на то, что признаки стволовости характерны для обоих типов анализируемых клеток и они не так далеко находятся друг от друга фенотипически, их уже сформированная мультипотентная дифференцировка и определила значительную разницу в протеомном профиле этих клеток. Во избежание громоздкости данного описания МПБ №№1, 2 в нижепредставленных Таблицах 3, 4 показаны частично, с указанием лишь нескольких из содержащихся в них белков.
НСИ РСК
Для дальнейшего анализа из МПБ №№1 и 2 исключили все белки, полная сигнальная интенсивность которых в НСК и МСК отличается от полной сигнальной интенсивности в РСК менее чем в два раза. В результате, в МПБ №1 осталось 637 белков, а в МПБ №2 - только 425 белков (соответственно 38,28% и 25,54% от общего числа белков).
Для дальнейшего анализа из МПБ №№1, 2 отобрали белки, каждый из которых содержится во всех трех протеомных профилях (НСК, МСК, РСК), для чего выбрали белки РСК, каждый из которых содержится в обеих МПБ. В результате этого было отобрано 503 белка, собранных в одну общую таблицу.
Далее из этой общей таблицы исключили белки, участвующие в канцерогенезе (онкоспецифичные белки). Онкоспецифичные белки определялись с использованием известных баз данных и обзора Bleeker F.E., Molenaar R.J., Leenstra S. Recent advances in the molecular understanding of glioblastoma. J Neurooncol. 2012 May; 108(1), pp 11-27. Определили три белка, участвующие в канцерогенезе глиобластомы головного мозга: CD44 molecule (Indian blood group), isocitrate dehydrogenase 1 (NADP+) soluble и vimentin. Эти три белка исключили из общей таблицы и, следовательно, из дальнейшего анализа.
Далее оставшиеся в общей таблице белки распределили по трем функционально значимым для внутриклеточной и межклеточной регуляции группам - на (А) мембранные (рецепторные) белки, (В) ядерные белки и (С) белки сигнальной трансдукции и межклеточной регуляции (секретируемые, внеклеточные белки). Аннотирование клеточной локализации белков провели с использованием баз данных PubMed (http://www.ncbi.nlm.nih.gov/pubmed/), PANTHER (http://www.pantherdb.org/). Gene Ontology (http://www.geneontology.org/) и KEGG (http://www.genome.jp/kegg/)/
(A) Мембранные белки. Выделили группу белков, преимущественно расположенных в или на мембранах НСК, МСК и РСК - 105 белков (6,31% от общего числа белков). Для этого выбирали белки, у которых в аннотации присутствовал код GO:0005886 plasma membrane.
(B) Ядерные белки. Выделили группу белков, содержащихся преимущественно в ядрах НСК, МСК и РСК -146 белков (8,77% от общего числа белков). Для этого выбирали белки, у которых в аннотации присутствовал код GO:0005634 nucleus.
(C) Белки сигнальной трансдукции и межклеточной регуляции. Выделили группу белков, секретируемых НСК и МСК - 33 белка (1,98% от общего числа белков). Для этого выбирали белки, у которых в аннотации присутствовал коды со словом extracellular: GO:0005576 extracellular region, GO:0005578 proteinaceous extracellular matrix, GO:0005615 extracellular space, GO:0031012 extracellular matrix, GO:0044420 extracellular matrix part.
Далее из каждой группы белков (А), (В), (С) и, следовательно, из дальнейшего анализа исключили функционально малозначимые белки. Так, были исключены митохондриальные белки и белки, ассоциированные с метаболомом НСК и РСК, т.е. белки, обеспечивающие быстрое воспроизводство АТФ для поддержки энергетического статуса, быстрый синтез макромолекул, белки дыхательной цепи, белки эффекта Варбурга и другие белки метаболома. Эти белки определяли с помощью поиска аннотаций белков по ключевым словам mitochondrion, mitochondrial, metabolic, metabolism, Warburg, electron transport. Были также исключены белки клеточного каркаса (белки цитоскелета, белки эндоплазматического ретикулума) с помощью поиска в базах данных аннотаций белков по ключевым словам cytoskeleton, cytoskeletal, reticulum. В результате для дальнейшего анализа в группе (А) осталось 19 белков, в группе (В) - 20 белков, а в группе (С) - 5 белков. Эти окончательно отобранные для дальнейшего анализа белки перечислены в Таблицах 5, 6, 7 соответственно.
Для белков из таблиц 5-7 провели аннотирование сигнальных путей белков с использованием известных баз данных:
Biocarta (http://www.biocarta.corn/); KEGG_PATHWAY (http://wvvrw.Renome.ip/kegg/); PANTHER_PATHWAY (http://www.pantherdb.org/); Reactome (http://www.reactome.org/).
Идентифицированные сигнальные пути представлены в Таблицах 8-9.
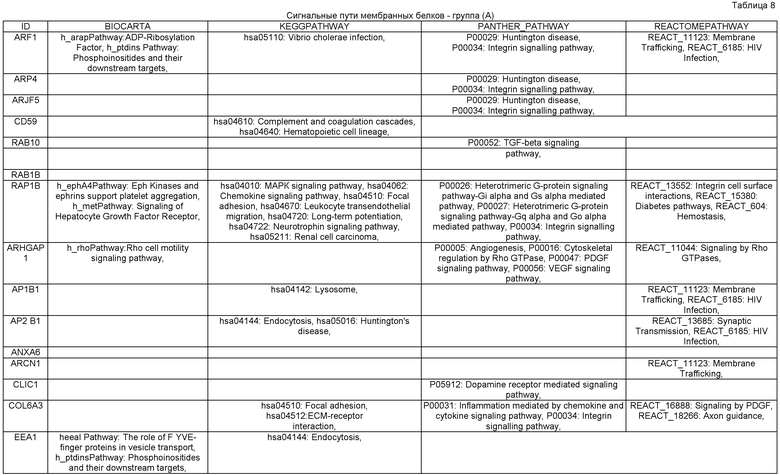


Анализ Таблиц 8-10 позволил выявить 10 сигнальных путей, в которых участвуют два и более белков, а именно: путь фосфоинозитидов и их мишеней, путь заражения холерным вибрионом, путь фокальной адгезии, лизосомальный путь, сигнальный путь интегрина, путь хореи Хантингтона, передача сигнала Ро-ГТФазами, путь ВИЧ-инфицирования, путь мембранного транспорта, путь гемостаза. Эти сигнальные пути и участвующие в них белки приведены далее в Таблице 11. Наибольший интерес для целей получения ПИПОТКП по настоящему изобретению представляют сигнальные пути, в которых участвуют белки из разных локализаций, т.е. из разных групп (А), (В), (С), например из ядра и из мембраны. Эти сигнальные пути выделены в Таблице 11 жирным шрифтом.
Лизосомальный путь и путь мембранного транспорта не передают сигнал в ядро, поэтому эти пути были исключены из дальнейшего рассмотрения. Пути инфицирования ВИЧ и холерным вибрионом характерны для клеток иммунной системы и кишечного эпителия соответственно и они не связаны со злокачественным перерождением клеток, поэтому тоже были исключены. Гемостазисный путь характерен для тромбоцитов и процесса свертывания крови, поэтому также был исключен для их дальнейшего рассмотрения. Наибольший интерес представляет путь интегрина, т.к. интегрины являются маркерами стволовых клеток, и изменение их уровней может быть связано с дедифференцировкой и изменением фенотипа. Этот путь большей частью совпадает с путем фокальной адгезии, поэтому эти два пути далее рассматривали как один сигнальный путь.
Схемы внутриклеточных сигнальных путей РСК, выделенной из линии клеточной культуры глиобластомы U87, в которых не выявлено неопластической трансформации, можно найти в известных источниках информации, используя, например, Интернет. Анализируя весь спектр идентифицированных внутриклеточных сигнальных путей в РСК U87, не пострадавших в результате канцерогенеза, можно достаточно просто определить белки-акцепторы мембран, т.е. белки-мишени для целей получения ПИПОТКП по настоящему изобретению. Далее указаны адреса в Интернете, по которым можно найти схемы перечисленных в Таблице 11 сигнальных путей:
1. hjptdinsPathway: Phosphoinositides and their downstream targets
http://www.biocarta.com/pathfiles/h_ptdinspathwav.asp
2. hsa05110:Vibrio cholerae infection
http://www.genome.ip/kegg-bin/show pathway?hsaO5110
3. hsa04510:FocaI adhesion
http://www.genome.ip/kegg/pathway/hsa/hsa04510.html
4. hsa04142:Lysosome
http://www.genome.ip/kegg-bin/show_pathwav7hsa04142
5. P00034:Integrin signalling pathway
http://www.pantherdb.org/pathway/pathwavDiagram.isp?catAccession=P00034
6. P00029:Huntington disease
http://www.pantherdb.org/pathway/pathwavDiagram.isp?catAccession=P00029
Другие нижеперечисленные внутриклеточные сигнальные пути имеют значительно меньшее функциональное значение для РСК:
7. REACT_11044:Signaling by Rho GTPases
http://www.reactome.org/entitvlevelview/PathwayBrowser.html%23DB=gk current&FOCU S SPECIES H>48887&FOCUS PATHWAY ID=194315&ID=194315
8. REACT_6185:HIV Infection
http://www.reactome.org/entitvlevelview/PathwayBrowser.html%23DB=gk current&FOCUS S PECIES ID=48887&FOCUS PATHWAY Ю=162906&Ц>162909&У1Р=5555459
9. REACT_11123:Membrane Trafficking
http://www.reactome.org/entitvlevelview/PathwayBrowser.html%23DB%5egk_current&FOCUS SPECIES ID=48887&FOCUS PATHWAY ID=199991&ID=29370&VID=4952936
10. REACT_604:Hemostasis
http://www.reactome.org/entityleve%5elview/PathwayBrowser.html#DB=gk_current&FOCUS SPECIES ID=48887&FOCUS PATHWAY ID=109582&ID=109582
Сигнальный путь интегрина/фокальной адгезии начинается с передачи сигнала в клетку ростовыми факторами (EGF, FIGF, HGF, IGF1, PDGFA, PDGFB, PGF, PDGFC, PDGFD, VEGFA, VEGFB, VEGFC) и белками внеклеточного матрикса (ламининами LAMA1, LAMA2, LAMA3, LAMA4, LAMA5, LAMC3, LAMB4, LAMB1, LAMB2, LAMB2, LAMC1, LAMC2, коллагенами COL1A1, COL1A2, COL2A1, COL3A1, COL4A1, COL4A2, COL4A4, COL4A5, COL4A6, COL5A1, COL5A1, COL5A2, COL6A1, COL6A2, COL6A3, COL11A1, COL11A2, фибронектином FN1, хондроадгерином CHAD, олигомерный матриксный протеин СОМР, тенасцины TNC, TNN, TNR, TNXB, интегрин-связывающим сиалопротеином IBSP, реелином RELN, секретируемым фосфопротеином 1 SPP1, тромбоспинодинами THBS1, THBS2, THBS3, THBS4, витронектином VTN и фактором фон Виллебранда VWF). На внешней стороне плазматической мембраны передача сигнала происходит за счет интегринов ITGA11, ITGA6, ITGA1, ITGA2, ITG2AB, ITGA3, ITGA4, ITGA5, ITGA7, ITGA9, ITGAV, ITGA10, ITGA8, ITGB1, ITGB3, ITGB4, ITGB5, ITGB6, ITGB7, ITGB8, кавеолинов CAV1, CAV2, CAV3 и тирозин-киназных рецепторов (EGFR, ERBB2, FLT1, FLT4, IGF1R, KDR, MET, PDGFRA, PDGFRB).
Таким образом, основной регуляторный путь в РСК, выделенной из линии глиобластомы U87, который может быть задействован для управлении эффекторными функциями этих клеток с целью получения ПИПОТКП по настоящему изобретению, это Р00034: Integrin signalling pathway (сигнальный путь интегрина). Акцепторным белком мембраны РСК (белком-мишенью) может выступать киназа фокальной адгезии. Киназы белка тирозин киназ фокальной адгезии (focal adhesion kinase - FAK) играют важную роль в сигнализации интегрина, FAK-активации, о чем свидетельствует увеличение фосфорилирования Tyr397. Активация FAK-акцептора приводит к вербовке ряда SH2-домен и SH3-домен-содержащих белков, которые опосредуют сигнализацию несколько ниже по течению к ядру всего сигнального пути. FAK-зависимая активация этих путей приводит к вовлечению в общую канву самых разнообразных клеточных процессов, включая миграцию клеток, сигнализацию факторов роста, прогрессию клеточного цикла и выживание клеток.
Для определения белков-лигандов (белков-партнеров), способных активировать белки-мишени, проводили аннотирование белок-белковых взаимодействий с использованием баз данных:
Biomolecular Interaction Network Database (BIND) - http://bind.ca;
Database of Interacting proteins (DIP) - http://dip.doe-mbi.ucla.edu/);
Molecular Interaction Database (MINT) - http://mint.bio.uniroma2.it/mint/);
NCICB_CAPATHWAY_interaction - (http://cgap.nci.nih.gov/Pathwavs/);
Reactome_Interaction - (http://www.reactome.org/).
Пример 2.
Этот пример иллюстрирует возможность определения пертурбогена, способного ремоделировать профиль экспрессии генов АСК и/или АПК и/или HLA-CK в направлении секреции ранее определенных белков-лигандов, которые должны продуцироваться ПИПОТКП.
Проанализировав данные вышеуказанной статьи [8] и используя представленные в ней результаты микрочипового анализа соматических клеток до и после нейральной дифференцировки, авторы настоящего изобретения задались целью: решили решить обратную задачу, зная транскриптомные профили экспресии генов нейрально подобных СК, осуществить ремоделирование их протеома и фенотипа в стромальные СК костного мозга и найти пертурбоген (химический ремоделирующий агент), с помощью которого провести требуемую модификацию траснкриптомного и протеомного профиля клеток и получить клетки с характерными для стромальных СК маркерами клеточной поверхности (CD34+, CD44+, CD45-).
Для решения этой задачи авторы настоящего изобретения использовали базы данных Affymetrix GeneChip итап Genome U133A Array, которые включают в себя информацию об изменении в экспрессии набора примерно из 22000 генов в различных культурах клеток, таких как HL-60 (human promyelocytic leukemia cells), MCF-7 (breast cancer cell line), PC3 (human prostate cancer cell line), K-MEL-5 (human skin melanoma cell line). При помощи специального математического алгоритма метода распознавания образов количественно сравнивали, насколько необходимые изменения профиля экспресии совпадают с экспериментами, имеющимися в базах данных. На основании полученной численной оценки заключали, насколько изменения в экспрессии генов, вызванные действием какого-либо низкомолекулярного вещества из базы данных, соответствуют изменениям, наблюдаемым в изучаемом профиле. Если соответствие было достаточно велико, приходили к выводу, что данное химическое соединение или сходные с ним по структуре и свойствам соединения могут вызывать подобный эффект. Либо, наоборот, если наблюдалась значимая антикорреляция, то делали вывод, что найденное соединение может вызвать прямо противоположный эффект в изменении экспрессии генов. Таким образом, определяли пертурбоген, способный ремоделировать профиль экспрессии генов АСК и/или АПК и/или HLA-CK в направлении секреции ранее определенных белков-лигандов.
Был найден подобный профиль изменения экспрессии набора генов у клеток РСЗ, обработанных химическим препаратом вориностат, см. график на фиг.3. На этом графике по вертикальной оси отложено значение фактора обогащения при сравнении изучаемого профиля с взятым из базы данных. Значение больше 0,6 позволяет судить о значимом совпадении профилей. При этом коэффициент обогащения рассчитывается независимо для положительных и отрицательных изменений. По горизонтальной оси отложены гены из набора Affymetrix GeneChip Human Genome U133A Array, ранжированные в соответствии с изменением экспрессии от наиболее положительного к наиболее отрицательному. Каждый пик на графике соответствует положению гена из изучаемого профиля в профиле vorinostat. Видно, что положительно и отрицательно регулируемые гены четко разграничиваются. Известно, что вориностат ингибирует гистондеацетилазу и обладает широким спектром эпигенетической активности. Механизм действия соединения, определенного с помощью вышеупомянутого математического алгоритма, позволяет говорить о том, что большинство изменений экспрессии генов имеют эпигенетическую природу.
Таким образом, с использованием подходов математической «теории распознавания образов» и известных баз данных транскриптомов, было найдено, что путем применения препарата воринстат в качестве пертурбогена можно вернуть НСК снова в фенотип стромальных клеток костного мозга.
В культуральной лаборатории авторы настоящего изобретения повторили эксперимент, описанный в статье [8], со стромальными клетками, получили нейральные стволовоподобные клетки, секретирующие нейральные маркеры, обработали эти клетки 5% расствором вориностата и культивировали эти клетки с ним в течение трех суток, затем отмыли их двухкратно физиологическим раствором, проверили их на содержание маркеров мембранной поверхности стромальных СК по протоколу, описанному в [8], и с использованием стандартных иммунохимических тестов полностью подтвердили их соответствие маркерам клеточной поверхности, представленными японскими исследователями как маркеры, характеризующие их стромальный стволовый характер (CD34+, CD 45-, CD44+, CD90+,CD29+, CD34-).
В данном примере проиллюстрирована возможность протеомного ремоделирования клеток за счет модификации транскриптомного профиля экспрессии генов соматических СК в заданном направлении методами химической индукции. Эта технология применена в способе по настоящему изобретению для получения ПИПОТКП, продуцирующей необходимый регуляторный белок-лиганд.
Анализ полнотранскриптомного профиля экспресии генов АСК и/или АПК (НСК, ГСК, МСК) пациента в процессе осуществления способа получения ПИПОТКП по настоящему изобретению проводили с использованием автоматизированной микрочиповой технологии на системе «GeneChip™ Scanner 3000 7G» компании Affymetrix (Великобритания). Эта система включала в себя все необходимое для проведения исследований. Для анализа данных полнотраснкриптомного профиля НСК и МСК использовали web-сервис NetAffx™.
Применение технологии персонифицированного определения пертурбогенов в «ручном» режиме на основании транскриптомов АСК и/или АПК пациента и результатов протеомного профилирования его АСК и/или ПК и РСК является достаточно трудоемкой и дорогостоящей задачей. Поэтому для выполнения значительного количества подобных задач в клинике авторы изобретения решили оптимизировать и автоматизировать этот трудоемкий процесс биоинформационного анализа. Для этого была разработана методика математического моделирования воздействий различной природы (химических соединений, генетических воздействий shRNA) на НСК, МСК и ГСК конкретного пациента и создано специализированное программное обеспечение, реализующее данный метод и позволяющее с помощью методов математического моделирования получить список веществ (пертурбогенов), заданным образом ремоделирующий протеомный профиль выбранного типа клеток. При этом для построения ранжированного списка пертурбогенов в соответствии со степенью их воздействия на клетку для изменения ее протеомного профиля был применен статистический метод Колмогорова-Смирнова, а также разработан основанный на этом методе алгоритм, позволяющий автоматизировать построение ранжированных списков пертурбогенов. Было создано специализированное программное обеспечение, реализующее данный алгоритм и генерирующее ранжированный список пертурбогенов по заданным спискам «активированных» и «подавленных» генов. Эта программа была применена для выявления пертурбогенов, оказывающих максимальное воздействие на НСК, ГСК и МСК с целью ремоделирования их протеомов для воздействия на сигнальные пути интегрина и фокальной адгезии в РСК линии глиобластомы человека U87.
Разработанное специализированное программное обеспечение позволяет с использованием персонального компьютера получить текстовый файл со списком химических соединений (пертурбогенов), необходимых для получения ПИПОТКП.
Пример 3 (описание работы программы поиска пертурбогенов).
На вход программы подавали два списка проб (соответствующих пробам чипа Affymetrix Microarray HG-133A) в формате текстовых файлов. В списках находились названия проб чипа HG-133A, соответствующие генам, активность которых должна быть либо увеличена (список UP), либо подавлена (список DOWN) для изменения протеомного профиля клетки. Названия проб чипа Affymetrix Microarray HG-133A могут быть получены с помощью сервиса NetAffx по заданному списку белков. Результатом работы программы явился текстовый файл с упорядоченным списком пертурбогенов, оказывающих воздействие на клетку с целью ремоделирования ее протеома в соответствии с заданным списками UP и DOWN. Полученные предварительные результаты были представлены в форме отчета о биоинформационном исследовании сигнальных путей белков клеточных линий НСК, МСК и РСК линии глиобластомы человека U87. Далее выявлялись наборы ядерных, мембранных и внеклеточных белков НСК, НСИ которых больше (список UP), либо меньше (список DOWN), чем в РСК. Провели четыре численных эксперимента, моделирующих изменение протеомного профиля НСК под воздействием пертурбогенов мембранных, ядерных, внеклеточных и совместно всех указанных типов исследуемых белков. В результате полученные четыре файла, содержащие списки воздействий, сортировали по степени эффективности. Каждое воздействие идентифицировалось уникальным номером, по которому можно определить тип воздействующего вещества (пертурбогена), его концентрацию и другие параметры.
Пример 4 (экспериментальное клиническое применение ПИПОТКП).
Больной Г., 16 лет, госпитализирован в клинику 05.06.2011 для контрольного обследования. Диагноз: рецидивирующая глиобластома левой теменно-затылочной области головного мозга. Жалоб не предъявляет. Из анамнеза: в мае 2004 г.в НИИ нейрохирургии им. Н.Н. Бурденко больному диагностирована глиобластома теменно-затылочной области слева, в этом же месяце осуществлена циторедуктивная нейрохирургическая операция, с последующим курсом рентгенохирургии и химиотерапии препаратом темодал по стандартной схеме. В течение 15 месяцев отмечалась ремиссия заболевания, но 13.08.2005 при контрольной МРТ головного мозга выявлен рецидив глиобластомы в ложе удаленной опухоли. Произведена повторная резекция рецидива глиальной опухоли 25.08.2005. Перед операцией пациента у его практически здоровой матери (гаплоиндентичной по HLA) 36 лет была произведена мобилизация ГСК с использованием колониестимулирующего фактора (препарата «Граноцит») в течение 4 дней и осуществлен сбор мобилизованных ГСК. Биоматериал из глиальной опухоли и костного мозга пациента был направлен в течение 3-х часов после забора в культуральную лабораторию отдела фундаментальной нейробиологии ГНЦССП им В.П. Сербского. Опухолевая ткань из глиобластомы в дальнейшем была ресуспендирована трипсином на клетки и проведена идентификация РСК с маркером CD 133+ и их иммуномагнитосепарация из культуральной взвеси ОК. Из эксфузата костного мозга пациента иммуносепарацией на магнитных шариках выделяли СК с маркером CD34+ и CD133+. Выделенные РСК из опухоли глиобластомы и ГСК из костного мозга пациента культивировались и из них готовились лизаты с использованием раствора Lysis Buffer 16 (1×107 клеток/мл) с протеазными ингибиторами. В дальнейшем, в лаборатории онкопротеомики РОНЦ РАМН им Н.Н. Блохина была проведена масс-спектроскопия лизатов здоровых ГСК и РСК, выделенных из глиобластомы. Был проведен протеомный анализ ГСК и РСК, а также полный транскриптомный анализ ГСК пациента. Данные сравнительного транскриптомного и протеомного анализа показали, что только 31% белков опухоли глиомасферы были представлены неопластически измененными белками. Данные были переданы в лабораторию молекулярного конструирования лекарственных средств ФГБУ ФКНЦ ФМБА России для проведения математического моделирования и выделения ВКСП в глиомасфере, не подвергшихся неопластической трансформации. В лаборатории после завершения математического этапа работ был определен наиболее хорошо функционирующий ВКСП, значимый для глиомасферы, - путь интегринов и путь фокальной адгезии. Кокультивирование культуры клеток опухоли глиобластомы больного с индуцированными ГСК матери пациента показало эффективность подавления опухолевого роста за неделю на ++ по сравнению с контролем (ГСК пациента). Осуществлена стандартная процедура криоконсервации клеток ГСК пациента и его матери, а также РСК опухоли пациента. Часть опухоли отправлена в НИИ ЭДИТО РОНЦ РАМН для приготовления противоопухолевой вакцины. В последующем через 6 месяцев диагностирован повторный рецидив глиобластомы в феврале 2006 г. больному проведен курс химиотерапии темодалом и иринотеканом по стандартной схеме, проведены три введения индивидуальной противоопухолевой вакцины. Состояние стабилизировалось. В августе 2006 в ложе повторных резекций глиобластомы выявлен новый рецидив опухоли. Хирургическое лечение признано нецелесообразным, исчерпаны возможности лучевой терапии (суммарная доза облучения составила более 50 грэй на зону головного мозга) и химиотерапии, больному проведены три инъекции противоопухолевой вакцины с интервалом в 1 неделю между каждой. Все виды конвенциональной терапии глиобластом были исчерпаны. С августа 2006 г. больному начали проводить экспериментальный курс лечения с применением ПИПОТКП, которую вводили интратекально 40 раз в течение 2-х лет. Опухоль значительно регрессировала (см. фиг.4). С августа 2008 года терапия остановлена. Четвертый рецидив опухоли отмечен 29.07.2010. Больному проведен курс интратекального введения ПИПОТКП в дозе 1-1,3×106 в количестве 30 инфузий в течение 23 месяцев. На ПЭТ-исследовании головного мозга выявлены накопления радиофармпрепарата в зоне опухоли. В настоящее время пациент жив и учится в школе. Опухоль не исчезла, но значительно регрессировала.
Часто используемые сокращения
АСК - аутологичные стволовые клетки.
АПК - аутологичные прогениторные клетки.
ВКСП - внутриклеточные сигнальные пути.
ГСК - гемопоэтические стволовые клетки.
ДМСО - диметилсульфоксид.
МПБ - матрица подобия белков.
МСК - мезенхимальные стволовые клетки.
НСК - нормализованная сигнальная интенсивность.
НСК - нейральные стволовые клетки.
ОК - опухолевые (раковые) клетки.
ПИПОТКП - противоопухолевый индивидуальный протеом-основанный таргетный клеточный препарат (по настоящему изобретению).
ПК - прогениторные клетки.
ПИПОТКП - протеом-модифицированная клеточная система (по настоящему изобретению).
РСК - раковые стволовые клетки.
СК - стволовые клетки.
HLA-CK - HLA-гаплоидентичные стволовые клетки.
Список литературы
1. Канцерогенез / Под ред. Д.Г.Заридзе. - М.: Медицина, 2004.
2. Morrison S.J., Spradling А.С. Stem cells and niches: mechanisms that promote stem cell maintenance throughout life // Cell, Vol.132 (4), Feb 22; 2008, pp 598-611.
3. Пальцев M.A., Иванов A.A., Северин С.Е. Межклеточные взаимодействия. - М.: Медицина, 2003.
4. Брюховецкий А.С., В.П.Чехонин, Г.Л.Менткевич, Зайцев А.Ю. Стволовые клетки в нейроонкологии: здоровые и раковые стволовые клетки, их возможная роль и место в канцерогенезе и современных высокотехнологичных сценариях лечения опухолей мозга // Материалы научно-практической конференции «Высокие технологии в терапии и реабилитации заболеваний нервной системы». - М., 2008, с.43-44.
5. Vickers М. et al. Modeling haemopoietic stem cell division by analysis of mutant red cells // British J. Haematol, Vol.110, 2000, pp 54-62.
6. Брюховецкий А.С. Клеточные технологии в нейроонкологии: циторегуляторная терапия глиальных опухолей головного мозга - М., Изд. группа РОНЦ, 2011.
7. Белушкина Н.Н. и др. Клеточная гибель и особенности ее регуляции в опухолевых клетках // Российский физиологический журнал им. И.М.Сеченова, том 95, №10, 2009, стр.1093-1107.
8. Satoshi Yamaguchi et al. The effects of neuronal induction on gene expression profile in bone marrow stromal cells (BMSC) - a preliminary study using microarray analysis. Brain Research, Volume 1087, Issue 1,4 May 2006, pp 15-27.
9. Патент RU 2283119 на изобретение «Препарат аутологичных гемопоэтических стволовых клеток, способ его получения, криоконсервации и использования для лечения травматической болезни центральной нервной системы» (опубликован 10.09.2006).
10. Викторов И.В., Савченко Е.А., Ухова О.В., Алексеева Н.Ю., Чехонин В.П. Мультипотентные стволовые и прогениторные клетки обонятельного эпителия // Клеточные технологии в биологии и медицине. - М., 2006, №4, с.185-193.
11. Roisen F.J., Klueber К.М., Lu C.L. et al. Human adult olfactory stem cells // Brain Res.-2001, Vol.890, pp 11-22.
12. Irina M. Conboy et al. (eds.). Protocols for Adult Stem Cells // Methods in Molecular Biology, vol. 621. - New York: Humana, 2010, pp 117-137.
13. Mohan C. Vemuri et al. (eds.). Mesenchymal Stem Cell Assays and Applications // Methods in Molecular Biology, vol. 698, Humana Press, 2011.
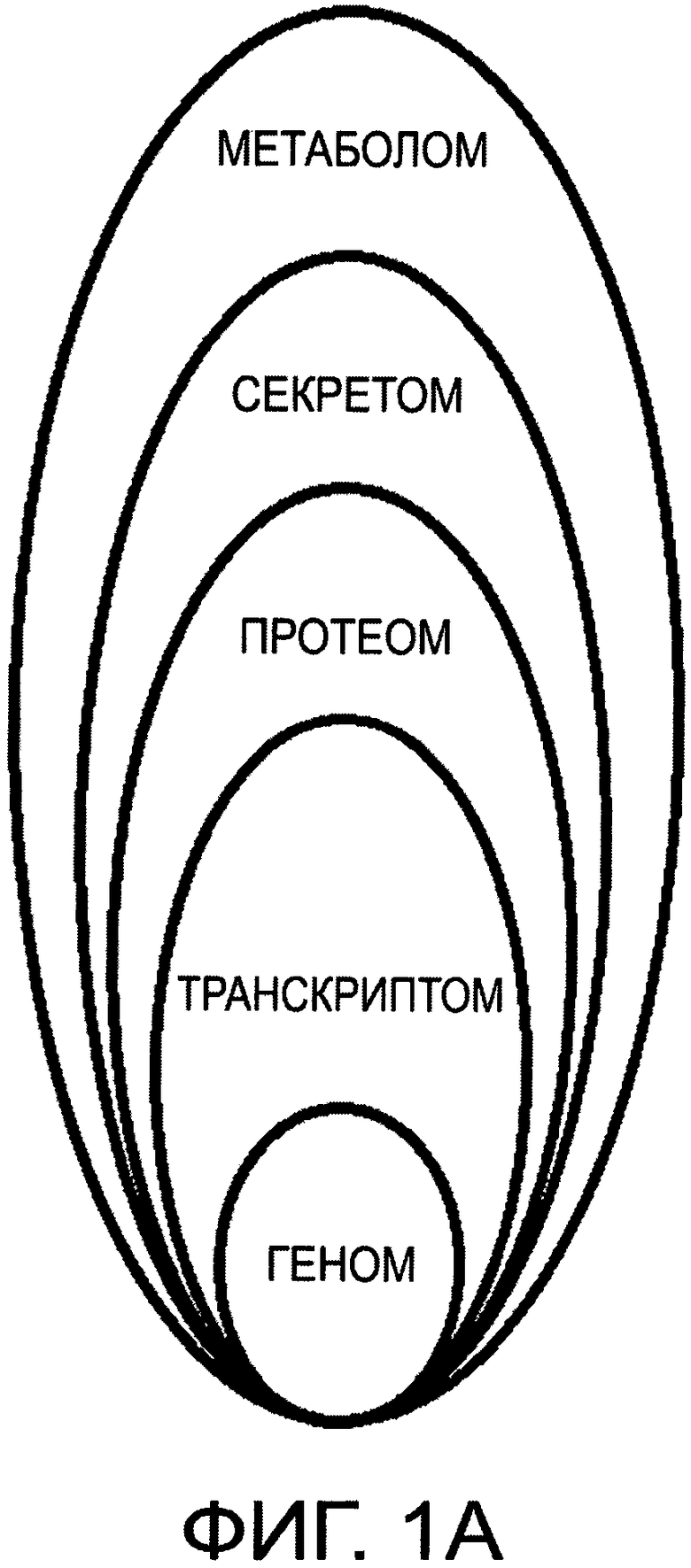
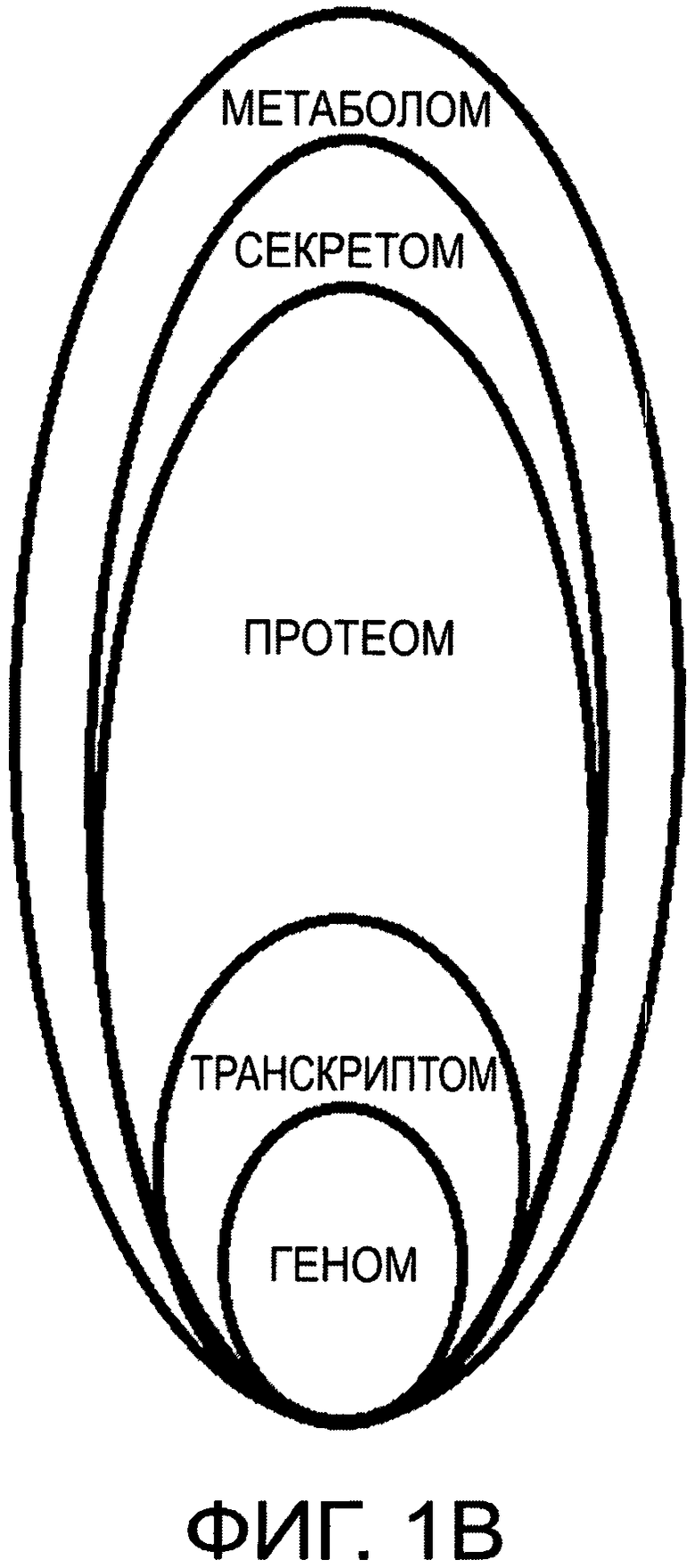
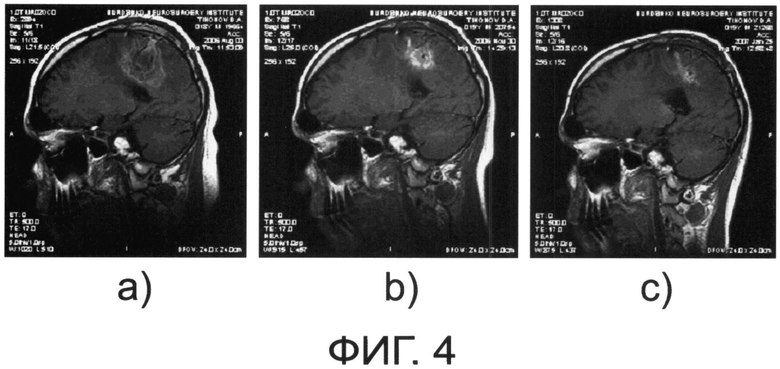
Группа изобретений относится к области биотехнологии и онкологии. Способ предусматривает: а) выделение постнатальных тканеспецифичных мультипотентных аутологичных стволовых клеток (АСК) и/или аутологичных прогениторных клеток (АПК) для их последующего протеомного и полнотранскриптомного анализов; б) выделение АСК и/или АПК и/или мультипотентных аллогенных HLA-гаплоидентичных стволовых клеток (HLA-CK) для последующего ремоделирования их протеомного профиля; в) выделение РСК из опухоли пациента; г) протеомный анализ АСК и/или АПК и РСК; д) полнотранскриптомный анализ АСК и/или АПК и РСК; е) определение набора белков, каждый из которых содержится в протеомных профилях как АСК и/или АПК, так и РСК; ж) анализ ранее определенного набора белков для идентификации в РСК внутриклеточных сигнальных путей, не подвергшихся неопластической трансформации в результате канцерогенеза, и определения белков-мишеней, являющихся мембранными акцепторами идентифицированных сигнальных путей; з) анализ полнотранскриптомного профиля экспрессии генов РСК и подтверждение сохранности и функциональной значимости структурных компонентов идентифицированных сигнальных путей в РСК; и) определение белков-лигандов, способных активировать белки-мишени; к) сравнительный анализ полнотранскриптомных профилей АСК и/или АПК с транскриптомными профилями, содержащимися в известных базах данных транскриптомов, для определения пертурбогенов, способных модифицировать профиль экспрессии генов АСК и/или АПК и/или HLA-CK, выделенных для ремоделирования их протеомного профиля, в направлении секреции ранее определенных белков-лигандов; л) ремоделирование протеомного профиля АСК и/или АПК и/или HLA-CK пертурбогенами с получением модифицированного транскриптомного профиля различных клеточных систем, способных оказывать регуляторное воздействие на РСК пациента. В препарате, полученном способом, учтены все индивидуальные особенности модификаций генома и протеома пациента, и он обладает заданным регуляторным воздействием на раковые стволовые клетки (РСК) и опухолевые клетки пациента. 3 н. и 5 з.п. ф-лы, 4 ил., 11 табл., 4 пр.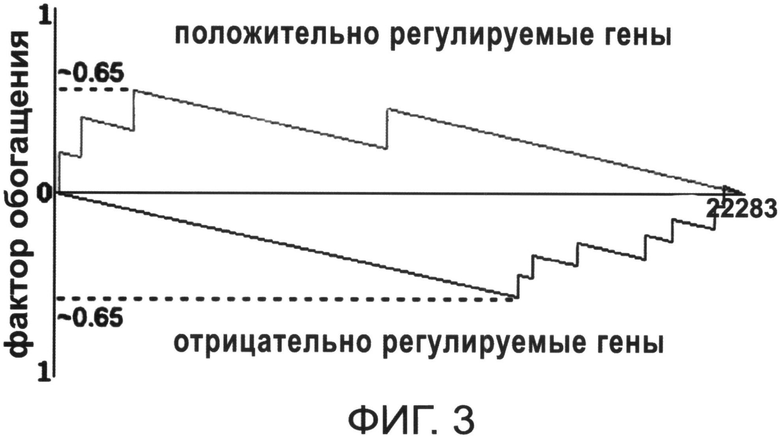
1. Способ получения противоопухолевого индивидуального протеом-основанного таргетного клеточного препарата для персонализированной терапии рака и других злокачественных новообразований, включающий в себя:
забор, выделение и изоляцию постнатальных тканеспецифичных мультипотентных аутологичных стволовых клеток (АСК) и/или аутологичных прогениторных клеток (АПК) для их последующего протеомного и полнотранскриптомного анализов, причем тип указанных АСК и/или АПК выбирают в соответствии с диагностированной у пациента нозологией онкологического заболевания и локализацией неопластического процесса;
забор, выделение и изоляцию постнатальных тканеспецифичных мультипотентных АСК и/или АПК и/или мультипотентных аллогенных HLA-гаплоидентичных стволовых клеток для последующего ремоделирования их протеомного профиля, причем тип этих клеток выбирают в соответствии с диагностированной у пациента нозологией онкологического заболевания и локализацией неопластического процесса;
забор, выделение и изоляцию раковых стволовых клеток (РСК) из опухоли пациента по соответствующим специфическим маркерам клеточной поверхности;
проведение протеомного анализа лизатов изолированных АСК и/или АПК и указанных РСК с картированием и получением протеомных профилей нормализованной сигнальной интенсивности белков этих клеток;
проведение полнотранскриптомного анализа экспресии генов изолированных АСК и/или АПК и РСК с картированием и получением полнотранскриптомных профилей нормализованной сигнальной интенсивности экспрессии генов этих клеток;
инвентаризация и определение видоспецифичного набора белков, каждый из которых содержится в полученных протеомных профилях как изолированных АСК и/или АПК, так и указанных РСК;
проведение сравнительного биоинформационного анализа ранее определенного набора белков протеомного профиля АСК (АПК) и РСК для идентификации в указанных РСК одного или нескольких внутриклеточных сигнальных путей, не подвергшихся неопластической трансформации в результате канцерогенеза, и определения одного или нескольких белков-мишеней, являющихся мембранными акцепторами идентифицированных сигнальных путей;
проведение биоинформационного анализа полнотранскриптомного профиля экспрессии генов РСК и подтверждение сохранности и функциональной значимости основных структурных компонентов идентифицированных сигнальных путей в РСК;
определение белков-лигандов, способных активировать белки-мишени диагностированных функционально сохранных сигнальных путей РСК;
проведение сравнительного анализа ранее полученных полнотранскриптомных профилей изолированных АСК и/или АПК с транскриптомными профилями, содержащимися в известных международных базах данных транскриптомов, для определения одного или нескольких пертурбогенов, способных модифицировать профиль экспрессии генов стволовых клеток, выделенных для дальнейшего ремоделирования их протеомного профиля и таргетной модификации транскриптомного профиля, в направлении секреции ранее определенных белков-лигандов, способных регуляторно воздействовать на идентифицированные сигнальные пути;
ремоделирование протеомного профиля выделенных для этого стволовых клеток ранее определенными пертурбогенами с получением в результате этого модифицированного транскриптомного профиля различных клеточных систем (стволовых клеток, прогенеторов, иммунокомпетентных клеток и т.д.), способных оказывать регуляторное воздействие на РСК пациента.
2. Способ по п.1, отличающийся тем, что белки-лиганды определяют с использованием известных баз данных белок-белковых взаимодействий.
3 Способ по п.1, отличающийся тем, что сравнительный анализ транскриптомных профилей проводят с использованием метода распознавания образов.
4. Способ по п.1, отличающийся тем, что в качестве пертурбогенов используют фармацевтические препараты, белковые препараты, антитела к белкам, микроРНК, матричные РНК, низкомолекулярные химические вещества, цитокины, факторы роста, нейротрофины, гормоны.
5. Способ по п.1, отличающийся тем, что ремоделирование протеомного профиля выделенных для этого стволовых клеток проводят путем добавления ранее определенных пертурбогенов в культуру ремоделируемых клеток, выдержки пертурбогенов в культуре и последующей отмывки ремоделированных клеток от пертурбогенов.
6. Способ по п.1, отличающийся тем, что в качестве указанных АСК и/или АПК и/или HLA-CK используют гемопоэтические, нейральные или мезенхимальные стволовые клетки.
7. Противоопухолевый индивидуальный протеом-основанный таргетный клеточный препарат, содержащий постнатальные тканеспецифичные мультипотентные аутологичные стволовые клетки и/или аутологичные прогениторные клетки и/или мультипотентные аллогенные HLA-гаплоидентичные стволовые клетки с ремоделированным протеомным профилем, полученные способом по любому из пп.1-6.
8. Применение противоопухолевого индивидуального протеом-основанного таргетного клеточного препарата, полученного способом по любому из пп.1-6, для персонализированной терапии злокачественных новообразований у человека или другого млекопитающего.
| RU 2008152343 A 10.07.2010 | |||
| SATOSHI Y | |||
| ET AL, The effects of neuronal induction on gene expression profile in bone marrow stromal cells (BMSC) preliminary study using microarray analysis, Brain Research, Vol | |||
| ПРИСПОСОБЛЕНИЕ К РОЯЛЮ ИЛИ ПИАНИНО ДЛЯ ПЕРЕДВИГАНИЯ ЛЕНТЫ С НОТНЫМИ ЗНАКАМИ | 1923 |
|
SU1087A1 |
| ИНГИБИТОР ПРОЛИФЕРАЦИИ СТВОЛОВОЙ КЛЕТКИ И СПОСОБ ЕГО ПРИМЕНЕНИЯ | 1995 |
|
RU2186579C2 |
Авторы
Даты
2014-12-20—Публикация
2012-12-24—Подача