Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к новым способам синтеза производных аманитина, имеющих гидроксигруппу, присоединенную к центральному триптофановому фрагменту. Настоящее изобретение, кроме того, относится к новым производным аманитина, имеющим гидроксигруппу, присоединенную в положении 4', 5' или 7' центрального триптофанового фрагмента, новым конъюгатам таких производных аманитина и фармацевтическая композициям, включающим в себя такие конъюгаты.
Предшествующий уровень техники настоящего изобретения
Аматоксины представляют собой циклические пептиды, состоящие из 8 аминокислот, которые обнаружены в грибах Amanita phalloides (см. фиг. 1). Аматоксины специфически ингибируют ДНК-зависимую РНК-полимеразу II клеток млекопитающих и тем самым также транскрипцию и биосинтез белка поврежденных клеток. Ингибирование транскрипции в клетке вызывает прекращение роста и пролиферации. Хотя и не связан ковалентно, комплекс между аманитином и РНК-полимеразой II является очень прочным (KD=3 нМ). Диссоциация аманитина от фермента является очень медленным процессом, что делает восстановление поврежденной клетки маловероятным. Если ингибирование транскрипции длится слишком долго, клетка подвергается запрограммированной клеточной смерти (апоптозу).
Применение аматоксинов в качестве цитотоксических фрагментов для противоопухолевой терапии уже исследовали в 1981 году путем связывания антитела против Thy 1,2 с α-аманитином с использованием линкера, присоединенного к индольному кольцу Trp (аминокислота 4; см. фиг. 1) через диазотирование (Davis & Preston, Science 213 (1981) 1385-1388). Davis и Preston идентифицировали сайт присоединения как положение 7'. Morris и Venton также продемонстрировали, что замещение в положении 7' дает производное, которое сохраняет цитотоксическую активность (Morris & Venton, Int. J. Peptide Protein Res. 21 (1983) 419-430).
В заявке на выдачу европейского патента № ЕР1859811 А1 (опубликованной 28 ноября 2007 года) описываются конъюгаты, в которых γ С-атом аматоксина аминокислоты 1 β-аманитина был непосредственно связан, т.е. без линкерной структуры, с альбумином или с моноклональным антителом НЕА125, ОКТ3 или РА-1. Более того, показан ингибирующий эффект этих конъюгатов в отношении пролиферации клеток рака молочной железы (MCF-7), клеток лимфомы Беркитта (Raji) и клеток Т-лимфомы (Jurkat). Предполагали применение линкеров, в том числе линкеров, включающих в себя элементы, такие как амид, сложный эфир, эфир, тиоэфир, дисульфид, мочевина, тиомочевина, углеводородные фрагменты и подобные, но такие конструкции фактически не были показаны и не было представлено больше подробностей, таких как сайты прикрепления на аматоксинах.
В заявках на выдачу патентов WO 2010/115629 и WO 2010/115630 (обе опубликованные 14 октября 2010 года) описаны конъюгаты, в которых антитела, такие как антитела против ЕрСАМ, такие как гуманизированное антитело huHEA125, связаны с аматоксинами посредством (i) γ С-атома аминокислоты 1 аматоксина, (ii) 6' С-атома аминокислоты 4 аматоксина, или (iii) посредством δ С-атома аминокислоты 3 аматоксина, в каждом случае или непосредственно или посредством линкера между антителом и аматоксинами. Предполагаемые линкеры включают в себя элементы, такие как амид, сложный эфир, эфир, тиоэфир, дисульфид, мочевина, тиомочевина, углеводородные фрагменты и подобные. Более того, показаны ингибирующие эффекты таких конъюгатов в отношении пролиферации клеток рака молочной железы (клеточной линии MCF-7), карциномы поджелудочной железы (клеточной линии Capan-1), рака толстой кишки (клеточной линии Со1о205) и холангиокарциномы (клеточной линии OZ).
В заявке на выдачу патентов WO 2012/119787 описывается, что связывающиеся с мишенью фрагменты могут быть присоединены к аматоксинам через линкеры по дополнительным сайтам присоединения на аминокислоте 4 триптофана, а именно в положениях 1'-N, без влияния на взаимодействие таких аматоксинов с их мишенью - ДНК-зависимой РНК-полимеразой II клеток млекопитающих.
В заявке на выдачу патентов WO 2014/009025 описывается полный синтез производных аманитина с использованием нового синтона для γ,δ-дигидроксиизолейцина в качестве одного из исходных материалов. Кроме того, в заявке на выдачу патентов РСТ/ЕР2016/078984 [опубликованной как WO 2017/089607] описывается полный синтез производных γ- и ε-аманитина с использованием легкодоступного (2S,3R,4S)-L-4-гидроксиизолейцина в качестве одного из исходных материалов. Тем не менее эти подходы и все другие полностью или частично синтетические подходы, применяемые до настоящего времени, заключаются во включении центрального триптофанового фрагмента в ядро аматоксина с использованием способа в соответствии с реакцией Savige-Fontana. В этом способе цис-2-карбокси-3а-гидрокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индол («Hpi») встраивают в линейную структуру предшественника аманитина. В катализируемой кислотой реакции сочетания Hpi-цистеина образуется аманитиновая кольцевая система с центральным триптофановым фрагментом.
Hpi, однако, не имеет никакого функционального фрагмента, присоединенного к фенильному кольцу индольного фрагмента в Hpi. Таким образом, аманитиновые продукты, полученные из способа в соответствии с реакцией Savige-Fontana, содержат центральный триптофановый фрагмент без каких-либо дополнительных заместителей. Встречающиеся в природе α-, β-, γ и ε-аманитины, однако, содержат центральный 6'-гидрокси-триптофановый фрагмент, и эту 6'-гидроксигруппу успешно использовали в качестве функциональной группы для функционализации аманитинов, например, путем присоединения нацеливающихся фрагментов, либо непосредственно, либо через линкеры (см., например, WO 2010/115629, WO 2010/115630 и WO 2012/041504). Таким образом, в случае синтетических аманитинов функционализация должна была быть выполнена (i) через γ С-атом аминокислоты 1 аматоксина, или (ii) через δ С-атом аминокислоты 3 аматоксина, как описано выше, или через атом азота триптофанового фрагмента, как описано в WO 2012/119787.
Hpi может быть получен путем осуществления реагирования триптофана с перуксусной кислотой или фотохимически с синглетным кислородом. Однако до сих пор не было описано никаких производных с заместителями, присоединенными к фенильному кольцу индольного фрагмента Hpi.
Хотя использование полностью синтетических путей для аматоксинов может обеспечить вариант поставки более крупных количеств аматоксинов, необходимых для терапевтических применений, и может обеспечить создание множества новых вариантов аматоксинов с использованием соответствующих исходных материалов в качестве строительных блоков, подходы, использовавшиеся ранее, были ограничены тем фактом, что нативная структура α-, β-, γ и/или ε-аманитина не могла быть получена, поскольку не мог быть включен 6'-гидроксифрагмент, присоединенный к триптофановому фрагменту в виде ядра, в таких аманитинах. Таким образом, варианты функционализации синтетических аманитинов до настоящего времени были довольно ограничены. Кроме того, было бы крайне желательно расширить диапазон вариантов, доступных для функционализации, поскольку такие факторы, как стерическое затруднение и реакционная способность, могут оказывать сильное влияние на реакционную способность, биологическую активность и/или стабильность синтетических аманитинов и их конъюгатов. Однако стабильность и эффективность конъюгатов, включающих в себя высокотоксические аманитины, имеют первостепенное значение для предполагаемого применения в качестве терапевтических молекул для введения людям.
Цель настоящего изобретения
Таким образом, все еще сохраняется большая потребность в экономически эффективном и надежном способе синтеза аматоксинов с гидроксигруппой, присоединенной к фенильному кольцу центрального триптофанового фрагмента. В частности, существует острая необходимость в идентификации исходных материалов, которые могли бы быть использованы в установленной реакции Savige-Fontana и которые обеспечены таким образом, чтобы могли вызывать включение таких гидроксигрупп.
Краткое раскрытие настоящего изобретения
Настоящее изобретение основано на неожиданном наблюдении, что могут быть синтезированы варианты Hpi, которые позволяют введение гидроксильных групп в ходе синтеза производных аманитина.
Таким образом, согласно одному аспекту настоящее изобретение относится к гидрокси-замещенному производному 2-карбокси-3а-гидрокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индола в соответствии с формулой I
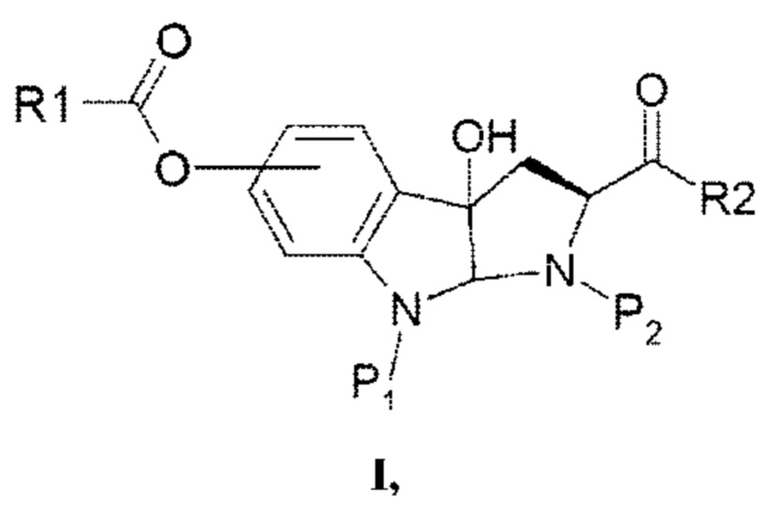
в которой R1 выбран из алкила, арила, гетероарила, замещенного алкила, замещенного арила и замещенного гетероарила;
P1 представляет собой водород или защитную группу, в частности, защитную группу, выбранную из Boc, PhCH2OCO-, СН2=CHCH2O-СО- и тритила;
Р2 представляет собой водород или защитную группу, в частности, защитную группу, в частности, защитную группу, выбранную из Boc, PhCH2OCO-, СН2=СНСН2О-СО- и тритила; и
R2 выбран из ОН, OR1 и полипептидной цепи, состоящей из 1-7 аминокислотных остатков.
Согласно второму аспекту настоящее изобретение относится к способу синтеза линейного предшественника, включающего в себя восемь аминокислотных остатков производного аманитина, включающего в себя гидроксилированный триптофановый фрагмент, предусматривающему стадию использования гидрокси-замещенного производного 2-карбокси-3а-гидрокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индола в соответствии с настоящим изобретением в пептидном синтезе указанного предшественника.
Согласно третьему аспекту настоящее изобретение относится к способу синтеза производного аманитина, включающего в себя гидроксилированный триптофановый фрагмент, предусматривающему стадии:
(i) инициирования или обеспечения образования связи между цистеиновым остатком и триптофановым фрагментом линейного предшественника в соответствии с настоящим изобретением; и
(ii) инициирования или обеспечения образования указанного производного аманитина путем осуществления реагирования N-концевого линейного предшественника в соответствии с настоящим изобретением с С-концом указанного предшественника.
Согласно четвертому аспекту настоящее изобретение относится к производному аманитина, включающему в себя гидроксилированный триптофановый фрагмент, который выбран из (i) S-дезокси-4'-гидрокси-аманина, 4'-гидрокси-аманина, S-дезокси-5'-гидрокси-аманина, 5'-гидрокси-аманина, S-дезокси-7'-гидрокси-аманина, 7'-гидрокси-аманина, (ii) S-дезокси-4'-гидрокси-аманинамида, 4'-гидрокси-аманинамида, S-дезокси-5'-гидрокси-аманинамида, 5'-гидрокси-аманинамида, S-дезокси-7'-гидрокси-аманинамида и 7'-гидрокси-аманинамида, (iii) производного аманитина в соответствии с (i), в котором фрагмент свободной карбоновой кислоты аминокислоты 1 превращается в сложный эфир карбоновой кислоты -C(=O)OR1 или во фрагмент -C(=O)NH-OR1, при этом R1 выбран из алкила, арила, гетероарила, замещенного алкила, замещенного арила и замещенного гетероарила.
Согласно пятому аспекту настоящее изобретение относится к конъюгату, включающему в себя (а) производное аманитина, включающее в себя гидроксилированный триптофановый фрагмент в соответствии с настоящим изобретением; (b) связывающийся с мишенью фрагмент и (с) необязательно линкер, связывающий указанное производное аманитина и указанный связывающийся с мишенью фрагмент.
Согласно шестому аспекту настоящее изобретение относится к фармацевтической композиции, включающей в себя аманитин в соответствии с настоящим изобретением или конъюгат в соответствии с настоящим изобретением.
Согласно седьмому аспекту настоящее изобретение относится к производному аманитина в соответствии с настоящим изобретением, конъюгату в соответствии с настоящим изобретением или фармацевтической композиции в соответствии с настоящим изобретением для применения в лечении злокачественной опухоли у больного, в частности, при этом злокачественная опухоль выбрана из группы, состоящей из рака молочной железы, рака поджелудочной железы, холангиокарциномы, рака толстой и прямой кишки, рака легкого, рака предстательной железы, рака яичника, рака желудка, рака почки, злокачественной меланомы, лейкоза и злокачественной лимфомы.
Согласно восьмому аспекту настоящее изобретение относится к конструкции, включающей в себя (а) производное аманитина в соответствии с настоящим изобретением и (b) линкерный фрагмент, несущий реакционноспособную группу Y для связывания указанного производного аманитина со связывающимся с мишенью фрагментом.
Краткое описание графических материалов
На фиг. 1 показаны структурные формулы различных аматоксинов. Числа, выделенные жирным шрифтом (от 1 до 8), обозначают стандартную нумерацию восьми аминокислот, образующих аматоксин. Также показаны стандартные обозначения атомов в аминокислотах 1, 3 и 4 (греческие буквы от α до γ, греческие буквы от α до δ и цифры от 1' до 7', соответственно).
На фиг. 2 показана структура соединения S-деокси-α-аманитина (HDP 30.0735) и α-аманитина.
На фиг. 3 показано, что Hpi (HDP 30.0079) образуется при одностадийном синтезе, исходя из Boc-L-триптофана.
На фиг. 4 показано, что соединение S-деокси-α-аманитина (HDP 30.0735) образуется путем твердофазного пептидного синтеза, включающего производное Hpi HDP 30.2555.
На фиг. 5 показана цитотоксичность S-деокси-α-аманитина (HDP 30.0735) и S-дезокси-5'-гидрокси-аманинамида HDP 30.2548 в отношении клеток HEK293 и в отношении клеток HEK293 ОАТР1В3.
На фиг. 6 показана конструкция на основе S-деокси-α-аманитина (HDP 30.0735) с расщепляемым линкером, присоединенным к 6'-гидроксигруппе и концевой малеимидной группе в качестве примера реакционноспособные группа Y, для связывания указанной конструкции со связывающимся с мишенью фрагментом.
На фиг. 7 показана альтернативная конструкция на основе S-деокси-α-аманитина (HDP 30.0735) с расщепляемым линкером, присоединенным к карбоксильной группе аминокислотного остатка 1 и концевой малеимидной группе в качестве примера реакционноспособной группы Y, для связывания указанной конструкции со связывающимся с мишенью фрагментом.
На фиг. 8 показано, что гидроксилированное производное Hpi HDP 30.2536 образуется при многостадийном синтезе, исходя из 5'-гидрокси-L-триптофана.
На фиг. 9 показано, что соединение предшественника аманитина HDP 30.2544 образуется путем твердофазного пептидного синтеза, включающего производное Hpi HDP 30.2536.
На фиг. 10 показано, что соединение производное аманитина HDP 30.2546 образуется путем замыкания кольца из предшественника аманитина HDP 30.2544.
На фиг. 11 показано, что производное аманитина HDP 30.2548 (S-дезокси-5'-гидрокси-аманинамид) образуется путем удаления защитных групп из производного аманитина HDP 30.2546.
На фиг. 12 показана конструкция на основе производного аманитина HDP 30.2548 (S-дезокси-5'-гидрокси-аманинамида) с расщепляемым линкером, присоединенным к 5'-гидроксигруппе и концевой малеимидной группе в качестве примера реакционноспособной группы Y, для связывания указанной конструкции со связывающимся с мишенью фрагментом.
На фиг. 13 показана цитотоксичность ADC HDP 30.2347, HDP 30.2371 и HDP 30.2602, нацеливающихся на А) HER-2/neu в клетках SKBR-3 (HER-2/neu+++) и в клетках JIMT-1 (HER-2/neu+), В) PSMA в клетках LnCap (PSMA+++) и в клетках 22rv1 (PSMA++), и С) CD19 в клетках Raji (CD19+++) и в клетках Nalm-6 (CD19++), по сравнению с ADC HDP 30.1699 (включающими в себя тот же расщепляемый линкер, что и HDP 30.2347, HDP 30.2371 и HDP 30.2602, но альфа-аманитин вместо описанных выше производных аманитина).
Подробное раскрытие настоящего изобретения
Прежде чем настоящее изобретение будет подробно описано ниже, следует отметить, что настоящее изобретение не ограничивается конкретными методологией, протоколами и реагентами, описанными в настоящем документе, поскольку они могут варьироваться. Также следует отметить, что используемая в настоящем документе терминология предназначена исключительно для описания конкретных вариантов осуществления и не предназначена для ограничения объема настоящего изобретения, который будет ограничиваться только прилагаемой формулой изобретения. Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют те же значения, которые обычно понимаются специалистом в данной области.
В частности, термины, используемые в настоящем документе, определяют, как описано в "A multilingual glossary of biotechnological terms: (IUPAC Recommendations)", Leuenberger, H.G.W, Nagel, B. and Kölbl, H. eds. (1995), Helvetica Chimica Acta, CH-4010 Basel, Switzerland.
По всему настоящему описанию и следующей за ним формуле изобретения, если контекст не требует иного, будет подразумеваться, что слово «включать в себя» и такие варианты, как «включает в себя» и «включающий в себя», подразумевают включение указанного целого числа, композиции или стадии, или группы целых чисел, композиций или стадий, в то время как любые дополнительные целое число, композиция или стадия, или группа целых чисел, композиций или стадий также могут необязательно присутствовать, в том числе имеются варианты осуществления, в которых нет дополнительных целого числа, композиции или стадии, или группы целых чисел, композиций или стадий. В таких последних вариантах осуществления термин «включающий в себя» используют совместно с «состоящим из».
Некоторые документы цитируется по всему тексту настоящего описания. Каждый из документов, цитируемых в настоящем документе (в том числе все патенты, заявки на выдачу патентов, научные публикации, спецификации производителя, инструкции, представления последовательностей в виде номеров доступа GenBank и т.д.), будь то выше или ниже, тем самым включен в качестве ссылки в полном своем объеме в той степени, в которой это возможно в рамках соответствующего патентного законодательства. Ничто в настоящем документе не должно быть истолковано как признание того, что изобретение не имеет права предшествовать такому раскрытию в силу наличия предшествующего изобретения.
Далее будет описано настоящее изобретение. В следующих частях более подробно определяются различные аспекты настоящего изобретения. Каждый определенный таким образом аспект может быть объединен с любым другим аспектом или аспектами, если явно не указано иное. В частности, любой признак, указанный как предпочтительный или преимущественный, может быть объединен с любым другим признаком или признаками, указанными как предпочтительные или преимущественные.
Настоящее изобретение основано на неожиданном наблюдении того, что могут быть синтезированы варианты Hpi, которые позволяют вводить гидроксильные группы в ходе синтеза производных аманитина.
Таким образом, согласно одному аспекту настоящее изобретение относится к гидрокси-замещенному производному 2-карбокси-3а-гидрокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индола в соответствии с формулой I
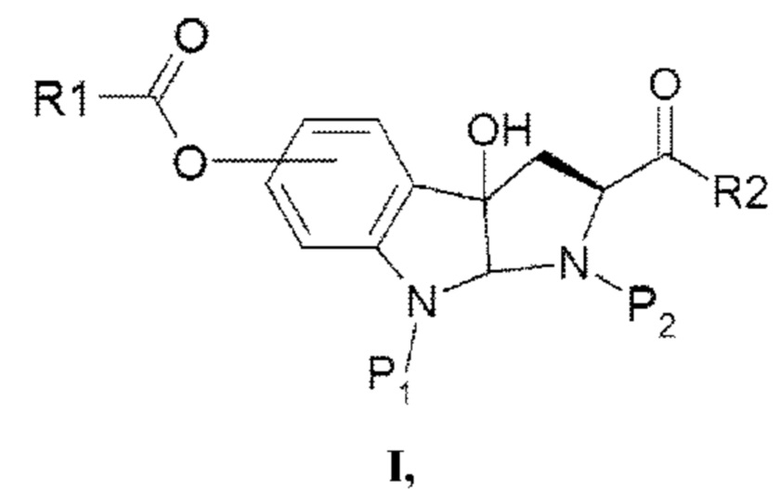
в которой R1 выбран из алкила, арила, гетероарила, замещенного алкила, замещенного арила и замещенного гетероарила;
P1 представляет собой водород или защитную группу;
Р2 представляет собой водород или защитную группу; и
R2 выбран из ОН, OR1 и полипептидной цепи, состоящей из 1-7 аминокислотных остатков.
В контексте настоящего изобретения термин «защитная группа» относится к группе, которая присоединяется к атому азота в положениях 1 или 8 центрального гексагидропирроло[2,3-b]индольного фрагмента для блокирования атома азота от осуществления реагирования с другими реактантами, используемыми для синтеза и/или для дальнейшей функционализации соединений в соответствии с формулой I. Рядовому специалисту в данной области хорошо известны различные защитные группы, которые доступны в уровне техники, которые могут быть присоединены к соответствующему атому азота при необходимости защиты атома азота и которые могут быть затем отщеплены, когда N-защита больше не требуется. Согласно конкретным вариантам осуществления для N-защиты используется N-ацилирующий реагент. Таким образом, согласно таким вариантам осуществления P1 и/или Р2 представляют собой ацильные группы. Согласно другим конкретным вариантам осуществления для N-защиты используется N-алкилирующий реагент. Таким образом, согласно таким вариантам осуществления Р1 и/или Р2 представляет собой алкильную группу.
Согласно конкретным вариантам осуществления защитная группа Р1 или Р2, если присутствует, независимо выбрана из Boc, PhCH2OCO-, СН2=СНСН2О-СО- и тритила.
Согласно конкретному варианту осуществления гидроксигруппа в положении 3а и атом водорода в положении 8а находятся в цис-конфигурации относительно функциональной группы, присоединенной в положении 2. Согласно другому конкретному варианту осуществления гидроксигруппа в положении 3а и атом водорода в положении 8а находятся в транс-конфигурации относительно функциональной группы, присоединенной в положении 2. Согласно конкретному варианту осуществления амино-замещенное производное в соответствии с настоящим изобретением представляет собой смесь соединений с цис- и транс-конфигурацией.
Согласно конкретному варианту осуществления заместитель R1-C(=O)-O-присоединяется в положении 4 в формуле I.
Согласно конкретному варианту осуществления заместитель R1-C(=O)-O-присоединяется в положении 5 в формуле I.
Согласно конкретному варианту осуществления заместитель R1-C(=O)-O-присоединяется в положении 6 в формуле I.
Согласно конкретному варианту осуществления заместитель R1-C(=O)-O-присоединяется в положении 7 в формуле I.
Согласно второму аспекту настоящее изобретение относится к способу синтеза линейного предшественника, включающего в себя восемь аминокислотных остатков производного аманитина, включающего в себя гидроксилированный триптофановый фрагмент, предусматривающему стадию использования гидрокси-замещенного производного 2-карбокси-3а-гидрокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индола в соответствии с настоящим изобретением в пептидном синтезе указанного предшественника.
Согласно третьему аспекту настоящее изобретение относится к способу синтеза производного аманитина, включающего в себя гидроксилированный триптофановый фрагмент, предусматривающему стадии:
(i) инициирования или обеспечения образования связи между цистеиновым остатком и триптофановым фрагментом линейного предшественника в соответствии с настоящим изобретением; и
(ii) инициирования или обеспечения образования указанного производного аманитина путем осуществления реагирования N-концевого линейного предшественника в соответствии с настоящим изобретением с С-концом указанного предшественника.
Согласно дополнительным аспектам настоящее изобретение относится к отдельным предшественникам аманитина, синтезируемым, как показано в примерах, в частности, к соединениям HDP 30.2569, HDP 30.2572 и твердофазным промежуточным соединениям, синтезируемым в соответствии с [00145].
Согласно конкретному варианту осуществления способ в соответствии с настоящим изобретением дополнительно предусматривает окисление атома серы цистеинового фрагмента с образованием сульфоксида или сульфона, в частности, сульфоксида.
Согласно четвертому аспекту настоящее изобретение относится к производному аманитина, включающему в себя гидроксилированный триптофановый фрагмент, который выбран из (i) S-дезокси-4'-гидрокси-аманина, 4'-гидрокси-аманина, S-дезокси-5'-гидрокси-аманина, 5'-гидрокси-аманина, S-дезокси-7'-гидрокси-аманина, 7'-гидрокси-аманина, (ii) S-дезокси-4'-гидрокси-аманинамида, 4'-гидрокси-аманинамида, S-дезокси-5'-гидрокси-аманинамида, 5'-гидрокси-аманинамида, S-дезокси-7'-гидрокси-аманинамида и 7'-гидрокси-аманинамида, (iii) производного аманитина в соответствии с (i), при этом фрагмент свободной карбоновой кислоты аминокислоты 1 превращается в сложный эфир карбоновой кислоты -C(=O)OR1 или во фрагмент -C(=O)NH-OR1, при этом R1 выбран из алкила, арила, гетероарила, замещенного алкила, замещенного арила и замещенного гетероарила.
Согласно конкретному варианту осуществления производное аманитина в соответствии с настоящим изобретением выбрано из S-дезокси-5'-гидрокси-аманина, 5'-гидрокси-аманина, S-дезокси-5'-гидрокси-аманинамида и 5'-гидрокси-аманинамида.
Согласно пятому аспекту настоящее изобретение относится к конъюгату, включающему в себя (а) производное аманитина, включающее в себя гидроксилированный триптофановый фрагмент в соответствии с настоящим изобретением; (b) связывающийся с мишенью фрагмент и (с) необязательно линкер, связывающий указанное производное аманитина и указанный связывающийся с мишенью фрагмент.
Согласно шестому аспекту настоящее изобретение относится к фармацевтической композиции, включающей в себя аманитин в соответствии с настоящим изобретением или конъюгат в соответствии с настоящим изобретением.
Согласно седьмому аспекту настоящее изобретение относится к производному аманитина в соответствии с настоящим изобретением, конъюгату в соответствии с настоящим изобретением или фармацевтической композиции в соответствии с настоящим изобретением для применения в лечении злокачественной опухоли у больного, в частности, при этом злокачественная опухоль выбрана из группы, состоящей из рака молочной железы, рака поджелудочной железы, холангиокарциномы, рака толстой и прямой кишки, рака легкого, рака предстательной железы, рака яичника, рака желудка, рака почки, злокачественной меланомы, лейкоза и злокачественной лимфомы.
Согласно восьмому аспекту настоящее изобретение относится к конструкции, включающей в себя (а) производное аманитина в соответствии с настоящим изобретением и (b) линкерный фрагмент, несущий реакционноспособную группу Y для связывания указанного производного аманитина со связывающимся с мишенью фрагментом.
В контексте настоящего изобретения термин «аманитин» относится к конкретной группе аматоксинов. В контексте настоящего изобретения термин «аматоксин» включает в себя все циклические пептиды, состоящие из 8 аминокислот, выделяемые из рода Amanita и описанные у Wieland, Т. и Faulstich Н. (Wieland Т, Faulstich Н., CRC Crit Rev Biochem. 5 (1978) 185-260). В контексте настоящего изобретения термин «аманитины» относится к бициклической структуре, которая основана на остатке аспарагиновой кислоты или аспарагина в положении 1, пролиновом остатке, в частности, гидроксипролиновом остатке в положении 2, изолейцине, гидроксиизолейцине или дигидроксиизолейцине в положении 3, остатке гидрокситриптофана в положении 4, остатках глицина в положениях 5 и 7, остатке изолейцина в положении 6 и остатке цистеина в положении 8, в частности, к производному цистеина, которое окисляется до сульфоксидного или сульфонового производного (нумерацию и иллюстративные примеры аманитинов см. на фиг. 1), и, кроме того, включает в себя все ее химические производные; кроме того, все ее полусинтетические аналоги; кроме того, все ее синтетические аналоги, построенные из строительных блоков в соответствии с основной структурой натуральных соединений (циклических, из 8 аминокислот), кроме того, все синтетические или полусинтетические аналоги, включающие в себя негидроксилированные аминокислоты вместо гидроксилированных аминокислот (при условии, что по меньшей мере одна гидроксигруппа присутствует в фенильном кольце триптофанового фрагмента), кроме того, все синтетические или полусинтетические аналоги, при этом в каждом случае любое такое производное или аналог является функционально активным в отношении ингибирования РНК-полимеразы II млекопитающих.
Таким образом, в контексте настоящего изобретения термин «восемь аминокислотных остатков производного аманитина» относится к определенным аминокислотам, которые образуют бициклическую структуру аманитинового полипептида.
Функционально аматоксины определяют как пептиды или депсипептиды, которые ингибируют РНК-полимеразу II млекопитающих. Предпочтительными аматоксинами являются таковые с функциональной группой (например, производное с карбоксильной группой или карбоновая кислота, такие как карбоксамид или гидроксамовая кислота, аминогруппой, гидроксигруппой, тиольной или тиолзахватывающей группой), которая может быть введена в реакцию с линкерными молекулами или связывающимися с мишенью фрагментами, определяемыми выше. Аматоксинами, которые особенно подходят для конъюгатов в соответствии с настоящим изобретением, являются ди-деокси варианты α-аманитина, β-аманитина, γ-аманитина, ε-аманитина, амануллина или амануллиновой кислоты, или моно-деокси варианты аманина, аманинамида, γ-аманина или γ-аманинамида, как показано на фиг. 1, а также их соли, химические производные, полусинтетические аналоги и синтетические аналоги.
Согласно конкретному варианту осуществления гидрокси-замещенное производное, производное аманитина, включающее в себя гидроксилированный триптофановый фрагмент, и/или конъюгат в соответствии с настоящим изобретением характеризуются чистотой более чем 90%, в частности, более чем 95%, более конкретно более чем 98% или даже более чем 99%.
В контексте настоящего изобретения термин «чистота» относится к суммарному количеству, например, присутствующих конъюгатов. Чистота более чем 90%, например, означает, что в 1 мг композиции, включающей в себя конъюгат в соответствии с настоящим изобретением, имеется более чем 90%, т.е. более чем 900 мкг, такого конъюгата. Остальная часть, т.е. примеси, может включать в себя непрореагировавший исходный материал и другие реактанты, растворители, продукты расщепления и/или побочные продукты.
Согласно конкретному варианту осуществления композиция, включающая в себя гидрокси-замещенное производное, производное аманитина, включающее в себя гидроксилированный триптофановый фрагмент, и/или конъюгат в соответствии с настоящим изобретением, включает в себя более чем 100 мг, в частности, более чем 500 мг, и более конкретно более чем 1 г такого гидрокси-замещенного производного, производного аманитина, включающего в себя гидроксилированный триптофановый фрагмент, и/или конъюгата. Таким образом, следовое количество, например, конъюгата в соответствии с настоящим изобретением, которое возможно может присутствовать в комплексных препаратах конъюгатов известного уровня техники, явно исключается.
Используемый в настоящем документе термин «связывающийся с мишенью фрагмент» относится к любой молекуле или части молекулы, которая может специфически связываться с мишеневой молекулой или мишеневым эпитопом. Предпочтительными связывающимися с мишенью фрагментами в контексте настоящей заявки являются (i) антитела или их антигенсвязывающие фрагменты; (ii) подобные антителу белки и (iii) аптамеры нуклеиновой кислоты. «Связывающиеся с мишенью фрагменты», подходящие для применения в соответствии с настоящим изобретением, как правило, имеют молекулярную массу 40000 Да (40 кДа) или больше.
Используемое в настоящем документе первое соединение (например, антитело) считается «специфически связывающимся» со вторым соединением (например, антигеном, таким как мишеневый белок), если оно характеризуется константой диссоциации KD с указанным вторым соединением 100 мкМ или меньше, в частности, 50 мкМ или меньше, в частности, 30 мкМ или меньше, в частности, 20 мкМ или меньше, в частности, 10 мкМ или меньше, в частности, 5 мкМ или меньше, более конкретно 1 мкМ или меньше, более конкретно 900 нМ или меньше, более конкретно 800 нМ или меньше, более конкретно 700 нМ или меньше, более конкретно 600 нМ или меньше, более конкретно 500 нМ или меньше, более конкретно 400 нМ или меньше, более конкретно 300 нМ или меньше, более конкретно 200 нМ или меньше, еще более конкретно 100 нМ или меньше, еще более конкретно 90 нМ или меньше, еще более конкретно 80 нМ или меньше, еще более конкретно 70 нМ или меньше, еще более конкретно 60 нМ или меньше, еще более конкретно 50 нМ или меньше, еще более конкретно 40 нМ или меньше, еще более конкретно 30 нМ или меньше, еще более конкретно 20 нМ или меньше и еще более конкретно 10 нМ или меньше.
В контексте настоящей заявки термины «мишеневая молекула» и «мишеневый эпитоп», соответственно, относятся к антигену и эпитопу антигена, соответственно, которые специфически связываются связывающимся с мишенью фрагментом. В частности, мишеневая молекула представляет собой связанный с опухолью антиген, в частности, антиген или эпитоп, который присутствует на поверхности одного или нескольких типов опухолевых клеток в повышенной концентрацией и/или в другой стерической конфигурации по сравнению с поверхностью неопухолевых клеток. В частности, указанный антиген или эпитоп присутствует на поверхности одного или нескольких типов опухолевых клеток, но не на поверхности неопухолевых клеток. Согласно конкретным вариантам осуществления связывающийся с мишенью фрагмент специфически связывается с эпитопом антигена, выбранного из PSMA, CD 19, CD269, сиалила Lewisa, HER-2/neu и адгезивной молекулы эпителиальных клеток (ЕрСАМ). Согласно другим вариантам осуществления указанный антиген или эпитоп преимущественно экспрессируется на клетках, вовлеченных в аутоиммунные заболевания. Согласно таким конкретным вариантам осуществления связывающийся с мишенью фрагмент специфически связывается с эпитопом рецептора IL-6 (IL-6R).
Используемый в настоящем документе термин «антитело или его антигенсвязывающий фрагмент» относится к молекулам иммуноглобулина и иммунологически активным частям молекул иммуноглобулина, т.е. к молекулам, которые содержат антигенсвязывающий сайт, иммуноспецифически связывающий антиген. Таким образом, термин «его антигенсвязывающие фрагменты» относится к фрагменту антитела, включающему в себя по меньшей мере функциональный антигенсвязывающий домен. Также включены подобные иммуноглобулину белки, которые отбирают посредством методик, включающих в себя, например, фаговый дисплей, для специфического связывания с мишеневой молекулой, например, с мишеневым белком, выбранным из PSMA, CD19, CD269, сиалила Lewisa, HER-2/neu и ЕрСАМ. Молекулы иммуноглобулина в соответствии с настоящим изобретением могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса молекулы иммуноглобулина. «Антитела и их антигенсвязывающие фрагменты», подходящие для применения в соответствии с настоящим изобретением, включают в себя без ограничения поликлональные, моноклональные, одновалентные, биспецифические, гетероконъюгатные, мультиспецифические, человеческие, гуманизированные (в частности, CDR-привитые), деиммунизированные или химерные антитела, одноцепочечные антитела (например, scFv), Fab фрагменты, F(ab')2 фрагменты, фрагменты, полученные с помощью экспрессионной библиотеки Fab, диатела или тетратела (Holliger P. et al., Proc Natl Acad Sci USA. 90 (1993) 6444-8), нонотела, антиидиотипические (против Id) антитела (в том числе, например, антитела против Id против антител в соответствии с настоящим изобретением) и эпитопсвязывающие фрагменты любого из вышеуказанного.
Согласно некоторым вариантам осуществления антигенсвязывающие фрагменты представляют собой человеческие антигенсвязывающие фрагменты антител в соответствии с настоящим изобретением и включают в себя без ограничения Fab, Fab' и F(ab')2, Fd, одноцепочечные Fv (scFv), одноцепочечные антитела, дисульфид-связанные Fv (dsFv) и фрагменты, включающие в себя либо VL, либо VH домен. Антигенсвязывающие фрагменты антител, в том числе одноцепочечные антитела, могут включать в себя вариабельный домен(ы) отдельно или в комбинации с полными или частью следующих: шарнирная область, CL, CH1, СН2 и СН3 домены. Также в настоящее изобретение включены антигенсвязывающие фрагменты, также включающие в себя любую комбинацию вариабельного домена(ов) с шарнирной область., CL, CH1, СН2 и СН3 доменами.
Антитела, применимые в соответствии с настоящим изобретением, могут происходить от любого животного, в том числе от птиц и млекопитающих. В частности, источником антител является человек, грызун (например, мышь, крыса, морская свинка, или кролик), курица, свинья, овца, коза, верблюд, корова, лошадь, осел, кошка или собака. Особенно предпочтительным является происхождение антител от человека или мыши. Используемый в настоящем документе термин «человеческие антитела» включает в себя антитела, имеющие аминокислотную последовательность человеческого иммуноглобулина, и включает в себя антитела, выделенные из библиотек человеческого иммуноглобулина или из животных, трансгенных по одному или нескольким человеческим иммуноглобулинам, и которые не экспрессируют эндогенные иммуноглобулины, как описано, например, в патенте США №5939598 Kucherlapati и Jakobovits.
Термин «подобный антителу белок» относится к белку, который был создан методом генной инженерии (например, путем мутагенеза петель) для специфического связывания с мишеневой молекулой. Как правило, такой подобный антителу белок включает в себя по меньшей мере одну вариабельную пептидную петлю, присоединенную на оба конца белкового каркаса. Такое двойное структурное ограничение значительно усиливает аффинность связывания подобного антителу белка до уровней, сравнимых с таковыми антитела. Длина вариабельной пептидной петли, как правило, составляет 10-20 аминокислот. Каркасным белком может быть любой белок, имеющий свойства хорошей растворимости. В частности, каркасным белком является малый глобулярный белок. Подобные антителу белки включают в себя без ограничения аффитела, антикалины и сконструированные белки с анкириновыми повторами (обзор см. в Binz et al., Nat Biotechnol. 2005, 1257-68). Подобные антителу белки могут быть получены из больших библиотек мутантов, например, могут быть получены из больших библиотек фагового дисплея и могут быть выделены по аналогии с обычными антителами. Также подобные антителу связывающие белки могут быть получены путем комбинаторного мутагенеза поверхностно-выставленных остатков в глобулярных белках.
Термин «аптамер нуклеиновой кислоты» относится к молекуле нуклеиновой кислоты, которая была создана методом генной инженерии посредством повторных циклов in vitro отбора или SELEX (систематической эволюции лигандов путем экспоненциального обогащения) для связывания с мишеневой молекулой (обзор см. в Brody and Gold, J Biotechnol. 74 (2000) 5-13). Аптамером нуклеиновой кислоты может быть молекула ДНК или РНК. Аптамеры могут содержать модификации, например, модифицированные нуклеотиды, такие как 2'-фтор-замещенные пиримидины.
Термин «линкер» в контексте настоящего изобретения относится к структуре, которая соединяет два компонента, каждый из которых присоединен к одному концу линкера. В случае, если линкер представляет собой связь, прямое связывание аматоксина с антителом может понизить способность аматоксина взаимодействовать с РНК-полимеразой II. Согласно конкретным вариантам осуществления линкер увеличивает расстояние между двумя компонентами и ослабляет стерическое взаимодействие между этими компонентами, как, например, в данном случае между антителом и аматоксином. Согласно конкретным вариантам осуществления линкер имеет непрерывную цепь от 1 до 30 атомов (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 атомов) в своем остове, т.е. длина линкера определяется как самое короткое соединение, измеренное числом атомов или связей между аматоксиновым фрагментом и антителом, при этом одна сторона остова линкера прореагировала с аматоксином, а другая сторона доступна для реакции или прореагировала с антителом. В контексте настоящего изобретения линкер, в частности, представляет собой С1-20-алкиленовую, C1-20-гетероалкиленовую, С2-20-алкениленовую, С2-20-гетероалкениленовую, С2-20-алкиниленовую, С2-20-гетероалкиниленовую, циклоалкиленовую, гетероциклоалкиленовую, ариленовую, гетероариленовую, аралкиленовую или гетероаралкиленовую группу, необязательно замещенную. Линкер может включать в себя один или несколько структурных элементов, таких как карбоксамид, сложный эфир, эфир, тиоэфир, дисульфид, мочевина, тиомочевина, углеводородные фрагменты и подобные. Линкер также может включать в себя комбинации двух или более из этих структурных элементов. Каждый из этих структурных элементов может быть представлен в линкере более чем один раз, например, два раза, три раза, четыре раза, пять раз или шесть раз. Согласно некоторым вариантам осуществления линкер может включать в себя дисульфидную связь. Следует учитывать, что линкер должен быть присоединен либо одной стадией, либо двумя или более последовательными стадиями к аматоксину и антителу. С этой целью данный линкер будет нести две группы, в частности, на проксимальном и дистальном концах, которые (i) могут образовывать ковалентную связь с группой, присутствующей в одном из компонентов, которые должны быть связаны, в частности, с активированной группой на аматоксине или связывающем мишень пептиде, или (ii) которые активируются или могут быть активированы для образования ковалентной связи с группой на аматоксине. Следовательно, предпочтительным является то, что химические группы находятся на дистальном и проксимальном конце линкера, что является результатом такой реакции сочетания, например, сложный эфир, эфир, уретан, пептидная связь и т.д.
Согласно конкретным вариантам осуществления линкер L представляет собой линейную цепь от 1 до 20 атомов, независимо выбранных из С, О, N и S, в частности, от 2 до 18 атомов, более конкретно от 5 до 16 атомов и еще более конкретно от 6 до 15 атомов. Согласно конкретным вариантам осуществления по меньшей мере 60% атомов в линейной цепи являются атомами С. Согласно конкретным вариантам осуществления атомы в линейной цепи связаны одинарными связями.
Согласно конкретным вариантам осуществления линкер L представляет собой алкиленовую, гетероалкиленовую, алкениленовую, гетероалкениленовую, алкиниленовую, гетероалкиниленовую, циклоалкиленовую, гетероциклоалкиленовую, ариленовую, гетероариленовую, аралкиленовую или гетероаралкиленовую группу, включающую в себя от 1 до 4 гетероатомов, выбранных из N, О и S, при этом указанный линкер необязательно является замещенным.
Термин «алкилен» относится к двухвалентным прямоцепочечным насыщенным углеводородным группам, имеющим от 1 до 20 атомов углерода, в том числе к группам, имеющим от 1 до 10 атомов углерода. Согласно некоторым вариантам осуществления алкиленовые группы могут быть группами низшего алкилена. Термин «низший алкилен» относится к алкиленовым группам, имеющим от 1 до 6 атомов углерода, а согласно некоторым вариантам осуществления - от 1 до 5 или от 1 до 4 атомов углерода. Примеры алкиленовых групп включают в себя без ограничения метилен (-CH2-), этилен (-СН2-СН2-), н-пропилен, н-бутилен, н-пентилен и н-гексилен.
Термин «алкенилен» относится к двухвалентным прямоцепочечным группам, имеющим от 2 до 20 атомов углерода, в которых по меньшей мере одна из связей углерод-углерод является двойной связью, тогда как другие связи могут быть одинарными связями или дополнительными двойными связями. Термин «алкинилен» в настоящем документе относится к группам, имеющим от 2 до 20 атомов углерода, в которых по меньшей мере одна из связей углерод-углерод является тройной связью, тогда как другие связи могут быть одинарными, двойными или дополнительными тройными связями. Примеры алкениленовых групп включают в себя этенилен (-СН=СН-), 1-пропенилен, 2-пропенилен, 1-бутенилен, 2-бутенилен, 3 бутенилен и подобные. Примеры алкиниленовых групп включают в себя этинилен, 1-пропинилен, 2-пропинилен и т д.
Используемый в настоящем документе термин «циклоалкилен» относится к двухвалентному кольцу, являющемуся частью любой стабильной моноциклической или полициклической системы, в которой такое кольцо имеет от 3 до 12 атомов углерода, но не гетероатом, и в которой такое кольцо является полностью насыщенным, а термин «циклоалкенилен» относится к двухвалентному кольцу, являющемуся частью любой стабильной моноциклической или полициклической системы, в которой такое кольцо имеет от 3 до 12 атомов углерода, но не гетероатом, и в которой такое кольцо является по меньшей мере частично ненасыщенным (но исключая любое ариленовое кольцо). Примеры циклоалкиленов включают в себя без ограничения циклопропилен, циклобутилен, циклопентилен, циклогексилен и циклогептилен. Примеры циклоалкениленов включают в себя без ограничения циклопентенилен и циклогексенилен.
Используемые в настоящем документе термины «гетероциклоалкилен» и «гетероциклоалкенилен» относятся к двухвалентному кольцу, являющемуся частью любой стабильной моноциклической или полициклической системы, в которой такое кольцо имеет от 3 до приблизительно 12 атомов, и в которой такое кольцо состоит из атомов углерода и по меньшей мере одного гетероатома, в частности, по меньшей мере одного гетероатома, независимо выбранного из группы, состоящей из N, О и S, при этом гетероциклоалкилен относится к такому кольцу, которое является полностью насыщенным, а гетероциклоалкенилен относится к такому кольцу, которое является по меньшей мере частично ненасыщенным (но исключая любое ариленовое или гетероариленовое кольцо).
Термин «арилен» означает двухвалентное кольцо или кольцевую систему, являющиеся частью любой стабильной моноциклической или полициклической системы, в которой такие кольцо или кольцевая система имеют от 3 до 20 атомов углерода, но не имеют гетероатом, при этом кольцо или кольцевая система состоит из ароматического фрагмента, как определяется правилом «4n+2» π-электронов, в том числе фенилена.
Используемый в настоящем документе, термин «гетероарилен» относится к двухвалентным кольцу или кольцевой системе, являющимся частью любой стабильной моноциклической или полициклической системы, в которой такие кольцо или кольцевая система имеют от 3 до 20 атомов, при этом кольцо или кольцевая система состоит из ароматического фрагмента, как определяется правилом «4n+2» π-электронов, и содержит атомы углерода и один или несколько гетероатомов азота, серы и/или кислорода.
В контексте настоящего изобретения термин «замещенный» означает указание того, что один или несколько водородов, присутствующих в остове линкера, замещаются с выбором из указанной группы(групп), при условии, что указанная нормальная валентность атома или таковая соответствующего атома группы, которая является замещенной, не превышается, и что замещение приводит к стабильному соединению. Термин «необязательно замещенный» означает, что линкер является либо незамещенным, либо замещенным, как определено в настоящем документе, одним или несколькими заместителями, определяемыми в настоящем документе. Когда заместителем является кето- (или оксо-, т.е. =O) группа, тио- или иминогруппа или подобные, то два водорода на линкерном остове заменяются. Иллюстративные заместители включают в себя, например, алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, гетероарил, аралкил, гетероаралкил, ацил, ароил, гетероароил, карбоксил, алкокси, арилокси, ацилокси, ароилокси, гетероароилокси, алкоксикарбонил, галоген, сложный (тио)эфир, циано, фосфорил, амино, имино, (тио)амидо, сульфгидрил, алкилтио, ацилтио, сульфонил, сульфат, сульфонат, сульфамоил, сульфонамидо, нитро, азидо, галогеналкил, в том числе перфторалкил (такой как трифторметил), галогеналкокси, алкилсульфанил, алкилсульфинил, ал кил сульфонил, алкилсульфониламино, арилсульфоноамино, фосфорил, фосфат, фосфонат, фосфинат, алкилкарбокси, алкилкарбоксиамид, оксо, гидрокси, меркапто, амино (необязательно моно- или дизамещенный, например, алкилом, арилом, или гетероарилом), имино, карбоксамид, карбамоил (необязательно моно- или дизамещенный, например, алкилом, арилом, или гетероарилом), амидино, аминосульфонил, ациламино, ароиламино, (тио)уреидо, (арилтио)уреидо, алкил(тио)уреидо, циклоалкил(тио)уреидо, арилокси, аралкокси или -O(СН2)n-ОН, -O(CH2)n-NH2, -O(СН2)nCOOH, -(СН2)nCOOH, -C(O)O(CH2)nR, -(CH2)nN(H)C(O)OR или -N(R)S(O)2R, в которых n равняется 1-4, и R независимо выбран из водорода, -алкила, -алкенила, -алкинила, -циклоалкила, -циклоалкенила, -(С-связанного-гетероциклоалкила), -(С-связанного-гетероциклоалкенила), -арила и -гетероарила, с возможностью множественных степеней замещения. Специалисту в данном области будет понятно, что заместители, такие как гетероциклоалкил, арил, гетероарил, алкил и т.д., или функциональные группы, такие как -ОН, -NHR и т.д., могут сами по себе быть замещены, если необходимо. Также специалисту в данной области понятно, что замещенные фрагменты сами по себе могут быть также замещены, если необходимо.
Согласно конкретным вариантам осуществления линкер L включает в себя фрагмент, выбранный из одного из следующих фрагментов: дисульфидный (-S-S-), эфирный (-O-), тиоэфирный (-S-), аминовый (-NH-), сложноэфирный (-O-С(=O)- или -С(=O)-O-), карбоксамидный (-NH-C(=O)- или -C(=O)-NH-), уретановый (-NH-C(=O)-O- или -O-C(=O)-NH-) и мочевинный фрагмент (-NH-C(=O)-NH-).
Согласно конкретным вариантам осуществления настоящего изобретения линкер L включает в себя число m групп, выбранный из перечня: алкиленовая, алкениленовая, алкиниленовая, циклоалкиленовая, гетероалкиленовая, гетероалкениленовая, гетероалкиниленовая, гетероциклоалкиленовая, ариленовая, гетероариленовая, аралкиленовая и гетероаралкиленовая группа, при этом каждая группа необязательно может быть независимо замещена, линкер, кроме того, включает в себя число n фрагментов, независимо выбранных из одного из следующих фрагментов: дисульфидный (-S-S-), эфирный (-O-), тиоэфирный (-S-), аминовый (-NH-), сложноэфирный (-O-С(=O)- или -С(=O)-O-), карбоксамидный (-NH-C(=O)- или -C(=O)-NH-), уретановый (-NH-C(=O)-O- или -O-C(=O)-NH-) и мочевинный фрагмент (-NH-C(=O)-NH-), при этом m=n+1. Согласно конкретным вариантам осуществления m равняется 2, и n равняется 1, или m равняется 3, и n равняется 2. Согласно конкретным вариантам осуществления линкер включает в себя 2 или 3 незамещенных алкиленовых группы и 1 или 2, соответственно, дисульфидных, эфирных, тиоэфирных, аминовых, сложноэфирных, карбоксамидовых, уретановых или мочевинных фрагмента, связывающих незамещенные алкиленовые группы.
Согласно конкретному варианту осуществления линкер L не содержит гетероариленовую группу.
Согласно конкретным вариантам осуществления атомы С в линейной цепи являются независимо частью необязательно замещенных метиленовых групп (-СН2-). Согласно таким конкретным вариантам осуществления необязательные заместители независимо выбраны из галогена и C1-6-алкила, в частности, метила.
Согласно конкретным вариантам осуществления линкер L представляет собой стабильной линкер.
В контексте настоящего изобретения термин «стабильной линкер» относится к линкеру, который является стабильным (i) в присутствии ферментов и (ii) во внутриклеточной восстановительной среде.
Согласно конкретным вариантам осуществления стабильный линкер не содержит (i) расщепляемую ферментом подструктуру и/или (ii) дисульфидную группу. Согласно таким конкретным вариантам осуществления линкер имеет в длину до 12 атомов, в частности, от 2 до 10, более конкретно от 4 до 9 и наиболее конкретно от 6 до 8 атомов.
Согласно другим конкретным вариантам осуществления линкер представляет собой расщепляемый линкер.
В контексте настоящего изобретения термин «расщепляемый линкер» относится к (i) линкеру, который расщепляется ферментом, или (ii) восстанавливающемуся линкеру. Согласно конкретным вариантам осуществления термин относится исключительно к линкеру, который расщепляется ферментом (а не к восстанавливающемуся линкеру).
В контексте настоящего изобретения термин «линкер, который является расщепляемым … ферментом» относится к линкеру, который может быть расщеплен ферментом, в частности, лизосомальной пептидазой, такой как катепсин В, что приводит в результате к внутриклеточному высвобождению токсинового груза, конъюгированного с нацеливающимся антителом, после интернализации (см. Dubowchik et al., Bioconjug Chem. 13 (2002) 855-69). Согласно конкретным вариантам осуществления расщепляемый линкер включает в себя дипептид, выбранный из Phe-Lys, Val-Lys, Phe-Ala, Val-Ala, Phe-Cit и Val-Cit, в частности, при этом расщепляемый линкер дополнительно включает в себя п-аминобензиловый (РАВ) спейсер между дипептидами и аматоксином.
Согласно таким конкретным вариантам осуществления расщепляемый линкер включает в себя структуру L1-L*-L2, в которой L* представляет собой п-аминобензиловый дипептидный фрагмент, L1 представляет собой часть линкера, которая соединяет L* с аматоксином, в частности, в которой L1 соединяется с L* через -NH- или -О- группу, в частности, группу -C(=O)-NH-,-C(=O)-NH-O- или -С(=O)-O-, и в которой L2 представляет собой часть линкера, которая соединяет L* со связывающимся с мишенью фрагментом, в частности, в которой L2 соединяется с L* через фрагмент -(СН2)m-, при этом m является целым числом, выбранным из 1-8, в частности, 1-5, или через фрагмент -(СН2-СН2О)n-, при этом n является целым числом, выбранным из 1-3, в частности, 1-2. Например, в случае расщепляемого линкера, включающего в себя дипептид Val-Ala, структура L1-L*-L2 является следующей
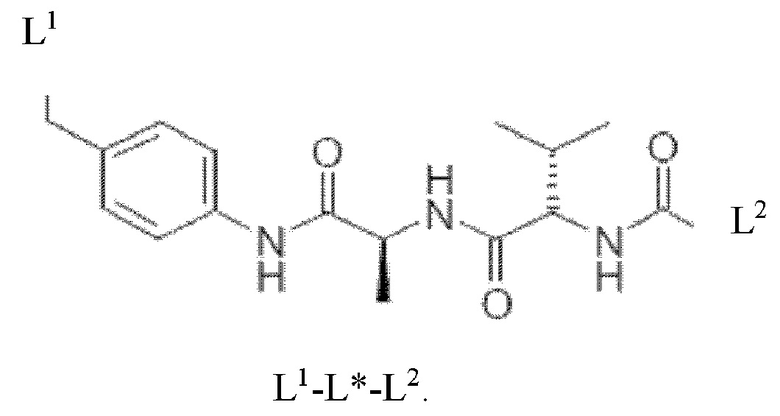
Согласно другим таким конкретным вариантам осуществления L* включает в себя дипептид Val-Lys и характеризуется следующей структурой
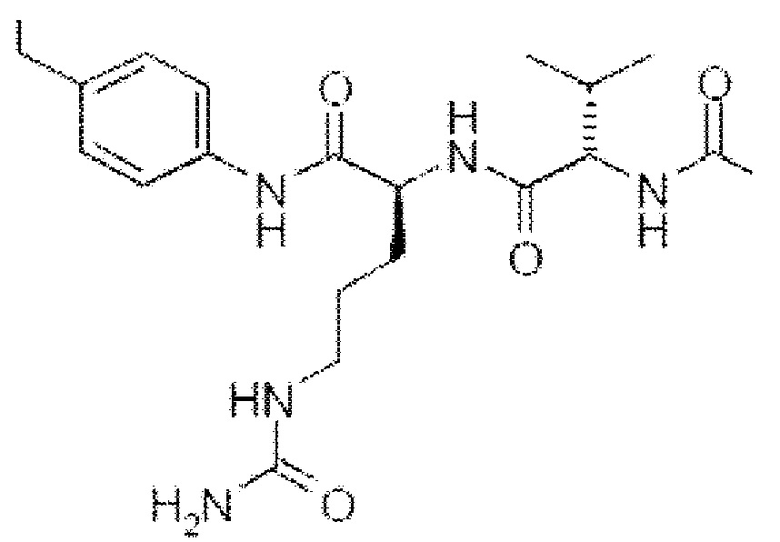
Согласно конкретным вариантам осуществления линкер L1 представляет собой линейную цепь от 1 до 4 атомов, независимо выбранных из С, О, N и S, в частности, от 1 до 3 атомов, более конкретно от 1 до 2 атомов и конкретнее только 1 атома. Согласно конкретным вариантам осуществления по меньшей мере 50% атомов в линейной цепи являются атомами С. Согласно конкретным вариантам осуществления атомы в линейной цепи связаны одинарными связями. Согласно конкретному варианту осуществления L представляет собой группу -NH- или -О-, которая является частью аматоксина. Согласно конкретным вариантам осуществления L1 представляет собой группу -О-, происходящую из гидроксигруппы, присоединенной в положении 4', 5', 6' или 7' центрального триптофанового фрагмента. Согласно конкретным вариантам осуществления L1 представляет собой группу -О-, происходящую из гидроксильной группы, являющейся частью карбоновокислотной группы аминокислотного остатка 1 аманинового производного в соответствии с настоящим изобретением. Согласно конкретным вариантам осуществления L1 представляет собой группу -NH-, происходящую из аминогруппы, являющейся частью карбоксамидной группы аминокислотного остатка 1 аманинамидного производного в соответствии с настоящим изобретением. Согласно конкретным вариантам осуществления L1 представляет собой группу -О-, происходящую из гидроксильной группы, являющейся частью аминокислотного остатка 3 аманинового или аманинамидного производного в соответствии с настоящим изобретением.
В контексте настоящего изобретения термин «восстанавливающийся линкер» относится к линкеру, который может быть расщеплен во внутриклеточной восстанавливающей среде, в частности, к линкеру, который содержит дисульфидные группы, что приводит в результате к внутриклеточному высвобождению токсинового груза, конъюгированного со связывающимся с мишенью фрагментом, после интернализации с помощью внутриклеточной восстанавливающей среды (см. Shen et al., J. Biol. Chem. 260 (1985) 10905-10908). Согласно конкретным вариантам осуществления восстанавливающийся линкер включает в себя фрагмент
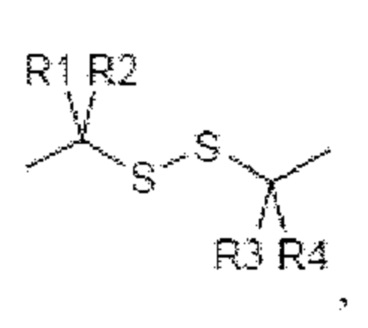
в котором R1 - R4 независимо выбраны из Н и метила.
Согласно таким конкретным вариантам осуществления такой расщепляемый линкер имеет в длину до 20 атомов, в частности, от 6 до 18, более конкретно от 8 до 16 и наиболее конкретно от 10 до 15 атомов. Согласно таким конкретным вариантам осуществления часть линкера, связывающего аматоксин в соответствии с настоящим изобретением и расщепляемую дисульфидную группу, представляет собой линейную цепь из 3 или 4 атомов, в частности, из 3 атомов С. Согласно конкретным вариантам осуществления 3 или 4 атома С в линейной цепи связаны одинарными связями. Согласно конкретным вариантам осуществления линкер представляет собой н-пропиленовую группу.
Согласно конкретным вариантам осуществления указанный линкер присутствует и присоединяется на одной стороне к гидроксильной группе, присоединенной к фенильному кольцу центрального триптофанового фрагмента, т.е. к 4', 5' или 7' гидроксизаместителю.
Согласно другим конкретным вариантам осуществления указанный линкер присутствует и присоединяется на одной стороне в положении производного аманитина в соответствии с настоящим изобретением, при этом указанное положение выбрано
(i) в случае S-дезокси-4'-гидрокси-аманинамида, 4'-гидрокси-аманинамида, S-дезокси-5'-гидрокси-аманинамида, 5'-гидрокси-аманинамида, S-дезокси-7'-гидрокси-аманинамида и 7'-гидрокси-аманинамида из атома азота карбоксамидной группы по γ С-атому аминокислоты 1 аматоксина (амидная связь);
(ii) в случае S-дезокси-4'-гидрокси-аманина, 4'-гидрокси-аманина, S-дезокси-5'-гидрокси-аманина, 5'-гидрокси-аманина, S-дезокси-7'-гидрокси-аманина, Т-гидрокси-аманина из атома кислорода кислотной группы по γ С-атому аминокислоты 1 аматоксина (сложноэфирная связь);
(iii) в случае производного аманитина в соответствии с настоящим изобретением, в котором фрагмент свободной карбоновой кислоты аминокислоты 1 был превращен во фрагмент -C(=O)NH-OR1, из атома кислорода группы гидроксамовой кислоты по γ С-атому аминокислоты 1 аматоксина;
(iv) из атома кислорода гидроксигруппы по δ С-атому аминокислоты 3 аматоксина, в частности, через сложноэфирную связь, эфирную связь или уретановую связь; или
(v) из азота кольца аминокислоты 4.
Соединение линкера со связывающимся с мишенью фрагментом может быть достигнуто рядом способов, хорошо известных рядовому специалисту в данной области, в частности, в области конъюгатов антитело-лекарственное средство (ADC).
Согласно конкретным вариантам осуществления указанный линкер соединяется со связывающимся с мишенью фрагментом через мочевинный фрагмент (…-линкер-NH-С(=O)-NH-связывающийся с мишенью фрагмент). Согласно таким конкретным вариантам осуществления мочевинный фрагмент является результатом реакции первичного амина, первоначально присутствующего в связывающемся с мишенью фрагменте, такого как аминогруппа боковой цепи лизина, с производным карбаминовой кислоты … -линкер-NH-C(O)-Z, в котором Z представляет собой уходящую группу, которая может быть заменена первичным амином.
Согласно другим конкретным вариантам осуществления указанный линкер присутствует и соединяется со связывающимся с мишенью фрагментом через тиоэфирный фрагмент (…-линкер-S-связывающийся с мишенью фрагмент). Таким образом, согласно таким вариантам осуществления настоящее изобретение относится к конъюгату общей формулы:
аманитин-L-X*-S-Tbm,
в которой аманитин представляет собой производное аманитина в соответствии с настоящим изобретением, L представляет собой линкер, X* представляет собой фрагмент, полученный в результате соединения тиольной группы с тиол-реакционноспособной группой, S представляет собой атом серы указанной тиольной группы, в частности, тиольной группы остатка аминокислоты цистеина, и Tbm представляет собой связывающийся с мишенью фрагмент, в частности, антитело или функциональный фрагмент антитела, включающие в себя указанный остаток аминокислоты цистеина. Согласно конкретным вариантам осуществления указанный остаток аминокислоты цистеина (i) располагается в домене антитела, выбранном из CL, CH1, СН2 и СН3; (ii) располагается в положении, в котором последовательность зародышевой линии, демонстрирующая самую близкую гомологию с последовательностью указанного домена антитела, содержит аминокислотный остаток, отличный от цистеина; и (iii) располагается в положении, которое подвергается воздействию растворителя.
В контексте настоящего изобретения термин «тиол-реакционноспособная группа» относится к группе, которая селективно реагирует с тиольной группой, например, свободного цистеина в антителе, в частности, при значении рН в диапазоне от 6,0 до 8,0, более конкретно при значении рН в диапазоне от 6,5 до 7,5. В частности, термин «селективно» означает, что менее чем 10% реакций сочетания молекулы, включающей в себя тиол-реакционноспособную группу, с антителом, включающим в себя по меньшей мере один остаток свободного цистеина, являются реакциями сочетания с остатками, не являющимися цистеиновыми, в антителе, такими как лизиновые остатки, в частности, менее чем 5%, более конкретно менее чем 2%. Согласно конкретным вариантам осуществления тиол-реакционноспособная группа выбрана из бромацетамида, йодацетамида, малеимида, малеимида, имеющего уходящую группу в положении 3, в частности, уходящую группу, выбранную из -Br и замещенного тиола (см., например, патент США №9295729), 1,2-дигидропиридазин-3,6-диона, имеющего уходящую группу в положении 4, в частности, уходящую группу, выбранную из -Br и замещенного тиола (см., например, патент США №9295729), метилсульфонилбензотиазола, метилсульфонилфенилтетразола, метилсульфонилфенилоксадиазола (см. Toda et al., Angew. Chem. Int. Ed. Engl., 52 (2013) 12592-6), 3-арилпропионитрила (см. Kolodych et al, Bioconjugate Chem. 2015, 26, 197-200) и 5-нитро-пиридин-2-ил-дисульфида (…-L-S-S-(5-нитро-пиридин-2-ила).
Согласно конкретным вариантам осуществления указанные положение или функциональная группа, которые на одной стороне соединяются с линкером и которые могут непосредственно или опосредованно соединяться с положением или функциональной группой, присутствующими в связывающемся с мишенью фрагменте, представляют собой фрагмент, который может реагировать с двумя тиольными группами, присутствующими в одном связывающемся с мишенью фрагменте или в двух связывающихся с мишенью фрагментах. Согласно конкретным вариантам осуществления тиол-реакционноспособные группы представляют собой малеимид, имеющий две уходящие группы в положениях 3 и 4, в частности, выбранные из 3,4-диброммалеимида, 3,4-бис(арилтио)-малеимида, в частности, 3,4-дифенилтио-малеимида и 3,4-бис(гетероарилтио)-малеимида, в частности, 3,4-бис(2-пиридинил-сульфанил)-малеимида. Согласно другим конкретным вариантам осуществления тиол-реакционноспособные группы представляют собой 1,2-дигидропиридазин-3,6-дион, имеющий две уходящие группы в положениях 4 и 5, в частности, выбранный из 4,5-бром-1,2-дигидропиридазин-3,6-диона, 4,5-бис(арилтио)-1,2-дигидропиридазин-3,6-диона, в частности, 4,5-дифенилтио-1,2-дигидропирид азин-3,6-диона и 4,5 -бис(гетероарилтио)-1,2-дигидропирид азин-3,6-диона, в частности, 4,5-бис(2-пиридинил-сульфанил)-1,2-дигидропиридазин-3,6-диона.
Согласно конкретным вариантам осуществления фрагмент, получающийся в результате сочетания тиольной группы с тиол-реакционноспособной группой, выбран из тиол-замещенного ацетамида; тиол-замещенного сукцинимида; тиол-замещенной сукцинамовой кислоты; тиол-замещенного гетероарила, в частности, тиол-замещенного бензотиазола, тиол-замещенного фенилтетразола и тиол-замещенного фенилоксадиазола и дисульфида, в котором один атом серы происходит из цистеинового остатка антитела. Согласно конкретным вариантам осуществления фрагмент, получающийся в результате сочетания тиольной группы с тиол-реакционноспособной группой, представляет собой тиол-замещенный сукцинимид.
Согласно конкретным вариантам осуществления линкер L во фрагменте L-X*-S, присутствующий в общей формуле абзаца [00101], выбран из следующей группы фрагментов:
(сторона аманитина) -(CH2)2-S-S-(CH2)2-X-S- (сторона Tbm);
(сторона аманитина) -(CH2)3-S-S-(CH2)2-X-S- (сторона Tbm);
(сторона аманитина) -(CH2)2-S-S-(CH2)3-X-S- (сторона Tbm);
(сторона аманитина) -(CH2)3-S-S-(CH2)3-X-S- (сторона Tbm);
(сторона аманитина) -(CH2)4-S-S-(CH2)4-X-S- (сторона Tbm);
(сторона аманитина) -(CH2)2-CMe2-S-S-(CH2)2-X-S- (сторона Tbm);
(сторона аманитина) -(CH2)2-S-S-CMe2-(CH2)2-X-S- (сторона Tbm);
(сторона аманитина) -(CH2)3-S-S- (сторона Tbm);
(сторона аманитина) -CH2-C6H4-NH-Cit-Val-CO(CH2)5-X-S- (сторона Tbm)
(сторона аманитина) -CH2-C6H4-NH-Ala-Val-CO(CH2)5-X-S- (сторона Tbm);
(сторона аманитина) -CH2-C6H4-NH-Ala-Val-CO(CH2)2-X-S- (сторона Tbm);
(сторона аманитина) -CH2-C6H4-NH-Ala-Phe-CO(CH2)2-X-S- (сторона Tbm);
(сторона аманитина) -CH2-C6H4-NH-Lys-Phe-CO(CH2)2-X-S- (сторона Tbm);
(сторона аманитина) -CH2-C6H4-NH-Cit-Phe-CO(CH2)2-X-S- (сторона Tbm);
(сторона аманитина) -CH2-C6H4-NH-Val-Val-CO(CH2)2-X-S- (сторона Tbm);
(сторона аманитина) -CH2-C6H4-NH-Ile-Val-CO(CH2)2-X-S- (сторона Tbm);
(сторона аманитина) -CH2-C6H4-NH-His-Val-CO(CH2)2-X-S- (сторона Tbm);
(сторона аманитина) -CH2-C6H4-NH-Met-Val-CO(CH2)2-X-S- (сторона Tbm);
(сторона аманитина) -CH2-C6H4-NH-Asn-Lys-CO(CH2)2-X-S- (сторона Tbm);
в которых -NH- и -СО-, фланкирующие дипептидные последовательности, представляют амино и карбонильные фрагменты линкера, образующие амидные связи с карбокси- и амино-концами дипептида, соответственно.
В контексте настоящего изобретения термин «фрагмент, получающийся в результате сочетания тиольной группы с тиол-реакционноспособной группой» относится к структуре, которая образуется в результате (i) нуклеофильного замещения уходящей группы Y, присутствующей в тиол-реакционноспособной группе, атомом серы цистеинового остатка, например, бромацетамидная группа, йодацетамидная, 4,6-дихлор-1,3,5-триазин-2-иламиногруппа, алкилсульфон или гетероарилсульфон; (ii) добавления HS-группы цистеинового остатка к активированной двойной связи тиол-реакционноспособной группы, например, малеимид, или (iii) дисульфидного обмена активированного дисульфида или метантиосульфоната на атом серы цистеинового остатка, например, на пиридин-2-тиол, 5-нитропиридин-2-тиол или метансульфинат в качестве уходящей группы; или (iv) любой другой химической реакции, которая дает стабильную связь между атомом серы цистеинового остатка и реакционноспособным фрагментом, являющимся частью тиол-реакционноспособной группы.
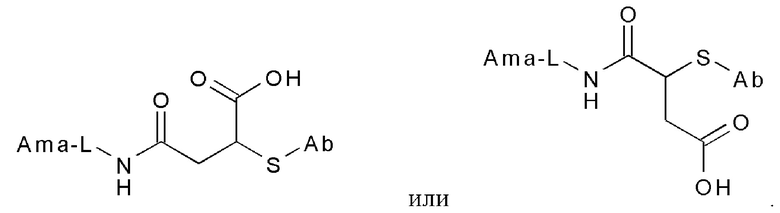
Первоначальный фрагмент, получающийся в результате сочетания тиольной группы, может быть необязательно далее дериватизирован, например, сукцинимидиловый тиоэфир, получающийся из малеимида, может быть гидролизован до тиоэфиров сукцинамовой кислоты со следующими общими структурами
Согласно другим конкретным вариантам осуществления сайт-специфическое сочетание может быть достигнуто путем восстановления дисульфидного мостика, присутствующего в связывающемся с мишенью фрагменте, и путем осуществления реагирования двух цистеиновых остатков с мостиковым фрагментом X*, присутствующим в конструкции аманитин-L-X* (см. Badescu et al. Bridging disulfides for stable and defined antibody drug conjugates. Bioconjugate Chemistry. 25 (2014) 1124-1136).
Согласно подобному варианту осуществления сайт-специфическое сочетание может быть достигнуто путем восстановления дисульфидного мостика, присутствующего в связывающемся с мишенью фрагменте, и путем осуществления реагирования двух цистеиновых остатков с мостиковым фрагментом X*, присутствующим в конструкции аманитин-L-X*, в частности, в которой X* представляет собой
(см. Bryden et al., Bioconjug Chem, 25 (2014) 611-617; Schumacher et al., Org Biomol Chem, 2014, 7261-7269).
Согласно другому конкретному варианту осуществления сочетание достигают путем региоспецифического сочетания аминогруппы, присутствующей в линкере, с глутаминовым остатком, присутствующим в связывающемся с мишенью фрагменте, посредством трансаминазы, в частности, путем сочетания с глутамином Q295 антитела.
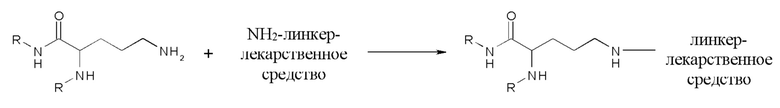
Согласно конкретному варианту осуществления сочетание достигают путем сайт-специфической конъюгации со связывающимися с мишенью фрагментами, включающими в себя N-гликановые боковые цепи. В частности, N-гликановая боковая цепь может быть разложена ферментативно, с последующим транс-гликозилированием с азидо-галактозой. С использованием клик-химии такой модифицированный связывающийся с мишенью фрагмент может быть соединен с соответствующим образом модифицированными конструкциями аманитин-L-X*, в которых X* представляет собой, например, дибензо-циклооксин (DIBO), или аналогичным фрагментом, включающим в себя тройную связь С-С. Например, конструкция аманитин-L-NH2 может быть соединена с DIBO-SE,
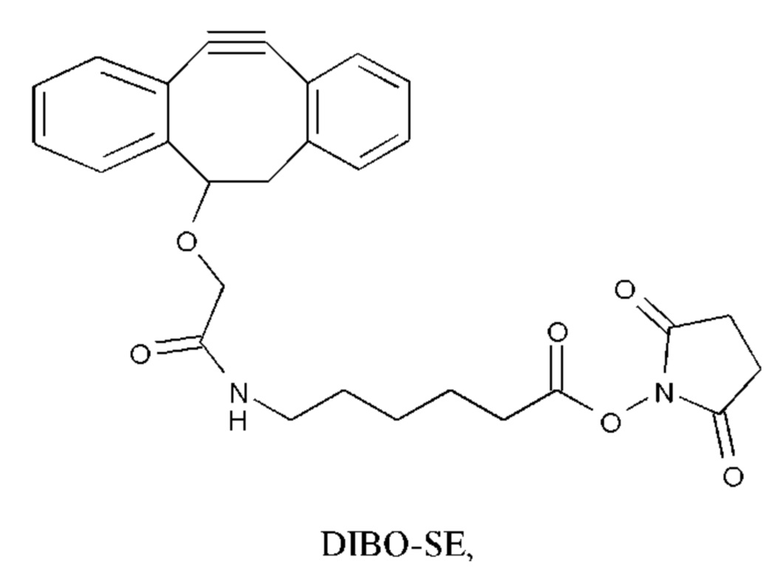
путем нуклеофильного замещения гидроксисукцинимидного фрагмента. Полученная в результате DIBO-модифицированная линкерная конструкция затем может быть соединена с упомянутым выше азидопроизводным. Согласно альтернативному варианту осуществления связывающийся с мишенью фрагмент может быть модифицирован путем включения не встречающейся в природе аминокислоты, которая допускает клик-химию, в частности, путем включения пара-азидометил-L-фенилаланина (pAMF).
Согласно конкретным вариантам осуществления линкер L в -L-X* представляет собой линейную цепь из по меньшей мере 5, в частности, по меньшей мере 10, более конкретно от 10 до 20 атомов, независимо выбранных из С, О, N и S, в частности, от 10 до 18 атомов, более конкретно от 10 до 16 атомов и еще более конкретно от 10 до 15 атомов. Согласно конкретным вариантам осуществления по меньшей мере 60% атомов в линейной цепи являются атомами С. Согласно конкретным вариантам осуществления атомы в линейной цепи связываются одинарными связями.
Согласно альтернативным вариантам осуществления положение или функциональная группа, которые непосредственно или опосредованно могут быть присоединены к положению или функциональной группе, присутствующим в связывающемся с мишенью фрагменте, не представляют собой этинильную группу, или, в более широком смысле, не представляют собой алкинильную группу, или не представляют собой группу, которая может быть введена в реакцию с 1,3-диполем в 1,3-диполярном циклоприсоединении (клик-химии).
Согласно другим конкретным вариантам осуществления сайт-специфическое сочетание конструкции аманитин-L-X* со связывающимся с мишенью фрагментом может быть достигнуто путем включения не встречающейся в природе аминокислоты, включающей в себя кетогруппу, в частности, п-ацетилфенилаланина (pAcPhe), в связывающийся с мишенью фрагмент, и путем осуществления реагирования такого модифицированного связывающегося с мишенью фрагмента с конструкцией аманитин-L-X*, в которой X* представляет собой гидроксиламиновый фрагмент.
Согласно следующему варианту осуществления формильная группа может быть введена путем образующего формилглицин фермента (FGE), который является высокоселективным в отношении цистеиновой группы в распознавании последовательности CxPxR с образованием альдегидной метки. Такая альдегидная метка может быть введена в реакцию с соответствующей группой X*, присутствующей в конструкции аманитин-L-X*, в частности, в которой X* представляет собой
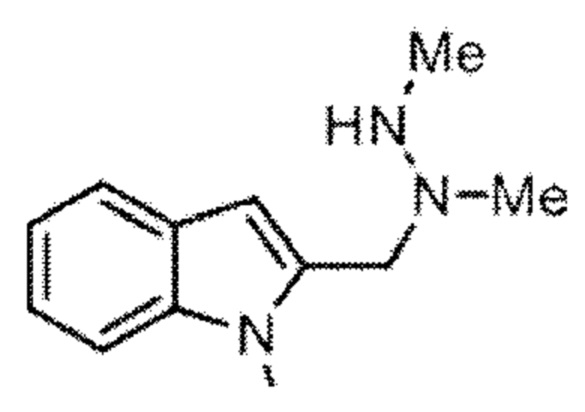
(см. Agarwal et al., Bioconjugate Chem 24 (2013) 846-851).
Согласно второму аспекту настоящее изобретение относится к фармацевтической композиции, включающей в себя конъюгат в соответствии с настоящим изобретением.
Согласно третьему аспекту настоящее изобретение относится к конъюгату в соответствии с настоящим изобретением для применения в лечении злокачественной опухоли у больного, в частности, при этом злокачественная опухоль выбрана из группы, состоящей из рака молочной железы, рака поджелудочной железы, холангиокарциномы, рака толстой и прямой кишки, рака легкого, рака предстательной железы, рака яичника, рака желудка, рака почки, злокачественной меланомы, лейкоза и злокачественной лимфомы.
Используемые в настоящем документе термины «лечить», «лечащий» или «лечение» заболевания или расстройства означает одно или несколько из следующего: (а) уменьшение тяжести расстройства; (b) ограничение или предупреждение развития характерных симптомов расстройства(расстройств), которое лечат; (с) ингибирование ухудшения характерных симптомов расстройства(расстройств), которое лечат; (d) ограничение или предупреждение рецидива расстройства(расстройств) у больных, которые ранее имели расстройство(а); и (е) ограничение или предупреждение рецидива симптомов у больных, которые ранее имели симптомы расстройства(расстройств).
Используемый в настоящем документе термин «лечение» может предусматривать введение конъюгата или фармацевтической композиции в соответствии с настоящим изобретением больному, при этом «введение» включает в себя in vivo введение, а также введение непосредственно в ткань ex vivo, например, в венозные трансплантаты.
Согласно конкретным вариантам осуществления используют терапевтически эффективное количество конъюгата в соответствии с настоящим изобретением.
Термин «терапевтически эффективное количество» представляет собой количество терапевтического средства, достаточное для достижения желаемой цели. Эффективное количество данного терапевтического средства будет варьировать в зависимости от факторов, таких как природа средства, путь введения, размер и вид животного, получающего терапевтическое средство, и цель введения. Эффективное количество в каждом отдельном случае может быть эмпирически определено специалистом в области техники в соответствии с установленными методами в уровне техники.
Согласно другому аспекту настоящее изобретение относится к фармацевтической композиции, включающей в себя производное аманитина в соответствии с настоящим изобретением или конъюгат в соответствии с настоящим изобретением производного аманитина со связывающимся с мишенью фрагментом и дополнительно включающей в себя один или несколько фармацевтически приемлемых разбавителей, носителей, вспомогательных средств, наполнителей, связывающих средств, смазывающих средств, глидантов, дезинтегрирующих средств, адсорбентов и/или консервантов.
Термин «фармацевтически приемлемый» означает одобренный регуляторными органами Федерального или государственного правительства или перечисленный в Фармакопее США или другой общепринятой фармакопее для применения у животных и более конкретно у людей.
Согласно конкретным вариантам осуществления фармацевтическую композицию используют в форме системно вводимого лекарственного препарата. Она включает в себя парентеральные средства, которые включают в себя, среди прочего, инъекционные препараты и инфузии. Инъекционные препараты составляют или в форме ампул, или в виде так называемых готовых к применению инъекционных препаратов, например, готовых к применению шприцев или одноразовых шприцев, и, кроме этого, во флаконах с прокалываемой пробкой для многократного использования. Введение инъекционных препаратов может осуществляться в форме подкожного (s.c), внутримышечного (i.m.), внутривенного (i.v.) или внутрикожного (i.e.) применения. В частности, можно получать соответственно подходящие инъекционные составы в виде суспензии кристаллов, растворов, систем наночастиц или коллоидных диспергированных систем, таких как, например, гидрозоли.
Инъекционные составы, кроме того, могут быть получены в виде концентратов, которые могут быть растворены или диспергированы в водных изотоничных разбавителях. Инфузия также может быть получена в форме изотонических растворов, жирных эмульсий, липосомных составов и микроэмульсий. Подобно инъекционным препаратам, инфузионные составы также могут быть получены в форме концентратов для разбавления. Инъекционные составы также могут применяться в форме постоянных инфузий или в стационарной или в амбулаторной терапии, например, с помощью мини-помп.
Можно добавлять парентеральные составы лекарственных средств, например, альбумин, плазму, расширитель, поверхностно-активные вещества, органические разбавители, вещества, влияющие на рН, комплексообразующие вещества или полимерные вещества, в частности, в виде веществ, для воздействия на адсорбцию конъюгата связывающегося с мишенью фрагмента и токсина в соответствии с настоящим изобретением белками или полимерами, или они могут быть добавлены с целью снижения адсорбции конъюгатов связывающегося с мишенью фрагмента и токсина в соответствии с настоящим изобретением к материалам, таким как инъекционные средства или упаковочные материалы, например, пластик или стекло.
Производные аманитина в соответствии с настоящим изобретением, включающие в себя связывающийся с мишенью фрагмент, могут быть связаны с микроносителями или наночастицами в парентеральных препаратах, как, например, с мелкодиспергированными частицами на основе поли(мет)акрилатов, полилактатов, полигликолатов, полиаминокислот или полиэфируретанов. Парентеральные составы также могут быть модифицированы как препараты депо, например, на основе «системы доставки на основе множественных частиц», если конъюгаты связывающегося с мишенью фрагмента и токсина в соответствии с настоящим изобретением вводят в мелкодиспергированной, диспергированной и суспендированной форме, соответственно, или в виде суспензии кристаллов в лекарственном препарате или на основе «системы доставки на основе одной частицы», если конъюгат связывающегося с мишенью фрагмента и токсина в соответствии с настоящим изобретением заключают в состав, например, в таблетку или стержень, который впоследствии имплантируют. Такие имплантаты или лекарственные препараты депо в составах на основе одной частицы и множества частиц часто состоят из так называемых биоразлагаемых полимеров, как, например, сложные полиэфиры молочной кислоты и гликолевой кислоты, полиэфируретаны, полиаминокислоты, поли(мет)акрилаты или полисахариды.
Адъювантами и носителями, добавляемыми во время получения фармацевтических композиций в соответствии с настоящим изобретением, составляемых в виде парентеральных препаратов, предпочтительно являются aqua sterilisata (вода стерильная), вещества, влияющие на значение рН, как, например, органические или неорганические кислоты или основания, а также их соли, буферные вещества для регуляции значений рН, вещества для изотонизации, как, например, хлорид натрия, гидрокарбонат натрия, глюкоза и фруктоза, тенсиды и поверхностно-активные вещества, соответственно, и эмульгаторы, как, например, частичные сложные эфиры жирных кислот и полиоксиэтиленсорбитов (например, Tween®), или, например, сложные эфиры жирной кислоты и полиоксиэтиленов (например, Cremophor®), жирные масла, как, например, арахисовое масло, соевое масло или касторовое масло, синтетические сложные эфиры жирных кислот, как, например, этилолеат, изопропилмиристат и нейтральное масло (например, Miglyol), а также полимерные вспомогательные вещества, как, например, желатин, декстран, поливинилпирролидон, добавки, которые повышают растворимость органических растворителей, как, например, пропиленгликоль, этанол, N,N-диметилацетамид, пропиленгликоль или комплексообразующие вещества, как, например, цитрат и мочевина, консерванты, как, например, гидроксипропиловый сложный эфир и метиловый сложный эфир бензойной кислоты, бензиловый спирт, антиоксиданты, как, например, сульфит натрия, и стабилизаторы, как, например, EDTA.
При составлении фармацевтических композиций в соответствии с настоящим изобретением в виде суспензий согласно предпочтительному варианту осуществления добавляют загустители для предупреждения оседания конъюгатов связывающегося с мишенью фрагмента и токсина в соответствии с настоящим изобретением или тенсиды и полиэлектролиты для обеспечения ресуспендируемости осадков и/или комплексообразующие средства, как, например, EDTA. Также можно получать комплексы активного ингредиента с различными полимерами. Примерами таких полимеров являются полиэтиленгликоль, полистирол, карбоксиметилцеллюлоза, Pluronics® или сложные эфиры жирных кислот и полиэтиленгликоль сорбита. Конъюгаты связывающегося с мишенью фрагмента и токсина в соответствии с настоящим изобретением также могут быть включены в жидкие составы в форме соединений включения, например, с циклодекстринами. Согласно конкретным вариантам осуществления диспергирующие средства могут быть добавлены в виде дополнительных вспомогательных веществ. Для получения лиофилизатов могут быть использованы диспергирующие средства, такие как маннит, декстран, сахароза, человеческий альбумин, лактоза, PVP или множества желатинов.
ПРИМЕРЫ
Далее настоящее изобретение объясняется более подробно неограничивающими примерами.
А. Общий синтез S-дезокси-α-аманитина HDP 30.0735
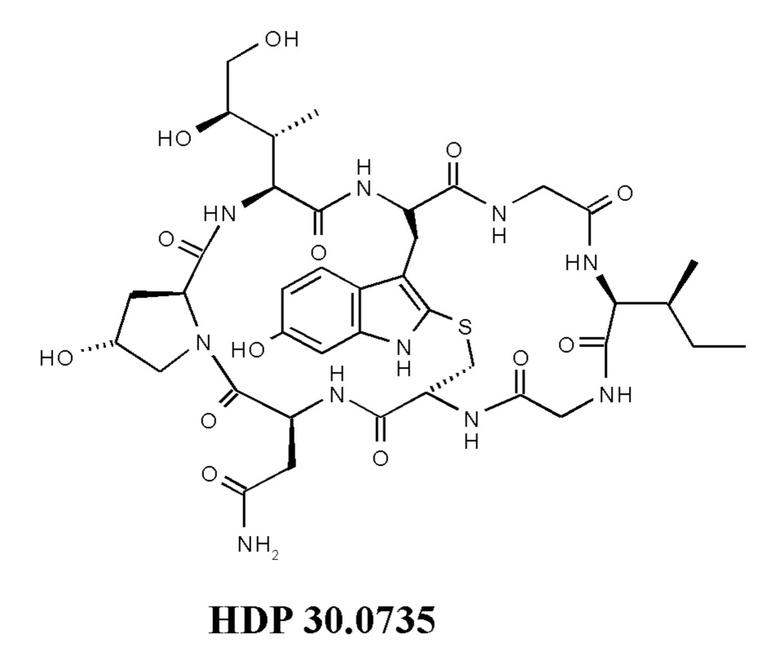
1. Получение N-(трет-бутоксикарбонил)-L-6-ацетокси-триптофана HDP 30.2550
590,0 мг (2,68 ммоль) 6-гидрокси-L-триптофана (CAS: 13567-14-1) суспендировали в смеси 30 мл 1,4-диоксана/воды 1:1 (объем/объем). Под аргоном добавляли 2,68 мл (2,68 ммоль) 1 н. NaOH один раз при окружающей температуре. Полученный в результате желтый раствор затем обрабатывали 574,6 мкл (2,68 ммоль) ангидрида Boc (Boc2O) и взбалтывали в течение 24 часов при комнатной температуре. Раствор подкисляли 1 н. хлористоводородной кислотой до рН 2,4 и экстрагировали 3 раза с 25 мл этилацетата. Объединенные экстракты этилацетата промывали насыщенным раствором NaCl и сушили над MgSO4. Фильтрация и выпаривание досуха давали 785,0 мг неочищенного материала. Неочищенный N-Вос-6-гидрокси-L-триптофан растворяли в 4,91 мл (4,91 ммоль) 1 H. NaOH и обрабатывали 463,2 мл (500,3 мг, 4,90 ммоль) уксусного ангидрида. Реакционную смесь взбалтывали в течение 3 часов под аргоном и подкисляли 5% лимонной кислотой. Водную фазу экстрагировали три раза с помощью 25 мл этилацетата, промывали насыщенным раствором NaCl и сушили над MgSO4. Фильтрация и выпаривание давали 635 мг неочищенного твердого вещества.
Неочищенный продукт очищали с помощью флэш-хроматографии в колонке с 330 г силикагеля (длина волны выявления 254 нм) с градиентом CH2Cl2 + 1% уксусной кислоты - CH2Cl2/МеОН (15:1) + 1% уксусной кислоты и после выпаривания с толуолом получали 564,4 мг (выход 56%) белого порошка.
MS (ESI-) - выявлено: 361,08 [М-Н]-; рассчитано: 362,15 (C18H22N2O6).
2. Получение цис,транс-1-(трет-бутоксикарбонил)-2-карбокси-3а-гидрокси-6-ацетокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индола, цис-HDP 30.2555 и транс-HDP 30.2555 (цис,транс-6-ацетокси-Hpi)
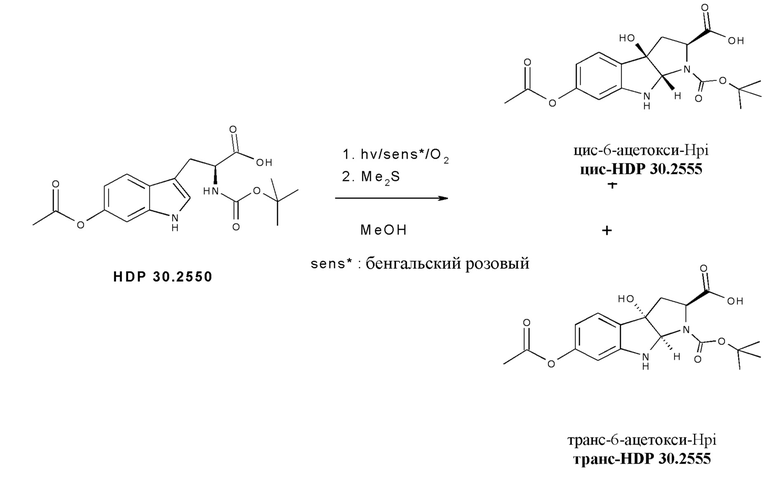
Фотоокисление
Фотоокисление осуществляли с натриевой лампой высокого давления 400 Вт (лампа Sinus X400, 230 В, 400 Вт; 55000 люмен на расстоянии 1,3 м) или, в качестве альтернативы, с вольфрам-галогеновой лампой (500 Вт). Использовали фильтрующий раствор (CuCl2-СаСО3), отсекающий свет с λ < 490 нм, для вольфрам-галогеновой лампы.
Использовали метиленовый синий или бенгальский розовый в качестве сенсибилизирующего красителя.
Реакцию осуществляли в 500-мл цилиндрическом реакционном сосуде с теплообменной рубашкой, сделанной из боросиликатного стекла DURAN®, с плоским дном и плоским лабораторным фланцем (DN) с двумя соединителями с нитью GL 18. Расстояние от лампы до реакционного сосуда составляло 15 см, а реакционная температура находилась в диапазоне 3-4°С.
Конечный продукт очищали на системе для флэш-хроматографии Teledyne ISCO с колонкой Silica Redi Sept Flash 330 г (№ по каталогу Teledyne ISCO 69-2203-330). Растворители CH2Cl2, СН3ОН, СН3СООН имели стандартную чистоту для HPLC или ВР.
Сухой кислород (99,5% чистоты) барботировали через реакционную смесь со скоростью 2-4 л в минуту.
943,0 мг (2,60 ммоль) N-(трет-бутоксикарбонил)-L-6-ацетокси-триптофана HDP 30.2550 и 100 мг бенгальского розового растворяли в 500 мл метанола и охлаждали до 3°C с использованием криостата Хубера с гликолем/водой в качестве охлаждающей среды. Реакционный раствор освещали натриевой лампой высокого давления 400 Вт. В ходе освещения медленный поток кислорода барботировали через реакционный раствор. После 5 часов освещения окисление и охлаждение останавливали и реакционную среду обрабатывали 10 мл диметилсульфида. Смесь взбалтывали в течение 2 часов и выпаривали досуха с использованием роторного выпаривателя с температурой водяной бани 35°С. Темно-красный остаток дополнительно сушили в высоком вакууме до 1,20 г кристаллического твердого вещества. Неочищенный продукт очищали в колонке с 330 г силикагеля (длина волны выявления 254 нм) с градиентом CH2Cl2 + 5% уксусной кислоты - CH2Cl2/МеОН (30:1) + 5% уксусной кислоты. 380 мг цис-HDP 30.2555 и 290 мг транс-HDP 30.2555 элюировали и выпаривали совместно с толуолом. После лиофилизации в трет-бутаноле оба изомера получали в виде грязно-белых порошков.
Цис-1-(трет-бутоксикарбонил)-2-карбокси-3а-гидрокси-6-ацетокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индол (цис-HDP 30.2555)
380 мг цис-HDP 30.2555, выход: 39%.
1H-ЯМР (400 МГц, CD3OD, δ = ppm)
δ = 1,22, 1,44, 1,54 [s, 9H, С(СН3)3]; 2,23 (s, 3H, ОСОСН3); 2,46-2,63 (m, 2H, CH2); 4,14-4,29 (m, 1H, 2-H); 5,35 (s, 1H, 8a-H); 6,39-6,46 (m, 2H, 7-H, 5-H); 7,20-7,24 (m, 1H, 4-H).
13С-ЯМР (100 МГц, CD3OD, δ = ppm)
δ = 20,93, 28,45, 31,12, 42,80, 61,12, 69,44, 82,21, 85,82, 87,93, 104,97, 112,98, 124,84, 129,42, 151,51, 154,04, 155,97, 171,34, 175,79.
MS (ESI+) - выявлено: 378,92 [МН]+; рассчитано: 378,14 (C18H22N2O7).
MS (ESI+) - выявлено: 401,17 [M+Na]+; рассчитано: 401,14 (C18H22N2NaO7).
UV/VIS (СН3ОН): λmax = 296 нМ, 23 9 нМ, 215 нМ.
λmin = 266 нМ, 227 нМ.
Транс-1-(трет-бутоксикарбонил)-2-карбокси-3а-гидрокси-6-ацетокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индол (транс-HDP 30.2555)
290 мг транс-HDP 30.2555, выход: 30%.
1H-ЯМР (400 МГц, CD3OD, δ = ppm)
δ = 1,22, 1,45, 1,54 [s, 9H, С(СН3)3]; 2,22 (s, 3H, ОСОСН3); 2,55-2,73 (m, 2H, CH2); 4,51-4,57 (m, 1H, 2-H); 5,21-5,24 (s, 1H, 8a-H); 6,36-6,41 (m, 2H, 7-H, 5-H); 7,17- 7,18 (m, 1H, 4-H).
13С-ЯМР (100 МГц, CD3OD, δ = ppm)
δ = 20,95, 28,50, 31,12, 42,47, 60,97, 69,44, 82,06, 84,84, 87,54, 104,74, 112,67, 125,03, 128,70, 152,31, 154,22, 156,00, 171,23, 174,67.
MS (ESI+) - выявлено: 379,00 [MH]+; рассчитано: 378,14 (C18H22N2O7).
MS (ESI+) - выявлено: 401,17 [M+Na]+; рассчитано: 401,14 (C18H22N2NaO7).
MS (ESI+) - выявлено: 779,00 [M+Na]+; рассчитано: 779,28 (C36H44N4Na2O14).
UV/VIS (СН3ОН): λmax = 299 нМ, 241 нМ, 215 нМ.
λmin = 268 нМ, 228 нМ.
3. Получение S-дезокси-α-аманитина HDP 30.0735
Стадия 1. HDP 30.0013
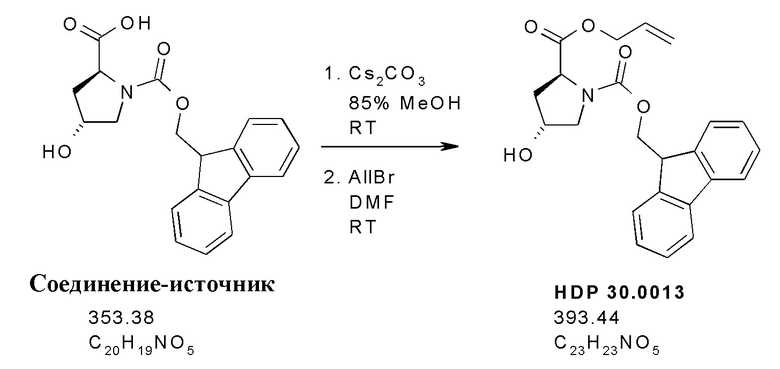
FmocHypOH (10,0 г, 28,3 ммоль) суспендировали в 100 мл 80% МеОН и добавляли CS2CO3 (4,6 г, 14,1 ммоль). Суспензию взбалтывали при 50°С в течение 30 минут до полного растворения. Реакционную смесь концентрировали досуха и повторно растворяли в 100 мл DMF. Каплями добавляли аллилбромид (1,6 мл, 3,6 г, 29,7 ммоль) и реакционную смесь взбалтывали на протяжении ночи при комнатной температуре. DMF отгоняли и остаток растворяли в трет-бутилметиловом эфире. Осадки отфильтровывали и прозрачный раствор абсорбировали на целите перед колоночной хроматографией. Соединение очищали на 220 г силикагеля с градиентом н-гексана/этилацетата. Выход: 11,5 г, 100%.
Стадия 2. HDP 30.0400
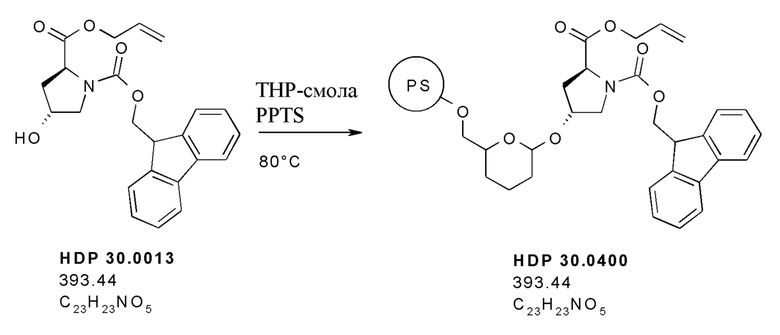
Добавляли HDP 30.0013 (5,0 г, 14,1 ммоль), пиридиния 4-толуолсульфонат (1,33 г, 5,3 ммоль) в суспензию 1,3-дигидро-2Н-пиран-2-ил-метоксиметиловой смолы (5,0 г, 1,0 ммоль/г THP-смолы) в 40 мл дихлопентана. Реакционную смесь взбалтывали при 80°С на протяжении ночи. После охлаждения смолу фильтровали и тщательно промывали дихлопентаном, диметилформамидом, ацетонитрилом, дихлорметаном и трет-бутилметиловым эфиром.
Загрузка составляла 0,62 ммоль/г (при определении с помощью УФ-спектроскопии флуоренметильной группы после удаления защитной группы).
Стадия 3. HDP 30.2569 (твердофазный синтез)
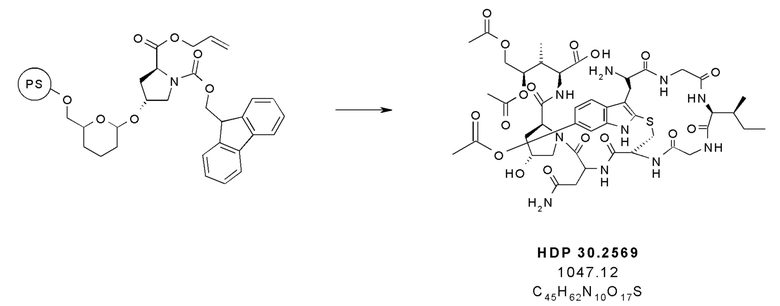
Предварительная обработка смолы
HDP 30.0400 (0,31 г, 0,25 ммоль) обрабатывали с помощью N,N-диметилбарбитуровой кислоты (241 мг, 1,55 ммоль) и Pd(PPh3)4 (35 мг, 0,03 ммоль). Смолу встряхивали на протяжении ночи при комнатной температуре. После этого смолу тщательно промывали дихлорметаном, DMF, ацетонитрилом, дихлорметаном и трет-бутилметиловым эфиром и сушили при пониженном давлении.
Процедура сочетания
Все реактанты и реагенты растворяли в дихлорметане/DMF (1:1, объем/объем). HDP 30.0477 [см. WO 2014/009025] (102 мг, 0,30 ммоль) растворяли в 6,0 мл дихлорметана/N,N-диметилформамида и обрабатывали с помощью 4,0 мл 0,2 н. раствора PyBOP/HOBt и 2 мл DIEA (40% в DMF). После добавления 2,0 мл N,N-диметилформамида реакционную смесь нагревали до 50°С в течение 8 минут с помощью микроволнового излучения (20 Вт, микроволновой реактор СЕМ) и промывали N,N-диметилформамидом после сочетания.
Удаление защитной группы Fmoc
Удаление защитной группы выполняли путем добавления 6,0 мл 20% пиперидина в N,N-диметилформамиде при 50°С в течение 10 минут. Смолу промывали N,N-диметилформамидом (отсутствие удаления защитной группы после сочетания конечной аминокислоты).
Все другие аминокислоты сочетали согласно приведенному выше протоколу, взвешивания показаны ниже.


После завершения смолу окончательно переносили в шприц с дном из фритты, промывали с помощью DCM и сушили при пониженном давлении.
Высвобождение смолы и образование В-кольца
Раствор 5 мл TFA, 5 мл DCM плюс 10% МеОН аспирировали в смолу и встряхивали в течение 15 минут при окружающей температуре. Раствор распределяли в 50-мл реакционную колбу и смолу промывали с помощью TFA/DCM 1:1 плюс 10% МеОН один раз и выливали в ту же колбу. Реакционную колбу взбалтывали в течение 16 часов. Добавляли триизопропилсилан (0,5 мл) и реакционную смесь концентрировали в вакууме. Остаток растворяли в 500 мкл МеОН и пептид осаждали в 50 мл охлажденного до температуры льда ТВМЕ. После центрифугирования надосадочную жидкость декантировали, осадок промывали один раз с помощью 50 мл ТВМЕ и сушили при пониженном давлении.
Осадок солюбилизировали в 2 мл метанола и очищали с помощью препаративной колоночной хроматографии с обращенной фазой. Метанол отгоняли при пониженном давлении и оставшуюся водную фазу сушили замораживанием.
Выход: 136,5 мг, 62,5%.
MS (ESI+) - выявлено: 1047,4 [М+Н]+; рассчитано: 1047,4 (C45H63N10O17S).
HPLC: 91,9% площади.
Стадия 4. Циклизация (образование А-кольца, HDP 30.2572)
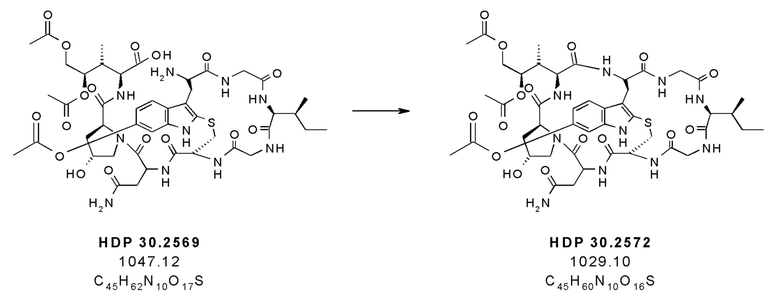
Приведенное выше высушенное замораживанием моноциклическое промежуточное соединение (136 мг, 130 мкмоль) растворяли в 16 мл DMF и обрабатывали дифенилфосфорилазидом (DPPA, 131 мкл, 1300 мкмоль, 10 эквив.) и диизопропилэтиламином (DIEA, 162 мкл, 1300 мкмоль, 10 эквив.). Реакционную смесь взбалтывали в течение 16 часов и гасили 500 мкл воды по завершении. За превращением наблюдали с помощью HPLC. Смесь концентрировали с помощью пониженного давления, повторно растворяли в 1 мл метанола и очищали с помощью препаративной колоночной хроматографии с обращенной фазой.
Выход: 55,3 мг, 41%.
MS (ESI+) - выявлено: 1029,33 [M+Na]+; рассчитано: 1030,10 (C45H61N10O16S).
HPLC: 99,2% площади.
Стадия 5. Удаление защитной группы ацетата (HDP 30.0735)
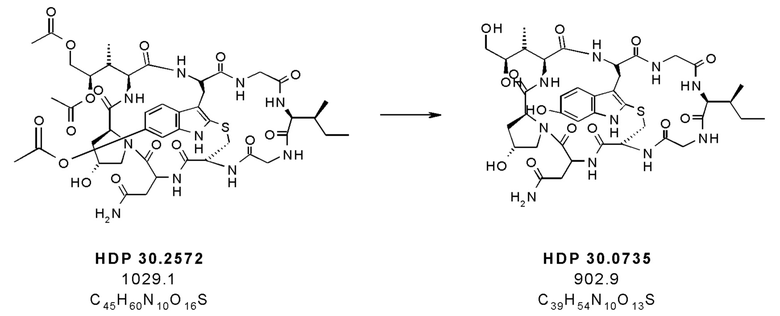
[001] HDP 30.2572 (55,3 мг, 53,7 мкмоль) растворяли в 7 н. метанольном растворе NH3 (3,0 мл) и взбалтывали. Превращение проверяли с помощью HPLC/MS. После завершения (6-8 часов) реакционную смесь концентрировали в вакууме, повторно суспендировали в 100 мкл МеОН и очищали с помощью препаративной HPLC.
Выход: 14,1 мг, 29%.
HPLC: 100%.
MS (ESI+) выявлено: 903,3 [М+Н]+; рассчитано: 902,9 (C39H54N10O13S).
выявлено: 925,33 [M+Na]+.
4. Получение 6'-((3-малеидопропанамидо)-Val-Ala-РАВ)-S-деокси-α-аманитина (HDP 30.2371)
Стадия 1. HDP 30.2364
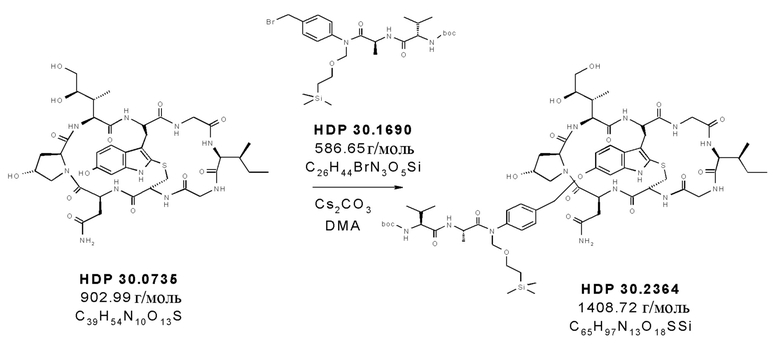
S-Дезокси-α-аманитин HDP 30.0735 (30 мг, 33,2 мкмоль) и HDP 30.1690 (WO 2016/142049, 78 мг, 133 мкмоль = 4,0 эквив.) растворяли в 1500 мкл сухого диметилацетамида (DMA). Добавляли 0,2 М раствор гидрокарбоната цезия в воде (199 мкл, 1,2 эквив.) одной порцией и смесь взбалтывали при комнатной температуре. Через 1,5 и 4 часа добавляли дополнительные порции по 99 мкл (0,6 эквив.) раствора карбоната цезия.
Через 18 часов растворитель выпаривали с помощью высокого вакуума.
Остаток растворяли в 400 мкл метанола и каплями добавляли в охлажденный до температуры льда МТВЕ (10 мл). После отстаивания при 0°С в течение 10 минут полученный в результате осадок выделяли с помощью центрифугирования (4 минуты, 4000 × g). Надосадочную жидкость отбрасывали, осадок повторно суспендировали в дополнительном МТВЕ (10 мл) и центрифугирование повторяли. Высушенный в вакууме неочищенного продукт растворяли в 400 мкл метанола и очищали с помощью препаративной HPLC в колонке Phenomenex Luna-C18(2) 10 мкм (250×21,2 мм) с градиентом 5% - 100% метанола в воде. Фракции продукта объединяли и приводили до 23 мг (70%) продукта в виде аморфного твердого вещества.
MS (ESI+) [M+Na]+ - выявлено: 1430,58; рассчитано: 1430,65 (C65H97N13NaO18SSi).
Путем выпаривания раннего пика элюирования извлекали 5 мг (17%) исходного материала.
Стадия 2. HDP 30.2366
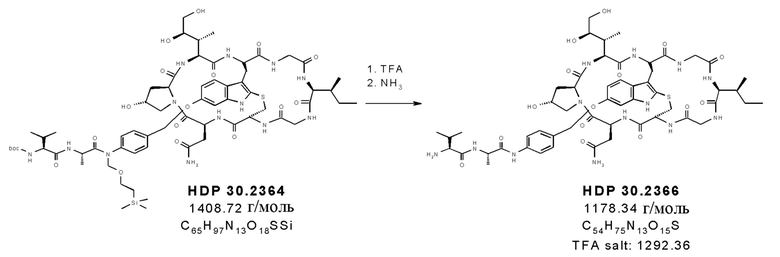
HDP 30.2364 (9,47 мг, 6,72 мкмоль) растворяли в 750 мкл трифторуксусной кислоты (TFA). Через 2 минуты летучие вещества удаляли in vacuo, остаток растворяли в 750 мкл воды и каплями добавляли 3% аммиак, пока не достигали рН 10 и осаждения.
Раствор сушили замораживанием и очищали с помощью препаративной HPLC последовательно (колонка Phenomenex Luna-C18(2), 10 мкм, 250×21,2 мм, градиента 5-100% метанола (0,05% TFA) в воде (0,05% TFA)) с получением 7,72 мг (89% на основе соли TFA) продукта.
MS (ESI+) [MH]+ - выявлено: 1178,42; рассчитано: 1178,53 (C54H76N13O15S).
Стадия 3. HDP 30.2371
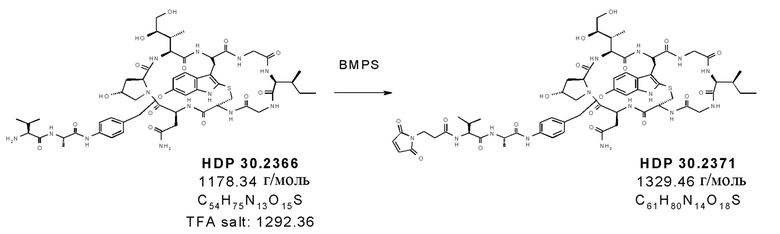
HDP 30.2366 (4,01 мг, 3,10 мкмоль) растворяли в 500 мкл сухого DMF.
Сложный эфир 3-(малеимидо)пропионовой кислоты и N-гидроксисукцинимида (BMPS, 1,65 мг, 2 эквив.) растворяли в 100 мкл DMF с последующим добавлением 2,1 мкл DIPEA.
После взбалтывания в течение 1 часа реакционную смесь капали в 10 мл охлажденного до температуры льда метил-трет-бутилового эфира. Пробирку держали на льду в течение 10 минут и центрифугировали при 4000 × g. Над осадочную жидкость удаляли и осадок промывали с помощью 10 мл свежего метил-трет-бутилового эфира.
Высушенный в вакууме осадок очищали с помощью RP-18 HPLC с градиентом 5-100% метанола в воде. Чистые фракции выпаривали досуха и лиофилизировали из 1 мл трет-бутанола/воды с получением 2,70 мг (65%) продукта в виде бесцветного порошка.
MS (ESI+) [MH]+ - выявлено: 1329,3; рассчитано: 1329,6 (C61H81N14O18S).
[M+Na]+ - выявлено: 1351,5; рассчитано: 1351,5 (C61H80N14NaO18S).
В. Общий синтез S-дезокси-5'-гидрокси-аманинамида HDP 30.2548
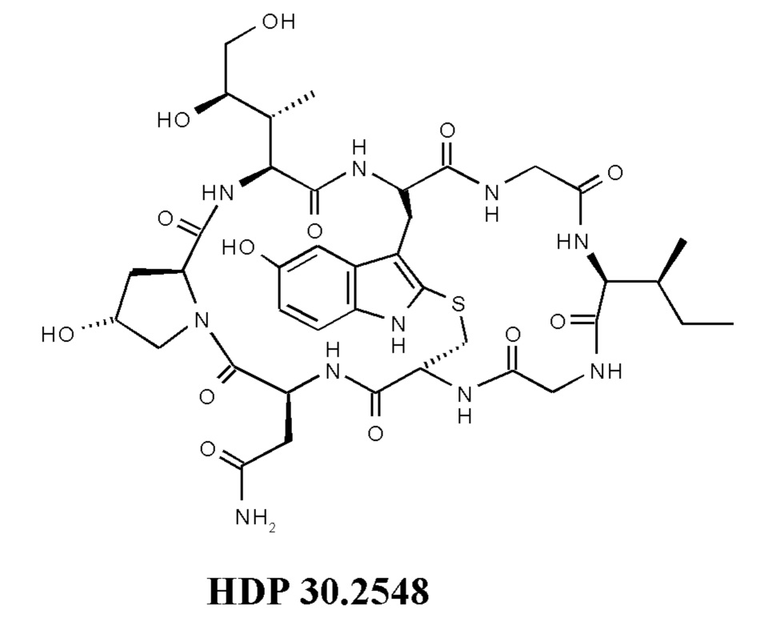
1. Получение N-(трет-бутоксикарбонил)-L-5-ацетокси-триптофана HDP 30.2531
800,0 мг (3,63 ммоль) 5-гидрокси-L-триптофана (CAS: 4350-09-8) суспендировали в смеси 40 мл 1,4-диоксана/воды 1:1 (объем/объем). Под аргоном добавляли 3,64 мл (3,64 ммоль) 1 н. NaOH за один раз при окружающей температуре. Полученный в результате желтый раствор затем обрабатывали с помощью 779,0 мкл (794,0 мг, 3,63 ммоль) Boc ангидрида (Boc2O) и взбалтывали в течение 24 часов при комнатной температуре. Раствор подкисляли 1 н. хлористоводородной кислотой до рН 2,4 и экстрагировали 3 раза с помощью 35 мл этилацетата. Объединенные этилацетатные экстракты промывали насыщенным раствором NaCl и сушили над MgSO4. Фильтрация и выпаривание досуха давали 1,26 г неочищенного материала. Неочищенный N-Вос-6-гидрокси-L-триптофан растворяли в 7,87 мл (7,87 ммоль) 1 н. NaOH и обрабатывали с помощью 743,0 мкл (802,4 мг, 7,86 ммоль) уксусного ангидрида. Реакционную смесь взбалтывали в течение 3 часов под аргоном и подкисляли 5% лимонной кислотой. Водную фазу экстрагировали три раза с помощью 25 мл этилацетата, промывали насыщенным NaCl и сушили над MgSO4. Фильтровали и выпаривали.
Неочищенное твердое вещество очищали с помощью флэш-хроматографии в колонке с 330 г силикагеля (длина волны выявления 254 нм) с градиентом CH2Cl2 + 1% уксусной кислоты - CH2Cl2/МеОН (15:1) + 1% уксусной кислоты и после совместного выпаривания с толуолом получали 1020,0 мг (выход 78%) белого порошка.
MS (ESI-) - выявлено: 361,08 [М-Н]-; рассчитано: 362,15 (C18H22N2O6).
1H-ЯМР (400 МГц, CD3OD, δ = ppm).
δ = 1,39 (s, 9H, С(СН3)3); 2,27 (s, 3H, ОСОСН3); 3,08-3,31 (m, 2H, СН2); 4,39-4,41 (m, 1Н, 2-H); 6,81-6,83; 7,13; 7,24-7,26 (m, 2H, 6-Н, 7-Н); 7,30- 7,32 (1Н, 4-Н).
2. Получение цис,транс-1-(трет-бутоксикарбонил)-2-карбокси-3а-гидрокси-5-ацетокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индола, цис-HDP 30.2536 и транс-HDP 30.2536 (цис,транс-5-ацетокси-Hpi)
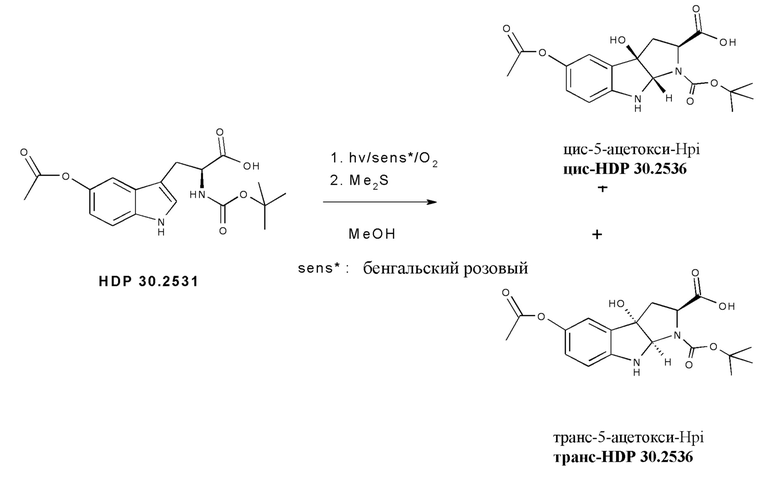
Фотоокисление
Фотоокисление осуществляли с натриевой лампой высокого давления 400 Вт (лампа Sirius X400, 230 В, 400 Вт; 55000 люмен на расстоянии 1,3 м) или, в качестве альтернативы, с вольфрам-галогеновой лампой (500 Вт). Использовали фильтрующий раствор (Cucl2-СаСО3), отсекающий свет с λ < 490 нм, для вольфрам-галогеновой лампы.
Использовали метиленовый синий или бенгальский розовый в качестве сенсибилизирующего красителя. Реакцию осуществляли в 500-мл цилиндрическом реакционном сосуде с теплообменной рубашкой, сделанной из боросиликатного стекла DURAN®, с плоским дном и плоским лабораторным фланцем (DN) с двумя соединителями с нитью GL 18. Расстояние от лампы до реакционного сосуда составляло 15 см, а реакционная температура находилась в диапазоне 3-4°С.
Конечный продукт очищали на системе для флэш-хроматографии Teledyne ISCO с колонкой Silica Redi Sept Flash 330 г (№ по каталогу Teledyne ISCO 69-2203-330). Растворители CH2Cl2, СН3ОН, СН3СООН имели стандартную чистоту для HPLC или ВР. Сухой кислород (99,5% чистоты) барботировали через реакционную смесь со скоростью 2-4 л в минуту.
1,20 г (3,17 ммоль) N-(трет-бутоксикарбонил)-L-5-ацетокси-триптофана HDP 30.2531 и 100 мг бенгальского розового растворяли в 500 мл метанола и охлаждали до 3°C с использованием криостата Хубера с гликолем/водой в качестве охлаждающей среды. Реакционный раствор освещали натриевой лампой высокого давления 400 Вт. В ходе освещения медленный поток кислорода барботировали через реакционный раствор. После 4 часов освещения окисление и охлаждение останавливали и реакционную среду обрабатывали 20 мл диметилсульфида. Смесь взбалтывали в течение 2 часов и выпаривали досуха с использованием роторного выпаривателя с температурой водяной бани 35°С. Темно-красный остаток дополнительно сушили в высоком вакууме до кристаллического твердого вещества. Неочищенный продукт очищали в колонке с 330 г силикагеля (длина волны выявления 254 нм) с градиентом CH2Cl2 + 5% уксусной кислоты - CH2Cl2/MeOH (30:1) + 5% уксусной кислоты.
178 мг цис-HDP 30.2536 и 132 мг транс-HDP 30.2536 элюировали и выпаривали совместно с толуолом. После лиофилизации в трет-бутаноле оба изомера получали в виде грязно-белых порошков.
Цис-1-(трет-бутоксикарбонил)-2-карбокси-3а-гидрокси-5-ацетокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индол (цис-HDP 30.2536)
178 мг цис-HDP 30.2536 выход: 15%.
1H-ЯМР (400 МГц, CD3OD, δ = ppm).
δ = 1,44, 1,54 (s, 9H, С(СН3)3); 2,23 (s, 3H, ОСОСН3); 2,45-2,62 (m, 2H, CH2); 4,18-4,33 (m, 1H, 2-H); 5,37 (s, 1H, 8a-H); 6,63-6,67; 6,82-6,84; (m, 2H, 7-Н, 6-Н); 6,96- 6,98 (m, 1Н, 4-Н).
13С-ЯМР (100 МГц, CD3OD, δ = ppm).
δ = 20,86, 28,46, 31,12, 42,81, 61,21, 82,14, 85,60, 111,49, 117,83, 123,98, 132,77, 144,99, 148,03, 156,07, 172,01, 175,89.
MS (ESI+) - выявлено: 379,00 [МН]+; рассчитано: 378,14 (C18H22N2O7).
MS (ESI+) - выявлено: 401,17 [M+Na]+; рассчитано: 401,14 (C18H22N2NaO7).
MS (ESI-) - выявлено: 377,17 [M-H]-; рассчитано: 378,14 (C18H22N2O7).
UV/VIS (СН3ОН): λmax = 299 нм, 242 нм, 207 нм.
λmin = 270 нм, 222 нм.
Транс-1-(трет-бутоксикарбонил)-2-карбокси-3а-гидрокси-5-ацетокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индол (транс-HDP 30.2536)
132 мг транс-HDP 30.2536, выход: 11%.
1H-ЯМР (400 МГц, CD3OD, δ = ppm).
δ = 1,47, 1,54 [s, 9H, С(СН3)3]; 2,21 (s, 3H, ОСОСН3); 2,50-2,70 (m, 2H, СН2); 4,51-4,56 (m, 1H, 2-H); 5,22-5,26 (s, 1H, 8a-H); 6,58-6,63; 6,80-6,81 (m, 6-H, 7-H); 6,92 (s, 1H, 4-H).
13С-ЯМР (100 МГц, CD3OD, δ = ppm).
δ = 20,88, 28,50, 31,12, 42,60, 61,11, 82,05, 85,38, 111,26, 117,88, 124,07, 131,94 144,66, 148,95, 156,11, 172,01, 174,81.
MS (ESI+) - выявлено: 379,00 [MH]+; рассчитано: 378,14 (C18H22N2O7).
MS (ESI+) - выявлено: 401,17 [M+Na]+; рассчитано: 401,14 (C18H22N2NaO7).
MS (ESI-) - выявлено: 377,17 [M-H]-; рассчитано: 378,14 (C18H22N2O7).
UV/VIS (СН3ОН): λmax = 302 нм, 244 нм, 208 нм.
λmin = 272 нм, 224 нм.
3. Получение S-дезокси-5'-гидрокси-аманинамида HDP 30.2548
Стадия 1. HDP 30.0013
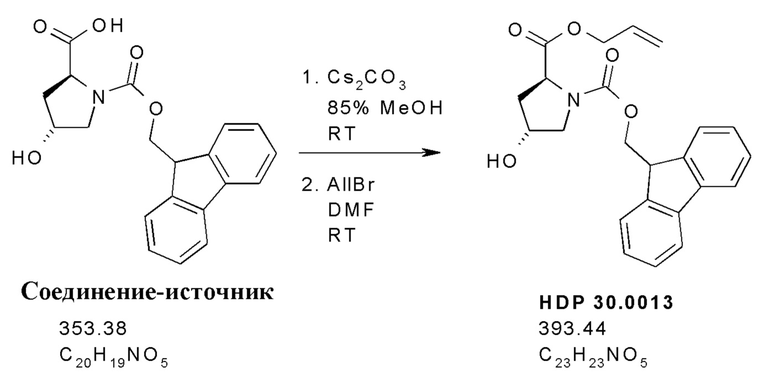
FmocHypOH (10,0 г, 28,3 ммоль) суспендировали в 100 мл 80% МеОН и добавляли Cs2CO3 (4,6 г, 14,1 ммоль). Суспензию взбалтывали при 50°С в течение 30 минут до полного растворения. Реакционную смесь концентрировали досуха и повторно растворяли в 100 мл DMF. Каплями добавляли аллилбромид (1,6 мл, 3,6 г, 29,7 ммоль) и реакционную смесь взбалтывали на протяжении ночи при комнатной температуре. DMF отгоняли и остаток растворяли в трет-бутилметиловом эфире. Осадки фильтровали и прозрачный раствор абсорбировали на целите перед колоночной хроматографией. Соединение очищали на 220 н силикагеля с градиентом н-гексана/этилацетата.
Выход: 11,5 г, 100%.
Стадия 2. HDP 30.0400
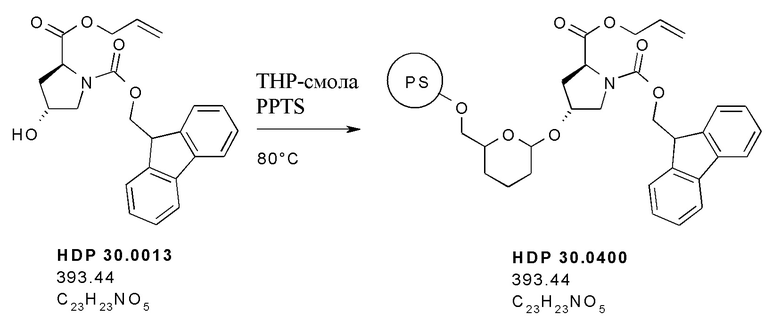
HDP 30.0013 (5,0 г, 14,1 ммоль), пиридиния 4-толуолсульфоната (1,33 г, 5,3 ммоль) добавляли в суспензию 1,3-дигидро-2Н-пиран-2-ил-метоксиметиловой смолы (5,0 г, 1,0 ммоль/г ТНР-смолы) в 40 мл дихлопентана. Реакционную смесь взбалтывали при 80°С на протяжении ночи. После охлаждения смолу фильтровали и тщательно промывали с помощью дихлопентана, диметилформамида, ацетонитрила, дихлорметана и трет-бутилметилового эфира.
Загрузка составляла 0,62 ммоль/г (при определении с помощью УФ-спектроскопии флуоренметильной группы после удаления защитной группы).
Стадия 3. HDP 30.2544 (твердофазный синтез)
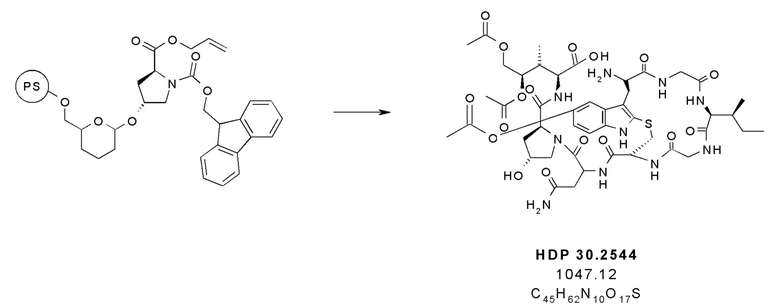
Предварительная обработка смолы
HDP 30.0400 (0,31 г, 0,25 ммоль) обрабатывали с помощью N,N-диметилбарбитуровой кислоты (241 мг, 1,55 ммоль) и Pd(PPh3)4 (35 мг, 0,03 ммоль). Смолу встряхивали на протяжении ночи при комнатной температуре. После этого смолу тщательно промывали дихлорметаном, DMF, ацетонитрилом, дихлорметаном и трет-бутилметиловым эфиром и сушили при пониженном давлении.
Процедура сочетания
Все реактанты и реагенты растворяли в дихлорметане/DMF (1:1, объем/объем). HDP 30.0477 [см. WO 2014/009025] (102 мг, 0,30 ммоль) растворяли в 6,0 мл дихлорметана/N,N-диметилформамида и обрабатывали с помощью 4,0 мл 0,2 н. раствора PyBOP/HOBt и 2 мл DIEA (40% в DMF). После добавления 2,0 мл N,N-диметилформамида реакционную смесь нагревали до 50°С в течение 8 минут с помощью микроволнового излучения (20 Вт, микроволновой реактор СЕМ) и промывали N,N-диметилформамидом после сочетания.
Удаление защитной группы Fmoc
Удаление защитной группы выполняли путем добавления 6,0 мл 20% пиперидина в N,N-диметилформамиде при 50°С в течение 10 минут. Смолу промывали N,N-диметилформамидом (отсутствие удаления защитной группы после сочетания конечной аминокислоты).
Все другие аминокислоты сочетали согласно приведенному выше протоколу, взвешивания показаны ниже.


После завершения смолу окончательно переносили в шприц с дном из фритты, промывали с помощью DCM и сушили при пониженном давлении.
Высвобождение смолы и образование В-кольца
Раствор 5 мл TFA, 5 мл DCM плюс 10% МеОН аспирировали в смолу и встряхивали в течение 15 минут при окружающей температуре. Раствор распределяли в 50-мл реакционную колбу и смолу промывали с помощью TFA/DCM 1:1 плюс 10% МеОН один раз и выливали в ту же колбу. Реакционную колбу взбалтывали в течение 16 часов. Добавляли триизопропилсилан (0,5 мл) и реакционную смесь концентрировали в вакууме. Остаток растворяли в 500 мкл МеОН и пептид осаждали в 50 мл охлажденного до температуры льда ТВМЕ. После центрифугирования надосадочную жидкость декантировали, осадок промывали один раз с помощью 50 мл ТВМЕ и сушили при пониженном давлении.
Осадок солюбилизировали в 2 мл метанола и очищали с помощью препаративной колоночной хроматографии с обращенной фазой. Метанол отгоняли при пониженном давлении и оставшуюся водную фазу сушили замораживанием.
Выход: 75,1 мг, 35,9%.
MS (ESI+) - выявлено: 1047,4 [М+Н]+; рассчитано: 1047,4 (C45H63N10O17S).
HPLC: 99,3% площади.
Стадия 4. Циклизация (образование А-кольца, HDP 30.2546)
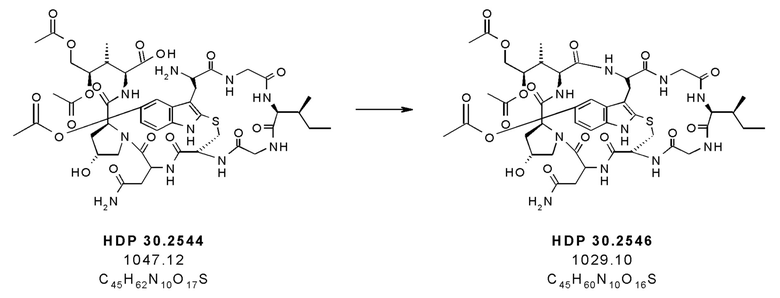
Приведенное выше высушенное замораживанием моноциклическое промежуточное соединение (49,4 мг, 47,2 мкмоль) растворяли в 3 мл DMF и обрабатывали дифенилфосфорилазидом (DPPA, 13 мкл, 237 мкмоль, 5 эквив.) и диизопропилэтиламином (DIEA, 40 мкл, 237 мкмоль, 5 эквив.). Реакционную смесь взбалтывали в течение 16 часов и гасили 500 мкл воды по завершении. За превращением наблюдали с помощью HPLC. Смесь концентрировали с помощью пониженного давления, повторно растворяли в 1 мл метанола и очищали с помощью препаративной колоночной хроматографии с обращенной фазой.
Выход: 32,5 мг, 67,9%.
MS (ESI+) - выявлено: [М+Н]+ 1029,33, [MH]+ 1051,3, [M+Na]+; рассчитано: 1029,39; 1051,42 (C45H61N10O16S; C45H60N10O16SNa).
HPLC: 88,3% площади.
Стадия 5. Удаление защитной группы ацетата (HDP 30.2548)
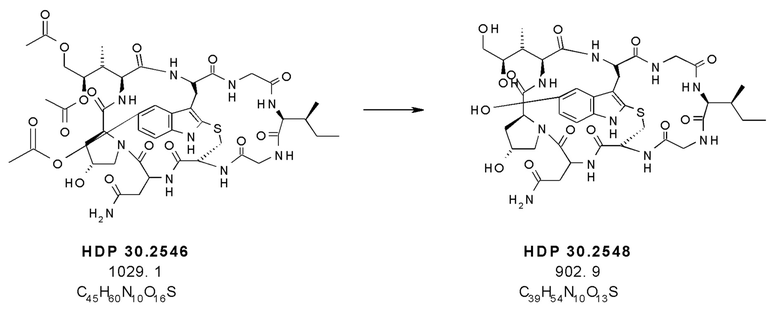
HDP 30.2546 (23,4 мг, 22,7 мкмоль) растворяли в 7 н. растворе метанола (2,3 мл) и взбалтывали. Превращение проверяли с помощью HPLC/MS. После завершения (6-8 часов) реакционную смесь концентрировали в вакууме, повторно суспендировали в 100 мкл МеОН и очищали с помощью препаративной HPLC.
Выход: 12,5 мг, 53,3%.
HPLC: 99%.
MS (ESI+) выявлено: 903,4 [М+Н]+; рассчитано: 902,9 (C39H54N10O13S).
выявлено: 925,4 [M+Na]+.
5. Получение 5'-((3-малеидопропанамидо)-Val-Aka-n-амининобензилокси)-S-деокси-аманинамида (HDP 30.2602)
Стадия 1. HDP 30.2563
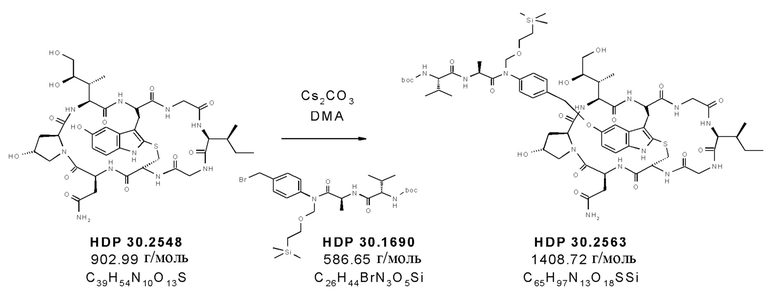
S-дезокси-5'-гидрокси-аманинамид HDP 30.2548 (9,66 мг, 10,7 мкмоль) и HDP 30.1690 (WO 2016/142049, 50,2 мг, 85,6 мкмоль = 8,0 эквив.) растворяли в 500 мкл сухого диметилацетамида (DMA). Добавляли 1,0 М раствор гидрокарбоната цезия в воде (17,12 мкл, 1,6 эквив.) одной порцией и смесь взбалтывали при комнатной температуре.
Через 1,5 часа добавляли дополнительные порции по 17,12 мкл (1,6 эквив.) раствора карбоната цезия.
Через 8 часов реакционную смесь нейтрализовали уксусной кислотой, пропускали через центрифужный фильтр (0,2 мкМ) и очищали с помощью HPLC в колонке Phenomenex Luna-C18(2) 10 мкм (250×21,2 мм) с градиентом (5-100%) ацетонитрила в воде. Фракции продукта объединяли и приводили до 4,00 мг (26%) продукта в виде аморфного твердого вещества.
MS (ESI+) [M+Na]+ - выявлено: 1430,58; рассчитано: 1430,65 (C65H97N13NaO18SSi).
Стадия 2. HDP 30.2378
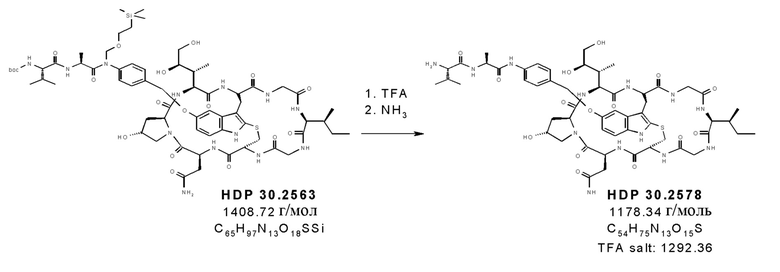
HDP 30.2563 (7,53 мг, 5,34 мкмоль) растворяли в 500 мкл смеси трифторуксусной кислоты/воды/триизопропилсилана 95:5:5. Через 5 минут летучие вещества удаляли in vacuo, остаток растворяли в 1000 мкл воды и каплями добавляли 3% аммиак, пока не достигали рН 10 и осаждения.
Раствор сушили замораживанием и очищали с помощью препаративной HPLC последовательно (колонка Phenomenex Luna-C18(2), 10 мкм, 250×21,2 мм, градиента 20-30% ацетонитрила в воде (0,05% TFA) за 16 минут с получением 3,95 мг (57% на основе соли TFA) продукта.
MS (ESF) [M+H]+ - выявлено: 1178,50; рассчитано: 1178,53 (C54H76N13O15S).
Стадия 3. HDP 30.2602
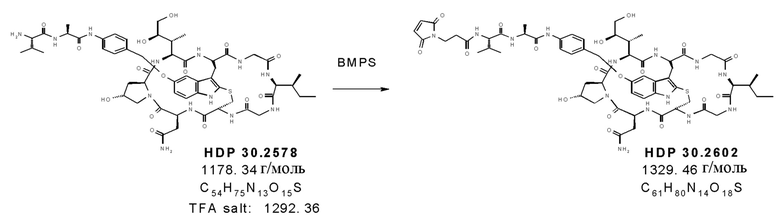
HDP 30.2578 (3,95 мг, 3,06 мкмоль) растворяли в 400 мкл сухого DMF.
Сложный эфир 3-(малеимидо)пропионовой кислоты и N-гидроксисукцинимида (BMPS, 1,63 мг, 2 эквив.) растворяли в 81,4 мкл DMF с последующим добавлением 2,1 мкл (2 эквив.) DIPEA.
После взбалтывания в течение 2 часов реакционную смесь пропускали через центрифужный фильтр (0,2 мкм) и очищали с помощью RP-18 HPLC с градиентом 5-70% ацетонитрила в воде + 0,05% TFA. Чистые фракции выпаривали досуха и лиофилизировали из 2 мл ацетонитрила/воды 1:1 с получением 2,73 мг (67%) продукта в виде бесцветного порошка.
MS (ESI+) [M+H]+ - выявлено: 1329,33; рассчитано: 1329,56 (C61H81N14O18S).
С. Общий синтез S-дезокси-4'-гидрокси-аманинамида
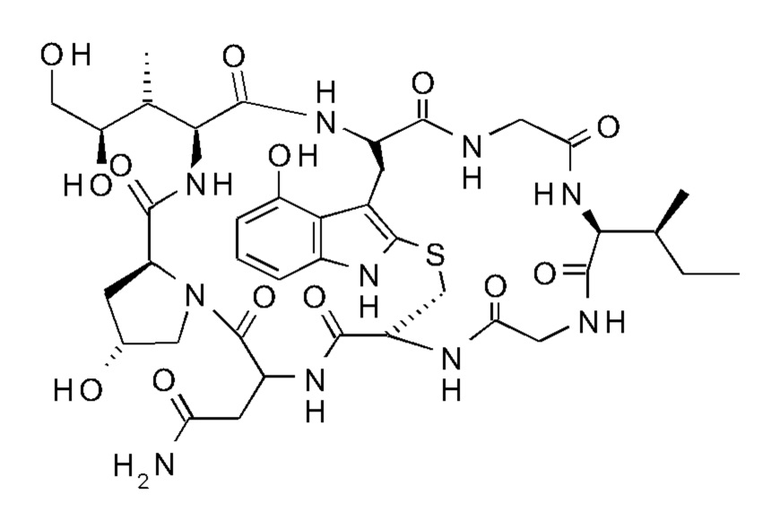
1. Схематический вид синтеза цис,транс-1-(трет-бутоксикарбонил)-2-карбокси-3а-гидрокси-4-ацетокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индола; цис- и транс (цис,транс-4-ацетокси-Hpi)
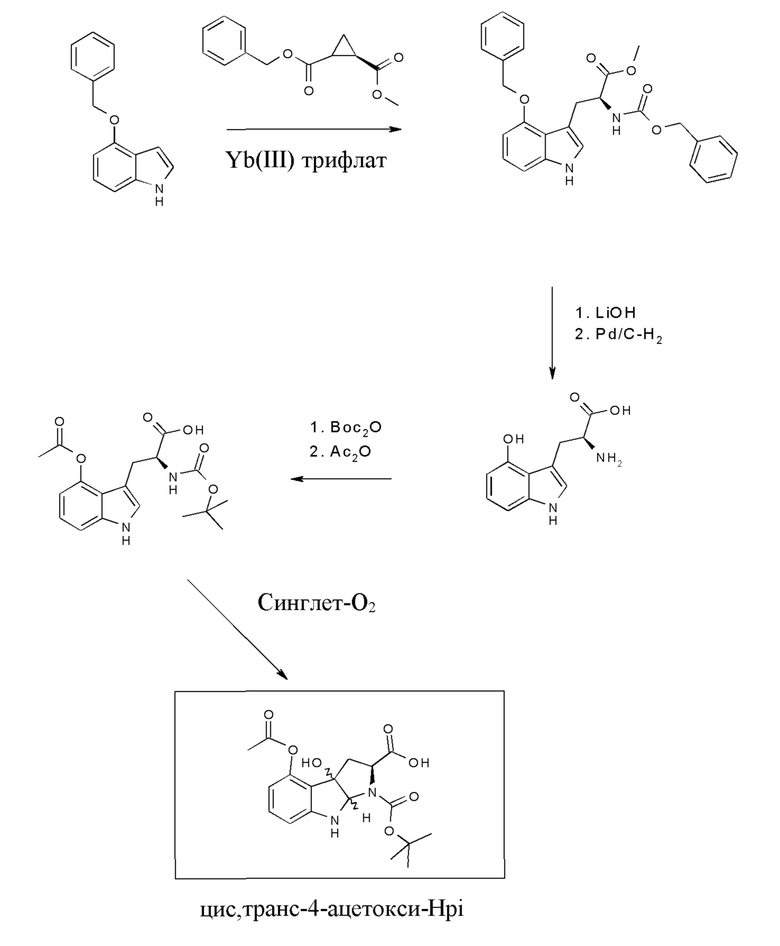
2. Схематический вид синтеза S-дезокси-4'-гидрокси-аманинамида
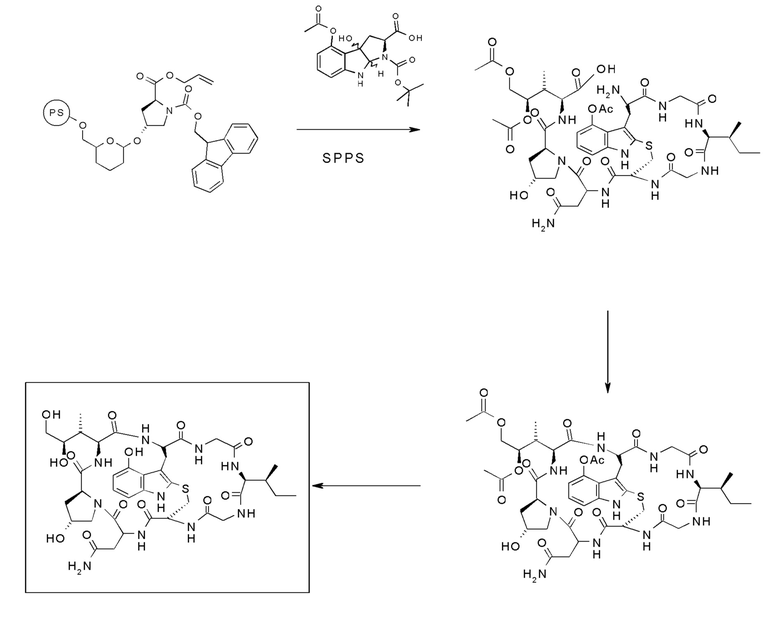
D. Общий синтез S-дезокси-7'-гидрокси-аманинамида
1. Синтез цис,транс-1-(трет-бутоксикарбонил)-2-карбокси-3а-гидрокси-4-ацетокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индола; (цис,транс-4-ацетокси-Hpi)
Синтез цис,транс-7-ацетокси-Hpi выполняли аналогично синтезу цис,транс-4-ацетокси-Hpi, исходя из коммерчески доступного 7-гидрокси-L-триптофана вместо 4-гидрокси-L-триптофана.
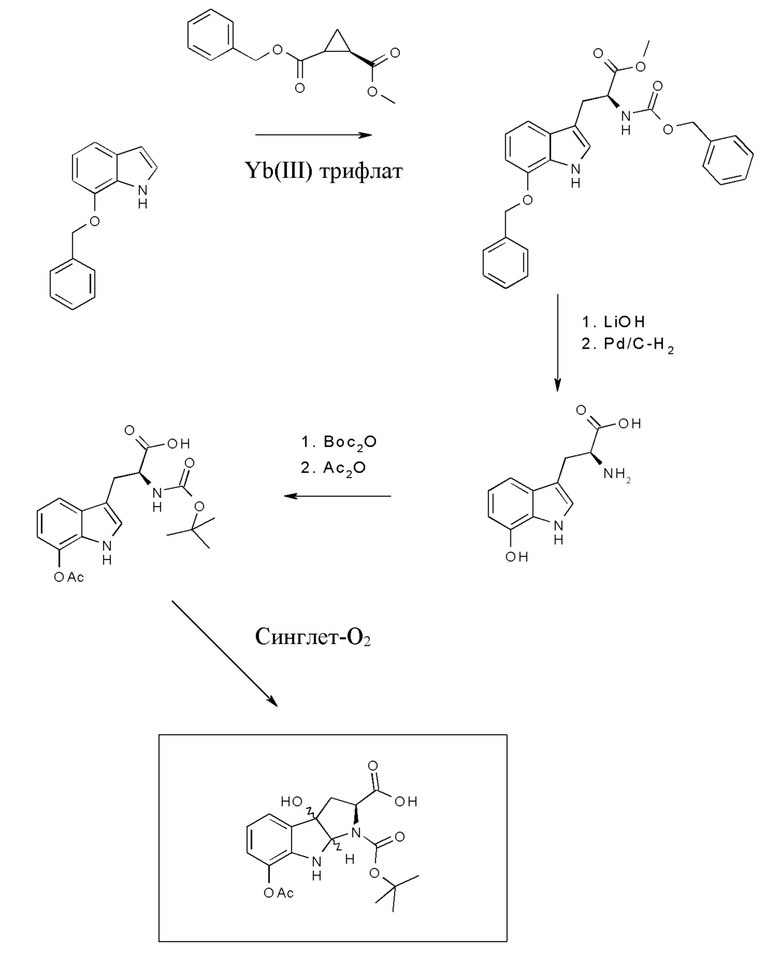
2. Схематический вид синтеза S-дезокси-7'-гидрокси-аманинамида
Синтез S-дезокси-7'-гидрокси-аманинамида выполняли аналогично синтезу S-дезокси-4'-гидрокси-аманинамида с использованием цис,транс-7-ацетокси-Hpi вместо цис,транс-4-ацетокси-Hpi.
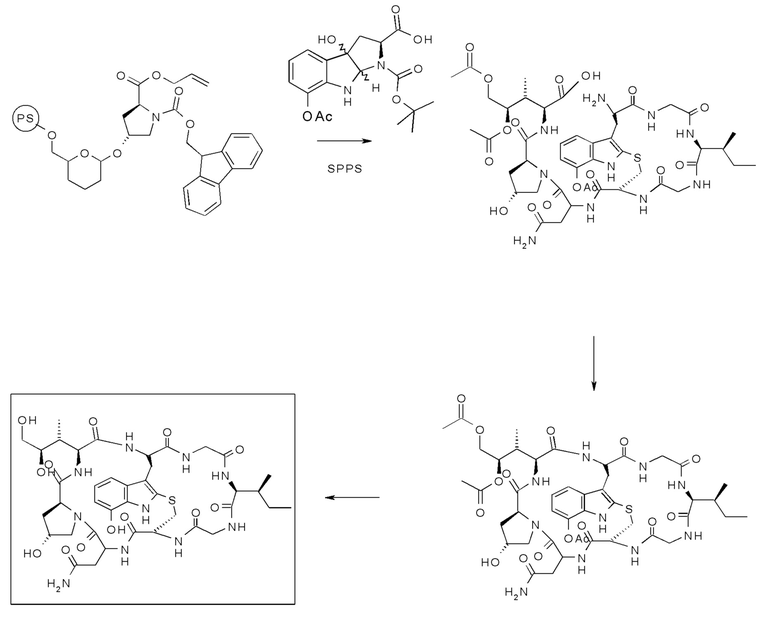
6. In vitro цитотоксичность S-дезокси-α-аманитина HDP 30.0735 и S-дезокси-5'-гидрокси-аманинамида HDP 30.2548
Анализ клеточной пролиферации с помощью BrdU на клетках HEK293 и HEK293 ОАТР1В3
Планшеты с культурой клеток HEK293-ОАТР1В3 покрывали поли-D-лизином.
Покрытие поли-D-лизином
5 мг поли-D-лизина в 50 мл стерильной воды
○ 50 мкл в каждую лунку 96-луночного планшета;
○ инкубация в течение 1 часа при RT;
○ промывание лунок два раза 200 мкл стерильной воды;
○ сушка по меньшей мере в течение 2 часов (RT).
Готовили черные 96-луночные планшеты с прозрачным дном с 2,0×103 клеток HEK293 и HEK293 ОАТР1В3/лунка и 90 мкл среды для выращивания на лунку, включающей в себя 10% FCS и добавки. Контроли: «холостой» готовили с 100 мкл среды без клеток, «фоновый» и «100%» готовили с клетками в 100 мкл среды.
• Инкубация в течение 24 часов при 37°С и 5% CO2.
Схема разбавления HDP 30.0735, HDP 30.2548 и альфа-аманитина Исходные растворы разбавляли 1:1000 (разбавление 1:10 и 1:100) в среде:
10 мкл исходного раствора производного аманитина (1,0×10-2 М) + 90 мкл PBS=100 мкл 1,0×10-3 М;
2 мкл разбавления + 198 мкл среды = 200 мкл 1×10-5 М.
Дополнительные разбавления
А: 200 мкл 1,0×10-5 М;
В: 80 мкл среды для выращивания + 20 мкл раствора А (разбавление 1:5);
С: 80 мкл среды для выращивания + 20 мкл раствора В (разбавление 1:5);
D: 80 мкл среды для выращивания + 20 мкл раствора С (разбавление 1:5);
Е: 80 мкл среды для выращивания + 20 мкл раствора D (разбавление 1:5);
F: 80 мкл среды для выращивания + 20 мкл раствора Е (разбавление 1:5);
G: 80 мкл среды для выращивания + 20 мкл раствора F (разбавление 1:5);
Н: 80 мкл среды для выращивания + 20 мкл раствора G (разбавление 1:5).
10 мкл каждого раствора добавляли в лунку в трех повторностях.
Конечный объем: 100 мкл/лунка.
Конечная доза: исходная 1×10-6 М; серии разбавлений 1:5.
• Инкубация в течение 96 часов при 37°С и 5% CO2.
• После 96 часов: анализ пролиферации Roche Cell, люминесцентный, в соответствии с инструкциями изготовителя.
• Концентрации ЕС50 определяли с помощью программного обеспечения для анализа данных Graphpad Prism 4.0.
7. Синтез HDP 30.2347, HDP 2371 и конъюгатов 30.2602
Пример. Синтез T-D265C-30.2371
10 мг Thiomab T-D265C в PBS буфере использовали для конъюгации HDP 30.2371.
Доведение раствора антитела до 1 мМ EDTA
2 мл раствора антитела (10,0 мг) + 20 мкл 100 мМ EDTA, рН 8,0; количество антитела: 10 мг = 6,9×10-8 моль.
Удаление кэппирования цистеинов с помощью реакции антитела с 40 эквив. ТСЕР:
- 2 мл раствора антитела (6,9×10-8 моль) + 55,2 мкл 50 мМ раствора ТСЕР (2,76×10-6 моль);
- инкубировали в течение 3 часов при 37°С на шейкере;
- два последовательных диализа при 4°С в 2,0 л 1 × PBS, 1 мМ EDTA, рН 7,4, в кассетах для диализа Slide-A-Lyzer 20,000 MWCO, первый диализ - приблизительно 4 часа, второй диализ - на протяжении ночи.
Окисление с помощью реакции антитела с 20 эквив. дегидроаскорбиновой кислоты (dhAA):
- приблизительно 2 мл раствора антитела (6,9×10-8 моль) + 27,6 мкл свежего 50 мМ раствора dhAA (1,38×10-6 моль);
- инкубировали в течение 3 часов при RT не шейкере.
Конъюгация с аманитином с использованием 6 эквив. HDP 30.2371 и гашение 25 эквив. N-ацетил-L-цистеина.
Солюбилизировали 2 мг HDP 30.2371 в 200 мкл DMSO = 10 мкг/мкл;
- приблизительно 2 мл раствора антитела (= 9,5 мг; 6,53×10-8 моль) + 52,1 мкл HDP 30.2371 (= 520,8 мкг; 3,92×10-7 моль);
- инкубировали в течение 1 часа при RT;
- гасили путем добавления 16,3 мкл 100 мМ N-ацетил-L-цистеина (1,63×10-6 моль);
- инкубировали в течение 15 минут при RT (или на протяжении ночи при 4°С);
- очищали реакционную смесь с помощью колонок 1 × PD-10, уравновешенных с помощью 1 × PBS, рН 7,4; идентифицировали включающие белок фракции с помощью реагента Брэдфорда на парапленке и объединяли включающие белок фракции вместе;
- диализ раствора антитела при 4°С на протяжении ночи в 2,0 л PBS, рН 7,4, и в кассетах для диализа Slide-A-Lyzer 20,000 MWCO;
- определение DAR с помощью анализа LC-ESI-MS.
Доводили концентрацию белка до 5,0 мг/мл (3,4×10-5 М) и доводили до стерильных состояний с помощью фильтрации. Хранили при 4°С.
Получали ADC с другим антителом или с другим производным аманитина, соответственно. Молекулярное количество антитела рассчитывали по MW соответствующего антитела. Количества линкерного токсина, ТСЕР, dhAA, N-ацетил-L-цистеина корректировали соответствующим образом, чтобы достичь соответствующих эквивалентов.
8. In vitro цитотоксичность HDP 30.2347, HDP 2371 и конъюгатов 30.2602
Анализ клеточной пролиферации с помощью BrdU на клетках SKBR-3, JIMT-1, LnCap и 22rv1
Анализ выполняли, как описано выше (6) со следующими изменениями.
Планшеты с культурой клеток не покрывали поли-D-лизином.
• Схема разбавления ADC.
• Исходные растворы разбавляли до 1,0×10-6 М средой для выращивания.
Дополнительные разбавления
А: 100 мкл 1,0×10-6 М;
В: 80 мкл среды для выращивания + 20 мкл раствора А (разбавление 1:5);
С: 80 мкл среды для выращивания + 20 мкл раствора В (разбавление 1:5);
D: 80 мкл среды для выращивания + 20 мкл раствора С (разбавление 1:5);
Е: 80 мкл среды для выращивания + 20 мкл раствора D (разбавление 1:5);
F: 80 мкл среды для выращивания + 20 мкл раствора Е (разбавление 1:5);
G: 80 мкл среды для выращивания + 20 мкл раствора F (разбавление 1:5);
Н: 80 мкл среды для выращивания + 20 мкл раствора G (разбавление 1:5).
• Добавляли 10 мкл каждого раствора в лунку в трех повторностях. Конечный объем: 100 мкл/лунка.
Конечная доза: исходная 1×10-7 М; серии разбавлений 1:5.
Анализ WST-I на клетках Raji и клетках Nalm-6
• Готовили 96-луночные планшеты с прозрачным F-образным дном с 2,0×103 клеток/лунка и 90 мкл соответствующей среды для выращивания на лунку, включающей в себя 10% FCS и добавки. Контроли: «холостой» готовили с 100 мкл среды без клеток;
«только с клетками» готовили с клетками в 100 мкл среды.
• Инкубация в течение 24 часов при 37°С и 5% CO2.
• Схема Разбавления ADC:
• Исходные растворы разбавляли до 1,0×10-6 М средой для выращивания.
Дополнительные разбавления
А: 100 мкл 1,0×10-6 М;
В: 80 мкл среды для выращивания + 20 мкл раствора А (разбавление 1:5);
С: 80 мкл среды для выращивания + 20 мкл раствора В (разбавление 1:5);
D: 80 мкл среды для выращивания + 20 мкл раствора С (разбавление 1:5);
Е: 80 мкл среды для выращивания + 20 мкл раствора D (разбавление 1:5);
F: 80 мкл среды для выращивания + 20 мкл раствора Е (разбавление 1:5);
G: 80 мкл среды для выращивания + 20 мкл раствора F (разбавление 1:5);
Н: 80 мкл среды для выращивания + 20 мкл раствора G (разбавление 1:5).
• 10 мкл каждого раствора добавляли в лунку в трех повторностях. Конечный объем: 100 мкл/лунка.
Конечная доза: исходная 1×10-7 М; серии разбавлений 1:5.
• Инкубация в течение 96 часов при 37°С и 5% CO2.
• После 96 часов: анализ пролиферации Roche Cell, люминесцентный, в соответствии с инструкциями изготовителя.
• Концентрации ЕС50 определяли с помощью программного обеспечения для анализа данных Graphpad Prism 4.0.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТЫ АМАТОКСИНА С УЛУЧШЕННЫМИ СВЯЗЯМИ | 2012 |
|
RU2575854C2 |
| ПРОИЗВОДНЫЕ АМАТОКСИНА | 2014 |
|
RU2695370C2 |
| КОНЪЮГАТЫ АМАТОКСИНОВ С УЛУЧШЕННЫМИ ЛИНКЕРАМИ | 2011 |
|
RU2601411C2 |
| СИНТЕЗ (S)-6-ГИДРОКСИТРИПТОФАНА И ЕГО ПРОИЗВОДНЫХ | 2019 |
|
RU2810786C2 |
| КОНЪЮГАТЫ АМАТОКСИН - АНТИТЕЛО | 2016 |
|
RU2724328C2 |
| СПОСОБЫ СИНТЕЗА АМАТОКСИНОВОГО СТРУКТУРНОГО БЛОКА И АМАТОКСИНОВ | 2013 |
|
RU2637924C2 |
| КОНЪЮГАТ АНТИТЕЛА С АМАТОКСИНОМ НЕПРИРОДНОГО ТИПА | 2018 |
|
RU2840926C2 |
| КОНЪЮГАТ АНТИТЕЛА С АМАТОКСИНОМ НЕПРИРОДНОГО ТИПА | 2018 |
|
RU2798981C2 |
| АМАТОКСИНОВЫЕ КОНЪЮГАТЫ АНТИТЕЛА С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2826004C2 |
| СИСТЕМЫ ДОСТАВКИ ДЛЯ КОНТРОЛИРУЕМОГО ВЫСВОБОЖДЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2016 |
|
RU2748992C2 |
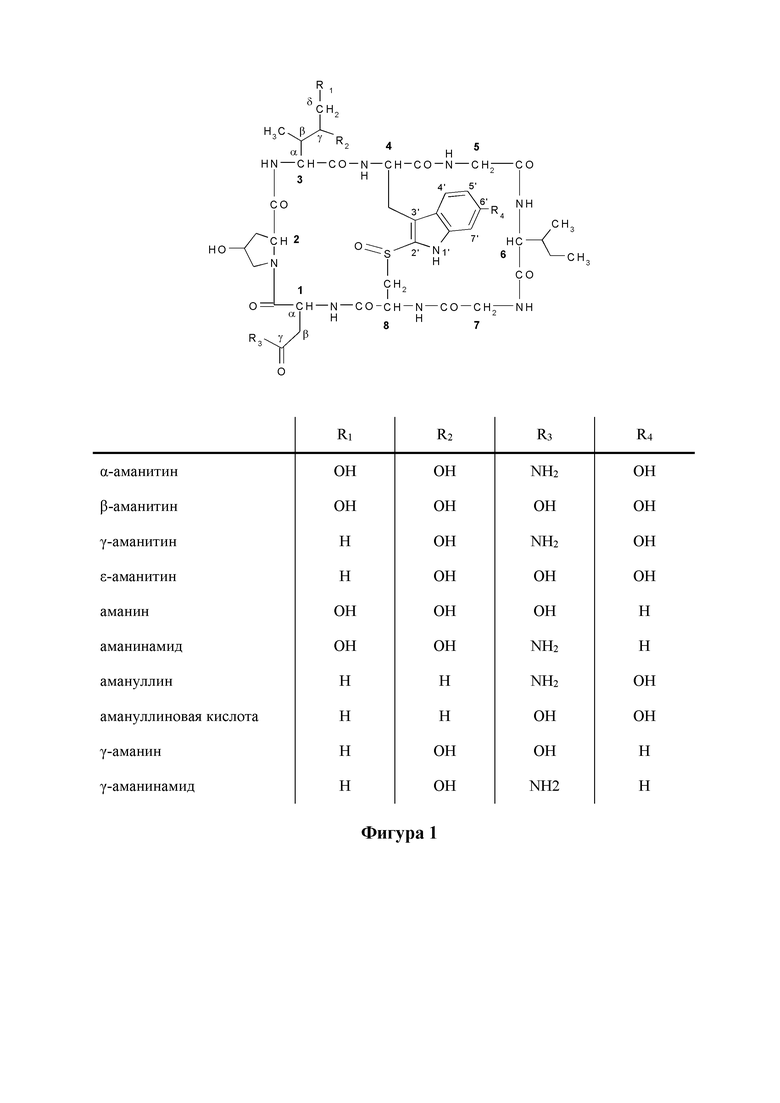
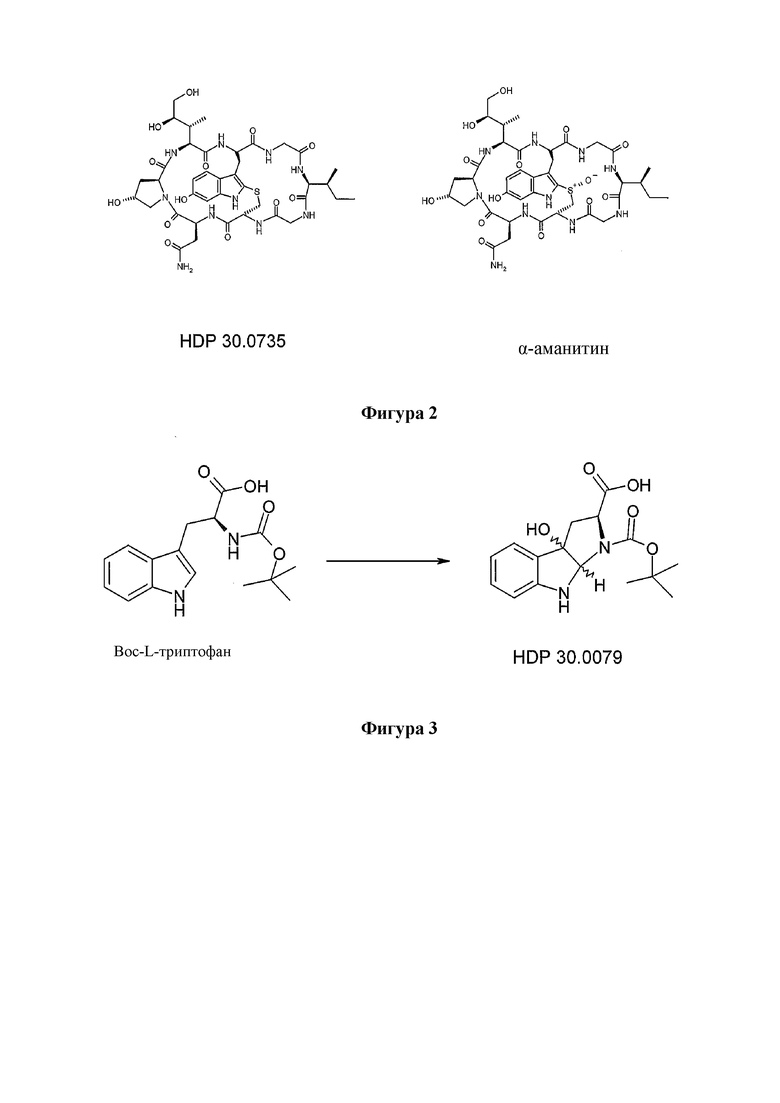
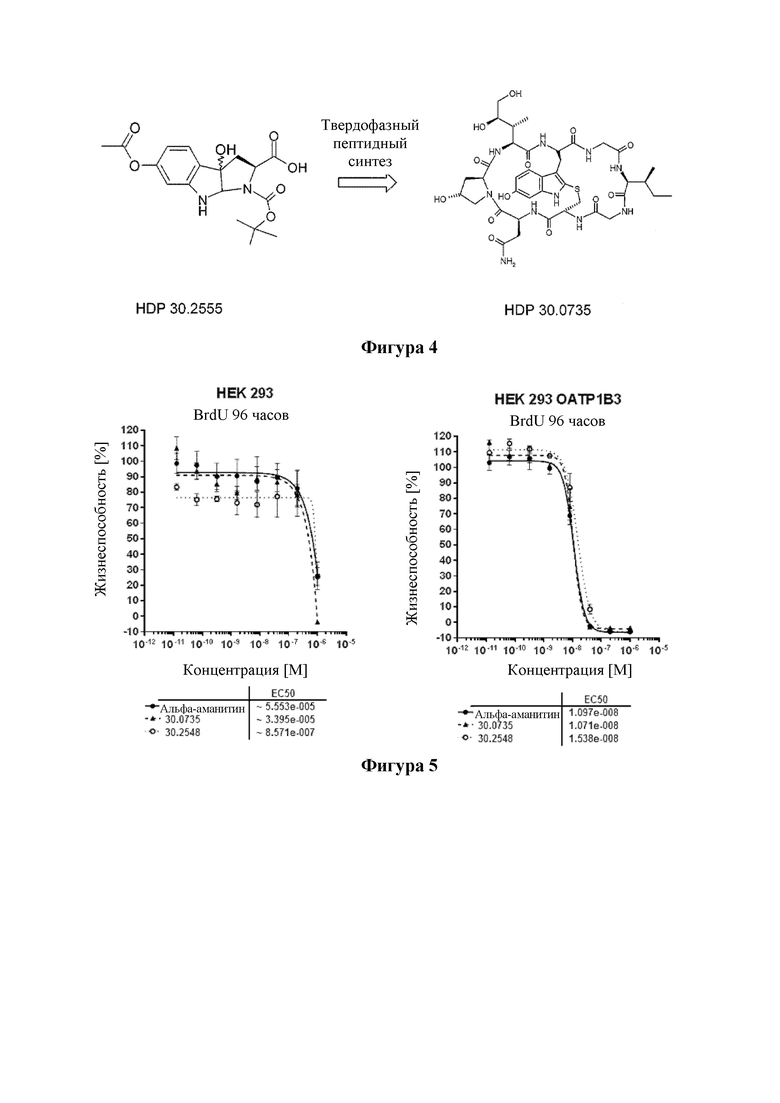
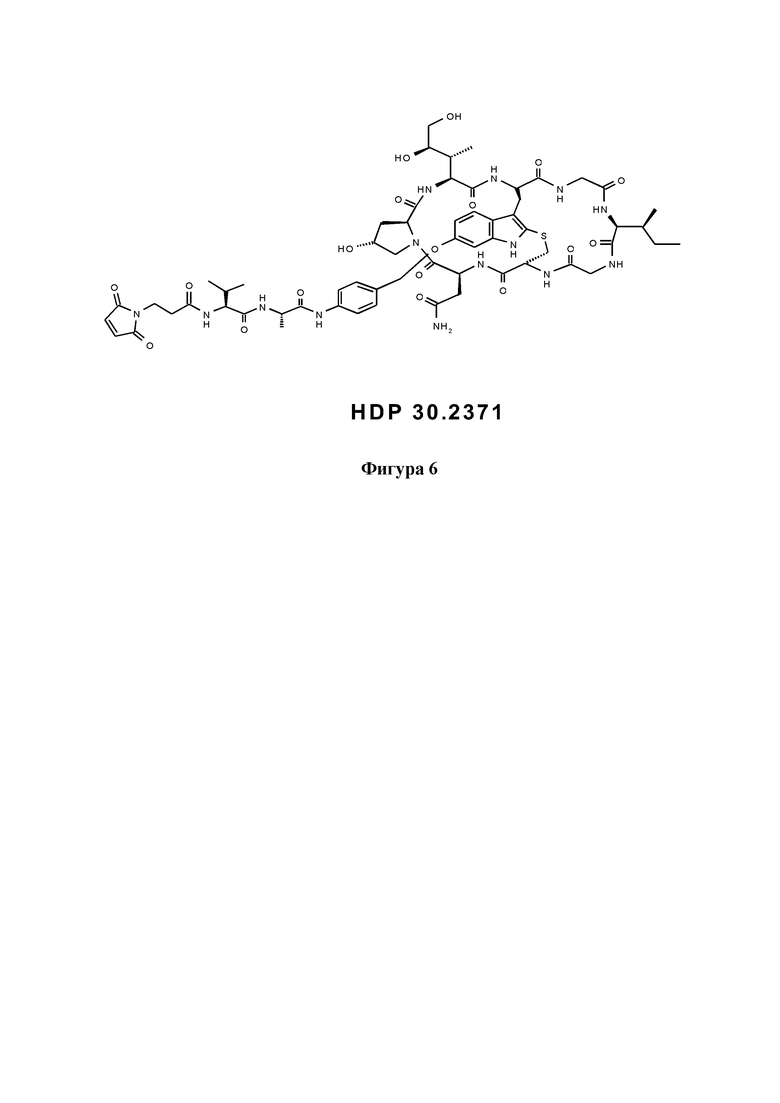
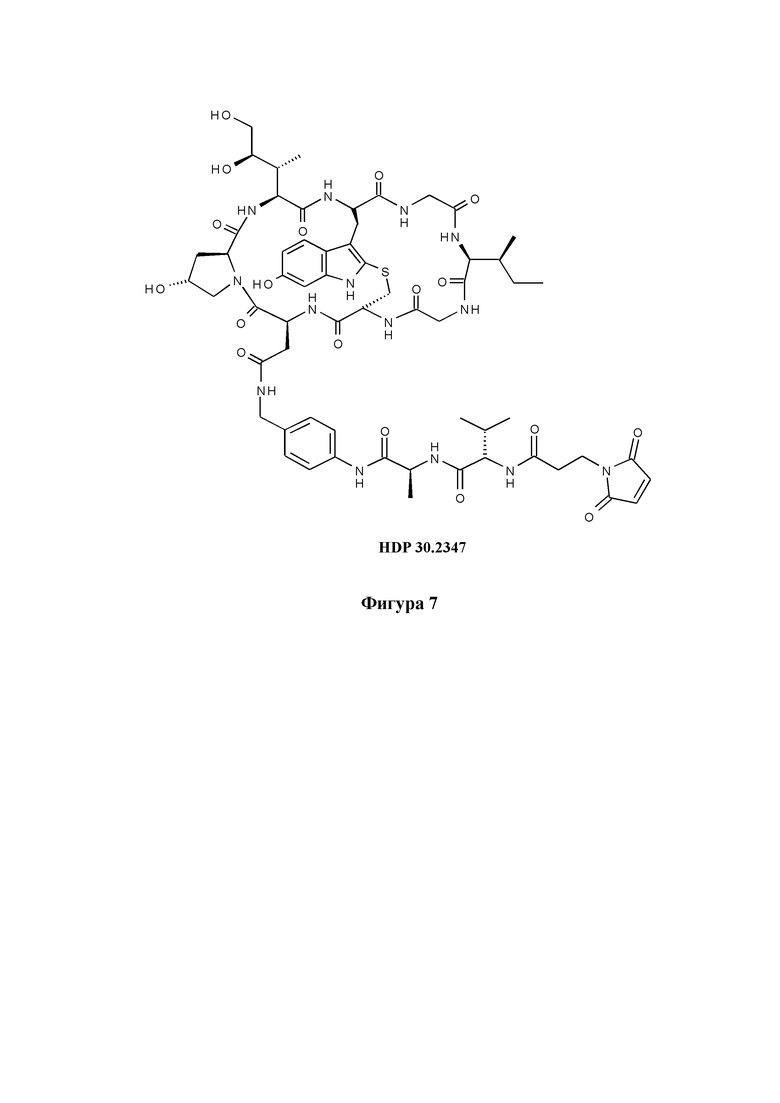
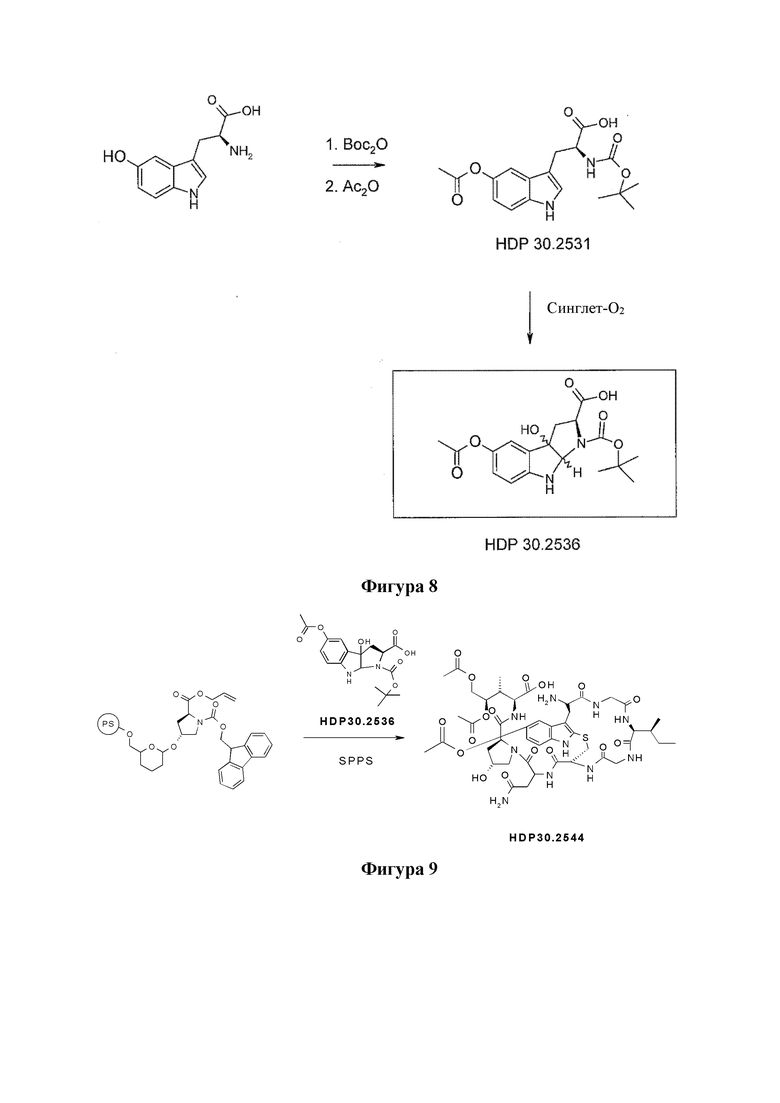
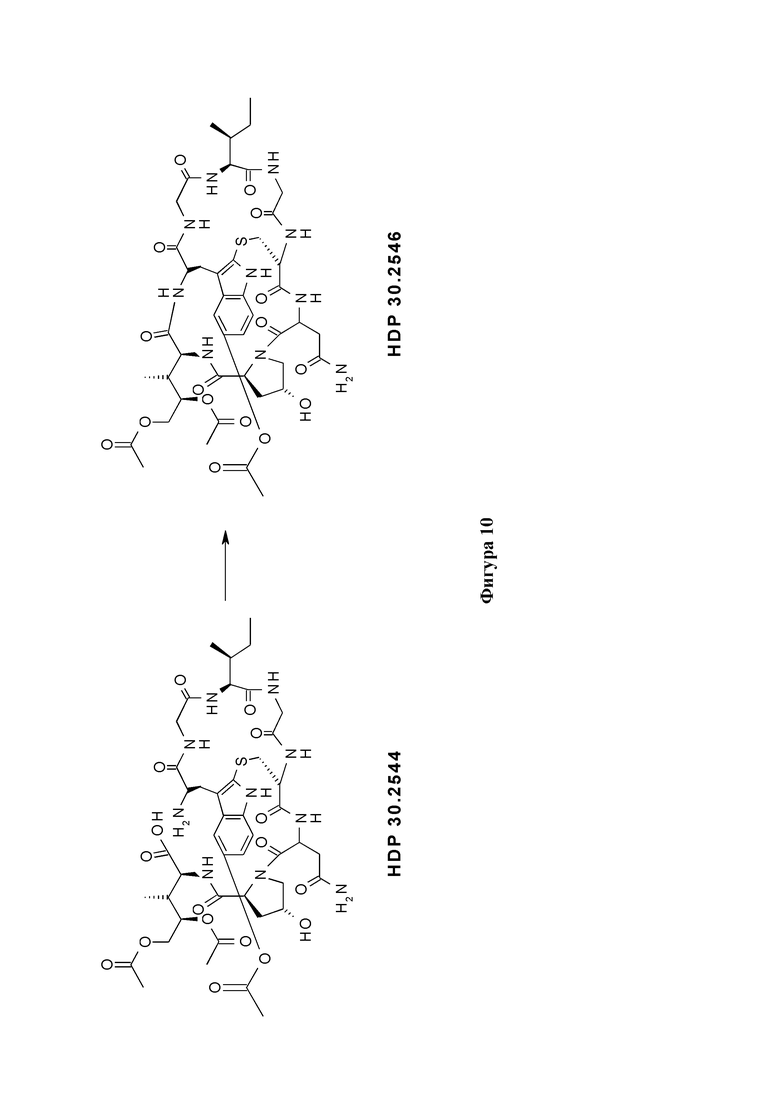
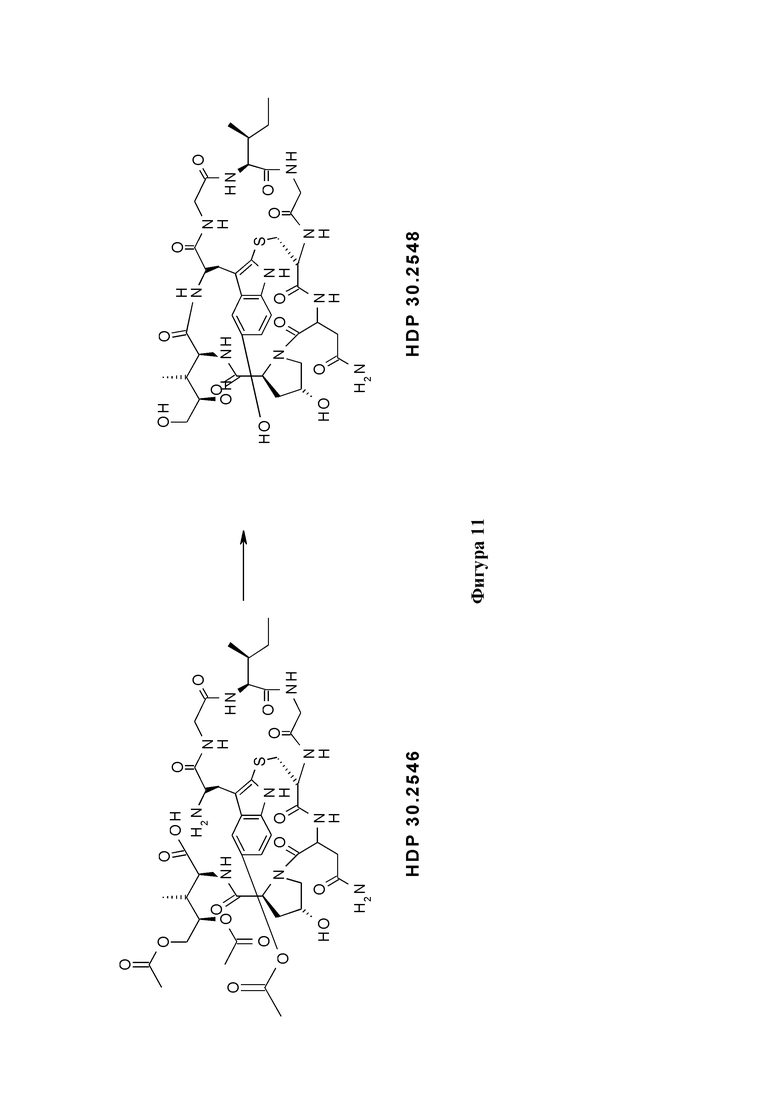
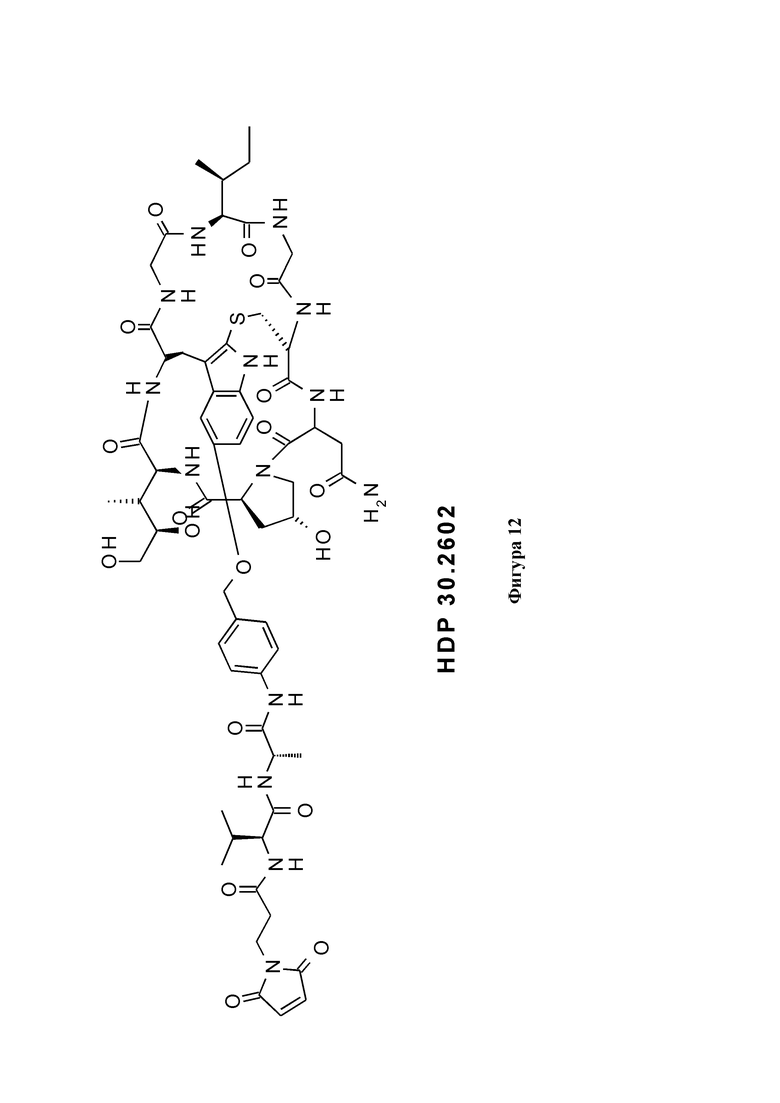
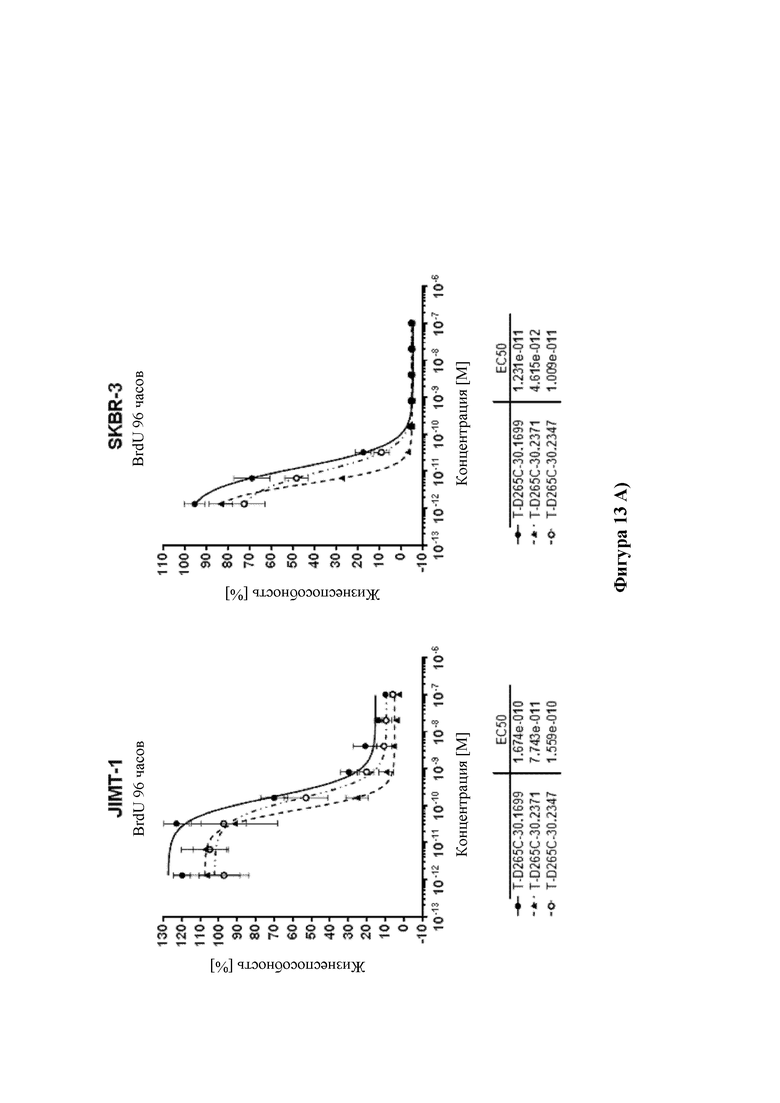
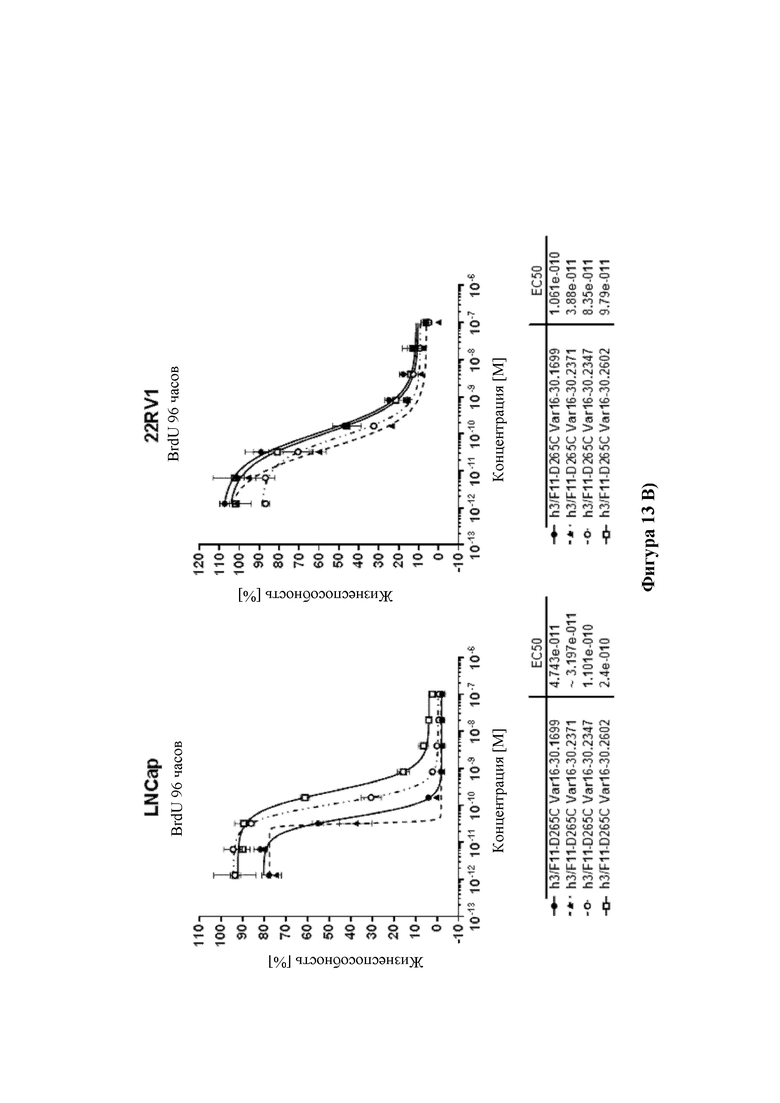
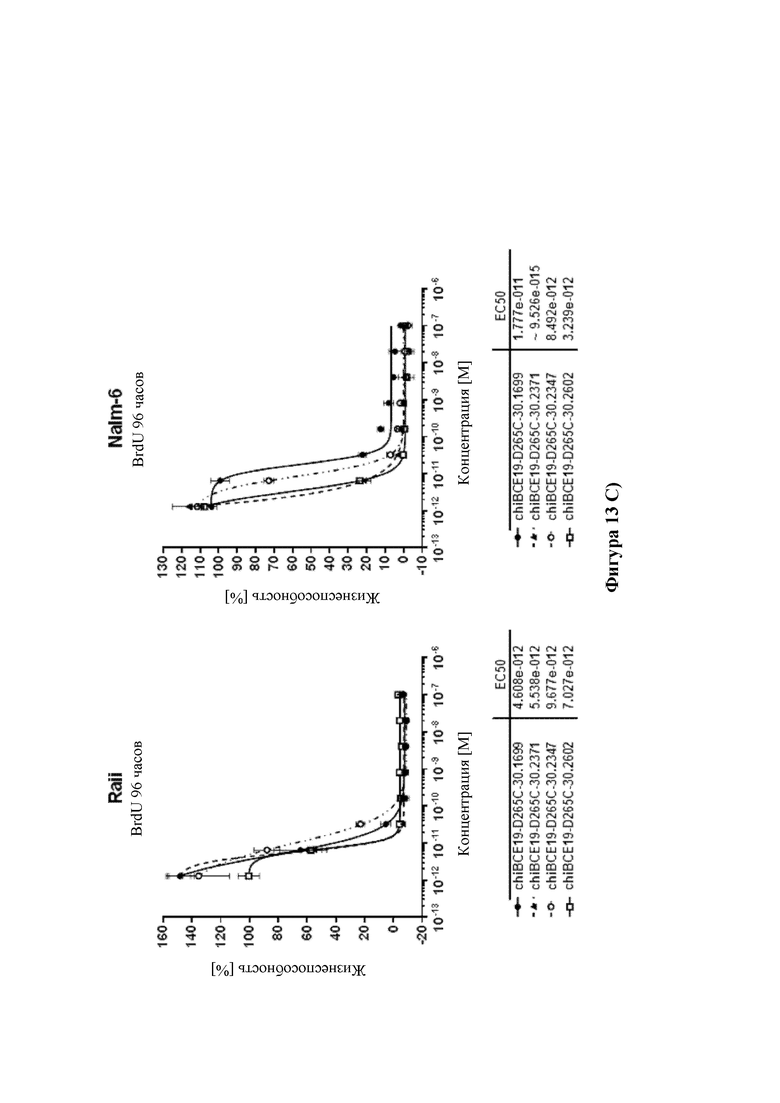
Изобретение относится к новым способам синтеза производных аманитина, имеющих гидроксигруппу, присоединенную к центральному триптофановому фрагменту, а также к гидрокси-замещенному производному 2-карбокси-3а-гидрокси-1,2,3,3а,8,8а-гексагидропирроло [2,3-b]индола в соответствии с формулой I
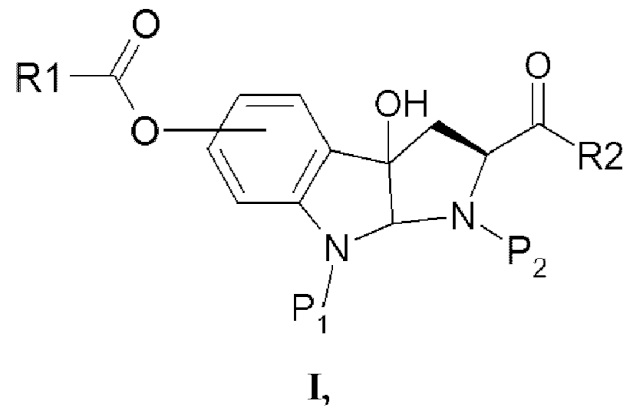
в которой R1 выбран из C1-2-алкила; P1 представляет собой водород или защитную группу; Р2 представляет собой водород или защитную группу и R2 выбран из ОН, OR1 и полипептидной цепи, состоящей из 1-7 аминокислотных остатков, причем защитная группа при наличии независимо выбрана из Boc, PhCH2OCO-, СН2=CHCH2O-СО- и тритила. Технический результат: получены новые производные аманитина, имеющие гидроксигруппу, присоединенную в положении 4', 5'', 6' или 7' центрального триптофанового фрагмента, новые конъюгаты таких производных аманитина и фармацевтические композиции, включающие в себя такие конъюгаты, для лечения злокачественной опухоли. 12 н. и 7 з.п. ф-лы, 1 пр., 15 ил.
1. Гидроксизамещенное производное 2-карбокси-3а-гидрокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индола в соответствии с формулой I
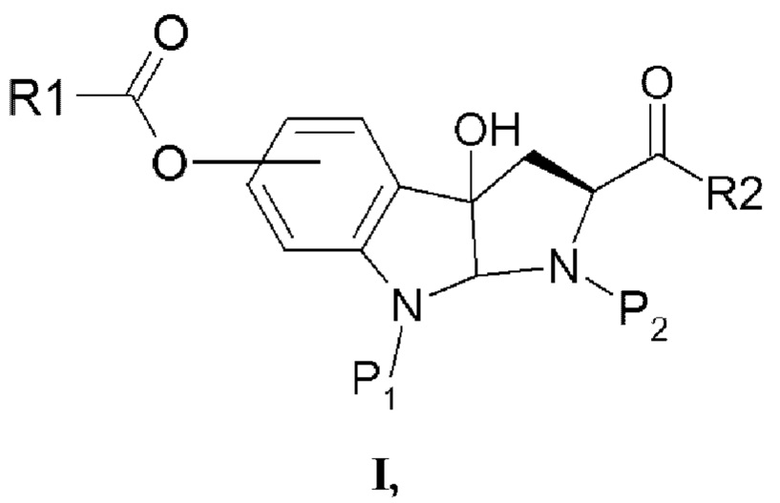
в которой R1 выбран из C1-2-алкила;
P1 представляет собой водород или защитную группу;
Р2 представляет собой водород или защитную группу и
R2 выбран из ОН, OR1 и полипептидной цепи, состоящей из 1-7 аминокислотных остатков, причем защитная группа при наличии независимо выбрана из Boc, PhCH2OCO-, СН2=CHCH2O-СО- и тритила.
2. Гидроксизамещенное производное 2-карбокси-3а-гидрокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индола по п. 1, в котором заместитель R1-C(=O)-O- присоединяется в положении 5 в формуле I.
3. Гидроксизамещенное производное 2-карбокси-3а-гидрокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индола по п. 1, в котором заместитель R1-C(=O)-O- присоединяется в положении 6 в формуле I.
4. Способ синтеза линейного предшественника, включающего в себя восемь аминокислотных остатков производного аманитина, включающего в себя гидроксилированный триптофановый фрагмент, предусматривающий стадию применения 4-, 5-, 6- или 7-гидрокси-L-триптофана для синтеза гидроксизамещенного производного 2-карбокси-3а-гидрокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индола по любому из пп. 1-3 в пептидном синтезе указанного предшественника.
5. Способ синтеза производного аманитина, включающего в себя гидроксилированный триптофановый фрагмент, предусматривающий стадии:
(i) получения линейного предшественника, состоящего из 8 аминокислотных остатков производного аманитина, используя 4-, 5-, 6- или 7-гидрокси-L-триптофан для синтеза гидрокси-замещенного производного 2-карбокси-3а-гидрокси-1,2,3,3а,8,8а-гексагидропирроло[2,3-b]индола по любому из пп. 1-3;
(ii) инициирования или обеспечения образования связи между цистеиновым остатком и триптофановым фрагментом линейного предшественника по стадии (i); и
(iii) инициирования или обеспечения образования указанного производного аманитина путем осуществления реагирования N-концевого линейного предшественника по стадии (ii) с С-концом указанного предшественника.
6. Способ по п. 5, дополнительно предусматривающий окисление атома серы цистеинового фрагмента с образованием сульфоксида или сульфона, в частности сульфоксида.
7. Производное аманитина, включающее в себя гидроксилированный триптофановый фрагмент, который выбран из
(i)
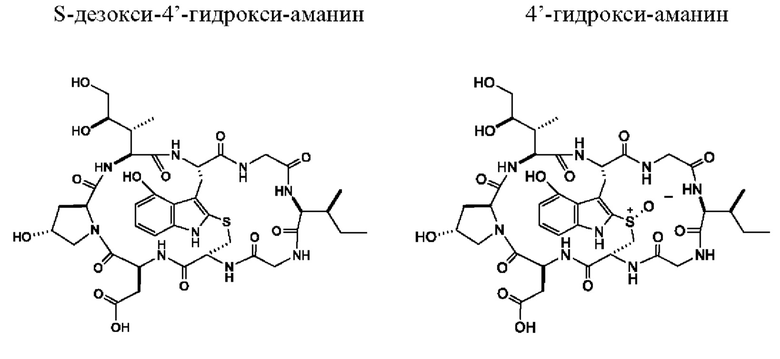
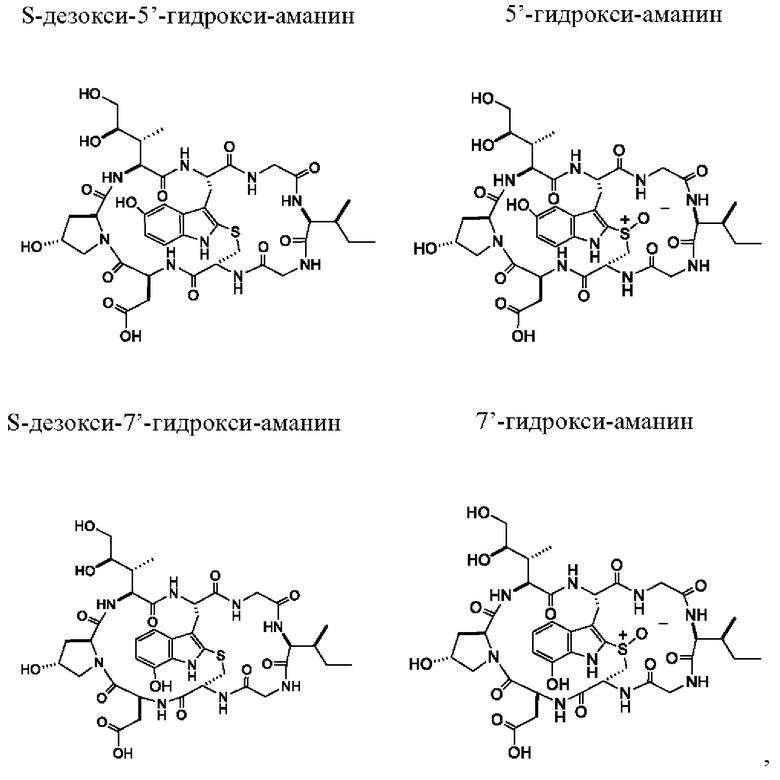
(ii)
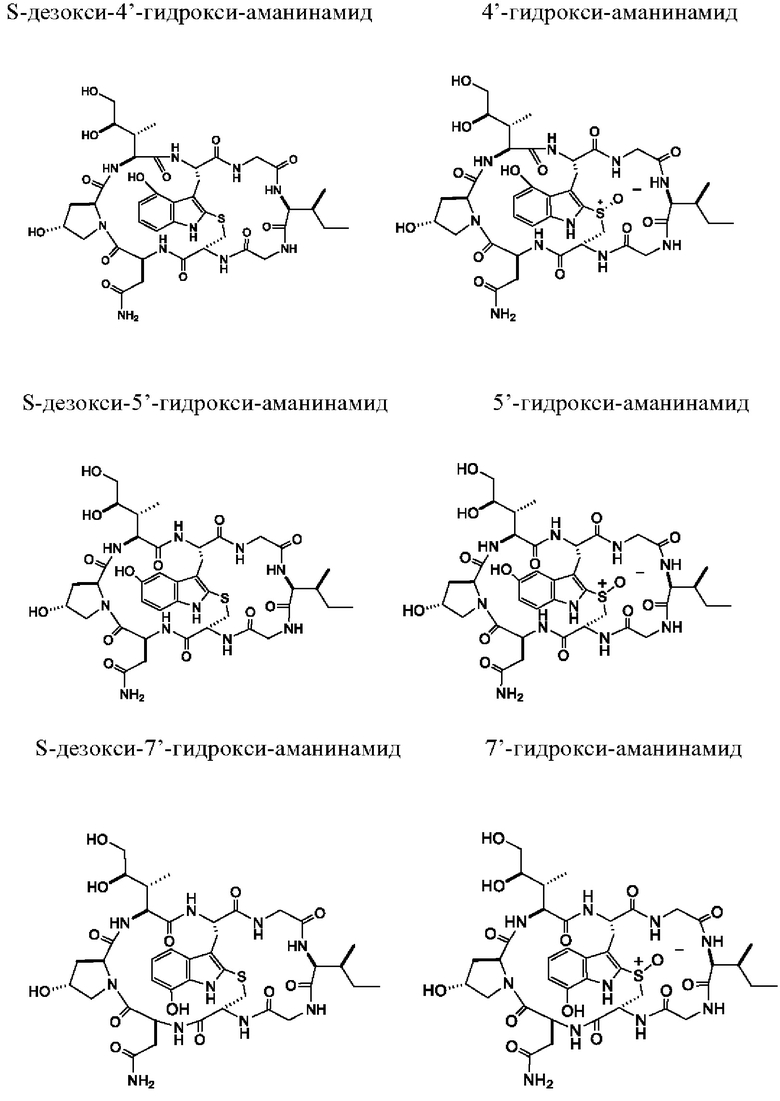
(iii) производного аманитина в соответствии с (i), при этом фрагмент свободной карбоновой кислоты аминокислоты 1 превращается в сложный эфир карбоновой кислоты -C(=O)OR1 или во фрагмент -C(=O)NH-OR1, в котором R1 выбран из алкила, арила, гетероарила.
8. Производное аманитина по п. 7, которое выбрано из S-дезокси-5'-гидрокси-аманина, 5'-гидрокси-аманина, S-дезокси-5'-гидрокси-аманинамида и 5'-гидрокси-аманинамида.
9. Применение производного аманитина по п. 7 или 8 для лечения злокачественной опухоли у больного, в частности, при этом злокачественная опухоль выбрана из группы, состоящей из рака молочной железы, рака поджелудочной железы, холангиокарциномы, рака толстой и прямой кишки, рака легкого, рака предстательной железы, рака яичника, рака желудка, рака почки, злокачественной меланомы, лейкоза и злокачественной лимфомы для достижения одной или более целей: (а) уменьшение тяжести злокачественной опухоли; (b) ограничение или предотвращение развития симптомов, характерных для злокачественной опухоли; (с) ингибирование ухудшения симптомов, характерных для злокачественной опухоли; (d) ограничение или предупреждение рецидива злокачественной опухоли у пациентов, у которых она уже обнаруживалась; и (е) ограничение или предотвращение повторного появления симптомов у пациентов.
10. Коньюгат, включающий в себя (а) производное аманитина, включающее в себя гидроксилированный триптофановый фрагмент по п. 7 или 8; (b) связывающийся с мишенью фрагмент, где мишень - это мишень на раковых клетках; и (с) необязательно линкер, связывающий указанное производное аманитина и указанный связывающийся с мишенью фрагмент, причем данный линкер имеет непрерывную цепь от 1 до 30 атомов и при этом данный линкер представляет собой алкиленовую, гетероалкиленовую, алкениленовую, гетероалкениленовую, алкиниленовую, гетероалкиниленовую, циклоалкиленовую, гетероциклоалкиленовую, ариленовую, гетероариленовую, аралкиленовую или гетероаралкиленовую группу.
11. Коньюгат по п. 10, где линкер включает в себя структуру, выбранную из группы, состоящей из
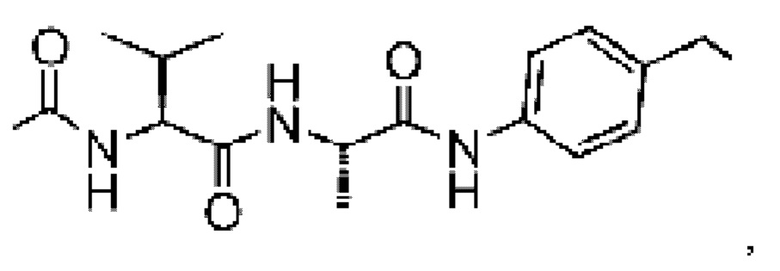
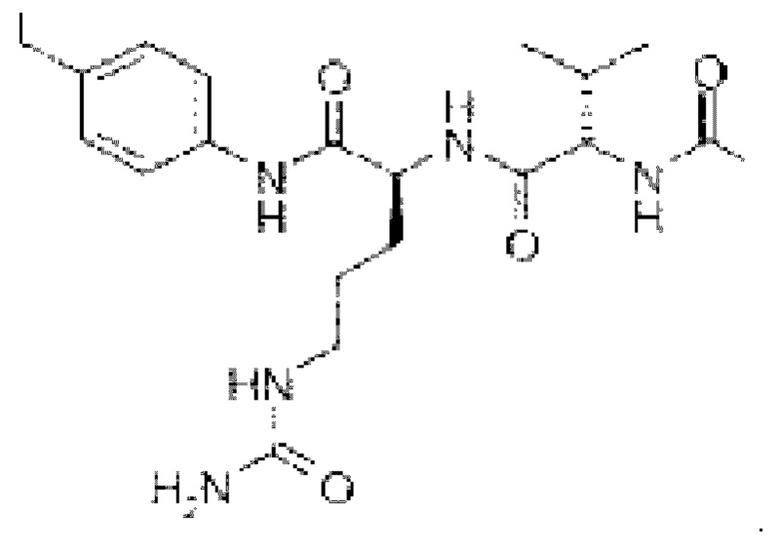
12. Применение конъюгата по п. 10 для лечения злокачественной опухоли у больного, в частности, при этом злокачественная опухоль выбрана из группы, состоящей из рака молочной железы, рака поджелудочной железы, холангиокарциномы, рака толстой и прямой кишки, рака легкого, рака предстательной железы, рака яичника, рака желудка, рака почки, злокачественной меланомы, лейкоза и злокачественной лимфомы для достижения одной или более целей: (а) уменьшение тяжести злокачественной опухоли; (b) ограничение или предотвращение развития симптомов, характерных для злокачественной опухоли; (с) ингибирование ухудшения симптомов, характерных для злокачественной опухоли, (d) ограничение или предупреждение рецидива злокачественной опухоли у пациентов, у которых она уже обнаруживалась; и (е) ограничение или предотвращение повторного появления симптомов у пациентов.
13. Фармацевтическая композиция для лечения злокачественной опухоли, включающая в себя производное аманитина по п. 7 или 8 в эффективном количестве и дополнительно включающая в себя один или несколько фармацевтически приемлемых разбавителей, носителей, вспомогательных средств, наполнителей, связывающих средств, смазывающих средств, глидантов, дезинтегрирующих средств, адсорбентов и/или консервантов, при этом злокачественная опухоль выбрана из группы, состоящей из рака молочной железы, рака поджелудочной железы, холангиокарциномы, рака толстой и прямой кишки, рака легкого, рака предстательной железы, рака яичника, рака желудка, рака почки, злокачественной меланомы, лейкоза и злокачественной лимфомы.
14. Применение фармацевтической композиции по п. 13 для лечения злокачественной опухоли у больного, в частности, при этом злокачественная опухоль выбрана из группы, состоящей из рака молочной железы, рака поджелудочной железы, холангиокарциномы, рака толстой и прямой кишки, рака легкого, рака предстательной железы, рака яичника, рака желудка, рака почки, злокачественной меланомы, лейкоза и злокачественной лимфомы, для достижения одной из следующих целей: (а) уменьшение тяжести злокачественной опухоли; (b) ограничение или предотвращение развития симптомов, характерных для злокачественной опухоли; (с) ингибирование ухудшения симптомов, характерных для злокачественной опухоли; (d) ограничение или предупреждение рецидива злокачественной опухоли у пациентов, у которых она уже обнаруживалась; и (е) ограничение или предотвращение повторного появления симптомов у пациентов.
15. Фармацевтическая композиция для лечения злокачественной опухоли, включающая в себя коньюгат по п. 10 в эффективном количестве и дополнительно включающая в себя один или несколько фармацевтически приемлемых разбавителей, носителей, вспомогательных средств, наполнителей, связывающих средств, смазывающих средств, глидантов, дезинтегрирующих средств, адсорбентов и/или консервантов, при этом злокачественная опухоль выбрана из группы, состоящей из рака молочной железы, рака поджелудочной железы, холангиокарциномы, рака толстой и прямой кишки, рака легкого, рака предстательной железы, рака яичника, рака желудка, рака почки, злокачественной меланомы, лейкоза и злокачественной лимфомы.
16. Применение фармацевтической композиции по п. 15 для применения в лечении злокачественной опухоли у больного, в частности, при этом злокачественная опухоль выбрана из группы, состоящей из рака молочной железы, рака поджелудочной железы, холангиокарциномы, рака толстой и прямой кишки, рака легкого, рака предстательной железы, рака яичника, рака желудка, рака почки, злокачественной меланомы, лейкоза и злокачественной лимфомы.
17. Конструкция, включающая в себя (а) производное аманитина по п. 7 или 8 и (b) линкерный фрагмент, несущий реакционноспособную группу Y, для связывания указанного производного аманитина со связывающимся с мишенью фрагментом, при этом одна сторона остова линкерного фрагмента прореагировала с производным аманитина, а другая сторона доступна для реакции с указанным связывающимся с мишенью фрагментом, причем после связывания указанного производного аманитина с указанным связывающимся с мишенью фрагментом данный линкер имеет непрерывную цепь от 1 до 30 атомов.
18. Конструкция по п. 17, где линкер включает в себя структуру, выбранную из группы, состоящей из
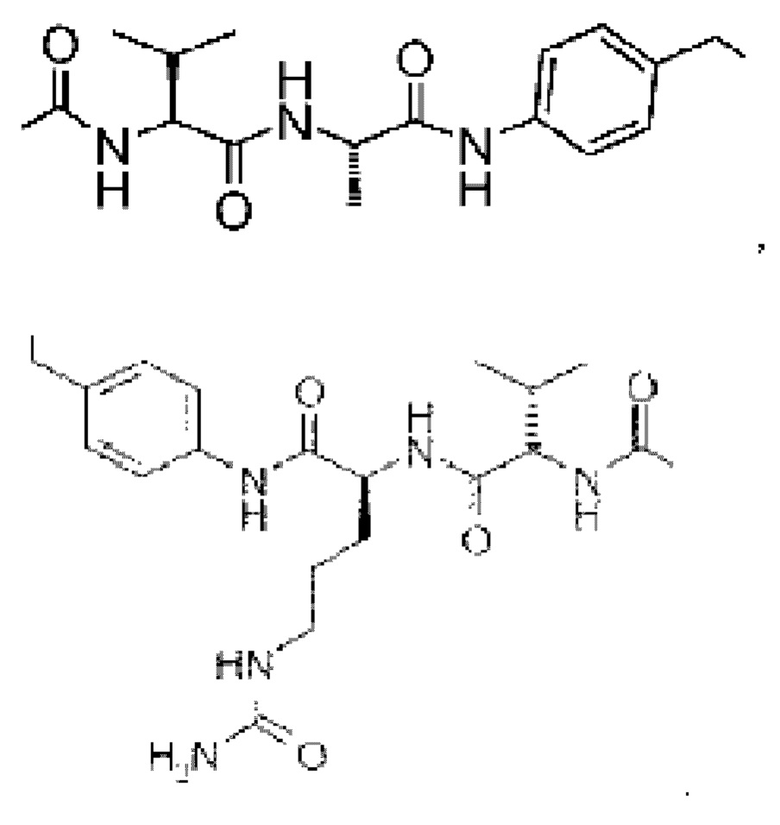
19. Конструкция по п. 17, причем указанная реакционноспособная группа Y представляет собой малеимидную группу.
| MASAKO NAKAGAWA ET AL., "DYE-SENSITIZED PHOTO-OXYGENATION OF TRYPTOPHAN", TETRAHEDRON, ELSEVIER SCIENCE PUBLISHERS, AMSTERDAM, NL, (19850101), vol | |||
| Механический грохот | 1922 |
|
SU41A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| US 2016220687 A1, 04.08.2016 | |||
| RU 2013145314 A, 20.04.2015 | |||
| WO 2014043403 A1, 20.03.2014 | |||
| КОНЪЮГАТЫ АМАТОКСИНОВ С УЛУЧШЕННЫМИ ЛИНКЕРАМИ | 2011 |
|
RU2601411C2 |
| RU | |||
Авторы
Даты
2023-03-20—Публикация
2018-08-06—Подача