Изобретение относится к новым конкурентным ингибиторам трипсиноподобных серин-протеаз, особенно тромбина, и кининогеназ, например калликреина, к их синтезу, к лекарственным формам, содержащим эти соединения в качестве активных компонентов, и к применению этих соединений в качестве ингибиторов тромбина и антикоагулянтов, а также в качестве противовоспалительных средств. Изобретение относится также к новому применению соединений в качестве исходных продуктов в синтезе ингибиторов серин-протеазы. Кроме того изобретение относится к новым фрагментам в структуре ингибиторов серин-протеазы.
Коагуляция крови является ключевым процессом, участвующим как в гемостазе (т. е. предотвращении потерь крови из поврежденных сосудов), так и в тромбозе (т. е. патологической закупорке кровеносных сосудов сгустками крови). Коагуляция является результатом серии сложных ферментативных реакций, где одна из конечных стадий заключается в превращении профермента протромбина в активный фермент тромбин.
Тромбин играет главную роль в коагуляции. Тромбин активирует тромбоциты, превращает фибриноген в мономеры фибрина, которые спонтанно полимеризуются в нити, и активирует фактор XIII, который в свою очередь сшивает полимер в нерастворимый фибрин. Фибрин, кроме того, активирует фактор V и фактор VIII в реакции с положительной обратной связью. Таким образом, ожидается, что ингибиторы тромбина будут эффективными антикоагулянтами за счет ингибирования тромбоцитов, ингибирования образования и стабилизации тромбина. Ожидается, что путем подавления механизма положительной обратной связи ингибирование ими происходит на ранних этапах в цепи событий, ведущих к коагулированию и тромбозу.
Кининогеназы относятся к серин-протеазам, которые действуют на кининогены с образованием кининов (брадикинина, каллидина и Met-Lys-брадикинина). К важнейшим кининогеназам относятся калликреин плазмы, калликреин тканей и триптаза мастоцитов.
Кинины (брадикинин, каллидин), как правило, участвуют в воспалительном процессе. К примеру, процесс активного воспаления связывают с повышенной проницаемостью кровеносных сосудов, ведущей к транссудации плазмы в ткани. Будущий плазменный экссудат содержит все белковые системы циркулирующей крови. Происходящие из плазмы кининогены неизбежно реагируют с различными калликреинами с непрерывным образованием кининов до тех пор, пока продолжается активный процесс экссудации плазмы. Экссудация плазмы происходит независимо от механизма, имеющего место при воспалении, будь то аллергия, инфекция или иные факторы (Persson и др. , под редакцией Thorax, 1992, 47, 993-1000). Таким образом, экссудация плазмы является признаком многих заболеваний, в том числе: астмы, ринита, насморка и воспалительных заболеваний кишечника. В частности, при аллергии происходит выделение триптазы мастоцитов (Salomonsson и др., Ann. Rev. Pespir. Dis., 1992, 146, 1535-1542) с внесением своего вклада в образование кининов и иных патогенных факторов при астме, рините и заболеваниях кишечника.
С биологической точки зрения кинины относятся к высокоактивным веществам, действующим на гладкую мускулатуру, с секреторной активностью, нейрогенной активностью и действием, способным влиять на воспалительные процессы, включающими активирование фосфолипазы A2 и повышающими проницаемость сосудов. Последний эффект потенциально индуцирует непрерывный цикл с участием кининов с образованием все большего количества кининов и т.п.
Тканевый килликреин преимущественно расщепляет низкомолекулярные кининогены с образованием каллидина, а плазменный калликреин предпочтительно образует брадикинин из высокомолекулярных кининогенов.
Первые сообщения об ингибиторах тромбина, основанных на аминокислотной последовательности вблизи участка отщепления для A α цепи фибриногена, имеются в работе Blomback и др. (J., Clin. Lab. Invest. 24, suppl. 107, 59 (1969)), в которой предполагается, что последовательность Phe-Val-Arg (P9-P2-P1, далее обозначаемая, как P3-P2-P1 последовательность) является наилучшим ингибитором.
В патенте США 4,346,078 (S. Bajusz и др.) в качестве ингибитора тромбина раскрыт H-DPhe-Pro-Agm, т. е. дипептидильное производное с аминоалкильным гуанидином в P1-положении.
Ингибиторы тромбина, основанные на пептидных производных с циклическим аминоалкильным гуанидином, напр., 3-аминометил-1-аминопиперидином в P1-положении, раскрыты в EP-A2-0,468,231.
В EP-A2-0,185,390 (S.Bajusz и др.) показано, что замена агматина альдегидом аргинина приводит к ингибитору тромбина с гораздо более высокой эффективностью.
Несколько ранее появились сообщения об ингибиторах калликреина, основанных на аминокислотной последовательности возле участка расщепления Arg-Ser.
В работах Kettner и Shaw (Biochemistry 1978, 17, 4778-4784 и Meth. Enzym. 1981, 80, 826-842) сообщается о хлорметилкетонах аргинина формул H-DPro-Phe-Arg-CH2Cl и H-DPhe-Phe-Arg-CH2Cl, как об ингибиторах калликреина плазмы.
Аналогичное сообщение о сложных эфирах и амидах, содержащих H-DPro-Phe-Arg последовательность, как об ингибиторах калликреина плазмы, приводятся в работе Farred и др. (Ann. N.Y. Acad. Sci. 1981, 370, 765-784).
Ингибиторы серин-протеаз, основанные на электрофильных кетонах, а не на альдегидах в P1-положении, раскрываются в следующих патентных публикациях.
В EP-A2-0,195,212 раскрыты пептидильные α- кетоэфиры и амиды, в EP-A1-0,362,002 раскрыты фторалкиламидокетоны и в EP-A2-0,364,344 раскрыты α,β,δ- трикетопроизводные, обладающие различными свойствами ингибиторов пептидаз.
Ингибиторы трипсиноподобных серин-протеаз, например: тромбина и калликреина, основанные на C-концевых производных аргинина с бороновой кислотой, и изотиурониевые аналоги этих производных раскрыты в EP-A2-0,293,881.
В патенте WO 92/04371 раскрыты ингибиторы кининогеназы, напр., ингибиторы калликреина, основанные на производных аргинина.
В патенте EP-A1-0,530,167 раскрыты α- алкоксикетопроизводные аргинина в качестве ингибиторов тромбина.
Задача настоящего изобретения заключается в создании новых и эффективных ингибиторов трипсиноподобной серин-протеазы, особенно к антикоагулянтным и противовоспалительным соединениям с конкурентной ингибирующей активностью по отношению к своим ферментам, т.е. вызывающим обратимое ингибирование. Более конкретно, предложены антикоагулянты для профилактики и лечения тромбоэмболических заболеваний, например, венозного тромбоза, эмболии легких, артериального тромбоза, в частности, при инфаркте миокарда и церебрального тромбоза, состояний общей сверхкоагуляции и состояний местной сверхкоагуляции, например, после пластических операций на сосудах и байпасных венечных операциях и в иных ситуациях, в которых, как полагают, свою роль играет тромбин, например, при болезни Альцгеймера, а также для ингибирования кининогеназ при лечении воспалительных нарушений, например, астмы, ринита, крапивницы, воспалительного заболевания кишечника и артрита. Еще одна цель изобретения заключается в получении ингибиторов тромбина, характеризующихся пероральной биодоступностью и селективным ингибированием тромбина по сравнению с другими серин-протеазами. И еще одна цель изобретения заключается в получении ингибиторов кининогеназ, которые могут вводиться перорально, ректально, местно, например, нанесением на кожу или путем ингаляции.
Соединения
В соответствии с изобретением обнаружено, что соединения общей формулы 1, как таковые или в виде физиологически приемлемых солей, включая и стереоизомеры, являются эффективными ингибиторами серин-протеаз, особенно тромбина и кининогеназ, например, калликреина:
A1 --- A2 --- N --- (CH2)n --- B, (I)
где A1 представляет структурный фрагмент формул IIa, IIb, IIc, IId и IIe: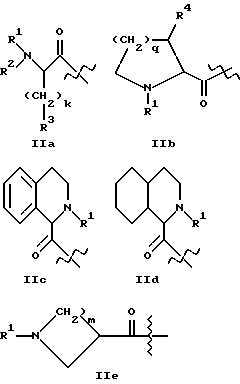
где k равно целому числу 0, 1, 2, 3 или 4;
m равно целому числу 1, 2, 3 или 4;
q равно целому числу 0, 1, 2 или 3;
R1 представляет H, алкильную группу с 1 - 4 атомами углерода или R11-OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможно замещена в альфа-положении к карбонильной группе, причем альфа-заместитель представлен группой R17-(CH2)p-, где p равно целому числу 0, 1 или 2 и R17 - метил, фенил, OH, COOR12, CONHR12, где R12 - H или алкильная группа с 1 - 4 атомами углерода и R11 - H или алкильная группа с 1 - 6 атомами углерода, или
R1 представляет Ph (4-COOR12)-CH2-, где R12 принимает вышеуказанные значения, или
R1 представляет R13-NH-CO-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1 - 4 атомами углерода, и где R13 - H, алкильная группа с 1 - 4 атомами углерода или -CH2-COOR12, где R12 принимает вышеуказанные значения, или R1 представляет R12OOC-CH2-OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1 - 4 атомами углерода, и где R12 принимает вышеуказанные значения, или
R1 представляет R14SO2-, Ph(4-COOR12)-SO2-, Ph(3-COOR12)-SO2-, Ph(2-COOR12)-SO2-, где R12 принимает вышеуказанные значения и R14 - алкильная группа с 1 - 4 атомами углерода, или
R1 представляет -CO-R15, где R15 - алкильная группа с 1 - 4 атомами углерода, или
R1 представляет -CO-OR15, где R15 принимает вышеуказанные значения, или
R1 представляет -CO-(CH2)p-COOR12, где R12 принимает вышеуказанные значения, p равно целому числу 0, 1 или 2, или
R1 представляет -CH2PO(OR16)2, -CH2SO3H или -CH2-(5-(1H)-тетразолил), где R16 независимо в каждом случае представляет H, метил или этил;
R2 представляет H, алкильную группу с 1 - 4 атомами углерода или R21OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и где R21 - H или алкильная группа с 1 - 4 атомами углерода;
R3 представляет алкильную группу с 1 - 4 атомами углерода, и алкильная группа незамещена или замещена одним или несколькими атомами фтора, или
R3 представляет циклопентильную, циклогексильную или фенильную группы, которые незамещены или замещены алкильной группой с 1 - 4 атомами углерода, или
R3 представляет фенильную группу, замещенную группой OR31, где R31 - H или алкильная группа с 1 - 4 атомами углерода и k = 0, 1 или
R3 представляет 1-нафтильную или 2-нафтильную группу и k = 0, 1, или
R3 представляет цис- или транс-декалиновую группу и k = 0, 1, или
R3 представляет 4-пиридил, 3-пирролидил или 4-индолил, которые незамещены или замещены группой OR31, где R31 принимает вышеуказанные значения, и k = 0, 1, или
R3 представляет Si(Me)3 или CH(R32)2, где R32 - циклогексильная или фенильная группа;
R4 представляет H, алкильную группу с 1 - 4 атомами углерода, цилкогексильную или фенильную группу;
A2 представляет структурный фрагмент формул IIIa, IIIb и IIIc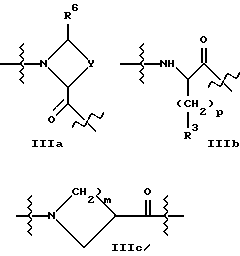
где p = 0, 1 или 2;
m = 1, 2, 3 или 4;
Y представляет метиленовую группу или
Y представляет этиленовую группу и образованный в результате 5-членный цикл незамещен или замещен одним или двумя атомами фтора, гидроксигруппой или оксогруппой в 4-положении, или ненасыщен, или
Y представляет -CH2-O-, -CH2-S-, -CH2-SO- с гетероатомной функциональностью в 4-положении, или
Y представляет н-пропиленовую группу, и образованный в результате 6-членный цикл незамещен или замещен в 5-положении одним атомом фтора, гидроксигруппой или оксогруппой, может содержать два атома фтора в одном из 4- или 5-положений или быть ненасыщенным в 4- и 5-положении или может содержать в 4-положении алкильную группу с 1 - 4 атомами углерода, или
Y представляет -CH2-O-CH2-, -CH2-S-CH2-, -CH2-SO-CH2-, или
Y представляет -CH2-CH2-CH2-CH2-;
R3 принимает вышеуказанные значения;
R5 представляет H или алкильную группу с 1 - 4 атомами углерода или
R5 представляет -CH2 p-COOR51, где p = 0, 1 или 2 и R51 - H или алкильная группа с 1 - 4 атомами углерода;
n = 0, 1, 2, 3 или 4;
B представляет структурный фрагмент формул IVa, IBb, IVc или IVd: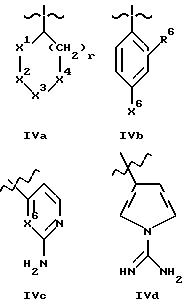
где r = 0 или 1;
X1 представляет CH2, NH или отсутствует;
X2 представляет CH2, NH или C=NH;
X3 представляет NH, C=NH, N-C(NH)-NH2, CH-C(NH)-NH2, CH-NH-C(NH)-NH2 или CH-CH2-C(NH)-NH2;
X4 представляет CH2 или NH;
К рекомендуемым сочетаниям X1, X2, X3, X4 и r относятся:
X1, X2 и X4 - группа CH2, X3 - группа CH-C(NH)-NH2 и r = 0, 1 или
X1, X2 и X4 - группа CH2, X3 - группа N-C(NH)-NH2 и r = 0, 1 или
X1 и X3 - группа NH, X2 - группа C=NH, X4 - группа CH2 и r = 0, 1 или
X1 и X4 - группа CH2, X2 - группа C=NH, X3 - группа NH и r = 0, 1 или
X1 - группа CH2, X2 и X4 - группа NH, X3 - группа C=NH и r = 0, 1 или
X1, X2 и X4 - группа CH2, X3 - группа CH-NH-C(NH)-NH2 и r = 0, 1 или
X1 отсутствует, X2 и X4 - группа CH2, X3 - группа CH-C(NH)-NH2 и r = 0 или
X1 отсутствует, X2 и X4 - группа CH2, X3 - группа N-C(NH)-NH2 и r = 0.
К особенно рекомендуемым сочетаниям X1, X2, X3, X4 и r относятся:
X1, X2 и X4 - группа CH2, X3 - группа CH-C(NH)-NH2 и r = 1;
X1, X2 и X4 - группа CH2, X3 - группа N-C(NH)-NH2 и r = 0 или 1;
X1 отсутствует, X2 и X4 - группа CH2, X3 - группа N-C(NH)-NH2 и r = 0;
X1 и X3 - группа NH, X2 - группа C=NH, X4 - группа CH2 и r = 1;
X5 представляет C(NH)-NH2 или NH-C(NH)-NH2;
R6 - H или алкильная группа с 1 - 4 атомами углерода;
X6 представляет CH или N.
К рекомендуемым соединениям формулы I относятся соединения, имеющие S-конфигурацию в аминокислоте A2, и из этих соединений особенно предпочтительны также соединения с R-конфигурацией для аминокислоты A1.
В контексте настоящего изобретения термин "алкильная группа с 1 - 4 атомами углерода", если нет особых указаний, относится к прямой или разветвленной группе. Алкильная группа с 1 - 4 атомами углерода может быть представлена метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом, втор-бутилом и трет-бутилом.
В контексте настоящего изобретения термин "алкильная группа с 1 - 6 атомами углерода", если нет особых указаний, относится к прямой или разветвленной группе. Алкильная группа с 1 - 6 атомами углерода может быть представлена метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом, втор-бутилом, трет-бутилом, н-пентилом, изопентилом, третпентилом, неопентилом, н-гексилом или изогексилом. Когда дается ссылка на ненасыщенность, в этом случае речь идет об углерод-углеродной двойной связи.
Волнистой линией у атома углерода в карбонильной группе в формулах IIa, IIb, IIc, IId, IIe, IIIa, IIIb, IIIc, у атома азота в формулах IIIa, IIIb, IIIc и V атома углерода в циклической системе в формулах IVa, IVb, IVc, IVd означает положение связи во фрагменте.
Перечень применения сокращений приведен в конце данного описания.
Согласно настоящему изобретению обнаружено, что соединения формулы Ia, как таковые или в виде физиологически приемлемых солей, включая и стереоизомеры, являются эффективными ингибиторами тромбина:
A1 --- A2 --- NH --- (CH2)n --- B, (Ia)
где A1 представляет структурный фрагмент формул IIa, IIb, IIc или IId, предпочтительно IIa или IIb;
где k = 0, 1, 2, 3 или 4, предпочтительно 0, 1;
q = 0, 1, 2 или 3, предпочтительно 1;
R1 представляет H, алкильную группу с 1 - 4 атомами углерода, R1IOOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможно замещена в альфа-положении к карбонильной группе, причем альфа-заместитель представлен группой R17-(CH2)p-, где p = 0, 1 или 2, R17 - метил, фенил, OH, COOR12, CONHR12, где R12 - H или алкильная группа с 1 - 4 атомами углерода и R11 - H или алкильная группа с 1 - 6 атомами углерода, или
R1 представляет Ph(4-COOR12)-CH2-, где R12 принимает вышеуказанные значения, или
R1 представляет R13-NH-CO-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1 - 4 атомами углерода и где R13 представляет H, алкильную группу с 1 - 4 атомами углерода или -CH2-COOR12, где R12 принимает вышеуказанные значения, или
R1 представляет R12OOC-CH2-OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1 - 4 атомами углерода и где R12 принимает вышеуказанные значения, или
R1 представляет R14SO2-, Ph(4-COOR12)-SO2-, Ph(3-COOR12)-SO2-, Ph(2-COOR12)-SO2-, где R12 принимает вышеуказанные значения и R14 - алкильная группа с 1 - 4 атомами углерода, или
R1 представляет -CO-R15, где R15 - алкильная группа с 1 - 4 атомами углерода, или
R1 представляет -CO-OR15, где R15 принимает вышеуказанные значения, или
R1 представляет -CO-(CH2)p-COOR12, где R12 принимает вышеуказанные значения, p равно 0, 1 или 2, или
R1 представляет -CH2PO(OR16)2, -CH2SO3H или -CH2-(5-(1H)-тетразолил), где R16 независимо в каждом случае представляет H, метил или этил.
Предпочтительно R1 представляет R11-OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода, и R11 - H.
R2 представляет H, алкильную группу с 1 - 4 атомами углерода или R21OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода, и R21 - H или алкильная группа с 1 - 4 атомами углерода;
R3 представляет алкильную группу с 1 - 4 атомами углерода, и алкильная группа незамещена или замещена одним или несколькими атомами фтора, или
R3 представляет циклопентильную, циклогексильную или фенильную группы, которые незамещены или замещены алкильной группой с 1 - 4 атомами углерода, или
R3 представляет 1-нафтильную или 2-нафтильную группу и k = 0, 1, или
R3 представляет цис- или транс-декалиновую группу и k = 0, 1, или
R3 представляет Si(Me)3 или CH(R32)2, где R32 - циклогексильная или фенильная группа;
R4 представляет алкильную группу с 1 - 4 атомами углерода, цилкогексильную или фенильную группу, предпочтительно циклогексильную или фенильную группу;
A2 представляет структурный фрагмент формул IIIa, IIIb или IIIc, предпочтительно IIIa,
где p = 0, 1 или 2;
m = 1, 2, 3 или 4, предпочтительно 2, 3;
Y представляет метиленовую группу или
Y представляет этиленовую группу, и образованный в результате 5-членный цикл незамещен или замещен одним или двумя атомами фтора, гидроксигруппой или оксогруппой в 4-положении, или может быть насыщенным или ненасыщенным, или
Y представляет -CH2-O-, -CH2-S-, -CH2-SO- с гетероатомной функциональностью в 4-положении, или
Y представляет н-пропиленовую группу, и образованный в результате 6-членный цикл незамещен или замещен в 5-положении одним атомом фтора, гидроксигруппой или оксогруппой, замещен двумя атомами фтора в одном из 4- или 5-положениях, может быть ненасыщенным в 4- или 5-положении или быть замещенным в 4-положении алкильной группой с 1 - 4 атомами углерода, или
Y представляет -CH2-O-CH2-, -CH2-S-CH2-, -CH2-SO-CH2-, или
Y представляет -CH2-CH2-CH2-CH2-;
R3 представляет алкильную группу с 1 - 4 атомами углерода или
R3 представляет группу Si(Me)3;
R5 представляет H или алкильную группу с 1 - 4 атомами углерода, предпочтительно H или метил, или
R5 представляет -(CH2)p-COOR51, где p = 0, 1 или 2 и R51 - H или алкильная группа с 1 - 4 атомами углерода, предпочтительно p = 0, и R51 - H;
n = 0, 1, 2, 3 или 4, предпочтительно 1, 2, 3;
B представляет структурный фрагмент формул IVa, IBb, IVc или IVd, предпочтительно IVa или IVb;
где X1, X2, X3, X4, X5 и X6 принимают вышеуказанные значения;
r = 0 или 1;
R6 - H или алкильная группа с 1 - 4 атомами углерода, предпочтительно H;
к рекомендуемым сочетаниям X1, X2, X3, X4 и r относятся:
X1, X2 и X4 - группа CH2, X3 - группа CH-C(NH)-NH2 и r = 0 или 1, или
X1, X2 и X4 - группа CH2, X3 - группа N-C(NH)-NH2 и r = 0 или 1, или
X1 и X3 - группа NH, X2 - группа C=NH, X4 - группа CH2 и r = 0 или 1, или
X1 и X4 - группа CH2, X2 - группа C=NH: X3 - группа NH и r = 0 или 1, или
X1 - группа CH2, X2 и X4- группа NH, X3 - группа C=NH и r = 0, 1 или
X1, X2 и X4 - группа CH2, X3 - группа CH-NH-C(NH)-NH2 и r = 0, 1 или
X1 отсутствует, X2 и X4 - группа CH2, X3 - группа CH-C(NH)-NH2 и r = 0, 1 или
X1 отсутствует, X2 и X4 - группа CH2, X3 - группа N-C(NH)-NH2 и r = 0;
к особенно рекомендуемым сочетаниям X1, X2, X3, X4 и r относятся:
X1 отсутствует, X2 и X4 - группа CH2, X3 - группа N-C(NH)-NH2 и r = 0 или
X1, X2 и X4 - группа CH2, X3 - группа CH-C(NH)-NH2 и r = 1, или
X1, X2 и X4 - группа CH2, X3 - группа N-C(NH)-NH2 и r = 0, 1 или
X1 и X3 - группа NH, X2 - группа C=NH, X4 - группа CH2, r = 1;
X5 представляет C(NH)-NH2 или NH-C(NH)-NH2; предпочтительно C(NH)NH2;
X6 представляет CH или N.
Согласно рекомендуемому воплощению изобретение относится к соединениям формулы Ia,
где
A1 представляет структурный фрагмент формулы IIa, где
k = 0 или 1;
R1 представляет R11OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода, в частности, метилен, этилен и R11 - H;
R2 представляет H;
R3 представляет циклогексильную группу;
A2 представляет структурный фрагмент формулы IIIa, где
Y представляет метиленовую группу, этиленовую группу или н-пропиленовую группу, и образованный 6-членный цикл незамещен или замещен в 4-положении алкильной группой с 1 - 4 атомами углерода, предпочтительно Y представляет метилен, этилен;
R5 представляет H;
B представляет структурный фрагмент формулы IVa, где
X1 отсутствует, X2 и X4 - группа CH2, X3 - группа N-C(NH)-NH2, r = 0, n = 1 или 2;
X1 и X3 - группа NH, X2 - группа C=NH, X4 - группа CH2, r = 1, n = 2, или
X1, X2 и X4 - группа CH2, X3 - группа CH-C(NH)-NH2, r = 1, n = 1, или
X1, X2 и X4 - группа CH2, X3 - группа N-C(NH)-NH2, r = 0 или 1, n = 1 или 2, или
более предпочтительно соединения, где B представляет структурный фрагмент формулы IVb, где
X5 представляет C(NH)-NH2, R6 - H, n = 1.
К рекомендуемым соединениям изобретения относятся соединения формул:
HOOC-CH2-(R)Cgl-Aze-Pab
HOOC-CH2-CH2-(R)Cgl-Aze-Pab
HOOC-CH2-(R)Cgl-Pro-Pab
HOOC-CH2-CH2-(R)Cgl-Pro-Pab
(HOOC-CH2)2-(R)Cgl-Pro-Pab
H-(R)Cgl-Pic-Pab
HOOC-CH2-(R,S)CH(COOH)-(R)Cgl-Pic-Pab
H-(R)Cha-Aze-Pab
HOOC-CH2-(R)Cha-Aze-Pab
HOOC-CH2-(R,S)CH(COOH)-(R)Cha-Aze-Pab
HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Aze-Pab/a
HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Aze-Pab/b
HOOC-CH2-CH2-(R)Cha-Aze-Pab
HOOC-CH2-NH-CO-CH2-(R)Cha-Aze-Pab
H-(R)Cha-Pro-Pab
HOOC-CH2-(R)Cha-Pro-Pab
HOOC-CH2-(Me)(R)Cha-Pro-Pab
HOOC-CH2-CH2-(R)Cha-Pro-Pab
HOOC-CH2-CH2-(Me)(R)Cha-Pro-Pab
HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Pro-Pab/a
HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Pro-Pab/b
HOOC-CH2-NH-CO-CH2-(R)Cha-Pro-Pab
EtOOC-CH2-CH2-CH2-(R)Cha-Pro-Pab
Ph(4-COOH)-SO2-(R)Cha-Pro-Pab
H-(R)Cha-Pic-Pab
HOOC-CH2-(R)Cha-Pic-Pab
HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Pic-Pab/a
HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Pic-Pab/b
HOOC-CH2-CH2-(R)Cha-Pic-Pab
HOOC-CO-(R)Cha-Pic-Pab
HOOC-CH2-CO-(R)Cha-Pic-Pab
Me-OOC-CH2-CO-(R)Cha-Pic-Pab
H2N-CO-CH2-(R)Cha-Pic-Pab
Boc-(R)Cha-Pic-Pab
Ac-(R)Cha-Pic-Pab
Me-SO2-(R)Cha-Pic-Pab
H-(R)Cha-(R,S)betaPic-Pab
HOOC-CH2-CH2-(R)Cha-(R,S)betaPic-Pab
HOOC-CH2-(R)Cha-Val-Pab
HOOC-CH2-CH2-(R)Cha-Val-Pab
H-(R)Hoc-Aze-Pab
HOOC-CH2-CH2-(R)Hoc-Aze-Pab
HOOC-CH2-(R,S)CH(COOH)-(R)Hoc-Pro-Pab
HOOC-CH2-(R)Hoc-Pic-Pab
(HOOC-CH2)2-(R)Hoc-Pic-Pab
HOOC-CH2-(R)Pro(3-(S)Ph)-Pro-Pab
HOOC-CH2-CH2-(R)Pro(3-(S)Ph)-Pro-Pab
HOOC-CH2-CH2-(R)Tic-Pro-Pab
HOOC-CH2-CH2-(R)Cgl-Aze-Pig
HOOC-CH2-(R)Cgl-Pro-Pig
H-(R)Cha-Aze-Pig
HOOC-CH2-(R)Cgl-Aze-Pac
H-(R)Cha-Pro-Pac
H-(R)Cgl-Ile-Pab
H-(R)Cgl-Aze-Pab
HOOC-(R,S)CH(Me)-(R)Cha-Pro-Pab
MeOOC-CH2-(R)Cgl-Aze-Pab
EtOOC-CH2-(R)Cgl-Aze-Pab
nBuOOC-CH2-(R)Cgl-Aze-Pab
nHexOOC-CH2-(R)Cgl-Aze-Pab
H-(R)Cgl-Pro-Рас
HOOC-CH2-(R)Cha-Pro-Pac
HOOC-CH2-CH2-(R)Cgl-Pro-Рас
HOOC-CH2-CH2-(R)Cha-Aze-Pac
HOOC-CH2-(R)Cha-Aze-Pig
HOOC-CH2-(R)Cha-Pro-Pig
HOOC-CH2-CH2-(R)Cha-Pro-Pig
(HOOC-CH2)2-(R)Cgl-Pro-Pig
HOOC-CH2-CH2(HOOC-CH2)-(R)Cha-Pro-Pig
HOOC-CH2-(R)Cgl-Aze-(R,S)Itp
HOOC-CH2-(R)Cha-Aze-(R,S)Itp
H-(R)Cha-Pic-(R,S)Itp
HOOC-CH2-(R)Cha-Pic-(R,S)Itp
H-(R)Cgl-Pro-(R,S)Hig
HOOC-CH2-(R)Cgl-Pro-(R,S)Hig
H-(R)Cha-Pro-(R,S)Hig
H-(R)Cgl-Aze-Rig
HOOC-CH2-(R)Cgl-Aze-Rig
HOOC-CH2-(R)Cha-Pro-Rig
HOOC-CH2-CH2-(R)Cha-Aze-Rig
HOOC-CH2-(R)Cha-Pro-(S)Itp
H-(R)Cha-Pro-(R,S)Nig
H-(R)Cha-Pro-Mig
H-(R)Cha-Pro-Dig
H-(R)Cha-Aze-Dig
B настоящее время к особенно рекомендуемым соединениям формулы Ia относятся следующие соединения:
HOOC-CH2-(R)Cgl-Aze-Pab
HOOC-CH2-CH2-(R)Cha-Aze-Pab
HOOC-CH2-(R)Cha-Pro-Pab
HOOC-CH2-CH2-(R)Cha-Pro-Pab
HOOC-CH2-(R)Cha-Pic-Pab
HOOC-CH2-(R)Cgl-Pro-Pig
EtOOC-CH2-(R)Cgl-Aze-Pab
HOOC-CH2-(R)Cha-Pro-Pac
HOOC-CH2-(R)Cha-Pro-Pig
В вышеприведенных перечнях буквы /a и /b относятся к по существу чистому стереоизомеру по атому углерода, отмеченному "R или S". Стереоизомер может быть идентифицирован для каждого соединения ссылкой на нижеследующую экспериментальную часть. Обозначение "R, S" относится к смеси стереоизомеров.
В соответствии с изобретением обнаружено, что соединения общей формулы Ib, как таковые или в виде физиологически приемлемых солей, включая и стереоизомеры, являются эффективными ингибиторами кининогеназ:
A1---A2---NH---(CH2)n---B, (Ib)
где A1 представляет структурный фрагмент формул IIa, IIb или IIe, предпочтительно IIa или IIb, где
k=0, 1, 2, 3 или 4, предпочтительно 0, 1;
q = 0, 1, 2 или 3, предпочтительно 1;
R1 представляет H, алкильную группу с 1 - 4 атомами углерода или R11-OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможно замещена в альфа-положении к карбонильной группе, причем альфа-заместитель представлен группой R17-(CH2)p-, где p равно 0, 1 или 2 и R17 - метил, фенил, OH, COOR12, CONHR12, где R12 - H или алкильная группа с 1 - 4 атомами углерода, и R11 - H или алкильная группа с 1 - 6 атомами углерода, или
R1 представляет Ph (4-COOR12)-CH2-, где R12 - H или алкильная группа с 1 - 4 атомами углерода, или
R1 представляет R13-NH-CO-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1 - 4 атомами углерода и где R13 - H, алкильная группа с 1 - 4 атомами углерода или -CH2-COOR12, где R12 принимает вышеуказанные значения, или
R1 представляет R12OOC-CH2-OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1 - 4 атомами углерода и где R12 принимает вышеуказанные значения, или
R1 представляет R14SO2-, Ph(4-COOR12)-SO2-, Ph(3-COOR12)-SO2-, Ph(2-COOR12)-SO2-, где R12 принимает вышеуказанные значения и R14 - алкильная группа с 1 - 4 атомами углерода, или
R1 представляет -CO-R15, где R15 - алкильная группа с 1 - 4 атомами углерода, или
R1 представляет -CO-OR15, где R15 принимает вышеуказанные значения, или
R1 представляет -CO-(CH2)p-COOR12, где R12 принимает вышеуказанные значения и p = 0, 1 или 2, или
R1 представляет -CH2PO(OR16)2, -CH2SO3H или -CH2-(5-(1H)-тетразолил), где R16 независимо в каждом случае представляет H, метил или этил;
R2 представляет H, алкильную группу с 1 - 4 атомами углерода или R21OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и где R21 - H или алкильная группа с 1 - 4 атомами углерода;
R3 представляет алкильную группу с 1 - 4 атомами углерода, причем алкильная группа незамещена или замещена одним или несколькими атомами фтора, или
R3 представляет циклопентильную, циклогексильную или фенильную группы, которые незамещены или замещены алкильной группой с 1 - 4 атомами углерода, или
R3 представляет фенильную группу, замещенную группой OR21, где R21 - H или алкильная группа с 1 - 4 атомами углерода и k = 0, 1 или
R3 представляет 1-нафтильную или 2-нафтильную группу и k = 0, 1, или
R3 представляет цис- или трансдекалиновую группу и k = 0, 1, или
R3 представляет 4-пиридил, 3-пирролидил или 3-индолил, которые незамещены или замещены группой OR31, где R31 принимает вышеуказанные значения и k = 0, 1, или
R3 представляет Si(Me)3 или CH(R32)2, где R32 - циклогексильная или фенильная группа;
R4 представляет H, алкильную группу с 1 - 4 атомами углерода, циклогексильную или фенильную группу, предпочтительно H;
A2 представляет структурный фрагмент формул IIIb или IIIc, предпочтительно IIIb, где
p = 0, 1 или 2;
m = 1, 2, 3 или 4, предпочтительно 2, 3;
R3 принимает вышеуказанные значения;
n = 0, 1, 2, 3 или 4, предпочтительно 1, 2, 3;
B представляет структурный фрагмент формул IVa, IBb, IVc или IVd, предпочтительно IVa или IVb, где
X1, X2, X3, X4 принимают вышеуказанные значения;
R6 - H или алкильная группа с 1 - 4 атомами углерода, предпочтительно H или метил;
r = 0 или 1;
к рекомендуемым сочетаниям X1, X2, X3 и X4 относятся:
X1, X2 и X4 - группа CH2, X3 - группа CH-C(NH)-NH2 и r = 0 или 1, или
X1, X2 и X4 - группа CH2, X3 - группа N-C(NH)-NH2 и r = 0 или 1, или
X1 и X3 - группа NH, X2 - группа C=NH, X4 - группа CH2 и r = 0 или 1, или
X1 и X4 - группа CH2, X2 - группа C=NH, X3 - группа NH и r = 0 или 1, или
X1 - группа CH2, X2 и X4 - группа NH, X3 - группа C=NH и r = 1, или
X1, X2 и X4 - группа CH2, X3 - группа CH-NH-C(NH)-NH2 и r = 0 или 1, или
X1 отсутствует, X2 и X4 - группа CH2, X3 - группа CH-C(NH)-NH2 и r = 0, или
X1 отсутствует, X2 и X4 - группа CH2, X3 - группа N-C(NH)-NH2 и r = 0;
особенно рекомендуемые сочетания X1, X2, X3 и X4 включают:
X1, X2 и X4 - группа CH2, X3 - группа CH-C(NH)-NH2 и r = 1, или
X1, X2 и X4 - группа CH2, X3 - группа N-C(NH)-NH2 и r = 1;
X5 представляет C(NH)-NH2 или NH-C(NH)-NH2, предпочтительно C(NH)-NH2;
X6 представляет CH или N.
Рекомендуемые соединения изобретения включают соединения формул:
H-(R)Pro-Phe-Pab
HOOC-CH2-(R)Pro-Phe-Pab
H-(R)Phe-Phe-Pab
HOOC-CO-(R)Phe-Phe-Pab
HOOC-CH2-(R)Phe-Phe-Pab
H-(R)Cha-Phe-Pab
HOOC-CH2-(R)Cha-Phe-Pab
H-(R)Phe-Cha-Pab
HOOC-CH2-(R)Phe-Cha-Pab
H-(R)Cha-Cha-Pab
HOOC-CH2-(R)Cha-Cha-Pab
Кроме того обнаружено, что соединения общей формулы V, как таковые или в виде физиологически приемлемых солей, включая и стереоизомеры, являются эффективными ингибиторами серин-протеаз, особенно тромбина, и кининогеназ, например калликреина, после перорального или парентерального введения:
A1 - A2 - NH - (CH2)n - B - D, (V)
где A1 представляет структурный фрагмент формул IIa, IIb, IIc, IId или IIe: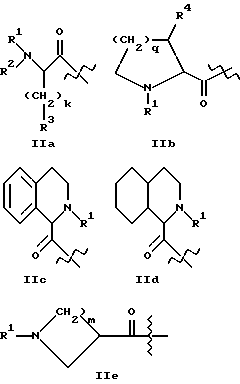
где k = 0, 1, 2, 3 или 4;
m = 1, 2, 3 или 4;
q = 0, 1, 2 или 3;
R1 представляет R11OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможна замещена в альфа-положении к карбонильной группе, причем альфа-заместитель представлен группой R17-(CH2)p-, где p равно 0, 1 или 2 и R17 - группа COOR12, CONHR12, где R12 - H, алкильная группа с 1 - 4 атомами углерода или бензильная группа и R11 - H, алкильная группа с 1 - 6 атомами углерода или бензильная группа, или
R1 представляет Ph(4-COOR12)-CH2-, где R12 принимает вышеуказанные значения, или
R1 представляет R13-NH-CO-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1 - 4 атомами углерода и где R13 - H, алкильная группа с 1 - 4 атомами углерода или -CH2-COOR12, где R12 принимает вышеуказанные значения, или
R1 представляет R12OOC-CH2-OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1 - 4 атомами углерода и где R12 принимает вышеуказанные значения, или
R1 представляет R14SO2-, Ph(4-COOR12)-SO2-, Ph(3-COOR12)-SO2-, Ph(2-COOR12)-SO2-, где R12 принимает вышеуказанные значения и R14 - алкильная группа с 1 - 4 атомами углерода, или
R1 представляет -CO-R15, где R15 - алкильная группа с 1 - 4 атомами углерода, или
R1 представляет -CO-OR15, где R15 принимает вышеуказанные значения, или
R1 представляет -CO-(CH2)p-COOR12, где R12 принимает вышеуказанные значения и p = 0, 1 или 2, или
R2 представляет H, алкильную группу с 1 - 4 атомами углерода или R21OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и где R21 - H, алкильная группа с 1 - 4 атомами углерода или бензильная группа;
R3 представляет алкильную группу с 1 - 4 атомами углерода, причем алкильная группа незамещена или замещена одним или несколькими атомами фтора, или
R3 представляет циклопентильную, циклогексильную или фенильную группы, которые незамещены или замещены алкильной группой с 1 - 4 атомами углерода, или
R3 представляет фенильную группу, замещенную группой OR31, где R31 - H или алкильная группа с 1 - 4 атомами углерода и k = 0, 1, или
R3 представляет 1-нафтильную или 2-нафтильную группу и k = 0, 1, или
R3 представляет цис- или транс-декалиновую группу и k = 0, 1, или
R3 представляет 4-пиридил, 3-пирролидинил или 3-индолил, которые незамещены или замещены группой OR31, где R31 принимает вышеуказанные значения и k = 0, 1, или
R3 представляет Si(Me)3 или CH(R32)2, где R32 - циклогексильная или фенильная группа;
R4 представляет H, алкильную группу с 1 - 4 атомами углерода, циклогексильную или фенильную группу;
A2, B и n принимают значения, указанные выше для формулы I;
D-группа Z или (Z)2, где Z представляет бензилоксикарбонильную группу.
Бензилоксикарбонильная группа (Z или (Z)2) присоединена к атомам азота амидино- или гуанидинофрагмента, присутствующих в B.
Рекомендуемые и особенно рекомендуемые комбинации те же, что и приведенные выше для формулы I.
Кроме того, обнаружено, что соединения общей формулы Va, как таковые или в виде физиологически приемлемых солей, включая и стереоизомеры, являются эффективными ингибиторами тромбина после перорального или парентерального введения:
A1 - A2 - NH - (CH2)n - B - D, (Va)
где A1 представляет структурный фрагмент формул IIa, IIb, IIc или IId, предпочтительно IIa или IIb, где
k = 0, 1, 2, 3 или 4, предпочтительно 0, 1;
q = 0, 1, 2 или 3, предпочтительно 1;
R1 представляет R11OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможна замещена в альфа-положении к карбонильной группе, причем альфа-заместитель представлен группой R17-(CH2)p-, где p равно 0, 1 или 2 и R17 - группа COOR12, CONHR12, где R12 - H, алкильная группа с 1 - 4 атомами углерода или бензильная группа, и R11 - H, алкильная группа с 1 - 6 атомами углерода или бензильная группа, или
R1 представляет Ph (4-COOR12)-CH2-, где R12 принимает вышеуказанные значения, или
R1 представляет R13-NH-CO-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1 - 4 атомами углерода и где R13 - H, алкильная группа с 1 - 4 атомами углерода или -CH2-COOR12, где R12 принимает вышеуказанные значения, или
R1 представляет R12OOC-CH2-OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1 - 4 атомами углерода и где R12 принимает вышеуказанные значения, или
R1 представляет R14SO2-, Ph(4-COOR12)-SO2-, Ph(3-COOR12)-SO2-, Ph(2-COOR12)-SO2-, где R12 принимает вышеуказанные значения и R14 - алкильная группа с 1 - 4 атомами углерода, или
R1 представляет -CO-R15, где R15 - алкильная группа с 1 - 4 атомами углерода, или
R1 представляет -CO-OR15, где R15 принимает вышеуказанные значения, или
R1 представляет -CO-(CH2)p-COOR12, где R12 принимает вышеуказанные значения, или
предпочтительно R1 представляет R11OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и R11 принимает вышеуказанные значения;
R2 представляет H, алкильную группу с 1 - 4 атомами углерода или R21OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и R21 - H, алкильная группа с 1 - 4 атомами углерода или бензильная группа;
R3 представляет алкильную группу с 1 - 4 атомами углерода, и алкильная группа незамещена или замещена одним или несколькими атомами фтора, или
R3 представляет циклопентильную, циклогексильную или фенильную группы, которые незамещены или замещены алкильной группой с 1 - 4 атомами углерода, или
R3 представляет 1-нафтильную или 2-нафтильную группу и k = 0, 1, или
R3 представляет цис- или транс-декалиновую группу и k = 0, 1, или
R3 представляет Si(Me)3 или CH(R32)2, где R32 - циклогексильная или фенильная группа;
R4 представляет алкильную группу с 1 - 4 атомами углерода, циклогексильную или фенильную группу, предпочтительно циклогексильную или фенильную группу;
A2, B и n принимают значения, приведенные выше для формулы Ia;
D - группа Z или (Z)2;
Z представляет бензилоксикарбонильную группу.
Рекомендуемые цифровые показатели, группы и комбинации и особенно предпочтительные комбинации те же, что приведенные выше для формулы Ia, однако R11 - H, алкильная группа с 1 - 6 атомами углерода или бензильная группа.
Рекомендуемые соединения Va включают:
BnOOC-CH2-(R)Cgl-Aze-Pab(Z)
BnOOC-CH2-CH2-(R)Cgl-Aze-Pab(Z)
BnOOC-CH2-(R)Cgl-Pro-Pab(Z)
BnOOC-CH2-CH2-(R)Cgl-Pro-Pab(Z)
(BnOOC-CH2)2-(R)Cgl-Pro-Pab(Z)
BnOOC-CH2-(R,S)CH(COOBn)-(R)Cgl-Pic-Pab(Z)
BnOOC-CH2-(R,S)CH(COOBn)-(R)Cha-Aze-Pab(Z)
BnOOC-CH2-(RorS)CH(COOBn)-(R)Cha-Aze-Pab(Z)/a
BnOOC-CH2-(RorS)CH(COOBn)-(R)Cha-Aze-Pab(Z)/b
BnOOC-CH2-CH2-(R)Cha-Aze-Pab(Z)
BnOOC-CH2-NH-CO-CH2-(R)Cha-Aze-Pab(Z)
BnOOC-CH2-(R)Cha-Pro-Pab(Z)
BnOOC-CH2-(Me)(R)Cha-Pro-Pab(Z)
BnOOC-CH2-CH2-(R)Cha-Pro-Pab(Z)
BnOOC-CH2-CH2-(Me)(R)Cha-Pro-Pab(Z)
BnOOC-CH2-(R,S)CH(COOBn)-(R)Cha-Pro-Pab(Z)
BnOOC-CH2-NH-CO-CH2-(R)Cha-Pro-Pab(Z)
Ph(4-COOH)-SO2-(R)Cha-Pro-Pab(Z)
Boc-(R)Cha-Pic-Pab(Z)
BnOOC-CH2-(R)Cha-Pic-Pab(Z)
BnOOC-CH2-(R,S)CH(COOBn)-(R)Cha-Pic-Pab(Z)
BnOOC-CH2-CH2-(R)Cha-Pic-Pab(Z)
EtOOC-CO-(R) Cha-Pic-Pab(Z)
MeOOC-CH2-CO-(R)Cha-Pic-Pab(Z)
H2N-CO-CH2-(R)Cha-Pic-Pab(Z)
Ac-(R)Cha-Pic-Pab(Z)
Me-SO2-(R)Cha-Pic-Pab(Z)
BnOOC-CH2-(R)Cha-Val-Pab(Z)
BnOOC-CH2-CH2-(R)Cha-(R,S)Val-Pab(Z)
BnOOC-CH2-CH2-(R)Hoc-Aze-Pab(Z)
BnOOC-CH2-(R,S)CH(COOB-(R)Hoc-Pro-Pab(Z)
BnOOC-CH2-(R)Hoc-Pic-Pdb(Z)
(BnOOC-CH2)2-(R)Hoc-Pic-Pab(Z)
BnOOC-CH2-(R)Pro(3-(S)Ph)-Pro-Pab(Z)
BnOOC-CH2-CH2-(R)Pro(3-(S)Ph)-Pro-Pab(Z)
BnOOC-CH2-CH2-(R)Tic-Pro-Pab(Z)
BnOOC-CH2-CH2-(R)Cgl-Aze-Pig(Z)2
BnOOC-CH2-(R)Cgl-Pro-Pig(Z)2
BnOOC-CH2-(R)Cgl-Aze-Pac(Z)
BnOOC-(R,S)CH(Me)-(R)Cha-Pro-Pab(Z)
MeOOC-CH2-(R)Cgl-Aze-Pab(Z)
EtOOC-CH2-(R)Cgl-Aze-Pab(Z)
nBuOOC-CH2-(R)Cgl-Aze-Pab(Z)
nHexOOC-CH2-(R)Cgl-Aze-Pab(Z)
BnOOC-CH2-(R)Cha-Pro-Pac(Z)
BnOOC-CH2-CH2-(R)Cgl-Pro-Pac(Z)
BnOOC-CH2-CH2-(R)Cha-Aze-Pac(Z)
BnOOC-CH2-(R)Cha-Aze-Pig(Z)
BnOOC-CH2-(R)Cha-Pro-Pig(Z)
BnOOC-CH2-CH2-(R)Cha-Pro-Pig(Z)
(BnOOC-CH2)2-(R)Cgl-Pro-Pig(Z)
BnOOC-CH2-CH2(BnOOC-CH2)-(R)Cha-Pro-Pig(Z)
BnOOC-CH2-(R)Cha-Pic-(R,S)Itp(Z)
BnOOC-CH2-(R)Cgl-Pro-(R,S)Hig(Z)
BnOOC-CH2-(R)Cgl-Aze-Rig(Z)
BnOOC-CH2-(R)Cha-Pro-Rig(Z)
BnOOC-CH2-CH2-(R)Cha-Aze-Rig(Z)
Особенно рекомендуются следующие соединения:
BnOOC-CH2-(R)Cgl-Aze-Pab(Z)
BnOOC-CH2-(R)Cha-Pro-Pab(Z)
BnOOC-CH2-(R)Cha-Pic-Pab(Z)
BnOOC-CH2-(R)Cgl-Pro-Pig(Z)2
EtOOC-CH2-(R)Cgl-Aze-Pab(Z)
BnOOC-CH2-(R)Cha-Pro-Pac(Z)
BnOOC-CH2-(R)Cha-Pro-Pig(Z)
Кроме того обнаружено, что соединения общей формулы Vb, как таковые или в виде физиологически приемлемых солей, включая и стереоизомеры, являются эффективными ингибиторами калликреина после перорального или парентерального введения:
A1-A2-NH-(CH2)N-B-D, (Vb)
где A1 представляет структурный фрагмент формул IIa, IIb или IIe, предпочтительно IIa или IIb, где
k = 0, 1, 2, 3 или 4, предпочтительно 0, 1;
q = 0, 1, 2 или 3, предпочтительно 1;
R1 представляет R11OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможно замещена в альфа-положении к карбонильной группе, причем альфа-заместитель представлен группой R17-(CH2)p-, где p = 0, 1 или 2 и R17 - группа COOR12, CONHR12, где R12 - H или алкильная группа с 1-4 атомами углерода, и R11 - H, алкильная группа с 1-6 атомами углерода или бензильная группа, или
R1 представляет Ph(4-COOR12)-CH2-, где R12 принимает вышеуказанные значения, или
R1 представляет R13-NH-CO-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группы с 1 - 4 атомами углерода и где R13 - H, алкильная группа с 1 - 4 атомами углерода или -CH2COOR12, где R12 принимает вышеуказанные значения, или R1 представляет R12OOC-CH2OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группы с 1 - 4 атомами углерода и
где R12 принимает вышеуказанные значения, или
R1 представляет R14SO2-, Ph(4-COOR12)-SO2-, Ph(3-COOR12)-SO2-, Ph(2-COOR12)-SO2-, где R12 принимает вышеуказанные значения и R14 - алкильная группа с 1 - 4 атомами углерода, или
R1 представляет -CO-R15, где R15 - алкильная группа с 1 - 4 атомами углерода, или
R1 представляет -CO-R15, где R15 принимает вышеуказанные значения, или
R1 представляет -CO-(CH2)p-COOR12, где R12 принимает вышеуказанные значения, и p = 0, 1 или 2, или
R2 представляет H, алкильную группу с 1 - 4 атомами углерода или R21OOC-алкил-, где алкильная группа имеет 1 - 4 атома углерода и R21 - H, алкильная группа с 1 - 4 атомами углерода или бензильная группа;
R3 представляет алкильную группу с 1 - 4 атомами углерода, и алкильная группа незамещена или замещена одним или несколькими атомами фтора или
R3 представляет циклопентильную, циклогексильную или фенильную группы, которые незамещены или замещены алкильной группой с 1 - 4 атомами углерода, или
R3 представляет фенильную группу, замещенную группой OR31, где R31 - H или алкильная группа с 1 - 4 атомами углерода и k = 0, 1, или
R3 представляет 1-нафтильную или 2-нафтильную группу и k = 0, 1, или
R3 представляет цис- или транс-декалиновую группу и k = 0, 1, или
R3 представляет 4-пиридил, 3-пирролидил или 3-индолил, которые незамещены или замещены группой OR31, где R31 принимает вышеуказанные значения, и k = 0, 1, или
R3 представляет Si(Me)3 или CH(R32)2, где R32 - циклогексильная или фенильная группа;
R4 представляет H, алкильную группу с 1 - 4 атомами углерода, циклогексильную или фенильную группу, предпочтительно H;
A2, B и n принимают значения, приведенные выше для формулы Ib;
D представляет Z или (Z)2.
Рекомендуемые цифровые значения, группы и комбинации и особенно предпочтительные комбинации те же, что приведенные выше для формулы Ib, однако R11 - H, алкильная группа с 1 - 6 атомами углерода или бензильная группа.
Рекомендуемые соединения Vb включают:
Boc-(R)Pro-Phe-Pab(Z)
BnOOC-CH2-(R)Pro-Phe-Pab(Z)
Boc-(R)Phe-Phe-Pab(Z)
MeOOC-CO-(R)Phe-Phe-Pab(Z)
BnOOC-CH2-(R)Phe-Phe-Pab(Z)
В еще одном своем воплощении изобретение относится к новому применению соединения формулы: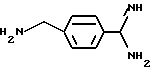
в качестве исходного продукта в синтезе пептидного ингибитора серин-протеазы, в частности, в синтезе пептидных ингибиторов тромбина или ингибиторов киногеназ. Соединение может быть использовано, как таковое или с амидиногруппой моно- или дизамещенной по атомам азота защитной группой, например, бензилоксикарбонилом. Защиту амидинопроизводных осуществляют известными, применяемыми для защиты амидиногруппы методами. Указанное соединение имеет название "1-амидино-4-аминометилбензола" или в данном описании "H-Pab". Ранее соединение раскрыто в Biochem. Pharm. т. 23, стр. 2247-2256.
Однако, структурный фрагмент формулы: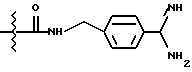
ранее не был указан в качестве структурного элемента фармацевтически активного соединения, в особенности пептидного соединения. Фрагмент придает соединениям свойства ингибитора серин-протеазы, в частности, ингибитора тромбина или ингибитора кининогеназ.
В еще одном своем воплощении изобретение относится к ранее неизвестному применению соединения формулы: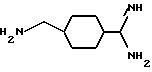
в качестве исходного продукта в синтезе пептидного ингибитора тромбина. Аминогруппа в указанном соединении может быть моно- или дизащищена по атомам азота такой защитной группой, как бензилоксикарбонил. Защиту амидинопроизводных известными способами, применяемыми для защиты амидиногруппы. Название этого соединения - "1-амидино-4-аминометилциклогексан" или в данном описании "H-Pac". Ранее соединение раскрыто в патенте DE 2748295.
Однако, структурный фрагмент формулы: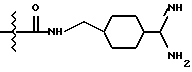
ранее не указывался в качестве структурного элемента, представляющего ценность ингибитора тромбина.
И в еще одном своем аспекте изобретение относится к новому соединению формулы: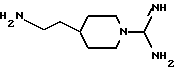
и к применению указанного соединения в качестве исходного продукта в синтезе ингибитора серин-протеазы, в особенности ингибитора тромбина или ингибитора кининогеназы. Атомы азота в амидиногруппе соединения могут быть моно- или дизащищены такой защитной группой, как бензилоксикарбонил. Защиту амидинопроизводных осуществляют известными способами, применяемыми для защиты амидиногруппы. Название этого соединения - "4-аминоэтил-1-амидинопиперидин" или в данном описании "H-Rig".
Однако, структурный фрагмент формулы: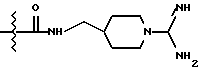
ранее не указывался в качестве структурного элемента фармацевтически активного соединения, в особенности пептидного соединения. Фрагмент придает соединениям свойства ингибитора серин-протеазы, в частности, ингибитора тромбина или ингибитора кининогеназ.
В еще одном своем воплощении изобретение относится к новому соединению формулы: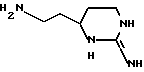
и к его применению в качестве исходного продукта в синтезе ингибитора серин-протеазы, в особенности ингибитора тромбина или ингибитора кининогеназы. Атомы азота в амидиногруппе соединения могут быть моно- или дизащищены такой защитной группой, как бензилоксикарбонил. Защиту амидинопроизводных проводят известными способами защиты амидиногруппы. Название этого соединения - "1,3-диаза-2-амино-1-аминоэтилциклогексан" или в данном описании "H-Itp".
Однако, структурный фрагмент формулы: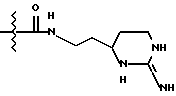
ранее не указывался в качестве структурного элемента фармацевтически активного соединения, в особенности пептидного соединения. Фрагмент придает соединениям свойства ингибитора серин-протеазы, в частности, ингибитора тромбина или ингибитора кининогеназ.
В еще одном своем воплощении изобретение относится к новым соединения формулы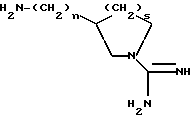
где n = 1 или 2,
s = 0 или 1,
и к применению этих соединений в качестве исходных продуктов в синтезе ингибиторов серин-протеаз, в особенности ингибиторов тромбина или ингибиторов кининогеназ. Атомы азота в амидиногруппе соединений могут быть моно- или дизащищены такой защитной группой, как бензилоксикарбонил. Защиту амидиногруппы проводят известными способами защиты амидинопроизводных. Эти соединения имеют следующие названия:
1-амидино-3-аминометилпирролидин или "H-Nig" при n = 1 и s = 1,
1-амидино-3-аминоэтилпирролидин или "H-Hig" при n = 2 и s = 1,
3-аминометил-1-амидиноазетидин или "H-Mig" при n = 1 и s = 0,
3-аминоэтил-1-амидиноазетидин или "H-Dig" при n = 2 и S = 0.
Однако, структурный фрагмент формулы: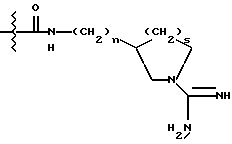
ранее не указывался в качестве структурного элемента фармацевтически активного соединения, особенно пептидного соединения. Фрагмент придает соединению свойства ингибитора серин-протеаз, в частности, ингибитора тромбина или ингибитора кининогеназ.
Еще одно воплощение изобретения относится к новым соединениям, в которых атомы азота амидиногруппы моно- или ди-защищены бензилоксикарбонильной группой. Примеры подобных соединений включают:
4-аминометил-1-(N-бензилоксикарбониламидино)бензол (H-Pab (Z)),
4-аминометил-1-(N,N'-ди(бензилоксикарбонил)амидино)бензол (H-Pab (Z)2),
4-аминометил-1-(N-бензилоксикарбониламидино)циклогексан (H-Pac (Z)),
4-аминометил-1-(N, N'-ди(бензилоксикарбонил)амидино)циклогексан (H-Pac (Z)2),
4-аминоэтил-1-(N-бензилоксикарбониламидино)пиперидин (H-Rig (Z)),
4-аминоэтил-1-(N, N'-ди(бензилоксикарбонил)амидино)пиперидин (H-Rig (Z)2),
(3RS)-1-(N-бензилоксикарбониламидино)-3-аминометилпирролидин (H-Hig (Z)),
(3RS)-1-(N, N'-ди(бензилоксикарбонил)амидино)-3-аминометилпирролидин (H-Hig (Z)2),
(3RS)-1-(N-бензилоксикарбонил)амидино)-3-аминоэтилпирролидин (H-Hig (Z)),
(3RS)-1-(N, N'-ди(бензилоксикарбонил)амидино)-3-аминоэтилпирролидин (H-Hig (Z)2),
3-аминометил-1-(N-бензилоксикарбониламидино)азетидин (H-Mig (Z)),
3-аминометил-1-(N, N'-ди(бензилоксикарбонил)амидино)азетидин (H-Mig (Z)2),
3-аминоэтил-1-(N-бензилоксикарбониламидино)азетидин (H-Dig (Z)),
3-аминоэтил-1-(N,N'-ди(бензилоксикарбонил)амидино)азетидин (H-Dig (Z)2).
Указанные соединения применяют в качестве исходных продуктов в получении заявленных пептидных производных формул I, Ia, Ib, V, Va и Vb.
Применение в медицине и фармацевтике
В изобретении отображены препараты и способы лечения у человека и животных тех состояний, при которых требуется подавление тромбина и физиологических нарушений, в особенности воспалительных заболеваний.
Ожидается, что подавляющие тромбин соединения изобретения окажутся полезными для лечения и профилактики у человека и животных тромбоза и сверхкоагулируемости в крови и тканях. Кроме того ожидается, что соединения найдут применение в тех ситуациях, когда происходит избыточное образование тромбина без признаков сверхкоагулируемости, как например, при болезни Альцгеймера и панкреатите. Болезненные состояния, при которых данные соединения потенциально применимы для лечения и/или профилактики, включают: венозный тромбоз, эмболию легких, артериальный тромбоз, например, при инфаркте миокарда, неустойчивую стенокардию, приступ в результате тромбоза и периферийный артериальный тромбоз, общей эмболии, как правило, из предсердия в ходе артериальной фибрилляции или из левого желудочка после трансмурального инфаркта миокарда. Кроме того ожидается, что соединения найдут применение в профилактике атеросклеротических заболеваний, например: коронарной артериальной болезни, серебральной артериальной болезни и периферийной артериальной болезни. Ожидается также, что соединения будут обладать синергическим антитромботическим действием при их применении с любым антитромботическим агентом с иным механизмом действия, например, с таким антитромбоцитарным агентом, как ацетилсалициловая кислота. Эти соединения, как ожидается, будут полезны при лечении в сочетании с тромболитиками тромботических заболеваний, например, инфаркта миокарда. Кроме того, ожидается, что соединения найдут применение для профилактики повторной окклюзии после тромбоза, чрескожной трансполосной пластической операции на сосудах (PTCA) и коронарных байпасных операциях. Ожидается также, что соединения найдут применение для профилактики ретромбоза после микрохирургии и хирургии на сосудах в целом. Ожидается также применение соединений для лечения и профилактики рассеянной внутрисосудистой коагуляции, вызванной бактериями, множественными травмами, интоксикацией и иными причинами. Кроме того, ожидается, что соединения будут применимы для антикоагулянтной обработки в случаях, когда кровь контактирует с чужеродными поверхностями в организме, например, в виде сосудистых имплантантов, сосудистых трансплантатов, сосудистых катетеров, механических и биологических протезов или любого другого медицинского устройства. Ожидается также возможность применения соединений для антикоагулянтной обработки в случаях, когда кровь контактирует с медицинскими устройствами вне организма, например, в ходе сердечно-сосудистой хирургии с применением аппарата сердце-легкие или при гемодиализе.
Еще одно ожидаемое применение антикоагулянтных соединений изобретения состоит в ополаскивании катетеров и медицинских устройств, применяемых в организме больных in vivo, и в качестве антикоагулянтов для консервации крови, плазмы и других производных крови in vitro.
Противовоспалительные соединения изобретения, как ожидается, найдут применение, в частности, для лечения и профилактики у человека и животных воспалительных заболеваний, например: астмы, ринита, панкреатита, крапивницы, воспалительных заболеваний кишечника и артрита. Эффективное количество ингибирующего кининогеназу соединения может быть использовано в виде чистого соединения или в виде его смеси с физиологически приемлемыми носителями и разбавителями, или в сочетании с другими терапевтическими агентами.
Способность соединений подавлять активность калликреинов определяют анализом по известным методикам с применением хромогенных субстратов. Противовоспалительное действие соединений настоящего изобретения может быть исследовано, например, по ингибированию ими вызванных аллергенов экссудативных воспалительных процессов в слизистой дыхательной или слизистой кишечника.
Лекарственные формы
Соединения изобретения, как правило, подлежат введению перорально, ректально, нанесением на кожу, через нос, через трахею, через бронхи, парентерально или путем ингаляции. Соединения вводятся в виде лекарственных форм, содержащих активный компонент в виде свободного основания или в виде фармацевтически приемлемой неядовитой соли, образованной давлением органической или неорганической кислоты, напр. : гидрохлорида, гидробромида, сульфата, гидросульфата, нитрата, лактата, ацетата, цитрата, бензоата, сукцината, тартрата, трифторацетата и т.п., в фармацевтически приемлемой дозированной форме. В зависимости от вида заболевания и состояния больного, подлежащего лечению, и от пути введения препараты могут вводиться в различных дозах.
Дозированные формы могут быть твердыми, полужидкими и жидкими, приготовленными по известной технологии. Обычно количество активного компонента составляет 0,1-99 мас.% на препарат, более конкретно, 0,1-50 мас.% на препарат, предназначенный для парентерального введения, и 0,2-75 мас.% на препарат, приемлемый для перорального введения.
Приемлемые ежедневные дозы соединений изобретения для лечения составляют 0,001-100 мг/кг массы тела при пероральном введении и 0,001-50 мг/кг массы тела при парентеральном введении.
Получение
Еще одной задачей изобретения является способ получения соединений. Соединения формул I и V могут быть получены способами, включающими присоединение защищенного в N-окончании дипептида или аминокислоты, если используют N-концевую аминокислоту с последующим прибавлением по известным методикам второй аминокислоты, к соединению формулы:
H2N --- (CH2)n --- X,
где n = 0, 1, 2, 3 или 4, X - группа B или B-D, где B принимает значения, указанные для формулы I, и D принимает значения, указанные для формулы V, причем атомы азота в гуанидино- или амидиногруппе незащищены или моно- или дизащищены аминозащитной группой, например: бензилоксикарбонильной, трет-бутилоксикарбонильной или п-толуолсульнильной группой, или X - группа, переносимая в B, с последующим удалением защитных групп или деблокированием N-концевого азота и затем алкилированием N-концевого азота и при желании деблокированием известными методами. При желании могут быть получены физиологически приемлемые соли, а в тех случаях, когда в результате реакции образуется смесь стереоизомеров, их возможно разделяют стандартными хроматографическими методами или перекристаллизацией с выделением при желании единственного стереоизомера.
Соединения формул I или V могут быть получены одним из следующих, раскрываемых более подробно способов.
Способ Ia
Способ состоит в присоединении к защищенному в N-окончании дипептиду, выбранному исходя из значений A1 и A2 для формул I и V и полученному стандартным способом соединения пептидов, соединения формулы:
использованием стандартной методики присоединения пептидов, иллюстрируемой следующей схемой реакции: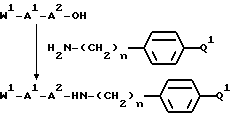
В приведенных формулах n принимает значения, указанные для формулы I, W1 - N-концевая аминозащитная группа, например: трет-бутилоксикарбонил и бензилоксикарбонил и Q1 - группа -C(NH)-NH2, -C(NW2)-NH-W2, -C(NH)-NH-W2, -NH-C(NH)-NH2, -NH-C(NH)-NH-W2, -N(W2)-C(NH)-NHW2 или -NH-C(NW2)-NH-W2, где W2 - аминозащитная группа, например: трет-бутилоксикарбонил или бензилоксикарбонил, или Q1 - группа -CN, -CO-NH2 или -CS-NH2, которая затем переносится в амидиногруппу (например, с образованием Q1 = -C(NH)-NH2) известными специалистам методами, или Q1 - группа NH2 или NH-W2, где W2 принимает вышеуказанные значения, причем аминогруппа затем переносится в гуанидиногруппу (с образованием Q1 = -NH-C(NH)-NH2) после удаления W2-группы, когда Q1 - группа -NH-W2 (W2 в этом случае должна быть ортогональна к W1) известными специалистам методами.
Конечные соединения могут быть получены одним из следующих способов в зависимости от природы применяемой Q1-группы. Удаляют защитную группу-(ы) (когда Q1 - группа -C(NH)-NH2, -C(NW2)-NH-W2, -C(NH)-NH-W2, -NH-C(NH)-NH2, -NH-C(NH)-NH-W2, -N(W2)-C(NH)-NH-W2 или -NH-C(NW2)-NH-W2) или проводят селективное деблокирование с удалением W1-группы (напр., когда Q1 - группа -C(NW2)-NHW2, -C(NH)-NH-W2, -NH-C(NH)-NH-W2, -N(W2)-C(NH)-NH-W2 или -NH-C(NW2)-NH-W2 (W2-группа в этом случае должна быть ортогональна к W1-группе) с последующим алкилированием по известным методикам N-концевого азота и при желании деблокированием известными методами.
Способ Ib
Способ состоит в присоединении к защищенной в N-окончании аминокислоте, выбранной исходя из значения A2 для формул I или V и полученной стандартными методами, соединения формулы: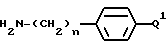
использованием стандартной методики присоединения пептидов, иллюстрируемой следующим уравнением реакции: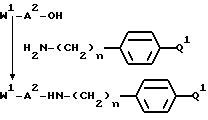
где n, W1 и Q1 принимают вышеуказанные значения, с последующим удалением W1-группы деблокированием и присоединением N-концевой аминокислоты в защищенной форме, тем самым защищая пептид, описанный в Способе Ia. Затем согласно способу Ia продолжают синтез конечных пептидов.
Способ IIa
Способ состоит из реакции защищенного в N-окончании дипептида, выбранного исходя из значений A1 и A2 для формул I или V и синтезированного стандартным методом соединения пептидов, с соединением формулы:
использованием стандартного метода присоединения пептидов, иллюстрируемого следующим уравнением реакции: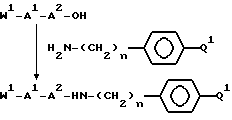
где n принимает значения, указанные для формулы I, W1 - N-концевая аминозащитная группа, например: трет-бутилоксикарбонил или бензилоксикарбонил и Q1 - группа -C(NH)-NH2, -C(NW2)-NH-W2, -C(NH)-NH-W2, -NH-C(NH)-NH2, -NH-C(NH)-NH-W2, -N(W2)-C(NH)-NH-W2 или -NH-C(W2)-NH-W2, где W2 - аминозащитная группа, например: трет-бутилоксикарбонил или бензилоксикарбонил, или Q1 - группа -CN, -CO-NH2 или -CS-NH2, которая затем переносится в амидиногруппу (с образованием, например, Q1 - -C(NH)-NH2) известными специалистам методами, или Q1 - группа NH2 или NH-W2, где W2 принимает вышеуказанные значения, причем аминогруппа переносится в гуанидиногруппу (с образованием Q1 = -NH-C(NH)-NH2) после удаления W2-группы деблокированием, когда Q1 - группа -NH-W2 (в этом случае W2-группа должна быть ортогональна W1-группе) известными специалистам методами.
Конечные соединения могут быть получены любым из следующих способов в зависимости от характера применяемой Q1-группы. Снимают защитную группу-(ы) (когда Q1 - группа -C(NH)-NH2, -C(NW2)-NH-W2, -C(NH)-NH-W2, -NH-C(NH)-NH2, -NH-C(NH)-NH-W2, -N(W2)-C(NH)-NH-W2 или -NH-C(NW2)-NH-W2), или селективно удаляют деблокированием W1-группу (напр., когда Q1 - группа -C(NW2)-NH-W2, -C(NH)-NH-W2, -NH-C(NH)-NH-W2, -N(W2)-C(NH)-NH-W2 или -NH-C(NW2)-NH-W2) (W2-группа в этом случае должна быть ортогональна к W1-группе) с последующим алкилированием по известным методикам N-концевого азота и при желании деблокированием известными методами.
Способ IIb
Способ состоит из реакции защищенной в N-окончании аминокислоты, выбранной исходя из значения A2 для формул I или V и полученной стандартными методами, с соединением формулы:
применением стандартной методики присоединения пептидов, иллюстрируемой следующим уравнением реакции:
где n, W1 и Q1 принимают вышеуказанные значения, с последующим удалением W1-группы деблокированием и присоединением N-концевой защищенной аминокислоты и получением в результате защищенного пептида, охарактеризованного в способе IIa. Синтез конечных пептидов осуществляют по методике способа IIa.
Способ IIIa
Способ состоит в реакции защищенного в N-окончании дипептида, выбранного исходя из значений A1 и A2 для формул I или V и полученного по стандартной методике соединения пептидов с соединением формулы: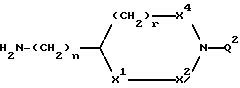
использованием стандартной методики присоединения пептидов, иллюстрируемой следующим уравнением реакции: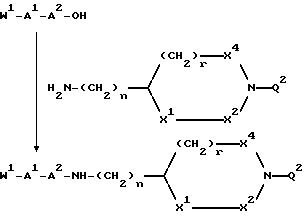
где n принимает значения, указанные для формулы I, r = 0, 1, когда X1, X2 и X4 - группа CH2, или r = 0, когда X2 и X4 - группа CH2, и X2 отсутствует, W1 - N-концевая аминозащитная группа, например: трет-бутилоксикарбонил или бензилоксикарбонил и Q2 - группа -C(NH)-NH2, -C(NW2)-NH-W2 или -C(NH)-NH-W2, где W2-аминозащитная группа, например: трет-бутилоксикарбонил или бензилоксикарбонил, или Q2 = W2, причем аминогруппа после удаления W2 - группы деблокированием (в этом случае W2 - группа должна быть ортогональна W1-группе) переносится затем в гуанидиногруппу использованием по известным методикам незащищенного, N-защищенного или N,N'-дизащищенного реагента гуанидирования (с образованием Q2 = -C(NH)-NH2, -C(NW2)-NH-W2 или -C(NH)-NH-W2).
Конечные соединения могут быть получены любым из следующих способов, зависящих от характера применяемой Q2-группы. Удаляют защитную группу-(ы) (когда Q2 - группа - -C(NH)-NH2, -C(NW2)-NH-W2 или -C(NH)-NH-W2) или селективно удаляют деблокированием W1-группу (напр. , когда Q2 - группа -C(NW2)-NH-W2, -C(NH)-NH-W2, в этом случае W2-группа должна быть ортогональна к W1-группе) с последующим алкилированием известными методами N-концевого азота и при желании деблокированием по известным методикам.
Способ IIIb
Способ состоит из реакции защищенной в N-окончании аминокислоты, выбранной исходя из значений A2 для формул I или V и полученной стандартными методами, с соединением формулы: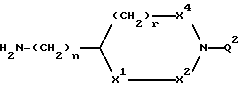
использованием стандартной методики соединения пептидов, иллюстрируемой следующим уравнением реакции: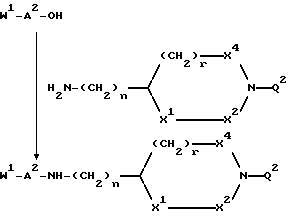
где n, r, X1, X2 и X4, W1 и Q2 принимают вышеуказанные значения, с последующим удалением W1-группы деблокированием и присоединением N-концевой аминокислоты в защищенной форме с образованием в результате защищенного дипептида, охарактеризованного в способе IIIa. Затем по методике способа IIIa продолжают синтез конечных пептидов.
Способ IVa
Способ состоит в реакции защищенного в N-окончании дипептида, выбранного исходя из значений A1 и A2 для формул I или V и полученного стандартным методом соединения пептидов, с соединением формулы: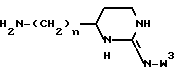
использованием стандартной методики присоединения пептидов, иллюстрируемой следующим уравнением реакции: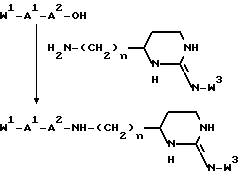
где n принимает значения, указанные для формулы I, W1 - N-концевая аминозащитная группа, например: трет-бутилоксикарбонил или бензилоксикарбонил и W3 - H или аминозащитная группа, например: арилсульфонил, бензилоксикарбонил или третбутилоксикарбонил. Конечные соединения могут быть получены любым из следующих способов. Удаляют защитную группу-(ы) или селективно удаляют W1-группу деблокированием (в этом случае W1-группа должна быть ортогональна к W3-группе) с последующим алкилированием N-концевого азота и при желании деблокированием.
Способ IVb
Способ состоит в реакции защищенной в N-окончании аминокислоты, выбранной из значений A2 для формул I или V и полученной стандартными методами, с соединением формулы: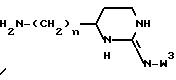
использованием стандартной методики присоединения пептидов, иллюстрируемой следующим уравнением реакции: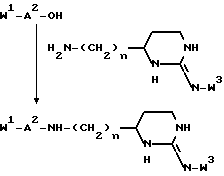
где n, W1 и W3 принимают вышеуказанные значения, с последующим удалением W1-группы деблокированием (W1-группа должна быть ортогональна к W3-группе) и присоединением N-концевой аминокислоты в защищенной форме с получением в результате защищенного пептида, охарактеризованного в способе IVa. Затем по методике способа IVa продолжают синтез конечных пептидов.
Последующее описание предназначено для иллюстрации аспектов изобретения.
Экспериментальная часть
Общие экспериментальные методики
Масс-спектры регистрируют на тройном квадрупольном масс-спектрометре Финнигэн MAT TSQ 700, снабженном электронапыляемой поверхностью раздела.
1H ЯМР и 13C ЯМР определения проводят на спектрометрах БРУКЕР AC-P 300 и ВРУКЕР AM 500, первый из которых работает при 1H частоте в 500,14 МГц и 13C частоте в 125,76 МГц, а второй при 1H и 13C частоте соответственно в 300,13 МГц и 75,46.
Образцы массой 10 - 50 мг растворяют в 0,6 мл одного из следующих растворителей: CDCl3 (изотопная чистота > 99,8%), CD3OD (изотопная чистота > 99,95%), D2O (изотопная чистота > 99,98%) или ДМСО-d6 (изотопная чистота > 99,8%), Все растворители производства фирмы Др. Глазер АГ, Базель.
Величины 1H и 13C химических сдвигов в CDCl3 и CD3OD даны относительно тетраметилсилана в качестве внешнего стандарта. 1H химические сдвиги в D2O даны относительно натриевой соли 3-(триметилсилил)-d4-пропановой кислоты, а 13C химические сдвиги в D2O приведены относительно 1,4-диоксана (67,3 част. /млн), каждый из которых является внешним стандартом. Калибровка по внешнему стандарту может в отдельных случаях привести к небольшим отличиям в химических сдвигах по сравнению с калибровкой по внутреннему стандарту, однако, разница в 1H химических сдвигах менее 0,02 част./млн, а в 13C химических сдвигах менее 0,1 част/млн.
1H ЯМР спектр пептидных последовательностей, содержащих пролин или "пролиноподобный" остаток, частот отличается наличием резонанса из двух серий. Это явление соответствует существованию двух вносящих свой вклад в спектр конформеров относительно вращения по амидной связи, при этом пролин является N-частью амидной связи. Конформеры обозначены, как имеющие цис- и транс-конфигурацию. В соединениях изобретения последовательности (R)Cha-Aze-, (R)Cha-Pro- и (R)Cha-Pic- часто приводят к цис-транс-равновесию с преобладанием одного из конформеров (> 90%). В этих случаях приводятся только 1H химические сдвиги основного конформера. И только в тех случаях, когда сигналы меньшего ротамера четко различимы, их приводят в ЯМР документации. Тот же критерий имеет место для NH-сигналов в CDCl3, когда в ЯМР документации приводятся только четко разрешимые сигналы. Это означает, что число протонов, указанных для некоторых промежуточных соединений, будет меньше числа протонов, ожидаемых на основании химической формулы.
Тонкослойную хроматографию проводят на продажных стеклянных или алюминиевых пластинках, покрытых силикагелем 60F254, фирмы Мерк. Визуальный анализ осуществляют сочетанием УФ облучения с последующим опрыскиванием раствором, приготовленным смешиванием 372 мл EtOH (95%), 13,8 мл концентрированной H2SO4, 4,2 мл концентрированной уксусной кислоты и 10,2 мл п-метоксибензальдегидного или фосфомолибденового реактива (5 - 10 мас.% в EtOH (95%)) и нагреванием.
Колоночную хроматографию проводят на силикагеле 60 (40-63 мм, 230-400 меш) фирмы Мерк под давлением воздуха.
Жидкостную хроматографию высокого разрешения с обращенными фазами (в Примерах сокращенно ОФЖХ) проводят на приборе Уотерс М-590, снабженном тремя колонками с обращенными фазами Кромсил 100, С8 (Эка-Нобель) различного размера: аналитическая (4,6 мм х 250 мм), полупрепаративная (1'' (25,4 мм) х 250 мм) и препаративная (2'' (50,8 мм) х 500 мм), с детектированием при 226 нм.
Сушку вымораживанием осуществляют с применением прибора Лейбоулд-Герэус модели Лайовак GT 2.
Получение исходных продуктов
Boc-(R)Pgl-OH
Получен из H-(R)Pgl-OH по методике, приведенной для получения Boc-(R)Cha-OH (см. ниже).
Boc-(R)Cha-OH
К раствору H-(R)Cha-OH (21,55 г, 125,8 ммоля) в 130 мл 1 М NaOH и 65 мл ТГФ добавляют 30 г (137,5 ммоля) (Boc)2O и смесь перемешивают 4,5 ч при комнатной температуре. После испарения ТГФ добавляют 150 мл воды. Водную щелочную фазу промывают дважды EtOAc, затем подкисляют 2 М KHSO4 и экстрагируют EtOAc (3 х 150 мл). Объединенную органическую фазу промывают водой, рассолом и сушат (Na2SO4). Испарением растворителя получают 30,9 г (90,5%) заглавного соединения в виде белого твердого вещества.
Boc-(R)Hop-OH
Получен по методике, приведенной для Boc-(R)Cha-OH, на основе H-(R)Hop-OH.
1H-ЯМР (300 МГц, CDCl3) δ: 1,45 (с, 9H), 2 (м, 1H), 2,22 (м, 1H), 2,75 (ш.т, 2H), 4,36 (ш.с, 1H), 5,05 (ш.с, 1H), 7,15-7,33 (м, 5H).
4-(трет-Бутилоксикарбониламиноэтил)пиридин
К раствору 10,81 г (100 ммолей) 4-аминометилпиридина в 100 мл ТГФ в течение 20 минут добавляют при 10oC раствор 24 г (110 ммолей) (Boc)2O в 70 мл ТГФ. Раствор оставляют нагреваться до комнатной температуры и перемешивают 4 ч (в ходе реакции образуется осадок и взвесь приобретает красную окраску). Растворитель удаляют, остаток растворяют в EtOAc и фильтруют через силикагель. Испарением растворителя получают заглавное соединение в виде красного масла, который постепенно кристаллизуется. Сырой продукт используют без дополнительной очистки.
1H-ЯМР (300 МГц, CDCl3) δ: 1,45 (с, 9H), 4,32 (д, 2H), 5,05 (ш.с, (NH)), 7,2 (д, 2H), 8,55 (д, 2H).
4-Аминометил-1-(N-бензилоксикарбониламидино)бензол (H-Pab(Z))
(1) 4-Цианобензилазид
К раствору 49,15 г (251 ммоль) 4-цианобензилбромида в 200 мл ДМФА добавляют при комнатной температуре раствор 20,23 г (0,31 моля) азида натрия в 50 мл воды. Протекает экзотермическая реакция, и спустя 1,5 ч реакционную смесь разбавляют 200 мл толуола (Внимание! Во избежание отделения потенциально взрывоопасных азидов перед добавлением воды к реакционной смеси рекомендуется добавлять толуол) и 500 мл воды. Водную фазу экстрагируют дополнительным количеством толуола (2 х 50 мл). Объединенные органические экстракты промывают водой (2 х 50 мл) и рассолом, сушат (MgSO4) и фильтруют. Раствор используют как таковой на следующей стадии.
1H-ЯМР (300 МГц, CDCl3) δ: 4,4 (с, 2H), 7,4 (д, 2H), 7,7 (д, 2H).
(II) 4-Амидинобензилазид
В смесь 250 мл абсолютного этанола и раствора со стадии (I) (примерно 200 мл) пробулькивают при -5oC до насыщения хлористый водород. Выдерживанием 24 ч при 8oC и испарением большей части растворителя с последующим осаждением добавлением безводного эфира получают белые кристаллы, которые отфильтровывают и растворяют в 1,8 л спиртового аммиака. Спустя 48 ч большую часть растворителя удаляют и после добавления 200 мл 3,75 М раствора NaOH осаждается в виде бесцветных кристаллов 4-амидинобензиламид. Кристаллы отфильтровывают и в этот момент выход 4-амидинобензилазида составляет 22,5 г (всего 51%).
Гидрохлорид Этилимидатобензилазида
1H-ЯМР (500 МГц, CD3OD) δ: 1,6 (т, 3H), 4,5 (с, 2H), 4,65 (к, 2H), 4,8 (ш.с, 2H), 7,6 (д, 2H), 8,1 (д, 2H).
4-Амидинобензиламид
1H-ЯМР (500 МГц, CDCl3) δ: 4,3 (с, 2H), 5,7 (ш.с, 3H), 7,3 (д, 2H), 7,6 (д, 2H).
13C-ЯМР (125 МГц, CDCl3) δ: углерод амидиногруппы: 165,5.
(III) 4-(Бензилоксикарбониламидино)бензилазид
Кристаллы со стадии (II) растворяют в 500 мл хлористого метилена, полученный раствор сушат (K2CO3) и после фильтрования добавляют 27 мл (194 ммоля) триэтиламина. К перемешиваемому раствору медленно прибавляют 25 мл бензилхлорформата с охлаждением реакционной смеси в бане со льдом. Через 30 минут добавляют еще 2 мл бензилхлорформата и перемешивание продолжают 30 минут. После добавления воды в водной фазе добавлением 2 М HCl устанавливают pH 7. Органическую фазу сушат (MgSO4) и растворитель удаляют в вакууме. Наконец из смеси эфир-хлористый метилен-гексан выделяют в виде бесцветных кристаллов 4-(бензилоксикарбониламидино)бензилазид.
1H-ЯМР (500 МГц, CDCl3) δ: 4,4 (с, 2H), 5,3 (с, 2H), 6,3-7 (ш.с, 1H), 7,3-7,4 (м, 5H), 7,5 (д, 2H), 7,9 (д, 2H), 9,3-9,6 (ш.с, 1H).
13C-ЯМР (125 МГц, CDCl3) δ: 167,5 (углерод амидиногруппы).
(IV) 4-аминометил-1-(бензилоксикарбониламидина)бензол (H-Pab (Z)).
К раствору 4-(бензилоксикарбониламидина)бензилазида со стадии (III) в 160 мл ТГФ добавляют при комнатной температуре 26,3 г (100 ммолей) трифенилфосфина. Спустя 16 ч добавляют еще 6,6 г (25 ммолей) трифенилфосфина и перед удалением растворителя в вакууме раствор оставляют на 4 ч. Остаток растворяют в хлористом метилене и экстрагируют 2 М HCl. Водную фазу промывают хлористым метиленом и эфиром и затем подщелачивают 3,75 М раствором гидроксида натрия. Экстрагированием хлористым метиленом с последующей сушкой (K2CO3) и удалением растворителя в вакууме получают 20 г (общий выход на исходный цианобензилбромид 28%) желтого масла, затвердевающего при стоянии.
1H-ЯМР (500 МГц, CDCl3) δ: 1,2-2,2 (ш.с, 2H), 3,8 (с, 2H), 5,2 (с, 2H), 7,2-7,35 (м, 5H), 7,4 (д, 2H), 7,8 (д, 2H), 9,1-9,6 (ш.с, 1H).
13C-ЯМР (125 МГц, CDCl3) δ: 164,6 и 168,17 (углероды амидиногруппы и карбонила).
H-Pig (Z)2
(1) 4-(трет-Бутилоксикарбониламинометил)пиперидин
К раствору 17,7 г 4-трет-бутилоксикарбониламинометилпиридина в 125 мл MeOH добавляют 2 г 5% Rh-Al2O3 и смесь гидрируют примерно сутки при 0,34 МПа. 1H-ЯМР спектр указывает на неполное гидрирование. Поэтому катализатор отфильтровывают, растворитель удаляют в вакууме, остаток растворяют в 100 мл уксусной кислоты и после добавления 2 г 5% Rh-Al2O3 смесь гидрируют 4 дня при 0,34 МПа. Катализатор отфильтровывают и большую часть уксусной кислоты удаляют в вакууме. После добавления к остатку 50 мл воды смесь подщелачивают 5 М NaOH и водную фазу экстрагируют CH2Cl2 (1 х 200 мл + 1 х 1 х 100 мл). Объединенную органическую фазу промывают 25 мл воды и сушат (MgSO4). Испарением растворителя получают 17,2 г коричневатого масла, которое растворяют в 50 мл диэтилового эфира. Добавлением 200 мл пентана получают осадок, фильтрование которого дает 7,7 г коричневого порошка. Испарением маточного раствора получают 7 г белого масла. Коричневый порошок растворяют в 100 мл EtOAc и органическую фазу промывают 1 М KHSO4 (1 х 50 мл + 1 х 25 мл). Объединенную кислую фазу подщелачивают 2 М NaOH и экстрагируют EtOAc (1 х 200 мл + 1 х 75 мл). Объединенную органическую фазу сушат и после испарения получают в виде белого порошка 5,2 г заглавного соединения.
Обработкой вышеуказанного белого масла, полученного из маточного раствора, тем же способом дополнительно получают 3,4 г продукта. Общий выход 40%.
1H-ЯМР (500 МГц, CDCl3, смесь двух ротамеров, 3:1) δ: (основной ротамер) 1,11 (дк, 2H), 1,44 (с, 9H), 1,49-1,6 (м, 1H), 1,63-1,7 (м, 2H), 2,58 (дт, 2H), 2,93-3,03 (м, 2H), 3,07 (м, 2H), 4,75 (ш.с, 1H (NH)).
Разрешаемые сигналы, создаваемые меньшим ротамером, появляются при δ: 1,21 (дк) и 1,91 (дт).
(II) Boc-Pig (Z)2
К раствору 2 г (9,33 ммоля) 4-трет-бутилоксикарбониламинометил)пиперидина в 60 мл CH3CN добавляют 3,34 г (9,33 ммоля) N,N'-(дибензилоксикарбонил)метилизомочевины и смесь перемешивают 22 ч при 60oC. Растворитель испаряют и остаток растворяют в EtOAc. Органическую фазу промывают 1 М KHSO4 (2 х 20 мл), водой (1 х 20 мл), рассолом (1 х 20 мл) и сушат (MgSO4). Испарением растворителя с последующей колоночной хроматографией с применением в качестве элюента смеси петролейный эфир-EtOAc (1:1) получают 2,43 г (50%) целевого продукта.
1H-ЯМР (500 МГц, CDCl3) δ: 1,19-1,31 (м, 2H), 1,43 (с, 9H), 1,63-1,8 (м, 3H), 2,66-3,05 (м, 4H), 3,7-4,5 (ш.с, 2H), 4,65 (ш.т, 1H (NH)), 5,13 (с, 4H), 7,2-7,4 (м, 10H), 10,5 (ш.с, 1H (NH)).
Отдельные сигналы, в особенности для пиперидинового цикла избирательно уширены вследствие процесса внутримолекулярного обмена. Особенно это заметно для 2- и 6-CH2-групп пиперидинового цикла, дающих широкий пик в интервале 3,7-4,5 ч/млн.
(III) H-Pig (Z)2
Раствор 163 мг (0,31 ммоля) Boc-Pig (Z)2 в 5 мл EtOAc, насыщенного HCl (г), перемешивают 3 ч и 20 минут при комнатной температуре. Растворитель испаряют и остаток растворяют в 30 мл CH2Cl2. Органическую фазу промывают 5 мл 2 М NaOH, 5 мл воды, 5 мл рассола и сушат (MgSO4). Испарением растворителя получают 100 мг (76%) заглавного соединения.
1H-ЯМР (500 МГц, CDCl3) δ: 1,18-1,37 (м, 2H), 1,46-1,63 (м, 1H), 1,68-1,83 (м, 2H), 2,57 (д, 2H), 2,86-3,03 (м, 2H), 3,7-4,5 (ш.с, 2H), 5,13 (с, 4H), 7,2-7,4 (м, 10H).
Отдельные сигналы, в особенности для пиперидинового цикла избирательно широки вследствие процесса внутримолекулярного обмена. Особенно это заметно для 2- и 6-CH2-групп пиперидинового цикла, дающих широкий пик в интервале 3,7-4,5 част./млн.
4-Аминометил-1-(N-бензилоксикрабониламидино)циклогексан (H-Pac(Z) • 2HCl)
(I) N-N/-4-(Бензилоксикарбонил)амидинобензил/-трет- бутилкарбамат
К охлаждаемому льдом раствору 1,81 г (6,4 ммоля) 4-(бензилоксикарбонил)амидинобензиламина и 1 мл (7,1 ммоля) триэтиламина в 25 мл хлористого метилена при перемешивании добавляют 1,466 г (6,7 ммоля) (Boc)2O. Спустя 20 минут добавляют дополнительное количество хлористого метилена и смесь промывают 5%-ой уксусной кислотой и 10%-ым раствором карбоната натрия. Сушкой (сульфатом магния) и удалением растворителя в вакууме получают остаток, который может быть кристаллизован из смеси хлористый метилен-гексан. Выход 1,66 г (68%).
(II) N-/N-4-Амидинобензил)-трет-бутилкарбамат
Смесь 1,6 г (4,2 ммоля) N-/4-(бензилоксикарбонил)амидинобензил/-трет-бутилкарбамата, 5 мл уксусной кислоты и 160 мг 10% палладия на угле в 50 мл этанола перемешивают 2 ч в атмосфере водорода. Катализатор удаляют фильтрованием через целлит и удалением растворителя в вакууме получают ацетат заглавного соединения с количественным выходом.
(III) N-/4-Амидиноциклогексилметил)-трет-бутилкарбамат
Ацетат N-/4-амидинобензил/-трет-бутилкарбамата (17 ммолей) гидрируют в 100 мл метанола гидрируют 20 ч при 3,4 МПа в присутствии 863 мг 5% родия на оксиде алюминия. Катализатор отфильтровывают и растворитель удаляют в вакууме. Остаток растворяют в воде и раствор подщелачивают гидроксидом натрия. Последующим экстрагированием хлористым метиленом, сушкой объединенной органической фазы (карбонат калия) и удалением растворителя в вакууме получают 3,8 г (87%) заглавного соединения.
(I) N-/N-4-(Бензилоксикарбонил)амидиноциклогексилметил/- трет-бутилкарбамат
К перемешиваемому при 0oC раствору 2,04 г (8 ммолей) N-/4-амидиноциклгексил/карбамата, 1,23 мл (8,8 ммоля) триэтиламина и 197 мг ДМАП в 40 мл хлористого метилена добавляют 1,25 мл (8,8 ммоля) бензилхлорформата. Спустя 10 минут реакционную смесь разбавляют хлористым метиленом и экстрагируют водой, разбавленной уксусной кислотой и раствором гидрокарбоната натрия. Органическую фазу наносят на колонку оксида кремния и последующим элюированием хлористым метиленом, содержащим возрастающие количества этилацетата, получают 2,49 г (80%) заглавного соединения.
(V) 4-Аминометил-1-(N-бензилоксикарбониламидино)циклогексан (H-Pac (Z) • 2HCl).
Через раствор 2 г (5,1 ммоля) N-/4-(бензилоксикарбонил)- амидиноциклогексилметил/-трет-бутилкарбамата в 40 мл этилацетата пропускают хлористый водород. Спустя 10 минут добавляют метанол и после удаления в вакууме некоторого количества растворителя происходит кристаллизация дигидрохлорида заглавного соединения.
4-Аминометил-1-(N-бензилоксикарбониламидино)пиперидин (H-Pig (Z) • HCl)
(I) 4-(N-трет-Бутилоксикарбониламинометил)-1-(N- бензилоксикарбониламидино)пипередин (Boc-Pig (Z))
В 25 мл этанола смешивают 7,8 г (36,4 ммоля) 4-(N-трет-бутилоксикарбониламинометил)пиперидина и 8,98 г (40 ммолей) N-бензилоксикарбонил-S-метилизотиомочевины. Смесь нагревают шесть часов при 60 - 70oC и оставляют на два дня при комнатной температуре. Растворитель испаряют и остаток растворяют в CH2Cl2. Органический слой промывают дважды 0,3 M KHSO4 и один раз рассолом. Объединенный органический слой сушат (Na2SO4), фильтруют и испаряют. Очисткой сырого продукта колоночной хроматографией с применением в качестве элюента ступенчатого градиента CH2Cl2/MeOH (100/0, 97/3, 95/5, 90/10) получают 5,22 г (37%) заглавного соединения.
(II) H-Pig (Z) • HCl (4-аминометил-1-(N- бензилоксикарбониламидино)пиперидин
В 100 мл этилацетата, насыщенного HCl (г), растворяют 5,22 г (13,5 ммоля) Boc-Pig (Z). Смесь оставляют на один час и затем испаряют. Остаток растворяют в воде и промывают смесью диэтилового эфира с этилацетатом. Сушкой вымораживанием водного слоя получают 4 г (91%) заглавного соединения.
1H-ЯМР (D2O, 300 МГц) δ: 1,4-1,6 (м, 2H), 2,05 (ш.д, 2H), 2,19 (м, 1H), 3,07 (д, 2H), 3,34 (ш.т, 2H), 4,08 (ш.д, 2H), 5,4 (с, 2H), 7,5-7,63 (м, 5H).
MC: m/z (291 (M+ + 1).
4-Аминоэтил-1-бензилоксикарбониламидинопиперидин (H-Rig (Z))
(I) 1-Бензилоксикарбониламидино-4-гидроксиэтилпиперидин
Смесь 6,2 г (0,028 моля) 4-гидроксиэтилпиперидина и 3,6 г (0,028 моля) N-бензилоксикарбонил-S-метилизотиомочевины в 50 мл ацетонитрила кипятят примерно сутки. Испарением и колоночной хроматографией на силикагеле с элюированием этилацетатом получают 3,5 г (41%) заглавного соединения.
1H-ЯМР (300 МГц, CDCl3) δ: 1,1-1,85 (м, 7H), 2,83 (ш.т, 2H), 4,7 (ш.т, 2H), 4,18 (ш.д, 2H), 5,12 (с, 2H), 6,9-7,2 (м, 2H), 7,2-7,5 (м, 5H).
(II)-1-Бензилоксикарбониламидино-4-мезилоксиэтилпиперидин
К охлаждаемому льдом раствору 3,5 г (0,0115 моля) 1-бензилоксикарбониламидино-4-гидроксиэтилпиперидина, 1,15 г (0,0115 моля) триэтиламина в 40 мл хлористого метилена и 10 мл тетрагидрофурана прибавляют по каплям 1,3 г (0,0115 моля) мезилхлорида. Реакционную смесь перемешивают 1 ч. Смесь переносят в воду и органический слой отделяют. Водный слой экстрагируют хлористым метиленом, объединенные органические слои сушат (Na2SO4) и испаряют. Продукты используют на следующей стадии без дополнительной очистки. Выход 4,4 г (100%).
1H-ЯМР (500 МГц, CDCl3) δ: 1,15-1,3 (м, 2H), 1,65-1,8 (м, 5H), 2,84 (ш. т, 2H), 3,01 (с, 3H), 4,2 (ш.д, 2H), 4,27 (т, 2H), 5,12 (с, 2H), 7,1-7,5 (м, 7H).
(III) 4-Азидоэтил-1-бензилоксикарбониламидинопиперидин
К раствору 4,4 г (0,0115 моля) сырого 1-бензилоксикарбониламидино-4-мезилоксиэтилпиперидина в 100 мл диметилформамида добавляют 4,5 г (0,069 моля) азида натрия и смесь нагревают 2,5 ч при 100oC. Затем смесь переносят в воду и трижды экстрагируют этилацетатом. Объединенную органическую фазу промывают водой, сушат (Na2SO4) и испаряют. Остаток подвергают колоночной хроматографии на силикагеле с применением в качестве элюента смеси этилацетатгептан (1:1). Выход 3 г (79%).
1H-ЯМР (500 МГц, CDCl3) δ: 1,2 (дк, 2H), 1,5-1,8 (м, 5H), 2,85 (дт, 2H), 3,35 (т, 2H), 4,22 (шд, 2H), 5,13 (с, 2H), 6,9-7,2 (ш., 2H), 7,2-7,45 (м, 5H).
(IV) 4-Аминоэтил-1-бензилоксикарбониламидинопиперидин (H-Rig (Z))
К 30 мл воды добавляют 0,4 г 10% Pd-C. В 30 мл воды растворяют 1 г (0,031 моля) боргидрида натрия и раствор осторожно прибавляют к охлаждаемой льдом взвеси Pd-C в воде. В 80 мл тетрагидрофурана растворяют 2,9 г (8,8 ммоля) 4-азидоэтил-1-бензилоксикарбониламидинопиперидина и полученный раствор по каплям прибавляют к охлаждаемой льдом вышеуказанной водной взвеси. После перемешивания 4 ч при комнатной температуре смесь вновь охлаждают льдом, после чего добавляют 30 мл 2 М HCl. Смесь фильтруют через целлит и целлит ополаскивают дополнительным количеством воды. Тетрагидрофуран испаряют и водную фазу промывают этилацетатом. После подщелачивания водной фазы 2 М NaOH ее трижды экстрагируют хлористым метиленом. Объединенную органическую фазу промывают водой, сушат (Na2SO4) и испаряют. Продукт используют на следующей стадии без дополнительной очистки.
1H-ЯМР (500 МГц, CDCl3) δ: 1,1-1,5 (м, 6H), 1,55-1,65 (м, 1H), 1,73 (ш. д, 2H), 2,72 (ш., 2H), 2,81 (дт, 2H), 4,2 (ш.д, 2H), 5,12 (с, 2H), 6,9-7,2 (ш., 2H), 7,2-7,5 (м, 2H).
(3RS)-1-(N-Бензилоксикарбониламидино)-3-аминометилпирролидин (H-(R, S)Nig(Z))
(1) (3RS)-3-Гидроксиметилпирролидин
(3RS)-1-Бензил-3-гидроксиметилпирролидин (16,4 г, 0,0857 моля) (H-R,S) Hig (Z) (1), см выше) смешивают с 1,6 г Pd-C (10%), 5 мл воды и 50 мл этанола и смесь гидрируют при 0,26 МПа примерно сутки. После фильтрования через гайфло и испарения растворителя 1H-ЯМР указывает на неполноту реакции. Продолжение гидрирования при 0,26 МПа в присутствии 1,6 г Pd-C (10%) мл воды и 150 этанола в течение трех дней завершают восстановление. Фильтрованием через гайфло и испарением растворителя с количественным выходом получают заглавное соединение.
(II) (3RS)-1-(N-Бензилоксикарбониламидино)-3- гидроксиметилпирролидин
В толуоле растворяют 1,01 г (0,01 моля) (3RS)-3-гидроксиметилпирролидина и 2,29 г (0,011 моля) N-бензилоксикарбонил-O-метилизомочевины (амин не очень растворим в толуоле) и смесь нагревают 3 часа при 60oC с последующим перемешиванием примерно сутки при комнатной температуре. После испарения смеси 1H-ЯМР указывает на неполноту реакции. Поэтому смесь растворяют в 15 мл ацетонитрила и нагревают три часа при 60oC с последующим перемешиванием при комнатной температуре примерно сутки. Растворитель испаряют и остаток растворяют в CH2Cl2, промывают водой один раз, сушат (Na2SO4) и испаряют. Очисткой сырого продукта колоночной хроматографией с применением в качестве элюента CH2Cl2-MeOH (95:5) получают 0,7 г (25%) продукта.
MC: m/z 278 (M+ + 1).
(III) (3RS)-1-(N-Бензилоксикарбониламидино)-3- мезилоксиметилпирролидин
В 15 мл смеси диэтиловый эфир-CH2Cl2 (1:1) растворяют 0,7 г (2,53 ммоля) (3RS)-1-(N-бензилоксикарбониламидино)-3-гидроксиметилпирролидина и 0,7 мл (5,05 ммоля) триэтиламина и смесь охлаждают до 0oC. Затем медленно прибавляют 0,25 мл (3,29 ммоля) метансульфонилхлорида в 3 мл диэтилового эфира и реакционную смесь перемешивают три часа при 0oC. Растворитель испаряют, остаток растворяют в этилацетате и экстрагируют 0,3 М раствором KHSO4. Водный слой промывают один раз CH2Cl2. Водный слой нейтрализуют 10 М раствором NaOH и экстрагируют дважды CH2Cl2. Объединенный органический слой сушат (Na2SO4), фильтруют и после испарения получают 0,45 г (50%) заглавного соединения.
(IV) (3RS)-1-(N-Бензилоксикарбониламидино)-3- азидометилпирролидин
В 10 мл диметилформамида растворяют 0,45 г (1,27 ммоля) (3RS)-1-(N-бензилоксикарбониламидино)-3-метилоксиметилпирролидина и 0,124 г (1,9 ммоля) азида натрия и смесь нагревают четыре чаа при 60oC с последующим перемешиванием примерно сутки при комнатной температуре. После добавления воды смесь дважды экстрагируют смесью толуол-этилацетат (2:1). Объединенный органический слой сушат (Na2SO4), фильтруют и испаряют. Очисткой сырого продукта колоночной хроматографией с применением в качестве элюента CH2Cl2-MeOH (95: 5) получают 0,262 г (68%) продукта.
MC: m/z 303 (M+ + 1).
(V) (3RS)-1-(N-Бензилоксикарбониламидино)-3- аминометилпирролидин (H-(R, S) Nig (Z))
Смешивают 32 мг Pd-C (10%) и 2,6 мл H2O и осторожно пропускают ток азота. Добавляют 98 мг NaBH4 в 2,6 мл H2O с последующим медленным прибавлением 262 мг (0,87 ммоля) (3RS)-1-(N-бензилоксикарбониламидино)-3-мезилоксиметилпирролидина в 7 мл MeOH. После выдерживания один час к смеси добавляют 5 мл 1 М HCl и фильтруют через гайфло. Органический растворитель испаряют при пониженном давлении, оставшийся водный слой один раз промывают этилацетатом, подщелачивают раствором NaOH и несколько раз экстрагируют CH2Cl2. Объединенный органический слой сушат (Na2SO4), фильтруют и после испарения получают 130 мг (54%) продукта.
MC: m/z 277 (M+ + 1).
(3RS)-1-(N-Бензилоксикарбониламидино)-3-аминоэтилпирролидин (H-(R,S)Hig (Z))
(I) (3RS)-1-Бензил-3-гидрометилпирролидин
К взвеси 6,22 г литийалюминийгидрида в 160 мл диэтилового эфира в атмосфере аргона медленно прибавляют 25,2 г (0,1063 моля) (3RS)-1-бензил-2-оксо-4-метоксикарбонилпирролидина. После перемешивания примерно сутки смесь кипятят один час. Реакционную смесь охлаждают до комнатной температуры, добавляют 0,2 г Na2SO4 • 10H2O с последующим медленным прибавлением в указанном порядке 6 мл воды, 18 мл 3,75 М раствора NaOH и 6 мл воды. Из взвеси удаляют избыток воды добавлением Na2SO4-целлита, фильтруют и после испарения получают 20,3 г продукта.
1H-ЯМР (CDCl3, 300 МГц) δ: 1,64-1,77 (м, 1H), 1,93-2,07 (м, 1H), 2,27-2,4 (м, 2H), 2,51 (дд, 1H), 2,62 (дд, 1H), 2,82 (м, 1H), 3,52 (дд, 1H), 3,59 (с, 2H), 3,67 (дд, 1H), 7,15-7,4 (м, 5H).
(II) (3RS)-1-Бензил-3-хлорметилпирролидин
К кипящему раствору 15,3 г (0,08 ммоля) (3RS)-1-бензил-3- гидроксиметилпирролидина в 220 мл CHCl3 медленно прибавляют тионилхлорид в 60 мл CHCl3 и кипячение продолжают один час. После испарения смеси остаток растворяют в воде. Водный слой промывают этилацетатом и подщелачивают 0,2 М раствором NaOH. Водный слой трижды экстрагируют этилацетатом, объединенный органический слой сушат (Na2SO4), фильтруют и после испарения с количественным выходом получают продукт (16,8 г).
1H-ЯМР (CDCl3, 300 МГц) δ: 1,55 (м, 1H), 2,05 (м, 1H), 2,38 (дд, 1H), 2,48-2,64 (м, 3H; там же 2,58 (т, 2H)), 2,73 (дд, 1H), 3,51 (д, 2H), 3,6 (с, 2H), 7,2-7,4 (м, 5H).
(III) (3RS)-1-Бензил-3-цианометилпирролидин
В 250 мл диметилсульфоксида растворяют 16,8 г (0,08 моля) (3RS)-1-бензил-3-хлорметилпирролидина и 5,88 г (0,12 моля) цианида натрия. Смесь перемешивают два дня при 60oC и одну неделю при комнатной температуре. После добавления воды смесь трижды экстрагируют этилацетатом. Объединенный органический слой промывают рассолом, сушат (Na2SO4), фильтруют и после испарения получают 14,7 г (92%) продукта.
1H-ЯМР (CDCl3, 500 МГц) δ: 1,55 (м, 1H), 2,13 (м, 1H), 2,35 (дд, 1H), 2,42 (т, 2H), 2,44-2,59 (м, 2H), 2,65 (м, 1H), 2,73 (дд, 1H), 3,61 (с, 2H), 7,2-7,4 (м, 5H).
(IV) (3RS)-1-Бензил-3-аминоэтилпирролидин
К взвеси 2,94 г литийалюминийгидрида в 74 мл диэтилового эфира медленно прибавляют в атмосфере аргона 14,7 г (0,0734 моля) (3RS)-1-бензил-3-цианометилпирролидина, растворенного в 220 мл диэтилового эфира. После перемешивания смеси примерно сутки добавляют 6 мл воды, 18 мл 3,75 М раствора NaOH и 6 мл воды. Взвесь сушат в присутствии Na2SO4-целлита с удалением избытка воды, фильтруют с отсосом и после испарения получают 14,84 г (99%) продукта.
1H-ЯМР (CDCl3, 300 МГц) δ: 1,41 (м, 1H), 1,51 (к, 2H), 1,9-2,1 (м, 2H, там же 2,05 (дд, 1H)), 2,18 (м, 1H), 2,43 (м, 1H), 2,55-2,75 (м, 3H), 2,8 (кажущийся т, 1H), 3,58 (кажущийся д, 2H), 7,15-7,4 (м, 5H).
(V) (3RS)-1-Бензил-3-(N-трет-бутилоксикарбониламиноэтил)- пирролидин
К смеси 14,84 г (0,0726 моля) (3RS)-1-бензил-3-аминоэтилпирролидина, 72,6 мл 1 М раствора NaOH, 6 мл воды и 145 мл ТГФ добавляют 17,44 г (0,08 моля) ди-трет-бутилдикарбоната и смесь перемешивают примерно сутки. Раствор концентрируют и трижды экстрагируют этилацетатом. Объединенный органический слой промывают рассолом, сушат (Na2SO4), фильтруют и испаряют. Очисткой сырого продукта колоночной хроматографией с применением в качестве элюента ступенчатого градиента CH2Cl2-MeOH (95/5, 80/10) получают 14,69 г (80%) продукта.
1H-ЯМР (CDCl3, 300 МГц) δ: 1,25-1,65 (м, 12H; там же 1,4 (с, 9H)), 1,9-2,25 (м, 3H), 2,46 (м, 1H), 2,67 (м, 1H), 2,8 (кажущийся т, 1H), 3,09 (м, 2H), 3,59 (с, 2H), 4,6 (ш.с, NH), 7,15-7,35 (м, 5H).
(VI) (3RS)-3-(N-трет-Бутилоксикарбониламиноэтил)пирролидин
(3RS)-1-бензил-3-(N-трет-бутилоксикарбонил)аминоэтил)- пирролидин (3,1 г, 0,01 моля) гидрируют при 0,28 МПа в присутствии 0,6 г катализатора Пирлмана (Pd(OH)2) в 40 мл этанола примерно сутки. После удаления катализатора фильтрованием через целлит и испарением растворителя 1H-ЯМР показал незавершенность реакции. Поэтому еще раз добавляют 0,6 г катализатор Пирлмана в 40 мл этанола (95%) и смесь выдерживают примерно сутки под давлением H2 в 0,28 МПа. Фильтрованием через целлит и испарением растворителя с количественным выходом получают продукт (2,18 г).
MC: m/z 214 (M+)
(VII) (3RS)-1-(N-Бензилоксикарбониламидино)-3-аминоэтилпирролидин (H-(R, S)Hig (Z))
В 30 мл толуола растворяют 2,18 г (0,0102 моля) (3RS)-3-(N-трет-бутилоксикарбониламиноэтил)пирролидин и 2,81 г (0,0125 моля) N-бензилоксикарбонил-S-метилизотиомочевины и смесь нагревают восемь часов при 60-70oC с последующим перемешиванием один день при комнатной температуре. После добавления 0,3 М раствора KHSO4 водный слой промывают смесью толуола с этилацетатом и оставляют на 2 дня, в течение которых происходит удаление Boc-группы. Кислотную водную фазу подщелачивают и четырежды экстрагируют CH2Cl2. Объединенный органический слой сушат (Na2SO4) и после испарения получают 2 г (51%) заглавного соединения.
1H-ЯМР (CDCl3, 330 K, 300 МГц) δ: 1,45-1,7 (м, 3H), 2,07 (м, 1H), 2,26 (м, 1H), 2,74 (т, 2H), 3 (кажущийся т, 1H), (3,33 (кажущийся к, 1H), 3,45-3,8 (м, 2H), 5,12 (с, 2H), 6,72 (ш.с, 2NH), 7,15-7,45 (м, 5H).
(4RS)-1,3-диаза-2-тозилимино-4-аминоэтилциклогексан (H-(R,S)Itp(TS))
(I) (4RS)-1,3-диаза-2-тозилимино-4-карбоксициклогексан
Получен по методике, приведенной в Journal of Org. Chem. стр. 46, 1971.
(II) (4RS)-1,3-диаза-2-тозилимино-4-гидроксиметилциклогексан
К охлажденной взвеси (температура бани со льдом) 9,9 г (33 ммоля) (4RS)-1,3-диаза-2-тозилимино-4-карбоксициклогексана в 330 мл сухого ТГФ осторожно прибавляют 12,9 г (345 ммолей) LiAlH4 и реакционную смесь перемешивают примерно сутки при комнатной температуре. Реакционную смесь обрабатывают согласно рекомендациям Физер и Физера, напр., добавлением к смеси 12,9 г воды, 38,7 г 3,75 М NaOH, 12,9 г воды, CH2Cl2 и целлита с последующим фильтрованием. Испарением растворителя получают 7 г (75%) целевого продукта.
MC: m/z 284 (M+ + 1).
(III) (4RS)-1,3-диаза-2-тозилимино-4-мезилоксиметилциклогексан
К охлажденной взвеси (температура бани со льдом) 7 г (24,7 ммоля) (4RS)-1,3-диаза-2-тозилимино-4-гидроксиметилциклогексана в 6,9 мл (49,4 ммоля) триэтиламина и 125 мл CH2Cl2 осторожно прибавляют 2,9 мл (37,1 ммоля) Ms-Cl. Спустя 1 ч 15 мин добавляют воду, органический слой отделяют, сушат (Na2SO4), фильтруют и после испарения с количественным выходом получают заглавное соединение.
MC: m/z 362 (M+ + 1).
(IV) (4RS)-1,3-диаза-2-тозилимино-4-цианоиметилциклогексан
В 75 мл ДМСО растворяют 8,9 г (24,7 ммоля) (4RS)-1,3-диаза-2-тозилимино-4-мезилоксиметилциклогексана и 1,3 г (27,2 ммоля) NaCN. После перемешивания 60 часов при 60oC добавляют еще NaCN в количестве 0,31 г (6 ммолей) и раствор перемешивают три часа при 65oC. После добавления 150 мл воды из раствора выпадают кристаллы. Фильтрованием и сушкой кристаллов получают 5,4 г (75%) целевого продукта.
MC: m/z 293 (M+ + 1).
(4RS)-1,3-Диаза-2-тозилимино-4-аминоэтилциклогексан (H-(R,S)Itp(Ts))
К охлажденной взвеси (температура бани со льдом) 2,4 г (8,2 ммоля) (4RS)-1,3-диаза-2-тозилимино-4-цианометилциклогексана в 90 мл ТГФ осторожно прибавляют 935 мг LiAlH4. После перемешивания 2 часа добавляют 1 г H2O, 3 г 3,75 М NaOH, 1 г H2O, Na2SO4, целлит и CH2Cl2. Фильтрованием смеси и удалением растворителя в вакууме получают 2,2 г (80%) целевого продукта.
1H-ЯМР (500 МГц, MeOD) δ: 1,52-1,71 (м, 3H), 1,88-1,96 (м, 1H), 2,37 (с, 3H), 2,64-2,73 (м, 2H), 3,2-3,4 (м, 2H, частично перекрывается сигналами растворителя), 3,44-3,53 (м, 1H), 7,28 (д, 1H), 7,71 (д, 2H).
(4S)-1,3-диаза-2-тозилимино-4-аминоэтилциклогексан (H-(S)Itp(Ts))
Получен на основе оптически чистой 2,4-диаминомасляной кислоты по методике, приведенной для получения H-(R,S)Itp(Ts).
1H-ЯМР (300,13 МГц, CDCl3) δ: 0,97-1,15 (ш.с, 1H), 1,48-1,69 (м, 3H), 1,84-1,95 (м, 1H), 2,37 (с, 3H), 2,68-2,82 (м, 1H), 2,86-2,98 (м, 1H), 3,22-3,44 (м, 2H), 3,45-3,58 (м, 1H), 7,19 (д, 2H), 7,19 (д, 2H), 7,72 (д, 2H).
13C-ЯМР (300,13 МГц, CDCl3) δ: 154,5 (углерод гуанидиногруппы).
H-Aze-OEt • HCl
Получен из H-Aze-OH по методике синтеза H-Pic-OEt • HCl (см. ниже).
H-Aze-OMe • HCl
Получено по методике, приведенной в работе: Seebach D. и др., Liebigs Ann. Chem., стр. 687, 1990.
H-Pab (Z) • HCl
Получен прибавлением 1 г молярного эквивалента 5 М HCl в изопропаноле к раствору сырого H-Pab (Z) в EtOH (около 1 г/10 мл) и немедленным осаждением из раствора H-Pab (Z) • HCl. После фильтрования осадок промывают 2 раза холодным EtOH и сушкой получают с количественным выходом заглавное соединение.
H-Pic-OEt • HCl
В 100 мл абс. этанола образуют взвесь L-пипеколиновой кислоты (4 г, 0,031 моля), через которую осторожно пробулькивают HCl (г) до образования прозрачного раствора. Раствор охлаждают в бане со льдом и к нему в течение 15 минут по каплям прибавляют 17 мл тионилхлорида. Баню удаляют и смесь кипятят 2,5 ч. После испарения растворителя получают с количественным выходом продукт в виде его гидрохлорида.
1H-ЯМР (300 МГц, D2O) δ: 1,33 (т, 3H), 1,8-2,1 (м, 5H), 2,3-2,5 (м, 1H), 3,1-3,3 (м, 1H), 3,5-3,7 (м, 1H), 4,14 (дд, 1H), 4,44 (к, 2H).
H-(R,S)бетаPic-OMe • HCl
К охлаждаемой в бане со льдом смеси 2 г (15,5 ммоля) нипекотиновой кислоты и 8 мл метанола добавляют хлористый тионил (2,76 г, 23,2 ммоля), после чего смесь перемешивают 20 часов при комнатной температуре. Растворитель испаряют, остаток растворяют в небольшом количестве метанола и после добавления диэтилового эфира осаждается H-(R,S)бетаPic-OMe • HCl в виде белых кристаллов. Кристаллы 2,57 г (92%) отделяют фильтрованием.
Boc-(R)Cgl-OH
К раствору 32,6 г (0,13 ммоля) Boc-(R)-Pgl-OH в 300 мл метанола добавляют 5 г Rh-Al2O3 и смесь гидрируют 3 дня при 5,2-2,8 МПа. После фильтрования и испарения растворителя ЯМР показал присутствие около 25% метилового эфира заглавного соединения. Сырой продукт растворяют в 500 мл ТГФ и 300 мл воды и к раствору добавляют 20 г LiOH. Смесь перемешивают примерно сутки и ТГФ испаряют. Оставшуюся водную фазу подкисляют KHSO4 и трижды экстрагируют этилацетатом. Объединенный органический слой промывают водой, сушат (Na2SO4) и после испарения получают 28,3 г (83%) целевого продукта.
1H-ЯМР (300 МГц, CDCl3) δ: 0,9-1,7 (м, 20H), 4-4,2 (м, 1H), 5,2 (д, 1H).
Boc-(R)Cgl-OSu
К охлаждаемому льдом раствору 2,01 г (7,81 ммоля) Boc-(R)Cgl-OH и 1,83 г (15,6 ммоля) ГСИ в 25 мл CH3CN добавляют 1,69 г (8,2 ммоля) ДЦК и реакционную смесь оставляют нагреваться до комнатной температуры. После перемешивания 3 дня осадок ДЦМ отфильтровывают и растворитель испаряют. Остаток растворяют в EtOAc и органическую фазу промывают H2O, KHSO4, NaHCO3, рассолом и сушат (Na2SO4). Испарением растворителя с количественным выходом получают заглавное соединение.
Boc-(R)Cha-OSu
Boc-(R)Cha-OH (1 экв. ), ГСИ (1,1 экв.) и ДЦК или ЦМЭ-КДИ (1,1 экв.) растворяют в ацетонитриле (примерно 2,5 мл/моль кислоты) и все перемешивают при комнатной температуре примерно сутки. Образовавшийся в ходе реакции осадок отфильтровывают, растворитель испаряют и продукт сушат в вакууме. (В случае применения ЦМЭ-КДИ в реакции полученный после испарения CH3CN остаток растворяют в EtOAc, органическую фазу промывают водой и сушат). Испарением растворителя получают заглавное соединение.
1H-ЯМР (500 МГц, CDCl3, 2 ротамера в соотношении прим. 1:1) 0,85-1,1 (м, 2H), 1,1-1,48 (м, 4H), 1,5-1,98 (м, 16H; там же 1,55 (ш.с, 9H)), 2,82 (ш.с, 4H), 4,72 (ш.с, 1H, основной ротамер), 4,85 (ш.с, 1H, меньший ротамер).
Boc-(R)Hoc-OH
К раствору 3,2 г (11,46 ммоля) Boc-(R)Hop-OH (см. выше) в метаноле (75 мл) добавляют 0,5 г родия на активированном оксиде алюминия (Ph-Al2O3) и смесь перемешивают 18 ч под давлением водорода в 0,41 МПа. Катализатор удаляют фильтрованием через гайфло и испарением почти с количественным выходом получают продукт.
1H-ЯМР (500 МГц, CDCl3) δ: 0,9 (м, 2H), 1,08-1,33 (м, 6H), 1,43 (с, 9H), 1,6-1,74 (м, 6H), 1,88 (ш.с, 1H), 4,27 (ш.с, 1H).
Boc-(R)Hoc-OSu
Получен из Boc-(R)Hoc-OH по методике получения Boc-(R)Cha-OSu
Boc-(R)Pro(3-(S)Ph)-OH
Получен по методике, приведенной в работе: J.Y.L.Chung и др., Journal of Organic Chemistry, N 1, стр. 270-275, 1990.
Boc-(R)Cgl-Aze-OH
(1) Boc-(R)Cgl-Aze-OMe
К перемешиваемой смеси 3,86 г (15 ммолей) Boc-(R)Cgl-OH, 2,27 г (15 ммолей) H-Aze-OMe • HCl и 2,75 г (22,5 ммоля) ДМАП в 40 мл CH3CN добавляют при 5oC 3,16 г (16,5 ммоля) ЭДК и реакционную смесь перемешивают 48 ч при комнатной температуре. Растворитель испаряют и остаток растворяют в 150 мл EtOAc и 20 мл H2O. Отделенный органический слой промывают 0,5 М KHSO4 (2 х 20 мл), насыщенным раствором NaHCO3 (2 х 10 мл), 10 мл H2O, 10 мл рассола и сушат (MgSO4). Испарением растворителя получают 4,91 г (92%) заглавного соединения, используемого на следующей стадии без дополнительной очистки.
1H-ЯМР (500 МГц, CDCl3, 0,1 г/мл) основной ротамер: 0,83-1,25 (м, 5H), 1,38 (с, 9H), 1,47-1,84 (м, 6H), 2,18-2,27 (м, 1H), 2,5-2,62 (м, 1H), 3,72 (с, 3H), 3,94-4,06 (м, 1H), 4,07-4,15 (м, 1H), 4,39-4,47 (м, 1H), 4,68 (дд, J = 9,1 J = 5,1, 1H), 5,09 (д, J = 9,2, 1H).
Разрешаемые пики меньшего ротамера: 2,27-2,35 (м, 1H), 3,77 (с, 3H), 3,8-3,87 (м, 1H), 3,88-3,95 (м, 1H), 4,92 (д, J = 9,2, 1H), 5,21 (дд, J = 9,1, J = 5,1H).
(II) Boc-(R)Cgl-Aze-OH
Гидролиз Boc-(R)Cgl-Aze-OMe проводят по методике гидролиза Boc-(R)Cha-Pic-OEl (см. ниже). Продукт кристаллизуют из смеси EtOH-ацетон-вода (1:1: 3,95). Выход 80%.
1H-ЯМР (500 МГц, CDCl3) δ: 0,85-1,3 (м, 5H), 1,4 (с, 9H), 1,5-1,9 (м, 6H), 1,95-2,2 (м, 2H), 3,92 (м, 1H), 4,09 (м, 1H), 4,35 (м, 1H), 4,95 (м, 1H), 5,16 (ш.д, 1H).
Boc-(R)Cgl-Pic-OH
(I) Boc-(R)Cgl-Pic-OMe
К раствору Boc-(R)Cgl-Pic-OH (2,086 г, 8,1 ммоля) и триэтиламина (1,13 мл, 8,1 ммоля) в толуоле (25 мл) и ДМФА (5 мл) добавляют пивалоилхлорид (1 мл, 8,1 ммоля). Затем при температуре бани со льдом добавляют смесь H-Pic-OMe • HCl (1,46 г, 8,1 ммоля) и триэтиламина (1,13 мл, 8,1 ммоля) в ДМФА (20 мл). Реакционную смесь оставляют медленно нагреваться до комнатной температуры и спустя 24 ч разбавляют водой и экстрагируют толуолом. После промывания 0,3 М KHSO4, 10% N2CO3 и рассолом испарением растворителя в вакууме получают 2,52 г (81%) бесцветного масла, которое используют без дополнительной очистки.
1H-ЯМР (500 МГц, CDCl3, 2 ротамера в отношении 5:1) δ: 0,8-1,8 (м, 25H), 2,25 (д, 1H), 2,75 (т, 1H, меньший ротамер), 2,3 (т, 1H), 3,7 (с, 3H), 3,85 (д, 1H), 4,3 (т, 1H, меньший ротамер), 4,5-4,6 (м, 1H), 5,25 (д, 1H), 5,3 (д, 1H).
(II) Boc-(R)Cgl-Pic-OH
Получен по методике гидролиза Boc-(R)Cha-Pic-OEl (см. ниже) использованием продукта вышеприведенной стадии (1). Продукт кристаллизован из диизопропилового эфира и гексана.
1H-ЯМР (500 МГц, CDCl3, 2 ротамера в отношении 5:1) δ: 0,8-1,8 (м, 25H), 2,3 (д, 1H), 2,8 (т, 1H, меньший ротамер), 3,3 (т, 1H), 3,9 (д, 1H), 4,4 (т, 1H, меньший ротамер), 4,5-4,6 (м, 1H), 5,1 (с, 1H, меньший ротамер), 5,3 (д, 1H), 5,4 (д, 1H).
Boc-(R)Cgl-Pro-OH
К смеси 3,59 г (31,24 ммоля) L-пролина, 20 мл воды и 1,18 г (29,7 ммоля) гидроксида натрия добавляют 2,8 г (7,8 ммоля) Boc-(R)Cgl-Pro-OSu в 10 мл ДМФА. Из-за плохой растворимости добавляют еще 30 мл ДМФА и реакционную смесь перемешивают три дня. После испарения растворителя добавляют воду. Водную фазу промывают этилацетатом, подкисляют 0,3 M KHSO4 и трижды экстрагируют этилацетатом. Органическую фазу промывают один раз водой и один раз рассолом, сушат (Na2SO4), фильтруют и после испарения получают 2,3 г (83%) продукта.
1H-ЯМР (300 МГц, CDCl3) δ: 0,89-2,17 (м, 23H), 2,37 (м, 1H), 3,55 (к, 1H), 3,9 (ш.с, 1H), 4,28 (т, 1H), 4,52 (ш.с, 1H), 5,22 (ш.с, 1H (NH)).
Boc-(R)Cha-Aze-OH
Получен реакцией Boc-(R)Cha-OH с H-Aze-OEt • HCl (см. ниже) по методике получения Boc-(R)Cha-Prc-OH.
Boc-(R)Cha-Pro-OH
В 750 мл 0,87 М раствора гидроксида натрия растворяют H-(S)Pro-OH (680 ммолей) и к раствору в течение 20 мин по каплям прибавляют Boc-(R)Cha-Osu (170 ммолей) в ДМФА (375 мл). Реакционную смесь перемешивают 20 ч при комнатной температуре, затем смесь подкисляют (2М KHSO4) и трижды экстрагируют этилацетатом. Органические слои объединяют и трижды промывают водой и один раз рассолом. После сушки над сульфатом натрия и испарения растворителя сиропообразное масло растворяют в диэтиловом эфире, растворитель испаряют и наконец сушкой продукта в вакууме получают с почти количественным выходом Boc-(R)Cha-Pro-OH в виде белого порошка.
1H-ЯМР (500 МГц, CDCl3, смесь двух ротамеров, 9:1) δ: 0,8-1,05 (м, 2H), 1,05-1,55 (м, 15H; там же 1,5 (ш.с, 9H)), 1,55-1,8 (м, 5H), 1,8-2,15 (м, 3H), 2,47 (м, 1H), 3,48 (м, 1H), 3,89 (м, 1H), 4,55 (м, 2H), 5,06 (м, 1H).
Разрешаемые сигналы меньшего ротомера появляются при δ 2,27 (м), 3,58 (м), 4,33 (м), 5 (м).
Boc-(Me)(R)Cha-Pro-OSu
(I) Boc-(Me)(R)Cha-Pro-OH
Получен реакцией Boc-(Me)(R)Cha-OSu и H-Pro-OH по вышеприведенной методике получения Boc-(R)Cha-Pro-OH.
(II) Boc-(Me)(R)Cha-Pro-OSu
Получен на основе Boc-(R)Cha-Pro-OH по методике, приведенной для синтеза Boc-(Me)(R)Cha-OSu.
Boc-(R)Cha-Pic-OH
(Ia) Boc-(R)Cha-Pic-OEt
В 150 мл CH2Cl2 растворяют 6,3 г (0,023 моля) Boc-(R)Cha-OH. Раствор охлаждают в бане со льдом, после чего добавляют 6,3 г (0,047 моля) N-гидроксибензотриазола и 11,2 г (0,0265 моля) ЦМЭ-КДИ. Через 15 мин баню со льдом убирают и реакционную смесь перемешивают 4 ч при комнатной температуре. Растворитель испаряют, остаток растворяют в 150 мл ДМФА и раствор охлаждают в бане со льдом. После прибавления 4,1 г (0,021 моля) H-Pic-OEt • HCl добавлением N-метлиморфолина устанавливают pH примерно 9. Через 15 мин баню со льдом убирают и реакционную смесь перемешивают 3 дня. Растворитель испаряют, остаток растворяют в этилацетате и промывают разбавленным раствором KHSO4 (водн. ), NaHCO3 (водн.) и водой. Органический слой сушат (Na2SO4) и после испарения растворителя получают 7,7 г (89%) Boc-(R)Cha-Pic-OEt, который используют без дополнительной очистки.
1H-ЯМР (500 МГц, CDCl3, два ротамера в отношении 3:1) δ: 0,7-1 (м, 2H), 1,1-1,9 (м, 29H; там же 1,28 (т, 3H)), 1,45 (ш.с, 9H), 2,01 (ш.д, 1H, основной ротамер), 2,31 (ш.д, 1H), 2,88 (ш.т, 1H, меньший ротамер), 3,33 (ш.т, 1H, основной ротамер), 3,8 (ш.д, 1H, основной ротамер), 4,15-4,3 (м, 2H), 4,5-4,7 (м, 2H, меньший ротамер), 4,77 (ш.у, 1H, основной ротамер), 4,9 (ш. д, 1H, меньший ротамер), 5,28 (ш.д, 1H, основной ротамер), 5,33 (ш.д, 1H, основной ротамер).
(Ib) Boc-(R)Cha-Pic-OMe
К перемешиваемой смеси 875 мг (3,22 ммоля) Boc-(R)Cha-OH и 450 мкл (3,23 ммоля) триэтиламина в 10 мл толуола и 2 мл ДМФА добавляют 400 мкл (3,23 ммоля) пивалоилхлорида. Через 45 минут к образовавшейся взвеси добавляют смесь 596 мг (3,32 ммоля) гидрохлорида метил-(S)-пипеколята и 463 мкл (3,32 моля) триэтиламина в 5 мл ДМФА. Спустя 2 ч добавляют 1000 мкл (0,72 ммоля) триэтиламина и перемешивание продолжают еще 18 ч. После добавления к реакционной смеси воды и толуола органическую фазу промывают 0,3 М KHSO4, 10% Na2CO3 и рассолом. Сушкой (MgSO4) и удалением растворителя в вакууме получают 1,16 г заглавного соединения.
(II) Boc-(R)Cha-Pic-OH
Boc-(R)Cha-Pic-OEt (5,6 г, 0,014 моля) смешивают со 100 мл ТГФ, 100 мл воды и 7 г LiOH и смесь перемешивают примерно сутки при комнатной температуре. ТГФ испаряют, водный раствор подкисляют KHSO4 (водн.) и трижды экстрагируют этилацетатом. Объединенную органическую фазу промывают водой, сушат (Na2SO4) и после испарения получают 4,9 г (94%) Boc(R)Cha-Pic-OH, которую используют без дополнительной очистки. Соединение может быть кристаллизовано из смеси диизопропиловый эфир-гексан.
Метиловый эфир, образованный по вышеприведенной методике (Ib), может быть гидролизован использованием методики, приведенной в разделе (II) для этилового эфира.
1H-ЯМР (500 МГц, CDCl3, 2 ротамера в отношении 3,5:1) δ: 0,8-1,1 (м, 2H), 1,1-2,1 (м, 27H; там же 1,43 (с, 9H, основной ротамер), 1,46 (с, 9H, меньший ротамер)), 2,33 (ш.с, 1H), 2,8 (ш.т, меньший ротамер), 3,33 (ш.т, 1H, меньший ротамер), 3,85 (ш.д, 1H, основной ротамер), 4,57 (ш.д, 1H, меньший ротамер), 4,68 (м, 1H, меньший ротамер), 4,68 (м, 1H, меньший ротамер), 4,77 (ш.к, 1H, основной ротамер), 5,03 (ш.с, 1H, меньший ротамер), 5,33 (ш. д, 1H, основной ротамер), 5,56 (м, 1H, основной ротамер).
Boc-(R)Cha-(R,S)бетаPic-OH
(I) Boc-(R)Cha-(R,S)бетаPic-OMe
К раствору 2 г (7,3 ммоля) Boc-(R)Cha-OH и 0,81 мл (7,3 ммоля) 4-N-метилморфолина в 20 мл ацетонитрила добавляют 0,9 мл (7,3 ммоля) пивалоилхлорида. Спустя 1 ч 30 минут добавляют 1,3 г (7,3 ммоля) H-(R,S)бетаPic-OMe • HCl и 1,62 мл (14,6 ммоля) 4-N-метилморфолина и реакционную смесь перемешивают 24 ч. Растворитель испаряют и остаток растворяют в толуоле и небольшом количестве диэтилового эфира. После промывания 0,3 М KHSO4 и раствором KHCO3 и сушки над Na2SO4 растворитель удаляют в вакууме. Вытеснительной хроматографией с применением в качестве элюента смеси гексан-этилацетат (7:3) получают 2,4 г (83%) целевого продукта.
(II) Boc-(R)Cha-(R,S)бетаPic-OH
В 35 мл ТГФ растворяют при комнатной температуре 2,35 г (5,9 ммоля) Boc-(R)Cha-(R, S)бетаPic-OMe и к раствору добавляют 2,1 г LiOH в 35 мл воды. После перемешивания 5 ч ТГФ удаляют в вакууме. Водную фазу подкисляют 2 М KHSO4 и экстрагируют этилацетатом, сушат над Na2SO4 и после испарения получают 2 г (89%) продукта.
Boc-(R)Cha-Val-OH
(I) Boc-(R)Cha-Val-OMe
К перемешиваемой смеси 6,75 г (25 ммолей) Boc-(R)Cha-OH и 3,5 мл (25 ммолей) триэтиламина в 50 мл ДМФА добавляют при комнатной температуре 3,1 мл (25 ммолей) пивалоилхлорида. После перемешивания 3 часа добавляют 4,16 г (25 ммолей) гидрохлорида метилового эфира валина в 50 мл ДМФА и 3 мл триэтиламина. После перемешивания примерно сутки добавляют несколько кристаллов ДМАП и реакционную смесь нагревают 5 минут при 50oC. Растворитель удаляют в вакууме и к остатку добавляют эфир и толуол. Промыванием 0,3 М KHSO4 и 10% Na2CO3 с последующей сушкой (MgSO4) и удалением растворителя в вакууме получают остаток, который подвергают колоночной хроматографии с применением в качестве элюента смеси толуол-этилацетат. Выход заглавного соединения 6,99 г (73%).
(II) Boc-(R)Cha-Val-OH
Смесь 8,73 г (23 ммоля) Boc-(R)Cha-Val-OMe и 5,6 г (230 ммолей) гидроксида лития в 75 мл ТГФ и 75 мл воды перемешивают 4 часа. ТГФ удаляют в вакууме, оставшийся раствор разбавляют водой и экстрагируют эфиром. Подкислением 2М KHSO4 и экстрагированием этилацетатом с последующей сушкой (MgSO4) и удалением растворителя в вакууме получают 8,15 г (96%) заглавного соединения.
Boc-(R)Hoc-Aze-OH
(I) Boc-(R)Hoc-Aze-OEt
В 15 мл CH2Cl2 при комнатной температуре растворяют 1 г (3,5 ммоля) Boc-(R)Hoc-OH и 0,95 г (7 ммолей) ГБТ. Раствор охлаждают в бане со льдом и к нему добавляют 0,77 г (4 ммоля) ЭДК. Баню со льдом убирают и реакционную смесь перемешивают 3 ч при комнатной температуре. Растворитель испаряют и остаток растворяют в 20 мл ДМФА. Добавляют 0,58 г (3,5 ммоля) H-(R)Aze-OH и добавлением N-метилморфолина устанавливают pH примерно 9. Затем реакционную смесь перемешивают один день. После распределения реакционной смеси между водой и толуолом органическую фазу отделяют, промывают 0,3 М KHSO4, разбавленным раствором KHCO3, рассолом, сушат над Na2SO4 и испаряют. Колоночной хроматографией (1% EtOH в CH2Cl2 и гептан-EtOAc) получают 0,35 г (25%) целевого продукта.
(II) Boc-(R)Hoc-Aze-OH
В 10 мл ТГФ растворяют при комнатной температуре 0,65 г (1,6 ммоля) Boc-(R)Hoc-Aze-OEt и к раствору добавляют 0,59 г LiOH в 10 мл воды. После перемешивания 24 ч добавляют 2 М KHSO4 и ТГФ удаляют в вакууме. Водную фазу подкисляют дополнительным количеством KHSO4, затем экстрагируют этилацетатом, сушат над Na2SO4 и после испарения получают 0,5 г (85%) заглавного соединения.
Boc-(R)Hoc-Pro-OH
Получен из Boc-(R)HOc-OSu по методике получения Boc-(R)Cha-Pro-OH.
1H-ЯМР (500 МГц, CDCl3) δ: 0,8-0,94 (м, 2H), 1,05-1,36 (м, 7H), 1,36-1,48 (ш.с, 9H), 1,48-1,78 (м, 7H), 1,98-2,14 (м, 2H), 2,34 (м, 1H), 3,48 (м, 1H), 3,85 (м, 1H), 4,43 (м, 1H), 4,52 (ш.д, 1H), 5,26 (ш.д, 1H); сигналы меньшего ротамера появляются при δ: 1,92, 2,25, 4,2 и 4,93.
Boc-(R)Hoc-Pic-OH
(I) Boc-(R)Hoc-Pic-OMe
Получен реакцией Boc-(R)Hoc-OH с H-Pic-OMe • HCl по методике, приведенной для синтеза Boc-(R)Cha-Pic-OEt (см. выше).
(II) Boc-(R)Hoc-Pic-OH
Получен из Boc-(R)Hoc-Pic-OMe по методике, приведенной для синтеза Boc-(R)Cha-Pic-OH (см. выше).
1H-ЯМР (500 МГц, CDCl3) δ: 0,82-0,97 (м, 2H), 1,1-1,36 (м, 7H), 1,36-1,5 (ш. с, 9H), 1,5-1,82 (м, 11H), 2,35 (ш.д, 1H), 3,28 (ш.т, 1H), 4,63 (м, 1H), 5,33 (ш.с, 1H), 5,44 (ш.д, 1H); сигналы меньшего ротамера появляются при δ: 1,88, 2,8, 4,25, 4,55 и 4,97.
Boc-(R)Pro-Phe-OH
(I) Boc-(R)Pro-Phe-OMe
К раствору 2 г (9,29 ммоля) Boc-(R)Pro-OH и 0,94 г (9,29 ммоля) триэтиламина в 70 мл смеси толуол-ДМФА (5:2) добавляют 1,12 г (9,29 ммоля) пивалоилхлорида и реакционную смесь перемешивают 30 минут при комнатной температуре. После охлаждения смеси до 0oC добавляют смесь 2 г (9,29 ммоля) H-Phe-OMe и 0,94 г триэтиламина в 40 мл ДМФА и реакционную смесь перемешивают примерно сутки при комнатной температуре. Реакционную смесь разбавляют толуолом, органическую фазу промывают 0,3 М KHSO4 (3 х 50 мл), 50 мл воды и сушат (Na2SO4).
Испарением растворителя с количественным выходом получают заглавное соединение, которое используют на следующей стадии без дополнительной очистки.
(II) Boc-(R)-Pro-Phe-OH
Смесь 4 г (10,6 ммоля) Boc-(R)Pro-Phe-OMe и 8,93 г (21,3 ммоля) LiOH • H2O в 140 мл водного ТГФ (1:1) интенсивно перемешивают примерно сутки при комнатной температуре. ТГФ испаряют, водную фазу подкисляют 1 М KHSO4 и экстрагируют EtOAc (3 х 75 мл). Объединенную органическую фазу промывают водой и сушат (Na2SO4). Фильтрование и испарение растворителя дает остаток, очисткой которого кристаллизацией из диизопропилового эфира получают 2,329 г (60%) заглавного соединения в виде белого кристаллического вещества.
Boc-(R)Pro(3-(S)Ph)-Pro-OH
(I) Boc-(R)Pro(3-(S)Ph)-Pro-OBn
К смеси 1,61 г Boc-(R)Pro(3-(S)Ph)-OH, 1,65 г H-Pro-OBn • HCl и 0,75 г ГБТ в 11 мл ДМФ добавляют при комнатной температуре 0,84 мл НММ и 2,92 г ЦМЭ-КДИ и реакционную смесь перемешивают три дня. Растворитель испаряют и остаток растворяют в 300 мл EtOAc. Органическую фазу промывают водой (2 х 100 мл), 1 М KHSO4 (2 х 100 мл), 1 М NaOH (3 х 100 мл), водой (3 х 100 мл) и сушат (MgSO4). Испарением растворителя получают масло (2,53 г), очисткой которого колоночной хроматографией с применением в качестве элюента CH2Cl2-MeOH (97:3) получают 2,11 г (88%) заглавного соединения.
(II) Boc-(R)Pro(3-(S)Ph)-Pro-OH
В 70 мл EtOH растворяют 0,94 г Boc-(R)Pro(3-(S)Ph)-Pro-OH гидрируют в присутствии 0,42 г 5% Pd-C в течение 3,5 часов. Фильтрованием катализатора и испарением растворителя получают с количественным выходом заглавное соединение.
Boc-(R)Tic-Pro-OH
Получен по методике, приведенной в патенте EP-0,479,489-A2 (P.D. Gesellchen, R.T. Shuman).
BnOOC-CH2-NH-CO-CH2-Br
К раствору п-TS OH • H-Gly-OBn (5 ммолей) и триэтиламина (5 ммолей) в 10 мл CH2Cl2 добавляют раствор 2-бромуксусной кислоты (5 ммолей) в 10 мл CH2Cl2 и дициклогексилкарбодиимид (5 ммолей). Смесь перемешивают примерно сутки при комнатной температуре и фильтруют. Органическую фазу промывают дважды 0,2 М KHSO4, 0,2 М NaOH, рассолом и сушат. Испарением и колоночной хроматографией (CH2Cl2-MeOH, 95:5) с количественным выходом получают целевое соединение.
1H-ЯМР (300 МГц, CDCl3) δ: 3,89 (с, 2H), 4,05-4,11 (д, 2H), 5,19 (с, 2H), 7,06 (ш.с, 1H), 7,3-7,4 (м, 5H).
Boc-(R)Cgl-Ile-OH
Получен по методике получения Boc-(R)Cgl-Pro-OH с использованием H-Ile-OH вместо H-Pro-OH. Выход 91%.
Boc-(R)Phe-Phe-OH
(I) Boc-(R)Phe-Phe-OMe
В 30 мл ацетонитрила растворяют Boc-(R)Phe-OH (18,8 ммоля; производство фирмы Бахэм Файнхемикалиен АГ), Phe-OMe (20,7 ммоля) и 4-диметиламинопиридин (37,7 ммоля). К охлажденному до температуры ледяной воды раствору добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (24,5 ммоля). Охлаждающую баню убирают и реакционную смесь перемешивают примерно сутки. Растворитель удаляют при пониженном давлении и остаток растворяют в 50 мл этилацетата. Промыванием органической фазы аликвотами по 50 мл 0,5 М гидросульфата калия, 1 М бикарбоната натрия и наконец водой с последующим испарением растворителя получают 7,5 г Boc-(R)Phe-Phe-OMe (94%), который используют на следующей стадии без дополнительной очистки.
(II) Boc-(R)Phe-Phe-OH
К раствору Boc-(R)Phe-Phe-OMe (16,4 ммоля) в 40 мл тетрагидрофурана быстро прибавляют раствор гидроксида лития (32,8 ммоля) в 20 мл воды. Реакционную смесь перемешивают 3,5 ч, после чего растворитель удаляют при пониженном давлении. Остаток растворяют в 50 мл этилацетата и промывают 50 мл 0,5 М сульфата калия и затем 50 мл воды. Удалением растворителя получают 8 г (колич. ) Boc-(R)Phe-Phe-OH в виде аморфного вещества. 1H-ЯМР (200 МГц, d-CHCl3)δ: 7,4-6,7 (м, 10H), 5,7-4,2 (м, 6H), 1,34 (с, 9H).
HO-CH2-COOBn
Получен по методике, приведенной в работе: Lattes A. и др. Bull Soc. Chim. France, N 11, стр. 4018-23, 1971.
Бензил-2-(орто-нитробензолсульфонилокси)ацетат (2-NO2)Ph- SO2-OCH2-COOBn
В 25 мл CH2Cl2 и 25 мл диэтилового эфира растворяют 1,66 г (10 ммолей) бензилгликолята. Смесь охлаждают до 0oC и добавляют 2,8 мл (10 ммолей) триэтиламина. Поддерживая температуру при 0oC, небольшими порциями в течение 15 минут прибавляют 2,44 г (11 ммолей) о-нитробензолсульфонилхлорида. После перемешивания взвеси 50 минут при 50oC добавляют 20 мл воды и 30 мл CH2Cl2. Фазы разделяют, органическую фазу промывают 20 мл 1 М HCl и 20 мл воды, сушат (Na2SO4), фильтруют и испарением в вакууме получают 3,34 г остатка, который подвергают колоночной хроматографии с применением в качестве элюента смеси гептан-EtOAc (2:1) и получением 1,18 г (34%) заглавного соединения.
1H-ЯМР (300 МГц, CDCl3) δ: 4,92 (с, 2H), 5,17 (с, 2H), 7,83 (м, 5H), 7,76 (м, 3H), 8,16 (дд, 1H).
Бензил-2-(пара-нитробензолсульфонилокси)ацетат (4-NO2)Ph- SO2-OCH2-COOBn
Получен по методике, использованной для синтеза бензил-2-(о-нитробензолсульфонилокси)ацетата и приведенной выше. Конечное соединение получено после испарения растворителя в кристаллической форме и достаточно чисто для применения без дополнительной очистки (выход 64%).
1H-ЯМР (300 МГц, CDCl3) δ: 4,79 (с, 2H), 5,13 (с, 2H), 7,2-7,4 (м, 5H), 8,1 (д, 2H), 8,2 (д, 2H).
TfO-CH2-COOMe
К смеси 4,05 мл (50 ммолей) метилгликолята и 4,04 мл (50 ммолей) пиридина в CH2Cl2 (в общей сложности 62,5 мл) при 0oC в течение 25 минут прибавляют по каплям 10,09 мл (60 ммолей) ангидрида трифторметансульфоновой кислоты в CH2Cl2 и затем перемешивают 1 ч при 0oC. После промывания 0,3 М KHSO4, насыщенным раствором Na2CO3, сушки (Na2SO4) и фильтрования испарением растворителя в вакууме получают 9,94 г (90%) заглавного соединения.
TfO-CH2-COOEt
Получен из этилгликолята по методике, приведенной для синтеза TfO-CH2-COOMe.
TfO-CH2-COO-н-Bu
Получен из бутилгликолята по методике, приведенной для синтеза TfO-CH2-COOMe.
TfO-CH2-COOBn
Получен на основе HO-CH2COOBn по методике получения TfO-CH2-COOMe.
TfO-CH2-COO-н-Hex
(I) HO-CH2-COO-н-Hex
К гликолевой кислоте (215 мг, 2,82 ммоля) в 12,8 мл CH3CN добавляют 719 мг (3,39 ммоля) 1-гексилйодида и 429 мг (2,82 ммоля) ДБУ. После перемешивания примерно сутки и кипячения 6 ч растворитель испаряют, добавляют этилацетат и 1 М KHSO4 и фазы разделяют. Органический слой промывают рассолом, сушат (MgSO4), фильтруют и испарением в вакууме получают 333 мг (74%) продукта.
(II) TfO-CH2COO-н-Hex
Получен из HO-CH2COO-н-Hex по методике, приведенной для синтеза TfO-CH2COOMe.
H-Mig(Z)(3-аминометил-1-(N-бензилоксикарбониламидино)азетидин
(I) 3-Аминометил-1-бензгидрилазетидин получен согласно литературному источнику, см.: A.G. Anderson Jr., R. Lok, J. Org. Chem., 37, 3953, 1972.
(II) 3-(N-трет-Бутилоксикарбониламинометил)-1-бензгидрилазетидин
К раствору 3,5 г (13,9 ммоля) 3-аминометил-1-бензгидрилазетидина в 45 мл ТГФ добавляют раствор 0,56 г (13,9 ммоля) NaOH в 45 мл воды. После охлаждения реакционной смеси до 0oC к ней добавляют 3,03 г (13,9 ммоля) ди-трет-бутилдикарбоната. Охлаждающую баню убирают спустя несколько минут и смесь перемешивают примерно сутки при комнатной температуре. ТГФ испаряют и остаток экстрагируют диэтиловым эфиром (3 х 45 мл). Объединенный органический слой промывают рассолом, сушат над Na2SO4 и фильтруют. Испарением растворителя получают 4,6 г (94%) заглавного соединения.
(III) 3-(N-трет-бутилоксикарбониламинометил)азетидин
В 170 мл MeOH растворяют 3,4 г (9,6 ммоля) 3-(N-трет-бутилоксикарбониламинометил)-1-бензгидрилазетидина и гидрируют примерно сутки при 5 МПа в присутствии 0,3 г Pd(OH)2. Катализатор отфильтровывают и растворитель испаряют. Очисткой сырого продукта колоночной хроматографией с применением в качестве элюента смесей MeOH-CH2Cl2 (1:9), затем MeOH (насыщен NH3 (г)) -CH2Cl2 получают 1,2 г (67%) заглавного соединения.
(IV) 3-(N-трет-Бутилоксикарбониламинометил)-1-(N- бензилоксикарбониламидино)азетидин (Boc-Mig (Z))
В 6,5 мл толуола смешивают 0,9 г (4,8 ммоля) 3-(N-трет-бутилоксикарбониламинометил)азетидина и 1,3 г (6,3 ммоля) N-бензилоксикарбонил-O-метилизомочевины и все нагревают 72 ч при 70oC и затем оставляют еще на 72 ч при комнатной температуре. Испарением с последующей колоночной хроматографией с применением в качестве элюента EtOAc, затем MeOH (насыщен NH3 (г)) -CH2Cl2 (1:9) получают 0,67 г (38%) заглавного соединения в виде белого порошка.
(V) 3-аминометил-1-(N-бензилоксикарбониламидино) азетидин (H-Mig (Z))
В 10 мл EtOAc, насыщенного HCl (г), растворяют 0,67 г (1,85 ммоля) Boc-Mig (Z), перемешивают 10 мин при комнатной температуре, после чего по каплям прибавляют 10 мл насыщенного водн. раствора KOH. Слои разделяют и водную фазу экстрагируют EtOAc (3 х 8 мл). Органические слои объединяют, промывают рассолом, сушат (Na2SO4) и испарением получают 0,43 г (89%) заглавного соединения.
1H-ЯМР (300 МГц, CDCl3) δ: 2,55-2,65 (м, 1H), 2,84 (д, 2H), 3,66 (дд, 2H), 4,03 (дд, 2H), 5,07 (с, 2H), 7,2-7,4 (м, 5H).
MC: m/z 263 (M+ + 1).
3-аминоэтил-1-(N-бензилоксикарбониламидино)азетидин (H-Dig (Z))
(1) 3-(карбоновая кислота)-1-бензгидрилазетидин получен по литературному источнику, см. Anderson Jr., R. Lok, J. Org. Chem., 37, 3953, 1972.
(II) 3-Гидроксиметил-1-бензгидрилазетидин
К суспензии 4,9 г (130,2 ммоля) LiAlH4 в 30 мл ТГФ при комнатной температуре медленно прибавляют раствор 8,7 г (32,5 ммоля) 3-(карбоновая кислота)-1-бензгидрилазетидина в 80 мл сухого ТГФ. После кипячения реакционной смеси 3,5 ч избыток гидрида гидролизуют осторожным прибавлением при охлаждении NH4Cl (водн. ), желеобразную массу фильтруют и фильтровальный пирог неоднократно промывают ТГФ. Испарением растворителя получают 7,1 г (86%) заглавного соединения в виде бледно-желтых кристаллов.
(III) 3-метансульфонатометил-1-бензгидрилазетидин
К раствору 6,62 г (26,1 ммоля) 3-гидроксиметил-1-бензгидрилазетидина в 50 мл сухого пиридина прибавляют при 0oC 4,5 г (39,2 ммоля) метансульфонилхлорида. Реакционную смесь перемешивают 1 ч и затем оставляют на ночь в холодильнике. Реакционную смесь переносят в смесь воды со льдом, осадок отделяют, промывают водой и после сушки в вакууме получают 7,75 г (89,5%) заглавного соединения.
(IV) 3-цианометил-1-бензгидрилазетидин
К раствору 7,75 г (23,4 ммоля) 3-метансульфонатометил-1-бензгидрилазетидина в 50 мл ДМФА добавляют раствор 3,44 г (70 ммолей) NaCN в 10 мл воды. Смесь нагревают 20 ч при 65oC, охлаждают и переносят в смесь воды со льдом. Осадок отделяют, промывают водой и после сушки в вакууме получают 5,7 г (93%) заглавного соединения.
(V) 3-аминоэтил-1-бензгидрилазетидин
К суспензии 2,9 г (76 ммолей) LiAlH4 в 80 мл сухого ТГФ при комнатной температуре медленно прибавляют 5,7 г (21,7 ммоля) 3-цианометил-1-бензгидрилазетидина. После кипячения реакционной смеси 4 ч избыток гидрида гидролизуют осторожным прибавлением при охлаждении NH4Cl (водн.). Желеобразную смесь фильтруют и фильтровальный пирог несколько раз промывают ТГФ. Растворитель испаряют, остаток растворяют в диэтиловом эфире, промывают рассолом и сушат над Na2SO4. Испарением растворителя получают 5 г (87%) заглавного соединения.
(IV) 3-(N-трет-бутилоксикарбониламиноэтил)-1- бензгидрилазетидин
Целевое соединение получено с выходом 6,5 г (95%) из 3-аминоэтил-1-бензгидрилазетидина по методике получения 3-(N-трет-бутилоксикарбониламинометил)-1-бензгидрид азетидина.
(VII) 3-(N-трет-бутилоксикарбониламиноэтил)азетидин
Целевое соединение получено с выходом 1,2 г (70%) из 3-(N-трет-бутилоксикарбониламиноэтил)-1-бензгидрилазетидина по методике получения 3-(N-трет-бутилоксикарбониламинометил)азетидина.
(VIII) 3-(N-трет-бутилоксикарбониламиноэтил)-1- (N-бензилоксикарбонилимидино)азетидин (Boc-Dig (Z))
Целевое соединение получено с выходом 0,09 г (34%) из 3-(N-трет-бутилоксикарбониламиноэтил)азетидина по методике получения 3-(N-трет-бутилоксикарбониламинометил)-1- (N-бензилоксикарбониламидино)азетидина.
(IX) 3-Аминоэтил-1-(N-бензилоксикарбониламидино) азетидин (H-Dig (Z))
В 10 мл EtOAc, насыщенного HCl (г), растворят 0,589 г (1,56 ммоля) Boc-Dig (Z) и перемешивают 10 мин при комнатной температуре. По каплям прибавляют 10 мл насыщенного раствора KOH (водн.), слои разделяют и водную фазу экстрагируют EtOAc (3 х 8 мл). Органические слои объединяют, промывают рассолом, сушат над Na2SO4 и испарением получают 0,415 г (96%) заглавного соединения.
1H-ЯМР (500 МГц, CDCl3) δ: 1,6 (дт, 2H), 1,52-2,54 (м, 3H), 3,53 (ш.с, 2H), 4 (ш.т, 2H), 5 (с, 2H), 7,17-7,31 (м, 5H).
Пример 1
HOOC-CH2-(R)Cgl-Aze-Pab
(1) Boc-(R)Cgl-Aze-Pab (Z)
К перемешиваемой смеси 3,4 г (10 ммолей) Boc-(R)Cgl-Aze-OH (см. раздел: получение исходных соединений) и 5,13 г (42 ммоля) ДМАП в 120 мл CH3CN добавляют 3,18 г H-Pab (Z) • HCl (см. раздел: получение исходных соединений). После перемешивания 2 часа при комнатной температуре смесь охлаждают до -8oC и затем добавляют 2,01 г (10,5 ммолей) ЭДК. Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивание продолжают еще 47 часов. Растворитель испаряют и остаток растворяют в 200 мл EtOAc. Органическую фазу промывают 50 мл воды, 0,5 М KHSO4 (1 х 50 мл + 2 х 25 мл), NaHCO3 (2 х 25 мл насыщенного раствора), 50 мл воды и сушат. Испарение растворителя дает 5,21 г (86%) заглавного соединения.
1H-ЯМР (500 МГц, CDCl3) δ: 0,8-1,9 (м, 20H; в нем же 1,3 (с, 9H)), 2,35-2,6 (м, 2H), 3,74 (ш.т, 1H), 4,1 (м, 1H), 4,25-4,4 (м, 2H), 4,45-4,6 (м, 1H, ротамеры), 4,75-5 (м, 1H, ротамеры), 5,08 (ш.д, 2H), 5,15 (с, 2H), 7,15-7,35 (м, 5H), 7,41 (д, 2H), 7,77 (д, 2H), 8,21 (м, 1H).
(II) H-(R)Cgl-Aze-Pab (Z)
К охлажденному (температура бани со льдом) раствору 18,8 г HCl в 195 мл EtOAc добавляют 4,69 г (7,743 ммоля) Boc-(R)Cgl-Aze-Pab (Z) вместе с 40 мл EtOAc. Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают 30 мин. К прозрачному раствору добавляют 140 мл Et2O с образованием при этом осадка. Реакционную смесь оставляют еще на 1 ч 40 минут при комнатной температуре. Осадок отфильтровывают, быстро промывают 150 мл Et2O и сушат в вакууме. Затем осадок растворяют в 50 мл воды и подщелачивают 15 мл 2М NaOH. Щелочную фазу промывают CH2Cl2 (1 х 100 мл + 1 х 50 мл). Объединенную органическую фазу промывают 20 мл воды, 20 мл рассола и сушат (MgSO4). Испарением растворителя получают 3,44 г (88%) заглавного соединения.
1H-ЯМР (500 МГц, CDCl3) δ: 0,8-2 (м, 11H), 2,51 (м, 1H), 2,67 (м, 1H), 3,07 (д, 1H), 4,11 (м, 1H), 4,18 (м, 1H), 4,43 (дд, 1H), 4,53 (дд, 1H), 4,91 (м, 1H), 5,22 (с, 2H), 7,2-7,4 (м, 7H), 7,45 (д, 2H), 8,51 (д, 2H).
(III) BnOOC-CH2-(R)Cgl-Aze-Pab (Z)
Смесь 1,13 г (2,2 ммоля) H-(R)Cgl-Aze-Pab (Z), 0,9 г (2,6 ммоля) бензил-2-(о-нитробензолсульфонилокси)ацетата ((2-NO2)-Ph-SO2-OCH2-COOBn, см. раздел: получение исходных соединений), 0,99 г (5,6 ммоля) K2CO3 и 113 мл CH3CN нагревают 3 ч на масляной бане при 60oC. После испарения растворителя добавляют EtOAc и смесь промывают водой. Органическую фазу экстрагируют 1М KHSO4 и полученную водную фазу промывают EtOAc. Кислотную водную фазу подщелачивают 1 н. NaOH до pH > 8 и экстрагируют EtOAc. Органическую фазу промывают водой, сушат (Na2SO4), фильтруют и испарением в вакууме получают 1,17 г остатка, который дважды подвергают колоночной хроматографии с применением в качестве элюента в первый раз CH2Cl2-MeOH (насыщен NH3) (95:5) и во второй раз диэтиловый эфир -MeOH (насыщен NH3) (9:1) с получением 0,526 г (36%) заглавного соединения.
Алкилирование кроме того проводят с применением бензил-2-(п-нитробензолсульфонилокси)ацетата ((4-NO2)Ph-SO2-OCH2-COOBn, см. раздел: получение исходных соединений) и использованием вышеприведенной методики, в результате чего получают заглавное соединение с выходом 52%.
1H-ЯМР (300 МГц, CDCl3) δ: 0,85-2,15 (м, 11H), 2,48 (м, 1H), 2,63 (м, 1H), 2,88 (д, 1H), 3,24 (д, 1H), 3,27 (д, 1H), 3,95 (м, 1H), 4,05 (м, 1H), 4,44 (м, 1H), 4,55 (м, 1H), 4,91 (м, 1H), 5,07 (с, 2H), 5,22 (с, 2H), 7,2-7,4 (м, 10H), 7,45 (д, 2H), 7,79 (д, 2H), 8,42 (м, 1H).
(IVa) HOOC-CH2-(R)Cgl-Aze-Pab • 2 HCl
В 5 мл метанола растворяют 20 мг (0,031 ммоля) BnOOC-CH2-(R)Cgl-Aze-Pab (Z). Добавляют несколько капель хлороформа и 5% Pd-C и смесь гидрируют 1 ч при атмосферном давлении. После фильтрования и испарения лиофилизацией продукта из воды получают 11 мг (72%) заглавного соединения.
1H-ЯМР (500 МГц, D2O) δ: 1-2 (м, 11H), 2,1 (м, 1H), 2,44 (м, 1H), 2,82 (м, 1H), 3,9 (c, 2H), 4,09 (д, 1H), 4,4-4,5 (м, 2H), 4,66 (с, 2H), 5,08 (м, 1H), 7,65 (д, 2H), 7,89 (д, 2H),
13C-ЯМР (75,5 МГц, D2O) δ: 167,3, 167,9, 169,9 и 172,4 (углероды амидиногруппы и карбонила).
(IVб) HOOC-CH2-(R)Cgl-Aze-Pab
В EtOH (99%) растворяют BnOOC-CH2-(R)Cgl-Aze-Pab (Z) и гидрируют при атмосферном давлении в присутствии 5% Pd-C. Фильтрованием катализатора через целлит и испарением растворителя получают с 97%-ным выходом заглавное соединение.
1H-ЯМР (500 МГц, CD3OD, смесь двух ротамеров) основной ротамер δ: 1-1,12 (м, 1H), 1,13-1,34 (м, 4H), 1,55-1,7 (м, 3H), 1,73-1,85 (м, 2H), 1,94-2,02 (ш. д, 1H), 2,32-2,42 (м, 1H), 2,54-2,64 (м, 1H), 2,95-3,1 (AB-система плюс д, 3H), 4,18-4,25 (ш.к, 1H), 4,28-4,32 (ш.к, 1H), 4,43-4,6 (AB-система, 2H), 4,8-4,85 (дд, 1H), 7,48-7,54 (д, 2H), 7,66-7,71 (д, 2H). Разрешимые сигналы меньшего ротамера появляются при δ: 0,95 (м), 1; 43 (м), 2,24 (м), 2,84 (д), 3,96 (м), 4,03 (м), 7,57 (ш.д.), 7,78 (ш.д.).
13C-ЯМР (125 МГц, CD3OD) δ: 168, 173, 176,3 и 179 (углероды амидиногруппы и карбонила).
Пример 2
HOOC-CH2-CH2-(R)Cgl-Aze-Pab • 2HCl
(I) H-(R)Cgl-Aze-Pab (Z)
Получен по методике, приведенной в Примере 1 (II) обработкой гидрохлорида основанием с получением свободного основания.
(II) BnOOC-CH2-CH2-(R)Cgl-Aze-Pab (Z)
В 2 мл изопропанола растворяют 0,19 г (0,38 ммоля) H-(R)Cgl-Aze-Pab (Z) и 70 мл (0,43 ммоля) бензилакрилата и смесь оставляют на 6 дней. Колоночной хроматографией с применением в качестве элюента CH2Cl2 - ТГФ (8:2) получают 0,12 г (48%) заглавного соединения.
1H-ЯМР (500 МГц, CDCl3) δ: 0,8-1,9 (м, 10H), 1,95 (ш.д, 1H), 2,4-2,6 (м, 4H), 2,7-2,8 (м, 3H; в нем же 2,79 (д, 1H)), 4,13 (м, 1H), 4,37 (дд, 1H), 4,6 (дд, 1H), 4,97 (дд, 1H), 5,09 (дд, 1H), 5,22 (с, 2H), 7,25-7,4 (м, 10H), 7,47 (д, 2H), 7,83 (д, 2H), 8,61 (ш.т, 1H).
(III) HOOC-CH2-CH2-(R)Cgl-Aze-Pab • 2HCl
В 10 мл этанола растворяют 0,1 г (0,15 ммоля) BnOOC-CH2-CH2-(R)Cgl-Aze-Pab (Z) и гидрируют 1 ч при атмосферном давлении в присутствии 5% Pd-C. Раствор фильтруют, испаряют и сырой продукт очищают с помощью ОФЖХ с применением CH3CN - 0,1 М NH4OAc (1:4). Полученный продукт сушат вымораживанием, обрабатывают избытком конц. HCl и после повторной сушки вымораживанием получают 31 мг дигидрохлорида.
1H-ЯМР (300 МГц, D2O) δ: 0,8-2,1 (м, 11H), 2,38 (м, 1H), 2,7-2,9 (м, 3H), 3,2-3,4 (м, 2H), 3,98 (д, 1H), 4,35-4,55 (м, 2H), 4,6 (с, 2H), 5,04 (дд, 1H), 7,59 (д, 2H), 7,83 (д, 2H).
13C-ЯМР (75 МГц, D2O) δ: 167,2, 167,6, 172,3 и 175,5 (углероды амидиногруппы и карбонила).
Пример 3
HOOC-CH2-(R)Cgl-Pro-Pab • 2HCl
(1) Boc-(R)Cgl-Pro-Pab (Z)
В 30 мл ацетонитрила смешивают 2,3 г (6,49 ммоля) Boc-(R)Cgl-Pro-OH (см. раздел: получение исходных соединений), 2,38 г (19,47 ммолей) ДМАП и 1,84 г (6,49 ммоля) H-Pab (Z) (см. раздел: получение исходных соединений). Смесь охлаждают до -15oC и к ней добавляют 1,31 г (6,81 ммоля) ЭДК. Смесь оставляют нагреваться до комнатной температуры и затем перемешивают примерно сутки. После испарения остаток растворяют в этилацетате и 0,3 М раствора KHSO4. Кислотную водную фазу трижды экстрагируют этилацетатом. Органическую фазу дважды промывают 0,3 М раствором KHSO4, дважды раствором NaHCO3 и один раз рассолом, сушат (Na2SO4), фильтруют и испаряют. Очисткой сырого продукта колоночной хроматографией на силикагеле с применением в качестве элюента этилацетата получают 1,77 г (44%) продукта.
1H-ЯМР (500 МГц, CDCl3) δ: 0,9-1,49 (м, 14H), 1,5-2,1 (м, 9H), 2,37 (ш. с, 1H), 3,53 (к, 1H), 3,94 (ш.с, 1H), 4,02 (м, 1H), 4,43 (ш.с, 2H), 4,65 (д, 1H), 5,09 (ш.с, 1H), 5,2 (с, 2H), 7,18-7,4 (м, 5H), 7,45 (д, 2H), 7,62 (ш.с, 1H), 7,81 (м, 2H).
H-(R)Cgl-Pro-Pab (Z)
В 75 мл насыщенного HCl этилацетата растворяют 1,45 г (2,34 ммоля) Boc-(R)Cgl-Pro-Pab (Z) и смесь оставляют на 10 минут при комнатной температуре. Испарением растворителя получают дигидрохлорид продукта.
1H-ЯМР (300 МГц, D2O) δ: 1-1,45 (м, 5H), 1,58-2,2 (м, 9H), 2,3-2,5 (м, 1H), 3,75-3,9 (м, 2H), 4,25 (д, 2H), 4,5-4,66 (м, 3H), 5,49 (с, 2H), 7,45-7,7 (м, 7H), 7,87 (д, 2H).
Амин получен растворением дигидрохлорида в 0,1 М растворе NaOH и трехкратным экстрагированием водной фазы этилацетатом. Органическую фазу промывают один раз рассолом, сушат (Na2SO4), фильтруют и после испарения получают 1,19 г (97%) заглавного соединения.
(III) BnOOC-CH2-(R)Cgl-Pro-Pab (Z)
В 4 мл дихлорметана смешивают 0,34 г (0,65 ммоля) H-(R)Cgl-Pro-Pab (Z), 0,215 г (0,65 ммоля) BnOOC-CH2-OTf (см. раздел: получение исходных соединений), 0,299 г (2,17 ммоля) K2CO3 и смесь кипятят полчаса. Затем реакционную смесь перемешивают примерно сутки при комнатной температуре. Реакционную смесь разбавляют CH2Cl2 и органический слой промывают один раз водой и рассолом, сушат (Na2SO4), фильтруют и испаряют. Очисткой сырого продукта колоночной хроматографией с применением ступенчатого градиента CH2Cl2-MeOH (97: 3, затем 95:5) получают 299 мг смеси двух продуктов (согласно ТСХ). Эту смесь дополнительно очищают колоночной хроматографией с применением ступенчатого градиента этилацетат-толуол (9:1, 93:7, 95:5, 100:0) и получением 46 мг (9%) (BnOOC-CH2)2-(R)Cgl-Pro-Pab (Z), который элюируется с колонки первым и вслед за которым элюировано 133 мг (31%) целевого BnOOC-CH2-(R)Cgl-Pro-Pab (Z).
1H-ЯМР (300 МГц, CDCl3) δ: BnOOC-CH2-(R)Cgl-Pro)Pab (Z): 0,9-1,3 (м, 5H), 1,4-2,1 (м, 9H), 2,3-2,4 (м, 1H), 3,05 (д, 1H), 3,2-3,37 (AB-система с центром при δ 3,29, 2H), 3,5-3,6 (м, 2H), 4,29-4,57 (ABX-система с центром при δ 4,43, 2H), 4,62 (д, 1H), 4,91 (кажущийся синглет, 2H), 5,19 (с, 2H), 6,75 (ш.с, NH), 7,1-7,5 (м, 12H), 8,7-8,8 (м, 2H + NH), 9,45 (ш.с, NH).
1H-ЯМР (300 МГц, CDCl3) δ: (BnOOC-CH2)2-(R)Cgl-Pro-Pab (Z): 0,68-0,9 (м, 2H), 1-1,3 (м, 3H), 1,43 (ш.д, 1H), 1,55-2 (м, 7H), 2,05 (ш.д, 1H), 2,3-2,4 (м, 1H), 3,15 (д, 1H), 3,25-3,48 (м, 2H), 3,55-3,79 (AB-система с центром при δ 3,67, 4H), 4,38-4,58 (ABX-система с центром при δ 4,48, 2H), 4,68 (д, 1H), 4,82-4,98 (AB-система с центром при δ 4,91, 4H), 5,19 (с, 2H), 6,66 (ш. с, NH), 7,1-7,5 (м, 17H), 7,75 (д, 2H), 7,8 (т, NH), 9,37 (ш.с, NH).
13C-ЯМР (75 МГц, CDCl3) δ: 164,7, 168,1, 171,5, 172,3 и 172,6 (углероды амидиногруппы и карбонила).
(IV) HOOC-CH2-(R)Cgl-Pro-Pab • 2HCl
Смешивают 0,133 г (0,2 ммоля) BnOOC-CH2-(R)Cgl-Pro-Pab (Z) с 0,06 г 5% Pd-C, 1 мл 1 М раствора HCl и 10 мл этанола и смесь гидрируют 1 час в атмосфере H2. После фильтрования через гайфло и испарения растворителя двухкратным вымораживанием из воды с выходом 93 мг (90%) получают продукт.
1H-ЯМР (300 МГц, D2O) δ: 1-1,45 (м, 5H), 1,5-2,1 (м, 9H), 2,2-2,4 (м, 1H), 3,55-3,85 (м, 4H; в нем же 3,79 (с, 2H)), 4,23 (д, 1H), 4,33-4,57 (м, 3H), 7,44 (д, 2H), 7,69 (д, 2H).
13H-ЯМР (75 МГц, D2O) δ: 166,9, 167,2, 169,1, 174,5 (углероды амидиногруппы и карбонила).
Пример 4
HOOC-CH2-CH2-(R)Cgl-Pro-Pab • 2HCl
(1) BnOOC-CH2-CH2-(R)Cgl-Pro-Pab (Z)
В 3 мл этанола растворяют 0,406 г (0,762 ммоля) H-(R)Cgl-Pro-Pab (Z). (см. Пример 3) и к раствору добавляют 132 мкл (0,861 ммоля) бензилакрилата. После перемешивания реакционной смеси при комнатной температуре смесь испаряют и очисткой сырого продукта колоночной хроматографией с применением в качестве элюента ступенчатого градиента CH2Cl2-MeOH (95:5 и 90:1) с выходом 0,399 мг (75%) получают продукт.
1H-ЯМР (300 МГц, CDCl3) δ: 0,8-1 (м, 1H), 1-1,3 (м, 4H), 1,35-2,2 (м, 9H), 3,4-3,6 (м, 2H), 4,26-4,52 (ABX-система с центром при 4,4, 2H), 4,64 (дд, 1H), 5,05 (с, 2H), 5,2 (с, 2H), 7,2-7,38 (м, 10H), 7,43 (д, 2H), 7,78 (д, 2H).
13C-ЯМР (75 МГц, CDCl3) δ: 164,7, 167,9, 171,3, 172,7 и 175,4 (углероды амидиногруппы и карбонила).
(II) HOOC-CH2-CH2-(R)Cgl-Pro-Pab • 2HCl
BnOOC-CH2-CH2-(R)Cgl-Pro-Pab (Z) (0,261 г, 0,383 ммоля) смешивают с 0,075 г 5% Pd-C, 1 мл 1 М раствора HCl и 10 мл этанола и смесь гидрируют два часа при атмосферном давлении. После фильтрования через гайфло и испарения растворителя двухкратным вымораживанием из воды получают 0,196 г (96%) продукта.
1H-ЯМР (300 МГц, D2O) δ: 1,17-1,4 (м, 5H), 1,6-1,82 (м, 5H), 1,92-2,2 (м, 4H), 2,32-2,48 (м, 1H), 2,81 (т, 2H), 3,11-3,36 (ABX2-система с центром при δ 3,24, 2H), 3,63-3,9 (м, 2H), 4,25 (д, 1H), 4,42-4,63 (м, 3H), 7,54 (д, 2H), 7,78 (д, 2H).
13C-ЯМР (75 МГц, D2) δ: 167, 167,3 174,6 и 174,7 (углероды амидиногруппы и карбонила).
Пример 5
(HOOC-CH2)2-(R)Cgl-Pro-Pab • 2HCl
(BnOOC-CH2)2-(R)Cgl-Pro-Pab (Z) (46 мг, 0,056 ммоля, см. Пример 3) смешивают с 25 мг 5% Pd-C, 0,7 мл 1 М раствора HCl и 7 мл этанола и смесь гидрируют один час при атмосферном давлении. Катализатор удаляют фильтрованием через гайфло и растворитель испаряют. Конечный продукт в количестве 25 мг (77%) получен двухкратной сушкой вымораживанием из воды.
1H-ЯМР (300 МГц, D2O) δ: 1-1,4 (м, 5H), 1,45-2,2 (м, 9H), 2,25-2,45 (м, 1H), 3,53-3,84 (м, 2H), 3,84-4,22 (AB-система с центром при δ 4,03, 4H), 4,26 (д, 1H), 4,35-4,6 (м, 3H), 7,53 (д, 2H), 7,77 (д, 2H).
13C-ЯМР (75 МГц, D2) δ: 167,1, 167,3, 170,6 и 174,5 (углероды амидиногруппы и карбонила).
Пример 6
H-(R)Cgl-Pic-Pab • 2HCl
(1) Boc-(R)Cgl-Pic-Pab (Z)
К перемешиваемому раствору 0,875 г (2,37 ммоля) Boc-(R)Cgl-Pic-OH (см. раздел: получение исходных соединений), 1,22 г (9,97 ммоля) ДМАП и 0,706 г (2,49 ммоля H-Pab (Z) (см. раздел: получение исходных соединений) в смеси 30 мл ацетонитрила и 1 мл ДМФА добавляют при -18oC 0,478 г (2,49 ммоля) ЭДК. Реакционную смесь оставляют на два часа нагреваться до комнатной температуры и перемешивание продолжают 48 с. После удаления растворителя в вакууме остаток растворяют в 50 мл этилацетата. Раствор промывают 15 мл воды, 0,3 М KHSO4 (3 х 15 мл), раствором Na2CO3 (2 х 15 мл) и водой. Удалением растворителя получают остаток, который подвергают колоночной хроматографии с применением в качестве элюента смеси этилацетат-гептан (9:1). Выход 0,96 г (64%).
(II) H-(R)Cgl-Pic-Pab (Z)
Через раствор 0,56 г (0,88 ммоля) Boc-(R)Cgl-Pic-Pab (Z) в 25 мл этилацетата пробулькивают хлористый водород. Через две минуты из раствора осаждаются кристаллы. Растворитель удаляют в вакууме и к остатку добавляют 50 мл этилацетата. Промыванием 2 М раствором гидроксида натрия (2 х 15 мл) и экстрагированием водной фазы 25 мл этилацетата с последующей сушкой (сульфат натрия) объединенных экстрактов и удалением растворителя в вакууме получают 0,448 г (95%) целевого продукта.
(III) H-(R)Cgl-Pic-Pab • 2HCl
Раствор 98 мг (0,18 ммоля) H-Cgl-Dic-Pab (Z) в 5 мл 95% этанола и 1 мл воды перемешивают 4 часа в атмосфере водорода в присутствии 5% Pd-C. После фильтрования смеси добавляют 0,3 мл 1 М соляной кислоты. Этанол удаляют в вакууме и сушкой вымораживанием остатка получают 70 мг (81%) целевого соединения.
1H-ЯМР (300 МГц, CD3OD) δ: 1 - 1,56 (м, 1H), 1,56 - 1,94 (м, 9H), 1,56 - 1,94 (м, 9H), 2,32 (ш.д, 1H), 3,32 - 3,45 (м, 1H), 3,9 (ш, д, 1H), 4,35 (д, 1H), 4,5 (с, 2H), 5,1 - 5,2 (м, 1H), 7,55 (д, 2H), 7,76 (д, 2H).
13C-ЯМР (75 МГц, D2O) δ: 167,2, 170,5 и 173,4 (углероды амидиногруппы и карбонила).
Пример 7
HOOC-CH2-(R,S)CH(COOH)-(R)Cgl-Pic-Pab • 2HCl
(I) BnOOC-CH2-(R,S)CH(COOBn)-(R)Cgl-Pic-Pab (Z)
Смесь 350 мг (0,66 ммоля) H-(R)Cgl-Pic-Pab (Z) (см. Пример 6) и 233 мг дибензилмалеата в 2,5 мл этанола выдерживают 4 дня при комнатной температуре. Этанол удаляют в вакууме и остаток подвергают колоночной хроматографии с применением в качестве элюента смеси этилацетат-гептан (9:1) и получением 0,108 мг целевого продукта.
(II) HOOC-CH2-(R,S)CH(COOH)-(R)Cgl-Pic-Pab • 2HCl
Раствор 105 мг (0,13 ммоля) BnOOC-CH2-(R,S)CH(COOBn)-(R)Cgl-Pic-Pab (Z) в 5 мл 95%-го этанола и 1 мл воды гидрируют 5 часов в присутствии 5% Pd-C. После добавления 0,3 мл 1 М соляной кислоты смесь фильтруют и растворитель удаляют в вакууме. Остаток растворяют в воде и сушкой вымораживанием получают 54 мг (73%) целевого соединения.
1H-ЯМР (300 МГц, CD3OD, смесь двух диастереомеров, 5:4) δ: 1,1 - 1,6 (м, 7H), 1,6 - 2,04 (м, 9H), 2,23 - 2,42 (м, 1H), 2,93 - 3,15 (м, 2H), 3,3 - 3,42 (м, 1H, частично экранирован MeOD-пиком), 3,71 - 3,95 (м, 1H), 3,98 - 4,1 (м, 1H), 4,4 - 4,6 (м, 3H), 5,1 - 5,2 (м, 1H), 7,49 - 7,6 (м, 2H), 7,7 - 8,1 (м, 2H).
13C-ЯМР (75 МГц, D2O) δ: 167,1, 168,95, 169,6, и 173,1 (углероды амидиногруппы и карбонила).
МС: m/z 516 (M+ + 1).
Пример 8
H-(R)Cha-Aze-Pab • 2HCl
(I) Boc-(R)Cha-Aze-Pab (Z)
К перемешиваемой смеси 0,72 г (2,03 ммоля) Boc-(R)Cha-Aze-OH (см. раздел: получение исходных соединений), 1,04 г (8,53 ммоля) ДМАП и 604 мг (2,13 ммоля) H-Pab (Z) (см. раздел: получение исходных соединений) в 20 мл ацетонитрила добавляют при -18oC 604 мг (2,13 ммоля) ЭДК. Реакционную смесь оставляют на ночь нагреваться при комнатной температуре и растворитель затем удаляют в вакууме. Остаток растворяют в 40 мл этилацетата и органическую фазу последовательно промывают 10 мл воды, 0,3 М KHSO4 (3 х 10 мл), Na2CO3-NaCl (водн. , 2 х 10 мл) и наконец 10 мл рассола. Сушкой (Na2SO4) и удалением растворителя в вакууме получают остаток, который подвергают колоночной хроматографии с применением в качестве элюента смеси этилацетат-метанол (9:1) и получением 645 мг (51%) заглавного соединения.
(II) H-(R)Cha-Aze-Pab (Z)
Через раствор 640 мг (1,03 ммоля) Boc-(R)Cha-Aze-Pab (Z) в 25 мл этилацетата пробулькивают хлористый водород. Спустя две минуты ТСХ-анализ указывает на завершение реакции. Для удаления избытка хлористого водорода применяют вакуум и затем смесь разбавляют этилацетатом до 50 мл. За промывкой Na2CO3 (водн. , 2 х 15 мл) последовало экстрагированием водной фазы 15 мл этилацетата. Объединенные органические экстракты промывают водой, сушат (Na2CO3) и удалением растворителя в вакууме получают 513 мг (96%) H-(R)Cha-Aze-Pab (Z).
(III) H-(R)Cha-Aze-Pab • 2HCl
Раствор 76 мг (0,15 ммоля) H-(R)Cha-Aze-Pab (Z) в 5 мл 95%-го этанола и 1 мл воды гидрируют 4 ч при атмосферном давлении в присутствии 5% Pd-C. Удалением катализатора фильтрованием, добавлением 0,4 мл 1 М соляной кислоты и испарением растворителя в вакууме получают остаток, который растворяют в 2 мл воды. Сушка вымораживанием дает 57 мг (85%) целевого продукта.
1H-ЯМР (500 МГц, D2O, смесь 2 ротамеров, 1:1) δ: 1,02 - 1,2 (м, 2H), 1,22 - 1,92 (м, 11H), 2,4 - 2,5 (м, 1H), 2,8 - 2,9 (м, 1H), 4,25 (ш.т, 1H), 4,4 (дк, 1H), 4,53 (дк, 1H), 4,65 (с, 2H), 5,05 - 5,1 (м, 1H), 7,65 (д, 2H), 7,88 (д, 2H).
Химические сдвиги для разрешимых сигналов меньшего ротамера δ: 0,57 (м), 0,85 (м), 2,95 (м), 4,06 (дк), 4,17 (дк), 4,63 (с), 5,33 (м), 7,7 (д), 7,93 (д).
13C-ЯМР (125 МГц, D2O) δ: 167,2, 170,4 и 172,8 (углероды амидиногруппы и карбонила).
Пример 9
HOOC-CH2-(R)Cha-Aze-Pab • 2HCl
(I) BnOOC-CH2-(R)Cha-Aze-Pab (Z)
К смеси 0,27 г (0,52 ммоля) H-(R)Cha-Aze-Pab (Z) (см. Пример 8) и 0,158 г (1,14 ммоля) K2CO3 в 5,2 мл ацетонитрила добавляют 0,119 г (0,52 ммоля) бензилбромацетата и нагревают 1 ч на масляной бане при 60oC. После удаления растворителя добавляют этилацетат и воду. Фазы разделяют, органическую фазу промывают рассолом и сушат (Na2SO4). Испарением в вакууме получают 0,344 г остатка, который подвергают колоночной хроматографии с применением в качестве элюента этилацетата, а в другой раз применением смеси этилацетат-тетрагидрофуран-NH3-насыщенный метанол (60:5:2). Получено 0,163 г целевого продукта.
1H-ЯМР (300 МГц, CDCl3) δ: 0,7 - 1 (м, 2H), 1,05 - 2,05 (м, 11H), 2,35 - 2,55 (м, 1H), 2,55 - 2,75 (м, 1H), 3,15 - 3,32 (м, 3H), 3,95 - 4,05 (т, 2H), 4,4 и 4,5 (ABX-система, 2H), 4,8 - 4,95 (м, 1H), 5,05 (с, 2H), 5,2 (с, 2H), 7,2 - 7,5 (м, 12H), 7,7 - 7,85 (д, 2H), 8,3 - 8,45 (т, 1H).
13C-ЯМР (75 МГц, CDCl3) δ: 164,5, 167,8, 170,7, 171,9 и 175,9 (углероды амидиногруппы и карбонила).
(II) HOOC-CH2-(R)Cha-Aze-Pab • 2HCl
Раствор 0,163 г (0,243 ммоля) BnOOC-CH2-(R)Cha-Aze-Pab (Z) в 5,5 мл этанола (99,5%) и 0,7 мл соляной кислоты (1 н.) гидрируют 4 ч в присутствии 0,17 г 5% Pd-C. Удалением катализатора, фильтрованием и испарением растворителя с последующим растворением в воде и сушкой вымораживанием получают 107 мг (85%) заглавного соединения.
1H-ЯМР (500 МГц, CD3OD, смесь двух ротамеров) основной ротамер δ: 0,95 - 1,95 (м, 13H), 2,3 - 2,4 (м, 1H), 2,6 - 2,75 (м, 1H), 3,5 - 3,75 (м, 2H), 4,05 - 4,15 (м, 1H), 4,15 - 4,23 (м, 1H), 4,36 - 4,43 (м, 1H), 4,43 - 4,5 (м, 1H), 4,58 - 4,65 (м, 1H), 4,83 - 4,88 (м, 1H), 7,5 - 7,6 (м, 2H), 7,73 - 7,82 (м, 2H).
Разрешаемые сигналы меньшего ротамера появляются при δ: 2,2 - 2,3 (м), 3,95 - 4,05 (м), 5,1 - 5,17 (м), 7,6 - 7,67 (м).
13C-ЯМР (75 МГц, CD3OD) δ: 168,2, 169,8, 168,9 и 172,3 (углероды амидиногруппы и карбонила).
Пример 10
HOOC-CH2-(R,S)CH(COOH)-(R)Cha-Aze-Pab • 2HCl
(I) BnOOC-CH2-(R,S)CH(COOBn)-(R)Cha-Aze-Pab (Z)
Смесь 230 мг (0,443 ммоля) H-(R)Cha-Aze-Pab (Z) (см. Пример 8) и 144 мг (0,487 ммоля) дибензилмалеата в 1,5 мл 95%-го этанола перемешивают в течение 5 дней при комнатной температуре. После удаления этанола в вакууме остаток подвергают колоночной хроматографии с применением в качестве элюента смеси этилацетат-метанол (95:5) и получением 54 мг (15%) целевого продукта.
(II) HOOC-CH2-(R,S)CH(COOH)-(R)Cha-Aze-Pab
Раствор 49 мг (0,06 ммоля) BnOOC-CH2-(R,S)CH(COOBn)-(R)Cha-Aze-Pab (Z) в 5 мл 95%-го этанола и 1 мл воды гидрируют 4,5 ч в присутствии 5% Pd-C. Удалением катализатора, фильтрованием и испарением растворителя в вакууме получают остаток, который растворяют в 2 мл воды и 0,2 мл 1 М соляной кислоты. Сушкой вымораживанием получают 32 мг (93%) целевого продута.
1H-ЯМР спектр заглавного соединения характеризуется двумя сериями сильно перекрывающихся сигналов вследствие присутствия двух диастереомеров. Кроме того, разрешаемые резонансы меньшего ротамера, составляющие примерно 15%, также появляются в спектре.
1H-ЯМР (300 МГц, D2O) δ: 1,03 - 2 (м, 13H), 2,32 - 2,53 (м, 1H), 2,72 - 2,96 (м, 1H), 3,06 - 3,28 (м, 2H), 4,1 - 4,55 (м, 4H), 4,62 (ш. с, 2H), 5 - 5,1 (м, 1H), 7,55 - 7,68 (м, 2H), 7,8 - 7,94 (м, 2H).
Разрешаемые сигналы меньшего ротамера появляются при δ: 0,65 (м), 0,8 (м), 4 (м), 5,24 (м), 5,35 (м).
13H-ЯМР (75 МГц, D2O) δ: 167,2, 169, 171, 172,3 и 174,1 (углероды амидиногруппы и карбонила).
Пример 11
HOOC-CH2-(R или S)CH(COOH)-Cha-Aze-Pab/a • 2HCl
(I) BnOOC-CH2-(R или S)CH(COOBn)-(R)Cha-Aze-Pab (Z)/a
Смесь 2 г (3,8491 ммоля) H-(R)Cha-Aze-Pab (Z) (см. Пример 8) и 1,37 г дибензилмалеата в 10 мл 95%-го этанола перемешивают в течение 4 дней при комнатной температуре. После удаления этанола в вакууме остаток подвергают колоночной хроматографии с применением в качестве элюента смеси этилацетат-метанол (98: 2) и получением 1,024 г (32%) BnOOC-CH2-(R,S)CH(COOBn)-(R)Cha-Aze-Pab (Z). Два диастереомера разделяют ОФЖХ с применением в качестве элюента CH3CN-0,1 М NH4OAc (65:35). Данный диастереомер элюируется в колонки первым. После удаления ацетонитрила в вакууме водную фазу трижды экстрагируют этилацетатом. Органическую фазу промывают один раз водой, сушат (Na2SO4), фильтруют и испарением в вакууме получают 0,352 г заглавного соединения в виде чистого стереоизомера.
(II) HOOC-CH2-(R или S)CH(COOH)-(R)Cha-Aze-Pab/a • 2 HCl
Раствор 350 мг (0,43 ммоля) BnOOC-CH2-(R или S)CH(COOBn)-(R)Cha-Aze-Pab (Z)/a (диастереомер с вышеприведенной стадии (I)) в 15 мл 95%-го этанола и 3 мл воды гидрируют 4,5 ч в присутствии 5% Pd-C. Удалением катализатора, фильтрованием и испарением растворителя в вакууме получают остаток, который растворяют в 5 мл воды и 1 мл 1 М соляной кислоты. Сушкой вымораживанием получают 214 мг (74%) продукта в виде чистого стереоизомера.
1H-ЯМР (300 МГц, MeOD, смесь двух ротамеров) δ: 0,85 - 1,93 (м, 13H), 2,25 - 2,38 (м, 1H), 2,6 - 2,75 (м, 1H), 2,88 (дд, 2H), 3,92 (т, 1H), 4,15 - 4,25 (м, 2H), 4,3 - 4,43 (м, 2H), 4,56 (AB-система, 2H), 4,76 - 4,86 (м, 1H, частично закрыт сигналом растворителя), 7,59 (д, 2H), 7,78 (д, 2H).
Разрешаемые сигналы, создаваемые меньшим ротамером, появляются при δ: 0,7, 2,95, 3,82, 4, 5,08 и 7,83.
13C-ЯМР (75 МГц, D2O) δ 166,9, 168,8, 171,7, 172,3 и 173,8 (углероды амидиногруппы и карбонила).
Пример 12
HOOC-CH2-(R или S)CH(COOH)-(R)Cha-Aze-Pab/b • 2HCl
(I) BnOOC-CH2-(R или S)CH(COOBn)-(R)Cha-Aze-Pab (Z)/b
Заглавное соединение синтезировано по методике, приведенной в Примере 11 для получения BnOOC-CH2-(R, S)CH(COOBn)-(R)Cha-Aze-Pab (Z). Данный диастереомер выходит с колонки после первого диастереомера. Выход 0,537 г.
(II) HOOC-CH2-(R или S)CH(COOH)-(R)Cha-Aze-Pab/b • 2 HCl
Раствор 530 мг (0,65 ммоля) BnOOC-CH2-(R или S)CH(COOBn)-(R)Cha-Aze-Pab (Z)/b в 15 мл 95%-го этанола и 3 мл воды гидрируют 5 ч в присутствии 5% Pd-C. Удалением катализатора фильтрованием и испарением растворителя в вакууме получают остаток, который растворяют в 6 мл воды и 1 мл 1 М соляной кислоты. Сушка вымораживанием дает 280 мг (78%) целевого продукта.
1H-ЯМР (300 МГц, MeOD, смесь двух ротамеров) δ: 0,86 - 1,9 (м, 13H), 2,3 - 2,42 (м, 1H), 2,6 - 2,75 (м, 1H), 2,75 - 2,85 (м, 1H), 2,95 - 3,05 (м, 1H), 3,65 - 3,71 (м, 1H), 4 - 4,1 (м, 1H), 4,14 - 4,24 (м, 1H), 4,36 - 4,62 (м, 3H), 4,78 - 4,86 (м, 1H, частично закрыт сигналом растворителя), 7,57 (д, 2H), 7,75 (д, 2H). Разрешаемые сигналы, создаваемые меньшим ротамером, появляются при δ: 0,78, 2,92, 3,82, 5,36 и 7,8.
13C-ЯМР (75 МГц, D2O) δ: 166,8, 169, 172, 172,4 и 175,2 (углероды амидиногруппы и карбонила).
Пример 13
HOOC-CH2-CH2-(R)Cha-Aze-Pab • 2HCl
(I) (BnOOC-CH2-CH2-(R)Cha-Aze-Pab (Z)
Смесь 182 мг (0,35 ммоля) H-(R)Cha-Aze-Pab (Z) (см. Пример 8) и 62,5 мг (0,385 ммоля) бензилакрилата в 1,5 мл 95%-го этанола перемешивают 4 дня при комнатной температуре. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии с применением в качестве элюента смеси этилацетат-метанол (9:1) и получением 200 мг (84%) заглавного соединения.
(II) HOOC-CH2-CH2-(R)Cha-Aze-Pab • 2HCl
Раствор 195 мг (0,29 ммоля) BnOOC-CH2-CH2-(R)Cha-Aze-Pab (Z) в 10 мл 95%-го этанола и 2 мл воды гидрируют 4 ч в присутствии 5% Pd-C. Удалением катализатора фильтрованием и испарением растворителя в вакууме получают остаток, который растворяют в 2 мл воды и 0,4 мл 1 М соляной кислоты. Сушка вымораживанием дает 130 мг (86%) целевого продукта.
1H-ЯМР (500 МГц, CD3OD) δ: 0,98 - 1,27 (м, 1H), 1,3 - 1,9 (м, 11H), 2,27 - 2,35 (м, 1H), 2,65 - 2,74 (м, 1H), 2,77 (т, 2H), 3,32 (т, 2H), 4,1 (т, 1H), 4,17 - 4,25 (м, 1H), 4,4 - 4,49 (м, 1H), 4,55 (AB, 2H), 4,83 - 4,9 (м, 1H), 7,58 (д, 2H), 7,77 (д, 2H).
13C-ЯМР (125 МГц; D2O) δ: 167, 168,9, 172,4 и 174,6 (углероды амидиногруппы и карбонила).
Пример 14
HOOC-CH2-NH-CO-CH2-(R)Cha-Aze-Pab • 2HCl
(I) BnOOC-CH2-NH-CO-CH2-(R)Cha-Aze-Pab (Z)
Смесь 0,212 г (0,408 ммоля) H-(R)Cha-Aze-Pab (Z) (см. Пример 8), 0,124 г (0,89 ммоля) K2CO3 и 0,128 г (0,449 ммоля) BnOOC-CH2-NH-CO-CH2-Br (см. раздел: получение исходных соединений) в 6 мл ацетонитрила перемешивают два часа при 50oC. После испарения растворителя остаток растворяют в воде и этилацетате. Водный слой дважды экстрагируют этилацетатом, объединенный органический слой сушат (Na2SO4), фильтруют и испаряют. Очисткой продукта колоночной хроматографией с применением ступенчатого градиента этилацетат-тетрагидрофуран (85:15, 4:1, 7:3) получают 0,19 г (64%) заглавного соединения.
1H-ЯМР (300 МГц, CDCl3) δ: 0,75 - 2,1 (м, 13H), 2,43 (м, 1H), 2,56 (д, 1H), 2,79 (м, 1H), 3 - 3,15 (м, 2H; в нем же 3,05 (д, 1H)), 3,89 - 4,18 (м, 5H), 4,8 - 4,98 (м, 2H), 5,15 (с, 2H), 5,18 (с, 2H), 7,2 - 7,47 (м, 12H), 7,72 (т, 11H), 7,86 (д, 2H), 8,14 (ш. с, NH), 8,31 (дд, NH), 9,42 (ш. с. NH).
13C-ЯМР (75 МГц, CDCl3) δ: 164,5, 168,7, 169,22, 169,83, 171,7, 175,5 (углероды амидиногруппы и карбонила).
(II) HOOC-CH2-NH-CO-CH2-(R)Cha-Aze-Pab • 2HCl
Смешивают 0,19 г (0,26 ммоля) BnOOC-CH2-NH-CO-CH2-(R)Cha-Aze-Pab (Z) с 0,075 г 5% Pd-C, 1,5 мл 1 н. раствора HCl, 3 мл воды и 17 мл этанола и гидрируют четыре часа при атмосферном давлении. Фильтрованием катализатора, испарением растворителя с последующей сушкой вымораживанием из воды получают 144 мг (97%) заглавного соединения.
1H-ЯМР (D2O, 300 МГц, два ротамера, 4:1) δ: 0,88 - 1,88 (м, 13H), 2,25 - 2,42 (м, 1H), 2,3 - 2,89 (м, 1H), 3,94 (с, 2H), 3,89 (кажущийся дублет, 2H), 4,16 (т, 1H), 4,28 (к, 1H), 4,41 (к, 1H), 4,56 (с, 2H), 4,98 (дд, 1H), 7,53 (д, 2H), 7,77 (д, 2H). Разрешаемые сигналы меньшего ротамера появляются при δ: 0,5 (ш. к), 0,77 (ш. к), 5,21 (дд), 7,56 (д) и 7,81 (д).
13C-ЯМР (D2O, 75 МГц) δ: 166,8, 166,9, 168,6, 172,3 и 173,4 (углероды карбонилов и амидиногруппы). Разрешаемые сигналы меньшего ротамера появляются при δ: 166,8, 169,6 и 172.
Пример 15
H-(R)Cha-Pro-Pab • 2HCl
(I) Boc-(R)Cha-Pro-Pab (Z)
К перемешиваемой при комнатной температуре смеси 0,135 мл (1,1 ммоля) триэтиламина и 405 мг (1,1 ммоля) Boc-(R)Cha-Pro-OH (см. раздел: получение исходных соединений) в 5 мл ДМФА добавляют 0,135 мл (1,1 ммоля). Спустя 3 ч добавляют 340 мг (1,1 ммоля) H-Pab (Z) (см. раздел: получение исходных соединений) в 5 мл ДМФА и перемешивание продолжают примерно сутки. Реакционную смесь разбавляют водой и экстрагируют смесью этилацетат-толуол (1:1). Органическую фазу сушат (MgSO4) и удалением растворителя в вакууме получают остаток, который подвергают колоночной хроматографии с применением в качестве элюента этилацетата. Выход 309 мг (49%).
(II) H-(R)Cha-Pro-Pab (Z)
Через раствор 1,246 г (2 ммоля) Boc-(R)Cha-Pro-Pab
(Z) в 20 мл этилацетата пробулькивают при комнатной температуре до насыщения хлористый водород. Спустя 30 минут добавляют 10%-ный раствор карбоната натрия, органическую фазу отделяют и сушат (K2CO3). Осушитель отмывают хлористым метиленом и испарением растворителя из объединенной органической фазы получают 1,11 г (100%) заглавного соединения.
(III) H-(R)Cha-Pro-Pab • 2HCl
Раствор 100 мг (0,19 ммоля) H-(R)Cha-Pro-Pab (Z) в 15 мл этанола гидрируют 1,5 ч в присутствии 38 мг 10% Pd-C. Разбавлением реакционной смеси водой и удалением катализатора фильтрованием с последующим удалением этанола в вакууме и сушкой вымораживанием получают в виде бесцветного порошка заглавное соединение. Пептид превращают в дигидрохлорид растворением в соляной кислоте и сушкой вымораживанием. Выход заглавного соединения 90 мг (100%).
1H-ЯМР (300 МГц, D2O) δ: 1 - 2 (м, 13H), 2 - 2,3 (м, 3H), 2,3 - 2,5 (м, 1H), 3,6 - 3,7 (м, 1H), 3,8 - 3,9 (м, 1H), 4,3 - 4,5 (т, 1H), 4,5 - 4,6 (м, 3H), 7,4 - 7,6 (м, 3H), 7,6 - 7,9 (м, 2H).
13C-ЯМР (75 МГц, D2O) δ: 167,2, 170, 174,9 (углероды амидиногруппы и карбонила).
Пример 16
HOOC-CH2-(R)Cha-Pro-Pab • 2HCl
(I) BnOOC-CH2-(R)Cha-Pro-Pab (Z)
Смесь 268 мг (0,5 ммоля) H-(R)Cha-Pro-Pab (Z) (см. пример 15), 90 мкл (0,55 ммоля) бензилбромацетата и 181 мг (1,3 ммоля) K2CO3 в 2 мл ацетонитрила обрабатывают 2,5 ч ультразвуком при 40oC. Смесь фильтруют через гайфло и удалением растворителя в вакууме получают остаток, который подвергают колоночной хроматографии с применением в качестве элюента этилацетат и получением 194 мг (57%) заглавного соединения.
HOOC-CH2-(R)Cha-Pro-Pab • 2 HCl
Раствор 194 мг (0,28 ммоля) BnOOC-CH2-(R)Cha-Pro-Pab (Z) в 10 мл этанола гидрируют 3 ч в присутствии 77 мг 10% Pd на активированном угле. Реакционную смесь разбавляют водой и катализатор удаляют фильтрованием. Испарением этанола в вакууме с последующей сушкой вымораживанием получают белый остаток. Добавляют соляную кислоту и сушкой вымораживанием полученного раствора получают 115 мг (68%) целевого продукта.
1H-ЯМР (330 МГц, D2O) δ: 1 - 1,2 (м, 2H), 1,2 - 1,5 (м, 3H), 1,5 - 2 (м, 8H), 2 - 2,3 (м, 3H), 2,3 - 2,5 (м, 1H), 3,6 - 3,8 (м, 1H), 3,8 - 4 (м, 3H), 4,4 - 4,7 (м, 4H), 7,5 - 7,7 (д, 2H), 7,7 - 7,9 (д, 2H).
13C-ЯМР (75 МГц, D2O) δ: 167,2, 168,2, 169,3, 174,6 (углероды амидиногруппы и карбонила).
Пример 17
HOOC-CH2-(Me)(R)Cha-Pro-Pab
(I) Boc-(Me)(R)Cha-Pro-Pab (Z)
К раствору 0,8 г (1,67 ммоля) Boc-(Me)(R)Cha-Pro-OSu (см. раздел: получение исходных соединений) в 3 мл ДМФА добавляют раствор 0,562 г (1,85 ммоля) H-Pab (Z) (см. раздел: получение исходных соединений) в 3 мл ДМФА. Добавлением N-метилморфолина в полученном растворе устанавливают pH 8 - 9, после чего раствор перемешивают 2 дня при комнатной температуре. Раствор выливают в воду и полученную смесь экстрагируют этилацетатом (3 х 25 мл). Органический раствор промывают 1 М раствором KHSO4, 10%-ным раствором NaHCO3, водой и рассолом и сушат (Na2SO4). Испарением растворителя получают 0,65 г (60%) заглавного соединения в виде желтовато-белого порошка.
(II) Me-(R)Cha-Pro-Pab (Z)
Раствор 0,6 г (0,92 ммоля) Boc-(Me)(R)Cha-Pro-Pab (Z) в 50 мл EtOH насыщают HCl при 0oC и затем хранят в холодильнике примерно сутки. Полученный раствор испаряют досуха, остаток растворяют в растворе Na2CO3 и экстрагируют этилацетатом (3 х 25 мл). Экстракт промывают рассолом и после испарения получают 0,4 г (79%) целевого соединения в виде белого пушистого порошка.
1H-ЯМР (CDCl3 300 МГц) δ: 0,8 - 1 (м, 2H), 1,1 - 1,4 (м, 5H), 1,4 - 1,55 (м, 1H), 1,6 - 1,9 (м, 10H), 1,9 - 2,05 (м, 2H), 2,05 - 2,2 (м, 2H), 2,19 (с, 3H), 2,4 - 2,5 (м, 1H), 3,28 (дд, 1H), 3,41 (к, 1H), 3,62 (м, 1H), 4,42 (м, 2H), 4,61 (д, 1H), 5,2 (с, 2H), 7,2 - 7,45 (м, 7H), 7,72 (т, 1H), 7,79 (д, 2H).
(III) BnOOC-CH2-(Me)(R)Cha-Pro-Pab (Z)
Смесь 0,4 г (0,73 ммоля) Me-(R)Cha-Pro-Pab (Z), 0,17 г BnOOC-CH2Br и 0,2 г (2 экв. ) K2CO3 (измельчен в ступке) в 15 мл CH3CN перемешивают примерно сутки при комнатной температуре. Образовавшуюся смесь испаряют, добавляют этилацетат и смесь промывают водой и рассолом, сушат (Na2SO4) и испаряют. Сырой продукт подвергают колоночной хроматографии (CH2Cl2-MeOH, 10:1) с получением 0,39 г (77%) светло-желтого очень вязкого масла.
HOOC-CH2-(Me)(R)Cha-Pro-Pab
К раствору 0,39 г (0,56 ммоля) BnOOC-CH2-(Me)(R)Cha-Pro-Pab (Z) в 30 мл EtOH добавляют 0,1 г 10% Pd-C и смесь гидрируют при атмосферном давлении. Раствор фильтруют и испаряют, после чего сушкой вымораживанием полученного сиропообразного продукта получают 0,25 г (95%) целевого соединения в виде белого кристаллического порошка.
1H-ЯМР (300 МГц, CD3OD) δ: 0,85 - 1,1 (м, 2H), 1,1 - 1,4 (м, 6H), 1,5 - 1,85 (м, 9H), 1,9 - 2,05 (м, 3H), 2,05 - 2,15 (м, 1H), 2,15 - 2,3 (м, 1H), 2,57 (с, 3H), 3,32 (д, 1H), 3,55 - 3,75 (м, 2H), 3,95 - 4,1 (м, 2H), 4,35 - 4,5 (м, 3H), 7,55 (д, 2H), 7,72 (д, 2H).
13C-ЯМР (75 МГц, CD3OD) δ: 168,4, 171,5, 174,7, 175,1 (углероды амидиногруппы и карбонила).
Пример 18
HOOC-CH2-CH2-(R)Cha-Pro-Pab • 2HCl
(I) BnOOC-CH2-CH2-(R)Cha-Pro-Pab (Z)
Смесь 149 мг (0,28 ммоля) H-(R)Cha-Pro-Pab (Z) (см. Пример 15) и 66 мг (0,4 ммоля) бензилакрилата в 1,5 мл этанола выдерживают 36 ч при комнатной температуре. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии с применением в качестве элюента этилацетата и получением 124 мг (64%) целевого продукта.
(II) HOOC-CH2-CH2-(R)Cha-Pro-Pab • 2HCl
Раствор 124 мг (0,18 ммоля) BnOOC-CH2-CH2-(R)Cha-Pro-Pab (Z) в 10 мл этанола гидрируют 1 ч в присутствии 55 мг 10% Pd-C. Катализатор удаляют фильтрованием и растворитель испаряют в вакууме. Остаток растворяют в соляной кислоте и сушкой вымораживанием образовавшегося раствора получают 87 мг (79%) заглавного соединения.
1H-ЯМР (300 МГц, D2O) δ: 1 - 2 (м, 13H), 2 - 2,2 (м, 3H), 2,2 - 2,4 (м, 1H), 2,7 - 2,8 (т, 2H), 3,2 - 3,3 (м, 1H), 3,3 - 3,4 (м, 1H), 3,5 - 3,7 (м, 1H), 3,7 - 3,9 (м, 1H), 4,3 - 4,6 (м, 4H), 7,4 - 7,6 (м, 2H), 7,7 - 7,8 (м, 2H).
13C-ЯМР (75 МГц, D2O) δ: 167, 168,3 и 174,6 (углероды амидиногруппы и карбонила. Два углерода перекрываются).
Пример 19
HOOC-CH2-CH2-(Me)(R)Cha-Pro-Pab • 2HCl
(I) BnOOC-CH2-CH2-(Me)(R)Cha-Pro-Pab (Z)
К раствору 274 мг (0,5 ммоля) (Me)-(R)Cha-Pro-Pab (Z) (см. Пример 17) в 5 мл EtOH (99%) добавляют 97,3 мг (0,6 ммоля) бензилакрилата и реакционную смесь перемешивают при комнатной температуре. Через 72 ч вносят дополнительное количество (16,2 мг, 0,1 ммоля) бензилакрилата и перемешивание продолжают 24 ч. Растворитель испаряют, остаток подвергают колоночной хроматографии (CH2Cl2-MeOH (NH3-насыщен), 95:5) и получают 198 мг (56%) заглавного соединения.
1H-ЯМР (500 МГц, CDCl3) δ: 0,8 - 2 (несколько м, 16H), 2,14 (с, 3H), 2,24 - 2,33 (м, 2H), 2,38 - 2,46 (м, 1H), 2,67 (т, 2H), 3,32 - 3,4 (м, 2H), 3,71 (м, 1H), 4,36 - 4,44 (м, 2H), 4,58 (м, 1H), 5,03 (кажущийся с, 2H), 5,2 (с, 2H), 7,25 - 7,37 (м, 10H), 7,43 (д, 2H), 7,64 (т, 1H) (NH)), 7,81 (д, 2H).
13C-ЯМР (125 МГц, CDCl3) δ: 164,7, 167,9, 171,7, 172,3 и 172,6 (углероды амидиногруппы и карбонила).
(II) HOOC-CH2-CH2-(Me)(R)Cha-Pro-Pab • 2HCl
К раствору 198 мг (0,27 ммоля) BnOOC-CH2-CH2-(Me)(R)Cha-Pro-Pab (Z) в 10 мл EtOH и 1 мл 1 М HCl добавляют 60 мг 5% Pd-C (содержит 50 мас.% воды) и смесь гидрируют 4 ч при атмосферном давлении. Катализатор отфильтровывают и растворитель испаряют. Оставшееся масло растворяют в воде и сушкой вымораживанием с количественным выходом получают заглавное соединение.
1H-ЯМР (500 МГц, D2O) δ: 1,08 - 1,2 (м, 2H), 1,2 - 1,42 (м, 4H), 1,68 - 1,91 (м, 5H), 1,93 - 2,08 (м, 2H), 2,09 - 2,26 (м, 3H), 2,48 (м, 1H), 2,95 (м, 2H), 3,03 (с, 3H), 3,6 (кажущийся ш. с, 2H), 3,82 (м, 1H), 3,98 (м, 1H), 4,53 (м, 1H), 4,61 (ш.с, 2H), 4,64 (м, 1H), 7,63 (д, 2H), 7,97 (д, 2H).
13C-ЯМР (75 МГц, D2O) δ: 167,2, 167,8, 174,5 (углероды амидиногруппы и карбонила. Два пика, вероятно, перекрываются).
Пример 20
HOOC-CH2-(R или S)CH(COOH)-(R)Cha-Pro-Pab/a • 2HCl
(I) BnOOC-CH2-(R,S)CH(COOBn)-(R)Cha-Pro-Pab (Z)
Смесь 0,5 г (0,94 ммоля H-(R)Cha-Pro-Pab (Z) (см. Пример 15) и 0,28 г (0,94 ммоля) дибензилмалеата в 20 мл этанола выдерживают 5 дней при комнатной температуре. Испарением растворителя и последующей колоночной хроматографией с применением в качестве элюента CH2Cl2-MeOH получают 0,15 г (19%) диастереомерной смеси.
1H-ЯМР (500 МГц, CDCl3) δ: 0,7 - 2,1 (м, 17H), 2,3 - 2,4 (м, 1H), 2,5 - 2,8 (м, 2H), 3,2 - 3,7 (м, 4H), 4,46 (д, 1H), 4,65 (ш. д, 1H), 4,81 (д, 1H), 4,9 - 5,1 (м, 3H), 5,2 (с, 2H), 7,1 - 7,4 (м, 2H), 7,4 - 7,5 (м, 2H), 7,6 - 7,8 (м, 3H).
(II) HOOC-CH2-(R или S)CH(COOH)-(R)Cha-Pro-Pab/a • 2HCl
Смесь 0,15 г (0,18 ммоля) BnOOC-CH2-(R, S)CH(COOBn)-(R)Cha-Pro-Pab (Z) растворяют в 5 мл этанола и гидрируют 1 ч в присутствии 5% Pd-C при атмосферном давлении с образованием HOOC-CH2-(R,S)CH(COOH)-(R)Cha-Pro-Pab. Смесь двух диастереомеров разделяют ОФЖХ с применением в качестве элюента CH3CN-0,1 М NH4OAc (15: 85) с последующей сушкой вымораживанием из HCl. Данный диастереомер элюируется с колонки первым. Выход 19 мг (18%).
1H-ЯМР (500 МГц, D2O, смесь двух ротамеров) основной ротамер δ: 1 - 2 (м, 15H), 2,15 (м, 2H), 2,44 (м, 1H), 3 (ш.д, 1H), 3,05 (ш.д, 1H), 3,69 (м, 1H), 3,84 (м, 1H), 3,97 (ш. с, 1H), 4,5 - 4,7 (м, 3H), 7,62 (д, 2H), 7,87 (д, 2H).
13C-ЯМР (75 МГц, D2O) δ: 167,2, 168,3, 173,8, 174,6 и 178,2 (углероды амидиногруппы и карбонила).
Пример 21
HOOC-CH2-(R или S)CH(COOH)-(R)Cha-Pro-Pab/b • 2HCl
Заглавное соединение получено по методике, приведенной в Примере 20 для синтеза HOOC-CH2-(R, S)CH(COOH)-(R)Cha-Pro-Pab. Данный диастереомер элюируется с колонки после первого диастереомера. Выход 19 мг (18%).
1H-ЯМР (500 МГц, D2O, смесь двух ротамеров) основной ротамер δ: 1 - 2 (м, 14H), 2,15 - 2,25 (м, 3H), 2,44 (м, 1H), 3,11 (ш.д, 1H), 3,19 (ш.д, 1H), 3,71 (м, 1H), 3,92 (м, 1H), 4,03 (ш.с, 1H), 4,5 - 4,7 (м, 3H), 7,56 (д, 2H), 7,84 (д, 2H).
Разрешаемые сигналы, создаваемые меньшим ротамером, появляются при δ: 7,66 (д) и 7,91 (д).
13C-ЯМР (75 МГц, D2O) δ: 167,3, 168,5 и 174,7 (углероды амидиногруппы и карбонила. Два углерода, вероятно, перекрываются).
Пример 22
HOOC-CH2-NH-CO-CH2-(R)Cha-Pro-Pab • 2HCl
(I) BnOOC-CH2-NH-CO-CH2-(R)Cha-Pro-Pab (Z)
В 6 мл ацетонитрила смешивают 0,246 г (0,46 ммоля) H-(R)Cha-Pro-Pab (Z) (см. Пример 15), 0,14 г (1,01 ммоля) K2CO3 и 0,145 г (0,506 ммоля) BnOOC-CH2-NH-CO-CH2-Br (см. раздел: получение исходных соединений). Смесь перемешивают 2 ч 30 минут при 50oC, растворитель испаряют и остаток распределяют между водой и этилацетатом. Слои разделяют и водный слой экстрагируют еще раз этилацетатом. Объединенный органический слой сушат (Na2SO4), и испарением получают масло. Очисткой сырого продукта колоночной хроматографией с применением ступенчатого градиента CH2Cl2-MeOH (97:3, 95:5, 92,5:7,5) получают 0,277 г (67%) заглавного соединения.
13C-ЯМР (75 МГц, CDCl3) δ: 25, 26, 26,2, 26,4, 26,7, 32,4, 34,2, 34,4, 40,8, 42,9, 46,7, 50,5, 58,4, 60,2, 67, 67,2, 127,5, 127,8, 128,2, 128,4, 128,5, 128,6, 134,1, 135,2, 137, 142,6, 164,7, 168,9, 169,3, 170,4, 172,2, 175.
(II) HOOC-CH2-NH-CO-CH2-(R)Cha-Pro-Pab • 2HCl
BnOOC-CH2-NH-CO-CH2-(R)Cha-Pro-Pab (Z) (0,089 г, 0,12 ммоля) смешивают с 30 мг 5% Pd-C и растворяют в 10 мл уксусной кислоты. Затем смесь гидрируют полтора часа при атмосферном давлении. Удалением катализатора фильтрованием через гайфло и сушкой вымораживанием из 1 мл 1 н. соляной кислоты получают 0,058 г (82%) целевого продукта.
1H-ЯМР (300 МГц, D2O) δ: 0,9 - 2,2 (м, 16H), 2,25 - 2,47 (м, 1H), 3,55 - 3,7 (м, 1H), 3,7 - 4,1 (м, 5H), 4,42 (т, 1H), 4,48 - 4,6 (м, 3H), 7,51 (д, 2H), 7,77 (д, 2H).
13C-ЯМР (75 МГц, D2O) δ: 166,8, 167,1, 168,2, 173,6 и 174,6 (углероды амидиногруппы и карбонила).
Пример 23
EtOOC-CH2-CH2-CH2-(R)Cha-Pro-Pab • HOAc
(I) EtOOC-CH=CH-CH2-(R)Cha-Pro-Pab (Z)
Смесь 275 мг (0,51 ммоля) H-(R)Cha-Pro-Pab (Z) (см. Пример 15), K2CO3 (141 мг, 1,02 ммоля) и BrCH2CH=CHCOOEt (108 мг, 0,56 ммоля) в 10 мл CH3CN выдерживают 20 ч при 20oC. После испарения растворителя остаток растворяют в 5 мл EtOAc и 2 мл воды. Органический слой отделяют, сушат (Na2SO4) и после концентрирования получают 387 мг масла, очисткой которого колоночной хроматографией с применением в качестве элюента EtOAc-гептана (1:4) получают 252 мг (77%) заглавного соединения.
1H-ЯМР (500 МГц, CDCl3) δ: 0,8 - 1,05 (м, 2H), 1,1 - 1,45 (м, 3H), 1,3 (т, 3H), 1,5 - 1,9 (м, 8H), 1,95 - 2,05 (м, 1H), 2,1 - 2,15 (м, 1H), 2,45 - 2,55 (м, 1H), 3 и 3,15 (два д, 2H), 3,35 - 3,45 (м, 2H), 3,55 - 3,65 (м, 1H), 4,15 (к, 2H), 4,6 - 4,7 (м, 2H), 5,2 (с, 2H), 5,85 (д, 1H), 6,75 (дт, 1H), 5,3 - 5,4 (м, 4H), 7,45 (д, 2H), 7,85 (д, 2H).
13C-ЯМР (75 МГц, CDCl3) δ: 165,7, 171,2 и 175,7 (углероды амидиногруппы и карбонила. Два пика, вероятно, перекрываются).
(II) EtOOC-CH2-CH2-CH2-(R)Cha-Pro-Pab • HOAc
Раствор 250 мг (0,38 ммоля) EtOOCCH=CHCH2-(R)Cha-Pro-Pab (Z) в этаноле гидрируют 2 ч в присутствии 5% Pd-C. Удалением катализатора фильтрованием и испарением растворителя в вакууме с последующей очисткой ОФЖХ с применением в качестве элюента CH3CN-0,1 М NH4OAc получают 70 г (36%) целевого продукта.
1H-ЯМР (500 МГц, CD3OD) δ: 0,9 - 1,05 (м, 2H), 1,15 - 1,55 (м, 5H), 1,25 (т, 3H), 1,6 - 1,85 (м, 7H), 1,95 - 2,6 (м, 8H), 3,55 - 3,65 (м, 2H), 3,8 (м, 1H), 4,1 (к, 2H), 4,45 (м и д, 2H), 4,55 (д, 1H), 7,55 и 7,75 (два д, 4H).
13C-ЯМР (75 МГц, CD3OD) δ: 168,3, 173,2, 174,6 и 174,9 (углероды амидиногруппы и карбонила).
Пример 24
Ph(4-COOH)-SO2(R)Cha-Pro-Pab • HCl
(I) Ph(4-COOH)-SO2-(R)Cha-Pro-Pab (Z)
К раствору 156 мг (0,29 ммоля) H-(R)Cha-Pro-Pab (Z) (см. Пример 15) и 59 мг (0,58 ммоля) триэтиламина в 4 мл хлористого метилена при температуре бани со льдом добавляют 64 мг (0,32 ммоля) 4-хлорсульфонилбензойную кислоту. Смесь оставляют медленно нагреваться до комнатной температуры и спустя 24 часа ее промывают водой и сушат (Na2SO4). Удалением растворителя в вакууме и последующей очисткой остатка колоночной хроматографией с применением в качестве элюентов смесей этилацетат-метанол (9:1) и затем хлористый метилен-метанол (3:1) получают 82 мг (39%) целевого продукта.
(II) Ph(4-COOH)-SO2-(R)Cha-Pro-Pab • HCl
Ph(4-COOH)-SO2-(R)Cha-Pro-Pab (Z) (80 мг, 0,11 ммоля) гидрируют в EtOH над 5% Pd-C. Катализатор отфильтровывают, растворитель успаряют, сырой продукт очищают ОФЖХ с применением в качестве элюента CH3CN-0,1 М NH4OAc (1:4) и затем превращают в дигидрохлорид сушкой вымораживанием из HCl с получением 21 мг (29%) целевого продукта.
1H-ЯМР (300 МГц, CD3OD, смесь двух ротамеров) δ: 0,45 - 1,82 (м, 13H), 1,9 - 2,3 (м, 4H), 2,95 - 4,16 (несколько м, всего 3H), 4,35 - 4,68 (м, 3H), 7,54 (д, 2H), 7,74 (д, 1H), 7,8 (д, 1H), 7,9 - 8 (м, 2H), 8,05 - 8,22 (м, 2H).
13C-ЯМР (75 МГц, CD3OD) δ: 168,4, 173,4, 173,9 и 174,2 (углероды амидиногруппы и карбонила).
МС: m/z 564 (M+ + 1)
Пример 25
H-(R)Cha-Pic-Pab • 2HCl
(I) Boc-(R)Cha-Pic-Pab (Z)
К смеси 7,11 г (18,6 ммоля) Boc-(R)Cha-Pic-OH (см. раздел: получение исходных соединений), 9,07 г (74,2 ммоля) ДМАП и 5,26 г (18,6 ммоля) H-Pab (Z) (см. раздел: получение исходных соединений) в 200 мл ДМФА добавляют при -15oC 3,57 г (18,6 ммоля) ЭДК и смесь оставляют нагреваться в течение примерно суток до 20oC. После удаления растворителя в вакууме добавляют толуол и воду. Органическую фазу промывают водой, 1 М KHSO4, 10% Na2CO3 и рассолом. Сушкой (MgSO4) и испарением растворителя в вакууме получают 13,63 г остатка, который подвергают колоночной хроматографии на силикагеле с применением в качестве элюента смеси этилацетат-толуол (2:1) и получением 9,5 г (79%) заглавного соединения.
1H-ЯМР (300 МГц, CDCl3) δ: 0,7 - 1 (м, 2H), 1 - 2,2 (м, 25H), 2,3 - 2,5 (м, 1H), 2,9 - 3,1 (м, 1H), 3,8 (д, 1H), 4,3 (дд, 1H), 4,4 - 4,6 (м, 2H), 5,1 (с, 2H), 5,1 - 5,3 (м, 2H), 7,2 - 7,3 (м, 5H), 7,35 (д, 2H), 7,4 - 7,5 (м, 1H), 7,75 (д, 1H).
13C-ЯМР (75 МГц, CDCl3) δ: 156,8, 164,6, 168,2, 170 и 173,4 (углероды амидиногруппы и карбонила).
(II) H-(R)Cha-Pic-Pab (Z)
Через раствор 9,5 г (14,7 ммоля) Boc-(R)Cha-Pic-Pab (Z) в 100 мл этилацетата при комнатной температуре пробулькивают до насыщения хлористый водород. Спустя 10 минут добавляют 10%-ный раствор Na2CO3, отделенную органическую фазу сушат (K2CO3) и удалением растворителя в вакууме получают с количественным выходом заглавное соединение.
1H-ЯМР (500 МГц, CD3OD) δ: 0,85 - 1,05 (м, 2H), 1,15 - 1,9 (м, 16H), 2,25 - 2,35 (м, 2H), 3,2 - 3,3 (м, 1H), 3,8 - 3,9 (д, 1H), 3,9 - 4 (м, 1H), 4,4 - 4,5 (два д, 2H), 4,7 (ш. с, 5H), 5,15 (с, 2H), 5,2 (м, 1H), 7,25 - 7,45 (м, 7H), 7,85 (д, 2H).
(II) H-(R)Cha-Pic-Pab • 2HCl
В смеси 5 мл этанола и 0,45 мл 1 М соляной кислоты растворяют 55 мг (0,1 ммоля) H-(R)Cha-Pic-Pab (Z) и гидрируют 1,5 ч в присутствии 13 мг Pd-C. Удалением катализатора, фильтрованием и испарением растворителя в вакууме получают остаток, который подвергают колоночной хроматографии с применением в качестве элюента 0,1 М NH4OAc-CH3CN. Затем очищенный пептид превращают в его дигидрохлорид путем растворения в соляной кислоте с последующей сушкой вымораживанием. Выход заглавного соединения 17 мг (35%).
1H-ЯМР (300 МГц, D2O, смесь 2 ротамеров, 1:1) δ: 1 - 2 (м, 18H), 2,33 (д, 1H), 3,4 - 3,5 (м, 1H), 3,8 - 3,9 (м, 1H), 4,4 - 4,8 (м, 3H), 5,15 - 5,25 (м, 1H), 7,5 - 7,7 (м, 2H), 7,8 - 8 (м, 2H).
Разрешаемые сигналы меньшего ротамера появляются при δ: 0,5 - 0,7 (м) и 3 - 3,1 (м).
13C-ЯМР (75 МГц, D2O) δ 167,3, 171,6 и 173,6 (углероды амидиногруппы и карбонила).
Разрешаемые сигналы меньшего ротамера появляются при: 170,6 и 172,4.
Пример 26
HOOC-CH2-(R)Cha-Pic-Pab • 2HCl
(I) BnOOC-CH2-(R)Cha-Pic-Pab (Z)
Смесь 742 мг (1,35 ммоля) H-(R)Cha-Pic-Pab (Z) (см. Пример 25), 230 мл (1,45 ммоля) бензилбромацетата и 558 мг (4 ммоля) K2CO3 в 4 мл ацетонитрила обрабатывают 40 минут ультразвуком при 40oC. Растворитель удаляют, остаток подвергают колоночной хроматографии и получают 720 мг (77%) целевого продукта.
1H-ЯМР (500 МГц, CDCl3) δ: 0,8 - 1 (м, 2H), 1,1 - 1,9 (м, 16H), 2,1 - 2,4 (ш. с, 1 или 2H), 2,4 (д, 2H), 3 (м, 1H), 3,25 (д, 1H), 3,45 (д, 1H), 3,55 - 3,65 (м, 1H), 3,7 (м, 1H), 4,35 (дд, 1H), 5,55 (дд, 1H), 4,8 (два д, 2H), 5,2 (с, 2H), 5,3 (м, 1H), 7,2 - 7,4 (м, 12H), 7,8 (д, 2H).
13C-ЯМР (125 МГц, CDCl3) δ: 164,5, 167,9, 170,5, 173,4 и 175,5 (углероды амидиногруппы и карбонила).
(II) HOOC-CH2-(R)Cha-Pic-Pab • 2HCl
Раствор 509 мг (0,73 ммоля) BnOOC-CH2-(R)Cha-Pic-Pab (Z) в 25 мл этанола гидрируют 4 ч в присутствии 259 мг 10% Pd-C. Удалением катализатора, фильтрованием и испарением растворителя в вакууме получают остаток, который растворяют в дистиллированной воде. Добавляют соляную кислоту и последующей сушкой вымораживанием получают 281 мг (79%) заглавного соединения.
1H-ЯМР (500 МГц, D2O, смесь ротамеров, 4:1) основной ротамер δ: 1 - 2 (м, 18H), 2,25 - 2,4 (м, 1H), 3,4 - 3,5 (м, 1H), 3,8 - 3,95 (м, 3H), 4,55 - 4,65 (два д, 2H), 5,15 (м, 1H), 7,55 - 7,75 (м, 2H), 7,8 - 8 (м, 2H).
13C-ЯМР (125 МГц, D2O) δ: 167,3, 169,9, 170,3 и 173,5 (углероды гуанидиногруппы и карбонила).
Разрешаемые сигналы меньшего ротамера появляются при δ: 169,2 и 172.
Пример 27
HOOC-CH2-(R или S)CH(COOH)-(R)Cha-Pic-Pab/a • 2HCl
(I) BnOOC-CH2-(R,S)CH(COOBn)-(R)Cha-Pic-Pab (Z)
Смесь 592 мг (1,1 ммоля) H-(R)Cha-Pic-Pab (Z) (см. Пример 15) и 332 мг (1,1 ммоля) дибензилмалеата в 1 мл этанола выдерживают 1 неделю при комнатной температуре. Растворитель удаляют в вакууме, остаток подвергают колоночной хроматографии с применением в качестве элюента смеси метанол-хлористый метилен и получают 275 мг (30%) диастереомерной смеси.
(II) HOOC-CH2-(R или S)CH(COOH)-(R)Cha-Pic-Pab/a • 2HCl
Раствор 275 мг BnOOC-CH2-(R, S)-CH(COOBn)-(R)Cha-Pic-Pab (Z) в 20 мл 95%-го этанола гидрируют 18 часов в присутствии 75 мг 10% Pd-C. Смесь фильтруют через гайфло и растворитель удаляют в вакууме. Добавлением воды с последующей сушкой вымораживанием получают 166 мг HOOC-CH2-(R,S)CH(COOH)-(R)Cha-Pic-Pab. Смесь двух диастереомеров разделяют ОФЖХ с применением CH3CN-0,1 М NH4OAc (1:4) с последующей сушкой вымораживанием из HCl. Данный диастереомер элюируется с колонки первым. Выход 9 мг.
1H-ЯМР (300 МГц, D2O, смесь ротамеров) δ: 1 - 2 (м, 18H), 2,25 - 2,4 (м, 1H), 3 - 3,2 (м, 2H), 3,4 (т, 1H), 3,8 (д, 1H), 4,05 (т, 1H), 4,5 - 4,7 (м, 3H), 5,2 (с, 1H), 7,55 (д, 2H), 7,9 (д, 2H).
Разрешаемые сигналы меньшего ротамера появляются при δ: 4 (т) и 7,7 (д).
Пример 28
HOOC-CH2-(R или S)CH(COOH)-(R)Cha-Pic-Pab/b • 2HCl
Заглавное соединение получено по методике, приведенной в Примере 27 для синтеза HOOC-CH2-(R, S)CH(COOH)-(R)Cha-Pic-Pab. Данный диастереомер элюируется с колонки вслед за первым диастереомером.
1H-ЯМР (500 МГц, D2O, смесь ротамеров) δ: 1 - 2 (м, 18H), 2,25 - 2,4 (м, 1H), 3 - 3,2 (м, 2H), 3,5 (т, 1H), 3,85 (д, 1H), 4,15 (с, 1H), 4,5 - 4,7 (м, 3H), 5,15 (с, 1H), 7,55 (д, 2H), 7,8 (д, 2H).
Разрешаемые сигналы меньшего ротамера появляются при δ: 4,35 (с), 7,65 (д), 7,9 (д).
Пример 29
HOOC-CH2-CH2-(R)Cha-Pic-Pab • 2HCl
(I) BnOOC-CH2-CH2-(R)Cha-Pic-Pab (Z)
Смесь 851 мг (1,55 ммоля) H-(R)Cha-Pic-Pab (Z) (см. Пример 25) и 269 мг (1,71 ммоля) бензилакрилата в 5 мл этанола выдерживают 40 ч при комнатной температуре. Растворитель удаляют в вакууме, остаток подвергают колоночной хроматографии с применением в качестве элюента смеси хлористый метилен-метанол и получают 812 мг (74%) целевого продукта.
1H-ЯМР (500 МГц, CDCl3) δ: 0,8 - 1 (м, 2H), 1,1 - 1,9 (м, 16H), 2,3 - 2,5 (м, 3H), 2,6 - 2,8 (м, 2H), 3 (м, 1H), 3,5 (м, 1H), 3,6 - 3,7 (м, 1H), 4,3 (дд, 1H), 4,6 (дд, 1H), 4,95 - 5,05 (два д, 2H), 5,2 (с, 2H), 5,3 (м, 1H), 6,5 - 6,9 (ш. с, 1H), 7 - 7,1 (м, 1H), 7,2 - 7,5 (м, 12H), 7,75 - 7,85 (д, 2H), 9,3 - 9,7 (ш. с, 1H).
(II) HOOC-CH2-CH2(R)Cha-Pic-Pab • 2HCl
Раствор 780 мг (1,1 ммоля) BnOOC-CH2-CH2(R)Cha-Pic-Pab (Z) в 25 мл этанола гидрируют 4 ч в присутствии 306 мг Pd-C (15%). Катализатор удаляют фильтрованием и растворитель испаряют в вакууме. Остаток растворяют в соляной кислоте и сушкой вымораживанием полученного раствора получают 481 мг (78%) заглавного соединения.
1H-ЯМР (500 МГц, D2O) δ: 0,95 - 1,1 (м, 2H), 1,15 - 1,9 (м, 16H), 2,2 - 2,3 (м, 1H), 2,7 - 2,8 (т, 2H), 3,2 - 3,3 (м, 3H), 3,4 - 3,5 (м, 1H), 3,75 - 3,85 (м, 1H), 4,4 - 4,6 (м, 3H), 5,15 (м, 1H), 7,5 - 7,6 (м, 2H), 7,8 - 7,9 (м, 2H), 8,6 - 8,7 (м, 1H).
13C-ЯМР (125 МГц, CD3OD) δ: 170,6, 175,9, 179,5 и 183,5 (углероды амидиногруппы и карбонила).
Пример 30
HOOC-CO-(R)Cha-Pic-Pab • HOAc
(I) EIOOC-CO-(R)Cha-Pic-Pab (Z)
К смеси 0,42 г (0,77 ммоля) H-(R)Cha-Pic-Pab (Z) (см. Пример 25) и 0,21 г (1,5 моля) K2CO3 в 10 мл CH3CN добавляют при комнатной температуре 0,12 г этилоксалилхлорида. Спустя 2 часа вносят дополнительное количество (0,07 г, 0,5 ммоля) этилоксалилхлолрида и смесь перемешивают примерно сутки при комнатной температуре. Растворитель удаляют в вакууме, остаток растворяют в CH2Cl2 и промывают водой. Испарением и колоночной хроматографией (толуол-этилацетат (1:2), затем CH2Cl2-метанол) 0,21 г (42%) целевого продукта.
(II) HOOC-CO-(R)Cha-Pic-Pab (Z)
К раствору 0,21 г (0,32 ммоля) EtOOC-CO(R)Cha-Pic-Pab (Z) в 3 мл ТГФ добавляют раствор 0,17 г (4,2 ммоля) LiOH в 3 мл воды. Смесь перемешивают примерно сутки при комнатной температуре и затем переносят в смесь этилацетат с водой. Фазы разделяют и органическую фазу промывают раствором KHCO3. Водную фазу подкисляют 0,5 M HCl (pH 1), экстрагируют CH2Cl2, сушат над Na2SO4, испаряют и получают 80 мг целевого продукта.
(III) HOOC-CO(R)Cha-Pic-Pab • HOAc
HOOC-CO(R)Cha-Pic-Pab (Z) гидрируют в EtOH в присутствии 5% Pd-C. Катализатор отфильтровывают и растворитель испаряют. Очисткой остатка ОФЖХ получают заглавное соединение.
1H-ЯМР (500 МГц, ДМСО-d6) δ: 0,8 - 1 (м, 2H), 1,1-1,75 (м, 15H), 1,86-1,94 (м, 1H), 2,13-2,2 (м, 1H), 3,75-3,81 (м, 1H), 4,32, 4,44 (AB, 2H), 4,71-4,77 (м, 1H), 4,98-5,02 (м, 1H), 7,41 (д, 2H), 7,75 (д, 2H), 8,1-8,15 (м, 1H), 8,22-8,27 (м, 1H), 9,32 (широкий с), 9,9 (широкий с). Сигналы одного из протонов частично экранированы сигналом растворителя.
МС: m/z 486 (M+ + 1).
Пример 31
HOOC-CH2-CO(R)Cha-Pic-Pab
(I) MeOOC-CH2-(R)Cha-Pic-Pab (Z)
К раствору 0,39 г (0,72 ммоля) H-(R)Cha-Pic-Pab (Z) (см. Пример 25) и 0,9 г (0,8 ммоля) монометилмалоната в 40 мл CH2Cl2 добавляют 0,16 г (0,8 ммоля) ДЦК и раствор перемешивают при комнатной температуре примерно сутки. Осадок ДЦМ отфильтровывают, фильтрат промывают 0,3 M KHSO4 и раствором KHCO3 и сушат (Na2SO4). Испарением растворителя с последующей колоночной хроматографией с применением в качестве элюента смеси толуола с этилацетатом (1: 3) получают 0,27 г (58%) целевого продукта.
(II) MeOOC-CH2-CO-(R)Cha-Pic-Pab
В 10 мл этанола растворяют 90 мг (0,14 ммоля) MeOOC-CH2-CO-(R)Cha-Pic-Pab (Z) и гидрируют 5 часов в присутствии 5% Pd-C. Удалением катализатора фильтрованием и испарением растворителя получают 50 мг (70%) заглавного соединения.
1H-ЯМР (300 МГц, CD3OD) δ: 0,85-1,1 (м, 2H), 1,1-1,9 (м, 16H), 2,35-2,45 (м, 1H), 3,2-3,4 (м, 3H), 3,7 (с, 3H), 3,95-4,05 (м, 1H), 4,4-4,55 (м, 3H), 5,15-5,25 (м, 1H), 7,4-7,55 (м, 2H), 7,7-7,85 (м, 2H).
13C-ЯМР (75 МГц, CD3OD) δ: 168,2, 168,7, 170, 172,4, 174,6 (углероды амидиногруппы и карбонила).
MC: m/z 514 (M+ + 1).
(III) HOOC-CH2-CO-(R)Cha-Pic-Pab
К раствору 0,14 г (0,27 ммоля) MeOOC-CH2-CO-(R)Cha-Pic-Pab в 5 мл метанола добавляют при комнатной температуре 2 мл 0,5 M NaOH. После перемешивания 5 часов добавляют воду и метанол удаляют в вакууме. Водную фазу сушат вымораживанием. Растворимые вещества экстрагируют из нерастворимых неорганических солей абсолютным этанолом. Оставшееся после испарения этанола твердое вещество суспендируют в воде и фильтрованием выделяют 70 мг (52%) заглавного соединения.
1H-ЯМР (300 МГц, ДМСО-d6) δ: 0,8 - 1 (м, 2H), 1-1,9 (м, 16H), 2,15-2,3 (м, 1H), 2,58, 2,86 (AB, 2H), 3,8-3,95 (м, 1H), 4,2-4,5 (м, 2H), 4,7-4,85 (м, 1H), 4,95-5,05 (м, 1H), 7,4 (д, 2H), 7,77 (д, 2H), 8,2-8,3 (м, 1H), 9,3-9,4 (м, 1H), 9,9 (широки с, 3H). Сигнал одного из протонов (3,21) частично экранируется сигналом растворителя.
13C-ЯМР (75 МГц, ДМСО-d6) δ: 165,8, 168,8, 169,9, 172,2 и 172,4 (углероды амидиногруппы и карбонила).
MC: m/z 500 (M+ + 1).
Пример 32
MeOOC-CH2-CO-(R)Cha-Pic-Pab
См. выше Пример 31 (II)
Пример 33
H2N-CO-CH2(R)Cha-Pic-Pab
(1) H2N-CO-CH2(R)Cha-Pic-Pab (Z)
Предпринятая попытка алкилирования 455 мг (0,83 моля) H-(R)Cha-Pic-Pab (Z) (см. Пример 25), 80 мг (0,86 ммоля) хлорацетамида в 3 мл ацетонитрила в присутствии 395 мг (2,86 ммоля) карбоната калия с обработкой при 40oC ультразвуком, как оказалось, ведет к чрезвычайно замедленной реакции. Даже добавление 230 мг (2,6 ммоля) бромида лития, видимо, не увеличивает скорость реакции. Однако, добавление йодида лития и ультразвуковая обработка с нагреванием приводит согласно ТСХ к небольшим количествам продукта. Обработка добавлением воды, экстрагированием смесью этилацетат-толуол, сушкой органической фазы (MgSO4) и удалением растворителя в вакууме дает остаток, который подвергают колоночной хроматографии с применением в качестве элюента смеси MeOH-CH2Cl2 и получают 118 мг (24%) целевого продукта.
(II) H2N-CO-CH2-(R)Cha-Pic-Pab • 2HCl
Раствор 118 мг (0,2 ммоля) H2N-CO-CH2-(R)Cha-Pic-Pab (Z) в 10 мл 95%-ного этанола гидрируют 2 ч в присутствии 143 мг 10% Pd-C. Смесь разбавляют дистиллированной водой и соляной кислотой и фильтруют через гайфло. Сушка вымораживанием дает 26 мг (24%) целевого продукта.
1H-ЯМР (300 МГц, CD3OD) δ: 0,9-1,1 (м, 2H), 1,1-1,9 (м, 16H), 2,3 (д, 1H), 3,4 (т, 1H), 3,6 (AB-система, 2H), 3,8 (д, 2H), 4,35 (т, 1H), 4,5 (с, 2H), 5,2 (с, 1H), 7,55 (д, 2H), 7,8 (д, 2H).
Пример 34
Boc-(R)Cha-Pic-Pab
Раствор 10 мг (0,0,15 моля) Boc-(R)Cha-Pic-Pab (Z) (см. Пример 25) в 5 мл этанола гидрируют 4 ч в присутствии 38 мг 10% Pd-C. Удалением катализатора, фильтрованием и испарением растворителя в вакууме с последующим растворением остатка в воде и сушкой вымораживанием получают 7,6 мг (95%) продукта.
1H-ЯМР (300 МГц, CD3OD): 0,9-1,1 (м, 2H), 1,1-1,9 (м, 16H), 2,4 (д, 1H), 3,25 (т, 1H), 4 (д, 1H), 4,5 (AB-система, 2H), 4,5-4,6 (м, 1H), 5,25 (с, 1H), 7,45 (д, 2H), 7,75 (д, 2H).
Пример 35
Ac-(R)Cha-Pic-Pab • HCl
(I) Ac-(R)Cha-Pic-Pab (Z)
К смеси 0,37 г (0,68 ммоля) H-(R)Cha-Pic-Pab (Z) (см. Пример 25) и 0,19 г (1,35 ммоля) K2CO3 в 10 мл CH3CN при комнатной температуре добавляют 0,06 г (0,8 ммоля) ацетилхлорида. После перемешивания 30 минут при комнатной температуре растворитель удаляют в вакууме. Остаток растворяют в CH2Cl2 и промывают водой. Испарением и колоночной хроматографией с применением ступенчатого градиента CH2Cl2MeOH (99,9:0,1, 99,8:0,2, 99,6:0,4, 99,2:0,8 и 98,4: 1,6) получают 0,24 г (60%) продукта.
(II) Ac-(R)Cha-Pic-Pab • HCl
Ac-(R)Cha-Pic-Pab (Z) гидрируют над 5% Pd-C при атмосферном давлении. После фильтрования катализатора и испарения растворителя сырой продукт очищают ОФЖХ с применением в качестве элюента CH3CN-0,1 M NH4OAc (35:65). Удалением растворителя и избытка NH4OAc с последующей сушкой вымораживанием из 1 M HCl получают заглавное соединение.
1H-ЯМР (300 МГц, CD3OD) δ: 0,85-1,1 (м, 1H), 1,15-2 (м, 19H), 2,35-2,47 (м, 1H), 3,2-3,33 (м, 1H), 3,95-4,05 (м, 1H), 4,46-4,57 (ABX, 2H) 5,16-5,22 (м, 1H), 7,51 (д, 2H), 7,76 (д, 2H), 8,23 (м, 1H). Сигнал одного из протонов полностью экранируется сигналом растворителя.
13C-ЯМР (75 МГц, CD3OD) δ: 168,3, 172,5, 173,8, 175,1 (углероды амидиногруппы и карбонила).
MC: m/z 456 (M+ + 1).
Пример 36
Me-SO2-(R)Cha-Pic-Pab • HCl
(I) Me-SO2-(R)Cha-Pic-Pab (Z)
Раствор 48 мг (0,42 ммоля) метансульфонилхлорида в 0,5 мл хлористого метилена добавляют при 0oC к перемешиваемому раствору 209 мг (0,382 ммоля) H-(R)Cha-Pic-Pab (Z) (см. Пример 25) и 0,11 мл (0,763 ммоля) триэтиламина в 5 мл хлористого метилена. Реакционную смесь составляют на ночь нагреваться до комнатной температуры. Промыванием водой с последующей сушкой (Na2SO4) и испарением растворителя в вакууме получают остаток, который подвергают колоночной хроматографии с применением в качестве элюента смеси этилацетат-метанол (95:5), и получают 159 мг (67%) продукта.
(II) Me-SO2-(R)Cha-Pic-Pab • HCl
Раствор 150 мг (0,24 ммоля) Me-SO2-(R)Cha-Pic-Pab (Z) в 5 мл 95%-го этанола и 1 мл воды гидрируют 4 ч в присутствии 5% Pd-C. Удалением катализатора фильтрованием, добавлением 0,2 мл 1 М соляной кислоты и испарением растворителя в вакууме получают остаток, который растворяют в 2 мл воды, и сушкой вымораживанием получают 116 мг (86%) целевого продукта.
1H-ЯМР (500 МГц, CD3OD) δ: 0,9-1,1 (м, 2H), 1,15-1,85 (м, 15H), 1,9 (ш. д, 1H), 2,3 (ш. д, 1H), 2,85 (с, 3H), 3,35 (дт, 1H), 3,9 (ш. д, 1H), 4,45 (AB-система, 2H), 4,5-4,55 (м, 1H), 5,13 (дд, 1H), 7,5 (д, 2H), 7,75 (д, 2H).
13C-ЯМР (125 МГц, D2O) δ: 166,8, 173 и 174,6 (углероды амидиногруппы и карбонила).
Пример 37
H-(R)Cha-(R,S)бетаPic-Pab • 2HCl
(I) Вос-(R)Cha-(R,S)бетаPic-Pab (Z)
К перемешиваемому при -18oC раствору 1 г (2,6 ммоля) Вос-(R)Cha-(R, S)бетаPic-OH (см. раздел: получение исходных соединений), 1,28 г (10,5 ммоля) ДМАП, 0,74 г (2,6 (ммоля) H-Pab (Z) (см. раздел: получение исходных соединений) в 15 мл ДМФА добавляют ЭДК. Реакционную смесь оставляют на ночь нагреваться до комнатной температуры и затем растворитель удаляют в вакууме. Остаток растворяют в CH2Cl2, органический слой последовательно промывают 0,3 M KHSO4, раствором KHCO3 и рассолом. Сушкой (Na2SO4) и удалением растворителя получают остаток, который подвергают вытеснительной хроматографии с применением смеси гептан-этилацетат с 4% метанола в качестве элюента, и получают 0,74 г (44%) целевого продукта.
(II) H-(R)Cha-(R,S)бетаPic-Pab (Z)
В насыщенном HCl (г) этилацетате растворяют 0,68 г (1,05 ммоля) Вос-(R)Cha-(R, S)бетаPic-Pab (Z) и раствор перемешивают 1 ч при комнатной температуре. После добавления воды смесь подщелачивают K2CO3. Водную фазу экстрагируют этилацетатом и органическую фазу промывают водой и сушат (Na2SO4). Испарением получают 0,5 г (87%) целевого продукта.
(III) H-(R)Cha-(R,S)бетаPic-Pab • 2HCl
В 7 мл этанола растворяют 65 мг (0,19 ммоля) H-(R)Cha-(R,S)бетаPic-Pab (Z) и гидрируют 4 часа в присутствии 5% Pd-C. Удалением катализатора фильтрованием, испарением растворителя и сушкой вымораживанием из 1 М HCl и воды получают 41 мг (71%) целевого продукта.
1H-ЯМР (300 МГц, D2O, диастереомера (4:5) и ротамеры) δ: 0,8-2,16 (м, ), 2,5-2,77 (м, 3H), 3,13-3,43 (м, 3H), 3,68-3,94 (м, 1H), 4,18-4,41 (м, 1H), 4,41-4,52 (м, 3H), 7,46-7,57 (м, 2H), 7,72-7,83 (м, 2H).
Пример 38
HOOC-CH2-CH2-(R)Cha-(R, S)бетаPic-Pab • 2HCl
(I) BnOOC-CH2-CH2-(R)Cha-(R, S)бетаPic-Pab (Z)
В мл этанола растворяют 0,21 г (0,38 ммоля) H-(R)Cha-(R,S)-бетаPic-Pab (Z) (см. Пример 37), добавляют 0,68 г (0,42 ммоля) бензилакрилата и раствор перемешивают 5 дней. Испарением и колоночной хроматографией с CH2Cl2-MeOH (95:5) в качестве элюента получают 0,19 г (70%) целевого продукта.
(II) HOOC-CH2-CH2-(R)Cha-(R, S)бетаPic-Pab • 2HCl
В 10 мл этанола растворяют 170 мг (0,24 ммоля) BnOOC-CH2CH2-(R)Cha-(R, S)бетаPic-Pab (Z) и гидрируют 4 часа в присутствии 5% Pd-C. Удалением катализатора фильтрованием, испарением растворителя и сушкой вымораживанием из 1 М HCl и воды получают 103 мг (77%) целевого продукта.
1H-ЯМР (300 МГц, D2O, смесь 2 диастереомеров (4:5) и ротамеры) δ: 0,92-2,03 (м, H), 2,51-2,78 (м, 1H), 3,21-3,52 (м, 1H), 3,88-4,01 (м, 1H), 4,07-4,3 (м, 2H), 4,4-4,71 (м, 2H), 7,59 (д, 2H), 7,86 (д, 2H).
13C-ЯМР (300,13 МГц, D2O, смесь 2 диастереомеров (4:5) и ротамеры) δ: 167, 168, 168,1, 175,9, 176, 176,3, 176,4 и 178,2 (углероды амидиногруппы и карбонила).
Пример 39
HOOC-CH2-(R)Cha-Val-Pab • 2HCl
(I) Boc-(R)Cha-Val-Pab (Z)
К смеси 3,41 г (8,2 ммоля) Boc-(R)Cha-Val-OH (см. раздел: получение исходных соединений), 2,61 г (9,2 ммоля) H-Pab (Z) (см. раздел: получение исходных соединений) и 4,5 г (36,8 ммоля) ДМФА добавляют при -12oC 1,77 г (9,2 ммоля) ЭДК. Реакционную смесь оставляют на ночь нагреваться до комнатной температуры и обрабатывают разбавлением водой с последующим экстрагированием толуолом, эфиром и этилацетатом. Последующей сушкой (MgSO4) объединенных органических экстрактов, удалением растворителя в вакууме и колоночной хроматографией с CH2Cl2-MeOH в качестве элюента получают 2,77 г (47%) целевого продукта.
(II) H-(R)Cha-Val-Pab (Z)
Через раствор 2,77 г (4,4 ммоля) Boc-(R)Cha-Val-Pab (Z) в 75 мл этилацетата пробулькивают хлористый водород. Через 15 минут добавляют раствор карбоната натрия до pH 10 и водную фазу экстрагируют этилацетатом. Сушкой (карбонат калия) и удалением растворителя в вакууме получают 1,8 г (77%) H-(R)Cha-Val-Pab (Z).
(III) BnOOC-CH2-(R)Cha-Val-Pab (Z)
Смесь 326 мг (0,61 ммоля) H-(R)Cha-Val-Pab (Z), 105 мл (0,67 ммоля) бензилбромацетата и 252 мг (1,83 ммоля) карбоната калия в 2 мл ацетонитрила 2,5 ч обрабатывают ультразвуком при 40oC. Для растворения продукта добавляют дополнительное количество ацетонитрила, затем смесь фильтруют и растворитель удаляют в вакууме. Остаток очищают колоночной хроматографией с применением в качестве элюента смеси метанол-хлористый метилен. Кристаллизацией продукта из экстракта получают в итоге 124 мг (30%) бесцветных кристаллов.
(IV) HOOC-CH2-(R)Cha-Val-Pab • 2HCl
BnOOC-CH2-(R)Cha-Val-Pab (Z) (124 мг, 0,128 ммоля) в 20 мл этанола гидрируют 2 часа в присутствии 25 мг 10% Pd-C. После добавления 10 мл ТГФ гидрирование продолжают 2 часа при 50oC. Смесь фильтруют через гайфло и фильтровальный пирог промывают разбавленной соляной кислотой. Из объединенных фильтратов в вакууме удаляют органические растворители. Сушкой вымораживанием оставшегося раствора получают 55 мг (50%) целевого соединения.
1H-ЯМР (500 МГц, D2O) δ: 0,75-1,4 (м, 12H), 1,5-1,9 (м, 7H), 2-2,15 (ш. с, 1H), 3,45 (AB-система, 2H), 4,1 (м, 2H), 4,5 (м, 2H), 7,5 (м, 2H), 7,7 (с, 2H), 8,9 (с, 1H).
Пример 40
HOOC-CH2-CH2-(R)Cha-Val-Pab • 2HCl
(I) H-(R)Cha-(R, S) Val-Pab (Z)
Заглавное соединение получено присоединением Boc-(R)Cha-Val-OH к H-Pab (Z) по методике присоединения пивалоила, приведенную для Boc-(R)Cha-Pic-OMe (см. раздел, получение исходных соединений). Происходит полная эпимеризация валина с образованием Boc-(R)Cha-(R, S) Val-Pab (Z). Удалением защитной Boc-группы по методике, приведенной для Boc-(R)Cha=Val-Pab (Z) (см. Пример 39), получают заглавное соединение.
(II) BnOOC-CH2-CH2-(R)Cha-(R, S) Val-Pab (Z)
Раствор 1,007 г (1,9 ммоля) H-(R)Cha-Val-Pab (Z) и 308 мг (1,9 ммоля) бензилакрилата в 3 мл этанола выдерживают примерно сутки при 40oC. Растворитель удаляют в вакууме и очисткой остатка колоночной хроматографией с применением в качестве элюента смеси метанол-хлористый метилен (10:90) получают 1,086 г (82%) заглавного соединения.
(III) HOOC-CH2-CH2-(R)Cha-Val-Pab (Z) • 2HCl
BnOOC-CH2-CH2-(R)Cha-(R, S) Val-Pab (Z) (1,086 г, 1,6 ммоля) в 25 мл ТГФ и 14 мл 0,5 М соляной кислоты гидрируют 2 часа в присутствии 233 мг 10% Pd-C. Удалением катализатора фильтрованием через целит и испарением ТГФ в вакууме с последующей сушкой вымораживанием оставшегося раствора получают остаток, примерно 300 мг которого подвергают ОФЖХ с применением в качестве элюента 25% ацетонитрила в 0,1 М аммонийацетатном буфере. Выделены две основные фракции, из которых вторая содержит заглавное соединение. В виде дигидрохлорида выделено 67 мг заглавного соединения.
1H-ЯМР (500 МГц, D2O) δ: 1-1,5 (м, 12H), 1,2-1,4 (м, 7H), 1,65-1,9 (м, 7H), 2,15-2,25 (м, 1H), 2,85 (т, 2H), 3,15-3,2 (м, 1H), 3,3-3,34 (м, 1H), 4,15-4,2 (м, 1H), 4,25 (д, 1H), 4,55-4,65 (AB-система, 2H), 7,5 (д, 2H), 7,85 (д, 2H).
13C-ЯМР (75 МГц, D2O) δ: 167, 169,8, 173,96 и 174,04 (углероды амидиногруппы и карбонила).
Пример 41
H-(R)-Hoc-Aze-Pab • 2HCl
(I) Boc-(R)Hoc-Aze-Pab (Z)
Получен по методике, приведенной для синтеза Boc(R)-Cha-Pic-Pab (Z) (см. Пример 25) с заменой Boc-(R)Cha-Pic-OH на Boc-(R)Hoc-Aze-OH (см. раздел: получение исходных соединений). Сырой продукт, подвергнутый колоночной хроматографии (толуол-EtOAc, 1:6), дает 0,32 г (37%) целевого продукта.
(II) H-(R)Hoc-Aze-Pab (Z)
Заглавное соединение с выходом 0,23 г (88%) получено обработкой Boc-(R)Hoc-Aze-Pab (Z) по методике, приведенной в Примере 25 для получения Boc-(R)Cha-Pic-Pab (Z).
(III) H-(R)Hoc-Aze-Pab • 2HCl
В 3 мл этанола растворяют 20 мг (0,037 ммоля) H-(R)Hoc-Aze-Pab (Z) и гидрируют 4 часа при атмосферном давлении в присутствии 5% Pd-C. Удалением катализатора фильтрованием, испарением растворителя и сушкой вымораживанием из 1 М HCl получают 11 мг (63%) целевого продукта.
1H-ЯМР (300,13 МГц, D2O, Смесь двух ротамеров, 3:1) δ: основной ротамер: 0,9-2,1 (м, 15H), 2,4-2,6 (м, H), 2,7-3 (м, 1H), 4,1-4,3 (м, 1H), 4,35-4,56 (м, 1H), 4,65 (с, 2H), 5-5,11 (м, 1H), 7,62 (д, 2H), 7,9 (д, 2H). Сигнал одного из протонов полностью экранирован H-O-D - сигналом.
Пример 42
HOOC-CH2-CH2-(R)Hoc-Aze-Pab • 2 ТФУК
(I) BnOOC-CH2-CH2-(R)Hoc-Aze-Pab (Z)
К раствору 0,2 г (0,37 ммоля) н-(R)Hoc-Aze-Pab (Z) (см. Пример 41) в 2 мл 95%-го этанола добавляют при комнатной температуре 0,067 г (0,41 ммоля) бензилакрилата и реакционную смесь оставляют на 5 дней при той же температуре. Растворитель удаляют в вакууме и очисткой остатка колоночной хроматографией (CH2Cl2-MeOH, 96:4) получают 0,16 г (62%) целевого продукта.
(II) HOOC-CH2-CH2-(R)Hoc-Aze-Pab • 2 ТФУК
В 10 мл этанола растворяют 160 мг (0,23 ммоля) BnOOC-CH2-CH2-(R)Hoc-AZe-Pab (Z) и гидрируют 3 часа при атмосферном давлении в присутствии 5% Pd на активированном угле. Удалением катализатора фильтрованием, испарением растворителями, сушкой вымораживанием из воды и ТФУК получают 120 мг (87%) целевого продукта.
1H-ЯМР (300,13 МГц, D2O, 2 ротамера, 3:1) основной ротамер δ: 0,9-1,9 (м, 13H), 1,94-2,16 (м, 2H), 2,38-2,55 (м, 1H), 2,7-2,97 (м, 3H), 3,2-3,44 (м, 2H), 4,16 (м, 1H), 4,35-4,58 (м, 2H), 4,65 (с, 2H), 5-5,12 (м, 1H), 7,63 (д, 2H), 7,87 (д, 2H).
13C-ЯМР (300,13 МГц, D2O) δ: 167,3, 168,7, 172,5 и 176,6 (углероды амидиногруппы и карбонила).
Пример 43
HOOC-CH2-(R, S)CH(COOH)-(R)Hoc-Pro-Pab • 2HCl
(I) Boc-(R)Hoc-Pro-Pab (Z)
Получен из Boc-(R)Hoc-Pro-OH (см раздел: получение исходных соединений) по методике, приведенной в Примере 25 для синтеза Boc-(R)Cha-Pic-Pab(Z). Колоночной хроматографией с применением в качестве элюента этилацетата получают 0,886 г (58%) заглавного соединения.
1H-ЯМР (300 МГц, CDCl3) δ: 0,7-0,95 (м, 2H), 0,95-2,1 (м, 27H (в нем же 1,2 (с, 9H)), 2,1-2,4 (м, 1H), 3,3 (м, 1H), 3,6-3,95 (м, 1H), 4-4,2 (м, 1H), 4,2-4,45 (м, 2H), 4,45-4,6 (д, 1H), 5,15 (кажущийся ш.с., 2H), 5,2-5,3 (д, 1H), 7,1-7,4 (м, 7H), 7,65 (м, 1H), 7,7-7,9 (д, 2H), 9,4 (ш.с, 1H).
13C-ЯМР (75 МГц, CDCl3) δ: 156,3, 164,6, 168,1, 171,4, и 172,4 (углероды амидиногруппы и карбонила).
(II) H-(R)Hoc-Pro-Pab (Z)
К 0,82 г (1,266 ммоля) Boc-(R)Hoc-Pro-Pab (Z) добавляют при 0oC 40 мл этилацетата, насыщенного хлористым водородом, и температуру оставляют повышаться до комнатной. Спустя 1,5 часа реакция еще не завершена, поэтому через реакционную смесь 5 минут пробулькивают хлористый водород. Растворитель испаряют, добавляют этилацетат и насыщенный раствор карбоната натрия и фазы разделяют. Органическую фазу промывают рассолом, сушат (Na2SO4) и испарением растворителя в вакууме получают заглавное соединение с почти количественным выходом.
1H-ЯМР (300 МГц, CDCl3) δ: 0,75-0,95 (м, 2H), 0,95-2,4 (м, 17H), 3,3-3,55 (м, 2H), 3,55-3,7 (м, 1H), 4,25-4,45 (м, 2H), 4,5-4,6 (м, 1H), 5,15 (с, 2H), 7,15-7,35 (м, 5H), 7,25-7,45 (м, 2H), 7,6-7,7 (м, 1H), 7,7-7,85 (д, 2H).
13C-ЯМР (75 МГц, CDCl3) δ: 164,5, 167,8, 171,4 и 175,3 (углероды амидиногруппы и карбонила).
(III) BnOOC-CH2-(R, S)CH(COOBn)-(R)Hoc-Pro-Pab (Z)
К 0,15 г (0,5 ммоля) бензилакрилата в 1,5 мл EtOH добавляют 0,273 г (0,498 ммоля) H-(R)Hoc-Pro-Pab (Z) и смесь перемешивают 10 дней при комнатной температуре. Растворитель удаляют в вакууме, остаток подвергают колоночной хроматографии с применением в качестве элюента этилацетата и получают 0,103 г (25%) BnOOC-CH2-(R, S)CH(COOBn)-(R)Hoc-Pro-Pab (Z).
1H-ЯМР (300 МГц, CDCl3) δ: 0,75-2,05 (м, 18H), 2,3-2,45 (м, 1H), 2,45-2,8 (м, 3H), 3,15-3,45 (м, 3H), 3,5-3,65 (м, 1H), 4,3-4,5 (м, 2H), 4,55-4,7 (м, 1H), 4,8 (с, 1H), 4,9-5,1 (м, 3H), 5,2 (с, 2H), 7,1-7,2 (м, 1H), 7,2-7,4 (м, 13H), 7,4-7,45 (д, 2H), 7,6-7,8 (м, 3H).
(IV) HOOC-CH2-(R, S)CH(COOH)-(R)Hoc-Pro-Pab • 2HCl
Раствор 103 мг (0,122 ммоля) BnOOC-CH2-(R, S)CH(COOBn)-(R)Hoc-Pro-Pab (Z) в 43 мл 99,5%-го этанола и 0,3 мл хлороформа гидрируют 2 ч в присутствии 111 мг 5% Pd-C. Удалением катализатора фильтрованием и испарением растворителя с последующим растворением в воде и сушкой вымораживанием обнаружена неполнота гидрирования. Гидрирование продолжают 5 часов в присутствии этанола, 1 н. HCl и 5% Pd-C.
Удалением катализатора фильтрованием и испарением растворителя с последующим растворением в воде и сушкой вымораживанием получают заглавное соединение.
1H-ЯМР (500 МГц, CD3OD, смесь двух диастереомеров) δ: 0,8-1 (м, 2H), 1,1-1,4 (м, 6H), 1,6-1,8 (м, 5H), 1,9-2,15 (м, 5H), 2,25-2,35 (м, 1H), 2,9-3,2 (м, 2H), 3,5-3,65 (м, 1H), 3,7-3,9 (2м, всего 1H), 4,15-4,4 (2, м, всего 1H), 4,4-4,6 (м, 4H), 7,5-7,6 (м, 2H), 7,7-7,85 (м, 2H).
13C-ЯМР (75 МГц, CDCl3) δ: 167,9, 168,2, 172,8, 173,6, 174,3 и 174,4 (углероды амидиногруппы и карбонила. Сигналы от двух диастереомеров частично перекрываются).
Пример 44
HOOC-CH2-(R)Hoc-Pic-Pab • 2HCl
(I) Boc-(R)Hoc-Pic-Pab (Z)
Получен из Boc-(R)Hoc-Pic-OH (см. раздел: получение исходных соединений) и H-Pab (Z) (см. раздел: получение исходных соединений) по методике, приведенной для синтеза Boc-(R)Cha-Pic-Pab (Z) (см. Пример 25). Колоночной хроматографией с применением в качестве элюента этилацетата получают 1,3 г (78%) заглавного соединения.
1H-ЯМР (300 МГц, CDCl3) δ: 0,75 - 0,95 (м, 2H), 0,95 - 2 (м, 31H (в нем же 1,3 (с, 9H)), 2,4 - 2,5 (м, 1H), 3 - 3,1 (м, 1H), 3,8 (м, 1H), 4,2 - 4,45 (м, 2H), 4,45 - 4,55 (м, 2H), 5,15 (кажущийся ш. с, 3H), 5,25 - 5,3 (м, 1H), 7 (ш. с, 1H), 7,15 - 7,5 (м, 7H), 7,7 - 7,85 (д, 2H), 9,45 (ш. с, 1H).
13C-ЯМР (75 МГц, CDCl3) δ: 156,6, 164,7, 168,1, 170 и 173 (углероды амидиногруппы и карбонила).
(II) H-(R)Hoc-Pic-Pab (Z)
К 1,3 г (1,96 ммоля) Boc-(R)Hoc-Pic-Pab (Z) добавляют при 0oC 100 мл насыщенного хлористым водородом этилацетата. Температуру оставляют повышаться до комнатной. Спустя 40 минут растворитель испаряют, добавляют этилацетат и насыщенный раствор карбоната натрия и фазы разделяют. Органическую фазу промывают рассолом, сушат (Na2SO4) и испарением растворителя в вакууме получают 0,85 г (77,5%) целевого продукта.
1H-ЯМР (300 МГц, CDCl3) δ: 0,75 - 0,95 (м, 2H), 1,05 - 2,3 (м, 25H), 3 - 3,15 (м, 1H), 3,6 - 3,75 (м, 2H), 4,25 - 4,4 (м, 2H), 5,15 (кажущийся ш.с. 3H), 7,05 - 7,2 (д, 2H), 7,2 - 7,35 (м, 4H), 7,35 - 7,4 (д, 1H), 7,6 - 7,8 (д, 2H).
13C-ЯМР (75 МГц, CDCl3) δ: 164,5, 167,9, 170,8 и 175,7 (углероды амидиногруппы и карбонила).
(III) BnOOC-CH2-(R)Hoc-Pic-Pab (Z)
К смеси 0,4 г (0,712 ммоля) H-(R)Hoc-Pic-Pab (Z) и 0,217 г (1,57 ммоля) K2CO3 в 7 мл ацетонитрила добавляют 0,171 г (0,748 ммоля) бензилбромацетата и смесь нагревают 1 ч на масляной бане при 60oC. После удаления растворителя добавляют этилацетат и воду. Фазы разделяют, органическую фазу промывают рассолом и сушат (Na2SO4). Испарением в вакууме получают 0,626 г остатка, который подвергают колоночной хроматографии с применением этилацетата в качестве элюента и получением 2 продуктов. Первым элюируемым с колонки соединением является (BnOOC-CH2)2-(R)Hoc-Pic-Pab (Z) (0,28 г), вторым с колонки элюируется заглавное соединение (0,27 г).
BnOOC-CH2(R)Hoc-Pic-Pab (Z)
1H-ЯМР (300 МГц, CDCl3) δ: 0,7 - 0,95 (м, 2H), 1 - 1,75 (м, 18H), 2,3 - 2,5 (м, 1 или 2H), 2,9 - 3,05 (м, 1H), 3,2 - 3,3 (м, 1H), 3,35 - 3,5 (м, 2H), 3,6 - 3,7 (м, 1H), 4,35, 4,55 (ABX-система, 2H), 4,75 (с, 2H) 5,15 (кажущийся с, 3H), 5,25 - 5,3 (м, 1H), 7,1 - 7,45 (м, 12H), 7,7 - 7,8 (д, 2H).
13C-ЯМР (75 МГц, CDCl3) δ: 164,6, 167,9, 170,5, 173,4 и 175 (углероды амидиногруппы и карбонила).
(IV) HOOC-CH2-(R)Hoc-Pic-Pab (Z) • 2HCl
Раствор 259 мг (0,365 ммоля) BnOOC-CH2-(R)Hoc-Pic-Pab (Z) в 7,8 мл этанола и 1,2 мл 1 н. соляной кислоты гидрируют 4 ч в присутствии 280 мг 5% Pd-C. Удалением катализатора фильтрованием и испарением растворителя с последующим растворением в воде и сушкой вымораживанием получают 170 мг (83%) заглавного соединения.
1H-ЯМР (300 МГц, CDCl3) δ: 0,4 - 1,85 (м, 20H), 1,85 - 2,2 (м, 1H), 2,9 - 3,2 (м, 1H), 3,4 - 3,9 (м, 3H), 3,05 - 4,3 (м, 2H), 4,3 - 5,05 (м, 2H), 7,1 - 7,4 (м, 2H), 7,4 - 7,7 (м, 2H).
13C-ЯМР (75 МГц, CDCl3) δ: 167,8, 168,6, 169,6 и 172,3 (углероды амидиногруппы и карбонила).
Пример 45
(HOOC-CH2)2-(R)Hoc-Pic-Pab • 2HCl
(1) (BnOOC-CH2)2-(R)Hoc-Pic-Pab (Z)
Заглавное соединение получено алкилированием H-(R)Hoc-Pic-Pab (Z) по методике вышеприведенного Примера 44.
1H-ЯМР (300 МГц, CDCl3) δ: 0,7 - 0,95 (м, -H), 0,95 - 1,95 (м, 18H), 2,35 - 2,5 (м, 1H), 2,9 - 3,05 (м, 1H), 3,5 - 3,85 (м, 6H), 4,35 - 4,55 (м, 2H), 4,9 (2 с, 4H), 5,2 (с, 2H), 5,25 - 5,35 (м, 1H), 7,1 - 7,45 (м, 16H), 7,5 - 7,65 (м, 1H), 7,7 - 7,85 (д, 2H).
13C-ЯМР (75 МГц, CDCl3) δ: 164,7, 167,9, 170,5, 172 и 172,4 (углероды амидиногруппы и карбонила).
(II) (HOOC-CH2)2-(R)Hoc-Pic-Pab • 2HCl
Раствор 153 мг (0,178 ммоля) (BnOOC-CH2)2-(R)Hoc-Pic-Pab (Z) в 4,5 мл этанола (99,5%) и 0,5 мл 1 н. соляной кислоты гидрируют 3,5 ч в присутствии 150 мг 5% Pd-C. Удалением катализатора фильтрованием и испарением растворителя с последующим растворением в воде и сушкой вымораживанием получают 109 мг (99%) дигидрохлорида (HOOC-CH2)2-(R)Hoc-Pic-Pab. Полученный сырой продукт (80% чистоты) подвергают ОФЖХ с применением CH3CN-0,1 M NH4OAc (1:4) в качестве элюента. Удалением растворителя и избытка NH4OAc с последующей сушкой вымораживанием из 1 M HCl получают заглавное соединение.
1H-ЯМР (500 МГц, D2O, смесь двух ротамеров) основной ротамер δ: 0,95 - 2,15 (м, 20H), 2,25 - 2,35 (м, 1H), 3,45 - 3,55 (м, 1H), 3,95 - 4,25 (м, 5H), 4,6 - 4,65 (м, 2H), 4,92 - 5,01 (м, 1H), 5,15 - 5,2 (м, 1H), 7,58 - 7,63 (д, 2H), 7,84 - 7,89 (д, 2H).
Разрешаемые сигналы, создаваемые меньшим ротамером, появляются при δ: 0,7 - 0,85 (м), 2,35 - 3,45 (м), 3,05 - 3,15 (м), 4,47 - 4,55 (м), 4,55 - 4,6 (м), 4,65 - 4,7 (м), 7,63 - 7,67 (д), 7,89 - 7,95 (д).
13C-ЯМР (75 МГц, D2O) δ: 168,2, 169,7, 170,2 и 172,71 (углероды амидиногруппы и карбонила).
Пример 46
(HOOC-CH2-(R)Pro(3-(S)Ph-Pro-Pab • 2HCl
(1) (Boc-(R)Pro-(3-(S)Ph)-Pro-Pab (Z)
К раствору 570 мг (1,5 ммоля) (Boc-(R)Pro(3-(S)Ph)-Pro-OH (см. раздел: получение исходных соединений), 425 мг (1,5 ммоля) H-Pab (Z) (см. раздел: получение исходных соединений) и 733 мг (6 ммолей) ДМАП в 25 мл CH3CN-ДМФА (1,5 - 1) добавляют 310 мг (1,62 ммоля) ЭДК и смесь перемешивают 23 ч при комнатной температуре. После удаления большей части растворителя к остатку добавляют 50 мл воды. Водную фазу экстрагируют EtOAc (1 х 75 мл и 2 х 50 мл). Объединенную органическую фазу промывают 1 M KHSO4 (1 х 20 мл + 1 х 10 мл), 15 мл NaHCO3 (водн. ), водой (3 х 15 мл) и 15 мл рассола и сушат (MgSO4). Фильтрованием и испарением растворителя получают 670 мл масла, которое очищают колоночной хроматографией с применением этилацетата в качестве элюента, и получают 529 мг (55%) заглавного соединения.
1H-ЯМР (300 МГц, CDCl3) δ: 1,26 (с, 9H), 1,53 - 1,88 (м, 3H), 2,1 - 2,31 (м, 3H), 2,52 (к, 1H), 3,58 - 3,77 (м, 4H), 4,31 (д, 1H), 4,35 и 4,47 (ABX-система, 2H), 4,65 (дд, 1H), 5,19 (с, 2H), 7,1 - 7,37 (м, 10H), 7,42 (д, 2H), 7,81 (д, 2H), 8 (т, 1H (NH)).
13C-ЯМР (75 МГц, CDCl3) δ: 154,6, 164,6, 168,1, 171,1 и 171,3 (углероды амидиногруппы и карбонила).
(II) H-(R)Pro-(3-(S)Ph-Pro-Pab-(Z)
В 15 мл EtOAc-HCl (г, насыщен) растворяют при комнатной температуре 529 мг (0,81 ммоля) Boc-(R)Pro-(3-(S)Ph)-Pro-Pab (Z) и перемешивают 3 часа. Растворитель испаряют и остаток растворяют в 70 мл CH2Cl2. Органическую фазу промывают 10 мл 2 M NaOH, 10 мл воды, 10 мл рассола и сушат (MgSO4). Фильтрованием и испарением растворителя получают 403 мг (90%) заглавного соединения.
1H-ЯМР (300 МГц, CDCl3) δ: 1,44 - 1,57 (м, 1H), 1,62 - 1,86 (м, 2H), 1,96 - 2,35 (м, 3H), 2,45 (к, 1H), 3,05 - 3,35 (м, 4H), 3,83 (ш. д, 1H), 4,25 - 4,45 (м, 2H), 4,53 (м, 1H), 5,19 (с, 2H), 7,16 - 7,37 (м, 10H), 7,42 (д, 2H), 7,66 (т, 1H, (NH)), 7,77 (д, 2H).
13C-ЯМР (75 МГц, CDCl3) δ: 164,4, 167,9, 171,1 и 173 (углероды амидиногруппы и карбонила).
(III) BnOOC-CH2-(R)Pro-(3-(S)Ph)-Pro-Pab (Z)
Смесь 200 мг (0,36 ммоля) H-(R)Pro(3-(S)Ph)-Pro-Pab (Z), 105 мг (0,46 ммоля) Br-CH2-COOBn и 125 мг (0,9 ммоля) K2CO3 в 10 мл CH3CN нагревают 1 ч и 30 минут при 50oC. Растворитель испаряют и остаток растворяют в 70 мл EtOAc. Органическую фазу промывают 10 мл воды и сушат (MgSO4).
Фильтрованием и испарением растворителя получают 260 мг масла. Очисткой сырого продукта колоночной хроматографией с применением ступенчатого градиента CH2Cl2-MeOH(NH3-насыщен) (95:5, затем 9:1) получают 182 мг (72%) заглавного соединения в виде белого твердого вещества.
1H-ЯМР (300 МГц, CDCl3) δ: 1,43 - 1,82 (м, 1H), 1,96 - 2,13 (м, 1H), 2,13 - 2,22 (м, 1H), 2,26 - 2,43 (м, 2H), 3,02 - 3,14 (м, 2H), 3,24 - 3,51 (м, 4H), 3,83 (д, 1H), 4,29 - 4,46 (ABX-система с центром при 4,37, 2H), 4,58 (дд, 1H), 4,97 - 5,1 (AB-система с центром при 5,03, 2H), 5,19 (с, 2H), 7,16 - 7,38 (м, 15H), 7,43 (д, 2H), 7,5 - 7,8 (м, 3H, одна NH-группа).
13C-ЯМР (75 МГц, CDCl3) δ: 164,5, 167,9, 171,15, 171,2 и 172,7 (углероды амидиногруппы и карбонила).
(IV) HOOC-CH2-(R)Pro(3-(S)-Ph)-Pro-Pab • 2HCl
BnOOC-CH2-(R)Pro(3-(S)Ph)-Pro-Pab (Z) (0,18 г, 0,26 ммоля) смешивают с 0,075 г 5% Pd-C, 1 мл 1 н. раствора HCl, 1 мл воды и 10 мл этанола и смесь гидрируют один час при атмосферном давлении. Фильтрованием катализатора через гайфло, испарением растворителя с последующей двукратной сушкой вымораживанием из воды получают 129 мг сырого продукта. Сырой продукт очищают ОФЖХ с применением ступенчатого градиента 0,1 M NH4OAc-CH3CN (4:1, затем 3:1). Испарением с последующей сушкой вымораживанием из воды и 1 н. раствора HCl получают 70 мг (50%) чистого продукта.
1H-ЯМР (300 МГц, D2O) δ: 1,42 - 1,6 (м, 1H), 1,65 - 1,83 (м, 1H), 1,83 - 1,98 (м, 1H), 2,03 - 2,2 (м, 2H), 2,63 (т, 2H), 3,28 - 3,4 (м, 1H), 3,55 - 3,78 (м, 2H), 3,81 - 3,96 (AB-система с центром при δ 3,88, 2H), 4,06 - 4,19 (м, 1H), 4,37 - 4,61 (AB- система с центром при δ 4,49, 2H), 4,48 (дд, 1H), 4,7 (д, 1H), 7,35 - 7,98 (м, 7H), 7,74 (д, 2H).
13C-ЯМР (75 МГц, CDCl3) δ: 167,02, 167,2, 169,3 и 174,4 (углероды амидиногруппы и карбонила).
Пример 47
HOOC-CH2-CH2-(R)Pro(3-(S)Ph)-Pro-Pab • 2HCl
(1) BnOOC-CH2-CH2-(R)Pro(3-(S)Ph)-Pro-Pab (Z)
К раствору 190 мг (0,34 ммоля) H-(R)Pro(3-(S)Ph)-Pro-Pab (Z) (см. Пример 46) в 7 мл EtOH (99%) добавляют 114 мг (0,7 ммоля) бензилакрилата и реакционную смесь перемешивают 24 ч при комнатной температуре. Испарением растворителя с последующей колоночной хроматографией с применением ступенчатого градиента CH2Cl2-MeOH(NH3-насыщ. ) (95:5, затем 9:1) получают 202 мг (83%) заглавного соединения.
1H-ЯМР (300 МГц, CDCl3) δ: 1,5 - 1,71 (м, 2H), 1,74 - 1,9 (м, 1H), 1,9 - 2,05 (м, 1H), 2,2 - 2,64 (м, 5H), 2,69 - 2,82 (м, 2H), 2,84 - 2,96 (м, 1H), 3,18 - 3,48 (м, 4H), 4,28 - 4,44 (м, 2H), 4,61 (м, 1H), 4,48 - 5,08 (AB-система с центром при 5,03, 2H), 5,19 (с, 2H), 7,15 - 7,37 (м, 15H), 7,44 (д, 2H), 7,75 - 7,85 (м, 3H, одна NH-группа).
13C-ЯМР (75 МГц, CDCl3) δ: 164,6, 168, 171,2, 172,5 и 172,9 (углероды амидиногруппы и карбонила).
(II) HOOC-CH2-CH2-(R)Pro(3-(S)-Ph)-Pro-Pab • 2HCl
BnOOC-CH2-CH2-(R)Pro(3-(S)Ph)-Pro-Pab (Z) (0,2 г, 0,28 ммоля) смешивают с 0,075 г 5% Pd-C, 1 мл 1 н. раствора HCl, 1 мл воды и 10 мл этанола и смесь гидрируют один час при атмосферном давлении. Фильтрованием катализатора через гайфло, испарением растворителя с последующей двукратной сушкой вымораживанием из воды получают 125 мг (79%) заглавного соединения.
H-ЯМР (300 МГц, D2O) δ: 1,44 (м, 1H), 1,65 - 1,9 (м, 2H), 2-2,2 (м, 2H), 2,62 (к, 2H), 2,83 (т, 2H), 3,27-3,4 (м, 1H), 3,4 - 3,8 (м, 4H), 4-4,15 (м, 1H), 4,35-4,6 (м, 3H), 4,68 (д, 1H), 7,38-7,6 (м, 7H), 7,77 (д, 2H).
13C-ЯМР (75 МГц, CDCl3) δ: 166,2, 167,1, 174,1 и 174,2 (углероды амидиногруппы и карбонила).
Пример 48
HOOC-CH2-CH2-(R)Tic-Pro-Pab • 2HCl
(I) Boc-(R)Tic-Pro-Pab (Z)
Получен по методике, приведенной для синтеза Boc-(R)Cha-Pic-Pab (Z) (см. Пример 25), использованием Boc-(R)Tic-Pro-OH (см. раздел: получение исходных соединений) вместо Boc-(R)Cha-Pic-OH. Колоночный хроматографией с применением в качестве элюентов смеси гептан-EtOAc (4:1) и затем EtOAc получают 425 мг (37%) заглавного соединения.
1H-ЯМР (500 МГц, CDCl3) δ: 1,35 (с, 9H), 1,95-2,15 (м, 3H), 2,4 (м, 1H), 2,8 (м, 1H), 3,3 (м, 1H), 3,55 (м, 2H), 4,25-4,4 (два м, 2H), 4,55-4,7 (два м, 2H), 7,15-7,5 (м, 10H), 7,85 (д, 2H).
13C-ЯМР (75 МГц, CDCl3) δ: 164,6, 171,5 и 171,6 (углероды амидиногруппы и карбонила. Два пика, вероятно, перекрываются).
(II) H-(R)Tic-Pro-Pab (Z)
Boc-(R)Tic-Pro-Pab (Z) (379 мг, 0,59 ммоля) растворяют в EtOAc, насыщенным HCl (г) и перемешивают при комнатной температуре. Испарением растворителя получают в виде белого порошка 251 мг (79%) заглавного соединения.
1H-ЯМР (500 МГц, CDCl3) δ: 1,65-2,15 (два м, 7H), 2,45 (м, 1H), 2,75 (м, 1H), 2,9 (м, 1H), 3 (м, 1H), 3,25 (м, 1H), 3,55 (м, 1H), 3,85 (м, 1H), 4,35-4,55 (м, 2H), 4,75 (д, 1H), 4,9 (с, 1H), 5,25 (с, 2H), 6,8-7,45 (несколько м, 8H), 7,5 и 7,85 (два д, 4H).
13C-ЯМР (75 МГц, CDCl3) δ: 164,5, 171,3 и 172,7 (углероды амидиногруппы и карбонила. Два пика, вероятно, перекрываются).
(III) BnOOC-CH2-CH2-(R)Tic-Pro-Pab (Z)
Смесь H-(R)Tic-Pro-Pab (Z) (140 мг, 0,26 ммоля) и 63 мг (0,39 ммоля) бензилакрилата в EtOH (1,3 мл) выдерживают 48 ч при 20oC. Испарением растворителя и колоночной хроматографией с применением в качестве элюентов 50% EtOAc в гептане и затем 10% MeOH в EtOAc получают в виде белого твердого вещества 133 мг (73%) целевого продукта.
1H-ЯМР (500 МГц, CDCl3) δ: 1,75-2 (два м, 4H), 2,25 (м, 1H), 1,4-1,65 (м, 3H), 2,7-2,95 (два м, 4H), 3,05-3,2 (м, 2H), 3,9 (м, 1H), 4,45 (м, 2H), 4,65 (м, 1H), 5,1 (два д, 2H), 5,25 (с, 2H), 6,85 -7,45 (несколько м, 12H), 7,5 и 7,9 (два д, 4H).
13C-ЯМР (75 МГц, CDCl3) δ: 171,5, 171,9 и 172,1 (углероды амидиногруппы и карбонила. Два пика, вероятно, перекрываются).
(IV) HOOC-CH2-CH2-(R)Tic-Pro-Pab • 2HCl
BnOOC-CH2-CH2-(R)Tic-Pro-Pab (Z) (125 мг, 0,17 ммоля) гидрируют над 5% Pd-C с применением EtOH-HCl в качестве растворителя. Фильтрованием катализатора и сушкой вымораживанием получают 73 мг (77%) заглавного соединения.
1H-ЯМР (500 МГц, D2O) δ: 2,1-2,35 (два м, 3H), 2,6 (м, 1H), 2,95-3,1 (м, 2H), 3,25-3,5 (два м, 2H), 3,65 (м, 3H), 4,65 (с, 2H), 4,75 (м, 1H), 5,85 (с, 1H), 7,15-7,6 (три м, 4H), 7,6 и 7,85 (два д, 4H).
13C-ЯМР (75 МГц, D2O) δ: 166,9, 167,1 и 174,3 (углероды амидиногруппы и карбонила. Два пика, вероятно, перекрываются).
Пример 49
HOOC-CH2-CH2-(R)Cgl-Aze-Pig- • 2HCl
(I) Boc-(R)Cgl-Aze-Pig (Z)2
К смеси 0,623 г (1,83 ммоля) Boc-(R)Cgl-Aze-OH (см. раздел: получение исходных соединений), 0,816 г (1,92 ммоля) H-Pig(Z)2 (см. раздел: получение исходных соединений) и 0,89 г (7,3 ммоля) ДМАП в 10 мл дихлорметана добавляют 0,368 г (1,92 ммоля) ЭДК и смесь перемешивают примерно сутки. После разбавления смесь промывают 0,3 М KHSO4 и рассолом. Органический слой (Na2SO4) фильтруют и испарением получают 1,4 г сырого продукта. Очисткой колоночной хроматографией с применением этилацетата в качестве элюента получают 0,3 г (22%) чистого продукта.
(II) H-(R)Cgl-Aze-Pig (Z)2
Boc-(R)Cgl-Aze-Pig (Z)2 (0,3 г, 0,4 ммоля) смешивают с 10 мл дихлорметана и 2,5 мл трифторуксусуной кислоты и смесь перемешивают полтора часа. После растворения растворителя остаток растворяют в дихлорметане и дважды промывают 0,2 М раствором NaOH. Объединенный водный слой еще раз промывают дихлорметаном. Объединенный органический слой сушат (Na2SO4), фильтруют и после испарения получают 0,24 г (93%) целевого продукта.
1H-ЯМР (300 МГц, CDCl3, 339 K) δ: 0,9-1,9 (м, 15H), 1,94 (ш. д, 1H), 2,37-2,52 (м, 1H), 2,65-2,8 (м, 1H), 2,9-3,08 (м, 3H), 3,2 (т, 2H), 4,05 - 4,28 (м, 4H), 4,86 (дд, 1H), 5,16 (с, 4H), 7,2 - 7,42 (м, 10H), 7,98 (ш. с, NH).
(III) BnOOC-CH2-CH2-(R)Cgl-Aze-Pig (Z)2
К раствору 0,231 г (0,36 ммоля) продукта стадии (II) в 2 мл этанола добавляют 61 мкл (0,4 ммоля) бензилакрилата и реакционную смесь перемешивают пять дней при комнатной температуре. Испарением смеси и очисткой сырого продукта колоночной хроматографией с применением ступенчатого градиента CH2Cl2-MeOH (95:5, 90:10) в качестве элюента получают 0,218 г (75%) чистого продукта.
1H-ЯМР (300 МГц, CDCl3, 335 K) δ: 0,93 (ш. к, 1H), 1,02-1,85 (м, 14H), 1,94 (ш. д, 1H), 2,33-2,5 (м, 3H), 2,58-2,77 (м, 2H), 2,79-3,02 (м, 4H), 3,17 (т, 2H), 4-4,25 (м, 4H), 4,86 (дд, 1H), 5,11 (с, 2H), 5,12 (с, 4H), 7,2-7,4 (м, 15H), 8,03 (ш. с, NH), 10,35 (ш. с, NH).
(IV) HOOC-CH2-CH2-(R)Cgl-Aze-Pig • 2HCl
BnOOC-CH2-CH2-(R)Cgl-Aze-Pig(Z)2 (0,218 г, 0,27 ммоля) смешивают с 0,1 г 5% Pd-C, 1 мл 1 M раствора HCl, 1 мл воды и 10 мл этанола и смесь гидрируют один час при атмосферном давлении. Фильтрованием катализатора через гайфло, испарением растворителя с последующей двукратной сушкой вымораживанием из воды получают 134 мг (95%) заглавного соединения.
1H-ЯМР (300 МГц, D2O) δ: 1-1,4 (м, 7H), 1,55-2,05 (м, 9H), 2,22-2,34 (м, 1H), 2,61-2,74 (м, 1H), 2,88 (т, 2H), 3,08 (ш. т, 2H), 3,19 (д, 2H), 3,34 (м, 2H), 3,83 (ш. д, 2H), 3,95 (д, 1H), 4,29-4,49 (м, 2H), 4,9 (дд, 1H).
13C-ЯМР (75 МГц, D2O) δ: 156,4, 167,6, 172,1 и 174,7 (углероды амидиногруппы и карбонила).
Пример 50
HOOC-CH2-(R)Cgl-Pro-Pig • 2HCl
(I) Boc-(R)Cgl-Pro-Pig (Z)2
К смеси 1 г (2,96 ммоля) Boc-(R)Cgl-Pro-OH (см. раздел: получение исходных соединений), 1,197 г (2,82 ммоля) H-Pig(Z)2 (см. раздел: получение исходных соединений) и 1,38 г (11,28 ммоля) ДМАП в ацетонитриле добавляют при -15oC 0,568 г (2,96 ммоля) ЭДК. Смесь оставляют на ночь нагреваться до комнатной температуры. После испарения растворителя в вакууме добавляют хлористый метилен и 1 M KHSO4. Фазы разделяют, органическую фазу промывают насыщенным раствором NaHCO3, водой и рассолом, сушат (Na2SO4) и испарением растворителя получают 2,033 г остатка, который подвергают колоночной хроматографии с применением этилацетата в качестве элюента. Хроматографией выделено два продукта: 720 мг (34%) заглавного соединения, элюирующего с колонки первым, с последующим элюированием 775 мг (44%) Boc-(R)Cgl-Pro-Pig (Z), образовавшегося за счет потери одной защитной Z-группы.
1H-ЯМР (300 МГц, CDCl3) δ: 0,85 - 2,1 (м, 19H), 2,3-2,45 (м, 1H), 2,8-3,2 (м, 4H), 3,45-3,55 (м, 1H), 3,55 - 3,65 (м, меньший ротаметр), 3,8 - 3,93 (м, 1H), 3,97 - 4,1 (м, 1H), 4,52-4,62 (д, 1H), 5,1 (кажущийся с, 5H), 7,12-7,41 (м, 10H).
Отдельные сигналы особенно пиперидинового цикла избирательно шире вследствие процесса внтуримолекулярного взаимодействия. Это особенно заметно для 2- и 6-CH2-групп пиперидинового цикла, дающих широкий пик в интервале 3,5-4,5 част/млн.
13C-ЯМР (75 МГц, CDCl3) δ: 155,2, 156,3, 171 и 172,1 (углероды пиперидиногруппы и карбонила).
(II) H-(R)Cgl-Pro-Pig (Z)2
В 35 мл ТФУК-CH2Cl2 (1:4) растворяют 720 мг (0,946 ммоля) Boc-(R)Cgl-Pro-Pig (Z)2 и перемешивают 30 минут. Растворитель удаляют в вакууме, после чего добавляют этилацетат и 2 M NaOH. Органический слой промывают водой и рассолом, сушат (Na2SO4) и испарением растворителя в вакууме с количественным выходом получают заглавное соединение.
1H-ЯМР (300 МГц, CDCl3) δ: 0,8-2,15 (м, 19H), 2,22 - 2,4 (м, 1H), 2,75 - 2,98 (м, 2H), 2,98 - 3,18 (м, 2H), 3,18-3,35 (м, 1H), 3,35-3,5 (к, 1H), 3,5-3,7 (м, 1H), 4,52-4,58 (д, 1H), 5,1 (с, 1H), 7,1-7,5 (м, 10H).
Отдельные сигналы, в особенности пиперидинового цикла, избирательно шире вследствие процесса внутримолекулярного обмена. Это особенно заметно для 2- и 6-CH2-групп пиперидинового цикла, дающих широкий пик в интервале 3,5-4,5 част./млн.
13C-ЯМР (75 МГц, CDCl3) δ: 154,96, 171,31, 174,82 (углероды амидиногруппы и карбонила).
(III) BnOOC-CH2-(R)Cgl-Pro-Pig (Z)2
К смеси 0,64 г (0,999 ммоля) H-(R)Cgl-Pro-Pig (Z)2 и 0,531 г (2,996 ммоля) K2CO3 в 6,4 мл ацетонитрила добавляют 0,298 г (0,999 ммоля) BnOOC-CH2-OTf ( см. раздел: получение исходных соединений) и нагревают до кипения. Спустя 1 ч 20 мин смесь промывают водой, сушат (Na2SO4) и испарением растворителя в вакууме получают 729 мг остатка, который подвергают колоночной хроматографии с применением в качестве элюента этилацетата. В результате получают два продукта: 120 мг (BnOOC-CH2)2-(R)Cgl-Pro-Pig (Z)2, элюирующегося в колонки первым, и 142 мг (18%) заглавного соединения.
1H-ЯМР (300 МГц, CDCl3) δ: 0,94-2,27 (м, 19H), 2,28-2,43 (м, 1H), 2,8-2,98 (м, 2H), 2,98-3,06 (м, 1H), 3,06-3,15 (д, 1H), 3,15-3,25 (м, 1H), 3,3-3,5 (м, 4H), 4,5-4,61 (д, 1H), 5,1 (с, 6H), 7,1-7,6 (м, 15H), 10,52 (ш. с, 1H).
Отдельные сигналы, в особенности пиперидинового цикла, избирательно уширены вследствие процесса внутримолекулярного обмена. Это особенно заметно для 2- и 6-CH2-групп пиперидинового цикла, дающих широкий пик в интервале 3,5-4,6 ч/млн.
(IV) HOOC-CH2-(R)Cgl-Pro-Pig • 2HCl
BnOOC-CH2-(R)Cgl-Pro-Pig (Z)2 (142 мг, 0,176 ммоля) гидрируют в присутствии 0,88 мл 1 М соляной кислоты, 10 мл этанола (99,5%) и 180 мг 5% Pd-C в течение 2 ч. Удалением катализатора фильтрованием через гайфло и милипористый фильтр с последующим испарением растворителя в вакууме и сушкой вымораживанием получают 95 мг HOOC-CH2-(R)Cgl-Pro-Pig • 2HCl. Полученный сырой продукт (79% чистоты) очищают ОФЖХ с применением CH3CN-0,1 M NH4OAc (15:85) в качестве элюента. Удалением растворителя и избытка NH4OAc, сушкой вымораживанием, превращением в соль соляной кислоты путем растворения в 1М соляной кислоте с последующей сушкой вымораживанием получают заглавное соединение.
1H-ЯМР (500 МГц, D2O) δ: 1,1-1,35 (м, 6Н), 1,63-2,14 (м, 13H), 2,26-2,36 (м, 1H), 3,01-3,23 (м, 4H), 3,49-3,62 (к, 2H), 3,62-3,77 (м, 2H), 3,77-3,88 (кажущийся д, 2H), 4,18-4,32 (д, 1H), 4,37-4,5 (м, 1H).
Пример 51
H-(R)Cha-Aze-Pig- • 2HCl
(I) Boc-(R)Cha-Aze-Pig (Z)2
К хорошо перемешиваемой смеси 86 мг (0,243 ммоля) Boc-(R)Cha-Aze-OH (см. Раздел: получение исходных соединений), 100 мг (0,236 ммоля) H-Pig (Z)2 (см. раздел: получение исходных соединений) и 115 мг (0,944 ммоля) ДМАР в 5 мл CH3CN добавляют 50 мг (0,26 ммоля) ЭДК и реакционную смесь перемешивают 20 ч при комнатной температуре. Растворитель испаряют, остаток растворяют в 70 мл EtOAc, органическую фазу промывают 1М KHSO4 (3 х 5 мл), 5 мл KHCO3, водой (3 х 5 мл), 5 мл рассола и сушат (MgSO4). Фильтрованием и испарением растворителя получают 141 мг масла. Очисткой сырого продукта колоночной хроматографией (36 г SiO2) с применением ступенчатого градиента CH2Cl2-MeOH (97:3, затем 95:5) получают 43 мг (24%) заглавного соединения.
(II) H-(R)Cha-Aze-Pig (Z)2
Через смесь 43 мг (0,0565 ммоля) Boc-(R)Cha-Aze-Pig-(Z)2 и 10 мл этилацетата 5 минут пробулькивают хлористый водород. После испарения растворителя в вакууме добавляют этилацетат и 0,1 М раствор NaOH. Фазы разделяют, органическую фазу промывают водой и рассолом и сушат (Na2SO4). Испарением растворителя получают 38 мг продукта, который подвергают колоночной хроматографии с применением в качестве элюента 10% NH3-насыщенного метанола в этилацетате, и получают 28 мг целевого продукта.
1H-ЯМР (300 МГц, CDCl3) δ: 0,75-1,85 (м, 18H), 2,55-2,53 (м, 1H), 2,62-2,78 (м, 1H), 2,8-3 (м, 2H), 3-3,28 (м, 2H), 3,28-3,37 (м, 1H), 3,97-4,18 (м, 2H), 4,8-4,9 (м, 1H), 5,1 (с, 4H), 7,2-7,45 (м, 9H), 8,05-8,15 (м, 1H).
Отдельные сигналы, в особенности пиперидинового цикла, избирательно уширены вследствие процесса внутримолекулярного обмена. Это особенно заметно в случае 2- и 6-CH2-групп пиперидинового цикла, дающих широкий пик в интервале 3,7-4,5 ч/млн.
(III) H-(R)Cgl-Aze-Pig • 2HCl
Раствор 28 мг (0,042 ммоля) H-(R)Cgl-Aze-Pig (Z)2 в 2 мл этанола (99,5%) и 0,13 мл 1 н. соляной кислоты гидрируют 4 ч в присутствии 35 мг 5% Pd-C. Удалением катализатора фильтрованием и испарением растворителя в вакууме с последующим растворением в воде сушкой вымораживанием получают 12 мг (60%) H-(R)Cgl-Aze-Pig дигидрохлорид.
1H-ЯМР (500 МГц, 300 К, CD3OD) δ: 0,75-2,1 (м, 18H), 2,2-2,35 (м, 1H), 2,62-2,75 (м, 1H), 3-3,12 (т, 2H), 3,12-3,23 (д, 2H), 3,85-3,95 (д, 2H), 3,95-4 (дд, 1H), 4,15-4,23 (м, 1H) 4,35-4,42 (м, 1H), 4,72-4,78 (м, 1H).
Отдельные сигналы, в особенности пиперидинового цикла, избирательно уширены вследствие процесса внутримолекулярного обмена. Это особенно заметно в случае 2- и 6-CH2-групп пиперидинового цикла, дающих широкий пик в интервале 3,7-4,5 част/млн.
13C-ЯМР (75 МГц, CD3OD) δ: 157,6 (гуанидиногруппа), 170 и 172,6 (углерод карбонила).
Пример 52
HOOC-CH2-(R)Cgl-Aze-Pac • 2HCl
(1) Boc-(R)Cgl-Aze-Pac (Z)
К раствору 0,47 г (1,4 ммоля) Boc-(R)Cgl-Aze-OH (см. раздел: получение исходных соединений), 0,4 г (1,4 ммоля) H-Pac (Z) (см. раздел: получение исходных соединений) и 0,67 г (5,5 ммоля) ДМАП в 5 мл ацетонитрила добавляют при 0oC 0,27 г ЭДК и смесь перемешивают примерно сутки при комнатной температуре, после чего разбавляют этилацетатом. Раствор промывают KHSO4 (водн. ) и NaHCO3 (водн.), сушат (Na2SO4), фильтруют и испаряют. Колоночной хроматографией с применением этилацетата и затем смеси этилацетат-метанол (98: 2) получают 0,25 г (30%) заглавного соединения в виде смеси 1,4-цис- и транс-изомеров относительно Pac-фрагмента молекулы.
1H-ЯМР (500 МГц, CDCl3) δ: 0,8-2 (м, 29H; в нем же 1,45 (с, 9H)), 2,15 и 2,34 (м, 1H, изомеры), 2,45-2,7 (м, 2H), 3-3,4 (м, 2H), 3,85 (м, 1H), 4,14 (м, 1H), 4,33 (м, 1H), 4,85 (м, 1H), 4,98 (м, 1H), 5,04 (с, 2H), 7,25-7,45 (м, 5H), 7,8-7,9 (м, 1H), 9,2-9,5 (м, 1H).
(II) H-(R)Cgl-Aze-Pac(Z) • HCl
В 100 мл этилацетата растворяют 0,25 г (0,41 ммоля) Boc-(R)Cgl-Aze-Pac(Z) и охлаждают в бане со льдом. Через раствор 5 мин пробулькивают HCl (г) и растворитель испаряют.
1H-ЯМР (300 МГц, MeOD) δ: 0,8-2 (м, 22H), 2,05-2,35 (м, 1H), 2,4-2,55 (м, 1H), 2,6-2,75 (м, 1H), 3 (д, 1H), 3,05 и 3,37 (мультиплеты, 0,6H и 0,4 H соответственно, изомеры), 3,15-3,3 (м, 1H), 4,05-4,2 (м, 2H), 4,88 (дд, 1H), 5,11 (с, 2H), 7,2-7,45 (м, 5H), 8-8,15 (м, 1H).
(III) BnOOC-CH2-(R)Cgl-Aze-Pac (Z)
Смесь 0,17 г (0,33 ммоля) H-(R)Cgl-Aze-Pac(Z) • HCl, 0,11 г (0,37 ммоля) бензилтрифторацетата и 0,14 г (1 ммоль) K2CO3 в 5 мл ацетонитрила перемешивают три дня при комнатной температуре. Сырой продукт подвергают колоночной хроматографии с элюированием смесью EtOAc-CH2Cl2-MeOH (95:20:5). Выход 70 мг (32%).
1H-ЯМР (500 МГц, CDCl3) δ: 0,85-2,3 (м, 20H), 2,48 (м, 1H), 2,63 (м, 1H), 2,87 (м, 1H), 3,05-3,25 (м, 1H), 3,25-3,35 (м, 2H), 3,38 (дд, 1H), 3,95 (м, 1H), 4,08 (м, 1H), 4,88 (м, 1H), 5,1-5,2 (м, 4H), 5,9-6,3 (м, 1H), 7,25-7,5 (м, 10H), 8-8,08 (широкие триплеты, 1H, изомеры).
(III) HOOC-CH2-(R)Cgl-Aze-Pac(Z) • 2HCl
К раствору 70 мг (0,11 ммоля) BnOOC-CH2-(R)Cgl-Aze-Pac(Z) в 5 мл этанола добавляют 5% Pd-C и 0,1 мл конц. HCl и смесь гидрируют 1 ч при атмосферном давлении. После фильтрования и испарения продукт очищают препаративной ОФЖХ с применением 0,1 M NH4OAc-CH3CN в качестве элюента. После замены соли гидрохлоридом и сушки вымораживанием заглавное соединение получено в виде смеси 1,4-цис и транс-изомеров (45:55) относительно Рас-фрагмента молекулы. Выход 40 мг (74%).
1H-ЯМР (500 МГц, D2O) δ: 1,1-2,1 (м, 20H), 2,32 (м, 1H), 2,52 (м, 1H), 2,63 (м, 1H), 2,72 (м, 1H), 3,1-3,3 (м, 1H), 3,4 (м, 1H), 3,8-3,95 (м, 2H), 4,04 (д, 1H), 4,39 (м, 1H), 4,93 (м, 1H).
13C-ЯМР (125 МГц, D2O) δ: 167,7, 172, 174,9 и 175,2 (углероды амидиногруппы и карбонила),
Пример 53
H-(R)Cha-Pro-Pac • 2HCl
(I) Boc-(R)Cha-Pro-Pac (Z)
К перемешиваемому при 0oC раствору 0,4 г (1,1 ммоля) H-Pac(Z) • 2HCl (см. раздел: получение исходных соединений), 0,4 г (1,1 ммоля) Boc-(R)Cha-Pro-OH (см. раздел: получение исходных соединений) и 0,55 г ДМАП в 7 мл ацетонитрила добавляют 211 мг (1,1 ммоля) ЭДК. Реакционную смесь перемешивают 1 ч при 0oC и 2 ч при комнатной температуре. После удаления растворителя в вакууме остаток разбавляют этилацетатом и водой. Органическую фазу промывают уксусной кислотой, водой и раствором гидрокарбоната натрия и сушат (MgSO4). Удалением растворителя в вакууме получают остаток, который очищают колоночной хроматографией с применением в качестве элюента этилацетата, и получают 196 мг (27%) заглавного соединения.
H-(R)Cha-Pro-Pac (Z)
Через раствор 196 мг Boc-(R)Cha-Pro-Pac (Z) в 25 мл этилацетата пробулькивают хлористый водород. Спустя 10 минут реакционную смесь разбавляют хлористым метиленом и затем добавляют раствор гидроксида натрия. Водную фазу несколько раз экстрагируют хлористым метиленом, объединенные органические фазы сушат (K2CO3) и удалением растворителя в вакууме получают 86 мг (52%) заглавного соединения.
(III) H-(R)Cha-Pro-Pac • 2HCl
Заглавное соединение получено гидрированием H-(R)Cha-Pro-Pac(Z) в этаноле в присутствии 10% Pd-C.
1H-ЯМР (300 МГц, D2O, смесь 1,4-цис и транс-изомеров в Pac фрагменте молекулы, прим. 1:1) δ: 1,15 -1,3 (к), 1,6-1,85 (м), 1,9-2 (м), 2-2,1 (д), 2,1-2,15, 2,15-2,2 (м), 2,65-2,7 (м), 2,7-2,8 (м), 2,95-3 (д), 3,15-3,2 (д), 5,4 (с), 7,45-7,55 (м).
Пример 54
H-(R)Cgl-Ile-Pab • 2HCl
(I) Boc-(R)Cgl-Ile-Pab (Z)
К перемешиваемой при +5oC смеси 1,33 г (3,6 ммоля) Boc-(R)Cgl-Ile-OH (см. раздел: получение исходных соединений), 1,12 г (3,9 ммоля) H-Pab (Z) (см. раздел: получение исходных соединений) и 1,76 г (14,4 ммоля) ДМАП в 50 мл CH3CN-ДМФА (1:1) добавляют 0,75 г (3,9 ммоля) ЭДК. Реакционную смесь оставляют нагреваться до комнатной температуры и выдерживают 60 ч. После испарения CH3CN остаток переносят в 100 мл воды (образуется желтый осадок). Смесь экстрагируют EtOAc (2 х 50 мл), объединенную органическую фазу промывают насыщенным раствором NaHCO3 (2 х 30 мл), 0,2 М HCl (2 x 50 мл), 50 мл рассола и сушат (MgSO4). Испарением с последующей колоночной хроматографией с применением CH2Cl2-ТГФ (85:15) в качестве элюента получают 510 мг (24%) заглавного соединения.
(II) H-(R)Cgl-Ile-Pab (Z)
В 14 мл CH2Cl2-ТФУК (2,5:1) растворяют 530 мг Boc-(R)Cgl-Ile-Pab (Z) и перемешивают 2 ч при комнатной температуре. Испарением растворителя с последующей колоночной хроматографией с применением CH2Cl2-MeOH(NH3-насыщен.) (95:5) в качестве элюента получают заглавное соединение.
(III) H-(R)Cgl-Ile-Pab • 2HCl
H-(R)Cgl-Ile-Pab (Z) (75 мг, 0,15 ммоля) гидрируют 6 ч при атмосферном давлении над 10% Pd-C в 5 мл этанола, содержащего для образования дигидрохлорида избыток HCl (г). Добавлением 2 г активированного угля и 20 мл EtOH с последующим фильтрованием через целлит, испарением растворителя и сушкой вымораживанием из воды получают в виде белого порошка 50 мг (89%) заглавного соединения.
1H-ЯМР (500 МГц, MeOD) δ: 0,9 (т, 3H), 0,94 (д, 3H), 1,1-2 (м, 14H), 3,83 (ш, с, 1H), 4,26 (д, 1H), 4,5 (м, 2H), 7,57 (ш, д, 2H), 7,78 (ш, д, 2H).
Пример 55
H-(R)Cgl-Aze-Pab
Гидрированием 257 мг (5,08 ммоля) H-(R)Cgl-Aze-Pab (Z) (см. Пример 1 (11)) 6 ч при атмосферном давлении над 5% Pd-C в 6 мл водного этанола с последующим фильтрованием катализатора, испарением растворителя и сушкой вымораживанием из воды получают 200 мг (89%) заглавного соединения.
1H-ЯМР (500 МГц, D2O) δ: 1-2 (м, 11H), 2,25 (м, 1H), 2,7 (м, 1H), 3,3 (м, 1H), 3,75 (м, 1H), 4,3 (м, 1H), 4,45 (м, 1H), 4,55 (м, 2H), 7,6 (м, 2H), 7,77 (м, 2H).
MC: m/z 372 (M++1).
Пример 56
HOOC-(R,S)CH(Me)-(R)Cha-Pro-Pab • HOAc
(I) BnOOC-(R,S)CH(Me)-(R)Cha-Pro-Pab (Z)
К охлажденному до -10oC раствору 0,25 г (0,47 ммоля) H-(R)Cha-Pro-Pab (Z) (см. пример 15) в 5 мл CH2Cl2 медленно прибавляют раствор 150 мг (0,48 ммоля) TfOCH2COOBn (см. раздел: получение исходных соединений) в 3 мл CH2Cl2. После добавления 200 мг (1,45 ммоля) карбоната калия смесь перемешивают 20 ч при комнатной температуре. Затем смесь разбавляют CH2Cl2, промывают водой и сушат (MgSO4). Испарением растворителя с последующей колоночной хроматографией с применением CH2Cl2-MeOH (9:1) в качестве элюента получают 150 мг (46%) заглавного соединения.
(II) HOOC-(R,S)CH(Me)-(R)Cha-Pro-Pab • HOAc
BnOOC-(R, S)CH(Me)-(R)Cha-Pro-Pab (Z) (150 мг, 0,2 ммоля) гидрируют 4 ч при атмосферном давлении над 50 мг 5% Pd-C в 20 мл EtOH. Фильтрованием катализатора, испарением растворителя и последующей очисткой ОФЖХ с применением CH3CN-0,1 М NH4OAc (1:4) в качестве элюента получают 35 мг (37%) заглавного соединения.
1H-ЯМР (500 МГц, MeOD) δ: 1 (м, 1H), 1,2-1,45 (м, 5H), 1,5 (м, 1H), 1,6-1,8 (м, 6H), 1,9-2,1 (м, 6H), 2,25 (м, 1H), 3,25 (м, 1H), 3,5 (м, 1H), 3,85 (м, 1H), 4,15 (м, 1H), 4,35-4,6 (м, 3H), 4,9 (м, частично экранирован HO-линией, 6H), 7,55 (д, 2H), 7,75 (д, 2H).
Пример 57
MeOOC-CH2-(R)Cgl-Aze-Pab • 2HCl
(I) MeOOC-CH2-(R)Cgl-Aze-Pab (Z)
Раствор 0,186 г (0,841 ммоля) TfO-CH2-COOMe (см. раздел: получение исходных соединений) в CH2Cl2 медленно прибавляют при комнатной температуре к смеси 0,425 г (0,841 ммоля) H-(R)Cgl-Aze-Pab (Z) (см. пример 1), 0,894 г (5,04 ммоля) K2CO3 в CH2Cl2 (в общей сложности 4,3 мл) и перемешивают примерно сутки. После внесения дополнительного количества CH2Cl2 смесь промывают водой и рассолом, сушат, фильтруют и испарением растворителя в вакууме получают остаток, который трижды подвергают колоночной хроматографии на силикагеле с применением в качестве элюентов следующих смесей: вначале CH2Cl2-ТГФ-MeOH (16: 4:1), затем CH2Cl2-ТГФ (2% NH3) (8:2) и наконец диэтиловый эфир-MeOH(NH3-насыщен) (95: 5). В результате получают 0,324 г (67%) заглавного соединения.
(II) MeOOC-CH2-(R)Cgl-Aze-Pab • 2HCl
MeOOC-CH2-(R)Cgl-Aze-Pab (Z) (220 мг, 0,38 ммоля) гидрируют в присутствии 1,14 мл 1 н. HCl, 6,5 мл MeOH и 300 мг Pd-C в течение 2 ч. Удалением катализатора, фильтрованием на целлите и милипористом фильтре с последующим испарением растворителя в вакууме и двукратной сушкой вымораживанием получают 178 мг (91%) заглавного соединения.
1H-ЯМР (500 МГц, D2O) δ: 1,12-1,4 (м, 5H), 1,68-1,81 (м, 2H), 1,81-1,9 (м, 3H), 1,97-2,1 (м, 1H), 2,29-2,4 (м, 1H), 2,68-2,8 (м, 1H), 3,86 (с, 3H), 4,1 (с, 2H), 4,1-4,5 (д, 1H), 4,36-4,42 (т, 2H), 4,59 (с, 2H), 4,99-5,04 (с, 1H), 7,65-7,7 (д, 2H), 7,8-7,85 (д, 2H).
13C-ЯМР (75 МГц, MeOD) δ: 146,78, 167,68, 168,15, 172,29 (углероды амидиногруппы и карбонила).
Пример 58
EtOOC-CH2-(R)Cgl-Aze-Pab • 2HCl
(I) EtOOC-CH2-(R)Cgl-Aze-Pab (Z)
TfO-CH2-COOEt (0,208 г, 0,876 ммоля) (см. раздел: получение исходных соединений) растворяют в CH2Cl2 и медленно прибавляют к охлаждаемой в бане со льдом смеси 0,443 мг (0,876 ммоля) H-(R)Cgl-Aze-Pab (Z) (см. пример 1) и 0,931 мг (5,26 ммоля) K2CO3 в CH2Cl2 (в общей сложности 4 мл). Спустя 2 ч баню убирают и перемешивание продолжают 2 ч пори комнатной температуре. После внесения дополнительного количества CH2Cl2 смесь промывают водой и рассолом, сушат, фильтруют и испарением растворителя в вакууме получают 0,51 г остатка, который подвергают колоночной хроматографии с применением в качестве элюента смеси диэтиловый эфир-метанол(NH3-насыщен.) (95:5). В результате получают 0,387 г (75%) заглавного соединения.
(II) EtOOC-CH2-(R)Cgl-Aze-Pab • 2HCl
EtOOC-CH2-(R)Cgl-Aze-Pab (Z) (395 мг, 0,668 ммоля) гидрируют 5 ч в присутствии 12 мл EtOH и 390 мг 5% Pd-C. Удалением катализатора фильтрованием через целлит и милипористый фильтр с последующим испарением растворителя в вакууме и двукратной с последующим испарением растворителя в вакууме и двукратной сушкой вымораживанием получают 281 мг (88%) EtOOC-CH2-(R)Cgl-Aze-Pab. После добавления 1 н. HCl и трехкратной сушки вымораживанием получают 288 мг (81%) заглавного соединения.
1H-ЯМР (500 МГц, D2O) δ: 1,05-1,48 (м, 8H), 1,6-2,05 (м, 6H), 2,15-2,33 (м, 1H), 2,58-2,79 (м, 1H), 3,89-4 (м, 3H), 4,2-4,33 (м, 3H), 4,33-4,44 (м, 1H), 4,44-4,66 (м, 2H), 4,91 (м, 1H (частично экранирован H-O-D-сигналом)), 7,54-7,63 (д, 2H), 7,72-7,84 (д, 2H).
Пример 59
н-BuOOC-CH2-(R)Cgl-Aze-Pab • HOAc
(I) н-BuOOC-CH2-(R)Cgl-Aze-Pab (Z)
Получен по методике, приведенной для синтеза н-HexOOC-CH2-(R)Cgl-Aze-Pab (Z) (см. пример 60 (1)), использованием Tf-O-CH2-Coo-н-Bu в качестве алкилирующего агента. Сырой продукт очищен двукратной колоночной хроматографией с применением в качестве элюента сначала CH2Cl2-MeOH (95:1) и затем смеси CH2Cl2-изопропиловый спирт (90:7). Получено 324 мг (47%) заглавного соединения.
(II) н-BuOOC-CH2-(R)Cgl-Aze-Pab • HOAc
Деблокирование осуществляют по методике, приведенной в примере 57 (II). Сырой продукт очищен ОФЖХ с применением в качестве элюента CH3CN в 0,05 М NH4OAc и 0,05 М HOAc. Получено 100 мг (53%) заглавного соединения.
1H-ЯМР (300 МГц, MeOD) δ: 0,85-2,1 (м, 18H), 2,15-2,37 (м, 1H), 2,58-2,8 (м, 1H), 3,7-5 (м, 10H), 4,88-5 (частично экранировано H-O-D-сигналом)), 7,46-7,65 (д, 2H), 7,71-7,88 (д, 2H).
13C-ЯМР (75 МГц, MeOD) δ: 146,8, 168,12, 168,2, 172,2 (углероды амидиногруппы и карбонила).
Пример 60
н-HexOOC-CH2-(R)Cgl-Aze-Pab • 2HCl
(I) н-HexOOC-CH2-(R)Cgl-Aze-Pab (Z)
TfO-CH2-COO-н-Hex (0,402 г, 1,375 ммоля) (см. раздел: получение исходных соединений) растворяют в CH2Cl2 и медленно прибавляют к охлаждаемой до температуры ниже -10oC смеси 0,695 г (1,375 ммоля) H-(R)Cgl-Aze-Pab (Z) (см. пример 1) и 1,463 г (8,25 ммоля) K2CO3 в CH2Cl2 (в общей сложности 4 мл). Через 1 ч баню с сухим льдом убирают и перемешивание продолжают 45 минут при комнатной температуре. После внесения дополнительного количества CH2Cl2 смесь промывают водой и рассолом, сушат, фильтруют и испарением растворителя в вакууме получают 0,828 г остатка, который подвергают двукратной колоночной хроматографии с применением вначале в качестве элюента смеси диэтиловый эфир-MeOH(NH3-насыщен) (95:5) и затем CH2Cl2-MeOH(NH3-насыщен) (95:5). В результате получают 0,42 г (47%) заглавного соединения.
(II) н-HexOOC-CH2-(R)Cgl-Aze-Pab • 2HCl
Гидрирование 400 мг (0,617 ммоля) н-HexOOC-CH2-(R)Cgl-Aze-Pab (Z) в присутствии 12 мл ТГФ и 400 мг Pd-C в течение 1,5 ч не дает полного деблокирования. Гидрирование завершается за 4 ч в присутствии 1,7 мл 1 н. HCl, 12 MeOH и 340 мг Pd-C. Удалением катализатора фильтрованием через целлит и милипористый фильтр с последующим испарением растворителя в вакууме и двукратной сушкой вымораживанием получают 287 мг (79%) заглавного соединения.
1H-ЯМР (300 МГц, MeOD) δ: 0,8-2,13 (м, 22H), 2,13-2,31 (м, 1H), 2,61-2,81 (м, 1H), 3,93-4,15 (м, 3H), 4,15-4,37 (м, 3H), 4,37-4,7 (м, 3H), 4,88-5 (м, 1H, частично экранирован H-O-D-сигналом)), 7,52-7,69 (д, 2H), 7,75-7,9 (д, 2H).
13C-ЯМР (75 МГц, MeOD) δ: 146,84, 167,67, 167,84, 172,17 (углероды амидиногруппы и карбонила).
Пример 61
H-(R)Cgl-Pro-Pac • 2HCl
(I) Boc-(R)Cgl-Pro-Pac (Z)
К перемешиваемому при 0oC раствору 708 мг (1,95 ммоля) Boc-(R)Cgl-Pro-OH (см. раздел: получение исходных соединений), H-Pac(Z) • 2HCl (см. раздел: получение исходных соединений) и 1,078 г (8,8 ммоля) ДМАП в 12,5 мл ацетонитрила добавляют 377 мг (1,87 ммоля) ЭДК. Реакционную смесь оставляют на ночь нагреваться до комнатной температуры. Растворитель удаляют в вакууме и остаток очищают вначале колоночной хроматографией с применением 10% метанола в хлористом метилене в качестве элюента и затем ОФЖХ. Выделены две фракции (51 мг и 150 мг), дающие МС: m/z 626 (M + 1).
(II) H-(R)Cgl-Pro-Pac (Z)
Через раствор 141 мг (0,22 ммоля) Boc-(R)Cgl-Pro-Pac (Z) в 50 мл этилацетата пробулькивают хлористый водород. Спустя 15 минут добавляют 10%-ный раствор карбоната натрия, органическую фазу отделяют и сушат (K2CO3). Испарение растворителя дает 71 мг (61%) целевого продукта.
(III) H-(R)Cgl-Pro-Pac • 2HCl
Смесь 71 мг (0,14 ммоля) H-(R)Cgl-Pro-Pac (Z) и взятого небольшим шпателем 10% Pd-C в 10 мл этанола гидрируют 2 ч при комнатной температуре и атмосферном давлении. Катализатор удаляют фильтрованием и растворитель испаряют в вакууме. Остаток растворяют в 50 мл воды и 0,6 г 1 М соляной кислоты. Сушкой вымораживанием получают 38 мг (58%) заглавного соединения.
МС: m/z 392 (M + 1).
Пример 62
HOOC-CH2-(R)Chal-Pro-Pac • HOAc
(I) BnOOC-CH2-(R)Cha-Pro-Pac (Z)
Смесь 84 мг (0,15 ммоля) H-(R)Cha-Pro-Pac (Z) (см. Пример 53 (II)), одного шпателя карбоната калия и 47 мг Tf-OCH2COOBn (см. раздел: получение исходных соединений) в 3 мл хлористого метилена перемешивают примерно сутки при комнатной температуре. Реакционную смесь фильтруют и удалением растворителя в вакууме получают остаток, который подвергают колоночной хроматографии с применением в качестве элюента смеси этилацетат-хлористый метилен-метанол (95:20:5). Выделено 29 мг целевого продукта.
(II) HOOC-CH2-(R)Cgl-Pro-Pac • HOAc
Смесь 29 мг BnOOC-CH2-(R)Cgl-Pro-Pac (Z) и 37 мг 10% Pd-C в 5 мл этанола перемешивают 4 ч при комнатной температуре и атмосферном давлении. Фильтрованием катализатора с последующим удалением растворителя и очисткой применением ОФЖХ получают целевое соединение.
МС: m/z 464 (M + 1).
Пример 63
HOOC-CH2-CH2-(R)Cgl-Pro-Pac
(I) BnOOC-CH2-CH2-(R)Cgl-Pro-Pac (Z)
Раствор 0,35 г (0,64 ммоля) H-(R)Cgl-Pro-Pac (Z) (см. пример 61 (11)), 124 мг (0,76 ммоля) бензилакрилата и 280 мкл (2 ммоля) триэтиламина в 1 мл этанола выдерживают 3 дня при комнатной температуре. Удалением растворителя с последующей очисткой с применением ОФЖХ получают 18 мг (4%) заглавного соединения.
(II) HOOC-CH2-CH2-(R)Cgl-Pro-Pac
Смесь 18 мг BnOOC-CH2-CH2-(R)Cgl-Pro-Pac (Z) и небольшого шпателька 10% Pd-C гидрируют 2 ч при комнатной температуре и атмосферном давлении в EtOH. Фильтрованием с последующим удалением растворителя в вакууме, растворением в воде и сушкой вымораживанием получают 7 мг (78%) заглавного соединения.
МС: m/z 464 (M + 1).
Пример 64
HOOC-CH2-CH2-(R)Cha-Aze-Pac
(I) Boc-(R)Cha-Aze-Pac (Z)
Раствор 0,4 г (1,38 ммоля) H-Pac (Z) (см. раздел: получение исходных соединений, синтез H-Pac (Z) • 2HCl), 0,5 г (1,41 ммоля) Boc-(R)Cha-Aze-OH (см. раздел: получение исходных соединений) и 0,67 г (5,5 ммоля) ДМАП в 20 мл ацетонитрила смешивают при 0oC с раствором 0,26 г (1,4 ммоля) ЭДК в 15 мл ацетонитрила. Реакционную смесь выдерживают примерно сутки при комнатной температуре и затем растворитель удаляют в вакууме. Остаток распределяют между этилацетатом и водой. Водную фазу еще раз экстрагируют этилацетатом и объединенные органические фазы промывают раствором гидросульфата натрия, раствором карбоната натрия, рассолом и затем сушат (сульфат натрия). Испарением растворителя получают 0,54 г (63%) заглавного соединения.
(II) H-(R)Cha-Aze-Pac (Z)
В раствор 0,54 г (0,9 ммоля) Boc-(R)Cha-Aze-Pac (Z) в этилацетате пробулькивают хлористый водород. Раствор оставляют на ночь в холодильнике, затем растворитель удаляют в вакууме и остаток растворяют в этилацетате. Раствор промывают водным гидрокарбонатом натрия, водой, рассолом и сушат (сульфат натрия). Удалением растворителя получают 0,35 г (77%) целевого продукта.
(III) BnOOC-CH2-CH2-(R)Cha-Aze-Pac (Z)
Раствор 180 мг (0,33 ммоля) H-(R)Cha-Aze-Pac (Z) и 53 мг (0,33 ммоля) бензилакрилата в этаноле выдерживают 60 ч при комнатной температуре. Растворитель удаляют в вакууме и остаток растворяют в этилацетате. Раствор промывают раствором гидросульфата калия, раствором гидрокарбоната натрия и рассолом. Сушкой (сульфат натрия) и удалением растворителя в вакууме получают остаток, который очищают колоночной хроматографией с применением в качестве элюента 10% метанола в хлористом метилене и получением 150 мг (66%) заглавного соединения.
(IV) HOOC-CH2-CH2-(R)Cha-Aze-Pac • 2HCl
Смесь 115 мг BnOOC-CH2-CH2-(R)Cha-Aze-Pac (Z) и 67 мг 10% Pd-C в 10 мл этанола гидрируют 1,5 ч при комнатной температуре и атмосферном давлении. Фильтрованием с последующим удалением растворителя в вакууме и растворением остатка в воде и 1,5 мл 1 М соляной кислоты получают раствор, сушка вымораживанием которого дает 30 мг (33%) заглавного соединения.
МС: m/z 464 (M + 1).
Пример 65
HOOC-CH2-(R)Cha-Aze-Pig • 2HCl
(I) Boc-(R)Cha-Aze-Pig (Z)
К смеси 0,473 г (1,236 ммоля) Boc-(R)Cha-Aze-OH (см. раздел: получение исходных соединений), 0,404 г (1,236 ммоля) H-Pig (Z) • HCl (см. раздел: получение исходных соединений) и 0,604 г (4,94 ммоля) ДМАП в 13,5 мл ДМФА добавляют при температуре ниже -15oC 0,249 г (1,298 ммоля) ЭДК. Смесь оставляют на ночь нагреваться до комнатной температуры. После испарения растворителя в вакууме добавляют EtOAc и 2 М KHSO4. Фазы разделяют и органическую фазу промывают насыщенным раствором NaHCO3 и рассолом. Повторением процедуры экстракции, сушкой (Na2SO4), фильтрованием и испарением растворителя получают 0,612 г остатка, который подвергают колоночной хроматографии с применением в качестве элюента смеси EtOAc-MeOH (9:1). В результате получают 407 мг (53%) заглавного соединения.
(II) H-(R)Cha-Aze-Pig (Z)
В 24,4 мл ТФУК-CH2Cl2 (1:4) растворяют 0,4 г (0,638 ммоля) Boc-(R)Cha-Aze-Pig (Z), перемешивают 30 минут в бане со льдом и 30 минут при комнатной температуре. После удаления растворителя в вакууме добавляют EtOAc и насыщенный раствор Na2CO3. Фазы разделяют и органическую фазу промывают водой и рассолом, сушат (Na2SO4), фильтруют и испарением растворителя в вакууме получают 336 мг (100%) заглавного соединения.
(III) BnOOC-CH2-(R)Cha-Aze-Pig (Z)
К нагретой до 60oC на масляной бане смеси 0,296 г (0,562 ммоля) H-(R)Cha-Aze-Pig (Z) и 0,171 г (1,236 ммоля) K2CO3 в 6 мл CH3CN медленно прибавляют 89 мл (0,562 ммоля) BnOOC-CH2Br. Спустя 1 ч 45 минут растворитель испаряют, добавляют EtOAc, смесь промывают водой, сушат (Na2SO4), фильтруют и испарением растворителя в вакууме получают 346 мг остатка, который подвергают колоночной хроматографии с применением смеси CH2Cl2-ТГФ-MeOH (8:2:1) в качестве элюента. В результате получают 297 мг (78%) заглавного соединения.
(IV) HOOC-CH2-(R)Cha-Aze-Pig • 2HCl
BnOOC-CH2-(R)Cha-Aze-Pig (Z) (243 мг, 0,36 ммоля) гидрируют в присутствии 1,7 мл 1 н. HCl, 10 мл EtOH (99,5%) и 300 мг Pd-C в течение 2 ч. Удалением катализатора фильтрованием на целлите и милипористом фильтре с последующим испарением растворителя в вакууме и двукратной сушкой вымораживанием получают 186 мг (88%) заглавного соединения.
1H-ЯМР (500 МГц, D2O) δ: 0,6-1,9 (м, 18H), 2,1-2,27 (м, 1H), 2,62-2,76 (м, 1H), 2,82-3,2 (м, 4H), 3,46-3,61 (м, 1H), 3,61-3,81 (м, 2H), 3,81-4 (м, 2H), 4-4,24 (м, 3H), 4,24-4,4 (м, 1H).
Пример 66
HOOC-CH2-(R)Cha-Pro-Pig • 2HCl
(I) Boc-(R)Cha-Pro-Pig (Z)
К смеси 0,3495 г (0,95 ммоля) Boc-(R)Cha-Pro-OH (см. раздел: получение исходных соединений), 0,464 г (3,8 ммоля) ДМАП, 0,31 г (0,95 ммоля) H-Pig (Z)) x HCl (см. раздел: получение исходных соединений) в 5 мл CH2Cl2 добавляют 0,182 г (1 ммоль) ЭДК и смесь перемешивают примерно сутки при комнатной температуре. Смесь испаряют и остаток растворяют в этилацетате. Органическую фазу дважды промывают 0,3 М KHSO4 и раз рассолом. Органический слой сушат (Na2SO4), фильтруют и испаряют. Очисткой сырого продукта с применением ступенчатого градиента CH2Cl2-MeOH (100:0, 97:3: 95:5, 90:10) в качестве элюента получают 307 мг заглавного соединения.
(II) H-(R)Cha-Pro-Pig (Z)
В 30 мл насыщенного HCl этилацетата растворяют 0,306 г (0,408 ммоля) Boc-(R)Cha-Pro-Pig (Z) и смесь оставляют на полчаса. Растворитель испаряют и остаток растворяют в CH2Cl2. Органический слой дважды промывают 0,2 М NaOH. Объединенный водный слой экстрагируют CH2Cl2 и объединенный органический слой сушат (Na2SO4), фильтруют и после испарения получают 257 мг (99%) заглавного соединения.
(III) BnOOC-CH2-(R)Cha-Pro-Pig (Z)
Смесь 0,256 г (0,473 ммоля) H-(R)Cha-Pro-Pig (Z), 0,144 г (1,04 ммоля) K2CO3 и 82 мкл (0,521 ммоля) бензилбромацетата в 6 мл ацетонитрила перемешивают два часа при 60oC. Растворитель испаряют, остаток растворяют в CH2Cl2, промывают водой и рассолом, сушат (Na2SO4), фильтруют и растворитель испаряют. Очисткой сырого продукта колоночной хроматографией с применением в качестве элюента ступенчатого градиента CH2Cl2-MeOH (97:3, 95:5, 90:10) получают 0,2 г (90% чистоты согласно ОФЖХ). Конечную очистку проводят на хроматотроне (Харрисон рисерч, модель 7924Т) с применением 2 мм пластинок с диоксидом кремния и смеси CH2Cl2 (95:5) и получением 0,158 г (48%) чистого продукта.
(IV) HOOC-CH2-(R)Cha-Pro-Pig • 2HCl
BnOOC-CH2-(R)Cha-Pro-Pig (Z) (0,158 г, 0,227 ммоля) смешивают с 0,075 г Pd-C (5%), 1 мл 1 н. раствора HCl и 10 мл этанола и смесь гидрируют один час при атмосферном давлении. Фильтрованием катализатора через целлит и испарением растворителя с последующей двукратной сушкой вымораживанием из воды получают 119 мг (87%) целевого продукта.
1H-ЯМР (D2O, 300 МГц) δ: 0,95-1,44 (м, 7H), 1,52 (м, 1H), 1,6-2,2 (м, 13H), 2,39 (м, 1H), 3,07-3,32 (м, 4H), 3,68 (м, 1H), 3,77-4,02 (м, 5H; в нем же 3,98 (с, 2H), 4,44-4,58 (м, 2H).
13C-ЯМР (D2O, 75 МГц) δ: 156,5, 168,3, 169,6, 174,5 (углероды карбонила и гуанидиногруппы).
Пример 67
HOOC-CH2-CH2-(R)Cha-Pro-Pig • 2HCl
(I) BnOOC-CH2-CH2-(R)Cha-Pro-Pig (Z)
К раствору 0,297 г (0,55 ммоля) H-(R)Cha-Pro-Pig (Z) (см. Пример 66 (II)) в 2 мл этанола добавляют 90 мкл (0,59 ммоля) бензилакрилата и реакционную смесь перемешивают четыре дня при комнатной температуре. Растворитель испаряют и сырой продукт хроматографируют на хромототроне (Харрисон рисерч, модель 7924Т) с применением 2 мм пластинок с диоксидом кремния и ступенчатого градиента CH2Cl2-MeOH (95:5, 90:10) в качестве элюента и получением 0,338 г (87%) заглавного соединения.
(II) HOOC-CH2-CH2-(R)Cha-Pro-Pig • 2HCl
BnOOC-CH2-CH2-(R)Cha-Pro-Pig (Z) (0,238 г, 0,227 ммоля) смешивают с 0,12 г Pd-C (5%), 1,2 мл 1 н. раствора HCl и 15 мл этанола и смесь гидрируют один час при атмосферном давлении. Фильтрованием катализатора через целлит, испарением растворителя с последующей двукратной сушкой из воды получают 178 мг (95%) заглавного соединения.
1H-ЯМР (D2O, 300 МГц, ) δ: 0,82-1,45 (м, 8H), 1,45-2,15 (м, 13H), 2,29 (м, 1H), 2,83 (т, 3H), 2,9-3,4 (м, 6H), 3,57 (ш. к, 1H), 3,67-3,87 (м, 3H), 4,25-4,43 (м, 2H).
13C-ЯМР (D2O, 75 МГц) δ 156,3, 168,2, 174,3, 174,6 (углероды карбонила и гуанидиногруппы).
МС: m/z 479 (M + 1).
Пример 68
(HOOC-CH2)2-(R)Cgl-Pro-Pig • 2HCl
(BnOOC-CH2)2-(R)Cgl-Pro-Pig (Z)2 (120 мг, 0,126 ммоля) (см. пример 50 (III)) гидрируют в присутствии 0,75 мл 1 н. HCl, 7 мл EtOH (99,5%) и 150 мг Pd-C в течение 4 ч. Удалением катализатора, фильтрованием на целлите и милипористом фильтре и испарением растворителя в вакууме с последующей сушкой вымораживанием получают 66 мг (90%) заглавного соединения.
1H-ЯМР (500 МГц, D2O) δ: 1,05-1,38 (м, 7H), 1,53-1,64 (д, 1H), 1,64-2,14 (м, 11H), 2,27-2,39 (м, 1H), 3,03-3,28 (м, 4H), 3,58-3,7 (м, 1H), 3,7-3,8 (м, 1H), 3,8-3,9 (д, 2H), 4,08-4,22 (м, 2H), 4,22-4,35 (м, 1H), 4,38-4,5 (м, 1H).
13C-ЯМР (75 МГц, D2O) δ: 156,28, 166,73, 170,14, 174,01 (углероды амидиногруппы и карбонила).
Пример 69
HOOC-CH2-CH2-(HOOC-CH2)(R)Cha-Pro-Pig • 2HCl
(I) BnOOC-CH2-CH2-(BnOOC-CH2)-(R)Cha-Pro-Pig (Z)
К охлажденной (температура бани со льдом) смеси 100 мг (0,14 ммоля) BnOOC-CH2-CH2-(R)Cha-Pro-Pig (Z) (см. пример 67 (I)) и 80 мг (0,21 ммоля) карбоната калия в 4 мл CH2Cl2 осторожно прибавляют раствор 64 мг (0,21 ммоля) TfO-CH2-COOBn в 1 мл CH2Cl2. Реакционную смесь оставляют на 30 минут при 0oC, затем оставляют на 2 ч нагреваться до комнатной температуры, после чего кипятят 30 минут и наконец оставляют на ночь при комнатной температуре. Испарением растворителя с последующей колоночной хроматографией с применением CH2Cl2-MeOH (97:3) получают 65 мг (54%) заглавного соединения.
(II) HOOC-CH2-CH2-(HOOC-CH2)-(R)Cha-Pro-Pig • 2HCl
В 10 мл EtOH- 1 М HCl (9:1) растворяют 65 мг (0,08 ммоля) BnOOC-CH2-CH2-(BnOOC-CH2)-(R)Cha-Pro-Pig (Z) и гидрируют 3 ч при атмосферном давлении над 10% Pd-C. Фильтрованием катализатора, испарением растворителя с последующей сушкой вымораживанием из воды получают 40 мг (97%) заглавного соединения в виде белого порошка.
13C-ЯМР (125 МГц, MeOD) δ: 157,5, 167,2, 169,1 и 174,1 (углероды амидиногруппы и карбонила).
Пример 70
HOOC-CH2-(R)Cgl-Aze-(R,S)Itp • 2HCl
(I) Boc-(R)Cgl-Aze-(R,S)Itp (TS)
В 6 мл CH3CN растворяют 400 мг (1,17 ммоля) Boc-(R)Cgl-Aze-OH (см. раздел: получение исходных соединений), 366 мг (1,23 ммоля) H-(R,S)Itp(TS) (см. раздел: получение исходных соединений) и 286 мг (2,34 ммоля) ДМАП и охлаждают до -5oC. Добавляют 236 мг (1,23 ммоля) ЭДК и полученную смесь перемешивают примерно сутки при комнатной температуре. После удаления CH3CN остаток растворяют в MeOH-EtOAc-H2O. Отделенный органический слой промывают K2CO3 (насыщ. ), 2 М KHSO4, рассолом и сушат (Na2SO4). Испарением растворителя получают 688 мг (85%) белого твердого вещества.
МС: m/z 620 (M+ + 1).
(II) H-(R)Cgl-Aze-(R,S)Itp (TS)
В 50 мл CH2Cl2 растворяют 500 мг (0,8 ммоля) Boc-(R)Cgl-Aze-(R,S)Itp (TS) и через раствор примерно 4 мин пробулькивают HCl (г). Спустя 45 мин растворитель испаряют, полученный продукт растворяют в EtOAc-MeOH-H2O и кислотный раствор подщелачивают 2 М NaOH (водн.) до pH 8-9. Органический слой отделяют и сушат (Na2SO4). Испарением растворителя получают 425 мг (100%) заглавного соединения в виде белого твердого вещества.
МС: m/z 520 (M+ + 1).
(III) BnOOC-CH2-(R)Cgl-Aze-(R,S)Itp (TS)
Смесь 400 мг (0,77 ммоля) H-(R)Cgl-Aze-(R,S)Itp(TS), 325 мг (0,92 ммоля) бензил-2-(п-нитробензолсульфонилокси)ацетата (см. раздел: получение исходных соединений) и 235 мг (1,7 ммоля) K2CO3 перемешивают в 5 мл CH3CN при 45oC. Спустя несколько часов превращение составляет только 25%, поэтому температуру повышают до 60oC и вносят дополнительное количество бензил-2-(п-нитробензолсульфонилокси)ацетата. Реакционную смесь перемешивают 48 ч (исходное соединение: продукт 25:63) и затем обрабатывают. После испарения растворителя к остатку добавляют EtOAc-H2O. Фазы разделяют, водную фазу дважды промывают EtOAc и объединенную органическую фазу промывают затем K2CO3 (насыщ.), 2 М KHSO4, водой и сушат (Na2SO4). В результате получают после обратной экстракции кислотного KHSO4 около 340 мг продукта, очисткой которого ОФЖХ получают 34 мг (7%) заглавного соединения.
МС: m/z 668 (M+ + 1).
(IV) HOOC-CH2-(R)Cgl-Aze-(R,S)Itp • 2HCl
В 5 мл ТГФ растворяют 34 мг (0,05 ммоля) BnOOC-CH2-(R)Cgl-Aze-(R,S)Itp (TS) и в реакционную колбу, охлаждаемую сухим льдом отгоняют 40 мл NH3 (г). При добавлении 11a появляется темно-голубое окрашивание. Реакционную смесь перемешивают 5 мин и затем нейтрализуют 50 мкл HOAc. Охлаждение сухим льдом, прекращают и смесь оставляют на испарение NH3 (ж). К остатку добавляют воду и HOAc до pH 7. Сушкой вымораживанием и препаративной ОФЖХ получают несколько фракций, которые анализируют методом ББА-МС. Две фракции содержат целевое соединение, полученное в количестве 3 мг (10%) после сушки вымораживанием с 2,2 экв. 1 М HCl.
МС: m/z 424 (M+ + 1).
Пример 71
HOOC-CH2-(R)Cha-Aze-(R,S)Itp
(I) Boc-(R)Cha-Aze-(R,S)Itp
В 2,5 мл CH3CN растворяют 169 мг (0,5 ммоля) Boc-(R)Cha-Aze-(R,S)Itp(TS) (см. раздел: получение исходных соединений), 155 мг (0,52 ммоля) H-(R, S)Itp(TS) (см. раздел: получение исходных соединений), 122 мг (1 ммоль) и раствор охлаждают до 5oC. Добавляют 115 мг (0,6 ммоля) ЭДК x HCl и полученную смесь перемешивают примерно сутки при комнатной температуре. Затем вносят дополнительные количества (0,5 экв.) H-(R,S)Itp(TS) и ЭДК и реакционную смесь перемешивают еще одну ночь, после чего обрабатывают по методике, приведенной для выделения Boc-(R)Cgl-Aze-(R, S)Itp(TS) (см. пример 70). В результате получают 260 мг сырого продукта. Очисткой с помощью ОФЖХ получают 180 мг (57%) заглавного соединения.
МС: m/z 634 (M+ + 1).
(II) H-(R)Cha-Aze-(R,S)Itp(TS)
В 20 мл CH2Cl2 растворяют 180 мг (0,28 ммоля) Boc-(R)Cha-Aze-(R, S)Itp(TS) и через раствор прим. 4 мин пробулькивают HCl (г). Спустя 45 мин растворитель испаряют, полученный продукт растворяют в CH2Cl2 и промывают 2 М NaOH до pH 8. Фазы разделяют, органическую фазу сушат (Na2SO4) и после испарения получают 163 мг (прим. 100%) продукта.
МС: m/z 534 (M+ + 1).
(III) BnOOC-CH2-(R)Cha-Aze-(R,S)Itp(TS)
Смесь 80 мг (0,15 ммоля) H-(R)Cha-Aze-(R,S)Itp(TS), 45 мг (0,33 ммоля) K2CO3 и Br-CH2-COOBn (39 мг, 0,17 ммоля) в 1,5 мл CH2CN перемешивают 2,5 ч при 60oC. После испарения растворителя остаток растворяют в EtOAc-H2O. Фазы разделяют, органическую фазу промывают 10%-ным раствором лимонной кислоты и сушат (Na2SO4). Испарением растворителя получают 171 мг сырого продукта, очисткой которого с помощью ОФЖХ получают 53 мг (52%) заглавного соединения.
МС: m/z 681 (M+ + 1).
(IV) HOOC-CH2-(R)Cha-Aze-(R,S)Itp
BnOOC-CH2-(R)Cha-Aze-(R, S)Itp(TS) обрабатывают по методике выделения BnOOC-CH2-(R)Cgl-Aze-(R, S)Itp(TS) (см. пример 70 (IV)). В результате в качестве продукта получают смесь, которую очищают с помощью ОФЖХ и получают 12 мг смеси (1:1) заглавного соединения с его восстановительной формой, дающей m/z при массе 439.
МС: m/z 438 (M+ + 1).
Пример 72
H-(R)Cha-Pic-(R,S)Itp • 2HCl
(I) Boc-(R)Cha-Pic-(R,S)Itp(TS)
В 40 мл ацетонитрила растворяют при комнатной температуре 2,1 г (5,5 ммоля) Boc-(R)Cha-Pic-OH (см. раздел: получение исходных соединений), 1 г (8,2 ммоля) ДМАП и 1,7 г (5,8 ммоля) H-(R,S)Itp(TS) (см. раздел: получение исходных соединений). После нескольких минут перемешивания добавляют 1,1 г (5,8 ммоля) ЭДК и перемешивание продолжают 60 часов. Растворитель удаляют в вакууме, остаток растворяют в CH2Cl2, промывают водой, 0,3 М KHSO4 и KHCO3 (водн. ) и сушат (Na2SO4). Испарением растворителя и фильтрованием через силикагель получают 2,43 г (67%) целевого продукта.
МС: m/z 661 (M+ + 1).
(II) Boc-(R)Cha-Pic-(R,S)Itp
В 15 мл ТГФ растворяют 2,4 г (3,6 ммоля) Boc-(R)Cha-Pic-(R,S)Itp(TS), в реакционной колбе конденсируют NH3 (г) и затем добавляют Na. Через 5 мин реакцию прекращают добавлением уксусной кислоты, затем NH3 и ТГФ испаряют. Остаток сушат вымораживанием из воды и после ОФЖХ (CH3CN- 0,1 М NH4OAc, 6:4) получают 0,93 г (51%) целевого продукта.
МС: m/z 507 (M+ + 1).
(III) H-(R)Cha-Pic-(R,S)Itp • 2HCl
В этилацетате, насыщенном HCl (г), растворяют при комнатной температуре 50 мг (0,099 ммоля) Boc-(R)Cha-Pic-(R,S)Itp. После перемешивания 2 ч растворитель удаляют в вакууме. Трехкратной сушкой вымораживанием остатка из воды получают 35 мг (74%) целевого продукта.
МС: m/z 407 (M+ + 1).
Пример 73
HOOC-CH2-(R)Cha-Pic-(R,S)Itp • 2HCl
(I) Boc-(R)Cha-Pic-(R,S)Itp(Z)
В 10 мл CH2Cl2 и 10 мл 0,5 М NaOH растворяют при комнатной температуре 0,84 г (1,66 ммоля) Boc-(R)Cha-Pic-(R,S)Itp (см. пример 72) и к раствору по каплям прибавляют 0,29 мл (1,82 ммоля) Z-Cl. После перемешивания 3 ч фазы разделяют, органическую фазу промывают водой и сушат над Na2SO4. Испарением и колоночной хроматографией (этилацетат-гептан, 9:1) получают 0,5 г (47%) целевого продукта.
МС: m/z 641 (M+ + 1).
(II) H-(R)Cha-Pic-(R,S)Itp(Z)
В насыщенном HCl этилацетате растворяют при комнатной температуре 0,5 г (0,78 ммоля) Boc-(R)Cha-Pic-(R,S)Itp(Z).
После добавления воды смесь подщелачивают K2CO3. Фазы разделяют, водную фазу экстрагируют CH2Cl2, а органическую фазу промывают водой. Объединенную органическую фазу сушат над Na2SO4. Испарением растворителя получают 0,3 г (71%) целевого продукта.
MC: m/z 541 (M+ + 1).
(III) BnOOC-CH2-(R)Cha-Pic-(R,S)Itp (Z)
В 25 мл ацетонитрила переносят 0,29 г (0,5 ммоля) H-(R)Cha-Pic-(R, S)Itp(Z) и 0,15 г (1 ммоль) K2CO3 и после добавления 154 мг (0,6 ммоля) бензилбромацетата смесь перемешивают 4 ч при 50oC. Испарением и ОФЖХ (ацетонитрил-0,1 М NH4OAc, 70:30) получают около 200 мг целевого продукта.
(IV) HOOC-CH2-(R)Cha-Pic-(R,S)Itp • 2HCl
К раствору 200 мг BnOOC-CH2-(R)Cha-Pic-(R,S)Itp (Z) небольшой ложечкой добавляют 10% Pd на угле и смесь гидрируют 4 ч. Фильтрованием через гайфло, испарением растворителя с последующей сушкой вымораживанием из воды получают 53 мг целевого продукта.
1H-ЯМР (300,13 МГц, D2O) δ: 1-2,35 (перекрывающиеся м, 22H), 3,28-3,51 (м, 5H), 3,51-2,64 (м, 1H), 3,75-4,03 (м, 3H), 5,03-5,14 (ш. с, 1H), Сигнал одного из протонов частично экранирован H-O-D-сигналом.
МС: m/z 465 (M+ + 1).
Пример 74
H-(R)Cgl-Pro-(R,S)Hig • 2HCl
(I) Boc-(R)Cgl-Pro-(R,S)Hig(Z)
К смеси 1 г (2,95 ммоля) Boc-(R)Cgl-Pro-OH (см. раздел: получение исходных соединений), 1,44 г (11,8 ммоля) ДМАП и 1,12 г (3,25 ммоля) H-(R, S)Hig(Z) (см. раздел: получение исходных соединений) в 15 мл CH2Cl2 добавляют 0,62 г (3,2 ммоля) ЭДК и смесь перемешивают примерно сутки при комнатной температуре. После испарения растворителя остаток растворяют в этилацетате. При двукратной промывке органического слоя 0,3 М раствором KHSO4 из органического слоя выделяется масло. Этилацетатный слой сушат (Na2SO4) и фильтруют. Масло и водный слой экстрагируют CH2Cl2. Органический слой сушат (Na2SO4), фильтруют и объединяют ранее полученной этилацетатной фазой. Испарением и очисткой сырого продукта на хроматотроне (Харрисон рисерч, модель 7924Т) с применением 2 мм пластинок с диоксидом кремния и ступенчатого градиента CH2Cl2-MeOH (97: 3, 95:5, 90:10) в качестве элюента получают 1,1 г (59%) заглавного соединения.
(II) H-(R)Cgl-Pro-(R,S)Hig • 2HCl
В 50 мл этилацетата, насыщенного HCl, растворяют 81 мг (0,13 ммоля) Boc-(R)Cgl-Pro-(R, S)Hig(Z). Смесь оставляют на один час, испаряют и остаток растворяют в 10 мл этанола. Добавляют 40 мг Pd-C (5%), 1 мл воды и 0,5 мл 1 М раствора HCl и смесь гидрируют примерно сутки при атмосферном давлении. Фильтрованием катализатора через целлит и испарением растворителя с последующей трехкратной сушкой вымораживанием из воды с выходом 75% получают заглавное соединение.
1H-ЯМР (D2O, 300 МГц) δ: 0,95-1,35 (м, 5H), 1,5-2,45 (м, 15H), 3,02 (ш. т, 1H), 3,1-3,8 (м, 7H), 4,13 (д, 1H), 4,38 (ш. д, 1H).
13C-ЯМР (D2O, 75 МГц) δ: 154,8, 168,9, 174,4 (углероды карбонила и гуанидиногруппы).
Пример 75
HOOC-CH2-(R)Cgl-Pro-(R,S)Hig • 2HCl
(I) H-(R)Cgl-Pro-(R,S)Hig(Z)
В 100 мл этилацетата, насыщенного HCl, растворяют 1 г (1,6 ммоля) Boc-(R)Cgl-Pro-(R, S)Hig(Z) (см. пример 72 (I)), и смесь оставляют на один час. Затем смесь испаряют и остаток растворяют в CH2Cl2. Органический слой промывают дважды 0,2 М раствором NaOH, сушат (Na2SO4), фильтруют и после испарения получают 0,825 г (98%) заглавного соединения.
(II) BnOOC-CH2-(R)Cgl-Pro-(R,S)Hig(Z)
В 12 мл ТГФ смешивают 0,442 г (0,839 ммоля) H-(R)Cgl-Pro-(R,S)Hig(Z), 0,256 г (1,85 ммоля) K2CO3 и 145 мкл (0,521 ммоля) бензилбромацетата и смесь перемешивают один час при 40oC и примерно сутки при комнатной температуре. После испарения растворителя остаток растворяют в CH2Cl2 и промывают водой и рассолом. Органический слой сушат (Na2-SO4), фильтруют и испаряют. Сырой продукт очищают на хроматотроне (Харрисон рисерч, модель 7924Т) с применением 2 мм пластинок с диоксидом кремния и ступенчатого градиента CH2Cl2-MeOH (97:3, 95:5, 90:10) в качестве элюента и получением 0,165 г (29%) заглавного соединения).
(III) HOOC-CH2-(R)Cgl-Pro-(R,S)Hig • 2HCl
Смесь 0,165 г (0,25 ммоля) BnOOC-CH2-(R)Cgl-Pro-(R,S)Hig(Z), 0,05 г Pd-C (5%), 0,7 мл 1М раствора HCl и 10 мл этанола гидрируют четыре часа при атмосферном давлении. Фильтрованием катализатора через целлит и испарением растворителя с последующей двукратной сушкой вымораживанием из воды получают 0,1 г (75%) целевого продукта.
1H-ЯМР (D2O, 300 МГц) δ: 1,05-1,45 (м, 5H), 1,55-2,5 (м, 15H), 3,08 (ш. т, 1H), 3,2-5,05 (м, 9H), 4,3 (д, 1H), 4,44 (м, 1H).
13C-ЯМР (D2O, 75 МГц) δ: 154,9, 167,2, 169,4, 174,1 (углероды карбонила и гуанидиногруппы).
Пример 76
H-(R)Cha-Pro-(R,S)Hig • 2HCl
(I) Boc-(R)Cha-Pro-(R,S)Hig(Z)
К 0,72 г (1,95 ммоля) Boc-(R)Cha-Pro-OH (см. раздел: получение исходных соединений), 0,95 г (7,8 ммоля) ДМАП, 0,74 г (2,14 ммоля, 82% чистоты) H-(R, S)Hig(Z) (см. раздел: получение исходных соединений) в 10 мл CH2Cl2 добавляют 0,486 г (2,54 ммоля) ЭДК и смесь перемешивают 3 дня при комнатной температуре. После разбавления смеси CH2Cl2 ее промывают водой, дважды 0,3 М KHSO4 и рассолом. Органический слой сушат (Na2SO4), фильтруют, испаряют и сырой продукт очищают колоночной хроматографией с применением CH2Cl2-MeOH (95:5) с получением 0,45 г (33%) целевого продукта.
(II) H-(R)Cha-Pro-(R,S)Hig • 2HCl
В 20 мл этилацетата, насыщенного HCl, растворяют 50 мг (0,078 ммоля) Boc-(R)Cha-Pro-(R, S)Hig(Z). Смесь оставляют на один час, испаряют и остаток растворяют в 10 мл этанола. Добавляют 20 мг Pd-C (5%) и 0,3 мл 1 М раствора HCl и смесь гидрируют два часа при атмосферном давлении. Фильтрованием катализатора через целлит и испарением растворителя с последующей двукратной сушкой вымораживанием из воды получают 28 мг (76%) заглавного соединения.
1H-ЯМР (D2O, 300 МГц) δ: 0,9-1,6 (м, 6H), 1,6-2,5 (м, 16H), 3,09 (т, 1H), 3,31 (т, 1H), 3,37-3,74 (м, 4H), 3,81 (м, 1H), 4,35-4,47 (м, 2H).
13C-ЯМР (D2O, 75 МГц) δ: 154,9, 169,8, 174,5 (углероды карбонила и гуанидиногруппы).
Пример 77
H-(R)Cgl-Aze-Rig • 2HCl
(I) Boc-(R)Cgl-Aze-Rig(Z)
К раствору 0,5 г (1,6 ммоля) H-Rig(Z) (см. раздел: получение исходных соединений), 0,59 г (1,6 ммоля) Boc-(R)Cha-Aze-OH (см. раздел: получение исходных соединений) и 0,84 г (6,9 ммоля) диметиламинопиридина в 30 мл ацетонитрила и 5 мл диметилформамида добавляют 0,33 г (1,7 ммоля) гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида. Реакционную смесь перемешивают 3 дня, затем испаряют между водным раствором гидросульфата калия и хлористым метиленом. Слой хлористого метилена промывают водным раствором бикарбоната натрия и водой, сушат (Na2SO4) и испаряют. Фильтрованием сырого продукта с отсосом через слой силикагеля вместе со смесью хлористый метилен-метанол (9: 1) получают после испарения 0,78 г (76%) целевого соединения.
1H-ЯМР (300 МГц, CDCl3) δ: 0,8-1,9 (м, 27H), 2,4-2,6 (м, 2H), 2,78 (ш. т, 2H), 3,15-3,4 (м, 2H), 3,8 (ш. т, 1H), 4-4,4 (м, 4H), 4,76 (ш. т, 1H), 4,97 (ш. д, 1H), 5,08 (с, 2H), 7,1-7,4 (м, 7H), 7,74 (ш., 1H).
(II) H-(R)Cgl-Aze-Rig(Z) • 2HCl
Колбу, содержащую 0,76 г (1,2 ммоля) Boc-(R)Cgl-Aze-Rig(Z) в 50 мл этилацетата, охлаждают в бане со льдом. Пробулькивают 5 мин сухой хлористый водород и после испарения раствора получают в виде белого порошка 0,74 г (100%) дигидрохлорида.
1H-ЯМР (300 МГц, MeOD) δ: 1,1-2 (м, 18H), 2,23 (м, 1H), 2,68 (м, 1H), 3,15-3,45 (м, 4H), 3,72 (ш. д, 1H), 3,9-4 (ш. д, 1H), 4,27 (м, 1H), 4,39 (м, 1H), 4,78 (м, 1H), 5,3 (с, 2H), 7,3-7,5 (м, 5H).
(III) H-(R)Cgl-Aze-Rig • 2HCl
Раствор 20 мг H-(R)Cgl-Aze-Rig(Z) и небольшое количество 5% Pd-C гидрируют в колбе 1 ч при атмосферном давлении. Смесь фильтруют через целлит и испаряют. Лиофилизацией остатка добавлением нескольких капель конц. получают 8 мг (52%) целевого продукта.
1H-ЯМР (300 МГц, D2O) δ: 1,1-2 (м, 18H), 2,37 (м, 1H), 2,75 (м, 1H), 3,08 (ш. т, 2H), 3,39 (ш. т, 2H), 3,8-4 (м, 3H), 4,35-4,5 (м, 2H), 4,9 (м, 1H).
13C-ЯМР (75,5 МГц, D2O) δ: 172,2, 169,4, 156,4 (углероды гуанидиногруппы и карбонила).
Пример 78
HOOC-CH2-(R)Cgl-Aze-Rig • 2HCl
(I) BnOOC-CH2-(R)Cgl-Aze-Rig(Z)
Смесь 0,2 г (0,33 ммоля) H-(R)Cgl-Aze-Rig(Z) (см. пример 77), 0,13 г карбоната калия, 80 мг йодида натрия, 10 мл тетрагидрофурана и 10 мл ацетонитрила нагревают 10 ч при 60oC. Растворители испаряют и сырой продукт подвергают колоночной хроматографии с применением в качестве элюента смеси хлористый метилен-метанол (92:8). Выход 0,13 (58%).
1H-ЯМР (300 МГц, CDCl3) δ: 0,9-2,1 (м, 18H), 2,45 (м, 1H), 2,61 (м, 1H), 2,81 (м, 2H), 2,88 (д, 1H), 3,2-3,5 (м, 4H), 3,94 (м, 1H), 4-4,25 (м, 3H), 4,85 (м, 1H), 5,12 (с, 2H), 5,14 (с, 2H), 6,9-7,2 (ш., 2H), 7,2-7,5 (м, 10H), 7,95 (м, 1H).
(II) HOOC-CH2-(R)Cgl-Aze-Rig • 2HCl
Смесь 0,12 г (0,18 ммоля) BnOOC-CH2-(R)Cgl-Aze-Rig(Z), 5 мл этанола, 3 капель конц. HCl и небольшого количества 5% Pd-C гидрируют 1 ч при атмосферном давлении. Смесь фильтруют через целлит и испаряют. Лиофилизацией остатка в воде получают 91 мг (98%) целевого продукта.
1H-ЯМР (500 МГц, D2O) δ: 1,1-1,9 (м, 17H), 2 (м, 1H), 2,29 (м, 1H), 2,7 (м, 1H), 3,1 (м, 2H), 3,34 (т, 2H), 3,83 (ш. д, 2H), 3,89 (дд, 2H), 4 (д, 1H), 4,35 (м, 2H), 4,87 (м, 1H).
13C-ЯМР (125,8 МГц, D2O) δ: 171,8, 169,6, 167,7, 156,3 (углероды гуанидино группы и карбонила).
Пример 79
HOOC-CH2-(R)Cha-Pro-Rig(Z)
(I) Boc-(R)Cha-Pro-Rig(Z)
К раствору 0,25 г (0,82 ммоля) 4-аминоэтил-1-бензилоксикарбониламидинопиперидина (H-Rig(Z)) (см. раздел: получение исходных соединений), 0,32 г (0,82 ммоля) Boc-(R)Cha-Pro-OH (см. раздел: получение исходных соединений) и диметиламинопиридина (0,4 г, 3,3 ммоля) в 10 мл ацетонитрила и 2 мл диметилформамида добавляют гидрохлорид N-(диметиламинопропил)-N'-этилкарбодиимида (0,165 г, 0,86 ммоля). Реакционную смесь перемешивают 3 дня, затем испаряют и распределяют между водным раствором гидросульфатом калия и хлористым метиленом. Слой хлористого метилена промывают водным раствором бикарбоната натрия и водой, сушат (Na2SO4) и испаряют. ЯМР-спектр сырого продукта был удовлетворителен, и продукт, содержащий некоторое количество диметилформамида, использован на следующей стадии без дополнительной очистки.
1H-ЯМР (500 МГц, CDCl3) δ: 0,8-2,2 (м, 32H; в нем же 1,41 (с, 9H)), 2,34 (м, 1H), 2,77 (ш. т, 2H), 3,1 (м, 1H), 3,29 (м, 1H), 3,4 (м, 1H), 3,83 (м, 1H), 4,17 (м, 2H), 4,3 (м, 1H), 4,54 (м, 1H), 5,07 (м, 1H), 5,08 (с, 2H), 7,03 (м, 1H), 7,05-7,4 (м, 7H).
(II) H-(R)Cha-Pro-Rig(Z)
Колбу, содержащую сырой Boc-(R)Cha-Pro-Rig(Z) в 100 мл этилацетата, охлаждают в бане со льдом. Через раствор 5 мин пробулькивают сухой HCl и для удаления избытка HCl раствор испаряют. Остаток растворяют в воде и для удаления оставшегося с предшествующей стадии диметилформамида раствор дважды экстрагируют этилацетатом. Водную фазу подщелачивают NaHCO3 и дважды экстрагируют хлористым метиленом. Объединенную органическую фазу промывают водой, сушат (Na2SO4) и испаряют. Выход на двух стадиях 0,37 г (81%).
1H-ЯМР (300 МГц, CDCl3) δ: 0,8-2,4 (м, 24H), 2,82 (ш. т, 2H), 3,26 (м, 2H), 3,42 (ш.к., 1H), 3,7 (м, 2H), 4,19 (м, 2H), 4,49 (ш. д, 1H), 5,11 (с, 2H), 6,9-7,5 (м, 8H).
(III) BnOOC-CH2-(R)Cha-Pro-Rig(Z)
Смесь 0,18 г (0,32 ммоля) H-(R)Cha-Pro-Rig(Z), избытка карбоната калия и 10 мл ацетонитрила нагревают 2 ч при 60oC. Растворитель испаряют и сырой продукт хроматографируют на колонке силикагеля с применением в качестве элюента смеси хлористый метилен-метанол (95:5). Выход 0,2 г (88%).
1H-ЯМР (300 МГц, CDCl3) δ: 0,8-2,1 (м, 23H), 2,37 (м, 1H), 3,1-3,5 (м, 7H), 4-4,2 (м, 2H), 4,54 (м, 1H), 5,1 (м, 4H), 6,9-7,5 (м, 13H).
(IV) HOOC-CH2-(R)Cha-Pro-Rig • 2HCl
Смесь 0,15 г (0,21 ммоля) BnOOC-CH2-(R)Cha-Pro-Rig(Z), 10 мл этанола, 4 капель кон. HCl и небольшого количества 5% Pd-C гидрируют 1 ч при атмосферном давлении. Смесь фильтруют через целлит и испаряют. Лиофилизацией остатка в воде получают 95% мг (64%) целевого продукта.
1H-ЯМР (500 МГц, MeOD) δ: 0,85-2,1 (м, 23H), 2,3 (м, 1H), 3,1 (м, 2H), 3,25 (м, 1H), 3,35 (м, 1H), 3,54 (м, 1H), 3,85-4 (м, 3H), 4,03 (д, 1H), 4,41 (м, 1H), 4,5 (м, 1H).
13C-ЯМР (125,8 МГц, D2O) δ: 174, 168,9, 168,1, 157,5 (углероды гуанидиногруппы и карбонила).
Пример 80
HOOC-CH2-CH2-(R)Cha-Aze-Rig • 2HCl
(I) Boc-(R)Cha-Aze-Rig(Z)
К раствору 0,25 г (0,82 ммоля) 4-аминоэтил-1-бензилоксикарбониламидинопиперидина (H-Rig(Z)) (см. раздел: получение исходных соединений), 0,31 г (0,86 ммоля) Boc-(R)Cha-Aze-OH (см. раздел: получение исходных соединений), 0,4 г (3,3 ммоля) диметиламинопиридина в 10 мл ацетонитрила и 2 мл диметилформамида добавляют 0,17 г (0,86 ммоля) гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида. Реакционную смесь перемешивают 3 дня, затем испаряют и распределяют между водным раствором гидросульфатом калия и хлористым метиленом. Слой хлористого метилена промывают водным раствором бикарбоната натрия и водой, сушат (Na2SO4) и испаряют. Сырой продукт, содержащий некоторое количество диметилформамида, используют на следующей стадии без дополнительной очистки.
1H-ЯМР (500 МГц, CDCl3) δ: 0,85 (м, 1H), 0,97 (м, H), 1,1-1,75 (м, 26H; в нем же 1,41 (с, 9H)), 1,82 (ш. д, 1H), 2,53 (м, 2H), 2,77 (ш. т, 2H), 3,25 (м, 2H), 4,03 (к, 1H), 4,08 (м, 1H), 4,18 (м, 2H), 4,29 (м, 1H), 4,78 (м, 1H), 4,97 (м, 1H), 5,09 (с, 2H), 7,1-7,4 (м, 7H), 7,65 (м, 1H).
(II) H-(R)Cha-Aze-Rig(Z)
Колбу, содержащую сырой Boc-(R)Cha-Aze-Rig(Z) в 100 мл этилацетата, охлаждают в бане со льдом. Через раствор 5 мин пробулькивают сухой HCl и для удаления избытка HCl раствор испаряют. Остаток растворяют в воде и для удаления оставшегося с предшествующей стадии диметилформамида дважды экстрагируют этилацетатом. Водную фазу подщелачивают NaHCO3 (водн.) и дважды экстрагируют хлористым метиленом. Объединенную органическую фазу промывают водой, сушат (Na2SO4) и испаряют. Выход на двух стадиях 0,31 г (70%).
1H-ЯМР (300 МГц, CDCl3) δ: 0,8-1,9 (м, 20H), 2,48 (м, 1H), 2,73 (м, 1H), 2,85 (ш. т, 2H), 3,25 (м, 1H), 3,35 (м, 2H), 4,05 (к, 1H), 4,1-4,25 (м, 3H), 4,86 (м, 1H), 5,12 (с, 2H), 6,9-7,2 (м, 2H), 7,2-7,45 (м, 5H), 7,93 (м, 1H).
(III) BnOOC-CH2-CH2-(R)Cha-Aze-Rig(Z)
Раствор 0,31 г (0,57 ммоля) H-(R)Cha-Aze-Rig(Z) и 93 мг (0,57 ммоля) бензилакрилата в 5 мл этанола оставляют на одну неделю при комнатной температуре. Раствор испаряют и остаток хроматографируют на колонке силикагеля с применением в качестве элюента смеси хлористый метилен-метанол (94:6). Выход 0,2 г (49%).
1H-ЯМР (500 МГц, CDCl3) δ: 0,8-1 (м, 2H), 1,1-1,8 (м, 18H), 2,48 (м, 1H), 2,54 (ш. т, 2H), 2,68 (м, 2H), 2,81 (ш. т, 2H), 2,87 (м, 1H), 3,2 (м, 1H), 3,25 (м, 1H), 3,31 (м, 1H), 4,04 (к, 1H), 4,1-4,2 (м, 3H), 4,84 (дд, 1H), 5,05-5,15 (м, 4H), 7-7,5 (м, 12H), 8,03 (м, 1H).
(IV) HOOC-CH2-CH2-(R)Cha-Aze-Rig • 2HCl
Заглавное соединение получено и очищено из 0,2 г (0,28 ммоля) BnOOC-CH2-CH2-(R)Cha-Aze-Rig(Z) по методике, приведенной в примере 80. Выход дигидрохлорида 30 мг (19%).
1H-ЯМР (500 МГц, CDCl3) δ: 1-1,9 (м, 20H), 2,33 (м, 1H), 2,7 (м, 1H), 2,83 (м, 2H), 3,1 (м, 2H), 3,3-3,4 (м, 4H), 3,85 (ш. д, 2H), 3,92 (м, ротамер), 4,14 (т, 1H), 4,17 (м, ротамер), 4,31 (м, 1H), 4,46 (м, 1H), 4,89 (м, 1H), 5,18 (м, ротамер).
13C-ЯМР (125,8 МГц, D2O) δ: 175,4, 171,8, 168,8, 156,3 (углероды гуанидиногруппы и карбонила).
Пример 81
HOOC-CH2-(R)Cha-Pro-(S)Itp • 2HCl
(I) Boc-(R)Cha-Pro-(S)Itp(TS)
В 12 мл ацетонитрила растворяют при комнатной температуре 0,87 г (2,36 ммоля) Boc-(R)Cha-Pro-OH (см. раздел: получение исходных соединений), 0,78 г (4,72 ммоля) ДМАП и 0,7 г (2,36 ммоля) H-(S)Itp(TS) (см. раздел: получение исходных соединений). После перемешивания 20 минут добавляют 0,59 г (3,07 ммоля) ЭДК. Спустя 18 часов растворитель удаляют в вакууме, остаток растворяют в CH2Cl2, промывают водой, 10%-ным раствором лимонной кислоты, KHCO3 (водн. ) водой и сушат над Na2SO4. Испарение дает 1,74 г (>100%, чистота около 60%) целевого продукта, который используют на следующей стадии без дополнительной очистки.
ББА-МС: m/z 647 (M+ + 1).
(II) H-(R)Cha-Pro-(S)Itp(TS)
Удалением защитной Boc-группы по методике, приведенной для Boc-(R)Cha-Pic-(R, S)Itp(Z) (см. пример 72 (II)), получают 0,75 г (81%) заглавного соединения.
ББА-МС: m/z 547 (M+ + 1).
(III) BnOOC-CH2-(R)Cha-Pro-(S)Itp(TS)
В 15 мл ацетонитрила переносят 0,75 г (1,37 ммоля) H-(R)Cha-Pro-(S)Itp(TS) и 0,38 г (2,74 ммоля) K2CO3. После добавления 0,39 г (1,65 ммоля) бензилбромацетата смесь перемешивают 2 ч при 50oC. Испарением растворителя с последующей колоночной хроматографией с применением в качестве элюента смеси этилацетат-метанол (95:5) получают около 530 мг целевого продукта.
ББА-МС: m/z 695 (M+ + 1).
(IV) HOOC-CH2-(R)Cha-Pro-(S)Itp • 2HCl
В 15 мл ТГФ растворяют 0,53 г (0,76 ммоля) BnOOC-CH2-(R)Cha-Pro-(S)Itp(TS). В реакционной колбе конденсируют NH3 (г) и добавляют Na. Спустя 30 мин реакцию прекращают добавлением уксусной кислоты, затем NH3 и ТГФ испаряют. Остаток сушат вымораживанием из воды и очисткой сырого продукта с помощью ОФЖХ (ацетонитрил-0,1 М HOAc) получают после сушки вымораживанием из водного HCl 0,25 г (61%) целевого продукта.
1H-ЯМР (500,13 МГц, D2O) δ: 0,9-2,09 (перекрывающиеся м, 20H), 2,22-2,35 (м, 1H), 3,2-3,36 (м, 4H), 3,44-3,62 (перекрывающиеся м, 2H), 3,7-3,8 (м, 1H), 3,87-3,99 (м, 2H), 4,33-4,48 (перекрывающиеся м, 2H).
13C-ЯМР (500,13 МГц, D2O) δ: 154,3, 168,1, 169 и 174,2 (углероды карбонила и гуанидиногруппы).
Пример 82
H-(R)Cha-Pro-(R,S)Nig • 2HCl
(I) Boc-(R)Cha-Pro-(R,S)Nig(Z)
В 2 мл CH2Cl2 смешивают 174 мг (0,471 ммоля) Boc-(R)Cha-Pro-OH (см. раздел: получение исходных соединений), 229 мг (1,87 ммоля) ДМАП, 130 мг (0,471 ммоля) H-(R, S)Nig(Z) (см. раздел: получение исходных соединений) и после добавления 117 мг (0,61 ммоля) ЭДК смесь перемешивают четыре дня. Смесь разбавляют CH2Cl2 и промывают водой, дважды 0,3 М раствором KHSO4 и рассолом. Органический слой сушат (Na2SO4), фильтруют, испаряют и сырой продукт очищают двукратной колоночной хроматографией с применением в первый раз в качестве элюента CH2Cl2-MeOH (95:5) и во второй раз - CH2Cl2-MeOH (97:3) с получением 0,104 г (35%) заглавного соединения.
МС: m/z 627 (M+ + 1).
(II) H-(R)Cha-Pro-(R,S)Nig • 2HCl
В 15 мл этилацетата, насыщенного HCl, растворяют 10 мг (0,016 ммоля) Boc-(R)Cha-Pro-(R, S)Nig(Z) и смесь оставляют на полчаса. Смесь испаряют, остаток растворяют в 6 мл этанола, добавляют 8 мг 5% Pd-C и 0,1 мл 1 М раствора HCl и смесь гидрируют полтора часа при атмосферном давлении. После фильтрования через гайфло и испарения растворителя получают 4 мг заглавного соединения.
1H-ЯМР (300 МГц, D2O) δ: 0,9-1,58 (м, 6H), 1,58-2,45 (м, 13H), 2,65 (м, 1H), 3,19 (м, 1H), 3,34 (д, 1H), 3,4-3,73 (м, 4H), 3,82 (м, 1H), 3,34-4,49 (м, 2H).
13C-ЯМР (75 МГц, D2O) δ: 155,1, 169,9 и 174,8 (углероды карбонила и гуанидиногруппы).
Пример 83
H-(R)Pro-Phe-Pab • 2HCl
(I) Boc-(R)Pro-Phe-Pab(Z)
К смеси 1,2 г (3,31 ммоля) Boc-(R)Pro-Phe-OH (см. раздел: получение исходных соединений) и 1,7 г (13,91 ммоля) ДМАП в 40 мл CH3CN добавляют при комнатной температуре 0,98 г (3,35 ммоля) H-Pab(Z) (см. раздел: получение исходных соединений), растворенный в 1 мл ДМФА. После перемешивания 2 ч реакционную смесь охлаждают до -18oC, добавляют 0,66 г (3,48 ммоля) ЭДК порциями и реакционную смесь оставляют примерно на сутки при комнатной температуре. Растворитель испаряют, остаток растворяют в 100 мл EtOAc и промывают 30 мл воды, 0,3 М KHSO4 (3 х 30 мл), 30 мл Na2CO3, 30 мл воды и сушат. Испарением растворителя с последующей колоночной хроматографией с применением в качестве элюента CH2Cl2-MeOH (95: 5) получают 0,691 г (38%) заглавного соединения.
(I) H-(R)Pro-Phe-Pab(Z)
В 30 мл этилацетата растворяют 0,673 г Boc-(R)Pro-Phe-Pab(Z) и раствор насыщают HCl (г) несколько минут (из раствора выпадает белый осадок). Растворитель и избыток HCl испаряют, к остатку добавляют 60 мл EtOAc и органическую фазу промывают 2 М NaOH (2 х 20 мл). Промывные воды экстрагируют EtOAc, экстракт присоединяют к другой EtOAc-фазе, объединенную органическую фазу промывают водой, сушат и после испарения получают 560 мг (98%) целевого продукта.
1H-ЯМР (500 МГц, CDCl3) δ: 1,5-1,74 (м, 3H), 1,98-2,05 (м, 1H), 2,78-2,85 (м, 1H), 2,9-2,96 (м, 1H), 3-3,2 (ABX-система с центром при 3,1, 2H), 3,62 (дд, 1H), 4,3-4,45 (ABX-система с центром при 4,37, 2H), 4,58 (к, 1H), 5,22 (с, 2H), 6,96 (ш. т, 1H), 7,1-7,4 (м, 10H), 7,46 (т, 2H), 7,76 (д, 2H), 8,12 (д, 1H).
(III) H-(R)Pro-Phe-Pab • 2HCl
В 10 мл 95%-го EtOH и 2 мл воды растворяют 200 мг H-(R)Pro-Phe-Pab(Z) и смесь гидрируют 5 ч над 5% Pd-C при атмосферном давлении. Фильтрованием катализатора и добавлением 1 мл 1 М HCl с последующим испарением и сушкой вымораживанием из воды с выходом 88% получают заглавное соединение.
1H-ЯМР (500 МГц, CD3OD) δ: 1,51-1,59 (м, 1H), 1,69-1,8 (м, 1H), 1,87-1,97 (м, 1H), 2,19-2,29 (м, 1H), 2,9 (дд, 1H), 3,2-3,33 (м, 3H, частично экранирован пиком растворителя), 4,27 (м, 1H), 4,43-4,54 (AB-система с центром при 4,48, 2H), 4,75-4,81 (м, 1H), 4,87 (с, 2H), 7,2-7,3 (м, 5H), 7,45 (д, 2H), 7,75 (д, 2H).
13C-ЯМР (125 МГц, D2O) δ: 166,7, 170,1 и 173,4 (углероды амидиногруппы и карбонила).
Пример 84
HOOC-CH2-(R)Pro-Phe-Pab • 2HCl
(I) BnOOC-CH2-(R)Pro-Phe-Pab(Z)
К взвеси 244 мг (0,463 ммоля) H-(R)Pro-Phe-Pab(Z) (см. пример 83) и 159,9 мг (1,157 ммоля) K2CO3 в 8 мл ДМФА-CH3CN (5:3) добавляют 127,2 мг (0,555 ммоля) бензилбромацетата в 2 мл ДМФА и смесь перемешивают 1,5 ч при 60oC и примерно сутки при комнатной температуре. Растворитель испаряют, остаток растворяют в 50 мл EtOAc, промывают водой (2 х 20 мл) и сушат (Na2SO4). Испарением растворителя и последующей колоночной хроматографией с применением CH2Cl2-MeOH (9: 1) в качестве элюента получают 176 мг (56%) заглавного соединения.
1H-ЯМР (300 МГц, CDCl3) δ: 1,45-1,8 (м, 3H), 2,06 (м, 1H), 2,54 (м, 1H), 2,92-3,28 (м, 6H), 4,3-4,5 (ABX-система с центром при δ 4,4, 2H), 4,6 (дд, 1H), 5,1 (кажущийся с, 2H), 5,2 (кажущийся с, 2H), 7,1-7,4 (м, 15H), 7,43 (д, 2H), 7,75 (д, 2H), 7,932 (д, 1H).
(II) HOOC-CH2-(R)Pro-Phe-Pab • 2HCl
В 12 мл EtOH-вода (5: 1) растворяют 170 мг (0,252 ммоля) BnOOC-CH2-(R)Pro-Phe-Pab(Z) и гидрируют 4,5 ч над 5% Pd-C при атмосферном давлении. Катализатор отфильтровывают, растворитель испаряют и сушкой остатка вымораживанием из HCl (вод.) получают заглавное соединение.
1H-ЯМР (500 МГц, CD3OD) δ: 1,62 (м, 1H), 1,82 (м, 1H), 2,08 (м, 1H), 2,38 (м, 1H), 2,9 (дд, 1H), 3,25-3,35 (м, 2H, частично экранирован пиком растворителя), 3,8 (м, 1H), 4,08-4,19 (AB-система с центром при δ 4,19, 2H), 4,39 (м, 1H), 4,45-4,58 (AB-система с центром при δ 4,5, 2H), 4,8 (м, 1H), 7,2-7,35 (м, 5H), 7,45 (д, 2H), 7,75 (д, 2H).
13C-ЯМР (125 МГц, D2O) δ: 166,8, 169,1, 169,5 и 173,2 (углероды амидиногруппы и карбонила).
Пример 85
H-(R)Phe-Phe-Pab
(I) Boc-(R)Phe-Phe-Pab(Z)
В 50 мл ацетонитрила растворяют Boc-(R)Phe-Phe-OH (16,4 ммоля) (см. раздел: получение исходных соединений), Pab(Z)-HCl (18 ммолей) и 4-диметиламинопиридин (24,6 ммоля). После охлаждения раствора до температуры ледяной воды добавляют гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (21,3 ммоля). Охлаждающую баню убирают и реакционную смесь перемешивают примерно сутки. Растворитель затем удаляют при пониженном давлении, остаток растворяют в 50 мл этилацетата и полученный раствор промывают 50 мл воды. Осадившийся из двухфазной смеси Boc-(R)Phe-Phe-Pab(Z) отфильтровывают и после промывания водой и сушки 24 ч в вакууме при 45oC получают 8,7 г (76%) продукта.
1H-ЯМР (200 МГц, d-CHCl3 и d4-CH3OH) δ: 8,35-7 (м, 18H), 4,63 (т, 1H), 4,3-4,1 (м, 1H), 3,4-2,7 (м, 6H), 1,3 (с, 9H).
(II) H-(R)Phe-Phe-Pab(Z)
К взвеси Boc-(R)Phe-Phe-Pab(Z) (10,3 ммоля) добавляют 31 мл 3,3 М HCl в этилацетате. Взвесь перемешивают 4 ч, после чего гидрохлорид H-(R)Phe-Phe-Pab(Z) отфильтровывают и промывают несколькими порциями этилацетата. Соль растворяют в смеси 50 мл хлористого метилена, 50 мл 1 М раствора карбоната калия и прим. 5 мл этанола. Органический слой отделяют и удалением растворителя при пониженном давлении получают 5 г (84%) H-(R)Phe-Phe-Pab(Z).
1H-ЯМР (200 МГц, d6-ДМСО) δ: 9,1 (с, 2H), 8,59 (м, 1H), 8,1 (м, 1H), 7,9 (д, 2H), 7,4-7 (м, 17H), 5,09 (с, 2H), 4,58 (м, 1H), 4,31 (м, 2H), 3,1-2,7 (м, 4H).
(III) В 10 мл тетрагидрофурана и 1 мл воды растворяют H-(R)Phe-Phe-Pab(Z). Добавляют палладий на угле (42 мг) и смесь гидрируют 2 дня в трясучке Парра под давлением водорода 45 фунт/кв.дюйм (3,2 кг/см2). По окончании гидрогенолиза смесь разбавляют метанолом и катализатор отфильтровывают. Испарением растворителя получают сырой H-(R)Phe-Phe-Pab, который очищают хроматографией на нейтральном оксиде алюминия (70-230 меш) с элюированием смесью хлористый метилен-метанол-гидроксид аммония (80:20:2). Выход заглавного соединения 76 мг (41%).
1H-ЯМР (200 МГц, d6-ДМСО) δ: 7,61 (д, 2H), 7,4-7 (м, 12H),
4,64 (м, 1H), 4,13 (т, 1H), 3,1-2,8 (м, 4H).
Пример 86
HOOC-CO-(R)Phe-Phe-Pab
(I) MeOOC-CO-(R)Phe-Phe-Pab(Z)
В 10 мл тетрагидрофурана растворяют H-(R)Phe-Phe-Pab(Z) (0,87 ммоля) (см. пример 85 (II). Раствор охлаждают в бане со льдом и к нему добавляют триэтиламин (1,73 ммоля) и затем метилоксалилхлорид (0,95 ммоля). Охлаждающую баню убирают и реакционную смесь перемешивают 18 ч при комнатной температуре. Реакционную смесь разбавляют этилацетатом и промывают водой. Органическую фазу отделяют и удалением растворителя при пониженном давлении получают 0,45 г (78%) MeOOC-CO-(R)Phe-Phe-Pab(Z), который используют на следующей стадии без дополнительной очистки. TSP-МС: найдено m/z 664 (вычислено для MH+ (C37H38N5O7) 664).
(II) HOOC-CO-(R)Phe-Phe-Pab(Z)
В 4 мл тетрагидрофурана и 2 мл воды растворяют MeOOC-CO-(R)Phe-Phe-Pab(Z) (0,68 ммоль), к раствору добавляют гидроксид лития (2,6 ммоля) и реакционную смесь перемешивают 1,5 ч при комнатной температуре. По окончании гидролиза реакционную смесь разбавляют 25 мл воды и подкисляют добавлением 0,5 мл уксусной кислоты. Осадок отфильтровывают и после промывания несколькими порциями воды и сушки в вакууме 24 ч при 45oC получают 0,4 г сырого HOOC-CO-(R)Phe-Phe-Pab(Z), образуют взвесь сырого продукта в 10 мл этанола и 1 мл воды, которую доводят до кипения, и фильтрованием нерастворимого заглавного соединения получают 0,23 г (41% на двух стадиях) HOOC-CO-(R)Phe-Phe-Pab(Z).
1H-ЯМР (200 МГц, d6-ДМСО) δ: 8,62 (м, 2H), 8,41 (д, 1H), 7,89 (д, 2H), 7,4-6,9 (м, 17H), 5,1 (с, 2H), 4,54 (м, 2H), 4,34 (м, 2H), 3,2-2,6 (м, 4H).
(III) HOOC-CO-(R)Phe-Phe-Pab
В 20 мл тетрагидрофурана и 5 мл воды образуют взвесь HOOC-CO-(R)Phe-Phe-Pab (0,2 ммоля), к которой добавляют палладий на угле (52 мг), и смесь гидрируют 2 дня в трясучке Парра под давлением водорода 45 фунт/кв.дюйм (3,2 кг/см2). По окончании гидрогенолиза смесь разбавляют 40 мл метанола и катализатор отфильтровывают. Испарением растворителя получают 50 мг (49%) заглавного соединения.
1H-ЯМР (200 МГц, d6-ДМСО) δ: 9,2 (с), 8,78 (д), 8,6 (м), 7,91 (м), 7,79 (д, 2H), 7,35-6,8 (м, 12H), 4,6-4 (м, 4H), 3-2,6 (м, 4H).
Пример 87
HOOC-CH2-(R)Phe-Phe-Pab
(I) BnOOC-CH2-(R)Phe-Phe-Pab(Z)
В 10 мл ацетонитрила образуют взвесь H-(R)Phe-Phe-Pab(Z) (0,87 ммоля) (см. пример 85 (II)) и карбоната калия (2,6 ммоля). К смеси добавляют йодбензилацетат (0,95 ммоля), раствор нагревают до 30oC и перемешивают при этой температуре 2 дня. По окончании алкилирования растворитель удаляют и остаток растворяют в 10 мл этилацетата. Раствор быстро промывают 10 мл воды, и из отделенной органической фазы осаждается заглавное соединение. BnOOC-CH2-(R)Phe-Phe-Pab(Z) отфильтровывают и после сушки 24 ч под вакуумом при 45oC получают 177 мг (28%) BnOOC-CH2-(R)Phe-Phe-Pab(Z).
1H-ЯМР (200 МГц, CDCl3) δ: 7,79 (д, 2H), 7,5-7,1 (м, 22H), 6,55 (т, 1H), 5,21 (с, 2H), 5,03 (с, 2H), 4,64 (м, 1H), 4,41 (м, 2H), 3,3-2,6 (м, 7H).
(II) HOOC-CH2-(R)Phe-Phe-Pab
В 30 мл тетрагидрофурана и 3 мл воды образуют взвесь BnOOC-CH2-(R)Phe-Phe-Pab(Z), к которой добавляют палладий на угле (41 мг), и смесь гидрируют 2 дня в аппарате для встряхивания Парра под давлением водорода 45 фунт/кв. дюйм (3,2 кг/см2). По окончании гидрогенолиза смесь разбавляют 40 мл воды и катализатор отфильтровывают. Испарением растворителя получают 95 мг (59%) заглавного соединения. TSP-МС: найдено m/z 502 (вычислено для MH+ (C28H32N5O4) 502).
Пример 88
H-(R)Cha-Pro-Mig
(I) Boc-(R)Cha-Pro-Mig(Z)
К перемешиваемой смеси 0,344 г (0,93 ммоля) Boc-(R)Cha-Pro-OH (см. раздел: получение исходных соединений), 0,245 г (0,93 ммоля) H-Mig(Z) (см. раздел: получение исходных соединений) и 0,227 г (1,86 ммоля) в 10 мл CH2CN добавляют при -10oC 0,232 г (1,86 ммоля) ЭДК. Реакционную смесь оставляют нагреваться до комнатной температуры и выдерживают 5 дней. После испарения CH3CN остаток растворяют в EtOAc и промывают водой, NaHCO3 (водн.) и рассолом. Органический слой сушат над Na2SO4 и испаряют. Очисткой сырого продукта колоночной хроматографией с применением ступенчатого градиента EtOAc-MeOH (от 95:5 до 90:10) получают 0,34 г (60%) заглавного соединения.
(II) H-(R)Cha-Pro-Mig(Z)
В 8 мл EtOAc, насыщенного HCl (г), растворяют 0,34 г (0,55 ммоля) Boc-(R)Cha-Pro-Mig(Z) и перемешивают 10 минут при комнатной температуре. Затем по каплям прибавляют 10 мл насыщенного раствора KOH (водн.). Слои разделяют и водную фазу экстрагируют EtOAc (3 х 8 мл). Органические слои объединяют, промывают рассолом, сушат над Na2SO4 и после испарения получают 0,286 г (100%) заглавного соединения.
(III) H-(R)Cha-Pro-Mig
В 3 мл MeOH растворяют 0,05 г (0,132 ммоля) H-(R)Cha-Pro-Mig(Z) и гидрируют примерно сутки при атмосферном давлении над 10% Pd-C. Раствор фильтруют через целлит и испарением растворителя получают 0,04 г (80%) заглавного соединения.
1H-ЯМР (500 МГц, MeOD) δ: 0,92-1,02 (м, 2H), 1,18-1,47 (м, 6H), 1,66-1,73 (м, 4H), 1,85-2,04 (м, 4H), 2,17-2,22 (м, 1H), 2,95-2,98 (м, 1H), 3,12-3,16 (м, 1H), 3,47-3,55 (м, 2H), 3,62-3,66 (м, 1H), 3,75-3,78 (м, 1H), 3,85-3,89 (м, 1H), 4,05-4,12 (м, 3H), 4,34-4,37 (м, 1H).
Сигналы меньшего ротамера появляются при δ: 3,4, 3,7, 4,13-4,16, 4,3.
МС: m/z 379 (M+ + 1).
Пример 89
H-(R)Cha-Pro-Dig
(I) Boc-(R)Cha-Pro-Dig(Z)
К перемешиваемой при -10oC смеси 0,28 г (0,76 ммоля) Boc-(R)Cha-Pro-OH (см. раздел: получение исходных соединений), 0,21 г (0,76 ммоля) H-Dig(Z) (см. раздел: получение исходных соединений) и 0,186 г (1,52 ммоля) ДМАП в 8 мл CH3CN добавляют 0,189 г (0,99 ммоля) ЭДК. Смесь оставляют нагреваться до комнатной температуры и выдерживают 4 дня. После испарения CH3CN остаток растворяют в EtOAc и промывают водой, NaHCO3 (водн.) и рассолом. Органический слой сушат над Na2SO4 и испаряют. Очисткой сырого продукта колоночной хроматографией с применением в качестве элюента линейного градиента EtOAc-MeOH (от 95:5 до 90:10) получают 0,21 г (44%) заглавного соединения.
(II) H-(R)Cha-Pro-Dig(Z)
В 8 мл EtOAc, насыщенного HCl (г), растворяют 0,21 г (0,33 ммоля) Boc-(R)Cha-Pro-Dig(Z) и перемешивают 10 мин при комнатной температуре. Затем по каплям прибавляют насыщенный раствор KOH (водн.). Слои разделяют и водную фазу экстрагируют EtOAc (3 х 8 мл). Органические слои объединяют, промывают рассолом, сушат над Na2SO4 и после испарения получают 0,146 г (83%) заглавного соединения.
(III) H-(R)Cha-Pro-Dig
В 3 мл MeOH растворяют 0,046 ммоля H-(R)Cha-Pro-Dig(Z) и гидрируют примерно сутки при атмосферном давлении над 10% Pd-C. раствор фильтруют через целлит и испарением растворителя получают 0,04 г (100%) заглавного соединения.
1H-ЯМР (500 МГц, MeOD) δ: 0,9-1,04 (м, 2H), 1,1-1,47 (м, 6H), 1,66-1,74 (м, 4H), 1,78-2,05 (м, 4H), 2,13-2,21 (м, 1H), 2,74-2,83 (м, 1H), 2,94-2,99 (м, 1H), 3,15-3,29 (м, 1H), 3,44-3,57 (м, 2H), 3,65-3,87 (м, 3H), 4,07-4,25 (м, 3H), 4,35-4,39 (м, 2H).
Сигналы меньшего ротамера появляются при δ: 4,29-4,32.
МС: m/z 393 (M+ + 1).
Пример 90
H-(R)Cha-Aze-Dig
(I) Boc-(R)Cha-Aze-Dig(Z)
Заглавное соединение с выходом 0,253 г (54%) получено из Boc-(R)Cha-Aze-OH и H-Dig(Z) (см. раздел: получение исходных соединений) по методике, приведенной для синтеза Boc-(R)Cha-Pro-Dig(Z).
(II) H-(R)Cha-Aze-Dig(Z).
Заглавное соединение с выходом 0,21 г (100%) получено из Boc-(R)Cha-Aze-Dig(Z) по методике, приведенной для Boc-(R)Cha-Pro-Dig(Z).
(III) H-(R)Cha-Aze-Dig
В 3 мл MeOH растворяют 0,06 г (0,117 ммоля) H-(R)Cha-Aze-Dig(Z) и гидрируют примерно сутки при атмосферном давлении над 10% Pd-C. Раствор фильтруют через целлит и испарением растворителя получают 0,042 г (95%) заглавного соединения.
1H-ЯМР (500 МГц, MeOD) δ: 0,91-1,02 (м, 2H), 1,18-1,48 (м, 6H), 1,66-1,9 (м, 8H), 2,15-2,17 (м, 1H), 2,66-2,68 (м, 1H), 2,8-2,83 (м, м, 1H), 3,14-3,29 (м, 1H), 3,39-3,44 (м, 1H), 3,72-3,8 (м, 2H), 4,01-4,04 (м, 1H), 4,14-4,23 (м, 2H), 4,48-4,49 (м, 1H), 4,6-4,64 (м, 1H).
Сигналы меньшего ротамера появляются при δ: 2,25, 2,6, 4,3, 4,67.
МС: m/z 379 (M+ + 1).
Примеры фармацевтических препаратов
Соединения по изобретению могут быть введены в состав твердых дозированных форм, предназначенных для перорального приема, например: простых таблеток, таблеток с покрытием или таблеток для модифицированного выделения, жидких или твердых-полужидких дозированных форм для ректального введения, лиофилизованного вещества или жидкостей в виде эмульсий или суспензий для парентерального введения, жидких, твердых и полужидких дозированных форм для нанесения местно.
Соединения по изобретению могут быть введены в состав находящихся под давлением аэрозолей или сухих порошков в ингаляторе для ингаляций через рот или нос.
Пример P1
Таблетки для приема перорально
Таблетки (1000 штук) получают из следующих компонентов, г:
Активное соединение - 100
Лактоза - 200
Поливинилпирролидон - 30
Микрокристаллическая целлюлоза - 30
Стеарат магния - 6
Активный компонент и лактозу смешивают с водным раствором поливинилпирролидона. Смесь сушат и после размалывания получают гранулы. Затем подмешивают микрокристаллическую целлюлозу и стеарат магния. Смесь прессуют в таблетирующей машине и получают 1000 таблеток, каждая из которых содержит 100 мг активного компонента.
Пример P2
Раствор для парентерального введения
Раствор получают из следующих компонентов, г:
Активное соединение - 5
Хлорид натрия для инъекций - 6
Гидроксид натрия для установления pH 5 - 7
Вода для инъекций до объема в 1000 мл
Активный компонент и хлорид натрия растворяют в воде. Добавлением 2 М NaOH устанавливают pH 3-9 и раствором заполняют стерильные ампулы.
Пример P3
Таблетки для перорального приема, г:
Активное соединение - 150
Натрийалюминийсиликат - 20
Парафин - 120
Микрокристаллическая целлюлоза - 20
Гидроксипропилцеллюлоза - 5
Натрийстеарилфумарат - 3
Компоненты 1-4 смешивают друг с другом и к ним добавляют водный раствор компонента 5. Смесь сушат, измельчают и смешивают с компонентом 6. Затем смесь прессуют в таблетирующей машине.
Пример B6
Порошок для ингаляций
Активное соединение распыляют в струйной мельнице до размера частиц, приемлемого для ингаляций (масс-диаметр < 4 мкм).
Распыленным порошком (100 мг) заполняют порошковый многодозовый ингалятор (Tурбогалер®). Ингалятор снабжают дозирующим устройством, подающим дозу в 1 мг.
Биология
Определение времени свертывания тромбина (ВСТ)
Человеческий тромбин (Т 6769, Сигма Кем. Ко.) в буферном растворе (pH 7,4, 100 мкл) и растворе ингибитора (100 мкл) инкубируют одну мин. Затем добавляют исходную нормальную с добавкой цитрата плазму человека (100 мкл) и в автоматическом устройстве (КС 10, Амелунг) измеряют время свертывания.
Строят кривую зависимости времени свертывания в секундах от концентрации ингибитора и интерполяцией определяют ИК50 ВСТ.
ИК50 ВСТ - это концентрация ингибитора, при которой происходит удвоение времени свертывания тромбина из плазмы крови человека.
Определение времени частичной активации тромбопластина (ВЧАТ)
ВЧАТ определяют на исходной нормальной с добавкой цитрата плазме крови человека применением реактива РТТ 5 для автоматических определений производства фирмы Стаго. К плазме добавляют ингибитор (10 мкл раствора ингибитора на 90 мкл плазмы) и ВЧАТ определяют с помощью анализатора свертывания КС10 (Амелунг) согласно указаниям изготовителя реактива. Строят график зависимости времени свертывания в секундах от концентрации ингибитора в плазме и интерполяцией определяют ИК50 ВЧАТ.
ИК50 ВЧАТ определяется, как концентрация ингибитора в плазме, при которой происходит удвоение времени частичной активации тромбопластина.
Определение времени свертывания тромбина ex vivo
Ингибирование тромбина после перорального приема соединений исследуют на находящихся в сознании крысах, которым за два дня до опытов встраивают катетер для отбора крови из сонной артерии. В день опыта образцы крови отбирают в определенное время в пластиковые пробирки, содержащие 1 часть раствора цитрата натрия (0,13 моля/л) и 9 частей крови. Для получения обедненной тромбоцитами плазмы пробирки центрифугируют. Плазму используют для определения времени свертывания тромбина по нижеприведенной методике.
Плазму крови крысы с добавкой цитрата (100 мкл) разбавляют солевым раствором (0,9%, 100 мкл) и коагуляцию плазмы инициируют добавлением тромбина человека (Т 6769, Сигма Кем. Ко.) в буферном растворе (pH 7,4, 100 мкл). Время свертывания измеряют на автоматическом анализаторе (КС 10, Амелунг, Германия).
Определение константы ингибирования (Kи) для плазменного калликреина
Определение Kи осуществляют методом с применением хромогенного субстрата с помощью Кобас Био центрифужного анализатора производства фирмы Рошэ (Базель, Швейцария). Остаточную ферментативную активность после инкубирования плазменного калликреина человека с различными концентрациями испытуемого соединения определяют при трех концентрациях субстрата и измеряют по изменению оптического поглощения при 405 нм и 37oC.
Плазменный калликреин человека (E.C.3.4.21.34, Хромогеникс АБ, Мельндаль, Швеция) в количестве 250 мкл 0,4 nkat/мл в буфере (0,05 моль/л Трис-HCl, pH 7,4, добавлено 0,15 моль/л NaCl) с коровьим альбумином (5 г/л, кат. N 810033, ИСИ Биокемикалз Лтд., Хай Уайкомб, Бакс, Великобритания) инкубируют 300 сек с 80 мкл раствора испытуемого соединения в растворе NaCl (0,15 моль/л), содержащем 10 г/л коровьего альбумина. На этом этапе дополнительно вносят 10 мкл воды. Затем добавляют 40 мкл субстрата калликреина (S-2302, Хромогеникс АБ, в концентрации 1,25, 2 и 4 ммоль/л в воде) вместе с еще 20 мкл воды и регистрируют изменение поглощения.
Значение Kи определяют по кривым Диксона, т.е. графикам концентрации ингибитора относительно 1/(ΔA/мин), на которых данные для различных концентраций образуют прямые линии, пересекающиеся при X= -Kи.
Сокращения
Ac - ацетил
водн. - водный
Aze - азетидин-2-карбоновая кислота
бетаPic - пиперидин-3-карбоновая кислота
Boc - трет-бутилоксикарбонил
Boc-Dig(Z) - 3-(N-трет-бутилоксикарбониламиноэтил)-1-(N- бензилоксикарбониламидино)азетидин
Boc-Mig(Z) - 3-(N-трет-бутилоксикарбониламинометил)-1-(N- бензилоксикарбониламидино)азетидин
Boc-Pig(Z) - 4-(N-трет-бутилоксикарбониламинометил)-1-(N- бензилоксикарбониламидино)пиперидин
Boc-Pig(Z)2 - 4-(N-трет-бутилоксикарбониламинометил)-1-(N,N'- дибензилоксикарбониламидино)пиперидин
рассол - насыщенный водный раствор NaCl
Bn - бензил
Bu - бутил
Cgl - циклогексилглицин
Cha-β-циклогексилаланин
ЦМЭ-КДИ - 1-циклогексил-3-(2-морфолиноэтил)карбодиимида- мето-п-толуолсульфонат
ДБУ - 1,8-диазабицикло/5.4.0/ундец-7-ен
ДЦК - дициклогексилкарбодиимид
ДЦУ - дициклокарбамид
ДМАП - N,N-диметиламинопиридин
ДМФА - диметилформамид
ДМСО - диметилсульфоксид
ЭДК - 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид
Et - этил
EtOAc - этилацетат
EtOH - этанол
Gly - глицин
ч - часы
HCl - хлористоводородная (соляная) кислота
Hex - гексил
HOAc - уксусная кислота
ГОБТ - N-гидроксибензотриазол
Hop - гомофенилаланин
Hoc - гомоциклогексилаланин
ГСИ - N-гидроксисукцинимид
H - Dig(Z) - 3-аминоэтил-1-(N-бензилоксикарбониламидино)-азетидин
H - Dig - 3-аминоэтил-1-амидиноазетидин
H-(R, S)Hig(Z)-(3RS)-1-(N-бензилоксикарбониламидино)-3- аминоэтилпирролидин
H-(R,S)Hig-(3RS)-1-амидино-3-аминоэтилпирролидин
н-Hig-1-амидино-3-аминоэтилпирролидин
H-(R,S)Itp(TS)-(4RS) - 1,3-диаза-2-тозилимино-4-аминоэтилциклогексан
H-(R,S)Itp-(4RS)-1,3-диаза-2-имино-4-аминоэтилциклогексан
H-(S)Itp(TS)-(4S)-1,3-диаза-2-тозилимино-4-аминоэтилциклогексан
н-(S)Itp-(4S)-1,3-диаза-2-имино-4-аминоэтилциклогексан
H-Itp-1,3-диаза-2-имино-4-аминоэтилциклогексан
H-Mig-(Z)-3-аминометил-1-(N-бензилоксикарбониламидино)-азетидид
H-Mig-3-аминометил-1-амидиноазетидин
H-(R, S)Nig(Z)-(3RS)-1-(N-бензилоксикарбониламидино)-3- аминометилпирролидин
H-(R,S)Nig-(3RS)-1-амидино-3-аминометилпирролидин
H-Nig-1-амидино-3-аминометилпирролидин
H-Pab-1-амидино-4-аминометилбензол
H-Pab(Z)-4-аминометил-1-(N-бензилоксикарбониламидино)-бензол
H-Pac-1-амидино-4-аминометилциклогексан
H-Pac(Z)-4-аминометил-1-(N-бензилоксикарбониламидино)-циклогексан
H-Pig-4-аминометил-1-амидинопиперидин
H-Pig(Z)-4-аминометил-1-(N-бензилоксикарбониламидино)-пиперидин; H-Pig(Z)2-4-аминометил-1-(N, N'-дибензилоксикарбониламидино) пиперидин; H-Rig(Z)-4-аминоэтил-1-(N-бензилоксикарбониламидино)-пиперидин
H-Rig-4-аминоэтил-1-N-амидинопиперидин
Me - метил
MeOH - метанол
Ms - мезил
NMM - N-метилморфолин
МПа - мегапаскаль
Pd-C - палладий на угле
Pgl - фенилглицин
Phe - фенилаланин
Pic - пипеколиновая кислота
Pro - пролин
ОФЖХ - с обращенными фазами жидкостная хроматография высокого разрешения
Tf - трифторметилсульфонил
ТФУК - трифторуксусная кислота
ТГФ - тетрагидрофуран
Tic-1-карбокси-1,2,3,4-тетрагидроизохинолин
Ts - тозил
Val - валин
Z - бензилоксикарбонил
Префиксы н-, втор-, трет- имеют свое обычное значение: нормальный, вторичный, третичный. Стереохимия аминокислот, если нет особых указаний, априорно (S).
Сокращения (продолжение. Волнистые линии у атомов азота в нижеприведенных структурных формулах указывают на положение связи во фрагменте).
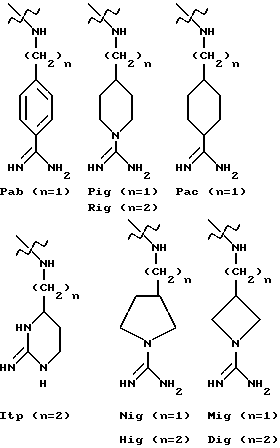
Пример 91
H-(R)Cha-Pro-(R,S)Nap • 2HCl
(I) 1-Бензил-3-гидроксиметил-5-оксо-3-пирролидин
К смеси метил-1-бензил-5-оксо-3-пирролидин-карбоксилата (2,0 г, 8,574 ммоля) в сухом ТГФ (5 мл) в атмосфере азота добавили боргидрид лития (0,176 г, 9,00 ммолей) в сухом ТГФ (10 мл). Реакционную смесь кипятили с обратным холодильником в течение 3 часов (добавили дополнительное количество ТГФ (10 мл)). Добавили воду (10 мл) и смесь выпарили. Водяной слой охладили на ледяной бане и добавили NaOH (2 М, 15 мл), за чем последовала экстракция метиленхлоридом. Органический слой промыли соляным раствором и выпарили. Выход: 1,62 г (92%).
1H-ЯМР (300 МГц, CDCl3): 2,15-2,55 (мультиплет, 3H), 3,00-3,60 (м, 4H), 4,25-4,50 (м, 2H), 7,10-7,40 (м, 5H).
(II) 1-Бензил-3-CH2OMs-5-оксо-3-пирролидин
К смеси 1-бензил-3-гидроксиметил-5-оксо-3-пирролидина (1,61 г, 7,863 ммоля) и триэтиламина (1,64 мл, 11,795 ммоля) в хлористом метилене (20 мл) при 4oC добавили метансульфонил хлорид (0,64 мл, 8,256 ммоля). Реакционную смесь перемешивали при 4oC в течение 3 часов. Добавили этиловый эфир (20 мл), смесь профильтровали и промыли HCl (1 М, 2 х 10 мл), после чего промыли водой и соляным раствором, осушили (Na2SO4) и выпарили. Выход: 2,11 г (95%).
1H-ЯМР (300 МГц, CDCl3): 2,20-2,30 (мультиплет, 1H), 2,55-3,15 (м, 6H), 3,35-3,45 (м, 1H), 4,00-4,20 (м, 2H), 4,40 (синглет, 2H), 7,15-7,40 (м, 5H).
(III) 1-Бензил-3-цианометил-5-оксо-3-пирролидин
1-Бензил-3-CH2OMs-5-оксо-3-пирролидин (5,25 г, 18,53 ммоля) растворили в ДМСО (93 мл) и добавили цианид натрия (2,27 г, 46,32 ммоля). Реакционную смесь перемешивали при 80oC в течение 1 часа. Добавили цианид натрия (0,45 г, 9,18 ммоля) и смесь перемешивали при 80oC еще в течение 1 часа. Добавили 500 мл воды и реакционную смесь выпарили. К водяному слою добавили хлористый метилен и после отделения органический слой промыли водой, осушили (Na2SO4) и выпарили. Выход: 3,49 г (88%).
1H-ЯМР (300 МГц, CDCl3): 2,10-2,75 (мультиплет, 5H), 2,90-3,05 (м, 1H), 3,35-3,50 (м, 1H), 4,25-4,50 (м, 2H), 7,05-7,35 (м, 5H).
(IV) 1-Бензил-3-аминоэтил-5-оксо-3-пирролидин
К смеси 1-бензил-3-цианометил-5-оксо-3-пирролидина (0,254 г, 1,185 ммоля) и безводного хлорида кобальта (0,308 г, 2,37 ммоля) в метаноле (34 мл) при 4oC добавили боргидрид натрия (0,448 г, 11,85 ммоля) по частям. Добавили HCl (2 М, 7,11 мл, 14,22 ммоля) и смесь перемешивали в течение 30 минут. Смесь выпарили и остаток разбавили гидроксидом аммония (2 М) и проэкстрагировали хлористым метиленом. Объединенный органический слой промыли соляным раствором, осушили (Na2SO4) и выпарили. Выход: 0,205 г (80%).
1H-ЯМР (300 МГц, CDCl3): 1,35-1,60 (мультиплет, 3H), 1,95-2,95 (м, 5H), 3,20-3,45 (м, 1H), 4,25-4,50 (м, 2H), 7,05-7,35 (м, 5H).
(V) Boc-NH-CH2-CH2-4-пирролидинил-1-бензил-2-он
К смеси 1-бензил-3-аминоэтил-5-оксо-3-пирролидина (0,199 г, 0,912 ммоля) и NaOH (2 М, 0,46 мл, 0,912 ммоля) в воде (1,2 мл) и ТГФ (1,2 мл) при 4oC добавили (Boc)2O (0,239 г, 1,094 ммоля). Реакционную смесь перемешивали при 4oC в течение 30 минут, за чем последовало 5 часов при комнатной температуре. Смесь выпарили и остаток разбавили водой (20 мл) и проэкстрагировали этилацетатом (3 х 10 мл). Объединенный органический слой промыли соляным раствором, осушили (Na2SO4) и выпарили. Неочищенный продукт очистили флеш-хроматографией (EtOAc:MeOH 95:5). Выход : 0,16 г (55%).
1H-ЯМР (300 МГц, CDCl3): 1,15-1,60 (мультиплет, 11H), 2,00-2,60 (м, 3H), 2,75-3,15 (м, 3H), 3,25-3,40 (м, 1H), 4,25-4,45 (м, 2H), 7,10-7,35 (м, 5H).
(VI) Boc-NH-CH2-CH2-4-пирролидинил-2-он
Boc-NH-CH2-CH2-4-пирролидинил-1-бензил-2-он (0,16 г, 0,502 ммоля) в сухом ТГФ (2 мл) охладили до - 80oC. Добавили аммиак (15-20 мл), после чего добавили натрий (0,115 г, 5 ммоль) тремя частями и реакционную смесь перемешивали в течение 1,5 часов. Добавили уксусную кислоту (0,4 мл) и смесь оставили выпариваться в течение 48 часов. Добавили воды (20 мл) и раствор проэкстрагировали этилацетатом (3 х 20 мл). Объединенный органический слой промыли соляным раствором, осушили (Na2SO4) и выпарили. Выход: 97 мг (85%).
1H-ЯМР (300 МГц, CDCl3): 1,25-1,70 (мультиплет, 11H), 1,90-2,05 (м, 1H), 2,30-2,50 (м, 2H), 2,90-3,15 (м, 3H), 3,40-3,50 (м, 1H), 4,80 (bs, NH), 6,75 (bs, NH).
(VII) Boc-NH-CH2-CH2-4-пирролидинил-2-тион
Смесь Boc-NH-CH2-CH2-4-пирролидинил-2-она (0,289 г, 1,264 ммоля) и реагент Лавессона (Lawesson) (0,256 г, 0,632 ммоля) в сухом ТГФ (12 мл) перемешивали в течение 1 часа. Добавили ложку силикагеля и смесь выпарили. Остаток очистили флеш-хроматографией (элюировали ТГФ и CH2Cl2:MeOH 9:1). Выход: 0,187 г (77%).
1H-ЯМР (300 МГц, CDCl3): 1,25-1,75 (мультиплет, 11H), 2,45-2,70 (м, 2H), 2,95-3,40 (м, 4H), 3,65-3,85 (м, 1H), 4,70 (bs, NH), 8,80 (bs, NH).
(VIII) Boc-(R)Cha-Pro-NH-CH2-CH2-4-пирролидинил-2-тион
Как описано в примере 1 (i) из Boc-NH-CH2-CH2-4-пирролидинил-2-тиона (0,159 г, 0,651 ммоля) и Boc-(R)Cha-Pro-OH (0,24 г, 0,651 ммоля) (смотри приготовление исходных материалов). Выход: 0:273 г (85%).
1H-ЯМР (300 МГц, CDCl3): 0,75-2,10 (м, 26H), 2,30-2,65 (м, 3H), 2,95-3,50 (м, 5H), 3,70-3,95 (м, 2H), 4,20-4,65 (м, 2H), 5,05-5,15 (м, 1H), 7,15 (bs, NH), 7,95 (bs, NH).
(IX) Boc-(R)Cha-Pro-NH-CH2-CH2-(5-(метилсульфонил)- 3,4-дигидро-2H-3-пирролил х HI
Смесь Boc-(R)Cha-Pro-NH-CH2-CH2-4-пирролидинил-2-тиона (0,57 г, 0,520 ммоля) и метил иодида (0,1 мл, 1,556 ммоля) в ацетоне (10 мл) перемешали при комнатной температуре в течение 6 часов. Осажденный продукт отфильтровали. Выход: 0,243 г (73%).
1H-ЯМР (300 МГц, CDCl3): 0,70-2,25 (м, 29H), 2,60-3,50 (м, 8H), 3,60-3,90 (м, 2H), 4,05-4,55 (м, 3H), 5,00-5,25 (м, 1H).
(X) Boc-(R)Cha-Pro-(R,S)Nap • HI
Смесь Boc-(R)Cha-Pro-NH-CH2-CH2-(5-(метилсульфонил)- 3,4-дигидро-2H-3-пирролил x HI (0,24 г, 0,376 ммоля) и ТГФ, насыщенного аммиаком (25 мл), перемешивали при комнатной температуре в течение ночи. Реакционную смесь выпарили. Выход: 0,237 г (100%).
Масс-спектрометрия бомбардировкой быстрыми атомами: m/z = 478 (M+ + 1)
(XI) H-(R)Cha-Pro-(R,S)Nap • 2HCl
Смесь Boc-(R)Cha-Pro-(R, S)Nap x HI (0,229 г, 0,378 ммоля) и трифторуксусной кислоты (1,5 мл) в хлористом метилене (1,5 мл) перемешали при комнатной температуре в течение 2 часов. Реакционную смесь выпарили и неочищенный продукт очистили RPLC (25% CH3CN/75% 0,1 М NH4OAc). Выход: 68 мг (40%).
Масс-спектрометрия бомбардировкой быстрыми атомами: m/z = 378 (M+ + 1)
Пример 92
HOOC-CH2-OOC-CH2-(R)Cgl-Aze-Pab • 2HCl
(I) HOOC-CH2-(R)Cgl-Aze-Pab(Z)
Смесь BnOOC-CH2-(R)Cgl-Aze-Pab(Z) (0,5 г, 0,76 ммоля) (смотри пример 1 (iii), гидроксида лития (0,765 мл (2М), 1,5 ммоля) и воды (несколько капель) в метаноле перемешали при комнатной температуре в течение 30 минут. Добавили HCl (2 М, 0,765 мл) и смесь выпарили. Неочищенный продукт очистили RPLC (30% CH3CN/70% 0,1 М NH4OAc). Выход: 0,12 г (28%).
1H-ЯМР (500 МГц, CD3OD): 0,90-1,95 (мультиплет, 11H), 2,20-2,70 (м, 2H), 3,25-3,85 (м, 3H), 3,95-4,55 (м, 4H), 4,75-5,25 (м, 3H), 7,25-7,90 (м, 9H).
(II) BnOOC-CH2-OOC-CH2-(R)Cgl-Aze-Pab(Z)
Бензил бромацетат (0,0924 г, 0,403 ммоля) добавили к HOOC-CH2-(R)Cgl-Aze-Pab(Z) (0,189 г, 0,336 ммоля) в сухом ДМФА (1 мл) при 0oC. Реакционную смесь перемешали при комнатной температуре в течение 24 часов. Добавили толуол (5 мл) и смесь промыли водой (4 х 2,5 мл), осушили (Na2SO4) и выпарили. Неочищенный продукт (0,18 г) очистили флеш-хроматографией (этил ацетат/метанол), после которой последовала RPLC (60% CH3CN/40% 0,1 М NH4OAc). Выход: 82 мг (34%).
Масс-спектрометрия бомбардировкой быстрыми атомами: m/z = 712 (M+ + 1)
(III) HOOC-CH2-OOC-CH2-(R)Cgl-Aze-Pab • 2HCl
BnOOC-CH2-OOC-CH2-(R)Cgl-Aze-Pab(Z) (0,070 г, 0,098 ммоля) растворили в ТГФ (10 мл) и воде (5 мл). Добавили HCl (1 М, 0,4 мл) и смесь была гидрогенизирована над 50% Pd/C при атмосферном давлении в течение 4,5 часов. Раствор профильтровали, выпарили и неочищенный продукт очистили RPLC (10% CH3CN/90% 0,1 М HOAc pH 2,8). Результирующий продукт осушили вымораживанием, обработали избытком HCl (1 М) и снова осушили вымораживанием. Выход: 21 мг (38%).
Масс-спектрометрия бомбардировкой быстрыми атомами: m/z = 488 (M+ + 1).
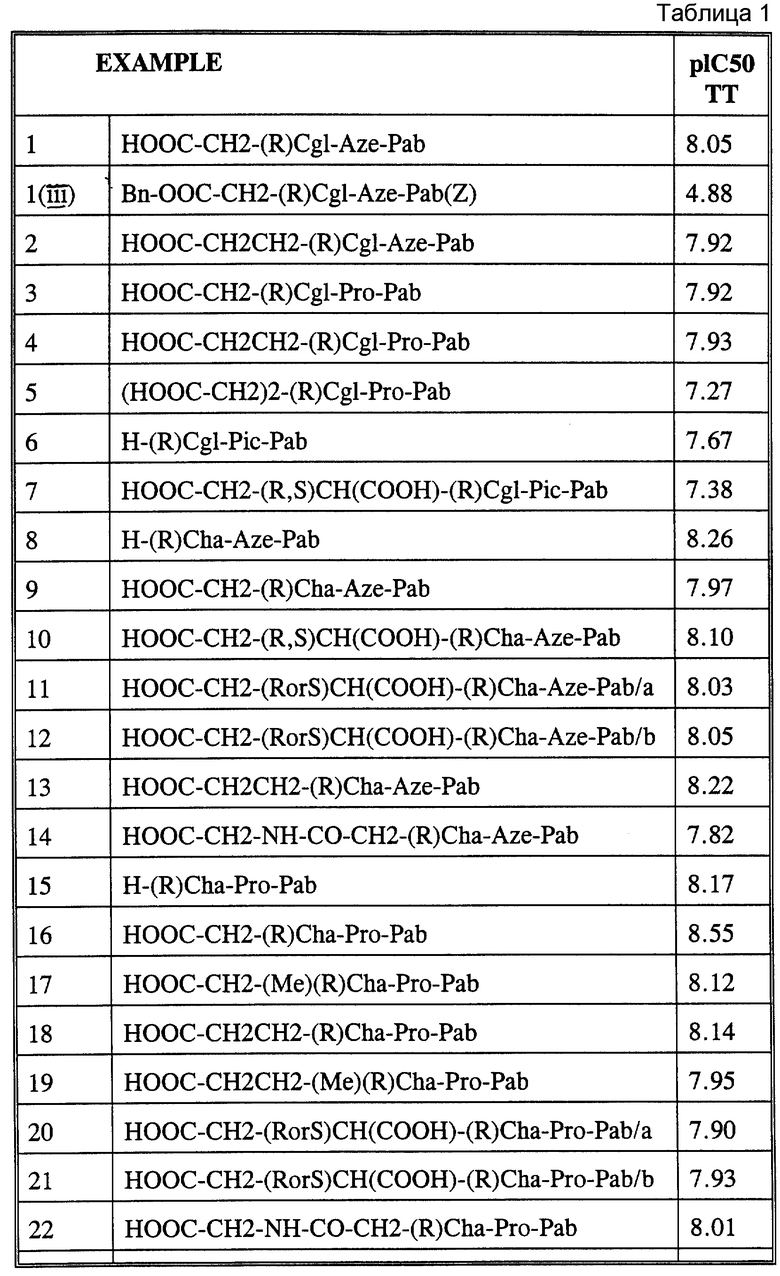
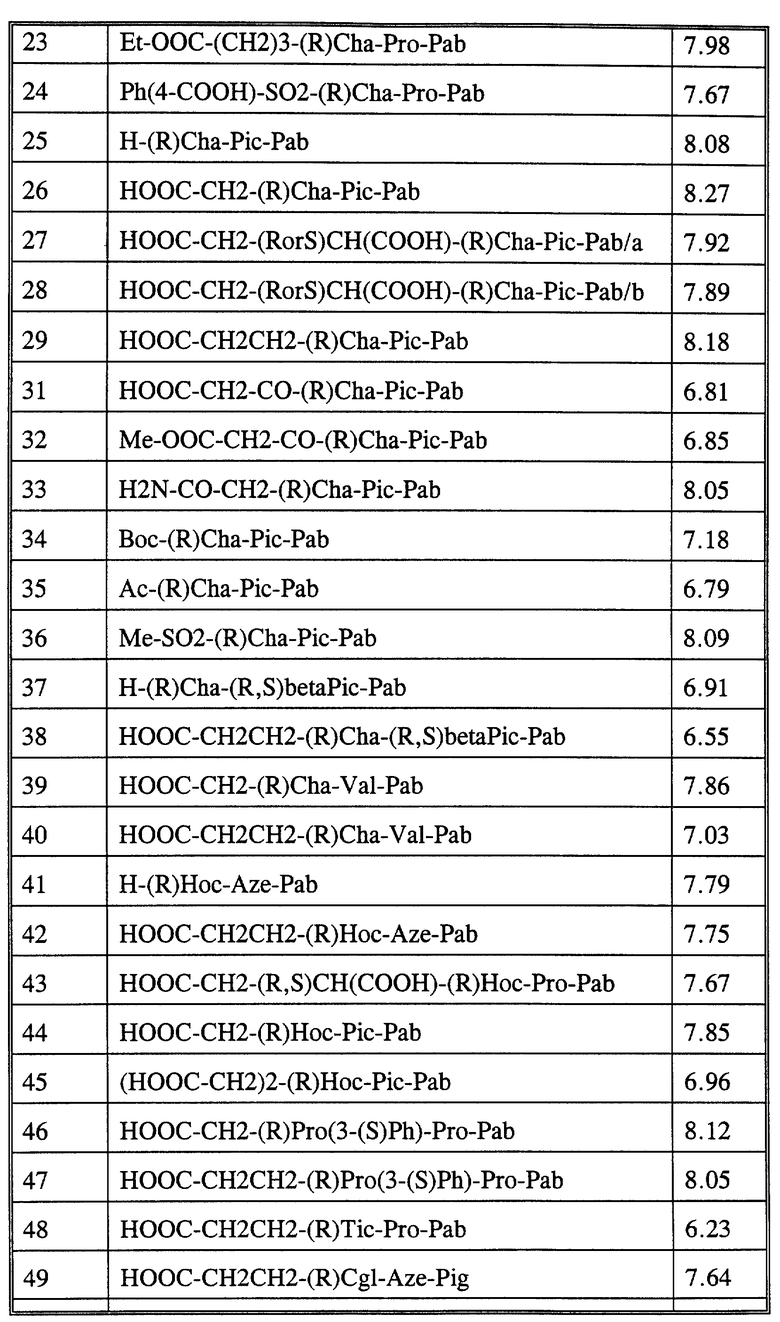
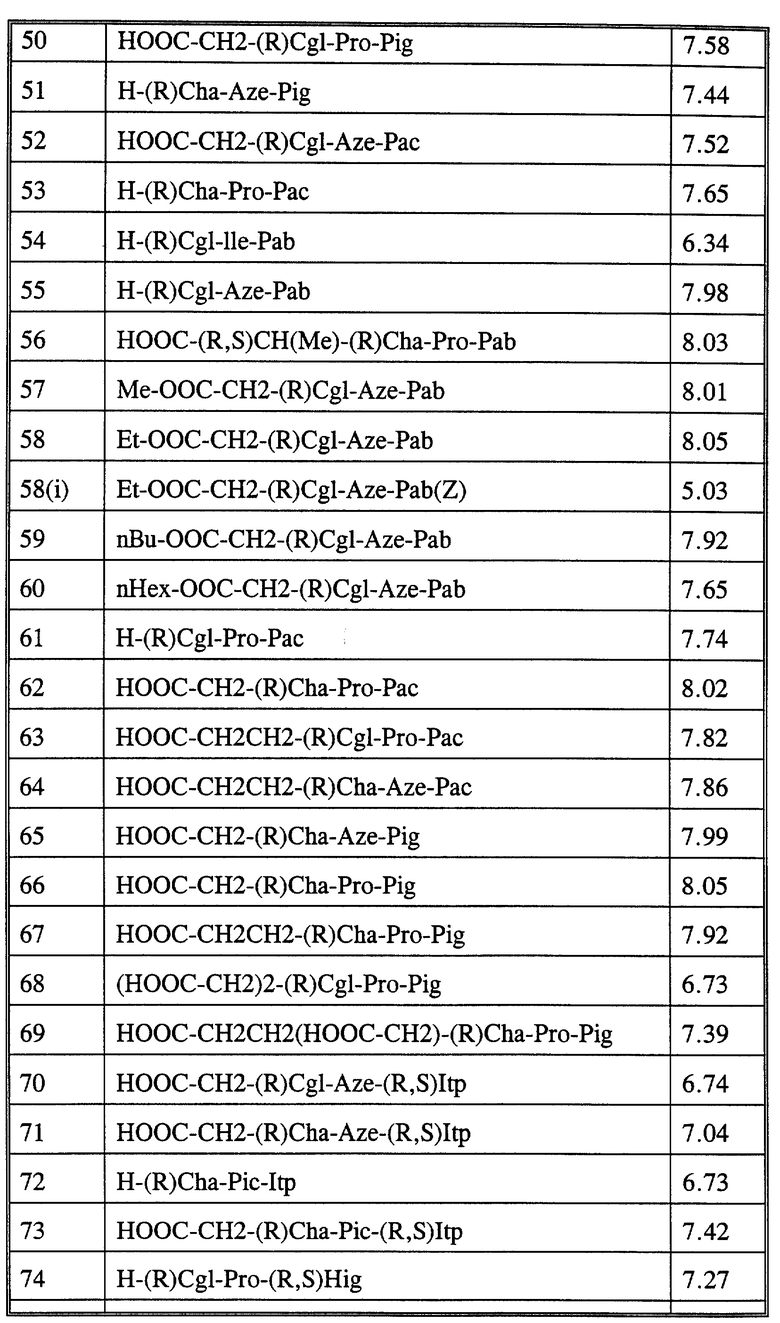
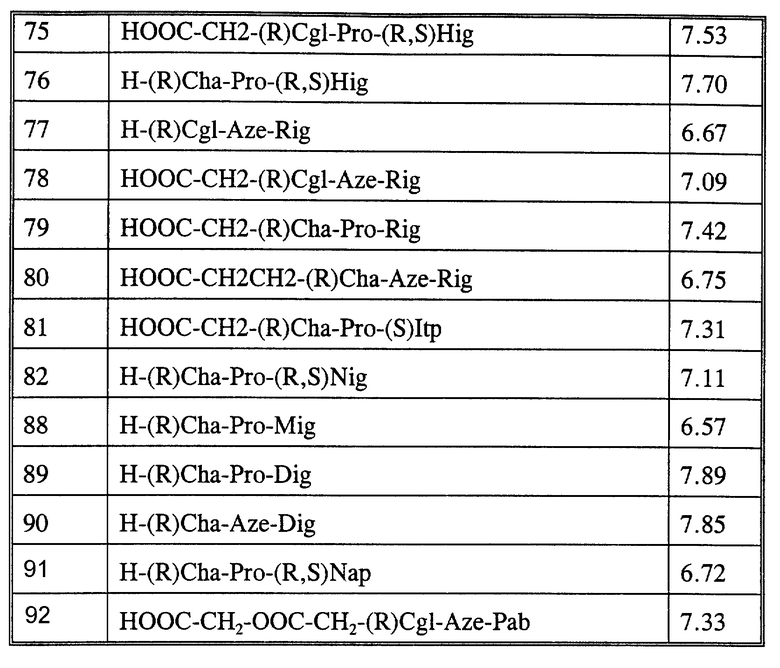
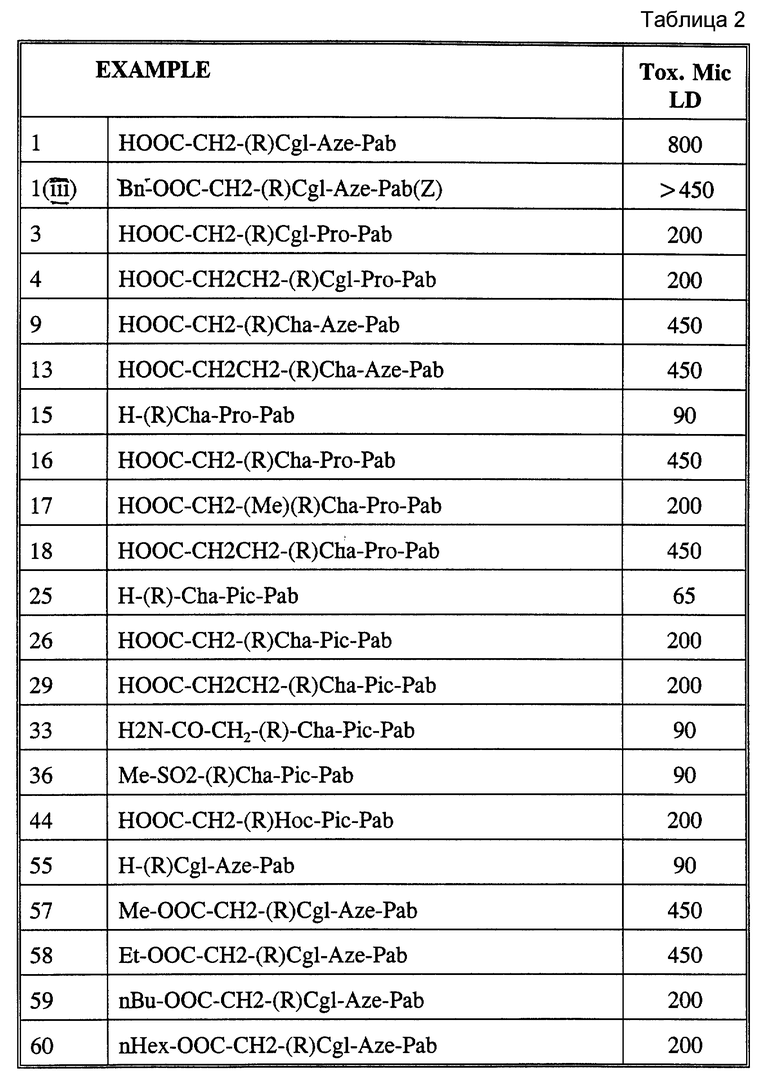
Пептидное производное общей формулы I А1 - А2 - NH -(СН)n - D, где А1 - структурный фрагмент формул IIа-д, k = 0-3, m = 1, 2; q = 0, 1, 2 или 3; R1 - H, С1-4алкил, R11OOC-алкил (другие обозначения см. п. 1 ф-лы изобретения). Соединения формулы I являются эффективными ингибиторами серин-протеаз, особенно тромбина, и кининогеназ, например калликреина. 10 с. и 28 з.п. ф-лы, 2 табл.
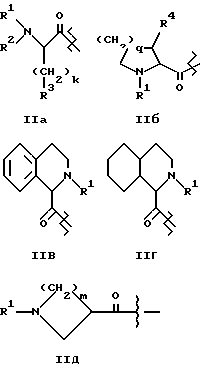
A1---A2---NH---(CH2)n---B---D,
где A1 - структурный фрагмент формулы IIa, IIb, IIc, IId или IIe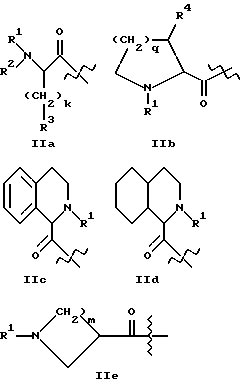
где k = 0, 1 или 2;
m = 1 или 2;
q = 0, 1, 2 или 3;
R1 представляет Н, алкильную группу с 1-4 атомами углерода или R11OOC-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу, причем альфа-заместитель представлен группой R17-(CH2)p-, где p = 0, 1 или 2 и R17 - метил, ОН, COOR12, где R12 - Н или алкильная группа с 1-4 атомами углерода или бензильная группа, R11 - H, алкильная группа с 1-6 атомами углерода или бензильная группа,
или R1 - R13-NH-CO-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и где R13 - Н, алкильная группа с 1-4 атомами углерода или CH2COOR12, где R12 принимает указанные значения,
или R1 - R12OOC-CH2-OOC-алкил, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и где R12 принимает указанные значения,
или R1 - R14SO2-, Ph(4-COOR12)-SO2-, Ph(3-COOR12)-SO2-, Ph(2-COOR12)-SO2-, где R12 принимает указанные значения, и R14 - алкильная группа с 1-4 атомами углерода,
или R1 - CO-R15, где R15 - алкильная группа с 1-4 атомами углерода,
или R1 - CO-OR15, где R15 принимает указанные значения,
или R1 - -CO-(CH2)p-COOR12, где R12 принимает указанные значения и p = 0, 1 или 2;
R2 представляет Н, алкильную группу с 1-4 атомами углерода или R21OOC-алкил, где алкильная группа имеет 1-4 атома углерода и где R21 - Н, алкильная группа с 1-4 атомами углерода или бензильная группа;
R3 представляет алкильную группу с 1-4 атомами углерода,
или R3 представляет циклопентильную, циклогексильную или фенильную группу, которая незамещена или замещена алкильной группой с 1-4 атомами углерода,
или R3 представляет фенильную группу, замещенную группой OR31, где R31 - Н или алкильная группа с 1-4 атомами углерода и k = 0, 1;
или R3 - 4-пиридил, 3-пирролидил или 3-индолил, которые незамещены или замещены ОR31-группой, где R31 принимает указанные значения и k = 0, 1;
R4 представляет Н, алкильную группу с 1-4 атомами углерода, циклогексильную или фенильную группу;
A2 - структурный фрагмент формулы IIIa, IIIb или IIIc: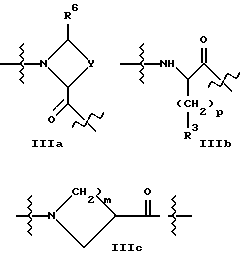
где p = 0, 1 или 2;
m = 1, 2 или 3,
Y представляет метиленовую группу,
или Y представляет этиленовую группу и образованный 5-членный цикл может быть незамещен или замещен одним или двумя атомами фтора, гидроксигруппой или оксогруппой в 4-м положении или может быть насыщенным или ненасыщенным,
или Y представляет н-пропиленовую группу, и образованный в результате 6-членный цикл может быть незамещен или замещен в 5-м положении одним атомом фтора, гидроксигруппой или оксогруппой, или содержать два атома фтора в 4-м или 5-м положении, или быть ненасыщенным в 4-м и 5-м положении, или содержать в 4-м положении алкильную группу с 1-4 атомами углерода,
или R3 принимает указанные значения;
R5 является Н, алкильной группой с 1-4 атомами углерода
или R5 - -(CH2)p-COOR51, где p = 0, 1 или 2 и R51 - Н или алкильная группа с 1-4 атомами углерода;
n = 0, 1, 2, 3 или 4,
В - структурный фрагмент формулы IVa, IVb, IVc или IVd
где r = 0 или 1;
X1 - CH2, NH или отсутствует;
X2 - CH2, NH или C=NH;
X3 - NH, C=NH, N-C(NH)-NH2 или CH-C(NH)-NH2;
X4 - CH2 или NH;
X5 - C(NH)-NH2;
X6 - CH или N;
R6 - H или алкильная группа с 1-4 атомами углерода;
D - группа Z, или (Z)2, или Н, где Z - бензилоксикарбонильная группа, связывающаяся с атомами азота амидино- или гуанидиногрупп, присутствующих в В,
как таковое, или его стереоизомеры, или в виде физиологически приемлемой соли.
A1----A2----NH-(CH2)n----B---D,
где A1 - структурный фрагмент формулы IIa, IIb, IIc, IId или IIe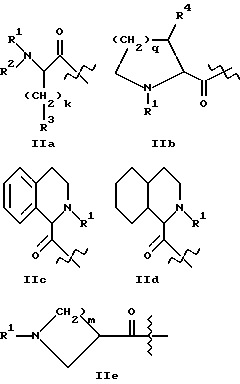
k = 0, 1 или 2;
m = 1 или 2 ;
q = 0, 1, 2 или 3;
R1 - R11OOC-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонильной группе, причем альфа-заместитель представлен группой R17-(CH2)p-, где p = 0, 1 или 2 и R17 - группа COOR12, где R12 - Н, алкильная группа с 1-4 атомами углерода или бензильная группа, R11 - H, алкильная группа с 1-6 атомами углерода или бензильная группа,
или R1 - R13-NH-CO-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбониду алкильной группой с 1-4 атомами углерода и где R13 - Н, алкильная группа с 1-4 атомами углерода или -CH2-COOR12, где R12 принимает указанные значения,
или R1 - R12OOC-CH2-OOC-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и где R12 принимает указанные значения,
или R1 - R14SO2-, Ph(4-COOR12)-SO2-, Ph(3-COOR12)-SO2-, Ph(2-COOR12)-SO2-, где R12 принимает указанные значения и R14 - алкильная группа с 1-4 атомами углерода,
или R1 - CO-R15, где R15 - алкильная группа с 1-4 атомами углерода,
или R1 - CO-OR15, где R15 принимает указанные значения,
или R1 - -CO-(CH2)p - COOR12, где R12 принимает указанные значения и p = 0, 1 или 2,
или R2 представляет Н, или алкильную группу с 1-4 атомами углерода, или R21OOC -алкил-, где алкильная группа имеет 1-4 атома углерода и где R21 - Н, алкильная группа с 1-4 атомами углерода или бензильная группа;
R3 представляет алкильную группу с 1-4 атомами углерода,
или R3 представляет циклопентильную, циклогексильную или фенильную группу, которая незамещена или замещена алкильной группой с 1-4 атомами углерода,
или R3 представляет фенильную группу, замещенную группой OR31,
где R31 - H или алкильная группа с 1-4 атомами углерода и K = 0, 1,
или R3 - 4-пиридил, 3-пирролидил или 3-индолил, которые незамещены или замещены группой OR31, где R31 принимает указанные значения и k = 0, 1;
R4 представляет Н, алкильную группу с 1-4 атомами углерода, циклогексильную или фенильную группу;
A2 - структурный фрагмент формулы IIIa, IIIb или IIIc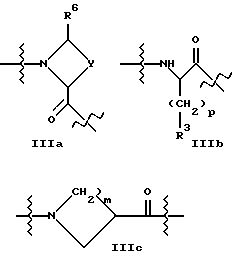
где p = 0, 1 или 2;
m = 1, 2 или 3,
Y представляет метиленовую группу,
или Y представляет этиленовую группу, и образованный в результате 5-членный цикл незамещен или замещен одним или двумя атомами фтора, гидроксигруппой или оксогруппой в 4-м положении или может быть ненасыщен,
или Y представляет н-пропиленовую группу, и образованный в результате 6-членный цикл незамещен или замещен в 5-м положении одним атомом фтора, гидроксигруппой или оксогруппой или может содержать в 4-м или 5-м положении два атома фтора, или быть ненасыщенным в 4-м или 5-м положении, или содержать в 4-м положении алкильную группу с 1-4 атомами углерода;
R3 принимает указанные значения;
R5 представляет Н или алкильную группу с 1-4 атомами углерода,
или R5 - -(CH2)p -COOR51, где p = 0, 1 или 2 и R51 - Н или алкильная группа с 1-4 атомами углерода,
n = 0, 1, 2, 3 или 4;
В - структурный фрагмент формулы IVa, IVb, IVc или IVd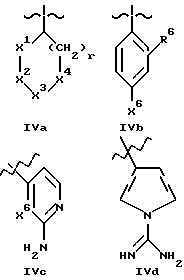
где r = 0 или 1;
X1 - CH2, NH или отсутствует;
X2 - CH2, NH или С = NH;
X3 - NH, C = NH, N-C(NH)-NH2, CH-C(NH)-NH2;
X4 - CH2 или NH;
X5 - C(NH)-NH2;
X6 - CH или N;
R6 - H или алкильная группа с 1-4 атомами углерода, D-группа Z или (Z)2, Z - бензилоксикарбонильная группа, связывающаяся с атомами азота присутствующих в В амидино- или гуанидиногрупп,
соединение как таковое или его стереоизомер или соединение в виде физиологически приемлемой соли.
HOOC-CH2-(R)Cgl-Aze-Pab
HOOC-CH2-CH2-(R)Cgl-Aze-Pab
HOOC-CH2-(R)Cgl-Pro-Pab
HOOC-CH2-CH2-(R)Cgl-Pro-Pab
(HOOC-CH2)2-(R)Cgl-Pro-Pab
H-(R)Cgl-Pic-Pab
HOOC-CH2-(R,S)CH(COOH)-(R)Cgl-Pic-Pab
H-(R)Cha-Aze-Pab
HOOC-CH2-(R)Cha-Aze-Pab
HOOC-CH2-(R,S)CH(COOH)-(R)Cha-Aze-Pab
HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Aze-Pab/a
HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Aze-Pab/b
HOOC-CH2-CH2-(R)Cha-Aze-Pab
HOOC-CH2-NH-CO-CH2-(R)Cha-Aze-Pab
H-(R)Cha-Pro-Pab
HOOC-CH2-(R)Cha-Pro-Pab
HOOC-CH2-(Me) (R)Cha-Pro-Pab
HOOC-CH2-CH2-(R)Cha-Pro-Pab
HOOC-CH2-CH2-(Me) (R)Cha-Pro-Pab
HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Pro-Pab/a
HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Pro-Pab/b
HOOC-CH2-NH-CO-CH2-(R)Cha-Pro-Pab
EtOOC-CH2-CH2-CH2-(R)Cha-Pro-Pab
Ph(4-COOH)-SO2-(R)Cha-Pro-Pab
H-(R)Cha-Pic-Pab
HOOC-CH2-(R)Cha-Pic-Pab
HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Pic-Pab/a
HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Pic-Pab/b
HOOC-CH2-CH2-(R)Cha-Pic-Pab
HOOC-CO-(R)Cha-Pic-Pab
HOOC-CH2-CO-(R)Cha-Pic-Pab
Me-OOC-CH2-CO-(R)Cha-Pic-Pab
H2N-CO-CH2-(R)Cha-Pic-Pab
Boc-(R)Cha-Pic-Pab
Ac-(R)Cha-Pic-Pab
Me-SO2-(R)Cha-Pic-Pab
H-(R)Cha-(R,S)betaPic-Pab
HOOC-CH2-CH2-(R)Cha-(R,S)betaPic-Pab
HOOC-CH2-(R)Cha-Val-Pab
HOOC-CH2-CH2-(R)Cha-Val-Pab
H-(R)Hoc-Aze-Pab
HOOC-CH2-CH2-(R)Hoc-Aze-Pab
HOOC-CH2-(R,S)CH(COOH)-(R)Hoc-Pro-Pab
HOOC-CH2-(R)Hoc-Pic-Pab
(HOOC-CH2)2-(R)Hoc-Pic-Pab
HOOC-CH2-(R)Pro(3-(S)Ph)-Pro-Pab
HOOC-CH2-CH2-(R)Pro(3-(S)Ph)-Pro-Pab
HOOC-CH2-CH2-(R)Tic-Pro-Pab
HOOC-CH2-CH2-(R)Cgl-Aze-Pig
HOOC-CH2-(R)Cgl-Pro-Pig
H-(R)Cha-Aze-Pig
HOOC-CH2-(R)Cgl-Aze-Pac
H-(R)Cha-Pro-Pac
H-(R)Cgl-Ile-Pab
H-(R)Cgl-Aze-Pab
HOOC-(R,S)CH(Me)-(R)Cha-Pro-Pab
MeOOC-CH2-(R)Cgl-Aze-Pab
EtOOC-CH2-(R)Cgl-Aze-Pab
nBuOOC-CH2-(R)Cgl-Aze-Pab
nHexOOC-CH2-(R)Cgl-Aze-Pab
H-(R)Cgl-Pro-Pac
HOOC-CH2-(R)Cha-Pro-Pac
HOOC-CH2-CH2-(R)Cgl-Pro-Pac
HOOC-CH2-CH2-(R)Cha-Aze-Pac
HOOC-CH2-(R)Cha-Aze-Pig
HOOC-CH2-(R)Cha-Pro-Pig
HOOC-CH2-CH2-(R)Cha-Pro-Pig
(HOOC-CH2)2-(R)Cgl-Pro-Pig
HOOC-CH2-CH2(HOOC-CH2)-(R)Cha-Pro-Pig
HOOC-CH2-(R)Cgl-Aze-(R,S)Itp
HOOC-CH2-(R)Cha-Aze-(R,S)Itp
H-(R)Cha-Pic-(R,S)Itp
HOOC-CH2-(R)Cha-Pic-(R,S)Itp
H-(R)Cgl-Pro-(R,S)Hig
HOOC-CH2-(R)Cgl-Pro-(R,S)Hig
H-(R)Cha-Pro-(R,S)Hig
H-(R)Cgl-Aze-Rig
HOOC-CH2-(R)Cgl-Aze-Rig
HOOC-CH2-(R)Cha-Pro-Rig
HOOC-CH2-CH2-(R)Cha-Aze-Rig
HOOC-CH2-(R)Cha-Pro-(S)Itp
H-(R)Cha-Pro-(R,S)Nig
H-(R)Cha-Pro-Mig
H-(R)Cha-Pro-Dig
H-(R)Cha-Aze-Dig
либо как таковое, либо как стереоизомер, либо в виде физиологически приемлемой соли.
HOOC-CH2-(R)Cgl-Aze-Pab
HOOC-CH2-CH2-(R)Cha-Aze-Pab
HOOC-CH2-(R)Cha-Pro-Pab
HOOC-CH2-CH2-(R)Cha-Pro-Pab
HOOC-CH2-(R)Cha-Pic-Pab
HOOC-CH2-(R)Cgl-Pro-Pig
EtOOC-CH2-(R)Cgl-Aze-Pab
HOOC-CH2-(R)Cha-Pro-Pac
HOOC-CH2-(R)Cha-Pro-Pig
либо как таковое, либо в виде стереоизомера, либо в виде физиологически приемлемой соли.
BnOOC-CH2-(R)Cgl-Aze-Pab(Z)
BnOOC-CH2-CH2-(R)Cgl-Aze-Pab(Z)
BnOOC-CH2-(R)Cgl-Pro-Pab(Z)
BnOOC-CH2-CH2-(R)Cgl-Pro-Pab(Z)
(BnOOC-CH2)2-(R)Cgl-Pro-Pab(Z)
BnOOC-CH2-(R,S)CH(COOBn)-(R)Cgl-Pic-Pab(Z)
BnOOC-CH2-(R)Cha-Aze-Pab(Z)
BnOOC-CH2-(R,S)CH(COOBn)-(R)Cha-Aze-Pab(Z)
BnOOC-CH2-(RorS)CH(COOBn)-(R)Cha-Aze-Pab(Z)/a
BnOOC-CH2-(RorS)CH(COOBn)-(R)Cha-Aze-Pab(Z)/b
BnOOC-CH2-CH2-(R)Cha-Aze-Pab(Z)
BnOOC-CH2-NH-CO-CH2-(R)Cha-Aze-Pab(Z)
BnOOC-CH2-(R)Cha-Pro-Pab(Z)
BnOOC-CH2-(Me)(R)Cha-Pro-Pab(Z)
BnOOC-CH2-CH2-(R)Cha-Pro-Pab(Z)
BnOOC-CH2-CH2-(Me)(R)Cha-Pro-Pab(Z)
BnOOC-CH2-(R,S)CH(COOBn)-(R)Cha-Pro-Pab(Z)
BnOOC-CH2-NH-CO-CH2-(R)Cha-Pro-Pab(Z)
Ph(4-COOH)-SO2-(R)Cha-Pro-Pab(Z)
Boc-(R)Cha-Pic-Pab(Z)
BnOOC-CH2-(R)Cha-Pic-Pab(Z)
BnOOC-CH2-(R,S)CH(COOBn)-(R)Cha-Pic-Pab(Z)
BnOOC-CH2-CH2-(R)Cha-Pic-Pab(Z)
EtOOC-CO-(R)Cha-Pic-Pab(Z)
MeOOC-CH2-CO-(R)Cha-Pic-Pab(Z)
H2N-CO-CH2-(R)Cha-Pic-Pab(Z)
Ac-(R)Cha-Pic-Pab(Z)
Me-SO2-(R)Cha-Pic-Pab(Z)
BnOOC-CH2-(R)Cha-Val-Pab(Z)
BnOOC-CH2-CH2-(R)Cha-(R,S)Val-Pab(Z)
BnOOC-CH2-CH2-(R)Hoc-Aze-Pab(Z)
BnOOC-CH2-(R,S)CH(COOBn)-(R)Hoc-Pro-Pab(Z)
BnOOC-CH2-(R)Hoc-Pic-Pab(Z)
(BnOOC-CH2)2-(R)Hoc-Pic-Pab(Z)
BnOOC-CH2-(R)Pro(3-(S)Ph)-Pro-Pab(Z)
BnOOC-CH2-CH2-(R)Pro(3-(S)Ph)-Pro-Pab(Z)
BnOOC-CH2-CH2-(R)Tic-Pro-Pab(Z)
BnOOC-CH2-CH2-(R)Cgl-Aze-Pig(Z)2
BnOOC-CH2-(R)Cgl-Pro-Pig(Z)2
BnOOC-CH2-(R)Cgl-Aze-Pac(Z)
BnOOC-(R,S)CH(Me)-(R)Cha-Pro-Pab(Z)
MeOOC-CH2-(R)Cgl-Aze-Pab(Z)
EtOOC-CH2-(R)Cgl-Aze-Pab(Z)
nBuOOC-CH2-(R)Cgl-Aze-Pab(Z)
nHexOOC-CH2-(R)Cgl-Aze-Pab(Z)
BnOOC-CH2-(R)Cha-Pro-Pac(Z)
BnOOC-CH2-CH2-(R)Cgl-Pro-Pac(Z)
BnOOC-CH2-CH2-(R)Cha-Aze-Pac(Z)
BnOOC-CH2-(R)Cha-Aze-Pig(Z)
BnOOC-CH2-(R)Cha-Pro-Pig(Z)
BnOOC-CH2-CH2-(R)Cha-Pro-Pig(Z)
(BnOOC-CH2)2-(R)Cgl-Pro-Pig(Z)
BnOOC-CH2-CH2(BnOOC-CH2)-(R)Cha-Pro-Pig(Z)
BnOOC-CH2-(R)Cha-Pic-(R,S)Itp(Z)
BnOOC-CH2-(R)Cgl-Pro-(R,S)Hig(Z)
BnOOC-CH2-(R)Cgl-Aze-Rig(Z)
BnOOC-CH2-(R)Cha-Pro-Rig(Z)
BnOOC-CH2-CH2-(R)Cha-Aze-Rig(Z)
либо как таковое, либо в виде стереоизомера, либо в виде физиологически приемлемой соли.
BnOOC-CH2-(R)Cgl-Aze-Pab(Z)
BnOOC-CH2-(R)Cha-Pro-Pab(Z)
BnOOC-CH2-(R)Cha-Pic-Pab(Z)
BnOOC-CH2-(R)Cgl-Pro-Pig(Z)2
EtOOC-CH2-(R)Cgl-Aze-Pab(Z)
BnOOC-CH2-(R)Cha-Pro-Pac(Z)
BnOOC-CH2-(R)Cha-Pro-Pac(Z)
либо как таковое, либо в виде стереоизомера, либо в виде физиологически приемлемой соли.
H-(R)Pro-Phe-Pab
HOOC-CH2-(R)Pro-Phe-Pab
H-(R)Phe-Phe-Pab
HOOC-CH2-(R)Phe-Phe-Pab
HOOC-CO-(R)Phe-Phe-Pab
либо как таковое, либо в виде стереоизомер, либо в виде физиологически приемлемой соли.
Boc-(R)Pro-Phe-Pab(Z)
BnOOC-CH2-(R)Pro-Phe-Pab(Z)
Boc-(R)Phe-Phe-Pab(Z)
MeOOC-CO-(R)Phe-Phe-Pab(Z)
BnOOC-CH2-(R)Phe-Phe-Pab(Z)
либо как таковое, либо как стереоизомер, либо в виде физиологически приемлемой соли.
H2N-(CH2)n-X,
где n = 0, 1, 2, 3;
X - В или В-D, где В принимает значения, указанные для формулы I, и D принимает значения, указанные для формулы V, как таковые, либо имеющие гуанидино- или амидиногруппы, атомы азота которых либо моно, либо дизащищены аминозащитной группой, представляющей собой бензилоксикарбонильную, трет-бутилоксикарбонильную, n-толуолсульфонильную группу, или Х является группой, переходящей в В с последующим снятием защитной группы или групп или деблокированием N-концевого азота с последующим алкилированием N-концевого азота и, если необходимо, деблокировании по известным методикам, образовании физиологически приемлемой соли и в тех случаях, когда в результате реакции образуется смесь стереоизомеров, смесь возможно разделяют стандартными хроматографическими или перекристаллизационными методами с выделением при желании единственного стереоизомера.
а) (Способ Ia) присоединение защищенного у N-окончания дипептида, выбранного на основании значений A1 и A2 в формуле I, применением стандартной методики присоединения пептидов, иллюстрируемой следующим уравнением реакции: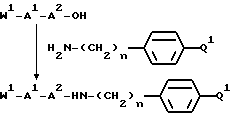
где n принимает значения, указанные для формулы I;
W4 - N-концевая аминозащитная группа, например трет-бутилоксикарбонил, бензилоксикарбонил;
Q1 представляет собой группу -C(NH)-NH2, -C(NW2)-NHW2, -C(NH)-NH-W2, -NH-C(NH)-NH2, -NH-C(NH)-NH-W2, -N(W2)-C(NH)-NH-W2 или -NH-C(NW2)-NH-W2, где W2 - аминозащитная группа, например трет-бутилоксикарбонил, бензилоксикарбонил,
или Q1 - группа -CN, -CO-NH2 или -CS-NH2, которая затем переносится в амидиногруппу,
или Q1 - группа NH2 или NH-W2, где W2 принимает указанные значения, причем аминогруппа затем переносится в гуанидиногруппу (с образованием Q1 = -NH-C(NH)-NH2) после снятия защиты W2 - группы, когда Q1 - группа -NH-W2 (в этом случае W2 - группа должна быть ортогональна к W1-группе) известными специалистам методами или
b) (Способ Ib) присоединение защищенной у N-окончания аминокислоты, выбранной на основании значений A2 для формулы I и полученной стандартным методом присоединения пептидов, иллюстрируемым следующим уравнением реакции: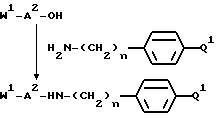
где n, W1 и Q1 принимают указанные значения,
с последующим удалением W1-группы деблокированием и соединением с N-концевой защищенной аминокислотой с образованием в результате защищенного пептида, охарактеризованного в а) приведенном Способе Ia,
или с) (Способ IIa) присоединение защищенного у N-окончания дипептида, выбранного на основании значений A1 и A2 для формулы I, использованием стандартного метода присоединения пептидов, иллюстрируемого следующим уравнением реакции: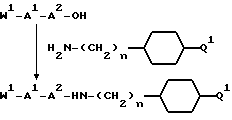
где n принимает значения, указанные для формулы I;
W1 - N - концевая аминозащитная группа, например трет-бутилоксикарбонил или бензилоксикарбонил;
Q1 - группа -C(NH)-NH2, -C(NW2)-NH-W2, -C(NH)-NH-W2, -NH-C(NH)-NH2, -NH-C(NH)-NH-W2, -N(W2)-C(NH)-NH-W2 или -NH-C(NW2)-NH-W2, где W2 - аминозащитная группа, например трет-бутилоксикарбонил или бензилоксикарбонил,
или Q1 - группа -CN, -CO-NH2 или -CS-NH2, которая затем переносится в амидиногруппу,
или Q1 - группа NH2 или NH-W2, где W2 принимает указанные значения, причем аминогруппа затем переносится в гуанидиногруппу (с образованием Q1 = NH-C(NH)-NH2) после снятия защиты W2-группы, когда Q1 - группа -NH-W2 (в этом случае W2-группа должна быть ортогональна W1-группе) известными специалистам методами,
или d) (Способ IIb) присоединение защищенной у N-окончания аминокислоты, выбранной на основании значений A2 для формулы I, применением стандартных методов присоединения пептидов, иллюстрируемых следующим уравнением реакции: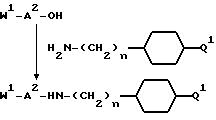
где n, W1 и Q1 принимают указанные значения,
с последующим снятием защиты W1-группы и соединением с N-концевой защищенной аминокислотой с образованием защищенного пептида, охарактеризованного в способе IIa,
или е) (Способ IIIa) присоединение защищенного у N-окончания дипептида, выбранного на основании значений A1 и A2 для формулы I, применением стандартного метода присоединения пептидов, иллюстрируемого следующим уравнением реакции: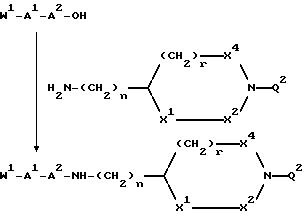
где n принимает значения, указанные для формулы I;
r = 0 или 1, когда X1, X2 и X4 - группа CH2, или r = 0, когда X2 и X4 - группа CH2 и X1 отсутствует;
W1 - N-концевая аминозащитная группа, например трет-бутилоксикарбонил или бензилоксикарбонил;
Q2 - группа -C(NH)-NH2, -C(NW2)-NH-W2 или -C(NH)-NH-W2, где W2 - аминозащитная группа, например трет-бутилоксикарбонил или бензилоксикарбонил, или Q2 = W2, при этом аминогруппа после снятия защитной W2-группы (в этом случае W2-группа должна быть ортогональна к W1-группе) затем переносится в гуанидиногруппу применением незащищенных, N-защищенных или N, N'-дизащищенных реагентов гуанидирования известными специалисту методами,
или f) (Способ IIIb) присоединение защищенной у N-окончания аминокислоты, выбранной на основании значений A2 в формуле I, применением стандартного метода присоединения пептидов, иллюстрируемого следующим уравнением реакции: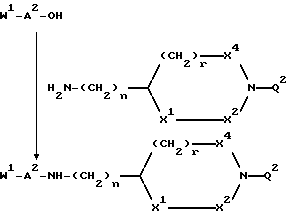
где n, r, X1, X2, X4, W1 и Q2 принимают указанные значения,
с последующим снятием защитной W1-группы и соединением с N-концевой аминокислотой в защищенной форме с образованием защищенного пептида, охарактеризованного в способе IIIa,
или g) (Способ IVa) присоединение защищенного у N-окончания дипептида, выбранного на основании значений A1 и A2 для формулы I, применением стандартного метода присоединения пептидов, иллюстрируемого следующим уравнением реакции: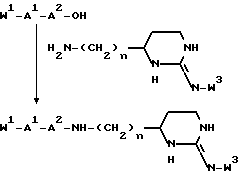
где n принимает значения, указанные для формулы I;
W1 - N - концевая аминозащитная группа, например трет-бутилоксикарбонил или бензилоксикарбонил;
W3 - Н или аминозащитная группа, например арилсульфонил, бензилоксикарбонил или трет-бутилоксикарбонил,
или h) (Способ IVb) присоединение защищенной у N-окончания аминокислоты, выбранной на основании значений A2 для формулы I, применением стандартного метода присоединения пептидов, иллюстрируемого следующим уравнением реакции:
где n, W1 и W3 принимают указанные значения,
с последующим снятием защитной W1-группы и соединением с N-концевой аминокислотой в защищенной форме с образованием защищенного пептида, охарактеризованного в способе IVa, конечные соединения могут быть получены любым из следующих способов, зависящих от природы используемой Q1- или Q2 - группы: снимают защитную группу(ы) (когда Q1 = -C(NH)-NH2, -C(NW2)-NH-W2, -C(NH)-NH-W2, -NH-C(NH)-NH2, -NH-C(NH)-NH-W2, -N(W2)-C(NH)-NH-W2 или -NH-C(NW2)-NH-W2) или селективно снимают защитную W1-группу (например, когда Q1 или Q2 = -C(NW2)-NH-W2, -C(NH)-NH-W2, -NH-C(NH)-NH-W2, -N(W2)-C(NH)-NH-W2 или -NH-C(NW2)-NH-W2 (в этом случае W2-группа должна быть ортогональна W1-группе)) с последующим алкилированием N-концевого азота и, при желании, деблокированием.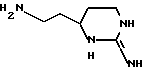
как таковое, или в котором атомы азота амидиногруппы моно- или дизащищены защитной группой, или в виде соли.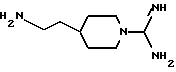
как таковое, или в котором атомы азота амидиногруппы моно- или дизащищены защитной группой, или в виде соли.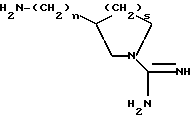
где n = 1, или 2;
s = 0 или 1,
как таковое, или в котором атомы азота амидиногруппы моно- или дизащищены защитной группой, или в виде соли.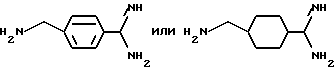
как такового, или в котором атомы азота амидиногруппы моно- или дизащищены защитной группой, или в виде соли в качестве исходного соединения в синтезе ингибитора тромбина и в особенности пептидного ингибитора тромбина.
| Способ получения производных пептидов | 1981 |
|
SU1055096A1 |
| RU 94034734 A1, 20.07.96 | |||
| Способ получения производных борсодержащих пептидов | 1988 |
|
SU1807988A3 |
| ТРЕХФАЗНЫЙ ИНВЕРТОР С ИСКУССТВЕННОЙ ЕМКОСТНОЙ КОММУТАЦИЕЙ ПО ТРЕТЬЕЙ ГАРМОНИКЕ | 0 |
|
SU185390A1 |
| СПОСОБ ОЧИСТКИ АДИПИНОВОЙ КИСЛОТЫ | 0 |
|
SU362002A1 |
| УСТРОЙСТВО ДЛЯ УКЛАДКИ ФУТЕРОВОЧНЫХ ПЛИТ В КОРПУСЕ МЕЛЬНИЦЫ | 0 |
|
SU364344A1 |
| УСТАНОВКА ДЛЯ СВИНЦЕВАНИЯ ТРУБ | 0 |
|
SU293881A1 |
| Преобразователь переменного тока | 1974 |
|
SU530167A1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| ПОГРУЖНОЙ НАСОСНЫЙ АГРЕГАТ | 2020 |
|
RU2748295C1 |
| MAPKWART FPITZ et al | |||
| Biochemical PHAPMACOI OGY | |||
| ПРИБОР ДЛЯ ЗАПИСИ И ВОСПРОИЗВЕДЕНИЯ ЗВУКОВ | 1923 |
|
SU1974A1 |
| Сдвоенный паровозный котел | 1925 |
|
SU2247A1 |
Авторы
Даты
1999-12-10—Публикация
1994-06-02—Подача