Изобретение относится к новым химическим соединениям класса А-секотритерпеноидов 18αН-олеананового и лупанового типов.
Для многих природных и полусинтетических А-секотритерпеноидов характерны противовирусные свойства, что делает данную группу соединений перспективной для разработки новых терапевтически значимых агентов [Y. Wei, C.-M. Ma, D.-Y. Chen, M. Hattori. Anti-HIV-1 protease triterpenoids from Stauntonia obovatifoliola Hayata subsp.intermedia // Phytochemistry. - 2008. - Vol.69. - P.1875-1879; Y. Wei, C.-M. Ma, M. Hattori. Synthesis of dammarane-type triterpene derivatives and their ability to inhibit HIV and HCV proteases // Bioorganic & Medicinal Chemistry. - 2009. - Vol.17. - P. 3003-3010; Y. Wei, C.-M. Ma, M. Hattori. Synthesis and evaluation of A-seco type triterpenoids for anti-HIV-1 protease activity // European Journal of Medicinal Chemistry. - 2009. - Vol.44. - P.4112-4120].
Среди соединений данного класса встречаются полусинтетические тритерпеноиды, содержащие высокореакционный фрагмент метилкетона в А-секокольце [Т. Honda, G.W. Gribble. Design and synthesis of 23,24-dinoroleanolic acid derivatives, novel triterpenoid-steroid hybrid molecules // Journal of Organic Chemistry - 1998. - Vol.63. - P.4846-4849; О.В. Kazakova, N.I. Medvedeva, O.S. Kukovinets, G.A. Tolstikov, E.F. Khusnutdinova, L. Zaprutko, B. Bednarczyk-Cwynar, Z. Paryzek. Chemoselective oxidation of oleanolic acid derivatives with ozone // Chemistry of Natural Compounds - 2010. - Vol.46. - №3. - P.397-399; Y. Deng, J. K. Snyder. Preparation of a 24-nor-1,4-dien-3-one triterpene derivative from betulin: a new route to 24-nortriterpene analogues // Journal of Organic Chemistry - 2002. - Vol.67. - P.2864-2873], в том числе обладающие антипаразитарными и цитотоксическими свойствами [С. Moiteiro, M.J.M. Curto, N. Mohamed, M. Bailen, R. Martinez-Diaz, A. Gonzalez-Coloma. Biovalorization of friedelane triterpenes derived from cork processing industry by products // Journal of Agricultural and Food Chemistry - 2006. - Vol.54. - P.3566-3571; С. Moiteiro, С. Manta, F. Justino, R. Tavares, M.J.M. Curto, M. Pedro, M.S. Nascimento, M. Pinto. Hemisynthetic secofriedelane triterpenes with inhibitory activity against the growth of human tumor cell lines in vitro // Journal of Natural Products - 2004. - Vol.67. - P.1193-1196].
Наиболее близким аналогом (прототипом) описываемых соединений по структуре является 3-нор-2,4-секофриделан-4-оксо-2-овая кислота, обладающая противоопухолевой (GI50 10,19-17,6 µM) [С. Moiteiro, С. Manta, F. Justino, R. Tavares, M.J.M. Curto, M. Pedro, M.S. Nascimento, M. Pinto. Hemisynthetic secofriedelane triterpenes with inhibitory activity against the growth of human tumor cell lines in vitro // Journal of Natural Products - 2004. - Vol.67. - P.1193-1196] и инсектицидной активностью (ЕС50 20,23 µг/мл) [С. Moiteiro, M.J.M. Curto, N. Mohamed, M. Bailen, R. Martinez-Diaz, A. Gonzalez-Coloma. Biovalorization of friedelane triterpenes derived from cork processing industry by products // Journal of Agricultural and Food Chemistry - 2006. - Vol.54. - P.3566-3571]. Однако в литературе нет сведений о противовирусных свойствах 3-нор-2,4-секофриделан-4-оксо-2-овой кислоты.
Задачей изобретения является синтез новых тритерпеновых производных для расширения сырьевой базы противовирусных агентов, перспективных также в качестве ключевых интермедиатов для получения новых биологически активных соединений.
1. Для решения поставленной задачи синтезированы А-секотритерпеноиды общей формулы (I)
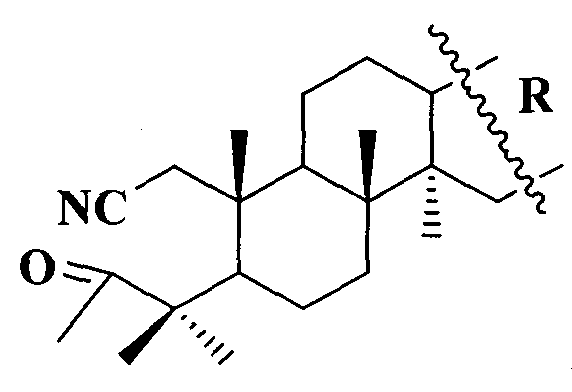 ,
,
где 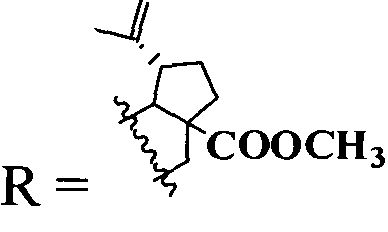 или
или 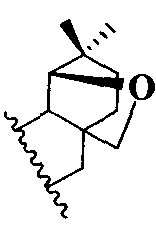 .
.
2. Соединение с 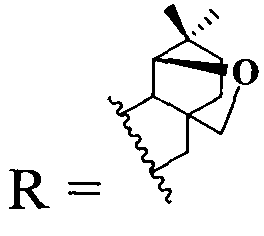 проявляет ингибирующую активность в отношении вируса герпеса простого I типа (ВГП-1, штамм 1 С) и ВИЧ-1.
проявляет ингибирующую активность в отношении вируса герпеса простого I типа (ВГП-1, штамм 1 С) и ВИЧ-1.
Синтезированы соединения общей формулы (I), где
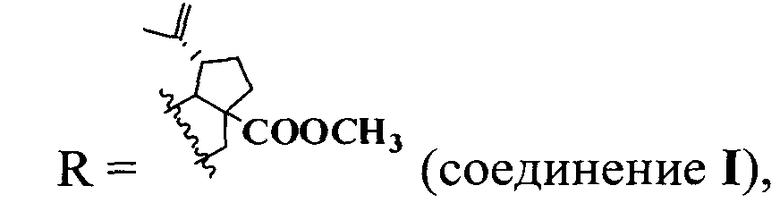

Полученные соединения представляют собой мелкокристаллические вещества белого цвета, хорошо растворимые в хлороформе, дихлорметане, четыреххлористом углероде, этиловом спирте, бензоле, толуоле, диметилсульфоксиде, плохо растворимые в гексане и нерастворимые в воде.
Структура соединений I и II подтверждена методами ИК и ЯМР спектроскопии. Спектральные характеристики соединений I, II и ключевых интермедиатов приведены в таблице. Спектры ЯМР 1Н (δ, м.д.; J, Гц) записывали для раствора в CDCl3 на спектрометре «Varian Mercury+300» (США) при рабочей частоте прибора 300 МГц, внутренний стандарт - гексаметилдисилоксан. ИК спектры (ν, см-1) регистрировали на ИК-Фурье-спектрометре IFS 66/S Bruker (Германия) в тонкой пленке, полученной испарением раствора вещества в CHCl3 на поверхности стекла NaCl. Пороговое значение температуры в точке плавления определяли на приборе OptiMelt MPA100 (США) со скоростью 1°С в мин. Величину удельного оптического вращения измеряли для раствора в CHCl3 на поляриметре 341 модели Perkin-Elmer (США) при длине волны 589 нм. Качественный контроль веществ проводили методом ТСХ на пластинах «Sorbfil» (Россия), для определения величины Rf использовали систему гексан-этилацетат 7:3, обнаружение веществ осуществляли обработкой 5% H2SO4 с последующим прогреванием пластины при 95-100°С в течение 2-3 мин. Для колоночной хроматографии использовали силикагель марки «Merck» (60-200 µm), элюент смесь гексан-этилацетат (10:1).
В исследованиях in vitro выявлена ингибирующая активность соединения II в отношении репродукции вируса герпеса простого I типа (ВГП-1) и вируса иммунодефицита человека I типа (ВИЧ-1).
Описания заявляемых соединений и их свойств в источниках информации не обнаружено.
Сущность предлагаемого решения и возможность его осуществления подтверждается примерами 1-6 и результатами исследований, приведенными в таблице.
Синтез заявляемых соединений проводили двумя способами.
Первый способ заключается в алкилировании 2-гидроксиминопроизводных бетулоновой кислоты или аллобетулона метилмагний-иодидом с последующим расщеплением по Бекману полученных 2-гидроксимино-3β-гидрокси-3-метилпроизводных бетулоновой кислоты или аллобетулона [Синтез лупановых и 19β,28-эпокси-18α-олеанановых 2,3-секо-производных на основе бетулина / И.А. Толмачева, А.В. Назаров, О.А. Майорова, В.В. Гришко // Химия природных соединений. - 2008. - №5. - С.491-494].
Второй способ состоит в алкилировании метилмагнийиодидом метилового эфира 1-циано-2,3-секо-2-норлуп-20(29)-ен-3-аль-28-овой кислоты или 1-циано-19β,28-эпокси-2,3-секо-2-нор-18αН-олеанан-3-аля [Синтез лупановых и 19β,28-эпокси-18α-олеанановых 2,3-секо-производных на основе бетулина / И.А. Толмачева, А.В. Назаров, О.А. Майорова, В.В. Гришко // Химия природных соединений. - 2008. - №5. - С.491-494] с последующим окислением реактивом Джонса полученных 3-гидрокси-3-метил-1-циано-2-нор-2,3-секотритерпеноидов.
Пример 1. Получение метилового эфира 3-метил-3-оксо-1-циано-2,3-секо-2-норлуп-20(29)-ен-28-овой кислоты (соединение I, метод 1).
К 3 мл свежеприготовленного раствора CH3MgI (13,2 ммоль) в диэтиловом эфире прибавляли небольшими порциями 6,6 ммоль метилового эфира 2-гидроксимино-3-оксолуп-20(29)-ен-28-овой кислоты, затем прикапывали 13 мл безводного диэтилового эфира. Реакционную смесь перемешивали при нагревании в течение 1 ч, затем прикапывали 25 мл ледяной воды и добавляли 20 мл разбавленной в два раза HCl. Смесь перемешивали до полного растворения осадка в течение 1 ч. Продукт реакции экстрагировали этилацетатом (3×20 мл). Органический слой отделяли, промывали насыщенным раствором NaHSO3, затем 5% раствором NaHCO3 и небольшим количеством воды, сушили над безводным MgSO4. Растворитель упаривали, остаток очищали с помощью колоночной хроматографии.
Выход продукта реакции составил 88%, Rf=0,6 (хлороформ-метанол 20:1), т.пл. 204,6°С (гексан-этилацетат 5:1); 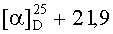
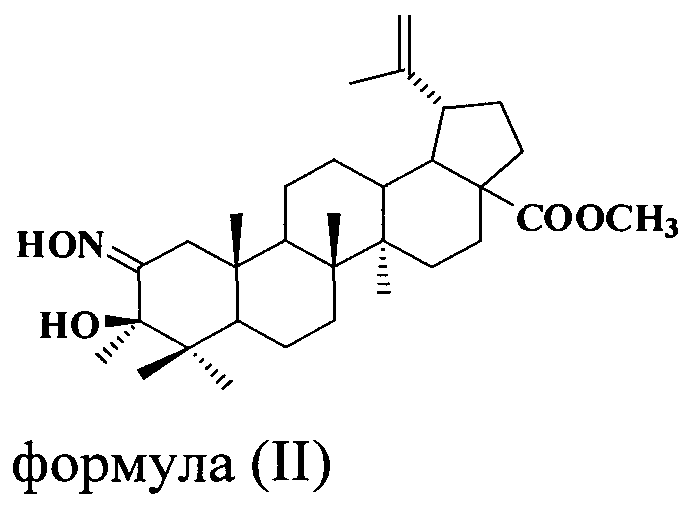
Полученный таким образом метиловый эфир 3β-гидрокси-3-метил-2-гидроксимино-2-норлуп-20(29)-ен-28-овой кислоты формулы (II) в количестве 4,6 ммоль растворяли при перемешивании в сухом дихлорметане, добавляли 14,0 ммоль тионилхлорида. Реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Проверяли полноту прохождения реакции методом ТСХ. После окончания реакции растворитель упаривали в вакууме водоструйного насоса. Остаток промывали два раза сухим дихлорметаном для избавления от следов тионилхлорида. Соединение I очищали с помощью колоночной хроматографии.
Выход 83%; Rf=0,6; т. пл. 229,8°С (гексан-этилацетат 5:1); 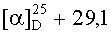
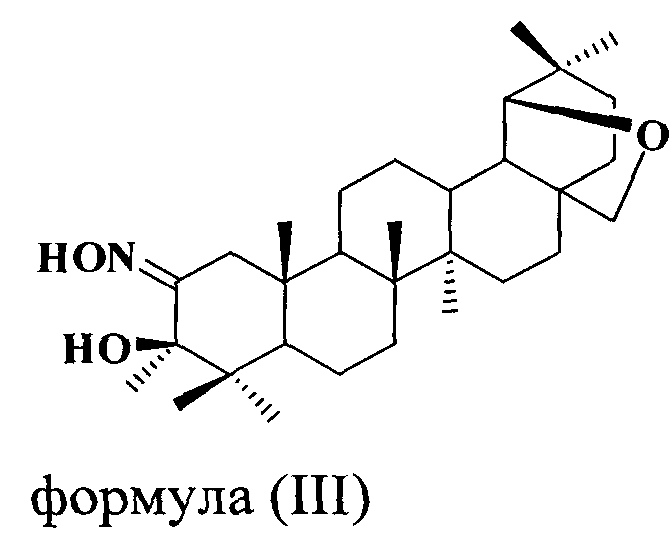
Пример 2. 3-Метил-1-циано-19β,28-эпокси-2,3-секо-2-нор-18αН-олеанан-3-он (соединение II, метод 1) синтезировали по методике, описанной в примере 1, используя в качестве исходного соединения 2-гидроксимино-19β,28-эпокси-18αН-олеан-3-он, из которого получали промежуточный 3β-гидрокси-3-метил-2-гидроксимино-19β,28-эпокси-2-нор-18αН-олеанан формулы (III) с выходом 86%, Rf=0,6 (хлороформ-метанол 20:1), т.пл. 193,7°С (гексан-этилацетат 5:1); 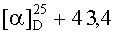
Выход соединения II 84%; Rf=0,4; т.пл. 163,4°С (гексан-этилацетат 5:1); 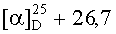
Пример 3. Получение метилового эфира 3-метил-3-оксо-1-циано-2,3-секо-2-норлуп-20(29)-ен-28-овой кислоты (соединение I, метод 2).
К 3 мл свежеприготовленного раствора CH3MgI (4,4 ммоль) в диэтиловом эфире прибавляли небольшими порциями 2,2 ммоль метилового эфира 1-циано-2,3-секо-2-норлуп-20(29)-ен-3-аль-28-овой кислоты, затем прикапывали 13 мл безводного диэтилового эфира. Реакционную смесь перемешивали при нагревании в течение 1 ч, затем прикапывали 25 мл ледяной воды и добавляли 20 мл разбавленной в два раза HCl. Смесь перемешивали до полного растворения осадка в течение 1 ч. Продукты реакции экстрагировали этилацетатом (3×20 мл). Органический слой отделяли, промывали насыщенным раствором NaHSO3, затем 5% раствором NaHCO3 и небольшим количеством воды, сушили над безводным MgSO4. Этилацетат упаривали в вакууме водоструйного насоса. Остаток в количестве 0,25 ммоль растворяли в 20 мл ацетона, добавляли 0,5 мл реактива Джонса. Реакционную смесь перемешивали в течение 6 ч. Контроль за ходом реакции осуществляли методом ТСХ. Ацетон отгоняли, остаток разбавляли водой и экстрагировали 10×3 мл этилацетата. Органический слой сушили над безводным MgSO4. Растворитель упаривали, соединение I очищали с помощью колоночной хроматографии.
Выход соединения I составил 75%.
Пример 4. 3-Метил-1-циано-19β,28-эпокси-2,3-секо-2-нор-18αН-олеанан-3-он (соединение II, метод 2) синтезировали по методике, описанной в примере 3. В качестве исходного соединения использовали 1-циано-19β,28-эпокси-2,3-секо-2-нор-18αН-олеанан-3-аль.
Выход соединения II составил 57%.
Пример 5. Исследование противовирусной активности в отношении вируса герпеса простого I типа.
При проведении исследований использовали линию клеток рабдомиосаркомы человека (RD) и вирус герпеса простого I типа (ВГП-1, штамм 1С). Монослойную культуру клеток RD, выращенную в лунках пластиковой 96-луночной панели, отмывали от ростовой среды, инфицировали 0,01-0,001 ТЦИД50/клетка ВГП-1 путем нанесения на клетки разведений вируссодержащей суспензии в объеме 0,1 мл на 1 ч при 37°С. Затем жидкость удаляли и клетки покрывали средой поддержки (среда DMEM), содержащей различные концентрации исследуемых веществ. Водонерастворимые вещества предварительно растворяли в 10% этаноле. При последующем разведении использовали DMEM. Содержание этанола в конечных концентрациях веществ для исследования не превышало 1%. На каждую концентрацию изучаемого вещества использовали по 2-4 лунки с культурой клеток, инфицированной одним разведением вируса. Для изучения противовирусных свойств каждого вещества использовали 3-4 разведения вируса. После 48 ч инкубации при 37°С регистрировали морфологические изменения монослоя клеток (цитопатическое действие (ЦПД) вируса, увеличение ×80). На основе наличия/отсутствия ЦПД вируса в лунках с разными концентрациями вещества вычисляли титр вируса. Первичным критерием противовирусного действия считали наличие различий в сравнении с контролем вируса. На основе значений титра вируса вычисляли среднеэффективную концентрацию вещества (ЕС50). Рассчитывали также отношение максимально переносимой концентрации (МПК) соединения к ЕС50. МПК определяли как максимальную концентрацию вещества, не оказывающую влияния на морфологию неокрашенной культуры клеток за период инкубации (48 ч).
Пример 6. Методика исследования противовирусной активности в отношении ВИЧ-1.
Испытания проводили на перевиваемой суспензионной Т-лимфо-бластоидной линии клеток человека МТ-4 (плотность 4-5×105 клеток/мл) на питательной среде RPMI-1640 Sigma-Aldrich (США). В качестве инфекционного агента использовали высокорепликативный изолят ВИЧ-1zmb с титром 6,0 lg ТЦИД50/мл. Определение наличия анти-ВИЧ активности проводили в формазановом тесте (МТТ-вариант). Исходный раствор препарата (5,0 мг/мл) готовили ex tempore путем растворения в 10% этаноле. Базовый раствор титровали в лунках 96-луночной панели с 5-кратным шагом, после чего в лунки последовательно вносили клетки и вирус (терапевтическая схема). Конечный объем реакционной смеси составлял 200 мкл/лунку. Контролями служили необработанные препаратом ВИЧ-инфицированные клетки (контроль вируса) и необработанные неинфицированные клетки (контроль клеток). Панели инкубировали в атмосфере, содержащей 5% CO2 при 37°С. Учет результатов осуществляли через 72 ч. В качестве позитивного контроля на анти-ВИЧ активность в каждой серии экспериментов использовали коммерческий препарат азидотимидина, который титровали параллельно с исследуемым образцом.
Методика базируется на определении интенсивности образования формазанового продукта при внесении в клеточную культуру реагента МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид). После 3-часовой экспозиции при 37°С надосадок удаляли, а образовавшийся формазановый продукт растворяли в диметилсульфоксиде, затем проводили измерение интенсивности развившегося окрашивания на спектрофотометре Plate Reader DAS A3 (Италия) при длине волны 550/630 нм. Результаты теста учитывали путем определения индекса защиты клеток, который в положительных случаях должен быть не ниже 50%. Вычисляли ЕС50 препарата и отношение МПК/ЕС50, характеризующее широту спектра его нетоксических эффективных концентраций.
Установлено, что соединение II подавляет репродукцию ВГП-1 и ВИЧ-1, ЕС50 составляет 21,1 и 7,2 мкг/мл, отношение МПК/ЕС50 - 9,5 и 9,4 соответственно.
Полученные вещества могут быть использованы в качестве ключевых интермедиатов для получения новых биологически активных соединений, а соединение II - непосредственно для разработки противовирусных средств.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРИТЕРПЕНОИДЫ С ФРАГМЕНТОМ ЕН-НИТРИЛА В А-ПЕНТАЦИКЛЕ | 2012 |
|
RU2496785C1 |
| ЦИТОТОКСИЧЕСКАЯ И ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ 3-АЦИЛОКСИМЕТИЛ-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОР-ТРИТЕРПЕНОИДОВ | 2018 |
|
RU2682669C1 |
| ЦИТОТОКСИЧЕСКАЯ И ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ 3-АЦИЛОКСИМЕТИЛ-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОР-ТРИТЕРПЕНОИДОВ | 2018 |
|
RU2686100C1 |
| ЛУПАНОВЫЕ А-СЕКОТРИТЕРПЕНОИДЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВОВИРУСНУЮ АКТИВНОСТЬ | 2011 |
|
RU2470003C1 |
| СПОСОБ ПОЛУЧЕНИЯ А-СЕКОТРИТЕРПЕНОВЫХ С-3(28) МОНО-И ДИАМИДОВ И ИХ СЕКОИНТЕРМЕДИАТОВ | 2013 |
|
RU2525546C1 |
| ТРИТЕРПЕНОВЫЕ АМИДЫ ЛУПАНОВОГО ТИПА С ФРАГМЕНТОМ 2-АМИНОБУТАН-1-ОЛА, ПРОЯВЛЯЮЩИЕ ВИРУСИНГИБИРУЮЩУЮ И ВИРУЛИЦИДНУЮ АКТИВНОСТЬ | 2017 |
|
RU2664804C1 |
| 3-ГИДРОКСИМИНОПРОИЗВОДНЫЕ 2,3-СЕКОЛУПАНОВОГО ТИПА, ПРОЯВЛЯЮЩИЕ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИРУСА ГРИППА А И ВИЧ-1 | 2011 |
|
RU2475476C1 |
| 2,3-СЕКО-ПРОИЗВОДНЫЕ БЕТУЛОНОВОЙ КИСЛОТЫ | 2009 |
|
RU2410390C1 |
| АЦЕТИЛГИДРАЗОН 1-ЦИАНО-19β,28-ЭПОКСИ-2,3-СЕКО-18α-ОЛЕАН-3-АЛЯ, ПРОЯВЛЯЮЩИЙ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИРУСА ВЕЗИКУЛЯРНОГО СТОМАТИТА ШТАММ "ИНДИАНА" | 2010 |
|
RU2429227C1 |
| МЕТИЛОВЫЕ ЭФИРЫ 3-МЕТИЛ-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОРЛУП-20(29)-ЕН-30-АЛЬ-28-ОВОЙ И 3-БРОММЕТИЛЕН-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОРЛУП-20(29)-ЕН-30-АЛЬ-28-ОВОЙ КИСЛОТ, ПРОЯВЛЯЮЩИЕ ЦИТОТОКСИЧЕСКУЮ АКТИВНОСТЬ | 2016 |
|
RU2632002C1 |
Изобретение относится к А-секотритерпеноидам общей формулы (I), проявляющим ингибирующую активность в отношении вируса герпеса простого I типа (ВГП-1, штамм 1С) и ВИЧ-1. Кроме того, Соединения (I) могут быть использованы в качестве интермедиатов для других биологически активных соединений 1 з.п. ф-лы, 1 табл., 6 пр.
 (I),
(I),
где  или
или 
1. А-секотритерпеноиды общей формулы
 ,
,
где  или
или  .
.
2. Соединение по п.1, где  , проявляющее ингибирующую активность в отношении вируса герпеса простого I типа (ВГП-1, штамм 1С) и ВИЧ-1.
, проявляющее ингибирующую активность в отношении вируса герпеса простого I типа (ВГП-1, штамм 1С) и ВИЧ-1.
| ЛУПАНОВЫЕ А-СЕКОТРИТЕРПЕНОИДЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВОВИРУСНУЮ АКТИВНОСТЬ | 2011 |
|
RU2470003C1 |
| АЦЕТИЛГИДРАЗОН 1-ЦИАНО-19β,28-ЭПОКСИ-2,3-СЕКО-18α-ОЛЕАН-3-АЛЯ, ПРОЯВЛЯЮЩИЙ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИРУСА ВЕЗИКУЛЯРНОГО СТОМАТИТА ШТАММ "ИНДИАНА" | 2010 |
|
RU2429227C1 |
| 3-ГИДРОКСИМИНОПРОИЗВОДНЫЕ 2,3-СЕКОЛУПАНОВОГО ТИПА, ПРОЯВЛЯЮЩИЕ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИРУСА ГРИППА А И ВИЧ-1 | 2011 |
|
RU2475476C1 |
Авторы
Даты
2015-01-10—Публикация
2013-11-28—Подача