Изобретение относится к новым химическим соединениям класса А-секотритерпеноидов лупанового типа, которые проявляют цитотоксическую активность.
Среди природных и полусинтетических пентациклических тритерпеноидов с разнообразной биологической активностью бетулин, бетулиновая, олеаноловая и урсоловая кислоты, как и их многочисленные полусинтетические производные имеют высокую значимость для разработки противораковых агентов [Е. Е. Rufino-Palomares,  , F. J. Reyes-Zurita,
, F. J. Reyes-Zurita,  , K. Mokhtari,
, K. Mokhtari,  , P.P. Medina,
, P.P. Medina, ,
,  . Anti-cancer and anti-angiogenic properties of various natural pentacyclic triterpenoids and some of their chemical derivatives // Current Organic Chemistry. - 2015. - Vol. 19. - 919 - P. 947; M. Kvasnica, M. Urban, N.J. Dickinsonc, J. Sarek. Pentacyclic triterpenoids with nitrogen- and sulfur-containing heterocycles: synthesis and medicinal significance // Natural Product Reports - 2015. - Vol. 32. - №9. - P. 1303-1330;
. Anti-cancer and anti-angiogenic properties of various natural pentacyclic triterpenoids and some of their chemical derivatives // Current Organic Chemistry. - 2015. - Vol. 19. - 919 - P. 947; M. Kvasnica, M. Urban, N.J. Dickinsonc, J. Sarek. Pentacyclic triterpenoids with nitrogen- and sulfur-containing heterocycles: synthesis and medicinal significance // Natural Product Reports - 2015. - Vol. 32. - №9. - P. 1303-1330;  ,
,  ,
,  , A. Stepulak. Comprehensive review on betulin as a potent anticancer agent // BioMed Research International. - 2015. - Vol. 2015. - P. 1-11; R. Csuk. Betulinic acid and its derivatives: a patent review (2008-2013) // Expert Opinion Therapeutic Patents. - 2014. - Vol. 24. - №8. - P. 1-11; S.Y. Lee, H.H. Kim, S.U. Park. Recent studies on betulinic acid and its biological and pharmacological activity // EXCLI Journal - 2015. - Vol. 14. - P. 199-203; D.-M. Zhang, H.-G. Xu, L. Wang, Y.-J. Li, P.-H. Sun, X.-M. Wu, G.-J. Wang, W.-M. Chen, W.-C. Ye. Betulinic acid and its derivatives as potential antitumor agents // Medicinal Research Reviews - 2015. - Vol. 35. - №6 - P. 1127-1155; M. Ali-Seyed, I. Jantan, K. Vijayaraghavan, S.N.A. Bukhari. Betulinic acid: recent advances in chemical modifications, effective delivery, and molecular mechanisms of a promising anticancer therapy // Chemical Biology and Drug Design - 2016. - Vol. 87. - №4. - P. 517-536; M.K. Shanmugam, X. Dai, A.P. Kumar, В.K. Tan, G. Sethi, A. Bishayee. Oleanolic acid and its synthetic derivatives for the prevention and therapy of cancer: preclinical and clinical evidence // Cancer Letters - 2014. - Vol. 346. - №2. - P. 206-216; H. Chen, Y. Gao, A. Wang, X. Zhou, Y. Zheng, J. Zhou. Evolution in medicinal chemistry of ursolic acid derivatives as anticancer agents // European Journal of Medicinal Chemistry - 2015. - Vol. 92. - P. 648-655; D. Kashyap, H.S. Tuli, A.K. Sharma. Ursolic acid (UA): A metabolite with promising therapeutic potential // Life Sciences - 2016. - Vol. 146. - P. 201-213].
, A. Stepulak. Comprehensive review on betulin as a potent anticancer agent // BioMed Research International. - 2015. - Vol. 2015. - P. 1-11; R. Csuk. Betulinic acid and its derivatives: a patent review (2008-2013) // Expert Opinion Therapeutic Patents. - 2014. - Vol. 24. - №8. - P. 1-11; S.Y. Lee, H.H. Kim, S.U. Park. Recent studies on betulinic acid and its biological and pharmacological activity // EXCLI Journal - 2015. - Vol. 14. - P. 199-203; D.-M. Zhang, H.-G. Xu, L. Wang, Y.-J. Li, P.-H. Sun, X.-M. Wu, G.-J. Wang, W.-M. Chen, W.-C. Ye. Betulinic acid and its derivatives as potential antitumor agents // Medicinal Research Reviews - 2015. - Vol. 35. - №6 - P. 1127-1155; M. Ali-Seyed, I. Jantan, K. Vijayaraghavan, S.N.A. Bukhari. Betulinic acid: recent advances in chemical modifications, effective delivery, and molecular mechanisms of a promising anticancer therapy // Chemical Biology and Drug Design - 2016. - Vol. 87. - №4. - P. 517-536; M.K. Shanmugam, X. Dai, A.P. Kumar, В.K. Tan, G. Sethi, A. Bishayee. Oleanolic acid and its synthetic derivatives for the prevention and therapy of cancer: preclinical and clinical evidence // Cancer Letters - 2014. - Vol. 346. - №2. - P. 206-216; H. Chen, Y. Gao, A. Wang, X. Zhou, Y. Zheng, J. Zhou. Evolution in medicinal chemistry of ursolic acid derivatives as anticancer agents // European Journal of Medicinal Chemistry - 2015. - Vol. 92. - P. 648-655; D. Kashyap, H.S. Tuli, A.K. Sharma. Ursolic acid (UA): A metabolite with promising therapeutic potential // Life Sciences - 2016. - Vol. 146. - P. 201-213].
Кроме того, высокий противоопухолевый потенциал демонстрируют Br-содержащие тритерпеноиды, в частности, соединения, выделенные из морских водорослей и проявляющие цитотоксичность в отношении линий клеток лейкемии и рака молочной железы [N.Y. Ji, X.М. Li, Н. Xie, J. Ding, K. Li, L.P. Ding, B.G. Wang. Highly Oxygenated triterpenoids from the marine red alga Laurencia mariannensis (Rhodomelaceae) // Helvetica Chimica Acta. - 2008. - Vol. 91 - P. 1940-1946; M.K. Peca, A. Aguirrea, K. Moser-Thier, J.J. Ferna'ndezb, M.L. Soutob, J. Dortab, F. Dia-Gonza'lez, J. Villar. Induction of apoptosis in estrogen dependent and independent breast cancer cells by the marine terpenoid dehydrothyrsiferol // Biochemical Pharmacology - 2003. - Vol. 65. - P. 1451-1461].
Наиболее близкими аналогами описываемых соединений по структуре являются 2-бром-дигидробетулоновая кислота, обладающая высокой цитотоксической активностью [М. Urban, М. Vlk, P. Dzubak, М. Hajduch, J. Sarek. Cytotoxic heterocyclic triterpenoids derived from betulin and betulinic acid // Bioorganical & Medical Chemistry - 2012. - Vol. 20. - P. 3666-3674] и метиловый эфир 3-метил-3-оксо-1-циано-2,3-секо-2-норлуп-20(29)-ен-28-овой кислоты [А.V. Pereslavtseva, I.A. Tolmacheva, P.A. Slepukhin, О.S. El'tsov, I.I. Kucherov, V.F. Eremin, V.V. Grishko. Synthesis of A-pentacyclic α,β-alkenenitriles // Chemistry of Natural Compounds. - 2014. - Vol. 49. - №6. - P. 1059-1066; А-Секотритерпеноиды с фрагментом метилкетона / Толмачева И.А., Гришко В.В., Переславцева А.В., Бореко Е.И., Еремин В.Ф., Савинова О.В., Кучеров И.И. // Патент РФ №2537840. - 10.01.2015].
Задачей изобретения является синтез новых тритерпеновых производных для расширения сырьевой базы противоопухолевых агентов, а также перспективных в качестве ключевых интермедиатов для получения новых биологически активных соединений.
1. Для решения поставленной задачи синтезированы
А-секотритерпеноиды общей формулы:
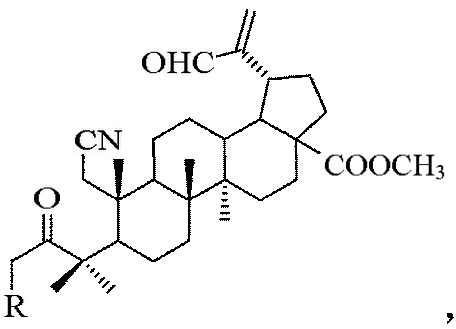
где R=Н или Br.
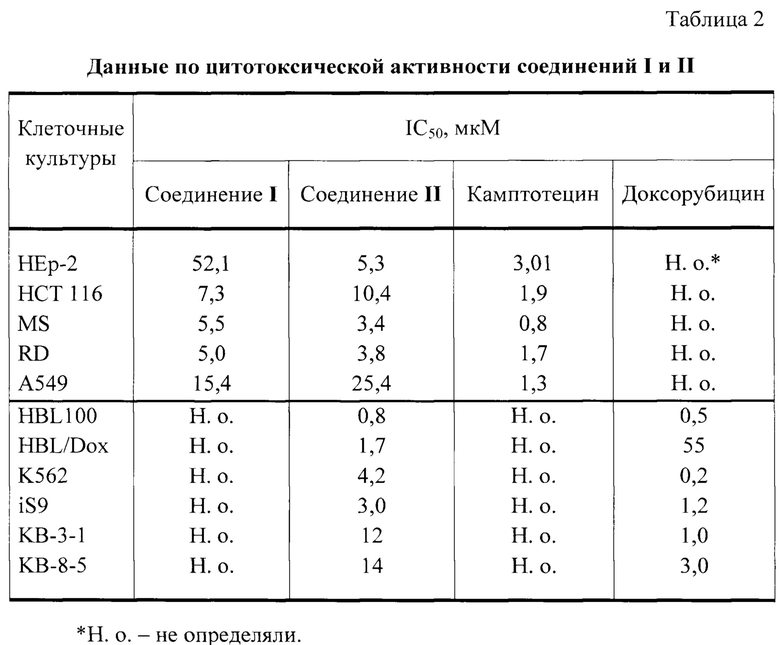
2. Соединения, где R=Н или Br, проявляют цитотоксическую активность в отношении опухолевых клеток линий НЕр-2 (карциномы гортани), НСТ 116 (колоректальной карциномы), MS (меланомы), RD ТЕ 32 (рабдомиосаркомы), А549 (немелкоклеточной карциномы легкого).
3. Соединение, где R=Br, проявляет цитотоксическую активность в отношении опухолевых клеток линий HBL100 (рак молочной железы), К562 (хронический миелолейкоз) и KB-3-1 (рак ротовой полости) и их лекарственно-устойчивых вариантов HBL/Dox (линия клеток рака молочной железы, устойчивых к доксорубицину), iS9 (линия клеток хронического миелолейкоза, устойчивых к доксорубицину) и KB-8-5 (линия клеток рака ротовой полости, устойчивых к доксорубицину).
Синтезированы соединения общей формулы, где
R=Н (соединение I),
R=Br (соединение II).
Полученные соединения представляют собой мелкокристаллические вещества белого цвета, хорошо растворимые в хлороформе, дихлорметане, четыреххлористом углероде, этиловом спирте, бензоле, толуоле, диметил-сульфоксиде, плохо растворимые в гексане и не растворимые в воде.
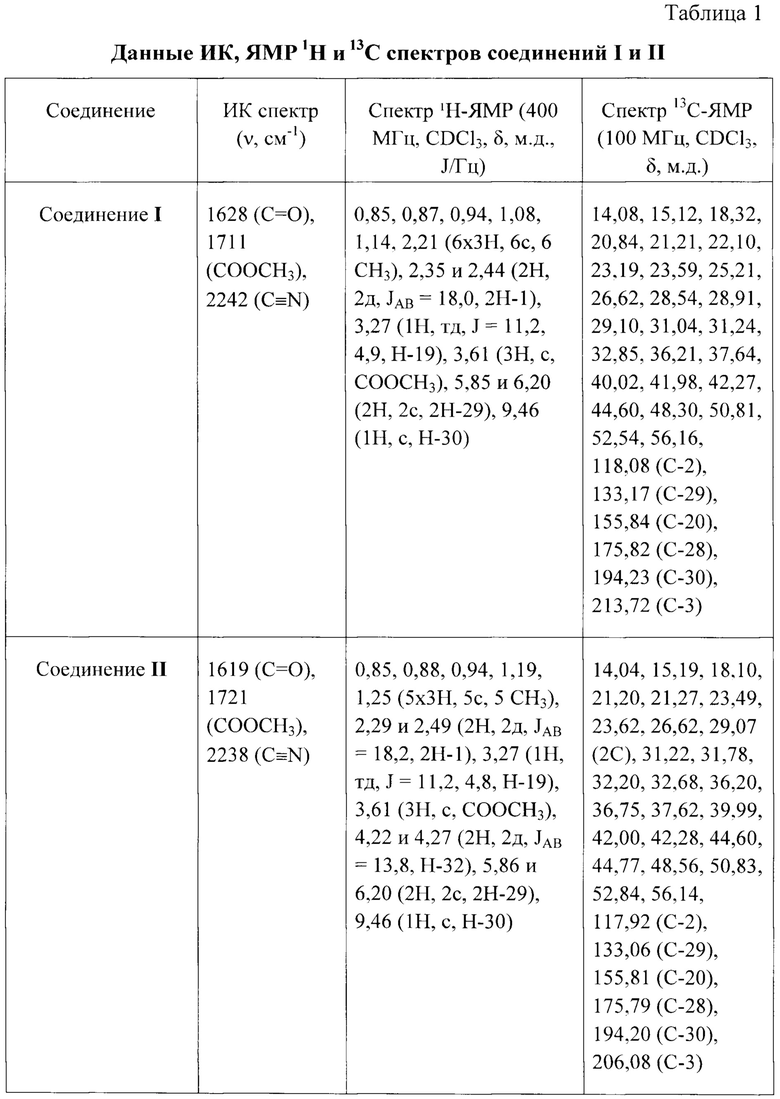
Структура соединений I и II подтверждена методами ИК и ЯМР спектроскопии. Спектральные характеристики соединений I и II приведены в таблице. Спектры ЯМР 1Н и 13С-ЯМР (δ, м.д.; J, Гц) записывали для растворов соединений в CDCl3 на спектрометре Bruker AVANCE II (Германия) при рабочей частоте прибора 400 и 100 МГц соответственно. В качестве внутреннего стандарта использовали тетраметилсилан. ИК спектры (v, см-1) регистрировали на ИК-Фурье-спектрометре IFS 66/S Bruker (Германия) в тонкой пленке, полученной испарением раствора вещества в СНСl3 на поверхности стекла NaCl. Пороговое значение температуры в точке плавления определяли на приборе OptiMelt МРА100 (США) со скоростью 1°С в мин. Величину удельного оптического вращения измеряли для растворов соединений в CHCl3 на поляриметре 341 модели Perkin-Elmer (США) при длине волны 589 нм. Качественный контроль реакции проводили методом ТСХ на пластинах «Sorbfil» (Россия). Обнаружение веществ осуществляли обработкой пластин 5% H2SO4 c последующим прогреванием при 95-100°С в течение 2-3 мин. Для колоночной хроматографии использовали силикагель марки «Macherey-nagel» (60-200 μm), элюент смесь петролейный эфир-этил ацетат (7:1).
В исследованиях in vitro выявлена цитотоксическая активность соединений I и II в отношении линий опухолевых клеток А549, НСТ 116,
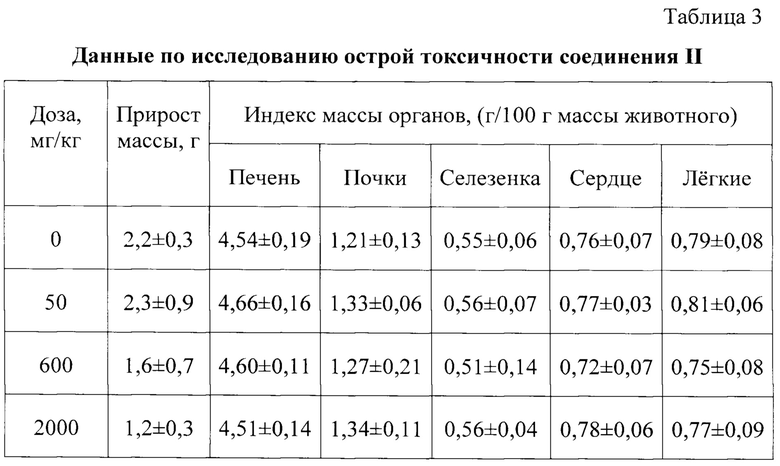
HEp-2, MS, PvD ТЕ 32. Соединение II проявляет также цитотоксическую активность в отношении линий опухолевых клеток HBL100, K562 и KB-3-1 и их лекарственно-устойчивых вариантов HBL/Dox, iS9 и KB-8-5 соответственно. Соединение II практически нетоксично в тесте острой токсичности на инбредных белых мышах (ЛД50 более 2000 мг/кг).
Описания заявляемых соединений и их свойств в источниках информации не обнаружено.
Сущность предлагаемого решения и возможность его осуществления подтверждается примерами 1-4 и результатами исследований, приведенными в таблицах 1-3.
Пример 1. Получение метилового эфира 3-метил-3-оксо-1-циано-2,3-секо-2-норлуп-20(29)-ен-30-аль-28-овой кислоты (соединение I).
В смесь диоксана и воды при 60°С и перемешивании вносили 1.2 ммоль H2SeO3, после полного растворения добавляли 0.4 ммоль метилового эфира 3-метил-3-оксо-1-циано-2,3-секо-2-норлуп-20(29)-ен-28-овой кислоты. Реакционную смесь нагревали при перемешивании с обратным холодильником, через 7 ч смесь охлаждали, отфильтровывали выпавший Se, диоксан отгоняли. Остаток разбавляли водой и экстрагировали этилацетатом (3×20 мл). Органический слой промывали 5% раствором NaHCO3 и водой, сушили над безводным MgSO4. Растворитель упаривали, соединение I очищали с помощью колоночной хроматографии.
Выход соединения I составил 78%, Rƒ0.3 (петролейный эфир-этилацетат, 7:3), т. пл. 166,3°С (гексан-этилацетат, 7:1), 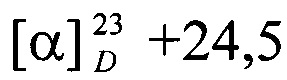 (с 0,4; CHCl3).
(с 0,4; CHCl3).
Пример 2. Получение метилового эфира 3-(бромметилен)-3-оксо-1-циано-2,3-секо-2-норлуп-20(29)-ен-30-аль-28-овой кислоты (соединение II).
Полученный по методике, описанной в примере 1, метиловый эфир 3-метил-3-оксо-1-циано-2,3-секо-2-норлуп-20(29)-ен-30-аль-28-овой кислоты в количестве 1 ммоль растворяли в уксусной кислоте, добавляли 0,5 ммоль пербромида пиридинийбромида и перемешивали при комнатной температуре, через 7 ч добавляли дополнительно 0,5 моль пербромида пиридинийбромида. Полученную смесь перемешивали при комнатной температуре в течение 6 ч. Полноту прохождения реакции контролировали методом ТСХ. Реакционную массу разбавляли водой и экстрагировали этилацетатом (3×20 мл). Органический слой промывали 5% раствором NaHCO3 и водой, сушили над безводным MgSO4. Растворитель упаривали, соединение II очищали с помощью колоночной хроматографии.
Выход 86%, Rƒ 0.3 (гексан-этилацетат, 5:1), т. пл. 155,8°С (гексан-этилацетат, 7:1); 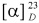 +63,0 (с 0,4; СНСl3).
+63,0 (с 0,4; СНСl3).
Пример 3. Исследование цитотоксической активности соединений I и II в отношении клеток А549, НСТ 116, НЕр-2, MS, RD ТЕ32 и соединения II в отношении клеток HBL100, HBL/Dox, K562, iS9, KB-3-1, KB-8-5.
Клетки выращивали при температуре 37°С во влажной стерильной атмосфере 5% CO2 в соответствующих средах: для НЕр-2, НСТ 116, RD ТЕ 32, А549, КВ-3-1 и КВ-8-5 использовали DMEM, для MS, HBL100, HBL/Dox, K562 и iS9 - RPMI 1640. В культуральные среды добавляли 10% эмбриональной телячьей сыворотки, 2 мМ L-глутамина и 1% гентамицина. В эксперименте клетки высевали в 96 луночные планшеты в концентрации 1×104 клеток/200 мкл. После 24 ч инкубации к монослою клеток добавляли исследуемые соединения в концентрации от 10-4 до 10-6 М в виде раствора в ДМСО. Через 72 ч инкубации в лунки вносили по 20 мкМ МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид) (Alfa Aesar, UK) в концентрации 5 мг/мл, после чего планшеты инкубировали еще 4 ч. Затем среду сливали, кристаллы формазана растворяли в 60 мкл ДМСО. Оптическую плотность растворов измеряли при 544 нм с помощью планшетного спектрофотометра FLUOstar Optima (BMG Labtech, GmbH).
По изменению оптической плотности определяли показатель IC50 - концентрацию, токсическую для 50% клеток в культуре. Результаты представлены в виде среднего значения трех независимых экспериментов. В качестве препарата-сравнения использовали камптотецин или доксорубицин.
Результаты исследований цитотоксической активности соединений I и II представлены в таблице 2.
Пример 4. Исследование острой токсичности соединения II на инбредных белых мышах.
Белых инбредных мышей-самцов массой 16-22 г содержали в условиях 12 ч светового дня, в пластиковых клетках, на подстилке из опилок, с неограниченным доступом к воде и питанию. Доступ к корму, но не к воде, ограничивали в течение 4 ч до введения вещества. Исследование острой токсичности соединения II проводили по методике [ГОСТ 32644-2014. Методы испытания по воздействию химической продукции на организм человека. Острая пероральная токсичность - метод определения класса острой токсичности. Москва: Стандартинформ, 2015]. В опытные группы отбирали по 3-6 животных без отклонений во внешнем виде и отклонением по массе не более чем на 10% от среднего значения.
Соединение II в виде суспензии в 500 мкл кукурузного масла вводили перорально однократно в дозе 50, 600 или 2000 мг/кг. При выборе доз ориентировались на растворимость вещества и максимальный объем жидкости, допустимый при пероральном введении мышам. В эксперименте использовали 24 аутбредных беспородных мышей самцов весом 16-22 г, разделенных на группы по 6 животных.
В качестве критерия оценки острой токсичности служили следующие показатели: число павших животных, сроки гибели, ЛД50 через 24-72 ч, картина интоксикации, результаты аутопсии павших и выживших животных. Учет гибели и общего состояния животных проводили каждые 24 ч эксперимента.
В течение 14 сут наблюдения не отмечалась гибель животных в опытных и контрольной группах. Животные экспериментальных групп по истечении периода наблюдения были выведены из эксперимента и вскрыты. Внешних отличий между животными опытных и контрольных групп выявлено не было. При патологоанатомическом осмотре не выявлено патологий внутренних органов. Таким образом, можно сделать вывод о том, что показатель ЛД50 для исследуемого соединения превышает 2000 мг/кг. Согласно классификации токсичности [ГОСТ 32644-2014. Методы испытания по воздействию химической продукции на организм человека. Острая пероральная токсичность - метод определения класса острой токсичности. Москва: Стандартинформ, 2015], исследуемое соединение II относится к 5 классу токсичности (ЛД50>2000 мг/кг).
В таблице 3 приведены индексы массы органов экспериментальных животных в виде среднего значения в группе и стандартного отклонения и прирост массы животных за 14 сут наблюдения. Индекс рассчитывали из отношения массы органа к 100 г массы животного, прирост массы рассчитывали как разницу между весом животного до затравки и на 14 сут наблюдения. Достоверных отличий между показателями контрольной группы и экспериментальных групп не отмечается. Прирост массы животных составил до 10% в опытных и контрольной группе.
Полученные вещества могут быть использованы в качестве ключевых интермедиатов для получения новых биологически активных соединений. Соединение II практически нетоксично и может быть использовано непосредственно для разработки противоопухолевых средств.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЦИТОТОКСИЧЕСКАЯ И ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ 3-АЦИЛОКСИМЕТИЛ-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОР-ТРИТЕРПЕНОИДОВ | 2018 |
|
RU2686100C1 |
| МЕТИЛОВЫЙ ЭФИР 24-ДИБРОМ-4-ОКСО-2-ЦИАНО-3,23-ДИНОРЛУП-28-ОВОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЙ ЦИТОТОКСИЧЕСКУЮ АКТИВНОСТЬ | 2022 |
|
RU2784317C1 |
| ЦИТОТОКСИЧЕСКАЯ И ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ 3-АЦИЛОКСИМЕТИЛ-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОР-ТРИТЕРПЕНОИДОВ | 2018 |
|
RU2682669C1 |
| N-[3-ОКСОЛУП-20(29)-ЕН-28-ОИЛ]-2,2,6,6-ТЕТРАМЕТИЛПИПЕРИДИН-4-ИЛАМИН, ОБЛАДАЮЩИЙ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ОПУХОЛЕВЫХ КЛЕТОК ЧЕЛОВЕКА | 2017 |
|
RU2641900C1 |
| АЦЕТИЛГИДРАЗОН 1-ЦИАНО-19β,28-ЭПОКСИ-2,3-СЕКО-18α-ОЛЕАН-3-АЛЯ, ПРОЯВЛЯЮЩИЙ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИРУСА ВЕЗИКУЛЯРНОГО СТОМАТИТА ШТАММ "ИНДИАНА" | 2010 |
|
RU2429227C1 |
| ТРИТЕРПЕНОИДЫ С ФРАГМЕНТОМ ЕН-НИТРИЛА В А-ПЕНТАЦИКЛЕ | 2012 |
|
RU2496785C1 |
| ТРИТЕРПЕНОВЫЕ АМИДЫ ЛУПАНОВОГО ТИПА С ФРАГМЕНТОМ 2-АМИНОБУТАН-1-ОЛА, ПРОЯВЛЯЮЩИЕ ВИРУСИНГИБИРУЮЩУЮ И ВИРУЛИЦИДНУЮ АКТИВНОСТЬ | 2017 |
|
RU2664804C1 |
| Способ получения N-[3-оксо-20(29)лупен-28-оил]-ω-аминокислот | 2019 |
|
RU2684288C1 |
| (17S)-N-БЕНЗИЛ-5-((3β-АЦЕТОКСИ-28-НОР-УРС-12-ЕН)-17-ИЛ)-1,3,4-ОКСАДИАЗОЛ-2-АМИН, ОБЛАДАЮЩИЙ СЕЛЕКТИВНОЙ ЦИТОТОКСИЧНОСТЬЮ В ОТНОШЕНИИ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ MCF-7 | 2019 |
|
RU2708400C1 |
| Применение N'-бензилиденгидразида 3β-О-ацетил-11-оксо-18βН-олеан-12-ен-30-овой кислоты в качестве средства, ингибирующего вирус Зика | 2022 |
|
RU2831765C2 |
Изобретение относится к A-секотритерпеноидам общей формулы:
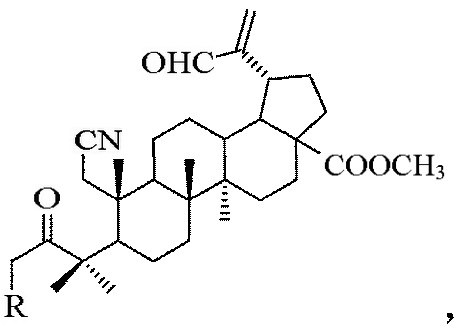
где R=Н или Br. Технический результат: получены новые А-секотритерпеноиды лупанового типа обладающие цитотоксической активностью. 2 з.п. ф-лы, 3 табл., 4 пр.
1. A-секотритерпеноиды общей формулы:
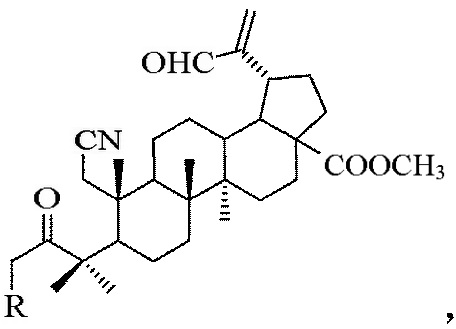
где R=Н или Br.
2. Соединения по п. 1, где R=Н или Br, проявляющие цитотоксическую активность в отношении опухолевых клеток линий НЕр-2, НСТ 116, MS, RD ТЕ 32 и A549.
3. Соединение по п. 1, где R=Br, проявляющее цитотоксическую активность в отношении опухолевых клеток линий HBL100, K562 и KB-3-1 и их лекарственно-устойчивых вариантов HBL/Dox, iS9 и KB-8-5.
| И | |||
| А | |||
| Толмачева и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Е | |||
| В | |||
| Игошева и др | |||
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
| 2,3-СЕКО-ПРОИЗВОДНЫЕ БЕТУЛОНОВОЙ КИСЛОТЫ | 2009 |
|
RU2410390C1 |
| ЛУПАНОВЫЕ А-СЕКОТРИТЕРПЕНОИДЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВОВИРУСНУЮ АКТИВНОСТЬ | 2011 |
|
RU2470003C1 |
| А-СЕКОТРИТЕРПЕНОИДЫ С ФРАГМЕНТОМ МЕТИЛКЕТОНА | 2013 |
|
RU2537840C1 |
Авторы
Даты
2017-10-02—Публикация
2016-12-28—Подача