Изобретение относится к новым химическим соединениям класса лу-пановых тритерпеноидов.
Для многих природных и полусинтетических А-секотритерпеноидов характерны цитотоксические или противовирусные свойства, что делает данную группу соединений перспективной для разработки новых терапевтически значимых агентов [Y. Wei, С.-М. Ma, D.-Y. Chen, М. Hattori. Anti-HIV-1 protease triterpenoids from Stauntonia obovatifoliola Hayata subsp.intermedia //Phytochemistry. - 2008. -Vol.69.-P. 1875-1879; Y. Wei, C.-M. Ma, M. Hattori. Synthesis and evaluation of A-seco type triterpenoids for anti-HIV-1 protease activity // European Journal of Medicinal Chemistry. -2009. - Vol.44. - P. 4112-4120; Y. Wei, C.-M. Ma, M. Hattori. Synthesis of dammarane-type triterpene derivatives and their ability to inhibit HIV and HCV proteases // Bioorganic & Medicinal Chemistry. - 2009. - Vol.17. - P. 3003-3010].
Известны лупановые и 19(3,28-эпокси-18αН-олеанановые 1-циано-2,3-секотритерпеноиды), проявляющие активность в отношении вирусов оболочечного типа (гриппа А, герпеса простого 1 типа и везикулярного стоматита, в частности) [И.А.Толмачева, В.В.Гришко, Е.И.Бореко, О.В.Савинова, Н.И.Павлова. Синтез и противовирусная активность 2,3-се/со-производных бетулоновой кислоты // Химия природных соединений. -2009. - №5. - С.566-568; Н.В.Галайко, И.А.Толмачева, В.В.Гришко, Л.В.Волкова, Е.Н.Перевозчикова, С.А.Пестерева. Противовирусная активность лупановых и 19β,28-эпокси-18α-олеанановых 2,3-секотритерпеновых гидразонов) // Биоорганическая химия. - 2010. - Т. 36. -№4.-С.556-562].
Известны также 1-циано-2,3-секотритерпеноиды, которые могут быть использованы в качестве базовых соединений в синтезе А-пентациклических тритерпеноидов с 1-циано-1-еновым фрагментом. Изомерный 2-циано-1-еновый фрагмент в шестичленном цикле А определяет высокий уровень фармакологической активности ряда полусинтетических тритерпеноидов [М.В.Sporn, К.Т.Liby, М.М.Yore, L.Fu, J.М.Lopchuk, G.W.Gribble. New synthetic triterpenoids: potent agents for prevention and treatment of tissue injury caused by inflammatory and oxidative stress // Journal of Natural Products.-2011.-Vol.74.-P. 537-545].
Наиболее близкими к заявляемым соединениям по структуре являются природная цеанотовая кислота и полусинтетические А-пентациклсодержащие тритерпеноиды, которые обладают выраженной цитотоксической активностью [S.-S. Lee, W.-C. Chen, C.-F. Huang, Y. Su. Preparation and cytotoxic effect of ceanothic acid derivatives // Journal of Natural Products. - 1998. - Vol.61. - P. 1343-1347; K. Nakagawa-Goto, K. Yamada, M. Taniguchi, H. Tokuda, K.-H.Lee. Cancer preventive agents 9. Betulinic acid derivatives as potent cancer chemopreventive agents // Bioorganic & Medicinal Chemistry Letters. 2009. - Vol.19. - P. 3378-3381].
Задачей изобретения является синтез новых тритерпеновых производных, проявляющих противовирусную активность для расширения сырьевой базы противовирусных средств, а также перспективных в качестве ключевых интермедиатов для получения новых биологически активных соединений.
Для решения поставленной задачи синтезированы
1. А-пентациклические тритерпеноиды общей формулы:
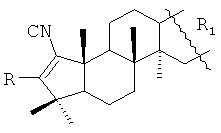 ,
,
где R=Н, R1=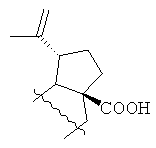 или R=Н, R1=
или R=Н, R1=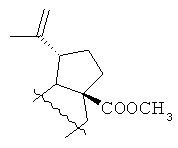 или
или
R=Н, R1=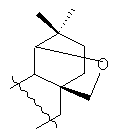 или R=NH2, R1=
или R=NH2, R1= или
или
R=NH2, R1=
2. Соединение по п.1, где R=Н, R1= , проявляющее ингибирующую активность в отношении ВИЧ-1.
, проявляющее ингибирующую активность в отношении ВИЧ-1.
3. Соединения по п.1, где R=Н, R1= или
или
R=Н, R1=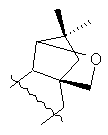 , проявляющие ингибирующую активность в отношении вируса герпеса простого I типа (ВГП-1, штамм 1 С).
, проявляющие ингибирующую активность в отношении вируса герпеса простого I типа (ВГП-1, штамм 1 С).
Получены соединения общей формулы, где R=Н, R1=
(соединение I); R=Н, R1= (соединение II); R=Н, R1=
(соединение II); R=Н, R1=
(соединение III), R=NH2, R1= (соединение IV), R=NH2, R1=
(соединение IV), R=NH2, R1=  (соединение V), которые представляют собой мелкокристаллические вещества белого цвета.
(соединение V), которые представляют собой мелкокристаллические вещества белого цвета.
Указанные соединения хорошо растворимы в хлороформе, дихлорметане, четыреххлористом углероде, этиловом спирте, бензоле, толуоле, диметилсульфоксиде, плохо растворимы в гексане и не растворимы в воде.
Синтез соединений I-III проводили способом, включающим внутримолекулярную циклизацию 1-циано-2,3-секолуп-20(29)-ен-3-аль-28-овой кислоты (для соединения I) или метилового эфира 1-циано-2,3-секолуп-20(29)-ен-3-аль-28-овой кислоты (для соединения II) или 1-циано-19β,28-эпокси-18αН-олеанан-3-аля (для соединения III). Синтез соединений IV и V проводили способом, включающим внутримолекулярную циклизацию метилового эфира 1,4-дициано-2,3-секолуп-20(29)-ен-28-овой кислоты (для соединения IV) или 1,4-дициано-19β,28-эпокси-18αН-олеанана (для соединения V).
Структура заявляемых соединений подтверждена методами ИК и ЯМР спектроскопии. Спектральные характеристики соединений I-V приведены в таблице 1. ИК-спектры (ν, см-1) регистрировали на ИК-Фурье-спектрометре IFS 66/S Bruker (Германия) в пасте с вазелиновым маслом. Спектры 1Н- и 13С-ЯМР (δ, м.д.; J, Гц) записывали для растворов в CDCl3 на спектрометре Varian Mercury+(США) при рабочей частоте прибора 300,0 МГц, внутренний стандарт - гексаметилдисилоксан. Пороговое значение температуры в точке плавления при скорости нагрева 1°С/мин определяли на приборе OptiMelt МРА100 (США). ТСХ-анализ проводили на пластинах Sorbfil (Россия) в системе гексан/этилацетат. Обнаружение веществ осуществляли обработкой 5% H2SO4 с последующим прогреванием пластины при 95-100°С в течение 2-3 мин. Для колоночной хроматографии использовали силикагель 60-200 µm марки Merck (Германия), элюент для каждого соединения подбирали индивидуально.
Противовирусная активность заявляемых соединений изучена на культурах клеток. Соединения II и III проявляют противовирусную активность в отношении вируса герпеса простого I типа (ВГП-1). Соединение II проявляет противовирусную активность в отношении вируса иммунодефицита человека I типа (ВИЧ-1).
Описания заявляемых соединений и их свойств в источниках информации не обнаружено.
Сущность предлагаемого решения и возможность его осуществления подтверждается примерами 1-7 и результатами исследований, приведенными в таблицах 1 и 2.
Пример 1. Получение 1-циано-2-нор-луп-1(3),20(29)-диен-28-овой кислоты (соединение I).
Смесь 0.5 ммоль 1-циано-2,3-секолуп-20(29)-ен-3-аль-28-овой кислоты и 1 ммоль t-BuOK в присутствии 10 мл t-BuOH кипятили в течение 1.5 ч. Реакцию контролировали методом ТСХ. Реакционную смесь разбавляли 30 мл 5% раствором HCl и экстрагировали этилацетатом (50 мл × 2). Органический слой промывали 10% раствором NaНСО3 и сушили над безводным Mg2SO4. Растворитель упаривали, остаток очищали с помощью метода колоночной хроматографии. Элюент - гексан/этилацетат (7:1). Выход 21%. Rf 0.70 хлороформ/метанол (20:1). Т. пл. 203.7°С (гексан/этилацетат (7:1)). 
Пример 2. Метиловый эфир 1-циано-2-нор-луп-1(3),20(29)-диен-28-овой кислоты (соединение II) получали по методике, описанной в примере 1, используя в качестве исходного соединения метиловый эфир 1-циано-2,3-секолуп-20(29)-ен-3-аль-28-овой кислоты и для очистки с помощью метода колоночной хроматографии в качестве элюента - гексан/этилацетат (10:1). Выход 30%. Rf 0.50 гексан/этилацетат (5:1). Т. пл. 202.6°С (гексан/этилацетат(10:1)). 
Пример 3. 1-Циано-19β,28-эпокси-2-нор-18αН-олеан-1(3)-ен (соединение III) получали по методике, описанной в примере 1, используя в качестве исходного соединения 1-циано-19β,28-эпокси-18αН-олеанан-3-аль и для очистки с помощью метода колоночной хроматографии в качестве элюента - гексан/этилацетат (10:1). Выход 25%. Rf 0.41 гексан/этилацетат (7:3). Т. пл. 231.6°С (гексан/этилацетат (10:1)). 
Пример 4. Получение метилового эфира 3-амино-1-циано-2-нор-луп-1(3),20(29)-диен-28-овой кислоты (соединение IV).
Для синтеза соединения IV предварительно синтезировали метиловый эфир 1,4-дициано-2,3-секолуп-20(29)-ен-28-овой кислоты.
Способ А). Смесь 1 ммоль метилового эфира 1-циано-2,3-секолуп-20(29)-ен-3-аль-28-овой кислоты и 3 ммоль NH2OH×HCl растворяли в 50 мл смеси C2H5OH/C5H5N (5:1). Реакционную смесь кипятили в течение 2-3 ч. Ход реакции контролировали с помощью метода ТСХ. По окончании реакции растворитель упаривали, остаток разбавляли водой и экстрагировали этилацетатом, органический слой отделяли, сушили над безводным Mg2SO4. Растворитель упаривали, остаток очищали с помощью метода колоночной хроматографии. Элюент - гексан/этилацетат (5:1). Полученный таким образом метиловый эфир 3-гидроксимино-1-циано-2,3-секолуп-20(29)-ен-28-овой кислоты и 1 ммоль CH3COONa растворяли в 3 мл уксусного ангидрида. Реакционную смесь кипятили в течение 3 ч. Ход реакции контролировали методом ТСХ. По окончании реакции реакционную смесь разбавляли водой, продукты экстрагировали этилацетатом (50 мл × 2), органический слой промывали 10% раствором NаНСО3 и сушили над безводным Mg2SO4. Растворитель упаривали, остаток очищали с помощью метода колоночной хроматографии. Элюент - гексан/этилацетат (5:1).
Способ Б). 1 Ммоль 1-циано-2,3-секолуп-20(29)-ен-3-аль-28-овой кислоты и 1.1 ммоль NH2OH×HCl растворяли в безводном ДМФА (10 мл) и нагревали до 100°С. В полученную смесь, продолжая нагревание, добавляли в течение 15 мин KF/Al2O3 (7.25 г) [V.К.Yadav, К.G.Babu, М.Mittal. KF-Al2O3 is an efficient solid support reagent for the acetylation of alcohols and amines, impeding effect of solvent on the reaction rate // Tetrahedron. - 2001. - Vol.57. - P. 7047-7051]. Реакцию контролировали методом TCX. Растворитель отгоняли, к остатку прибавляли 20 мл дихлорметана и смесь отфильтровывали. Фильтрат промывали водой (50 мл х 2), органический слой отделяли, сушили безводным Mg2SO4, растворитель отгоняли, остаток очищали с помощью метода колоночной хроматографии, элюент - гексан/этилацетат (5:1).
Смесь 0.5 ммоль полученного метилового эфира 1,4-дициано-2,3-секолуп-20(29)-ен-28-овой кислоты и 1 ммоль t-BuOK в присутствии 10 мл t-BuOH кипятили в течение 1.5 ч. Реакцию контролировали с помощью метода ТСХ. Реакционную смесь разбавляли 30 мл 5% раствором соляной кислоты и экстрагировали этилацетатом (50 мл × 2). Органический слой промывали 10% раствором NaHCO3 и сушили над безводным Mg2SO4. Растворитель упаривали, остаток очищали с помощью метода колоночной хроматографии. Элюент - гексан/этилацетат (7:1). Выход 14%. Rf 0.39 гексан/этилацетат (7:3). Т. пл. 156.6°С (гексан/этилацетат (7:1)). 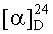
Пример 5. 3-Амино-1-циано-19β,28-эпокси-2-нор-18αН-олеан-1(3)-ен (соединение V) получали по методике, описанной в примере 4, используя в качестве исходного соединения 1,4-дициано-19β,28-эпокси-18αН-олеанан). Выход 13%. Rf 0.41 гексан/этилацетат (7:3). Т. пл. 172.2°С (гексан/этилацетат (7:1)). 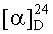
Пример 6. Исследование противовирусной активности в отношении вируса герпеса простого I типа.
При проведении исследований использовали линию клеток рабдо-миосаркомы человека (RD) и вирус герпеса простого I типа (ВГП-1, штамм 1 С). Монослойную культуру клеток RD, выращенную в лунках пластиковой 96-луночной панели, отмывали от ростовой среды, инфицировали 0,01-0,001 ТЦИД50/клетка ВГП-1 путем нанесения на клетки разведений вируссодержащей суспензии в объеме 0,1 мл на 1 ч при 37°С. Затем жидкость удаляли и клетки покрывали средой поддержки (среда DMEM), содержащей различные концентрации исследуемых веществ. Водонерастворимые вещества предварительно растворяли в 10% этаноле. При последующем разведении использовали DMEM. Содержание этанола в конечных концентрациях веществ для исследования не превышало 1%. На каждую концентрацию изучаемого вещества использовали по 2-4 лунки с культурой клеток, инфицированной одним разведением вируса. Для изучения противовирусных свойств каждого вещества использовали 3-4 разведения вируса. После 48 ч инкубации при 37°С регистрировали морфологические изменения монослоя клеток (цитопатическое действие (ЦПД) вируса, увеличение × 80). На основе наличия/отсутствия ЦПД вируса в лунках с разными концентрациями вещества вычисляли титр вируса. Первичным критерием противовирусного действия считали наличие различий в сравнении с контролем вируса. На основе значений титра вируса вычисляли среднеэффективную концентрацию вещества (ЕС50). Рассчитывали также отношение максимально переносимой концентрации (МПК) соединения к ЕС50. МПК определяли как максимальную концентрацию вещества, не оказывающую влияния на морфологию неокрашенной культуры клеток за период инкубации (48 ч).
Установлено, что соединения II и III обладают способностью подавлять репродукцию ВГП-1 в диапазонах концентраций от МПК до 1/40 МПК со снижением титра вируса, достигающим у соединений II и III более 2,2 lg ТЦИД50/мл. Вычисленные значения ЕС50, а также отношения МПК/ЕС50 приведены в таблице 2.
Пример 7. Методика исследования противовирусной активности в отношении ВИЧ-1.
Испытания проводили на перевиваемой суспензионной Т-лимфобластоидной линии клеток человека МТ-4 (плотность 4-5×105 клеток/мл) на питательной среде RPMI-1640 Sigma-Aldrich (США). В качестве инфекционного агента использовали высокорепликативный изолят ВИЧ-1zmb с титром 6,0 lg ТЦД50. Определение наличия анти-ВИЧ активности проводили с помощью формазанового теста в МТТ-варианте. Исходный раствор препарата (5,0 мг/мл) готовили ex tempore путем растворения в 10% этаноле. Базовый раствор титровали в лунках 96-луночной панели с 5-кратным шагом, после чего в лунки последовательно вносили клетки и вирус (терапевтическая схема). Конечный объем реакционной смеси составлял 200 мкл/лунку. Контролями служили необработанные препаратом ВИЧ-инфицированные клетки (контроль вируса) и необработанные препаратом неинфицированные клетки (контроль клеток). Панели инкубировали в атмосфере, содержащей 5% СО2 при 37°С. Учет результатов осуществляли через 72 ч. В качестве позитивного контроля на анти-ВИЧ активность в каждой серии экспериментов использовали коммерческий препарат азидотимидина, который титровали параллельно с исследуемым образцом.
Методика базируется на определении интенсивности образования формазанового продукта при внесении в клеточную культуру реагента МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид). После 3-часовой экспозиции при 37°С надосадок удаляли, а образовавшийся формазановый продукт растворяли в диметилсульфоксиде, затем проводили измерение интенсивности развившегося окрашивания на спектрофотометре Plate Reader DAS A3 (Италия) при длине волны 550/630 нм. Результаты теста учитывали путем определения индекса защиты клеток, который в положительных случаях должен быть не ниже 50%. Вычисляли ЕС50 препарата и соотношение МПК/ЕС50, характеризующее широту спектра его нетоксических эффективных концентраций.
Установлено, что соединение II обладает способностью подавлять репродукцию ВИЧ-1 в диапазонах концентраций от 1/3 МПК до 1/10 МПК (таблица 2). Полученные результаты подтверждены с помощью методики непрямой иммунофлуоресценции.
Заявляемые соединения могут быть использованы для разработки противовирусных средств и в качестве ключевых интермедиатов для получения новых биологически активных соединений.
нения
нения
| название | год | авторы | номер документа |
|---|---|---|---|
| А-СЕКОТРИТЕРПЕНОИДЫ С ФРАГМЕНТОМ МЕТИЛКЕТОНА | 2013 |
|
RU2537840C1 |
| ЛУПАНОВЫЕ А-СЕКОТРИТЕРПЕНОИДЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВОВИРУСНУЮ АКТИВНОСТЬ | 2011 |
|
RU2470003C1 |
| ЦИТОТОКСИЧЕСКАЯ И ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ 3-АЦИЛОКСИМЕТИЛ-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОР-ТРИТЕРПЕНОИДОВ | 2018 |
|
RU2682669C1 |
| ЦИТОТОКСИЧЕСКАЯ И ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ 3-АЦИЛОКСИМЕТИЛ-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОР-ТРИТЕРПЕНОИДОВ | 2018 |
|
RU2686100C1 |
| ТРИТЕРПЕНОВЫЕ АМИДЫ ЛУПАНОВОГО ТИПА С ФРАГМЕНТОМ 2-АМИНОБУТАН-1-ОЛА, ПРОЯВЛЯЮЩИЕ ВИРУСИНГИБИРУЮЩУЮ И ВИРУЛИЦИДНУЮ АКТИВНОСТЬ | 2017 |
|
RU2664804C1 |
| 3-ГИДРОКСИМИНОПРОИЗВОДНЫЕ 2,3-СЕКОЛУПАНОВОГО ТИПА, ПРОЯВЛЯЮЩИЕ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИРУСА ГРИППА А И ВИЧ-1 | 2011 |
|
RU2475476C1 |
| 2,3-СЕКО-ПРОИЗВОДНЫЕ БЕТУЛОНОВОЙ КИСЛОТЫ | 2009 |
|
RU2410390C1 |
| СПОСОБ ПОЛУЧЕНИЯ А-СЕКОТРИТЕРПЕНОВЫХ С-3(28) МОНО-И ДИАМИДОВ И ИХ СЕКОИНТЕРМЕДИАТОВ | 2013 |
|
RU2525546C1 |
| АЦЕТИЛГИДРАЗОН 1-ЦИАНО-19β,28-ЭПОКСИ-2,3-СЕКО-18α-ОЛЕАН-3-АЛЯ, ПРОЯВЛЯЮЩИЙ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИРУСА ВЕЗИКУЛЯРНОГО СТОМАТИТА ШТАММ "ИНДИАНА" | 2010 |
|
RU2429227C1 |
| ИНГИБИТОР РЕПРОДУКЦИИ ВИЧ-1 И ВИРУСА ГРИППА А | 2012 |
|
RU2477134C1 |
Изобретение относится к А-пентациклическим тритерпеноидам общей формулы:
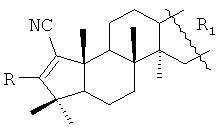 , где R=Н, R1=
, где R=Н, R1= ,
,  или
или  ; R=NH2, R1=
; R=NH2, R1= или
или  . Соединения обладают противовирусной активностью, в том числе в отношении вируса герпеса простого I типа (ВГП-1, штамм 1 С), ВПГ-1 и ВИЧ-1, а также может быть использовано в качестве интермедиатов для новых биологически активных соединений. 2 з.п. ф-лы, 2 табл., 7 пр.
. Соединения обладают противовирусной активностью, в том числе в отношении вируса герпеса простого I типа (ВГП-1, штамм 1 С), ВПГ-1 и ВИЧ-1, а также может быть использовано в качестве интермедиатов для новых биологически активных соединений. 2 з.п. ф-лы, 2 табл., 7 пр.
1. А-пентациклические тритерпеноиды общей формулы
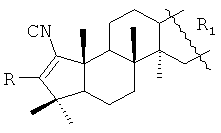 ,
,
где R=Н, R1=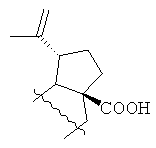 или R=Н, R1=
или R=Н, R1=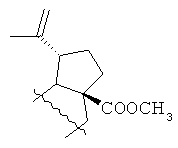 или
или
R=Н, R1=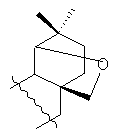 или R=NH2, R1=
или R=NH2, R1= или
или
R=NH2, R1=
2. Соединение по п.1, где R=Н, R1= , проявляющее ингибирующую активность в отношении ВИЧ-1.
, проявляющее ингибирующую активность в отношении ВИЧ-1.
3. Соединения по п.1, где R=Н, R1= или
или
R=Н, R1= , проявляющие ингибирующую активность в отношении вируса герпеса простого I типа (ВГП-1, штамм 1С).
, проявляющие ингибирующую активность в отношении вируса герпеса простого I типа (ВГП-1, штамм 1С).
| СПОСОБ РАСКРЫТИЯ ТЕТРАГИДРОФУРАНОВОГО КОЛЬЦА АЛЛОБЕТУЛИНА | 2009 |
|
RU2402560C1 |
| КОРРЕКТОР ЦИТОСТАТИЧЕСКОЙ ПОЛИХИМИОТЕРАПИИ | 2007 |
|
RU2353623C1 |
| WO 1999045025 A1, 10.09.1999 | |||
| WO 2009100532 A1, 20.08.2009. | |||
Авторы
Даты
2013-10-27—Публикация
2012-09-24—Подача