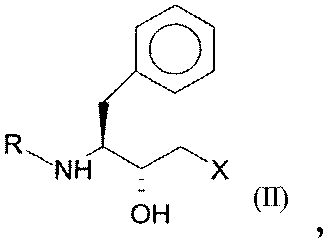
Настоящее изобретение относится к способу энантиоселективного ферментативного восстановления кетосоединения общей формулы I:
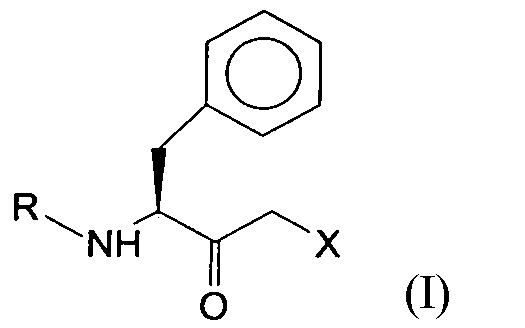
где R может представлять собой любую защитную группу для функциональных аминогрупп (трет-бутилоксикарбонильную группу, бензилоксикарбонильную группу, 9-флуоренилметоксикарбонильную группу), и X означает -Cl, -CN, -OH, Br, F,
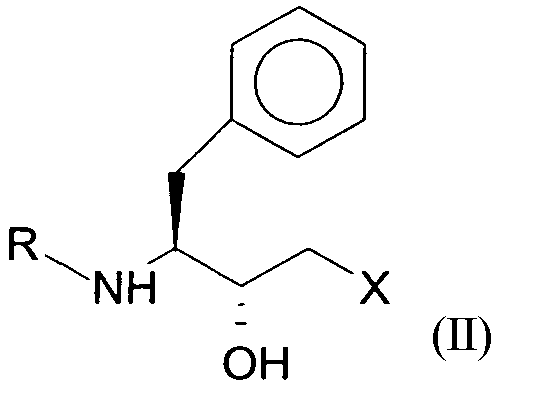
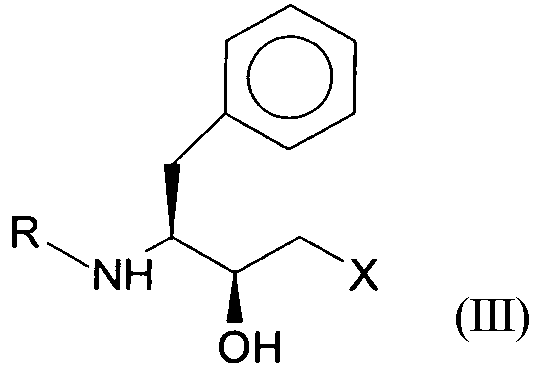
до соединений формул II (R,S-спирт) и III (S,S-спирт), соответственно, с помощью оксидоредуктазы в присутствии кофактора.
Предпочтительные соединения формулы I содержат бутилоксикарбонильную группу или бензилоксикарбонильную группу в качестве аминозащитной группы и атом хлора в положении X.
Хиральные спирты общих формул II и III представляют собой важные промежуточные соединения при получении протеазных ингибиторов, предназначенных для терапии ВИЧ. Такие протеазные ингибиторы представляют собой, например, ритонавир, ампренавир, фосампренавир, атазанавир или дарунавир.
Промежуточные соединения формул II (R,S-спирт) и III (S,S-спирт) соответственно могут быть получены, например, энантиоселективным восстановлением соответствующих кетосоединений формулы I, которое в существующих в настоящее время способах получения осуществляется химическими методами. При этом химически катализируемое восстановление имеет такой недостаток, что, с одной стороны, оно может привести в результате к получению побочных продуктов благодаря жестким условиям реакции и, с другой стороны, приводит к получению неудовлетворительных энантиомерных или диастереомерных избытков, соответственно, а также оно технически реализуется только ценой больших усилий. Таким образом, промежуточное соединение формулы II (R,S-спирт) в его энантиомерно обогащенной форме при химических методах менее доступен, чем соединение формулы III (S,S-спирт).
По этой причине в течение некоторого времени проводились попытки разработки биокаталитических способов, которые позволяют осуществление энантиоселективного восстановления указанных промежуточных соединений. Биокатилитические способы обычно осуществляются в умеренных условиях, по этой причине, они, как можно ожидать, дают возможность проводить восстановление кетосоединений формулы I без образования дополнительных побочных продуктов. Однако до сих пор было невозможно выявить какие-либо подходящие биокатализаторы, посредством которых будет возможно ферментативное восстановление с помощью отдельных ферментов.
Насколько известно авторам настоящего изобретения, существует только несколько публикаций, в которых описаны реакции восстановления кетонов формулы I с помощью штаммов Rhodococcus или Streptomyces в способах с использованием цельных клеток (Tetrahedron Asymmetry 14 (2003) 3105-3109, Tetrahedron Asymmetry 8 (1997) p.2547). Однако таким образом осуществлялись реакции только с цельными клетками и лизатами, соответственно, штаммов дикого типа и, таким образом, проводились только при очень низких концентрациях, намного ниже 2% и без регенерации кофермента. Способы ферментативного восстановления, используемые в промышленном масштабе, до сих пор недоступны, и ферменты, вовлеченные в реакцию, никогда не были ни выделены, ни идентифицированы.
Целью изобретения является предоставление способа, который дает возможность осуществления экономичного получения энантиомерно чистых и, соответственно, энантиомерно обогащенных промежуточных соединений общих формул II и III с высоким выходом и с высокой степенью энантиомерной чистоты при отсутствии каких-либо побочных продуктов. Согласно настоящему изобретению указанная цель достигается с помощью способа изначально указанного типа, который отличается тем, что оксидоредуктаза, используемая для получения соединения формулы II (R,S-спирт),
a) включает аминокислотную последовательность согласно SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:4, или
b) включает аминокислотную последовательность, в которой по меньшей мере 60% аминокислот идентичны аминокислотам аминокислотных последовательностей SEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:3, SEQ ID NO:4, или
c) включает аминокислотную последовательность, в которой по меньшей мере 70% аминокислот идентичны аминокислотам аминокислотных последовательностей SEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:3, SEQ ID NO:4, или
d) кодируется последовательностью нуклеиновой кислоты SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, или
e) кодируется последовательностью нуклеиновой кислоты, которая гибридизована с SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19 в жестких условиях, или
f) имеет длину от 220 до 260 аминокислот и включает одну или несколько из неполных последовательностей, выбранных из группы, состоящей из SEQ ID NO:31-SEQ ID NO:51, и восстанавливает соединение формулы I до соединения формулы II.
nalvtgasrgig (31) nalvtggsrgig (32), gysvt (33), gynvt (34), gygitl (35), gygvt (51),
vlaklp (36), vkaklp (37),
fkgaplpa (38), frgaplpa (39), lkgaplpa (40),
spialtk (41), spvaltk (42), sqialtq (43),
avysask (44), avysatk (45), gvysatk (46),
pikgwi (47), piegwi (48), piggwi (49) и pisgwi (50).
Кроме того, указанная цель достигается с помощью способа изначально указанного типа, который отличается тем, что оксидоредуктаза, используемая для получения соединения формулы III (S,S-спирт),
a) включает аминокислотную последовательность SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15,
b) включает аминокислотную последовательность, в которой по меньшей мере 60% аминокислот идентичны аминокислотам аминокислотных последовательностей SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, или
c) кодируется последовательностью нуклеиновой кислоты SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29 или SEQ ID NO:30, или
d) кодируется последовательностью нуклеиновой кислоты, которая гибридизована с SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29 или SEQ ID NO:30 в жестких условиях, или
e) имеет длину от 220 до 260 аминокислот, и включает одну или несколько из неполных последовательностей, выбранных из группы, состоящей из SEQ ID NO:31-SEQ ID NO:66, и восстанавливает соединение формулы I до соединения формулы III.
nalvtgasrgig (31) nalvtggsrgig (32), gysvt (33), gynvt (34), gygitl (35), gygvt (51),
vlaklp (36), vkaklp (37),
fkgaplpa (38), frgaplpa (39), lkgaplpa (40), fkaaplpa (52), fkgsplpa (53),
spialtk (41), spvaltk (42), sqialtq (43),
avysask (44), avysatk (45), gvysatk (46),
pikgwi (47), piegwi (48), piggwi (49) and pisgwi (50),
gigrat (54), gigrasa (55), gigret (56),
nnagig (57), nnagieg (58),
irwaiapg (59), irvnaiapg (60), irvnaicpg (61), irwgiapg (62),
peqiagav (63), peaianav (64), peevanav (65), peaianav (66).
Понятно, что полипептид, который восстанавливает соединение формулы I предпочтительно до соединения формулы II, представляет собой такой полипептид, в котором максимальный энантиомерный изыток R,S-спирта достигает в оптимальных условиях реакции количества, составляющее по меньшей мере 50%. Таким образом, понятно, что оптимальные условия реакции являются такими условиями для полипептида, при которых полипептид дает наиболее высокий энантиомерный избыток R,S-спирта.
Было обнаружено, что полипептиды, включающие аминокислотные последовательности SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 и SEQ ID NO:4, показывают оксидоредуктазную активность и могут быть использованы для восстановления соединения формулы I предпочтительно до соединения формулы II (R,S-соединения). Достигаемый энантиомерный избыток количества R,S-спирта составляет >50%, предпочтительно, >80% и, наиболее предпочтительно, >95%. Энантиомерный избыток, достигаемый при использовании последовательности SEQ ID NO:1, может, например, обеспечивать количество R,S-соединения (формула II), составляющее до >99%.
Подобным образом, было обнаружено, что полипептиды, включающие аминокислотные последовательности SEQ ID NO:5-SEQ ID NO:15, показывают оксидоредуктазную активность и могут быть использованы для восстановления соединения формулы I предпочтительно до соединения формулы III (S,S-соединения). Достигаемый энантиомерный избыток количества R,S-спирта составляет >80%, предпочтительно, >90% и, наиболее предпочтительно, >95%. Энантиомерный избыток, достигаемый при использовании последовательностей SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:9 или SEQ ID NO:12, может обеспечивать количество R,S-соединения (формула II), составляющее до >99%.
Ряд приведенных оксидоредуктаз, таких как, например, SEQ ID NO:1, 3, 4, 5, 6, 7 и 15 обладают дополнительным преимуществом, состоящим в том, что они способны регенерировать окисленный кофактор, образованный во время восстановления, путем восстановления вторичного спирта. Таким образом, конкретное экономическое преимущество состоит также в том, что не нужно использовать дополнительный фермент для регенерации кофактора, в отличие от способов, известных в данной области.
ДНК-последовательность SEQ ID NO:20, которая кодирует полипептид, включающий SEQ ID NO:5, можно получить, например, из генома организма Rubrobacter xylanophilus DSM 9941.
ДНК-последовательность SEQ ID NO:21, которая кодирует полипептид, включающий SEQ ID NO:6, можно получить, например, из генома организма Geobacillus thermodenitrificans DSM 465.
ДНК-последовательность SEQ ID NO:22, которая кодирует полипептид, включающий SEQ ID NO:7, можно получить, например, из генома организма Chloroflexus aurantiacus DSM 635.
ДНК-последовательность SEQ ID NO:23 или ДНК-последовательность SEQ ID NO:24, которые кодируют полипептид, включающий SEQ ID NO:8 или SEQ ID NO:9, соответственно, можно получить, например, из организма Candida magnoliae DSMZ 70638.
ДНК-последовательность SEQ ID NO:26, которая кодирует полипептид, включающий SEQ ID NO:11, можно получить, например, из организма Candida magnoliae DSMZ 70639.
ДНК-последовательность SEQ ID NO:16, которая кодирует полипептид, включающий SEQ ID NO:1, можно получить, например, из организма Candida magnoliae CBS 6396.
Кроме того, оксидоредуктазы SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14 и SEQ ID NO:15 могут быть получены, например, с помощью скрининга гомологии с использованием штаммов Candida magnoliae CBS 5659, CBS 7318, CBS 2798, JCM 9448, Candida geochares MUCL 29832, Candida spec. MUCL 40660, Candida gropengiesseri MUCL 29836.
Таким образом, настоящее изобретение относится к способу восстановления кетосоединений общей формулы I до соединений общих формул II и III, соответственно, отличающемуся тем, что одно из соединений II или III образуется явно в избытке, с использованием полипептида, включающего одну из аминокислотных последовательностей SEQ ID NO:1-SEQ ID NO:15, или полипептида, который включает аминокислотную последовательность, которая идентична по меньшей мере на 50% одной из аминокислотных последовательностей SEQ ID NO:1-SEQ ID NO:15, т.e. с использованием полипептида, который может быть получен из SEQ ID NO:1-SEQ ID NO:15 путем замены, вставки, делеции или добавления по меньшей мере одной аминокислоты, или с использованием полипептида, который кодируется одной из последовательностей нуклеиновой кислоты SEQ ID NO:16-SEQ ID NO:30, или который кодируется последовательностями нуклеиновой кислоты, которые гибридизуются в жестких условиях с одной из SEQ ID NO:16-SEQ ID NO:30.
Понятно, что последовательность нуклеиновой кислоты, которая гибридизуется в жестких условиях, например, c SEQ ID NO:16, представляет собой полинуклеотид, который может быть идентифицирован методом гибридизации колоний, методом гибридизации бляшек, методом гибридизации по Саузерну или аналогичными методами, с использованием в качестве ДНК-зонда последовательности SEQ ID NO:16.
Для этой цели полинуклеотид, иммобилизованный на фильтре, гибридизуют, например, c SEQ ID NO:16 в 0,7-1M растворе NaCl при 60°C. Гибридизацию осуществляют, как описано, например, в руководстве Molecular Cloning, A Laboratory Manual, Second Edition (Cold Spring Harbor Laboratory Press, 1989) или в подобных публикациях. Затем фильтр отмывают раствором 0,1х-2xSSC при 65°C, где понятно, что раствор 1xSSC представляет собой смесь, состоящую из 150 мМ NaCl и 15 мМ цитрата натрия.
Кроме того, настоящее изобретение относится к полипептидам аминокислотных последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14 и SEQ ID NO:15, а также к полипептидам, которые идентичны по меньшей мере на 55%, предпочтительно, на 65%-75%, наиболее предпочтительно, более чем на 75%, одной из аминокислотных последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14 и SEQ ID NO:15, т.e. относится к полипептидам, которые могут быть получены из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14 и SEQ ID NO:15 путем замены, вставки, делеции или добавления по меньшей мере одной аминокислоты. Кроме того, изобретение относится к полипептидам, которые кодируются последовательностями нуклеиновой кислоты SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29 или SEQ ID NO:30 или последовательностями нуклеиновой кислоты, которые гибридизуются в жестких условиях с одной из SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29 или SEQ ID NO:30.
В способе настоящего изобретения полипептиды, включающие последовательности SEQ ID NO:1-SEQ ID NO:15, и полипептиды, получаемые из указанных полипептидов, соответственно, могут использоваться либо в полностью очищенной форме, в частично очищенной форме, либо в виде клеток, содержащих один из полипептидов SEQ ID NO:1-SEQ ID NO:15. Таким образом, используемые клетки могут быть предоставлены в нативной форме, пермеабилизованной или в лизированной форме. Предпочтительно, полипептиды, включающие последовательности SEQ ID NO:1-SEQ ID NO:15 и полученные из них производные, соответственно, сверхэкспрессируются в подходящем организме-хозяине, таком как, например, Escherichia coli, и рекомбинантный полипептид используют для восстановления гидроксикетона общей формулы I.
Ферментативное восстановление согласно настоящему изобретению осуществляют в мягких условиях таким образом, чтобы можно было в большей степени избежать деградации нестабильных соединений формулы I и, следовательно, образования нежелательных побочных продуктов. Способ согласно настоящему изобретению обладает энантиомерной чистотой соединения формулы II (R,S-соединения), достигающей до 99%, хотя бы по меньшей мере 50%-энантиомерной чистотой R,S-соединения в зависимости от используемого полипептида.
Для соединения формулы III (S,S-соединения), способ согласно настоящему изобретению обладает энантиомерной чистотой соединения формулы III (S,S-соединения), достигающей до 99%, хотя бы по меньшей мере 80%-энантиомерной чистотой R,S-соединения в зависимости от используемого полипептида.
Предпочтительный вариант осуществления изобретения отличается тем, что кофактор, используемый в способе, непрерывно восстанавливается с помощью субстрата. Предпочтительно, NAD(P)H используют в качестве кофактора вместе с образующимся NAD(P), который в процессе восстановления обратно восстанавливается до NAD(P)H с помощью косубстрата.
В способе согласно настоящему изобретению окисленный кофактор NAD или NADP, образованные с помощью оксидоредуктазы/дегидрогеназы, предпочтительно непрерывно регенерируются.
Согласно предпочтительному варианту осуществления всех способов согласно настоящему изобретению окисленный кофактор NAD или NADP регенерируется путем окисления спирта.
Для регенерации кофермента используют вторичные спирты, такие как 2-пропанол, 2-бутанол, 2-пентанол, 3-пентанол, 4-метил-2-пентанол, 2-гептанол, 2-октанол или циклогексанол. Согласно конкретному варианту осуществления изобретения для регенерации кофермента используются 2-пропанол или 4-метил-2-пентанол. Количество косубстрата для регенерации может находиться в интервале, составляющем от 5 до 95% по объему от общего объема.
Предпочтительно, для регенерации кофактора используют вторичый спирт общей формулы RxRyCHOH, где Rx и Ry независимо представляют собой водород, разветвленную или неразветвленную С1-С8алкильную группу и Собщий≥3.
Согласно следующему предпочтительному варианту осуществления способа согласно настоящему изобретению для регенерации кофактора дополнительно добавляют оксидоредуктазу/дегидрогеназу.
В следующем предпочтительном варианте осуществления изобретения, для регенерации кофактора может быть дополнительно добавлена спирт-дегидрогеназа. Подходящие NADH-зависимые спирт-дегидрогеназы можно получить, например, из пекарских дрожжей, из Candida parapsilosis (CPCR) (US 5523223 и US 5763236, Enzyme Microb. Technol., 1993, 15(11):950-8), Pichia capsulata (DE 10327454.4), из Rhodococcus erythropolis (RECR) (US 5523223), Norcardia fusca (Biosci. Biotechnol. Biochem., 63(10), 1999, p. 1721-1729; Appl. Microbiol. Biotechnol,. 2003, 62(4):380-6; Epub 2003, Apr. 26) или из Rhodococcus ruber (J. Org. Chem., 2003, 68(2):402-6). Подходящие косубстраты для таких спирт-дегидрогеназ, представляют собой, например, указанные выше вторичные спирты, такие как 2-пропанол (изопропанол), 2-бутанол, 2-пентанол, 4-метил-2-пентанол, 2-октанол или циклогексанол.
Подходящие вторичные спирт-дегидрогеназы для регенерации NADPH представляют собой, например, такие, как описано выше, и выделенные из организмов рода Lactobacillales, например, Lactobacillus kefir (US 5200335), Lactobacillus brevis (DE 19610984 Al; Acta Crystallogr. D. Biol. Crystallogr. 2000 Dec; 56 Pt 12:1696-8), Lactobacillus minor (DE 101 19274), Leuconostoc carnosum (A 1261/2005, Kl. C12N) или, как описано, из Thermoanerobium brockii, Thermoanerobium ethanolicus или Clostridium beijerinckii. Однако другие ферментативные системы также могут в принципе использоваться для регенерации кофактора. Например, регенерация кофактора может быть осуществлена с использованием NAD- или NADP-зависимой формиат-дегидрогеназы (Tishkov et al., J. BiotechNol. Bioeng. [1999] 64, 187-193, Pilot-scale production and isolation of recombinant NAD and NADP specific formate dehydrogenase). Подходящие косубстраты формиат-дегидрогеназы представляют собой, например, соли муравьиной кислоты, такие как формиат аммония, формиат натрия или формиат кальция.
В способе согласно настоящему изобретению в реакционной смеси используется соединение общей формулы I, предпочтительно, в количестве, составляющем от 10 г/л до 500 г/л, предпочтительно, от 25 г/л до 300 г/л, наиболее предпочтительно, от 50 г/л до 200 г/л, от общего объема.
Водная часть реакционной смеси, в которой происходит ферментативное восстановление, предпочтительно содержит буфер, например, фосфатно-калиевый буфер, трис/HCl или триэтаноламин, имеющий pH со значением от 5 до 10, предпочтительно, pH от 6 до 9. Кроме того, буфер может содержать ионы для стабилизации или активации ферментов, таких как, например, ионы цинка или ионы магния.
Во время осуществления способа согласно настоящему изобретению температура подходящим образом поддерживается в интервале примерно от 10°C до 70°C, предпочтительно, от 20°C до 45°C.
В следующем предпочтительном варианте осуществления способа согласно настоящему изобретению, ферментативную реакцию проводят в присутствии органического растворителя, который не смешивается с водой или смешивается только в ограниченной степени. Указанный растворитель представляет собой, например, симметричный или несимметричный ди(C1-C6)алкиловый эфир, алкан с линейной цепью или алкан с разветвленной цепью, или циклоалкан или не растворимый в воде вторичный спирт, который одновременно представляет собой косубстрат. Предпочтительные органические растворители представляют собой диэтиловый эфир, метил-трет-бутиловый эфир, диизопропиловый эфир, дибутиловый эфир, бутилацетат, гептан, гексан, 2-октанол, 2-гептанол, 4-метил-2-пентанол и циклогексанол. В данном случае, растворитель может одновременно служить в качестве косубстрата для регенерации кофактора.
Если используются нерастворимые в воде растворители и косубстраты, соответственно, то реакционная смесь состоит из водной фазы и органической фазы. Согласно его растворимости, соединение распределено между органической фазой и водной фазой. Как правило, органическая фаза имеет пропорцию, составляющую от 5 до 95%, предпочтительно, от 10 до 90%, от общего реакционного объема. Две жидких фазы предпочтительно смешивают механически, чтобы между ними генерировалась большая площадь поверхности. Также в данном варианте осуществления изобретения, например, NAD(P), образованный во время ферментативного восстановления, может быть восстановлен обратно до NAD(P)H с помощью косубстрата, такого, как описано выше.
Концентрация кофактора в водной фазе, в частности, NADH или NADPH, соответственно, находится в интервале, составляющем от 0,001 мМ до 10 мМ, в частности от 0,01 мМ до 1 мМ.
TTN (общее число превращений равно количеству молей восстановленного соединения формулы I/количество молей использованного кофактора) обычно достигает в способах согласно настоящему изобретению интервалов, составляющих от 102 до 105, однако, предпочтительно, составляет ≥103.
В способе согласно настоящему изобретению также может быть использован стабилизатор оксидоредуктазы/дегидрогеназы. Подходящие стабилизаторы представляют собой, например, глицерин, сорбит, 1,4-DL-дитиотреитол (DTT) или диметилсульфоксид (ДМСО).
Способ согласно настоящему изобретению осуществляют, например, в закрытом реакционном сосуде, сделанном из стекла или металла. По этой причине компоненты переносят в реакционный сосуд по отдельности и перемешивают в атмосфере, например, азота или на воздухе.
Согласно другому возможному варианту осуществления изобретения окисленный косубстрат (например, ацетон) может удаляться непрерывно, и/или косубстрат (например, 2-пропанол) может вновь непрерывно добавляться, чтобы сдвигать равновесие реакции в сторону продукта реакции.
В следующем варианте осуществления изобретения, добавление оксидоредуктаз SEQ ID NO:1-SEQ ID NO:15 и/или косубстрата также может осуществляться постепенно в ходе осуществления способа согласно настоящему изобретению.
После завершения восстановления, реакционную смесь обрабатывают. Для этой цели, например, необязательно отделяют водную фазу от органической фазы, и органическую фазу, содержащую продукт, фильтруют. Необязательно в дальнейшем водная фаза может быть экстрагирована и обработана подобно органической фазе. Затем растворитель выпаривают из органической фазы и получают продукт общей формулы II или III в виде неочищенного продукта. Неочищенный продукт может быть затем дополнительно очищен или может использоваться непосредственно для синтеза конечного продукта реакции. Ниже изобретение дополнительно иллюстрируется с помощью примеров.
Пример 1
Клонирование и получение оксидоредуктазы из Rubrobacter xylanophilus DSM 9941 (SEQ ID NO:5)
A) Культивирование Rubrobacter xylanophilus DSM 9941
Клетки Rubrobacter xylanophilus DSM 9941 культивировали в следующей среде при 50°C (pH 7,2) при перемешивании при 140 об/мин в бактериальном шейкере: 0,1% дрожжевой экстракт, 0,1% триптон, 0,004% CaSO4×2H2O, 0,02% MgCl2×6H2O, 0,01% нитрилтриуксусной кислоты, 100 мл фосфатного буфера [5,44 г/л KH2PO4, 43 г/л Na2HPO4×12H2O], 500 мкл/л 0,01M цитрата железа, 500 мкл/л микроэлемента [500 мкл/л H2SO4, 2,28 г/л MnSO4×H2O, 500 мг/л ZnSO4×7H2O, 500 мг H3BO3, 25 мг/л CuSO4×5H2O, 25 мг/л Na2MoO4×2H2O, 45 мг/л CoCl2×6H2O]. На 6 день культивирования клетки отделяли от культуральной среды с помощью центрифугирования и хранили при -80°C.
B) Амплификация гена, кодирующего селективную оксидоредуктазу
Геномную ДНК экстрагировали согласно методу, описанному в "Molecular Cloning", Manniatis & Sambrook. Полученная в результате нуклеиновая кислота служила в качестве матрицы в полимеразной цепной реакции (ПЦР), включающей специфичные праймеры, которые получали из генной последовательности, зарегистрированной под номером 46106817 в базе данных NCBI. При этом праймеры получали в направлении от 5'-концевого положения вместе с сайтами рестрикции эндонуклеаз Nde I и Hind III или Sph I, соответственно (SEQ ID NO:67, SEQ ID NO:68, SEQ ID NO:69), для последующего клонирования в экспрессирующий вектор.
Амплификацию проводили в ПЦР-буфере [10 мМ Трис-HCl, (pH 8,0); 50 мМ KCl; 10 мМ MgSO4; 1 мМ dNTP-Микс; в каждом случае использовали 20 пмоль праймера и 2,5 Ед. ДНК-полимеразы Platinum Pfx (Invitrogen)] вместе с 500 нг геномной ДНК и с использованием следующих температурных циклов:
Полученный в результате ПЦР-продукт, имеющий размер, составляющий примерно 750 п.о., после очистки в 1% агарозном геле подвергали рестрикции с помощью эндонуклеаз Nde I и Hind III или Sph I и Hind III, соответственно, и лигировали в структуру вектора pET21a (Novagen) или вектора pQE70 (Qiagen), соответственно, структура которых была обработана аналогичной эндонуклеазой. После трансформирования 2 мкл лигазной смеси в клетки E.coli Top 10 F' (Invitrogen), плазмидную ДНК устойчивых к ампициллину колоний тестировали на присутствие вставки, имеющей размер, составляющий 750 п.о., с помощью рестрикционного анализа с использованием эндонуклеаз Nde I и Hind III или Sph I и Hind III, соответственно. Плазмидные препараты из клонов, которые были положительными на предмет присутствия фрагмента, подвергали секвенированию и затем трансформировали в Escherichia coli BL21 Star (Invitrogen) и в E.coli RB791 (genetic stock, Yale), соответственно.
C.) Эффективная экспрессия полипептида SEQ ID NO:5 в клетках Escherichia coli
Для эффективной экспрессии полипептида SEQ ID NO:5 в клетках Escherichia coli, кодирующую ДНК SEQ ID NO:70 использовали в качестве матрицы в ПЦР-реакции для клонирования в экспрессирующий вектор. Прежде всего данная последовательность ДНК отличалась 153 основаниями от известной ранее последовательности ДНК (SEQ ID NO:20). Такая модификация является консервативной и не приводит в результате к получению измененной аминокислотной последовательности.
Амплификацию проводили в ПЦР-буфере [10 мМ Трис-HCl, (pH 8,0); 50 мМ KCl; 10 мМ MgSO4; 1 мМ dNTP-микс; в каждом случае использовали 20 пмоль праймера (SEQ ID NO:71, SEQ ID NO:68) и 2,5 Ед ДНК-полимеразы Platinum Pfx (Invitrogen)] вместе с 50 нг ДНК SEQ ID NO:70 в качестве матрицы, и использовали следующие температурные циклы:
Полученный в результате ПЦР-продукт, имеющий размер, составляющий примерно 750 п.о., после очистки в 1% агарозном лигировали с помощью эндонуклеаз Nhe I и Hind III в структуру вектора pET21a (Novagen), структура которых была обработана с помощью аналогичных эндонуклеаз. После трансформирования 2 мкл лигазной смеси в клетки E.coli Top 10 F' (Invitrogen), плазмидную ДНК устойчивых к ампициллину колоний тестировали на присутствие вставки, имеющей размер, составляющий 750 п.о., с помощью рестрикционного анализа с использованием эндонуклеаз Nhe I и Hind III. Плазмидные препараты из клонов, которые были положительными на предмет присутствия фрагмента, подвергали секвенированию и затем трансформировали в Escherichia coli BL21 Star (Invitrogen).
D.) Получение оксидоредуктазы из Rubrobacter xylanophilus DSM 9941
Штаммы Escherichia coli BL21 Star (Invitrogen, Karlsruhe, Germany) и RB791 (E.coli, генетический фонд, Йель, США), соответственно, которые трансформировали с помощью экспрессирующей конструкции, культивировали в среде (1% триптон, 0,5% дрожжевой экстракт, 1% NaCl) в присутствии ампициллина (50 мкг/мл) до тех пор, пока оптическая плотность не достигала 0,5 при измерении при 550 нм. Экспрессию рекомбинантного белка индуцировали путем добавления изопропилтиогалактозида (IPTG) в концентрации 0,1 мМ. Через 16 часов после индуцирования при 25°C и 220 об/мин клетки собирали и замораживали при -20°C.
Для извлечения фермента, 30 г клеток суспендировали в 150 мл буфера триэтаноламина (100 мМ, pH 7, 2 мМ MgCl2, 10% глицерин) и разрушали с использованием гомогенизатора высокого давления. Затем раствор фермента смешивали вместе с 150 мл глицерина и хранили при -20°C.
Полученный таким образом раствор фермента использовали для восстановления соединения I (пример 3).
Аналогично методике, приведенной в примере 2, также могут быть получены оксидоредуктазы SEQ ID NO:6 и SEQ ID NO:7.
Пример 2
Клонирование и получение оксидоредуктазы из Candida magnoliae с помощью молекулярного скрининга (SEQ ID NO:1)
A) Молекулярный скрининг на предмет поиска оксидоредуктазы
Геномную ДНК, изолированную из клеток Candida magnoliae CBS 6396, использовали в качестве матрицы для молекулярного скрининга посредством ПЦР. При этом амплификацию проводили в ПЦР-буфере [16 мМ (NH4)2SO4; 67 мМ Трис-HCl pH 8,3 (при 25°C); 1,5 мМ MgCl2; 0,01% Tween 20; 0,2 мМ dNTP-микс; в каждом случае использовали 30 пмоль праймера (SEQ ID NO:72, SEQ ID NO:73) и 1,25 Ед Полимеразы Bio Therm Star Polymerase (Genecraft)] вместе с 50 нг геномной ДНК, изолированной из клеток Candida magnoliae CBS 6396, в качестве матрицы и использовали следующие циклы:
После фракционирования полной ПЦР-смеси в 1% агарозном геле, фрагмент размером примерно 400 п.о. идентифицировали и клонировали с помощью выступающих компонентов аденозина в вектор Topo-TA (Invitrogen) для определения последовательности ДНК.
ДНК-фрагмент, полученный в результате проведения реакции скрининга, показал наличие открытой рамки считывания, соответствующей фрагменту оксидоредуктазы, размером 137 аминокислотных остатков.
B) Выделение (общей РНК и мРНК)
600 мг свежевыращенных клеток ресуспендировали в 2,5 мл ледяного буфера LETS. К указанной суспензии добавляли 5 мл (примерно 20 г) стеклянных шариков, промытых в азотной кислоте и уравновешенных 3 мл фенола (pH 7,0). Альтернативно, полную смесь затем обрабатывали следующим образом: по 30 секунд встряхивания и по 30 секунд охлаждения на льду, всего 10 минут. Затем добавляли 5 мл ледяного буфера LETS и снова интенсивно встряхивали. Указанную суспензию клеток центрифугировали при 4°C и при 11000 g в течение 5 мин. Водную фазу отделяли и экстрагировали дважды равным объемом раствора фенол:хлороформ:изоамиловый спирт (24:24:1). Затем экстрагировали хлороформом. После конечной экстракции общую РНК осаждали при -20°C в течение 4 ч путем добавления 1/10 объема 5M LiCl2.
Полученный таким образом 1 мг общей РНК использовали для обработки олиго-dT целлюлозой (NEB Biolabs) для обогащения молекул мРНК.
Определение полной последовательности, кодирующей оксидоредуктазу, осуществляли RACE (быстрая амплификация концов кДНК), согласно методу описанному в руководстве "Molecular Cloning", Manniatis & Sambrook.
Последовательность гена, кодирующего оксидоредуктазу, включает 720 пар оснований и эквивалентна длине 239 аминокислотных остатков.
C) Синтез с помощью ПЦР полноразмерного транскрипта, кодирующего форму ADH с короткой цепью из Candida magnoliae CBS 6396
Конкретные праймеры конструировали для последующего клонирования полноразмерного транскрипта в подходящие экспрессирующие системы. При этом модифицировали 5'-праймер путем введения последовательности распознавания для Nde I и 3'-праймер путем введения последовательности распознавания для Hind III (SEQ ID NO:74, SEQ ID NO:75). Геномная ДНК, выделенная из клеток Candida magnoliae CBS 6396, служила в качестве матрицы для полимеразной цепной реакции. Амплификацию проводили в ПЦР-буфере [10 мМ Трис-HCl, (pH 8,0); 50 мМ KCl; 10 мМ MgSO4; 1 мМ dNTP-микс; в каждом случае использовали 20 пмоль праймера и 2,5 Ед ДНК-полимеразы Platinum Pfx (Invitrogen)] вместе с 50 нг ДНК SEQ ID NO:70 в качестве матрицы, и использовали следующие температурные циклы:
Полученный в результате ПЦР-продукт, имеющий размер, составляющий примерно 750 п.о., после очистки в 1% агарозном геле подвергали рестрикции с помощью эндонуклеаз Nde I и Hind III и лигировали в структуру вектора pET21a (Novagen), структура которых была обработана с помощью аналогичных эндонуклеаз. После трансформирования 2 мкл лигазной смеси в клетки E.coli Top 10 F' (Invitrogen), плазмидную ДНК устойчивых к ампициллину (или канамицину) колоний тестировали на присутствие вставки, имеющей размер, составляющий 750 п.о., с помощью рестрикционного анализа с использованием эндонуклеаз Nde I и Hind III. Экспрессирующие конструкции pET21-MIX секвенировали. Ген из Candida magnoliae, кодирующий осидоредуктазу с короткой цепью, имеет открытую рамку считывания, содержащую всего 720 п.о. (SEQ ID NO:16), которая соответствует белку из 239 аминокислот (SEQ ID NO:1).
D) Экспрессия рекомбинантной оксидоредуктазы в клетках E.coli
Компетентные клетки Escherichia coli Star BL21(De3) (Invitrogen) и клетки RB791 (E.coli genetic stock, Yale, USA), соответственно, трансформировали экспрессирующими конструкциями pET21-MIX, кодирующими оксидоредуктазу. Колонии Escherichia coli, трансформированные экспрессирующими конструкциями, затем культивировали в 200 мл среды LB (1% триптон, 0,5% дрожжевой экстракт, 1% NaCl) в присутствии 50 мкг/мл ампициллина или 40 мкг/мл канамицина, соответственно, до тех пор, пока оптическая плотность не достигнет значения 0,5 по измерениям при 550 нм. Экспрессию рекомбинантного белка индуцировали путем добавления изопропилтиогалактозида (IPTG) с концентрацией 0,1 мМ. Через 16 часов после индуцирования при 25°C и при 220 об/мин, клетки собирали и замораживали на -20°C. Для проведения теста на активность, 10 мг клеток смешивали с 500 мкл 100 мМ буфера TEA pH 7, 1 мМ MgCl2 и 500 мкл стеклянных шариков и гидролизовали в течение 10 мин с использованием шаровой мельницы. Полученный лизат затем использовали в разведенном состоянии для соответствующих измерений.
Тест на активность проводили следующим образом: 960 мкл 100 мМ буфера TEA pH 7, 1 мМ MgCl2, 160 мкг NADPH, 10 мкл разведенного клеточного лизата. Реакцию запускали путем добавления к реакционной смеси 10 мкл 100 мМ раствора субстрата.
Для извлечения фермента в больших количествах, 30 г клеток ресуспендировали в 150 мл буфера триэтаноламина (100 мМ, pH 7, 2 мМ MgCl2, 10% глицерин) и гидролизовали с использованием гомогенизатора высокого давления. Затем раствор фермента смешивали с 150 мл глицерина и хранили при -20°C.
Аналогично методике, приведенной выше в примере 2, также могут быть получены оксидоредуктазы SEQ ID NO:2, 3, 4, 8, 9, 10, 11, 12, 13, 14, 15.
Пример 3
Характеризация оксидоредуктаз SEO ID NO:1-SEQ ID NO:15 в отношении их способности восстанавливать соединения формулы I
Оксидоредуктазы последовательностей SEQ ID NO:1-SEQ ID NO:15 исследовали на предмет преобразования соединения формулы I, как описано ниже.
Реакционная смесь A (без регенерации кофермента)
160 мкл буфера (триэтаноламин 100 мМ pH 7, 1 мМ MgCl2, 10% глицерин)
150 мкл NAD(P)H (40 мг/мл)=6 мг
20 мкл 2-пропанола
2 мг соединения формулы I
50 мкл раствора фермента согласно примеру 1D
Реакционная смесь B (с регенерацией кофермента)
400 мкл буфера (триэтаноламин 100 мМ pH 7, 1мМ MgCl2, 10% глицерин)
0,05 мг NAD(P)H
50 мкл 2-пропанола
10 мг соединения формулы I
50 мкл раствора фермента согласно примеру 1D
Через 24 ч инкубации образцов A и B, в каждом случае добавляли 1 мл ацетонитрила для завершения реакционных смесей, реакционные смеси центрифугировали и переносили в пробирку для ВЭЖХ-анализа (1 мг/мл).
Реакционные смеси анализировали ВЭЖХ (Nucleodur 100 5 C18 ec, 125 мм, диаметр 4 мм, Macherey-Nagel). Использовали поток 1 мл/мин и систему растворителей из ацетонитрила (B) и воды (A). Соединения формул I, II и III можно было разделить в течение 10 мин при увеличении линейного градиента ацетонитрила от 40% до 80%.
Время удерживания составило (кетон формулы I) 10 мин; (R,S-соединение формулы II) 9,3 мин и (S,S-соединение формулы III) 8,5 мин
Результаты
Пример 4
Преобразование соединения формулы I в соединение формулы II (R,S-соединение) с помощью оксидоредуктазы SEQ ID NO:1
Для преобразования соединения формулы I в соединение формулы II (R,S-соединение), в каждом случае добавляли 2,25 мл суспензии фермента SEQ ID NO:1 (см. пример 1D) и 75 единиц (=2 мл) сверхэкспрессированной спирт-дегидрогеназы из Thermoanerobium brockii к смеси из 3 мл буфера (100 мМ TEA, pH 8, 10% глицерин), 1,5 г соединения формулы I, 0,3 мг NADP и 7 мл 4-метил-2-пентанола. Реакционную смесь инкубировали при комнатной температуре при постоянном интенсивном перемешивании. Через 48 ч, более чем 95% использованного соединения формулы I было восстановлено до соединения формулы II. Энантиомерный избыток составил >98%.
Пример 5
Преобразование соединения формулы I в соединение формулы III (S,S-соединение) с помощью оксидоредуктазы SEQ ID NO:5
Для дальнейшего преобразования соединения формулы I в соединение формулы III (S,S-соединение), смесь из 600 мкл буфера (100 мМ TEA, pH 9), 200 мкл 2-пропанола, 50 мг соединения формулы I, 0,1 мг NAD и 200 мкл суспензии фермента SEQ ID NO:5 (см. пример 1D) инкубировали в реакционной пробирке Eppendorf. Реакционную смесь инкубировали при комнатной температуре при постоянном интенсивном перемешивании. Через 48 ч, более чем 90% использованного соединения формулы I было восстановлено до соединения формулы III (S,S). Энантиомерный избыток составил >98%.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ (R)-1-АРИЛ-2-ТЕТРАЗОЛИЛЭТИЛОВОГО ЭФИРА КАРБАМИНОВОЙ КИСЛОТЫ | 2010 |
|
RU2539983C2 |
| ПОЛУЧЕНИЕ КСИЛИТА ИЗ ГЛЮКОЗЫ ПРИ ПОМОЩИ РЕКОМБИНАНТНОГО ШТАММА | 2015 |
|
RU2693593C2 |
| ХИМИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ СПИРОИНДОЛОНОВ И ИХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 2013 |
|
RU2662815C2 |
| МОДИФИЦИРОВАННЫЕ МИКРООРГАНИЗМЫ И СПОСОБЫ ПОЛУЧЕНИЯ БУТАДИЕНА С ИХ ПРИМЕНЕНИЕМ | 2012 |
|
RU2639564C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХИРАЛЬНЫХ АЛЬФА-ГАЛОАЛКАНОВЫХ КИСЛОТ | 2018 |
|
RU2790496C2 |
| ПОЛУЧЕНИЕ ТЕРМИНАЛЬНЫХ АЛКЕНОВ С ПОМОЩЬЮ ФЕРМЕНТАТИВНОГО ДЕКАРБОКСИЛИРОВАНИЯ 3-ГИДРОКСИАЛКАНОЕВЫХ КИСЛОТ | 2009 |
|
RU2571933C2 |
| ИММУНОГЕННЫЕ ГИБРИДНЫЕ ПОЛИПЕПТИДЫ ПРОТИВ ОЖИРЕНИЯ И КОМПОЗИЦИЯ ВАКЦИН ПРОТИВ ОЖИРЕНИЯ, СОДЕРЖАЩАЯ ЭТИ ПОЛИПЕПТИДЫ | 2007 |
|
RU2418005C2 |
| ВАРИАНТЫ ГЛИКОЛИПИДАЦИЛТРАНСФЕРАЗЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2004 |
|
RU2377300C2 |
| БЕЛКИ | 2004 |
|
RU2518345C2 |
| СПОСОБЫ УСИЛЕНИЯ ДЕГРАДАЦИИ ИЛИ ПРЕВРАЩЕНИЯ ЦЕЛЛЮЛОЗНОГО МАТЕРИАЛА | 2006 |
|
RU2441912C2 |



































Изобретение относится к области биотехнологии и может быть использовано для энантиоселективного ферментативного восстановления
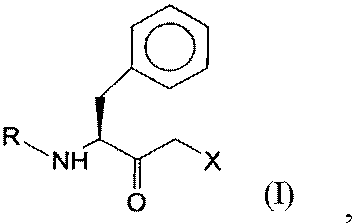
кетосоединения общей формулы (I):

где R представляет собой защитную группу для функциональных аминогрупп, а Х означает -Cl, -CN, -OH, Br, F. Полипептиды, которые имеют оксидоредуктазную активность, в зависимости от аминокислотной последовательности восстанавливают указанное соединение до соответствующих R,S- и S,S-гидроксисоединений. Применение изобретения позволяет снизить возможность образования побочных продуктов при восстановлении кетосоединения формулы (I). 6 н.п. ф-лы, 5 пр.
1. Полипептид аминокислотной последовательности, выбранной из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 и SEQ ID NO:4, который имеет оксидоредуктазную активность и восстанавливает кетосоединение общей формулы I:
,
где R представляет собой защитную группу для функциональных аминогрупп, и Х означает -Cl, -CN, -ОН, Br, F, до гидроксисоединения общей формулы II (R,S-соединения):
где R и Х имеют значения, как определено для формулы I.
2. Полипептид, который кодируется последовательностью нуклеиновой кислоты, выбранной из SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18 или SEQ ID NO:19, который имеет оксидоредуктазную активность и восстанавливает кетосоединение общей формулы I:

где R представляет собой защитную группу для функциональных аминогрупп, и Х означает -Cl, -CN, -ОН, Br, F, до гидроксисоединения общей формулы II (R,S-соединения):
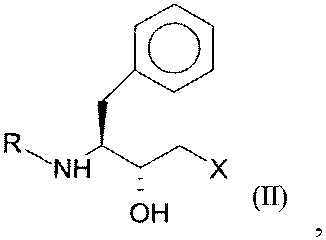
где R и Х имеют значения, как определено для формулы I.
3. Полипептид, который кодируется последовательностью нуклеиновой кислоты, которая гибридизуется в жестких условиях с одной из SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18 или SEQ ID NO:19, и который имеет оксидоредуктазную активность и восстанавливает кетосоединение общей формулы I:
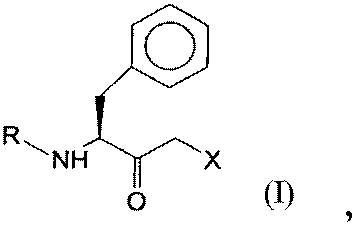
где R представляет собой защитную группу для функциональных аминогрупп, и Х означает -Cl, -CN, -ОН, Br, F, до гидроксисоединения общей формулы II (R,S-соединения):
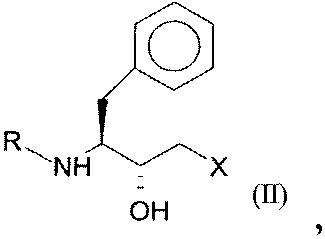
где R и Х имеют значения, как определено для формулы I.
4. Полипептид аминокислотной последовательности, выбранной из SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14 и SEQ ID NO:15, который имеет оксидоредуктазную активность и восстанавливает кетосоединение общей формулы I:
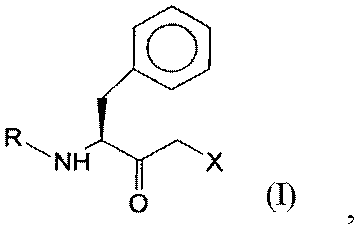
где R представляет собой защитную группу для функциональных аминогрупп, и Х означает -Cl, -CN, -ОН, Br, F, до гидроксисоединения общей формулы III (S,S-соединения):
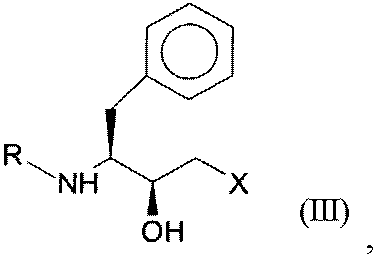
где R и Х имеют значения, как определено для формулы I.
5. Полипептид, который кодируется последовательностью нуклеиновой кислоты, выбранной из SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29 или SEQ ID NO:30, который имеет оксидоредуктазную активность и восстанавливает кетосоединение общей формулы I:

где R представляет собой защитную группу для функциональных аминогрупп, и Х означает -Cl, -CN, -ОН, Br, F, до гидроксисоединения общей формулы III (S,S-соединения):
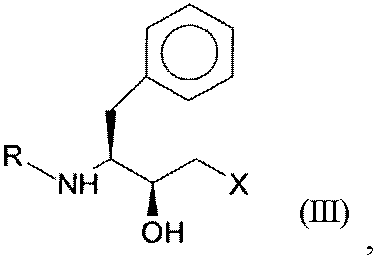
где R и Х имеют значения, как определено для формулы I.
6. Полипептид, который кодируется последовательностью нуклеиновой кислоты, которая гибридизуется в жестких условиях с одной из SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29 или SEQ ID NO:30, и который имеет оксидоредуктазную активность и восстанавливает кетосоединение общей формулы I:
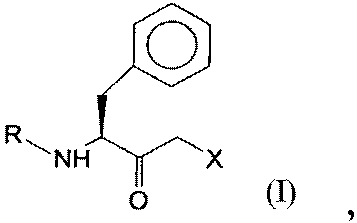
где R представляет собой защитную группу для функциональных аминогрупп, и Х означает -Cl, -CN, -OH, Br, F, до гидроксисоединения общей формулы III (S,S-соединения):
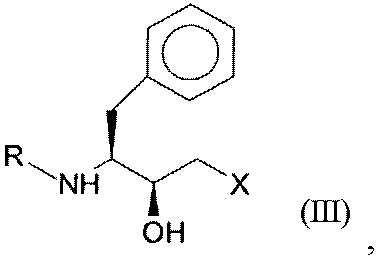
где R и Х имеют значения, как определено для формулы I.
| Буквопечатающий телеграфный аппарат системы Сименса | 1915 |
|
SU1893A1 |
| US 2007083055 A1, 12.04.2007 | |||
| WO 2007073875 A, 05.07.2007 | |||
| (ЦИТОХРОМ Р450)-МОНООКСИГЕНАЗЫ | 1998 |
|
RU2237714C2 |
Авторы
Даты
2013-06-27—Публикация
2008-09-22—Подача