РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной патентной заявки с серийным No. 60/916978, поданной 9 мая 2007 года, полное содержание которой включено в настоящий документ в качестве ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Преобразование, утилизация и доступность энергии лежат в основе множества сложных задач настоящего времени, включая задачи, связанные с возобновляемостью, качеством окружающей среды, безопасностью и нехваткой средств. Для решения этих задач требуются новые способы применения развивающихся технологий. Биотехнология, одна из наиболее мощных из развивающихся технологий, может обеспечить важные новые процессы преобразования энергии. Растительные биомассы и их производные являются источником для биологического преобразования энергии в формы, подходящие для человечества.
Среди форм растительной биомассы, лигноцеллюлозная биомасса ("биомасса") особенно подходит для энергетического применения вследствие ее высокой доступности, низкой стоимости и экологически благоприятной продукции. В частности, многие циклы выработки и утилизации, основанные на целлюлозной биомассе, имеют практически нулевое выделение вызывающих парниковый эффект газов на основе жизненного цикла. Основным препятствием, затрудняющим более распространенную выработку энергии из сырья биомассы, является общее отсутствие недорогой технологии для преодоления неподатливости этих материалов к преобразованию в пригодное топливо. Лигноцеллюлозная биомасса содержит углеводные фракции (например, целлюлозу и гемицеллюлозу), которые можно превращать в этанол. Для преобразования этих фракций, целлюлозу и гемицеллюлозу необходимо в конечном итоге превращать или гидролизовывать в моносахариды; именно гидролиз, как исторически подтверждено, является проблематическим.
Биологически опосредуемые процессы являются перспективными для преобразования энергии, в частности для преобразования лигноцеллюлозной биомассы в топливо. Схемы переработки биомассы, вовлекающие ферментативный и микробный гидролиз, обычно вовлекают четыре биологически опосредуемых преобразования: (1) продукцию сахаролитических ферментов (целлюлаз и гемицеллюлаз); (2) гидролиз углеводных компонентов, присутствующих в предварительно обработанной биомассе до сахаров; (3) ферментацию гексозных сахаров (например, глюкозы, маннозы и галактозы); и (4) ферментацию пентозных сахаров (например, ксилозы и арабинозы). Эти четыре преобразования происходят на единой стадии схемы процесса, называемой объединенной биотехнологией (CBP), которая отличается от других менее высоко интегрированных схем тем, что она не вовлекает специальную стадию процесса для продукции целлюлазы и/или гемицеллюлазы.
CBP обеспечивает возможность более низкой стоимости и более высокой эффективности, чем процессы, характерные для специализированной продукции целлюлазы. Преимущества, частично, являются следствием избежания затрат капитала, материалов субстрата и другого сырья, и удобства, связанного с продукцией целлюлазы. Кроме того, при использовании CBP, несколько факторов поддерживают осуществление более высоких скоростей гидролиза, и, таким образом, снижение объема реактора и вложений капитала, включая синергию фермент-микроорганизм и применение термофильных организмов и/или комплексных систем целлюлазы. Более того, микроорганизмы, адгезивные к целлюлозе, вероятно, будут успешно конкурировать за продукты гидролиза целлюлозы с неадгезивными микроорганизмами, например, контаминирующими организмами, что может повышать стабильность промышленных процессов на основе микробной утилизации целлюлозы. Прогресс разработки обеспечивающих CBP микроорганизмов был достигнут путем двух стратегий: инженерия встречающихся в природе целлюлолитических микроорганизмов для повышения связанных с продуктом свойств, таких как выход и титр; и инженерия нецеллюлолитических организмов, которые проявляют высокий выход и титры продукта, для экспрессии гетерологичной системы целлюлазы и гемицеллюлазы, обеспечивающей утилизацию целлюлозы и гемицеллюлозы.
Многие бактерии обладают способностью ферментировать простые гексозные сахара в смесь кислых и pH-нейтральных продуктов путем процесса гликолиза. Гликолитический каскад широко распространен и включает серию ферментативных стадий, посредством которых молекула глюкозы из шести атомов углерода распадается, через множество промежуточных соединений, на две молекулы пирувата, соединения из трех атомов углерода. Этот процесс приводит к суммарному образованию ATP (биологический источник энергии) и восстановленному кофактору NADH.
Пируват является важным промежуточным соединением при метаболизме. Например, в аэробных условиях пируват может окисляться до ацетил-кофермента A (ацетил-CoA), который затем входит в цикл трикарбоновых кислот (TCA), который, в свою очередь, образует синтетические предшественники, CO2 и восстановленные кофакторы. Затем кофакторы окисляются, путем донорства водородных эквивалентов посредством серии ферментативных стадий, до кислорода, что приводит к образованию воды и ATP. Этот процесс выработки энергии известен как окислительное фосфорилирование.
В анаэробных условиях (без доступа кислорода) происходит ферментация, при которой продукты деградации органических соединений служат в качестве доноров и акцепторов водорода. Избыток NADH при гликолизе окисляется в реакциях, вовлекающих восстановление органических субстратов до продуктов, таких как лактат и этанол. Кроме того, ATP регенерирует при образовании органических кислот, таких как ацетат, в процессе, известном как фосфорилирование на уровне субстрата. Таким образом, продукты ферментации при гликолизе и метаболизме пирувата включают множество органических кислот, спирты и CO2.
Большинство факультативных анаэробных бактерий не продуцируют высокие уровни этанола ни в аэробных, ни в анаэробных условиях. Большинство факультативных анаэробов метаболизируют пируват аэробно с помощью пируватдегидрогеназы (PDH) и цикла трикарбоновых кислот (TCA). В анаэробных условиях, главный энергетический каскад для метаболизма пирувата представляет собой каскад через пируватформиатлиазу (PFL) с образованием формиата и ацетил-CoA. Затем ацетил-CoA превращается в ацетат под действием фосфотрансацетилазы (PTA) и ацетаткиназы (ACK) с одновременной продукцией ATP, или восстанавливается в этанол ацетальальдегиддегидрогеназой (AcDH) и алкогольдегидрогеназой (ADH). Для поддержания равновесия восстанавливающих эквивалентов избыток NADH, образующийся при гликолизе, подвергается перокислению в NAD+ лактатдегидрогеназой (LDH) в ходе восстановления пирувата до лактата. Также NADH может подвергаться перокислению посредством AcDH и ADH в ходе восстановления ацетил-CoA в этанол, однако это является вспомогательной реакцией в клетках с функциональной LDH. Таким образом, теоретический выход этанола не достигается, поскольку большая часть ацетил-CoA превращается в ацетат для регенерации ATP, и избыток NADH, образующийся в ходе гликолиза, окисляется LDH.
Метаболическая инженерия микроорганизмов может также приводить к осуществлению нацеленного нокаута генов, кодирующих продукцию ферментов, таких как лактатдегидрогеназа. В этом случае, "нокаут" генов означает частичную, существенную или полную делецию, подавление, инактивацию или супрессию. Если преобразование пирувата в лактат (форма соль молочной кислоты) под действием LDH не доступна на ранних стадиях гликолитического каскада, тогда пируват может более эффективно превращаться в ацетил-CoA под действием пируватдегидрогеназы или пируватферредоксиноксидоредуктазы. Если дальнейшее преобразование ацетил-CoA в ацетат (форму соли уксусной кислоты) фосфотрансацетилазой и ацетаткиназой также не доступно, т.е. если гены, кодирующие продукцию PTA и ACK, подвергнуты нокауту, тогда ацетил-CoA может более эффективно превращаться в этанол с помощью AcDH и ADH. Таким образом, генетически модифицированный штамм микроорганизмов с таким направленным нокаутом генов, который устраняет продукцию органических кислот, может иметь способность к увеличенной продукции этанола в качестве продукта ферментации.
Продуцирующие этанол организмы, такие как Zymomonas mobilis, Zymobacter palmae, Acetobacter pasteurianus или Sarcina ventriculi и некоторые дрожжи (например, Saccharomyces cerevisiae), способны ко второму типу анаэробной ферментации, обычно называемой спиртовым брожением, при котором пируват метаболизируется до ацетальдегида и CO2 пируватдекарбоксилазой (PDC). Затем ацетальдегид восстанавливается до этанола посредством ADH, регенерирующей NAD+. Спиртовая ферментация приводит к метаболизму одной молекулы глюкозы до двух молекул этанола и двух молекул CO2. Если бы преобразования пирувата в нежелательные органические кислоты можно было бы избежать, как подробно описано выше, то такой генетически модифицированный микроорганизм имел бы способность к повышенной продукции этанола в качестве продукта ферментации.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Один аспект изобретения относится к выделенной молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность любой из SEQ ID NO:1-5, 30-31 и 47-61, или к комплементарной ей молекуле. Другой аспект изобретения относится к выделенной молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, которая обладает по меньшей мере 80% идентичностью с нуклеотидной последовательностью любой из SEQ ID NO:1-5, 30-31 и 47-61, или к комплементарной ей молекуле. В определенных вариантах осуществления, изобретение относится к указанной выше молекуле нуклеиновой кислоты, которая обладает по меньшей мере приблизительно 95% идентичностью последовательности с нуклеотидной последовательностью любой из SEQ ID NO:1-5, 30-31 и 47-61, или к комплементарной ей молекуле.
Другой аспект настоящего изобретения относится к генетической конструкции, содержащий любую из SEQ ID NO:1-5, 30-31 и 47-61, функционально связанную с промотором, экспрессируемой в термофильной или мезофильной бактерии. Также настоящее изобретение относится к рекомбинантной термофильной или мезофильной бактерии, содержащей указанную выше генетическую конструкцию.
Также настоящее изобретение относится к вектору, содержащему любую из указанных выше молекул нуклеиновых кислот. Также настоящее изобретение относится к клетке-хозяину, содержащей одну из указанных выше молекул нуклеиновых кислот. В определенных вариантах осуществления, изобретение относится к указанной выше клетке-хозяину, где указанная клетка-хозяин представляет собой термофильную или мезофильную бактериальную клетку.
Другой аспект изобретения относится к генетически модифицированному термофильному или мезофильному микроорганизму, где первый нативный ген частично, по существу, или полностью удален, подавлен, инактивирован или супрессирован, причем первый нативный ген кодирует первый нативный фермент, вовлеченный в метаболическую продукцию органической кислоты или ее соли, тем самым повышая нативную способность указанного термофильного или мезофильного микроорганизма продуцировать этанол в качестве продукта ферментации. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный микроорганизм представляет собой грамотрицательную бактерию или грамположительную бактерию. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный микроорганизм представляет собой вид рода Thermoanaerobacterium, Thermoanaerobacter, Clostridium, Geobacillus, Saccharococcus, Paenibacillus, Bacillus, Caldicellulosiruptor, Anaerocellum или Anoxybacillus. В определенных вариантах осуществления, настоящее изобретение относится к указному выше генетически модифицированному микроорганизму, где указанный микроорганизм представляет собой бактерию, выбранную из группы, состоящей из: Thermoanaerobacterium thermosulfurigenes, Thermoanaerobacterium aotearoense, Thermoanaerobacterium polysaccharolyticum, Thermoanaerobacterium zeae, Thermoanaerobacterium xylanolyticum, Thermoanaerobacterium saccharolyticum, Thermoanaerobium brockii, Thermoanaerobacterium thermosaccharolyticum, Thermoanaerobacter thermohydrosulfuricus, Thermoanaerobacter ethanolicus, Thermoanaerobacter brocki, Clostridium thermocellum, Clostridium cellulolyticum, Clostridium phytofermentans, Clostridium straminosolvens, Geobacillus thermoglucosidasius, Geobacillus stearothermophilus, Saccharococcus caldoxylosilyticus, Saccharoccus thermophilus, Paenibacillus campinasensis, Bacillus flavothermus, Anoxybacillus kamchatkensis, Anoxybacillus gonensis, Caldicellulosiruptor acetigenus, Caldicellulosiruptor saccharolyticus, Caldicellulosiruptor kristjanssonii, Caldicellulosiruptor owensensis, Caldicellulosiruptor lactoaceticus и Anaerocellum thermophilum. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный микроорганизм представляет собой Thermoanaerobacterium saccharolyticum. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный микроорганизм выбран из группы, состоящей из: (a) термофильного или мезофильного микроорганизма с нативной способностью метаболизировать гексозный сахар; (b) термофильного или мезофильного микроорганизма с нативной способностью метаболизировать пентозный сахар; и (c) термофильного или мезофильного микроорганизма с нативной способностью метаболизировать гексозный сахар и пентозный сахар. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный микроорганизм обладает нативной способностью метаболизировать гексозный сахар. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный микроорганизм представляет собой Clostridium straminisolvens или Clostridium thermocellum. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный микроорганизм обладает нативной способностью метаболизировать гексозный сахар и пентозный сахар. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный микроорганизм представляет собой Clostridium cellulolyticum, Clostridium kristjanssonii или Clostridium stercorarium подвида leptosaprartum. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где встроен первый ненативный ген, причем первый ненативный ген кодирует первый ненативный фермент, который придает способность метаболизировать пентозный сахар, тем самым, позволяя указанному термофильному или мезофильному микроорганизму продуцировать этанол в качестве продукта ферментации из пентозного сахара. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный микроорганизм обладает нативной способностью метаболизировать пентозный сахар. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный микроорганизм выбран из группы, состоящей из Thermoanaerobacterium saccharolyticum, Thermoanaerobacterium xylanolyticum, Thermoanaerobacterium polysaccharolyticum и Thermoanaerobacterium thermosaccharolyticum. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где встроен первый ненативный ген, причем первый ненативный ген кодирует первый ненативный фермент, который придает способность метаболизировать гексозный сахар, тем самым, позволяя указанному термофильному или мезофильному микроорганизму продуцировать этанол в качестве продукта ферментации из гексозного сахара. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанная органическая кислота выбрана из группы, состоящей из молочной кислоты и уксусной кислоты. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанная органическая кислота представляет собой молочную кислоту. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанная органическая кислота представляет собой уксусную кислоту. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый нативный фермент выбран из группы, состоящей из лактатдегидрогеназы, ацетаткиназы и фосфотрансацетилазы. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый нативный фермент представляет собой лактатдегидрогеназу. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый нативный фермент представляет собой ацетаткиназу. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый нативный фермент представляет собой фосфотрансацетилазу. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где второй нативный ген частично, по существу, или полностью удален, подавлен, инактивирован или супрессирован, причем второй нативный ген кодирует второй нативный фермент, вовлеченный в метаболическую продукцию органической кислоты или ее соли. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный второй нативный фермент представляет собой ацетаткиназу или фосфотрансацетилазу. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный второй нативный фермент представляет собой лактатдегидрогеназу.
Другой аспект изобретения относится к генетически модифицированному термофильному или мезофильному микроорганизму, где (a) первый нативный ген частично, по существу, или полностью удален, подавлен, инактивирован или супрессирован, причем первый нативный ген кодирует первый нативный фермент, вовлеченный в метаболическую продукцию органической кислоты или ее соли, и (b) встроен первый ненативный ген, причем первый ненативный ген кодирует первый ненативный фермент, вовлеченный в метаболическую продукцию этанола, тем самым позволяя указанному термофильному или мезофильному микроорганизму продуцировать этанол в качестве продукта ферментации. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый ненативный ген кодирует первый ненативный фермент, который придает способность метаболизировать гексозный сахар, тем самым позволяя указанному термофильному или мезофильному микроорганизму метаболизировать гексозный сахар. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый ненативный ген кодирует первый ненативный фермент, который придает способность метаболизировать пентозный сахар, тем самым позволяя указанному термофильному или мезофильному микроорганизму метаболизировать пентозный сахар. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый ненативный ген кодирует первый ненативный фермент, который придает способность метаболизировать гексозный сахар; и встроен второй ненативный ген, причем второй ненативный ген кодирует второй ненативный фермент, который придает способность метаболизировать пентозный сахар, тем самым позволяя указанному термофильному или мезофильному микроорганизму метаболизировать гексозный сахар и пентозный сахар. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанная органическая кислота представляет собой молочную кислоту. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанная органическая кислота представляет собой уксусную кислоту. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый ненативный фермент представляет собой пируватдекарбоксилазу (PDC) или алкогольдегидрогеназу (ADH). В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный второй ненативный фермент представляет собой ксилозоизомеразу. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый ненативный ген соответствует SEQ ID NO:6, 10 или 14. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный ненативный фермент представляет собой ксилулокиназу. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный ненативный ген соответствует SEQ ID NO:7, 11 или 15. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный ненативный фермент представляет собой L-арабинозоизомеразу. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный ненативный ген соответствует SEQ ID NO:8 или 12. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный ненативный фермент представляет собой L-рибулозо-5-фосфат A-эпимеразу. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный ненативный ген соответствует SEQ ID NO:9 или 13. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный микроорганизм способен превращать по меньшей мере 60% углерода из метаболизированной биомассы в этанол. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный микроорганизм выбран из группы, состоящей из: (a) термофильного или мезофильного микроорганизма с нативной способностью гидролизовывать целлюлозу; (b) термофильного или мезофильного микроорганизма с нативной способностью гидролизовывать ксилан; и (c) термофильного или мезофильного микроорганизма с нативной способностью гидролизовывать целлюлозу и ксилан. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный микроорганизм обладает нативной способностью гидролизовывать целлюлозу. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный микроорганизм обладает нативной способностью гидролизовывать целлюлозу и ксилан. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где встроен первый ненативный ген, причем первый ненативный ген кодирует первый ненативный фермент, который придает способность гидролизовывать ксилан. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный микроорганизм обладает нативной способностью гидролизовывать ксилан. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где встроен первый ненативный ген, причем первый ненативный ген кодирует первый ненативный фермент, который придает способность гидролизовывать целлюлозу. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанная органическая кислота выбрана из группы, состоящей из молочной кислоты и уксусной кислоты. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанная органическая кислота представляет собой молочную кислоту. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанная органическая кислота представляет собой уксусную кислоту. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый нативный фермент выбран из группы, состоящей из лактатдегидрогеназы, ацетаткиназы и фосфотрансацетилазы. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый нативный фермент представляет собой лактатдегидрогеназу. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый нативный фермент представляет собой ацетаткиназу. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый нативный фермент представляет собой фосфотрансацетилазу. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где второй нативный ген частично, по существу, или полностью удален, подавлен, инактивирован или супрессирован, причем второй нативный ген кодирует второй нативный фермент, вовлеченный в метаболическую продукцию органической кислоты или ее соли. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный второй нативный фермент представляет собой ацетаткиназу или фосфотрансацетилазу. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный второй нативный фермент представляет собой лактатдегидрогеназу. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где (a) первый нативный ген частично, по существу, или полностью удален, подавлен, инактивирован или супрессирован, причем первый нативный ген кодирует первый нативный фермент, вовлеченный в метаболическую продукцию органической кислоты или ее соли, и (b) встроен первый ненативный ген, причем первый ненативный ген кодирует первый ненативный фермент, вовлеченный в гидролиз полисахарида, тем самым позволяя указанному термофильному или мезофильному микроорганизму продуцировать этанол в качестве продукта ферментации. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый ненативный ген кодирует первый ненативный фермент, который придает способность гидролизовывать целлюлозу, тем самым позволяя указанному термофильному или мезофильному микроорганизму гидролизовывать целлюлозу. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый ненативный ген кодирует первый ненативный фермент, который придает способность гидролизовывать ксилан, тем самым позволяя указанному термофильному или мезофильному микроорганизму гидролизовывать ксилан. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый ненативный ген кодирует первый ненативный фермент, который придает способность гидролизовывать целлюлозу; и встроен второй ненативный ген, причем второй ненативный ген кодирует второй ненативный фермент, который придает способность гидролизовывать ксилан, тем самым позволяя указанному термофильному или мезофильному микроорганизму гидролизовывать целлюлозу и ксилан. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанная органическая кислота представляет собой молочную кислоту. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанная органическая кислота представляет собой уксусную кислоту. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный первый ненативный фермент представляет собой пируватдекарбоксилазу (PDC) или алкогольдегидрогеназу (ADH). В определенных вариантах осуществления, настоящее изобретение относится к указанному выше генетически модифицированному микроорганизму, где указанный микроорганизм способен превращать по меньшей мере 60% углерода из метаболизированной биомассы в этанол.
В определенных вариантах осуществления, настоящее изобретение относится к любому из указанных выше генетически модифицированных микроорганизмов, где указанный микроорганизм является мезофильным. В определенных вариантах осуществления, настоящее изобретение относится к любому из указанных выше генетически модифицированных микроорганизмов, где указанный микроорганизм является термофильным.
Другой аспект изобретения относится к процессу преобразования лигноцеллюлозной биомассы в этанол, включающему контактирование лигноцеллюлозной биомассы с любым из указанных выше генетически модифицированных термофильных или мезофильных микроорганизмов. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше процессу, где указанная лигноцеллюлозная биомасса выбрана из группы, состоящей из травы, проса, спартины изящной, райграса многолетнего пастбищного, двукисточника тростниковидного, травы смешанных прерий, мискантуса, остатков переработки сахара, выжимки сахарного тростника, соломы сахарного тростника, сельскохозяйственных отходов, соломы риса, рисовой шелухи, соломы ячменя, сердцевин кукурузного початка, соломы хлебных злаков, соломы пшеницы, соломы канолы, соломы овса, овсяной шелухи, кукурузного волокна, соломы для скота, соевой соломы, кукурузной соломы, древесных отходов, утилизированного волокна древесной пульпы, бумажной пульпы, древесных опилок, твердой древесины, мягкой древесины и их сочетаний. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше процессу, где указанная лигноцеллюлозная биомасса выбрана из группы, состоящей из кукурузной соломы, выжимки сахарного тростника, проса и древесины тополя. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше процессу, где указанная лигноцеллюлозная биомасса представляет собой кукурузную солому. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше процессу, где указанная лигноцеллюлозная биомасса представляет собой выжимку сахарного тростника. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше процессу, где указанная лигноцеллюлозная биомасса представляет собой просо. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше процессу, где указанная лигноцеллюлозная биомасса представляет собой древесину тополя. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше процессу, где указанная лигноцеллюлозная биомасса представляет собой иву. В определенных вариантах осуществления, настоящее изобретение относится к указанному выше процессу, где указанная лигноцеллюлозная биомасса представляет собой бумажную пульпу.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фигуре 1 представлен каскад гликолиза.
На фигуре 2 представлены взаимопреобразования пентоз и глюкуроната и выделены цветом ферменты ксилозоизомераза (XI или 5.3.1.5) и ксилулокиназа (XK или 2.7.1.17), в каскаде от D-ксилозы до этанола.
На фигуре 3 представлены взаимопреобразования пентоз и глюкуроната и выделены цветом ферменты L-арабинозоизомераза (5.3.1.4) и L-рибулозо-5-фосфат 4-эпимераза (5.1.3.4), в каскаде утилизации L-арабинозы.
На фигуре 4 представлены взаимопреобразования пентоз и глюкуроната и показано, что гены для ксилозоизомеразы, ксилулокиназы, L-арабинозоизомеразы и L-рибулозо-5-фосфат 4-эпимеразы присутствуют в C. cellulolyticum.
На фигуре 5 представлены взаимопреобразования пентоз и глюкуроната и показано, что ксилозоизомераза и ксилулокиназа присутствуют, а L-арабинозоизомераза и L-рибулозо-5-фосфат 4-эпимераза отсутствуют в C. phytofermentans.
Фигура 6 представлено выравнивание Clostridium thermocellum (SEQ ID NO:77), Clostridium cellulolvticum (SEQ ID NO:78), Thermoanaerobacterium saccharolyticum (SEQ ID NO:79), C. stercorarium (SEQ ID NO:80), C. stercorarium II (SEQ ID NO:81), Caldiscellulosiruptor kristianssonii (SEQ ID NO:82), C. phvtofermentans (SEQ ID NO:83), что указывает приблизительно на 73-89% гомологию на уровне гена рДНК 16S.
На фигуре 7 представлена конструкция вектора для нокаута с двойным кроссинговером для инактивации гена ack в Clostridium thermocellum на основе плазмиды pIKM1.
На фигуре 8 представлена конструкция вектора для нокаута с двойным кроссинговером для инактивации гена ack в Clostridium thermocellum не основе репликативной плазмиды pNW33N.
На фигуре 9 представлена конструкция вектора для нокаута с двойным кроссинговером для инактивации гена ldh в Clostridium thermocellum на основе плазмиды pIKM1.
На фигуре 10 представлена конструкция вектора для нокаута с двойным кроссинговером для инактивации гена ldh в Clostridium thermocellum на основе репликативного плазмидного вектора pNW33N.
На фигуре 11 представлена конструкция вектора-"самоубийцы" для двойного кроссинговера для инактивации гена ldh в Clostridium thermocellum на основе плазмиды pUC19.
На фигурах 12A и 12B представлено образование продукта и OD600 для C. straminisolvens, выращенных на целлобиозе и Avicel®, соответственно.
На фигурах 13A и 13B представлено образование продукта и OD600 для C. thermocellum, выращенных на целлобиозе и Avicel®, соответственно.
На фигурах 14A и 14B представлено образование продукта и OD600 для C. cellulolyticum, выращенных на целлобиозе и Avicel®, соответственно.
На фигурах 15A и 15B представлено образование продукта и OD600 для C. stercorarium subs. leptospartum, выращенных на целлобиозе и Avicel®, соответственно.
Фигуры 16A и 16B представлено образование продукта и OD600 для Caldicellulosiruptor kristjanssonii, выращенных на целлобиозе и Avicel®, соответственно.
На фигурах 17A и 17B представлено образование продукта и OD600 для Clostridium phytofermentans, выращенных на целлобиозе и Avicel®, соответственно.
На фигуре 18 представлены тотальные метаболические побочные продукты после 48 часов ферментации 2,5 г/л ксилана и 2,5 г/л целлобиозы. на фигуре 19 представлена карта гена ack и области, амплифицированной посредством ПЦР для встраивания в ген.
На фигуре 20 представлена карта гена ldh 2262 и область, амплифицированная посредством ПЦР для встраивания в ген.
На фигуре 21 представлен пример фрагмента ldh (2262) C. cellulolyticum (C. cell.) с нокаутом двойным кроссинговером.
На фигуре 22 представлена карта гена ack Clostridium phytofermentans и область, амплифицированная посредством ПЦР для встраивания в ген.
На фигуре 23 представлен пример предполагаемой конструкции для нокаута с двойным кроссинговером с геном mLs в качестве селективного маркера в Clostridium phytofermentans.
На фигуре 24 представлена карта гена ldh 1389 и область, амплифицированная посредством ПЦР для встраивания в ген.
На фигуре 25 представлен пример предполагаемой конструкции для нокаута с двойным кроссинговером с геном mLs в качестве селективного маркера.
На фигуре 26 представлена диаграмма, на которой изображены п.н. 250-550 pMODTM-2<MCS> (SEQ ID NO:84).
На фигуре 27 представлены профили концентрации продукта для 1% Avicel® с использованием C. straminisolvens. Отношение "этанол к ацетату" представлено в качестве E/A и отношение "этанол к общим продуктам" представлено в качестве E/T.
На фигуре 28 представлен пример вектора для перенацеливания интрона L1.LtrB на вставку в ген ACK C. cell. (SEQ ID NO:21).
На фигуре 29 представлен пример вектора для перенацеливания интрона L1.LtrB на вставку в ген LDH2744 C. cell. (SEQ ID NO:23).
На фигуре 30 представлено выравнивание T. pseudoethanolicus 39E (SEQ ID NO:85), штамма T. sp 59 (SEQ ID NO:86), T. saccharolyticum B6A-RI (SEQ ID NO:87), T. saccharolyticum YS485 (SEQ ID NO:88) и консенсусной последовательности (SEQ ID NO:89) на уровне гена рДНК 16S.
На фигуре 31 представлено выравнивание T. sp. штамма 59 (SEQ ID NO:36), T. Pseudoethanolicus (SEQ ID NO:35), T. saccharolyticum B6A-RI (SEQ ID NO:38), T. saccharolyticum YS485 (SEQ ID NO:32) и консенсусной последовательности (SEQ ID NO:90) на уровне гена pta.
На фигуре 32 представлено выравнивание T. sp. штамма 59 (SEQ ID NO:37), T. Pseudoethanolicus (SEQ ID NO:34), T. saccharolyticum B6A-RI (SEQ ID NO:39), T. saccharolyticum YS485 (SEQ ID NO:33) и консенсусной последовательности (SEQ ID NO:91) на уровне гена ack.
На фигуре 33 представлено выравнивание T. sp. штамма 59 (SEQ ID NO:41), T. pseudoethanolicus 39E (SEQ ID NO:42), T. saccharolyticum B6A-RI (SEQ ID NO:43), T. saccharolyticum YS485 (SEQ ID NO:40) и консенсусной последовательности (SEQ ID NO:92) на уровне гена ldh.
На фигуре 34 представлена схема каскада гликолиза/ферментации.
На фигуре 35 представлен пример плазмиды pMU340.
На фигуре 36 представлен пример плазмиды pMU102 Z. mobilis PDC-ADH.
На фигуре 37 представлен пример плазмиды pMU102 Z. palmae PDC, Z. mobilis ADH.
На фигуре 38 представлена карта плазмиды pMU360. Последовательность ДНК pMU360 указана в качестве SEQ ID NO:61.
На фигуре 39 представлены уровни лактата в девяти колониях устойчивых к тиамфениколу трансформантов.
На фигуре 40 представлен пример плазмиды для однократного кроссинговера KO pfl T. sacch. (SEQ ID NO:47).
На фигуре 41 представлен пример плазмиды для двойного кроссинговера KO pfl T. sacch. (SEQ ID NO:48).
На фигуре 42 представлен пример плазмиды для однократного кроссинговера KO pfl C. therm (SEQ ID NO:49).
На фигуре 43 представлен пример плазмиды для двойного кроссинговера KO pfl C. therm (SEQ ID NO:50).
На фигуре 44 представлен пример плазмиды для однократного кроссинговера KO pfl C. phyto. (SEQ ID NO:51).
На фигуре 45 представлен пример плазмиды для двойного кроссинговера KO pfl C. phyto. (SEQ ID NO:52).
На фигуре 46 представлен пример плазмиды для однократного кроссинговера KO L-ldh T. sacch. #59 (SEQ ID NO:53).
На фигуре 47 представлен пример плазмиды для двойного кроссинговера KO L-ldh T. sacch. #59 (SEQ ID NO:54).
На фигуре 48 представлен пример плазмиды для однократного кроссинговера KO pta/ack T. sacch. #59 (SEQ ID NO:55).
На фигуре 49 представлен пример плазмиды для двойного кроссинговера KO pta/ack T. sacch. #59 (SEQ ID NO:56).
На фигуре 50 представлен пример плазмиды для однократного кроссинговера KO L-ldh T. pseudo. (SEQ ID NO:57).
На фигуре 51 представлен пример плазмиды для двойного кроссинговера KO L-ldh T. pseudo. (SEQ ID NO:58).
На фигуре 52 представлен пример плазмиды для однократного кроссинговера KO ack T. pseudo. (SEQ ID NO:59).
На фигуре 53 представлен пример плазмиды для двойного кроссинговера KO pta/ack T. pseudo. (SEQ ID NO:60).
КРАТКОЕ ОПИСАНИЕ ТАБЛИЦ
В таблице 1 обобщенно представлены репрезентативные высоко целлюлолитические организмы.
В таблице 2 обобщенно представлены нативные целлюлолитические и ксиланолитические организмы.
В таблице 3 представлена классификация бактериальных штаммов на основе утилизации ими субстрата.
В таблице 4 представлена локализация вставки и праймеры для повторного нацеливания интрона на ацетаткиназу C. cellulolyticum.
В таблице 5 представлена локализация вставки и праймеры для повторного нацеливания интрона на лактатдегидрогеназу C. cellulolyticum.
В таблице 6 представлены характеристики ферментации полученных способами инженерии штаммов Thermoanaerobacter и Thertnoanaerobacterium.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Аспекты настоящего изобретения относятся к инженерии термофильных или мезофильных микроорганизмов для применения в продукции этанола из лигноцеллюлозной биомассы. Применение термофильных бактерий для продукции этанола обеспечивает множество преимуществ над традиционными процессами на основе мезофильных продуцентов этанола. Например, применение термофильных организмов обеспечивает существенные экономические сбережения по сравнению со способами традиционных процессов вследствие более низкой стоимости выделения этанола, сниженной потребности в добавлении внешнего фермента, и сниженного времени переработки.
Аспекты настоящего изобретения относятся к процессу, посредством которого стоимость продукции этанола из содержащих целлюлозную биомассу материалов можно снизить с использованием новой схемы переработки. В частности, настоящее изобретение относится к различным способам повышения продукции этанола в генетически модифицированном микроорганизме.
В некоторых других вариантах осуществления, настоящее изобретение относится к генетически модифицированным термофильным или мезофильным микроорганизмам, где ген или конкретная полинуклеотидная последовательность частично, по существу, или полностью удалена, подавлена, инактивирована или супрессирована, причем ген или полинуклеотидная последовательность кодирует фермент, который придает микроорганизму способность продуцировать органические кислоты в качестве продуктов ферментации, тем самым повышая способность микроорганизма продуцировать этанол в качестве основного продукта ферментации. Кроме того, посредством нового комбинирования стадий переработки, обычно известных как объединенная биотехнология, аспекты по настоящему изобретению обеспечивают более эффективную продукцию этанола из содержащего целлюлозную биомассу сырья. Включение генетически модифицированных термофильных или мезофильных микроорганизмов в переработку указанных материалов позволяет проведение стадий ферментации при более высоких температурах, улучшая экономику процесса. Например, кинетика реакции, как правило, пропорциональна температуре, так что более высокие температуры, как правило, ассоциированы с повышением общего уровня продукции. Кроме того, более высокая температура способствует удалению летучих продуктов из среды и снижает необходимость в охлаждении после предварительной обработки.
В определенных вариантах осуществления, настоящее изобретение относится к генетически модифицированным или рекомбинантным термофильным или мезофильным микроорганизмам со способностью к повышенной продукции ферментов, которые придают способность продуцировать этанол в качестве продукта ферментации, причем наличие этого фермента(ов) модифицирует процесс метаболизма материалов лигноцеллюлозной биомассы для продукции этанола в качестве основного продукта ферментации. В одном аспекте изобретения, один или несколько ненативных генов встроены в генетически модифицированный термофильный или мезофильный микроорганизм, где указанный ненативный ген кодирует фермент, вовлеченный в метаболическую продукцию этанола, например, такой фермент может придавать способность метаболизировать пентозный сахар и/или гексозный сахар. Например, в одном варианте осуществления, фермент может быть вовлечен в каскад D-ксилозы или L-арабинозы, тем самым позволяя микроорганизму метаболизировать пентозный сахар, т.е. D-ксилозу или L-арабинозу. При введении (например, встраивании или добавлении) ненативного гена, который кодирует фермент, вовлеченный в метаболизм или утилизацию D-ксилозы или L-арабинозы, микроорганизм обладает способностью к повышенной продукции этанола относительно нативного организма.
Также настоящее изобретение относится к новым композициям, которые можно вводить в микроорганизмы по изобретению. В одном варианте осуществления, выделенная молекула нуклеиновой кислоты по изобретению содержит молекулу нуклеиновой кислоты, которая комплементарна нуклеотидной последовательности, представленной в любой из SEQ ID NO:1-76. В другом варианте осуществления, выделенная молекула нуклеиновой кислоты по изобретению содержит молекулу нуклеиновой кислоты, которая комплементарна нуклеотидной последовательности, представленной в любой из SEQ ID NO:1-76, или части любой из этих нуклеотидных последовательностей. Молекула нуклеиновой кислоты, которая комплементарна нуклеотидной последовательности, представленной в любой из SEQ ID NO:1-76, или ее кодирующей области, представляет собой молекулу, которая достаточно комплементарна нуклеотидной последовательности, представленной в любой из SEQ ID NO:1-76, или ее кодирующей области, так что она может гибридизоваться с нуклеотидной последовательностью, представленной в любой из SEQ ID NO:1-76, или ее кодирующей областью, тем самым образуя стабильный дуплекс.
В другом предпочтительном варианте осуществления, выделенная молекула нуклеиновой кислоты по настоящему изобретению содержит нуклеотидную последовательность, которая по меньшей мере приблизительно на 50%, 54%, 55%, 60%, 62%, 65%, 70%, 75%, 78%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологична нуклеотидным последовательностям (например, полноразмерной нуклеотидной последовательности), представленным в любой из SEQ ID NO:1-76, или части любой из этих нуклеотидных последовательностей.
Более того, молекулы нуклеиновых кислот по изобретению могут содержать только часть последовательности нуклеиновой кислоты любой из SEQ ID NO:1-76, или ее кодирующей части; например, молекула нуклеиновой кислоты может представлять собой фрагмент, который можно использовать в качестве зонда или праймера или фрагмента, кодирующего биологически активную часть белка. В другом варианте осуществления, молекулы нуклеиновых кислот могут содержать по меньшей мере приблизительно 12 или 15, предпочтительно приблизительно 20 или 25, более предпочтительно приблизительно 30, 35, 40, 45, 50, 55, 60, 65 или 75 последовательно расположенных нуклеотидов любой из SEQ ID NO:1-76.
Определения
Термин "гетерологичный полинуклеотидный сегмент" включает полинуклеотидный сегмент, который кодирует один или несколько полипептидов или частей или фрагментов полипептидов. Гетерологичный полинуклеотидный сегмент может быть из любого источника, например, эукариот, прокариот, вирусов или фрагментов синтетических полинуклеотидов.
Термины "промотор" или "заменяющий промотор" включает полинуклеотидный сегмент, который может транскрипционно контролировать представляющий интерес ген, транскрипцию которого он не контролирует в природе. В определенных вариантах осуществления, транскрипционный контроль заменяющего промотора приводит к повышению экспрессии представляющего интерес гена. В определенных вариантах осуществления, заменяющий промотор помещен с 5'-стороны от представляющего интерес гена. Заменяющий промотор можно использовать для замены природного промотора, или его можно использовать в дополнение к природному промотору. Заменяющий промотор может быть эндогенным с точки зрения клетки-хозяина, в которой его используют, или он может представлять собой гетерологичную полинуклеотидную последовательность, введенную в клетку-хозяина, например, экзогенную с точки зрения клетки-хозяина, в которой его используют.
Термины "ген(ы)" или "полинуклеотидный сегмент" или "полинуклеотидная последовательность(и)" включают молекулы нуклеиновых кислот, например, полинуклеотиды, которые включают открытую рамку считывания, кодирующую полипептид, и могут дополнительно включать некодирующие регуляторные последовательности и интроны. Кроме того, термины включают один или несколько генов, которые картированы на функциональном локусе. Кроме того, термины включают конкретный ген для выбранной цели. Ген может быть эндогенным для клетки-хозяина или он может быть рекомбинантно введен в клетку-хозяина, например, в качестве плазмиды, поддерживающейся эписомно, или плазмиды (или ее фрагмента), которая стабильно интегрирована в геном. В дополнение к форме плазмиды, ген может, например, иметь форму линейной ДНК. В определенных вариантах осуществления, ген полинуклеотидного сегмента вовлечен по меньшей мере в одну стадию биопреобразования углевода в этанол. Таким образом, термин включает любой ген, кодирующий полипептид, такой как ферменты ацетаткиназа (ACK), фосфотрансацетилаза (PTA), и/или лактатдегидрогеназа (LDH), ферменты каскада D-ксилозы, такие как ксилозоизомераза и ксилулокиназа, ферменты каскада L-арабинозы, такие как L-арабинозоизомераза и L-рибулозо-5-фосфат 4-эпимераза. Также термин ген охватывает все копии конкретного гена, например, все последовательности ДНК в клетке, кодирующие конкретный продукт гена.
Термин "транскрипционный контроль" включает способность модулировать экспрессию гена на уровне транскрипции. В определенных вариантах осуществления, транскрипцию, и, таким образом, экспрессию гена, модулируют заменой или добавлением замещающего промотора вблизи 5'-конца кодирующей области представляющего интерес гена, что, тем самым, приводит к измененной экспрессии гена. В определенных вариантах осуществления, транскрипционный контроль одного или нескольких генов осуществляют способами инженерии, чтобы получить оптимальную экспрессию таких генов, например, в требуемом соотношении. Также термин включает индуцируемый транскрипционный контроль, как известно в данной области.
Термин "экспрессия" включает экспрессию гена по меньшей мере на уровне продукции мРНК.
Термин "продукт экспрессии" включает конечный продукт, например полипептид, экспрессируемого гена.
Термин "повышенная экспрессия" включает изменение экспрессии гена по меньшей мере на уровне повышенной продукции мРНК и, предпочтительно, на уровне экспрессии полипептида. Термин "повышенная продукция" включает повышение количества экспрессируемого полипептида, уровня ферментативной активности полипептида, или их сочетания.
Термины "активность", "виды активности", "ферментативная активность" и "виды ферментативной активности" используют взаимозаменяемо, и они включают любую функциональную активность, обычно свойственную выбранному полипептиду, продуцированному в благоприятных условиях. Как правило, активность выбранного полипептида охватывает общую ферментативную активность, ассоциированную с продуцированным полипептидом. Полипептид, продуцируемый клеткой-хозяином и обладающий ферментативной активностью, может быть расположен во внутриклеточном пространстве клетки, он может быть ассоциированным с клеткой, секретируемым во внеклеточную среду, или их сочетание. Способы определения общей активности по сравнению с активностью при секреции описаны в настоящем документе, и они известны в данной области.
Термин "ксиланолитическая активность" включает способность гидролизовывать гликозидные связи в олигопентозах и полипентозах.
Термин "целлюлолитическая активность" включает способность гидролизовывать гликозидные связи в олигогексозах и полигексозах. Также целлюлолитическая активность включает способность к деполимеризации и устранению ветвления целлюлозы и гемицеллюлозы.
Как используют в настоящем документе, термин "лактатдегидрогеназа" или "LDH" включает фермент, способный превращать пируват в лактат. Понятно, что LDH также может катализировать окисление гидроксибутирата.
Как используют в настоящем документе термин "алкогольдегидрогеназа" или "ADH" включает фермент, способный превращать ацетальдегид в спирт, преимущественно, этанол.
Термин "активность пируватдекарбоксилазы" включает способность полипептида ферментативно превращать пируват в ацетальдегид (например, "пируватдекарбоксилаза" или "PDC"). Как правило, активность выбранного полипептида охватывает общую ферментативную активность, ассоциированную с продуцированным полипептидом, включающую, например, лучшую аффинность к субстрату фермента, термостабильность, стабильность при различных pH или сочетание этих качеств.
Термин "образующий этанол" включает способность микроорганизма продуцировать этанол из углевода в качестве продукта ферментации. Термин включает, но не ограничивается ими, встречающиеся в природе образующие этанол организмы, образующие этанол организмы со встречающимися в природе или индуцированными мутациями, и образующие этанол организмы, которые являются генетически модифицированными.
Термины "ферментирующий" и "ферментация" включают ферментативный процесс (например, клеточный или бесклеточный, например, в лизате или очищенной смеси полипептидов), посредством которого образуется этанол из углевода, в частности, в качестве продукта ферментации.
Термин "секретируемый" включает движение полипептидов в периплазматическое пространство или внеклеточную среду. Термин "повышенная секреция" включает случаи, при которых данный полипептид секретируется на повышенном уровне (т.е., в избытке относительно встречающегося в природе уровня секреции). В определенных вариантах осуществления, термин "с повышенной секрецией" относится к повышению секреции данного полипептида, которая по меньшей мере приблизительно на 10% или по меньшей мере приблизительно 100%, 200%, 300%, 400%, 500%, 600%, 700%, 800%, 900%, 1000% или более превышает встречающийся в природе уровень секреции.
Термин "секреторный полипептид" включает любой полипептид(ы), отдельно или в сочетании с другими полипептидами, который облегчает транспорт другого полипептида из внутриклеточного пространства клетки во внеклеточную среду. В определенных вариантах осуществления, секреторный полипептид(ы) охватывает все необходимые секреторные полипептиды, достаточные для придания секреторной активности грамотрицательной или грамположительной клетке-хозяину. Как правило, секреторные белки кодируются в единичной области или локусе, который может быть выделен из одной клетки-хозяина и перенесен в другую клетку-хозяина с использованием генетической инженерии. В определенных вариантах осуществления, источником секреторного полипептида(ов) является любая бактериальная клетка, имеющая секреторную активность. В определенных вариантах осуществления, секреторный полипептид(ы) образован из клетки-хозяина, имеющей секреторную активность типа II. В определенных вариантах осуществления, клетка-хозяин представляет собой термофильную бактериальную клетку.
Термин "образованный из" включает выделение (целиком или частично) полинуклеотидного сегмента из указанного источника или очистку полипептида из указанного источника. Подразумевают, что термин включает, например, прямое клонирование, амплификацию посредством ПЦР или искусственный синтез с последовательности, ассоциированной с указанным источником полинуклеотида, или синтез на ее основе.
Под "термофильным" подразумевают организм, который растет при температуре приблизительно 45°C или более.
Под "мезофильным" подразумевают организм, который растет при температуре приблизительно 20-45°C.
Термин "органическая кислота" известен в данной области. Термин "молочная кислота" относится к органической кислоте, 2-гидроксипропионовой кислоте, либо в форме свободной кислоты, либо в форме соли. Форму соли молочной кислоты называют "лактатом" независимо от нейтрализующего агента, т.е. карбоната кальция или гидроксида аммония. Термин "уксусная кислота" относится к органической кислоте, метанкарбоновой кислоте, также известной как этановая кислота, либо в форме свободной кислоты, либо в форме соли. Форму соли уксусной кислоты называют "ацетатом".
Определенные варианты осуществления настоящего изобретения относятся к "введению", (например, добавлению, встраиванию, включению или внесению) определенных генов или конкретных полинуклеотидных последовательностей в термофильные или мезофильные микроорганизмы, причем следует понимать, что введение генов или конкретных полинуклеотидных последовательностей включает "генетическую модификацию(и)" или "трансформацию(и)", так что следует понимать, что полученные штаммы указанных термофильных или мезофильных микроорганизмов являются "генетически модифицированными" или "трансформированными". В определенных вариантах осуществления, штаммы могут иметь бактериальное, грибное или дрожжевое происхождение.
Определенные варианты осуществления настоящего изобретения относятся к "инактивации" или "делеции" определенных генов или конкретных полинуклеотидных последовательностей в термофильных или мезофильных микроорганизмах, причем следует понимать, что "инактивация" или "делеция" генов или конкретных полинуклеотидных последовательностей включает "генетическую модификацию(и)" или "трансформацию(и)", так что следует понимать, что такие полученные штаммы указанных термофильных или мезофильных микроорганизмов являются "генетически модифицированными" или "трансформированными". В определенных вариантах осуществления, штаммы могут иметь бактериальное, грибное или дрожжевое происхождение.
Термин "организм CBP" включает микроорганизмы по изобретению, например, микроорганизмы, которые имеют свойства, пригодные для CBP.
В одном аспекте изобретения, гены или конкретные полинуклеотидные последовательности встраивают для активации активности, которую они кодируют, такой как экспрессия фермента. В определенных вариантах осуществления, в мезофильный или термофильный организм можно добавлять гены, кодирующие ферменты для метаболической продукции этанола, например, ферменты, которые метаболизируют пентозные и/или гексозные сахара. В определенных вариантах осуществления изобретения, фермент может придавать способность метаболизировать пентозный сахар, и он может быть вовлечен, например, в каскад D-ксилозы и/или L-арабинозы.
В одном аспекте изобретения, гены или конкретные полинуклеотидные последовательности частично, по существу, или полностью удалены, подавлены, инактивированы или супрессированы для инактивации активности, которую они кодируют, такой как экспрессия фермента. Делеции обеспечивают максимальную стабильность, поскольку отсутствует возможность для обратной мутации и восстановления функции. Альтернативно гены могут быть частично, по существу, или полностью удалены, подавлены, инактивированы или супрессированы встраиванием последовательностей нуклеиновых кислот, которые нарушают функцию и/или экспрессию гена (например, трансдукция P1 или другие способы известны в данной области). Термины "устранять", "устранение" и "нокаут" используют взаимозаменяемо с термином "делеция". В определенных вариантах осуществления, штаммы представляющих интерес термофильных или мезофильных микроорганизмов можно создавать способами инженерии путем сайт-направленной гомологичной рекомбинации для нокаута продукции органических кислот. В других вариантах осуществления, можно использовать RNAi или антисмысловую ДНК (asDNA) для частичного, существенного или полного подавления, инактивации или супрессии конкретного представляющего интерес гена.
В определенных вариантах осуществления, гены, предназначенные для делеции или инактивации, как описано в настоящем документе, могут быть эндогенными для нативного штамма микроорганизма, и, таким образом, следует понимать, что их обозначают "нативным геном(ами)" или "эндогенным геном(ами)". Организм находится в "нативном состоянии", если он не получен способами генетической инженерии или не подвергнут иным манипуляциям человеком так, чтобы происходило намеренное изменение генетической и/или фенотипической конституции организма. Например, организмы дикого типа можно считать находящимися в нативном состоянии. В других вариантах осуществления, ген(ы), предназначенный для делеции или инактивации, может быть ненативным для организма.
Биомасса
Термины "лигноцеллюлозный материал", "лигноцеллюлозный субстрат" и "целлюлозная биомасса" означают любой тип биомассы, содержащей целлюлозу, гемицеллюлозу, лигнин или их сочетания, такой как, но не ограничиваясь ими, древесная биомасса, кормовые травы, травяные культуры, используемые в качестве источника энергии, биомасса недревесных растений, сельскохозяйственные отходы и/или сельскохозяйственные остатки, остатки лесничества и/или отходы лесничества, пульпа, образованная при продукции бумаги, и/или пульпа бумажных отходов, пульпа обработки сточных вод, муниципальные твердые отходы, кукурузное волокно из заводов по влажному и сухому производству этанола из кукурузы, и остатки от переработки сахара.
В неограничивающем примере, лигноцеллюлозный материал может включать, но не ограничиваться ими, древесную биомассу, такую как утилизированное волокно древесной пульпы, древесные опилки, твердая древесина, мягкая древесина и их сочетания; травы, такой как просо, спартина изящная, райграс многолетний пастбищный, двукисточник тростниковидный, мискантус или их сочетания; остатки переработки сахара, такие как, но не ограничиваясь этим, выжимка сахарного тростника; сельскохозяйственные отходы, такие как, но не ограничиваясь этим, солома риса, рисовая шелуха, солома ячменя, сердцевины кукурузного початка, солома хлебных злаков, солома пшеницы, солома канолы, солома овса, овсяная шелуха и кукурузное волокно; солому для скота, такую как, но не ограничиваясь ими, соевая солома, кукурузная солома; и древесные отходы, такие как, но не ограничиваясь этим, утилизированное волокно древесной пульпы, древесные опилки, твердая древесина (например, тополь, дуб, клен, береза, ива), мягкая древесина и любое их сочетание. Лигноцеллюлозный материал может содержать один вид волокна; альтернативно лигноцеллюлозный материал может содержать смесь волокон, источником которых являются различные лигноцеллюлозные материалы. Особенно преимущественными лигноцеллюлозными материалами являются сельскохозяйственные отходы, такие как солома хлебных злаков, включая солому пшеницы, солому ячменя, солому канолы и солому дуба; кукурузное волокно; солома для скота, такая как кукурузная солома и соевая солома; травы, такие как просо, двукисточник тростниковидный, спартина изящная и мискантус; или их сочетания.
Бумажная пульпа также является пригодным сырьем для продукции этанола. Бумажная пульпа представляет собой твердый остаток, получаемый при образовании пульпы и изготовлении бумаги, и, как правило, она удаляется из сбросной отработанной воды в первичном отстойнике. При стоимости уничтожения $30/тонна влажного материала, стоимость удаления осадка равна $5/тонна бумаги, которую изготавливают для продажи. Стоимость удаления влажного осадка является существенным стимулом для преобразования материала для других применений, таких как преобразование в этанол. Процесс, обеспечиваемый настоящим изобретением, широко применим. Более того, продукты осахаривания и/или ферментации можно использовать для продукции этанола или более высокоценных дополнительных химических реактивов, таких как органические кислоты, ароматические соединения, сложные эфиры, ацетон и промежуточные соединения полимеров.
Пируватформиатлиаза (PFL)
Пируватформиатлиаза (PFL) представляет собой важный фермент (встречающийся в Escherichia coli и других организмах), который помогает регулировать анаэробный метаболизм глюкозы. С использованием химии радикалов, он катализирует обратимое преобразование пирувата и кофермента-A в формиат и ацетил-CoA, предшественник этанола. Пируватформиатлиаза представляет собой гомодимер, состоящий из субъединиц размером 759 остатков массой 85 кДа. Она имеет мотив бета/альфа-бочонка из 10 цепей, в который встроен бета-палец, который содержит основные каталитические остатки. Активный центр фермента, определенный рентгеновской кристаллографией, содержит три необходимых аминокислоты, которые осуществляют катализ (Gly734, Cys418 и Cys419), три основных остатка, которые удерживают субстратный пируват вблизи (Arg435, Arg176 и Ala272) и два фланкирующих гидрофобных остатка (Trp333 и Phe432).
Исследования выявили структурные сходства между активным центром пируватформиатлиазы и активным центром ферментов рибонуклеотидредуктаз (RNR) класса I и класса III. Роли 3 каталитических остатков являются следующими: Gly734 (глицильный радикал) - переносит радикал на и с Cys418 через Cys419; Cys418 (тиильный радикал) - осуществляет химическую реакцию ацилирования на атоме углерода карбонила пирувата; Cys419 (тиильный радикал) - осуществляет перенос атомов водорода.
Предложенный механизм для пируватформиатлиазы начинается с переноса радикала с Gly734 на Cys418, через Cys419. Тиильный радикал Cys418 присоединяется ковалентно к C2 (второй атом углерода) пирувата с образованием промежуточного соединения ацетил-фермент (которое теперь содержит радикал). Промежуточное соединение ацетил-фермент высвобождает формильный радикал, который подвергается переносу атома водорода с Cys419. Это приводит к образованию формиата и радикала Cys419. Кофермент-A подвергается переносу атома водорода на радикал Cys419 с образованием радикала кофермента-A. Затем радикал кофермента-A присоединяет ацетильную группу с Cys418 с образованием ацетил-CoA, оставляя радикал Cys418. Затем пируватформиатлиаза может подвергаться переносу радикала для возращения радикала на Gly734. Каждая из указанных выше стадий также является обратимой.
Два дополнительных фермента регулируют состояния "включения" и "выключения" пируватформиатлиазы для регуляции анаэробного метаболизма глюкозы: PFL-активаза (AE) и PFL-дезактиваза (DA). Активированная пируватформиатлиаза позволяет образование ацетил-CoA, низкомолекулярного соединения, важного для выработки энергии, когда пируват доступен. Дезактивированная пируватформиатлиаза, даже если субстрат присутствует, не катализирует реакцию. PFL-активаза является частью суперсемейства радикалов SAM (S-аденозилметионин).
Фермент пируватформиатлиаза "включается" преобразованием Gly734 (G-H) в радикал Gly734 (G*) через 5'-дезоксиаденозильный радикал (радикал SAM). PFL-дезактиваза (DA) "выключает" пируватформиатлиазу тушением радикала Gly734. Более этого, пируватформиатлиаза является чувствительной к молекулярному кислороду (O2), наличие которого выключает фермент.
Метаболизм ксилозы
Ксилоза представляет собой моносахарид из пяти углеродов, который может метаболизироваться до пригодных продуктов различными организмами. Существуют два основных каскада метаболизма ксилозы, каждый из которых уникален собственными ферментами, которые в нем используются. Один каскад называется каскадом "ксилозоредуктазы-ксилитдегидрогеназы" или каскадом XR-XDH. Ксилозоредуктаза (XR) и ксилитдегидрогеназа (XDH) представляют собой два основных фермента, используемых в этом способе деградации ксилозы. XR, кодируемый геном XYL1, отвечает за восстановление ксилозы до ксилита и ему способствуют кофакторы NADH или NADPH. Затем ксилит окисляется до ксилулозы под действием XDH, которая экспрессируется с помощью гена XYL2, и это окисление происходит исключительно под действием кофактора NAD+. Благодаря различным кофакторам, требуемым для этого каскада и степени, с которой они доступны для применения, дисбаланс может приводить к сверхпродукции побочного продукта ксилита и к эффективной продукции требуемого этанола. В лаборатории в попытках оптимизировать эффективность каскада метаболизма ксилозы тестировали варьирующие уровни экспрессии ферментов XR и XDH.
Другой каскад для метаболизма ксилозы называется каскадом "ксилозоизомеразы" (XI). Фермент XI отвечает за прямое преобразование ксилозы в ксилулозу, и оно не протекает через промежуточное соединение ксилит. В обоих каскадах образуется ксилулоза, хотя используемые ферменты отличаются. После образования ксилулозы как каскад XR-XDH, так и каскад XI, протекает через фермент ксилулокиназу (XK), кодируемый на гене XKS1, для последующей модификации ксилулозы до ксилулозо-5-P, где она затем входит в каскад фосфата пентозы для последующего катаболизма.
Исследования протекания каскада фосфатов пентоз в ходе метаболизма ксилозы показали, что ограничение скорости этой стадии может быть полезным для эффективности ферментации до этанола. Модификации этого протекания, которые могут повысить продукцию этанола, включают a) снижение активности фосфоглюкозоизомеразы, b) делецию гена GND1, и c) делецию гена ZWF1 (Jeppsson et al., 2002). Поскольку каскад фосфатов пентоз приводит к образованию дополнительного NADPH в ходе метаболизма, ограничение этой стадии поможет скорректировать уже очевидный дисбаланс между кофакторами NAD(P)H и NAD+ и снизить образование побочного продукта ксилита. В другом эксперименте, где сравнивали два каскада метаболизма ксилозы, показали, что каскад XI обладает наилучшей способностью метаболизировать ксилозу с образованием наибольшего выхода этанола, хотя каскад XR-XDH достигает значительно более высокой скорости образования этанола (Karhumaa et al., 2007).
Микроорганизмы
Настоящее изобретение включает множество стратегий для разработки микроорганизмов с сочетанием свойств утилизации субстрата и образования продуктов, требуемых для CBP. "Нативная целлюлолитическая стратегия" вовлекает изменение способами инженерии встречающихся в природе целлюлолитических микроорганизмов для повышения связанных с продуктом свойств, таких как выход и титр. "Рекомбинантная целлюлолитическая стратегия" вовлекает изменение способами инженерии нативных нецеллюлолитических организмов, которые обладают высокими выходами и титрами продукта, для экспрессии гетерологичной системы целлюлазы, которая обеспечивает утилизацию целлюлозы или утилизацию гемицеллюлозы, или утилизацию обеих из них.
Целлюлолитические микроорганизмы
Несколько микроорганизмов, описанных в литературе в качестве целлюлолитических или имеющих целлюлолитическую активность охарактеризованы различными способами, включая их способность расти на микрокристаллической целлюлозе, а также на различных других сахарах. Кроме того, организмы можно охарактеризовать другими способами, включая, но не ограничиваясь ими, их способность к деполимеризации и устранению ветвления целлюлозы и гемицеллюлозы. Clostridium thermocellum (штамм DSMZ 1237) использовали в качестве исходной точки для представляющих интерес организмов. Как используют в настоящем документе, C. thermocellum может включать различные штаммы, включая, но не ограничиваясь ими, DSMZ 1237, DSMZ 1313, DSMZ 2360, DSMZ 4150, DSMZ 7072 и ATCC 31924. В определенных вариантах осуществления изобретения, штамм C. thermocellum может включать, но не ограничиваться ими, DSMZ 1313 или DSMZ 1237. В другом варианте осуществления, особенно пригодные представляющие интерес организмы для применения в настоящем изобретении включают целлюлолитические микроорганизмы с более чем 70% гомологией рДНК 16S с C. thermocellum. Выравнивание Clostridium thermocellum, Clostridium cellulolyticum, Thermoanaerobacterium saccharolyticum, C stercorarium, C stercorarium II, Caldiscellulosiruptor kristjanssonii, C phytofermentans указывает на 73-85% гомологию на уровне гена рДНК 16S (фигура 6).
Было определено, что Clostridium straminisolvens растет практически также как и C. thermocellum на Avicel®. В таблице 1 обобщенно представлены некоторые высоко целлюлолитические организмы.
No.
45-60
6,0-8,5
Организмы выращивали на 20 г/л целлобиозы или 20 г/л Avicel®. C thermocellum выращивали при 60°С и C. straminisolvens выращивали при 55°С. Оба организма предварительно культивировали из исходной культуры, замороженной при -80°С (исходной DSMZ) на M122 с 50 мМ MOPS. В ходе от средней до поздней логарифмической фазы роста предварительные культуры использовали для инокуляции порционных культур в 100-мл бутыли с сывороткой до рабочего объема 50 мл. Жидкие образцы удаляли периодически для анализа ВЭЖХ побочных продуктов метаболизма и потребления сахара. OD600 определяли в каждый из этих моментов времени. На фигурах 12A и 12B представлено образование продукта и OD600 для C. straminisolvens на целлобиозе и Avicel®, соответственно. Существенное количество целлобиозы (37%) было употреблено за 48 часов до падения OD и прекращения образования продукта. На фигурах 13A и 13B представлено образование продукта и OD600 для C. thermocellum на целлобиозе и Avicel®, соответственно. C. thermocellum употребили ~60% целлобиозы в течение 48 часов, и в этот момент времени образование продукта прекратилось. Ингибирование вследствие образования органических кислот вызывало неполную утилизацию субстратов.
Определенные микроорганизмы, включая, например, C. thermocellum и C. straminisolvens, не могут метаболизировать пентозные сахара, такие как D-ксилоза или L-арабиноза, однако они способны метаболизировать гексозные сахара. Как D-ксилоза, так и L-арабиноза, являются изобилующими сахарами в биомассе, причем D-ксилоза составляет приблизительно 16-20% в мягкой и твердой древесине, и L-арабиноза составляет приблизительно 25% в кукурузном волокне. Таким образом, одной из задач изобретения является предоставление генетически модифицированных целлюлолитических микроорганизмов со способностью метаболизировать пентозные сахара, такие как D-ксилоза и L-арабиноза, тем самым повышая их применение в качестве биокатализаторов для ферментации в промышленности по переработке биомассы в этанол.
Целлюлолитические и ксиланолитические микроорганизмы
Несколько микроорганизмов, определенных из литературы в качестве как целлюлолитических, так и ксиланолитических, охарактеризованы по их способности расти на микрокристаллической целлюлозе и ксилана древесины березы, а также на множестве других сахаров. Clostridium thermocellum использовали в качестве исходной точки для представляющего интерес организма. Среди штаммов, выбранных для охарактеризации, Clostridium cellulolyticum, Clostridium stercorarium subs. leptospartum, Caldicellulosiruptor kristjanssonii и Clostridium phytofermentans росли слабо на Avicel® и хорошо на ксилане древесины березы. В таблице 2 обобщенно представлены некоторые из нативных целлюлолитических и ксиланолитических организмов.
No.
5812
9219
700394
(положительный тип по Грамму)
Организмы выращивали на 20 г/л целлобиозы, 20 г/л Avicel® или 5 г/л ксилана древесины березы. C. cellulolyticum выращивали при 37°С, C. stercorarium subs. leptospartum выращивали при 60°С, Caldicellulosiruptor kristjanssonii выращивали при 75°С и Clostridium phytofermentans выращивали при 37°С. Все из них предварительно культивировали из исходной культуры, замороженной при -80°С в M122c, дополненной 50 мМ MOPS. В ходе от средней до поздней логарифмической фазы роста предварительные культуры использовали для инокуляции порционных культур в 100-мл бутыли с сывороткой до рабочего объема 50 мл. Жидкие образцы удаляли периодически для анализа ВЭЖХ побочных продуктов метаболизма и потребления сахара. OD600 определяли в каждый из этих моментов времени. На фигурах 14A-17B представлено образование продукта и OD600 для роста на целлобиозе и Avicel®.
В отдельном эксперименте, организмы выращивали на 2,5 г/л отдельных сахаров, включающих целлобиозу, глюкозу, ксилозу, галактозу, арабинозу, маннозу и лактозу, а также 5 г/л Avicel® и ксилана древесины березы. На фигуре 18 представлено сравнение образования продукта на целлобиозе и ксилане древесины березы через двое суток. В таблице 3 обобщенно представлено, каким образом бактериальные штаммы можно классифицировать на основе их утилизации субстрата.
Трансгенное преобразование микроорганизмов
Настоящее изобретение относится к композициям и способам для трансгенного преобразования определенных микроорганизмов. Когда гены, кодирующие ферменты, вовлеченные в метаболический каскад этанола, включая, например, D-ксилозу и/или L-арабинозу, вводят в бактериальный штамм, который лишен одного или нескольких из этих генов, например, C. thermocellum или C. straminisolvens, можно выбирать трансформированные штаммы для роста на D-ксилозе или роста на L-арабинозе. Ожидается, что гены из других видов клостридий должны экспрессироваться в C. thermocellum и C. straminisolvens. Доноры гена-мишени могут включать микроорганизмы, которые придают способность метаболизировать гексозные и пентозные сахара, например, C. cellulolyticum, Caldicellulosiruptor kristjanssonii, C. phytofermentans, C. stercorarium и Thermoanaerobacterium saccharolyticum.
Геномы T. saccharolyticum, C. cellulolyticum и C. phytofermentans являются доступными. Таким образом, настоящее изобретение относится к последовательностям, которые соответствуют ксилозоизомеразе и ксилулокиназе в каждом из трех хозяев, указанных выше. В частности, последовательности, соответствующие ксилозоизомеразе (SEQ ID NO:6), ксилулокиназе (SEQ ID NO:7), L-арабинозоизомеразе (SEQ ID NO:8) и L-рибулозо-5-фосфат 4-эпимеразе (SEQ ID NO:9) из T. saccharolyticum указаны в настоящем документе. Аналогично, в настоящем документе представлены последовательности, соответствующие ксилозоизомеразе (SEQ ID NO:10), ксилулокиназе (SEQ ID NO:11), L-арабинозоизомеразе (SEQ ID NO:12) и L-рибулозо-5-фосфат 4-эпимеразе (SEQ ID NO:13) из C. cellulolyticum. C. phytofermentans используют каскад D-ксилозы и не утилизируют L-арабинозу. Таким образом, последовательности, соответствующие ксилозоизомеразе (SEQ ID NO:14) и ксилулокиназе (SEQ ID NO:15) из C. phytofermentans, указаны в настоящем документе.
C. kristjanssonii метаболизирует ксилозу. В связи с этим, гены ксилозоизомеразы (SEQ ID NO:71) и ксилулокиназы (SEQ ID NO:70) C. kristjanssonii были отсеквенированы и они представлены в настоящем документе. Было показано, что C. straminisolvens не растет на ксилозе, однако они содержат гены ксилозоизомеразы (SEQ ID NO:73) и ксилулокиназы (SEQ ID NO:72), которые могут быть функциональными после адаптации на ксилозе в качестве источника углерода.
В C. thermocellum и C. straminisolvens может отсутствовать один или несколько известных генов или ферментов каскада от D-ксилозы до этанола и/или каскада утилизации L-арабинозы. На фигурах 2 и 3 представлены два ключевых фермента, которые отсутствуют в каждом из этих каскадов в C. thermocellum. C. straminisolvens имеют ксилозоизомеразу и ксилулокиназу, однако функциональность этих ферментов не известна. Геномное секвенирование не выявило копию как L-арабинозоизомеразы, так и L-рибулозо-5-фосфат 4-эпимеразы в C. straminisolvens.
C. thermocellum и C. straminisolvens не способны метаболизировать ксилулозу, что может отражать отсутствие (C. thermocellum) или недостаток активности и/или экспрессии (C. straminsolvens) генов ксилозоизомеразы (обозначаемой на фигуре 2 как "XI" или 5.3.1.5), которая превращает D-ксилозу в D-ксилулозу, и ксилулокиназы (также обозначаемой на фигуре 2 как "XK" или 2.7.1.1), которая превращает D-ксилулозу в D-ксилулозо-5-фосфат. Более того, транспорт ксилозы может быть ограничением для C. straminsolvens. Это потенциальное ограничение может быть преодолено экспрессией генов транспорта сахаров из утилизирующих ксилозу организмов, таких как T. saccharolyticum и C. kristjanssonii.
C. thermocellum и C. straminisolvens также не способны метаболизировать L-арабинозу, что может отражать отсутствие генов L-арабинозоизомеразы (также обозначаемой на фигуре 3 как 5.3.1.4) и L-рибулозо-5-фосфат 4-эпимеразы (также обозначаемой на фигуре 3 как 5.1.3.4).
Четыре гена, описанных выше, например, ксилозоизомеразы, ксилулокиназы, L-арабинозоизомеразы и L-рибулозо-5-фосфат 4-эпимеразы, присутствуют в нескольких видах клостридий и видах Thermoanaerobacterium saccharolyticum, включая, но не ограничиваясь ими, Clostridium cellulolyticum (см. фигуру 4), Thermoanaerobacterium saccharolyticum, C. stercorarium, Caldiscellulosiruptor kristjanssonii и C. phytofermentans; эти штаммы хорошо утилизируют эти сахара. Понятно, что указанные выше бактериальные штаммы можно использовать в качестве доноров генов, описанных в настоящем документе.
C. phytofermentans экспрессируют гены двух каскадов ксилозы, описанных выше (ксилозоизомеразы и ксилулокиназы), однако у них снижена или отсутствует экспрессия генов каскада арабинозы, описанного выше (L-арабинозоизомеразы и L-рибулозо-5-фосфат 4-эпимеразы) (см. фигуру 5).
Таким образом, задачей изобретения является модификация некоторых из описанных выше бактериальных штаммов, так чтобы оптимизировать способность утилизировать сахара путем, например, введения генов для одного или нескольких ферментов, требуемых для продукции этанола из образованных из биомассы пентоз, например, для метаболизма D-ксилозы или L-арабинозы. Для экспрессии этих генов можно использовать промоторы, включая нативные промоторы C. thermocellum или C. straminisolvens, такие как промоторы триозофосфатизомеразы (TPI), GAPDH и LDH. Последовательности, которые соответствуют нативным промоторам C. thermocellum, включают (TPI) (SEQ ID NO:16), GAPDH (SEQ ID NO:17) и LDH (SEQ ID NO:18). После клонирования гена, можно проводить оптимизацию кодонов перед экспрессией. Затем можно использовать кассеты, содержащие, например, нативный промотор, ксиланолитический ген или арабинолитический ген, и селективный маркер для трансформации C. thermocellum или C. straminisolvens и селекции по росту на D-ксилозе и L-арабинозе на среде, содержащей D-ксилозу или L-арабинозу в качестве единственного источника углеводов.
Транспозоны
Для селекции по чужеродной ДНК, которая проникла в хозяина, предпочтительно, чтобы ДНК стабильно поддерживалась в представляющем интерес организме. В отношении плазмид, существуют два процесса, посредством которых это может произойти. Одним из них является процесс через применение репликативных плазмид. Эти плазмиды имеют ориджины репликации, которые распознаются хозяином и позволяют плазмидам реплицироваться в качестве стабильных, автономных, внехромосомных элементов, которые распределяются в ходе деления клеток в дочерние клетки. Второй процесс происходит через интеграцию плазмиды на хромосоме. Это происходит, главным образом, путем гомологичной рекомбинации и приводит к встраиванию целой плазмиды, или частей плазмиды, в хромосому хозяина. Таким образом, плазмида и селективный маркер(ы) реплицируются в качестве неотъемлемой части хромосомы и расходятся в дочерние клетки. Таким образом, для определения проникновения плазмидной ДНК в клетку в ходе трансформации с использованием селективных маркеров требуется применение репликативной плазмиды или способность рекомбинировать плазмиду на хромосому. Этим признакам не всегда можно удовлетворить, особенно при работе с организмами, которые не имеют подходящих генетических инструментов.
Одним путем избежания проблем, связанных с ассоциированными с плазмидой маркерами, является применение транспозонов. Транспозон представляет собой подвижный элемент ДНК, ограниченный мозаичными последовательностями ДНК, который распознается ферментативным аппаратом, называемым транспозазой. Функция транспозазы состоит во встраивании случайным образом ДНК транспозона в ДНК хозяина или в ДНК-мишень. Селективный маркер можно клонировать в транспозон стандартными способами генетической инженерии. Полученный фрагмент ДНК можно связывать с аппаратом транспозазы в реакции in vitro и комплекс можно вводить в клетки-мишени электропорацией. Стабильное встраивание маркера на хромосому требует только функционирования аппарата транспозазы и снижает необходимость в гомологичной рекомбинации или репликативных плазмидах.
Случайный характер встраивания транспозонов имеет дополнительное преимущество действия в качестве формы мутагенеза. Можно создавать библиотеки, которые содержат объединенные мутанты транспозонов. Эти библиотеки можно использовать для скрининга или селекции в целях получения мутантов с требуемыми фенотипами. Например, библиотеку транспозонов организма CBP можно подвергать скринингу в отношении способности продуцировать большее количество этанола или меньшее количество молочной кислоты и/или меньшее количество ацетата.
Нативная целлюлолитическая стратегия
Встречающиеся в природе целлюлолитические микроорганизмы являются исходными точками для разработки организма CBP посредством нативной стратегии. Особый интерес представляют анаэробы и факультативные анаэробы. Первичной задачей является обеспечение способами инженерии выходов продукта и титров этанола, удовлетворяющих требованием производственного процесса. Метаболическая инженерия ферментаций смешанных кислот в отношении этих задач была успешной в случае мезофильных, нецеллюлолитических кишечных бактерий. Последние разработки пригодных способов переноса генов позволяют проведение этого типа работы на целлюлолитических бактериях.
Рекомбинантная целлюлолитическая стратегия
Нецеллюлолитические микроорганизмы с желательными свойствами образования продукта (например, высоким выходом и титром этанола) являются исходными точками для разработки организма CBP посредством рекомбинантной целлюлолитической стратегии. Главной задачей такой разработки является создание способами инженерии гетерологичной системы целлюлазы, которая обеспечивает рост и ферментацию на предварительно обработанной лигноцеллюлозе. Гетерологичную продукцию целлюлаз проводят главным образом в бактериальных хозяевах, продуцирующих этанол с высоким выходом (полученные способами инженерии штаммы E. coli, Klebsiella oxytoca и Zymomonas mobilis) и в дрожжах Saccharomyces cerevisiae.
Экспрессия целлюлазы в штаммах K. oxytoca приводила к повышенному выходу гидролиза - но не к росту без добавления целлюлазы - микрокристаллической целлюлозы, и анаэробному росту на аморфной целлюлозе. Хотя дюжины сахаролитических ферментов были функционально экспрессированы в S. cerevisiae, анаэробный рост на целлюлозе в результате такой экспрессии не был окончательно продемонстрирован.
Аспекты настоящего изобретения относятся к применению термофильных или мезофильных микроорганизмов в качестве хозяев для модификации посредством нативной целлюлолитической стратегии. Их потенциал в отношении применения в процессах биотехнологии является следствием их способности расти при относительно высоких температурах с сопутствующими высокими скоростями метаболизма, продукцией физически и химически стабильных ферментов, и повышенными выходами конечных продуктов. Основные группы термофильных бактерий включают эубактерии и архебактерии. Термофильные эубактерии включают: фототрофные бактерии, такие как цианобактерии, пурпурные бактерии и зеленые бактерии; грамположительные бактерии, такие как Bacillus, Clostridium, молочнокислые бактерии и Actinomyces; и другие эубактерии, такие как Thiobacillus, Spirochete, Desulfotomaculum, грамотрицательные аэробы, грамотрицательные анаэробы и Thermotoga. К архибактериям относят Methanogens, крайних термофилов (известный в данной области термин) и Thermoplasma. В определенных вариантах осуществления, настоящее изобретение относится к грамотрицательным органотрофным термофилам рода Thermus, грамположительным эубактериям, таким как род Clostridium, и которые также включают как палочки, так и кокки, роды в группе эубактерий, такие как Thermosipho и Thermotoga, род Archaebacteria, такие как Thermococcus, Thermoproteus (палочковидные), Thermofilum (палочковидные), Pyrodictium, Acidianus, Sulfolobus, Pyrobaculum, Pyrococcus, Thermodiscus, Staphylothermus, Desulfurococcus, Archaeoglobus и Methanopyrus. Некоторые примеры термофилов или мезофилов (включая бактерии, прокариотический микроорганизм и грибы), которые могут быть пригодны для настоящего изобретения, включают, но не ограничиваются ими: Clostridium thermosulfurogenes, Clostridium cellulolyticum, Clostridium thermocellum, Clostridium thermohydrosulfuricum, Clostridium thermoaceticum, Clostridium thermosaccharolyticum, Clostridium tartarivorum, Clostridium thermocellulaseum, Clostridium phytofermentans, Clostridium straminisolvens, Thermoanaerobacterium thermosaccarolyticum, Thermoanaerobacterium saccharolyticum, Thermobacteroides acetoethylicus, Thermoanaerobium brockii, Methanobacterium thermoautotrophicum, Anaerocellum thermophilium, Pyrodictium occultum, Thermoproteus neutrophilus, Thermofilum librum, Thermothrix thioparus, Desulfovibrio thermophilus, Thermoplasma acidophilum, Hydrogenomonas thermophilus, Thermomicrobium roseum, Thermus flavas, Thermus ruber, Pyrococcus furiosus, Thermus aquaticus, Thermus thermophilus, Chloroflexus aurantiacus, Thermococcus litoralis, Pyrodictium abyssi, Bacillus stearothermophilus, Cyanidium caldarium, Mastigocladus laminosus, Chlamydothrix calidissima, Chlamydothrix penicillata, Thiothrix carnea, Phormidium tenuissimum, Phormidium geysericola, Phormidium subterraneum, Phormidium bijahensi, Oscillatoria filiformis, Synechococcus lividus, Chloroflexus aurantiacus, Pyrodictium brockii, Тиоbacillus thiooxidans, Sulfolobus acidocaldarius, Тиоbacillus thermophilica, Bacillus stearothermophilus, Cercosulcifer hamathensis, Vahlkampfia reichi, Cyclidium citrullus, Dactylaria gallopava, Synechococcus lividus, Synechococcus elongatus, Synechococcus minervae, Synechocystis aquatilus, Aphanocapsa thermalis, Oscillatoria terebriformis, Oscillatoria amphibia, Oscillatoria germinata, Oscillatoria okenii, Phormidium laminosum, Phormidium parparasiens, Symploca thermalis, Bacillus acidocaldarias, Bacillus coagulans, Bacillus thermocatenalatus, Bacillus licheniformis, Bacillus pamilas, Bacillus macerans, Bacillus circulans, Bacillus laterosporus, Bacillus brevis, Bacillus subtilis, Bacillus sphaericus, Desulfotomaculum nigrificans, Streptococcus thermophilus, Lactobacillus thermophilus, Lactobacillus bulgaricus, Bifidobacterium thermophilum, Streptomyces fragmentosporus, Streptomyces thermonitrificans, Streptomyces thermovulgaris, Pseudonocardia thermophila, Thermoactinomyces vulgaris, Thermoactinomyces sacchari, Thermoactinomyces Candidas, Thermomonospora curvata, Thermomonospora viridis, Thermomonospora citrina, Microbispora thermodiastatica, Microbispora aerata, Microbispora bispora, Actinobifida dichotomica, Actinobifida chromogena, Micropolyspora caesia, Micropolyspora fiaeni, Micropolyspora cectivugida, Micropolyspora cabrobrunea, Micropolyspora thermovirida, Micropolyspora viridinigra, Methanobacterium thermoautothropicum, Caldicellulosiruptor acetigenus, Caldicellulosiruptor saccharolyticus, Caldicellulosiruptor kristjanssonii, Caldicellulosiruptor owensensis, Caldicellulosiruptor lactoaceticus, их варианты и/или их потомков.
В определенных вариантах осуществления, настоящее изобретение относится к термофильным бактериям, выбранным из группы, состоящей из Fervidobacterium gondwanense, Clostridium thermolacticum, Moorella sp. и Rhodothermus marinus.
В определенных вариантах осуществления, настоящее изобретение относится к термофильным бактериям рода Thermoanaerobacterium или Thermoanaerobacter, включая, но не ограничиваясь ими, виды, выбранные из группы, состоящей из: Thermoanaerobacterium thermosulfurigenes, Thermoanaerobacterium aotearoense, Thermoanaerobacterium polysaccharolyticum, Thermoanaerobacterium zeae, Thermoanaerobacterium xylanolyticum, Thermoanaerobacterium saccharolyticum, Thermoanaerobium brockii, Thermoanaerobacterium thermosaccharolyticum, Thermoanaerobacter thermohydrosulfuricus, Thermoanaerobacter ethanolicus, Thermoanaerobacter brockii, их вариантов и их потомков.
В определенных вариантах осуществления, настоящее изобретение относится к микроорганизмам рода Geobacillus, Saccharococcus, Paenibacillus, Bacillus и Anoxybacillus, включая, но не ограничиваясь ими, виды, выбранные из группы, состоящей из: Geobacillus thermoglucosidasius, Geobacillus stearothermophilus, Saccharococcus caldoxylosilyticus, Saccharoccus thertnophilus, Paenibacillus campinasensis, Bacillus flavothermus, Anoxybacillus kamchatkensis, Anoxybacillus gonensis, их вариантов и их потомков.
В определенных вариантах осуществления, настоящее изобретение относится к мезофильным бактериям, выбранным из группы, состоящей из Saccharophagus degradans; Flavobacterium johnsoniae; Fibrobacter succinogenes; Clostridium hungatei; Clostridium phytofermentans; Clostridium cellulolyticum; Clostridium aldrichii; Clostridium termitididis; Acetivibrio cellulolyticus; Acetivibrio ethanolgignens; Acetivibrio multivorans; Bacteroides cellulosolvens; и Alkalibacter saccharofomentans, их вариантов и их потомков.
Способы по изобретению
В процессе гликолиза, клетки превращают простые сахара, такие как глюкоза, в пировиноградную кислоту, с образованием в итоге ATP и NADH. В отсутствии функционирующей системы транспорта электронов для окислительного фосфорилирования, по меньшей мере 95% пировиноградной кислоты употребляется в коротких каскадах, которые регенерируют NAD+, что явялется обязательным требованием для продолжения гликолиза и продукции ATP. Побочные продукты этих систем регенерации NAD+ обычно называют продуктами ферментации.
Микроорганизмы продуцируют разнообразный набор продуктов ферментации, включая органические кислоты, такие как лактат (форма соли молочной кислоты), ацетат (форма соли уксусной кислоты), сукцинат и бутират, и нейтральные продукты, такие как этанол, бутанол, ацетон и бутандиол. Конечные продукты ферментации в различной степени обладают несколькими основными признаками, включая: они относительно нетоксичны в условиях, при которых они исходно продуцируются, однако становятся более токсичными при накоплении; и они являются более восстановленными, чем пируват, поскольку их непосредственные предшественники служат в качестве конечных акцепторов электронов в ходе гликолиза. Аспекты настоящего изобретения относятся к применению технологии нокаута генов для получения новых микроорганизмов, пригодных для продукции этанола из субстратов лигноцеллюлозной биомассы. Трансформированные организмы получают делецией или инактивацией одного или нескольких генов, которые кодируют конкурирующие каскады, такие как неограничивающие каскады образования органических кислот, описанные в настоящем документе, необязательно с последующей селекцией на основе роста мутантов с улучшенными характеристиками продукции этанола в качестве продукта ферментации.
В определенных вариантах осуществления, термофильный или мезофильный микроорганизм, который в нативном состоянии содержит по меньшей мере один ген, который придает микроорганизму способность продуцировать молочную кислоту в качестве продукта ферментации, трансформируют для снижения или устранения экспрессии указанного по меньшей мере одного гена. Ген, который придает указанному микроорганизму способность продуцировать молочную кислоту в качестве продута ферментации, может кодировать экспрессию лактатдегидрогеназы. Делеция или супрессия гена(ов) или конкретной полинуклеотидной последовательности(ей), которая кодирует экспрессию LDH, подавляет или устраняет схему реакции в общем гликолитическом каскаде, посредством которой пируват превращается в молочную кислоту; полученное относительное изобилие пирувата после этих первых стадий гликолиза должно позволить повышенную продукцию этанола.
В определенных вариантах осуществления, термофильный или мезофильный микроорганизм, который в нативном состоянии содержит по меньшей мере один ген, который придает микроорганизму способность продуцировать уксусную кислоту в качестве продукта ферментации, трансформируют для устранения экспрессии указанного по меньшей мере одного гена. Ген, который придает микроорганизму способность продуцировать уксусную кислоту в качестве продукта ферментации, может кодировать экспрессию ацетаткиназы и/или фосфотрансацетилазы. Делеция или супрессия гена(ов) или конкретной полинуклеотидной последовательности(ей), которая кодирует экспрессию ACK и/или PTA, подавляет или устраняет схему реакции в общем гликолитическом каскаде, посредством которой ацетил-CoA превращается в уксусную кислоту (фигура 1); полученное относительное изобилие ацетил-CoA после этих последних стадий гликолиза должно обеспечить повышенную продукцию этанола.
В определенных вариантах осуществления, подробно описанные выше схемы нокаута генов можно применять по отдельности или совместно. Устранение механизма продукции лактата (т.е. нокаут генов или конкретных полинуклеотидных последовательностей, которые кодируют экспрессию LDH) приводит к образованию большего количества ацетил-CoA; следовательно, если механизм продукции ацетата также устранить (т.е. нокаутом генов или конкретных полинуклеотидных последовательностей, которые кодируют экспрессию ACK и/или PTA), изобилие ацетил-CoA будет далее увеличиваться, что приведет к повышенной продукции этанола.
В определенных вариантах осуществления, не требуется, чтобы термофильные или мезофильные микроорганизмы имели нативную или эндогенную PDC или ADH. В определенных вариантах осуществления, гены, кодирующие PDC и/или ADH, можно экспрессировать рекомбинантно в генетически модифицированных микроорганизмах по настоящему изобретению. В определенных вариантах осуществления, технологию нокаута генов по настоящему изобретению можно применять для рекомбинантных микроорганизмов, которые могут содержать гетерологичный ген, который кодирует PDC и/или ADH, где указанный гетерологичный ген экспрессируется на достаточных уровнях для повышения способности указанного рекомбинантного микроорганизма (который может быть термофильным) продуцировать этанол в качестве продукта ферментации или для придания указанному рекомбинантному микроорганизму (который может быть термофильным) способности продуцировать этанол в качестве продукта ферментации.
В определенных вариантах осуществления, аспекты настоящего изобретения относятся к ферментации лигноцеллюлозных субстратов для получения этанола в концентрации, которая составляет по меньшей мере 70% от теоретического выхода, исходя из содержания целлюлозы, или содержания гемицеллюлозы, или содержания обеих из них.
В определенных вариантах осуществления, аспекты настоящего изобретения относятся к ферментации лигноцеллюлозных субстратов для продукции этанола в концентрации, которая составляет по меньшей мере 80% от теоретического выхода, исходя из содержания целлюлозы, или содержания гемицеллюлозы, или содержания обеих из них.
В определенных вариантах осуществления, аспекты настоящего изобретения относятся к ферментации лигноцеллюлозных субстратов для продукции этанола в концентрации, которая составляет по меньшей мере 90% от теоретического выхода, исходя из содержания целлюлозы, или содержания гемицеллюлозы, или содержания обеих из них.
В определенных вариантах осуществления, существенного или полного устранения продукции органической кислоты из микроорганизмов в нативном состоянии можно достигать с использованием одного или нескольких событий сайт-направленной гомологичной рекомбинации ДНК.
Манипулирование одновременным осахариванием и процессом коферментации (SSCF) или CBP при термофильных температурах обеспечивает несколько важных преимуществ над общепринятыми мезофильными температурами ферментации 30-37°С. В частности, стоимость стадии процесса продукции целлюлазы существенно снижается (например, в 2 раза или более) для термофильных SSCF и она эта стадия устраняется для CBP. Ожидается, что стоимость, связанная с охлаждением биореактора, а также теплообменом до и после ферментации, также снизится для обоих термофильных SSCF и CBP. В итоге, характерные для процесса термофильные биокатализаторы могут быть менее подверженными микробной контаминации по сравнению с характерными для процесса общепринятыми мезофильными биокатализаторами.
Способность к переориентированию перехода электронов посредством модификаций реакций преобразования углерода имеет широкие применения. Например, этот подход можно использовать для продукции высоких выходов этанола в штаммах, отличных от T. saccharotyticum и/или для продукции растворителей, отличных от этанола, например, высших спиртов (т.е. бутанола).
Метаболическая инженерии посредством стратегий антисмысловых олигонуклеотидов (asRNA)
Ферментирующие микроорганизмы, такие как дрожжи и анаэробные бактерии, ферментируют сахара до этанола и других восстановленных органических конечных продуктов. Теоретически, преобразование углерода можно было бы направить на продукцию этанола, если бы можно было подавить образование конкурирующих конечных продуктов, таких как лактат и ацетат. Настоящее изобретение относится к нескольким подходам генетической инженерии, предназначенным для удаления таких конкурирующих каскадов из организмов CBP по изобретению. В большинстве из этих подходов используют конструкции для нокаута (для рекомбинации с однократным кроссинговером) или конструкции для обмена аллелей (для рекомбинации с двойным кроссинговером) и они нацелены на генетические локусы для ack и ldh. Хотя в этих инструментах используются испытанные способы разработки штаммов, существует несколько потенциальных задач, которые могут помешать прогрессу: (i) они зависят от эффективности рекомбинации в хозяине, которая во всех случаях неизвестна для организмов CBP; (ii) их можно использовать для нокаута только одного каскада за один раз, таким образом, необходимы последовательные изменения с несколькими селективными маркерами или повторно используемыми маркерами; (iii) делеция генов-мишеней может быть токсичной или она может иметь полярные эффекты на экспрессию расположенного ниже гена.
Настоящее изобретение относится к дополнительным подходам, направленным на генетическую инженерию, которые не основаны на эффективности рекомбинации хозяина. Один из этих альтернативных инструментов называют антисмысловой РНК (asRNA). Хотя антисмысловые олигонуклеотиды используют в течение двадцати пяти лет для ингибирования уровней экспрессии генов как in vitro, так и in vivo, недавние достижения в предсказании структуры мРНК облегчили более быстрое конструирование молекул asRNA. Эти достижения побудили ряд групп продемонстрировать пригодность asRNA в метаболической инженерии бактерий.
Преимущества применения asRNA по сравнению с технологией нокаута и аллельного обмена являются многочисленными: (i) снижение необходимости во множестве селективных маркеров, поскольку на множество каскадов можно осуществить нацеливание единичной конструкции asRNA; (ii) ослабление уровня мРНК-мишени можно корректировать увеличением или снижением константы ассоциации между asRNA; (iii) инактивация каскада может быть зависимой от условий, если транскрипты asRNA запускаются зависимыми от условий промоторами. Недавно, эту технологию использовали для повышения образования растворителя в грамположительном мезофиле, Clostridium acetobutilicum (Tummala et al. (2003)). Хотя точный механизм ослабления посредством asRNA экспрессии генов неясен, вероятный механизм запускается при гибридизации asRNA в мРНК-мишенью. Механизмы могут включать одно или несколько из следующих: (i) ингибирование трансляции мРНК в белок блокированием надлежащего взаимодействия участка связывания рибосом с рибосомой, (ii) снижение времени полужизни мРНК с помощью dsRNA-зависимых РНКаз, таких как РНКаза H, которые быстро деградируют дуплекс РНК, и (iii) ингибирование транскрипции вследствие ранней терминации транскрипции мРНК.
Конструирование антисмысловых последовательностей
asRNA, как правило, имеют длину 18-25 нуклеотидов. Существует несколько доступных вычислительных инструментов для целесообразного конструирования нацеленных на РНК нуклеиновых кислот (Sfold, Integrated DNA Technologies, STZ Nucleic Acid Design), которые можно использовать для выбора последовательностей asRNA. Например, последовательность гена ack (ацетаткиназы) Clostridium thermocellum можно внести на сервер для целесообразного конструирования и можно выбрать несколько последовательностей asRNA. В кратком изложении, выбирают параметры конструирования для последовательностей мРНК-мишеней, которые не имеют предсказанной вторичной структуры.
Конструирование вектора для доставки
Репликативную плазмиду можно использовать для доставки кодирующей asRNA последовательности в орагнизм-мишень. Векторы, такие как, но не ограничиваясь ими, pNW33N, pJIR418, pJIR751 и pCTC1, образуют остов конструкций asRNA для доставки кодирующих последовательностей asRNA внутрь клетки-хозяина. В дополнение к внехромосомной экспрессии (на основе плазмиды), asRNA можно стабильно встраивать в гетерологичный локус на геноме микроорганизма для получения стабильной экспрессии asRNA. В определенных вариантах осуществления, штаммы представляющих интерес термофильных или мезофильных микроорганизмов сайт-направленной можно конструировать гомологичной рекомбинацией для нокаута продукции органических кислот, и другие представляющие интерес гены можно частично, по существу, или полностью удалять, инактивировать, или супрессировать посредством asRNA.
Выбор промотора
Для обеспечения экспрессии транскриптов asRNA промоторы совместимые с данным хозяином можно подвергать слиянию с asRNA, кодирующей последовательность. Кассеты промотор-asRNA конструируют в одной стадии ПЦР. Смысловой и антисмысловой праймеры, предназначенные для амплификации, модифицируют так, чтобы последовательность asRNA (отобранная с помощью подхода целесообразного конструирования) была присоединена к 5'-концу антисмыслового праймера. Кроме того, на концы каждого праймера добавляют участки рестрикции, такие как EcoR1 или BamR1, так чтобы конечный ампликон ПЦР можно было конструировать непосредственно с помощью ферментов рестрикции и встраивать в остов вектора посредством традиционных способов клонирования.
В отношении микроорганизмов, которые не имеют способности метаболизировать пентозные сахара, но способны метаболизировать гексозные сахара, как описано в настоящем документе, понятно, что нацеливание на инактивацию генов ack и ldh Clostridium thermocellum и Clostridium straminisolvens, можно проводить, например, с использованием антисмысловых РНК в соответствии со способами, описанными в настоящем документе.
В отношении микроорганизмов, которые придают способность метаболизировать пентозные и гексозные сахара, как описано в настоящем документе, будет понятно, что нацеливание на инактивацию генов ack и ldh Clostridium cellulolyticum, Clostridium phytofermentans и Caldicellulosiruptor kristjanssonii, можно проводить, например, с использованием антисмысловых молекул в соответствии со способами, описанными в настоящем документе.
В дополнение к селекции на антибиотиках для штаммов, экспрессирующих векторы для доставки asRNA, такие штаммы можно подвергать селекции на зависимых от условий средах, которые содержат любой из нескольких аналогов токсичных метаболитов, таких как фторацетат натрия (SFA), бромуксусная кислота (BAA), хлоруксусная кислота (CAA), 5-фтороротовая кислота (5-FOA) и хлормолочная кислота. Применение химических мутагенов, включая, но не исключительно, этанметилсульфонат (EMS) можно использовать в сочетании с экспрессией антисмыслового олигонуклеотида (asRNA) для получения штаммов, которые имеют один или несколько генов, частично, по существу, или полностью удаленных, подавленных, инактивированных или супрессированных.
ПРИМЕРЫ
После описания, в целом, изобретения, оно будет более понятно с помощью представленных ниже примеров, которые включены только для целей иллюстрации определенных аспектов и вариантов осуществления настоящего изобретения, и не предназначены для ограничения изобретения.
ПРИМЕР 1
Создание специализированных транспозонов для мезофильных и термофильных целлюлолитических, ксиланолитических организмов
Настоящее изобретение относится к способам создания специализированных транспозонов для целлюлолитических, и/или ксиланолитических, и/или термофильных организмов. Для этого, нативный промотор из организма-хозяина можно подвергать слиянию с селективным маркером, который, как определено, работает в этом организме. Этот фрагмент можно клонировать в транспозон EZ-Tn5TM, который находится на векторе pMODTM-2<MCS> (Epicenter®Biotechnologies). Например, промотор gapDH C. thermocellum можно подвергать слиянию с маркером лекарственного средства mLs, а также с геном cat, а затем субклонировать в вектор pMODTM-2<MCS>.
Коммерческие транспозоны лишены термостабильных маркеров лекарственных средств и нативных промоторов целлюлолитических, и/или ксиланолитических, и/или термофильных организмов. Маркеры mLs и cat функционируют в термофильных бактериях, и промотор gapDH регулирует ключевой гликолитический фермент, и он должен постоянно экспрессироваться. Сочетание указанных выше маркеров лекарственных средств и промотора gapDH может значительно повысить вероятность получения функционального транспозона. Этот подход можно применять для других целлюлолитических, и/или ксиланолитических, и/или термофильных организмов.
Схема эксперимента
На фигуре 26 представлена диаграмма, взятая из руководства пользователя Epicenter®Biotechnologies, которое включено в настоящий документ в качестве ссылки, на которой представлены 250-550 п.н. pMODTM-2<MCS>. В верхней части, черными стрелками, обозначенными ME, указаны мозаичные концы размером 19 п.н., которые определяют транспозон. Участки EcoRI и HindIII определяют полилинкер, который показан черной рамкой, обозначенной MCS. В нижней части, показаны последовательность ДНК и ферменты рестрикции, ассоциированные с MCS.
Следующие праймеры используют для амплификации слитых с промотором фрагменты из pMQ87-gapDH-cat и pMQ87-gapDH-mls: GGCGgaattc CTT GGT CTG ACA ATC GAT GC (SEQ ID NO:19); GGCGgaattc TATCAGTTATTACCCACTTTTCG (SEQ ID NO:20). Строчными буквами указаны сконструированные участки рестрикции EcoRI. Размер полученного ампликона составляет ~1,9 т.п.н. Стандартные молекулярные способы позволят расщепить ампликон посредством EcoRI и клонировать в уникальный участок EcoRI pMODTM-2<MCS>. Транспозон и последующую транспозосому можно получать и вводить в организмы-хозяева, как описано изготовителем.
ПРИМЕР 2
Конструкции для получения способами инженерии целлюлолитических и ксиланолитических штаммов
Настоящее изобретение относится к композициям и способам для получения способами генетической инженерии представляющего интерес организма для CBP мутацией генов, кодирующих ключевые ферменты метаболических каскадов, которые отводят реакции преобразования углерода от этанола. Конструкции для нокаута с однократным кроссинговером конструируют так, чтобы встроить крупные фрагменты чужеродной ДНК в представляющий интерес ген для его частичного, существенного или полного удаления, подавления, инактивации или супрессии. Конструкции для нокаута с двойным кроссинговером конструируют, чтобы частично, по существу, или полностью удалить, подавить, инактивировать или супрессировать представляющий интерес ген на хромосоме или заменить представляющий интерес ген на хромосоме мутантной копией гена, так чтобы образовался ген, прерывающийся кассетой устойчивости к антибиотикам.
Конструирование векторов для нокаута с однократным кроссинговером требует клонирования внутреннего фрагмента представляющего интерес гена в систему на основе плазмиды. В идеальном случае, этот вектор обладает селективным маркером, который экспрессируется в штамме-хозяине, но не реплицируется в штамме-хозяине. Таким образом, при введении в штамм-хозяина плазмида не реплицируется. Если клетки помещают в кондициональную среду для селекции по маркеру, находящемуся на плазмиде, растут только те клетки, которые нашли способ поддержания плазмиды. Поскольку плазмида неспособна реплицироваться в качестве автономного элемента ДНК, наиболее вероятным путем, посредством которого поддерживается плазмида, является рекомбинация на хромосоме хозяина. Наиболее вероятной областью для прохождения рекомбинации является область гомологии между плазмидой и хромосомой хозяина.
Альтернативно, реплицирующиеся плазмиды можно использовать для создания вставок путем однократного кроссинговера. Клетки, которые захватили вектор для нокаута можно подвергать селекции на кондициональной среде, затем пассировать в отсутствии селекции. Без положительной селекции, обеспечиваемой кондициональной средой, множество организмов теряют плазмиду. В случае, когда плазмида встраивается на хромосому хозяина, она не утрачивается в отсутствии селекции. Затем клетки можно возвращать в кондициональную среду и растут только те из них, которые сохранили маркер посредством встраивания в хромосому. Можно разработать способ на основе ПЦР для скрининга организмов, которые содержат маркер, расположенный на хромосоме.
Конструирование векторов для нокаута путем двойного кроссинговера требует по меньшей мере клонирования ДНК, фланкирующей представляющий интерес ген (~1 т.п.н.) в плазмиду и, в некоторых случаях, оно может включать клонирование представляющего интерес гена. Селективный маркер может быть помещен между фланкирующей ДНК или, если клонируют представляющий интерес ген, маркер помещают внутрь гена. В идеальном случае, используемая плазмида не способна реплицироваться в штамме-хозяине. При введении плазмиды хозяина и селекции на кондициональной среде для маркера, растут только те клетки, в которых произошла рекомбинация гомологичной ДНК на хромосому. Для замены представляющего интерес гена селективным маркером требуется два события рекомбинации.
Альтернативно реплицирующиеся плазмиды можно использовать для проведения замен гена путем двойного кроссинговера. Клетки, которые захватили вектор с нокаутом, можно подвергать селекции на кондициональной среде, затем пассировать в отсутствии селекции. Без положительной селекции, обеспечиваемой кондициональной средой, многие организмы утрачивают плазмиду. В случае, когда маркер лекарственного средства встраивают в хромосому хозяина, он не будет утрачен в отсутствии селекции. Затем клетки можно возвращать в кондициональную среду, и растут только те клетки, которые сохраняют маркер посредством встраивания в хромосому. Можно разработать способ на основе ПЦР для скрининга организмов, которые содержат маркер, расположенный на хромосоме.
В дополнение к схемам селекции на антибиотиках, можно использовать несколько токсических аналогов метаболитов, таких как фторацетат натрия (SFA), бромуксусная кислота (BAA), хлоруксусная кислота (CAA), 5-фтороротовая кислота (5-FOA) и хлормолочная кислота для селекции мутантов, появляющихся либо посредством гомологичной рекомбинации, либо посредством стратегий на основе транспозонов. Можно использовать применение химических мутагенов, включая, но не исключительно, этанметилсульфонат (EMS) в сочетании со схемами направленного мутагенеза, в которых используются гомологичная рекомбинация или стратегии на основе транспозонов.
Конструкции для нокаута в C. cellulolyticum
Ацетаткиназа (ген 131 из опубликованного генома C. cellulolyticum):
Однократный кроссинговер
Ген ацетаткиназы C. cellulolyticum имеет длину 1110 п.н. Внутренний фрагмент размером 662 п.н. (SEQ ID NO:21), охватывающий нуклеотиды 91-752, амплифицировали посредством ПЦР и клонировали в векторы-"самоубийцы" и реплицирующиеся векторы, которые имеют различные селективные маркеры. Селективные маркеры могут включать маркеры, которые обеспечивают устойчивость к эритромицину и хлорамфениколу. Эти плазмиды используют для встраивания в ген ack. Карта гена ack и области, амплифицированной посредством ПЦР для встраивания в ген, представлена на фигуре 19. Подчеркнутые участки SEQ ID NO:21, указанные ниже, соответствуют участкам, которые представляют собой участки EcoRI, которые фланкируют фрагмент для нокаута.
gaattctgcgacagaatagggattgacaattcctttataaagcaatcaaggggttcagaagaggctgttattttgaataaagagctaaagaatcacaaagatgcaatagaggctgttatttctgcactgactgacgataatatgggcgttataaaaaacatgtccgaaatatcagcagtgggacacagaatagtacacggcggtgaaaaattcaacagttctgtagttatagatgaaaacgttatgaatgcagtaagagagtgtatagacgttgcaccgcttcataatccgccgaatattataggtatagaggcttgccagcagattatgcccaatatacctatggtagctgtatttgataccactttccacagctccatgcctgattatgcatacctttacgcattgccatatgaactttatgaaaagtacggtataagaaaatatggtttccacggaacatcacacaaatatgttgcagaaagagcttctgcaatgcttgataagtctttgaacgaattaaagataattacatgccatcttgggaacggttcaagtatttgtgctgttaacaagggtaaatcaattgatacttccatgggctttacacctttgcagggacttgcaatgggtacaagaagcggtacaatagaccctgaagttgttacgaattc
Эти участки конструировали в ходе конструирования "праймеров ack KO" и они обеспечивают последующее клонирование фрагмента во множество векторов.
Двойной кроссинговер
Для конструирования вектора для двойного кроссинговера для гена ack C. cellulolyticum, клонируют ~1 т.п.н. ДНК, фланкирующей каждую сторону гена ack. Между фланкирующей ДНК встраивают селективный маркер. Селективные маркеры могут включать маркеры, которые обеспечивают устойчивость к эритромицину и хлорамфениколу. 3'-фланкирующая область гена ack не доступна в доступном предварительном геноме. Для получения этой ДНК, используют набор, такой как Genome Walker от Clontech.
Лактатдегидрогеназа (гены 2262 и 2744 опубликованного генома C. cellulolyticum):
Однократный кроссинговер
Гены ldh C. cellulolyticum имеют длину 951 п.н. (для гена 2262) (SEQ ID NO:22) и 932 п.н. (для гена 2744) (SEQ ID NO:23). Внутренний фрагмент размером ~500 п.н. вблизи 5'-конца каждого гена амплифицируют посредством ПЦР и клонируют в векторы-"самоубийцы" и реплицирующиеся векторы, которые имеют различные селективные маркеры. Селективные маркеры могут включать маркеры, которые обеспечивают устойчивость к эритромицину и хлорамфениколу. Эти плазмиды используют для встраивания в гены ldh 2262 и ldh 2744. В качестве примера, карта гена ldh 2262 и области, амплифицированной посредством ПЦР для встраивания в ген, представлена на фигуре 20.
Двойной кроссинговер
Для конструирования вектора для двойного кроссинговера для гена(ов) ldh C. cellulolyticum, клонируют ~1 т.п.н. ДНК, фланкирующей каждую сторону гена(ов) ldh. Между фланкирующей ДНК встраивают селективный маркер. Селективные маркеры могут включать маркеры, которые обеспечивают устойчивость к эритромицину и хлорамфениколу. На фигуре 21 представлен пример фрагмента для нокаута с двойным кроссинговером ldh (2262) C. cellulolyticum.
В последовательности, указанной ниже (SEQ ID NO:24) ген mLs (селективный маркер) подчеркнут и фланкирующая ДНК представляет собой остальную последовательность. В ходе конструирования праймеров, конструируют участки рестрикции и 5'- и 3'-концы указанного выше фрагмента так, чтобы его можно было клонировать в ряд репликативных и нерепликативных векторов. Ту же стратегию используют для создания вектора для удаления ldh 2744.
gacgcatacaggttgtaacacccatttcccttagcttttcgggagatgaataaaacaaactttccgggtcctttaccacaccgcccacataaagagctatgccgcatgaaagaaacgatatgttatcatttttttcgtaaactgttatttccgaacccggataaagctttaccatattattaactgctgccgtccctgcatgtgtacaccctataaccactattttcatatacatcctcctttgtttgcttgtaaatatatcccatatataccacctaaatatattttataaacaaattcggtatatcattcttttggtaaataaaaagtacatccgatattagaatgtacctaaaaaaaattattattttattgtatatgctttatctgttttcattatatggtttgctatccattctacggtaaaatcaagtaattccattaagtactgatcctgatccttgtctatcctgctataatccgtattactgattttctcaataaaatcatggtgttcaactttgtgggagagaagcttgcgatatcctatgctatgcatgtattcttcttcataggtaaaatgaaagacagtgtaatcttttagttccgtaattagccgtacaatttcatcatatttgtctgtaataagctgatttttcgtggcctcataaatttccgaagcaatctggaatagtttcttatgctgttcgtcgattttctcaattccaagaataaattcgtctctccattctatcatatggaccctcctaaattgtaatgtataccaagattatacatacttcctagaatataaacaatacaaggataaaattttaatatcgtatacctacataaatgactaacttaaagctctctaaaacttcttttttattatttctatactactaaaatcaaaaatattctctaaagtatttctacaaatgttgtttttgcaacaaagtagtatacttttgcacccagaatgttttgttataacttacaaattaggggtatatttatagtaaatactaaatggaagagtaggatattgattatgaacgagaaaaatataaaacacagtcaaaactttattacttcaaaacataatatagataaaataatgacaaatataagattaaatgaacatgataatatctttgaaatcggctcaggaaaagggcattttacccttgaattagtacagaggtgtaatttcgtaactgccattgaaatagaccataaattatgcaaaactacagaaaataaacttgttgatcacgataatttccaagttttaaacaaggatatattgcagtttaaatttcctaaaaaccaatcctataaaatatttggtaatataccttataacataagtacggatataatacgcaaaattgtttttgatagtatagctgatgagatttatttaatcgtggaatacgggtttgctaaaagattattaaatacaaaacgctcattggcattatttttaatggcagaagttgatatttctatattaagtatggttccaagagaatattttcatcctaaacctaaagtgaatagctcacttatcagattaaatagaaaaaaatcaagaatatcacacaaagataaacagaagtataattatttcgttatgaaatgggttaacaaagaatacaagaaaatatttacaaaaaatcaatttaacaattccttaaaacatgcaggaattgacgatttaaacaatattagctttgaacaattcttatctcttttcaatagctataaattatttaataagatcccctttacttcggatgcatgccgcaggcaggcatccgaagtagtttctccattatacaagtattctcttgagtacgtcgtcgcttctcagcagctgctttgctttttccctgttttccggcacatggagataagtgtatctgttaggcttaatagtgtgtgccatgtcaattgccttttcgaagtcatctgccttcatttttaaggtttccacaaaattgataaaacccgtatcagtcagaaattttactacccgctgatatctgtgttcttgaaccctgctcataagataggttgcaatcccaacctgaattccatgaagctgaggtgtctccagcagcttatctaaagcatgagatattagatgctcactaccgctggctggagcactgctgtctgctatctgcatggcaattccgctcattgtcagagagtctaccatttcctttaaaaagaagttttctgtaacctgtgtgtagggcatccttacaatactgtttactgactttttagcaatcattgcagcaaaatcgtcaacctttgccgcattgttcctttcttcaaaataccagtcatacacagccgtaattttggatattatgtctccgagacctgaataaataaatttcataggtgcattttttaatacatctaaatccactaatattccaaatggcatcgaggcatgtacggaagtacgcctgccatttataatcaaagagcagcctgagctggaaaaaccatcgtttgaggttgatgtaggtatactgataaaaggaagcttgtttaaaaaagctatatatttggctgcatcaagcacctttcctcctcctactccgaccactgcatcggttttggagggaatagtaaaagccttgagcataagattttcaagctttatgtcatcatagtcgtaagtttcaagtactgcaagagattttcttgactttatggaatccagaatcttttcaccaaataagtcacgtattccctctccaaaaagtactacaacattactaattcctgccctttcaatatgtgc
Конструкции для нокаута в C. phytofertnentans
Для ацетаткиназы (ген 327 из опубликованного генома C. phytofermentans):
Ген ацетаткиназы C. phytofertnentans имеет длину 1244 п.н. Внутренний фрагмент размером 572 п.н. (SEQ ID NO:21), охватывающий нуклеотиды 55-626, амплифицируют посредством ПЦР и клонируют в векторы-"самоубийцы" и реплицирующиеся векторы, которые имеют различные селективные маркеры. Селективные маркеры могут включать маркеры, которые обеспечивают устойчивость C. phytofertnentans к лекарственному средству. Эти плазмиды используют для встраивания в ген ack. Карта гена ack и области, амплифицированной посредством ПЦР для встраивания в ген, представлена на фигуре 22. Участки рестрикции конструируют в ходе конструирования "праймеров ack KO" и они обеспечивают последующее клонирование фрагмента во множество векторов. Последовательность фрагмента для нокаута, описанного выше, указана в качестве SEQ ID NO:25.
Двойной кроссинговер
Для конструирования вектора для двойного кроссинговера для гена ack C. phytofertnentans, клонируют ~1 т.п.н. ДНК, фланкирующей каждую сторону гена ack. Между фланкирующей ДНК встраивают селективный маркер. Селективные маркеры могут включать маркеры, которые обеспечивают устойчивость штамма к лекарственному средству. Пример предлагаемой конструкции для нокаута с двойным кроссинговером с геном mLs в качестве предлагаемого селективного маркера представлен на фигуре 23.
Последовательность, которая соответствует фрагменту, изображенному на фигуре 23 (SEQ ID NO:26), указана ниже. Ген mLs (предполагаемый селективный маркер) подчеркнут, и остальная часть соответствует фланкирующей ДНК. В ходе конструирования праймеров, конструируют участки рестрикции и 5'- и 3'-концы указанного выше фрагмента так, чтобы его можно было клонировать в ряд репликативных и нерепликативных векторов.
ctgagtgcaatgtaaaaaaggatgcctcaagtattcttgaaacatccttatattatactacaaaatcataaagtaaattactcagctgtagcaatgatctcttttttgttgtaagatccacaagctttacaaactctatgaggcatcataagtgcaccacacttgctgcatttcactaagtttggagcagtcatcttccagtttgcacgacgactatctcttctagctttggaatgtttattctttggacaaatagctcccattgattacacctccttaaacttgttaaaaatatctcggatagcagacattcttgggtctagttctgtacggtcacacccgcactctccttcatttaggttagcaccgcagaccttgcagattcctttacagtcttctttgcacagaaccttcattgggaaaccaatcaagacttcttcatagataagtttatctacgtctaaatcatatccggaaacaaaatttgtttcatctaaatcctcggtacgctgttcctctgttttcgatacatcaatctctgtagccacgtcgatgtcttgttggatggtttcttccttcaaacaacgatcgcaaggaacggctaacgctaatttcgtttttgcttccaccagaatttttcggccacctagattagttaatctaagtttaaccggttctttataggtaatagaataaccgacaccatttaattcgaatatatcaaattcaatcggtgcagtgtattctttgagaccattaggaacattcatgacttcagacatttgtatcagcataagtaactcctgtctaaaaaaacgcataatgtaagcgcccaaaaattcacactgttagtattataaacgcttaaaataggtttgtcaactcctaactgttaaaaatgtcagaattgtgtaaccatattttctcttcattatcgttcttcccttattaaataatttatagctattgaaaagagataagaattgttcaaagctaatattgtttaaatcgtcaattcctgcatgttttaaggaattgttaaattgattttttgtaaatattttcttgtattctttgttaacccatttcataacgaaataattatacttctgtttatctttgtgtgatattcttgatttttttctatttaatctgataagtgagctattcactttaggtttaggatgaaaatattctcttggaaccatacttaatatagaaatatcaacttctgccattaaaaataatgccaatgagcgttttgtatttaataatcttttagcaaacccgtattccacgattaaataaatctcatcagctatactatcaaaaacaattttgcgtattatatccgtacttatgttataaggtatattaccaaatattttataggattggtttttaggaaatttaaactgcaatatatccttgtttaaaacttggaaattatcgtgatcaacaagtttattttctgtagttttgcataatttatggtctatttcaatggcagttacgaaattacacctctgtactaattcaagggtaaaatgcccttttcctgagccgatttcaaagatattatcatgttcatttaatcttatatttgtcattattttatctatattatgttttgaagtaataaagttttgactgtgttttatatttttctcgttcattgtatttctccttataatgttcttaaattcatttatcacggggcaacttaatatatccgaaatatagttcttctatatcgttcccccagtataatgattattatactatttaatcttcaacttaacaattggagtttccagttaagaaataataatttaatgccaaagcggatattcgcaatccgcttacgctacttgctcataacctcaacaggcaatgaagctaagttaattatttactctgtgcctgaacagcagtgattgcaacaacaccaacgatatcatcagaagaacaacctcttgataaatcatttactggagctgcaataccctgagttaatggtccataagcttctgcctttgcaagacgctgtgttaacttatatccaatgttaccagcatcaaggtctgggaagattaatacgttagcttttccagcaatatcactaccaggagcttttgaagcacctacactaggaacgattgctgcatctaactggaactcgccgtcgatcttatattctgggtataattcatttgcaatcttagttgcttctacaaccttatcaacatctgcatgctttgcgcttccctttgttgaatgagaaagcatagctacgataggttcagagccaactaattgttcaaaactcttcgctgtggaaccagcgattgctgctaactcttcagcatttggattctgatttaaaccagcatcagagaaaaggaaagttccatttgcgcccatatcacaattaggtactaccattacgaagaaagcagaaactaacttagtatttggagcagtttttaaaatctgaagacatggtcttaaggtatctgctgtagagtgacaagcaccagatactaaaccatctgcatcgcccatcttaaccatcattacaccgtatgtaatgtagtctgttgttaaaagctcttttgctttttcaggggtcatgccttttgcctgtctaagttctaca agcttgttaatgtaagc
Для лактатдегидрогеназы (гены 1389 и 2971 опубликованного генома C. phytofermentans)
Однократный кроссинговер
Гены ldh C. phytofertnentans имеют длину 978 п.н. (для гена 1389) (SEQ ID NO:27) и 960 п.н. (для гена 2971) (SEQ ID NO:28). Внутренний фрагмент размером ~500 п.н. вблизи 5'-конца каждого гена амплифицируют посредством ПЦР и клонируют в векторы-"самоубийцы" и реплицирующиеся векторы, которые имеют различные селективные маркеры. Селективные маркеры могут включать маркеры, которые обеспечивают устойчивость к лекарственному средству. Эти плазмиды используют для встраивания в гены ldh 1389 и ldh 2971. В качестве примера, карта гена ldh 1389 и области, амплифицированной посредством ПЦР для встраивания в ген, представлена на фигуре 24.
Двойной кроссинговер
Для конструирования вектора для двойного кроссинговера для гена(ов) ldh C. phytofertnentans, клонируют ~1 т.п.н. ДНК, фланкирующей каждую сторону гена(ов) ldh. Между фланкирующей ДНК встраивают селективный маркер. Селективные маркеры могут включать маркеры, которые обеспечивают устойчивость этого штамма к лекарственному средству. Пример предполагаемой конструкции для нокаута с двойным кроссинговером с геном mLs в качестве предполагаемого селективного маркера представлен на фигуре 23.
Последовательность, которая соответствует фрагменту, изображенному на фигуре 25, указана ниже в качестве (SEQ ID NO:29). Ген mLs (селективный маркер) подчеркнут и остальная часть соответствует фланкирующей ДНК. В ходе конструирования праймеров, конструируют участки рестрикции и 5'- и 3'-концы указанного выше фрагмента так, чтобы его можно было клонировать в ряд репликативных и нерепликативных векторов. Ту же стратегию используют для создания вектора для удаления ldh 2971.
tggaatctcactatgcaccaatgtggtactaaattatatctttatctatggaaaattaggttttccgcgaatggagatagagggagctgccattgctactttaatttgtagaattcttgagagtattttagttgttatttatatgtataagggtgagaaggtacttaagatgagactttcttatatttttaagagatctaaacagtattttcgctctttggctcgttatagtgcgccagtgcttatgagtgaggttaactgggggcttgggattgctgttcagtctgcaatcattgggcgtatgggtgttagttttcttacagccgccagcttcattaatgtagtacaacagttagccggaatcattctgattggtattggtgtgggttcgagcattataatagggaatttgattggtgagggaaaagagcatgaggcgagaatgctagccaataagttaatacgtatcagtatgatactcggaggaattgttgcttttgcagtaatcttactacgtccaatcgctcctaactttattgaggcgtctaaggaaacagcggatttaattcgtcagatgctatttgtttcggcttacctcttattcttccaagccttatctgtattaactatggccggaatattacgtggtgcaggggataccctttactgtgcaacctttgatgttttgaccttatgggtactaaaacttggaggaggtttgcttgcaaccatagtacttcatcttccacctgtatgggtttactttatcttaagtagcgatgagtgtgttaaagcgctatttacggtaccgcgggtcttaaagggacgttggattcatgatacaacactgcattaagatttcatatgtccagatatttttgcacagtagcataattactagagcttattcctataatattcataggttttgatggtccattttacgttacgatagcatatattacatcaaaaccaattctatataagatgaggttatagtatgaacgagaaaaatataaaacacagtcaaaactttattacttcaaaacataatatagataaaataatgacaaatataagattaaatgaacatgataatatctttgaaatcggctcaggaaaagggcattttacccttgaattagtacagaggtgtaatttcgtaactgccattgaaatagaccataaattatgcaaaactacagaaaataaacttgttgatcacgataatttccaagttttaaacaaggatatattgcagtttaaatttcctaaaaaccaatcctataaaatatttggtaatataccttataacataagtacggatataatacgcaaaattgtttttgatagtatagctgatgagatttatttaatcgtggaatacgggtttgctaaaagattattaaatacaaaacgctcattggcattatttttaatggcagaagttgatatttctatattaagtatggttccaagagaatattttcatcctaaacctaaagtgaatagctcacttatcagattaaatagaaaaaaatcaagaatatcacacaaagataaacagaagtataattatttcgttatgaaatgggttaacaaagaatacaagaaaatatttacaaaaaatcaatttaacaattccttaaaacatgcaggaattgacgatttaaacaatattagctttgaacaattcttatctcttttcaatagctataaattatttaataagaagtaataggaaataatactcgaattattctgcaatctgttctaaaaaataaaattaagaaattactatagcaagccaggttaaaattactagcttgctatttttgtgcatttagtacagttttgattattaaagaataaatttaataactattttgcaataagttattgactatttcacaagttagtgttactatacaagtatgaaataaagatacataaaaaaataaataatatgaaacataaattcatgacatgcggaatagaatgaaagaatattatgtcggttcctaatactaaatggatataacaatctattgaaacacttatggggtgtaagtgtggagagaatttctaaagcgccaaaagactctacatatgaaattctaaagcttcacacgggaataatctaatttatgtatcttattatcataattcaggaaggtagtgtgaaaatataaaaattagttttcctgtttcattcaggcagtagcatttcttaaacaaatttgctatgcattgggtgttatctgaaaaacaaaaagcaattttctcacaacttatttctgaacaacaatggtattaaaaatttggaggaggattttactatgaaaaaaacggtaacattactgttggttctgaccatggtggtaagcttatttgcagcatgtggtaagaaaaatggatcaagcgaaaccggcacaaaagatcctgtggcaacaagcggtgcaaaagaacctgacaaacaagatccaggcaataaagagcctgaaaaacaagaccctgttaaaatcaagatttattactctgataatgcaaccttaccatttaaagaagattggttagttataaaggaagctgagaagagatttaatgttgatttcgatttcgaagtaattccaattgcagattatcaaacaaaagtttctttaacattaaatacaggaaataacgctccagatgtcatcctttatcagtcaacgcagggagagaatgcatct
Cald. kristjanssonii и C. stercorarium subs leptospartum
Насколько известно авторам изобретения, секвенирование генома указанных выше организмов не проводили, и, если проводили, то его не сделали доступным обществу. Исходя из экспериментальных результатов авторов настоящего изобретения эти организмы являются целлюлолитическими и ксиланолитическими. Для изменения способами генетической инженерии этих организмов и отклонения в них в сторону реакций преобразования углерода до этанола необходимы последовательности ДНК генов, кодирующих ключевые метаболические ферменты, этих организмов. Они включают такие ферменты, как ацетаткиназа и лактатдегидрогеназа. Для получения последовательностей этих генов, геномы этих организмов можно секвенировать.
Имея доступ к последовательностям генома, консервативный характер указанных выше ферментов можно использовать для выявления кодирующих генов и фланкирующей ДНК. Эти последовательности используют для конструирования конструкций для направленного мутагенеза с использованием стратегий как однократного, так и двойного кроссинговера. Эти стратегии идентичны стратегиям, описанным выше. Также авторы настоящего изобретения определили, какие антибиотики можно использовать в качестве селективных маркеров в этих организмов и какие протоколы трансформации являются наилучшими.
ПРИМЕР 3
Трансформация C. cellulolyticum
Клетки выращивали в 50 мл среды GS с 4 г/л целлобиозы до OD 0,8 в анаэробных условиях и инкубировали при 34°С. После сбора их промывали 3 раза в равных объемах буфером для промывания, содержащим 500 мМ сахарозу и 5 мМ MOPS с pH, доведенным до 7. После конечного промывания, клеточный осадок ресуспендировали в равном объеме буфера для промывания. Аликвоты по 10 мкл суспензии клеток помещали в стандартную кювету для электропорации с расстоянием между электродами 1 мм. Добавляли 1 мкл плазмидной ДНК. Концентрацию плазмидной ДНК доводили для обеспечения молярного соотношения плазмиды к клеткам между 1:1 и 10:1. Применяли 5-мс импульс с напряженностью поля 7 кВ/см (измерено) в образце. Использовали обычный генератор импульсов. Образец сразу разбавляли 1000:1 с помощью той же среды, которую использовали при исходном культивировании, и позволяли восстановиться до возобновления роста, и его определяли по повышению OD (24-48 ч). Выделенный образец разбавляли 50:1 и помещали в селективные среды либо с 15 мкг/мл эритромицина, либо с 15 мкг/мл хлорамфеникола, и позволяли расти в течение 5-6 суток. Образцы, обладающие ростом в селективной среде, тестировали для подтверждения, что они в действительности представляют собой C. cellulolyticum и что они имеют плазмиду.
ПРИМЕР 4
Конструкции для получения способами инженерии целлюлолитических штаммов
Целлюлоза является одним из основных компонентов биомассы, который потенциально можно использовать в качестве субстрата для получения топливного этанола ферментацией с Clostridium thermocellum. Однако в этом процессе большое количество энергии и источников углерода используется для образования побочного продукта ацетата и лактата. Инженерия метаболических каскадов утилизации целлюлозы в Clostridium thermocellum необходима для сведения к минимуму продукции лактата и ацетата и для того, чтобы преобразование энергии и углерода способствовали образованию этанола.
Ацетаткиназа представляет собой важный фермент метаболического каскада утилизации целлюлозы с образованием ацетата в Clostridium thermocellum, который кодируется геном ack. Инактивация гена ack может стать препятствием для образования ацетаткиназы, что ведет к снижению или устранению ацетата.
Лактатдегидрогеназа представляет собой важный фермент метаболического каскада утилизации целлюлозы с образованием лактата в Clostridium thermocellum, который кодируется геном ldh. Инактивация гена ldh может стать препятствием для образования лактатдегидрогеназы, что ведет к снижению или устранению образования лактата.
Инактивация гена ack в C. thermocellum на основе плазмиды pIKMI
Для нокаута гена ack конструируют вектор на полилинкерах (MCS) плазмиды pIKM1, в которой ген cat, кодирующий хлорамфениколацетилтрансферазу, встроен во фрагмент ДНК размером 3055 п.н., включающий гены ack и pta (кодирующий фосфотрансацетилазу), что ведет к нокауту 476 п.н. гена ack и 399 п.н. гена pta, и образованию фланкирующих областей размером 1025 п.н. и 1048 п.н. на обеих сторонах гена mLs, соответственно (фигура 7). pNW33N содержит репликон pBC1, который выделен из Bacillus coagulans и Staphylococcus aureus, и, согласно ожиданиям, стабильно реплицируется в грамположительных штаммах бактерий, включая Clostridium thermocellum. Последовательность вектора для нокаута ack, сконструированная на плазмиде pIKM1, указана в качестве SEQ ID NO:1.
Инактивация гена ack в C thermocellum на основе репликативной плазмиды pNW33N
Для нокаута гена ack конструируют вектор на полилинкерах (MCS) репликативной плазмиды pNW33N, в которую встроен ген mLs для устойчивости к макролидам, линкозамиду и стрептограмину B (MLSB) во фрагмент ДНК размером 3345 п.н., который включает ген ack, ген pta (кодирующий фосфотрансацетилазу) и неизвестный расположенный выше ген, что ведет к нокауту 855 п.н. гена ack и образованию фланкирующих областей размером 1195 п.н. и 1301 п.н. на каждой стороне гена mLs (фигура 8). pNW33N содержит репликон pBC1, который выделен из Bacillus coagulans и Staphylococcus aureus, и, согласно ожиданиям, стабильно реплицируется в грамположительных штаммах бактерий, включая Clostridium thermocellum. Последовательность вектора для нокаута ack, сконструированная на плазмиде pNW33N, указана в качестве SEQ ID NO:2.
Инактивацния гена ldh в C. thermocellum на основе плазмиды pIKM1
Для нокаута гена ldh конструируют вектор на полилинкерах (MCS) плазмиды pIKM1, в которой ген cat, кодирующий хлорамфениколацетилтрансферазу, встроен во фрагмент ДНК размером 3188 п.н., включающий гены ldh и mdh (кодирующий малатдегидрогеназу), что ведет к нокауту фрагмента ДНК размером 1171 п.н., включающему часть генов ldh и mdh, и образованию фланкирующих областей размером 894 п.н. и 1123 п.н. на обеих сторонах гена mLs, соответственно (фигура 9). Последовательность вектора для нокаута ldh, сконструированная на плазмиде pIKM1, указана в качестве SEQ ID NO:3.
Инактивацния гена ldh в C. thermocellum на основе плазмиды pNW33N
Для нокаута гена ldh конструируют вектор на полилинкерах (MCS) репликативной плазмиды pNW33N, в которую встроен ген mLs для устойчивости к макролидам, линкозамиду и стрептограмину B (MLSB) во фрагмент ДНК размером 2523 п.н., который включает ген ldh и ген mdh (кодирующий малатдегидрогеназу), что ведет к нокауту фрагмента 489 п.н. гена ldh и образованию фланкирующих областей размером 1034 п.н. и 1000 п.н. на каждой стороне гена mLs (фигура 10). pNW33N содержит репликон pBC1, который выделен из Bacillus coagulans и Staphylococcus aureus, и согласно ожиданиям, стабильно реплицируется в грамположительных штаммах бактерий, включая Clostridium thermocellum. Последовательность вектора для нокаута ldh, сконструированного на плазмиде pNW33N, указана в качестве SEQ ID NO:4.
Инактивацния гена ldh в Clostridium thermocellum на основе плазмиды pUC 19
Для нокаута гена ldh конструируют вектор на полилинкерах (MCS) плазмиды pUC19, в которой ген, кодирующий хлорамфениколацетилтрансферазу (ген cat) встроен во фрагмент гена ldh размером 717 п.н., что ведет к фланкирующей области размером 245 п.н. и 255 п.н. на каждой стороне гена cat (фигура 11). pUC19 представляет собой плазмидный вектор E. coli, содержащий ориджин pMB1, который не может амплифицироваться в грамположительных штаммах бактерий, включая Clostridium thermocellum. Можно конструировать сходный вектор, в котором ген mLs фланкируется фрагментами гена ldh. Последовательность вектора для нокаута ldh, сконструированного на плазмиде pUC19, указана в качестве SEQ ID NO:5.
Экспрессия ксилозоизомеразы и ксилулозокиназы в C. thermocellum и C. straminisolvens (предсказывающий пример)
Для экспрессии ксилозоизомеразы и ксилулозокиназы в C. thermocellum гены ксилозоизомеразы и ксилулозокиназы клонировали из T. saccharolyticum и помещали под контроль промотора gapDH C. thermocellum. Эту кассету помещали в соответствующую репликативную плазмиду C. thermocellum на основе остова pNW33N, с получением pMU340 (фиг. 35) SEQ ID NO:74. При переносе в C. thermocellum полученную трансформацию можно анализировать в отношении способности расти на ксилозе. Аналогичные конструкции можно создавать с использованием генов ксилозоизомеразы и ксилулозокиназы C. kristajanssonii. Эти конструкции также можно тестировать в отношении функциональности в C. straminsolvens.
Экспрессия пируватдекарбоксилазы и алкогольдегидрогеназы в C. thermocellum и C. straminisolvens (предсказывающий пример)
Для экспрессии пируватдекарбоксилазы и алкогольдегидрогеназы в C. thermocellum гены пируватдекарбоксилазы клонируют из источников Z mobilis и Z palmae и ген алкогольдегидрогеназы клонируют из источника Z mobilis. Эти гены (pdc и adh) будут экспрессироваться в качестве оперона с промотора pta-ack C. thermocellum. Эта кассета находится в репликативной плазмиде C. thermocellum на основе остова pNW33N (фигуры 36 и 37), SEQ ID NO:75 и 76. При переносе в C. thermocellum полученные трансформанты можно подвергать скринингу в отношении повышенной продукции этанола и/или продукции альдегида для определения функциональности экспрессированных ферментов. Эти конструкции также будут тестировать в отношении функциональности в C. straminsolvens.
ПРИМЕР 5
Ферментация Avicel® с использованием C. straminisolvens
C. straminisolvens использовали для ферментации 1% Avicel® в бутылях с сывороткой, содержащих среду CTFUD. Профиль концентрации продукта и соотношения представлены на фигуре 27. Приблизительно 2 г/л общих продуктов получали в 3 d с этанолом, составляющим приблизительно 50% от общих продуктов. На фигуре 27 представлены профили концентрации продукта для 1% Avicel® с использованием C. straminisolvens. Соотношение этанола и ацетата представлено в качестве E/A, и соотношение этанола и общих продуктов представлено в качестве E/T.
ПРИМЕР 6
Сконструированные интроны группы II для мезофильных и термофильных целлюлолитических, ксиланолитических организмов
Подвижные интроны группы II, встречающиеся во многих бактериальных геномах, представляют собой как каталитические РНК, так и подвергаемые ретротранспозиции элементы. В них используется механизм подвижности, известный как ретротранспозиция, в котором вырезанная РНК интрона подвергается обратному сплайсингу прямо в участок-мишень ДНК, а затем подвергается обратной транскрипции посредством кодируемого интроном белка. Подвижный интрон группы II L1.LtrB Lactococcus lactis разработан в качестве генетических инструментов, известных как векторы TargetronTM, которые коммерчески доступны от Sigma Aldritch (каталожный номер # TA0100). Этот продукт и его применение являются объектами одного или нескольких из патентов США N 5698421, 5804418, 5869634, 6027895, 6001608 и 6306596 и/или других рассматриваемых патентных заявок США и других стран, контролируемых InGex, LLC.
Кассеты Targetrons (фигуры 28 и 29), которые содержат все необходимые последовательности для ретротранспозиции, можно субклонировать в векторы, способные реплицироваться в мезофильных или термофильных целлюллолитических организмах. Кассету Targetron можно модифицировать заменой промотора lac специфичными для хозяина или видоспецифическими конститутивными или индуцибельными промоторами. Кассеты можно далее модифицировать посредством сайт-направленного мутагенеза нативных последовательностей для распознавания, так чтобы интрон группы II перенацеливался на встраивание в представляющие интерес гены, осуществляя генетические нокауты. Например, интрон группы II можно переконструировать для нокаута лактатдегидрогеназы или ацетаткиназы в любом мезофильном или термофильном целлюлолитическом организме. В таблице 4 представлен пример расположения вставки и праймеров для перенацеливания интрона на ацетаткиназу C. cellulolyticum (SEQ ID NO:21). В таблице 5 представлен пример расположения вставки и праймеры для перенацеливания интрона на лактатдегидрогеназу C. cellulolyticum (SEQ ID NO:21).
Пример вектора для перенацеливания интрона L1.Ltrb на вставку в ген ack C. cell. (SEQ ID NO:21) представлен на фигуре 28. Последовательность вектора pMU367 (вектор KO ацетаткиназы C. cell.) представляет собой SEQ ID NO:30.
Пример вектора для перенацеливания интрона L1.Ltrb на вставку в ген LDH2744 C. cell. (SEQ ID NO:23) представлен на фигуре 29. Последовательность вектора pMU367 (вектор KO лактатдегидрогеназы C. cell.) представляет собой SEQ ID NO:31.
ПРИМЕР 7
Трансформация штаммов Thermoanaerobacter и Thermoanaerobacterium (предсказывающий пример)
Thermoanaerobacter pseudoethanoHcus 39E, Thermoanaerobacterium saccharolyticum JW/SL-YS485, Thermoanaerobacterium saccharolyticum B6A-RI и Thermoanaerobacter sp. штамм 59 можно трансформировать с помощью следующего протокола. Клетки выращивают при 55°С в 40 мл среды DSMZ M122 (http://www.dsmz.de/microorganisms/media_list.php) со следующими модификациями: 5 г/л целлобиозы вместо целлюлозы, 1,8 г/л K2HPO4, отсутствие глутатиона, и 0,5 г/л L-цистеин-HCl до оптической плотности от 0,6 до 0,8. Затем клетки собирают и промывают два раза 40 мл 0,2 M целлобиозы при комнатной температуре. Клетки ресуспендируют в 0,2 M целлобиозе в аликвотах 100 мкл и добавляют от 0,1 до 1 мкг плазмидной ДНК в образец в кювету для электропорацией с шириной окна 1 мм. Применяют экспоненциальный импульс (Bio-Rad Instruments) 1,8 кВ, 25 мкФ, 200 Ом, ~3-6 мс для кюветы и клетки разбавляют в 100-200 раз в свежей M122 и инкубируют в течение 12-16 часов при 55°C. Затем выделенные клетки разбавляют в 25-100 раз в чашках Петри свежей содержащей агар средой, содержащей средство для селекции, такое как 200 мкг/мл канамицина. После затвердевания среды планшеты инкубируют при 55°C в течение 24-72 часов для образования колоний. Колонии можно тестировать с помощью ПЦР в отношении признаков сайт-специфической рекомбинации.
ПРИМЕР 8
Характеристики ферментации полученных способами инженерии штаммов Thermoanaerobacter и Thermoanaerobacterium
В таблице 6 представлены характеристики ферментации полученных способами инженерии штаммов Thermoanaerobacter и Thermoanaerobacterium. Культуры выращивали в течение 24 часов в M122 при 55°С без встряхивания. В таблице 6 используют следующие сокращения 6: целлобиоза (CB), глюкоза (G), молочная кислота (LA), уксусная кислота (AA) и этанол (Etoh). Значения приведены в граммах на литр. YS485 - Thermoanaerobacterium saccharolyticum JW/SL-YS485, B6A-RI-Thermoanaerobacterium saccharolyticum B6A-RI, 39E-Thermoanaerobacter pseudoethanolicus 39E.
ПРИМЕР 9
Конструкция для получения способами инженерии целлюлолитических и ксиланолитических штаммов - пример технологии антисмысловых РНК
Репликативная плазмида (фигура 38), имеющая кассету антисмысловой РНК, нацеленную на ген C. thermocellum, кодирующий лактатдегидрогеназу (Cthe_1053),переносили в C. thermocellum 1313 электропорацией и селекцией на тиамфениколе. Эффективность трансформации, наблюдаемая для этой плазмиды, был равна эффективности трансформации исходного вектора pMU102. Последовательность плазмиды представлена в SEQ ID NO:61. Кассета asRNA представлена на фигуре 38 и она устроена следующим образом: (i) целая кассета размером 1827 п.н. клонирована в полилинкер pMU102 в ориентации, представленной на фигуре 38, (ii) нативная промоторная область содержится в пределах первых 600 п.н. кассеты, (iii) первые 877 п.н. открытой рамки считывания ldh являются слитыми с нативным промотором в антисмысловой ориентации, (iv) приблизительно 300 дополнительных п.н. включены ниже области asRNA ldh.
Полученные устойчивые к тиамфениколу колонии подвергали скринингу в отношении измененного образования конечного продукта выращиванием стационарных культур на среде M122C в присутствии 6 мкг/мл тиамфеникола (для поддержания плазмиды), как представлено на фигуре 39. Предварительный скрининг 9 случайным образом отобранных устойчивых к тиамфениколу трансформантов показал, что 4 обладали низкими уровнями продукции лактата относительно дикого типа. Кроме того, конструкция, обладающая антисмысловой РНК, направленной на оба гена ldh, подлежит конструированию для частичного, существенного или полного удаления, подавления, инактивации или супрессии обоих генов одновременно.
ПРИМЕР 10
SEQ ID NO:44, 45 и 46 представляют собой гены пируватформиатлиазы (формиатацетилтрансфераза aka, EC. 2.3.1.54, pfl) из Thermoanaerobacterium saccharolyticum YS485, Clostridium thermocellum ATCC 27405 и Clostridium phytofermentans. Pfl катализирует преобразование пирувата в ацетил-CoA и формиат (фигура 34). Делеция pfl приводит к устранению продукции формиата и может привести к снижению выхода уксусной кислоты в некоторых термофильных штаммах с повышением в результате выхода этанола.
В SEQ ID NO:47-52, представленные на фигурах 40-45, представлены плазмиды с нокаутом pfl, по две для каждого из трех организмов, приведенных выше. Каждый организм имеет плазмиду для однократного кроссинговера и двойного кроссинговера, сконструированную для частичного, существенного или полного удаления, подавления, инактивации или супрессии фермента pfl. Плазмиды для однократного кроссинговера конструируют с одной последовательностью ДНК (от 400 п.н. до 1000 п.н.), гомологичной внутреннему участку гена pfl, плазмиды для двойного кроссинговера конструируют с двумя последовательностями ДНК (от 400 до 1000 п.н.), гомологичными участкам выше (5') и ниже (3') гена pfl. Все плазмиды конструируют, чтобы в них использовались наиболее доступные маркеры антибиотиков для селекции данного организма. Плазмиды можно поддерживать в E. coli и конструировать с помощью компании по договору, синтезирующей ДНК, такой как Codon Devices или ДНК 2.0.
ВКЛЮЧЕНИЕ В КАЧЕСТВЕ ССЫЛОК
Все патенты США и опубликованные патентные заявки США, цитированные в настоящем документе, включены в настоящий документ в качестве ссылок в полном объеме.
ЭКВИВАЛЕНТЫ
Специалистам в данной области понятно, или они способны узнать с использованием не более чем общепринятого экспериментирования, множество эквивалентов конкретным вариантам осуществления изобретения, описанным в настоящем документе. Подразумевают, что такие эквиваленты охватываются представленной ниже формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| МИКРООРГАНИЗМ, ЭКСПРЕССИРУЮЩИЙ КСИЛОЗОИЗОМЕРАЗУ | 2009 |
|
RU2553537C2 |
| БИОТЕХНОЛОГИЧЕСКАЯ ОПТИМИЗАЦИЯ МИКРООРГАНИЗМОВ | 2020 |
|
RU2832723C2 |
| МИКРООРГАНИЗМЫ ДЛЯ ПОВЫШЕННОГО ПРОДУЦИРОВАНИЯ АМИНОКИСЛОТ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2015 |
|
RU2688486C2 |
| РЕКОМБИНАНТНЫЕ АТТЕНУИРОВАННЫЕ МИКРООРГАНИЗМЫ CLOSTRIDIUM И ВАКЦИНА | 2007 |
|
RU2445364C2 |
| ИСКУССТВЕННАЯ ЦЕЛЛЮЛОСОМА И ЕЕ ПРИМЕНЕНИЕ ДЛЯ ФЕРМЕНТАТИВНОГО РАСЩЕПЛЕНИЯ ЭЛАСТИЧНЫХ СУБСТРАТОВ | 2011 |
|
RU2580047C2 |
| НОВЫЙ МИКРООРГАНИЗМ И СПОСОБ ПОЛУЧЕНИЯ 1,2-ПРОПАНДИОЛА, ОСНОВАННЫЙ НА НАДФН-ЗАВИСИМОЙ АЦЕТОЛРЕДУКТАЗЕ И УЛУЧШЕННОЙ ДОСТАВКЕ НАДФН | 2015 |
|
RU2711870C2 |
| Генетическая модификация продуцирующих (S)-молочную кислоту термофильных бактерий | 2015 |
|
RU2671528C2 |
| Микроорганизм, продуцирующий молочную кислоту, и способ продуцирования молочной кислоты с его использованием | 2016 |
|
RU2711983C2 |
| Микроорганизм, имеющий повышенную продуктивность в отношении молочной кислоты, и способ получения молочной кислоты с использованием данного микроорганизма | 2015 |
|
RU2636467C2 |
| Микроорганизм, продуцирующий O-ацетилгомосерин, и способ получения O-ацетилгомосерина с использованием этого микроорганизма | 2016 |
|
RU2706535C2 |
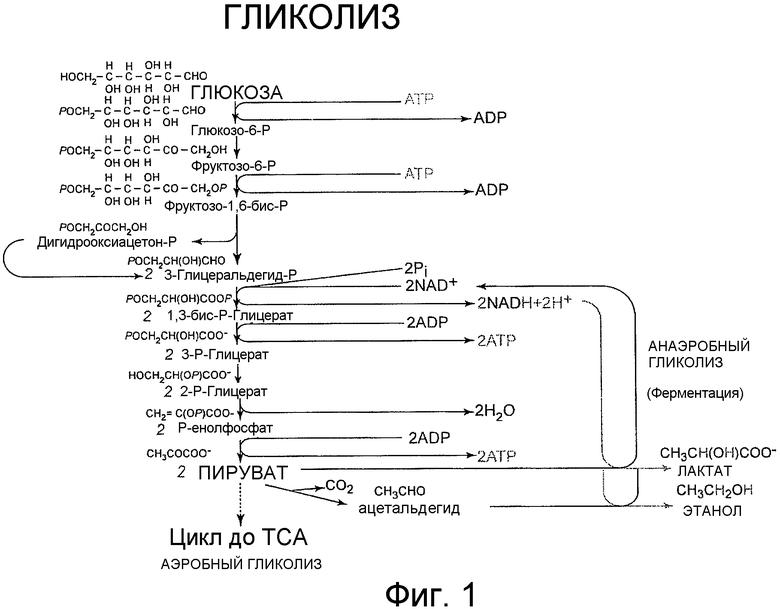
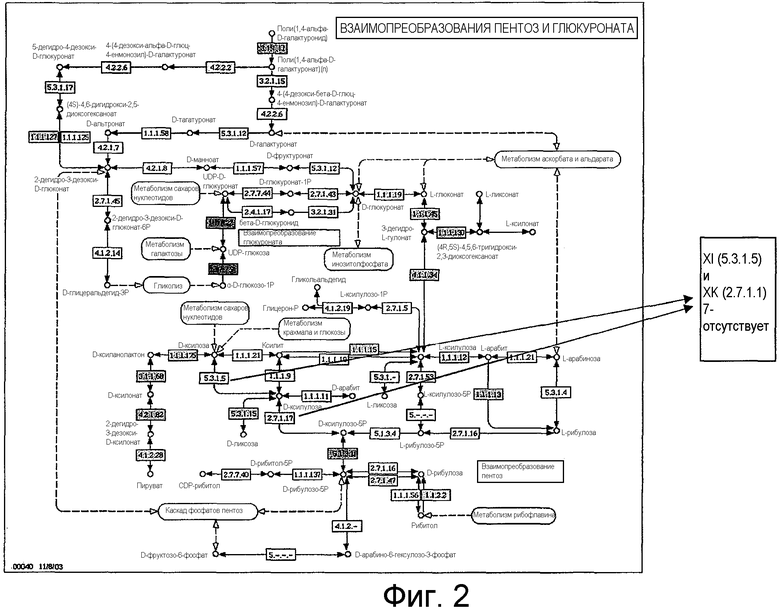
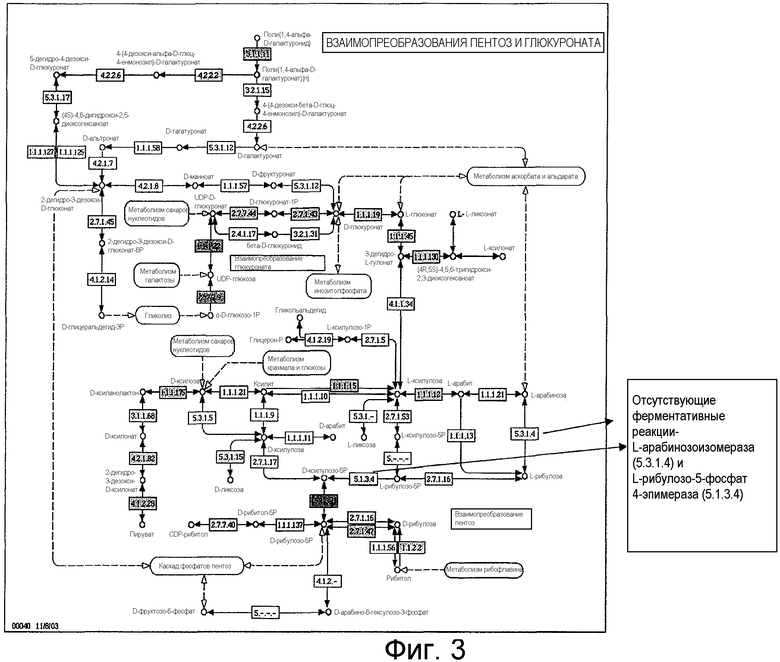
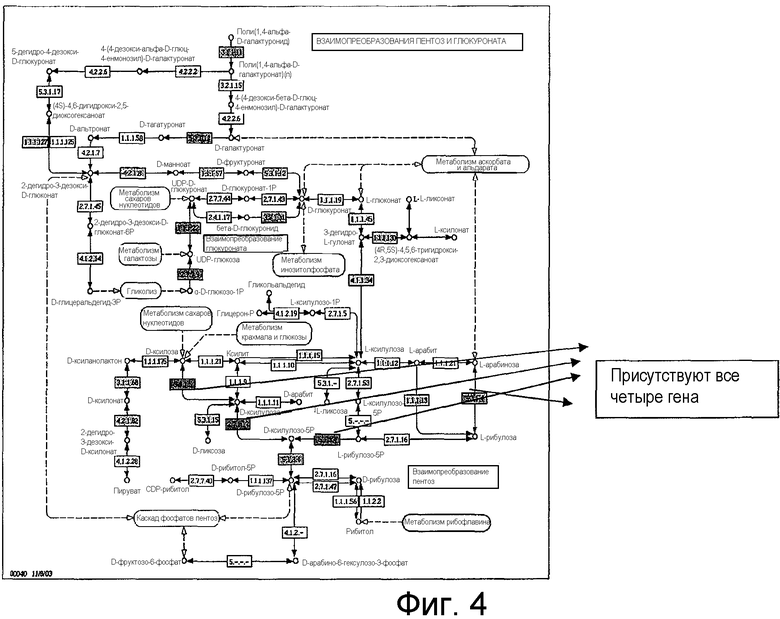
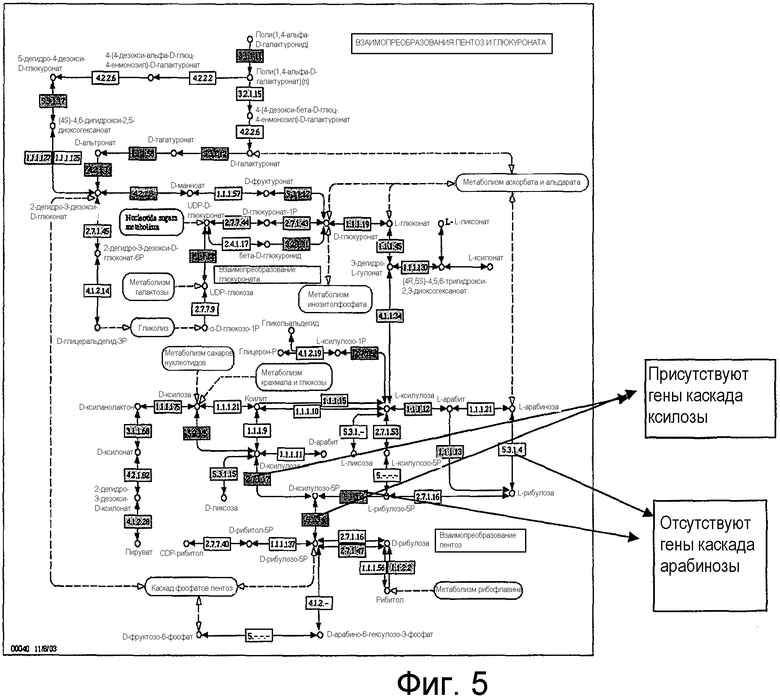


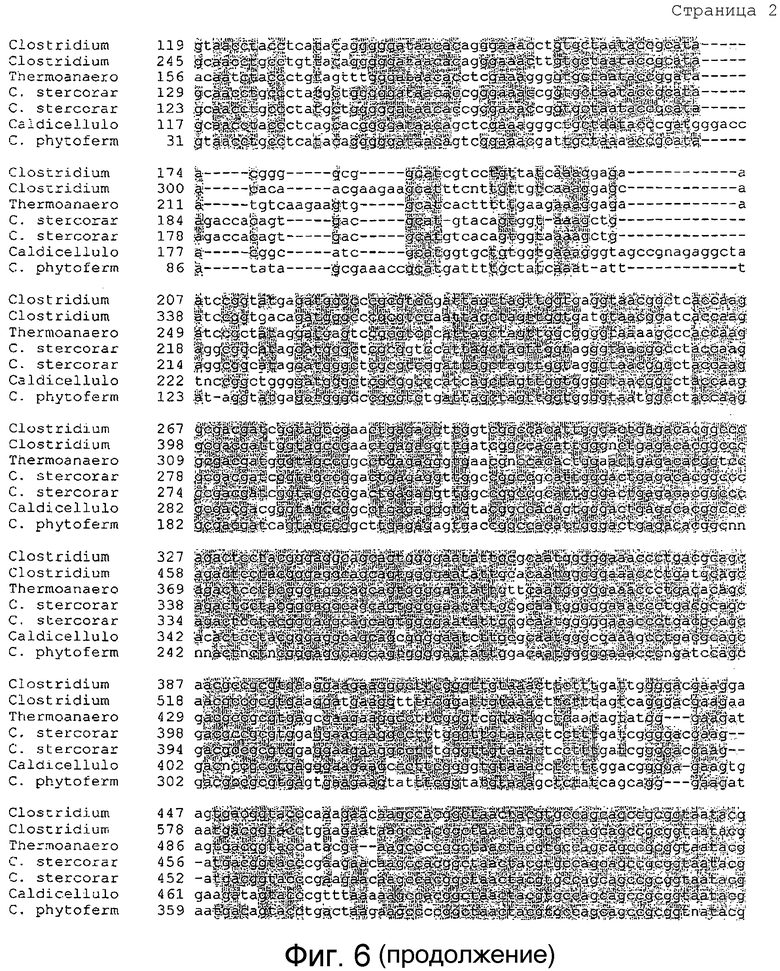
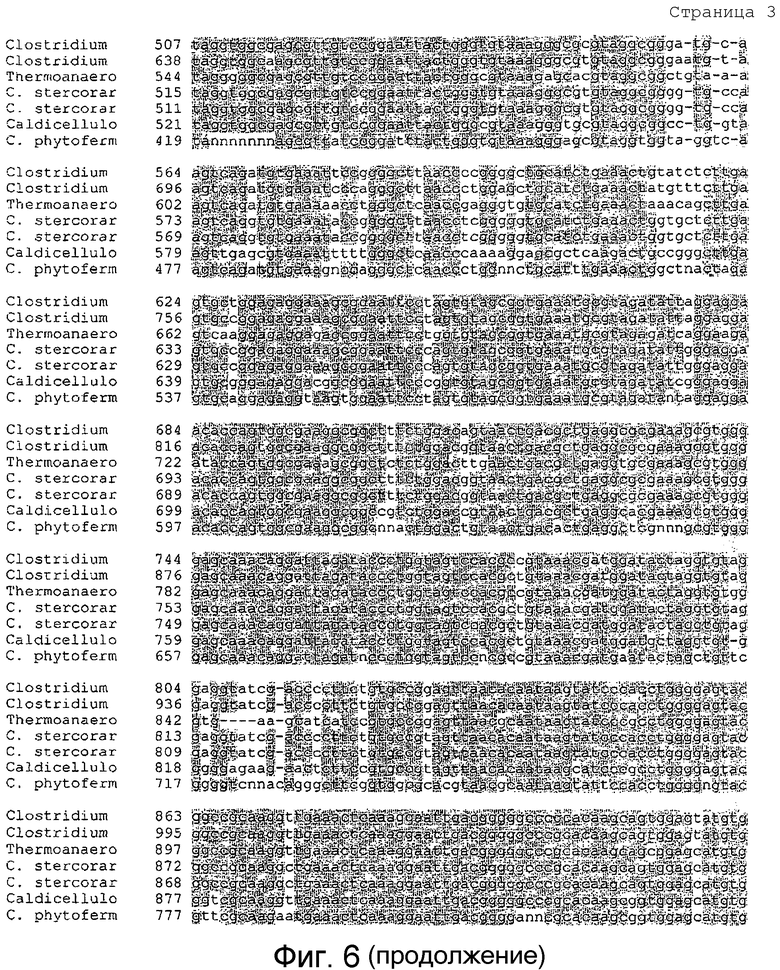
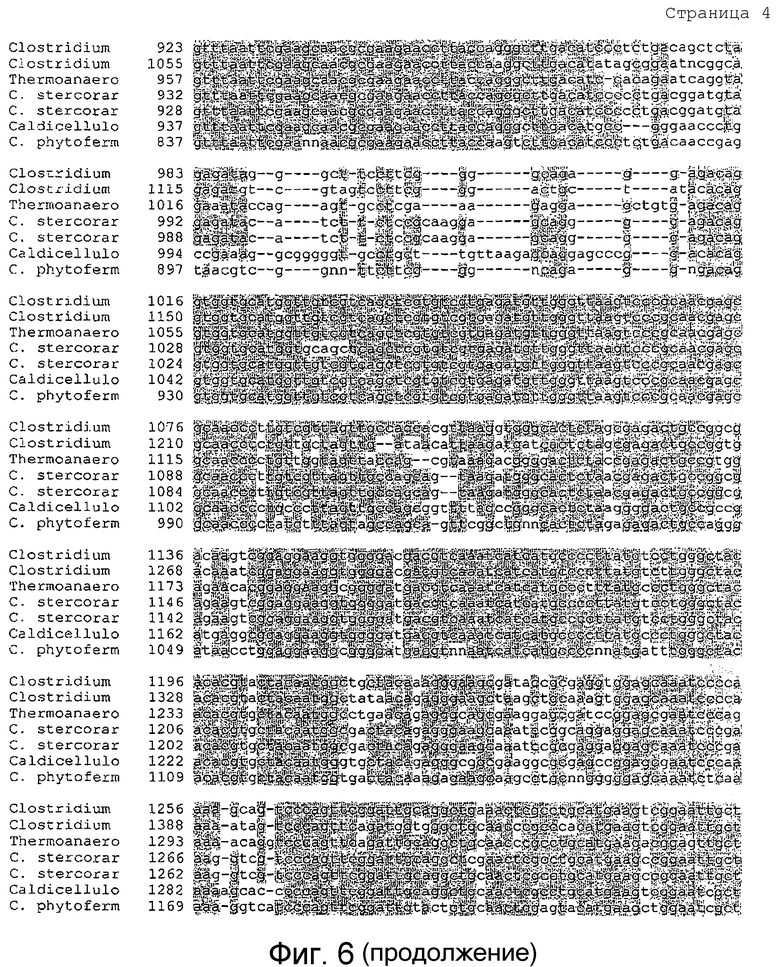

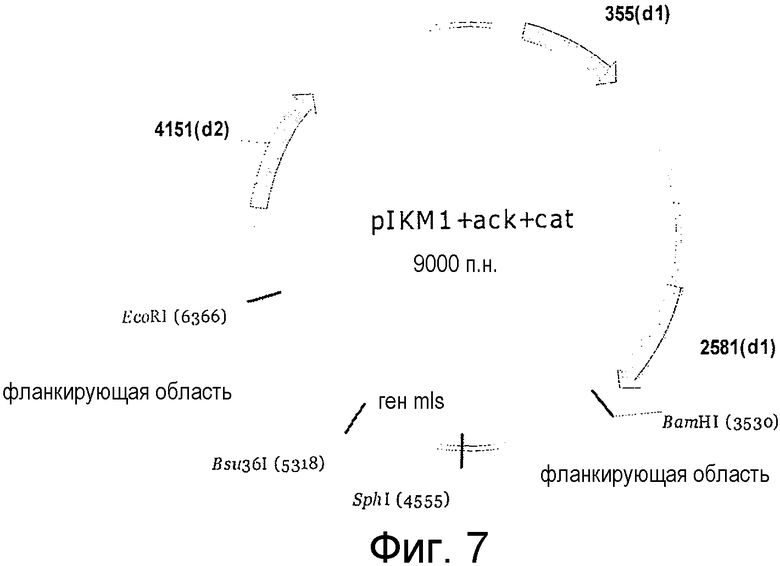
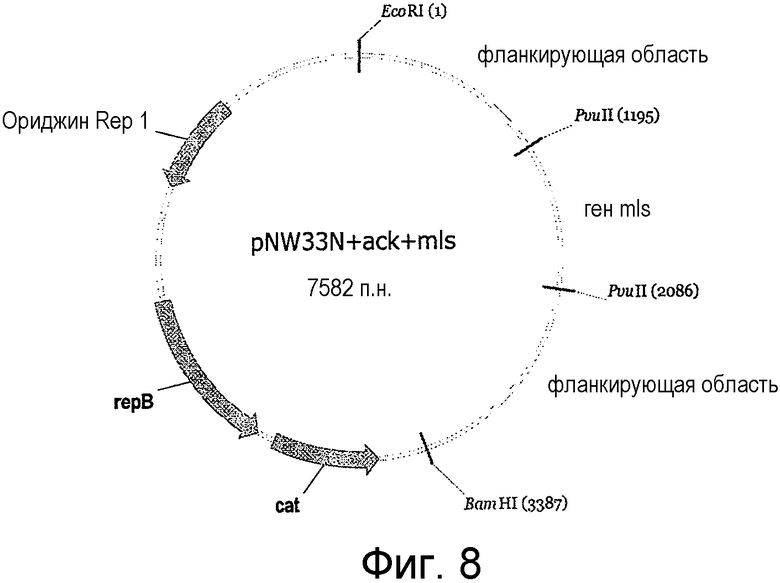
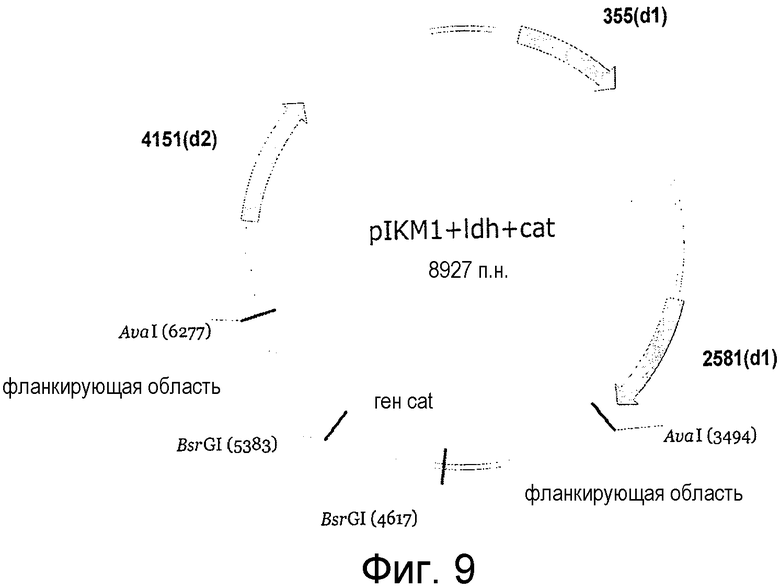
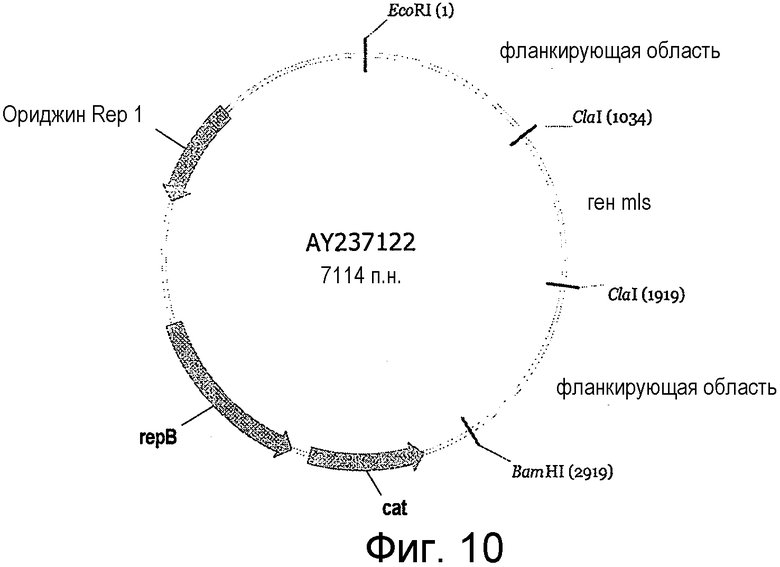
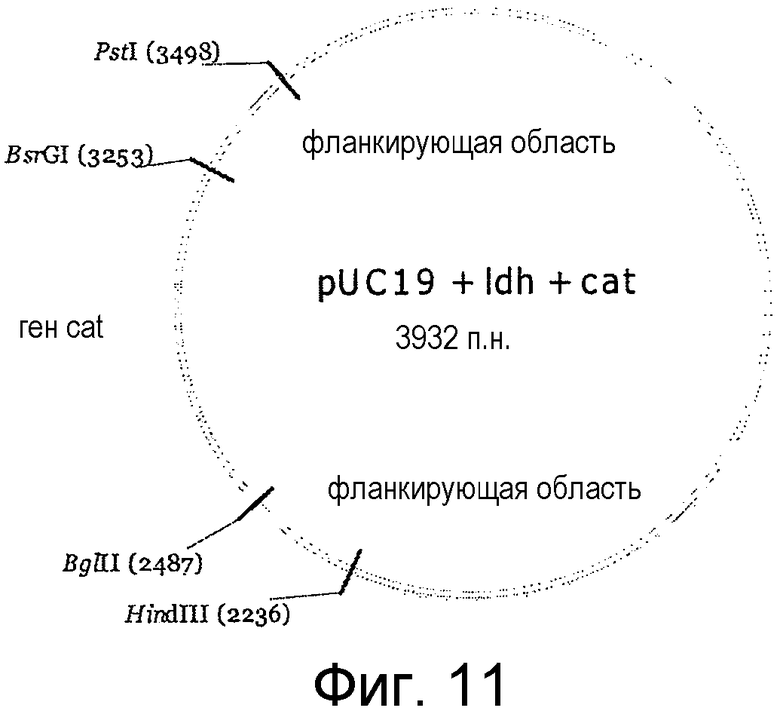
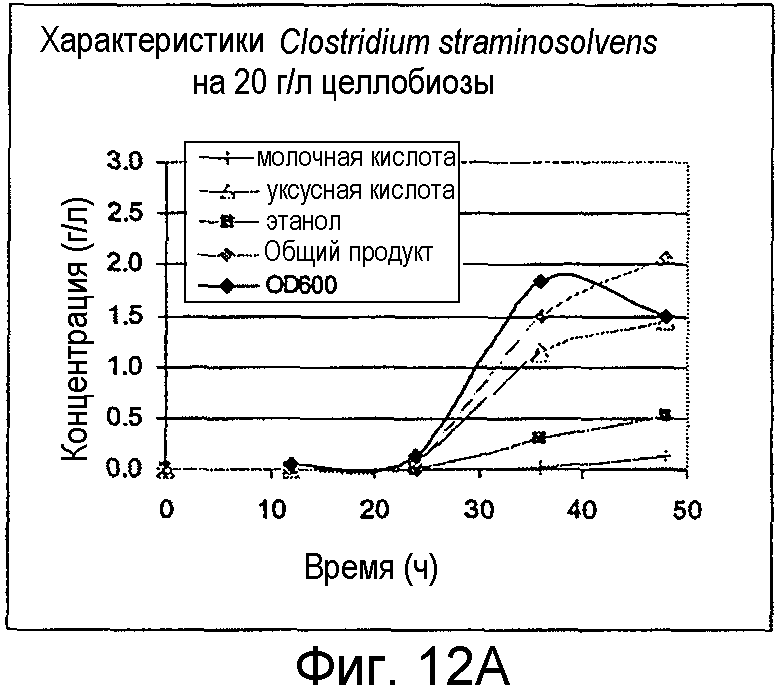
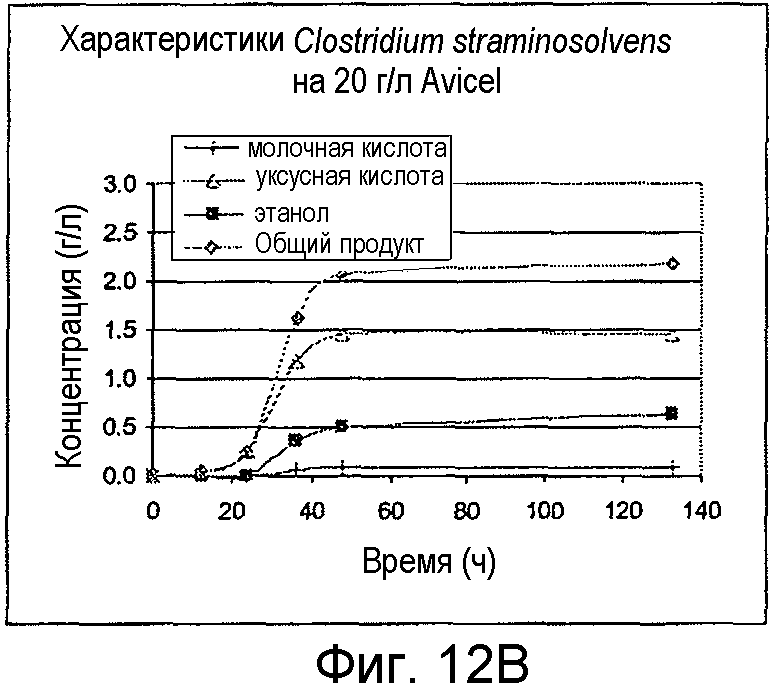
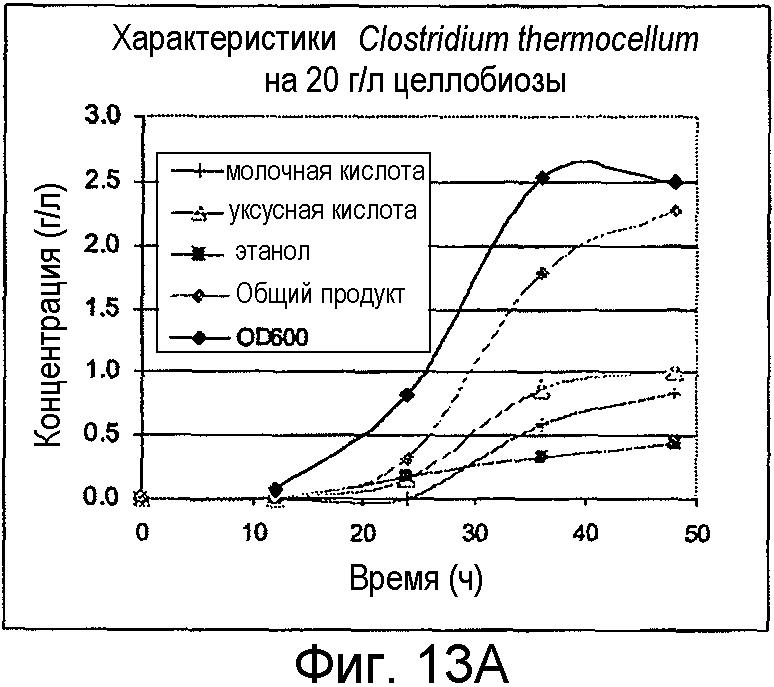
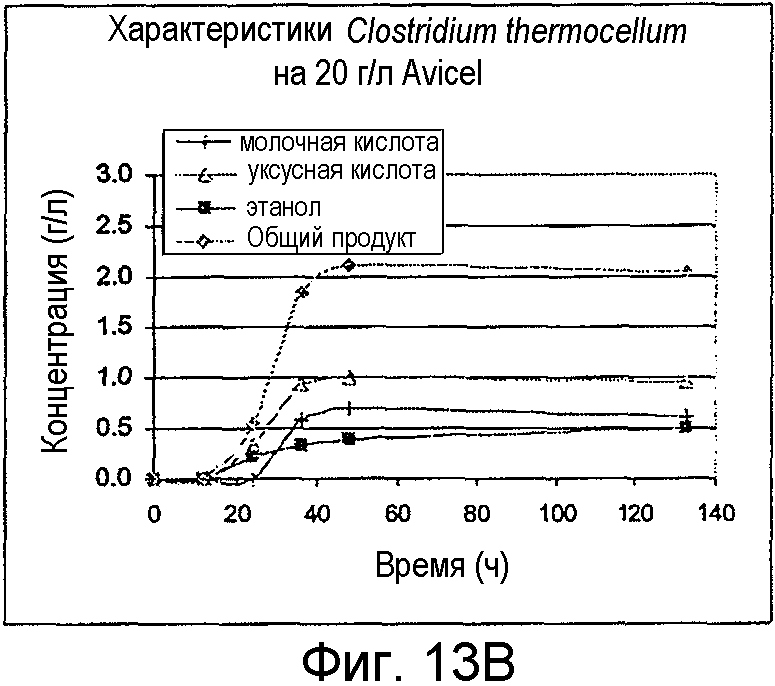
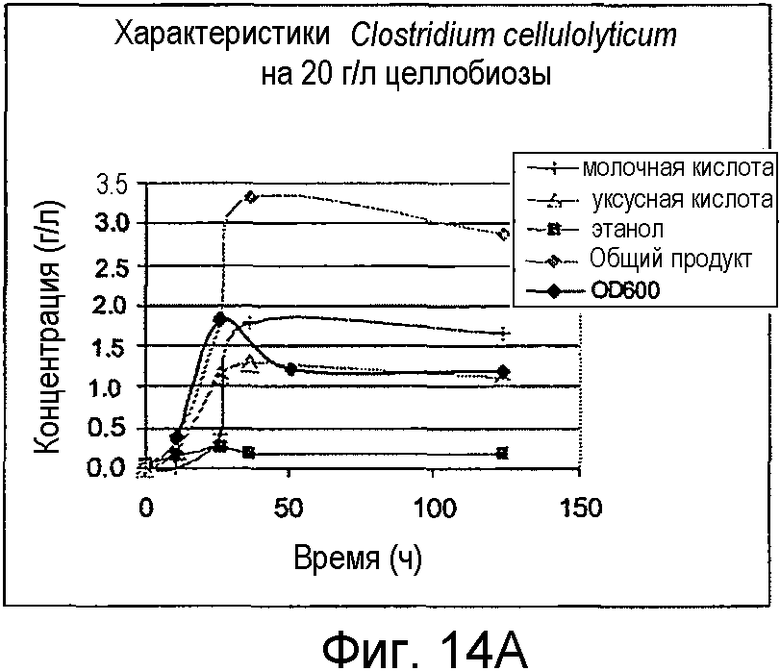
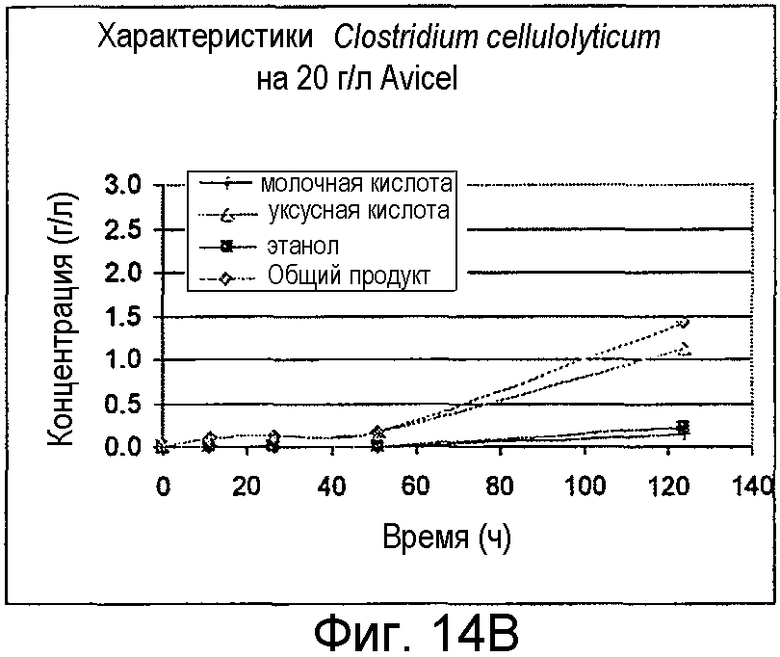
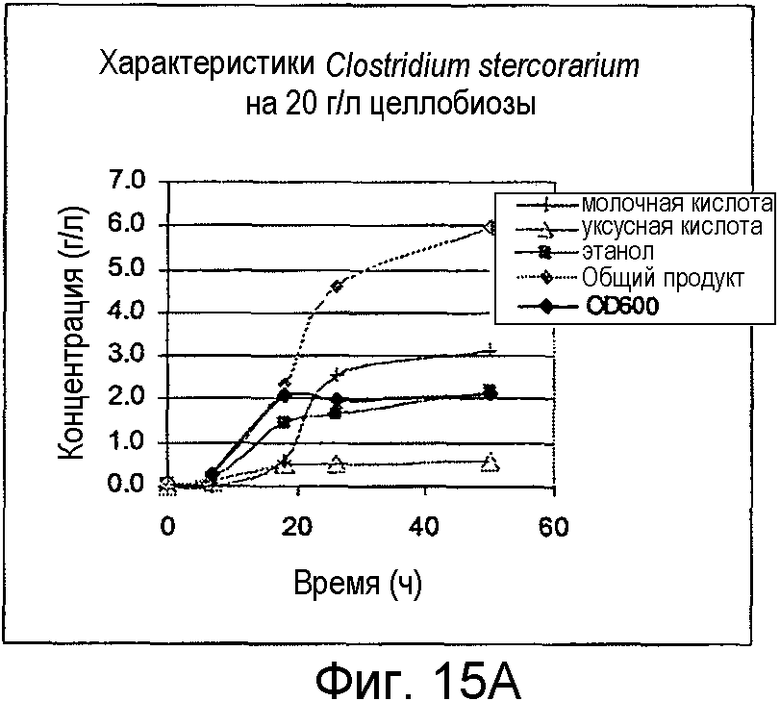
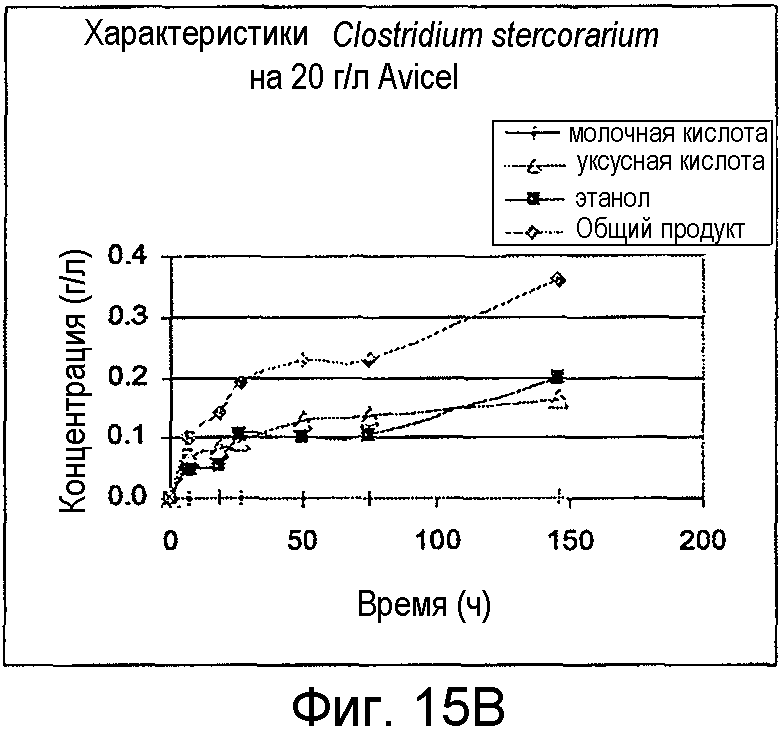
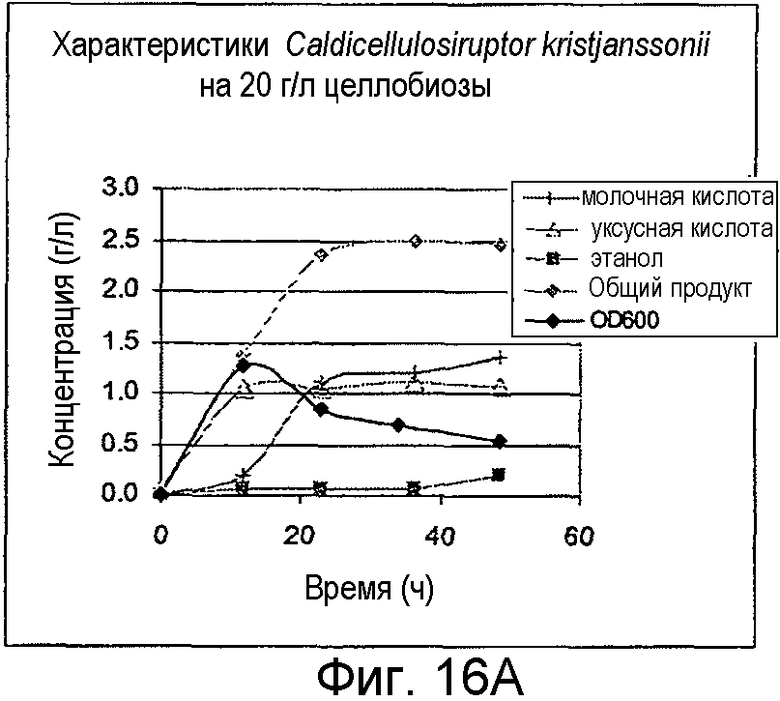
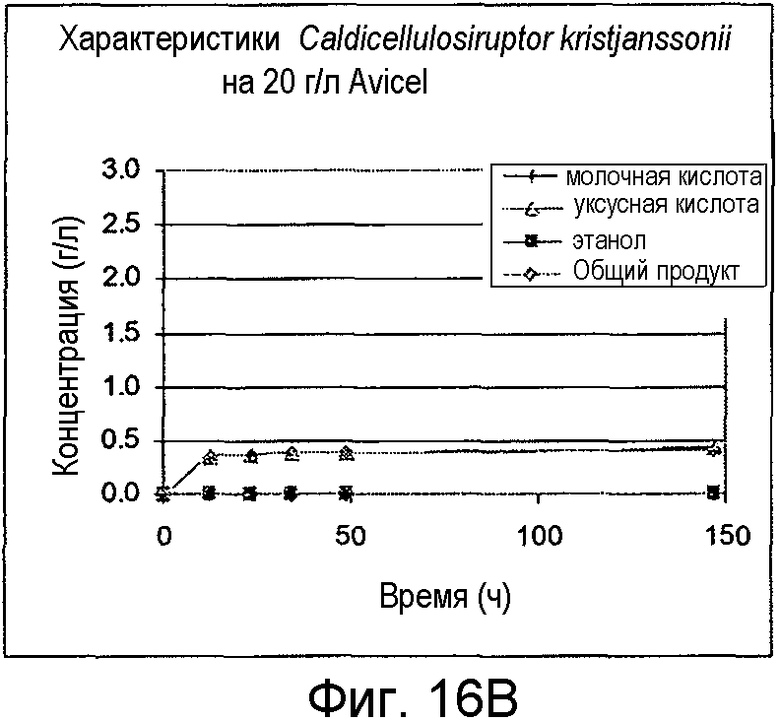
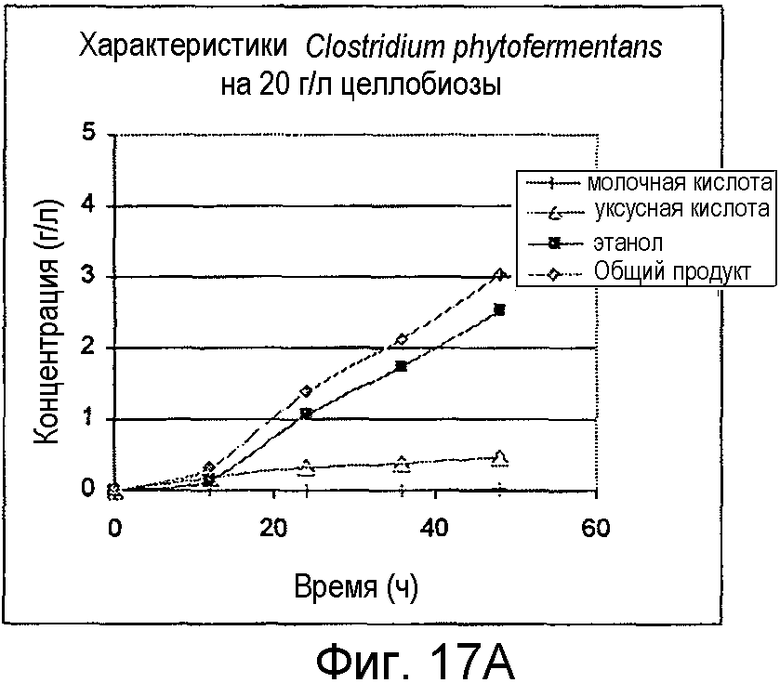
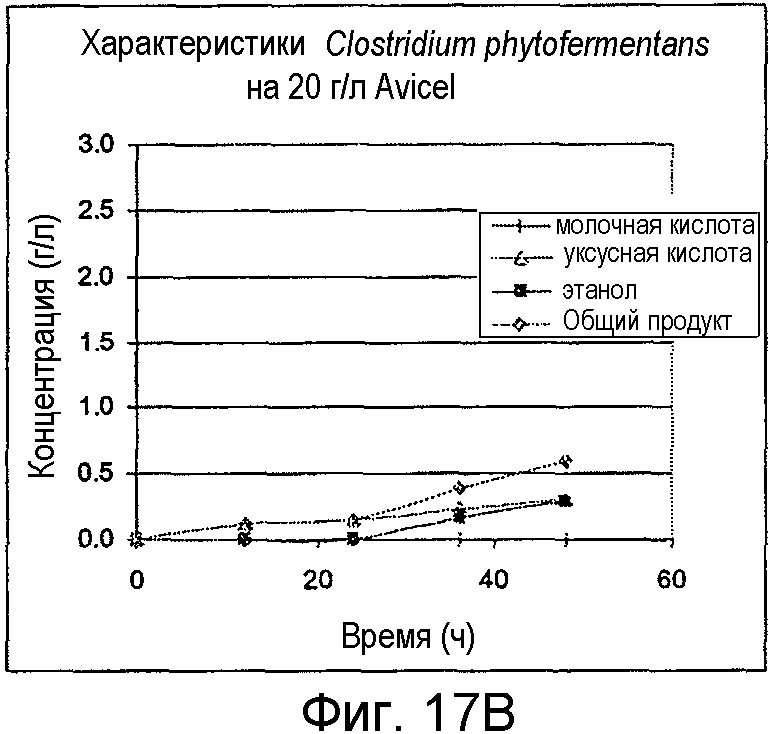
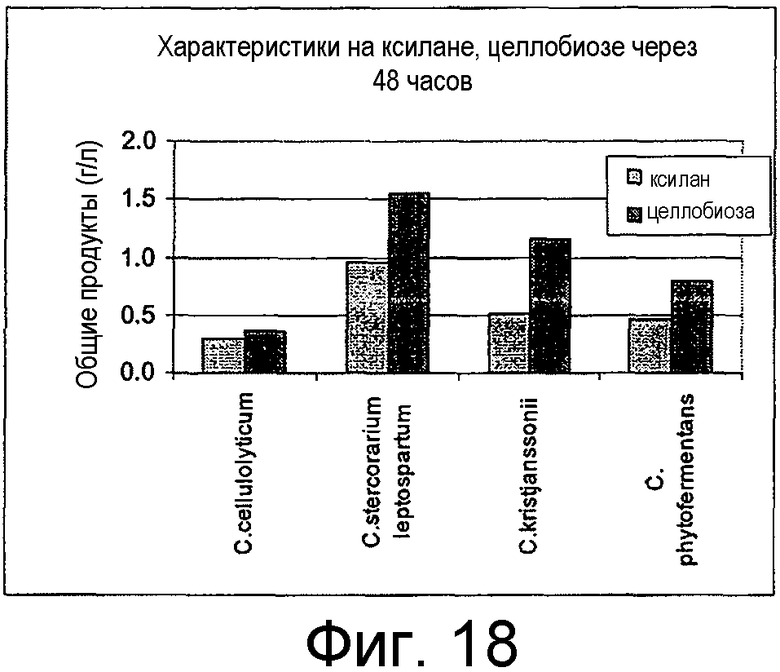
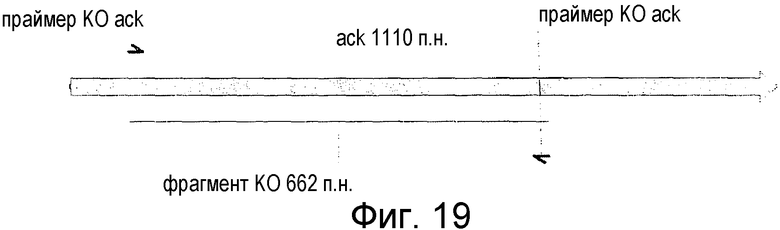
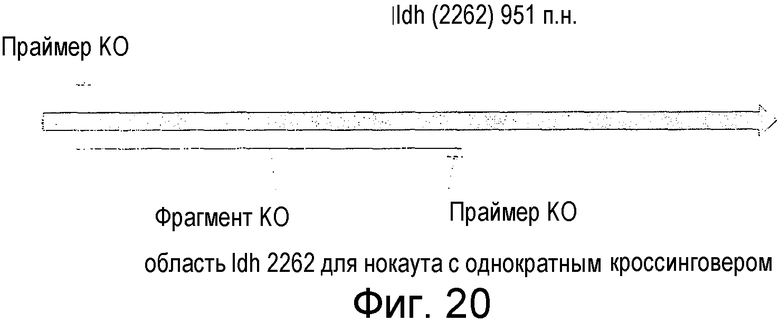
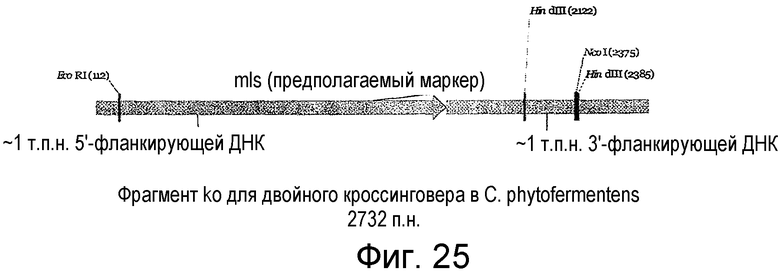
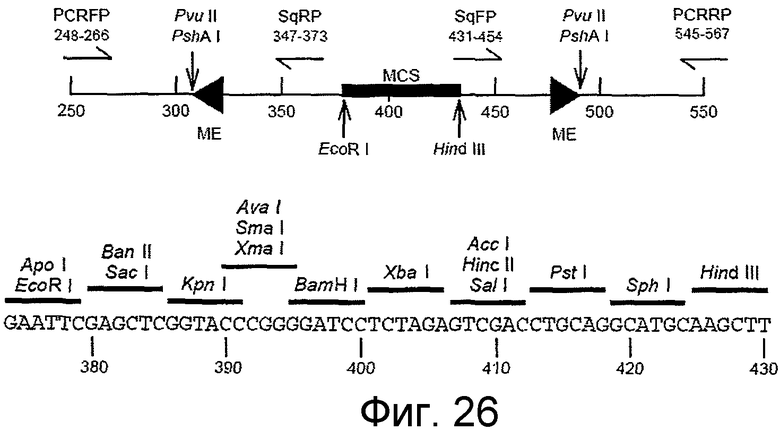
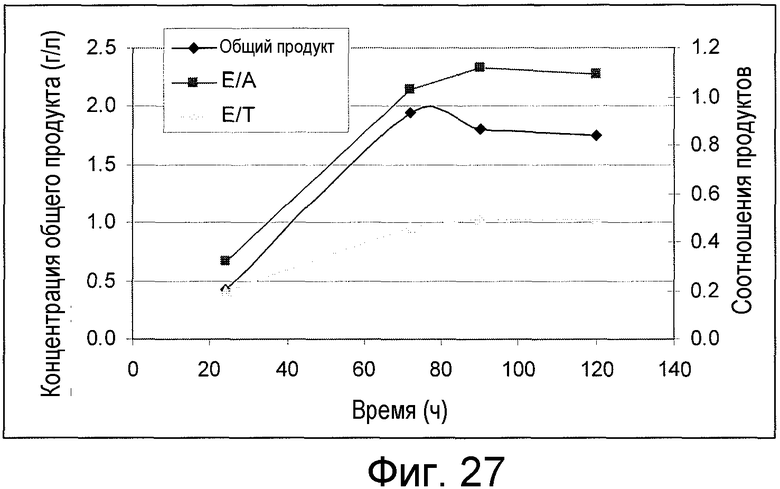
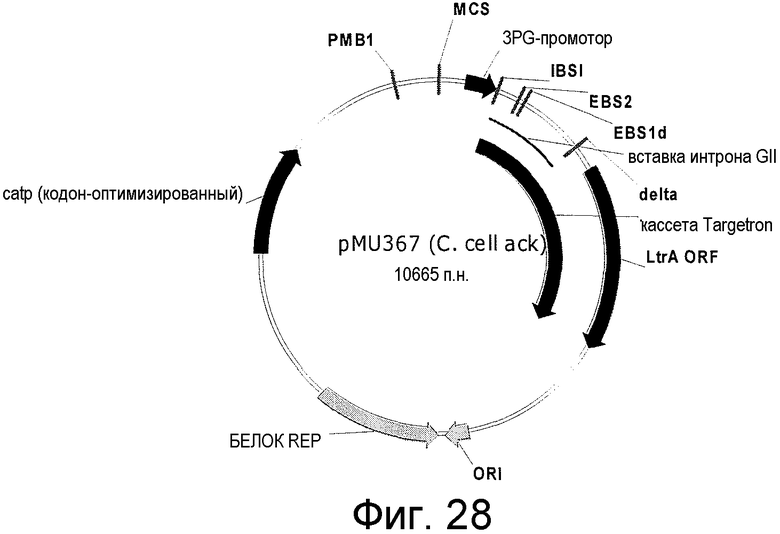
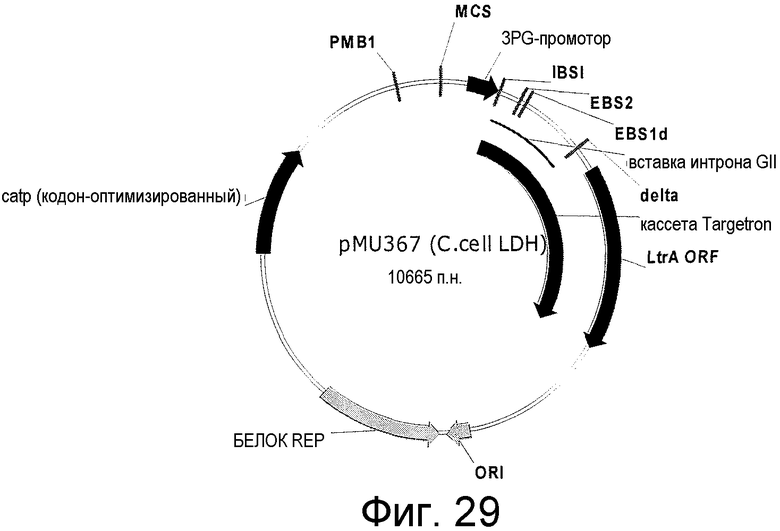




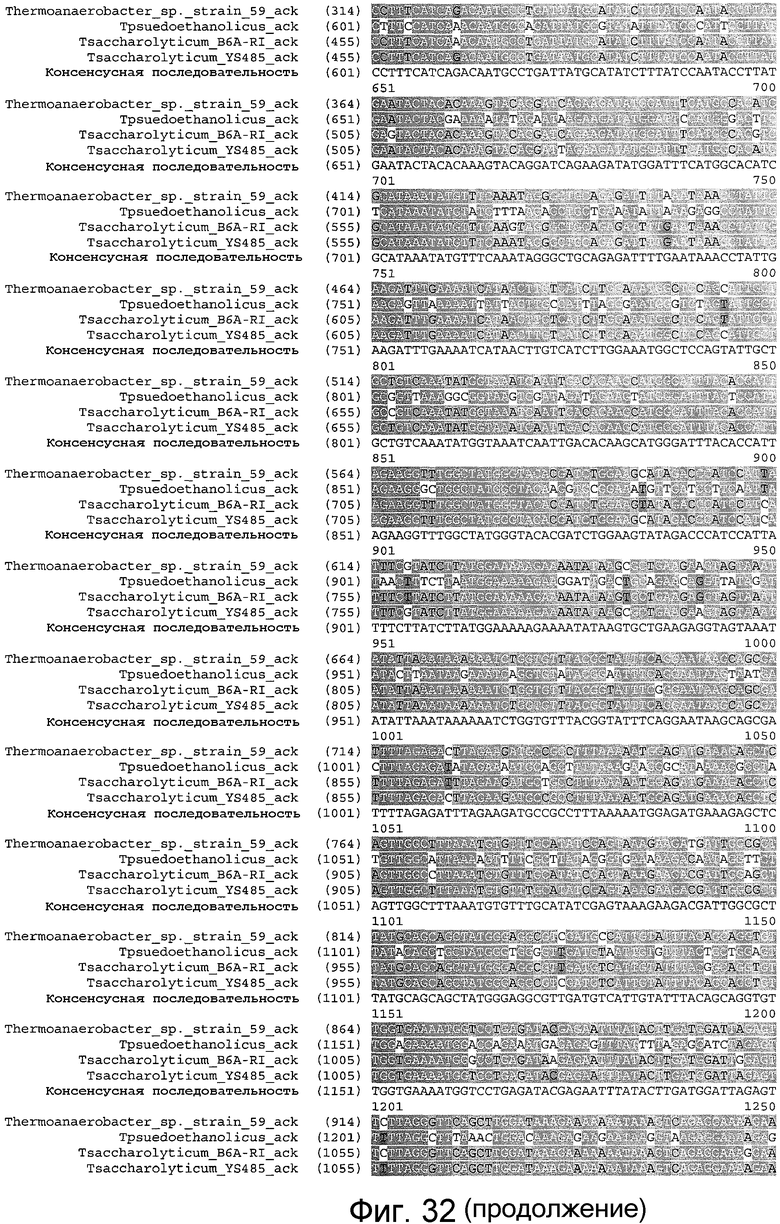

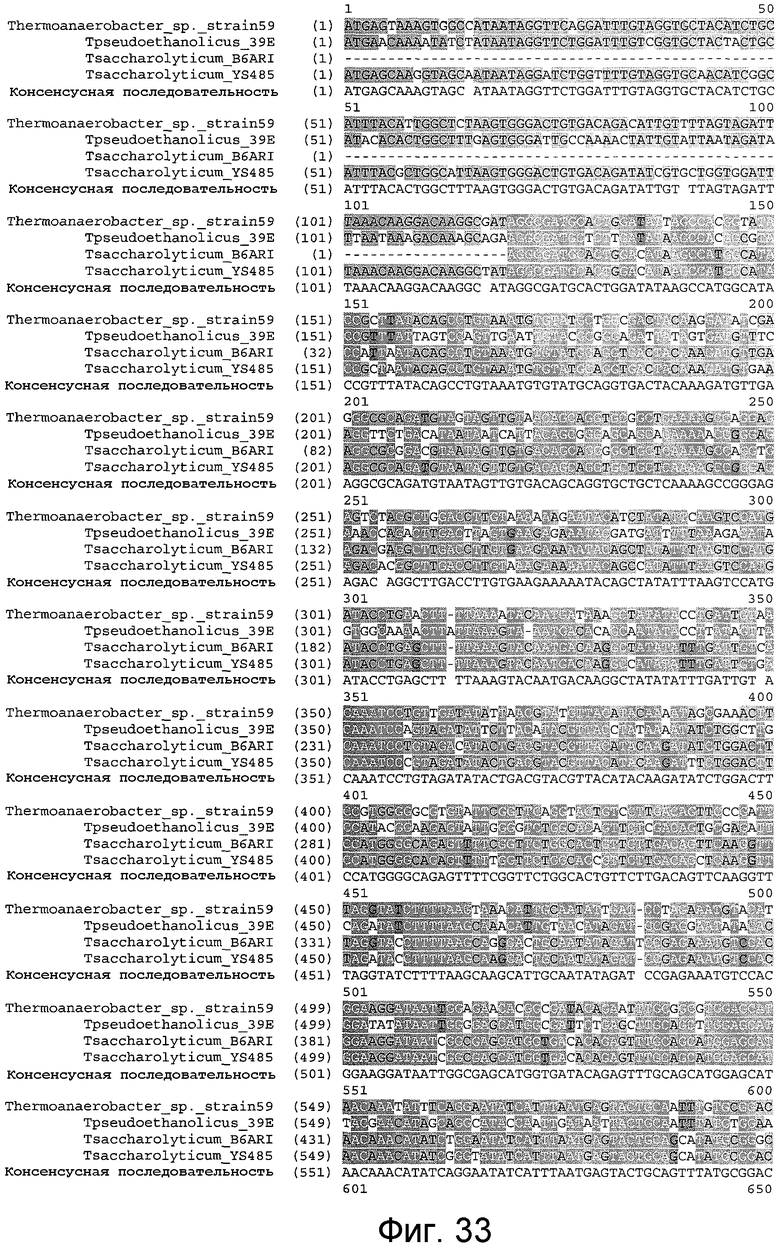

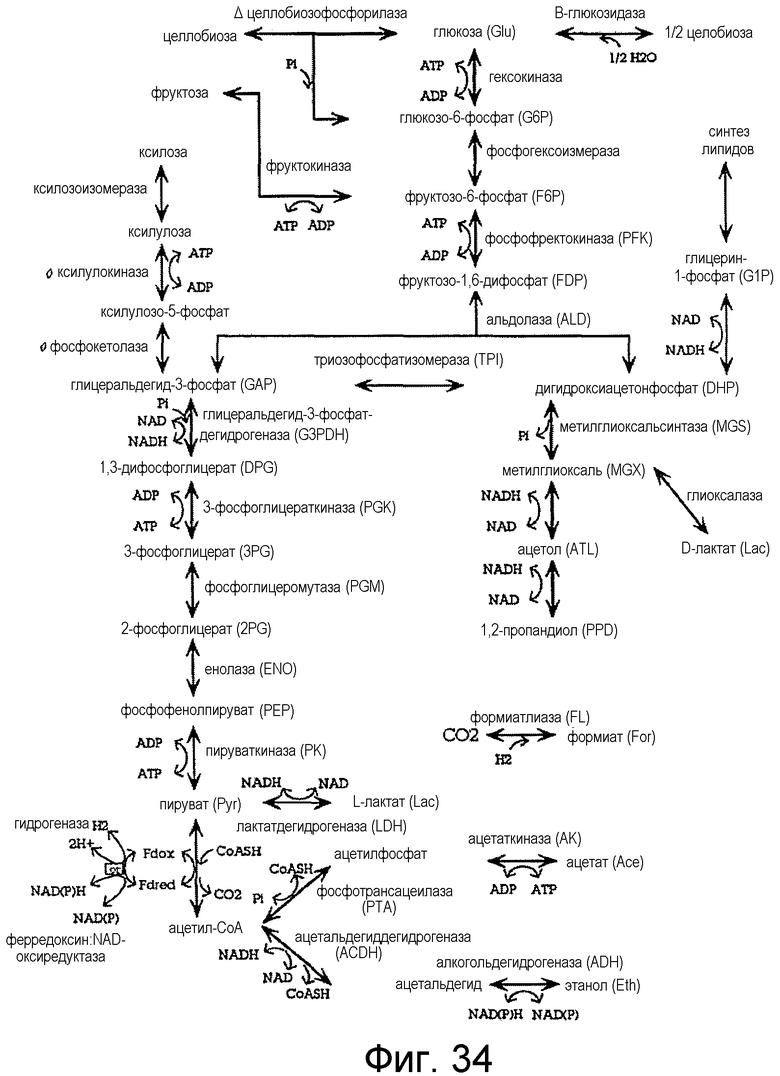
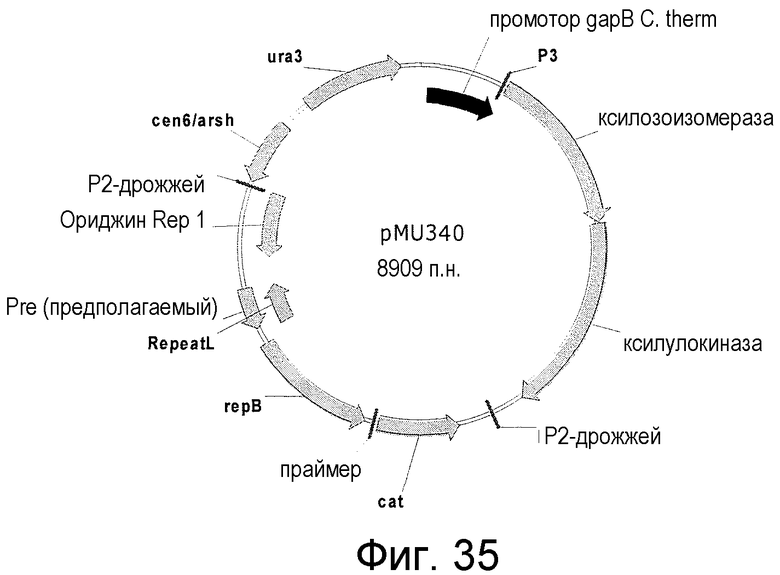
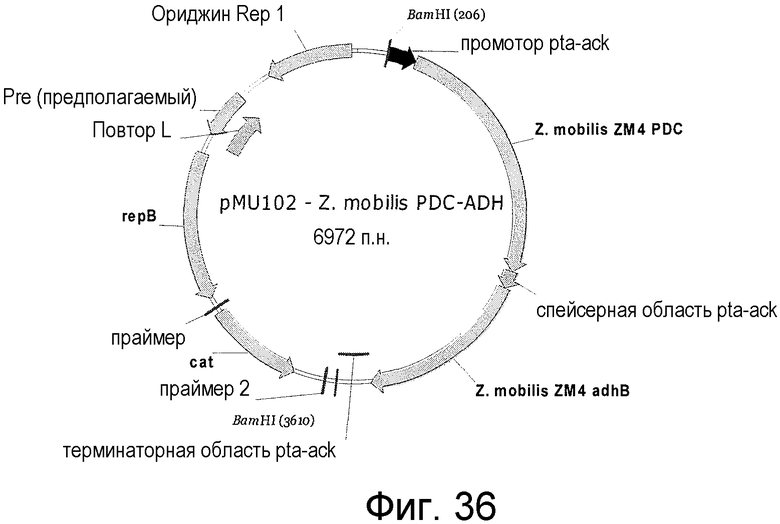
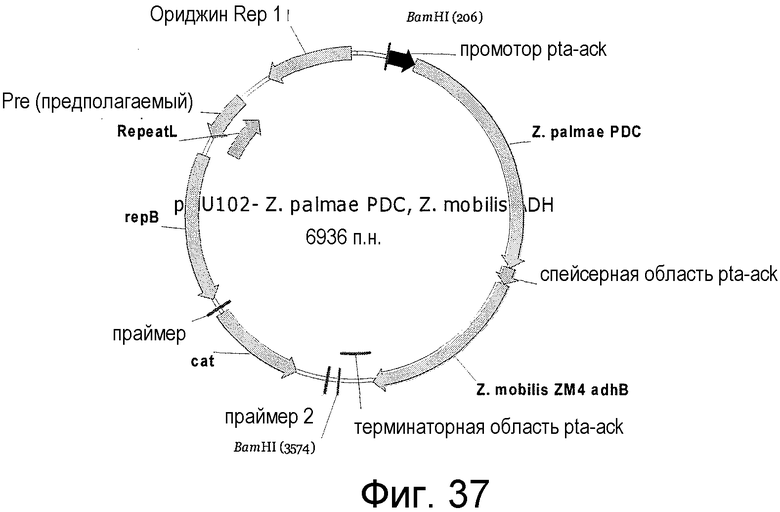
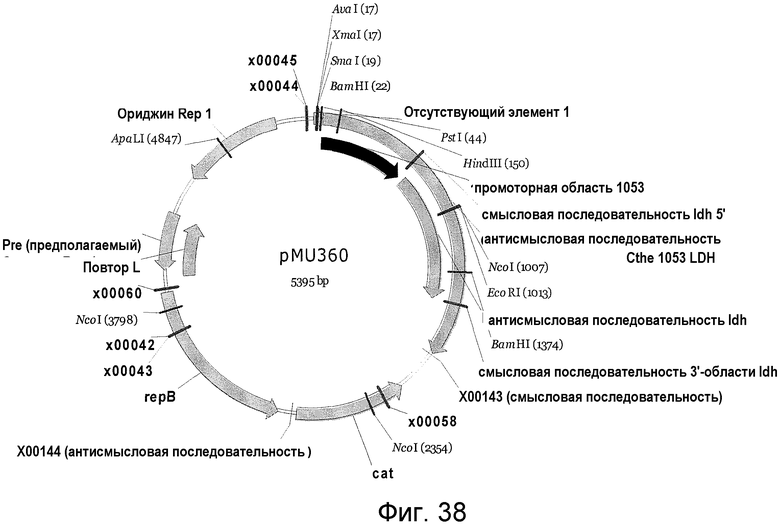
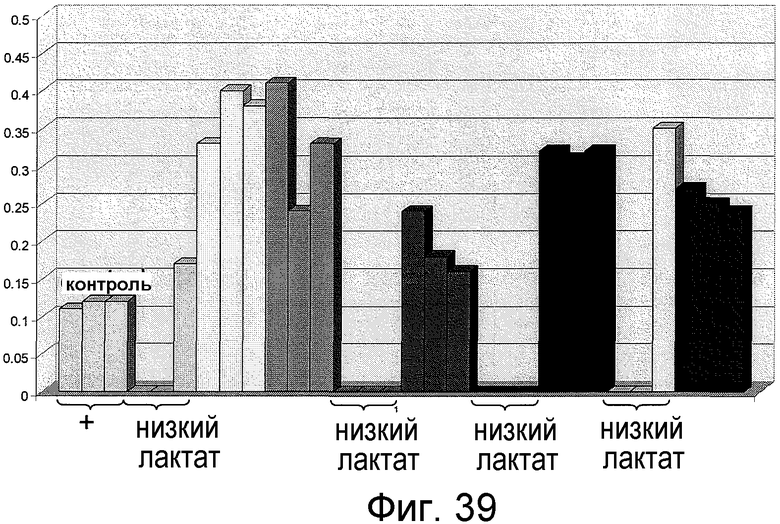
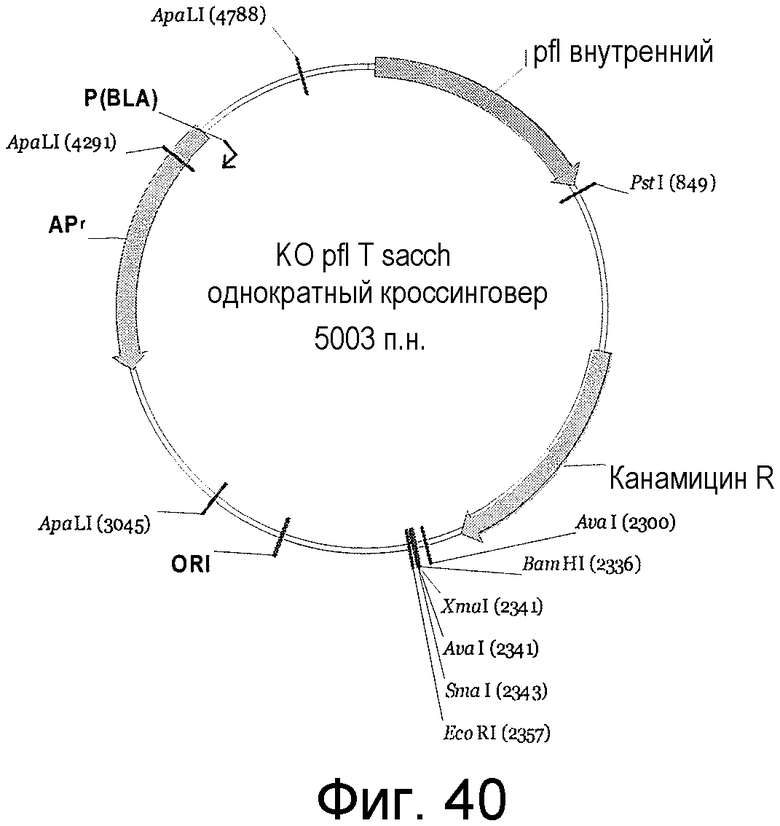
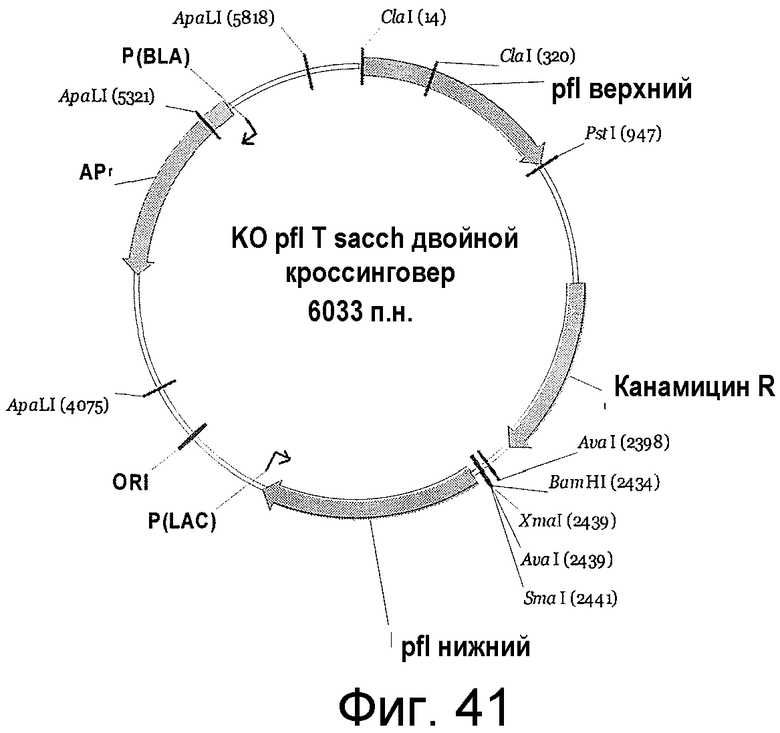
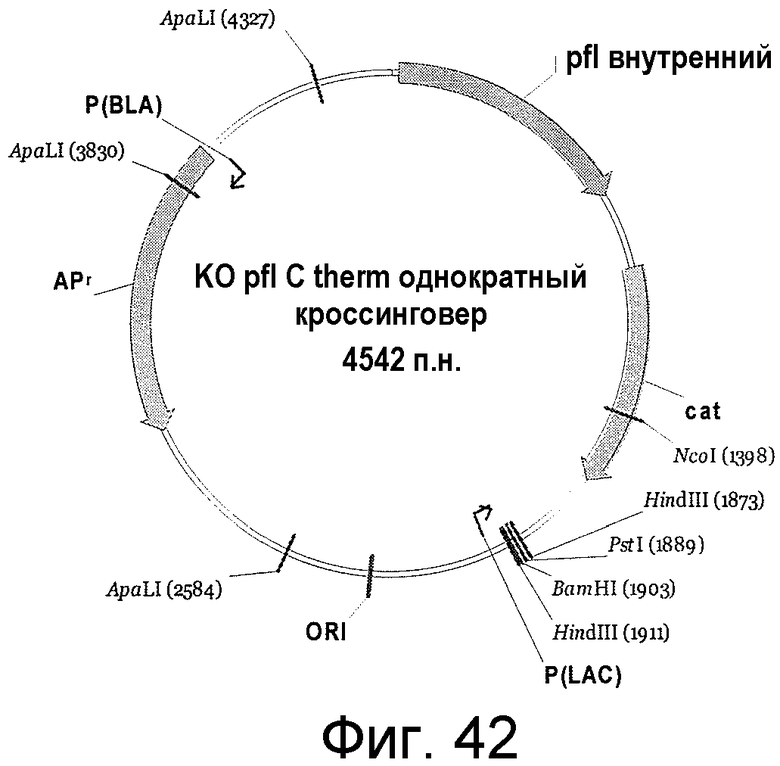
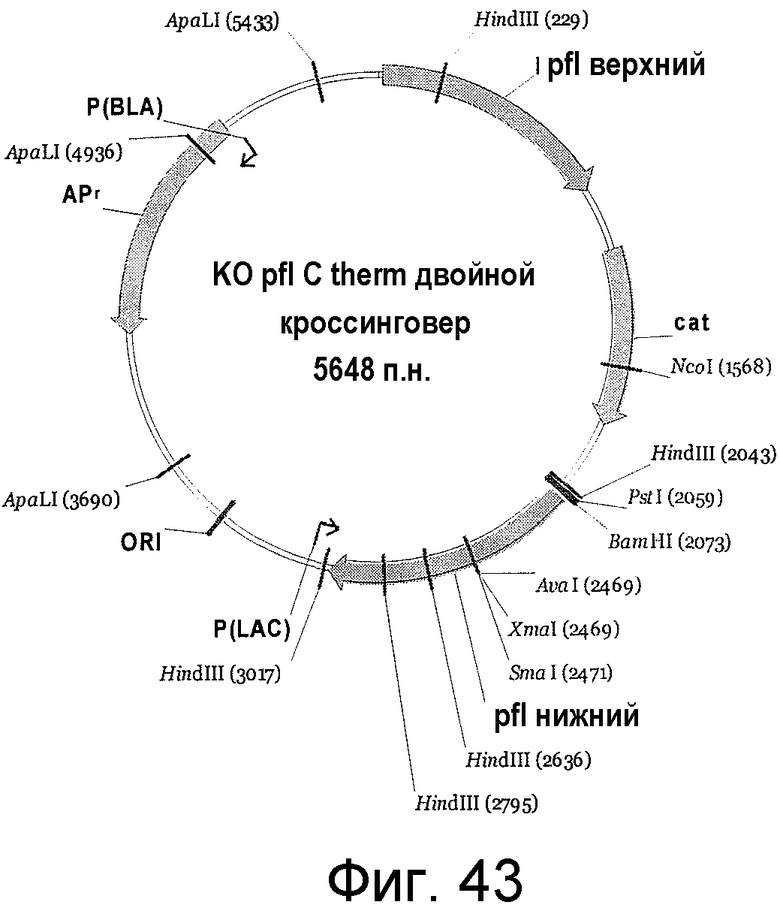
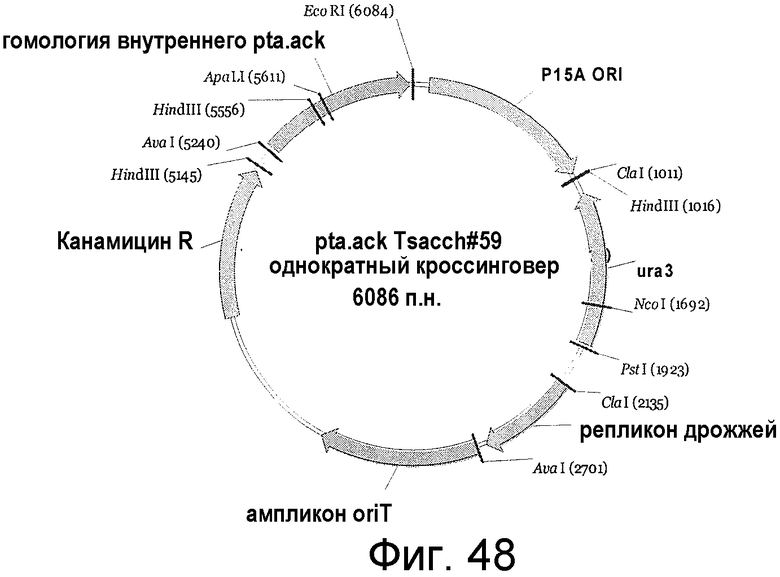
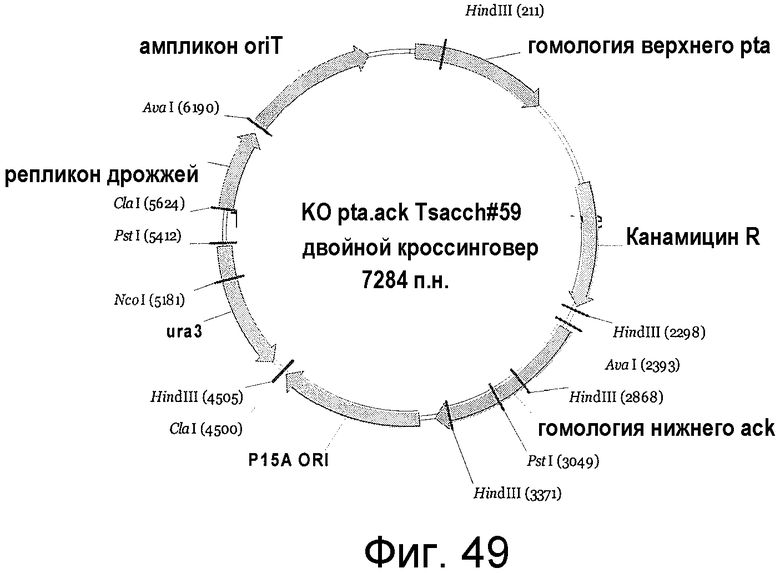
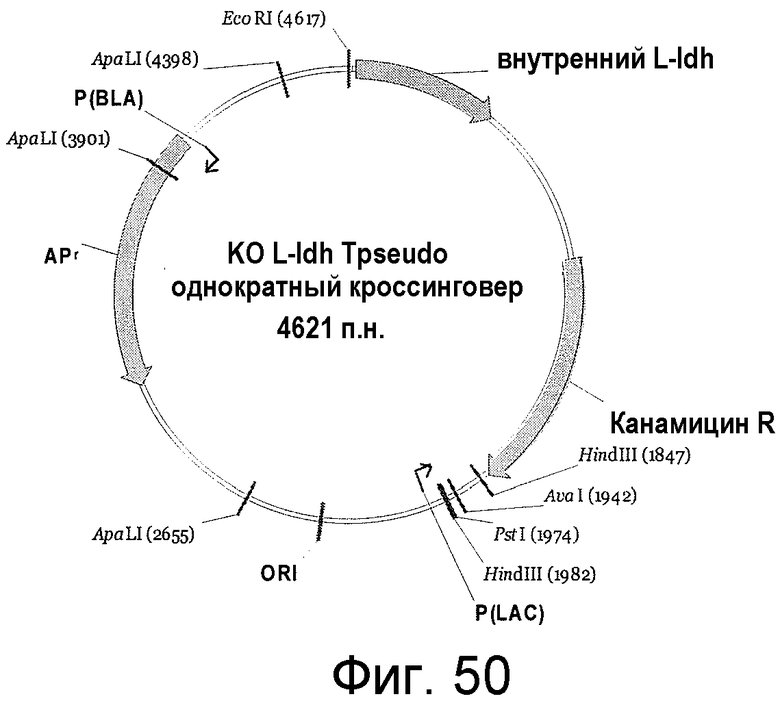
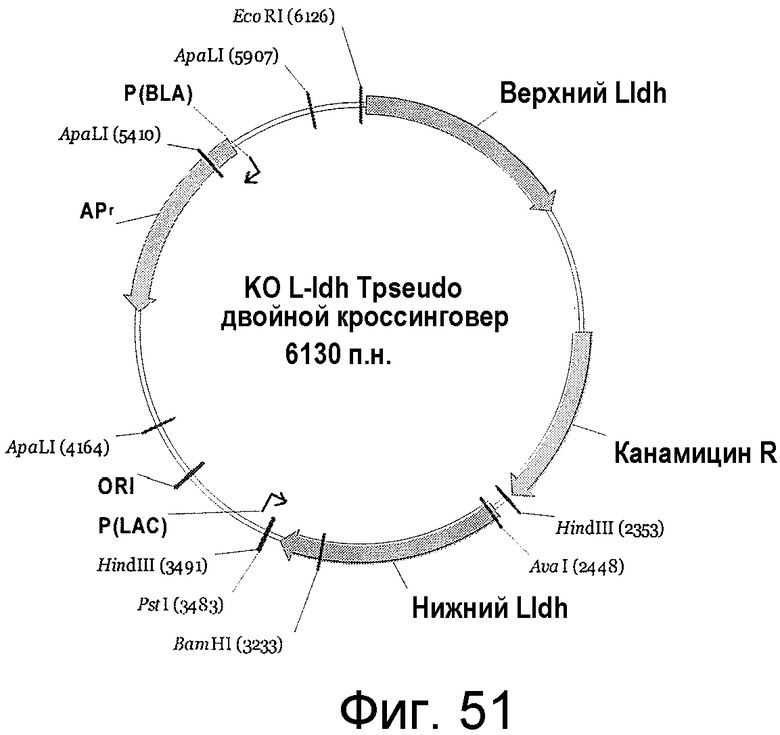
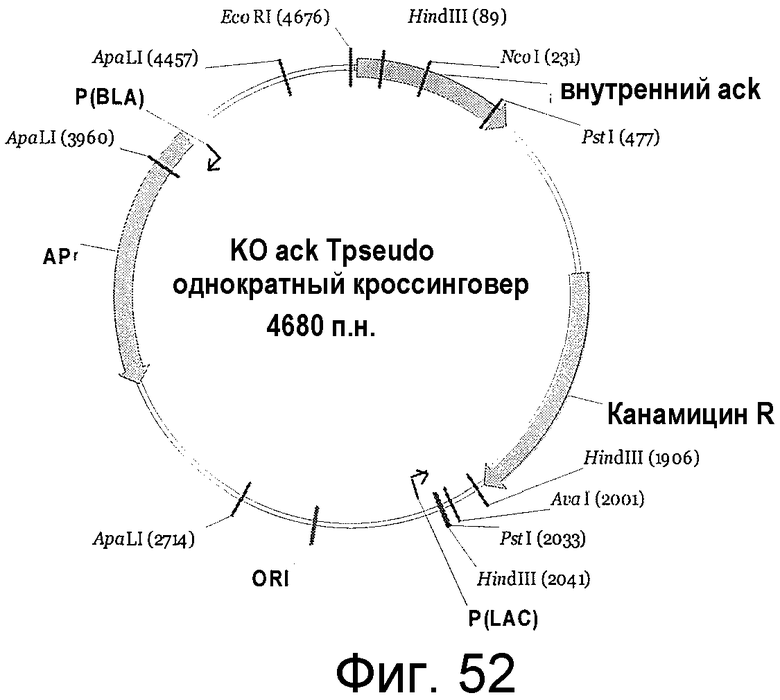
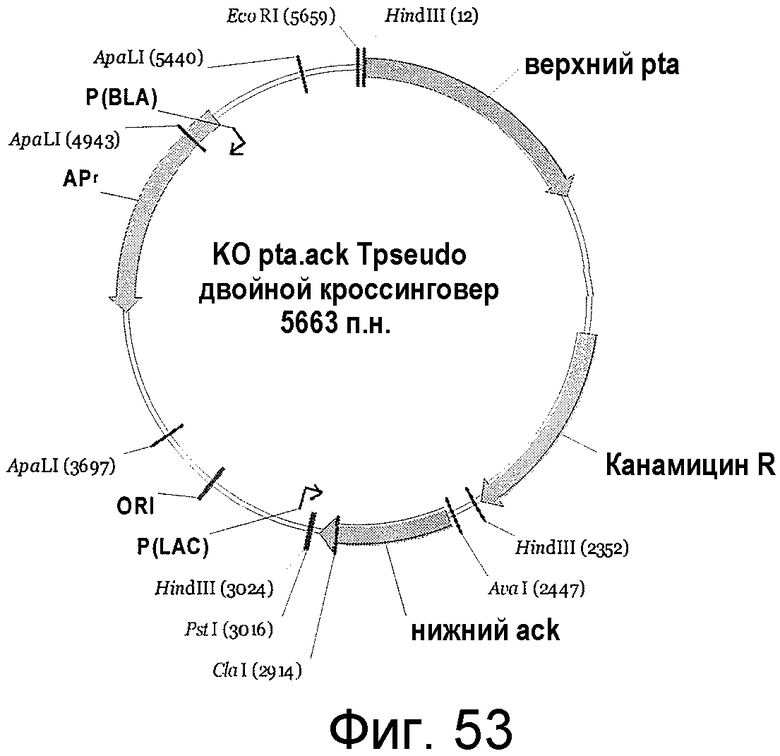
Изобретения относятся к области биотехнологии и касаются вектора, клетки-хозяина, содержащего вектор, генетически модифицированного микроорганизма Clostridium thermocellum, способа получения такого микроорганизма и способа преобразования лигноцеллюлозной биомассы в этанол. Представленный вектор предназначен для нокаута гена ацетаткиназы в Clostridium thermocellum и имеет нуклеотидную последовательность SEQ ID NO:1 или SEQ ID NO:2. Представленный генетически модифицированный микроорганизм трансформирован нуклеотидной последовательностью SEQ ID NO:1 или SEQ ID NO:2, а также может дополнительно содержать ненативный ген, который придает способность метаболизировать пентозный сахар, гидролизовать ксилан или вовлечен в метаболическую продукцию этанола. Представленный способ преобразования лигноцеллюлозной биомассы в этанол включает приведение в контакт биомассы с указанным выше генетически модифицированным микроорганизмом. Охарактеризованные изобретения позволяют получать повышенное количество этанола. 5 н. и 12 з.п. ф-лы, 53 ил., 6 табл., 10 пр.
1. Вектор для нокаута гена ацетаткиназы в Clostridium thermocellum, имеющий любую нуклеотидную последовательность SEQ ID NO:1 или 2, или комплементарную ей последовательность.
2. Клетка-хозяин, содержащая вектор по п.1.
3. Генетически модифицированный микроорганизм Clostridium thermocellum, обладающий повышенной способностью к продукции этанола в качестве продукта ферментации, где генетически модифицированный микроорганизм трансформирован любой нуклеотидной последовательностью SEQ ID NO:1 или 2.
4. Генетически модифицированный микроорганизм по п.3, дополнительно содержащий ненативный ген, где указанный ненативный ген кодирует ненативный фермент, который придает способность метаболизировать пентозный сахар.
5. Генетически модифицированный микроорганизм по п.3, дополнительно содержащий ненативный ген, где указанный ненативный ген кодирует ненативный фермент, который придает способность гидролизировать ксилан.
6. Генетически модифицированный микроорганизм Clostridium thermocellum по п.3, дополнительно содержащий ненативный ген, где указанный ненативный ген кодирует ненативный фермент, вовлеченный в метаболическую продукцию этанола.
7. Генетически модифицированный микроорганизм по п.6, где указанный ненативный фермент придает способность метаболизировать гексозный сахар или пентозный сахар.
8. Генетически модифицированный микроорганизм по п.7, где указанный ненативный фермент придает способность метаболизировать гексозный сахар, и дополнительно содержит второй ненативный ген, где указанный второй ненативный ген кодирует второй ненативный фермент, который придает способность метаболизировать пентозный сахар.
9. Генетически модифицированный микроорганизм по п.6, где указанный ненативный фермент представляет собой пируватдекарбоксилазу или алкогольдегидрогеназу.
10. Генетически модифицированный микроорганизм по п.8, где указанный второй ненативный фермент представляет собой ксилозоизомеразу или указанный второй ненативный ген соответствует последовательности SEQ ID NO:6, 10 или 14.
11. Генетически модифицированный микроорганизм по п.8, где указанный второй ненативный фермент представляет собой ксилулокиназу или указанный второй ненативный ген соответствует последовательности SEQ ID NO:7, 11 или 15.
12. Генетически модифицированный микроорганизм по п.8, где указанный второй ненативный фермент представляет собой L-арабинозоизомеразу или указанный второй ненативный ген соответствует последовательности SEQ ID NO:8 или 12.
13. Генетически модифицированный микроорганизм по п.8, где второй указанный ненативный фермент представляет собой L-рибулозо-5-фосфат 4-эпимеразу или указанный второй неприродный ген соответствует последовательности SEQ ID NO:9 или 13.
14. Генетически модифицированный микроорганизм Clostridium thermocellum по п.3, дополнительно содержащий ненативный ген, где указанный ненативный ген кодирует ненативный фермент, вовлеченный в гидролиз полисахарида.
15. Генетически модифицированный микроорганизм по п.14, где указанный полисахарид представляет собой целлюлозу или ксилан.
16. Способ преобразования лигноцеллюлозной биомассы в этанол, включающий приведение в контакт лигноцеллюлозной биомассы с генетически модифицированным микроорганизмом Clostridium thermocellum по любому из пп.3-15.
17. Способ получения генетически модифицированного микроорганизма Clostridium thermocellum, включающий стадии
(a) введения в микроорганизм любой нуклеотидной последовательности из SEQ ID NO:1 и 2; и
(b) отбора для повышения способности продуцировать этанол в качестве ферментативного продукта подгруппы микроорганизмов в кондициональной среде, где кондициональная среда выбрана для маркера, несущего любую последовательность из SEQ ID NO:1 и 2.
| Liu S et al., Metabolic engineering of a Lactobacillus plantarum double ldh knockout strain for enhanced ethanol production, J Ind Microbiol Biotechnol | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Liu S., A simple method to generate chromosomal mutations in Lactobacillus plantarum strain TF103 to eliminate undesired fermentation products, Appl Biochem Biotechnol. | |||
Авторы
Даты
2015-02-20—Публикация
2008-05-09—Подача