ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к микроорганизму.
В частности, настоящее изобретение относится к трансформированному микроорганизму, способному к: более высокой активности ксилозоизомеразы, чем у эквивалентного микроорганизма перед трансформацией, и/или к более высокой скорости роста в среде для роста или на среде для роста, содержащей ксилозу, чем у эквивалентного микроорганизма перед трансформацией; и/или более быстрому метаболизму ксилозы, чем у эквивалентного микроорганизма перед трансформацией; и/или к более высокой продукции этанола при выращивании в анаэробных условиях на ксилозе в качестве источника углерода, чем у эквивалентного микроорганизма перед трансформацией.
Кроме того, настоящее изобретение относится к способу получения трансформированных микроорганизмов, способных к: более высокой активности ксилозоизомеразы, чем у эквивалентного микроорганизма перед трансформацией, и/или к более высокой скорости роста в среде для роста или на среде для роста, содержащей ксилозу, чем у эквивалентного микроорганизма перед трансформацией; и/или более быстрому метаболизму ксилозы, чем у эквивалентного микроорганизма перед трансформацией; и/или к более высокой продукции этанола при выращивании в анаэробных условиях на ксилозе в качестве источника углерода, чем у эквивалентного микроорганизма перед трансформацией.
Кроме того, настоящее изобретение относится к инокуляту и культуральной среде, содержащим микроорганизм в соответствии с настоящим изобретением или микроорганизм, полученный способом в соответствии с настоящим изобретением.
В другом аспекте настоящее изобретение относится к способу ферментации, включающему культивирование в культуральной среде микроорганизма в соответствии с настоящим изобретением или микроорганизма, полученного способом по настоящему изобретению.
Кроме того, настоящее изобретение относится к способам получения биотоплива и/или продукта, происходящего из ксилозы, включающим культивирование в культуральной среде микроорганизма по настоящему изобретению или микроорганизма, полученного способом по настоящему изобретению.
Кроме того, настоящее изобретение относится к биотопливу и/или продукту, происходящему из ксилозы, полученному способом по настоящему изобретению.
Кроме того, настоящее изобретение относится к применению микроорганизма в соответствии с настоящим изобретением или микроорганизма, полученного способом по настоящему изобретению, для получения продукта, происходящего из ксилозы, и/или биотоплива.
УРОВЕНЬ ТЕХНИКИ
Этанол считается привлекательной альтернативой транспортному топливу, которую можно использовать в качестве добавки, дополнения или частичной замены бензина из ископаемого топлива, которое является ограниченным в конечном итоге источником.
Этанол можно использовать в меньших концентрациях вместо метил-трет-бутилового эфира (MTBE) в качестве более чистой присадки, повышающей октановое число, или оксигенирующей добавки в бензин, или его можно использовать для примешивания в бензин в более высоких количествах, составляющих от 10 до 85%, причем эти смеси можно использовать в только незначительно модифицированных автомобильных двигателях по сравнению с известными в настоящее время двигателями. Таким образом, он имеет огромное преимущество относительно других альтернативных транспортных топлив. Можно проводить любую частичную замену с максимальной гибкостью, и без значительных изменений технологии транспортных двигателей, известной на сегодняшний день.
Этанол имеет преимущество, состоящее в том, что он является возобновляемым источником, поскольку его можно получать в очень больших количествах из растительного материала. Из этого также следует преимущество наличия низкого суммарного вклада в выброс диоксида углерода в атмосферу, поскольку диоксид углерода, высвобождаемый при использовании этанола, повторно абсорбируется вследствие необходимости продукции растительного материала для регенерации использованного этанола.
При традиционной продукции этанола посредством ферментации используемым растительным материалом является сахар с 6 атомами углерода, либо прямо экстрагированный из растений, содержащих свободные моносахариды или дисахариды, либо образованный путем гидролиза крахмала из крахмалсодержащих частей растений. Эти сахара получают из частей растений, которые также используются для употребления человеком или животными. Таким образом, традиционная продукция этанола прямо конкурирует за растительный материал, который в ином случае использовался бы для продуктов питания или кормов. Конверсия пищи в топливо приводит к этическим проблемам в мире, где миллионы людей голодают; вычисления показывают, что количество кукурузы, необходимое для продукции бака топлива для одного самого обычного вездеходного автомобиля в США, приблизительно равно количеству, требуемому для того, чтобы кормить одного голодающего, в противном случае, человека в течение одного полного года.
Альтернативным решением является применение для получения энергии и топлива лигноцеллюлозного растительного материала, который в ином случае считается отходами. Это, в общем, воспринимается высоко положительно, и, таким образом, разработка путей применения лигноцеллюлозного растительного материала для продукции этанола получила во многих странах решительную поддержку, как политически, так и в обществе. Другим преимуществом является изобилие лигноцеллюлозного материала, что в действительности делает теоретически возможной замену 50% или более современного употребляемого бензина этанолом.
Существуют многочисленные источники лигноцеллюлозного материала, который можно использовать для продукции этанола, при условии что может быть достигнут эффективный и экономичный процесс сбора и конверсии. Несколько примеров, где сбор уже проводится в настоящее время, включает жмых сахарного тростника, древесную стружку, кукурузную солому и пшеничную солому.
Двумя главными техническими проблемами, с которыми сталкиваются при применении лигноцеллюлозного материала для продукции этанола посредством ферментации, являются:
1. трудность гидролиза целлюлозы, содержащей сахар с 6 атомами углерода, до глюкозы без образования побочных продуктов, которые мешают или препятствуют дальнейшей микробной конверсии глюкозы в этанол; и
2. отсутствие организма, который способен эффективно осуществлять конверсию сахаров с 5 атомами углерода (например, ксилозы и арабинозы), присутствующих в гемицеллюлозной части лигноцеллюлозного материала, в этанол.
Saccharomyces cerevisiae в течение более чем 6000 лет является предпочтительным микроорганизмом для конверсии сахаров с 6 атомами углерода, происходящих из растительного материала, в этанол. Это является следствием благоприятной комбинации высокого выхода этанола, высокой удельной продуктивности и высокой толерантности к этанолу вместе со способностью расти и осуществлять ферментацию при низких pH, где другим конкурирующим микроорганизмам трудно просто выжить. Когда трудности в гидролизе целлюлозы будут преодолены, S. cerevisiae, наиболее вероятно, продолжат быть предпочтительным организмом для получения этанола ферментацией высвобожденных мономеров сахаров с 6 атомами углерода. Однако, к сожалению, S. cerevisiae не способны метаболизировать сахара с 5 атомами углерода, которые составляют вплоть до одной трети лигноцеллюлозного сахарного материала.
Следовательно, в последние два десятилетия проводится работа по поиску путей для модификации способами генетической инженерии S. cerevisiae для внесения в них способности ферментировать сахар из 5 атомов углерода. Эта работа, главным образом, сфокусирована на ферментации ксилозы, поскольку ксилоза составляет преобладающую часть сахаров с 5 атомами углерода в лигноцеллюлозе. Хотя S. cerevisiae не могут метаболизировать ксилозу, они способны метаболизировать ее изомер ксилулозу (Wang and Schneider, 1980), которая представляет собой метаболит, являющийся точкой вхождения в пентозофосфатный путь. Таким образом, в принципе, проблема может быть решена предоставлением S. cerevisiae, способных конвертировать ксилозу в ксилулозу.
Для направления ксилозы на пентозофосфатный путь через ксилулозу в S. cerevisiae были внесены два различных существующих биохимических каскада. В природных метаболизирующих ксилозу грибах ксилоза конвертируется в ксилулозу в двухстадийном процессе (см. фигуру 1). Сначала ксилоза восстанавливается до ксилита ксилозоредуктазой (XR - EC 1.1.1.21). Затем ксилит дегидрогенизируется до ксилулозы ксилитдегидрогеназой (XDH - EC 1.1.1.9). Редуктаза и дегидрогеназа не присутствуют в S. cerevisiae, однако возможно перенести и экспрессировать гены, кодирующие эти два фермента, из Pichia stipitis в S. cerevisiae, и полученный модифицированный штамм S. cerevisiae будет способен метаболизировать ксилозу.
Активность этих двух ферментов требует NADPH и NAD+, и в результате нее образуются NADP+ и NADH, так что необходимо, чтобы организм регенерировал баланс NAD+ - NADH и NADP+ - NADPH посредством окислительно-восстановительных процессов где-либо в другой части метаболизма, иначе метаболизм ксилозы будет прекращать функционировать при истощении NADPH и NAD+. Довольно низкую скорость метаболизма ксилозы и образования значительных количеств ксилита в штаммах S. cerevisiae, модифицированных подобным образом, связывают с этой присущей им проблемой каскада ксилозоредуктазы-ксилитдегидрогеназы.
В метаболизирующих ксилозу бактериях конверсия ксилозы в ксилулозу отличается: один фермент, ксилозоизомераза (EC 5.3.1.5), конвертирует ксилозу непосредственно в ксилулозу (см. фигуру 1). Этот путь очевидно является более простым, и не создает дисбаланса NAD+ - NADPH, упомянутого выше. Таким образом, это также было первоначальной стратегией, предложенной для обеспечения способности S. cerevisiae метаболизировать ксилозу. Однако было показано, что осуществление этой стратегии является трудным. Экспрессия большинства генов ксилозоизомеразы из бактерий не приводит к присутствию активной ксилозоизомеразы в S. cerevisiae, и точная причина этого до сих пор неизвестна. В различных исследованиях было выявлено, что часто белок, продуцируемый при экспрессии бактериального гена, может быть выявлен, однако экспрессированный белок, по-видимому, не сворачивается в S. cerevisiae в активный фермент.
Термостабильные ферменты часто являются более стабильными в других типах экстремальных условий, таких как высокое содержание соли и предельные значения pH. Это может указывать на то, что термостабильные ферменты с большей вероятностью сохраняют (и, возможно, также претерпевают) правильное сворачивание. Кроме того, действительно можно найти примеры бактериальных генов ксилозоизомеразы, выделенных из термофильных организмов, которые экспрессируют активные ксилозоизомеразы в S. cerevisiae (см.: Walfridsson et al, 1996; и Bao et al, 1999). Было показано, что эти гены обеспечивает метаболизм ксилозы в S. cerevisiae, но с очень низкой скоростью. Низкую скорость приписывают тому факту, что термостабильные ксилозоизомеразы имеют оптимальную активность при 80-90°С, но температуры, которые поддерживают выживание большинства штаммов S. cerevisiae, составляют 30-35°C.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к трансформированному микроорганизму, способному к:
(a) более высокой активности ксилозоизомеразы, чем у эквивалентного микроорганизма перед трансформацией; и/или
(b) более высокой скорости роста в среде для роста или на среде для роста, содержащей ксилозу, чем у эквивалентного микроорганизма перед трансформацией; и/или
(c) более быстрому метаболизму ксилозы, чем у эквивалентного микроорганизма перед трансформацией; и/или
(d) более быстрой продукции этанола при выращивании в анаэробных условиях на ксилозе в качестве источника углерода, чем у эквивалентного микроорганизма перед трансформацией.
В другом аспекте настоящее изобретение относится к инокуляту, содержащему микроорганизм в соответствии с настоящим изобретением.
В другом аспекте настоящее изобретение относится к культуральной среде, содержащей микроорганизм в соответствии с настоящим изобретением.
В следующем аспекте настоящее изобретение относится к способу получения трансформированного микроорганизма, причем указанный способ включает стадию трансформации микроорганизма, так чтобы указанный трансформированный микроорганизм был способен к:
(a) более высокой активности ксилозоизомеразы, чем у микроорганизма перед трансформацией; и/или
(b) более высокой скорости роста в среде для роста или на среде для роста, чем у микроорганизма перед трансформацией; и/или
(c) более быстрому метаболизму ксилозы, чем у микроорганизма перед трансформацией; и/или
(d) более быстрой продукции этанола при выращивании в анаэробных условиях на ксилозе в качестве источника углерода, чем у микроорганизма перед трансформацией.
В другом аспекте настоящее изобретение относится к способу ферментации, включающему культивирование в культуральной среде микроорганизма в соответствии с настоящим изобретением или микроорганизма, полученного способом по настоящему изобретению.
В следующем аспекте настоящее изобретение относится к способу получения продукта, происходящего из ксилозы, включающему культивирование в культуральной среде микроорганизма в соответствии с настоящим изобретением или микроорганизма, полученного способом по настоящему изобретению.
В другом аспекте настоящее изобретение относится к способу получения биотоплива, где указанный способ включает стадию культивирования в культуральной среде микроорганизма по настоящему изобретению или микроорганизма, полученного способом по настоящему изобретению.
В другом аспекте настоящего изобретения предусмотрено биотопливо, полученное способом по настоящему изобретению.
В следующем аспекте настоящего изобретения предусмотрен продукт, происходящий из ксилозы, полученный способом по настоящему изобретению.
В следующем аспекте настоящего изобретения предусмотрено применение микроорганизма в соответствии с настоящим изобретением или микроорганизма, полученного способом по настоящему изобретению, для продукции продукта, происходящего из ксилозы.
Кроме того, настоящее изобретение относится к применению микроорганизма в соответствии с настоящим изобретением или микроорганизма, полученного способом по настоящему изобретению, для продукции биотоплива.
В другом аспекте настоящее изобретение относится к трансформированному микроорганизму, где указанный трансформированный микроорганизм содержит экзогенную нуклеотидную последовательность, кодирующую ксилозоизомеразу.
ОБСУЖДЕНИЕ
Прежние попытки найти гены бактериальной ксилозоизомеразы мезофильного происхождения с высокой активностью при экспрессии, например, в Saccharomyces cerevisiae, оказались безуспешными. Неожиданно, как описано в настоящем документе, авторы изобретения успешно идентифицировали бактерии, в частности, мезофильные бактерии, которые содержат нуклеотидные последовательности, кодирующие ксилозоизомеразу, которая при экспрессии, например, в S. cerevisiae, приводит к высокой внутриклеточной активности ксилозоизомеразы в организме. Такие последовательности можно использовать, например, для конструирования штаммов семейства Saccharomyces, обеспечивая конверсию дрожжами ксилозы в ксилулозу и, тем самым способствуя эффективной продукции и/или метаболизму ксилозы в этанол. На фигуре 4 детально показан метаболизм ксилозы в этанол; ксилулоза-5-фосфат - промежуточное соединение, которое может образовываться из D-ксилозы - входит в пентозофосфатный путь и далее метаболизируется в этанол в анаэробных условиях. Однако в дополнение к этому, такие последовательности также можно использовать для конструирования штаммов, например, S. cerevisiae, являющихся эффективными продуцентами других соединений, происходящих из ксилозы, через пенозофосфатный путь. Примеры таких соединений включают, но не ограничиваются ими, ароматические аминокислоты, молочную кислоту, янтарную кислоту, уксусную кислоту, ацетальдегид, фурфураль, итаконовую кислоту, глутаминовую кислоту, лимонную кислоту, крезол, лизин, 3-гидроксипропионовую кислоту, поли-3-гидроксиалканоаты, протокатеховую кислоту, пирокатехол, гваякол, вератрол, резвератрол, ванилин, ванилиновую кислоту, ванилиновый спирт, муконовую кислоту, адипиновую кислоту, 4-гидроксибензойную кислоту, 4-гидроксибензальдегид, 4-метоксибензойную кислоту, 4-аминобензоат, 4-гидроксианилин, 4-метоксианилин, хинол, анизол, фенол, антраниловую кислоту, 3-гидроксиантранилат, 2,3-дигидроксибензойную кислоту, 2-аминофенол, 1,4-циклогександион, изопрен и стирол.
НЕКОТОРЫЕ ПРЕИМУЩЕСТВА
Преимущественно, настоящее изобретение относится к трансформации (инженерии) микроорганизмов, таких как микроорганизмы семейства Saccharomyces, для обеспечения метаболизма микроорганизмами ксилозы. Это, в свою очередь, преимущественно увеличивает эффективность микроорганизмов, в частности, штаммов Saccharomyces, в отношении продукции этанола из содержащего ксилозу сырья (такого как лигноцеллюлозный материал). Кроме того, это преимущественно увеличивает эффективность микроорганизмов в отношении продукции других природных или полученных способами инженерии метаболитов, происходящих из промежуточных соединений в пентозофосфатном пути, таких как ароматические аминокислоты, молочная кислота, янтарная кислота, уксусная кислота, ацетальдегид, фурфураль, итаконовая кислота, глутаминовая кислота, лимонная кислота, крезол, лизин, 3-гидроксипропионовая кислота, поли-3-гидроксиалканоаты, протокатеховая кислота, пирокатехол, гваякол, вератрол, резвератрол, ванилин, ванилиновая кислота, ванилиновый спирт, муконовая кислота, адипиновая кислота, 4-гидроксибензойная кислота, 4-гидроксибензальдегид, 4-метоксибензойная кислота, 4-аминобензоат, 4-гидроксианилин, 4-метоксианилин, хинол, анизол, фенол, антраниловая кислота, 3-гидроксиантранилат, 2,3-дигидроксибензойная кислота, 2-аминофенол, 1,4-циклогександион, изопрен и стирол. Кроме того, это способствует общему применению содержащего ксилозу материала в качестве сырья для выращивания штаммов семейства Saccharomyces для промышленных целей.
Следующее преимущество состоит в том, что нуклеотидная последовательность, кодирующая ксилозоизомеразу, происходит из мезофильного организма и/или способна к высокой активности при мезофильных температурах.
Другое преимущество состоит в том, что микроорганизмы в соответствии с настоящим изобретением продуцируют активную ксилозоизомеразу.
Преимущественно, с использованием микроорганизмов в соответствии с настоящим изобретением, можно получать биотоплива (такие как этанол).
Более преимущественно, с использованием микроорганизмов в соответствии с настоящим изобретением, можно получать биотоплива из отходов, таких как сельскохозяйственные отходы (включая солому злаковых, такую как пшеничная солома; свекловичную пульпу; жмых сахарного тростника; такую солому, как солома сорго, соевых бобов маиса или кукурузы; и древесную стружку). С помощью настоящего изобретения отсутствует необходимость (или снижается необходимость) в применении материалов (таких как экстракт сахарного тростника, экстракт сахарной свеклы, крахмал сорго, маисовый крахмал, пшеничный крахмал или кукурузный крахмал), которые в ином случае можно использовать в качестве источника пищи для людей и/или в качестве корма для животных.
Преимущественно, микроорганизмы в соответствии с настоящим изобретением обеспечивают оптимальное использование сахаров, высвобождающихся при гидролизе лигноцеллюлозного материала посредством ферментации пентозных сахаров, ксилозы.
Настоящее изобретение обеспечивает продукцию биотоплива, которое является более CO2-нейтральным по сравнению с транспортным топливом на основе нефти. С помощью настоящего изобретения выброс CO2 является низким (еще более низким) при получении биотоплива согласно настоящему изобретению, по сравнению с получением типичного транспортного топлива на основе нефти (ископаемые топлива).
ФИГУРЫ
Фигура 1. Схематическое представление метаболических каскадов, на которой детально показан метаболизм двух альдопентоз, D-ксилозы и L-арабинозы. Обе альдопентозы конвертируются в кетопентозу, и далее в D-ксилулоза-5-фосфат. Без связи с теорией, как показано на фигуре, один тип каскада (альдозоредуктазный тип) встречается у грибов, в то время как другой тип каскада (изомеразный тип) встречается у бактерий. В каскаде грибного типа, первые ферменты могут быть названы "D-ксилозоредуктаза" и "L-арабинозоредуктаза", однако часто один и тот же фермент может восстанавливать как D-ксилозу, так и L-арабинозу, а затем может участвовать в обоих каскадах, и он может быть обозначен менее специфическим названием "альдозоредуктаза".
Фигура 2. Без связи с теорией, на фигуре 2 показано схематическое представление грибного и бактериального типов метаболических каскадов для некоторых менее распространенных пентоз (D- и L-ликсоза, D-рибоза), детализирующее начальный метаболизм до вхождения в пентозофосфотный путь.
Фигура 3. Схематическое представление неокислительной части пентозофосфатного пути (PPP).
Фигура 4. Схематическое представление метаболической конверсии ксилозы в этанол. Здесь, кетопентоза ксилулоза-5-фосфат, которая может происходить из D-ксилозы, далее метаболизируется в этанол в анаэробных условиях. XI представляет собой ксилозоизомеразу, и XK представляет собой ксилулокиназу. Показано суммарное вхождение ксилозы в процесс и суммарный выход этанола из процесса (итог процесса).
Фигура 5. Активность ксилозоизомеразы (XI) в Saccharomyces cerevisiae, трансформированной нуклеотидной последовательностью, кодирующей бактериальную ксилозоизомеразу. Бактериальная ксилозоизомераза происходит из (i) Pseudomonas syringae, (ii) Thermoanaerobacter thermohydrosulfuricus, (iii) Thermoanaerobacter thermohydrosulfurigenes или (iv) Lactococcus lactis subsp. lactis (Lactobacillus xylosus).
Фигура 6. Рост на ксилозе Saccharomyces cerevisiae, трансформированных нуклеотидными последовательностями, кодирующими и экспрессирующими бактериальную ксилозоизомеразу и нуклеотидную последовательность, кодирующую и экспрессирующую килулозокиназу, клонированную из Pichia stipitis.
Фигура 7. Удельная активность ксилозоизомеразы Saccharomyces cerevisiae, трансформированных нуклеотидной последовательностью, кодирующей и экспрессирующей вариант ксилозоизомеразы Lactococcus. Вариант ксилозоизомеразы (XI) Lactococcus имеет аминокислотную последовательность SEQ ID NO: 14, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 или SEQ ID NO: 20.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Как используют в настоящем документе, выражения "более высокая активность ксилозоизомеразы, чем у эквивалентного микроорганизма перед трансформацией" и "более высокая активность ксилозоизомеразы, чем у микроорганизма перед трансформацией" относятся к трансформированному микроорганизму, который обладает активностью ксилозоизомеразы по меньшей мере 0,16, 0,2, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0 единиц ксилозоизомеразы на мг белка микроорганизма при культивирования в пригодных условиях культивирования, позволяющих по меньшей мере поддержание указанного микроорганизма; например, указанная культуральная среда может содержать один или несколько субстратов (например, ксилозу), способных активировать экспрессию нуклеотидной последовательности, кодирующей ксилозоизомеразу, однако указанная культуральная среда не содержит какого-либо субстрата, который способен ингибировать экспрессию нуклеотидной последовательности, кодирующей ксилозоизомеразу. Один пример пригодных условий культивирования описан в примере 5. Указанную активность ксилозоизомеразы измеряют с использованием анализа с цистеин-карбазолом, описанного Dische and Borenfreund (1951). Активность ксилозоизомеразы у трансформированного микроорганизма превышает активность ксилозоизомеразы у эквивалентного микроорганизма перед трансформацией, или микроорганизма перед трансформацией, при культивировании в тех же условия культивирования, что и для трансформированного микроорганизма.
Как используют в настоящем документе, выражения "более высокая скорость роста в среде для роста или на среде для роста, содержащей ксилозу, чем у эквивалентного микроорганизма перед трансформацией" и "более высокая скорость роста в среде для роста или на среде для роста, чем у микроорганизма перед трансформацией" относятся к трансформированному микроорганизму, способному к увеличению скорости роста, так чтобы время, требуемое для удвоения числа микроорганизмов, было по меньшей мере на 10%, 15%, 20% или 25% ниже, чем время, требуемое для удвоения числа эквивалентных микроорганизмов перед трансформацией, или микроорганизмов перед трансформацией, при культивировании в одинаковых условиях.
Выражения "более быстрый метаболизм ксилозы, чем у эквивалентного микроорганизма перед трансформацией" и "более быстрый метаболизм ксилозы, чем у эквивалентного микроорганизма перед трансформацией", как используют в настоящем документе, относятся к трансформированному микроорганизму, который способен метаболизировать ксилозу, так чтобы употребленное количество ксилозы на клетку в культуральной среде было по меньшей мере на 10%, 20%, 25%, 30% или 35% выше, чем употребленное количество ксилозы для эквивалентного микроорганизма перед трансформацией, или микроорганизма перед трансформацией, при культивировании в одинаковых условиях в течение данного периода времени в экспоненциальной фазе роста. Указанный трансформированный микроорганизм культивируют в пригодных условиях культивирования, позволяющих по меньшей мере поддержание указанного микроорганизма; например, указанная культуральная среда может содержать одно или несколько веществ (например, ксилозу), способных активировать экспрессию нуклеотидной последовательности, кодирующей ксилозоизомеразу, однако указанная культуральная среда не содержит какой-либо субстрат, который способен ингибировать экспрессию нуклеотидной последовательности, кодирующей ксилозоизомеразу.
Как используют в настоящем документе, выражения "более быстрая продукция этанола при выращивании в анаэробных условиях на ксилозе в качестве источника углерода, чем у эквивалентного микроорганизма перед трансформацией" и "более быстрая продукция этанола при выращивании в анаэробных условиях на ксилозе в качестве источника углерода, чем у микроорганизма перед трансформацией" относятся к трансформированному микроорганизму, который способен продуцировать по меньшей мере на 10%, 20% или 30% больше этанола на клетку, чем эквивалентный микроорганизм перед трансформацией при культивировании в анаэробных условиях с ксилозой в качестве источника углерода в течение данного периода времени.
Термин "эквивалентный микроорганизм перед трансформацией", как используют в настоящем документе, включает указание на микроорганизм перед трансформацией нуклеотидной последовательностью, которая кодирует ксилозоизомеразу, или перед трансформацией нуклеотидной последовательностью, которая вызывает повышенную регуляцию (например, сверхэкспрессию) ксилозоизомеразы.
В одном варианте осуществления микроорганизм в соответствии с настоящим изобретением трансформирован нуклеотидной последовательностью, которая приводит к сверхэкспрессии микроорганизмом ксилозоизомеразы. Например, в геном микроорганизма встраивают промотор, который обеспечивает сверхэкспрессию в микроорганизме эндогенной нуклеотидной последовательности, кодирующей ксилозоизомеразу.
В другом варианте осуществления микроорганизм в соответствии с настоящим изобретением трансформирован нуклеотидной последовательностью, кодирующей ксилозоизомеразу. Например, микроорганизм трансформирован экспрессирующим вектором, содержащим нуклеотидную последовательность, кодирующую ксилозоизомеразу, функционально связанную с регуляторной последовательностью.
Предпочтительно, микроорганизм в соответствии с настоящим изобретением трансформирован нуклеотидной последовательностью, кодирующей ксилозоизомеразу.
Предпочтительно, микроорганизм в соответствии с настоящим изобретением трансформирован нуклеотидной последовательностью, кодирующей экзогенную ксилозоизомеразу.
Предпочтительно, микроорганизм в соответствии с настоящим изобретением трансформирован нуклеотидной последовательностью, кодирующей экзогенную ксилозоизомеразу, происходящую из видов Lactococcus.
В предпочтительном варианте осуществления микроорганизм в соответствии с настоящим изобретением трансформирован нуклеотидной последовательностью, кодирующей аминокислотную последовательность, представленную в качестве SEQ ID NO: 14, SEQ ID NO: 11, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 или SEQ ID NO: 20, или ее вариант, гомолог или производное.
В более предпочтительном варианте осуществления микроорганизм в соответствии с настоящим изобретением трансформирован нуклеотидной последовательностью, кодирующей аминокислотную последовательность, представленную в качестве SEQ ID NO: 19 или SEQ ID NO: 20, или ее вариант, гомолог или производное.
В предпочтительном варианте осуществления микроорганизм в соответствии с настоящим изобретением трансформирован нуклеотидной последовательностью, представленной в качестве SEQ ID NO: 1, SEQ ID NO: 10, SEQ ID NO: 17, SEQ ID NO: 12, SEQ ID NO: 27 или SEQ ID NO: 28, или ее вариантом, гомологом или производным.
В более предпочтительном варианте осуществления микроорганизм в соответствии с настоящим изобретением трансформирован нуклеотидной последовательностью, представленной в качестве SEQ ID NO: 27 или SEQ ID NO: 28, или ее вариантом, гомологом или производным.
В одном аспекте микроорганизм в соответствии с настоящим изобретением трансформирован двумя или более нуклеотидными последовательностями, кодирующими ксилозоизомеразу.
Предпочтительно, нуклеотидная последовательность, кодирующая ксилозоизомеразу, упомянутую в настоящем документе, представляет собой кодирующий ее экспрессирующий вектор.
Предпочтительно, экспрессирующий вектор, упомянутый в настоящем документе, содержит промотор, способный сверхэкспрессировать нуклеотидную последовательность, кодирующую ксилозоизомеразу. Примеры таких промоторов включают промотор GPD, промотор TEF и промотор ADP. Предпочтительные промоторы, которые можно использовать для сверхэкспрессии ксилозоизомеразы, могут представлять собой любые из регуляторных элементов, контролирующих экспрессию нуклеотидных последовательностей, кодирующих белки, вовлеченные в гликолиз и ферментацию глюкозы.
В одном варианте осуществления в способе в соответствии с настоящим изобретением микроорганизм трансформируют нуклеотидной последовательностью, которая обеспечивает сверхэкспрессию микроорганизмом ксилозоизомеразы. Например, в геном микроорганизма встраивают промотор, который обеспечивает сверхэксирессию микроорганизмом эндогенной нуклеотидной последовательности, кодирующей ксилозоизомеразу. В следующем примере в геном микроорганизма встраивают промотор, который обеспечивает конститутивную экспрессию микроорганизмом эндогенной нуклеотидной последовательности, кодирующей ксилозоизомеразу.
В другом варианте осуществления в способе в соответствии с настоящим изобретением микроорганизм трансформируют нуклеотидной последовательностью, кодирующей ксилозоизомеразу.
Например, микроорганизм трансформируют экспрессирующим вектором, содержащим нуклеотидную последовательность, кодирующую ксилозоизомеразу, функционально связанную с регуляторной последовательностью.
В следующем примере микроорганизм трансформируют экспрессирующим вектором, содержащим нуклеотидную последовательность, кодирующую ксилозоизомеразу, функционально связанную с регуляторной последовательностью, где указанная регуляторная последовательность обеспечивает конститутивную экспрессию нуклеотидной последовательности, кодирующей ксилозоизомеразу.
Предпочтительно, в способе в соответствии с настоящим изобретением, микроорганизм трансформируют нуклеотидной последовательностью, кодирующей ксилозоизомеразу.
Предпочтительно, в способе в соответствии с настоящим изобретением, микроорганизм трансформируют нуклеотидной последовательностью, кодирующей экзогенную ксилозоизомеразу.
В предпочтительном варианте осуществления в способе в соответствии с настоящим изобретением микроорганизм трансформируют нуклеотидной последовательностью, кодирующей ксилозоизомеразу, содержащей нуклеотидную последовательность, представленную в SEQ ID NO: 1, SEQ ID NO: 10, SEQ ID NO: 17, SEQ ID NO: 12, SEQ ID NO: 27 или SEQ ID NO: 28, или ее вариант, гомолог или производное.
В предпочтительном варианте осуществления в способе в соответствии с настоящим изобретением микроорганизм трансформируют нуклеотидной последовательностью, кодирующей ксилозоизомеразу, содержащей аминокислотную последовательность, представленную в качестве SEQ ID NO: 14, SEQ ID NO: 11, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 или SEQ ID NO: 20, или ее вариант, гомолог или производное.
В одном аспекте в способе в соответствии с настоящим изобретением микроорганизм трансформируют двумя или более нуклеотидными последовательностями, кодирующими ксилозоизомеразу.
В способе в соответствии с настоящим изобретением предпочтительно нуклеотидная последовательность, кодирующая ксилозоизомеразу, представляет собой кодирующий ее экспрессирующий вектор.
Как используют в настоящем документе термин "способ ферментации" относится к культивированию микроорганизма или микроорганизмов в аэробных и анаэробных условиях.
В одном варианте осуществления культуральная среда содержит ксилозу и/или источник ксилозы.
В одном варианте осуществления культуральная среда содержит пентозный сахар и/или источник пентозного сахара. Предпочтительно, пентозный сахар представляет собой ксилозу. В одном варианте осуществления пентозный сахар происходит и/или является получаемым из лигноцеллюлозного материала.
Альтернативно или дополнительно, культуральная среда содержит материал, происходящий из лигноцеллюлозного материала.
Предпочтительно, способ в соответствии с настоящим изобретением, кроме того, включает стадию получения биотоплива из культуральной среды.
В одном варианте осуществления продукт, происходящий из ксилозы, выбран из группы, состоящей из ксилулозы, ксилулозо-5-фосфата, этанола, ароматических аминокислот, молочной кислоты, янтарной кислоты, уксусной кислоты, ацетальдегида, фурфураля, итаконовой кислоты, глутаминовой кислоты, лимонной кислоты, крезола, лизина, 3-гидроксипропионовой кислоты, поли-3-гидроксиалканоатов, протокатеховой кислоты, пирокатехола, гваякола, вератрола, резвератрола, ванилина, ванилиновой кислоты, ванилинового спирта, муконовой кислоты, адипиновой кислоты, 4-гидроксибензойной кислоты, 4-гидроксибензальдегида, 4-метоксибензойной кислоты, 4-аминобензоата, 4-гидроксианилина, 4-метоксианилина, хинола, анизола, фенола, антраниловой кислоты, 3-гидроксиантранилата, 2,3-дигидроксибензойной кислоты, 2-аминофенола, 1,4-циклогександиона, изопрена и стирола.
Предпочтительно, продукт, образованный из ксилозы, выбран из группы, состоящей из ксилулозы, ксилулоза-5-фосфата, этанола, ароматических аминокислот, молочной кислоты, янтарной кислоты, уксусной кислоты, ацетальдегида, фурфураля, итаконовой кислоты, глутаминовой кислоты, лимонной кислоты, крезола, лизина, 3-гидроксипропионовой кислоты и поли-3-гидроксиалканоатов.
В высоко предпочтительном варианте осуществления продукт, образованный из ксилозы, представляет собой этанол.
Как используют в настоящем документе, термин "сверхэкспрессирует" в выражении "нуклеотидная последовательность, которая обеспечивают сверхэкспрессию микроорганизмом ксилозоизомеразы" и "промотор, способный сверхэксирессировать нуклеотидную последовательность, кодирующую ксилозоизомеразу" относится к повышению экспрессии от нулевого уровня до некоторого уровня экспрессии или начиная с низкого уровня экспрессии до более высокого уровня экспрессии (например, повышение регуляции), когда трансформированный микроорганизм сравнивают с эквивалентным микроорганизмом перед трансформацией. Микроорганизмы, сверхэкспрессирующие ксилозоизомеразу, обладают увеличенной способностью катализировать конверсию ксилозы в ксилулозу. Способность конвертировать ксилозу в ксилулозу можно подтверждать путем определения способности клеточного лизата продуцировать ксилулозу из ксилозы путем оценки продуцированной ксилоулозы с использованием, например, анализа кетопентоз, как описано Dische and Borenfreund (Dische and Borenfreund, 1951), также описанного в разделе "Примеры" настоящего документа.
Предпочтительно, трансформированный микроорганизм, который сверхэкспрессирует ксилозоизомеразу, способен к:
(a) более высокой активности ксилозоизомеразы, чем у эквивалентного микроорганизма перед трансформацией; и/или
(b) более высокой скорости роста в среде для роста или на среде для роста, содержащей ксилозу, чем у эквивалентного микроорганизма перед трансформацией; и/или
(c) более быстрому метаболизму ксилозы, чем у эквивалентного микроорганизма перед трансформацией; и/или
(d) более быстрой продукции этанола при выращивании в анаэробных условиях на ксилозе в качестве источника углерода, чем у эквивалентного микроорганизма перед трансформацией.
Примеры микроорганизмов, сверхэкспрессирующих ксилозоизомеразу, включают: (i) микроорганизмы, трансформированные экспрессирующим вектором, кодирующим ксилозоизомеразу (перед трансформацией указанный микроорганизм не был способен экспрессировать ксилозоизомеразу); и (ii) микроорганизмы, трансформированные для повышенной регуляции экспрессии эндогенной ксилозоизомеразы (перед трансформацией указанный микроорганизм был способен экспрессировать указанную ксилозоизомеразу в данном наборе условий культивирования в ходе экспоненциального роста, однако после трансформации указанный микроорганизм способен экспрессировать указанную ксилозоизомеразу на более высоком уровне, в тех же условиях культивирования в ходе экспоненциального роста).
Термин "нуклеотидная последовательность, кодирующая ксилозоизомеразу", как используют в настоящем документе, охватывает нуклеотидные последовательности, содержащие регуляторные последовательности, обеспечивающие экспрессию нуклеотидной последовательности, кодирующей ксилозоизомеразу, такие как промоторы и энхансеры, которые могут быть природным образом или неприродным образом ассоциированы с нуклеотидной последовательностью, кодирующей ксилозоизомеразу.
В одном аспекте настоящее изобретение относится к генетически модифицированной дрожжевой клетке, имеющей функциональный экзогенный ген ксилозоизомеразы, происходящий из микроорганизма семейства Lactococcus, где экзогенный ген ксилозоизомеразы функционально связан с промоторными и терминаторными последовательностями, которые функциональны в дрожжах.
В другом аспекте настоящее изобретение относится процессу ферментации, в котором микроорганизм, как описано в настоящем документе, культивируют в условиях ферментации в ферментационном бульоне, который включает материал, происходящий из лигноцеллюлозного материала.
В другом аспекте, настоящее изобретение относится к процессу ферментации с использованием микроорганизма в соответствии с настоящим изобретением, где ферментационный бульон (т.е. культуральная среда) содержит пентозный сахар.
Трансформированный микроорганизм
Как упоминается в настоящем документе, термин "трансформированный микроорганизм" относится к микроорганизму, который генетически изменен технологией рекомбинантных ДНК. Термин "трансформированный", как используют в настоящем документе, является синонимом таких терминов, как "трансфицированный", "рекомбинантный", "модифицированный способами генетической инженерии" и "генетически модифицированный".
Термин "трансформированный микроорганизм" применительно к настоящему изобретению включает любой микроорганизм, который содержит экспрессирующий вектор(ы), содержащий нуклеотидная последовательность(и), упомянутую в настоящем документе, и/или промотор(ы), который способен обеспечивать экспрессию (в частности, сверхэкспрессию, т.е. повышенную регуляцию) нуклеотидной последовательности(ей), упомянутой в настоящем документе. В одном варианте осуществления нуклеотидная последовательность(и) включена в геном микроорганизма. В другом варианте осуществления промотор включен в геном микроорганизма. Эти признаки обеспечивают наличие у трансформированного микроорганизма (по сравнению с эквивалентным микроорганизмом перед трансформацией) (a) более высокой активности ксилозоизомеразы; и/или (b) более высокой скорости роста в среде для роста или на среде для роста, содержащей ксилозу; и/или (c) более быстрого метаболизма ксилозы; и/или (d) более быстрой продукции этанола при выращивании в анаэробных условиях на ксилозе в качестве источника углерода.
Термин "трансформированный микроорганизм" не охватывает кодирующие нативный нуклеотид последовательности в их природном окружении, когда они находятся под контролем их нативного промотора, который также находится в его природном окружении.
Таким образом, трансформированный микроорганизм по настоящему изобретению включает микроорганизм, содержащий любую из нуклеотидных последовательностей, кодирующих ферменты, упомянутые в настоящем документе, конструкций, содержащих указанные нуклеотидные последовательности, векторов, содержащих указанные нуклеотидные последовательности, плазмид, содержащих указанные нуклеотидные последовательности и экспрессирующих векторов, содержащих указанные нуклеотидные последовательности, или их комбинации.
Таким образом, следующий вариант осуществления настоящего изобретения относится к микроорганизмам, трансформированным или трансфицированным нуклеотидной последовательностью(ями), которая экспрессирует фермент(ы), упомянутый в настоящем документе. Микроорганизм выбирают, чтобы он был совместим с вектором, и он может представлять собой, например, клетки бактерий, грибов или дрожжей.
Примерами пригодных бактериальных организмов-хозяев являются грамположительные или грамотрицательные виды бактерий.
В зависимости от природы нуклеотидной последовательности(ей), кодирующей фермент(ы), упомянутый в настоящем документе, могут быть предпочтительными эукариотические хозяева, такие как дрожжи или другие грибы. Как правило, дрожжевые клетки являются предпочтительными относительно клеток грибов, поскольку ими легче манипулировать.
Применение пригодных микроорганизмов, таких как клетки-хозяева дрожжей и грибов, может обеспечить посттрансляционные модификации (например, миристоилирование, гликозилирование, укорочение, липидизацию и фосфорилирование тирозина, серина или треонина), которые могут быть необходимы для придания оптимальной биологической активности рекомбинантным продуктам экспрессии, упомянутым в настоящем документе.
Пригодные микроорганизмы включают бактерии, грибы и дрожжи. Предпочтительно, микроорганизм представляет собой дрожжи.
Предпочтительно, указанный трансформированный микроорганизм представляет собой трансформированные дрожжи. Предпочтительно, указанные трансформированные дрожжи происходят из рода Saccharomyces. Более предпочтительно, указанные трансформированные дрожжи представляет собой Saccharomyces cerevisiae.
В одном варианте осуществления трансформированный микроорганизм, описанный в настоящем документе, способен к более высокой активности ксилозоизомеразы, чем у эквивалентного микроорганизма перед трансформацией.
В другом аспекте трансформированный микроорганизм, описанный в настоящем документе, способен к более высокой скорости роста в среде для роста или на среде для роста, содержащей ксилозу, чем у эквивалентного микроорганизма перед трансформацией.
В следующем аспекте трансформированный микроорганизм, описанный в настоящем документе, способен к более быстрому метаболизму ксилозы, чем у эквивалентного микроорганизма перед трансформацией.
В другом аспекте трансформированный микроорганизм, описанный в настоящем документе, способен к более быстрой продукции этанола при выращивании в анаэробных условиях на ксилозе в качестве источника углерода, чем у эквивалентного микроорганизма перед трансформацией.
Микроорганизм можно трансформировать с использованием способов, которые являются общепринятыми в данной области, таких как электропорация (Sambrook et al 1989). Кроме того, присутствие последовательности в трансформированном микроорганизме можно определять с помощью селекции по росту на пригодной среде, которая осуществляет селекцию по росту трансформированного микроорганизма. Альтернативно или дополнительно, присутствие встроенных гетерологичных последовательностей ДНК можно определять прямой ПЦР колоний с использованием праймеров, предназначенных специфично для встроенной последовательности. Такие способы хорошо известны и являются общепринятыми в данной области (см., например, Sambrook et al, 1989, и Ausbel et al, 1995).
Трансформированные микроорганизмы в соответствии с настоящим изобретением можно использовать в комбинации с одним или несколькими другими микроорганизмами. Например, один или несколько трансформированных микроорганизмов в соответствии с настоящим изобретением можно культивировать в комбинации по меньшей мере с одним микроорганизмом, способным продуцировать, в определенных условиях культивирования, один или несколько компонентов, выбранных из списка, состоящего из: этанола, ароматических аминокислот, молочной кислоты, янтарной кислоты, уксусной кислоты, ацетальдегида, фурфураля, итаконовой кислоты, глутаминовой кислоты, лимонной кислоты, крезола, лизина, 3-гидроксипропионовой кислоты, поли-3-гидроксиалканоатов, протокатеховой кислоты, пирокатехола, гваякола, вератрола, резвератрола, ванилина, ванилиновой кислоты, ванилинового спирта, муконовой кислоты, адипиновой кислоты, 4-гидроксибензойной кислоты, 4-гидроксибензальдегида, 4-метоксибензойной кислоты, 4-аминобензоата, 4-гидроксианилина, 4-метоксианилина, хинола, анизола, фенола, антраниловой кислоты, 3-гидроксиантранилата, 2,3-дигидроксибензойной кислоты, 2-аминофенола, 1,4-циклогександиона, изопрена и стирола.
В следующем аспекте предусмотрена комбинация (i) одного или нескольких трансформированных микроорганизмов в соответствии с настоящим изобретением и (ii) по меньшей мере одного дополнительного микроорганизма, способного продуцировать, в определенных условиях культивирования, один или несколько компонентов, выбранных из списка, состоящего из: этанола, ароматических аминокислот, молочной кислоты, янтарной кислоты, уксусной кислоты, ацетальдегида, фурфураля, итаконовой кислоты, глутаминовой кислоты, лимонной кислоты, крезола, лизина, 3-гидроксипропионовой кислоты, поли-3-гидроксиалканоатов, протокатеховой кислоты, пирокатехола, гваякола, вератрола, резвератрола, ванилина, ванилиновой кислоты, ванилинового спирта, муконовой кислоты, адипиновой кислоты, 4-гидроксибензойной кислоты, 4-гидроксибензальдегида, 4-метоксибензойной кислоты, 4-аминобензоата, 4-гидроксианилина, 4-метоксианилина, хинола, анизола, фенола, антраниловой кислоты, 3-гидроксиантранилата, 2,3-дигидроксибензойной кислоты, 2-аминофенола, 1,4-циклогександиона, изопрена и стирола.
Кроме того, настоящее изобретение относится к инокуляту, содержащему комбинацию трансформированного микроорганизма в соответствии с настоящим изобретением и одного или нескольких дополнительных микроорганизмов.
Кроме того, предусматривается культуральная среда, содержащая комбинацию трансформированного микроорганизма в соответствии с настоящим изобретением и одного или нескольких других микроорганизмов.
Кроме того, настоящее изобретение относится к набору, содержащему инокулят, содержащий один или несколько микроорганизмов в соответствии с настоящим изобретением.
Кроме того, настоящее изобретение относится к набору, содержащему (i) инокулят, содержащий один или несколько микроорганизмов в соответствии с настоящим изобретением, и (ii) инокулят, содержащий один или несколько других микроорганизмов.
ТРАНСФОРМИРОВАННЫЕ ДРОЖЖИ
В предпочтительном варианте осуществления трансгенный микроорганизм представляет собой дрожжи.
Обзор принципов экспрессии гетерологичных генов в дрожжах предоставлен, например, в Methods Mol Biol (1995), 49:341-54, и Curr Opin Biotechnol (1997) Oct; 8(5):554-60.
В этом отношении, дрожжи, такие как виды Saccharomyces cerevisi или Pichia pastoris (см. FEMS Microbiol Rev (2000 24(1):45-66), можно использовать в качестве носителя для экспрессии гетерологичных генов.
Обзор принципов экспрессии гетерологичных генов в Saccharomyces cerevisiae и секреции продуктов генов приведен E Hinchcliffe E Kenny (1993, "Yeast as a vehicle for the expression of heterologous genes", Yeasts, Vol 5, Anthony H Rose and J Stuart Harrison, eds, 2nd edition, Academic Press Ltd.).
Для трансформации дрожжей разработано несколько протоколов трансформации. Например, трансгенных Saccharomyces в соответствии с настоящим изобретением можно получать, следуя указаниям Hinnen et al, (1978, Proceedings of the National Academy of Sciences of the USA 75, 1929); Beggs, J D (1978, Nature, London, 275, 104); и Ito, H et al (1983, J Bacteriology 153, 163-168).
Трансформированные клетки дрожжей можно отбирать с использованием различных селективных маркеров, таких как ауксотрофные маркеры и доминантные маркеры устойчивости к антибиотикам.
Экспрессирующий вектор
Термин "экспрессирующий вектор" означает конструкцию, способную к экспрессии in vivo или in vitro.
В одном аспекте экспрессирующий вектор встроен в геном пригодного микроорганизма. Термин "встроенный" предпочтительно охватывает стабильное встраивание в геном.
Нуклеотидные последовательности, упомянутые в настоящем документе, могут присутствовать в векторе, в котором нуклеотидная последовательность функционально связана с регуляторными последовательностями, способными обеспечивать экспрессию нуклеотидной последовательности пригодным микроорганизмом-хозяином.
Векторы трансформируют в пригодный микроорганизм-хозяина, как описано в настоящем документе.
Выбор вектора, например, плазмидного, космидного или фагового вектора, часто зависит от микроорганизма, в который его намереваются встроить.
Векторы для применения для настоящего изобретения могут содержать одну или несколько нуклеотидных последовательностей селективных маркеров, таких как нуклеотидная последовательность, которая обеспечивает устойчивость к антибиотику, например, устойчивость к ампициллину, канамицину, хлорамфениколу или тетрациклину. Альтернативно селекцию можно проводить путем котрансформации (как описано в WO91/17243).
Векторы можно использовать in vitro, например, для трансфекции, трансформации, трансдукции или инфицирования микроорганизма-хозяина.
Кроме того, вектор может содержать нуклеотидную последовательность, обеспечивающую репликацию вектора в рассматриваемом микроорганизме-хозяине. Примерами таких последовательностей являются ориджины репликации плазмид pUC19, pACYC177, pUB110, pE194, pAMB1 и pU702.
В предпочтительном аспекте, микроорганизм, способный конвертировать ксилозу в ксилулозу, как упоминается в настоящем документе, содержит нуклеотидную последовательность, кодирующую ксилозоизомеразу.
Предпочтительно, экспрессирующий вектор, как упоминается в настоящем документе, содержит нуклеотидную последовательность, кодирующую ксилозоизомеразу.
В следующем аспекте, предпочтительно, микроорганизм, способный конвертировать ксилозу в ксилулозу, содержит по меньшей мере один экспрессирующий вектор, кодирующий ксилозоизомеразу.
Предпочтительно, в другом аспекте микроорганизм, способный конвертировать ксилозу в ксилулозу, как упоминается в настоящем документе, может дополнительно содержать по меньшей мере один экспрессирующий вектор, кодирующий один или несколько ферментов, выбранных из группы, состоящей из ксилулокиназы, D-рибулокиназы, рибозо-5-фосфатизомеразы, рибулозо-5-фосфатэпимеразы, трансальдолазы, транскетолазы и любого другого фермента пентозофосфатного пути. Более предпочтительно, указанный микроорганизм, способный конвертировать альдопентозу в кетопентозу, как упоминается в настоящем документе, кроме того, содержит по меньшей мере один экспрессирующий вектор, кодирующий ксилулокиназу.
В одном аспекте экспрессирующий вектор, как упоминается в настоящем документе, может дополнительно кодировать один или несколько ферментов, выбранных из группы, состоящей из альдозо-1-эпимеразы, ксилозоредуктазы, D-ксилулозоредуктазы, арабинозоредуктазы, L-арабит-4-дегидрогеназы, L-ксилулозоредуктазы, L-арабинозоизомеразы, рибулокиназы, рибулозофосфат-4-эпимеразы, D-ликсозоизомеразы, D-рибозоизомеразы, ксилулокиназы, D-рибулокиназы, рибулозо-5-фосфатэпимеразы, рибозо-5-фосфатизомеразы, трансальдолазы и транскетолазы.
В одном аспекте экспрессирующий вектор, упоминаемый в настоящем документе, кроме того, может кодировать один или несколько ферментов, выбранных из группы, состоящей из альдозо-1-эпимеразы, ксилулокиназы, D-рибулокиназы, рибозо-5-фосфатизомеразы, D-рибулозо-5-фосфатэпимеразы, трансальдолазы, транскетолазы и любого другого фермента пентозофосфатного пути. Предпочтительно, указанный экспрессирующий вектор, как упоминается в настоящем документе, кроме того, кодирует ксилулокиназу.
В предпочтительном аспекте микроорганизм, способный конвертировать ксилозу в ксилулозу, как упоминается в настоящем документе, кроме того, содержит по меньшей мере один экспрессирующий вектор, кодирующий альдозо-1-эпимеразу.
Предпочтительно, экспрессирующий вектор, упоминаемый в настоящем документе, кроме того, содержит нуклеотидную последовательность, кодирующую альдозо-1-эпимеразу.
Регуляторные последовательности
В некоторых применениях, нуклеотидная последовательность(и), упомянутая в настоящем документе, функционально связана с регуляторной последовательностью, которая способна обеспечивать экспрессию нуклеотидной последовательности, например, выбранным микроорганизмом. В качестве примера, настоящее изобретение охватывает применение вектора, содержащего нуклеотидную последовательность(и), упомянутую в настоящем документе, функционально связанную с такой регуляторной последовательностью, т.е. вектор представляет собой экспрессирующий вектор.
Термин "функционально связанный" относится к соседнему положению, где описанные компоненты находятся во взаимосвязи, позволяющей им функционировать предполагаемым для них образом. Регуляторная последовательность, "функционально связанная" с кодирующей последовательностью, лигирована таким образом, чтобы достигалась экспрессия кодирующей последовательности в условиях, совместимых с последовательностями контроля.
Термин "регуляторные последовательности" включает промоторы и энхансеры и другие регулирующие экспрессию сигналы.
В одном варианте осуществления регуляторная последовательность обеспечивает конститутивную экспрессию нуклеотидной последовательности(ей), функционально связанной с регуляторной последовательностью, в клетке-хозяине.
Как используют в настоящем документе термины "конститутивно экспрессируемый" и "конститутивная экспрессия" относятся к постоянной транскрипции нуклеотидной последовательности, функционально связанной с регуляторной последовательностью (такой как конститутивный промотор). Таким образом, например, культуральная среда не должна содержать субстрат для активации экспрессии нуклеотидной последовательности, кодирующей ксилозоизомеразу. В другом примере культуральная среда может не содержать субстрат, который ингибирует регуляторную последовательность и, таким образом, ингибирует экспрессию нуклеотидной последовательности, кодирующей ксилозоизомеразу.
Термин "промотор" используют в обычном его значении в данной области, например, в значении участка связывания РНК-полимеразы.
Усиленной экспрессии нуклеотидной последовательности(ей), кодирующей фермент(ы), упомянутый в настоящем документе, также можно достигать путем выбора гетерологичных регуляторных областей, например, областей промотора, секреторной лидерной последовательности и терминатора.
Предпочтительно, нуклеотидная последовательность(и), упомянутая в настоящем документе, функционально связана по меньшей мере с промотором.
Также для регуляции экспрессии полипептида(ов), упомянутого в настоящем документе, можно использовать другие промоторы.
Примеры пригодных промоторов для направления транскрипции нуклеотидной последовательности в клетках бактерий, грибов или дрожжей хорошо известны в данной области.
Кроме того, промотор может включать элементы, обеспечивающие или повышающие экспрессию в пригодном хозяине. Например, эти элементы могут представлять собой консервативные области, такие как бокс Прибнова или TATA-бокс.
В одном варианте осуществления промотор обеспечивает конститутивную экспрессию в клетке-хозяине нуклеотидной последовательности(ей), функционально связанной с промотором.
Конструкции
Термин "конструкция", который является синонимом таких терминов, как "конъюгат", "кассета" и "гибрид", включает нуклеотидную последовательность, упомянутую в настоящем документе, прямо или непрямо связанную с промотором.
Примером непрямого связывания является предоставление пригодной спейсерной группы, такой как последовательность интрона, такая как Sh1-интрон или ADH-интрон, между промотором и нуклеотидной последовательностью(ями), упомянутой в настоящем документе. Это же является справедливым для термина "слитый" в отношении настоящего изобретения, который включает прямое или непрямое связывание. В некоторых случаях эти термины не охватывают природную комбинацию нуклеотидной последовательности, кодирующей белок, обычно ассоциированную с промотором гена дикого типа, и когда они оба находятся в их природном окружении.
Конструкция также может содержать или экспрессировать маркер, который позволяет селекцию генетической конструкции.
Для некоторых применений, предпочтительно, конструкция содержит по меньшей мере нуклеотидную последовательность(и), упомянутую в настоящем документе, функционально связанную с промотором.
Промоторы
Как упоминается в настоящем документе, в одном аспекте настоящее изобретение относится к микроорганизму, который трансформирован нуклеотидной последовательностью, такой как промотор, которая обеспечивает сверхэкспрессию микроорганизмом ксилозоизомеразы.
Например, в геном микроорганизма встроен промотор, который обеспечивает сверхэкспрессию микроорганизмом (например, повышенную регуляцию) эндогенной нуклеотидной последовательности, кодирующей ксилозоизомеразу.
В одном варианте осуществления в геном микроорганизма встроен промотор, который обеспечивает конститутивную экспрессию микроорганизмом эндогенной нуклеотидной последовательности, кодирующей ксилозоизомеразу.
В другом аспекте промотор функционально связан с нуклеотидной последовательностью, например, в экспрессирующем векторе.
В одном варианте осуществления промотор обеспечивает конститутивную экспрессию нуклеотидной последовательности(ей), функционально связанной с промотором, в клетке-хозяине.
В другом аспекте промотор не подавляется присутствием глюкозы.
Примеры пригодных промоторов, которые можно использовать в микроорганизмах в соответствии с настоящим изобретением, таких как Saccharomyces cerevisiae, включают: промотор гена глицеральдегид-3-фосфатдегидрогеназы (GPD); промотор гена алкогольдегидрогеназы (ADH); и промотор гена тиротропного эмбрионального фактора (TEF).
Предпочтительные промоторы, которые можно использовать для сверхэкспрессии ксилозоизомеразы, могут представлять собой любые из регуляторных элементов, контролирующих экспрессию нуклеотидных последовательностей, кодирующих белки, вовлеченные в гликолиз и ферментацию глюкозы в дрожжах, в частности, в Saccharomyces, таких как S. cerevisiae. Их примерами являются промотор глюкокиназы (GLK1), промотор фосфоглюкозоизомеразы (PGI1), промотор фосфофруктокиназы (PFK1) и промотор глицеральдегид-3-фосфатдегидрогеназы (TDH3).
Биотопливо
Как используют в настоящем документе, термин "биотопливо" относится к топливу (например, жидкому топливу), пригодному для применения (например) в двигателях внутреннего сгорания. Указанное биотопливо получают из биологического материала, который содержит пентозные сахара и/или из которого пентозные сахара могут быть получены гидролизом ферментативным путем и/или обработкой кислотой. Предпочтительно, указанный сахар представляет собой альдопентозу ксилозу.
Растительные материалы, включающие растительные отходы, содержащие лигноцеллюлозный материал (например: солома из злаковых, такая как пшеничная солома; пульпа сахарной свеклы; жмых сахарного тростника; солома сорго; солома сои; маисовая солома; кукурузная солома; древесная стружка и бумажная пульпа) и целые растения (такие растения, которые выращивают для энергетических целей, например, просо), являются пригодными источниками пентозных сахаров, в частности, альдопентозных сахаров (таких как ксилоза), для настоящего изобретения. Другие пригодные источники растительного материала включают не являющиеся отходами продукты (иными словами, источники пищи и корма), такие как экстракт сахарного тростника, экстракт сахарной свеклы, сорго, соевые бобы, пшеничный крахмал и кукурузный крахмал.
Предпочтительно, биотопливо, упомянутое в настоящем документе, содержит по меньшей мере один спирт.
В предпочтительном аспекте спирт выбран из группы, состоящей из метанола, этанола, пропанола и бутанола. Более предпочтительно, биотопливао содержит этанол.
Предпочтительно, указанное биотопливо получают (или является получаемым), иными словами экстрагируют (или является экстрагируемым), из культуральной среды, в которой один или несколько трансформированных микроорганизмов в соответствии с настоящим изобретением культивируются в пригодных условиях. Указанное биотопливо можно получать (или является получаемым) из культуральной среды с использованием способов, которые являются общепринятыми в данной области, таких как удаление микроорганизма центрифугированием, выделение супернатанта с последующей перегонкой и следующую стадию дегидратации с получением на 99,5% чистого спирта, такого как этанол.
Биотопливо может содержать один или несколько других компонентов биотоплива, таких как бутанол.
Один или несколько дополнительных компонентов биотоплива можно смешивать с биотопливом до и/или после того, как биотопливо получают или экстрагируют (является получаемым или экстрагируемым) из культуры.
Альтернативно или дополнительно, один или несколько других компонентов биотоплива можно продуцировать культивированием микроорганизма в культуральной среде до и/или после и/или одновременно с культивированием трансформированного микроорганизма в соответствии с настоящим изобретением в культуральной среде для получения биотоплива.
Кроме того, настоящее изобретение относится к транспортному топливу, которое содержит биотопливо, продуцируемое с использованием микроорганизмов в соответствии с настоящим изобретением.
Этанол, используемый в качестве транспортного топлива, может выполнять две различных задачи:
(i) он может действовать в качестве оксигенированной добавки, которая повышает октановое число и снижает выброс реформулированного бензина (RFG) (замена тетраэтилсвинца или MTBE);
(ii) он может выступать в качестве частичной или полной замены бензина стандартного качества (RG) для снижения зависимости от снабжения горючим.
Безводный этанол имеет октановое число 130, и его можно добавлять в концентрациях 5-10% (в зависимости от сезона) в бензин стандартного качества, полученный прямо из нефтеперегонного завода. Традиционно, тетраэтилсвинец используют для повышения октанового числа, однако вследствие вопросов охраны здоровья, применение свинца запрещено практически во всем мире. Добавление оксигенатов к бензину стандартного качества снижает выброс монооксида углерода, а также других частиц, приводящих к загрязнению воздуха. Поначалу метил-трет-бутиловый эфир (MTBE) использовали в качестве оксигенирующей добавки, однако появление примеси MTBE в водоносных слоях с питьевой водой вынудило некоторые штаты запретить применение этого оксигената. Этанол в возрастающей степени используют по всему миру в качестве замены MTBE в качестве оксигенирующей добавки для изготовления RFG.
Помимо роли в качестве оксигенирующей добавки при изготовлении реформулированного бензина, этанол можно использовать в качестве общей замены для бензина стандартного качества. Автомобили могут использовать смеси E10 (10% добавленный этанол) без модификации двигателя.
Кроме того, производят транспортные средства, которые могут работать на 100% этаноле, иными словами, отсутствует необходимость в ископаемом топливе.
Трансформированные микроорганизмы в соответствии с настоящим изобретением или микроорганизмы, полученные способом в соответствии с настоящим изобретением, способны продуцировать биотопливо на более высоком уровне, чем эквивалентный микроорганизм перед трансформацией. Как используют в настоящем документе, термин "более высокая скорость" относится к трансформированному микроорганизму, который способен продуцировать в культуральной среде по меньшей мере на 5%, 10%, 20%, 25%, 30% или 35% больше биотоплива (такого как биоэтанол) на клетку, чем эквивалентный микроорганизм перед трансформацией при культивирования в тех же условиях культивирования в течение данного периода времени в экспоненциальной фазе роста.
Происходящий из ксилозы продукт
Как используют в настоящем документе, термин "происходящий из ксилозы продукт" или "продукт, происходящий из ксилозы" относится к любому соединению, происходящему из ксилозы.
Примеры продуктов, происходящих из ксилозы, включают, но не ограничиваются ими: этанол, ароматические аминокислоты, молочную кислоту, янтарную кислоту, уксусную кислоту, ацетальдегид, фурфураль, итаконовую кислоту, глутаминовую кислоту, лимонную кислоту, крезол, лизин, 3-гидроксипропионовую кислоту, поли-3-гидроксиалканоаты, протокатеховую кислоту, пирокатехол, гваякол, вератрол, резвератрол, ванилин, ванилиновую кислоту, ванилиновый спирт, муконовую кислоту, адипиновую кислоту, 4-гидроксибензойную кислоту, 4-гидроксибензальдегид, 4-метоксибензойную кислоту, 4-аминобензоат, 4-гидроксианилин, 4-метоксианилин, хинол, анизол, фенол, антраниловую кислоту, 3-гидроксиантранилат, 2,3-дигидроксибензойную кислоту, 2-аминофенол, 1,4-циклогександион, изопрен и стирол.
Продукт, происходящий из ксилозы, можно конвертировать в другой продукт. Например, кетопентоза D-ксилулоза, происходящая из альдопентозы D-ксилозы, может конвертироваться посредством пентозофосфатного пути в этанол.
Предпочтительно, указанный продут, происходящий из ксилозы, представляет собой один или несколько продуктов, выбранных из группы, состоящей из этанола, ароматических аминокислот, молочной кислоты, янтарной кислоты, уксусной кислоты, ацетальдегида, фурфураля, итаконовой кислоты, глутаминовой кислоты, лимонной кислоты, крезола, лизина, 3-гидроксипропионовой кислоты, поли-3-гидроксиалканоатов, протокатеховой кислоты, пирокатехола, гваякола, вератрола, резвератрола, ванилина, ванилиновой кислоты, ванилинового спирта, муконовой кислоты, адипиновой кислоты, 4-гидроксибензойной кислоты, 4-гидроксибензальдегида, 4-метоксибензойной кислоты, 4-аминобензоата, 4-гидроксианилина, 4-метоксианилина, хинола, анизола, фенола, антраниловой кислоты, 3-гидроксиантранилата, 2,3-дигидроксибензойной кислоты, 2-аминофенола, 1,4-циклогександиона, изопрена и стирола.
Более предпочтительно, указанный продукт, происходящий из ксилозы, представляет собой этанол.
Культуральная среда
В одном варианте осуществления культуральная среда содержит ксилозу и/или источник ксилозы.
Кроме того, культуральная среда может содержать по меньшей мере одну дополнительную пентозу. В предпочтительном аспекте культуральная среда дополнительно содержит по меньшей мере одну альдопентозу.
Предпочтительно, трансформированные микроорганизмы выращивают в оптимальной культуральной среде для указанного микроорганизма. Оптимальную культуральную среду можно определять с использованием общепринятых способов; кроме того, можно определять оптимальные условия роста.
В одном варианте осуществления культуральная среда содержит один или несколько субстратов, способных активировать экспрессию нуклеотидной последовательности, кодирующей ксилозоизомеразу в микроорганизме в соответствии с настоящим изобретением, однако указанная культуральная среда не содержит какой-либо субстрат, способный ингибировать нуклеотидную последовательность, кодирующую ксилозоизомеразу в микроорганизме в соответствии с настоящим изобретением. Например: если нуклеотидная последовательность, кодирующая ксилозоизомеразу, содержит индуцируемый ксилозой промотор, тогда среда содержит ксилозу.
В одном аспекте указанная культуральная среда содержит приблизительно 1%, приблизительно 2%, приблизительно 4%, приблизительно 8%, приблизительно 15% или приблизительно 25% ксилозы перед инокуляцией микроорганизмом (т.е. в нулевой момент времени).
Предпочтительно, указанная культуральная среда содержит оптимальные количества солей, витаминов и других питательных веществ, необходимых для микроорганизма.
Микроорганизмы, предпочтительно, культивируют при их оптимальной для роста температуре. Квалифицированный специалист способен легко определить оптимальную температуру для культивирования микроорганизмов, упомянутых в настоящем документе.
В одном варианте осуществления микроорганизмы культивируют при приблизительно 20°С, 25°C, 30°С, 35°С или 37°C.
В одном варианте осуществления микроорганизмы культивируют при приблизительно от 35°C до 39°C, предпочтительно при приблизительно от 36°C до 38°C, более предпочтительно при приблизительно от 35,5°C до 37,5°C.
В одном варианте осуществления микроорганизмы культивируют в течение приблизительно от 3 до 96 часов; предпочтительно приблизительно от 3 до 48 часов, приблизительно от 3 до 24 часов, приблизительно от 3 до 15 часов и приблизительно от 3 до 6 часов.
Предпочтительно, микроорганизмы культивируют в течение приблизительно 3 часов, приблизительно 6 часов, приблизительно 15 часов, приблизительно 24 часов, приблизительно 48 часов или приблизительно 96 часов.
В одном аспекте микроорганизм, в частности, трансформированный микроорганизм, является устойчивым к спирту и/или устойчивым к кислоте.
Термин "устойчивый к спирту" в отношении настоящего изобретения относится к микроорганизмам, которые способны расти в культуральной среде, которая содержит по меньшей мере 2%, 5%, 10% или 15% спирта.
Как упоминается в настоящем документе, термин "устойчивый к кислоте" относится к микроорганизмам, которые способны расти в культуральной среде, которая имеет значение pH, равное или меньшее чем 6,5, 6,0, 5,0, 4,0 или 3,0.
В предпочтительном аспекте культуральную среду инокулируют по меньшей мере от 5×107 до 5×1011 клеток на кг культуральной среды, предпочтительно от 5×l08 до 5×l010 клеток на кг культуральной среды, предпочтительно от 1×109 до 1×1010 клеток на кг культуральной среды и более предпочтительно приблизительно 5×109 клеток на кг культуральной среды.
Термины "инокулят" и "исходная культура" являются взаимозаменяемыми.
Условия культивирования позволяют по меньшей мере поддержание микроорганизма в соответствии с настоящим изобретением или микроорганизма, полученного способом в соответствии с настоящим изобретением. Условия культивирования необязательно могут позволять рост микроорганизма в соответствии с настоящим изобретением или микроорганизма, полученного способом в соответствии с настоящим изобретением.
Источники ксилозы
Ксилоза является альдопентозой. Ксилоза может быть получена из: растительных материалов, как правило, используемых в качестве пищевых или кормовых источников (таких как: сахарный тростник, сахарная свекла, сорго, пшеница и кукуруза - которые представляют собой богатые крахмалом и богатые сахаром растительные материалы); целых растений (таких как растения, выращенные для энергетических целей, например, просо); и, в частности, материалов сельскохозяйственных (растительных) отходов (такие как: солома злаковых, например, пшеничная солома; пульпа сахарной свеклы; жмых, например, жмых сахарного тростника; такие соломы, например, как солома сорго, сои, маиса или кукурузы; и древесная стружка).
Источники ксилозы для культуральной среды, описанной в настоящем документе, включают лигноцеллюлозные материалы, обычно считающиеся материалами сельскохозяйственных отходов. Стебли, стволы и листья содержат лигноцеллюлозный материал и, таким образом, являются источниками лигноцеллюлозного материала. Жмых сахарного тростника, кукурузная солома и древесная стружка (только гемицеллюлоза) являются тремя из легко доступных источников лигноцеллюлозного материала, поскольку их уже собирают или запасают в больших количествах по различным причинам.
Лигноцеллюлозный материал состоит, главным образом, из сахаров с длинной цепью. В среднем две трети из этих сахаров представляют собой гексозные сахара, которые, главным образом, присутствуют в целлюлозе, и одна треть сахаров представляют собой пентозные сахара, присутствующие, главным образом, в арабиноксилановых полимерах.
Значительное количество происходящего из гемицеллюлозы пентозного сахара представляет собой ксилозу.
Лигноцеллюлозные материалы можно гидролизовать для высвобождения гексозных и/или пентозных сахаров в сахарах с длинной цепью в целлюлозе, гемицеллюлозе и лигнине.
Гидролиз лигноцеллюлозных материалов можно проводить кислотной обработкой при повышенной температуре. Однако эта обработка может давать происходящие из сахара побочные продукты, которые являются токсичными для большинства микроорганизмов и препятствуют конверсии сахара в этанол. Такие токсичные побочные продукты (если они образуются) можно удалять, однако это обычно является неэкономичным.
Альтернативно, лигноцеллюлозные материалы можно гидролизовать с использованием ферментов, гидролизующих целлюлозу и гемицеллюлозу. Преимущественно, в этом процессе не образуются токсичные побочные продукты.
В предпочтительном аспекте культуральная среда содержит материал, происходящий из одного или нескольких лигноцеллюлозных материалов, которые были обработаны (примеры таких способов обработки включают: обработка паром, паровой взрыв, влажное окисление, кислотный гидролиз, щелочное влажное окисление и расширение волокон аммиаком) для высвобождения ксилозы. Предпочтительно, лигноцеллюлозный материал обрабатывают посредством процесса ферментативного гидролиза. Указанный гидролизованный лигноцеллюлозный материл можно далее обрабатывать для экстракции сахаров перед применением указанного экстракта в культуральной среде.
Гидролиз лигноцеллюлозного материала
Первоначальная механическая обработка:
Лигноцеллюлозный материал при необходимости измельчают на фрагменты меньшего размера. Например, пшеничную солому нарезают на фрагменты длиной приблизительно 5 см.
Последующая гидротермическая предварительная обработка:
Гидротермическую предварительную обработку лигноцеллюлозного материала можно проводить в качестве предварительной обработки паром с последующей стадией промывания, тем самым получая фракцию волокон и жидкую фракцию. Фракия волокон содержит более чем 90% целлюлозы, лигнин, первоначально присутствующий в целлюлозном материале, и некоторое количество гемицеллюлоз. Жидкая фракция содержит сахара гемицеллюлоз (C5-сахара), более чем 90% хлоридов щелочей, содержащихся в лигноцеллюлозной биомассе, и большую часть ингибиторов ферментации, возникающих при предварительной обработке лигноцеллюлозного сырья.
Как правило, пшеничную солому нагревают паром до температуры между 180 и 200°С в течение времени воздействия 5-15 мин. Предварительно обработанную биомассу выгружают из реактора высокого давления и промывают и прессуют. Высвобожденный пар собирают и повторно используют для выпаривания жидкой фракции с получением кормовой мелассы.
Ферментативный гидролиз:
Последующий гидролиз полимеров сахаров можно проводить путем добавления целлюлаз и гемицеллюлаз, либо перед ферментацией или в процессе ферментации, либо, среди прочего, в одновременном процессе осахаривания и ферментации.
Гексозы
Гексозные сахара имеют 6 атомов углерода. Альдогексозы имеют альдегид в 1 положении, и кетогексозы имеют кетон во 2 положении. Примером альдогексозы является глюкоза. Примером кетогексозы является фруктоза.
Пентозы
Пентозные сахара имеют 5 атомов углерода. Пентозы либо имеют альдегидную функциональную группу в 1 положении (альдопентозы), либо кетоновую функциональную группу во 2 положении (кетопентозы). Примерами пентоз являются ксилоза, арабиноза, рибоза, ликсоза, ксилулоза и рибулоза.
Альдопентозы
Примерами альдопентоз являются ксилоза, арабиноза, рибоза и ликсоза.
В одном аспекте предпочтительно указанной альдопентозой является ксилоза.
Ксилоза может представлять собой L-ксилозу или D-ксилозу.
Предпочтительно, указанная ксилоза представляет собой D-ксилозу.
Кетопентозы
Примерами кетопентоз являются ксилулоза и рибулоза.
В одном аспекте указанной кетопентозой является ксилулоза или рибулоза.
В одном предпочтительном аспекте указанной кетопентозой является ксилулоза.
Ксилулоза может представлять собой L-ксилулозу или D-ксилулозу.
Предпочтительно, указанная ксилулоза представляет собой D-ксилулозу.
В альтернативном варианте осуществления указанная кетопентоза представляет собой рибулозу. Более предпочтительно, указанная рибулоза представляет собой D-рибулозу.
Ферменты
Номенклатурные номера ферментов (номера EC), упомянутые в настоящем документе, относятся к рекомендациям Nomenclature Committee of the International Union of Biochemistry and Molecular Biology по номенклатуре и классификации ферментов, опубликованным в 1992 году (ISBN 0-12-227165-3).
Ферменты, упомянутые в настоящем документе, можно получать с помощью нуклеотидных последовательностей, происходящих из широкого множества источников. В одном аспекте нуклеотидные последовательности, кодирующие ферменты, упомянутые в настоящем документе, могут происходить или могут быть получаемыми из видов Lactococcus (таких как Lactococcus lactis и Lactococcus lactis subsp. lactis), Geobacillus stearothermophilus, Enterococcus faecalis, Piromyces sp, виды Thermoanaerobacter (такие как Thermoanaerobacter thermohydrosulfuricus и Thermoanaerobacter thermosulphurigenes), Pichia stipitis или Saccharomyces cerevisiae. Предпочтительно, нуклеотидные последовательности, кодирующие ферменты, упомянутые в настоящем документе, происходят или могут быть получаемыми из видов Lactococcus (таких как Lactococcus lactis и Lactococcus lactis subsp. lactis).
Ксилозоизомераза (EC 5.3.1.5)
Ксилозоизомераза имеет номенклатурный номер EC: EC 5.3.1.5. Ксилозоизомераза может быть обозначена как D-ксилозоизомераза, D-ксилозокетоизомераза или D-ксилозокетолизомераза.
Термин "ксилозоизомераза" относится к ферменту, который способен конвертировать D-ксилозу в D-ксилулозу и наоборот.
Ксилозоизомераза, упомянутая в настоящем документе, способна действовать на D-ксилозу.
Ксилозоизомераза может происходить из бактериальных видов, таких как виды Lactococcus. В частности, ксилозоизомераза может происходить из Lactococcus lactis subsp. lactis; Lactococcus lactis subsp. lactis штамм NRRL B-449; Lactococcus lactis subsp. lactis штамм KF 147; Lactococcus lactis subsp. lactis штамм DSM20175; и Lactococcus lactis subsp. lactis strain IO-1.
Примеры ксилозоизомераз, пригодных для применения, как описано в настоящем документе, включают ксилозоизомеразы, содержащие: аминокислотную последовательность, представленную в качестве SEQ ID NO: 14, SEQ ID NO: 11, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 или SEQ ID NO: 20, или ее вариант, гомолог или производное; аминокислотную последовательность, представленную как последовательность с регистрационным номером GenBank ABX75758; или аминокислотную последовательность, представленную как последовательность с регистрационным номером GenBank AAD20249.
Примеры ксилозоизомераз, пригодных для применения, как описано в настоящем документе, включают ксилозоизомеразу, кодируемую: нуклеотидной последовательностью, представленной в качестве SEQ ID NO: 1, SEQ ID NO: 10, SEQ ID NO: 17, SEQ ID NO: 12, SEQ ID NO: 27 или SEQ ID NO: 28, или ее вариантом, гомологом или производным; нуклеотидной последовательностью, кодирующей аминокислотную последовательность, представленную в качестве SEQ ID NO: 14, SEQ ID NO: 11, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 или SEQ ID NO: 20, или ее вариант, гомолог или производное.
Альдозо-1-эпимераза (EC 5.1.3.3)
Альдозо-1-эпимераза, упомянутая в настоящем документе, способна действовать на альдопентозу.
Альдозо-1-эпимераза имеет номенклатурный номер EC 5.1.3.3. Альдозо-1-эпимераза может быть обозначена как мутаротаза или альдозомутаротаза.
Термин "альдозо-1-эпимераза" относится к ферменту, который способен конвертировать α-альдозопентозу в β-альдопентозу и наоборот.
В предпочтительном варианте осуществления альдозо-1-эпимераза кодируется нуклеотидной последовательностью, выбранной из группы, состоящей из: AAD20257, ABX75760, AAK05605, AAD20245, AAD20251, ABJ73095, ABI49935 и AAO80762 (регистрационные номера NCBI). Более предпочтительно, альдозо-1-эпимераза выбрана из группы, состоящей из: AAD20257, ABX75760, AAK05605, AAD20245 и AAD20251.
Примеры альдозо-1-эпимераз, пригодных для применения, как описано в настоящем документе, включают альдозо-1-эпимеразу, кодируемую: нуклеотидной последовательностью гена альдозо-1-эпимеразы Lactococcus lactis (регистрационный номер NCBI AAD20245); нуклеотидной последовательностью гена GAL10 Saccharomyces cerevisiae (в частности, части, кодирующей аминокислотную последовательность, имеющую активность мутаротазы); и нуклеотидной последовательностью гена GAL10 Saccharomyces cerevisiae штамма D0002 (в частности, части, кодирующей аминокислотную последовательность, имеющую активность мутаротазы).
Альдозоредуктаза (EC 1.1.1.21)
Альдозоредуктаза имеет номенклатурный номер EC 1.1.1.21. Альдозоредуктаза может быть обозначена как: полиолдегидрогеназа, альдегидредуктаза, ALR2, NADPH-альдопентозоредуктаза, NADPH-альдозоредуктаза, алдитол:NADP оксидоредуктаза или алдитол:NADP+ 1-оксидоредуктаза.
Термин "альдозоредуктаза" относится к ферменту, который способен конвертировать альдитол в альдозу и наоборот.
Альдозоредуктаза может восстанавливать более одного типа альдозы. Например, один и тот же фермент может быть способен восстанавливать как D-ксилозу, так и L-арабиноза, и, таким образом, такой фермент может называться альдозоредуктазой, или он может быть назван более конкретно по одному из субстратов, например, ксилозоредуктаза.
Ксилозоредуктаза (EC 1.1.1.21)
В одном варианте осуществления альдозоредуктаза представляет собой ксилозоредуктазу. Ксилозоредуктаза имеет номенклатурный номер EC 1.1.1.21.
Термин "ксилозоредуктаза" относится к ферменту, который способен конвертировать D-ксилозу в ксилит и наоборот.
Ксилозоредуктаза, упомянутая в настоящем документе, способна действовать на D-ксилозу.
Примеры ксилозоредуктаз, пригодных для применения, как описано в настоящем документе, включают ксилозоредуктазу, кодируемую: нуклеотидной последовательностью гена ксилозоредуктазы Pichia stipitis (PsXR); нуклеотидной последовательностью гена ксилозоредуктазы Pichia stipitis штамма DSM3651 (PsXR) - регистрационный номер NCBI X59465; нуклеотидной последовательностью Candida tenuis (указанная нуклеотидная последовательность, кодирующая ксилозоредуктазу, может быть получена, как описано Kavanagh et al., 2003); и нуклеотидной последовательностью Neurospora crassa (указанная нуклеотидная последовательность, кодирующая ксилозоредуктазу, может быть получена, как описано Woodyer et al., 2005).
Арабинозоредуктаза (EC 1.1.1.21)
В другом варианте осуществления альдозоредуктаза представляет собой арабинозоредуктазу. Арабинозоредуктаза имеет номенклатурный номер EC 1.1.1.21.
Термин "арабинозоредуктаза" относится к ферменту, который способен конвертировать L-арабинозу в L-арабит и наоборот.
Арабинозоредуктаза, упомянутая в настоящем документе, способна действовать на L-арабинозу.
D-ксилозоредуктазы, известные в настоящее время в данной области, также могут действовать на L-арабинозу в качестве субстрата со сходной активностью. Таким образом, термин L-арабинозоредуктаза также может относиться к ферментам, которые классифицированы как являющиеся D-ксилозоредуктазами, и ксилозоредуктазы, упомянутые в настоящем документе как пригодные для включения в метаболизм ксилозы, аналогично пригодны для применения во включении в метаболизм арабинозы в микроорганизме.
В следующем варианте осуществления альдозоредуктаза может быть способна конвертировать L-ликсозу в L-арабит и наоборот. В другом варианте осуществления альдозоредуктаза может быть способна конвертировать D-ликсозу в D-арабит и наоборот.
В другом варианте осуществления альдозоредуктаза может быть способна конвертировать рибозу в рибит (в частности, D-рибозу в D-рибит) и наоборот.
Ксилулозоредуктаза (EC 1.1.1.9 и EC 1.1.1.10)
Термин "ксилулозоредуктаза" охватывает D-ксилулозоредуктазу и L-ксилулозоредуктазу.
D-ксилулозоредуктаза (EC 1.1.1.9)
D-ксилулозоредуктаза имеет номенклатурный номер EC 1.1.1.9. D-ксилулозоредуктаза может быть обозначена как ксилитдегидрогеназа, ксилит-2-дегидрогеназа, 2,3-цис-полиол(DPN)дегидрогеназа (C3-5), NAD-зависимая ксилитдегидрогеназа, эритритдегидрогеназа или пентитол-DPN-дегидрогеназа.
Термин "D-ксилулозоредуктаза" относится к ферменту, который способен конвертировать ксилит в D-ксилулозу и наоборот.
D-ксилулозоредуктаза, упомянутая в настоящем документе, способна действовать на ксилит.
Примеры D-ксилулозоредуктаз, пригодных для применения, как описано в настоящем документе, включают D-ксилулозоредуктазу, кодируемую: нуклеотидной последовательностью гена D-ксилулозоредуктазы Pichia stipitis (PsXDH); и нуклеотидной последовательностью гена D-ксилулозоредуктазы Pichia stipitis штамма DSM3651 (PsXDH) - регистрационный номер NCBI X55392.
L-ксилулозоредуктаза (EC 1.1.1.10)
L-ксилулозоредуктаза имеет номенклатурный номер EC 1.1.1.10. L-ксилулозоредуктаза может быть обозначена как L-ксилитдегидрогеназа.
Термин "L-ксилулозоредуктаза" относится к ферменту, который способен конвертировать L-ксилулозу в ксилит и наоборот.
L-ксилулозоредуктаза, упомянутая в настоящем документе, способна действовать на L-ксилулозу.
Нуклеотидная последовательность, кодирующая L-ксилулозоредуктазу, может происходить из Aspergillus niger, как описано Witteveen et al. (1994), или из дрожжей Ambrosiozyma monospora (Verho et al., 2004).
Ксилулокиназа (EC 2.7.1.17)
Ксилулокиназа имеет номенклатурный номер EC 2.7.1.17. Ксилулокиназа может быть обозначена как D-ксилулокиназа.
Термин "ксилулокиназа" относится к ферменту, который способен конвертировать D-ксилулозу в D-ксилулозо-5-фосфат и наоборот.
Ксилулокиназа, упомянутая в настоящем документе, способна действовать на D-ксилулозу.
Примеры ксилулокиназ, пригодных для применения, как описано в настоящем документе, включают ксилулокиназу, кодируемую: нуклеотидной последовательностью гена ксилулокиназы Pichia stipitis (PsXKS); нуклеотидной последовательностью гена ксилулокиназы Pichia stipitis штамма DSM3651 (PsXKS) - регистрационный номер NCBI AF127802; нуклеотидной последовательностью гена ксилулокиназы S. cerevisiae (ScXKS); и нуклеотидной последовательностью гена ксилулокиназы S. cerevisiae штамма D0002 (ScXKS) - регистрационный номер NCBI X61377.
D-арабинит-4-дегидрогеназа (EC 1.1.1.11)
D-арабинит-4-дегидрогеназа имеет номенклатурный номер EC 1.1.1.11. D-арабинит-4-дегидрогеназа может быть обозначена как D-арабитдегидрогеназа или арабитдегидрогеназа.
Термин "D-арабинит-4-дегидрогеназа" относится к ферменту, который способен конвертировать D-арабинит в D-ксилулозу и наоборот.
D-арабинит-4-дегидрогеназа, упомянутая в настоящем документе, способна действовать на D-арабинит.
Пригодная D-арабинит-4-дегидрогеназа и соответствующий ген описаны Cheng et al 2005.
L-арабинит-4-дегидрогеназа (EC 1.1.1.12)
L-арабинит-4-дегидрогеназа имеет номенклатурный номер EC 1.1.1.12. L-арабинит-4-дегидрогеназа может быть обозначена как L-арабит-4-дегидрогеназа или пентитол-DPN-дегидрогеназа.
Термин "L-арабинит-4-дегидрогеназа" относится к ферменту, который способен конвертировать L-арабинит в L-ксилулозу и наоборот.
L-арабинит-4-дегидрогеназа, упомянутая в настоящем документе, способна действовать на L-арабинит.
Пригодная L-арабинит-4-дегидрогеназа и соответствующий ген описаны Richard et al. (2001).
L-арабинозоизомераза (EC 5.3.1.4)
L-арабинозоизомераза имеет номенклатурный номер EC 5.3.1.4. L-арабинозоизомераза может быть обозначена как L-арабинозокетолизомераза.
Термин "L-арабинозоизомераза" относится к ферменту, который способен конвертировать L-арабинозу в L-рибулозу и наоборот.
L-арабинозоизомераза, упомянутая в настоящем документе, способна действовать на L-арабинозу.
Примером нуклеотидной последовательности, кодирующей L-арабинозоизомеразу, является нуклеотидная последовательность, которая может быть получена из Lactobacillus plantarum штамма NCIMB8826 (ATCC 14917) (ген, описанный под регистрационным кодом NCBI NC_004567).
Рибулокиназа (EC 2.7.1.16)
Рибулокиназа имеет номенклатурный номер EC 2.7.1.16. Рибулокиназа может быть обозначена как L-рибулокиназа.
Термин "рибулокиназа" относится к ферменту, который способен конвертировать (i) L-рибулозу в L-рибулозо-5-фосфат и наоборот; и/или (ii) D-рибулозу в D-рибулозо-5-фосфат и наоборот.
Рибулокиназа, упомянутая в настоящем документе, способна действовать на L-рибулозу и/или D-рибулозу.
Пригодную нуклеотидную последовательность, кодирующую рибулокиназу, можно получить из Lactobacillus plantarum штамм NCIMB8826 (ATCC 14917) (ген, описанный по регистрационным кодом NCBI NC_004567).
D-рибулокиназа (EC 2.7.1.47)
D-рибулокиназа имеет номенклатурный номер EC 2.7.1.47.
Термин "рибулокиназа" относится к ферменту, который способен конвертировать D-рибулозу в D-рибулозо-5-фосфат и наоборот.
Пример нуклеотидной последовательности, кодирующей D-рибулокиназу, может быть получен из Botryotinia fuckeliana (регистрационный код GenBank CH476984). Под регистрационным номером GenBank EDN20859 детально представлена аминокислотная последовательность D-рибулокиназы.
L-рибулозофосфат-4-эпимераза (EC 5.1.3.4)
L-рибулозофосфат-4-эпимераза имеет номенклатурный номер EC 5.1.3.4. L-рибулозофосфат-4-эпимераза может быть обозначена как рибулозофосфат-4-эпимераза, фосфорибулозоизомераза, L-рибулозо-5-фосфат-4-эпимераза, AraD или L-Ru5P.
Термин "L-рибулозофосфат-4-эпимераза относится к ферменту, который способен конвертировать L-рибулозо-5-фосфат в D-ксилулозо-5-фосфат и наоборот.
L-рибулозофосфат-4-эпимераза, упомянутая в настоящем документе, способна действовать на L-рибулозо-5-фосфат.
Пригодная нуклеотидная последовательность, кодирующая L-рибулозофосфат-4-эпимеразу, может быть получена из Lactobacillus plantarum штамма NCIMB8826 (ATCC 14917) (ген, описанный под регистрационным кодом NCBI NC_004567).
D-рибит-4-дегидрогеназа (EC 1.1.1.56)
D-рибит-4-дегидрогеназа имеет номенклатурный номер EC 1.1.1.56. Этот фермент также может быть обозначен как рибит-2-дегидрогеназа, адонитдегидрогеназа или рибитдегидрогеназа.
Термин "D-рибит-4-дегидрогеназа" относится к ферменту, который способен конвертировать рибит в D-рибулозу и наоборот.
D-рибит-4-дегидрогеназа, упомянутая в настоящем документе, способна действовать на D-рибит.
Пригодная D-рибит-4-дегидрогеназа и соответствующий ген описаны Dothie et al., 1985.
D-ликсозоизомераза (EC 5.3.1.15)
D-ликсозоизомераза имеет номенклатурный номер EC 5.3.1.15. Этот фермент также может быть обозначен как D-ликсозокетолизомераза.
Термин "D-ликсозоизомераза" относится к ферменту, который способен конвертировать D-ликсозу в D-ксилулозу и наоборот.
D-ликсозоизомераза, упомянутая в настоящем документе, способна действовать на D-ликсозу.
Нуклеотидную последовательность, кодирующую D-ликсозо/L-рибозоизомеразу, можно клонировать из организма Acinetobacter sp. штамма DL-28 (Shimonishi and Izumori, 1996) или из Aerobacter aerogenes (Anderson and Allison, 1965).
Рибозоизомераза (EC 5.3.1.20)
Рибозоизомераза имеет номенклатурный номер EC 5.3.1.20. Этот фермент также может быть обозначен как D-рибозоизомераза или D-рибозокетолизомераза.
Термин "рибозоизомераза" относится к ферменту, который способен конвертировать D-рибозу в D-рибулозу и наоборот.
Рибозоизомераза, упомянутая в настоящем документе, способна действовать на D-рибозу.
D-рибозоизомераза была найдена в организме Mycobacterium smegmatis (Izumori el al., 1975), из которого ее можно клонировать.
Рибулозо-5-фосфат-3-эпимераза (EC 5.1.3.1)
Рибулозо-5-фосфат-3-эпимераза имеет номенклатурный номер EC 5.1.3.1. Этот фермент также может быть обозначен как: пентозо-5-фосфат-3-эпимераза, фосфокетопентозо-3-эпимераза, фосфокетопентозоэпимераза, фосфорибулозоэпимераза, рибулозофосфат-3-эпимераза; D-рибулозо-5-фосфатэпимераза; D-рибулозофосфат-3-эпимераза; D-рибулозо-5P-3-эпимераза; D-ксилулозо-5-фосфат-3-эпимераза; эритрозо-4-фосфатизомераза; рибулозо-5-фосфат-3-эпимераза; и ксилулозофосфат-3-эпимераза.
Термин "рибулозо-5-фосфат-3-эпимераза" относится к ферменту, который способен конвертировать D-рибулозо-5-фосфат в D-ксилулозо-5-фосфат и наоборот.
Примеры рибулозо-5-фосфат-3-эпимеразы, пригодные для применения, как описано в настоящем документе, включают рибулозо-5-фосфат-3-эпимеразу, кодируемую: нуклеотидной последовательностью гена RPE1 S. cerevisiae; нуклеотидной последовательностью гена RPE1 S. cerevisiae штамма D0002; нуклеотидной последовательностью под регистрационным кодом NCBI NP_012414; и рибулозо-5-фосфатизомеразу из P. stiptitis, которая может быть найдена под регистрационным номером NCBI NP_012414.
Рибозо-5-фосфатизомераза (EC 5.3.1.6)
Рибозо-5-фосфатизомераза имеет номенклатурный номер EC 5.3.1.6. Этот фермент также может быть обозначен как фосфопентоизомераза, фосфопентозоизомераза, фосфопентозоизомераза, фосфорибоизомераза, рибозо-5-фосфатэпимераза, рибозофосфатизомераза, 5-фосфорибозоизомераза или D-рибозо-5-фосфаткетолизомераза.
Термин "рибозо-5-фосфатизомераза" относится к ферменту, который способен конвертировать D-рибозо-5-фосфат в D-рибулозо-5-фосфат и наоборот.
Примеры рибозо-5-фосфатизомеразы, пригодной для применения, как описано в настоящем документе, включают рибозо-5-фосфаткетолизомеразу, кодируемую: нуклеотидной последовательностью гена RKII S. cerevisiae; нуклеотидной последовательностью гена RKII S. cerevisiae штамма D0002; нуклеотидной последовательностью под регистрационным кодом NCBI X94335; нуклеотидной последовательностью под регистрационным кодом NCBI NP_014738, и рибозо-5-фосфатизомеразу из P. stiptitis, которая может быть найдена под регистрационным номером NC_009043.
Транскетолаза (EC 2.2.1.1)
Транскетолаза имеет номенклатурный номер EC 2.2.1.1. Этот фермент также может быть обозначен как гликольальдегидтрансфераза.
Термин "транскетолаза" относится к ферменту, который способен конвертировать седогептулозо-7-фосфат + D-глицеральдегид-3-фосфат в D-рибозо-5-фосфат + D-ксилулозо-5-фосфат и наоборот.
Примеры транскетолаз, пригодных для применения, как описано в настоящем документе, включают транскетолазу, кодируемую: нуклеотидной последовательностью гена TKL1 Saccharomyces cerevisiae; нуклеотидной последовательностью гена TKL1 Saccharomyces cerevisiae штамма D0002; нуклеотидной последовательностью под регистрационным кодом NCBI X73224; нуклеотидной последовательностью под регистрационным кодом NCBI NP_015399, и транскетолазу из P. stiptitis, которая может быть найдена под регистрационным номером CP000496.
Трансальдолаза (EC 2.2.1.2)
Трансальдолаза имеет номенклатурный номер EC 2.2.1.2. Этот фермент также может быть обозначен как дигидроксиацетонтрансфераза, дигидроксиацетонсинтаза, формальдегидтранскетолаза или глицеронтрансфераза.
Термин "трансальдолаза" относится к ферменту, который способен конвертировать седогептулозо-7-фосфат + D-глицеральдегид-3-фосфат в D-эритрозо-4-фосфат + D-фруктозо-6-фосфат и наоборот.
Примеры трансальдолаз, пригодных для применения, как описано в настоящем документе, включают трансальдолазу, кодируемую: нуклеотидной последовательностью гена TAL1 Saccharomyces cerevisiae; нуклеотидной последовательностью гена TAL1 Saccharomyces cerevisiae штамма D0002; нуклеотидной последовательностью под регистрационным кодом NCBI X15953; нуклеотидной последовательностью под регистрационным кодом NCBI NP_013458, и трансальдолазу из P. sliptitis, которая может быть найдена под регистрационным номером CP000502.
Экзогенная ксилозоизомераза
В одном аспекте ксилозоизомераза, упомянутая в настоящем документе, представляет собой экзогенную ксилозоизомеразу.
В одном аспекте нуклеотидная последовательность, кодирующая ксилозоизомеразу, упомянутую в настоящем документе, кодирует экзогенную ксилозоизомеразу.
Предпочтительно, экзогенная ксилозоизомераза происходит из мезофильного микроорганизма. Более предпочтительно, экзогенная ксилозоизомераза происходит из мезофильной бактерии.
Как используют в настоящем документе, термин "мезофильный микроорганизм" относится к микроорганизму, который растет и/или наилучшим образом разрастается при температуре между 15°C и 40°С. Примеры мезофильных микроорганизмов включают виды Lactococcus, виды Saccharomyces (такие как S. cerevisiae), виды Escherichia (такие как E. coli) и виды Bacillus (такие как B. subtilis).
В одном варианте осуществления экзогенная ксилозоизомераза происходит из вида Lactococcus. Предпочтительно, экзогенная ксилозоизомераза происходит из вида Lactococcus, способного расти на ксилозе. Предпочтительно, экзогенная ксилозоизомераза происходит из Lactococcus lactis. Более предпочтительно, экзогенная ксилозоизомераза происходит из Lactococcus lactis subsp. lactis. В высоко предпочтительном варианте осуществления экзогенная ксилозоизомераза происходит из Lactococcus lactis штамма NRRL B-4449, штамма DSM 20175, штамма KF147 или штамма IO-1.
Микроорганизм Lactococcus lactis subsp. lactis может быть обозначен как Lactobacillus xylosus.
Анализ альдопентозы
Количество альдопентозы (такой как ксилоза) в растворе (таком как культуральная среда) можно определять колориметрически способом с флюроглюцином, как описано Ebert et al. (A Simplified, Colorimetric Micromethod for Xylose in Serum or Urine, with Phloroglucinol, 1979, Clin. Chem. 25, no.8, pp. 1440-1443).
Цветной реагент состоит из 0,5 г флюроглюцина (1,3,5-тригидроксибензол), 100 мл ледяной уксусной кислоты и 10 мл концентрированной HCl. К 950 мкл цветного реагента добавляют 50 мкл образца. Смесь нагревают до 100°С в течение 4 минут, и считывают поглощение смеси при 554 нм. Количество альдопентозы (такой как ксилоза) в образце определяют согласно стандартной кривой, полученной с той же альдопентозой в качестве стандарта. Этот способ также можно использовать для определения количества арабинозы, ликсозы и рибозы в культуральной среде.
Анализ кетопентозы
Количество кетопентозы (такой как ксилулоза) в растворе (таком как культуральная среда) можно определять колориметрически способом с цистеин-карбазолом, как описано Zacharias Dische and Ellen Borenfreund (1951; J. Biol. Chem. 192 (2): 583).
Анализ ксилозоизомеразы
Величину активности ксилозоизомеразы в растворе можно определять следующим образом.
Превращение ксилозы в ксилулозу определяют в растворе, содержащем некоторое количество ксилозоизомеразы, 2% ксилозу и 2 мМ MgCl2 в 20 мМ TRIS-буфере, pH 7,4, и инкубацию проводят при выбранной температуре. Реакцию начинают добавлением ксилозы и останавливают помещением реакционной смеси или образца реакционной смеси на лед. Время реакции, как правило, составляет 30 или 60 минут, или образцы для последующей реакции можно отбирать в различные моменты времени. Полученную ксилулозу количественно определяют с использованием способа с цистеин/карбазолом (Dische and Borenfreund, 1951). Одну единицу активности ксилозоизомеразы определяют как величину активности, которая катализирует превращение 1 наномоль ксилозы в ксилулозу в минуту.
В высоко предпочтительном аспекте трансформированный микроорганизм имеет активность ксилозоизомеразы по меньшей мере 0,2 единицы ксилозоизомеразы на мг белка микроорганизма. Величину активности ксилозоизомеразы анализируют, как упоминается в настоящем документе, и содержание белка определяют, как описано ниже. Микроорганизмы предварительно культивируют в течение 96 часов или менее в культуральной среде, содержащей ксилозу.
Содержание белка
Количество белка (т.е. содержание белка) в растворе определяли с использованием коммерчески доступного набора для анализа BCA (Pierce Biotechnology inc., USA) на основе анализа с бицинхониновой кислотой (Smith et al., 1985), с использованием бычьего сывороточного альбумина в качестве стандарта.
Анализ этанола
Количество биотоплива, такого как этанол, в растворе (таком как культуральная среда) можно определять с использованием коммерчески доступного набора для анализа этанола, K-ETOH Kit, изготавливаемого и продаваемого Megazyme International, Bray Business Park, Bray, Co. Wicklow, Ирландия; или его можно определять, например, с использованием газовой хроматографии.
Пентозофосфатный путь
Кетопентозы (такие как ксилулоза) конвертируются в этанол через пентозофосфатный путь. Его пример представлен на фигуре 4.
Примеры ферментов, вовлеченных в пентозофосфатный путь, включают: транскетолазу, трансальдолазу, рибозо-5-фосфаткетолизомеразу и рибулозо-5-фосфат-3-эпимеразу.
В одном варианте осуществления микроорганизм в соответствии с настоящим изобретением также трансформирован для экспрессии или сверхэкспрессии одного или нескольких ферментов, вовлеченных в пентозофосфатный путь.
В одном варианте осуществления микроорганизм в соответствии с настоящим изобретением также трансформирован одной или несколькими нуклеотидными последовательностями, которые обеспечивают сверхэкспрессию микроорганизмом одного или нескольких ферментов, вовлеченных в пентозофосфатный путь. Например, в геном микроорганизма встраивают промотор, который обеспечивает сверхэкспрессию микроорганизмом эндогенной нуклеотидной последовательности, кодирующей фермент, вовлеченный в пентозофосфатный путь.
В другом варианте осуществления микроорганизм трансформирован одной или несколькими нуклеотидными последовательностями, кодирующими один или несколько ферментов, вовлеченных в пентозофосфатный путь. Например, микроорганизм трансформирован экспрессирующим вектором, содержащим нуклеотидную последовательность, кодирующую один или несколько ферментов, вовлеченных в пентозофосфатный путь.
Предпочтительно, экспрессирующий вектор, упомянутый в настоящем документе, содержит один или несколько промоторов, способных сверхэкспрессировать одну или несколько нуклеотидных последовательностей, кодирующих один или несколько ферментов, вовлеченных в пентозофосфатный путь. Примеры таких промоторов включают промотор GPD, промотор TEF и промотор ADP. Предпочтительные промоторы, которые можно использовать для сверхэкспрессии одной или нескольких нуклеотидных последовательностей, кодирующих один или несколько ферментов, вовлеченных в пентозофосфатный путь, могут представлять собой любые из регуляторных элементов, контролирующих экспрессию нуклеотидных последовательностей, кодирующих белки, вовлеченные в гликолиз и ферментацию глюкозы.
Как используют в настоящем документе, термин "сверхэкспрессировать" в выражении "одна или несколько нуклеотидных последовательностей, которые обеспечивают сверхэкспрессию микроорганизмом одного или нескольких ферментов, вовлеченных в пентозофосфатный путь" и "один или несколько промоторов, способных сверхэкспрессировать одну или несколько нуклеотидных последовательностей, кодирующих один или несколько ферментов, вовлеченных в пентозофосфатный путь" относится к увеличению экспрессии от нулевого уровня до некоторого уровня экспрессии или начиная с низкого уровня экспрессии до более высокого уровня экспрессии (например, повышение регуляции), когда трансформированный микроорганизм сравнивают с эквивалентным микроорганизмом перед трансформацией. Микроорганизмы, сверхэкспрессирующие один или несколько ферментов, вовлеченных в пентозофосфатный путь, имеют увеличенную способность катализировать конверсию кетопентозы (такой как ксилулозо-5-фосфат) в биотопливо (такое как этанол).
Предпочтительно, указанный трансформированный микроорганизм, который сверхэкспрессирует один или несколько ферментов, вовлеченных в пентозофосфатный путь, способен катализировать конверсию кетопентозы (такой как ксилулозо-5-фосфат) в биотопливо (такое как этанол) со скоростью, которая по меньшей мере на 10%, 15%, 20% или 25% более превышает скорость у нетрансформированного микроорганизма.
Примеры микроорганизмов, сверхэкспрессирующих один или несколько ферментов, вовлеченных в пентозофосфатный путь, включают: (i) микроорганизмы, трансформированные одним или несколькими экспрессирующими векторами, кодирующими одну или несколько из транскетолазы, трансальдолазы, рибозо-5-фосфаткетолизомеразы и рибулозо-5-фосфат-3-эпимеразы; и (ii) микроорганизмы, трансформированные для повышения регуляции экспрессии одной или нескольких нуклеотидных последовательностей, кодирующих одну или несколько из транскетолазы, трансальдолазы, рибозо-5-фосфаткетолизомеразы и рибулозо-5-фосфат-3-эпимеразы (перед трансформацией указанный микроорганизм был способен экспрессировать один или несколько из этих ферментов в данном наборе условий культивирования в ходе экспоненциального роста, однако после трансформации указанный микроорганизм способен сверхэкспрессировать один или несколько из этих ферментов на более высоком уровне, в тех же условиях культивирования, в процессе экспоненциального роста).
ВАРИАНТЫ/ГОМОЛОГИ/ПРОИЗВОДНЫЕ
Настоящее изобретение относится к применению вариантов, гомологов и производных любой аминокислотной последовательности белка или любой нуклеотидной последовательности, кодирующей такой белок.
В частности, настоящее изобретение относится к применению вариантов, гомологов и производных аминокислотной последовательности, кодируемой SEQ ID NO: 14, SEQ ID NO: 11, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 или SEQ ID NO: 20.
Кроме того, настоящее изобретение относится к применению вариантов, гомологов и производных нуклеотидной последовательности, кодирующей аминокислотную последовательность, представленную в качестве SEQ ID NO: 14, SEQ ID NO: 11, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 или SEQ ID NO: 20; и нуклеотидной последовательности, представленной в качестве SEQ ID NO: 1, SEQ ID NO: 10, SEQ ID NO: 17, SEQ ID NO: 12, SEQ ID NO: 27 или SEQ ID NO: 28.
Например, вариант, гомолог и производное нуклеотидной последовательности (такой как SEQ ID NO: 1, SEQ ID NO: 10, SEQ ID NO: 17, SEQ TD No 12, SEQ ID NO: 27 или SEQ ID NO: 28; или нуклеотидная последовательность, кодирующая аминокислотную последовательность, представленную в качестве SEQ ID NO: 14, SEQ ID NO: 11, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 или SEQ ID NO: 20), может содержать вплоть до 30, 21, 15, 9, 6 или 3 замен в нуклеиновой кислоте.
Например, вариант, гомолог и производное аминокислотной последовательности (такой как SEQ ID NO: 14, SEQ ID NO: 11, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 или SEQ ID NO: 20) может содержать вплоть до 10, 7, 5, 3, 2 или 1 аминокислотных замен.
Без связи с теорией, два аминокислотных остатка (а именно, D296 и D339) в ксилозоизомеразе могут быть вовлечены в связывание двухвалентных ионов металлов в активном центре (Meng, M. et al., 1993). В одном варианте осуществления D296 и D339 важны для связывания двухвалентных ионов металлов в активном центре. Таким образом, в одном варианте осуществления вариант, гомолог или производное аминокислотной последовательности (такой как SEQ ID NO: 14, SEQ ID NO: 11, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 или SEQ ID NO: 20) содержит аминокислоту аспарагиновую кислоту (D) в остатке 296 и/или аминокислоту аспарагиновую кислоту (D) в остатке 339 SEQ ID NO: 14, SEQ ID NO: 11, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 и SEQ ID NO: 20 или эквивалентную замену(ы) в других пригодных аминокислотных последовательностях.
Кроме того, без связи с теорией, аминокислотный остаток (гистидин 101) в ксилозоизомеразе может быть вовлечен в активный центр (Lee et al. 1989). В одном варианте осуществления для активного центра важен H101. Таким образом, в одном варианте осуществления вариант, гомолог или производное аминокислотной последовательности (такой как SEQ ID NO: 14, SEQ ID NO: 11, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 или SEQ ID NO: 20) содержит аминокислоту гистидин (H) в остатке 101 SEQ ID NO: 14, SEQ ID NO: 11, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 и SEQ ID NO: 20 или эквивалентную замену в других пригодных аминокислотных последовательностях.
В одном варианте осуществления вариант, гомолог или производное аминокислотной последовательности (такой как SEQ ID NO: 14, SEQ ID NO: 11, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 или SEQ ID NO: 20) содержит аминокислоту аргинин (R) в остатке 391 и/или аминокислоту лизин (K) в остатке 407 SEQ ID NO: 14, SEQ ID NO: 11, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 и SEQ ID NO: 20 или эквивалентные замены в других пригодных аминокислотных последовательностях.
В одном варианте осуществления вариант, гомолог и производное нуклеотидной последовательности (такой как SEQ ID NO: 1, SEQ ID NO: 10, SEQ ID NO: 17, SEQ ID NO: 12, SEQ ID NO: 27 или SEQ ID NO: 28; или нуклеотидная последовательность, кодирующая аминокислотную последовательность, представленную в качестве SEQ ID NO: 14, SEQ ID NO: 11, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 или SEQ ID NO: 20) содержит молчащие изменения в последовательности кодонов для того, чтобы последовательность была оптимизирована предпочтительными кодонами для конкретной клетки-хозяина, в которой последовательность экспрессируется. Например, использование кодонов в последовательности можно оптимизировать на основе таблицы использования кодонов дрожжами из базы данных использования кодонов Kazusa (Nakamura et al., 2000).
В настоящем документе термин "гомолог" означает молекулу, имеющую некоторую гомологию с рассматриваемыми аминокислотными последовательностями и рассматриваемыми нуклеотидными последовательностями. В настоящем документе термин "гомология" может быть отождествлен с "идентичностью".
В настоящем контексте подразумевают, что гомологичная последовательность включает аминокислотную последовательность, которая может быть по меньшей мере на 75, 80, 85 или 90% идентичной; предпочтительно по меньшей мере на 95, 96, 97, 98 или 99% идентичной рассматриваемой последовательности; и в высоко предпочтительном варианте осуществления по меньшей мере на 98, 99 или 99,5% идентична рассматриваемой последовательности. Как правило, гомолог содержит те же активные центры и т.д., что и рассматриваемая аминокислотная последовательность. Хотя гомологию также можно рассматривать с точки зрения сходства (т.е. аминокислотные остатки, имеющие сходные химические свойства/функции), в контексте настоящего изобретения предпочтительно выражать гомологию с точки зрения идентичности последовательностей.
В настоящем контексте подразумевают, что гомологичная последовательность включает нуклеотидную последовательность, которая может быть по меньшей мере на 75, 80, 85 или 90% идентичной; предпочтительно по меньшей мере на 95, 96, 97, 98 или 99% идентичной рассматриваемой последовательности; и в высоко предпочтительном варианте осуществления по меньшей мере на 98, 99 или 99,5% идентична рассматриваемой последовательности. Как правило, гомолог содержит те же последовательности, которые кодируют активные центры и т.д., что и рассматриваемая аминокислотная последовательность. Хотя гомологию также можно рассматривать с точки зрения сходства (т.е. аминокислотные остатки, имеющие сходные химические свойства/функции), в контексте настоящего изобретения предпочтительно выражать гомологию с помощью идентичности последовательностей.
Сравнение гомологии можно проводить визуально, или более часто, с помощью легко доступных программ для сравнения последовательностей. Эти коммерчески доступные компьютерные программы могут вычислять % гомологию между двумя или более последовательностями.
% гомологию можно вычислять на протяжении непрерывных последовательностей, т.е. одну последовательность выравнивают с другой последовательностью, и каждую аминокислоту в одной последовательности прямо сравнивают с соответствующей аминокислотой в другой последовательности, по одному остатку за один раз. Это называют выравниванием "без пропусков". Как правило, такое выравнивание без пропусков проводят только на протяжении относительно короткого количества остатков.
Хотя этот способ является очень простым и логичным, он не учитывает, например, того, что в идентичной в ином случае паре последовательностей, одна вставка или делеция приведет к выключению последующих аминокислотных остатков из выравнивания, таким образом, потенциально приводя к большому снижению % гомологии при проведении глобального выравнивания. Следовательно, большинство способов сравнения последовательностей предназначены для проведения оптимальных выравниваний, в которых учитываются возможные вставки и делеции без чрезмерного ухудшения показателя общей гомологии. Этого достигают внесением "пропусков" при выравнивании последовательностей, чтобы попытаться максимально увеличить локальную гомологию.
Однако эти более сложные способы присваивают "штрафы за пропуски" для каждого пропуска, который возникает при выравнивании, так что для одного и того же числа идентичных аминокислот, выравнивание последовательностей с максимально малым возможным количеством пропусков, отражающее более высокое родство между двумя сравниваемыми последовательностями, достигнет более высокого показателя, чем выравнивание со многими пропусками. Обычно используют "стоимость аффинного пропуска", которая присваивает относительно высокую стоимость для каждого существующего пропуска и меньший штраф для каждого последующего остатка в пропуске. Эта система оценки пропусков является наиболее широко используемой. Высокие штрафы за пропуски безусловно будут приводить к оптимизированному выравниванию с меньшим количеством пропусков. Большинство программ для выравнивания допускают модификацию штрафов за пропуски. Однако при использовании такого программного обеспечения для сравнения последовательностей предпочтительно использовать величины по умолчанию. Например, при использовании пакета программ GCG Wisconsin Bestfit штраф за пропуск по умолчанию для аминокислотных последовательностей составляет -12 для пропуска и -4 для каждого продолжения.
Вычисление максимальной % гомологии, таким образом, во-первых требует проведении оптимального выравнивания с учетом штрафов за пропуски. Пригодной компьютерной программой для проведения такого выравнивания является пакет программ GCG Wisconsin Bestfit (Devereux et al. 1984 Nuc. Acids Research 12 p387). Примеры другого программного обеспечения, которое может проводить сравнения последовательностей, включают, но не ограничиваются ими, пакет программ BLAST (см. Ausubel et al., 1999 Short Protocols in Molecular Biology, 4th Ed - Chapter 18), FASTA (Altschul et al., 1990 J. Mol Biol. 403-410) и набор инструментов сравнения GENEWORKS. Как BLAST, так и FASTA, доступны для поиска как в автономном, так и в интерактивном режиме (см. Ausubel et al., 1999, Short Protocols in Molecular Biology, pages 7-58 to 7-60). Однако для некоторых применений предпочтительно использовать программу GCG Bestfit. Также для сравнения белковой и нуклеотидной последовательностей доступен новый инструмент, называемый BLAST 2 Sequences (см. FEMS Microbiol Lett 1999 174(2): 247-50; FEMS Microbiol Lett 1999 177(1): 187-8 и tatiana@ncbi.nlm.nih.gov).
Хотя конечную % гомологию можно измерять в величинах идентичности, процесс выравнивания сам по себе, как правило, не основан на попарном сравнении по принципу "все или ничего". Вместо этого, обычно используют масштабную оценивающую сходство матрицу, которая присваивает баллы каждому попарному сравнению, исходя из сходства и эволюционного расстояния. Примером такой широко используемой матрицы является матрица BLOSUM62, матрица по умолчанию для набора программ BLAST. В программах GCG Wisconsin обычно используются либо общеизвестные величины по умолчанию, либо специальная таблица сравнения символов, если она предоставлена (для дальнейших деталей см. руководство пользователя). Для некоторых применений предпочтительно использовать общеизвестные величины по умолчанию для пакета программ GCG, или в случае другого программного обеспечения, матрицу по умолчанию, такую как BLOSUM62.
Альтернативно, процентную гомологию можно вычислять с использованием в элементе множественного выравнивания в DNASISTM (Hitachi Software), на основе алгоритма, аналогичного CLUSTAL (Higgins DG & Sharp PM (1988), Gene 73(1), 237-244).
После проведения программным обеспечением оптимального выравнивания, можно вычислить % гомологию, предпочтительно % идентичность последовательностей. Программное обеспечение, как правило, осуществляет это в качестве части сравнения последовательностей и выдает числовой результат.
Последовательности также могут иметь делеции, вставки или замены аминокислотных остатков, которые вызывают молчащие изменения и приводят к функционально эквивалентной молекуле. Преднамеренные аминокислотные замены можно проводить, исходя из сходства в полярности, заряде, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатков, при условии, что вторичная связывающая активность вещества сохраняется. Например, отрицательно заряженные аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту; положительно заряженные аминокислоты включают лизин и аргинин; и аминокислоты с незаряженными полярными концевыми группами, имеющие сходные величины гидрофильности, включают лейцин, изолейцин, валин, глицин, аланин, аспарагин, глутамин, серин, треонин, фенилаланин и тирозин.
Консервативные замены можно проводить, например, согласно таблице ниже. Аминокислоты в одном блоке во втором столбце и предпочтительно в одной строке в третьем столбце могут заменять друг друга:
Настоящее изобретение также относится к гомологичной замене (как замену, так и замещение используют в настоящем документе для обозначения обмена существующего аминокислотного остатка альтернативным остатком), которая может происходить, т.е. к замене подобной на подобную, такой как основной на основную, кислотной на кислотную, полярной на полярную и т.д. Также может происходить негомологичная замена, т.е. замена остатка одного класса на замену остатка другого класса, или альтернативно вовлекающая включение неприродных аминокислот, таких как орнитин (в дальнейшем обозначаемый как Z), диаминомасляная кислота орнитин (в дальнейшем обозначаемая как B), норлейцин орнитин (в дальнейшем обозначаемый как O), пирилаланин, тиенилаланин, нафтилаланин и фенилглицин.
Неприродные аминокислоты, на которые можно проводить замены, также включают; альфа*- и альфа-двухзамещенные* аминокислоты, N-алкиламинокислоты*, молочную кислоту*, галогенидные производные природных аминокислот, такие как трифтортирозин*, п-Cl-фенилаланин*, п-Br-фенилаланин*, п-I-фенилаланин*, L-аллил-глицин*, β-аланин*, L-α-аминомасланную кислоту*, L-γ-аминомаслянную кислоту*, L-α-аминоизомасляную кислоту*, L-ε-аминокапроевую кислоту#, 7-аминогептановую кислоту*, L-метионинсульфон#*, L-норлейцин*, L-норвалин*, п-нитро-L- фенилаланин*, L-гидроксипролин#, L-тиопролин*, метильные производные фенилаланина (Phe), такие как 4-метил-Phe*, пентаметил-Phe*, L-Phe (4-амино)#, L-Tyr (метил)*, L-Phe (4-изопропил)*, L-Tic (1,2,3,4-тетрагидроизохинолин-3-карбоксильную кислоту)*, L-диаминопропионовую кислоту# и L-Phe (4-бензил)*. Обозначение * использовали для целей представленного выше обсуждения (обозначение гомологичной или негомологичной замены), чтобы показать гидрофобную природы производного, в то время как # использовали, чтобы показать гидрофильную природу производного, #* указывает на амфипатические свойства.
Варианты аминокислотных последовательностей могут включать пригодные спейсерные группы, которые могут быть встроены между двумя аминокислотными остатками последовательности, включая алкильные группы, такие как метильная, этильная или пропильная группы, в дополнение к аминокислотным спейсерам, таким как остатки глицина или β-аланина. Следующая форма изменения, включающая присутствие одного или нескольких аминокислотных остатков в пептоидной форме, будет хорошо понятна специалистам в данной области. Для устранения сомнений, "пептоидную форму" используют для обозначения вариантных аминокислотных остатков, где α-углеродная группа заместителя находится на остатке атома азота, а не на α-углерода. Способы получения пептидов в пептоидной форме известны в данной области, например, Simon RJ el al., PNAS (1992) 89(20), 9367-9371 и Horwell DC, Trends Biolechnol. (1995) 13(4), 132-134. Нуклеотидные последовательности для применения в настоящем изобретении могут включать синтетические или модифицированные нуклеотиды. В данной области известен ряд различных типов модификации олигонуклеотидов. Они включают метилфосфонатные и фосфоротиоатные основные цепи и/или добавление акридиновых или полилизиновых цепей на 3'- и/или 5'-концы молекулы. Для целей настоящего изобретения следует понимать, что нуклеотидные последовательности, описанные в настоящем документе, можно модифицировать любым способом, доступным в данной области. Такие модификации можно проводить для повышения активности in vivo или увеличения времени существования нуклеотидных последовательностей по настоящему изобретению.
Также настоящее изобретение охватывает применение нуклеотидных последовательностей, которые комплементарны последовательностям, представленным в настоящем документе, или их любому производному, фрагменту или производному. Если последовательность комплементарна ее фрагменту, тогда эту последовательность можно использовать в качестве зонда для идентификации сходных кодирующих последовательностей в других организмах и т.д.
Полинуклеотиды, которые не являются на 100% гомологичными последовательностям, упомянутым в настоящем документе, можно получать рядом способов. Другие варианты последовательностей, описанных в настоящем документе, можно получать, например, с помощью библиотек ДНК-зондов. Кроме того, можно получать другие гомологи, и такие гомологи и их фрагменты, как правило, способны селективно гибридизоваться с последовательностями, представленными в списке последовательностей настоящего документа. Такие последовательности можно получать с помощью библиотек кДНК-зондов с зондами, содержащими всю любую из последовательностей в прилагаемых списках последовательностей или ее часть в условиях от средней до высокой строгости.
Варианты и штаммовые/видовые гомологи также можно получать с использованием вырожденной ПЦР, в которой используются праймеры, предназначенные для нацеливания на последовательности в вариантах и гомологах, кодирующих консервативные аминокислотные последовательности, в последовательностях, упомянутых в настоящем документе. Консервативные последовательности могут быть предсказаны, например, путем выравнивания аминокислотных последовательностей из нескольких вариантов/гомологов. Выравнивание последовательностей можно проводить с использованием компьютерного программного обеспечения, известного в данной области. Например, широко используют программу GCG Wisconsin PileUp.
Праймеры, используемые для вырожденной ПЦР, содержат одно или несколько вырожденных положений, и их используют в условиях более низкой строгости, чем условия для клонирования последовательностей с праймерами с единой последовательностью, в отношении известных последовательностей.
Альтернативно, такие полинуклеотиды можно получать сайт-направленным мутагенезом охарактеризованных последовательностей. Это может быть пригодно, когда, например, требуются молчащие изменения последовательности кодонов для оптимизации в кодоны, предпочтительные для конкретной клетки-хозяина, в которой намереваются экспрессировать полинуклеотидные последовательности. Могут быть желательными другие изменения последовательности для внесения участков распознавания ферментами рестрикции, или для изменения свойства или функции полипептидов, кодируемых полинуклеотидами.
Полинуклеотиды (нуклеотидные последовательности), упомянутые в настоящем документе, можно использовать для получения праймера, например, праймера для ПЦР, праймера для альтернативной реакции амплификации, зонда, например, меченного обеспечивающей выявление меткой, общепринятыми способами с использованием радиоактивных или нерадиоактивных меток, или полинуклеотиды можно клонировать в векторы. Такие праймеры, зонды и другие фрагменты имеют длину по меньшей мере 15, предпочтительно по меньшей мере 20, например, по меньшей мере 25, 30 или 40 нуклеотидов, и также охватываются термином "полинуклеотиды", как используют в настоящем документе.
Полинуклеотиды, такие как ДНК-полинуклеотиды и зонды, упомянутые в настоящем документе, можно продуцировать рекомбинантными способами, синтетическими способами или любыми способами, доступными специалистам в данной области. Также их можно клонировать стандартными способами.
Как правило, праймеры получают синтетическими способами, вовлекающими пошаговое получение желаемой последовательности нуклеиновой кислоты по одному нуклеотиду за один раз. Способы проведения этого синтеза с использованием автоматизированных технологий широко доступны в данной области.
Более длинные полинуклеотиды обычно можно получать с использованием рекомбинантных способов, например, с использованием способов клонирования на основе ПЦР (полимеразная цепная реакция). Праймеры можно конструировать так, чтобы они содержали пригодные участки распознавания ферментом рестрикции, так чтобы амплифицированную ДНК можно было клонировать в пригодный клонирующий вектор.
Далее изобретение описано с помощью примеров, и подразумевают, что они служат для помощи специалисту в данной области в осуществлении изобретения и не предназначены для ограничения каким-либо образом объема изобретения.
ПРИМЕРЫ
Общие способы технологии рекомбинантных ДНК
В настоящем изобретении используются, если нет иных указаний, общепринятые способы химии, молекулярной биологии, микробиологии, рекомбинантных ДНК и иммунологии, которые находятся в пределах способностей специалиста в данной области. Такие способы поясняются в литературе. См., например, J. B. Roe, J. Crabtree and A. Kahn, 1996, DNA Isolation and Sequencing: Essential Techniques, John Wiley & Sons; M. J. Gait (Editor), 1984, Oligonucleotide Synthesis: A Practical Approach, Irl Press; D. M. J. Lilley and J. E. Dahlberg, 1992, Methods of Enzymology: DNA Structure Part A: Synthesis and Physical Analysis of DNA Methods in Enzymology, Academic Press; Sambrook J., et al. (1989) Molecular Cloning: A Laboratory Manual, 2nd ed., Vol. 1-3. Cold Spring Harbor Laboratory Press; и Ausubel F. M., et al. (1995 (и периодические дополнения)) Current Protocols in Molecular Biology, Vol. ch. 9, 13 and 16. John Wiley & Sons, New York, N.Y. Каждый из этих общих справочников включен в настоящий документ в качестве ссылки.
Организмы:
Lactococcus является семейством грамположительных бактерий, обычно встречающихся во всех частях мира. Штаммы этого семейства имеют длительную историю безопасного применения для ферментации молочных продуктов для продукции, например, сыра. Такой штамм используют в этих примерах: штамм Lactococcus lactis DSM 20175, который может быть получен в депозитарном учреждении DSMZ - Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (German collection of Microorganisms and Cell Cultures).
Saccharomyces представляет собой семейство дрожжевых штаммов, обычно встречающихся во всех частях мира. Они имеют длительную историю безопасного применения для выпекания, пивоварения и виноделия, и в настоящее время являются наиболее хорошо охарактеризованными эукариотическими организмами. Таким образом, они являются очень популярным организмом для экспериментального применения в молекулярно-биологических и микробиологических лабораториях. В примерах настоящего документа использован штамм S. cerevisiae BY4741. Этот штамм может быть получен от Euroscarf (EUROpean Saccharomyces Cerevisiae ARchive for Functional Analysis - Германия).
Все из штамма S. cerevisiae T0040, штамма S. cerevisiae T0028, штамма S. cerevisiae T0049 и штамма S. cerevisiae T0004, использованных в представленных ниже примерах, представляют собой изогенные варианты, сконструированные из BY4741, полученного от Euroscarf.
Escherichia coli представляет собой грамположительную бактерию, которая обычно встречается в нижнем отделе кишечника высших животных и человека. Многие штаммы этого организма имеют длительную историю безопасного применения в микробиологических и молекулярно-биологических лабораториях. Штамм, используемый в представленных ниже примерах, представляет собой штамм E. coli DH5-alpha, широко используемый в молекулярно-биологических лабораториях для клонирования и размножения генетического материала. Этот штамм может быть получен от компании "InVitrogen" (InVitrogen Corporation, Калифорния, США).
Thermoanaerobacter представляет собой семейство термофильных анаэробно растущих грамположительных бактериальных штаммов. Оба штамма, ферменты из которых используются в представленных ниже примерах, Thermoanaerobacter thermohydrosulfuricus (DSM no. 15750) и Thermoanaerobacterium thermosulfurigenes (ATCC 33743) первоначально выделены из термальных источников, DSM no. 15750 в Ayas, Турция, и ATCC 33743 в Yellowstone National Park, США. Они могут быть получены из DSMZ - Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (German collection of Microorganisms and Cell Cultures). Однако генетический материал, кодирующий ферменты из этих штаммов и использованный в примерах, получен синтетически на основе обратной трансляции аминокислотных последовательностей, указанных в списке последовательностей в качестве SEQ ID NO: 15 и SEQ ID NO: 16.
Pichia stipitis представляют собой вид дрожжей, которые выделены из кишечников личинок насекомых и термитов. Штамм Pichia stipitis, гены из которого использовали в представленных ниже примерах, представляет собой штамм Pichia stipitis DSM no. 3651, который может быть получен из DSMZ - Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (German collection of Microorganisms and Cell Cultures).
Pseudomonas представляют собой многообразное семейство палочковидных аэробных грамотрицательных бактерий, обычно встречающихся в воде и в семенах растений и тканях растений. Штамм, используемый в этих примерах, представляет собой штамм Pseudomonas syringae DSM 50315, первоначально выделенный из порезанной растительной ткани. Этот штамм может быть получен из депозитарного учреждения DSMZ - Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (German collection of Microorganisms and Cell Cultures).
Пример 1 - Конструирование штамма S. cerevisiae, экспрессирующего XI Lactobacillus xylosus и ксилулозокиназу Pichia stipitis.
Пример 1a - клонирование TOPO гена D-ксилозоизомеразы из Lactobacillus xylosus (Lactococcus Metis, штамм DSM 20175), с использованием последовательностей праймеров, которые основаны на последовательности с регистрационным кодом NCBI AF092042 (SEQ ID NO: 1).
Целый ген D-ксилозоизомеразы L. xylosus (Lx XI) подвергали ПЦР-амплификации с ДНК, полученной из штамма DSM 20175 с использованием праймеров, обозначенных как SEQ ID NO: 2 и SEQ ID NO: 3. Кодирующая область гена ксилозоизомеразы, клонированного с помощью ПЦР из штамма Lactococcus lactis DSM 20175 с использованием праймеров, представленных в SEQ ID NO: 2 и SEQ ID NO: 3, представлена в SEQ ID NO: 17. Вносили участок рестрикции для NheI, проксимальный ATG-инициирующему кодону, и участок рестрикции для XhoI, дистальнее стоп-кодона, фланкирующие ген Lx XI. В качестве матрицы использовали ДНК из L. xylosus в концентрации 0,2 нг/мкл реакционной смеси для ПЦР. ПЦР проводили в 30 циклах из 30 секунд при 96°C, 30 секунд при 50°С и 150 секунд при 72°C, с последующей конечной инкубацией в течение 10 минут при 72°C с использованием высокоточной ДНК-полимеразы Phusion High Fidelity DNA-polymerase (Finnzymes Oy, Финляндия). Продукт ПЦР подвергали электрофоретическому разделению на 1% легкоплавком агарозном геле и выделяли фрагмент размером 1339 т.п.н. Фрагмент ДНК подвергали клонированию TOPO в вектор PCR-Blunt II-TOPO (Invitrogen, США) согласно инструкциям изготовителя, и полученную плазмиду использовали для трансформации E. coli TOP10. Плазмида была названа PCR-Blunt 2 LxXI.
Пример 1b - Конструирование плазмиды LxXI-2a, содержащей ген ксилозоизомеразы L. xylosus (LxXI) под контролем промотора GPD и терминатора CYC1 из S. cerevisiae.
Высококопийный челночный вектор E. coli/S. cerevisiae P426-GPD (Mumberg et al., 1995) расщепляли посредством SpeI и XhoI, и полученные концы дефосфорилировали щелочной фосфатазой. Аналогично, фрагмент ДНК, кодирующий ген ксилозоизомеразы L. xylosus высвобождали из вектора PCR-Blunt 2 LxXI (описанного в примере 1a) расщеплением посредством NheI и XhoI. Полученную линеаризованную плазмиду P426-GPD и фрагмент ДНК, кодирующий ThXI, подвергали электрофоретическому разделению на 1% легкоплавком агарозном геле и выделяли. Два фрагмента ДНК лигировали с получением плазмиды, названной LxXI-2a.
Пример 1c - клонирование TOPO гена D-ксилулокиназы из штамма Pichia stipitis DSM36S1 на основе последовательности с регистрационным кодом NCBI AF127802.
Целый ген D-ксилулокиназы P. stipitis (PsXKS) подвергали ПЦР-амплификации с ДНК, полученной из штамма DSM3651 с использованием праймеров, указанных в SEQ ID NO: 4 и SEQ ID NO: 5. Вносили участок рестрикции для NheI, проксимальный ATG-инициирующему кодону, и участок рестрикции для XhoI, дистальнее стоп-кодона, фланкирующие ген PsXKS. В качестве матрицы использовали ДНК из P. stipitis в концентрации 0,2 нг/мкл реакционной смеси для ПЦР. ПЦР проводили в 30 циклах из 30 секунд при 96°C, 30 секунд при 50°С и 150 секунд при 72°C, с последующей конечной инкубацией в течение 10 минут при 72°C с использованием высокоточной ДНК-полимеразы Phusion High Fidelity DNA-polymerase (Finnzymes Oy, Финляндия). Продукт ПЦР подвергали электрофоретическому разделению на 1% легкоплавком агарозном геле, и выделяли фрагмент размером 1891 т.п.н. Фрагмент ДНК подвергали клонированию TOPO в вектор PCR-Blunt II-TOPO (Invitrogen, США) согласно инструкциям изготовителя, и полученную плазмиду использовали для трансформации E. coli TOP10. Плазмида была названа PCR-Blunt 2 P.stip XKS.
Пример 1d - Конструирование плазмиды PsXKS-14a, содержащей ген D-ксилулокиназы (PsXKS) P. stipitis под контролем промотора GPD и терминатора CYC1 из S. cerevisiae.
Высококопийный челночный вектор E. coli/S. cerevisiae P426-GPD (Mumberg et al., 1995) расщепляли посредством SpeI и XhoI, и полученные концы дефосфорилировали щелочной фосфатазой. Аналогично, фрагмент ДНК, кодирующий ген ксилулозокиназы P. stipitis высвобождали из вектора PCR-Blunt 2 P.stip XKS (описанного в примере 1a) расщеплением посредством NheI и XhoI. Полученную линеаризованную плазмиду P426-GPD и фрагмент ДНК, кодирующий PsXKS, подвергали электрофоретическому разделению на 1% легкоплавком агарозном геле и выделяли. Два фрагмента ДНК лигировали с получением плазмиды, названной PsXKS-14a.
Пример 1e - Конструирование штаммов S. cerevisiae, содержащих LxXI-2a и PsXKS-14a.
200 нг каждой из плазмид объединяли и использовали для трансформации штамм дрожжей S. cerevisiae BY4741 (Euroscarf, Германия) способом электропорации с использованием системы Biorad Gene Pulser II system (Biorad, США) согласно инструкции изготовителя. Клетки дрожжей делали компетентными согласно стандартному протоколу (Becker and Guarente, 1991). Селекцию клонов, трансформированных обеими плазмидами, проводили на твердой синтетической полной среде, из которой исключены урацил и лейцин, и дополненной 2% D-глюкозой (SC-Ura, Leu) (Rose et al., 1990). Первичные колонии среднего размера повторно наносили штрихами на SC-Ura, Leu, и получали одну колонию штамма T0004, трансформированного плазмидами LxXI-2a и PsXKS-14a.
Пример 2 - Конструирование штамма S. cerevisiae, экспрессируклцего XI Thermoanaerobacter thermohydrosulfuricus и ксилулозокиназу Pichia stipitis.
Пример 2a - Конструирование синтетического гена ксилозоизомеразы, кодирующего ксилозоизомеразу Thermoanaerobacter thermohydrosulfuricus, на основе последовательности с регистрационным кодом NCBI D00756.
Целый ген ксилозоизомеразы Т. thermohydrosulfuricus (ThXI) синтезировали и подвергали сборке в Geneart AG (Regensburg, Германия). Использование кодонов в последовательности оптимизировали, исходя из таблицы использования кодонов дрожжами из базы данных использования кодонов Kazusa (Nakamura et al., 2000). В синтетическую конструкцию включали участок рестрикции для Nhel, проксимальнее ATG-инициирующего кодона, и участок рестрикции для Xhol, дистальнее стоп-кодона, фланкирующие открытую рамку считывания. Целостность синтетического гена ThXI определяли секвенированием обеих цепей. Нуклеотидная последовательность ThXI, включающая фланкирующие участки рестрикции, обозначена как SEQ ID NO: 6, где показана синтезированная последовательность ДНК с трансляцией аминокислот кодирующей области, представленной выше нуклеотидной последовательности. Содержащая ее плазмида была названа 0717046pGA14.
Пример 2b - Конструирование плазмиды ThXI-5а, содержащей ген ксилозоизомеразы Т. thermohydrosulfuricus (ThXI) под контролем промотора GPD и терминатора CYC1 из S. cerevisiae.
Высококопийный челночный вектор E. coli/S. cerevisiae P426-GPD (Mumberg et al., 1995) расщепляли посредством SpeI и XhoI, и полученные концы дефосфорилировали щелочной фосфатазой. Аналогично, фрагмент ДНК, кодирующий ген ксилозоизомеразы T. thermohydrosulfuricus, высвобождали из вектора 0717046pGA14 (описанного в примере 2a) расщеплением посредством NheI и XhoI. Полученную линеаризованную плазмиду P426-GPD и фрагмент ДНК, кодирующий ThXI, подвергали электрофоретическому разделению на 1% легкоплавком агарозном геле и выделяли. Два фрагмента ДНК лигировали с получением плазмиды, названной ThXI-5a.
Пример 2c - Конструирование штаммов S. cerevisiae, содержащих ThXI-5a и PsXKS-14a.
200 нг каждой из плазмид объединяли и использовали для трансформации штамм дрожжей S. cerevisiae BY4741 (Euroscarf, Германия) способом электропорации с использованием системы Biorad Gene Pulser II system (Biorad, США) согласно инструкции изготовителя. Клетки дрожжей делали компетентными согласно стандартному протоколу (Becker and Guarente, 1991). Селекцию клонов, трансформированных обеими плазмидами, проводили на твердой синтетической полной среде, из которой исключены урацил и лейцин, и дополненной 2% D-глюкозой (SC-Ura, Leu) (Rose et al., 1990). Первичные колонии среднего размера повторно наносили штрихами на SC-Ura, Leu, и получали одну колонию штамма T0049, трансформированного плазмидами ThXI-1a и PsXKS-14a.
Пример 3 - Конструирование штамма S. cerevisiae, экспрессирующего ксилозоизомеразу Thermoanaerobacter thermosulphurigenes и ксилулокиназу Pichia stipitis.
Пример 3a - Конструирование синтетического гена ксилозоизомеразы, кодирующего ксилозоизомеразу Thermoanaerobacter thermosulphurigenes, на основе последовательности с регистрационным кодом NCBI J05650.
Целый ген ксилозоизомеразы T. thermosulphurigenes (TsXI) синтезировали и подвергали сборке в Geneart AG (Regensburg, Германия). Использование кодонов в последовательности оптимизировали, исходя из таблицы использования кодонов дрожжами из базы данных использования кодонов Kazusa (Nakamura et al., 2000). В синтетическую конструкцию включали участок рестрикции для NheI, проксимальнее ATG-инициирующего кодона, и участок рестрикции для XhoI, дистальнее стоп-кодона, фланкирующие открытую рамку считывания. Целостность синтетического гена TsXI определяли секвенированием обеих цепей. Нуклеотидная последовательность TsXI, включающая фланкирующие участки рестрикции, обозначена как SEQ ID NO: 7, где показана синтезированная последовательность ДНК с трансляцией аминокислот кодирующей области, представленной выше нуклеотидной последовательности. Содержащая ее плазмида была названа 0717047pGA18.
Пример 3b - Конструирование плазмиды TsXI-28a, содержащей ген ксилозоизомеразы T. thermosulphurigenes (TsXI) под контролем промотора GPU и терминатора CYC1 из S. cerevisiae.
Высококопийный челночный вектор E. coli/S. cerevisiae P426-GPD (Mumberg et al., 1995) расщепляли посредством SpeI и XhoI, и полученные концы дефосфорилировали щелочной фосфатазой. Аналогично, фрагмент ДНК, кодирующий ген ксилозоизомеразы T. thermosulphurigenes, высвобождали из вектора 0717047pGA18 (описанного в примере 3a) расщеплением посредством NheI и XhoI. Полученную линеаризованную плазмиду P426-GPD и фрагмент ДНК, кодирующий TsXI, подвергали электрофоретическому разделению на 1% легкоплавком агарозном геле и выделяли. Два фрагмента ДНК лигировали с получением плазмиды, названной TsXI-28a.
Пример 3c - Конструирование штаммов S. cerevisiae, содержащих TsXI-28a и PsXKS-14a.
200 нг каждой из плазмид объединяли, и использовали для трансформации штамм дрожжей S. cerevisiae BY4741 (Euroscarf, Германия) способом электропорации с использованием системы Biorad Gene Pulser II system (Biorad, США) согласно инструкции изготовителя. Клетки дрожжей делали компетентными согласно стандартному протоколу (Becker and Guarente, 1991). Селекцию клонов, трансформированных обеими плазмидами, проводили на твердой синтетической полной среде, из которой исключены урацил и лейцин, и дополненной 2% D-глюкозой (SC-Ura, Leu) (Rose et al., 1990). Первичные колонии среднего размера повторно наносили штрихами на SC-Ura, Leu, и получали одну колонию штамма T0028, трансформированного плазмидами TsXI-28a и PsXKS-14a.
Пример 4 - конструирование штамма S. cerevisiae, экспрессирующего XylA Pseudomonas syringae (PsXI) и ксилулозокиназу Pichia stipitis.
Пример 4a - Клонирование TOPO гена D-ксилозоизомеразы (PsXI) из Pseudomonas syringae pv Tomato
Целый ген D-ксилозоизомеразы P. syringae (Ps XI) подвергали ПЦР-амплификации с ДНК, полученной из штамма DSM 50315 с использованием праймеров, обозначенных как SEQ ID NO: 8 и SEQ ID NO: 9. Вносили участок рестрикции для NheI, проксимальнее ATG-инициирующего кодона, и участок рестрикции для XhoI, дистальнее стоп-кодона, фланкирующие ген Ps XI. В качестве матрицы использовали ДНК из P. syringae в концентрации 0,2 нг/мкл реакционной смеси для ПЦР. ПЦР проводили в 30 циклах из 30 секунд при 96°C, 30 секунд при 50°С и 150 секунд при 72°C, с последующей конечной инкубацией в течение 10 минут при 72°C с использованием высокоточной ДНК-полимеразы Phusion High Fidelity DNA-polymerase (Finnzymes Oy, Финляндия). Продукт ПЦР подвергали электрофоретическому разделению на 1% легкоплавком агарозном геле и выделяли фрагмент размером 1323 т.п.н. Фрагмент ДНК подвергали клонированию TOPO в вектор pCR-Blunt II-TOPO (Invitrogen, США) согласно инструкциям изготовителя, и полученную плазмиду использовали для трансформации E. coli TOP10. Плазмида была названа pCR-Blunt 2 PsXI.
Пример 4b - Конструирование плазмиды PsXI-34a, содержащей ген ксилозоизомеразы P. syringae (PsXI) под контролем промотора GPD и терминатора CYC1 из S. cerevisiae.
Высококопийный челночный вектор E. coli/S. cerevisiae P426-GPD (Mumberg et al., 1995) расщепляли посредством SpeI и XhoI, и полученные концы дефосфорилировали щелочной фосфатазой. Аналогично, фрагмент ДНК, кодирующий ген ксилозоизомеразы P. syringae, высвобождали из вектора pCR-Blunt 2 PsXI (описанного в примере 4a) расщеплением посредством NheI и XhoI. Полученную линеаризованную плазмиду P426-GPD и фрагмент ДНК, кодирующий PsXI, подвергали электрофоретическому разделению на 1% легкоплавком агарозном геле и выделяли. Два фрагмента ДНК лигировали с получением плазмиды, названной PsXI-34a.
Пример 4c - Конструирование штаммов S. cerevisiae, содержащих PsXI-34a и PsXKS-14a.
200 нг каждой из плазмид объединяли, и использовали для трансформации штамм дрожжей S. cerevisiae BY4741 (Euroscarf, Германия) способом электропорации с использованием системы Biorad Gene Pulser II system (Biorad, США) согласно инструкции изготовителя. Клетки дрожжей делали компетентными согласно стандартному протоколу (Becker and Guarente, 1991). Селекцию клонов, трансформированных обеими плазмидами, проводили на твердой синтетической полной среде, из которой исключены урацил и лейцин, и дополненной 2% D-глюкозой (SC-Ura, Leu) (Rose et al., 1990). Первичные колонии среднего размера повторно наносили штрихами на SC-Ura, Leu, и получали одну колонию штамма T0040, трансформированного плазмидами PsXI-34a и PsXKS-14a.
Пример 5 - Определение и сравнение удельной активности ксилозоизомеразы, полученной при экспрессии четырех различных бактериальных ксилозоизомераз в Saccharomyces cerevisiae.
Четыре различных штамма: штамм S. cerevisiae T0040, содержащий PsXI-34a и PsXKS-14a; штаммы S. cerevisiae T0028, содержащие TsXI-28a и PsXKS-14a; штаммы S. cerevisiae T0049, содержащие ThXI-5a и PsXKS-14a; и штаммы S. cerevisiae T0004, содержащие LxXI-2a и PsXKS-14a; наносили штрихами на чашки и выращивали в течение ночи на твердой синтетической полной среде, из которой исключены урацил и лейцин, и дополненной 2% D-глюкозой (SC-Ura, Leu) (Rose et al., 1990).
50-мл пробирки, содержащие 10 мл синтетической полной среды, из которой исключены урацил и лейцин, и дополненной 2% D-глюкозой (SC-Ura, Leu) (Rose et al., 1990), инокулировали колониями из чашек с нанесенными штрихами штаммами, для доведения OD600 до 0,1, и выращивали в течение 18 часов при встряхивании, 200 об./мин., при 30°С. Культуры собирали центрифугированием, 4000 об./мин. в течение 15 минут, промывали ресуспендированием в 2 мл воды и снова осаждали. Клетки лизировали добавлением 300 мкл набора CelLytic Y Plus Kit (Sigma- Aldrich), а затем инкубировали при комнатной температуре в течение 30 минут при осторожном встряхивании и центрифугировали при 16000 × g в течение 10 минут для удаления клеточного дебриса. Супернатант выделяли и использовали для определения активности ксилозоизомеразы и содержания белка. Активность ксилозоизомеразы определяли с использованием способа с цистеин-карбазолом, как описано Dische и Borenfreund (Dische and Borenfreund, 1951). Содержание белка определяли с использованием коммерчески доступного набора для анализа с бицинхониновой кислотой (набор для анализа с BCA, Pierce Biotechnology inc., USA).
Результаты представлены на фигуре 5. Наиболее высокая общая активность ксилозоизомеразы на мг общего белка дрожжей, полученная при экспрессии ксилозоизомеразы L. xylosus, приблизительно в 10 раз превышает второй наилучший результат, полученный при экспрессии ксилозоизомеразы из T. thermohydrosulphuricus. Очевидно, что ксилозоизомераза L. xylosus значительно превосходит другие бактериальные изомеразы. Полученные результаты в единицах ксилозоизомеразы/мг белка дрожжей для двух термофильных бактерий, согласуются с другими результатами, полученными с использованием ксилозоизомераз из термофильных бактерий (Waifriedsson et al., 1996; Lonn et al., 2003), и удельная активность изомеразы L. xylosus равна или превышает удельную активность, полученную с использованием ксилозоизомеразы из гриба Piromyces sp. EII (Kuyper et al., 2003).
Пример 6 - Рост на ксилозе в качестве источника углерода штаммов S. cerevisiae, экспрессирующих LxXI-2a и PsXKS-14a (штамм Т0004).
Штамм S. cerevisiae Т0004, описанный в примере 1е, содержит экспрессирующую кассету, содержащую SEQ ID N0: 17 (которая кодирует ксилозоизомеразу), и экспрессирующую кассету, содержащую нуклеотидную последовательность, кодирующую ксилулокиназу P. slipitis.
Штамм Т0004, описанный в примере 1е, постепенно адаптировали к росту на ксилозе путем серийного разведения по содержанию глюкозы с последующим выращиванием на ксилозе в качестве единственного источника углерода. Это осуществляли с использованием следующей процедуры:
Рецепт синтетической полной среды для роста без урацила и лейцина (среда SC-Ura&Leu):
бакто-дрожжевые азотистые основания без аминокислот: 6,7 г/л; дополненные 40 мг/л всех аминокислот, за исключением лейцина; и дополненные п-аминобензойной кислотой, 40 мг/л.
Инокулировать первую культуральную пробирку, содержащую 10 мл среды SC-Ura&Leu, содержащей 2% ксилозу + 0,5% глюкозу, штаммом T0004. Инкубировать пробирку при 30°С и 150 об./мин. при вращении до достижения OD600 1,5. Эта культура обозначается в настоящем документе как "1. культура".
Инокулировать вторую культуральную пробирку, содержащую 9 мл среды SC-Ura&Leu, содержащей 2% ксилозу, 1 мл описанной выше "1. культуры". Инкубировать культуральную пробирку при 30°С и 150 об./мин. при вращении до достижения OD600 1,0. Эта культура обозначается в настоящем документе как "2. культура".
Инокулировать третью культуральную пробирку, содержащую 9 мл среды SC-Ura&Leu, содержащей 2% ксилозу, 1 мл описанной выше "2. культуры". Инкубировать культуральную пробирку при 30°С и 150 об./мин. при вращении до достижения OD600 от 0,5 до 1,0. Эта культура обозначается в настоящем документе как "3. культура".
Инокулировать 250-мл вращающиеся колбы с перегородками, содержащие 50 мл среды SC-Ura&Leu, содержащей 2% ксилозу, количеством "3. культуры", требуемым для достижения величины OD600 0,05. Инкубировать пробирку при 30°С и 150 об./мин. при вращении и наблюдение за ростом путем измерения OD600 на протяжении периода культивирования 240 часов.
Рост штамма T0004 на ксилозе в качестве источника углерода можно наблюдать на фигуре 6. После лаг-фазы максимальная скорость роста достигала 0,05/ч без других модификаций штамма.
Пример 7 - Демонстрация высокой активности ксилозоизомеразы в клетках S. cerevisiae путем внутриклеточной экспрессии трех встречающихся в природе вариантов и двух искусственных вариантов изомеразы Lactococcus.
Встречающиеся в природе ксилозоизомеразы с аминокислотными последовательностями, представленными в SEQ ID NO: 13, SEQ ID NO: 14 и SEQ ID NO: 18, внутриклеточно экспрессировали в штамме Saccharomyces cerevisiae BY4741 (Euroscarf, Германия). Кроме того, также получали (как подробно описано ниже) и экспрессировали два родственных варианта, не встречающихся в каком-либо организме. Аминокислотные последовательности этих двух вариантов представлены в SEQ ID NO: 19 и SEQ ID NO: 20. За исключением варьирования в аминокислотном положении 391 (аргинин или лизин), положении 407 (глутаминовая кислота или лизин) или 416 (тирозин или гистидин), все варианты имеют идентичные аминокислотные последовательности. Это означает, что по сравнению с SEQ ID NO: 18, SEQ ID NO: 13 имеет аминокислоту K в положении 391, аминокислоту K в положении 407 и аминокислоту H в положении 416. Эти аминокислоты в SEQ ID NO: 13 подчеркнуты в списке последовательностей. По сравнению с SEQ ID NO: 18, SEQ ID NO: 14 имеет аминокислоту K в положении 391. Эта аминокислота в SEQ ID NO: 14 подчеркнута в списке последовательностей. По сравнению с SEQ ID NO: 18, SEQ ID NO: 19 имеет аминокислоту K в положении 407 и аминокислоту H в положении 416. Эти аминокислоты в SEQ ID NO: 19 подчеркнуты в списке последовательностей. По сравнению с SEQ ID NO: 18, SEQ ID NO: 20 имеет аминокислоту K в положении 407. Эта аминокислота в SEQ ID NO: 20 подчеркнута в списке последовательностей.
Все последовательности ДНК, кодирующие аминокислотные последовательности SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 19 и SEQ ID NO: 20, использованные в этом примере, получали сайт-направленным мутагенезом последовательности ДНК, представленной в качестве SEQ ID NO: 17, с использованием конструкции, полученной, как описано в примере 1a, в качестве исходной матрицы. (Аминокислотная последовательность SEQ ID NO: 18 кодируется SEQ ID NO: 17.) Сайт-направленный мутагенез проводили с использованием набора "Quick Change" (Stratagene, La Jolla, США) для изменения кодонов, кодирующих аминокислотные остатки 391, 407 и 416, соответственно. Набор использовали согласно протоколу изготовителя. Последовательности мутагенных ДНК-праймеров представлены в SEQ ID NO: 21 и SEQ ID NO: 22 (замена R391K и удаление участка рестрикции Psp1406I), SEQ ID NO: 23 и SEQ ID NO: 24 (замена E407K и удаление участка рестрикции HindIII) и SEQ ID NO: 25 и SEQ ID NO: 26 (комбинированная замена E407K и Y416H и добавление участка рестрикции HindIII). Добавление или удаление участков рестрикции позволяет легкую идентификацию мутантных векторов. Правильность всех последовательностей ДНК полученных конструкций ДНК впоследствии подтверждали секвенированием ДНК.
Для внутриклеточной экспрессии вариантов ксилозоизомеразы использовали модифицированный вариант высококопийного челночного вектора pRS426-gpd E. coli/S. cerevisiae (Mumberg et al., 1995). Вектор модифицировали путем замены маркера URA3 в pRS426-gpd на маркер устойчивости к нурсеотрицину из вектора pAG35 (Euroscarf, Германия), с использованием стандартных молекулярно-биологических способов субклонирования. Этот полученный челночный вектор придает S. cerevisiae устойчивость к нурсеотрицину.
Пять различных генов ксилозоизомеразы выделяли и встраивали в модифицированный экспрессирующий вектор согласно описанию в примере 1b. Полученные плазмидные конструкции были названы pRS426gpd_nat::XI13, pRS426gpd_nat::XI14, pRS426gpd_nat::XI18, pRS426gpd_nat::XI19 и pRS426gpd_nat::XI20, соответственно.
Каждый вариант плазмидной конструкции трансформировали в штамм S. cerevisiae BY4741 (Euroscarf, Германия) посредством электропорации с использованием системы Biorad Gene Pulser II system (Biorad, USA) согласно инструкции изготовителя. Дрожжевые клетки делали компетентными согласно стандартному протоколу (Becker and Guarente, 1991). Селекцию трансформированных клонов проводили на чашках с YPD (20 г/л триптона, 10 г/л экстракта дрожжей и 20 г/л глюкозы с 15 г/л бактоагара, добавленного для застывания) содержащих 100 мг/л нурсеотрицина.
Получили пять клеточных линий, каждая из которых экспрессировала один из вариантов ксилозоизомераз Lactococcus.
Удельную активность ксилозоизомеразы в каждой клеточной линии определяли в двух экземплярах и сравнивали, как описано в примере 5, за исключением того, что среда, использованная для роста дрожжей, представляла собой YPD (20 г/л триптона, 10 г/л дрожжевого экстракта и 20 г/л глюкозы), дополненную 100 мг/л нурсеотрицина.
Полученная средняя удельная активность ксилозоизомеразы при определениях в двух экземплярах, вычисленная в качестве единиц ксилозоизомеразы/мг общего экстрагированного дрожжевого белка для пяти штаммов, представлена на фигуре 7.
Все протестированные варианты ксилозоизомеразы Lactococcus являются высоко активными при экспрессии в S. cerevisiae. Таким образом, это можно считать общим для генов ксилозоизомеразы lactococcus, которые кодируют активные ксилозоизомеразы в Lactococcus. Очевидно, что при сравнении активности SEQ ID NO: 19 и SEQ ID NO: 20, замена Y416H приводит к очень небольшой разнице в активности. Напротив, как замена K391R, так и замена E407K, повышают удельную активность в дрожжах приблизительно на 15-20%, и это эффект, по-видимому, является аддитивным при комбинировании этих двух замен, как в SEQ ID NO: 19 и SEQ ID NO: 20.
ССЫЛКИ:






Все публикации, упомянутые в представленном выше описании, включены в настоящий документ в качестве ссылок. Специалистам в данной области будут очевидны различные модификации и варианты описанных способов и системы по изобретению без отклонения от объема и сущности изобретения. Хотя изобретение описано применительно к конкретным предпочтительным вариантам осуществления, следует понимать, что заявленное изобретение не следует чрезмерно ограничивать такими конкретными вариантами осуществления. Действительно, подразумевают, что различные модификации описанных способов осуществления изобретения, которые очевидны специалистам в области биохимии и молекулярной биологии или родственных областей, находятся в объеме представленной ниже формулы изобретения.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1:
Кодирующая область гена ксилозоизомеразы Lactococcus lactis subsp. lactis (Lactobacillus xylosus) штамма NRRL-4449, как описано под регистрационным номером AF092042. Аминокислотная последовательность, кодируемая этой нуклеотидной последовательностью, представлена в качестве SEQ ID NO: 14.


SEQ ID NO: 2:
SEQ ID NO: 3:
SEQ ID NO: 4:
SEQ ID NO: 5:
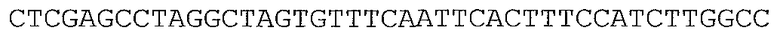
SEQ ID NO: 6:
Искусственный ген ксилозоизомеразы Thermoanaerobacter thermohydrosulfuricus, с N-концевой и C-концевой фланкирующими областями. Кодирующая область основана на аминокислотной последовательности под регистрационным кодом GenBank D00756. Аминокислотная последовательность, кодируемая кодирующей нуклеотидной последовательностью, представлена в качестве SEQ ID NO: 15.

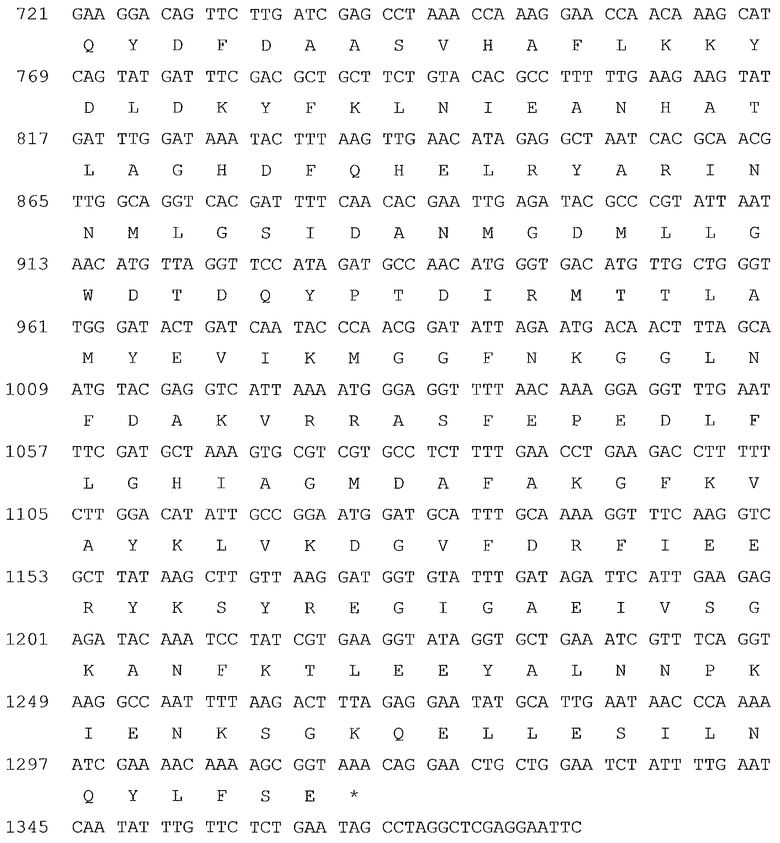

SEQ ID NO: 7:
Искусственный ген ксилозоизомеразы Thermoanaerobacter thermosulphurigenes с N-концевой и C-концевой фланкирующими областями. Кодирующая область основана на аминокислотной последовательности под регистрационным кодом GenBank J05650, за исключением того, что вторая аминокислота заменена с N на A для обеспечения использования "консенсусной последовательности Козака" для экспрессии в эукариотах. C. thermosulfurogenes представляет собой альтернативное название для Thermoanaerobacter thermosulphurigenes (Lee et al. 1993). Аминокислотная последовательность, кодируемая кодирующей областью этой нуклеотидной последовательности, представлена в качестве SEQ ID NO: 16.
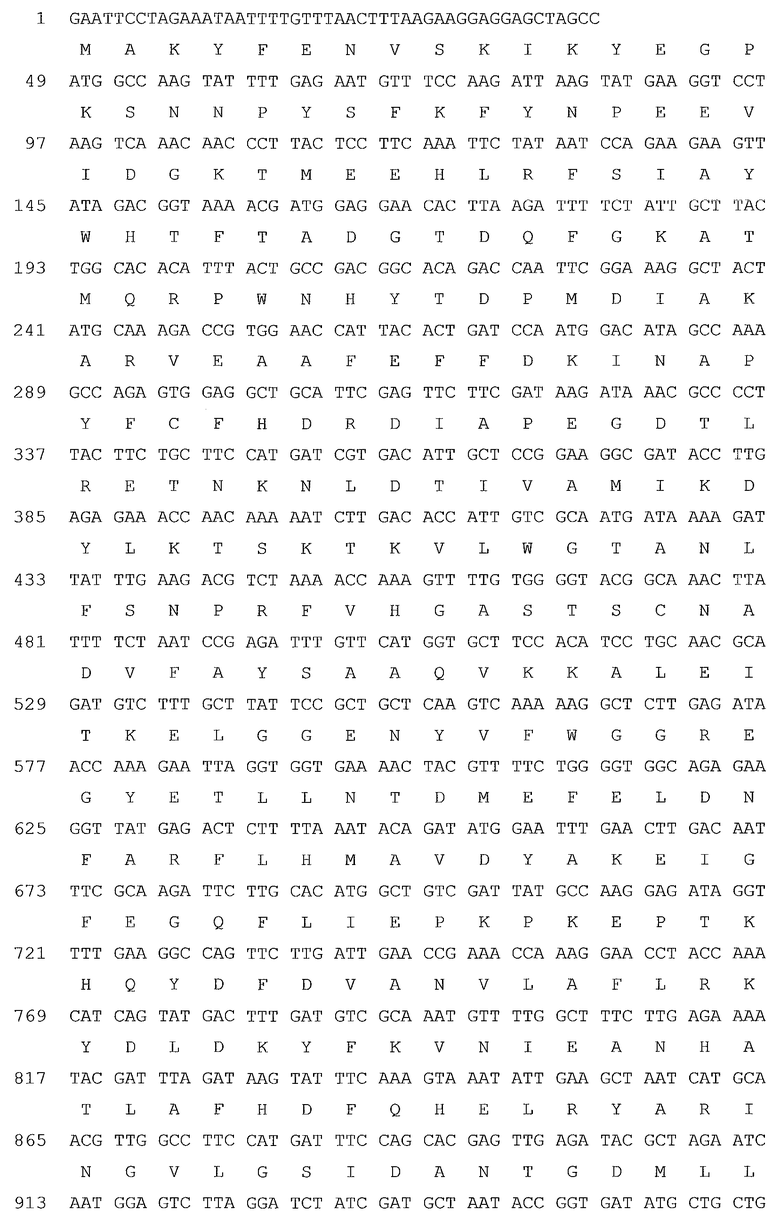

SEQ ID NO: 8:
SEQ ID NO: 9:
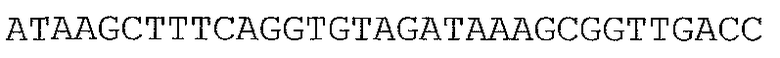
SEQ ID NO: 10:
Ген ксилозоизомеразы Lactococcus lactis subsp. lactis, штамм KF147. Основан на последовательности под регистрационным номером GenBank EU255918. Аминокислотная последовательность, кодируемая этой нуклеотидной последовательностью, представлена в качестве SEQ ID NO: 11.


SEQ ID NO: 11:
Ген ксилозоизомеразы Lactococcus lactis subsp. lactis, штамм KF147. Основан на последовательности с регистрационным номером GenBank ABX75758. Аминокислотная последовательность, кодируемая нуклеотидной последовательностью SEQ ID NO: 10.

SEQ ID NO: 12:
Ген ксилозоизомеразы Lactococcus lactis subsp. lactis, штамм IO-1. Основан на последовательности с регистрационным номером GenBank AF092041. Аминокислотная последовательность, кодируемая этой нуклеотидной последовательностью, представлена в качестве SEQ ID NO: 13.

SEQ ID NO: 13:
Ксилозоизомераза Lactococcus lactis subsp. lactis, штамм IO-1. Основана на последовательности с регистрационным номером GenBank AAD20249. Аминокислотная последовательность, кодируемая нуклеотидной последовательностью SEQ ID NO: 12. Аминокислоты, которые отличаются относительно SEQ ID NO: 18, подчеркнуты.

SEQ ID NO: 14:
Аминокислотная последовательность, кодируемая нуклеотидной последовательностью SEQ ID NO: 1. Аминокислота, которая отличается относительно SEQ ID NO: 18, подчеркнута.


SEQ ID NO: 15:
Регистрационный номер GenBank BAA00652. Аминокислотная последовательность, кодируемая кодирующей областью нуклеотидной последовательности SEQ ID NO: 6.


SEQ ID NO: 16:
Регистрационный номер GenBank AAA23285. Аминокислотная последовательность, кодируемая кодирующей областью нуклеотидной последовательности SEQ ID NO: 7.

SEQ ID NO: 17:
Кодирующая область гена ксилозоизомеразы, клонированного посредством ПЦР из штамма Lactococcus lactis, обозначенного как DSM 20175, с использованием праймеров, представленных в SEQ ID NO: 2 и SEQ ID NO: 3.


SEQ ID NO: 18:
Аминокислотная последовательность, кодируемая SEQ ID NO: 17.


SEQ ID NO: 19:
Искусственный вариант ксилозоизомеразы Lactococcus, аминокислотная последовательность (SEQ ID NO: 18). Аминокислоты, которые отличаются относительно SEQ ID NO: 18, подчеркнуты. Нуклеотидная последовательность, кодирующая эту аминокислотную последовательность, представлена в качестве SEQ ID NO: 27.

SEQ ID NO: 20:
Искусственный вариант ксилозоизомеразы Lactococcus, аминокислотная последовательность (SEQ ID NO: 18). Аминокислоты, которые отличаются относительно SEQ ID NO: 18, подчеркнуты. Нуклеотидная последовательность, кодирующая эту аминокислотную последовательность, представлена в качестве SEQ ID NO: 28.

SEQ ID NO: 21:
Смысловой праймер R391K:
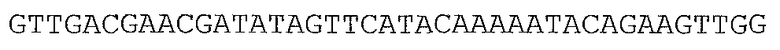
SEQ ID NO: 22:
Антисмысловой праймер R391K:
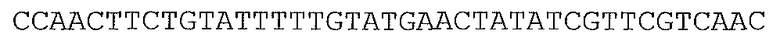
SEQ ID NO: 23:
Смысловой праймер E407K:
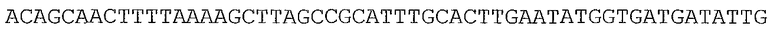
SEQ ID NO: 24:
Антисмысловой праймер E407K:
SEQ ID NO: 25:
Смысловой праймер E407K-Y416H:
SEQ ID NO: 26:
Антисмысловой праймер E407K-Y416H:
SEQ ID NO: 27:
Нуклеотидная последовательность, кодирующая аминокислотную последовательность, представленную в качестве SEQ ID NO: 19.

SEQ ID NO: 28:
Нуклеотидная последовательность, кодирующая аминокислотную последовательность, представленную в качестве SEQ ID NO: 20.


| название | год | авторы | номер документа |
|---|---|---|---|
| МИКРООРГАНИЗМЫ Corynebacterium, СПОСОБНЫЕ УТИЛИЗИРОВАТЬ КСИЛОЗУ, И СПОСОБ ПОЛУЧЕНИЯ L-ЛИЗИНА С ПРИМЕНЕНИЕМ ТАКИХ МИКРООРГАНИЗМОВ | 2013 |
|
RU2584593C2 |
| ВЕКТОР ДЛЯ НОКАУТА ГЕНА АЦЕТАТКИНАЗЫ В Clostridium thermocellum, КЛЕТКА-ХОЗЯИН, ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЙ МИКРООРГАНИЗМ Clostridium thermocellum, СПОСОБ ПОЛУЧЕНИЯ ТАКОГО МИКРООРГАНИЗМА И СПОСОБ ПРЕОБРАЗОВАНИЯ ЛИГНОЦЕЛЛЮЛОЗНОЙ БИОМАССЫ В ЭТАНОЛ. | 2008 |
|
RU2541785C2 |
| СПОСОБ ПОЛУЧЕНИЯ КСИЛИТА | 1993 |
|
RU2142999C1 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ МЕТОДОМ ФЕРМЕНТАЦИИ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИЙ, ОБЛАДАЮЩИХ ПОВЫШЕННОЙ ЭКСПРЕССИЕЙ ГЕНОВ УТИЛИЗАЦИИ КСИЛОЗЫ | 2005 |
|
RU2283346C1 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИЙ, ПРИНАДЛЕЖАЩИХ К РОДУ ESCHERICHIA | 2005 |
|
RU2304615C2 |
| ПОЛУЧЕНИЕ КСИЛИТА ИЗ ГЛЮКОЗЫ ПРИ ПОМОЩИ РЕКОМБИНАНТНОГО ШТАММА | 2015 |
|
RU2693593C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТОИНА | 2015 |
|
RU2686614C2 |
| ПОЛИПЕПТИД, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ D-ЛАКТАТДЕГИДРОГЕНАЗЫ, ПОЛИНУКЛЕОТИД, КОДИРУЮЩИЙ ЭТОТ ПОЛИПЕПТИД, И СПОСОБ ПОЛУЧЕНИЯ D-МОЛОЧНОЙ КИСЛОТЫ | 2010 |
|
RU2553563C2 |
| СПОСОБ ПРОДУКЦИИ СУЛЬФАТИРОВАННОГО ПОЛИСАХАРИДА И СПОСОБ ПРОДУКЦИИ PAPS | 2021 |
|
RU2811941C1 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ | 2008 |
|
RU2515044C2 |



























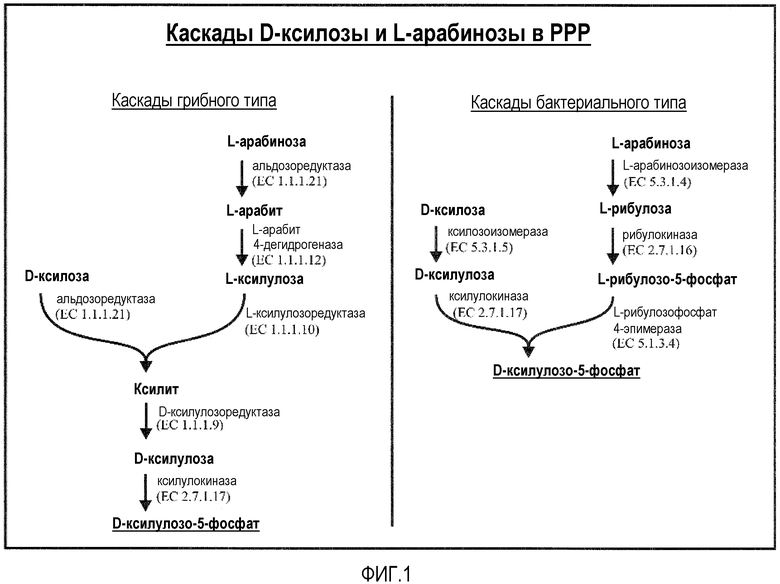

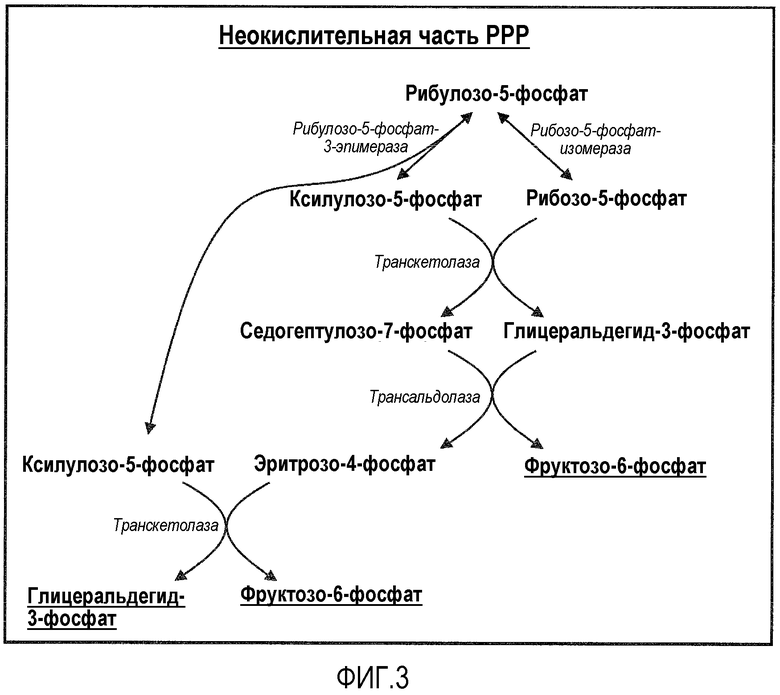
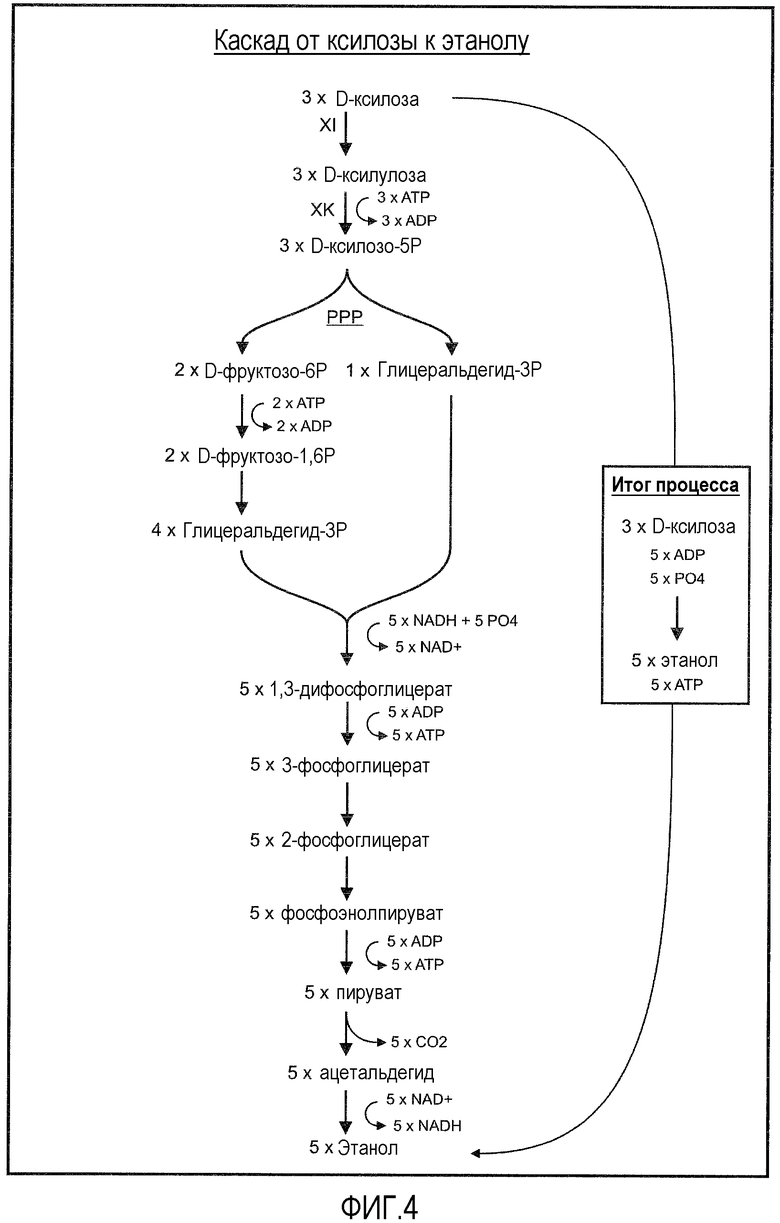
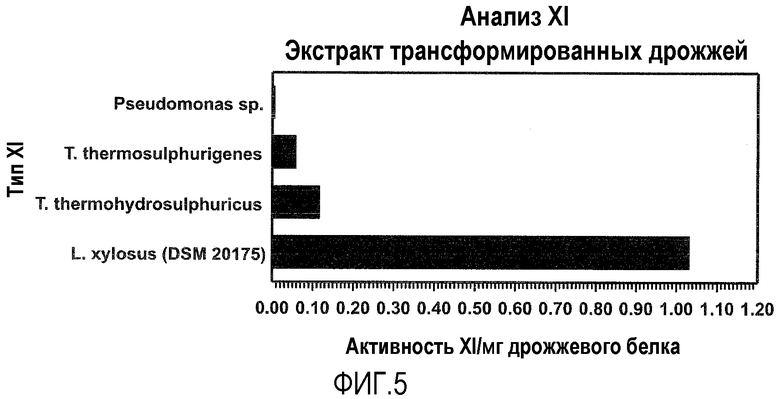
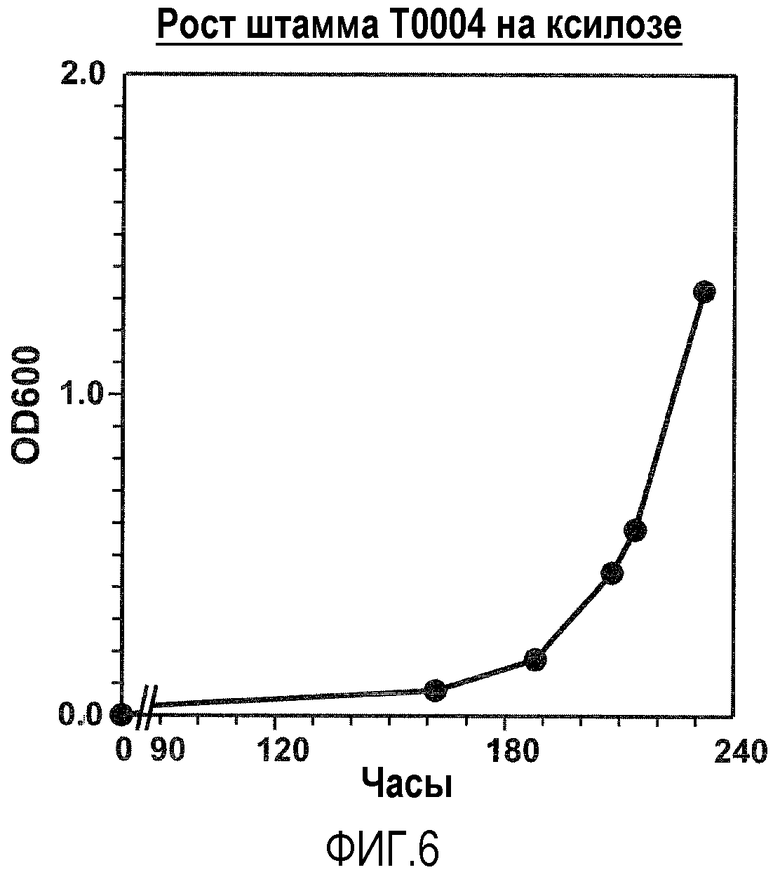
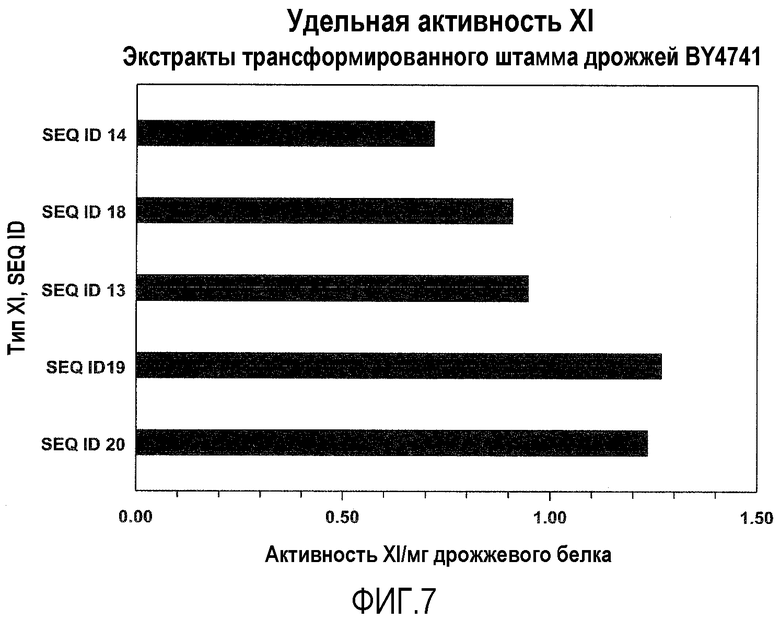
Изобретение относится к области биотехнологии. Представлен трансформированный микроорганизм - дрожжи Saccharomyces для получения этанола, где упомянутый микроорганизм трансформирован нуклеотидной последовательностью, кодирующей ксилозоизомеразу, и указанный микроорганизм трансформирован нуклеотидной последовательностью, кодирующей ксилулокиназу, или указанный микроорганизм трансформирован промотором, способным повышать экспрессию эндогенной ксилулокиназы. Указанный микроорганизм способен к более высокой активности ксилозоизомеразы; более высокой скорости роста в среде для роста или на среде для роста, содержащей ксилозу; более быстрому метаболизму ксилозы; и/или более быстрой продукции этанола при выращивании в анаэробных условиях на ксилозе в качестве источника углерода, чем у эквивалентного микроорганизма перед трансформацией. Описаны инокулят и культуральная среда, содержащие указанные трансформированные дрожжи и ксилозу или источник ксилозы. Предложен способ получения указанного трансформированного микроорганизма, включающий стадию трансформации микроорганизма нуклеотидной последовательностью, кодирующей ксилозоизомеразу, и либо нуклеотидной последовательностью, кодирующей ксилулокиназу, либо промотором, способным повышать экспрессию эндогенной ксилулокиназы. Раскрыт способ ферментации, включающий культивирование указанного микроорганизма в культуральной среде, содержащей ксилозу или источник ксилозы. Представлен способ получения биотоплива, содержащего этанол, где указанный способ включает стадию культивирования микроорганизма по настоящему изобретению в культуральной среде, содержащей ксилозу или источник ксилозы. Описано применение дрожжей по настоящему изобретению для получения этанола. Изобретение позволяет получать этанол с помощью указанного трансформанта в большем количестве, по сравнению с эквивалентным микроорганизмом до трансформации, на среде, содержащей ксилозу. 7 н. и 4 з.п. ф-лы, 7 ил., 1 табл., 7 пр.
1. Трансформированный микроорганизм, способный к:
(a) более высокой активности ксилозоизомеразы, чем у эквивалентного микроорганизма перед трансформацией; и/или
(b) более высокой скорости роста в среде для роста или на среде для роста, содержащей ксилозу, чем у эквивалентного микроорганизма перед трансформацией; и/или
(c) более быстрому метаболизму ксилозы, чем у эквивалентного микроорганизма перед трансформацией; и/или
(d) более быстрой продукции этанола при выращивании в анаэробных условиях на ксилозе в качестве источника углерода, чем у эквивалентного микроорганизма перед трансформацией,
где упомянутый микроорганизм трансформирован нуклеотидной последовательностью, кодирующей аминокислотную последовательность, представленную в качестве SEQ ID NO: 14, SEQ ID NO: 18, SEQ ID NO: 13, SEQ ID NO: 19 или SEQ ID NO: 20, или где указанный микроорганизм трансформирован нуклеотидной последовательностью, представленной в качестве SEQ ID NO: 1, SEQ ID NO: 17, SEQ ID NO: 12, SEQ ID NO: 27 или SEQ ID NO: 28;
и где указанный микроорганизм трансформирован нуклеотидной последовательностью, кодирующей ксилулокиназу, или указанный микроорганизм трансформирован промотором, способным повышать экспрессию эндогенной ксилулокиназы;
и где указанный трансформированный микроорганизм представляет собой трансформированные дрожжи, где указанные трансформированные дрожжи представляют собой Saccharomyces, и где упомянутая трансформированная Saccharomyces используется для получения продукта, происходящего из ксилозы, где продуктом, происходящим из ксилозы, является этанол.
2. Инокулят, содержащий микроорганизм по п. 1.
3. Культуральная среда, содержащая микроорганизм по п. 1, где упомянутая культуральная среда содержит ксилозу или источник ксилозы.
4. Культуральная среда по п. 3, где указанная культуральная среда содержит источник ксилозы.
5. Культуральная среда по п. 3 или 4, где указанная культуральная среда содержит материал, происходящий из лигноцеллюлозного материала.
6. Способ получения трансформированного микроорганизма, причем указанный способ включает стадию трансформации микроорганизма, так чтобы указанный трансформированный микроорганизм был способен к:
(a) более высокой активности ксилозоизомеразы, чем у микроорганизма перед трансформацией; и/или
(b) более высокой скорости роста в среде для роста или на среде для роста, содержащей ксилозу, чем у микроорганизма перед трансформацией; и/или
(c) более быстрому метаболизму ксилозы, чем у микроорганизма перед трансформацией; и/или
(d) более быстрой продукции этанола при выращивании в анаэробных условиях на ксилозе в качестве источника углерода, чем у микроорганизма перед трансформацией;
где указанный микроорганизм трансформирован нуклеотидной последовательностью, кодирующей ксилозоизомеразу, где указанная нуклеотидная последовательность содержит нуклеотидную последовательность, представленную в качестве SEQ ID NO: 1, SEQ ID NO: 17, SEQ ID NO: 12, SEQ ID NO: 27 или SEQ ID NO: 28, и где указанную нуклеотидную последовательность вводят в геном;
и где указанный микроорганизм трансформирован нуклеотидной последовательностью, кодирующей ксилулокиназу, или указанный микроорганизм трансформирован промотором, способным повышать экспрессию эндогенной ксилулокиназы;
и где указанный трансформированный микроорганизм представляет собой трансформированные дрожжи, где указанные трансформированные дрожжи представляют собой Saccharomyces.
7. Способ по п. 6, где указанная нуклеотидная последовательность, кодирующая ксилозоизомеразу, присутствует в кодирующем ее экспрессирующем векторе.
8. Способ ферментации, включающий культивирование в культуральной среде микроорганизма по п. 1 или микроорганизма, полученного способом по п. 6, где упомянутая культуральная среда содержит ксилозу или источник ксилозы.
9. Способ получения биотоплива, где указанный способ включает стадию культивирования в культуральной среде микроорганизма по п. 1 или микроорганизма, полученного способом по п. 6, где упомянутая культуральная среда содержит ксилозу или источник ксилозы, и где биотопливо содержит этанол.
10. Способ по п. 9, где указанный способ дополнительно включает стадию получения биотоплива из культуральной среды.
11. Применение микроорганизма по п. 1 или микроорганизма, полученного способом по п. 6 для получения продукта, происходящего из ксилозы, где продуктом, происходящим из ксилозы, является этанол.
| K | |||
| L | |||
| TRAFF, et al "Deletion of the GRE3 Aldose Reductase Gene and Its Influence on Xylose Metabolism in Recombinant Strains of Saccharomyces cerevisiae Expressing the xylA and XKS1 Genes", APPLIED AND ENVIRONMENTAL MICROBIOLOGY, Dec | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Приспособление для получения кинематографических стерео снимков | 1919 |
|
SU67A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| КОНТРОЛЬНЫЙ АППАРАТ ДЛЯ КИПЯТИЛЬНИКОВ | 1926 |
|
SU5668A1 |
| MERVI H | |||
| TOIVARI, et al., "Conversion of Xylose to Ethanol by Recombinant | |||
Авторы
Даты
2015-06-20—Публикация
2009-12-10—Подача