Настоящее изобретение относится к кристаллическим формам и гидратам гидрохлорида FTY720 и к их применению.
Соединения 2-амино-2-[2-(4-С2-20алкилфенил)этил]пропан-1,3-диола раскрыты в заявке EP-A-0627406, релевантное описание которой включено в настоящее описание посредством ссылки. Исходя из наблюдаемой активности, было установлено, что данные соединения пригодны в качестве иммунодепрессантов. Поэтому данные соединения могут быть пригодны для лечения или предотвращения различных аутоиммунных состояний, включая рассеянный склероз. Конкретным соединением данного класса является FTY720 (2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диол; финголимонд), который может быть получен из свободного основания или гидрохлоридной соли. FTY720 имеет следующую структуру:
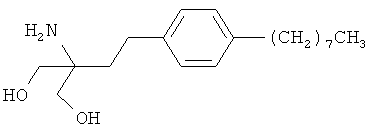
Настоящее изобретение частично основано на открытии того, что гидрохлорид FTY720 проявляет полиморфизм. Как следует из приведенных в данной заявке примеров, гидрохлорид FTY720 при комнатной температуре существует в конкретной кристаллической форме (далее Форма I). Кристаллическая Форма I претерпевает трансформацию в альтернативную кристаллическую форму (Форма II) при температуре перехода приблизительно 40°C. Кроме того, кристаллическая Форма II претерпевает переход в третью кристаллическую форму (Форма III) при температуре приблизительно 66°C. При температуре приблизительно 107°C гидрохлорид FTY720 образует фазу с низким кристаллическим порядком.
Таким образом, настоящее изобретение относится к новым кристаллическим формам гидрохлорида FTY720, включая их сольваты и, особенно, гидраты.
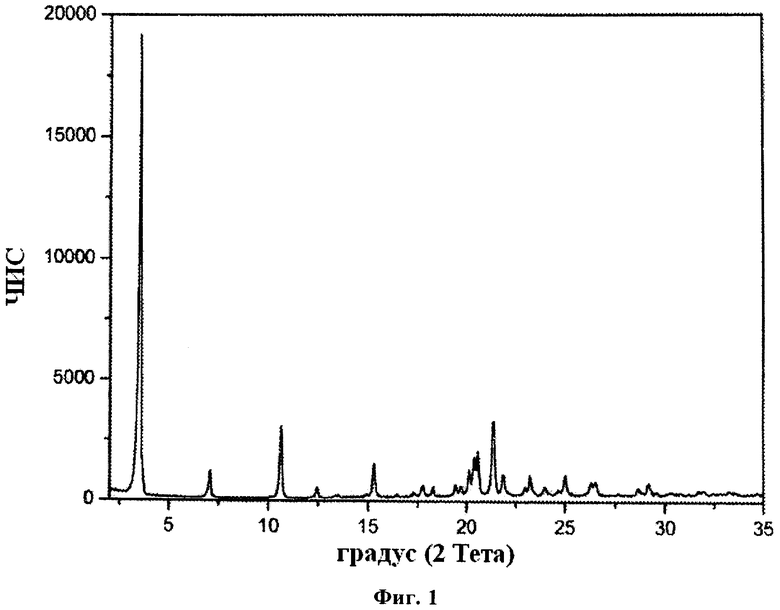
Кристаллическая Форма I гидрохлорида FTY720 характеризуется рентгеновской порошковой дифрактограммой, имеющей пики, по меньшей мере, у двух, предпочтительно, по меньшей мере, у четырех, и более предпочтительно у всех перечисленных значений 2-Тета: 3,6, 7,1, 10,7, 12,5, 15,4 и 20,6 градусов 2-Тета. Пики при перечисленных значениях 2-Тета имеют следующую относительную интенсивность: 3,6 (сильная), 7,1 (слабая), 10,7 (слабая), 12,5 (слабая), 15,4 (средняя) и 20,6 (средняя).
В одном из вариантов осуществления изобретения данная кристаллическая форма характеризуется рентгеновской порошковой дифрактограммой, имеющей пики, по меньшей мере, у двух, предпочтительно, по меньшей мере, у четырех, и более предпочтительно у всех перечисленных значений 2-Тета: 3,55, 7,12, 10,71, 12,48, 15,42 и 20,59 градусов 2-Тета. Пики при перечисленных значениях 2-Тета имеют следующую относительную интенсивность: 3,55 (сильная), 7,12 (слабая), 10,71 (слабая), 12,48 (слабая), 15,42 (средняя) и 20,59 (средняя).
В частном варианте осуществления изобретения данная кристаллическая форма, характеризуется рентгеновской порошковой дифрактограммой, соответствующей по существу дифрактограммой, представленной на фиг.1.
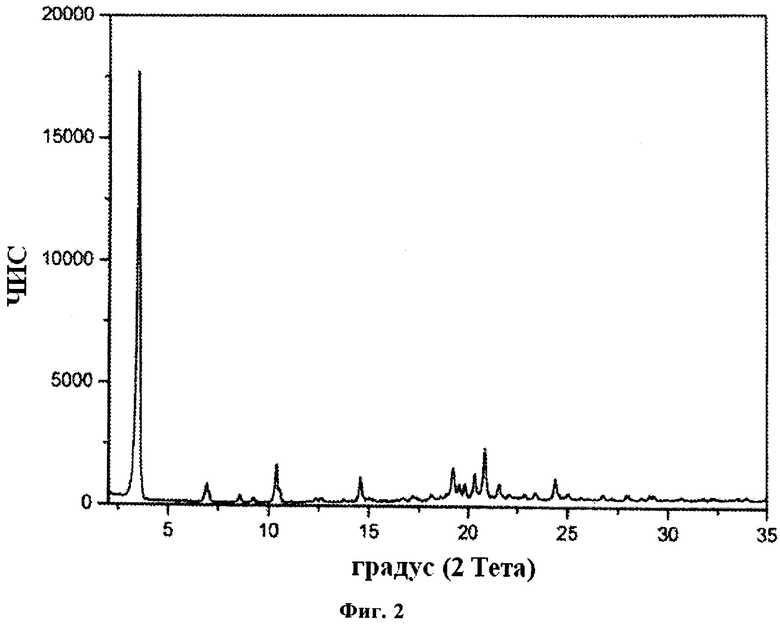
Кристаллическая Форма II гидрохлорида FTY720 характеризуется рентгеновской порошковой дифрактограммой, имеющей пики, по меньшей мере, у двух, предпочтительно, по меньшей мере, у четырех, и более предпочтительно у всех перечисленных значений 2-Тета: 3,5, 6,9, 10,4, 14,6, 19,2, 20,3 и 20,9 градусов 2-Тета. Пики при перечисленных значениях 2-Тета имеют следующую относительную интенсивность: 3,5 (сильная), 6,9 (слабая), 10,4 (слабая), 14,6 (слабая), 19,2 (слабая), 20,3 (слабая) и 20,9 (слабая).
В одном из вариантов осуществления изобретения данная кристаллическая форма характеризуется рентгеновской порошковой дифрактограммой, имеющей пики, по меньшей мере, у двух, предпочтительно, по меньшей мере, у четырех, и более предпочтительно у всех перечисленных значений 2-Тета: 3,47, 6,92, 10,38, 14,58, 19,20, 20,34 и 20,86 градусов 2-Тета. Пики при перечисленных значениях 2-Тета имеют следующую относительную интенсивность: 3,47 (сильная), 6,92 (слабая), 10,38 (слабая), 14,58 (слабая), 19,20 (слабая), 20,34 (слабая) и 20,86 (слабая).
В частном варианте осуществления изобретения данная кристаллическая форма характеризуется рентгеновской порошковой дифрактограммой, соответствующей по существу дифрактограмме, представленной на фиг.2.
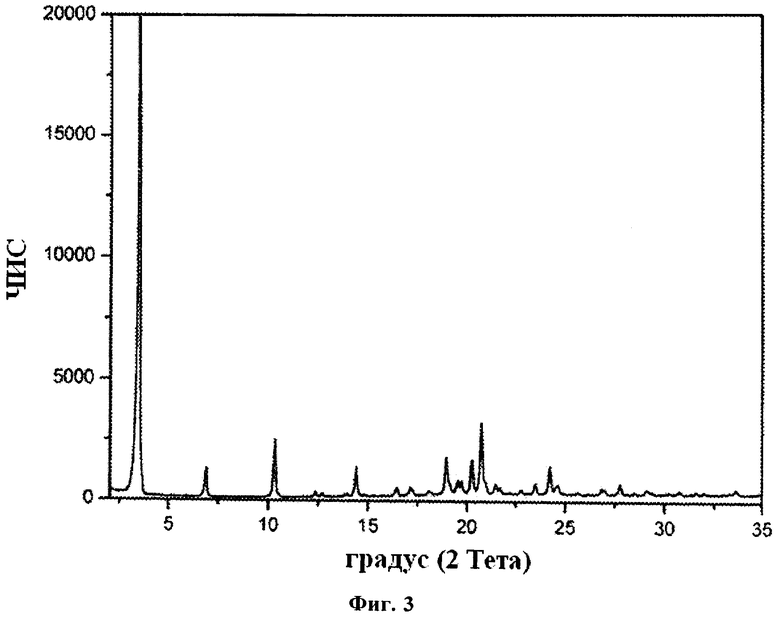
Кристаллическая Форма III гидрохлорида FTY720 характеризуется рентгеновской порошковой дифрактограммой, имеющей пики, по меньшей мере, у двух, предпочтительно, по меньшей мере, у четырех, и более предпочтительно у всех перечисленных значений 2-Тета: 3,5, 6,9, 10,3, 14,4, 18,9, 20,3, 20,7 и 24,2 градусов 2-Тета. Пики при перечисленных значениях 2-Тета имеют следующую относительную интенсивность: 3,5 (сильная), 6,9 (слабая), 10,3 (слабая), 14,4 (слабая), 18,9 (слабая), 20,3 (слабая), 20,7 (слабая) и 24,2 (слабая).
В одном из вариантов осуществления изобретения данная кристаллическая форма характеризуется рентгеновской порошковой дифрактограммой, имеющей пики, по меньшей мере, у двух, предпочтительно, по меньшей мере, у четырех, и более предпочтительно у всех перечисленных значений 2-Тета: 3,46, 6,88, 10,32, 14,41, 18,94, 20,26, 20, 73 и 24,23 градусов 2-Тета. Пики при перечисленных значениях 2-Тета имеют следующую относительную интенсивность: 3,46 (сильная), 6,88 (слабая), 10,32 (слабая), 14,41 (слабая), 18,94 (слабая), 20,26 (слабая), 20,73 (слабая) и 24,23 (слабая).
В частном варианте осуществления изобретения данная кристаллическая форма характеризуется рентгеновской порошковой дифрактограммой, соответствующей по существу дифрактограмме, представленной на фиг.3.
Кроме того, изобретение относится к способу получения кристаллической Формы I гидрохлорида FTY720, включающему охлаждение кристаллической Формы II или Формы III гидрохлорида FTY720 до температуры менее чем 40°C. Предпочтительно способ включает охлаждение до температуры 30°C или меньше, более предпочтительно до 20°С или меньше, более предпочтительно хотя бы до 10°С или меньше, например, хотя бы до 8°C или меньше, например до 2-8°С, для того, чтобы гарантировать превращение в кристаллическую Форму I.
Также было установлено, что гидрохлорид FTY720 может существовать по существу в форме гидрата. В одном из вариантов осуществления изобретения гидрат характеризуется рентгеновской порошковой дифрактограммой, имеющей пики, по меньшей мере, у двух, предпочтительно, по меньшей мере, у четырех, и более предпочтительно у всех перечисленных значений 2-Тета: 2,9, 17,2, 30,6, 28,2, 24,4, 8,6 и 25,9 градусов 2-Тета. Пики при перечисленных значениях 2-Тета имеют следующую относительную интенсивность: 2,9 (сильная), 17,2 (средняя), 30,6 (слабая), 28,2 (слабая), 24,4 (слабая), 8,6 (слабая) и 25,9 (слабая). В частном варианте осуществления изобретение относится к гидрату гидрохлорида FTY720, характеризующемуся рентгеновской порошковой дифрактограммой, соответствующей по существу дифрактограмме, представленной на фиг.4.
Для иллюстрации и без ограничения различные кристаллические формы и гидраты гидрохлорида FTY720 могут быть получены в соответствии с методиками, приведенными в примерах настоящего описания. В частности, взаимопревращение различных полиморфных форм гидрохлорида FTY720 может быть осуществлено посредством нагревания или охлаждения гидрохлорида FTY720 в соответствии с методиками, описанными в примерах.
Предпочтительно различные кристаллические солевые формы изобретения могут обладать одним или несколькими требуемыми свойствами по сравнению со свободным основанием FTY720. Например, кристаллические соли изобретения могут быть более стабильными и иметь лучшее качество, чем свободное основание, в частности, при хранении и распределении. Кроме того, соли могут иметь высокую степень диссоциации в воде и, следовательно, по существу улучшенную растворимость в воде. Соли также могут быть предпочтительны, поскольку они демонстрируют незначительное влагопоглощение или износ.
Кристаллические формы могут быть охарактеризованы основными пиками рентгеновской порошковой дифракторгаммы, как показано в примерах настоящей заявки. Также кристаллические формы могут отличаться термодинамической стабильностью, физическими параметрами, такими как спектр поглощения при инфракрасной спектроскопии (ИК) или пики фазового перехода при дифференциальной сканирующей калориметрии (ДСК).
В одном из вариантов осуществления различные кристаллические солевые формы настоящего изобретения находятся в, по существу, чистой кристаллической форме. Термин «по существу чистый», используемый в настоящей заявке, относится к кристаллическим формам с полиморфной чистотой более чем 90%, более предпочтительно 95%, более предпочтительно 96%, более предпочтительно 97%, более предпочтительно 98%, более предпочтительно 99%, как определено, например, рентгеновской порошковой дифрактограммой, рамановской спектроскопией или ИК-спектроскопией.
Также настоящее изобретение относится к фармацевтическим составам, содержащим кристаллическую соль настоящего изобретения. Фармацевтический состав изобретения предпочтительно содержит 0,01-20% масс., соли, более предпочтительно - 0,1-10%, например, 0,5-5% масс., исходя из общей массы состава.
Фармацевтические составы могут представлять собой твердые фармацевтические композиции в форме, подходящей для орального введения, например в виде таблеток или капсул. Композиции могут быть получены традиционным способом, например смешением соли настоящего изобретения с фармацевтически приемлемым носителем или разбавителем.
В частном варианте осуществления изобретения состав представляет собой твердую фармацевтическую композицию, содержащую соль изобретения и сахарный спирт. Композиции данного вида раскрыты в заявке WO 2004/089341, содержимое которой включено в настоящее описание посредством ссылки. Твердые композиции, раскрытые в данной публикации, особенно хорошо подходят для орального введения солей настоящего изобретения. Композиции обеспечивают удобное средство для систематического введения соединений, для которого не характерны недостатки жидких составов для инъекций или орального применения, и обладают хорошими физико-химическими свойствами и хорошо хранятся. В частности, композиции настоящего изобретения могут демонстрировать высокий уровень однородности при распределении соединения в композиции, а также высокую стабильность. Кроме того, композиции могут быть получены на высокоскоростном автоматизированном оборудовании и, таким образом, не требуется ручная инкапсуляция.
Сахарный спирт может действовать как разбавитель, носитель, наполнитель или объемообразующий агент, и, предпочтительно, представляет собой маннит, мальтит, инозит, ксилит или лактит, предпочтительно, по существу негигроскопичный сахарный спирт, например маннит (D-маннит). Может быть использован как единичный сахарный спирт, так и смесь двух или более сахарных спиртов, например смесь маннита и ксилита, например, в соотношении от 1:1 до 4:1.
В конкретном предпочтительном варианте осуществления изобретения сахарный спирт получают из высушенной распылением композиции, например композиции маннита, имеющей высокоспецифичную площадь поверхности. Применение данного типа композиции маннита способствует промотированию однородного распределения соединения и маннита в композиции. Высокая площадь поверхности может быть достигнута путем получения сахарного спирта, например маннита, содержащего частицы, имеющие небольшой размер и/или неровную поверхность каждой частицы. Как было установлено, применение высушенного распылением сахарного спирта, например маннита, например, с размеров частиц 300 мкм или менее, улучшает сжимаемость и прочность таблеток, полученных из композиции.
Предпочтительно площадь поверхности препарата сахарного спирта, например маннита, измеренная в одной точке, составляет 1-7 м2/г, например 2-6 м2/г или 3-5 м2/г. Предпочтительно препарат маннита может иметь размер частиц 100-300 мкм, например 150-250 мкм, и объемную плотность 0,4-0,6 г/мл, например 0,45-0,55 г/мл. Подходящим маннитом с высокой площадью поверхности является Parteck М200, коммерчески доступный от Е.Merck.
Композиция предпочтительно содержит 75-99,99% масс. сахарного спирта, более предпочтительно - 85-99,9%, например 90-99,5% масс., исходя из общей массы композиции.
Композиция предпочтительно дополнительно содержит смазочный материал. Подходящие смазочные материалы включают стеариновую кислоту, стеарат магния, стеарат кальция, стеарат цинка, глицерила пальмитостеарат, натрия стеарилфумарат, масло канолы, гидрированное растительное масло, такое как гидрированное касторовое масло (например, Cutina® или Lubriwax®101), минеральное масло, натрия лаурилсульфат, оксид магния, коллоидный диоксид кремния, силиконовую жидкость, полиэтиленгликоль, поливиниловый спирт, бензоат натрия, тальк, полоксамер или смесь любого из вышеперечисленных. Предпочтительные смазочные материалы включают стеарат магния, гидрированное касторовое масло и минеральное масло. Коллоидная жидкость и полиэтиленгликоль менее предпочтительны в качестве смазочных материалов.
Предпочтительно композиция содержит 0,01-5% масс. смазочного материала, более предпочтительно - 1-3% масс., например около 2% масс., исходя из общей массы композиции.
Композиция может содержать один или несколько дополнительных эксципиентов, таких как носители, связующие вещества или разбавители. В частности, композиция может содержать микрокристаллическую целлюлозу (например, Avicel®), метилцеллюлозу, гидроксипропилцеллюлозу, крахмал (например, кукурузный крахмал) или дикальция фосфат, предпочтительно в количестве от 0,1 до 90% масс., например 1-30% масс., исходя из общей массы композиции. В случае применения связующего вещества, например микрокристаллической целлюлозы, метилцеллюлозы, гидроксипропилцеллюлозы, его содержание составляет от 1 до 8%, например 3-6% масс., исходя из общей массы композиции. Применение связующего вещества увеличивает прочность гранул состава, которая особенно важна при тонком гранулировании. Микрокристаллическая целлюлоза и метилцеллюлоза являются наиболее предпочтительными в том случае, если требуется высокая прочность таблетки и/или более длительное время дезинтеграции. Гидроксипропилцеллюлоза предпочтительна в том случае, если требуется быстрая дезинтеграция. При необходимости в качестве дополнительного связующего вещества может быть также добавлен ксилит, например, в дополнение к микрокристаллической целлюлозе, например, в количестве до 20% масс., сахарного спирта, например ксилита.
В одном из вариантов осуществления изобретения композиция дополнительно содержит стабилизатор, предпочтительно глицин НСl или бикарбонат натрия. Количество стабилизатора может составлять от 0,1 до 30%, предпочтительно 1-20% масс.
Композиция может иметь форму порошка, гранулы, чешуек или дозированной лекарственной формы, например, в виде таблетки или капсулы. Композиции настоящего изобретения хорошо адаптированы для инкапсулирования в оболочку капсулы для орального введения, в частности в оболочку твердой желатиновой капсулы.
Как вариант, композиции могут быть спрессованы в таблетки. Таблетки необязательно могут иметь покрытие, например покрытие тальком или полисахаридом (например, целлюлозой) или гидроксипропилметилцеллюлозой.
В том случае, если композиция представляет собой дозированную лекарственную форму, каждая лекарственная форма может содержать, например, от около 0,5 до около 10 мг соли изобретения.
Композиции настоящего изобретения демонстрируют хорошие показатели стабильности согласно стандартным исследованиям стабильности, например обладают стабильностью при хранении один, два или три года и даже больше. Показатели стабильности могут быть определены, например, посредством определения разложения продуктов методом ВЭЖХ после хранения в определенные промежутки времени, при определенной температуре, например 20, 40 или 60°C.
Фармацевтические композиции настоящего изобретения могут быть получены стандартными методами, например традиционным смешиванием, гранулированием, покрытием сахаром, растворением или лиофилизацией. Используемые методики известны из уровня техники (см., например, L. Lachman et al. The Theory and Practice of Industrial Pharmacy, 3-е изд., 1986, H Sucker et al., Pharmazeutische Technologie, Thieme, 1991, Hagers Handbuch der pharmazeutischen Praxis, 4-е изд. (Springer Veriag, 1971) и Remington's Pharmaceutical Sciences, 13 изд., (Mack Publ., Co., 1970) или более поздние издания).
В еще одном варианте осуществления изобретения фармацевтическую композицию получают способом, включающим следующие стадии:
(а) смешивают соль настоящего изобретения и сахарный спирт;
(б) полученную на стадии (а) смесь измельчают и/или гранулируют и
(в) измельченную и/или гранулированную на стадии (б) смесь смешивают со смазочным материалом.
При использовании данного способа получают состав, обладающий хорошим уровнем содержания и однородностью смешивания (т.е. по существу однородным распределением соли в композиции), временем растворения и стабильностью.
Соли необязательно могут быть микронизированы и/или предварительно просеяны, например, через сито с размером ячейки 400-500 мкм, перед стадией (а) для удаления комков. Стадия смешения (а) может включать перемешивание соли и сахарного спирта, например маннита, в любом подходящем миксере или смесителе при, например, 100-400 оборотах.
Способ может быть осуществлен при сухом смешивании компонентов. В данном варианте осуществления изобретения: стадия измельчения (б) может включать пропускание смеси, полученной на стадии (а), через сито, которое предпочтительно имеет размер ячейки 400-500 мкм. Стадия способа (а) может включать стадию смешения общего количества соли в начале с небольшим количеством сахарного спирта, например от 5 до 25% масс., исходя из общей массы сахарного спирта, для получения предварительной смеси. Затем к предварительной смеси добавляют оставшееся количество сахарного спирта. Стадия (а) также может включать стадию добавления к смеси связующего раствора, например метилцеллюлозы и/или ксилита, например, в виде водного раствора. Как вариант, связующее добавляют к сухой смеси, а воду добавляют на стадии гранулирования.
Полученную на стадии (б) измельченную смесь необязательно перемешивают еще раз перед смешением со смазочным материалом. Смазочный материал, например стеарат магния, перед смешением предпочтительно предварительно просеивают, например, через 800-900 мкм сито.
Альтернативно используют метод влажного гранулирования. В данном варианте осуществления изобретения соль предпочтительно в начале в сухом виде смешивают с требуемым сахарным спиртом, например маннитом, и затем полученную смесь сахарный спирт/соль в сухом виде смешивают со связующим, таким как гидроксипропилцеллюлоза или гидроксипропилметилцеллюлоза. После этого добавляют воду и смесь гранулируют, например, с использованием автоматического гранулятора. Полученный гранулят сушат и измельчают.
При необходимости на стадии (в) к смеси, полученной на стадии (б), может быть добавлено дополнительное количество связующего.
Способ может включать дополнительную стадию таблетирования или инкапсулирования смеси, полученной на стадии (в), например, в твердые желатиновые капсулы, с использованием автоматического инкапсулирующего устройства. Капсулы могут быть окрашены или маркированы для придания индивидуального внешнего вида и мгновенного распознавания. Применение красителей улучшает внешний вид, а также используется для идентификации капсул. Красители, пригодные для использования в фармацевтике, обычно включают каротиноиды, оксиды железа и хлорофилл. Предпочтительно капсулы настоящего изобретения маркируют посредством кода.
Соли настоящего изобретения могут быть использованы:
а) для лечения или предотвращения отторжения трансплантированного органа или ткани, например для лечения реципиентов трансплантата сердца, легких, сердца и легких вместе, печени, почек, поджелудочной железы, кожи или роговицы, и для предотвращения реакций «трансплантат против хозяина», таких как изредка происходящая реакция после пересадки костного мозга; в частности для лечения острого или хронического отторжения алло- и ксенотрансплантата, или при трансплантации клеток, продуцирующих инсулин, например клеток островков Лангерганса; и
б) для лечения или предотвращения аутоиммунных заболеваний или воспалительных состояний, например ревматоидного артрита, системной красной волчанки, тиреоидита Хашимото, рассеянного склероза, миастении гравис, диабета типа I или II и связанных с ними расстройств, васкулита, пернициозной анемии, синдрома Шегрена, увеита, псориаза, офтальмопатии Грейвса, очаговой алопеции и др., аллергических заболеваний, например аллергической астмы, атопического дерматита, аллергического ринита/конъюнктивита, аллергического контактного дерматита, воспалительных заболеваний, необязательно, на основе аберрантных реакций, например воспалительного заболевания кишечника, болезни Крона или язвенного колита, внутренней астмы, воспалительных повреждений легких, воспалительных повреждений печения, воспалительных повреждений почек, атеросклероза, ирритантного контактного дерматита и других экзематозных дерматитов, себорейного дерматита, кожных проявлений иммунологически опосредованных заболеваний, воспалительных заболеваний глаз, кератоконъюнктивита, миокардита или гепатита.
Для вышеуказанных применений требуемая дозировка будет изменяться в зависимости от типа введения, конкретных состояний, подвергающихся лечению, и требуемого результата. В основном удовлетворительный результат достигается при суточной дозировке, составляющей от около 0,1 до около 100 мг/кг массы тела. Номинальная суточная дозировка для больших млекопитающих, например людей, находится в интервале от около 0,5 мг до 2000 мг, для удобства введения, например, разделенная на дозы до четырех в сутки, или в форме с замедленным высвобождением;
Соли могут быть введены любыми подходящими способами, например орально, например в форме таблетки или капсулы, топически или парентерально, например внутривенно. Фармацевтические композиции, содержащие соли настоящего изобретения вместе с, по меньшей мере, одним фармацевтически приемлемым носителем или разбавителем, могут быть получены традиционными способами посредством смешения с фармацевтически приемлемым носителем или разбавителем. Дозированные лекарственные формы для орального введения содержат, например, от около 0,1 мг до около 500 мг активного вещества.
Соли могут быть введены в качестве единственного активного ингредиента или вместе с другими лекарственными средствами в иммуномодулирующих режимах или с другими противовоспалительными агентами, например, для лечения или предотвращения острого или хронического отторжения аллотрансплантата, воспалительных или аутоиммунных заболеваний. Например, соли могут быть использованы в комбинации с ингибиторами кальциневрина, например циклоспорином A, циклоспорином G, FK-506, АВТ-281, ASM 981; ингибиторами mTOR, например рапамицином, 40-О-(2-гидрокси)этилрапамицином, CCI779, АВТ578 или АР23573 и др.; кортикостероидами; циклофосфамидом; азатиопреном; метотрексатом; другими рецепторами агониста S1P, например FTY720 или его аналогами; лефлуномидом или его аналогами; мирозибином; микофеноловой кислотой; микофенолятом мофетила; 15-деоксиспергуалином или его аналогами; иммуносупрессивными моноклинальными антителами, например моноклональными антителами к рецепторам лейкоцитов; например МНС, CD2, CD3, CD4, CDlla/CD18, CD7, CD25, CD27, В7, CD40, CD45, CD58, CD137, ICOS, CD150 (SLAM), ОХ40, 4-1 ВВ или их лигандами, например CD 154; или с другими иммуномодуляторами, например рекомбинантной связывающей молекулой, содержащей, по меньшей мере, часть внеклеточного домена CTLA4 или его мутанта, например, по меньшей мере, внеклеточную часть CTLA4 или его мутанта, связанную с не-CTLA4 белковой последовательностью, например CTLA4Ig (например, обозначенную как АТСС 68629) или его мутантом, например, LEA29Y, или с другими ингибиторами адгезионных молекул, например mAbs или ингибиторами с небольшой молекулярной массой, включая антагонисты LFA-1, антагонисты селектина и антагонисты VLA-4.
В случае если соль вводят совместно с другим иммуномодулирующим или противовоспалительным агентом, дозировка данного агента будет изменяться в зависимости от типа совместно используемого лекарственного средства, состояния, подвергающегося лечению, и т.д.
Настоящее изобретение также относится к:
1. Способу лечения или предотвращения отторжения трансплантированного органа или ткани, включающему введение субъекту терапевтически эффективного количества кристаллической соли изобретения.
2. Способу лечения или предотвращения аутоиммунного заболевания или воспалительного состояния, включающему введение субъекту терапевтически эффективного количества кристаллической соли изобретения.
3. Кристаллической соли изобретения для применения в качестве фармацевтического препарата.
4. Фармацевтической композиции, содержащей кристаллическую соль изобретения и фармацевтически приемлемый разбавитель или носитель.
5. Применению кристаллической соли изобретения для получения лекарственного средства, например, в вышеописанных способах.
6. Фармацевтической композиции, содержащей (а) кристаллическую соль изобретения и (б) второе лекарственное средство, при этом данное лекарственное средство пригодно для предотвращения или лечения вышеописанных состояний.
7. Способу, описанному выше, включающему совместное введение, например одновременно или последовательно, (а) кристаллической соли изобретения и (б) второго лекарственного средства, при этом данное лекарственное средство пригодно для предотвращения или лечения вышеописанных состояний.
Следующие примеры иллюстрируют настоящее изобретение. В примерах 1-13 ссылки на соединение A, FTY720 или гидрохлорид соль FTY720 также включают ссылки на любую из различных кристаллических солевых форм настоящего изобретения.
Пример 1
Микроизмельченное соединение A, например гидрохлорид 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола (FTY720), просеивают и 116,7 г просеянного соединения смешивают с 9683,3 г микрокристаллической целлюлозы. Затем смесь измельчают в устройстве Frewitt MGI (Key International Inc., США) с использованием сита с размером ячейки 30 меш. Стеарат магния просеивают через сито с размером ячейки 20 меш и 200 г просеянного соединения смешивают со смесью FTY720, получая композицию продукта.
После этого композицию продукта помещают на таблеточный пресс, содержащий 7 мм пресс-формы, и получают таблетки по 120 мг, при этом каждая таблетка содержит:
*1 мг соединения A в свободной форме эквивалентен 1,12 мг FTY720.
Пример 2
В данном примере используют методику примера 1 за исключением того, что стеарат магния заменяют на Cutina® (гидрированное касторовое масло).
Пример 3
Соединение A, например FTY720, и микрокристаллическую целлюлозу, например Avicel РН 102, по отдельности просеивают через сито с размером ячейки 18 меш. 1,9 г просеянного FTY720 смешивают с 40 г просеянной микрокристаллической целлюлозы в течение 120 оборотов в миксере при 32 об/мин. После этого смесь FTY720 просеивают через сито с размером ячейки 35 меш.
Просеянную смесь FTY720 помещают в гранулятор вместе с дополнительным количеством (340,1 г) микрокристаллической целлюлозы, например Avicel РН 102, и 12 г гидроксипропилцеллюлозы. Смесь перемешивают в течение 3-х мин. Затем со скоростью 100 мл/мин добавляют воду и смесь гранулируют в течение 2-х мин. Гранулят переносят в центробежную сушилку и сушат при 50°C в течение 150 мин.
После этого смесь измельчают в приборе Frewitt MGI с использованием сита с размером ячейки 35 меш. Стеарат магния просеивают и 6 г просеянного соединения перемешивают в миксере на протяжении 90 оборотов при 32 об/мин со смесью FTY720, с получением композиции продукта, демонстрирующей по существу однородное распределение агониста рецептора S1P в микрокристаллической целлюлозе, например Avicel РН 102.
Затем композицией продукта заполняют твердые желатиновые оболочки размера 3 на приборе для инкапсуляции H&K 400. В каждую капсулу помещают 120 мг композиции продукта. Таким образом, каждая капсула содержит:
Пример 4
В данном примере повторяют способ примера 3 за исключением того, что стеарат магния заменяют на Cutina® (гидрированное касторовое масло).
Пример 5
В данном примере повторяют способ примера 3 за исключением того, что гидроксипропилцеллюлозу заменяют на гидроксипропилметилцеллюлозу.
Пример 6а
Микроизмельченное соединение A, например FTY720, просеивают через сито с размером ячейки 400 мкм (40 меш.). 58,35 г просеянного соединения смешивают с 4841,65 г микрокристаллической целлюлозы, например Avicel РН 102, в 25 л миксере Bohle bin в течение 240 полных оборотов. После этого смесь измельчают в приборе Frewitt MGI с использованием сита с размером ячейки 425 мкм, и измельченную смесь перемешивают еще раз. Стеарат магния просеивают и 100 г просеянного соединения смешивают со смесью FTY720, с получением композиции продукта, демонстрирующей по существу однородное распределение агониста рецептора S1P в смеси.
Затем композицией продукта заполняют твердые желатиновые оболочки размера 3 на приборе для инкапсуляции H&K 400. В каждую капсулу помещают 120 мг композиции продукта. Таким образом, каждая капсула содержит:
Пример 6б
В альтернативном варианте осуществления капсулы получают с использованием компонентов и их количеств, описанных в примере 6а, но FTY720 в начале смешивают с 14 мг маннита (перед просеиванием). Данную смесь затем просеивают, как описано выше. Просеянную смесь смешивают с оставшимся количеством маннита и добавляют к ней стеарат магния, а затем еще раз перемешивают и заполняют смесью капсулы.
Примеры 7 и 8
В данных примерах капсулы получают так, как описано в примере 6, за исключением того, что капсула содержит каждый компонент в следующем количестве:
Примеры 9-11
В данных примерах капсулы получают так, как описано в примерах 6-8, за исключением того, что стеарат магния заменяют на Cutina® (гидрированное касторовое масло).
Примеры 12 и 13
Капсулы, содержащие следующие компоненты, получают посредством взвешивания каждого компонента, смешения компонентов в ступке, а затем наполнения полученной смесью капсул:
Пример 14: Полиморфы и гидраты гидрохлорида FTY720
Кривые дифференциальной сканирующей калориметрии (ДСК) регистрируют с использованием системы PerkinElmer DSC-7 and Pyris 1.
Кривые нагрева ДСК демонстрируют три характеристических перехода при приблизительно 40°C, 66°C и 107°C. Первый эндотермический пик при 40°C, за которым следует небольшой эндотермический пик, указывает на плавление Формы I и последующую перекристаллизацию в Форму II. Второй переход между Формой II и Формой III представляет собой переход между твердыми фазами. Третий переход наблюдается при 107°C. Около 10°C рентгеновская порошковая дифракторгамма почти исчезает и остается только один сильный пик при 2,9°, что, как полагают, указывает на образование при данной температуре фазы с низкокристаллической структурой. Термомикроскопия показывает двоякое лучепреломление при около 107°C, которое исчезает только при температуре около 230°C, которая ниже начала разложения, наблюдаемого при около 260°C.
После этого проводят порошковую рентгеновскую дифракцию при различных температурах для исследования природы различных переходов, наблюдаемых при ДСК. Для каждого эксперимента скорость нагрева составляет 10 К/мин, а время исследования - 5 мин. Рентгеновские порошковые дифрактограммы регистрируют между 2° и 35° (2-Тета) при CuKα-излучении с использованием дифракционной системы Scintag X1. Порошковую рентгеновскую дифракцию при различных температурах и показателях влажности осуществляют с использованием системы "Scintag XDS 2000; снабженной блоками управления температурой и влажностью.
В соответствии с данными порошковой рентгеновской дифракции при различных температурах гидрохлорид FTY720 существует, по меньшей мере, в четырех различных кристаллических формах. При около 107°C практически все дифракционные пики исчезают и остается только один сильный пик при 2,9°. Данные результаты совпадают с результатами ДСК. Однако другая кристаллическая форма (Форма IV), наблюдаемая при 0°C, обнаружена только порошковой рентгеновской дифракцией, но не выявлена ДСК. Поскольку рентгеновская порошковая дифрактограмма Формы IV очень похожа на дифрактограмму Формы I, а при ДСК термический процесс не наблюдается, полагают, что свойства кристаллов Формы IV очень схожи со свойствами Формы I.
Рентгеновская порошковая дифрактограмма Формы I гидрохлорида FTY720 представлена на фиг.1, характерные пики приведены ниже:
В отдельном варианте осуществления изобретения рентгеновская порошковая дифрактограмма Формы I гидрохлорида FTY720 имеет следующие характеристики:
Рентгеновская порошковая дифрактограмма Формы II гидрохлорида FTY720 представлена на фиг.2, характерные пики приведены ниже:
В отдельном варианте осуществления изобретения рентгеновская порошковая дифрактограмма Формы II гидрохлорида FTY720 имеет следующие характеристики:
Рентгеновская порошковая дифрактограмма Формы III гидрохлорида FTY720 представлена на фиг.3, характерные пики приведены ниже:
В отдельном варианте осуществления изобретения рентгеновская порошковая дифрактограмма Формы III гидрохлорида FTY720 имеет следующие характеристики:
Для каждого значения угла 2θ может быть допущен минимальный предел ошибки приблизительно ±0,2 град.
Изотермы сорбции/десорбции измеряют с использованием Dynamic Vapor System (DVS-1). Измерение проводят при 25°C и 40°C.
Согласно изотерме десорбции воды, зарегистрированной при 25°C, при относительной влажности (ОВ) между 90% и 60% наблюдают почти постоянное содержание воды 5,2-5,9%. Полученные данные указывают на образование гидрата (теоретическое содержание воды в моногидрате 4,98%). Согласно изотерме сорбции воды, полученной при 40°C, наблюдают первое значительное поглощение воды уже при ОВ 80%, тогда как согласно изотерме, зарегистрированной при 25°C, первое поглощение наблюдают при ОВ 90%. Для образцов Формы I, хранящихся в течение 1 месяца при 60°C и ОВ 75% и в течение 1 месяца при 80°C и ОВ 75%, характерно превращение в гидратную форму с содержанием воды 10,2-10,6%, которое близко к вычисленному содержанию воды 9,48% для двух молей воды.
Рентгеновская порошковая дифрактограмма гидрата представлена на фиг.4, характерные пики приведены ниже:
В отдельном варианте осуществления изобретения рентгеновская порошковая дифрактограмма гидрата имеет следующие характеристики:
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЛИ ФИНГОЛИМОДА | 2009 |
|
RU2543621C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ И СПОСОБЫ ПОЛУЧЕНИЯ ЛЕНВАТИНИБА БЕЗИЛАТА | 2019 |
|
RU2801812C2 |
| НОВЫЕ КРИСТАЛЛИЧЕСКИЕ ФОРМЫ НАТРИЕВОЙ СОЛИ(4-{ 4-[5-(6-ТРИФТОРМЕТИЛ-ПИРИДИН-3-ИЛАМИНО) ПИРИДИН-2-ИЛ] ФЕНИЛ} ЦИКЛОГЕКСИЛ) УКСУСНОЙ КИСЛОТЫ | 2011 |
|
RU2612556C2 |
| КРИСТАЛЛИЧЕСКИЕ СОЛЬВАТЫ ГИДРОХЛОРИДА 6-(ПИПЕРИДИН-4-ИЛОКСИ)-2Н-ИЗОХИНОЛИН-1-OHA | 2012 |
|
RU2619129C2 |
| СТАБИЛЬНЫЕ СОСТАВЫ ИМАТИНИБА | 2008 |
|
RU2470641C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ИНГИБИТОРА TLR7/TLR8 | 2019 |
|
RU2792005C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ, СОЛИ И ПОЛИМОРФЫ ТРАНСНОРСЕРТРАЛИНА И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2578956C2 |
| ВИНОРЕЛБИНА МОНОТАРТРАТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2730521C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ N-[4-(ХЛОРДИФТОРМЕТОКСИ)ФЕНИЛ]-6-[(3R)-3-ГИДРОКСИПИРРОЛИДИН-1-ИЛ]-5-(1H-ПИРАЗОЛ-5-ИЛ)ПИРИДИН-3-КАРБОКСАМИДА | 2020 |
|
RU2836337C2 |
| ГИДРАТ ФУМАРАТА ДИМЕТИЛАМИНОМИХЕЛИОЛИДА И СПОСОБ ЕГО ПОЛУЧЕНИЯ, И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2824144C1 |
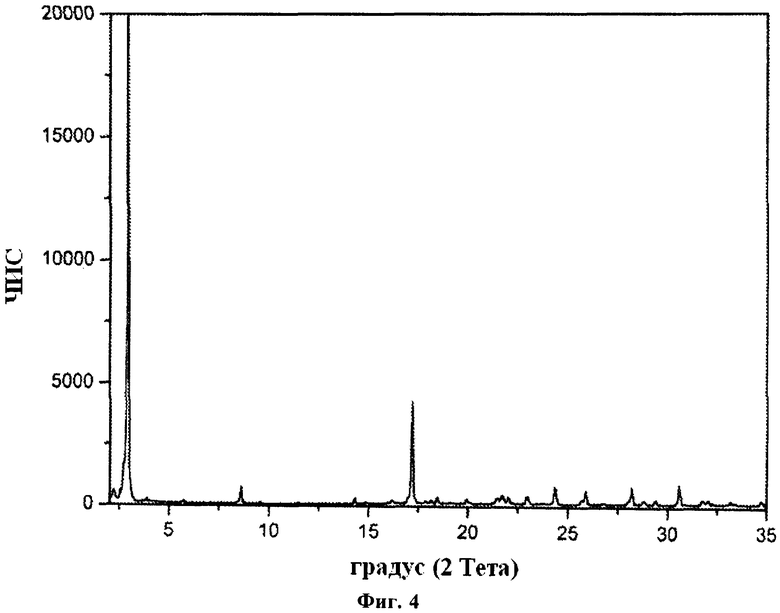
Изобретение относится к новому гидрату гидрохлоридной соли 2-амино-2-(2-(4-октилфенил)этил)пропан-1,3-диола в кристаллической форме с указанными ниже характеристиками. Гидрат может быть использован для получения лекарственного средства или для лечения или предотвращения отторжения трансплантированного органа или ткани или аутоиммунных заболеваний в терапевтически эффективном количестве. Указанный гидрат характеризуется рентгеновской порошковой дифрактограммой, имеющей пики при около 2,9, 17,2, 30,6, 28,2, 24,4, 8,6 и 25,9 градусов 2-Тета, с пределом ошибки ±0,2 град. для каждого значения угла 2θ, имеющий чистоту 90% или более, и содержанием воды в от 5,2 до 5,9%. Изобретение также характеризует фармацевтическую композицию с использованием вышеуказанного гидрата. 4 н.п. ф-лы, 4 ил., 8 табл., 14 пр.
1. Фармацевтическая композиция для применения в лечении или предотвращении отторжения трансплантированного органа или ткани или аутоиммунных заболеваний, содержащая кристаллическую гидрохлоридную соль 2-амино-2-(2-(4-октилфенил)этил)пропан-1,3-диола (FTY720) в форме гидрата, характеризующегося рентгеновской порошковой дифрактограммой, имеющей пики при около 2,9, 17,2, 30,6, 28,2, 24,4, 8,6 и 25,9 градусов 2-Тета, с пределом ошибки ±0,2 град для каждого значения угла 2θ, имеющего чистоту 90% или более, и с содержанием воды от 5,2 до 5,9%.
2. Применение композиции по п. 1 для получения лекарственного средства для лечения или предотвращения отторжения трансплантированного органа или ткани или аутоиммунных заболеваний.
3. Способ лечения или предотвращения отторжения трансплантированного органа или ткани или аутоиммунных заболеваний у пациента, включающий введение терапевтически эффективного количества соли по п. 1.
4. Гидрат гидрохлоридной соли 2-амино-2-(2-(4-октилфенил)этил)пропан-1,3-диола в кристаллической форме, характеризующейся рентгеновской порошковой дифрактограммой, имеющей пики при около 2,9, 17,2, 30,6, 28,2, 24,4, 8,6 и 25,9 градусов 2-Тета, с пределом ошибки ±0,2 град для каждого значения угла 2θ, имеющий чистоту 90% или более, и содержание воды в котором составляет от 5,2 до 5,9%
| WO 2004089341 A1,21.10.2004 & RU2358716 | |||
| US 6476004 B1, 05.11.2002 | |||
| RU 2011101771 А, опубл | |||
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2015-05-10—Публикация
2009-11-10—Подача