ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к технической области кристаллизации лекарственного средства и, в частности, относится к гидрату фумарата диметиламиномихелиолида, способу его получения и его применению.
УРОВЕНЬ ТЕХНИКИ
Партенолид является основным активным ингредиентом, экстрагируемым из трав пиретрум девичий и пижма семейства Asteraceae, и представляет собой природный сесквитерпеновый лактон. Традиционно пиретрум девичий в основном применяют для лечения таких заболеваний, как лихорадка, ревматоидный артрит, мигрень и зубная боль. В последние годы исследования, проведенные в Китае и других странах, показали, что партенолид также оказывает противоопухолевое действие, но является нестабильным по своим свойствам в кислотных или основных условиях.
Чтобы улучшить его стабильность, соединение партенолид модифицировали с получением михелиолида (MCL), сесквитерпенового лактона типа гвайэна. В соответствующих публикациях и патентах сообщалось, что михелиолид оказывает влияние на лечение раковых заболеваний, но имеет низкую растворимость в воде. Для улучшения растворимости в воде и биологической активности проводят реакцию путем нагревания в метанольном растворителе, с триэтиламином в качестве катализатора, с получением производного михелиолида, т.е. диметиламиномихелиолида (DMAMCL) с молекулярной формулой C17H27NO3 и структурной формулой ниже. DMAMCL обладает в некоторой степени улучшенной растворимостью в воде по сравнению с MCL, но является нестабильным, так как будет разрушаться после длительного хранения. Для дальнейшего улучшения его растворимости в воде и стабильности его часто готовят в форме соли. Авторы настоящего изобретения обнаружили фумарат диметиламиномихелиолида, полученный из производного партенолида. При этом в патенте WO 2011/131103 А1 раскрыт способ получения производных михелиолида или их солей, или их фармацевтических композиций, включая фумарат диметиламиномихелиолида, и их применение для получения лекарственного средства для лечения рака.
Фумарат диметиламиномихелиолида имеет молекулярную формулу C21H31NO7 и относительную молекулярную массу 409. Он представляет собой белый кристаллический порошок, бесцветный и без запаха. Он растворим в воде, метаноле, этаноле, тетрагидрофуране, 1,4-диоксане, ацетоне, ацетонитриле и изопропилацетате и практически нерастворим в циклогексане, н-гексане, н-гептане, дихлорметане, изопропиловом эфире и толуоле. Химическая структурная формула выглядит следующим образом:
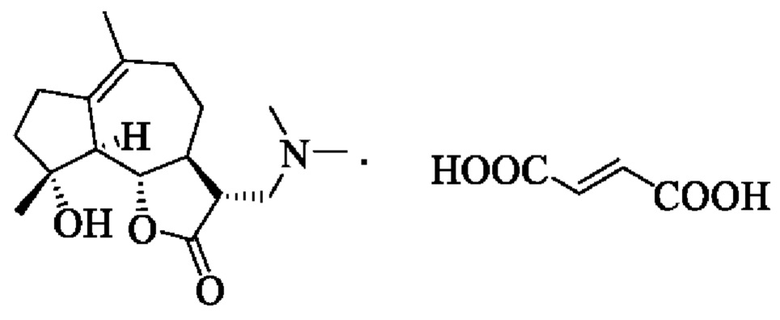
Полиморфизм относится к существованию вещества в различных кристаллических структурах, возникающих из различных расположений или конформаций молекул. Согласно статистике, он встречается среди 80% коммерчески доступных лекарственных средств. Различные кристаллические формы лекарственного средства отличаются физико-химическими свойствами, такими как цвет, растворимость, температура плавления, плотность, твердость и морфология кристаллов, что приводит к различиям в свойствах, таких как стабильность, скорость растворения и биодоступность лекарственного средства и, таким образом, влияет на последующую обработку и лечение, а также в некоторой степени на терапевтические эффекты и безопасность лекарственного средства. В процессе контроля качества лекарственных средств и разработки новых лекарственных форм исследования полиморфизма лекарственных средств стали незаменимой частью.
В китайском патенте CN 103724307 В раскрыт фумарат диметиламиномихелиолида в кристаллической форме А и способ его получения. Кристаллическая форма А характеризуется в указанном патенте РПД (рентгеновской порошковой дифрактограммой), имеющей характеристические пики при 2θ 7,10°, 7,58°, 11,72°, 12,26°, 13,30°, 14,24°, 15,70°, 16,38°, 17,04°, 19,02°, 19,86°, 20,14°, 20,66°, 21,20°, 21,78°, 22,64°, 23,58°, 23,8°, 24,48°, 25,08°, 26,24°, 27,08°, 27,60°, 28,40°, 28,94°, 34,48°, 34,82°, 36,12°, 38,72° и 45°. Кристаллическую форму А получают путем перекристаллизации из этилацетатного растворителя. В этом способе продукт получают путем естественного охлаждения. Однако, поскольку процесс перекристаллизации контролируется как термодинамикой, так и динамикой, условия перекристаллизации при естественном охлаждении сильно зависят от изменений окружающей среды, и скорость охлаждения трудно контролировать, что приводит к небольшому размеру частиц продукта, причем размер первичных частиц составляет 35,8 мкм, низкая насыпная плотность всего 0,270 г/мл, угол естественного откоса 62°, плохая текучесть и большие различия в качестве между кристаллическими продуктами различных партий. Между тем, кристаллическая форма А имеет низкую стабильность, поскольку она склонна к превращению, и в твердом порошке наблюдается электростатическое действие, приводящее к облакам пыли в способе производства, что вызывает много проблем в переработке и обработке на более поздней стадии.
КРАТКОЕ ОПИСАНИЕ
Для решения вышеуказанных проблем в настоящем изобретении предложен гидрат фумарата диметиламиномихелиолида, способ его получения и его применение. Кристаллический продукт гидрат фумарата диметиламиномихелиолида с высокой кристалличностью, высокой насыпной плотностью, хорошей текучестью, большим размером частиц, гладкими и чистыми кристаллическими поверхностями без агломерации и хорошей стабильностью получают путем активной кристаллизации. Способ получения прост и характеризуется высоким выходом продукта и хорошей воспроизводимостью, что способствует крупномасштабному производству.
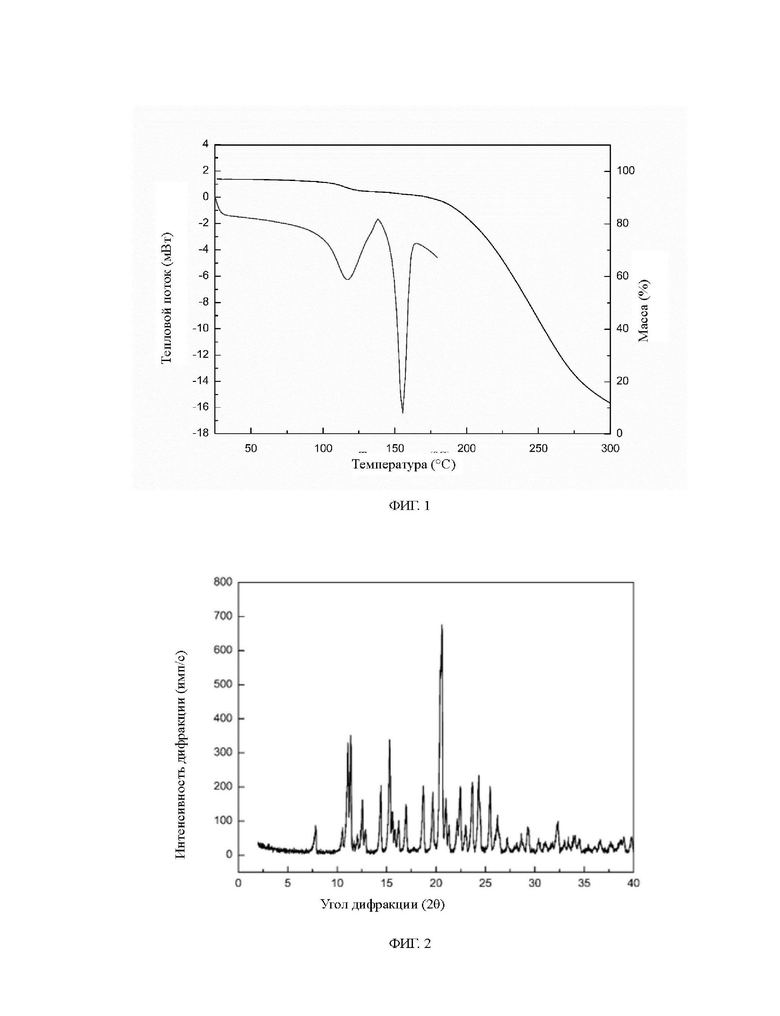
Настоящее изобретение относится к гидрату фумарата диметиламиномихелиолида, при этом гидрат находится в кристаллической форме D, молярное отношение фумарата диметиламиномихелиолида к воде составляет 1:1, и гидрат имеет молекулярную формулу C17H27NO3⋅C4H4O4⋅H2O; как показано на диаграммах термогравиметрического анализа/дифференциальной сканирующей калориметрии, термогравиметрический анализ демонстрирует потерю массы 3,97%-4,22% перед разложением; диаграмма дифференциальной сканирующей калориметрии демонстрирует эндотермический пик обезвоживания при 75±5°С и характерный пик плавления при 148±5°С.
В настоящем изобретении предложен гидрат фумарата диметиламиномихелиолида, при этом гидрат имеет характеристические пики при углах 2θ 7,8±0,2°, 11,1±0,2°, 11,4±0,2°, 12,6±0,2°, 12,9±0,2°, 14,4±0,2°, 15,3±0,2°, 17,0±0,2°, 18,7±0,2°, 19,7±0,2°, 20,6±0,2°, 21,0±0,2°, 22,5±0,2°, 23,7±0,2°, 24,3±0,2°, 25,5±0,2° и 26,2±0,2° на рентгеновской порошковой дифрактограмме с использованием излучения Cu-Kα, где пик при 7,8±0,2° является исходным пиком; характеристический пик при 20,6±0,2° имеет относительную интенсивность 100%; кристаллическая форма D находится в ортотриметрической кристаллографической системе и имеет пространственную группу Р212121, параметр ячейки а=8,8346(18) Å, b=14,796 (3) Å, с=16,385(3) Å, α=90°, β=90° и γ=90°; и объем ячейки 2141,8(8) Å3.
В настоящем изобретении предложен гидрат фумарата диметиламиномихелиолида, при этом гидрат также имеет характеристические пики при углах 2θ 10,5±0,2°, 11,7±0,2°, 12,0±0,2°, 15,6±0,2°, 15,9±0,2°, 16,2±0,2°, 21,3±0,2°, 22,1±0,2°, 23,0±0,2°, 26,4±0,2°, 27,2±0,2°, 28,2±0,2°, 28,6±0,2°, 29,3±0,2°, 30,4±0,2° и 31,1±0,2° на рентгеновской порошковой дифрактограмме с использованием излучения Cu-Kα.
Настоящее изобретение также относится к способу получения гидрата фумарата диметиламиномихелиолида, который может быть осуществлен при помощи активной кристаллизации: при перемешивании добавляют диметиламиномихелиолид и фумаровую кислоту к смешанной системе растворителей, состоящей из растворителя S1 и растворителя S2, при постоянной температуре 30°С-70°С, при этом массовое соотношение растворителя S2 к растворителю S1 составляет (0-3):1 и мольное соотношение диметиламиномихелиолида к фумаровой кислоте составляет (1-1,6):1; после 5-10 ч реакции, проводят фильтрование реакционной смеси и сушку остатка при 25°С-45°С при нормальном давлении в течение 6-10 ч с получением фумарата диметиламиномихелиолида в кристаллической форме D.
Растворитель S1 представляет собой смешанный растворитель из воды и любого из ацетона, тетрагидрофурана, 1,4-диоксана, ацетонитрила и метилизобутилкетона.
Массовое отношение любого из ацетона, тетрагидрофурана, 1,4-диоксана, ацетонитрила и метилизобутилкетона к воде в растворителе S1 составляет (5-10):1.
Растворитель S2 представляет собой смешанный растворитель из сложноэфирных и простых эфирных растворителей.
Сложноэфирный растворитель выбран из любого одного или двух из метилацетата, этилацетата, гексилацетата и изопропилацетата.
Простой эфирный растворитель выбран из любого одного или двух из диэтилового эфира, метилэтилового эфира, метил-трет-бутилового эфира, дипропилового эфира, дибутилового эфира, диметилового эфира этиленгликоля, монометилового эфира этиленгликоля, 1,4-диоксана, тетрагидрофурана и 2-метилтетрагидрофурана.
Растворитель S1 представляет собой смешанный растворитель из воды и любого из ацетона, тетрагидрофурана, 1,4-диоксана, ацетонитрила и метилизобутилкетона.
Массовое отношение сложноэфирного растворителя к простому эфирному растворителю в растворителе S2 составляет (1-3):1.
Массовое отношение твердого исходного материала диметиламиномихелиолида к S1 составляет 1:(6-10).
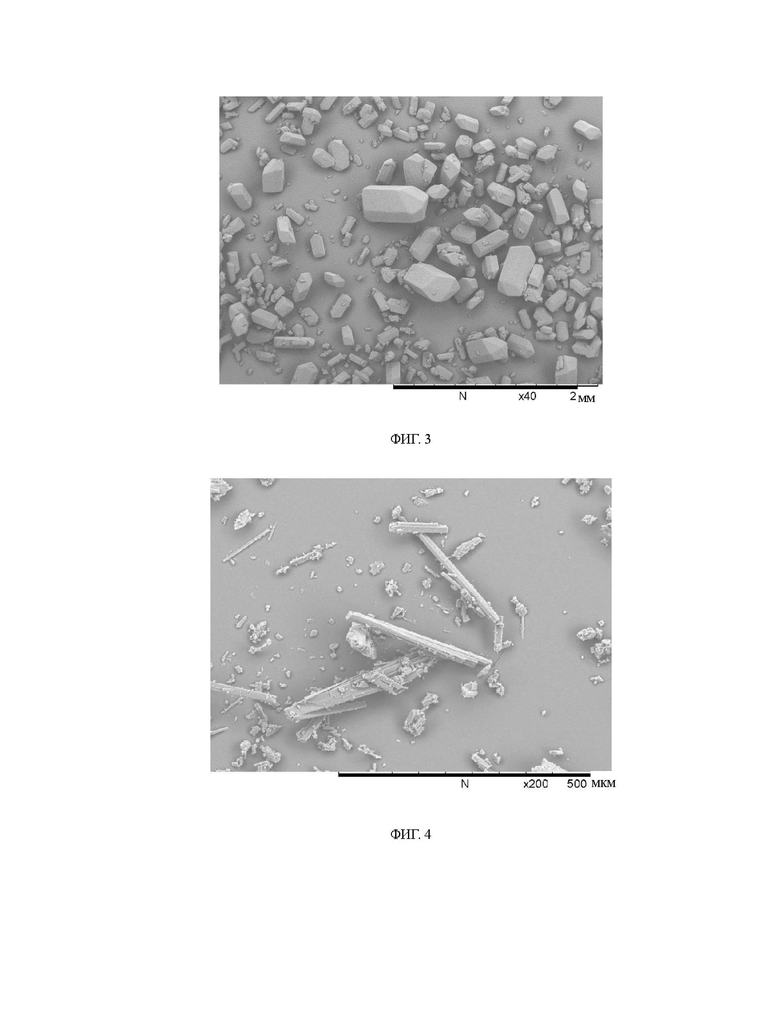
Габитус кристалла гидрата фумарата диметиламиномихелиолида изучен в настоящем изобретении, и его сканирующая электронная микрофотография представлена на фиг. 3. - Кристалл имеет правильный блочный габитус, и поверхность частицы гладкая без агломерации, при этом кристалл имеет большой средний размер частиц, который может достигать 300 мкм, насыпную плотность 0,65 г/мл и угол естественного откоса 32°. Продукт обладает высокой насыпной плотностью и хорошей текучестью. Для сравнения, кристаллическая форма А, полученная с использованием способа перекристаллизации с естественным охлаждением, описанного в патенте CN 103724307 B, имеет размер первичных частиц 35,8 мкм, насыпную плотность всего 0,270 г/мл и угол естественного откоса 62°, и ее сканирующая электронная микрофотография представлена на фиг. 4. Продукт фумарата диметиламиномихелиолида в кристаллической форме D, предложенный в настоящем изобретении, имеет значительно улучшенный размер частиц, что решает проблемы низкой насыпной плотности и плохой текучести продукта в кристаллической форме А.
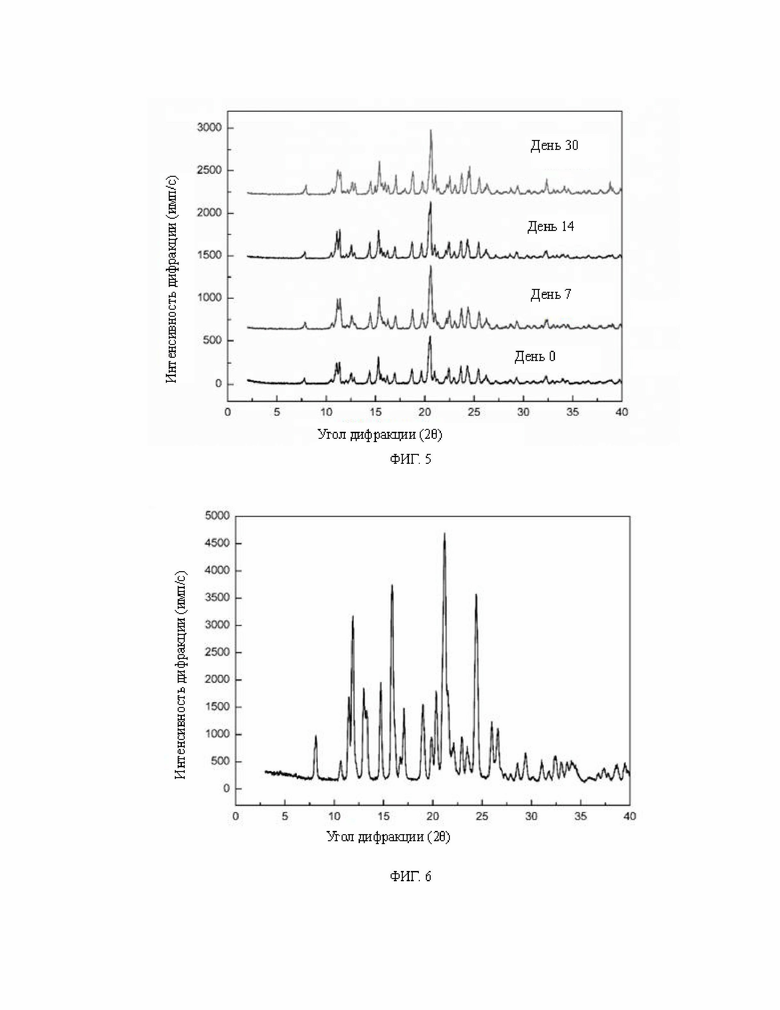
В настоящем изобретении исследуют стабильность гидрата фумарата диметиламиномихелиолида. Продукт в виде безводного кристаллического соединения равномерно распределяют в открытой чашке Петри. Температуру контролировали при 45°С, влажность составляет 75%, а толщина образца составляет менее 5 мм. Чашку Петри герметично помещают в сушилку на 30 дней. Затем образцы, помещенные на 7, 14 и 30 дней, исследовали с помощью РПД и сравнивали с результатами в день 0. Конкретная дифрактограмма показана на фиг. 5. Результаты показывают отсутствие существенных изменений в дифрактограмме. При этом образцы в дни 7, 14 и 30 подвергают анализу на чистоту. По сравнению с результатами определения чистоты на 0-й день, изменение чистоты образца на 7-й день составляет всего 0,015%, изменение чистоты образца на 14-й день составляет всего 0,027%, а изменение чистоты образца на 30-й день составляет всего 0,046%, что свидетельствует об отсутствии существенного изменения чистоты образца. При объединении дифрактограмм и результатов анализа чистоты показано, что гидрат фумарата диметиламиномихелиолида обладает хорошей стабильностью.
Гидрат фумарата диметиламиномихелиолида, предложенный в настоящем изобретении, можно применять для получения не содержащего растворитель соединения фумарата диметиламиномихелиолида в кристаллической форме В. Способ получения кристаллической формы В включает: нагревание гидрата фумарата диметиламиномихелиолида при постоянной температуре 80°С-120°С в течение 10 мин - 30 мин с получением не содержащего растворитель соединения фумарата диметиламиномихелиолида в кристаллической форме В, рентгеновская порошковая дифрактограмма которого показана на фиг. 6, демонстрируя характеристические пики при углах 2θ 8,1±0,2°, 10,7±0,2°, 11,5±0,2°, 11,9±0,2°, 13,0±0,2°, 13,3±0,2°, 14,7±0,2°, 15,9±0,2°, 16,1±0,2°, 16,7±0,2°, 17,1±0,2°, 19,0±0,2°, 19,9±0,2°, 20,3±0,2°, 21,2±0,2°, 21,5±0,2°, 22,1±0,2°, 23,0±0,2°, 23,5±0,2°, 24,4±0,2°, 26,0±0,2°, 26,6±0,2°, 26,9±0,2°, 27,4±0,2°, 27,9±0,2°, 28,6±0,2°, 29,4±0,2°, 30,2±0,2° и 31,0±0,2°. Сканирующая электронная микрофотография аналогична той, которая показана на фиг. 5, что указывает на то, что габитус кристалла соответствует гидрату и размер частиц велик.
Гидрат фумарата диметиламиномихелиолида согласно настоящему изобретению также обеспечивает фармацевтическую композицию, которая содержит фармацевтически приемлемый вспомогательный материал и может также содержать один, два или более других фармакологически активных ингредиентов, отличных от гидрата фумарата диметиламиномихелиолида.
Фармацевтически приемлемый вспомогательный материал включает, без ограничения, другие не обладающие фармакологической активностью ингредиенты, отличные от активных ингредиентов, таких как фумарат диметиламиномихелиолида в кристаллической форме, например, не обладающие фармакологической активностью ингредиенты, которые можно применять для фармацевтической композиции согласно настоящему изобретению, включая носители или вспомогательные вещества, такие как наполнители, скользящие агенты, смазывающие вещества, связующие вещества, стабилизаторы и/или другие вспомогательные материалы.
Наполнители включают, без ограничения, по меньшей мере один из кукурузного крахмала, глюкозы, маннита, сорбита, диоксида кремния, микрокристаллической целлюлозы, карбоксиметилкрахмала натрия, композитного крахмала и предварительно желатинизированного крахмала.
Улучшающие текучесть агенты включают, без ограничения, по меньшей мере один из диоксида кремния, гидратированного диоксида кремния, легкой безводной кремниевой кислоты, сухого геля гидроксида алюминия, силиката алюминия и силиката магния. Смазочные материалы включают, без ограничения, по меньшей мере один из пшеничного крахмала, рисового крахмала, кукурузного крахмала, стеариновой кислоты, стеарата кальция, стеарата магния, гидратированного диоксида кремния, легкой безводной кремниевой кислоты, синтетического силиката алюминия, сухого геля гидроксида алюминия, талька, алюмометасиликата магния, дикальцийфосфата, безводного дикальцийфосфата, сложных эфиров сахарозы и жирных кислот, парафинов, гидрогенизированного растительного масла и полиэтиленгликоля.
Фармацевтическую композицию согласно настоящему изобретению применяют для получения фармацевтического препарата, причем фармацевтический препарат включает фармацевтическую композицию в виде таблетки, капсулы или гранулированной лекарственной формы. Фармацевтический препарат более предпочтительно представляет собой капсулу.
Настоящее изобретение также относится к применению гидрата фумарата диметиламиномихелиолида или фармацевтической композиции для получения лекарственного средства для лечения или предотвращения заболевания или состояния, при этом заболевание или состояние предпочтительно представляет собой рак, выбранный из лейкоза, рака молочной железы, рака предстательной железы, рака носоглотки, рака толстой кишки, рака легкого, рака печени, рака пищевода, рака желудка, рака кишечника, рака почки, рака полости рта, лимфомы Ходжкина, рака поджелудочной железы, колоректального рака, рака шейки матки, неходжкинской лимфомы, глиомы, меланомы, рака мочевого пузыря, рака яичника, рака щитовидной железы и саркомы Капоши.
Положительные эффекты
Гидрат согласно настоящему изобретению обладает хорошей текучестью и более подходит для получения в качестве лекарственного средства на более поздней стадии. Хорошо известно, что текучесть активного ингредиента как таковая, как правило, с трудом удовлетворяет условиям наполнения капсул или микрокапсул, и вспомогательные материалы, такие как предварительно желатинизированный крахмал, диоксид кремния и стеарат магния, необходимы для удовлетворения требованиям текучести по условиям наполнения для достижения желаемого качества лекарственных форм и эффективности производства. Возьмем в качестве примера технические требования для капсул 100 мг, если в качестве активных ингредиентов применяют другие формы, такие как кристаллическая форма А, масса содержимого капсулы достигает примерно 310 мг после добавления вспомогательных материалов, и, таким образом, должна быть использована самая большая оболочка капсулы 0#, и техническое требование для больших доз, таких как капсулы, содержащие 200 мг активных ингредиентов, не может быть получено. По этой причине пациенты должны были бы обеспечивать введение высоких доз путем увеличения количества принимаемых капсул или частоты введения, что значительно уменьшило бы соблюдение пациентом режима лечения. Однако авторы настоящего изобретения обнаружили, что угол естественного откоса 32° может быть достигнут за счет превосходной текучести гидрата фумарата диметиламиномихелиолида в кристаллической форме D даже без добавления вспомогательных материалов. По этой причине требуемая текучесть для условий наполнения капсул или микрокапсул может быть достигнута при значительно меньшем количестве вспомогательных материалов и даже без добавления какого-либо вспомогательного материала. Кроме того, снижение количества вспомогательных материалов позволяет получать технические требования для капсул высокой дозировки, значительно улучшая соблюдение пациентом режима лечения.
Кроме того, в связи с тем, что гидрат фумарата диметиламиномихелиолида в кристаллической форме D может значительно или даже полностью уменьшать добавление вспомогательных материалов, и что для кристаллической формы А требуется большое количество вспомогательных материалов для достижения такой же текучести, как и у кристаллической формы D, что приводит к низкой стабильности, гидрат в кристаллической форме D улучшает стабильность препарата.
Кроме того, способ получения гидрата фумарата диметиламиномихелиолида в кристаллической форме D является простым и характеризуется высоким выходом продукта и хорошей воспроизводимостью, а полученный продукт обладает высокой кристалличностью, гладкими и чистыми без агломерации поверхностями частиц, отсутствием статического электричества между частицами и высокой насыпной плотностью, что способствует крупномасштабному производству.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 показан график термогравиметрического анализа/дифференциальной сканирующей калориметрии гидрата фумарата диметиламиномихелиолида согласно настоящему изобретению.
На фиг. 2 показана рентгеновская дифрактограмма гидрата фумарата диметиламиномихелиолида согласно настоящему изобретению.
На фиг. 3 показана сканирующая электронная микрофотография гидрата фумарата
диметиламиномихелиолида согласно настоящему изобретению (при увеличении 40).
На фиг. 4 показана сканирующая электронная микрофотография продукта в кристаллической форме А, полученного в соответствии со способом, описанным в патенте CN 103724307 В (при увеличении 200).
На фиг. 5 показано сравнение графиков испытания на стабильность гидрата фумарата диметиламиномихелиолида согласно настоящему изобретению, причем последовательно снизу вверх размещены дифрактограммы ПРД образцов в дни 0, 7, 14 и 30.
На фиг. 6 показана рентгеновская дифрактограмма не содержащего растворитель соединения фумарата диметиламиномихелиолида в кристаллической форме В согласно настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ
Вышеприведенное описание настоящего изобретения будет дополнительно подробно объяснено с помощью конкретных вариантов реализации в форме примеров. Однако его не следует толковать как ограничивающее объем вышеизложенного предмета настоящего изобретения приведенными ниже примерами. Все способы, реализованные на основании приведенного выше описания настоящего изобретения, входят в объем настоящего изобретения.
Пример 1
Получение гидрата фумарата диметиламиномихелиолида
При перемешивании 0,293 г диметиламиномихелиолида и 0,116 г фумаровой кислоты добавляли в смешанную систему растворителей, состоящую из растворителя S1 и растворителя S2, при постоянной температуре 30°С, при этом масса растворителя S1 была равна массе растворителя S2, при этом растворитель S1 состоял из 1,598 г ацетонового растворителя и 0,16 г воды, а растворитель S2 состоял из 0,879 г этилацетата и 0,879 г диэтилового эфира. Через 5 ч реакции реакционную смесь фильтровали, и остаток сушили при 25°С при нормальном давлении в течение 6 ч с получением продукта фумарата диметиламиномихелиолида в кристаллической форме D. Термогравиметрический анализ/дифференциальная сканирующая калориметрия продукта соответствует Фиг. 1. Термогравиметрический анализ показывает потерю массы на 4,22% до разложения, а анализ методом дифференциальной сканирующей калориметрии показывает эндотермический пик дегидратации при 75°С и характерный пик плавления при 148°С. Рентгеновская порошковая дифрактограмма продукта соответствует фиг. 2, показывая характеристические пики при углах дифракции 2θ 7,8°, 11,1°, 11,4°, 12,6°, 12,9°, 14,4°, 15,3°, 17,0°, 18,7°, 19,7°, 20,6°, 21,0°, 22,5°, 23,7°, 24,3°, 25,5° и 26,2°, где пик при 7,8° представляет собой начальный пик, а характеристический пик при 20,6° имеет относительную интенсивность 100%. Рентгеновская порошковая дифрактограмма продукта также показывает характерные пики при углах 2θ 10,5±0,2°, 11,7±0,2°, 12,0±0,2°, 15,6±0,2°, 15,9±0,2°, 16,2±0,2°, 21,3±0,2°, 22,1±0,2°, 23,0±0,2°, 26,4±0,2°, 27,2±0,2°, 28,2±0,2°, 28,6±0,2°, 29,3±0,2°, 30,4±0,2° и 31,1±0,2°. Изображение СЭМ морфологии кристаллов соответствует фиг. 4, показывая объемные кристаллы с большим средним размером частиц, который может достигать 300 мкм, проверенной насыпной плотностью 0,646 г/мл и углом естественного откоса 32,5°.
Пример 2
Получение гидрата фумарата диметиламиномихелиолида
При перемешивании 1,758 г диметиламиномихелиолида и 0,58 г фумаровой кислоты добавляли в смешанную систему растворителей, состоящую из растворителя S1 и растворителя S2, при постоянной температуре 50°С, при этом масса растворителя S2 в 2 раза превышала массу растворителя S1, при этом растворитель S1 состоял из 12,306 г тетрагидрофуранового растворителя и 1,758 г воды, а растворитель S2 состоял из 21,096 г изопропилацетата и 7,032 г метил-трет-бутилового эфира. Через 8 ч реакции реакционную смесь фильтровали, и остаток сушили при 30°С при нормальном давлении в течение 10 ч с получением продукта фумарата диметиламиномихелиолида в кристаллической форме D. Термогравиметрический анализ/дифференциальная сканирующая калориметрия продукта соответствует Фиг. 1. Термогравиметрический анализ показывает потерю массы 4,20% перед разложением, а анализ методом дифференциальной сканирующей калориметрии показывает эндотермический пик дегидратации при 78°С и характерный пик плавления при 150°С. Рентгеновская порошковая дифрактограмма продукта соответствует фиг. 2, показывая характеристические пики при углах дифракции 2θ 8,0°, 11,2°, 11,5°, 12,7°, 12,9°, 14,5°, 15,4°, 17,1°, 18,8°, 19,8°, 20,6°, 21,1°, 22,5°, 23,7°, 24,5°, 25,6° и 26,3°, где пик при 7,8° представляет собой начальный пик, а характеристический пик при 20,6° имеет относительную интенсивность 100%. Рентгеновская порошковая дифрактограмма продукта также показывает характеристические пики при углах дифракции 2θ 10,6°, 11,8°, 12,2°, 15,1°, 15,7°, 16,0°, 21,4°, 22,0°, 22,3°, 23,1°, 27,3°, 28,2°, 28,7°, 29,4°, 30,5°, 30,6° и 31,3°. Изображение СЭМ морфологии кристаллов соответствует фиг. 4, показывая объемные кристаллы с большим средним размером частиц, который может достигать 300 мкм, проверенной насыпной плотностью 0,655 г/мл и углом естественного откоса 32°.
Пример 3
Получение гидрата фумарата диметиламиномихелиолида
При перемешивании 4,688 г диметиламиномихелиолида и 1,16 г фумаровой кислоты добавляли в смешанную систему растворителей, состоящую из растворителя S1 и растворителя S2, при постоянной температуре 70°С, при этом масса растворителя S2 в 3 раза превышала массу растворителя S1, при этом растворитель S1 состоял из 39 г 1,4-диоксанового растворителя и 7,88 г воды, а растворитель S2 состоял из 93,76 г метилацетата и 46,88 г метилэтилового эфира. Через 10 ч реакции реакционную смесь фильтровали, и остаток сушили при 45°С при нормальном давлении в течение 8 ч с получением продукта фумарата диметиламиномихелиолида в кристаллической форме D. Термогравиметрический анализ/дифференциальная сканирующая калориметрия продукта соответствует Фиг. 1. Термогравиметрический анализ показывает потерю массы 3,97% перед разложением, а анализ методом дифференциальной сканирующей калориметрии показывает эндотермический пик дегидратации при 75°С и характерный пик плавления при 145°С. Рентгеновская порошковая дифрактограмма продукта соответствует фиг. 2, показывая характеристические пики при углах дифракции 2θ 7,8°, 11,0°, 11,4°, 12,5°, 12,8°, 14,4°, 15,3°, 17,0°, 18,7°, 19,7°, 20,6°, 21,0°, 22,4°, 23,7°, 24,3°, 25,4° и 26,2°, где пик при 7,8° представляет собой начальный пик, а характеристический пик при 20,6° имеет относительную интенсивность 100%. Рентгеновская порошковая дифрактограмма продукта также показывает характеристические пики при углах дифракции 2θ 10,5°, 11,7°, 12,0°, 15,6°, 15,9°, 16,2°, 21,3°, 22,2°, 22,9°, 26,4°, 27,3°, 28,2°, 28,6°, 29,3°, 30,4°, 30,6° и 31,1°. Изображение СЭМ морфологии кристаллов соответствует фиг. 4, показывая объемные кристаллы с большим средним размером частиц, который может достигать 300 мкм, проверенной насыпной плотностью 0,65 г/мл и углом естественного откоса 32°.
Пример 4
Получение гидрата фумарата диметиламиномихелиолида
При перемешивании 4,102 г диметиламиномихелиолида и 1,16 г фумаровой кислоты добавляли в смешанную систему растворителей, состоящую из растворителя S1 и растворителя S2, при постоянной температуре 60°С, при этом масса растворителя S2 в 3 раза превышала массу растворителя S1, при этом растворитель S1 состоял из 35,8925 г ацетонитрильного растворителя и 5,1275 г воды, а растворитель S2 состоял из 87,9 г гексилацетата и 35,16 г диметилового эфира этиленгликоля. Через 10 ч реакции реакционную смесь фильтровали, и остаток сушили при 45°С при нормальном давлении в течение 9 ч с получением продукта фумарата диметиламиномихелиолида в кристаллической форме D. Термогравиметрический анализ/дифференциальная сканирующая калориметрия продукта соответствует Фиг. 1. Термогравиметрический анализ показывает потерю массы 4,10% перед разложением, а анализ методом дифференциальной сканирующей калориметрии показывает эндотермический пик дегидратации при 80°С и характерный пик плавления при 150°С. Рентгеновская порошковая дифрактограмма продукта соответствует фиг. 2, показывая характеристические пики при углах дифракции 2θ 7,8°, 11,1°, 11,4°, 12,6°, 12,9°, 14,4°, 15,4°, 17,0°, 18,8°, 19,8°, 20,6°, 21,0°, 22,5°, 23,7°, 24,4°, 25,5° и 26,2°, где пик при 7,8° представляет собой начальный пик, а характеристический пик при 20,6° имеет относительную интенсивность 100%. Рентгеновская порошковая дифрактограмма продукта также показывает характеристические пики при углах дифракции 2θ 10,6°, 11,8°, 12,1°, 15,9°, 16,3°, 21,4°, 22,2°, 23,0°, 26,5°, 27,3°, 28,7°, 29,3°, 30,4°, 29,3°, 30,4°, 30,6° и 31,1°. Изображение СЭМ морфологии кристаллов соответствует фиг. 4, показывая объемные кристаллы с большим средним размером частиц, который может достигать 300 мкм, проверенной насыпной плотностью 0,659 г/мл и углом естественного откоса 32,2°.
Пример 5
Получение гидрата фумарата диметиламиномихелиолида
При перемешивании 0,293 г диметиламиномихелиолида и 0,116 г фумаровой кислоты добавляли в смешанную систему растворителей, состоящую из растворителя S1 и растворителя S2, при постоянной температуре 30°С, при этом масса растворителя S1 была равна массе растворителя S2, при этом растворитель S1 состоял из 1,598 г ацетонитрильного растворителя и 0,16 г воды, а растворитель S2 состоял из 0,879 г изопропилацетата и 0,879 г монометилового эфира этиленгликоля. Через 5 ч реакции реакционную смесь фильтровали, и остаток сушили при 25°С при нормальном давлении в течение 6 ч с получением продукта фумарата диметиламиномихелиолида в кристаллической форме D. Термогравиметрический анализ/дифференциальная сканирующая калориметрия продукта соответствует Фиг. 1. Термогравиметрический анализ показывает потерю массы на 4,22% до разложения, а анализ методом дифференциальной сканирующей калориметрии показывает эндотермический пик дегидратации при 75°С и характерный пик плавления при 148°С. Рентгеновская порошковая дифрактограмма продукта соответствует фиг. 2, показывая характеристические пики при углах дифракции 2θ 7,8°, 11,1°, 11,4°, 12,6°, 12,9°, 14,4°, 15,3°, 17,0°, 18,7°, 19,7°, 20,6°, 21,0°, 22,5°, 23,7°, 24,3°, 25,5° и 26,2°, где пик при 7,8° представляет собой начальный пик, а характеристический пик при 20,6° имеет относительную интенсивность 100%. Рентгеновская порошковая дифрактограмма продукта также показывает характерные пики при углах 2θ 10,5±0,2°, 11,7±0,2°, 12,0±0,2°, 15,6±0,2°, 15,9±0,2°, 16,2±0,2°, 21,3±0,2°, 22,1±0,2°, 23,0±0,2°, 26,4±0,2°, 27,2±0,2°, 28,2±0,2°, 28,6±0,2°, 29,3±0,2°, 30,4±0,2° и 31,1±0,2°. Изображение СЭМ морфологии кристаллов соответствует фиг. 4, показывая объемные кристаллы с большим средним размером частиц, который может достигать 300 мкм, проверенной насыпной плотностью 0,645 г/мл и углом естественного откоса 32°.
Пример 6
Получение гидрата фумарата диметиламиномихелиолида
При перемешивании 4,688 г диметиламиномихелиолида и 1,16 г фумаровой кислоты добавляли в смешанную систему растворителей, состоящую из растворителя S1 и растворителя S2, при постоянной температуре 70°С, при этом масса растворителя S2 в 3 раза превышала массу растворителя S1, при этом растворитель S1 состоял из 39 г метилизобутилкетонового растворителя и 7,88 г воды, а растворитель S2 состоял из 46,88 г метилацетата, 46,88 г изопропилацетата, 23,44 г тетрагидрофурана и 23,44 г дибутилового эфира. Через 10 ч реакции реакционную смесь фильтровали, и остаток сушили при 45°С при нормальном давлении в течение 8 ч с получением продукта фумарата диметиламиномихелиолида в кристаллической форме D. Термогравиметрический анализ/дифференциальная сканирующая калориметрия продукта соответствует Фиг. 1. Термогравиметрический анализ показывает потерю массы 3,97% перед разложением, а анализ методом дифференциальной сканирующей калориметрии показывает эндотермический пик дегидратации при 75°С и характерный пик плавления при 145°С. Рентгеновская порошковая дифрактограмма продукта соответствует фиг. 2, показывая характеристические пики при углах дифракции 2θ 7,8°, 11,0°, 11,4°, 12,5°, 12,8°, 14,4°, 15,3°, 17,0°, 18,7°, 19,7°, 20,6°, 21,0°, 22,4°, 23,7°, 24,3°, 25,4° и 26,2°, где пик при 7,8° представляет собой начальный пик, а характеристический пик при 20,6° имеет относительную интенсивность 100%. Рентгеновская порошковая дифрактограмма продукта также показывает характеристические пики при углах дифракции 2θ 10,5°, 11,7°, 12,0°, 15,6°, 15,9°, 16,2°, 21,3°, 22,2°, 22,9°, 26,4°, 27,3°, 28,2°, 28,6°, 29,3°, 30,4° и 31,1°. Изображение СЭМ морфологии кристаллов соответствует фиг. 4, показывая объемные кристаллы с большим средним размером частиц, который может достигать 300 мкм, проверенной насыпной плотностью 0,65 г/мл и углом естественного откоса 32,3°.
Пример 7
Получение гидрата фумарата диметиламиномихелиолида
При перемешивании 1,758 г диметиламиномихелиолида и 0,58 г фумаровой кислоты добавляли в смешанную систему растворителей, состоящую из растворителя S1 и растворителя S2, при постоянной температуре 50°С, при этом масса растворителя S2 в 2 раза превышала массу растворителя S1, при этом растворитель S1 состоял из 12,306 г метилизобутилкетонового растворителя и 1,758 г воды, а растворитель S2 состоял из 21,096 г метилацетата и 7,032 г 2-метилтетрагидрофурана. Через 9 ч реакции реакционную смесь фильтровали, и остаток сушили при 30°С при нормальном давлении в течение 10 ч с получением продукта фумарата диметиламиномихелиолида в кристаллической форме D. Термогравиметрический анализ/дифференциальная сканирующая калориметрия продукта соответствует Фиг. 1. Термогравиметрический анализ показывает потерю массы 4,20% перед разложением, а анализ методом дифференциальной сканирующей калориметрии показывает эндотермический пик дегидратации при 78°С и характерный пик плавления при 150°С. Рентгеновская порошковая дифрактограмма продукта соответствует фиг. 2, показывая характеристические пики при углах дифракции 2θ 8,0°, 11,2°, 11,5°, 12,7°, 12,9°, 14,5°, 15,4°, 17,1°, 18,8°, 19,8°, 20,6°, 21,1°, 22,5°, 23,7°, 24,5°, 25,6° и 26,3°, где пик при 7,8° представляет собой начальный пик, а характеристический пик при 20,6° имеет относительную интенсивность 100%. Рентгеновская порошковая дифрактограмма продукта также показывает характеристические пики при углах дифракции 2θ 10,6°, 11,8°, 12,2°, 15,1°, 15,7°, 16,0°, 21,4°, 22,0°, 22,3°, 23,1°, 27,3°, 28,2°, 28,7°, 29,4°, 30,5°, 30,6° и 31,3°. Изображение СЭМ морфологии кристаллов соответствует фиг. 4, показывая объемные кристаллы с большим средним размером частиц, который может достигать 300 мкм, проверенной насыпной плотностью 0,65 г/мл и углом естественного откоса 32°.
Пример 8
Получение гидрата фумарата диметиламиномихелиолида
При перемешивании 4,102 г диметиламиномихелиолида и 1,16 г фумаровой кислоты добавляли в смешанную систему растворителей, состоящую из растворителя S1 и растворителя S2, при постоянной температуре 60°С, при этом масса растворителя S2 в 3 раза превышала массу растворителя S1, при этом растворитель S1 состоял из 35,8925 г тетрагидрофуранового растворителя и 5,1275 г воды, а растворитель S2 состоял из 87,9 г метилацетата и 35,16 г 1,4-диоксана. Через 10 ч реакции реакционную смесь фильтровали, и остаток сушили при 45°С при нормальном давлении в течение 9 ч с получением продукта фумарата диметиламиномихелиолида в кристаллической форме D. Термогравиметрический анализ/дифференциальная сканирующая калориметрия продукта соответствует Фиг. 1. Термогравиметрический анализ показывает потерю массы 4,10% перед разложением, а анализ методом дифференциальной сканирующей калориметрии показывает эндотермический пик дегидратации при 80°С и характерный пик плавления при 150°С. Рентгеновская порошковая дифрактограмма продукта соответствует фиг. 2, показывая характеристические пики при углах дифракции 2θ 7,8°, 11,1°, 11,4°, 12,6°, 12,9°, 14,4°, 15,3°, 17,0°, 18,7°, 19,7°, 20,6°, 21,0°, 22,5°, 23,7°, 24,3°, 25,5° и 26,2°, где пик при 7,8° представляет собой начальный пик, а характеристический пик при 20,6° имеет относительную интенсивность 100%. Рентгеновская порошковая дифрактограмма продукта также показывает характерные пики при углах 2θ 10,5±0,2°, 11,7±0,2°, 12,0±0,2°, 15,6±0,2°, 15,9±0,2°, 16,2±0,2°, 21,3±0,2°, 22,1±0,2°, 23,0±0,2°, 26,4±0,2°, 27,2±0,2°, 28,2±0,2°, 28,6±0,2°, 29,3±0,2°, 30,4±0,2° и 31,1±0,2°. Изображение СЭМ морфологии кристаллов соответствует фиг. 4, показывая объемные кристаллы с большим средним размером частиц, который может достигать 300 мкм, проверенной насыпной плотностью 0,654 г/мл и углом естественного откоса 32,1°.
Пример 9
Получение гидрата фумарата диметиламиномихелиолида
При перемешивании 0,293 г диметиламиномихелиолида и 0,116 г фумаровой кислоты добавляли в смешанную систему растворителей, состоящую из растворителя S1 и растворителя S2, при постоянной температуре 30°С, при этом масса растворителя S1 была равна массе растворителя S2, при этом растворитель S1 состоял из 1,598 г ацетонового растворителя и 0,16 г воды, а растворитель S2 состоял из 0,879 г изопропилацетата и 0,879 г дипропилового эфира. Через 7 ч реакции реакционную смесь фильтровали, и остаток сушили при 25°С при нормальном давлении в течение 6 ч с получением продукта фумарата диметиламиномихелиолида в кристаллической форме D. Термогравиметрический анализ/дифференциальная сканирующая калориметрия продукта соответствует Фиг. 1. Термогравиметрический анализ показывает потерю массы на 4,22% до разложения, а анализ методом дифференциальной сканирующей калориметрии показывает эндотермический пик дегидратации при 75°С и характерный пик плавления при 148°С. Рентгеновская порошковая дифрактограмма продукта соответствует фиг. 2, показывая характеристические пики при углах дифракции 2θ 7,8°, 11,0°, 11,4°, 12,5°, 12,8°, 14,4°, 15,3°, 17,0°, 18,7°, 19,7°, 20,6°, 21,0°, 22,4°, 23,7°, 24,3°, 25,4° и 26,2°, где пик при 7,8° представляет собой начальный пик, а характеристический пик при 20,6° имеет относительную интенсивность 100%. Рентгеновская порошковая дифрактограмма продукта также показывает характеристические пики при углах дифракции 2θ 10,5°, 11,7°, 12,0°, 15,6°, 15,9°, 16,2°, 21,3°, 22,2°, 22,9°, 26,4°, 27,3°, 28,2°, 28,6°, 29,3°, 30,4° и 31,1°. Изображение СЭМ морфологии кристаллов соответствует фиг. 4, показывая объемные кристаллы с большим средним размером частиц, который может достигать 300 мкм, проверенной насыпной плотностью 0,645 г/мл и углом естественного откоса 32,3°.
Пример 10
Получение не содержащего растворителей соединения фумарата диметиламиномихелиолида в кристаллической форме В
Навеску 0,1 г продукта из Примера 1 помещали в рентгеновский дифрактометр с переменной температурой и нагревали при постоянной температуре 80°С в течение 30 мин. Проводили рентгеноструктурный анализ образца, и полученная дифрактограмма согласуется с фиг. 6, указывая на не содержащее растворителей соединение фумарата диметиламиномихелиолида в кристаллической форме В. Сканирующая электронная микрофотография твердого вещества демонстрирует морфологию, соответствующую представленной на фиг. 5, что свидетельствует о сохранении габитуса кристаллов блочной формы.
Пример 11
Получение не содержащего растворителей соединения фумарата диметиламиномихелиолида в кристаллической форме В
Навеску 0,15 г продукта из Примера 3 помещали в рентгеновский дифрактометр с переменной температурой и нагревали при постоянной температуре 120°С в течение 10 мин. Проводили рентгеноструктурный анализ образца, и полученная дифрактограмма согласуется с фиг. 6, указывая на не содержащее растворителей соединение фумарата диметиламиномихелиолида в кристаллической форме В. Сканирующая электронная микрофотография твердого вещества демонстрирует морфологию, соответствующую представленной на фиг. 5, что свидетельствует о сохранении габитуса кристаллов блочной формы.
Пример 12
Получение не содержащего растворителей соединения фумарата диметиламиномихелиолида в кристаллической форме В
Навеску 0,1 г продукта из Примера 4 помещали в рентгеновский дифрактометр с переменной температурой и нагревали при постоянной температуре 100°С в течение 20 мин. Проводили рентгеноструктурный анализ образца, и полученная дифрактограмма согласуется с фиг. 6, указывая на не содержащее растворителей соединение фумарата диметиламиномихелиолида в кристаллической форме В. Сканирующая электронная микрофотография твердого вещества демонстрирует морфологию, соответствующую представленной на фиг. 5, что свидетельствует о сохранении габитуса кристаллов блочной формы.
Пример 13
Состав препарата для кристаллической формы А капсулы 1 является следующим:
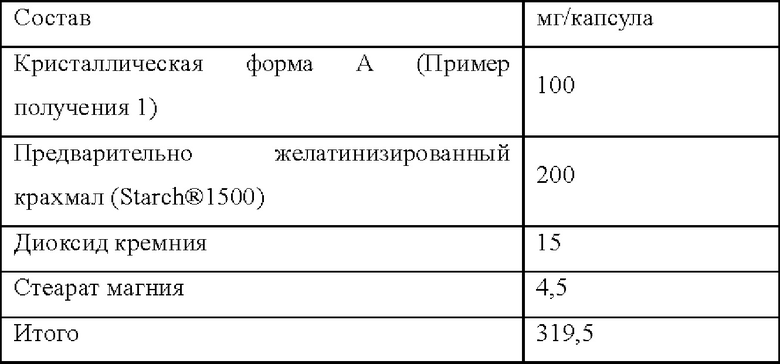
Способ: (1) при пропускании кристаллической формы А через сито 100 меш было обнаружено, что просеивание было трудным, и оставалось много остатков; после просеивания было произведено много статического электричества; (2) предварительно желатинизированный крахмал и диоксид кремния пропускали через сито 80 меш, а затем смешивали с кристаллической формой А в мешке на молнии в течение 5 минут; (3) стеарат магния пропускали через сито 80 меш, а затем смешивали с порошковой смесью выше в мешке на молнии в течение 1 минуты; (4) желатиновые капсулы 0# заполняли полученной смесью вручную.
Результаты определения показывают, что капсулы согласно настоящему примеру имеют угол естественного откоса 32,91°, что близко к данным текучести гидрата в кристаллической форме D, измеренной в примере 1.
Пример 14
Получение капсулы 2 кристаллической формы А
Формула из Примера 13 была принята снова, и применяли следующий способ: (1) при пропускании кристаллической формы А вместе с предварительно желатинизированным крахмалом через сито 80 меш, результаты просеивания были несколько улучшены, но все еще не идеальны, и было произведено много статического электричества; (2) диоксид кремния пропускали через сито 80 меш, а затем смешивали с порошковой смесью выше в мешке на молнии в течение 3 мин; (3) стеарат магния пропускали через сито 80 меш, а затем смешивали с порошковой смесью выше в мешке на молнии в течение 1 мин; (4) желатиновые капсулы 0# заполняли полученной смесью вручную.
Результаты определения показывают, что капсулы согласно настоящему примеру имеют угол естественного откоса 32,88°, что близко к текучести гидрата в кристаллической форме D согласно примеру 5. Дополнительно были проведены эксперименты с влияющими факторами.
Пример 15
Состав препарата для капсул гидрата в кристаллической форме D является следующим, другие вспомогательные материалы не задействованы:

Способ: (1) брали и пропускали через сито 80 меш соответствующее формуле количество гидрата в кристаллической форме D, полученного в Примере 1; (2) заполняли желатиновые капсулы 3#, осторожно выравнивали исходные материалы и надевали крышки капсул; проводили эксперименты с влияющими факторами.
Пример 16
Эксперименты с влияющими факторами
А. Испытание при высокой температуре
100 капсул продуктов из Примеров 14 и 15 помещали в открытую чашку Петри в инкубаторе при 60°С, и отбирали образцы в дни 5 и 10. Наблюдали характеристики и внешний вид, выявляли родственные соединения и определяли их содержание.
B. Испытание при высокой влажности
100 капсул продуктов из Примеров 14 и 15 помещали в открытую чашку Петри в закрытом контейнере с относительной влажностью 90±5% (насыщенный раствор нитрата калия), и отбирали образцы в дни 5 и 10. Наблюдали характеристики и внешний вид, выявляли родственные соединения и определяли их содержание.
C. Испытание на интенсивное облучение светом
100 капсул продуктов из Примеров 14 и 15 помещали в открытую чашку Петри и облучали с использованием флуоресцентной лампы 4500±500 LX, и отбирали образцы в дни 5 и 10. Наблюдали характеристики и внешний вид, выявляли родственные соединения и определяли их содержание.
Результаты приведены ниже:
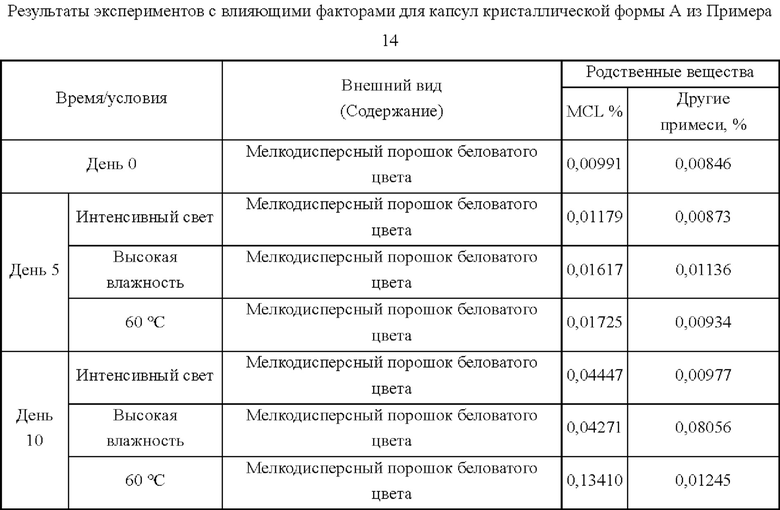
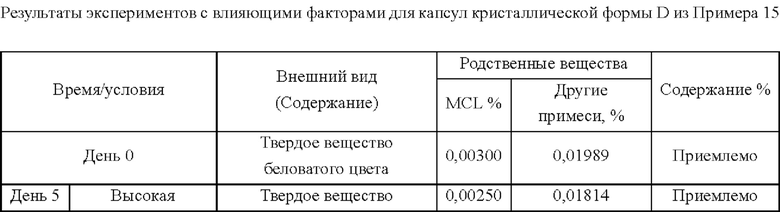
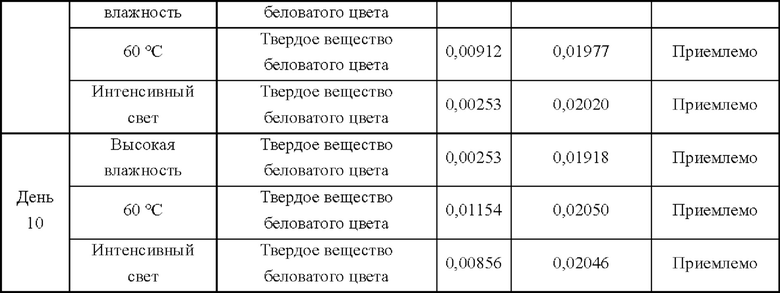
Приведенные выше результаты показывают, что при аналогичной текучести в экспериментах с влияющими факторами для капсул гидрата в кристаллической форме D содержание MCL (михелиолида) существенно не изменялось в течение 5 суток, в то время как в экспериментах с капсулами кристаллической формы А содержание MCL значительно увеличивалось через 5 суток и более. Следовательно, благодаря превосходной текучести, гидрат в кристаллической форме D может быть получен в капсулах без добавления вспомогательных материалов и клинически применен. Что касается кристаллической формы А, однако, она имеет значительно худшую стабильность, чем кристаллическая форма D, даже если текучесть ее капсул была улучшена путем добавления вспомогательных материалов и оптимизации способа. Следовательно, капсулы гидрата в кристаллической форме D превосходят капсулы кристаллической формы А с точки зрения способа получения, стабильности или приемлемости для пациента.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ КРИСТАЛЛИЧЕСКИЕ ФОРМЫ НАТРИЕВОЙ СОЛИ(4-{ 4-[5-(6-ТРИФТОРМЕТИЛ-ПИРИДИН-3-ИЛАМИНО) ПИРИДИН-2-ИЛ] ФЕНИЛ} ЦИКЛОГЕКСИЛ) УКСУСНОЙ КИСЛОТЫ | 2011 |
|
RU2612556C2 |
| ПОЛИМОРФ МАЛЕАТА ИНГИБИТОРА ДИПЕПТИДИЛПЕПДИДАЗЫ IV(DPPIV) И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2017 |
|
RU2732577C1 |
| КРИСТАЛЛИЧЕСКИЙ ПОЛИМОРФ 4-[5-(ПИРИДИН-4-ИЛ)-1Н-1,2,4-ТРИАЗОЛ-3-ИЛ]-ПИРИДИН-2-КАРБОНИТРИЛА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2639149C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ИНГИБИТОРА TLR7/TLR8 | 2019 |
|
RU2792005C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ (R)-5-[3-ХЛОР-4-(2, 3-ДИГИДРОКСИПРОПОКСИ)БЕНЗ[Z]ИЛИДЕН]-2-([Z]-ПРОПИЛИМИНО)-3-о-ТОЛИЛТИАЗОЛИДИН-4-ОНА | 2009 |
|
RU2519548C2 |
| КРИСТАЛЛИЧЕСКАЯ ФОРМА ПРОИЗВОДНОГО ТИОФЕНА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2022 |
|
RU2830948C1 |
| Способ получения полиморфа гидрохлорида 2-[4-(метиламинометил)фенил]-5-фтор-бензофуран-7-карбоксамида | 2018 |
|
RU2783418C1 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 1-[(3R,4S)-4-ЦИАНОТЕТРАГИДРОПИРАН-3-ИЛ]-3-[(2-ФТОР-6-МЕТОКСИ-4-ПИРИДИЛ)АМИНО]ПИРАЗОЛ-4-КАРБОКСАМИДА | 2019 |
|
RU2828229C2 |
| МОНОСЕБАЦИНАТ ПРОИЗВОДНОГО ПИРАЗОЛА | 2008 |
|
RU2482122C2 |
| СОЛЕВАЯ ФОРМА СОЕДИНЕНИЯ ИЗОХИНОЛИНОНОВОГО ТИПА В КАЧЕСТВЕ ИНГИБИТОРА ROCK И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2021 |
|
RU2821792C1 |
Изобретение относится к способу получения гидрата фумарата диметиламиномихелиолида, характеризующегося тем, что гидрат находится в кристаллической форме D, молярное отношение фумарата диметиламиномихелиолида к воде составляет 1:1, и гидрат имеет молекулярную формулу C17H27NO3⋅C4H4O4⋅H2O. Термогравиметрический анализ показывает потерю массы 3,97% - 4,22% перед разложением, график дифференциальной сканирующей калориметрии показывает эндотермический пик дегидратации при 75±5°C и характерный пик плавления при 148±5°C. При этом гидрат имеет характеристические пики при углах 2θ 7,8±0,2°, 11,1±0,2°, 11,4±0,2°, 12,6±0,2°, 12,9±0,2°, 14,4±0,2°, 15,3±0,2°, 17,0±0,2°, 18,7±0,2°, 19,7±0,2°, 20,6±0,2°, 21,0±0,2°, 22,5±0,2°, 23,7±0,2°, 24,3±0,2°, 25,5±0,2° и 26,2±0,2° в порошковой рентгеновской дифрактограмме с использованием излучения Cu-Kα. Кристаллическая форма D находится в орторомбической кристаллографической системе и имеет пространственную группу P212121, параметр ячейки a = 8,8346(18)  , b = 14,796(3)
, b = 14,796(3)  , c= 16,385(3)
, c= 16,385(3)  , α = 90°, β = 90° и γ = 90°; и объем ячейки 2141,8(8)
, α = 90°, β = 90° и γ = 90°; и объем ячейки 2141,8(8)  3. Способ осуществляют активной кристаллизацией, где под действием перемешивания добавляют диметиламиномихелиолид и фумаровую кислоту в смешанную систему растворителей, состоящую из растворителя S1 и растворителя S2, при постоянной температуре 30-70°С, при этом массовое отношение растворителя S2 к растворителю S1 составляет (0–3):1, а молярное отношение диметиламиномихелиолида к фумаровой кислоте составляет (1-1,6):1; через 5–10 ч реакции фильтруют реакционную смесь и сушат остаток при 25–45°С при нормальном давлении в течение 6–10 ч с получением фумарата диметиламиномихелиолида в кристаллической форме D. Растворитель S1 представляет собой смешанный растворитель, состоящий из воды и любого из ацетона, тетрагидрофурана, 1,4-диоксана, ацетонитрила и метилизобутилкетона; растворитель S2 представляет собой смешанный растворитель, состоящий из сложного эфира и простого эфира; сложноэфирный растворитель может быть выбран из любого одного или двух из метилацетата, этилацетата, гексилацетата и изопропилацетата; простой эфирный растворитель может быть выбран из любого одного или двух из диэтилового эфира, метилэтилового эфира, метил-трет-бутилового эфира, дипропилового эфира, дибутилового эфира, диметилового эфира этиленгликоля, монометилового эфира этиленгликоля, 1,4-диоксана, тетрагидрофурана и 2-метилтетрагидрофурана. Технический результат – высокий выход гидрата фумарата диметиламиномихелиолида с высокой кристалличностью, высокой насыпной плотностью, с хорошей текучестью и стабильностью. 2 з.п. ф-лы, 6 ил., 2 табл., 16 пр.
3. Способ осуществляют активной кристаллизацией, где под действием перемешивания добавляют диметиламиномихелиолид и фумаровую кислоту в смешанную систему растворителей, состоящую из растворителя S1 и растворителя S2, при постоянной температуре 30-70°С, при этом массовое отношение растворителя S2 к растворителю S1 составляет (0–3):1, а молярное отношение диметиламиномихелиолида к фумаровой кислоте составляет (1-1,6):1; через 5–10 ч реакции фильтруют реакционную смесь и сушат остаток при 25–45°С при нормальном давлении в течение 6–10 ч с получением фумарата диметиламиномихелиолида в кристаллической форме D. Растворитель S1 представляет собой смешанный растворитель, состоящий из воды и любого из ацетона, тетрагидрофурана, 1,4-диоксана, ацетонитрила и метилизобутилкетона; растворитель S2 представляет собой смешанный растворитель, состоящий из сложного эфира и простого эфира; сложноэфирный растворитель может быть выбран из любого одного или двух из метилацетата, этилацетата, гексилацетата и изопропилацетата; простой эфирный растворитель может быть выбран из любого одного или двух из диэтилового эфира, метилэтилового эфира, метил-трет-бутилового эфира, дипропилового эфира, дибутилового эфира, диметилового эфира этиленгликоля, монометилового эфира этиленгликоля, 1,4-диоксана, тетрагидрофурана и 2-метилтетрагидрофурана. Технический результат – высокий выход гидрата фумарата диметиламиномихелиолида с высокой кристалличностью, высокой насыпной плотностью, с хорошей текучестью и стабильностью. 2 з.п. ф-лы, 6 ил., 2 табл., 16 пр.
1. Способ получения гидрата фумарата диметиламиномихелиолида, характеризующийся тем, что гидрат находится в кристаллической форме D, молярное отношение фумарата диметиламиномихелиолида к воде составляет 1:1, и гидрат имеет молекулярную формулу C17H27NO3⋅C4H4O4⋅H2O; термогравиметрический анализ показывает потерю массы 3,97% - 4,22% перед разложением; график дифференциальной сканирующей калориметрии показывает эндотермический пик дегидратации при 75±5°C и характерный пик плавления при 148±5°C,
при этом гидрат имеет характеристические пики при углах 2θ 7,8±0,2°, 11,1±0,2°, 11,4±0,2°, 12,6±0,2°, 12,9±0,2°, 14,4±0,2°, 15,3±0,2°, 17,0±0,2°, 18,7±0,2°, 19,7±0,2°, 20,6±0,2°, 21,0±0,2°, 22,5±0,2°, 23,7±0,2°, 24,3±0,2°, 25,5±0,2° и 26,2±0,2° в порошковой рентгеновской дифрактограмме с использованием излучения Cu-Kα, где пик при 7,8±0,2° является исходным пиком; характеристический пик при 20,6±0,2° имеет относительную интенсивность 100%; кристаллическая форма D находится в орторомбической кристаллографической системе и имеет пространственную группу P212121, параметр ячейки a = 8,8346(18)  , b = 14,796(3)
, b = 14,796(3)  , c = 16,385(3)
, c = 16,385(3)  , α = 90°, β = 90° и γ = 90°; и объем ячейки 2141,8(8)
, α = 90°, β = 90° и γ = 90°; и объем ячейки 2141,8(8)  3,
3,
при этом получение осуществляют активной кристаллизацией: под действием перемешивания добавляют диметиламиномихелиолид и фумаровую кислоту в смешанную систему растворителей, состоящую из растворителя S1 и растворителя S2, при постоянной температуре 30-70°С, при этом массовое отношение растворителя S2 к растворителю S1 составляет (0–3):1, а молярное отношение диметиламиномихелиолида к фумаровой кислоте составляет (1-1,6):1; через 5–10 ч реакции, фильтруют реакционную смесь и сушат остаток при 25–45°С при нормальном давлении в течение 6–10 ч с получением фумарата диметиламиномихелиолида в кристаллической форме D;
растворитель S1 представляет собой смешанный растворитель, состоящий из воды и любого из ацетона, тетрагидрофурана, 1,4-диоксана, ацетонитрила и метилизобутилкетона;
растворитель S2 представляет собой смешанный растворитель, состоящий из сложного эфира и простого эфира;
сложноэфирный растворитель может быть выбран из любого одного или двух из метилацетата, этилацетата, гексилацетата и изопропилацетата;
простой эфирный растворитель может быть выбран из любого одного или двух из диэтилового эфира, метилэтилового эфира, метил-трет-бутилового эфира, дипропилового эфира, дибутилового эфира, диметилового эфира этиленгликоля, монометилового эфира этиленгликоля, 1,4-диоксана, тетрагидрофурана и 2-метилтетрагидрофурана.
2. Способ получения гидрата фумарата диметиламиномихелиолида по п. 1, характеризующийся тем, что указанный гидрат также имеет характеристические пики при углах 2θ 10,5±0,2°, 11,7±0,2°, 12,0±0,2°, 15,6±0,2°, 15,9±0,2°, 16,2±0,2°, 21,3±0,2°, 22,1±0,2°, 23,0±0,2°, 26,4±0,2°, 27,2±0,2°, 28,2±0,2°, 28,6±0,2°, 29,3±0,2°, 30,4±0,2° и 31,1±0,2° в рентгеновской порошковой дифрактограмме с использованием излучения Cu-Kα.
3. Способ получения гидрата фумарата диметиламиномихелиолида по п. 1 или 2, характеризующийся тем, что массовое отношение любого из ацетона, тетрагидрофурана, 1,4-диоксана, ацетонитрила и метилизобутилкетона к воде в растворителе S1 составляет (5–10):1;
массовое отношение сложноэфирного растворителя к простому эфирному растворителю в растворителе S2 составляет (1–3):1;
массовое отношение твердого исходного материала диметиламиномихелиолида к S1 составляет 1:(6–10).
| CN 103724307 A, 16.04.2014 | |||
| US 20160367525 A1, 22.12.2016 | |||
| EP 3320901 A4, 14.11.2018 | |||
| СПОСОБЫ ИЗГОТОВЛЕНИЯ И НАЗНАЧЕНИЕ ДЕРИВАТА SPHAELACTONE И ЕГО КОМПОЗИТНЫЕ ЛЕКАРСТВА | 2011 |
|
RU2537319C2 |
| CN 104876899 A, 02.09.2015 | |||
| BOMMAGANI S., et al.: "13-(N,N-Dimethylamino)micheliolide 0.08-hydrate", Acta Crystallographica Section E Structure Reports, 2013, vol.E69, pp.o1789-o1790 | |||
| MINO.R.CAIRA, Crystalline polymorphism of organic | |||
Авторы
Даты
2024-08-06—Публикация
2020-03-26—Подача