Область техники, к которой относится изобретение
Настоящее изобретение относится к катализатору синтеза аммиака, подходящему для синтеза аммиака с помощью взаимодействия водорода и азота, к способу получения катализатора синтеза аммиака и к способу синтеза аммиака, использующему катализатор синтеза аммиака.
Уровень техники
Минеральные удобрения (сульфат аммония и мочевина), которые являются незаменимыми при производстве сельскохозяйственных культур для поддержания дальнейшего существования человечества, производят из аммиака. Способ синтеза аммиака с использованием азота и водорода в качестве исходных материалов и при использовании катализатора, изготовленного преимущественно из железа, был открыт Габером и Бошем. Этот способ (называемый «процессом Габера-Боша») используют до сих пор в качестве основного метода поддержания жизни человечества, даже спустя примерно одно столетие с момента промышленного осуществления процесса Габера-Боша в 1910 г.
Процесс Габера-Боша включает стадию прямого взаимодействия газовой смеси из азота и водорода для осуществления реакции в условиях высокой температуры и высокого давления, от 400 до 600°C и примерно от 20 МПа до примерно 100 МПа, с помощью дважды промотированного железного катализатора, который преимущественно изготовлен из Fe3O4, содержащего несколько массовых процентов Al2O3 и K2O, и стадию выделения аммиака, образованного по реакции N2+3H2→2NH3, с помощью охлаждения образованного аммиака или поглощения его водой. Даже сейчас такой метод используют в промышленном масштабе в процессе производства практически таким же образом, как и когда он был первоначально реализован.
С другой стороны, существует известный катализатор, использующий в качестве элемента переходного металла, проявляющего активность в синтезе аммиака при низкой температуре 300°C или ниже, элементы одного типа, выбранные из Mo, W, Re, Fe, Co, Ru и Os или любой из комбинаций Fe и Ru, Ru и Re и Fe и Mo преимущественно в металлическом состоянии (патентная литература (PTL) 1). Также разработаны способы синтеза аммиака, использующие в качестве катализатора любой из переходных металлов группы 8 или 9, например, Fe, Ru, Os и Co (PTL 2-4). Также разработаны способы, в частности, использующие рутений в качестве катализатора для синтеза аммиака (PTL 5-8). Кроме того, были разработаны способы синтеза аммиака, использующие в качестве катализатора нитриды переходных металлов группы 8 или 6B и композитные нитриды Co и Mo (PTL 9 и 10).
Кроме того, способ производства аммиака из азота и водяного пара при помощи плазменного контакта, использующий катализатор, содержащий в материале носителя компонент, который проявляет каталитическую активность и который отбирают в качестве, по меньшей мере, одного переходного металла из группы, состоящей из Ti, Zr, Hf, V, Nb, Ta, Cr, Mo, W, Fe, Ru, Os, Co, Rh, Ir, Ni, Pd, Pt, Mn и Cu, представлен в патентной заявке (PTL 11).
До настоящего времени, чтобы использовать катализатор синтеза аммиака, например, Ru или Fe, с высокой эффективностью, в качестве носителей катализатора используют оксид магния, оксид алюминия, графит, оксид церия и т.д., и в качестве промоторов используют щелочные металлы, соединения щелочных металлов, соединения щелочноземельных металлов и т.д.
Когда кислотное соединение, например оксид алюминия, используется в качестве носителя, обычно требуется добавлять большое количество соединения, которое служит в качестве промотора, имеющего высокую электроотрицательность, с целью повышения электронодонорной способности и получения катализатора с высокой активностью.
В то же время среди алюмосиликатов кальция, содержащих CaO, Al2O3 и SiO2 в качестве составляющих, существует химическое соединение, имеющее название минерала «майенит». Соединение, имеющее такой же тип кристаллической структуры, что и кристалл майенита, называется «соединением майенитового типа». Соединение майенитового типа имеет характерный состав 12CaO·7Al2O3 (далее обозначаемый как «C12A7»). Сообщается, что кристалл C12A7 имеет уникальную кристаллическую структуру, в которой два из 66 ионов кислорода, присутствующих в элементарной ячейке, содержащей две молекулы, включены в виде «свободных ионов кислорода» в пространство внутри клетки («кэйджа»), которое образует каркасную структуру C12A7 (непатентная литература (NPL) 1).
После 2003 года авторы обнаружили, что эти свободные ионы кислорода могут быть заменены различными анионами. В частности, все свободные ионы кислорода могут быть заменены электронами с помощью выдерживания C12A7 в сильно восстановительной атмосфере. C12A7, в котором свободные ионы кислорода заменены электронами, можно выразить химической формулой [Ca24Al28O64]4+(e-)4 (далее обозначаемой как [C12A7:e-]). Вещество, содержащее электроны, заменяющие анионы, как описано выше, называется электридом, и электрид отличается хорошей электропроводностью (NPL 2).
Кроме того, авторы обнаружили C12A7:e-, которое является электропроводящим соединением майенитового типа, 12SrO·7Al2O3, которое является соединением того же типа, что и C12A7, смешанное кристаллическое соединение C12A7 и 12SrO·7Al2O3 и способ их синтеза (PTL 12). Изобретение, касающееся соединения майенитового типа, в котором Al частично заменен Ga или In, также представлено в патентной заявке (PTL 16). Такое соединение майенитового типа подходит в качестве электродных материалов, требующих высокотемпературной термообработки, например, материала защитной пленки плазменной индикаторной панели (PDP) и материала инжекции заряженных электронов в органическом электролюминесцентном (EL) устройстве. Авторы далее обнаружили, что C12A7:e-, содержащий электроны проводимости в концентрации 1×1019/см3 или более, и соединение того же типа, что и C12A7, можно получить (A) способом отжига монокристалла C12A7 при высокой температуре в парах щелочного металла или щелочноземельного металла, (B) способом ионной имплантации неактивных ионов в монокристалл C12A7, или (C) способом непосредственного отверждения из расплава монокристалла C12A7 в восстановительной атмосфере (PTL 13).
Кроме того, авторы добились успеха в получении C12A7:e-, который проявляет металлическую электропроводность, с помощью отжига монокристалла C12A7 в парах металлического титана (Ti), и представили изобретения, касающиеся способа производства C12A7:e- и использования его в качестве электронно-эмиссионного материала в патентной заявке (PTL 14). C12A7:e-, проявляющий металлическую электропроводность, также можно непосредственно синтезировать в форме порошка путем смешивания CaCO3 и Al2O3 в соотношении 11:7, нагревания смеси при 1300°C и последующего нагревания полученного продукта в атмосфере паров металлического Ca (NPL 3).
Поскольку электроны, включенные в C12A7:e-, неплотно удерживаются внутри клетки положительно заряженной каркасной структуры, эти электроны можно извлечь наружу, подавая напряжение или с помощью применения химических методов. Исходя из предположения, что эти электроны, извлеченные наружу, можно использовать в восстановительной реакции, авторы разработали способ получения вторичных спиртов и дикетоновых соединений путем восстановления кетоновых соединений с помощью электронов, включенных в C12A7:e-, и предоставили способ в патентной заявке (PTL 15).
Перечень ссылок
Патентная литература
PTL 1: Прошедшая экспертизу опубликованная заявка на патент Японии № 51-47674
PTL 2: Прошедшая экспертизу опубликованная заявка на патент Японии № 54-37592
PTL 3: Прошедшая экспертизу опубликованная заявка на патент Японии № 59-16816
PTL 4: Международная публикация WO96/38222
PTL 5: Не прошедшая экспертизу опубликованная заявка на патент Японии № 2-258066
PTL 6: Не прошедшая экспертизу опубликованная заявка на патент Японии № 9-239272
PTL 7: Не прошедшая экспертизу опубликованная заявка на патент Японии № 2004-35399
PTL 8: Не прошедшая экспертизу опубликованная заявка на патент Японии № 2006-231229
PTL 9: Не прошедшая экспертизу опубликованная заявка на патент Японии № 2000-264625
PTL 10: Не прошедшая экспертизу опубликованная заявка на патент Японии № 2008-13435
PTL 11: Не прошедшая экспертизу опубликованная заявка на патент Японии № 2001-151507
PTL 12: Внутреннее переиздание международной публикации РСТ для заявки на патент № 2005/000741
PTL 13: Не прошедшая экспертизу опубликованная заявка на патент Японии № 2005-314196
PTL 14: Внутреннее переиздание международной публикации РСТ для заявки на патент № 2007/060890
PTL 15: Не прошедшая экспертизу опубликованная заявка на патент Японии № 2008-214302
PTL 16: Не прошедшая экспертизу опубликованная заявка на патент Японии № 2009-203126
Непатентная литература
NPL 1: H.B. Bartl and T. Scheller “N. Jahrbuch Mineral. Monatsh”, 547, (1970)
NPL 2: S. Matsuishi, Y. Toda, M. Miayakawa, K. Hayashi, T. Kamiya, M. Hirano, I. Tanaka and H. Hocono, “Science”, 301, 626-629, (2003)
NPL 3: S. Matsuishi, T. Nomura, M. Hirano, K. Kodama, S. Shamoto and H. Hosono, “Chemistry of Materials”, 21, 2589-2591, (2009)
Сущность изобретения
Техническая проблема
Поскольку процесс Габера-Боша является реакцией уменьшения объема, предпочтительно проводить реакцию под высоким давлением, примерно 20 МПа или выше, с точки зрения повышения эффективности реакции. Кроме того, процесс Габера-Боша требует проведения реакции при высокой температуре, чтобы обеспечить активность катализатора, преимущественно сделанного из Fe. Соответственно, процесс Габера-Боша имеет недостатки, заключающиеся в том, что размер устройства синтеза повышен и что потери тепловой энергии являются большими. Кроме того, существующий способ производства аммиака является неудовлетворительным в том, что так как уровень однопроходной конверсии является низким, - непрореагировавший газ должен быть направлен на рециркуляцию, и количество энергии, используемой для рециркуляции, повышается.
В то же время известно, что когда в качестве катализатора синтеза аммиака используется Ru, реакция прогрессирует при низком давлении. Таким образом, Ru привлекает внимание как катализатор синтеза аммиака второго поколения. Однако каталитические свойства одного Ru очень малы, и нужно использовать носитель или промоторное соединение для повышения каталитической способности Ru. В последнее время промотированный Ru катализатор, нанесенный на углерод, введен в промышленное производство. Хотя Ru катализатор обладает высокой активностью, известно, что, поскольку при взаимодействии носителя и водорода в условиях синтеза аммиака образуется метан, носитель теряет свою функцию, порождая, таким образом, серьезную проблему в технологическом процессе. По этой причине потребовалась разработка стабильного катализатора, принимая во внимание условия промышленного синтеза аммиака.
Целью настоящего изобретения является разработка вещества катализатора, которое является стабильным и эффективным в синтезе аммиака, одного из наиболее важных химических веществ для компонентов удобрений и т.п., вещества катализатора, проявляющего каталитическую активность в мягких условиях синтеза, не требующих высокого давления, и выгодного также с точки зрения экономии ресурсов. Другие цели настоящего изобретения заключаются в разработке способа получения каталитического соединения и способа синтеза аммиака с помощью каталитического соединения.
Решение проблемы
В результате проведения интенсивных исследований с намерением достичь вышеприведенных целей авторы изобретения обнаружили, что активность синтеза аммиака резко повышается благодаря созданию нанесенного металлического катализатора на основе переходного металла, например, Ru или Fe, нанесенного на соединение майенитового типа, содержащее электроны проводимости, и что катализатор синтеза аммиака является стабильным в реакции даже в течение долгого времени и проявляет намного более высокую производительность, чем обычные катализаторы, полученные без использования любого из нестабильных щелочных металлов, щелочноземельных металлов и их соединений в качестве промоторных соединений.
Настоящее изобретение относится к катализатору синтеза аммиака, включающего нанесенный металлический катализатор, который нанесен на соединение майенитового типа, содержащее электроны проводимости в концентрации 1015 см-3 или более и служащее носителем для катализатора синтеза аммиака.
В соединении майенитового типа оксидные ионы (O2 - и O2 2-), включенные в структуру клетки, заменены электронами, которые служат в качестве электронов проводимости. C12A7, содержащее эти электроны проводимости, выражается формулой состава ([Ca24Al28O64]4+(O2-)2-x(e-)2x) (0<x<2). Посредством замены оксидных ионов электронами электроны проводимости в концентрации 1×1015 см-3 или более могут быть включены в соединение майенитового типа. Таким образом, соединение майенитового типа, включающее электроны проводимости, можно называть «электропроводящим соединением майенитового типа». Теоретически максимальная концентрация электронов проводимости составляет 2,3×1021 см-3 в случае C12A7. Соединение майенитового типа, содержащее электроны проводимости в концентрации, равной теоретическому значению, можно получить вышеописанным способом.
C12A7 обладает каталитическими свойствами, даже когда он не включает электроны проводимости. Для получения более высокой активности синтеза аммиака по сравнению с обычными катализаторами соединение майенитового типа, тем не менее, должно включать электроны проводимости в концентрации 1015 см-3 или более в катализаторе настоящего изобретения. Соединение майенитового типа, содержащее большее количество электронов проводимости, обеспечивает более высокую эффективность синтеза аммиака. В катализаторе настоящего изобретения соединение майенитового типа предпочтительно содержит электроны проводимости в концентрации 1017 см-3 или более, и более предпочтительно содержит электроны проводимости в концентрации 1018 см-3 или более.
Соединение майенитового типа дает пики оптического поглощения при 2,8 эВ и 0,4 эВ. Плотность электронов проводимости определяется с помощью измерения коэффициента оптического поглощения. Плотность электронов проводимости можно просто определить с помощью метода диффузного отражения, когда образец находится в форме порошка. Поскольку электроны проводимости в клетке обладают спиновой активностью, плотность электронов проводимости внутри клетки также можно измерить с помощью электронно-спинового резонанса (ЭСР). Кроме того, соединение майенитового типа, содержащее электроны проводимости, восстанавливает йод в тех случаях, когда соединение майенитового типа растворено в растворе, содержащем йод. Используя такое действие, плотность электронов проводимости внутри клетки также можно измерять с помощью проведения окислительно-восстановительного титрования.
Нанесенный металлический катализатор можно получить с помощью одного из способов: пропитки, физического смешивания, термического разложения, жидкофазного процесса и осаждения из пара. Предпочтительно нанесенный металлический катализатор получают с помощью стадий диспергирования порошка соединения майенитового типа, содержащего электроны проводимости в концентрации 1015 см-3 или более, в растворе растворителя соединения переходного металла, испарения растворителя из раствора растворителя и нагревания предшественника катализатора, полученного из высушенного в восстановительной атмосфере соединения переходного металла, образуя, таким образом, каталитический металл путем восстановления соединения переходного металла. Аммиак можно синтезировать с высокой эффективностью с помощью использования катализатора, полученного, как описано выше, и путем взаимодействия азота и водорода в качестве исходных материалов на катализаторе в реакционной установке в условиях температуры реакции от 100°C до 600°C или ниже, и давления реакции от 10 кПа до 30 МПа.
Определение соединения майенитового типа
В настоящем изобретении термин "соединение майенитового типа" означает сам майенит в форме минерала, породу майенитового типа и смешанный оксид, имеющий такую же кристаллическую структуру, что и майенит в форме минерала. Кристалл соединения майенитового типа построен таким образом, что клеткообразные структуры (называемые «клетками»), имеющие внутренний диаметр примерно 0,4 нм, соприкасаются поверхностями своих стенок и трехмерно соединены друг с другом. Анионы, такие как O2-, обычно включены в каждую клетку соединения майенитового типа, но эти анионы могут быть заменены электронами проводимости с помощью отжига. Концентрация электронов проводимости в соединении майенитового типа повышается при увеличении времени отжига.
Характерный состав электропроводящего соединения майенитового типа выражен формулой [Ca24Al28O64]4+(O2-)2-x(e-)2x) (0<x<2). Электропроводящее соединение майенитового типа можно получить, например, отжигом C12A7, полученного в процессе спекания в парах металла, например, Ca или Ti, примерно при 1100°C. Известны различные способы получения электропроводящего соединения майенитового типа, и любые соединения, полученные с помощью этих способов, можно в некоторых случаях использовать в настоящем изобретении.
Когда соединение майенитового типа отжигают в парах металлического Ti, соединение майенитового типа, содержащее электроны проводимости в теоретически максимальной концентрации (2,3×1021 см-3 в случае C12A7), может быть получено с помощью отжига в течение примерно 24 часов, даже при использовании монокристаллического соединения майенитового типа толщиной 3 мм. Альтернативно, соединение майенитового типа можно получить отверждением расплава соединения майенитового типа, имеющего стехиометрический состав в восстановительной атмосфере. Концентрация электронов проводимости соединения майенитового типа, полученного путем отверждения в восстановительной атмосфере, составляет менее 1021 см-3.
Электропроводящее соединение майенитового типа также можно получить с помощью ионной имплантации Ar+ ионов при высокой концентрации в соединении майенитового типа. Концентрацию электронов проводимости полученного электропроводящего соединения майенитового типа можно определить по интенсивности полосы оптического поглощения (2,8 эВ в случае 12CaO·7Al2O3). Когда концентрация электронов проводимости электропроводящего соединения майенитового типа мала, концентрацию электронов проводимости также можно определять по интенсивности полосы поглощения электронно-спинового резонанса.
В электропроводящем соединении майенитового типа Ca, присутствующий в указанной выше формуле характерного состава, может быть частично или полностью заменен, по меньшей мере, одним или более элементами конкретных металлов или элементов переходных металлов, которые выбраны из группы, состоящей из Li, Na, K, Mg, Sr, Ba, Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Ir, Ru, Rh и Pt. Кроме того, Al, присутствующий в указанной выше формуле характерного состава, может быть частично или полностью заменен, по меньшей мере, одним или более элементами конкретных металлов или элементов переходных металлов, которые выбраны из группы, состоящей из B, Ga, C, Si, Fe и Ge. Кроме того, О, присутствующий в указанной выше формуле характерного состава, может быть частично или полностью заменен, по меньшей мере, одним или более конкретными элементами или элементами металлов, которые выбраны из группы, состоящей из H, F, Cl, Br и Au.
Полезные эффекты изобретения
Согласно способу настоящего изобретения аммиак может быть синтезирован путем взаимодействия водорода и азота при использовании недорогого и нетоксичного соединения, изготовленного только из элементов, имеющих относительно высокие кларковые числа, таких как кальций, алюминий и кислород, не только с меньшим энергопотреблением при низком давлении реакции от 10 кПа до 30 МПа, более предпочтительно от 10 кПа до 20 МПа, но также и с долгосрочной стабильностью при высокой эффективности, поскольку каталитическая активность не уменьшается при повторении реакции синтеза. Кроме того, элементы переходных металлов, такие как Fe и Co, в отличие от дорогих редких металлов, таких как Ru, также можно использовать в качестве нанесенного металлического катализатора. Поэтому настоящее изобретение является ценным с точки зрения эффективного использования ресурсов. Кроме того, из-за отсутствия необходимости добавления промоторов, например, щелочных металлов, соединений щелочных металлов и соединений щелочноземельных металлов, в отличие от обычных носителей на основе оксида алюминия и т.д., технология производства упрощается.
Краткое описание фигур
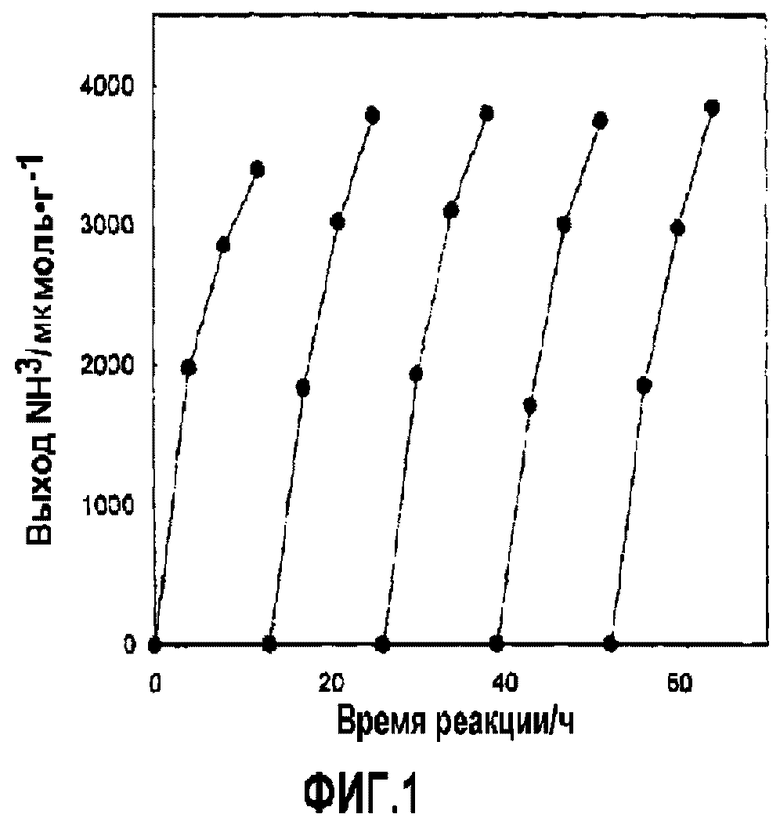
[Фиг.1] На фиг.1 представлена зависимость образования аммиака (обозначенного как «выход NH3/мкмоль г-1») от времени (обозначенного как «время реакции/ч»), в тех случаях, когда в реакции синтеза аммиака неоднократно используют Ru/C12A7:e-(концентрация электронов проводимости 1021 см-3) примера 2.
Описание вариантов осуществления
Катализатор настоящего изобретения, способ получения катализатора и способ синтеза аммиака с использованием катализатора (далее называется как «способ настоящего изобретения») будут подробно описаны ниже.
Способ включения электронов проводимости в соединение майенитового типа
Соединение майенитового типа, используемое в качестве исходного материала в способе получения катализатора настоящего изобретения, может иметь любую форму, включая порошок, пористый материал, спеченное изделие, тонкую пленку или монокристалл. Соединение майенитового типа также может быть соединением майенитового типа, осажденным на носителе, сделанном из другого вещества. Соединение майенитового типа, содержащее электроны проводимости, можно непосредственно получить из сырьевых материалов, без временного получения в виде обычного соединения майенитового типа, за исключением случаев, когда используется тонкая пленка или монокристалл. Кроме того, минералы майенитового типа, шлак и сожженную золу, содержащие майенит и т.д., можно использовать в качестве сырьевых материалов.
Порошок соединения майенитового типа, содержащий электроны проводимости, можно получить нагреванием порошка сырьевых материалов соединения майенитового типа, который имеет стехиометрический состав в восстановительной атмосфере. Спеченное изделие соединения майенитового типа, содержащего электроны проводимости, можно получить нагреванием порошка сырьевых материалов соединения майенитового типа, который имеет стехиометрический состав, примерно при 1300°C в восстановительной атмосфере, тем самым спекая и отверждая порошок.
Тонкая пленка соединения майенитового типа, содержащего электроны проводимости, может быть получена с помощью использования в качестве мишени спеченного изделия соединения майенитового типа, образуя тонкую пленку соединения майенитового типа на подложке, изготовленной, например, из MgO или Y3Al5O12, например, способом импульсного лазерного осаждения (PLD), напыления или плазменного напыления, и с помощью повторного осаждения тонкой пленки соединения майенитового типа способом PLD для объединения с уже осажденной тонкой пленкой, при нагревании последней при 500°C или выше. При повторении способа PLD соединение майенитового типа, приведенное в состояние плазмы, служит в качестве восстановителя, так что электроны проводимости оказываются включенными в осажденную тонкую пленку.
Монокристалл соединения майенитового типа, содержащего электроны проводимости, можно получить с помощью образования монокристалла соединения майенитового типа посредством стадии вытягивания из расплава, в которой порошок сырьевого материала соединения майенитового типа расплавляют примерно при 1600°C (т.е. с помощью CZ метода (Чохральского)), запечатывая образовавшийся монокристалл в вакуумной стеклянной трубке, например, вместе с металлическим порошком Ca или Ti, и с помощью нагревания их в восстановительной атмосфере, так что электроны проводимости оказываются включенными в монокристалл.
Электропроводящее соединение майенитового типа в форме спеченного изделия или монокристалла также может быть переработано в порошок. Переработка в порошок может осуществляться, например, с помощью размола с использованием ступки или струйной мельницы. Хотя размер порошка не ограничивается размером частиц, при использовании указанного выше способа переработки в порошок получают частицы с диаметром, распределенным в диапазоне от примерно 100 нм до 1 мм. Соединение майенитового типа, содержащее электроны проводимости в концентрации 1×1015 см-3 или более, получают согласно любому из вышеописанных способов.
В зависимости от способа получения электроны проводимости могут исчезать с поверхности соединения майенитового типа безотносительно от использованного соединения майенитового типа, взятого в форме порошка, пористого материала, спеченного изделия, тонкой пленки и монокристалла. В таком случае желательно нагревать полученное соединение майенитового типа при температуре не ниже 900°C и ниже, чем температура плавления (1250°C) соответствующего соединения в вакууме, инертном газе или в восстановительной атмосфере, таким образом, чтобы электроны проводимости были включены вплоть до наружной поверхности соединения майенитового типа.
Стадия нанесения переходного металла
Элементы переходных металлов используются в качестве катализаторов гомогенной системы и гетерогенной системы в различных реакциях синтеза. В частности, известно, что переходные металлы, относящиеся к группам 6, 8 и 9, такие как Fe, Ru, Os, Co и Mo, подходят в качестве катализаторов для синтеза аммиака путем прямого взаимодействия водорода и азота. В настоящем изобретении один или более металлов 6 группы, выбранных из Cr, Mo и W, один или более металлов 7 группы, выбранных из Mn, Tc и Re, один или более металлов 8 группы, выбранных из Fe, Ru и Os, и один или более металлов 9 группы, выбранных из Co, Rh и Ir, могут быть использованы в качестве элемента (элементов) переходных металлов по отдельности или в комбинации. Кроме того, также могут использоваться соединения указанных выше элементов, например, Co3Mo3N, Fe3Mo3N, Ni2Mo3N и Mo2N.
В тех случаях, когда порошок или пористый материал соединения майенитового типа используется в качестве носителя, порошок или пористый материал соединения майенитового типа, полученный с помощью вышеописанных стадий и содержащий электроны проводимости в концентрации 1×1015 см-3 или более, смешивают с соединением переходного металла с помощью способа пропитки или способа физического смешивания. Если используется спеченное изделие, тонкая пленка, монокристалл и т.п. соединения майенитового типа, то в дополнение к способу пропитки, как в случае порошка или пористого материала, можно применять способ осаждения соединения переходного металла на поверхности спеченного изделия, тонкой пленки или монокристалла с помощью, например, химического осаждения из пара (CVD) или напыления и термического разложения осажденного соединения переходного металла, тем самым вызывая осаждение переходного металла. В тех случаях, когда используется соединение переходного металла, соединение также может быть получено, например, с помощью способа осаждения любого из соответствующих сырьевых металлов на майенит, с помощью, например, способа CVD, термического разложения осажденного материала и затем азотирования его газообразным аммиаком.
Примерами соединений переходных металлов являются, но, не ограничиваясь ими, неорганические соединения металлов и органические металлокомплексы, которые подвержены термическому разложению, включающие, например, додекакарбонилтрирутений [Ru3(CO)12], дихлортетракис(трифенилфосфин)рутений(II) [RuCl2(PPh3)4], дихлортрис(трифенилфосфин)рутений(II) [RuCl2(PPh3)3], трис(ацетилацетонато)рутений(III) [Ru(acac)3], рутеноцен [Ru(C5H5)], хлорид рутения [RuCl3], пентакарбонил железа [Fe(CO)5], йодид тетракарбонилжелеза(II) [Fe(CO)4I2], хлорид железа(III) [FeCl3], ферроцен [Fe(C5H5)2], трис(ацетилацетонато)железо(III) [Fe(acac)3], додекакарбонилтрижелезо [Fe3(CO)12], хлорид кобальта(III) [CoCl3], трис(ацетилацетонато)кобальт(III) [Co(acac)3], ацетилацетонат кобальта(II) [Co(acac)2], октакарбонил кобальта [Co2(CO)8], кобальтоцен [Co(C5H5)2], додекакарбонил триосмия [Os3(CO)12] и гексакарбонил молибдена [Mo(CO)6].
Способ пропитки может быть выполнен, например, следующим образом. Порошкообразный носитель катализатора диспергируют и перемешивают в растворе соединения переходного металла (например, в гексановом растворе карбонильного комплекса Ru). В то же время загружают соединение переходного металла от 0,01 до 40% масс., предпочтительно от 0,02 до 30% масс., и более предпочтительно от 0,05 до 20% масс. относительно порошкообразного носителя. После этого раствор нагревают при температуре от 50 до 200°C в течение от 30 минут до 5 часов в токе инертного газа, например, азота, аргона или гелия, или в вакууме для испарения растворителя досуха. Затем восстанавливают предшественник катализатора, полученный из высушенного соединения переходного металла. Посредством вышеописанных стадий получают нанесенный металлический катализатор, в котором переходный металл нанесен в виде тонкодисперсных частиц, имеющих диаметр от нескольких нанометров до нескольких сотен нанометров, на порошкообразный носитель.
Удельная поверхность нанесенного металлического катализатора составляет от 0,1 до 100 м2/г, и содержание переходного металла составляет от 0,01 до 30% масс., предпочтительно от 0,02 до 20% масс. и более предпочтительно от 0,05 до 10% масс. относительно порошкообразного носителя. Порошкообразный носитель, на который нанесен переходный металл, содержит электроны в концентрации, сопоставимой с концентрацией на начальной стадии, даже после стадии нанесения переходного металла, и имеет низкую работу выхода при использовании в качестве носителя. Таким образом, порошкообразный носитель проявляет высокую способность донора электронов по отношению к переходному металлу и в значительной степени способствует активации азота и водорода на переходном металле, таким образом, выступая в качестве высокопроизводительного катализатора синтеза аммиака. Высокая производительность, вполне вероятно, объясняется тем фактом, что достаточная инжекция электронов в переходный металл, который тесно связан с поверхностью носителя электрида, происходит при диссоциации водорода и азота. Катализатор настоящего изобретения функционирует как высокопроизводительный катализатор синтеза аммиака, даже если любой щелочной металл, щелочноземельный металл и их соединения не используются в качестве промоторного соединения. Однако такое промоторное соединение может использоваться дополнительно по мере необходимости.
Аналогичный нанесенный металлический катализатор также может быть получен, вместо вышеописанного способа, путем смешивания порошка соединения майенитового типа, содержащего электроны проводимости в концентрации от 1×1015 см-3 или более, и порошка соединения переходного металла в твердой фазе с помощью способа физического смешивания, и далее нагревания смеси в условиях, аналогичных описанным выше для восстановительного разложения соединения переходного металла в переходный металл.
Кроме того, нанесенный металлический катализатор также можно получить в виде формованного изделия с помощью применения обычного метода формования. На практике формованное изделие может принимать любую из форм, например, гранулы, сферы, таблетки, кольца, червячка, четырехлепесткового клевера, кубика и соты. Как вариант, нанесенный металлический катализатор можно использовать после нанесения на подходящую подложку.
Синтез аммиака
Способом синтеза аммиака настоящего изобретения является способ, использующий в качестве катализатора вышеописанный нанесенный металлический катализатор и взаимодействие водорода и азота на катализаторе. Обычный процесс реакции заключается, как и в известном процессе Габера-Боша, в прямом взаимодействии газовой смеси азота и водорода при нагревании и под давлением, и в выделении аммиака, образующегося по реакции N2+3H2→2NH3, при помощи охлаждения образованного аммиака или поглощения его водой. Газообразные азот и водород подают для приведения в контакт с нанесенным металлическим катализатором, помещенным в реакционный сосуд. Непрореагировавшие газообразные азот и водород повторно возвращают в реакционный сосуд после извлечения образовавшегося аммиака. Предпочтительно до подачи газообразного азота и водорода осуществляют предварительную обработку для удаления оксидов и т.п., присоединенных к нанесенному переходному металлу в процессе восстановления, на поверхности нанесенного металлического катализатора в качестве восстановительной обработки с использованием газообразного водорода или газовой смеси водорода и азота.
Соединение майенитового типа предпочтительно адсорбирует влагу из атмосферного воздуха и разлагается в присутствии избытка влаги. Поэтому желательно, чтобы реакция синтеза аммиака проводилась в атмосфере, содержащей как можно меньше влаги, т.е. при использовании газообразных азота и водорода с содержанием влаги от 100 ч./млн. (частей на миллион) или менее, предпочтительно 50 ч./млн. или менее.
Аммиак синтезируют с помощью нагревания нанесенного металлического катализатора в атмосфере газовой смеси азота и водорода в качестве исходных материалов. В качестве условия синтеза аммиака молярное соотношение азота к водороду составляет примерно от 1/10 до 1/1, предпочтительно от 1/5 до 1/1. Температура реакции находится предпочтительно не ниже 100°C и ниже 600°C, более предпочтительно - в диапазоне от примерно 200°C или выше до примерно 500°C, и еще более предпочтительно - в диапазоне от примерно 250°C или выше до примерно 500°C. Более низкая температура реакции предпочтительна для поддержания равновесия более удовлетворительным для образования аммиака. Желательно, чтобы температура реакции находилась в указанном выше диапазоне с точки зрения обеспечения достаточной скорости образования аммиака и одновременно сохранения удовлетворительного равновесия для образования аммиака.
Реакционное давление газовой смеси из азота и водорода во время реакции синтеза не ограничено конкретным уровнем, но предпочтительно составляет от 10 кПа до 30 МПа. С практической точки зрения реакцию синтеза желательно осуществлять под давлением, и практически более предпочтительный диапазон реакционного давления составляет примерно от 100 кПа до 30 МПа.
Реакционная установка может работать в любом из режимов: периодическом, замкнутой циркуляции и проточном. Однако с практической точки зрения реакционная установка проточного типа является наиболее предпочтительной. Реакцию синтеза аммиака предпочтительно осуществляют при условии высокого давления и низких температур с точки зрения равновесия. Кроме того, поскольку реакция является экзотермической, реакцию синтеза аммиака предпочтительно проводят при одновременном отведении тепла. Различные приспособления предложены для повышения выхода с промышленной точки зрения. Например, при использовании проточного реактора предлагается способ получения высокого выхода аммиака, в котором несколько реакционных сосудов, наполненных катализатором, соединены последовательно, и температуру на входе каждого из реакционных сосудов понижают с помощью установки промежуточного охладителя на выходе из каждого реакционного сосуда для отведения тепла. Также предложен способ применения реакционного сосуда, который включает внутри несколько слоев катализатора, заполненных железным катализатором и катализатором на основе Ru, и точное регулирование температуры на выходе из каждого реакционного слоя.
В настоящем изобретении аммиак можно синтезировать, используя, как в известных способах, один реакционный сосуд или несколько реакционных сосудов, при этом каждый реакционный сосуд наполнен катализатором. Катализатор, используемый для синтеза аммиака, может быть одним из катализаторов настоящего изобретения, сочетанием двух или более типов, выбранных из катализаторов настоящего изобретения, или сочетанием одного или нескольких катализаторов настоящего изобретения и одного или нескольких известных катализаторов. Также можно использовать любой другой подходящий способ, например, объединения нескольких реакционных сосудов или использования реакционного сосуда, включающего несколько реакционных слоев в одном сосуде.
В тех случаях, когда в настоящем изобретении используется сочетание катализаторов, катализатор настоящего изобретения предпочтительно используется в реакционном сосуде последней ступени, поскольку он проявляет повышенную активность при более низкой температуре. Иначе говоря, более высокий выход аммиака можно получить с помощью проведения последней реакции при настолько низкой температуре, которая оказывается предпочтительной с точки зрения равновесия.
В условиях равновесной реакции промышленного синтеза аммиака концентрация аммиака в реакционном газе на выходе из реакционного сосуда составляет 20% или менее в связи с ограничениями равновесной реакции. Соответственно после охлаждения и извлечения образовавшегося аммиака из реакционного газа непрореагировавшие исходные материалы удаляются из системы на рециркуляцию, чтобы повторно использоваться в качестве исходных материалов после стадии разделения реакционного газа и части примесей, содержащихся в непрореагировавших исходных материалах.
Водород в качестве исходного материала способа синтеза аммиака может быть представлен любым из водородных газов, которые получают различными способами, например, способом использования угля, нефти или природного газа в качестве исходного сырья и получения водорода в сочетании процесса парового риформинга, процесса частичного окислительного риформинга, процесса автотермического риформинга и реакции конверсии, способом использования биомассы в качестве сырья, способом электролитического разложения воды и способом разложения воды с помощью фотокатализатора.
При использовании природного газа в качестве исходного материала для способа синтеза аммиака, газообразный водород и азот получают с помощью стадии парового риформинга и стадии частичного окислительного риформинга, каждая из которых выполняется на природном газе, стадии конверсии CO, стадии отведения CO2 и последующей стадии отведения CO с превращением CO в метан. Поскольку реакция парового риформинга является эндотермической, используется тепло реакции, образовавшееся в автотермической реакции. При использовании воздуха в качестве сырья газообразного азота, отношение H/N составляет примерно 1,7-2,5 в молярном соотношении. Поскольку непрореагировавший газ после стадии парового риформинга содержит газообразный водород, его предпочтительно направляют на стадию парового риформинга для повторного использования в качестве газа рециркуляции. Разработан способ эффективного проведения реакции с помощью регулирования соотношения свежего газа к газу рециркуляции. Аналогичным образом, этот способ также можно использовать в настоящем изобретении.
С другой стороны, разработан способ использования обогащенного кислородом воздуха в качестве способа получения исходного материала с более высоким соотношением H/N. Такой способ является предпочтительным с точки зрения экономии энергии, поскольку количество газа рециркуляции снижается при использовании исходного материала с более высоким соотношением H/N. Кроме того, способ разделения воздуха посредством сжатия и далее использования кислорода при получении водорода с помощью автотермического процесса и использования азота в виде реакционного газа или технологического азота является предпочтительным способом с точки зрения экономии энергии. Любой из указанных выше способов также можно использовать в настоящем изобретении как способ получения исходного материала.
Настоящее изобретение ниже будет описано более подробно со ссылкой на примеры. Активность синтеза аммиака оценивали путем количественного измерения выхода NH3 с помощью газовой хроматографии и определения скорости образования аммиака.
Пример 1
Получение соединения майенитового типа, содержащего электроны проводимости
Соответствующие порошки CaCO3 и Al2O3 смешивали друг с другом при молярном соотношении Ca к Al 11:7 и нагревали при 1300°C в течение 6 часов в тигле из оксида алюминия. Полученный порошок помещали в трубку из кварцевого стекла и нагревали при 1100°C в течение 15 часов в вакууме 1×10-4 Па. 3 г полученного таким образом порошка запечатывали в трубке из кварцевого стекла вместе с 0,18 г порошка металлического Ca и нагревали при 700°C в течение 15 часов, таким образом, заполняя внутреннее пространство трубки парами металлического Ca. В результате получали порошок C12A7:e-, имеющий концентрацию электронов проводимости 2×1021 см-3 (обозначаемый как C12A7e21).
Нанесение Ru на порошкообразный носитель
1 г порошка C12A7e21, полученного как описано выше, смешивали с Ru3(CO)12, растворенным в гексановом растворителе, и растворитель выпаривали досуха. В то же время количество Ru3(CO)12 в растворителе регулировали таким образом, что количество Ru, нанесенного на порошок C12A7e21, составляло 6% масс. относительно порошка C12A7e21. Полученный порошок нагревали при 100°C в течение 4 часов в вакууме, посредством чего удаляли остающийся компонент растворителя и формировали предшественник катализатора. Предшественник катализатора далее подвергали термообработке при 400°C в течение 3 часов в атмосфере газообразного водорода (26,7 кПа) для восстановления Ru3(CO)12. В результате получали нанесенный металлический катализатор, сделанный из порошка электрида (Ru/C12A7e21) с нанесенным металлическим Ru. Удельная поверхность по методу БЭТ полученного катализатора составляла примерно 3 м2г-1.
Реакция синтеза аммиака
Осуществляли взаимодействие газообразного азота (N2) и газообразного водорода (H2) и образования газообразного аммиака (NH3). Взаимодействие осуществляли путем помещения 0,3 г катализатора, полученного, как описано выше, в U-образную стеклянную трубку и присоединения U-образной стеклянной трубки к сделанной из стекла установке замкнутой циркуляции. Сделанная из стекла установка замкнутой циркуляции, к которой присоединяли U-образную стеклянную трубку, имела внутренний объем 200 мл. Перед началом взаимодействия выполняли предварительную обработку на поверхности Ru/C12A7e21 при 400°C в течение 3 часов, путем введения H2 при 26,7 кПа в установку замкнутой циркуляции. После этого взаимодействие проводили при 400°C с помощью введения N2 при 6,7 кПа и H2 при 20,0 кПа. Реакцию продолжали в течение 4 часов, 8 часов и 12 часов и измеряли выход NH3 в зависимости от времени. Количественное определение продукта выполняли газовой хроматографией. Измеренная скорость образования аммиака приведена в таблице 1.
Пример 2
Реакцию синтеза аммиака осуществляли в таких же условиях, как в примере 1, за исключением того, что использовали C12A7, имеющий стехиометрический состав и содержащий электроны проводимости в концентрации 1×1019 см-3 (т.e. C12A7e19). Измеренная скорость образования аммиака приведена в таблице 1.
Сравнительный пример 1
Реакцию синтеза аммиака осуществляли в таких же условиях, как в примере 1, за исключением того, что использовали C12A7 (нелегированный), имеющий стехиометрический состав, но не содержащий электронов проводимости, вместо электропроводящего соединения майенитового типа примера 1.
Сравнительный пример 2
Реакцию синтеза аммиака осуществляли в таких же условиях, как в примере 1, за исключением того, что использовали γ-Al2O3 (удельная поверхность по методу БЭТ 170 м2г-1), вместо электропроводящего соединения майенитового типа примера 1.
Сравнительный пример 3
Реакцию синтеза аммиака осуществляли в таких же условиях, как в примере 1, за исключением того, что использовали CaO (удельная поверхность по методу БЭТ 4 м2г-1), вместо электропроводящего соединения майенитового типа примера 1.
Сравнительный пример 4
Реакцию синтеза аммиака осуществляли в таких же условиях, как в примере 1, за исключением того, что использовали активированный уголь (удельная поверхность по методу БЭТ 800 м2г-1) вместо электропроводящего соединения майенитового типа примера 1. Измеренная скорость образования аммиака приведена в таблице 1.
(м2·г-1)
г-1·ч-1
м-2·ч-1
нелегированный
Как видно из перечисленных в таблице 1 скоростей образования аммиака, нанесенные Ru катализаторы на носителе, сделанном из, например, γ-Al2O3, CaO и активированного угля (AC) имеют почти сопоставимую производительность с Ru, нанесенным на C12A7 (нелегированный). С другой стороны, также видно, что каталитическая активность значительно увеличивается вместе с повышением содержания легированных электронов, и что C12A7e21 с нанесенным Ru демонстрирует производительность примерно в 10 раз выше, чем у существующих катализаторов. Такой высокий уровень производительности вполне вероятно объясняется тем фактом, что достаточная инжекция электронов в Ru металл, который тесно контактирует с поверхностью носителя электрида, происходит при диссоциации водорода и азота.
Пример 3
После осуществления реакции синтеза в течение десяти с лишним часов в таких же условиях, как в примере 1, реакционную систему перевели в состояние вакуума. Реакцию синтеза затем проводили снова при 400°C в течение десяти с лишним часов, вводя N2 при 6,7 кПа и H2 при 20,0 кПа в реакционную систему. Стабильность катализатора оценивали с помощью повторения указанных выше операций более трех раз. На фиг.1 представлены результаты повторения реакции синтеза при использовании в качестве катализатора Ru/C12A7e21. Кривые на фиг.1 представляют слева направо результаты первой, второй, третьей, четвертой и пятой реакций синтеза. Как видно из фиг.1, даже после пятикратного повторения реакции синтеза снижение каталитической активности совсем не проявляется, и все реакции синтеза прогрессируют под действием катализатора. Таким образом, доказано, что катализатор настоящего изобретения не ухудшается в ходе реакции синтеза и остается стабильным даже после длительного использования.
Пример 4
Нанесенный Ru катализатор создавали вместо способа нанесения Ru на порошкообразный носитель в примере 1 с помощью физического смешивания порошкообразного носителя и Ru3(CO)12, с использованием шаровой мельницы без применения растворителя и далее осуществляя термообработку смеси в вакууме при 450°C в течение 2 часов. При выполнении реакции синтеза аммиака таким же образом, как в примере 1, получали результат, аналогичный результату в примере 1.
Пример 5
Реакцию синтеза аммиака осуществляли в таких же условиях, как в примере 1, за исключением того, что использовали карбонил железа вместо Ru3(CO)12 в примере 1. Удельная поверхность по методу БЭТ катализатора, сделанного из Fe, нанесенного на порошок электрида, составляла примерно 3 м2г-1. Скорость образования аммиака составляла 38 мкмоль г-1ч-1 (13 мкмоль м-2ч-1). Таким образом, было подтверждено, что катализатор примера 5 может синтезировать аммиак при более низкой температуре и более низком давлении, чем известные катализаторы, использующие железо. При условиях реакции, аналогичных заданным в примере 5, аммиак не образуется с помощью известных катализаторов, изготовленных на основе оксида кальция, γ-оксида алюминия и углерода, каждый из которых содержит нанесенное Fe.
Пример 6
Нанесение Ru на порошкообразный носитель
1 г порошка C12A7e21 и 0,042 г Ru3(CO)12 помещали в стеклянную трубку, изготовленную из стекла «Пирекс» (Pyrex, зарегистрированная торговая марка), и стеклянную трубку герметизировали после вакуумирования. Смесь подвергали термообработке в соответствии со следующей программой, пока вакуумированную и гереметизированную трубку вращали в электрической печи.
[40°C, 20 мин разогрев → 40°C, 60 мин выдерживание → 70°C, 120 мин разогрев → 70°C, 60 мин выдерживание → 120°C, 120 мин разогрев → 120°C, 60 мин выдерживание → 250°C, 150 мин разогрев → 250°C, 120 мин выдерживание]
После этого вакуумированную и герметизированную стеклянную трубку разбивали, и электрид с нанесенным 2% масс. Ru (т.е. 2% масс. Ru/C12A7e21) получали путем нагревания до 300°C в течение 5 часов и последующей термообработки в течение 2 часов в атмосфере газообразного водорода (26,7 кПа).
Реакция синтеза аммиака
Осуществляли взаимодействие газообразного азота (N2) и газообразного водорода (H2) и образование газообразного аммиака (NH3). Взаимодействие осуществляли путем помещения 0,2 г катализатора, полученного, как описано выше, в трубку из кварцевого стекла, и присоединения трубки из кварцевого стекла к проточному реактору. Условия реакции были установлены таким образом, чтобы общая скорость газового потока составляла 60 мл/мин, т.е. N2:15 мл/мин и H2 45 мл/мин, давление было атмосферным, и температура реакции была 400°C. Газ, выходящий из реакционного сосуда в установке проточного типа, барботировали в 0,005M водном растворе серной кислоты, таким образом, вызывая растворение полученного аммиака в растворе. Образованные ионы аммония количественно измеряли методом ионной хроматографии. Полученные результаты реакции представлены в таблице 2.
Методика расчета TOF
Термин «частота оборотов (TOF)» подразумевает число, представляющее в каталитической реакции, сколько раз один активный центр способствовал реакции в среднем в единицу времени, и оно рассчитывается путем деления числа реагирующих молекул, образованных в единицу времени, на число каталитически активных центров. Поскольку в разработанной здесь каталитической реакции активный центр является Ru, TOF получают путем определения числа атомов Ru, подверженных на поверхности катализатора адсорбции CO, и деления числа молекул аммиака, образованных в единицу времени, на количество атомов Ru.
Пример 7
Нанесение Ru на порошкообразный носитель
Катализатор синтезировали в таких же условиях, как в примере 6, за исключением того, что использовали 0,0105 г Ru3(CO)12, и получали электрид с нанесенным 0,5% масс. Ru (т.е. 0,5% масс. Ru/C12A7e21).
Реакция синтеза аммиака
Реакцию синтеза аммиака осуществляли в таких же условиях, как в примере 6, за исключением того, что использовали 0,5% масс. Ru/C12A7e21. Полученные результаты реакции представлены в таблице 2.
Пример 8
Нанесение Ru на порошкообразный носитель
Катализатор синтезировали в таких же условиях, как в примере 6, за исключением того, что использовали 0,0021 г Ru3(CO)12, и получали электрид с нанесенным 0,1% масс. Ru (т.е. 0,1% масс. Ru/C12A7e21).
Реакция синтеза аммиака
Реакцию синтеза аммиака осуществляли в таких же условиях, как в примере 6, за исключением того, что использовали 0,1% масс. Ru/C12A7e21. Полученные результаты реакции представлены в таблице 2.
Сравнительный пример 5
Реакцию синтеза аммиака осуществляли в таких же условиях, как в примере 6, за исключением того, что использовали C12A7 (нелегированный), имеющий стехиометрический состав, но не содержащий электронов проводимости, вместо электропроводящего соединения майенитового типа примера 6.
Сравнительный пример 6
Реакцию синтеза аммиака осуществляли в таких же условиях, как в примерах 6-8, за исключением того, что использовали γ-Al2O3 (удельная поверхность по методу БЭТ 170 м2г-1) с нанесенным 6% масс. Ru, вместо электропроводящих соединений майенитового типа примеров 6-8.
Сравнительный пример 7
Реакцию синтеза аммиака осуществляли в таких же условиях, как в примерах 6-8, за исключением того, что использовали CaO (удельная поверхность по методу БЭТ 4 м2г-1) с нанесенным 2% масс. Ru, вместо электропроводящих соединений майенитового типа примеров 6-8.
Сравнительный пример 8
Реакцию синтеза аммиака осуществляли в таких же условиях, как в примерах 6-8, за исключением того, что использовали активированный уголь (удельная поверхность по методу БЭТ 310 м2г-1) с нанесенным 9,1% масс. Ru и Ba (Ba/Ru=6,2), вместо электропроводящих соединений майенитового типа примеров 6-8.
Сравнительный пример 9
Реакцию синтеза аммиака осуществляли в таких же условиях, как в примерах 6-8, за исключением того, что использовали MgO (удельная поверхность по методу БЭТ 12 м2г-1) с нанесенным 6% масс. Ru и Cs (Cs/Ru=1), вместо электропроводящих соединений майенитового типа примеров 6-8.
NH3
г-1·ч-1
активированный уголь
Как видно из скоростей образования аммиака, приведенных в таблице 2, каталитическая активность значительно повышается за счет модифицирования C12A7 (нелегированного) в электрид (C12A7e21). Кроме того, по сравнению с 9,1% масс. Ru-Ba/активированный уголь и 6% масс. Ru-Cs/MgO, которые указаны как имеющие самую высокую активность среди существующих катализаторов, видно, что активность электрида на единицу массы сопоставима по производительности с этими указанными выше катализаторами. Сравнивая активность на единицу площади поверхности, так как площадь поверхности электрида очень мала, т.е. 1 м2/г электрида проявляет в 10 раз более высокую производительность, чем существующие катализаторы. Кроме того, сравнивая производительности (TOF) на активный центр Ru, очевидно, что производительность электрида гораздо выше, чем у других катализаторов. Такой высокий уровень производительности вполне вероятно объясняется тем фактом, что при диссоциации водорода и азота происходит достаточная инжекция электронов в металл Ru, который тесно контактирует с поверхностью носителя электрида.
Пример 9
Реакция синтеза аммиака
Осуществляли взаимодействие газообразного азота (N2) и газообразного водорода (H2) и образование газообразного аммиака (NH3). Взаимодействие осуществляли путем помещения 0,2 г катализатора (0,5% масс. Ru/C12A7e21), синтезированного в примере 7, в реакционную трубку, изготовленную из нержавеющей стали, и присоединения реакционной трубки к проточному реактору. Условия реакции устанавливали таким образом, чтобы общая скорость газового потока составляла 60 мл/мин, т.е. N2:15 мл/мин и H2:45 мл/мин, давление было от 0,1 до 1,0 МПа, и температура реакции была 400°C. Газ, выходящий из реакционного сосуда в установке проточного типа, барботировали в 0,005M водном растворе серной кислоты, таким образом, вызывая растворение образовавшегося аммиака в растворе. Образованные ионы аммония количественно измеряли методом ионной хроматографии. Полученные результаты реакции представлены в таблице 3.
В таблице 3 представлена каталитическая активность электрида с нанесенным Ru при изменении давления реакционного газа от 0,1 МПа до 1,0 МПа. Каталитическая активность возрастает с повышением давления, но она убывает, когда давление повышается до 0,7 МПа или 1 МПа. Такой результат вполне вероятно объясняется влиянием водородного отравления на активные центры Ru. Ожидается дальнейшее повышение каталитической активности за счет изменения парциального давления N2.
(мкмоль г-1 ч-1)
Пример 10
Нанесение Fe на порошкообразный носитель
1 г порошка C12A7e21 и 0,063 г Fe(acac)3 помещали в стеклянную трубку, изготовленную из стекла «Пирекс» (Pyrex, зарегистрированная торговая марка), и стеклянную трубку герметизировали после вакуумирования. Смесь подвергали термообработке в соответствии со следующей программой, пока вакуумированую и гереметизированную трубку вращали в электрической печи.
[100°C, 120 мин разогрев → 100°C, 60 мин выдерживание → 200°C, 120 мин разогрев → 200°C, 60 мин выдерживание → 350°C, 150 мин разогрев → 300°C, 120 мин выдерживание]
После этого вакуумированную и герметизированную стеклянную трубку разбивали, и электрид с нанесенным 1% масс. Fe (т.е. 1% масс. Fe/C12A7e21) получали путем нагревания до 450°C в течение 5 часов и последующей термообработки в течение 2 часов, в то время как продолжали вакуумирование.
Реакция синтеза аммиака
Реакцию синтеза аммиака осуществляли в таких же условиях, как в примере 6, за исключением того, что использовали 0,1% масс. Fe/C12A7e21. Измеренная скорость образования аммиака приведена в таблице 4.
Пример 11
Нанесение Co на порошкообразный носитель
1 г порошка C12A7e21 и 0,029 г Co2(CO)8 помещали в стеклянную трубку, изготовленную из стекла «Пирекс» (Pyrex, зарегистрированная торговая марка), и стеклянную трубку герметизировали после вакуумирования. Смесь подвергали термообработке в соответствии со следующей программой, пока вакуумированую и гереметизированную трубку вращали в электрической печи.
[100°C, 120 мин разогрев → 100°C, 60 мин выдерживание → 200°C, 120 мин разогрев → 200°C, 60 мин выдерживание → 350°C, 150 мин разогрев → 300°C, 120 мин выдерживание]
После этого вакуумированную и герметизированную стеклянную трубку разбивали, и электрид с нанесенным 1% масс. Co (т.е. 1% масс. Co/C12A7e21) получали путем нагревания до 450°C в течение 5 часов и последующей термообработки в течение 2 часов, в то время как продолжали вакуумирование.
Реакция синтеза аммиака
Реакцию синтеза аммиака осуществляли в таких же условиях, как в примере 6, за исключением того, что использовали 1% масс. Co/C12A7e21. Измеренная скорость образования аммиака приведена в таблице 4.
Сравнительный пример 10
Реакцию синтеза аммиака осуществляли, синтезируя нанесенный Fe катализатор в таких же условиях, как в примере 10, за исключением того, что использовали C12A7 (нелегированный), имеющий стехиометрический состав, но не содержащий электронов проводимости, вместо электропроводящего соединения майенитового типа примера 10.
Сравнительный пример 11
Реакцию синтеза аммиака осуществляли, синтезируя нанесенный Co катализатор в таких же условиях, как в примере 11, за исключением того, что использовали C12A7 (нелегированный), имеющий стехиометрический состав, но не содержащий электронов проводимости, вместо электропроводящего соединения майенитового типа примера 11.
В таблице 4 приведены соответствующие значения каталитической активности электридов с нанесенными Fe и Co в качестве металлов, в отличие от Ru. Как видно из таблицы 4, катализаторы, полученные путем нанесения Fe и Co на C12A7e21, легированный электронами, проявляют каталитическую активность в 10 или более раз высокую, чем у катализаторов, полученных путем нанесения Fe и Co на C12A7 (нелегированный), без легирования электронами. Тем самым, это подтверждает, что инжекция электронов в Fe и Co из электридов также является эффективной.
(м2·г-1)
г-1·ч-1
Промышленная применимость
В то время как высокое давление, примерно 20 МПа или выше, необходимо в способе синтеза (процесс Габера-Боша), который очень часто используется в производстве аммиака в настоящее время, и который использует дважды промотированный железный катализатор, преимущественно состоящий из Fe3O4 и нескольких массовых процентов Al2O3 и K2O, в способе настоящего изобретения реакция синтеза может проводиться при сравнительно низком давлении, не требуя высокого давления. Таким образом, можно утверждать, что способ настоящего изобретения является предпочтительным с точки зрения упрощения технологии производства и экономии энергопотребления. Кроме того, в способе настоящего изобретения можно производить аммиак по более низкой цене и с гораздо большей эффективностью, чем в способах с использованием известных Ru-катализаторов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПОРОШКА ПРОВОДЯЩЕГО СОЕДИНЕНИЯ ТИПА МАЙЕНИТА | 2013 |
|
RU2647290C2 |
| ФОРМОВАННОЕ СПЕЧЕННОЕ ТЕЛО И СПОСОБ ИЗГОТОВЛЕНИЯ ФОРМОВАННОГО СПЕЧЕННОГО ТЕЛА | 2020 |
|
RU2823618C2 |
| КАТАЛИЗАТОР СИНТЕЗА АММИАКА, СПОСОБ ПОЛУЧЕНИЯ КАТАЛИЗАТОРА И СПОСОБ СИНТЕЗА АММИАКА | 1998 |
|
RU2130337C1 |
| Катализатор для синтеза аммиака | 1977 |
|
SU904505A3 |
| КАТАЛИЗАТОР СИНТЕЗА АММИАКА И СПОСОБ ЕГО РЕГЕНЕРАЦИИ | 2001 |
|
RU2267353C2 |
| Способ приготовления катализатора для синтеза аммиака | 1990 |
|
SU1747147A1 |
| СТРУКТУРИРОВАННЫЙ КАТАЛИЗАТОР И ПРОЦЕСС ТРАНСФОРМАЦИИ БИОТОПЛИВ В СИНТЕЗ-ГАЗ | 2013 |
|
RU2541316C1 |
| КАТАЛИЗАТОР, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ ВОДОРОДА ИЗ АММИАКА | 2022 |
|
RU2787379C1 |
| КАТАЛИЗАТОР И СПОСОБ ПОЛУЧЕНИЯ АММИАКА | 2000 |
|
RU2271249C2 |
| СПОСОБ УДАЛЕНИЯ ЦИАНИСТОГО ВОДОРОДА И АММИАКА ИЗ СИНТЕЗ-ГАЗА | 2008 |
|
RU2475446C2 |
Изобретение относится к катализатору синтеза аммиака. Данный катализатор представляет собой нанесенный металлический катализатор, который нанесен на соединение майенитового типа, содержащее электроны проводимости в концентрации 1015 см-3 или более и служащее носителем для катализатора синтеза аммиака. Изобретение также относится к способу получения такого катализатора и способу синтеза аммиака с его использованием. Предлагаемый катализатор позволяет синтезировать аммиак с высокой эффективностью в мягких условиях. 3 н. и 4 з.п. ф-лы, 1 ил., 4 табл., 11 пр.
1. Катализатор синтеза аммиака, включающий нанесенный металлический катализатор, который нанесен на соединение майенитового типа, содержащее электроны проводимости в концентрации 1015 см-3 или более и служащее носителем для катализатора синтеза аммиака.
2. Катализатор пo п.1, в котором соединение майенитового типа является 12CaO·7Al2O3.
3. Катализатор пo п.1, в котором металл металлического катализатора является по меньшей мере металлом, выбранным из элементов металлов, принадлежащих к группам 6, 7, 8 и 9.
4. Катализатор пo п.1, в котором соединение майенитового типа принимает одну из форм порошка, пористого материала, спеченного изделия, тонкой пленки или монокристалла.
5. Способ получения катализатора по любому из пп.1-4, включающий стадию нанесения металлического катализатора на порошок соединения майенитового типа, содержащего электроны проводимости в концентрации 1015 см-3 или более, с помощью одного из способов: пропитки, физического смешивания, термического разложения, жидкофазного процесса и осаждения из пара.
6. Способ получения катализатора, в котором способ пропитки по п.5 включает стадии диспергирования порошка соединения майенитового типа, содержащего электроны проводимости в концентрации 1015 см-3 или более, в растворе растворителя соединения переходного металла, испарения растворителя из раствора растворителя и образования предшественника катализатора, полученного из высушенного соединения переходного металла, и нагревания соединения переходного металла в восстановительной атмосфере, и образования металлического катализатора путем восстановления соединения переходного металла.
7. Способ синтеза аммиака при использовании катализатора по любому из пп.1-4, включающий стадию взаимодействия азота и водорода в качестве исходных материалов на катализаторе в реакционной установке в условиях температуры реакции от 100°C до 600°C и давления реакции от 10 кПа до 30 МПа.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Катализатор для синтеза аммиака | 1977 |
|
SU598632A1 |
Авторы
Даты
2015-05-20—Публикация
2011-12-06—Подача