Изобретение относится к медицине, а именно к микробиологии и биотехнологии.
Известно, что качественные и количественные изменения микрофлоры сопутствуют многим патологическим состояниям [1]. Это обусловливает не только необходимость лечения основного заболевания, но и требует коррекции микробиоценозов. Одним из подходов при коррекции микрофлоры является заместительная терапия пробиотическими штаммами [1, 2]. Однако создание временного микробиоценоза с помощью экзогенных культур не всегда приносит ожидаемые результаты. В большинстве случаев пробиотические микроорганизмы гибнут, преодолевая естественные барьеры ЖКТ, и до толстой кишки доходит лишь десятитысячная доля от их исходной численности [3]. Остаточные количества пробиотических микроорганизмов, которые достигают толстой кишки в жизнеспособном состоянии, являются чужеродными для естественной микрофлоры, не приживаются в биопленке кишечника и отторгаются [3]. Причинами низкой эффективности терапии пробиотиками является бионесовместимость по типу «хозяин против пробиотика», т.е. видовая индивидуальная специфичность микрофлоры пациента [4]. Поэтому приоритетными в нормализации микробного статуса являются подходы, связанные со стимуляцией собственной микрофлоры, т.е. использование бифидогенных факторов [3, 5]. По определению [1] бифидогенные факторы - это стимуляторы роста и развития бифидобактерий.
Термин «бифидогенные факторы» означает - стимулятор роста и развития бифидобактерий.
Известно средство для лечения дисбактериоза (патент №2123345, заявка №97112482, класс МПК А61К 35/74, А61К 38/43, опубликованный 20.12.1998) [6]. Сущность изобретения заключается в создании средства, включающего лиофилизированную смесь биомассы бифидобактерий, лизоцим и нуклеинат натрия при следующем соотношении компонентов на одну дозу: биомасса бифидобактерий 105-108 КОЕ, лизоцим 5-20 мг, нуклеинат натрия 50-250 мг. Известно, что используемый нуклеинат натрия представляет собой натриевую соль низкомолекулярной дрожжевой РНК [6]. Указанный фактор вызывает существенные изменения в микробных популяциях, обусловленные неспецифической стимуляцией роста представителей кишечного микробиоценоза [6]. Таким образом, основным недостатком нуклеината натрия является отсутствие у него селективности действия по отношению к бифидобактериям. Кроме того, технология получения РНК из дрожжевых клеток должна обеспечивать очистку целевого продукта от белковых компонентов, которые, в свою очередь, могут быть причиной аллергических реакций [2].
Известен способ получения плазмидной ДНК из микробной биомассы (патент №1124033, заявка №3555304, класс МПК C12N 15/00, С07Н 21/04, опубликованный 15.11.1984) [7]. Способ включает в себя лизис бактериальных клеток с использованием щелочного раствора додецилсульфата натрия. Использование щелочного раствора может негативно сказываться на нативных свойствах целевого компонента, а применение додецилсульфата натрия в некоторых случаях может потребовать дополнительной стадии очистки.
Техническим результатом предлагаемого изобретения является получение высокочистого образца ДНК и использование его для ускорения роста бифидобактерий.
Предлагается способ получения бифидогенного фактора, предусматривающий выделение дезоксирибонуклеиновой кислоты из биомассы бифидобактерий путем троекратной обработки ультразвуком при частоте 40 кГц в течение 30 минут с последующим после каждой обработки отделением супернатантов центрифугированием при 5000 об/мин и хроматографированием объединенных супернатантов на сефарозе (Sepharose) CL-4B.
Способ осуществляется следующим образом. Вначале у пациента определяют качественный и количественный состав микрофлоры кишечника стандартным бактериологическим методом. При микроэкологических нарушениях, сопровождающихся низким количественным уровнем бифидобактерий, проводят накопление чистой культуры и определение ее видовой принадлежности. Решение задачи достигается путем выделения ДНК - бифидогенного фактора из пробиотического штамма с видовой принадлежностью, соответствующей по видовой принадлежности штамму пациента, который требует стимуляции. Для этого выращивают культуру пробиотического штамма выбранного вида бифидобактерий на жидкой Бифидум-среде (г. Оболенск). Культивирование проводят при 37°С в течение 48 ч, что позволяет получить биомассу с содержанием бифидобактерий около 108 КОЕ/мл. Затем биомассу переносят в стерильные центрифужные пробирки и трижды отмывают фосфатным буферным раствором (140 мМ натрия хлорида; 3 мМ калия хлорида; 8 мМ натрия гидрофосфата; 2 мМ натрия дигидрофосфата рН=7,2) от питательной среды.
На каждом этапе осуществляют центрифугирование при 3-4 тыс.об/мин. Ресуспендируют клеточную массу в буферной системе из расчета 2 мл на 1 г клеточной массы. Взвесь в буферном растворе подвергают ультразвуковой обработке при частоте 40 кГц в течение 30 мин. После этого производят центрифугирование при 5 тыс. об/мин. Процедуру УЗ обработки клеточной массы повторяют трижды.
Объединенные супернатанты подвергают хроматографической очистке с использованием Сефарозы CL-4В. Элюцию осуществляют 0,9% раствором натрия хлорида, выделяя фракцию дезоксирибонуклеиновой кислоты. Как показали экспериментальные данные выделенная дезоксирибонуклеиновая кислота является бифидогенным фактором.
Заявляемый способ подразумевает использование пробиотических штаммов бифидобактерий, зарегистрированных в Российской Федерации для производства пробиотиков и продуктов функционального питания [8]. При микроэкологических нарушениях, сопровождающихся низким количественным уровнем Bifidobacterium bifidum, производят стимуляцию размножения бифидофлоры бифидогенным фактором - ДНК, выделенной из пробиотического штамма, например Bifidobacterium bifidum 791.
При микроэкологических нарушениях, сопровождающихся низким количественным уровнем Bifidobacterium infantis, производят стимуляцию размножения бифидофлоры бифидогенным фактором - ДНК, выделенной из пробиотического штамма, например Bifidobacterium infantis 73-15.
Пример 1. У пациента С. изучали состояние кишечного микробиоценоза. Было установлено снижение количественного уровня бифидобактерий до 108 КОЕ/г. Идентификацию бифидобактерий, выделенных от пациента, проводили по морфологическим, тинкториальным, культуральным и биохимическим свойствам. Последние изучали с помощью коммерческой тест-системы ANAERO-TEST 23 (Lachema, Чехия). Для создания анаэробных условий применяли анаэростаты (BBL, США) и газогенерирующие пакеты (НПО «Новое дело», Санкт-Петербург). В результате был идентифицирован вид Bifidobacterium bifidum. Из совокупности зарегистрированных на территории РФ пробиотических штаммов бифидобактерий для получения бифидогенного фактора был использован, например, штамм Bifidobacterium bifidum 791, депонированный в Государственной коллекции микроорганизмов - представителей нормальной микрофлоры человека ФГУН МНИИЭМ им. Г.Н. Габричевского. Как пример результат приводится в описании более подробно. Для накопления и выделения ДНК предварительно готовили жидкую Бифидум-среду (г. Оболенск), в которую затем помещали 1 колонию В. bifidum 791. Культивирование проводили при 37°С в течение 48 ч. Для определения количественного содержания бактерий в 1 мл среды проводили титрование в стерильном физиологическом растворе от 10-1 до 10-9 КОЕ/мл с последующим высевом по 0,1 мл на плотную Бифидум-среду (г. Оболенск) и культивированием в анаэробных условиях. Количественные посевы показали, что содержание бифидобактерий в среде накопления составило около 108 КОЕ/мл. Затем биомассу переносили в стерильные центрифужные пробирки и трижды отмывали фосфатным буферным раствором (140 мМ натрия хлорида; 3 мМ калия хлорида; 8 мМ натрия гидрофосфата; 2 мМ натрия дигидрофосфата рН=7,2) от питательной среды. На каждом этапе центрифугирование проводили при 3-4 тыс. об/мин. Клеточную массу ресуспендировали в буферной системе из расчета 2 мл на 1 г клеточной массы. Взвесь в буферном растворе трижды подвергали ультразвуковой обработке при частоте 40 кГц в течение 30 мин. После каждого УЗ воздействия производили центрифугирование при 5 тыс. об/мин. Супернатанты подвергали хроматографической очистке с использованием Сефарозы CL-4В. Элюцию осуществляли 0,9% раствором натрия хлорида, выделяя фракцию дезоксирибонуклеиновых кислот.
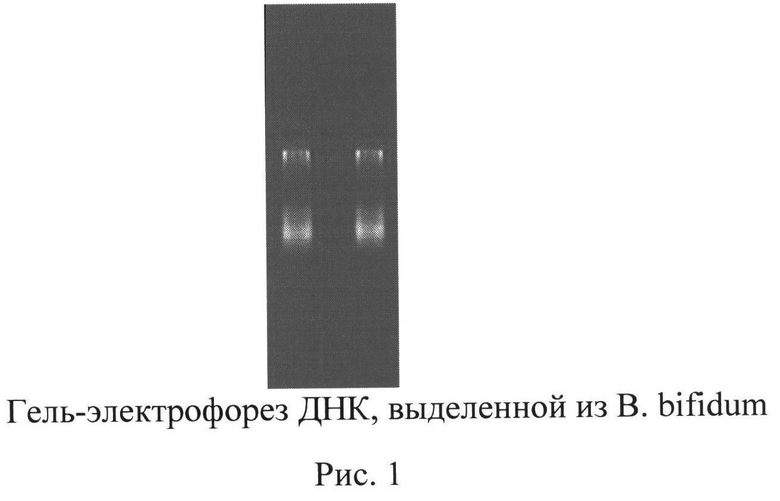
Для установления наличия ДНК проводили электрофорез аликвоты образца объемом 10 мкл в 3% агарозном геле с добавлением бромистого этидия в качестве красителя. Процесс осуществляли в течение 15 мин при напряжении электрического поля 200 В. Полученная электрофореграмма образца ДНК приведена на рис. 1.
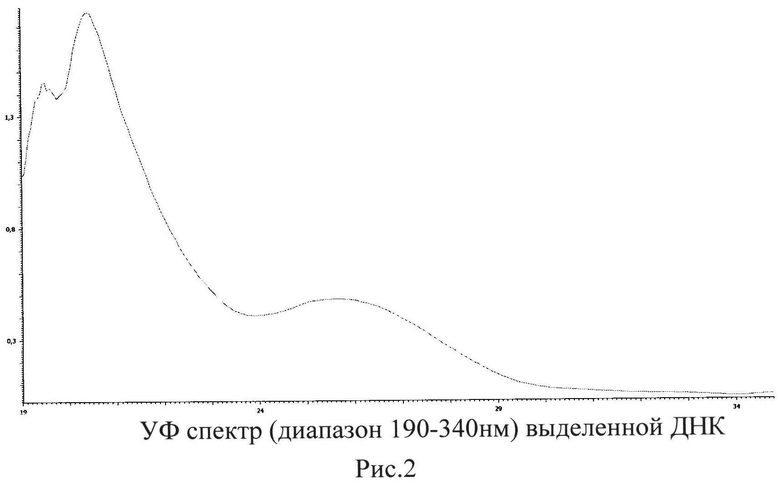
Выделенную ДНК анализировали спектрофотометрически с применением спектрофотометра СФ-2000 в кварцевой кювете (1×1 см). Полученный УФ спектр приведен на рис. 2. Чистоту ДНК, ее концентрацию определяли по методикам, рекомендованным в [9]. Спектрофотометрическая характеристика чистоты выделенной ДНК составила 1,88, что соответствует данным [9], как ДНК высокой степени очистки. Полученная концентрация двухцепочечной ДНК составила 70,75 мкг/мл.
Стимулирующее влияние выделенной ДНК на бифидофлору пациента С. устанавливали in vitro. Предварительно выращивали В. bifidum, выделенную от пациента, на плотной Бифидум-среде (г. Оболенск) в анаэробных условиях. Брали 4 стерильные пробирки. Разливали: в пробирку №1 - 9,5 мл жидкой Бифидум-среды и 0,5 мл раствора ДНК, в пробирку №2 - 8 мл среды и 2 мл раствора ДНК, в пробирку №3 - 7 мл среды и 3 мл раствора ДНК. Пробирка №4 была контрольной, в нее помещали 10 мл жидкой Бифидум-среды без раствора ДНК. В каждую пробирку вносили по 1 колонии В. bifidum и инкубировали 24 часа при 37°С. Далее проводили титрование содержимого пробирок от 10-1 до 10-9 КОЕ/г с последующим высевом на плотную Бифидум-среду. Чашки инкубировали 48 ч при 37°С в анаэробных условиях, после этого подсчитывали число выросших колоний из наибольших разведений. Результат выражали в КОЕ/мл. Опыт был проведен в двух повторностях, данные представлены в таблице 1.

Исследования показали, что объем раствора ДНК 0,5 мл не влиял на размножение бифидофлоры, так как их количественный уровень не отличался от контроля (без добавления ДНК). Раствор ДНК в объеме 2 и 3 мл стимулировал В. bifidum, так как количественный уровень был в 10 раз выше, чем в контроле.
Пример 2. У пациента А. было установлено снижение количественного уровня бифидобактерий до 107 КОЕ/г. По совокупности морфологических, тинкториальных, культуральных и биохимических свойств был идентифицирован вид Bifidobacterium infantis. Из совокупности зарегистрированных на территории РФ пробиотических штаммов бифидобактерий для получения бифидогенного фактора был использован штамм Bifidobacterium infantis 73-15. Выделение ДНК и изучение ее стимулирующего влияния проводили согласно условиям, описанным в примере 1. Результаты представлены в табл. 2.

Используемая литература
1. Шендеров Б.А. Медицинская микробная экология и функциональное питание. Т. 3. Пробиотики и функциональное питание [текст] / Б.А. Шендеров - М.: Грантъ, 2001. - 288 с.
2. Доронин А.Ф. Функциональное питание [текст] / А.Ф. Доронин, Б.А. Шендеров - М.: Грантъ, 2002. - 296 с.
3. Чичерин И.Ю. Кишечная микрофлора: взгляд изнутри [текст]: инновационный сборник научных статей. Выпуск 2 / И.Ю. Чичерин, И.П. Погорельский, И.В. Дармов. - 2013. - 148 с.
4. Глушанова Н.А. Взаимоотношения пробиотических и индигенных лактобацилл хозяина в условиях совместного культивирования in vitro [текст] / Н.А. Глушанова, Б.А. Шендеров // Журн. микробиол. - 2005. - №2. - С. 56-61.
5. Шендеров Б.А. Роль питания и кишечной микрофлоры в программировании и реализации эпигенома здоровых и больных людей [текст] / Б.А. Шендеров // Вестник восстановительной медицины. - 2013. - №1. (спец выпуск). - С. 102-107.
6. Средство для лечения дисбактериоза: пат. №2123345 Рос. Федерация: / Э.Г. Щербакова, Н.Н. Липатов, В.М. Земсков и др.; опуб. 20.12.1998.
7. Способ получения плазмидной ДНК А.С. №1124033 / A.M. Зилбере, А.Б. Шафранский, Я.Я. Хартмане и др.; опуб. 15.11.1984.
8. Мазанкова Л.Н. Пробиотики: характеристика препаратов и выбор в педиатрической практике [текст] / Л.Н. Мазанкова, Е.А. Лыкова // Детские инфекции. - 2004. - №1. - С. 18-23.
9. Брюханов А.Л. Молекулярная микробиология [текст]: учебник для вузов. / А.Л. Брюханов, К.В. Рыбак, А.И. Нетрусов - М.: Издательство.
Изобретение относится к биотехнологии. Способ получения бифидогенного фактора предусматривает выделение дезоксирибонуклеиновой кислоты из биомассы бифидобактерий путем троекратной обработки ультразвуком при частоте 40 кГц в течение 30 мин с последующей хроматографией объединенных супернатантов на сефарозе Sepharose CL-4В. Способ обеспечивает получение высокочистого образца ДНК из биомассы бифидобактерий. Спектрофотометрическая характеристика чистоты выделенной ДНК составляет 1,88. 2 ил., 2 табл., 2 пр.
Способ получения бифидогенного фактора, предусматривающий выделение дезоксирибонуклеиновой кислоты из биомассы бифидобактерий путем троекратной обработки ультразвуком при частоте 40 кГц в течение 30 мин с последующим после каждой обработки отделением супернатанта центрифугированием при 5000 об/мин и хроматографированием объединенных супернатантов на сефарозе Sepharose CL-4B.
| Способ получения плазмидной ДНК | 1983 |
|
SU1124033A1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ДИСБАКТЕРИОЗА | 1997 |
|
RU2123345C1 |
| УСТРОЙСТВО ДЛЯ МЕХАНИЧЕСКОГО ПОПЕРЕЧНОГО РАЗРЕЗАНИЯ ОТФОРМОВАННОЙ МАШИНОЙ ТОРФОМАССЫ | 1929 |
|
SU16185A1 |
| HIRAMATSU Y | |||
| ET AL | |||
| Bifidobacterium components have immunomodulatory characteristics dependent on the method of preparation // Cytotechnology, 2007, 55:79-87 | |||
Авторы
Даты
2015-06-20—Публикация
2013-05-20—Подача