Перекрестная ссылка на родственные заявки
По данной заявке испрашивается приоритет на основании предварительной заявки США №60/914965, поданной 30 апреля 2007 г., которая включена в данное описание посредством ссылки во всей полноте.
Область техники, к которой относится изобретение
Настоящее изобретение относится к применению ингибиторных белковых гидролизатов для стабилизации содержащих металлопротеазу детергентных составов в условиях хранения.
Предшествующий уровень техники
Ферменты являются ключевыми активными ингредиентами многих детергентных составов. Вследствие каталитической активности ферменты способны разрушать пятна с высокой эффективностью. Однако поскольку ферменты представляют собой биологические продукты, они входят в число наиболее дорогих ингредиентов. Следовательно, поддержание высокой ферментативной активности на протяжении срока службы детергентного состава является критическим условием для успешного применения продуктов, полученных на основе таких детергентных составов.
Ферменты, используемые в таких составах, включают протеазы, липазы, амилазы, целлюлазы, маннозидазы, а также другие ферменты или их смеси.
Хорошо известны проблемы, связанные с поддержанием стабильности фермента при хранении (т.е. до использования) в жидком виде. Как правило, применение протеаз создает большие проблемы со стабильностью, поскольку их каталитическая активность направлена на разрушение других белков в составе, а также самих протеаз в результате автолиза (т.е. саморазрушения). Однако вследствие относительной простоты, с которой можно стабилизировать серинпротеазы (например, субтилизин), а также разработки рекомбинантных мутантов, обладающих повышенной стабильностью, этот класс протеаз широко используют в детергентных составах. Фактически субтилизины относятся к наиболее коммерчески важным протеазным ферментам вследствие их использования в детергентах.
Металлопротеазы, напротив, редко используются или совсем не используются в промышленных продуктах, таких как детергентные составы. Металлопротеазы представляют собой более сложные белковые системы, для стабильности и функционирования которых абсолютно необходимы кальций и ионы металлов, соответственно. Детергентные составы и другие чистящие композиции обычно содержат сложную комбинацию активных ингредиентов, которая сильно осложняет поддержание стабильности и активности металлопротеазы. В частности, детергентные составы зачастую содержат соединения, образующие хелатные комплексы с кальцием и/или необходимыми ионами металлов, что приводит к уменьшению потерь стабильности или каталитической активности.
В патентной заявке США №11/581102, поданной 12 октября 2006 г. (которая включена в данное описание посредством ссылки), раскрыты нейтральные металлопротеазы, которые позволяют преодолеть трудности, связанные с использованием металлопротеаз в детергентных составах. В частности, обнаружено, что нейтральные металлопротеазы из Bacillus sp. NprE и PMN устойчивы к условиям детергентных составов и являются стабильными в течение примерно 4 недель при концентрации ионов цинка ниже 15 мМ. Кроме того, указанные нейтральные металлопротеазы обладают хорошими очищающими свойствами даже при низких температурах. В частности, показано, что рекомбинантная нейтральная металлопротеаза из Bacillus amyloliquefaciens, NprE, обладает лучшими чистящими характеристиками применительно к Equest Grass (Warwick), чем другие детергентные составы. Таким образом, нейтральные металлопротеазы при достаточной стабилизации можно использовать для создания усовершенствованных, коммерчески рентабельных промышленных детергентов.
Применение нейтральных металлопротеаз все еще связано с характерной для протеаз проблемой, заключающейся в автолитической деградации, которая приводит к быстрому уменьшению их активности и, следовательно, стабильности детергентных составов при хранении. Относительно высокая стоимость металлопротеаз (или любого фермента) требует перед применением минимизировать потери активности, чтобы сделать их коммерчески рентабельными в качестве ингредиентов детергента. Безусловно, никакие композиции и/или способы, используемые для минимизации автолитической деградации металлопротеаз, не должны слишком сильно увеличивать стоимость, которая может повыситься в результате ингибирования желаемой ферментативной активности (например, обеспечивающей деградацию белковых компонентов пятен и др.) при применении. Следовательно, нужно достичь тонкого баланса с тем, чтобы минимизировать автолитическую активность при хранении детергента без уменьшения желаемой активности при применении. Таким образом, остается потребность в способах, соединениях, составах и композициях, предотвращающих деградацию металлопротеаз, в частности, входящих в состав детергентных составов и других очищающих композиций.
Сущность изобретения
Настоящее изобретение относится к композициям и детергентным составам, которые содержат фермент металлопротеазу и ингибитор металлопротеазы и, как следствие, обладают повышенной стабильностью против деградации. Данное изобретение также относится к способам получения таких стабилизированных ингибитором композиций и детергентных составов, содержащих металлопротеазу.
Все раскрытые в данном описании композиции и детергентные составы содержат металлопротеазу и обладают повышенной стабильностью вследствие включения в их состав ингибитора металлопротеазы, который связывается с ферментом и предотвращает автолитическую деградацию фермента. Важно, что указанные стабилизированные ингибитором композиции и детергентные составы получают таким образом, что при хранении ингибитор связывается с металлопротеазой и эффективно уменьшает ее деградацию, но после разбавления композиции или детергента при его применении, ингибитор отделяется, высвобождая активный фермент. Настоящее изобретение раскрывает белковые гидролизаты в качестве особенно эффективных ингибиторов металлопротеазы для стабилизации ее против деградации. В особенно предпочтительном варианте осуществления ингибиторный белковый гидролизат получают путем расщепления (гидролиза) белкового субстрата непосредственно самим ферментом металлопротеазы. Полученный продукт гидролиза может быть выделен и является особенно эффективным конкурентным ингибитором металлопротеазы, под действием которой он образуется.
В одном из предпочтительных вариантов осуществления изобретение относится к детергентным составам (а также способам их получения), где ингибиторы металлопротеазы представляют собой белковые гидролизаты. Белковые гидролизаты по настоящему изобретению состоят из пептидных фрагментов, образующихся в результате гидролиза (или ферментативного, или неферментативного) ряда белков (например, казеина). Белковые гидролизаты, используемые в настоящем изобретении в качестве ингибиторов, включают, но без ограничения: гидролизат пшеничной клейковины (например, HyPep 4601™), кислый гидролизат соевого белка (например, Amisoy), кислый гидролизат казеина коровьего молока (например, Amicase) и ферментативный гидролизат растительного белка (например, протеозопептон). Кроме того, данное изобретение описывает применение ингибиторного белкового гидролизата, полученного путем гидролиза/гидролитического расщепления под действием одного или нескольких металлопротеазных ферментов, например, представляющего интерес фермента металлопротеазы.
В ряде предпочтительных вариантов осуществления изобретение относится к жидким детергентным составам, содержащим нейтральные металлопротеазы, выделенные из Bacillus sp, и в частности, рекомбинантную нейтральную металлопротеазу из Bacillus amyloliquifaciens, NprE.
В одном варианте осуществления изобретение относится к жидкому детергентному составу, который содержит: (a) от примерно 1% до примерно 75% по массе поверхностно-активного вещества; (b) от примерно 10% до примерно 95% по массе воды; (c) от примерно 0,01% до примерно 5% по массе нейтральной металлопротеазы; и (d) количество ингибитора нейтральной металлопротеазы, такое, что ингибитор связывается с по меньшей мере 90% молекул нейтральной металлопротеазы, а именно, связывается с активным центром или с участком, отличным от активного центра, и предотвращает или ингибирует каталитическое взаимодействие субстрата с активным центром перед применением, и где соответствующее разбавление детергентного состава приводит к диссоциации ингибитора с по меньшей мере примерно 25% связанных молекул нейтральной металлопротеазы. Как правило, соответствующее разбавление происходит, когда жидкий детергентный состав добавляют к большому объему промывочной воды, что приводит к разбавлению детергентного состава в 200, 400, 500, 600 или даже 1000 раз.
В одном варианте осуществления данного состава при разбавлении указанного детергента высвобождается более или равное 45%, 65%, 75%, 85% или даже 95% связанного с ингибитором фермента нейтральной металлопротеазы в виде формы, не содержащей ингибитора. В одном варианте осуществления ингибитор, выбранный для состава, конкурентно ингибирует нейтральную металлопротеазу с кажущейся Ki от примерно 5 мМ до примерно 15 мМ в интервале pH от примерно 6,5 до примерно 11, предпочтительно, от примерно 7,5 до примерно 9,5. В предпочтительном варианте осуществления детергентная композиция содержит ингибиторный белковый гидролизат, имеющий кажущуюся Ki ~10 мМ при pH примерно 8,0.
Хотя абсолютное количество ингибитора, используемое в составе, может варьировать в зависимости от аффинности связывания, концентрации фермента и других факторов, как правило, оно составляет от примерно 0,1% до примерно 15%, от примерно 0,05% до примерно 5%, от примерно 0,1% до примерно 2,5% от массы жидкого детергентного состава перед соответствующим разбавлением.
В одном варианте осуществления жидкий детергентный состав дополнительно стабилизируют с помощью других присутствующих ингредиентов, включающих полипропиленгликоль и/или ионы кальция (например, CaCl2). В некоторых вариантах осуществления состав представляет собой детергент HDL, полученный согласно характерному составу HDL, выбранному из группы, состоящей из: DW-AA, DW-AF, DW- AK, DW-CR, DW-CS и DW-CT. В некоторых вариантах осуществления жидкий детергентный состав не содержит бор.
В другом варианте осуществления настоящее изобретение относится к стабилизированной ингибитором композиции нейтральной металлопротеазы, содержащей: (a) от примерно 0,001% до примерно 10% по массе нейтральной металлопротеазы; и (b) конкурентный ингибитор, где конкурентный ингибитор связан с по меньшей мере примерно 90% молекул указанной нейтральной металлопротеазы. В предпочтительном варианте осуществления конкурентный ингибитор представляет собой белковый гидролизат. В другом предпочтительном варианте осуществления нейтральная металлопротеаза получена из Bacillus sp., в частности, она представляет собой NprE из B. amyloliquifaciens. Такая стабилизированная ингибитором композиция может находиться в жидкой или сухой (например, гранулированной) форме. В одном варианте осуществления композицию используют в качестве ингредиента-предшественника при получении описанных выше детергентных составов по настоящему изобретению. В другом варианте осуществления стабилизированная ингибитором композиция металлопротеазы находится в виде инкапсулированной частицы.
Таким образом, в другом варианте осуществления стабилизированную ингибитором композицию металлопротеазы используют для получения детергентного состава путем объединения композиции с: (a) водой; (b) детергентным поверхностно-активным веществом, составляющим от примерно 0,1% до примерно 75% по массе; (c) пропиленгликолем, составляющим от примерно 5% до примерно 15% по массе; и (d) ионом Ca2+ в количестве, составляющим от примерно 0,5 мМ до примерно 5,0 мМ.
Другой вариант осуществления настоящего изобретения представляет собой жидкий детергентный состав, полученный путем объединения ингредиентов, включающих: (a) водный буфер, имеющий pH в интервале от примерно 6,5 до примерно 8,5; (b) детергентное поверхностно-активное вещество, составляющее от примерно 0,1% до примерно 75% по массе; (c) металлопротеазу, составляющую от примерно 0,01% до примерно 5% по массе; и (d) субстратный белок, где в результате расщепления субстратного белка под действием по меньшей мере одной металлопротеазы, т.е. одной или нескольких металлопротеаз, образуется продукт, который связывается с по меньшей мере примерно 90% молекул металлопротеазы. В одном варианте осуществления субстратный белок выбран из группы, состоящей из: пшеничной клейковины, казеина, соевого белка и растительного белка. В одном варианте осуществления субстратный белок используют в количестве, составляющем от примерно 0,01% до примерно 15% по массе. Как в случае других раскрываемых в данном описании составов, в некоторых вариантах осуществления металлопротеаза представляет собой нейтральную металлопротеазу, выделенную из Bacillus sp., в частности, нейтральную металлопротеазу NprE.
В другом варианте осуществления настоящее изобретение относится к способу получения стабилизированного ингибитором жидкого детергентного состава, включающему: (a) инкубацию смеси, содержащей по меньшей мере одну нейтральную металлопротеазу, т.е. одну или несколько нейтральных металлопротеаз, и белковый субстрат, в водном буфере при pH в интервале от примерно 6,5 до примерно 11 и при температуре от примерно 22°C до примерно 37°C, в процессе которой расщепление субстратного белка под действием по меньшей мере одной нейтральной металлопротеазы, т.е. одной или нескольких нейтральных металлопротеаз, приводит к образованию продукта гидролиза; (b) выделение продукта гидролиза с молекулярной массой менее приблизительно 5000 Да; и (c) объединение продукта гидролиза стадии (b) с жидким детергентным составом, содержащим от примерно 0,001% до примерно 10% по массе нейтральной металлопротеазы. В другом варианте осуществления изобретение относится к способу получения стабилизированного ингибитором жидкого детергентного состава, включающему объединение белкового продукта гидролиза с жидким детергентным составом, содержащим от примерно 0,001% до примерно 10% по массе нейтральной металлопротеазы, где белковый продукт гидролиза получают путем инкубации смеси, содержащей по меньшей мере одну нейтральную металлопротеазу, т.е. одну или несколько нейтральных металлопротеаз, и белковый субстрат, в водном буфере при pH в интервале от примерно 6,5 до примерно 11 и при температуре от примерно 22°C до примерно 37°C, в процессе которой расщепление субстратного белка под действием по меньшей мере одной нейтральной металлопротеазы, т.е. одной или нескольких нейтральных металлопротеаз, приводит к образованию продукта гидролиза, и где продукт гидролиза с молекулярной массой менее приблизительно 5000 Да выделяют перед объединением с нейтральной металлопротеазой. В одном варианте осуществления инкубационная смесь содержит от примерно 0,001% до примерно 10% нейтральной металлопротеазы и от примерно 5% до примерно 20% по массе белкового субстрата. В предпочтительном варианте осуществления нейтральная металлопротеаза представляет собой NprE, и белковый субстрат представляет собой казеин коровьего молока.
В одном варианте осуществления настоящее изобретение относится к вектору экспрессии, содержащему ген нейтральной металлопротеазы и ген белкового субстрата, где продукт гена белкового субстрата ферментативно превращают под действием продукта гена нейтральной металлопротеазы с образованием ингибитора белкового гидролизата. В другом варианте осуществления вектор экспрессии дополнительно содержит промотор, функционально связанный с геном белкового субстрата, где промотор увеличивает экспрессию продукта гена белкового субстрата, но не продукта гена нейтральной металлопротеазы. В одном варианте осуществления ген нейтральной металлопротеазы получают из Bacillus sp., и белковый субстрат получают из казеина. В предпочтительном варианте осуществления ген нейтральной металлопротеазы представляет собой NprE из B. amyloliquifaciens, и белковый субстрат представляет собой казеин.
Краткое описание фигур
На фиг.1 изображен график, полученный с использованием экспериментальных аналитических данных, который показывает, что NprE в повышенных концентрациях с добавлением полипропиленгликоля (PPG) и CaCl2 позволяет сохранить повышенную активность AGLA с течением времени. Все образцы содержат NprE в указанной концентрации, а также 10% PPG и 0,5 мМ CaCl2. Закрашенные кружки обозначают контроль, содержащий 625 ч./млн NprE без добавления PPG или CaCl2.
На фиг.2 изображены кинетические данные, полученные для равновесного состояния, которые показывают, что продукт гидролиза казеина под действием NprE является конкурентным ингибитором NprE. На фиг.2A показана зависимость активности NprE по отношению к субстрату от возрастающих количеств ингибитора. На фиг.2B показан двойной график обратной зависимости с общим отрезком, отсекаемым на оси Y. На фиг.2C показан построенный по новым данным график зависимости кажущейся Km от концентрации ингибиторного пептида. На фиг.2D показан построенный по новым данным двойной график обратной зависимости от увеличивающейся концентрации ингибиторного пептида. На фиг.2C и 2D отсекаемый на оси Х отрезок показывает, что кажущаяся Ki соответствует концентрации продукта гидролиза казеина, составляющей примерно 10 мМ.
На фиг.3 изображен график зависимости активности NprE от времени в присутствии различных белковых гидролизатов.
Подробное описание настоящего изобретения
Общее представление
Настоящее изобретение относится к композициям и детергентным составам, содержащим фермент металлопротеазы и ингибитор металлопротеазы, которые обладают повышенной стабильностью против деградации. Настоящее изобретение также относится к способам получения указанных стабилизированных ингибитором металлопротеазы композиций и детергентных составов.
Все раскрытые в данном описании композиции и детергентные составы содержат металлопротеазу и обладают повышенной стабильностью, которая обусловлена присутствием конкурентного ингибитора, способного обратимо связываться с ферментом и посредством этого предотвращать его автолитическую деградацию. Как указано в данном описании, ингибитор может связываться с активным центром и непосредственно препятствовать взаимодействию субстрата с ферментом по активному центру. Альтернативно, ингибитор может связываться с участком, отличным от активного центра (т.е. ингибитор не является специфичным в отношении активного центра), и предотвращать или ингибировать каталитическое взаимодействие субстрата с ферментом, например, путем индуцирования изменений третичной или четвертичной структуры, которые препятствуют или затрудняют взаимодействие субстрата с активным центром. Важно, что указанные стабилизированные ингибитором композиции и детергентные составы получают таким образом, что при хранении ингибитор связывается с металлопротеазой и эффективно уменьшает ее деградацию, но после разбавления композиции или детергента при его применении ингибитор отделяется, высвобождая активный фермент. Настоящее изобретение раскрывает белковые гидролизаты в качестве особенно эффективных ингибиторов металлопротеазы, стабилизирующих ее против деградации. В особенно предпочтительном варианте осуществления ингибиторный белковый гидролизат получают путем гидролиза белкового субстрата под действием непосредственно самого фермента металлопротеазы. Полученный продукт гидролиза может быть выделен и является особенно эффективным конкурентным ингибитором металлопротеазы, под действием которой он образуется.
Определения
Если не указано иное, все используемые в данном описании технические и научные термины имеют значения, традиционно используемые специалистами в области, к которой относится настоящее изобретение. Например, толкования многих используемых как использовано в данном описании, терминов специалисты в данной области могут найти в общих словарях Singleton and Sainsbury, Dictionary of Microbiology and Molecular Biology, 2d Ed., John Wiley and Sons, NY (1994); и Hale and Marham, The Harper Collins Dictionary of Biology, Harper Perennial, NY (1991). Хотя в данном описании описаны предпочтительные способы и материалы, при осуществлении настоящего изобретения можно использовать любые способы и материалы, подобные или эквивалентные описанным. Соответственно, определенные ниже термины более полно разъясняются посредством ссылки на описание в целом. Кроме того, если в контексте явно не указано иное, как использовано в данном описании, термины, используемые в единственном числе, включают множественное число. Если не указано иное, нуклеиновые кислоты читаются слева направо в направлении от 5'-конца к 3'-концу; аминокислотные последовательности читаются слева направо в направлении от амино-конца к карбокси-концу, соответственно. Следует понимать, что настоящее изобретение не ограничивается конкретными описанными методиками, протоколами и реагентами, поскольку специалисты в данной области смогут модифицировать их в зависимости от преследуемых целей.
Подразумевается, что все максимальные пределы численных значений, приведенные в настоящем описании, включают все более низкие пределы численных значений, как если бы такие более низкие пределы численных значений были специально указаны в данном описании. Все минимальные пределы численных значений, приведенные в настоящем описании, включают все более высокие пределы численных значений, как если бы такие более высокие пределы численных значений были специально указаны в данном описании. Все численные интервалы, приведенные в настоящем описании, каждый включает более узкие численные интервалы, которые входят в такие более широкие численные интервалы, как если бы такие более узкие численные интервалы были специально указаны в данном описании.
Все цитируемые документы, в соответствующей части, включены в данное описание посредством ссылки; цитирование какого-либо документа не является допущением того, что он относится к известному уровню техники в области, к которой относится настоящее изобретение.
Как использовано в данном описании, термин "фермент" относится к любому белку, который катализирует химическую реакцию. Каталитическая функция фермента составляет его "активность" или "ферментативную активность". Фермент обычно классифицируют согласно типу его каталитической функции, такому как, например, гидролиз пептидных связей.
В данном описании выражение "эффективное количество фермента" относится к количеству фермента, необходимому для достижения ферментативной активности, требующейся для конкретного применения (например, для применения средства личной гигиены, чистящей композиции и др.). Такое эффективное количество может быть легко определено специалистом в данной области с учетом различных факторов, таких как конкретный используемый вариант фермента, применение детергента, конкретный состав детергента и т.п.
Как использовано в данном описании, термины "протеаза" или "протеиназа" относятся ко всем ферментам, катализирующим гидролиз пептидных связей в молекуле белка.
Как использовано в данном описании, термины "металлопротеаза" "металлопротеиназа" или "металлопептидаза" относятся к протеазе, которая может выполнять каталитическую функцию после связывания иона металла.
Как использовано в данном описании, термин "нейтральная металлопротеаза" относится к металлопротеазе, каталитическая активность которой реализуется в присутствии ионов цинка и достигает оптимального уровня при нейтральных значениях pH. Как правило, нейтральные металлопротеазы имеют размер от 30 до 40 кДа. Нейтральные металлопротеазы по настоящему изобретению, также называемые "нейтральными металлоэндопептидазами", включают ферменты класса EC 3.4.24.4.
Как использовано в данном описании, термин "субстрат" относится к веществу (например, химическому соединению), которое под действием каталитической активности фермента способно превращаться в продукт. В случае металлопротеазы субстрат обычно представляет собой белок, хотя металлопротеазы также могут воздействовать на пептидные или сложноэфирные связи небелковых соединений. Так, термин "белковый субстрат" относится к субстрату, который представляет собой белок.
Как использовано в данном описании, термин "активный центр" относится к участку фермента, в котором происходит связывание субстрата и реализация каталитической активности. В некоторых случаях фермент может содержать несколько активных центров. Как правило, металлопротеазы содержат один активный центр.
Как использовано в данном описании, термин "ингибитор" относится к любому веществу, которое уменьшает ферментативную активность. Например, ингибитор может представлять собой белковый гидролизат, полипептид, природный или синтетический аналог белкового гидролизата или полипептида. Так, ингибиторы могут включать синтетические соединения, которые имитируют некоторые аспекты способности белкового гидролизата связываться с активным центром фермента нейтральной металлопротеазы.
Как использовано в данном описании, термин "конкурентный ингибитор" относится к ингибитору, который обратимо связывается с ферментом и посредством этого препятствует связыванию субстрата, т.е. ингибитор конкурирует с субстратом за связывание с активным центром или ингибитор связывается с другим участком фермента и предотвращает или ингибирует каталитическое взаимодействие субстрата с ферментом в активном центре.
Как использовано в данном описании, "Ki" или "константа ингибирования" определяется как константа диссоциации комплекса фермент-ингибитор, т.е. отношение концентрации свободного фермента (т.е. "[E]") к концентрации фермента, связанного с ингибитором (т.е. "[E-I]"). Ki можно определить с помощью хорошо известных методов равновесной ферментативной кинетики, описанных в большинстве руководств по биохимии (см., например, Fersht, "Enzyme Structure and Mechanism," W.H. Freeman, 2nd Ed., 1985). Коротко говоря, константу ингибирования Ki определяют путем измерения влияния присутствия ингибитора (т.е. концентрации ингибитора) на равновесные кинетические константы фермента (т.е. Km и kcat) с помощью анализа, в котором используется известный субстрат.
Как использовано в данном описании, термин "кажущаяся Ki" относится к значению Ki, определенному в том случае, когда фактическая концентрация ингибитора не может быть точно определена. Например, если ингибитор представляет собой смесь продуктов гидролиза (т.е. смесь фрагментов белка), измеряемая Ki представляет собой "кажущуюся Ki", поскольку абсолютную концентрацию ингибитора можно определить, например, только путем химического анализа концентрации пептида. Фактические концентрации конкретных фрагментов, входящих в состав смеси, которые связываются с молекулой фермента и ингибируют ее, могут быть гораздо ниже, чем измеряемые концентрации. Следовательно, значение "кажущейся Ki" будет выше, чем значение Ki, определенное с использованием очищенного ингибитора.
Как использовано в данном описании, термин "автолиз" относится к лизису ткани или клетки под действием собственных ферментов. В одном варианте осуществления термин "автолиз" относится к гидролизу под действием фермента его собственной цепи, например, к автопротеолизу под действием фермента протеазы.
Как использовано в данном описании, термин "стабильность" в отношении фермента относится к его способности сохранять с течением времени определенный уровень функциональной активности в конкретных условиях окружающей среды. Термин "стабильность" можно использовать в ряде контекстов, относящихся к представляющим интерес конкретным условиям окружающей среды. Например, термин "автолитическая стабильность" относится к способности фермента противостоять автолитической деградации (т.е. автопротеолизу). Существенным изменением стабильности считается увеличение или уменьшение (в большинстве вариантов осуществления предпочтительно увеличение) периода полужизни ферментативной активности по меньшей мере примерно на 5% или больше, по сравнению с ферментативной активностью в отсутствии стабилизатора (например, ингибиторного соединения). Подразумевается, что данный термин не ограничивается использованием какой-либо конкретной протеазы для определения стабильности белка.
Как использовано в данном описании, термин "ферментативное превращение" относится к модификации субстрата или промежуточного продукта путем контактирования субстрата или промежуточного продукта с ферментом. В некоторых вариантах осуществления контактирование осуществляют путем непосредственного воздействия субстрата или промежуточного продукта на соответствующий фермент. В других вариантах осуществления контактирование включает воздействие субстрата или промежуточного продукта на организм, который экспрессирует и/или секретирует фермент, и/или метаболизирует желаемый субстрат и/или промежуточный продукт до целевого промежуточного соединения и/или конечного продукта, соответственно.
Как использовано в данном описании, термин "расщепление" относится к ферментативному превращению белкового субстрата в продукты под действием протеазы.
Как использовано в данном описании, термины "очищенный" и "выделенный" относятся к соединению, которое получают после удаления из образца загрязняющих примесей и/или веществ, с которыми соединение (например, полипептид или полинуклеотид) ассоциировано в природе.
Как использовано в данном описании, термин "гидролизат" относится к любому веществу, полученному в результате гидролиза. Подразумевается, что данный термин не ограничивается веществом, полученным с помощью какого-либо конкретного метода гидролиза. Предполагается, что данный термин включает "гидролизаты", полученные путем ферментативных, а также неферментативных реакций. Например, все известные гидролитические ферменты (например, серинпротеазы, металлопротеазы, гидролазы и др.) способны продуцировать гидролизаты в рамках значений термина, используемого в настоящем описании. Подобным образом, неферментативные методы гидролиза (например, кислотный/основной гидролиз и др.) также дают возможность получать гидролизаты в рамках значений термина, используемого в настоящем описании.
Как использовано в данном описании, термин "белковый гидролизат" относится к гидролизату, полученному путем гидролиза белка любого типа или класса. Любой известный белок можно гидролизовать с получением белкового гидролизата в рамках значений термина, используемого в настоящем описании. "Белковый гидролизат" может быть получен с помощью ферментативных или неферментативных методов и может содержать фрагменты белков (например, полипептиды), размер которых варьирует от двух до 100 или более аминокислот. Кроме того, как использовано в данном описании, термин "белковый гидролизат" не ограничивается одним соединением-продуктом и может включать гетерогенное распределение или смесь продуктов гидролиза (например, белковых фрагментов). Он также может включать гомогенное соединение или очищенную фракцию продуктов гидролиза. Предпочтительные варианты осуществления белковых гидролизатов включают: HyPep 4601™ (белковый гидролизат пшеничной клейковины), Amisoy (кислый гидролизат соевого белка), Amicase (кислый гидролизат казеина коровьего молока), протеозопептон (ферментативный гидролизат растительного белка).
Как использовано в данном описании, термин "белок" относится к любому соединению, состоящему из аминокислот, и определяемому специалистами в данной области как белок. Термины "белок", "пептид" и "полипептид" используются в настоящем описании как взаимозаменяемые. Там, где пептид является частью белка, специалисты в данной области понимают применение термина в контексте. Термины "дикого типа" и "нативный" используются применительно к природным белкам. В некоторых вариантах осуществления белковая последовательность дикого типа используется как исходная при получении рекомбинантных белков.
Как использовано в данном описании, термины "родственный белок" или "гомологичный белок" относятся к функционально и/или структурно подобным белкам (т.е. имеющим одинаковые функции и/или структуры). Предполагается, что данный термин охватывает одинаковые или подобные ферменты (например, с точки зрения структуры и функции), полученные из разных видов. Подразумевается, что настоящее изобретение не ограничивается родственными белками из какого-либо конкретного источника (источников) или белками, родственными в эволюционом отношении. Кроме того, термины родственные или гомологичные белки охватывают гомологи по третичной структуре и гомологи по первичной последовательности. Так, термины включают белки, последовательности которых являются "вариантными" или "мутантными" по сравнению с последовательностью дикого типа.
Как использовано в данном описании, термины "детергент", "композиция детергента" и "детергентный состав" относятся к смесям, предназначенным для применения в моющей среде для очистки загрязненных объектов. В некоторых вариантах осуществления термины используют применительно к стирке тканей и/или предметов одежды (например, "моющие средства для стирки"). В других вариантах осуществления термин относится к детергентам, используемым, например, для мытья посуды, столовых приборов и др. (таким как "средства для мытья посуды"). Как правило, данные термины охватывают составы, включая "высокоэффективные жидкости" ("HDL"), которые содержат, например, ферменты металлопротеазы, ингибиторы металлопротеаз, такие как белковые гидролизаты, стабилизаторы ферментов, такие как полипропиленгликоль, поверхностно-активные вещества, трансферазы, гидролитические ферменты, оксидоредуктазы, добавки, повышающие моющее действие, отбеливающие средства, активаторы отбеливания, подсинивающие средства и флуоресцентные красители, ингибиторы комкования, маскирующие средства, активаторы ферментов, антиоксиданты и солюбилизаторы. Подразумевается, что настоящее изобретение не ограничивается каким-либо конкретным детергентным составом или детергентной композицией.
Как использовано в данном описании, термин "поверхностно-активное вещество" относится к поверхностно-активному соединению, которое уменьшает поверхностное натяжение. Данный термин охватывает все хорошо известные типы поверхностно-активных веществ и систем поверхностно-активных веществ, которые включают неионные поверхностно-активные вещества, анионные поверхностно-активные вещества, катионные поверхностно-активные вещества, амфолитические поверхностно-активные вещества, цвиттерионные поверхностно-активные вещества, семиполярные неионные поверхностно-активные вещества и их смеси.
В данном описании фраза "стабильность детергента" относится к сохранению способности детергентных составов очищать загрязненные объекты в моющей среде в определенных условиях окружающей среды и в течение определенного периода времени. Термин стабильность детергента включает стабильность при хранении (т.е. перед использованием) или стабильность при применении в моющей среде. Стабильность детергента может варьировать в зависимости от типа тестирования очистки, используемого для определения стабильности. Кроме того, стабильность детергента может полностью соответствовать стабильности конкретных активных ингредиентов детергентного состава, если такие конкретные ингредиенты принимают значимое участие в тестировании очистки.
Если не указано иное, как использовано в данном описании, термины "чистящая композиция" и "чистящий состав" относятся к композициям, используемым для удаления нежелательных соединений из подлежащих очистки объектов, таких как ткани, посуда, контактные линзы, другие твердые основы, волосы (шампуни), кожа (мыла и кремы), зубы (жидкости для полоскания рта, зубные пасты) и др. Термин охватывает все вещества/соединения, выбранные для конкретного типа желаемой чистящей композиции и формы продукта (например, жидкость, гель, гранулы или композиция спрея), при условии совместимости композиции с металлопротеазой и другими ферментами, используемыми в составе. Конкретный выбор чистящей композиции может быть легко осуществлен специалистом в данной области с учетом поверхности, объекта или ткани, подлежащих очистке, а также формы композиции, подходящей для условий очистки при применении.
Термины "чистящая композиция" и "чистящий состав" также относятся к любой композиции, подходящей для очистки, отбеливания, дезинфекции и/или стерилизации объекта и/или поверхности. Подразумевается, что данные термины включают, но без ограничения, детергентные составы (например, жидкие и/или твердые стиральные средства и моющие средства для деликатных тканей; композиции для очистки твердых поверхностей, таких как стеклянные, деревянные, керамические и металлические столешницы и окна; чистящие средства для ковров; чистящие средства для духовок; средства для обновления тканей; средства для смягчения тканей; а также средства для предварительной очистки текстильных изделий и белья и средства для мытья посуды).
Кроме того, если не указано иное, как использовано в данном описании, термины "чистящая композиция" и "чистящий состав" включают гранулированные или порошкообразные универсальные или высокоэффективные моющие средства, в частности, чистящие средства; жидкие, гелеобразные или пастообразные универсальные моющие средства, в частности, так называемые высокоэффективные жидкости (HDL); жидкие моющие средства для деликатных тканей; средства для ручного мытья посуды или средства для мытья посуды в легком режиме, в частности, средства с высоким пенообразованием; средства для посудомоечных машин, включая различные таблетки, гранулы, жидкости и ополаскиватели для домашнего и производственного применения; жидкие чистящие и дезинфицирующие средства, включая противобактериальные средства для мытья рук, чистящие бруски, жидкости для полоскания рта, очищающие средства для зубов и полости рта, шампуни для автомобилей или ковров, чистящие средства для ванной; шампуни и ополаскиватели для волос; гели для душа и пены для ванн; чистящие средства для металлов; а также вспомогательные чистящие средства, такие как отбеливающие добавки и средства для "нанесения на пятно" или предварительной обработки.
Как использовано в данном описании, термин "ткань" охватывает любой текстильный материал. Так, подразумевается, что данный термин охватывает предметы одежды, а также ткани, пряжи, волокна, нетканые материалы, природные материалы, синтетические материалы и другие текстильные материалы.
Термин "рекомбинантная молекула ДНК" в данном описании относится к молекуле ДНК, которая содержит сегменты ДНК, соединенные методами молекулярной биологии.
Термин "рекомбинантный олигонуклеотид" относится к олигонуклеотиду, полученному методами молекулярной биологии, включающих, но без ограничения, лигирование двух или более олигонуклеотидных последовательностей, полученных в результате расщепления полинуклеотидной последовательности под действием рестрикционного фермента, синтез олигонуклеотидов (например, синтез праймеров или олигонуклеотидов) и т.п.
Термин "регуляторный элемент" в данном описании относится к генетическому элементу, который контролирует некоторые аспекты экспрессии неклеотидных последовательностей. Например, промотор представляет собой регуляторный элемент, который обеспечивает инициацию транскрипции функционально связанного с ним кодирующего участка. Дополнительные регуляторные элементы включают сигналы сплайсинга, сигналы полиаденилирования и сигналы терминации.
Термин "промотор/энхансер" означает сегмент ДНК, который содержит последовательности, несущие как промоторные, так и энхансерные функции (например, длинные концевые повторы ретровирусов выполняют как промоторные, так и энхансерные функции). Энхансер/промотор может быть "эндогенным" или "экзогенным", или "гетерологичным". Эндогенный энхансер/промотор является одним, который природно связан с конкретным геном в геноме. Экзогенный (гетерологичный) энхансер/промотор является одним, который размещен в сопоставление гену посредством генетических манипуляций (т.е. методами молекулярной биологии).
Как использовано в данном описании, термин "вектор экспрессии" относится к конструкции ДНК, которая содержит последовательность ДНК, функционально связанную с подходящей регуляторной последовательностью, способной обеспечивать экспрессию ДНК в подходящем хозяине. Такие регуляторные последовательности включают промотор, обеспечивающий транскрипцию, необязательную операторную последовательность, контролирующую такую транскрипцию, последовательность, кодирующую подходящие участки связывания мРНК с рибосомой, и последовательности, контролирующие терминацию транскрипции и трансляции. Вектор может представлять собой плазмиду, фаговую частицу или просто потенциальную геномную вставку. После трансформации подходящего хозяина вектор может реплицироваться и функционировать независимо от генома хозяина или, в некоторых случаях, он может интегрироваться в геном хозяина.
Термины "плазмида", "экспрессионная плазмида" и "вектор" в данном описании используются как взаимозаменяемые, причем в данном случае плазмида представляет собой наиболее часто используемую форму вектора. Однако подразумевается, что настоящее изобретение включает другие формы экспрессионных векторов, выполняющих эквивалентные функции, которые известны в данной области или становятся известными.
Термин "введенный" применительно к вставке нуклеотидной последовательности в клетку, означает трансформацию, трансдукцию или трансфекцию. Способы трансформации включают протопластную трансформацию, осаждение хлоридом кальция, электропорацию, метод "оголенной" ДНК и другие известные в данной области методы. (См. Chang and Cohen, Mol. Gen. Genet., 168:111-115 [1979]; Smith et al., Appl. Env. Microbiol., 51:634 [1986]; и обзорную статью Ferrari et al., в Harwood, Bacillus, Plenum Publishing Corporation, p. 57-72 [1989]).
В данном описании "клетки-хозяева", как правило, представляют собой прокариотические или эукариотические организмы, которые трансформируют или трансфицируют векторами, сконструированными методами рекомбинантных ДНК, известными в данной области. Трансформированные клетки-хозяева могут либо реплицировать векторы, кодирующие варианты белков, либо экспрессировать желаемый вариант белка. В случае векторов, кодирующих пре- или препро-форму варианта белка, такие варианты, если они экспрессируются, обычно секретируются из клетки-хозяина в культуральную среду.
Ферменты нейтральной металлопротеазы
Металлопротеазы представляют собой разнотипный класс протеаз, которые можно обнаружить в бактериях, грибках, а также в высших организмах. Связанный ион металла в активном центре обеспечивает каталитическую активацию молекулы воды. Затем молекула воды функционирует как нуклеофил, расщепляя карбонильную группу пептидной связи. Последовательность и структура в данном классе широко варьируют, однако активный центр подавляющего большинства металлопротеаз содержит связанный ион цинка. В некоторых металлопротеазах ион цинка может быть заменен ионом другого металла, такого как кобальт или никель, и активность при этом не уменьшается. В настоящее время существует теория, что каталитический механизм металлопротеаз включает образование нековалентного тетраэдрического промежуточного соединения в результате воздействия цинк-связанной молекулы воды на карбонильную группу связи, расщепляемой ферментом.
Нейтральные металлопротеазы (т.е. нейтральные металлоэндопептидазы, EC 3.4.24.4) принадлежат к классу протеаз, для каталитической активности которых требуется обязательное присутствие ионов цинка. Данные ферменты имеют оптимальную активность при нейтральных значениях pH и варьируют по размеру от 30 до 40. Нейтральные металлопротеазы связывают от двух до четырех ионов кальция, которые участвуют в обеспечении структурной стабильности белка. Семейство нейтральных металлопротеаз включает бактериальный фермент термолизин и другие термолизин-подобные протеазы ("TLP"), а также карбоксипептидазу A (гидролизующий фермент) и металлопротеазы матрикса, которые катализируют реакции, участвующие в ремоделировании и деградации тканей.
С точки зрения функции и стабильности, вероятно, лучше всего охарактеризованы такие нейтральные металлопротеазы, как термолизин и TLP. Многие исследования сфокусированы на получении рекомбинантных термолизинов Bacillus subtilis с повышенной термостабильностью (см., например, Vriend et al., In, Tweel et al. (eds), Stability and Stabilization of Enzymes, Elsevier, p. 93-99 [1993]). Многочисленные усилия предпринимаются для повышения стабильности TLP путем изменений структурных детерминант, идентифицированных с помощью молекулярного моделирования, которые могут предотвратить процессы локального разворачивания, повышающие автолиз и денатурацию при высоких температурах (см., например, van den Burg et al., in Hopsu-Havu et al., (eds), Proteolysis in Cell Functions Manipulating the Autolvtic Pathway of a Bacillus Protease. Biomedical and Health Research Vol. 13, IOS Press [1997] p. 576). Сообщалось, что ионы кальция могут участвовать в предотвращении автолиза нейтральной металлопротеазы. Нейтральную протеазу B. stearothermophilus стабилизируют против автолиза и протеолитической деградации путем добавления кальция (см. Durrschmidt et al, FEBS J., 272:1523-1534 [2005]).
Композиции и способы получения рекомбинантных нейтральных металлопротеаз, включая NprE с улучшенными характеристиками, описаны в патентной заявке США №11/581102, поданной 12 октября 2006, которая включена в данное описание посредством ссылки. Среди других аспектов патентная заявка США №11/581102 предлагает композиции и способы, подходящие для получения рекомбинантных нейтральных металлопротеаз, структурная стабильность которых не зависит от кальция. В других предлагающихся там вариантах осуществления рекомбинантные нейтральные металлопротеазы несут изменения, предотвращающие локальное разворачивание конкретного элемента вторичной структуры и, как следствие, протеолиз.
К стабильным нейтральным металлопротеазам, описанным в патентной заявке США №11/581102, относятся металлопротеаза дикого типа из Bacillus amyloliquefaciens (например, очищенная MULTIFECT® Neutral; "PMN") и рекомбинантная нейтральная металлопротеаза (например, нейтральная металлопротеаза Bacillus amyloliquefaciens, клонированная в Bacillus subtilis), называемая NprE.
Помимо нейтральной металлопротеазы из Bacillus amyloliquefaciens настоящее изобретение охватывает применение родственных ферментов из других источников, в частности, Bacillus sp., включающих, но без ограничения, гомологи металлопротеаз, полученные из: B. cereus, B. cereus E33L, B. caldolyticus, B. pumulis, B. megaterium, B. subtilis amylosacchariticus, Brevibacillus brevis, Paenibacillus polymyxa (Bacillus polymyxa), B. stearothermophilus, B. thuringiensis, B. subtilis и S. aureus, а также ауреолизин, внеклеточную эластазу и нейтральную протеазу B.
Металлопротеазы, пригодные для использования в вариантах осуществления настоящего изобретения, можно очистить путем удаления из раствора или препарата загрязняющих белков и других соединений, отличных от металлопротеазы. В некоторых вариантах осуществления рекомбинантную металлопротеазу экспрессируют в бактериальных или грибковых клетках-хозяевах, затем полученную рекомбинантную металлопротеазу очищают путем удаления других компонентов клеток-хозяев; в результате в образце увеличивается содержание рекомбинантных полипептидов металлопротеазы. В особенно предпочтительных вариантах осуществления металлопротеазы, используемые согласно настоящему изобретению, очищают практически до уровня, составляющего по меньшей мере примерно 99% белковых компонентов, что определяют с помощью метода SDS-PAGE или других стандартных методов, известных в данной области. В альтернативных предпочтительных вариантах осуществления металлопротеазы по настоящему изобретению составляют по меньшей мере примерно 99% протеазных компонентов составе. В других альтернативных вариантах осуществления содержание металлопротеазы находится в интервале, составляющем по меньшей мере примерно 90-95% от общего количества белка и/или протеазы.
Функциональную характеристику ферментов металлопротеаз дикого типа и вариантных металлопротеаз можно осуществлять с помощью любых подходящих способов, предпочтительно, на основе анализа представляющих интерес свойств. Например, в некоторых вариантах осуществления настоящего изобретения определяют стабильность при воздействии различных pH и/или температур, а также детергентов и/или окислителей. В действительности предполагается, что в контексте настоящего изобретения можно использовать металлопротеазные ферменты с разной степенью стабильности по одной или нескольким из указанных характеристик (протеолитическая или автолитическая стабильность, детергентная стабильность, pH-стабильность, термостабильность и/или окислительная стабильность).
Одним из способов усовершенствования ферментов с точки зрения стабильности детергентного состава является изменение структуры самого фермента, т.е. разработка ферментов с вариантными аминокислотными последовательностями, которые обладают повышенной активностью и/или специфичностью в условиях применения детергентного состава. Например, в данной области описан ряд вариантов протеаз. См., например, EP 0130756, который соответствует переуступленному патенту США №34606 (Genencor); EP 0214435 (Henkel); WO 87/04461 (Amgen); WO 87/05050 (Genex); EP 0260105 (Genencor); WO 88/08028 (Genex); WO 88/08033 (Amgen); WO 95/27049 (Solvay); WO 95/30011 (Procter & Gamble); WO 95/30010 (Procter & Gamble); WO 95/29979 (Procter & Gamble); патент США №5543302 (Solvay); EP 0251446 (Genencor); WO 89/06279 (Novozymes A/S); WO 91/00345 (Novozymes A/S); EP 0525610 A1 (Solvay).
Вариантные ферменты могут отличаться от исходного белка и друг от друга по небольшому числу аминокислотных остатков. Число различающихся аминокислотных остатков может быть равно или больше единицы, предпочтительно, оно составляет 1, 2, 3, 4, 5, 10, 15, 20, 30, 40, 50 или больше. В некоторых предпочтительных вариантах осуществления число аминокислотных остатков, различающихся у разных вариантов, находится в интервале от 1 до 10. В некоторых особенно предпочтительных вариантах осуществления родственные белки, в частности вариантные белки, имеют идентичность аминокислотной последовательности, составляющую по меньшей мере 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99%.
В данной области существует несколько способов, подходящих для получения вариантов ферментов по настоящему изобретению, которые включают, но без ограничения, сайт-насыщающий мутагенез, сканирующий мутагенез, инсерционный мутагенез, случайный мутагенез, сайт-специфический мутагенез и направленное развитие, а также другие различные рекомбинантные способы.
Ряд вариантных последовательностей нейтральной металлопротеазы описан в заявке США №11/581102, поданной 12 октября 2006, которая включена в данное описание посредством ссылки. По функциональным характеристикам такие вариантные ферменты могут отличаться от фермента дикого типа в различной степени. Однако их можно использовать в соответствии с раскрытыми в данном описании составами и способами, при условии, что такая вариантная нейтральная металлопротеаза обладает автолитической активностью и, кроме того, конкурентно ингибируется белковым гидролизатом. Таким образом, любой из описанных в данном описании вариантов осуществления стабилизированной ингибитором металлопротеазы можно осуществить, используя не только фермент нейтральной металлопротеазы дикого типа, но и ряд ее активных мутантов и других вариантов.
В одном варианте осуществления настоящее изобретение относится к применению сайт-специфического мутагенеза для получения активного центра нейтральной металлопротеазы, в котором частица белкового гидролизата будет ингибировать ингибиторные связывающие характеристики, что будет оказывать более благоприятное действие на улучшение стабильности детергентного состава. Способы получения "сайт-аналитических библиотек" (SEL) мутантов нейтральной металлопротеазы раскрыты в заявке США №11/581102, поданной 12 октября 2006, которая включена в данное описание посредством ссылки. В соответствии с настоящим изобретением указанные SEL можно использовать для получения мутантов нейтральной металлопротеазы по активному центру, которые затем можно подвергнуть скринингу для выявления улучшенных характеристик связывания белкового гидролизата (или другого ингибитора), повышающих вероятность применения указанных ингибиторов для стабилизации детергентных составов и чистящих композиций против автолитической деградации.
Белковые гидролизаты в качестве ингибиторов и стабилизаторов
Нейтральные металлопротеазы, такие как NprE, при хранении в растворе могут со временем утрачивать значительную долю активности. Большая часть такой утраты ферментативной активности обусловлена автолизом, т.е. каталитическим протеолизом молекулы нейтральной металлопротеазы под действием других молекул фермента металлопротеазы или той же самой молекулы. Автолиз может необратимо нарушать сворачивание молекулы фермента, после чего его функция или активность могут сильно ослабеть или полностью прекратиться. Как правило, такая автолитическая потеря активности усиливается под действием повышенных температур, зачастую используемых в условиях мытья, которым подвергаются детергентные составы. Как следствие, данная утрата активности фермента приводит к непосредственному уменьшению стабильности детергента.
В идеале, чтобы минимизировать автолиз до применения, нужно блокировать каталитическую активность каждой молекулы нейтральной металлопротеазы. Ингибитор фермента может блокировать его активность; однако ингибитор, связывающийся с активным центром фермента, зачастую является предельно устойчивым и необратимым. Например, так называемые "суицидные ингибиторы" химически изменяют активный центр фермента и делают невозможным восстановление каталитической активности.
Существуют способы повышения стабильности серинпротеаз в детергентных составах при хранении путем добавления ингибиторов, таких как ингибиторные соединения на основе бора (например, борная кислота и различные бороновые кислоты). Известно, что указанные ингибиторы на основе бора обратимо ингибируют ферменты серинпротеазы. Например, ингибирование серинпротеазы субтилизина под действием бороновой кислоты описано в Molecular & Cellular Biochemistry 51, 1983, p. 5-32. Указанные ингибиторы на основе бора неэффективно ингибируют металлопротеазы, каталитический механизм которых отличается от каталитического механизма серинпротеаз. Кроме того, некоторые контрольные органы стали поднимать вопросы, касающиеся безопасности соединений на основе бора, и рассматривать ограничение их выделения в окружающую среду.
Для целей настоящего изобретения желательно, чтобы блокирование автолитической активности под действием ингибиторов металлопротеаз было обратимым. При хранении металлопротеазы ингибиторы должны связываться с ней прочно, но обратимо, и затем, когда нужно использовать ее каталитическую функцию, они должны отделяться от молекулы фермента, обеспечивая восстановление его активности. Кроме того, указанное обратимое ингибирование должно быть совместимо с условиями окружающей среды, присутствующими, когда фермент является ингредиентом детергентного состава или другой чистящей композиции.
Таким образом, в одном варианте осуществления настоящее изобретение относится к стабилизированной ингибитором композиции металлопротеазы, которая содержит: (a) от примерно 0,001% до примерно 10% по массе нейтральной металлопротеазы; и (b) конкурентный ингибитор, где конкурентный ингибитор связан с по меньшей мере примерно 90% молекул указанной нейтральной металлопротеазы. Такая стабилизированная ингибитором композиция может находиться в виде жидкого или сухого (например, гранулярного) препарата. В одном варианте осуществления композицию используют в качестве ингредиента-предшественника для получения детергентных составов по настоящему изобретению, описанных более подробно ниже. В другом варианте осуществления стабилизированная ингибитором композиция металлопротеазы представляет собой инкапсулированную частицу, как более подробно описано ниже.
Хорошо известно, что активность ферментов серинпротеаз лучше сохраняется, если их хранить при повышенных концентрациях. Полагают, что это обусловлено связыванием продукта автолиза с активным центром серинпротеаз при хранении фермента в повышенных концентрациях. Другими словами, скорость диссоциации продукта автолиза сильно уменьшается. Фактически повышение общей концентрации фермента заставляет продукт автолиза действовать в качестве ингибитора. Если концентрацию уменьшить (путем разбавления), продукт автолиза может легко диссоциировать, и реакция автолиза может возобновиться.
Как описано ниже в примере 1, нейтральные металлопротеазы обладают повышенной стабильностью (т.е. сохраняют больше активности с течением времени) при хранении в повышенной концентрации. Как и в случае ферментов серинпротеаз, такая повышенная стабильность при увеличении концентрации указывает на то, что продукты автолиза металлопротеаз могут действовать как ингибиторы.
Таким образом, в одном варианте осуществления настоящее изобретение относится к стабилизированному составу нейтральной металлопротеазы, который содержит раствор нейтральной металлопротеазы, где концентрация нейтральной металлопротеазы составляет по меньшей мере примерно 500 ч./млн, 1000 ч./млн, 2500 ч./млн, 5000 ч./млн, 10000 ч./млн или выше. В одном варианте осуществления раствор нейтральной металлопротеазы дополнительно содержит по меньшей мере примерно 10% пропиленгликоля. В другом варианте осуществления раствор нейтральной металлопротеазы дополнительно содержит по меньшей мере примерно 0,5 мМ, например, от примерно 0,5 мМ до примерно 5 мМ ионов кальция (например, хлорид, формиат, цитрат, аскорбат, ацетат или фосфат кальция). В одном варианте осуществления раствор нейтральной металлопротеазы содержит от примерно 0,5 мМ до примерно 5 мМ CaCl2.
Тот факт, что при высоких концентрациях нейтральных металлопротеаз, таких как NprE, их автолиз ингибируется под действием продукта, позволяет предположить, что другие продукты гидролиза могут действовать в качестве ингибиторов, стабилизируя ферменты против автолиза. Таким образом, в одном варианте осуществления настоящее изобретение относится к составу (или композиции), содержащему нейтральную металлопротеазу и белковый гидролизат. В одном варианте осуществления белковый гидролизат получают под действием самой нейтральной металлопротеазы. Например, как раскрыто ниже в примере 2, коровий белок, такой как молочный казеин, обрабатывают активной нейтральной металлопротеазой, такой как NprE, получая ферментативным способом смесь белкового гидролизата. Как правило, такой полученный ферментативным способом белковый гидролизат представляет собой гетерогенную смесь пептидных продуктов различного размера, например, пептидов, полученных в результате расщепления казеина, катализируемого NprE. В одном варианте осуществления полученную ферментативным способом композицию белкового гидролизата можно использовать в качестве ингибитора как таковой. В других вариантах осуществления полученную смесь можно подвергнуть дополнительному выделению и/или очистке, с получением более концентрированного и/или гомогенного состава белкового гидролизата.
В одном варианте осуществления настоящего изобретения полученный под действием нейтральной металлопротеазы белковый гидролизат пропускают через мембрану, отделяющую компоненты с молекулярной массой 5000 Да, с получением смеси низкомолекулярных соединений. Затем полученную смесь низкомолекулярных соединений добавляют к составу, содержащему нейтральную металлопротеазу, чтобы стабилизировать его против автолитической деградации при хранении.
В соответствии с настоящим изобретением ингибитор металлопротеазы должен представлять собой конкурентный ингибитор. Способный обратимо связываться конкурентный ингибитор позволяет значительно уменьшить содержание металлопротеазы в детергентном составе или другой чистящей композиции. При выборе конкурентного ингибитора для получения стабилизированной ингибитором металлопротеазы следует учитывать следующие факторы: (1) ингибитор металлопротеазы нужно выбирать в зависимости от Ki, и/или ингибитор следует добавлять в количестве, достаточном для того, чтобы по меньшей мере примерно 90% молекул фермента в детергентном составе (или чистящей композиции) были связаны с ингибитором при хранении (т.е. перед применением); и (2) ингибитор следует выбирать таким образом, чтобы при применении, когда детергентный состав (или чистящую композицию) разводят водой (или другой подходящей жидкостью) примерно в 10-10000 раз или примерно в 10-100000 раз, по меньшей мере примерно 25, 50, 75, 95 или более % связанного ингибитора отделялось от молекул фермента.
В одном варианте осуществления конкурентный ингибитор присутствует в количестве, достаточном для связывания по меньшей мере примерно 90% молекул металлопротеазы перед разбавлением, и после разбавления водой (или другой подходящей жидкостью) примерно в 10-10000 раз или примерно в 10-100000 раз, ингибитор отделялся от по меньшей мере примерно 25, 50, 75, 95 или более % связанных молекул фермента, которые высвобождаются в каталитически активной форме.
В любом одном из вариантов осуществления стабилизированной ингибитором металлопротеазы по настоящему изобретению выбранным ингибитором металлопротеазы может являться белковый гидролизат. В одном предпочтительном варианте осуществления настоящего изобретения ингибитор металлопротеазы представляет собой белковый гидролизат, полученный путем гидролиза белка под действием металлопротеазы. В одном варианте осуществления металлопротеаза представляет собой NprE, и ингибитор представляет собой продукт гидролиза казеина коровьего молока под действием NprE. В другом варианте осуществления металлопротеаза представляет собой NprE, и ингибитор представляет собой белковый гидролизат, выбранный из группы, состоящей из: гидролизата пшеничной клейковины (например, HyPep 4601TM), кислого гидролизата соевого белка (например, Amisoy), кислого гидролизата казеина коровьего молока (например, Amicase), ферментативного гидролизата растительного белка (например, протеозопептон), а также любых их комбинаций.
Коммерчески доступными являются и многие другие смеси белковых гидролизатов. Например, в каталоге Sigma Chemical присутствуют следующие белковые гидролизаты: гидролизат альбумина; не содержащий витаминов кислый гидролизат казеина; гидролизат казеина; бульон гидролизата казеина; казеиновый содержащий магний бульон; казеиновый дрожжевой содержащий магний агар; казеиновый дрожжевой содержащий магний бульон; Edamin® K; ферментный гидролизат желатина; ферментный гидролизат клейковины кукурузы; Hy-Case P; Hy-Case(® M; гидролизат лактальбумина; печеночный гидролизат; N-Z-Amine® B; N-Z-Amine® BT; N-Z-Amine® YTT; пептон; пептон из казеина, полученный кислым расщеплением; пептон из лактальбумина, полученный ферментативным расщеплением, легкорастворимый; пептон из мяса, полученный путем пепсинового расщепления; пептон из сухих веществ молока; пептон из лосося; пептон Hy-Soy® T; Peptone N-Z-Soy® BL 4; Primatone; белковый гидролизат Amicase®; белковый гидролизат N-Z-Amine® AS; протеозопептон; кислый гидролизат соевого белка; триптон; триптоза; и растительный гидролизат №2.
Общим признаком всех указанных смесей белковых гидролизатов является то, что они содержат смесь пептидных фрагментов, образующихся после гидролиза белка. На основании этого общего признака специалист в данной области сможет сделать вывод, что все смеси белковых гидролизатов являются потенциальными ингибиторами металлопротеазы. В соответствии с настоящим изобретением специалист в данной области может подвергнуть указанные белковые гидролизаты скринингу на способность ингибировать (и стабилизировать против автолиза) целевую металлопротеазу. В действительности многие из указанных смесей белковых гидролизатов получены путем гидролиза распространенного белка (например, казеина). Следовательно, можно ожидать, что смесь содержит полипептидные фрагменты, которые имеют структуру, подобную структуре ингибитора металлопротеазы, и, следовательно, способны выполнять подобную функцию. Как описано ниже, функцию белкового гидролизата можно легко определить с помощью хорошо известных методов ферментативной кинетики.
В одном варианте осуществления используемые в настоящем изобретении ингибиторы металлопротеазы являются конкурентными ингибиторами, выбранными на основе наблюдаемого значения Ki, определенного при взаимодействии с представляющей интерес металлопротеазой. Таким образом, в одном варианте осуществления кажущуюся Ki белковых гидролизатов по настоящему изобретению можно измерить с помощью стандартных, хорошо известных методов равновесной ферментативной кинетики. Кажущаяся Ki продуктов NprE-опосредованного гидролиза казеина с ММ менее примерно 5000 Да, определенная с помощью равновесного кинетического анализа, составляет примерно 10 мМ.
Как показано ниже в примере 2, композиция продукта гидролиза казеина под действием нейтральной металлопротеазы действует как конкурентный ингибитор фермента. В одном варианте осуществления настоящее изобретение относится к применение белковых гидролизатов, которые имеют кажущуюся Ki менее чем примерно 15 мМ, примерно 10 мМ, примерно 5 мМ, примерно 0,5 мМ или меньше. Определяют значения кажущейся Ki, поскольку композиции ферментных гидролизатов представляют собой гетерогенную смесь пептидов, и некоторые пептиды могут действовать как слабые ингибиторы или совсем не являются ингибиторами фермента.
В случае относительно очищенной, относительно гомогенной композиции белкового гидролизата значения измеряемой Ki примерно в 100-1000 раз меньше и находятся в интервале Ki ~1-10 мкМ.
В настоящем изобретении предполагается, что оптимальное ингибирование, как правило, наблюдается в том случае, если металлопротеаза находится в смеси с ингибитором, концентрация которого примерно в 5-10 раз, примерно в 5-100 раз или больше превосходит значение Ki, измеренное для взаимодействия ингибитора с металлопротеазой.
Основываясь на пригодности белковых гидролизатов для использования в качестве ингибиторов металлопротеазы в детергентных составах, настоящее изобретение также относится к стабилизированной ингибитором композиции металлопротеазы, которую можно использовать в качестве предшественника для получения жидких детергентных составов или для других применений, включая получение чистящих композиций. В данном варианте осуществления настоящее изобретение относится к стабилизированной ингибитором композиции металлопротеазы, которая содержит от примерно 0,001% до примерно 10% по массе нейтральной металлопротеазы, и конкурентный ингибитор связан с по меньшей мере примерно 90% молекул указанной нейтральной металлопротеазы. Такая стабилизированная ингибитором композиция может находиться в виде жидкого или сухого (например, гранулированного) препарата. В другом варианте осуществления стабилизированная ингибитором композиция металлопротеазы представляет собой инкапсулированную частицу.
Чтобы получить сухую композицию, сначала получают связанный с ингибитором фермент путем контактирования находящегося в растворе фермента с белковым субстратом (например, казеином) или с белковым гидролизатом (например, Amisoy) в концентрации, которая обеспечивает связывание по меньшей мере примерно 90% молекул металлопротеазы с гидролизатным ингибитором. Затем полученный раствор дегидратируют, например, путем лиофилизации, сушки замораживанием и/или с помощью других методов, хорошо известных в области белковых составов. Полученную высушенную композицию связанного с ферментом ингибитора необязательно хранят до последующего использования в производстве жидкого детергентного состава, содержащего стабилизированную ингибитором металлопротеазу, путем добавления воды и других ингредиентов детергентного состава.
Альтернативно, стабилизированную ингибитором композицию металлопротеазы можно использовать для получения состава в виде инкапсулированной частицы.
Таким образом, в другом варианте осуществления стабилизированную ингибитором композицию металлопротеазы используют для получения детергентного состава путем объединения композиции с: (a) водой; (b) детергентным поверхностно-активным веществом, содержание которого составляет от примерно 0,1% до примерно 75% по массе; (c) пропиленгликолем, содержание которого составляет от примерно 5% до примерно 15% по массе; и (d) ионом Ca2+, содержание которого составляет от примерно 0,5 мМ до примерно 5,0 мМ.
Таким образом, в одном варианте осуществления настоящее изобретение относится к стабилизированному ингибитором составу нейтральной металлопротеазы, содержащему нейтральную металлопротеазу и ингибитор, где ингибитор представляет собой белковый гидролизат, полученный под действием фермента, и концентрация ингибитора в составе в по меньшей мере примерно 5 раз превышает кажущуюся Ki белкового гидролизата, определенную при взаимодействии с нейтральной металлопротеазой. В одном варианте осуществления кажущаяся Ki составляет от примерно 5 мМ до примерно 15 мМ, и концентрация белкового гидролизата в составе составляет по меньшей мере примерно 25 мМ, примерно 35 мМ, примерно 50 мМ или более.
Абсолютное количество ингибитора, используемое в составах или композициях по настоящему изобретению, может варьировать в зависимости от аффинности связывания ингибитора (т.е. Ki), молекулярной массы ингибитора, концентрации фермента и других факторов. Однако обычно количество ингибитора, используемое в вариантах осуществления жидкого детергентного состава по настоящему изобретению, составляет от примерно 0,01% до примерно 15%, от примерно 0,05% до примерно 5% или от примерно 0,1% до примерно 2,5% по массе до разбавления, связанного с использованием композиции для мытья.
В одном альтернативном варианте осуществления конкретный белковый субстрат может быть получен методами молекулярной биологии (например, сайт-направленного мутагенеза) таким образом, чтобы после его ферментативного превращения под действием конкретной нейтральной металлопротеазы можно было получить продукт гидролиза с более благоприятными характеристиками ингибирования. Такой вариантный белковый субстрат можно использовать для получения стабилизированной ингибитором композиции нейтральной металлопротеазы.
Векторы и клетки-хозяева, совместно экспрессирующие белковые субстраты, используемые для стабилизации нейтральной металлопротеазы
В одном варианте осуществления настоящее изобретение относится к вектору экспрессии, содержащему ген нейтральной металлопротеазы и ген белкового субстрата, где продукт гена белкового субстрата ферментативно превращается под действием экспрессированной нейтральной металлопротеазы в ингибиторный белковый гидролизат. После клонирования вектор, содержащий гены нейтральной металлопротеазы и белкового субстрата, можно ввести в клетку-хозяина (с помощью хорошо известных методов трансформации или трансфекции клеток), чтобы обеспечить совместную экспрессию продуктов генов двух белков.
Поскольку белковый субстрат совместно экспрессируется с нейтральной металлопротеазой, белковый субстрат может быть сразу подвергнут ферментативному превращению под действием металлопротеазы, с образованием белкового продукта гидролиза (т.е. белкового гидролизата). Как описано в данном описании, полученный белковый гидролизат способен ингибировать нейтральную металлопротеазу, обеспечивая повышенную защиту экспрессируемого фермента от автолитической деградации.
В данном варианте осуществления вектор совместной экспрессии содержит элементы, необходимые для эффективной экспрессии генов (например, промотор, функционально связанный с представляющим интерес геном). В некоторых вариантах осуществления указанными необходимыми элементами являются промотор, гомологичный гену, если он распознается (т.е. транскрибируется хозяином), терминатор транскрипции (участок полиаденилирования в случае эукариотических клеток-хозяев), который является экзогенным или эндогенным концевым участком гена нейтральной металлопротеазы. В некоторых вариантах осуществления в состав вектора также вводят ген селекции, такой как ген устойчивости к антибиотику, который позволяет инфицированным плазмидой клеткам-хозяевам сохранять жизнеспособность в течение длительного времени при культивировании в среде, содержащей противомикробное средство.
В предпочтительном варианте осуществления генный элемент, контролирующий продукцию белкового субстрата, функционально связан с отдельным промотором, который увеличивает продукцию только белкового субстрата, но не белка нейтральной металлопротеазы. Следовательно, при экспрессии вектора в подходящем хозяине продуцируется больше продукта гена белкового субстрата, чем металлопротеазы. Повышенное отношение белкового субстрата к металлопротеазе в ферментационном бульоне приводит к увеличению количества продукта гидролиза и, как следствие, к повышению его способности связываться с молекулой металлопротеазы и ингибировать автолитическую деградацию.
В другом варианте осуществления генные элементы, контролирующие продукцию нейтральной металлопротеазы и белкового субстрата, находятся на разных векторах (например, плазмидах), которые трансфицируют в одного хозяина. В данном варианте осуществления также предпочтительно, чтобы ген белкового субстрата был функционально связан с промотором, обеспечивающим его продукцию на более высоком уровне, чем продукция металлопротеазы.
В одном варианте осуществления клетку-хозяина и вектор выбирают таким образом, чтобы совместно экспрессируемые белки секретировались во внеклеточный ферментационный бульон.
В некоторых вариантах осуществления вектор совместной экспрессии представляет собой плазмиду, реплицирующуюся в клетке-хозяине. В одном варианте осуществления используемая плазмида содержит хорошо известные элементы, необходимые для репликации плазмиды. Альтернативно, плазмиду можно сконструировать таким образом, чтобы она интегрировалась в хромосому хозяина.
Методы рекомбинантного клонирования, экспрессии и ферментации нейтральной металлопротеазы из B. amyloliquifaciens, NprE, кодируемой плазмидным вектором, введенным в хозяина B. subtilis, раскрыты в патентной заявке США №11/581102, поданной 12 октября 2006 г., которая включена в данное описание посредством ссылки. В одном варианте осуществления настоящего изобретения указанную систему экспрессии NprE адаптируют для совместной экспрессии с белковым субстратом фермента NprE. В предпочтительном варианте осуществления совместно экспрессируемый белковый субстрат представляет собой казеин.
Детергентные составы и чистящие композиции
Стабилизированные ингибитором композиции металлопротеаз по настоящему изобретению используют для получения различных детергентных составов и чистящих композиций. Указанные составы и композиции преимущественно могут использоваться, например, для стирки, очистки твердых поверхностей, автоматического мытья посуды, а также для косметических применений, таких как очистка зубных протезов и зубов, мытье волос и кожи. Однако вследствие повышенной эффективности в растворах с пониженной температурой и превосходного профиля цветосберегающих свойств ферментов нейтральных металлопротеаз по настоящему изобретению, стабилизированные ингибитором композиции идеально подходят для стирки.
В дополнение к раскрытым в данном описании, широкий ряд детергентных составов и чистящих композиций, подходящих для применения со стабилизированными ингибитором металлопротеазами по настоящему изобретению, описан в патентной заявке США №11/581102, поданной 12 октября 2006 г., которая включена в данное описание посредством ссылки.
Если не указано иное, в данном описании все уровни компонентов или композиций приводятся со ссылкой на активный уровень компонента или композиции при отсутствии примесей, например, остаточных растворителей или побочных продуктов, которые могут присутствовать в коммерчески доступных источниках. Массы ферментных компонентов приводятся в отношении общего активного белка. Если не указано иное, все проценты и соотношения рассчитывают по массе. Если не указано иное, все проценты и соотношения рассчитывают по отношению к общей массе композиции.
В примерах детергентных составов и чистящих композиций уровни фермента выражают в виде отношения массы чистого фермента к общей массе композиции и, если не указано иное, уровни детергентных ингредиентов выражают в виде отношения их массы к общей массе композиции.
В одном варианте осуществления детергентные составы и чистящие композиции по настоящему изобретению содержат по меньшей мере: (1) поверхностно-активные вещества, предпочтительно неионные или анионные поверхностно-активные вещества; (2) от примерно 10% до примерно 95% воды по массе; (3) фермент металлопротеазы; и (4) ингибитор металлопротеазы.
В других вариантах осуществления такой простой детергентный состав может дополнительно содержать ряд других веществ (т.е. вспомогательных веществ), выбранных из группы, состоящей из: других поверхностно-активных веществ, добавок, повышающих моющее действие, хелатирующих средств, средств, ингибирующих перенос красителя, осаждающих средств, диспергирующих средств, других ферментов, стабилизаторов ферментов, каталитических веществ, активаторов отбеливания, усилителей отбеливания, пероксида водорода, источников пероксида водорода, полученных заранее перкислот, полимерных диспергирующих средств, средств, удаляющих глинистую почву/препятствующих переотложению, блескообразующих средств, средств, подавляющих пенообразование, красителей, отдушек, средств, пластифицирующих структуру, мягчителей тканей, носителей, гидротропных веществ, средств, облегчающих обработку и/или пигментов.
В одном варианте осуществления изобретение относится к жидкому детергентному составу, содержащему: (a) от примерно 1% до примерно 75% поверхностно-активного вещества по массе; (b) от примерно 10% до примерно 95% воды по массе; (c) от примерно 0,01% до примерно 5% нейтральной металлопротеазы по массе; и (d) количество ингибитора нейтральной металлопротеазы, такое, что ингибитор связывается с по меньшей мере 90% молекул нейтральной металлопротеазы перед применением, причем соответствующее разбавление детергентного состава приводит к диссоциации ингибитора с по меньшей мере примерно 25% связанных молекул нейтральной металлопротеазы. Как правило, соответствующее разбавление происходит, когда жидкий детергентный состав добавляют к большому объему промывочной воды, что приводит к разбавлению детергентного состава в 200, 400, 500, 600 или даже 1000 раз.
В другом варианте осуществления указанного жидкого детергентного состава, после разбавления указанного детергента более или равного 45%, 65%, 75%, 85% или даже 95% связанного с ингибитором фермента нейтральной металлопротеазы высвобождается в виде формы, не содержащей ингибитора. В одном варианте осуществления ингибитор, входящий в состав, конкурентно ингибирует нейтральную металлопротеазу с кажущейся Ki в интервале от примерно 5 мМ до примерно 15 мМ при значении рН, составляющем от примерно 6,5 до примерно 11, предпочтительно, от примерно 7,5 до примерно 9,5. В предпочтительном варианте осуществления жидкий детергентный состав содержит ингибиторный белковый гидролизат, имеющий кажущуюся Ki ~10 мМ при pH примерно 8,0.
В одном варианте осуществления жидкого детергентного состава, предлагаемого настоящим изобретением, выбранный ингибитор металлопротеазы представляет собой белковый гидролизат. В предпочтительном варианте осуществления ингибитор металлопротеазы представляет собой белковый гидролизат, полученный в результате гидролиза белка под действием металлопротеазы. В другом варианте осуществления металлопротеаза представляет собой NprE, и ингибитор представляет собой продукт гидролиза казеина коровьего молока под действием NprE. В другом варианте осуществления ингибитор представляет собой белковый гидролизат, выбранный из группы, состоящей из: гидролизата пшеничной клейковины (например, HyPep 4601TM), кислого гидролизата соевого белка (например, Amisoy), кислого гидролизата казеина коровьего молока (например, Amicase), ферментативного гидролизата растительного белка (например, протеозопептон), а также любых их комбинаций.
Составы нейтральной металлопротеазы, стабилизированные ингибиторными белковыми гидролизатами по настоящему изобретению, в особенности подходят для применения в высокоэффективных жидких (HDL) детергентных составах.
В одном варианте осуществления стабилизированную ингибитором композицию металлопротеазы по настоящему изобретению можно включить в детергентный состав HDL, который содержит: от примерно 30% до примерно 60% по массе воды; от примерно 45% до примерно 15% по массе активных ингредиентов, соответственно; где отношение детергентного состава HDL к стабилизированной ингибитором композиции металлопротеазы составляет от примерно 9 до примерно 1 по объему.
В некоторых вариантах осуществления, состав HDL содержит от примерно 33% до примерно 53%, от примерно 35% до примерно 51% или от примерно 36% до примерно 44% воды по массе. В некоторых вариантах осуществления состав HDL содержит примерно 40%, 38%, 36%, 34%, 32%, 30% или меньше % воды по массе.
В одном варианте осуществления детергентные составы HDL по настоящему изобретению дополнительно содержат от примерно 5% до примерно 15%, от примерно 7,5% до примерно 12,5% или по меньшей мере примерно 10% пропиленгликоля.
В одном варианте осуществления детергентные составы HDL по настоящему изобретению содержат от примерно 20% до примерно 50% поверхностно-активных веществ по массе. В некоторых вариантах осуществления состав HDL содержит смесь поверхностно-активных веществ, выбранных из группы, состоящей из: этоксилатов C12 (Alfonic 1012-6, Hetoxol LA7, Hetoxol LA4), алкилбензолсульфонатов натрия (например, Nacconol 90G), этерифицированного лаурилсульфата натрия (например, Steol CS-370) и любых их комбинаций. В некоторых вариантах осуществления состав HDL содержит одно или несколько поверхностно-активных веществ, выбранных из алкилбензолсульфонатов, сульфатов простых алкиловых эфиров и этоксилатов спиртов.
В одном варианте осуществления детергентный состав HDL по настоящему изобретению содержит от примерно 35% до примерно 52% воды по массе и от примерно 24% до примерно 40% поверхностно-активных веществ по массе, где поверхностно-активные вещества включают: Nacconol 90G, Alfonic 1012-6 и Steol CS-370. В другом варианте осуществления конкретное отношение по объему воды и поверхностно-активных веществ в составе HDL (если принять, что всего 90 частей) составляет: 30 частей воды, 17 частей Nacconol 90G, 13 частей Alfonic 1012-6 и 10 частей Steol CS-370. Для специалистов в данной области будет очевидно, что можно получить альтернативные составы HDL по настоящему изобретению, содержащие эквивалентные поверхностно-активные вещества в подобных количествах.
В таблицах 1-5 (ниже) приведены составы ряда конкретных составов HDL, которые можно использовать в соответствии с настоящим изобретением. Такие конкретные составы, содержащие различные количества воды и других активных ингредиентов, объединяют со стабилизированной ингибитором композицией металлопротеазы в соотношении 90 к 10. В предпочтительном варианте осуществления жидкие детергентные составы содержат стабилизированную ингибитором металлопротеазу (предпочтительно металлопротеазу, стабилизированную белковым гидролизатом) и ингредиенты любой из конкретных детергентных составов HDL в соотношениях, указанных в таблицах 1-5.
Конкретные детергентные составы HDL: DW-CR, DW-CS и DW-CT
2 Включает воду, добавленную в чистом виде, помимо воды, присутствующей в тетраборате натрия, борной кислоте, этаноле и Steol CS370. Количество воды в тетраборате натрия и борной кислоте рассчитывают исходя из формулы Na2B4O5(OH)4×8H2O.
Конкретные детергентные составы HDL: DW-AA, DW-AF и DW-AK
2 Включает воду, добавленную в чистом виде, помимо воды, присутствующей в тетраборате натрия, борной кислоте, этаноле и Steol CS370. Количество воды в тетраборате натрия и борной кислоте рассчитывают исходя из формулы Na2B4O5(OH)4×8H2O.
Конкретные детергентные составы HDL: DW-CO, DW-CP и DW-CQ
2 Включает воду, добавленную в чистом виде, помимо воды, присутствующей в тетраборате натрия, борной кислоте, этаноле и Steol CS370. Количество воды в тетраборате натрия и борной кислоте рассчитывают исходя из формулы Na2B4O5(OH)4×8H2O.
3 "TSP" = додекагидрат ортофосфата тринатрия, 0,25М гидроксид натрия.
Конкретные детергентные составы HDL: DW-BL, DW-BN и DW-BP
2 Включает воду, добавленную в чистом виде, помимо воды, присутствующей в тетраборате натрия, борной кислоте, этаноле и Steol CS370. Количество воды в тетраборате натрия и борной кислоте рассчитывают исходя из формулы Na2B4O5(OH)4×8H2O.
3 "TSP" = додекагидрат ортофосфата тринатрия, 0,25М гидроксид натрия.
Конкретные детергентные составы HDL: DW-BV и DW-CF
Подразумевается, что приведенные выше в таблицах конкретные составы HDL не являются ограничивающими. В одном варианте осуществления любой из них можно использовать в качестве основы для получения коммерческих составов HDL, которые содержат ряд других вспомогательных средств. Однако стабилизированные ингибитором композиции металлопротеаз по настоящему изобретению можно включать в другие подходящие составы HDL, известные в данной области. Такие составы HDL могут содержать ряд различных комбинаций буферов, поверхностно-активных веществ и/или других вспомогательных средств.
Детергентные составы, чистящие композиции и чистящие добавки по настоящему изобретению содержат эффективное количество фермента металлопротеазы. В некоторых вариантах осуществления необходимый уровень фермента обеспечивают путем добавления одного или нескольких видов металлопротеазы. Как правило, детергентные составы по настоящему изобретению содержат фермент металлопротеазы в количестве, составляющем примерно 0,0001-10%, более предпочтительно, примерно 0,001-5% и, наиболее предпочтительно, примерно 0,01-2,0% по массе детергентного состава до применения (т.е. в форме, в которой он хранится), при условии, что активность фермента составляет 100%. Активность фермента нужно учитывать при получении любых составов по настоящему изобретению.
В некоторых предпочтительных вариантах осуществления детергентные составы и чистящие композиции, предлагающиеся в данном описании, обычно получают таким образом, чтобы при применении в водной среде рН промывочной воды составлял от примерно 5,0 до примерно 11,5 или в альтернативных вариантах осуществления даже от примерно 6,0 до примерно 10,5. В некоторых предпочтительных вариантах осуществления жидкие продукты состава обычно получают таким образом, чтобы их чистый pH составлял от примерно 3,0 до примерно 9,0, тогда как в некоторых альтернативных вариантах осуществления чистое значение рН композиции составляет от примерно 3 до примерно 5. В некоторых вариантах осуществления гранулированные стиральные средства обычно получают таким образом, чтобы рН составлял от примерно 8 до примерно 11. Способы поддержания рН на рекомендованном уровне, включающие использование буферов, щелочей, кислот и др., хорошо известны специалистам в данной области.
Составы инкапсулированных частиц
В некоторых вариантах осуществления стабилизированную ингибитором нейтральную металлопротеазу можно использовать в составе гранулированной или жидкой композиции, где нейтральная металлопротеаза, образующая комплекс с ингибитором, находится в форме инкапсулированной частицы, которая защищает комплекс от других компонентов состава при хранении. Инкапсулирование обеспечивает дополнительные средства контролирования доступности стабилизированной ингибитором нейтральной металлопротеазы при очистке и может повышать эффективность стабилизированной ингибитором нейтральной металлопротеазы. Предполагается, что инкапсулированную стабилизированную ингибитором нейтральную металлопротеазу по настоящему изобретению можно использовать для различных применений. Также предполагается, что стабилизированную ингибитором нейтральную металлопротеазу можно инкапсулировать, используя любые подходящие капсулирующие вещества, с помощью известных в данной области способов.
В некоторых предпочтительных вариантах осуществления в капсулы заключается по меньшей мере часть стабилизированной ингибитором нейтральной металлопротеазы. В некоторых вариантах осуществления капсулирующее вещество является водорастворимым и/или вододиспергируемым. В некоторых других вариантах осуществления капсулирующее вещество имеет температуру стеклования (Tg) 0°C или выше (более подробную информацию, касающуюся температур стеклования, можно найти, например, в WO 97/11151, в частности, начиная со страницы 6, строка 25, до примерно страницы 7, строка 2).
В некоторых вариантах осуществления используют капсулирующее вещество, выбранное из группы, состоящей из углеводов, природных или синтетических камедей, хитина и хитозана, целлюлозы и производных целлюлозы, силикатов, фосфатов, боратов, поливинилового спирта, полиэтиленгликоля, парафиновых восков и их комбинаций. В некоторых вариантах осуществления, в которых капсулирующее вещество представляет собой углевод, его выбирают из группы, состоящей из моносахаридов, олигосахаридов, полисахаридов и их комбинаций. В некоторых вариантах осуществления капсулирующее вещество представляет собой крахмал (описание некоторых примеров подходящих крахмалов можно найти, например, в EP 0922499; US 4977252, US 5354559 и US 5935826).
В других вариантах осуществления капсулирующее вещество включает микросферы, полученные из пластика (такого как термопластик, акрилонитрил, метакрилонитрил, полиакрилонитрил, полиметакрилонитрил и их смеси; пригодные для применения коммерчески доступные микросферы включают, но без ограничения EXPANCEL® [Casco Products, Stockholm, Sweden], PM 6545, PM 6550, PM 7220, PM 7228, EXTENDOSPHERES® и Q-CEL® [PQ Corp., Valley Forge, PA], LUXSIL® и SPHERICELL® [Potters Industries, Inc., Carlstadt, NJ and Valley Forge, PA]).
Составы чистящих добавок
Стабилизированные ингибитором композиции металлопротеаз по настоящему изобретению также можно использовать для получения чистящих добавок. Чистящая добавка, содержащая по меньшей мере один фермент по настоящему изобретению, идеально подходит для моющего процесса, в котором требуется дополнительная эффективность отбеливания. Такие случаи включают, но без ограничения, очистку в растворе при низкой температуре. Добавка, в самом простом виде, может представлять собой одну или несколько стабилизированных ингибитором нейтральных металлопротеаз по настоящему изобретению. В некоторых вариантах осуществления добавка предоставляется в виде дозированной формы для добавления в процесс очистки, в котором используется пероксид и требуется повышенная эффективность отбеливания. В некоторых вариантах осуществления дозированная форма для однократного применения включает пилюлю, таблетку, гелевую капсулу или другую однократную дозированную форму, такую как заранее отмеренное количество порошка и/или жидкости.
В некоторых вариантах осуществления, чтобы увеличить объем такой композиции, в ее состав вводят наполнитель (наполнители) и/или носитель (носители). Подходящие наполнители или носители включают, но без ограничения, различные соли, такие как сульфаты, карбонаты и силикаты, а также тальк, глину и т.п. В некоторых вариантах осуществления наполнители и/или носители, используемые в жидких составах, включают воду и/или низкомолекулярные первичные и вторичные спирты, включая, полиолы и диолы. Примеры таких спиртов включают, но без ограничения, метанол, этанол, пропанол и изопропанол. В некоторых вариантах осуществления композиции содержат от примерно 5% до примерно 90% таких веществ. В других вариантах осуществления, чтобы уменьшить рН композиции, используют кислые наполнители. В некоторых альтернативных вариантах осуществления чистящая добавка содержит по меньшей мере один источник активированного пероксида, как описано ниже, и/или вспомогательные ингредиенты, более полно описанные ниже.
Способы получения и применения детергентных составов и чистящих композиций
Стабилизированные ингибитором композиции металлопротеаз по настоящему изобретению можно ввести в состав любых подходящих детергентных составов или чистящих композиций с помощью любого подходящего способа, выбранного разработчиком. Способы получения таких композиций хорошо известны в данной области. См., например, патент США 5879584, патент США 5691297, патент США 5574005, патент США 5569645, патент США 5565422, патент США 5516448, патент США 5489392, патент США 5486303, патент США 4515705, патент США 4537706, патент США 4515707, патент США 4550862, патент США 4561998, патент США 4597898, патент США 4968451, патент США 5565145, патент США 5929022, патент США 6294514 и патент США 6376445, каждый из которых включен в данное описание посредством ссылки.
В предпочтительных вариантах осуществления детергентные составы и чистящие композиции по настоящему изобретению можно использовать для мытья тканей и поверхностей. В некоторых вариантах осуществления по меньшей мере часть поверхности и/или ткани контактирует по меньшей мере с одним вариантом осуществления чистящих композиций по настоящему изобретению, в чистом виде или после разбавления моющей жидкостью, затем поверхность и/или ткань необязательно промывают и/или ополаскивают. Для целей настоящего изобретения "промывание" включает, но без ограничения, промывку и механическое перемешивание. С помощью составов по настоящему изобретению можно чистить любые ткани, подходящие для стирки в нормальных условиях.
В предпочтительных вариантах осуществления концентрации детергентных составов и чистящих композиций по настоящему изобретению в растворе составляют от примерно 500 ч./млн до примерно 15000 ч./млн. В вариантах осуществления, в которых промывочный растворитель представляет собой воду, ее температура обычно варьирует от примерно 5°C до примерно 90°C. В некоторых предпочтительных вариантах осуществления, касающихся очистки тканей, отношение массы воды к массе тканей обычно составляет от примерно 1:1 до примерно 30:1.
Вспомогательные средства, используемые в настоящем изобретении
В данном описании приводится неограничивающий список вспомогательных средств, подходящих для применения в некоторых вариантах осуществления чистящих композиций по настоящему изобретению, хотя для достижения целей изобретения такое применение не является обязательным. В действительности, в некоторых вариантах осуществления в состав чистящих композиций по настоящему изобретению входят вспомогательные средства. В некоторых вариантах осуществления вспомогательные вещества используют для облегчения очистки и/или повышения ее эффективности, обработки подлежащего очистке субстрата и/или модификации эстетических характеристик чистящей композиции (например, отдушки, пигменты, красители и др.). Подразумевается, что такие вспомогательные средства добавляют к составам и композициям, которые содержат стабилизированные ингибитором композиции металлопротеаз по настоящему изобретению. Точная природа указанных дополнительных компонентов, а также их содержание зависят от физической формы композиции и вида чистящей операции, в которой используют композицию.
Подходящие вспомогательные средства включают, но без ограничения, поверхностно-активные вещества, добавки, повышающие моющее действие, хелатирующие средства, средства, ингибирующие перенос красителя, осаждающие средства, диспергирующие средства, другие ферменты, стабилизаторы ферментов, каталитические вещества, активаторы отбеливания, усилители отбеливания, пероксид водорода, источники пероксида водорода, полученные заранее перкислоты, полимерные диспергирующие средства, средства, удаляющие глинистую почву/препятствующие переотложению, блескообразующие средства, средства, подавляющие пенообразование, красители, отдушки, средства, эластифицирующие структуру, мягчители тканей, носители, гидротропные вещества, средства, облегчающие обработку и/или пигменты.
В дополнение к предлагающимся в настоящем описании в данной области известны и другие вспомогательные вещества. (см., например, патенты США №№5576282, 6306812 B1 и 6326348 B1.) В некоторых вариантах осуществления указанные выше вспомогательные ингредиенты уравновешивают составы и композиции по настоящему изобретению.
Поверхностно-активные вещества - В некоторых вариантах осуществления чистящие композиции по настоящему изобретению содержат по меньшей мере одно поверхностно-активное вещество или систему поверхностно-активных веществ, где поверхностно-активное вещество выбрано из неионных поверхностно-активных веществ, анионных поверхностно-активных веществ, катионных поверхностно-активных веществ, амфолитических поверхностно-активных веществ, цвиттерионных поверхностно-активных веществ, семиполярных неионных поверхностно-активных веществ и их смесей. Примеры поверхностно-активных веществ, которые можно использовать в детергентных составах по настоящему изобретению, содержащих стабилизированную ингибитором металлопротеазу, по отдельности или в смесях, включают: этоксилаты C12 (Alfonic 1012-6, Hetoxol LA7, Hetoxol LA4), алкилбензолсульфонаты натрия (например, Nacconol 90G) и этерифицированный лаурилсульфат натрия (например, Steol CS-370).
В некоторых вариантах осуществления чистящих композиций с низкими значениями рН (например, в случае композиций, имеющих чистые значения рН от примерно 3 до примерно 5) композиция обычно не содержит этоксилированный алкилсульфат, поскольку полагают, что указанный тип поверхностно-активного вещества может гидролизоваться под действием композиции в таких кислых условиях.
В некоторых вариантах осуществления содержание поверхностно-активных веществ составляет от примерно 0,1% до примерно 75%, тогда как в альтернативных вариантах осуществления их содержание составляет от примерно 1% до примерно 50%, и в следующих вариантах осуществления их содержание составляет от примерно 5% до примерно 40% от массы чистящей композиции.
Добавки, повышающие моющее действие - В некоторых вариантах осуществления чистящие композиции по настоящему изобретению одну или несколько детергентных добавок, повышающих моющее действие, или систему детергентных добавок, повышающих моющее действие. В некоторых вариантах осуществления, содержащих по меньшей мере одну добавку, повышающую моющее действие, чистящие композиции содержат по меньшей мере примерно 1%, от примерно 3% до примерно 60%, или даже от примерно 5% до примерно 40% добавки, повышающей моющее действие, от массы чистящей композиции.
Добавки, повышающие моющее действие, включают, но без ограничения, полифосфатные соли щелочных металлов, аммония и алканоламмония, силикаты щелочных металлов, карбонаты щелочноземельных и щелочных металлов, алюмосиликатные добавки поликарбоксилатные соединения, простые эфиры гидроксиполикарбоксилаты, сополимеры малеинового ангидрида и этилена или винилметилового эфира, 1,3,5-тригидроксибензол-2,4,6-трисульфоновую кислоту и карбоксиметилоксиянтарную кислоту, различные полиацетатные соли щелочных металлов, аммония и замещенного аммония, такие как этилендиаминтетрауксусная кислота и нитрилотриуксусная кислота, а также поликарбоксилаты, такие как меллитовая кислота, янтарная кислота, лимонная кислота, оксидиянтарная кислота, полималеиновая кислота, бензол-1,3,5-трикарбоновая кислота, карбоксиметилоксиянтарная кислота и их растворимые соли. В действительности предполагается, что любую подходящую добавку, повышающую моющее действие, можно использовать в различных вариантах осуществления настоящего изобретения.
Хелатирующие средства - В некоторых вариантах осуществления чистящие композиции по настоящему изобретению содержат по меньшей мере одно хелатирующее средство. Подходящие хелатирующие средства включают, но без ограничения, средства, образующие хелатные комплексы с медью, железом и/или марганцем, а также их смеси. В вариантах осуществления, в которых используется по меньшей мере одно хелатирующее средство, чистящие композиции по настоящему изобретению содержат от примерно 0,1% до примерно 15%, или даже от примерно 3,0% до примерно 10% хелатирующего средства от массы рассматриваемой чистящей композиции.
Осаждающие средства - В некоторых вариантах осуществления чистящие композиции по настоящему изобретению содержат по меньшей мере одно осаждающее средство. Подходящие осаждающие средства включают, но без ограничения, полиэтиленгликоль, полипропиленгликоль, поликарбоксилат, полимеры, высвобождающие грязь, такие как политерефталевая кислота, глины, такие как каолинит, монтмориллонит, аттапульгит, иллит, бентонит, галлуазит и их смеси.
Средства, ингибирующие перенос красителя - В некоторых вариантах осуществления чистящие композиции по настоящему изобретению содержат одно или несколько средств, ингибирующих перенос красителя. подходящие полимерные средства, ингибирующие перенос красителя, включают, но без ограничения, полимеры на основе поливинилпирролидона, полимеры на основе N-оксида полиамина, сополимеры N-винилппирролидона и N-винилимидазола, поливинилоксазолидоны и поливинилимидазолы или их смеси.
В вариантах осуществления, в которых используется по меньшей мере одно средство, ингибирующее перенос красителя, чистящие композиции по настоящему изобретению содержат от примерно 0,0001% до примерно 10%, от примерно 0,01% до примерно 5% или даже от примерно 0,1% до примерно 3% средства, ингибирующего перенос красителя, от массы чистящей композиции.
Диспергирующие средства - В некоторых вариантах осуществления чистящие композиции по настоящему изобретению содержат по меньшей мере одно диспергирующее средство. Подходящие водорастворимые органические диспергирующие средства включают, но без ограничения, гомо- или сополимерные кислоты или их соли, где поликарбоновая кислота содержит по меньшей мере два карбоксильных радикала, отделенных друг от друга не более чем двумя атомами углерода.
Ферменты - В некоторых вариантах осуществления чистящие композиции по настоящему изобретению содержат один или несколько детергентных ферментов помимо металлопротеазы, описанной в данном описании, которые обеспечивают проведение очистки и/или уход за тканью. Примеры подходящих ферментов включают, но без ограничения, гемицеллюлазы, пероксидазы, протеазы, целлюлазы, ксиланазы, липазы, фосфолипазы, эстеразы, кутиназы, пектиназы, кератиназы, редуктазы, оксидазы, фенолоксидазы, липоксигеназы, лигниназы, пуллуланазы, танназы, пентозаназы, маланазы, β-глюканазы, арабинозидазы, гиалуронидазу, хондроитиназу, лакказу и амилазы или их смеси. В некоторых вариантах осуществления используют комбинацию ферментов (т.е. "коктейль"), включающее традиционно используемые ферменты, такие как протеаза, липаза, кутиназа и/или целлюлаза, и амилазу.
Стабилизаторы ферментов - В некоторых вариантах осуществления настоящего изобретения ферменты, используемые в детергентных составах по настоящему изобретению, стабилизируют. Подразумевается. что в настоящем изобретении можно использовать различные методы стабилизации ферментов. Например, в некоторых вариантах осуществления описанные в данном описании ферменты стабилизируют путем добавления в конечную композицию водорастворимых источников ионов цинка (II), кальция (II) и/или магния (II), которые предоставляют такие ионы ферментам, а также источников ионов других металлов (например, бария (II), скандия (II), железа (II), марганца (II), алюминия (III), олова (II), кобальта (II), меди (II), никеля (II) и оксованадия (IV)).
Каталитические комплексы металлов - В некоторых вариантах осуществления чистящие композиции по настоящему изобретению содержат один или несколько каталитических комплексов металлов. В некоторых вариантах осуществления используют содержащий металл катализатор отбеливания. В некоторых предпочтительных вариантах осуществления содержащий металл катализатор отбеливания включает каталитическую систему, содержащую катион переходного металла, обладающий определенной способностью катализировать отбеливание (такой как катион меди, железа, титана, рутения, вольфрама, молибдена или марганца), вспомогательный катион металла, у которого способность катализировать отбеливание отсутствует или находится на низком уровне (такой как катион цинка или алюминия), и разделяющий фрагмент, обладающий определенными константами стабильности по отношению к каталитическим и вспомогательным катионам металлов, в частности, этилендиаминтетрауксусная кислота, этилендиаминтетра(метиленфосфоновая кислота) и их водорастворимые соли (см., например, патент США 4430243).
В некоторых вариантах осуществления каталитическая активность чистящих составов по настоящему изобретению обусловлена соединением марганца. Такие соединения и их используемые уровни хорошо известны в данной области (см., например, патент США 5576282). В других вариантах осуществления чистящих составах по настоящему изобретению используют кобальтовые катализаторы отбеливания. В данной области известно много кобальтовых катализаторов отбеливания (см., например, патенты США 5597936 и 5595967). Такие кобальтовые катализаторы можно легко получить известными способами (см., например, патенты США 5597936 и 5595967).
В дополнительных вариантах осуществления чистящие композиции по настоящему изобретению содержат комплекс переходного металла с макрополициклическим жестким лигандом ("MRL"). В качестве практического примера, но не для ограничения, некоторые варианты осуществления композиций и процессов очистки, предлагаемых настоящим изобретением, осуществляют с использованием по меньшей мере одной части на сто миллионов активных видов MRL в водной промывочной среде, и в некоторых предпочтительных вариантах осуществления от примерно 0,005 ч./млн до примерно 25 ч./млн, более предпочтительно, от примерно 0,05 .ч/млн до примерно 10 ч./млн и, наиболее предпочтительно, от примерно 0,1 ч./млн до примерно 5 ч./млн MRL в промывочной жидкости.
Предпочтительные переходные металлы, входящие в состав растворимого катализатора отбеливания, включают, но без ограничения, марганец, железо и хром. Предпочтительные MRL также включают, но без ограничения, специальные сверхжесткие лиганды, имеющие поперечные мостики (например, 5,12-диэтил-1,5,8,12-тетраазабицикло[6.6.2]гексадекан). Подходящие комплексы переходных металлов с MRL можно легко получить по известным методикам (см., например, WO 00/32601 и US 6225464).
Примеры
Следующие примеры предлагаются для демонстрации и дополнительной иллюстрации некоторых предпочтительных вариантов осуществления и аспектов настоящего изобретения и не должны рассматриваться как ограничение его объема.
В приведенном ниже экспериментальном описании используют следующие сокращения: °C (градусы Цельсия); об/мин (обороты в минуту); Да (Дальтон), кДа (килоДальтон); г (граммы); мкг (микрограммы); мг (миллиграммы); нг (нанограммы); мкл (микролитры); мл (миллилитры); мм (миллиметры); нм (нанометры); мкм (микрометры); M (молярный); мМ (миллимолярный); мкМ (микромолярный); ед. (единицы); ММ (молекулярная масса); сек (секунды); мин (минуты); ч (часы); OD280 (оптическая плотность при 280 нм); OD405 (оптическая плотность при 405 нм); OD600 (оптическая плотность при 600 нм); PAGE (электрофорез в полиакриламидном геле); EtOH (этанол); PBS (забуференный фосфатом физиологический раствор [150 мМ NaCl, 10 мМ натрий-фосфатный буфер, pH 7,2]); SDS (додецилсульфат натрия); Tris (трис(гидроксиметил)аминометан); TAED (N,N,N'N'-тетраацетилэтилендиамин); MES (моногидрат 2-морфолиноэтансульфоновой кислоты; f.w. 195,24; Sigma # M-3671); CaCl2 (хлорид кальция, безводный; f.w. 110,99; Sigma # C-4901); ДМФА (N,N-диметилформамид, f.w. 73,09, d=0.95); мас./об. (отношение массы к объему); об./об. (отношение объема к объему); NprE (нейтральная металлопротеаза); PMN (очищенная металлопротеаза MULTIFECT®).
В описанных ниже примерах используют следующие анализы.
A. Анализ Брэдфорда с использованием 96-луночных титрационных микропланшетов (MTP) для определения концентрации NprE.
Концентрацию протеазы NprE в образцах, используемых в нижеследующих примерах, определяют методом Брэдфорда в формате 96-луночного MTP.
В данном анализе Брэдфорда используют следующие химические соединения и растворы реагентов: окрашивающий реагент Quick Start Bradford (BIO-RAD, #500-0205); буфер для разведения: 10 мМ NaCl, 0,1 мМ CaCl2, 0,005% TWEEN®-80.
Для проведения анализа используют оборудование Biomek FX Robot (Beckman) и MTP-ридер SpectraMAX (тип 340); MTP получают от Costar (тип 9017).
В данном анализе в каждую лунку пипеткой вносят 200 мкл окрашивающего реагента Брэдфорда и затем 15 мкл буфера для разведения. В конце в лунки добавляют 10 мкл фильтрованного культурального бульона.
После тщательного перемешивания MTP инкубируют в течение по меньшей мере 10 минут при комнатной температуре. Возможные пузырьки воздуха удаляют и считывают OD в лунках при 595 нм.
Чтобы определить концентрацию белка, фоновые значения (т.е. полученные в контрольных лунках) вычитают из значений, полученных для лунок, содержащих образец. Полученные значения OD595 являются относительной мерой содержания белка в образцах. Линейность калибровочных кривых NprE при концентрации от 0 до 5 мкг позволяет использовать значения OD595 в качестве относительной меры содержания белка. Поскольку ожидаемое содержание NprE в супернатанте составляет 200-300 мкг/мл, используемый в анализе образец объемом 10 мкл содержит менее 5 мкг белка, соответственно, полученные результаты попадают в линейный диапазон.
B. Анализ AGLA, используемый для определения активности NprE и кинетики ингибирования
С помощью описанного ниже анализа "AGLA" получают воспроизводимые значения активности нейтральной металлопротеазы (например, NprE). Хотя анализ можно адаптировать к конкретным лабораторным условиям, все результаты, полученные с помощью модифицированного метода, следует согласовывать с результатами, полученными с помощью оригинального метода.
Нейтральные металлопротеазы расщепляют пептидную связь между глицином и лейцином в Abz-AGLA-Nba (2-аминобензоил-L-аланилглицил-L-лейцил-L-аланино-4-нитробензиламид; f.w. 583.65; доступный под №H-6675 от BaChem AG, Bubendorf, Switzerland, или под № по каталогу 100040-598 от VWR). Свободный 2-аминобензоил-L-аланилглицин (Abz-AG) в растворе имеет максимум эмиссии флуоресценции при 415 нм и максимум возбуждения при 340 нм. В интактной молекуле Abz-AGLA-Nba флуоресценция Abz-AG гасится нитробензиламидом.
В данном анализе высвобождение Abz-AG в результате расщепления Abz-AGLA-Nba под действием протеазы отслеживают с помощью флуоресцентной спектроскопии (λexc=340 нм/λemis=415 нм). Скорость образования Abz-AG является мерой протеолитической активности. Анализы проводят в условиях начальной скорости, не ограниченной субстратом.
Оборудование, используемое для анализа
Чтобы получить воспроизводимые результаты, для проведения анализа требуется миксер для микропланшет с регуляцией температуры (например, термомиксер Eppendorf). Перед добавлением фермента аналитические растворы инкубируют в миксере для микропланшетов до достижения желаемой температуры (например, 25°C). Растворы ферментов добавляют в планшет на миксере, энергично перемешивают и быстро переносят в планшет-ридер.
Используют спектрофлуориметр с непрерывным считыванием данных, линейнорегрессионным анализом и регулируемой температурой, например, SpectraMax M5, Gemini EM (Molecular Devices, Sunnyvale, CA). Ридер всегда держат при желаемой температуре (например, 25°C). Ридер устанавливают на верхнее считывание значений флуоресценции, длину волны возбуждения устанавливают на 350 нм и длину волны эмиссии устанавливают на 415 нм, при этом фильтр с ограниченным пропусканием не используют. PMT устанавливают на среднюю чувствительность и 5 считываний на лунку. Включают автокалибровку, но только перед первым считыванием. Результаты анализа измеряют в течение 3 минут с минимизацией интервалов считывания в соответствии с числом лунок, выбранных для мониторинга. Ридер программируют для определения скорости милли-RFU/мин (тысячных долей относительных единиц флуоресценции в минуту). Число считываний, используемое для расчета скорости (значения Vmax), определяют для интервала времени 2 минуты с учетом интервалов считывания (например, при считывании каждые 10 секунд для расчета скорости используют 12 точек). Максимальное значение RFU устанавливают на 50000.
Перенос исходных растворов фермента и субстрата осуществляют с помощью пипеток с объемным вытеснением (Rainin Microman). Буферные растворы, аналитические растворы и рабочие растворы фермента отбирают из пробирок, резервуаров для реагентов или исходных микропланшетов с помощью одно- или многоканальных пипеток с вытеснением воздухом (Rainin LTS). Если используется несколько лунок, аналитический раствор в лунки планшета можно переносить с помощью многозарядной пипетки (Eppendorf), позволяющей минимизировать потерю реагента. Для переноса растворов фермента из рабочего исходного микропланшета в аналитический микропланшет можно использовать автоматизированные пипетирующие инструменты, такие как Beckman FX или Cybio Cybi-well, которые позволяют инициировать реакцию во всем микропланшете сразу.
Реагенты и растворы
Исходный буфер MES - 52,6 мМ MES/NaOH, 2,6 мМ CaCl2, pH 6,5: кислоту MES (10,28 г) и 292 мг безводного CaCl2 растворяют приблизительно в 900 мл очищенной воды. Раствор растирают с NaOH до pH 6,5 (при 25°C или с рН-зондом с регуляцией температуры). Общий объем буфера, имеющего требуемый рН, доводят до примерно 1 л. Конечный раствор фильтруют через стерильный фильтр 0,22 мкм и выдерживают при комнатной температуре.
Буфер для разведения фермента - 50 мМ MES, 2,5 мМ CaCl2, pH 6,5: Данный буфер получают путем добавления 5 мл очищенной воды к 95 мл исходного буфера MES.
Исходный раствор фермента: очищенный фермент NprE разводят буфером для разведения фермента до примерно концентрации примерно 1 ч./млн (1 мкг/мл). Нейтральную металлопротеазу MULTIFECT® (NprE дикого типа) разводят до примерно концентрации ниже 6 ч./млн (6 мкг/мл). Проводят серийные разведения. Растворы стабильны при комнатной температуре в течение 1 часа, однако при более длительном хранении растворы выдерживают на льду.
Исходный раствор субстрата - 48 мМ Abz-AGLA-Nba в ДМФА: Примерно 28 мг Abz-AGLA-Nba помещают в маленькую пробирку. Затем это количество растворяют примерно в 1 мл ДМФА (объем может варьировать в зависимости от отмеренной массы Abz-AGLA-Nba) и энергично перемешивают несколько минут. Раствор хранят при комнатной температуре, защищая от света. Abz-AGLA-Nba растворяют в ДМФА и используют в тот же день.
Буфер для разведения субстрата - 50 мМ MES, 2,5 мМ CaCl2, 5% ДМФА, pH 6,5: Пять мл чистого ДМФА добавляют к 95 мл исходного буфера MES. Полученный буфер используют для определения кинетических параметров.
Аналитический раствор - 50 мМ MES, 2,5 мМ CaCl2, 5% ДМФА, 2,4 мМ Abz-AGLA-Nba, pH 6,5: Один мл исходного раствора субстрата добавляют к 19 мл буфера для разведения субстрата и энергично перемешивают. Раствор хранят при комнатной температуре, защищая от света.
Методика анализа
Готовят все буферы, исходные и рабочие растворы. Если не указано иное, каждое разведение фермента анализируют в трех повторах. Если планшет заполнен не целиком, в исходном микропланшете для рабочих растворов фермента заполняют вертикальные колонки, начиная с левого края планшета (чтобы приспособить к планшет-ридеру). Соответствующий аналитический планшет устанавливают подобным образом. Спектрофлуориметр для микропланшет устанавливают, как описано выше.
Сначала аликвоты аналитического раствора объемом 200 мкл помещают в лунки 96-луночного микропланшета. Планшет инкубируют в течение 10 мин при 25°С в миксере для микропланшетов с регулируемой температурой, защищая от света. Анализ инициируют путем перенесения 10 мкл рабочих раствором фермента из исходного микропланшета в аналитический микропланшет на миксере. Предпочтительно используют 96-луночное пипетирование или сначала переносят растворы из самой левой колонки с помощью 8-луночной многоканальной пипетки. Растворы энергично перемешивают в течение 15 секунд (900 об/мин в термомиксере Eppendorf). Аналитический микропланшет сразу переносят в спектрофлуориметр для микропланшетов и начинают регистрировать значения флуоресценции при длине волны возбуждения 350 нм и длине волны эмиссии 415 нм. С помощью программного обеспечения спектрофлуориметра рассчитывают скорости увеличения флуоресценции в каждой лунке по кривой линейной регрессии в милли-RFU/мин. В некоторых экспериментах второй планшет помещают в миксер для микропланшетов, чтобы уравновесить температуру, пока прочитывается первый планшет.
Начальные скорости находятся в линейной зависимости от концентрации продукта (т.е. флуоресценция высвобождающегося 2-аминобензоила) до примерно достижения уровня 0,3 мМ, что соответствует примерно 50000 RFU в растворе, исходя из 2,3 мМ Abz-AGLA-Nba при фоновой флуоресценции примерно 22000 RFU.
Пример 1
Увеличение стабильности NprE при повышении концентрации хранения
Данный пример иллюстрирует увеличение стабильности нейтральной металлопротеазы при хранении фермента при повышенных концентрациях и/или в присутствии 10% пропиленгликоля (PPG) и CaCl2.
Получают образцы, содержащие нейтральную металлопротеазу, NprE, в диапазоне концентраций от 625 до примерно 10000 ч./млн в буфере 10 мМ HEPES (N-(2-гидроксиэтил)пиперазин-N'-(2-этансульфоновая кислота)) при pH 8,0. Все образцы, за исключением одного контроля, при концентрации NprE 625 ч./млн содержат 10% PPG и 0,5 мМ CaCl2. Все образцы инкубируют при температуре 32°C в течение 6 часов. Активность NprE в образцах измеряют с помощью анализа AGLA в разные моменты времени.
Результаты
Как показано на фиг.1, контрольный образец, содержащий 625 ч./млн NprE и не содержащий PPG или CaCl2, почти полностью утрачивает активность в течение первых 2 часов. И наоборот, в других образцах сохраняется большая часть активности NprE в соответствии с повышенной концентрацией белка. При концентрации NprE 10000 мкг/мл (или ч./млн) фермент сохраняет активность почти полностью в течение 1,5 часов, затем теряет активность. Для сравнения, в образце с концентрацией белка 625, 1250 и 2500 ч./млн наблюдается снижение активности (-60% в течение 1,5 ч). Образец с высокой концентрацией демонстрирует значительное увеличение стабильности при хранении по сравнению с контрольным образцом.
Полученные результаты, демонстрирующие, что существует корреляция между повышением стабильности NprE и увеличением концентрации, согласуются с данными по стабилизации в результате ингибирования продуктом.
Пример 2
Ингибирование NprE продуктом гидролиза казеина
Данный пример иллюстрирует использование нейтральной металлопротеазы для получения продуктов гидролиза белка, которые затем используют для стабилизации нейтральной металлопротеазы посредством конкурентного ингибирования.
Материалы и методы
Казеин бычьего молока (№ по каталогу C 7078; Sigma Chemical, St. Louis, MO) в концентрации 100 мг/мл инкубируют при встряхивании с нейтральной металлопротеазой NprE в концентрации 0,4 мг/мл в 10 мл буфера (50 мМ MES, 2,5 мМ CaCl2, pH 6,5) в течение ночи при 32°C. Полученную гидролизную смесь центрифугируют при 18000 об/мин на центрифуге Sorvall RC-5B Plus (Thermo Fisher Scientific, Inc., Waltham MA), оборудованной угловым ротором SM-24, при 4°C в течение 30 минут, для удаления не прореагировавших частиц. После центрифугирования супернатант фильтруют через мембрану 5K MWCO, используя устройство для центрифужного фильтрования Vivaspin 20 (Sartorius AG, Germany). Собирают пропускаемое вещество, которое содержит только продукты гидролиза (также называемые "казеиновыми пептидами") с молекулярной массой менее чем примерно 5000 Да.
Количество продуктов гидролиза казеина определяют с помощью тринитробензолсульфоновой кислоты (TNBS), которая позволяет колориметрически определять свободные амины, присутствующие в пептидах смеси, используя в качестве стандарта свободную аминокислоту. Как правило, образцы объемом 10 мкл смешивают с 60 мкл раствора TNBS 1,2 мг/мл в 120 мМ боратном буфере, pH 9 и инкубируют в течение 15 минут при 50°C. Реакционные смеси нейтрализуют путем добавления 140 мкл 500 мМ фосфатного буфера, pH 7,5. Изменение цвета регистрируют при 420 нм, в качестве стандартов откаллиброванные против аминокислоты (№ по каталогу AAS18; Sigma Chemical, St. Louis, MO). Используя количественно определенную смесь продуктов гидролиза казеина, получают исходный раствор для проведения описанного ниже анализа кинетических параметров ингибирования.
Кинетические параметры ингибирования NprE под действием смеси продуктов гидролиза казеина определяют с помощью общего анализа активности AGLA, как описано выше, но с использованием различных концентраций продуктов гидролиза казеина в аналитической смеси. Получают стандартные кривые Михаэлиса-Ментена для скорости ферментативных реакций, с помощью которых определяют различные кинетические константы продуктов гидролиза казеина, включая кажущуюся Ki. Аналитический раствор представляет собой 50 мМ буфер MES, содержащий 2,5 мМ CaCl2 и 0,005% Tween 80, и имеющий pH 6,5 при комнатной температуре.
Результаты
На фиг.2 показано ингибирование NprE под действием продуктов гидролиза казеина, полученных и выделенных с помощью описанного выше способа. На фиг.2A-2D изображены стандартные кинетические кривые Михаэлиса-Ментена для ингибирования под действием продукта гидролиза казеина против флюорогенного субстрата AGLA. На фиг.2B показан двойной график обратной зависимости с общим отрезком, отсекаемым на оси Y, который свидетельствует о том, что продукт гидролиза казеина действует как конкурентный ингибитор NprE. На фиг.2C и 2D изображены кажущаяся Km и угол наклона перестроенного двойного графика обратной зависимости, соответственно.
Полученные результаты показывают, что смесь продуктов гидролиза казеина, полученных в результате расщепления казеина молока под действием NprE, также представляет собой белковый гидролизатный ингибитор NprE с кажущейся Ki ~10 мМ.
Пример 3
Повышенная стабильность NprE в жидких детергентных составах
Данный пример иллюстрирует использование ряда белковых гидролизатов для стабилизации детергентного состава, содержащего нейтральную металлопротеазу.
Материалы
Следующие белковые гидролизаты получают от Sigma Chemical (St. Louis, MO) и используют без дополнительной очистки: HyPep 4601™, белковый продукт гидролиза клейковины пшеницы (№ по каталогу H 6784), Amisoy, кислый гидролизат соевого белка (№ по каталогу S 1674), Amicase, кислый гидролизат казеина коровьего молока (№ по каталогу A 2427) и протеозопептон, продукт ферментативного гидролиза растительного белка (№ по каталогу P 0431). Для гидролиза под действием NprE используют казеин коровьего молока (№ по каталогу C7078; Sigma Chemical, St. Louis, MO).
Исходные растворы белкового гидролизата
Используя коммерческие реагенты, получают исходные растворы белкового гидролизата с концентрацией 70 мг/мл в буфере 10 мМ HEPES при pH 8,0.
Гидролизат казеина коровьего молока получают путем расщепления казеина под действием 8 мг/мл NprE в 50 мМ буфере MES, содержащем 2,5 мМ CaCl2, pH 6,5 при 37°C. Нерасщепленное вещество удаляют центрифугированием, с последующим диализом против мембраны MWCO 5 кДа. Пропущенное вещество собирают и хранят в аликвотах при -20°C до последующего применения. Путем анализа пептидов с использованием тринитробензолсульфоновой кислоты (TNBS) (как в примере 2) определяют, что продукт гидролиза казеина представляет собой ~90 мМ пептидный раствор.
Высокоэффективный жидкий (HDL) детергентный препарат
В данном примере в качестве детергентного состава HDL используют DW-CT. Данный состав содержит 37% воды и составляет 90% по объему, имея 10% свободного пространства (по объему), чтобы добавить такие ингредиенты, как стабилизаторы или ферменты. Его получают в соответствии с методикой, приведенной выше в таблице 1.
Анализы проводят с использованием 10% детергентного состава DW-CT, полученного путем смешивания 5 мл DW-CT (полученного по методике, приведенной в таблице 1), 1 мл 500 мМ HEPES при pH 8,0 и 44 мл дистиллированной воды.
Анализ стабильности препарата образца
Образцы для анализа стабильности получают, используя пять различных кандидатных белковых гидролизатов, в качестве контроля используют образец, не содержащий ингибитора.
Как правило, 20 мкл исходного раствора ингибитора заранее смешивают с 10 мкл исходного раствора NprE с концентрацией 50 мг/мл. Затем к каждому образцу добавляют 220 мкл 10% детергентный состав DW-CT в 10 мМ HEPES так, чтобы конечная концентрация NprE составляла 2 мг/мл. Образцы инкубируют в титрационном микропланшете при 32°C в термомиксере (Eppendorf).
Конечная концентрация фермента NprE в каждом образце составляет 2 мг/мл. Конечные концентрации ингибитора в соответствующих образцах составляют: 5,6 мг/мл Amisoy, Amicase, HyPep 4601 или протеозопептона, соответственно; или 7,2 мМ в случае смеси продуктов гидролиза казеина (после 12,5-кратного разведения). Конечная концентрация детергентного состава DW-CT составляет 9%.
Анализ остаточной активности AGLA
Остаточную активность NprE во всех образцах для анализа стабильности (полученных, как описано выше) измеряют в разные моменты времени с помощью общего анализа активности AGLA, за исключением того, что используемый аналитический раствор содержит 50 мМ MES, 2,5 мМ CaCl2 и 0,005% Tween 80 при pH 6,5. С помощью анализа AGLA обнаружено, что существует линейная зависимость остаточной активности в диапазоне более чем 9000-кратных разведений.
SDS-PAGE образцов анализа стабильности
Для независимого измерения уровня защиты NprE от автолиза под действием ингибиторов проводят анализ всех образцов анализа стабильности методом SDS-PAGE, позволяющим определить относительное количество интактной NprE по сравнению с количеством продуктов автолиза.
В конце инкубационного периода анализа стабильности (t=200 мин) отбирают 10 мкл каждого образца и гасят 200 мкл 1н. HCl. Сразу после этого добавляют 200 мкл 5% TCA. Осаждение TCA проводят на льду в течение 20 минут. Осадок собирают центрифугированием и промывают охлажденным на льду 90% ацетоном. Затем осадок снова суспендируют в 1,5× буфере для загрузки образца и нагревают при 95°C в течение 5 минут. Затем образцы загружают на 4-12% гель для SDS-PAGE. Электрофорез и визуализацию геля проводят с помощью хорошо известных в данной области стандартных методов SDS-PAGE и окрашивания Кумасси синим.
Результаты
Как показано на фиг.3, металлопротеаза NprE утрачивает более 80% исходной активности в течение примерно одного часа при инкубации с детергентным составом HDL, DW-CT. Добавление ингибиторных белковых гидролизатов к тому же детергентному составу NprE значительно улучшает стабильность фермента. Например, в детергентных составах, содержащих Amisoy (кислый гидролизат соевого белка), продукт гидролиза казеина под действием NprE, HyPep 4601™ (продукт гидролиза пшеничной клейковины), Amicase (кислый гидролизат казеина), протеозопептон (продукт гидролиза растительного белка), активность NprE сохраняется в значительной степени. Amisoy обеспечивает самую высокую стабильность NprE-содержащего детергентного состава HDL, с сохранением более 50% активности через 3 часа. Композиция, содержащая продукт гидролиза казеина, также показывает хорошие результаты, сохраняя 40% активности через 3 часа.
Результаты SDS-PAGE для образцов анализа стабильности через 200 минут показывают, что белковые гидролизаты Amisoy и продукт гидролиза казеина обеспечивают самую высокую защиту NprE от автолиза в детергентном составе. Способность указанных белковых гидролизатов стабилизировать фермент подтверждается результатами SDS-PAGE для данных образцов, демонстрирующими одну интенсивную полосу NprE и отсутствие детектируемых полос, соответствующих низкомолекулярным соединениям, которые указывают на наличие продуктов автолиза. Фактически интенсивность полосы NprE сравнима с интенсивностью полосы контрольного образца NprE, который не инкубировали. Для сравнения, образец NprE, инкубированный в отсутствии ингибитора, анализируют методом SDS-PAGE, который демонстрирует почти полное отсутствие детектируемой полосы NprE, свидетельствуя о том, что через 200 минут незащищенная NprE в детергентном составе деградирует практически полностью. Образец белкового гидролизата HyPep 4601 имеет одну интенсивную полосу NprE при небольшой интенсивности или отсутствии полос низкомолекулярных продуктов, хотя полоса NprE не является такой интенсивной, как у Amisoy и продуктов гидролиза казеина. Белковые гидролизаты Amicase и протеозопептон имеют полосы NprE в SDS-PAGE, однако их интенсивность не намного выше, чем у образцов, инкубированных в отсутствие ингибиторов. Таким образом, результаты SDS-PAGE подтверждают сохранение активности NprE, обнаруженное с помощью анализа AGLA (показано на фиг.3).
Все приведенные в данном описании патенты и публикации указывают на уровень специалистов в области, к которой относится настоящее изобретение. Все патенты и публикации включены в данное описание посредством ссылки в той же степени, как если бы каждая публикация была специально и отдельно включена посредством ссылки.
Хотя иллюстрируются и описываются конкретные варианты осуществления настоящего изобретения, для специалистов в данной области будет очевидно, что различные изменения и модификации могут быть осуществлены без отступления от сущности и объема настоящего изобретения. Таким образом, подразумевается, что все такие изменения и модификации, входящие в объем настоящего изобретения, охватываются прилагаемой формулой изобретения.
Иллюстративно описанное выше изобретение можно осуществить подходящим способом в отсутствии какого-либо элемента или элементов, ограничения или ограничений, которые специально не раскрываются в данном описании. Используемые термины и выражения предназначаются для описания, а не для ограничения, и использование таких терминов и выражений не предполагает исключения каких-либо эквивалентов обозначаемых и описываемых признаков или их фрагментов, но допускает различные модификации в пределах объема формулы изобретения. Таким образом, следует понимать, что, хотя настоящее изобретение специально раскрывается путем описания предпочтительных вариантов осуществления и необязательных признаков, специалисты в данной области смогут осуществить модификации и вариации раскрытых в данном описании концепций в пределах объема настоящего изобретения, определенного прилагаемой формулой изобретения.
В данном описании изобретение раскрывается в широком и общем смысле. Каждый из более узких и менее общих аспектов, входящих в объем общего описания, также является частью настоящего изобретения. Это относится к общему описанию настоящего изобретения с условием или негативным ограничением удаления какого-либо предмета из рассмотрения, независимо от того, указывается ли специально исключаемый предмет в настоящем описании или нет.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ УЛУЧШЕНИЯ ЭФФЕКТИВНОСТИ БЕЛКОВ | 2008 |
|
RU2569106C2 |
| ПРОДУЦИРОВАНИЕ ТЕРМОЛИЗИНА И ЕГО ВАРИАНТОВ И ЕГО ИСПОЛЬЗОВАНИЕ В ЖИДКИХ ДЕТЕРГЕНТАХ | 2008 |
|
RU2536255C2 |
| ПРОДУЦИРОВАНИЕ ТЕРМОЛИЗИНА И ЕГО ВАРИАНТОВ И ЕГО ИСПОЛЬЗОВАНИЕ В ЖИДКИХ ДЕТЕРГЕНТАХ | 2014 |
|
RU2733541C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ УЛУЧШЕННЫХ ВАРИАНТОВ БЕЛКА | 2008 |
|
RU2520808C2 |
| СПОСОБЫ УЛУЧШЕНИЯ МНОЖЕСТВЕННЫХ СВОЙСТВ БЕЛКА | 2008 |
|
RU2553550C2 |
| МНОГОЦЕЛЕВОЙ ФЕРМЕНТНЫЙ ДЕТЕРГЕНТ И СПОСОБЫ СТАБИЛИЗАЦИИ ПРИМЕНЯЕМОГО РАСТВОРА | 2014 |
|
RU2642077C2 |
| ПРИМЕНЕНИЕ И ПОЛУЧЕНИЕ СТАБИЛЬНОЙ ПРИ ХРАНЕНИИ НЕЙТРАЛЬНОЙ МЕТАЛЛОПРОТЕИНАЗЫ | 2006 |
|
RU2433182C2 |
| НОВЫЕ ГЕНЫ, КОДИРУЮЩИЕ НОВЫЕ ПРОТЕОЛИТИЧЕСКИЕ ФЕРМЕНТЫ | 2002 |
|
RU2423525C2 |
| ПРОТЕАЗЫ, СОДЕРЖАЩИЕ ОДНУ ИЛИ НЕСКОЛЬКО КОМБИНИРУЕМЫХ МУТАЦИЙ | 2009 |
|
RU2560978C2 |
| КОМПОЗИЦИИ И СПОСОБЫ, ВКЛЮЧАЮЩИЕ В СЕБЯ ПРИМЕНЕНИЕ ВАРИАНТНЫХ МИКРОБНЫХ ПРОТЕАЗ | 2009 |
|
RU2575073C2 |
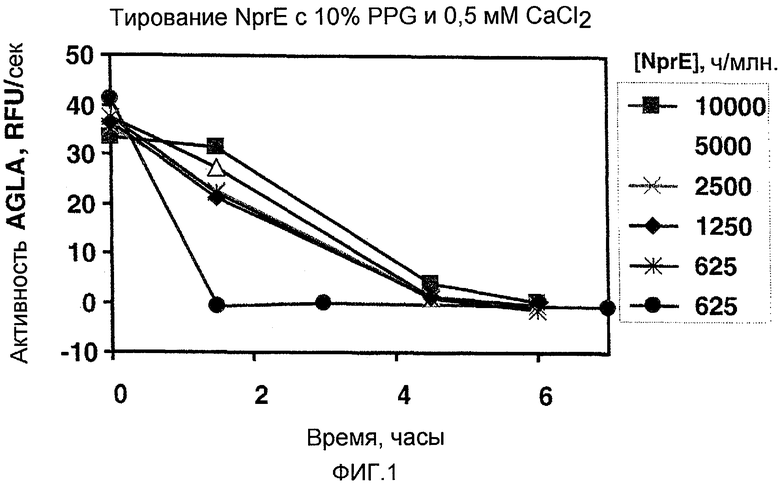
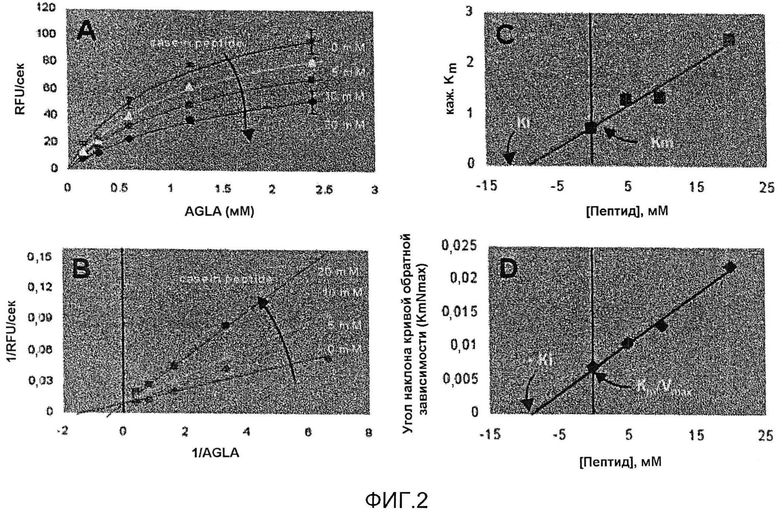
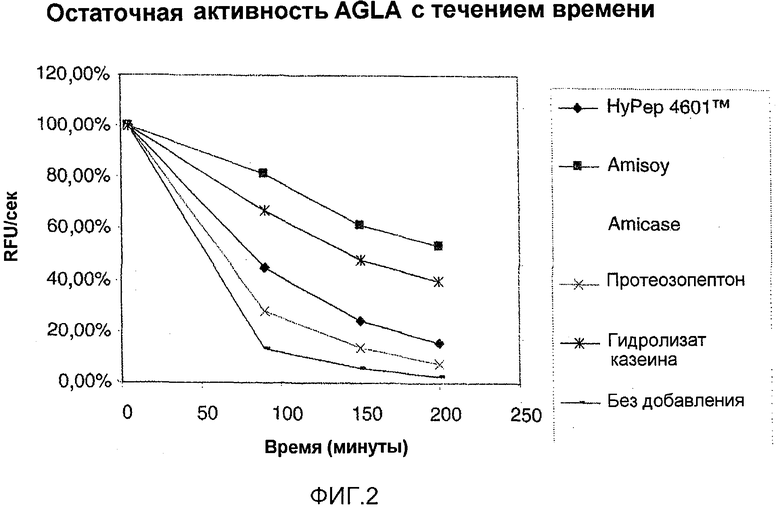
Группа изобретений относится к области биохимии. Предложена стабилизированная ингибитором композиция нейтральной металлопротеазы для получения жидкого детергентного состава. Композиция содержит от примерно 0,001% до примерно 10% по массе нейтральной металлопротеазы и конкурентный ингибитор. Причем конкурентный ингибитор представляет собой белковый гидролизат и связан с по меньшей мере примерно 90% молекул указанной нейтральной металлопротеазы. Также предложен способ получения стабилизированной ингибитором композиции нейтральной металлопротеазы. Инкубируют смесь, содержащую по меньшей мере одну нейтральную металлопротеазу и белковый субстрат, в водном буфере при рН в интервале от примерно 6,5 до примерно 11 и при температуре от примерно 22°С до примерно 37°С. В процессе инкубации происходит расщепление субстратного белка под действием металлопротеазы, что приводит к образованию продукта гидролиза. Выделяют продукт гидролиза с молекулярной массой менее приблизительно 5000 Да и объединяют с нейтральной металлопротеазой. Изобретения способствуют повышению стабильностью при хранении детергентных составов без уменьшения желаемой активности нейтральной металлопротеазы при применении. 2 н. и 10 з.п. ф-лы, 3 ил., 5 табл., 3 пр.
1. Стабилизированная ингибитором композиция нейтральной металлопротеазы для получения жидкого детергентного состава, содержащая:
(a) от примерно 0,001% до примерно 10% по массе нейтральной металлопротеазы; и
(b) конкурентный ингибитор, где конкурентный ингибитор связан с по меньшей мере примерно 90% молекул указанной нейтральной металлопротеазы, и в которой конкурентный ингибитор представляет собой белковый гидролизат.
2. Композиция по п.1, в которой белковый гидролизат выбран из гидролизата пшеничной клейковины, кислого гидролизата соевого белка, кислого гидролизата казеина коровьего молока, ферментативного гидролизата растительного белка и их комбинаций.
3. Композиция по п.1, в которой белковый гидролизат представляет собой продукт гидролиза, полученный в результате расщепления белка под действием по меньшей мере одной нейтральной металлопротеазы.
4. Композиция по п.3, в которой продукт гидролиза содержит белковые фрагменты размером менее чем примерно 5000 Да.
5. Композиция по п.3, в которой белок представляет собой казеин.
6. Композиция по п.1, в которой композиция находится в виде инкапсулированной частицы.
7. Композиция по п.1, в которой ингибитор конкурентно ингибирует нейтральную металлопротеазу с кажущейся Ki от примерно 5 мМ до примерно 15 мМ при рН от примерно 7,5 до примерно 9,5.
8. Композиция по п.1, в которой нейтральную металлопротеазу выделяют из Bacillus sp.
9. Композиция по п.1, в которой нейтральная металлопротеаза представляет собой NprE.
10. Способ получения стабилизированной ингибитором композиции нейтральной металлопротеазы по любому из пп.1-9, включающий:
(a) инкубацию смеси, содержащей по меньшей мере одну нейтральную металлопротеазу и белковый субстрат, в водном буфере при рН в интервале от примерно 6,5 до примерно 11 и при температуре от примерно 22°С до примерно 37°С, в процессе которой расщепление субстратного белка под действием металлопротеазы приводит к образованию продукта гидролиза;
(b) выделение продукта гидролиза с молекулярной массой менее приблизительно 5000 Да; и
(c) объединение продукта гидролиза стадии (b) нейтральной металлопротеазой.
11. Способ по п.10, где инкубационная смесь содержит от примерно 0,001% до примерно 10% нейтральной металлопротеазы и от примерно 5% до примерно 20% белкового субстрата по массе.
12. Способ по п.10, где нейтральная металлопротеаза представляет собой NprE и белковый субстрат представляет собой казеин.
| WO 2007044993 А2, 19.04.2007 | |||
| KAMMOUN R | |||
| ET AL | |||
| Protein size distribution and inhibitory effect of wheat hydrolysates on Neutrase // Bioresource Technology, №90, 2003, pp.249-254 | |||
| Система управления исполнительным органом в печатной машине | 1978 |
|
SU1359157A1 |
| СПОСОБ СТАБИЛИЗАЦИИ ВОДНОГО РАСТВОРА ИЛИ СУСПЕНЗИИ МЕТАЛЛОПРОТЕАЗЫ И СТАБИЛИЗИРОВАННЫЙ ВОДНЫЙ РАСТВОР ИЛИ СУСПЕНЗИЯ МЕТАЛЛОПРОТЕАЗЫ | 1994 |
|
RU2167937C2 |
Авторы
Даты
2013-06-10—Публикация
2008-04-23—Подача