Настоящее изобретение относится к области медицины, в частности к кардиологии и молекулярной биологии, и может быть использовано для выявления мутаций кодирующей части генов NKX2.5, CFC1, GATA4 и выявления мутаций, ассоциированных с орфанной моногенной патологией, лежащей в основе семейных форм врожденных пороков сердца, для определения тактики ведения больных семейными формами врожденных пороков сердца и оценки рисков развития заболевания.
Примерно 1% всех новорожденных имеет аномалии развития сердца, или врожденные пороки сердца. Значительная часть этих аномалий ассоциирована с мутациями в генах, отвечающих за эмбриональное развитие сердца. Часть врожденных пороков сердца носит семейный характер. Ранняя диагностика таких состояний позволит подбирать своевременное и адекватное лечение, а также подбирать тактику ведения пациентов при планировании беременности.
Врожденные пороки сердца (ВПС) - дефекты в структуре сердца или прилегающих к нему крупных сосудов, присутствующих с рождения. ВПС являются одними из самых распространенных врожденных нарушений и самой распространенной причиной детской смертности. По данным van der Linde с соавторами, распространенность врожденных пороков сердца достигает 1% от числа всех новорожденных, из них преобладающими пороками являются дефект межжелудочковой перегородки и дефект межпредсердной перегородки [van der Linde D, Konings EEM, Slager MA, Witsenburg M, Helbing WA, Takkenberg JJM, Roos-Hesselink JW. (2011) Birth Prevalence of Congenital Heart Disease Worldwide: A Systematic Review and Meta-Analysis. Journal of the American College of Cardiology, Vol.58, Pages 2241-2247]. Наиболее известные причины врожденных пороков сердца - точечные генные изменения, либо хромосомные мутации в виде делеции или дупликации сегментов ДНК. В литературе описано не менее 12 генов, ассоциированных с развитием различных форм ВПС [Hinton RB Jr., Yutzey КЕ, Benson DW. (2005) Congenital heart disease: Genetic causes and developmental insights. Progress in Pediatric Cardiology, Vol.20, Pages 101-111]. Наиболее вовлеченными в нормальное развитие сердца являются такие гены как NKX2.5, GATA4, также важную роль в нормальном развитии сердца играют гены CFC1, ТВХ5, PTPN11 и другие. Мутации в этих генах приводят к морфофункциональным нарушениям сердца, которые являются причиной врожденных пороков сердца разной степени выраженности. Диагностика и терапия у детей с сердечно-сосудистыми заболеваниями требует мультидисциплинарного подхода для раннего выявления причин, характера и выраженности заболевания. В случае семейных форм ВПС, генетическая диагностика позволит осуществить ранний прогноз развития заболевания у всех членов семьи и сделать информированный выбор при планировании беременности.
Быстрое генотипирование является важным инструментом для принятия информированного решения о дальнейшей стратегии лечения пациентов раннего возраста с сердечно-сосудистыми заболеваниями, в частности с ВПС. Однако известные до сих пор методы определения последовательности генов, ассоциированных с ВПС, слишком дорогие и трудозатратные, что не позволяет сделать их скрининговыми методами и оснастить ими большинство клинических лабораторий. Таким образом, в лабораторной практике высока потребность в разработке тест-системы для определения генов, ассоциированных с ВПС, достаточно простой для того, чтобы использовать ее в качестве скринингового метода дифференциальной диагностики ВПС, а также методов диагностики возможных нарушений при планировании беременности.
NKX2.5 - первый описанный маркер эмбрионального развития сердца позвоночных. Этот ген кодирует гомеобокс-содержащий транскрипционный фактор, который участвует в формировании и развитии сердца. Мутации гена NKX2.5 приводят к развитию дефектов межпредсердной перегородки с нарушениями атриовентрикулярной проводимости, а также тетраду Фалло, которые являются пороками сердца. Продукт гена NKX2.5 молекулярной массой 35 кДа представляет собой белки, относящиеся к классу гомеобокс-содержащих транскрипционных факторов. Ген NKX2.5 располагается на длинном плече хромосомы 5 (5q34). Ген состоит из 2 экзонов, которые расположены на участке 3209 пар оснований, и является высококонсервативным среди животных. NKX2.5 экспрессируется по всему развивающемуся сердцу. К настоящему времени описано более 50 мутаций кодирующей части гена NKX2.5.
Ген CFC1 кодирует белок Cripto с молекулярной массой 24 кДа, входящий в семейство эпидермальных факторов роста - FRL-1-CFC- Cryptic, которое задействовано в путях передачи сигнала во время эмбрионального развития. Cripto необходим для правильного формирования лево-правой эмбриональной оси. Мутации гена CFC1 ассоциированы с дефектами развития органов, в том числе с висцеральной гетеротаксией и врожденными пороками сердца. Ген CFC1 располагается на длинном плече хромосомы 2. Ген состоит из 6 экзонов, которые расположены на участке 7411 пар оснований, и является высококонсервативным среди позвоночных.
Ген GATA4 кодирует специфический для сердца транскрипционный фактор - GATA-связывающий белок 4. Этот белок с молекулярной массой 45 кДа принадлежит к группе родственных пальцевых белков, которые распознают последовательности ДНК известные как GATA мотив. GATA4 - критический регулятор развития сердца у человека, показано, что мутации гена GATA4 могут являться причиной врожденных пороков развития сердца. Также GATA4 участвует в поддержании нормального сердечного ремоделирования и процессах программированной клеточной гибели [Perrino С., Rockman НА. (2006) GATA4 and the two sides of gene expression reprogramming. Circ Res., Vol.98, No 6, Pages 715-716]. Ген GATA4 располагается на коротком плече хромосомы 8 (8р23). Ген состоит из 7 экзонов, которые расположены на участке 55793 пар оснований, и является высококонсервативным среди животных. GATA связывающий белок 4 экспрессируется во взрослом состоянии в тканях сердца, кишечном эпителии и гонадах. Во время эмбрионального развития этот белок экспрессируется в энтодерме желточного мешка и клетках, участвующих в формировании сердца. Известно, что GATA связывающий белок 4 и белок NKX2.5 могут физически взаимодействовать посредством С-терминальных цинковых пальчиков и соседней щелочной области GATA связывающего белка 4 и С-терминально располагающегося гомеодомена белка NKX2.5. Установлено также, что GATA связывающий белок 4 и белок NKX2.5 могут синергично активировать промотор ANF, кроме того их коооперация необходима для связывания с ДНК.
Выявление мутаций кодирующей части генов NKX2.5, CFC1, GATA4 рекомендовано для использования в практическом здравоохранении у больных различными видами врожденных пороков сердца для определения генетической причины заболевания. Однако в настоящее время в рутинной практике медицинских лабораторий не проводится скрининг мутаций кодирующей части генов NKX2.5, CFC1, GATA4, поскольку все известные способы определения последовательности кодирующей части этих генов требуют больших затрат времени, включают большое количество манипуляций и приводят к большому количеству ошибок из-за сложности постановки реакций.
Из уровня техники известен способ определения последовательности кодирующей части гена NKX2.5, описанный в: Zhang W, Li X, Shen A, Jiao W, Guan X, Li Z (2009) Screening NKX2.5 mutation in a sample of 230 Han Chinese children with congenital heart diseases. Genet Test Mol Biomarkers, Vol.13, No 2, Pages 159-162. При осуществлении этого способа геномную ДНК выделяют из образцов крови пациентов, применяя стандартную методику выделения ДНК. На выделенной ДНК проводят амплификацию методом полимеразной цепной реакции (ПЦР) с использованием 3 пар синтетических олигонуклеотидов, называемых также праймерами, сконструированных для 2 экзонов гена NKX2.5. Последовательности праймеров приведены ниже:
exon 1F CTTGTGCTCAGCGCTACCT
exon 1R CTGAGTTTCTTGGGGACGAA
exon 2-IF GCGCTCCGTAGGTCAAGC
exon 2-1R TAGGGATTGAGGCCCACG
exon 2-2F CAGACTCTGGAGCTGGTGG
exon 2-2R CCCACGAGAGTCAGGGAG.
ПЦР проводят с использованием 37,5 нг геномной ДНК, в присутствии буфера для ПНР, 1,5 ммоль/л MgCl2, 0,2 ммоль/л каждого деоксинуклеотидтрифосфата, 0,3 мкмоль/л прямого праймера, 0,3 мкмоль/л обратного праймера, 1 ед. Taq-полимеразы в конечном объеме 25 мкл. ПЦР проводят на амплификаторе РТС220 (MJ Research, Watertown, MA), используя следующий протокол: начальная денатурация 94°С в течение 3 мин, затем 35 циклов (денатурация при 94°С 30 секунд, отжиг при 60-63°С 30 секунд и элонгация при 72°С 30 секунд), и завершающая стадия синтеза при 72°С 7 мин. В результате ПЦР получают фрагменты ДНК размером 550, 469 и 443 пары оснований соответственно. Продукты ПЦР очищают с помощью стандартной методики. Очищенные продукты ПЦР секвенируют на генетическом анализаторе 3730 Automatic Sequencer (Applied Biosystems).
В Benson DW, Silberbach GM, Kavanaugh-McHugh A, Cottrill C, Zhang Y, Riggs S, Smalls 0, Johnson MC, Watson MS, Seidman JG, Seidman CE, Plowden J, Kugler JD. (1999) Mutations in the cardiac transcription factor NKX2.5 affect diverse cardiac developmental pathways. J Clin Invest., Vol.104, No 11, Pages 1567-1573 описан способ определения последовательности гена NKX2.5 с использованием следующих праймеров
1F GTCCCGCCTCTCCTGCCCCTTGTG
1R TCCTCCTCCTGGCCCTGAGTTTCT
2F TGGGCGCTCCAGGCAGGACACAGT
2R GCTTGCCATCGCGCACCAGCACTG
3F GTTCCAGAACCGGCGCTACAAGTG
3R GCGCGTGGGACAGAAAAAGTTCCT
При осуществлении этого способа ПЦР проводят с использованием 100 нг геномной ДНК, в присутствии 5 мкл раствора Q (QIAGEN Inc., USA), 1,5 ммоль/л MgCl2, 0,2 ммоль/л каждого деоксинуклеотидтрифосфата, 40 нг прямого праймера, 40 нг обратного праймера, Taq-полимеразы в конечном объеме 25 мкл. ПЦР проводят, используя следующий протокол: начальная денатурация 95°С в течение 2 мин, затем 35 циклов (денатурация при 94°С 10 секунд, отжиг при 65°С 30 секунд и элонгация при 68°С 2 минуты). Продукты ПЦР очищают с помощью стандартной методики. Очищенные продукты ПЦР секвенируют на генетическом анализаторе ABI377 с использованием Auto Assembler (Perkin-Elmer Biosystems, USA) и SEQMAN (DNASTAR Inc., USA).
Известен способ определения последовательности кодирующей части гена NKX2.5, описанный в: Goldmuntz E, Geiger E, Benson DW. (2001) NKX2.5 mutations in patients with tetralogy of fallot. Circulation, Vol.104, No 21, Pages 2565-2568. При осуществлении этого способа, геномную ДНК выделяют из образцов крови пациентов, применяя стандартную методику выделения ДНК. На выделенной ДНК проводят амплификацию методом полимеразной цепной реакции (ПНР) с использованием 4 пар праймеров, сконструированных для 2 экзонов гена NKX2.5. Последовательности праймеров приведены ниже:
1А 5' exon 1F CGGCACCATGCAGGGAAG
1A 5' exon 1R AGGGTCCTTGGCTGGGTCGG
1B 3' exon 1F CCTAAACCTGGAACAGCAGC
1B 3' exon 1R TCCTGGCCCTGAGTTTCTTG
2A 5' exon 2F GCGCTCCGTAGGTCAAGC
2A 5' exon 2R TAGGGATTGAGGCCCACG
2B 3' exon 2F CAGACTCTGGAGCTGGTGG
2В 3' exon 2R CCCACGAGAGTCAGGGAG
ПЦР проводят, используя следующий протокол: начальная денатурация 95°С в течение 2 мин, затем 35 циклов, состоящих из денатурации при 95°С в течение 45 секунд, отжига при 60 или 61°С в течение 30 секунд и элонгации при 72°С в течение 45 секунд. Завершающую стадию синтеза проводят при 72°С в течение 7 мин. В результате ПЦР получают фрагменты ДНК размером 404, 355, 469 и 442 пары оснований соответственно. Продукты ПЦР очищают с помощью стандартной методики. Очищенные продукты ПЦР секвенируют на генетическом анализаторе ABI Prism 373 или 377 (Applied Biosystems).
Из уровня техники известен способ определения последовательности кодирующей части гена GATA4, описанный в: Reamon-Buettner SM, Cho SH, Borlak J. (2007) Mutations in the 3'-untranslated region of GATA4 as molecular hotspots for congenital heart disease (CHD). BMC Med Genet., Vol.8, Page 38-50. При осуществлении этого способа геномную ДНК выделяют из образцов крови пациентов, применяя стандартную методику выделения ДНК. На выделенной ДНК проводят амплификацию методом полимеразной цепной реакции (ПНР) с использованием 13 пар праймеров, сконструированных для 7 экзонов гена GATA4. Последовательности праймеров приведены ниже:
GT4x1F CTTGCACGTGACTCCCACAG
GT4x1R AAGCAAAGGCGGAGAAGCTC
GT4x2-1F TCTCTTTCTGTCGTTCCTCTT
GT4x2-1R GCACGTAGACTGGCGAGGAC
GT4x2-2F GGACCATGTATCAGAGCTTGG
GT4x2-2R GCCCTCGCGCTCCTACTCAC
GT4x3F AGTCAGAGTGAGGAAGAGCAAGAG
GT4x3R CAGTTTCTGTGTGCCGAAGAG
GT4x4F CCAGCCCTGCCTCCCGTTAG
GT4x4R GAGGACTGAGAGATGGGCATCAG
GT4x5F AGTAGCCATCACATCACACAGG
GT4x5R AAAGCTCCCAACACGTTCC
GT4x6F GTTTGTCCCTGCCGCTGATT
GT4x6R GCAGTCGGCCTCCCCACAAA
GTx7-1F ACAAGGCTATGCGTCTCCC
GTx7-1R CTGAGAAAATCCAACACCCG
GT4x7-2F GCGTAATCTTCCCTCTTCCC
GT4x7-2R GGGACAAGGACATCTTGGG
GTx7-3F GTCGACAATCTGGTTAGGGG
GTx7-3R GTACATGGCAAACAGATGCC
GTx7-4F GAGGATCTGAGAACAAGCGG
GTx7-4R CAGCTGCATTTTGATGAGGC
GTx7-5F AAATTGTGGGGTGTGACATACA
GTx7-5R GTTGCAGAATCTCTGGCTTTTT
GTx7-6F CTGTCTGTCTGCTCCTCCTAGC
GTx7-6R ACCTCCCAGTGAAGACCACTAA
Для каждой пары праймеров подбирают свои условия ПЦР - время и температуру отжига. В результате ПЦР получают фрагменты ДНК размером 250, 600, 641, 541, 294, 504, 247, 289, 291, 281, 270, 577 и 586 пар оснований соответственно. Продукты ПЦР очищают с помощью стандартной методики. Очищенные продукты ПЦР секвенируют на генетическом анализаторе ABI 3100 (Applied Biosystems) с помощью набора реагентов «BigDyeTerminator v3.1 Kit» компании Applied Biosystems и указанных выше праймеров.
Известен способ определения последовательности кодирующей части гена GATA4, описанный в: Yang Y-Q, Wang M-Y, Zhang X-L, Tan H-W, Shi H-F, Jiang W-F, Wang X-H, Fang W-Y, Liu X. (2011) GATA4 loss-of-function mutations in familial atrial fibrillation. Clinica Chimica Acta, Vol.412, No 19-20, Pages 1825-1830. При осуществлении этого способа геномную ДНК выделяют из образцов крови пациентов, применяя стандартную методику выделения ДНК. На выделенной ДНК проводят амплификацию методом полимеразной цепной реакции (ПЦР) с использованием 7 пар праймеров, сконструированных для 6 экзонов гена GATA4. Последовательности праймеров приведены ниже:
2-aF GATCTTCGCGACAGTTCCTC
2-aR GTCCCCGGGAAGGAGAAG
2-bF GCTGGGCCTGTCCTACCT
2-bR AAAAACAAGAGGCCCTCGAC
3F GGGCTGAAGTCAGAGTGAGG
3R GATGCACACCCTCAAGTTCC
4F GAGATCTCATGCAGGGTCGT
4R GCCCCTTCCAAATCTAAGTC
5F TCTTTCTCGCTGAGTTCCAG
5R GGGATGTCCGATGCTGTC
6F GCCATCCCTGTGAGAACTGT
6R GAGGGTAGCTCACTGCTTGC
7F AAGTGCTCCTTGGTCCCTTC
7R TTCCCCTAACCAGATTGTCG
ПЦР проводят, используя стандартный протокол. В результате ПЦР получают фрагменты ДНК размером 458, 554, 437, 390, 379, 444 и 479 пары оснований соответственно. Продукты ПЦР очищают с помощью стандартной методики. Очищенные продукты ПЦР секвенируют на генетическом анализаторе ABI Prism 3130 (Applied Biosystems) с помощью набора реагентов BigDye® Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems) и указанных выше праймеров.
Из уровня техники известен способ определения последовательности кодирующей части гена CFC1, описанный в: Selamet Tiemey ES, Marans Z, Rutkin MB, Chung WK (2007) Variants of the CFC1 gene in patients with laterality defects associated with congenital cardiac disease. Cardiol Young, Vol.17, No 3, Pages 268-274. При осуществлении этого способа геномную ДНК выделяют из образцов крови пациентов, применяя стандартную методику выделения ДНК. На выделенной ДНК проводят амплификацию методом полимеразной цепной реакции (ПЦР) с использованием 5 пар праймеров, сконструированных для 6 экзонов гена CFC1. Последовательности праймеров приведены ниже:
1F CTGGAGTAAAGACACCTTCAAATG
1R ATTTATTCTGAGGCTCTTAAGACC
2-3F GATGTAAATTTCTGCTTATACTTC
2-3R TGAATTTATCCTACATATTCTCAG
4F TTTCACATCCCTAACAAGCAG
4R CCCTCTCCTGACGCCTACTC
5F CCACCGCATTGATGCAGGTC
5R GCACTGTGGATCGGTATGGAGG
6F GGACAGAGCCTAGTGAGGGCG
6R CCGGTCACAGTGGTGCTGGG
ПЦР проводят с использованием 100 нг геномной ДНК, в присутствии 2,5 мкл 10-кратного буфера для ПЦР, 50 мкмоль каждого деоксинуклеотидтрифосфата, 0,1 мкмоль/л прямого праймера, 0,1 мкмоль/л обратного праймера, 1 ед. Taq-полимеразы в конечном объеме 25 мкл. ПЦР проводят, используя следующий протокол: начальная денатурация 94°С в течение 30 секунд, затем 35 циклов, состоящих из денатурации при 94°С в течение 45 секунд, отжига при 63°С первые 12 циклов или 58°С в последующие, в течение 30 секунд и элонгации при 72°С в течение 30 секунд. Завершающую стадию синтеза проводят при 72°С в течение 6 мин. В результате ПЦР получают фрагменты ДНК размером 404, 355, 469 и 442 пары оснований соответственно. Продукты ПЦР очищают с помощью стандартной методики. Очищенные продукты ПЦР секвенируют на генетическом анализаторе ABI Prism 377 (Applied Biosystems) с использованием стандратных реагентов и описанных выше праймеров.
Однако провести диагностику всех трех генов, ассоциированных с орфанной моногенной патологией, лежащей в основе семейных форм врожденных пороков сердца, с помощью этих способов очень трудоемко и такой анализ занимает много времени: из-за разной температуры и времени отжига, ПЦР для каждой пары праймеров нужно проводить отдельно. На стадии внесения реагентов в микропланшет для проведения секвенирования много времени уходит на проверку соответствия внесенных праймеров и продуктов амплификации. На этом этапе допускается основная масса ошибок, приводящих к необходимости проведения повторного определения последовательности кодирующей части генов NKX2.5, CFC1 и GATA4. Эти особенности делают невозможным широкое применение упомянутых способов в рутинной лабораторной практике для скрининга мутаций кодирующей части генов NKX2.5, CFC1 и GATA4.
Из уровня техники не выявлен прототип данного изобретения.
Техническим результатом, на достижение которого направлено изобретение, является сокращение времени, затрачиваемого в процессе амплификации, уменьшение количества манипуляций на стадии секвенирования, а также повышение точности и достоверности диагностики путем снижения вероятности ошибок при определении последовательности кодирующих экзонов генов NKX2.5, CFC1, GATA4.
Уменьшение затраченного времени достигается в результате проведения амплификации всех экзонов генов NKX2.5, CFC1, GATA4 одновременно при одной и той же температуре и времени отжига праймеров за счет использования предлагаемого набора праймеров с последовательностями Seq ID NO:1-30.
Дополнительно, уменьшение количества манипуляций и вследствие этого дополнительное уменьшение затраченного времени и снижение вероятности ошибок достигается в результате последующего секвенирования полученных продуктов амплификации с использованием одной пары универсальных праймеров за счет присоединения к последовательностям Seq ID NO:1-30 с 5'-конца последовательности одного из упомянутой пары универсальных праймеров.
В частности, в качестве таких универсальных праймеров могут быть использованы прямой праймер pUC/M13(-21) Seq ID NO:31 и обратный праймер М13(-29) Seq ID NO:32.
В настоящем изобретении предлагается набор праймеров для определения последовательности кодирующих экзонов генов NKX2.5, CFC1, GATA4, с использованием которого амплификацию всех экзонов можно проводить одновременно при одной температуре и времени отжига праймеров, а последующее секвенирование продуктов амплификации можно проводить с использованием одной пары универсальных праймеров.
Создание специфических праймеров для амплификации
Выбор специфических праймеров для амплификации интересующего фрагмента ДНК осуществляют способом, хорошо известным специалистам в данной области. Работа над созданием праймеров строится обычно следующим образом:
1) С помощью открытых и коммерческих баз данных нуклеотидных последовательностей в целевом геноме выбирают уникальный участок, содержащий область интереса исследователя.
2) На основании выбранного участка генома с помощью специального программного обеспечения подбирают последовательность олигонуклеотидов, используемых для проведения ПЦР, как правило, 2 праймера. Многие из таких программ находятся в свободном доступе, например РптегЗ (http://frodo.wi.mit.edu/), Primer designing tool (NCBI), PerlPrimer (http://perlprimer. sourceforge.net/).
3) Пары праймеров дополнительно проверяют на полиморфизмы целевой последовательности в области, комплементарной 3'-концевому участку праймера.
4) К последовательностям прямых праймеров с 5'-конца присоединяют последовательность одного из универсальных праймеров, а к последовательностям обратных праймеров с 5'-конца присоединяют последовательность другого универсального праймера, отличную от той, которая присоединена к прямым праймерам.
4) Праймеры синтезируют на заказ в специализированном сервисном центре, например НПК Синтол.
5) С помощью практических экспериментов доказывают пригодность подобранных последовательностей праймеров для конкретных целей.
Выбор праймеров, являющихся предметом настоящего изобретения, характеризуется тем, что праймеры подбирали таким образом, чтобы оптимальные температура и время отжига всех праймеров для кодирующих экзонов генов NKX2.5, CFC1, GATA4 были одинаковыми.
Предлагаемый набор праймеров для амплификации кодирующих экзонов генов NKX2.5, CFC1, GATA4 характеризуется тем, что содержит
1) праймеры следующего нуклеотидного состава:
2) дополнительно, к последовательностям праймеров Seq ID NO:1, Seq ID NO:3, Seq ID NO:5, Seq ID NO:7, Seq ID NO:9, Seq ID NO:11, Seq ID NO:13, Seq ID NO:15, Seq ID NO:17, Seq ID NO:19, Seq ID NO:21, Seq ID NO:23, Seq ID NO:25, Seq ID NO:27, Seq ID NO:29, называемых «прямыми праймерами», с 5'-конца присоединена последовательность одного универсального праймера, например прямого праймера pUC/M13(-21) Seq ID NO:31, а к последовательностям праймеров Seq ID NO:2, Seq ID NO:4, Seq ID NO:6, Seq ID NO:8, Seq ID NO:10, Seq ID NO:12, Seq ID NO:14, Seq ID NO:16, Seq ID NO:18, Seq ID NO:20, Seq ID NO:22, Seq ID NO:24, Seq ID NO:26, Seq ID NO:28, Seq ID NO:30, называемых «обратными праймерами», с 5'-конца присоединена последовательность другого универсального праймера, например обратного праймера М13(-29) Seq ID NO:32.
Помимо предлагаемых праймеров, в реакционную смесь для амплификации входят следующие компоненты:
- смесь дезоксирибонуклеотидтрифосфатов четырех типов (dATP, dTTP, dGTP, dCTP);
- фермент Taq-полимераза;
- реакционный буфер: 100 ммоль Tris-HCl, pH 8,8 при 25°С, 500 ммоль KCl, 20 ммоль MgCl2);
Амплификация экзонов генов NKX2.5, CFC1, GATA4
Кодирующая часть гена NKX2.5 длиной 1669 пар нуклеотидов состоит из 2 фрагментов, или экзонов. Кодирующая часть гена CFC1 длиной 1677 пар нуклеотидов состоит из 6 фрагментов, или экзонов. Кодирующая часть гена GATA4 длиной 3419 пар нуклеотидов состоит из 7 фрагментов, или экзонов. В случае небольших экзонов, таких как 2 и 3 экзоны гена CFC1, предлагаемый набор праймеров позволяет амплифицировать 2 целых экзона с находящимся между фрагментами некодирующим участком гена, или интроном. В случае больших экзонов, например экзона 2 гена NKX2.5 и экзона 2 гена GATA4, амплификацию проводят в виде двух перекрывающихся фрагментов. Амплификацию проводят из расчета 15 реакций на один образец геномной ДНК по следующей схеме:
Реакцию амплификации проводят одновременно для всех реакционных смесей с использованием специализированного оборудования - амплификатора Veriti® Thermal Cycler, Applied Biosystems, США согласно следующему температурному режиму:
Секвенирование экзонов генов NKX2.5, CFC1, GATA4
После окончания реакции амплификации полученные на первом этапе анализа продукты амплификации используют для постановки реакции секвенирования. В реакции секвенирования продуктов амплификации, полученных в результате первого этапа анализа, используют универсальные праймеры, например прямой праймер pUC/M13(-21) Seq ID NO:31 и обратный праймер М13(-29) Seq ID NO:32. При этом праймеры смешивают с реакционным буфером перед работой, и таким образом исключают стадию внесения разных праймеров в лунки микропланшета, в которых будет проходить реакция секвенирования, это существенно снижает риск допустить ошибку во время внесения компонентов и уменьшает время внесения реактивов более чем в два раза.
Реакцию секвенирования проводят с применением набора меченых дидезоксирибонуклеотидтрифосфатов (BigDye Terminator Cycle Sequencing Kit, версия 3.0, Applied Biosystems, США) и специализированного оборудования - амплификатора Veriti® Thermal Cycler, Applied Biosystems, США, согласно следующему температурному режиму:
Электрофоретический анализ продуктов секвенирования производят на секвенаторе ABI PRISM 377, Applied Biosystems, США. Обработку полученных данных производят с помощью программы BioEdit, или другого аналогичного программного обеспечения.
Изобретение иллюстрируется следующим графическим материалом.
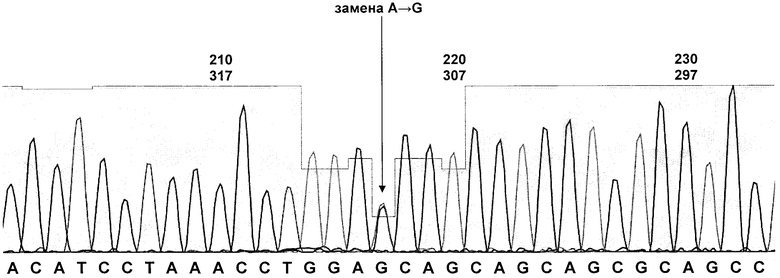
На чертеже представлено графическое изображение результатов секвенирования полученных при использовании заявляемых праймеров для амплификации и определения нуклеотидной последовательности 2 экзона гена NKX2.5. Обнаружен полиморфизм - синонимичная замена A/G (Glu→Glu) с положением 21 в белке.
Заявляемый набор праймеров применяют следующим образом.
1) Получение биологического материала от пациента. В качестве образцов для проведения анализа могут быть использованы биоптаты тканей, кровь, соскобы буккального эпителия.
2) Выделение и очистка препаратов ДНК из исходных образцов. Способы выделения ДНК из биологического материала хорошо известны специалистам и, как правило, включают стадии лизиса клеток, выделения ДНК и ее очистки. Быстрое и качественное выделение ДНК можно проводить с использованием коммерчески доступных наборов реагентов, например «Flexi Gene DNA kit» (не являются предметом данного патента).
3) Амплификация полученных препаратов геномной ДНК с применением предлагаемого набора праймеров, специфичных к экзонам генов NKX2.5, CFC1, GATA4, 15 реакций при одинаковых условиях, 1 загрузка амплификатора. Электрофоретическое разделение и последующая очистка продуктов амплификации.
4) Секвенирование продуктов амплификации, полученных в п.3 с применением пары коммерчески доступных универсальных праймеров, 7 реакций. Очистка продуктов реакции секвенирования и последующий капиллярный электрофорез.
5) Анализ результатов реакции секвенирования с использованием специализированного программного обеспечения, например BioEdit.
Перечень последовательностей нуклеотидов приведен в конце описания.
| название | год | авторы | номер документа |
|---|---|---|---|
| НАБОР СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДОВ ДЛЯ ОПРЕДЕЛЕНИЯ НУКЛЕОТИДНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ КОДИРУЮЩЕЙ ЧАСТИ ГЕНА DES И ВЫЯВЛЕНИЯ МУТАЦИЙ, АССОЦИИРОВАННЫХ С ДЕСМИНОВЫМИ КАРДИОМИОПАТИЯМИ | 2013 |
|
RU2556832C2 |
| Способ поиска мутаций гена ATP7B для постановки диагноза болезни Вильсона (Вильсона-Коновалова) | 2023 |
|
RU2821573C1 |
| Способ генотипирования полиморфного локуса rs139794067 (G>T) гена MYL3 | 2025 |
|
RU2837876C1 |
| Способ преимплантационной генетической диагностики анемии Фанкони | 2018 |
|
RU2697398C2 |
| Способ генотипирования полиморфного локуса rs36210422 (G>A) гена KCNH2 | 2025 |
|
RU2837877C1 |
| Способ анализа крови ВИЧ-инфицированных пациентов | 2024 |
|
RU2830447C1 |
| СПОСОБ АНАЛИЗА СОМАТИЧЕСКИХ МУТАЦИЙ В ГЕНЕ PI3K С ИСПОЛЬЗОВАНИЕМ LNA-БЛОКИРУЮЩЕЙ МУЛЬТИПЛЕКСНОЙ ПЦР И ПОСЛЕДУЮЩЕЙ ГИБРИДИЗАЦИЕЙ С ОЛИГОНУКЛЕОТИДНЫМ БИОЛОГИЧЕСКИМ МИКРОЧИПОМ (БИОЧИПОМ) | 2013 |
|
RU2549682C1 |
| Способ преимплантационной генетической диагностики спинальной мышечной атрофии типа 1 | 2017 |
|
RU2671156C1 |
| НОВЫЕ ПРАЙМЕРЫ ДЛЯ СКРИНИРОВАНИЯ ШИЗОФРЕНИИ И СПОСОБ ЕЕ СКРИНИРОВАНИЯ | 2002 |
|
RU2338788C2 |
| Способ анализа терминальных мутаций в генах BRCA1, BRCA2, ATM и PALB2 с использованием мультиплексной ПЦР и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом) | 2020 |
|
RU2729360C1 |












Изобретение относится к области кардиологии и касается набора синтетических олигонуклотидов. Представленный набор используется для выявления мутаций кодирующей части генов NKX2.5, CFC1, GATA4, ассоциированных с орфанной моногенной патологией, лежащей в основе семейных форм врожденных пороков сердца. Мутации выявляют путем определения полной нуклеотидной последовательности кодирующей части генов NKX2.5, CFC1, GATA4. Осуществляют амплификацию кодирующей части генов NKX2.5, CFC1, GATA4 с помощью 15 пар синтетических олигонуклеотидов при одной температуре и времени отжига с последующим секвенированием полученных продуктов амплификации с помощью одной пары универсальных праймеров. Предложенное изобретение позволяет чувствительно и специфично определять мутации генов NKX2.5, CFC1, GATA4, при этом сокращаются время реакции амплификации, количество манипуляций, время внесения реактивов для реакции секвенирования и снижается вероятность ошибки при постановке реакции. 2 з.п. ф-лы, 1 ил., 4 табл.
1. Набор синтетических олигонуклеотидов для определения нуклеотидной последовательности кодирующей части генов NKX2.5, CFC1, GATA4 и выявления мутаций, ассоциированных с орфанной моногенной патологией, лежащей в основе семейных форм врожденных пороков сердца, включающий праймеры следующей нуклеотидной последовательности:
2. Набор синтетических нуклеотидов по п. 1, в котором к последовательностям Seq ID NO:1, Seq ID NO:3, Seq ID NO:5, Seq ID NO:7, Seq ID NO:9, Seq ID NO:11, Seq ID NO:13, Seq ID NO:15, Seq ID NO:17, Seq ID NO:19, Seq ID NO:21, Seq ID NO:23, Seq ID NO:25, Seq ID NO:27, Seq ID NO:29 с 5'-конца присоединена последовательность первого универсального праймера, а к последовательностям Seq ID NO:2, Seq ID NO:4, Seq ID NO:6, Seq ID NO:8, Seq ID NO:10, Seq ID NO:12, Seq ID NO:14, Seq ID NO:16, Seq ID NO:18, Seq ID NO:20, Seq ID NO:22, Seq ID NO:24, Seq ID NO:26, Seq ID NO:28, Seq ID NO:30 с 5'-конца присоединена последовательность второго универсального праймера, при этом в качестве первого и второго универсального праймера используют разные универсальные праймеры.
3. Набор синтетических нуклеотидов по п.2, в котором в качестве одного из первого или второго универсальных праймеров используют прямой праймер pUC/M13(-21) Seq ID NO:31, а в качестве другого универсального праймера используют обратный праймер М13(-29) Seq ID NO:32.
| Мешалка для паровых котлов или аккумуляторов | 1928 |
|
SU17529A1 |
| Электрический переключатель | 1925 |
|
SU22780A1 |
| WO 2011044927 A1, 21.04.2011 | |||
| ZHANG Wei-min et al., GATA4 and NKX2.5 gene analysis in Chinese Uygur patients with congenital heart disease, Chin Med J 2009, Vol.122, No.4, p.p.416-419 | |||
Авторы
Даты
2015-06-20—Публикация
2013-09-03—Подача