Область техники
Настоящее изобретение относится к гуманизированному антителу против рецептора IGF-1, и более конкретно к гуманизированному антителу против рецептора IGF-1, которое специфически связывается с рецептором IGF-1.
Уровень техники
1. IGF-1
IGF-1 представляет собой инсулиноподобный фактор роста, секретируемый главным образом печенью через активацию рецептора гормона роста (GH) гормоном роста, секретируемым гипофизом, и воздействует на рецептор IGF-1, таким образом выражая различные физиологические функции в различных органах. Вследствие этого ожидается, что IGF-1 будет использоваться для лечения различных заболеваний. Так как аминокислотная последовательность IGF-1 имеет высокое подобие - примерно 40% с последовательностью проинсулина, IGF-1 может связываться с рецептором инсулина и посредством этого проявлять инсулиноподобные действия. Кроме того, так как аминокислотная последовательность рецептора IGF-1 имеет высокое подобие - примерно 60% с последовательностью рецептора инсулина, эти рецепторы могут образовывать гетеродимер и посредством этого проявлять физиологические эффекты. Инсулин может воздействовать на рецептор инсулина, посредством этого проявляя сильный эффект снижения уровня глюкозы в крови, и поэтому используется в качестве гипогликемического лекарственного средства.
2. Рецептор IGF-1
Рецептор IGF-1 представляет собой трансмембранный белок, состоящий из альфа-цепи и бета-цепи, и имеет шесть внеклеточных доменов (L1, CR, L2, Fn1, Fn2 и Fn3), трансмембранный домен и внутриклеточный домен. Внутриклеточный домен рецептора IGF-1 включает тирозинкиназу. Внеклеточный домен участвует в активации внутриклеточной тирозинкиназы, связанной с конформационным изменением рецептора IGF-1, которое происходит, когда IGF-1 связывается с рецептором IGF-1. Рецептор IGF-1 образует гомодимерный комплекс (гомотип). Связывание IGF-1 с рецептором IGF-1 (гомотип) запускает передачу сигналов через активацию рецепторной киназы. Рецептор IGF-1 также образует гетеродимерный комплекс (гетеротип) с рецептором инсулина. Связывание инсулина или IGF-1 с рецептором IGF-1 (гетеротип) запускает передачу сигналов через активацию рецепторной киназы.
3. Физиологические эффекты IGF-1
Показано, что IGF-1 проявляет стимулирующие рост эффекты, такие как увеличение длины тела и массы тела, и инсулиноподобные метаболические эффекты, такие как ускорение метаболизма глюкозы и гипогликемические эффекты. Обнаружено, что мекасермин, человеческий рекомбинантный IGF-1, улучшает симптомы, связанные с аномалией рецептора инсулина, такие как гипергликемия, гиперинсулинемия, черный акантоз и гирсутизм. Также показано, что IGF-1 вызывает улучшение при нарушениях роста при карликовости, резистентной к гормону роста (непатентная литература 1).
4. Способствующие росту эффекты IGF-1
IGF-1 является основным фактором, способствующим росту (непатентная литература 2, непатентная литература 3). Действительно, человеческий рекомбинантный IGF-1 мекасермин клинически используется в качестве лекарственного средства для лечения карликовости. Известно также, что IGF-1 повышает способность хондроцитов человека к синтезу ДНК. Введение IGF-1 также увеличивает массу тела и увеличивает длину бедренной кости у крыс, подвергнутых эктомии гипофиза.
5. Действие IGF-1 на увеличение мышечной массы
Усиление активности клеточной пролиферации с помощью IGF-1 требует непрерывной активации рецептора IGF-1. Животное, сконструированное для сверхэкспрессии рецептора IGF-1, показывает увеличенную мышечную массу. Длительное введение IGF-1/IGFBP 3 пациенту с переломом проксимального отдела бедренной кости повышает у нее/него силу захвата и улучшает ее/его способность вставать из сидячего положения без посторонней помощи. Известно, что уровни IGF-1 в мышцах пожилых людей и мышей ниже, чем у молодых. Повышенная экспрессия IGF-1 специфически в мышечных тканях пожилых мышей увеличивает их мышечную массу по сравнению с мышами дикого типа (непатентная литература 4).
6. Предшествующие продукты для увеличения мышечной массы
Агонист рецептора грелина анаморелин увеличивал мышечную массу тела в ходе клинических исследований при кахексии, которая представляет собой атрофию мало используемых мышц. Однако это влечет за собой побочные эффекты, такие как появление тошноты и гипергликемия. Отрицательный фактор регулятора скелетного миогенеза миостатин воздействует на рецептор активина II (ActRII), тем самым ингибируя Akt/mTOR. Антитело против миостатина LY2495655 увеличивает мышечную массу пациентов, перенесших тотальную артропластику по замене тазобедренного сустава, и лиц пожилого возраста. Антитело против ActRII бимагрумаб увеличивает мышечную массу у пациентов с нервно-мышечными заболеваниями. Однако до сих пор не существует лекарственного средства, которое способствует формированию скелетных мышц и, таким образом, может быть использовано для лечения субъекта, нуждающегося в этом.
6. Гипогликемическое действие IGF-1
Известно, что IGF-1 обладает гипогликемическим действием в виде инсулиноподобного эффекта. IGF-1 усиливает эффект поглощения глюкозы клетками крысы, происходящими из мышц. Введение IGF-1 также снижает уровень глюкозы в крови крыс. Сообщается, что снижающее уровень глюкозы действие IGF-1 вызывает гипогликемию как клиническое побочное действие. Кроме того, введение IGF-1 человеку вызывает гипогликемию. Поэтому в начале лечения IGF-1 необходимо продолжать контролировать дозировку, начиная с низкой дозы, наблюдая за различными клиническими данными, включая уровень глюкозы в крови после введения.
IGF-1 проявляет гипогликемическое действие, например, через промотирование фосфорилирования Akt. Активный вариант Akt усиливает поглощение глюкозы клетками 3T3-L1. С другой стороны, у мыши с дефицитом Akt2 наблюдается повышенный уровень глюкозы в крови. Ингибитор Akt подавляет индуцированное инсулином поглощение глюкозы клетками крысы, происходящими из мышц. Кроме того, также известно, что IGF-1 активирует рецептор инсулина, который играет некую роль в гипогликемическом действии. Такие данные предполагают, что гипогликемическое действие IGF-1 включает гиперактивацию Akt и активацию рецептора инсулина.
8. Короткое время полужизни IGF-1 в крови
IGF-1 имеет короткое время полужизни в крови и поэтому при использовании в лечении требует частых введений. Фактически, человеческий рекомбинантный IGF-1 мекасермин имеет время полужизни в крови от примерно 11 часов до примерно 16 часов, и поэтому при лечении карликовости его необходимо вводить один-два раза в день. Примерно 70-80% IGF-1 в крови связывается с IGFBP3, в то время как свободная форма IGF-1 проявляет физиологический эффект. Связывание IGF-1 с IGFBP3 поддерживает его время полужизни в крови в течение периода времени от примерно 10 часов до примерно 16 часов. Комбинированное лекарственное средство IGF-1 с IGFBP3 IPLEX показывает время полужизни в крови, увеличенное по сравнению с временем полужизни IGF-1 до времени полужизни от примерно 21 часа до примерно 26 часов и, таким образом, позволяет снизить частоту введения до одного раза в день. Однако IPLEX уже выведен с рынка. Также предпринята попытка разработать пегилированный IGF-1 с улучшенной кинетикой IGF-1, но до сих пор не имеется ни одного успешно разработанного лекарственного средства, доступного в настоящее время.
9. Терапевтические действия, которые, как ожидается, будут достигаться через эффекты IGF-1
Известно, что IGF-1 воздействует на различные органы и выполняет широкий ряд физиологических функций. Сообщается, что IGF-1 оказывает нейропротекторное действие на центральную нервную систему путем защиты митохондрий и антиоксидантного действия через активацию рецептора IGF-1. IGF-1 способствует регенерации поврежденных нейритов. Считается, что IGF-1 эффективен при лечении цирроза печени, который развивается в результате повреждения печени или хронического заболевания печени и включает фиброз печени. Введение IGF-1 вызывает улучшение при фиброзе печени у животной модели с циррозом печени. Известно также, что IGF-1 играет некую роль в развитии и функциях почек. IGF-1 обладает защитным действием против окислительного стресса и апоптоза вследствие глюкотоксичности в мезангиальных клетках почек. Ожидается использование IGF-1 в качестве лекарства для лечения нефропатии.
Примеры состояний, которые, как ожидается, будут улучшаться через введение IGF-1, включают саркопению, атрофию мало работающих мышц, кахексию, карликовость, синдром Ларона, цирроз печени, фиброз печени, старение, ограничение внутриутробного роста (IUGR), неврологические заболевания, инсульт головного мозга, повреждение спинного мозга, сердечно-сосудистую защиту, диабет, инсулинорезистентность, метаболический синдром, нефропатию, остеопороз, муковисцидоз, заживление ран, миотоническую дистрофию, СПИД-ассоциированную саркопению, ВИЧ-ассоциированный синдром перераспределения жира, ожог, болезнь Крона, синдром Вернера, Х-сцепленное комбинированное заболевание с иммунодефицитом, потерей слуха, нервной анорексией и ретинопатией недоношенных (непатентная литература 19). Таким образом, ожидается использование IGF-1 в качестве лекарственного средства для лечения различных заболеваний вследствие широкого спектра его физиологических эффектов. Однако такие проблемы, как его неблагоприятное гипогликемическое действие и его короткое время полужизни, требующее многократного введения, мешают его клиническому применению.
10. Антитело-агонист против рецептора IGF-1
Как правило, препараты антител имеют длительное время полужизни и доказывают свою эффективность, если вводятся один-два раза в месяц. Сообщается, что некоторые антитела-агонисты рецептора IGF-1 эффективны in vitro в активации рецептора. В частности, антитела 3B7 и 2D1 усиливают синтез ДНК клетками, экспрессирующими рекомбинантный рецептор IGF-1, и культивируемыми в течение пяти часов in vitro (непатентная литература 5). Антитела-антагонисты против рецептора IGF-1 11A1, 11A4, 11A11 и 24-57, которые обладают активностью по ингибированию пролиферации линии раковых клеток, усиливают, хотя и очень незначительно, фосфорилирование тирозина рецептора IGF-1 in vitro (непатентная литература 6). Показано, что антитела 16-13, 17-69, 24-57, 24-60 и 24-31 эффективны при стимулировании синтеза клеточной ДНК и поглощения глюкозы in vitro за короткое время и обладают потенциалом для проявления гипогликемического эффекта (непатентная литература 7).
Однако фосфорилирование тирозина рецептора IGF-1 наблюдают даже с антителами-антагонистами рецептора IGF-1, которые оказывают ингибирующее действие на пролиферацию раковых клеток, таких как αIR-3, то есть оно не является показателем действия агониста (непатентная литература 5, 6, 8). Оно также не может быть индикатором антител-агонистов с активностью клеточной пролиферации, так как в анализах клеточной пролиферации с использованием синтеза ДНК в качестве индикатора, таких как поглощение тимидина или BrdU, поглощение тимидина также наблюдают для антител-антагонистов рецептора IGF-1 с активностью ингибирования роста раковых клеток (непатентная литература 5-8). Кроме того, все упомянутые выше данные были получены в кратковременных в течение 24 часов анализах, и нет никаких сообщений об антителах-агонистах рецептора IGF-1 которые стимулируют клеточную пролиферацию в культуре в течение нескольких дней (непатентная литература 5-8), не говоря уже об антителах, которые проявляли агонистическую активность в отношении рецептора IGF-1 in vivo. Кроме того, так как IGF-1 оказывает как гипогликемическое действие, так и действие на пролиферацию клетки, необходимо избегать гипогликемических эффектов для того, чтобы можно было вводить антитела-агонисты против рецептора IGF-1 людям в качестве терапевтических агентов, однако сообщений о таких антителах-агонистах рецептора IGF-1 не имеется. Кроме того, антитела имеют большую молекулярную массу и, как известно, показывают низкое распределение в тканях, с распределением в головном мозге около 0,1% и распределением в мышечной ткани около 2%. Поэтому требуются антитела, которые проявляют достаточную фармакологическую активность при чрезвычайно низких концентрациях (порядка пМ), чтобы оказывать свое действие в тканях, где миграция антител низкая. Однако не имеется никаких сообщений об антителах-агонистах рецептора IGF-1, которые могут действовать в таких чрезвычайно низких концентрациях.
На таком фоне авторам настоящего изобретения удалось получить моноклональное мышиное антитело против рецептора IGF-1 IGF11-16, которое вызывает пролиферативную активность миобластов при очень низких концентрациях in vitro и не индуцирует поглощение глюкозы дифференцированными клетками скелетных мышц при таких концентрациях. Кроме того, полученное моноклональное антитело IGF11-16 можно использовать для индукции поглощения глюкозы клетками скелетных мышц. Кроме того, авторы подтвердили, что полученное моноклональное мышиное антитело индуцирует увеличение мышечной массы и удлинение пластинки роста in vivo, не вызывая симптомов гипогликемии (патентная литература 1).
11. Антитело-антагонист рецептора IGF-1
Предпринимаются попытки использовать антитело, которое связывается с рецептором IGF-1, для лечения злокачественных новообразований, основываясь на его антагонистическом действии ингибирования связывания IGF-1 с рецептором IGF-1. Однако существующие антитела-антагонисты рецептора IGF-1 имеют различные побочные эффекты, такие как гипергликемия (непатентная литература 9) при монотерапии, и в комбинации с другими противоопухолевыми агентами также для них показана повышенная частота гипергликемии (непатентная литература 10). Соответственно, ожидается, что их терапевтическое применение будет ограниченным. Недавно для лечения офтальмопатии при гипертиреозе одобрен тепротумумаб (непатентная литература 11).
Список цитированной литературы
Патентная литература
[Патентная литература 1] WO2018/221521A
Непатентная литература
[Непатентная литература 1] Human somatomedin C “Somazon ® Formulation for Injection 10 mg,” Drug interview form, revised May 2015, 5th ed.
[Непатентная литература 2] Abuzzahab, M.J., et al., IGF-1 receptor mutations resulting in intrauterine and postnatal growth retardation. N. Engl. J. Med., 2003. 349(23): p. 2211-22.
[Непатентная литература 3] Woods, K.A., et al., Intrauterine growth retardation and postnatal growth failure associated with deletion of the insulin-like growth factor I gene. N. Engl. J. Med., 1996. 335(18): p. 1363-7.
[Непатентная литература 4] Musaro, A., et al., Localized Igf-1 transgene expression sustains hypertrophy and regeneration in senescent skeletal muscle, Nature Genetics, 2001, Vol.27, No.2, pp.195-200.
[Непатентная литература 5] Xiong, L., et al., Growth-stimulatory monoclonal antibodies against human insulin-like growth factor I receptor. Proc. Natl. Acad. Sci. U S A, 1992. 89(12): p. 5356-60.
[Непатентная литература 6] Runnels, H.A., et al., Human monoclonal antibodies to the insulin-like growth factor 1 receptor inhibit receptor activation and tumor growth in preclinical studies. Adv. Ther., 2010. 27(7): p. 458-75.
[Непатентная литература 7] Soos, M.A., et al., A panel of monoclonal antibodies for the type I insulin-like growth factor receptor. Epitope mapping, effects on ligand binding, and biological activity. J. Biol. Chem., 1992. 267(18): p. 12955-63.
[Непатентная литература 8] Kato, H., et al., Role of tyrosine kinase activity in signal transduction by the insulin-like growth factor-I (IGF-1) receptor. Characterization of kinase-deficient IGF-1 receptors and the action of an IGF-1-mimetic antibody (alpha IR-3). J. Biol. Chem., 1993. 268(4): p. 2655-61.
[Непатентная литература 9] Atzori, F., et al., A Phase I Pharmacokinetic and Pharmacodynamic Study of Dalotuzumab (MK-0646), an Anti-Insulin-like Growth Factor-1 Receptor Monoclonal Antibody, in Patients with Advanced Solid Tumors. Clin. Cancer Res., 2011.17(19):p.6304-12.
[Непатентная литература 10] de Bono J.S., et al., Phase II randomized study of figitumumab plus docetaxel and docetaxel alone with crossover for metastaticcastration-resistant prostate cancer. Clin. Cancer Res., 2014.20(7):p.1925-34.
[Непатентная литература 11] Markham. A, Teprotumumab: First Approval. Drugs, 2020. 80(5): p.509-512.
[Непатентная литература 12] Riechman, L., Clark, M., Waldmann, H., Winter, G.: Reshaping human antibodies for therapy. Nature, 1988. 332:p.323-327.
[Непатентная литература 13] Kabat et al., The Journal of Immunology, 1991, Vol.147, No.5, pp.1709-1719.
[Непатентная литература 14] Al-Lazikani et al., Journal of Molecular Biology, 1997, Vol.273, No.4, pp.927-948.
[Непатентная литература 15] Abhinandan, K.R. et al., Molecular Immunology, 2008, Vol.45, pp.3832-3839.
[Непатентная литература 16] Jian, Y. et al., Nucleic Acids Research, 2013, Vol.41, W34-W40.
[Непатентная литература 17] Yamada, T. et al., Therapeutic monoclonal antibodies. Keio Journal of Medicine, 2011, Vol.60, No.2, pp37-46.
[Непатентная литература 18] Burks, E. A., et al., Proc. Natl. Acad. Sci. USA, 1997, Vol.94, No.2, pp.412-417.
[Непатентная литература 19] Dumet, C., et al., MAbs, 2019, Vol.11, No.8, pp.1341-1350.
[Непатентная литература 20] Saunders, K. O., Frontiers in Immunology, 2019, Vol.10, Article 1296.
[Непатентная литература 21] Walle et al., Expert Opin. Biol. Ther., 2007, Vol.7, No.3, pp.405-418.
[Непатентная литература 22] Silva, J-P., et al., The Journal of Biological Chemistry, 2015, Vol.290, No.9, pp.5462-5469.
Сущность изобретения
Проблема, решаемая изобретением
Целью настоящего изобретения является предоставление гуманизированного антитела против рецептора IGF-1 или его фрагмента или его производного, имеющего специфичность и аффинность связывания или активность, эквивалентные или превышающие таковые у ранее описанного мышиного антитела против рецептора IGF-1 IGF11-16 (патентная литература 1), а также способ его получения.
Конкретные цели настоящего изобретения включают, но без ограничения, с целью получения гуманизированного антитела, имеющего специфичность и аффинность связывания или активность, эквивалентные или более высокие, чем у ранее описанного мышиного антитела IGF11-16 против рецептора IGF-1 (патентная литература 1), (1) предоставление аминокислотных остатков, необходимых для конструирования человеческого каркаса; (2) предоставление позиций аминокислот, необходимых для поддержания активности в последовательностях CDR, которые являются сайтами связывания с антигеном (идентифицированными в настоящем изобретении методом Kabat); (3) предоставление аминокислотных замен для снижения иммуногенности; и (4) предоставление аминокислотных замен для того, чтобы избежать риска деамидирования.
Использование и применение настоящего изобретения позволяет получить гуманизированное антитело против рецептора IGF-1, которое может увеличивать мышечную массу, например, через рецептор IGF-1 человека, не вызывая симптомов гипогликемии. Это делает возможным получение гуманизированного антитела против рецептора IGF-1, которое можно вводить людям с целью лечения состояний или заболеваний, связанных с передачей сигналов рецептором IGF-1, таких как, например, саркопения, мышечная атрофия при неиспользовании или кахексия, или улучшения состояния при них. Это также позволяет получить гуманизированное антитело с низкой иммуногенностью и физической стабильностью, которое можно вводить людям.
Средства для решения проблемы
Таким образом, настоящее изобретение относится, например, к следующим далее аспектам.
[Аспект 1]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное, включающие
участки, определяющие комплементарность тяжелой цепи и легкой цепи (CDR), каждый из которых получен из мышиного родительского антитела IGF11-16; и
участки каркаса тяжелой цепи и легкой цепи (FR), каждый из которых получен из человеческого антитела,
причем по меньшей мере один из CDR содержит замену по меньшей мере одного аминокислотного остатка относительно соответствующего CDR мышиного родительского антитела IGF11-16.
[Аспект 2]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по п.1, причем аминокислотный остаток в 25-й позиции в каркасном участке 1 вариабельной области тяжелой цепи (FR-H1) представляет собой остаток пролина.
[Аспект 3]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по п.1 или 2, включающие
в качестве последовательности CDR-1 вариабельной области тяжелой цепи (CDR-H1), аминокислотную последовательность согласно SEQ ID NO: 1, или аминокислотную последовательность, полученную из SEQ ID NO: 1 путем замены любого одного аминокислотного остатка,
в качестве последовательности CDR-2 вариабельной области тяжелой цепи (CDR-H2), SEQ ID NO: 3 или аминокислотную последовательность согласно SEQ ID NO: 5, или аминокислотную последовательность, полученную из SEQ ID NO: 3 или SEQ ID NO:5 путем замены любого одного, двух, или трех аминокислотных остатков,
в качестве последовательности CDR-3 вариабельной области тяжелой цепи (CDR-H3), аминокислотную последовательность согласно SEQ ID NO: 7, или аминокислотную последовательность, полученную из SEQ ID NO: 7 путем замены любого одного или двух аминокислотных остатков,
в качестве последовательности CDR-1 вариабельной области легкой цепи (CDR-L1), аминокислотную последовательность согласно SEQ ID NO: 9, или аминокислотную последовательность, полученную из SEQ ID NO: 9 путем замены любого одного или двух аминокислотных остатков,
в качестве последовательности CDR-2 вариабельной области легкой цепи (CDR-L2), аминокислотную последовательность согласно SEQ ID NO: 11, или аминокислотную последовательность, полученную из SEQ ID NO: 11 путем замены любого одного аминокислотного остатка,
в качестве последовательности CDR-3 вариабельной области легкой цепи (CDR-L3), аминокислотную последовательность согласно SEQ ID NO: 13, или аминокислотную последовательность, полученную из SEQ ID NO: 13 путем замены любого одного или двух аминокислотных остатков.
[Аспект 4]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по п.1 или 2, включающие
в качестве последовательность CDR-1 вариабельной области тяжелой цепи (CDR-H1), аминокислотную последовательность, имеющую гомологию 80% или более с SEQ ID NO: 1,
в качестве последовательности CDR-2 вариабельной области тяжелой цепи (CDR-H2), аминокислотную последовательность, имеющую гомологию 82% или более с SEQ ID NO: 3 или SEQ ID NO: 5,
в качестве последовательности CDR-3 вариабельной области тяжелой цепи (CDR-H3), аминокислотную последовательность, имеющую гомологию 75% или более с SEQ ID NO: 7,
в качестве последовательности CDR-1 вариабельной области легкой цепи (CDR-L1), аминокислотную последовательность, имеющую гомологию 81% или более с SEQ ID NO: 9,
в качестве последовательности CDR-2 вариабельной области легкой цепи (CDR-L2), аминокислотную последовательности, имеющую гомологию 85% или более с SEQ ID NO: 11, и
в качестве последовательности CDR-3 вариабельной области легкой цепи (CDR-L3), аминокислотную последовательность, имеющую гомологию 77% или более с SEQ ID NO: 13.
[Аспект 5]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по п.1 или 2, включающие
в качестве последовательности CDR-1 вариабельной области тяжелой цепи (CDR-H1), аминокислотную последовательность, полученную из SEQ ID NO: 1, в которой Trp в 3-ей позиции SEQ ID NO: 1 сохраняется или заменяется подобным аминокислотным остатком, причем аминокислотная последовательность дополнительно включает замену любого одного аминокислотного остатка иного, чем аминокислотный остаток в 3-ей позиции, или имеющую гомологию 80% или более с SEQ ID NO: 1,
в качестве последовательности CDR-2 вариабельной области тяжелой цепи (CDR-H2),
аминокислотную последовательность, полученную из SEQ ID NO: 3, в которой Glu в 1-й позиции и Asn в 3-ей позиции SEQ ID NO: 3, каждый, сохраняется или замещается подобным аминокислотным остатком, и Asn в 6-й позиции сохраняется или замещается Ser или Gln, причем аминокислотная последовательность дополнительно включает замену любого одного, двух или трех аминокислотных остатков иных, чем аминокислотные остатки в 1-ой позиции, 3-ей позиции и 6-ой позиции, или имеющую гомологию 82% или более с SEQ ID NO: 3, или
аминокислотную последовательность, полученную из SEQ ID NO: 5, в которой Glu в 1-ой позиции и Asn в 3-ей позиции SEQ ID NO: 5 каждый сохраняется или заменяется подобным аминокислотным остатком, и Ser в 6-ой позиции SEQ ID NO: 5 сохраняется или заменяется Asn или Gln, причем аминокислотная последовательность дополнительно включает замену любого одного, двух или трех аминокислотных остатков иных, чем аминокислотные остатки в 1-ой позиции, 3-ей позиции и 6-ой позиции, или имеющую гомологию 82% или более с SEQ ID NO: 5,
в качестве последовательности CDR-3 вариабельной области тяжелой цепи (CDR-H3), аминокислотную последовательность, полученную из SEQ ID NO: 7, в которой Arg в 4-ой позиции SEQ ID NO: 7 сохраняется или заменяется подобным аминокислотным остатком, причем аминокислотная последовательность дополнительно включает замену любого одного или двух аминокислотных остатков иных, чем аминокислотный остаток в 4-ой позиции SEQ ID NO: 7, или имеющую гомологию 75% или более с SEQ ID NO: 7,
в качестве последовательности CDR-1 вариабельной области легкой цепи (CDR-L1), аминокислотную последовательность, полученную из SEQ ID NO: 9, в которой Trp в 9-ой позиции SEQ ID NO: 9 сохраняется или заменяется подобным аминокислотным остатком, причем аминокислотная последовательность дополнительно включает замену любого одного или двух аминокислотных остатков иных, чем аминокислотный остаток в 9-ой позиции SEQ ID NO: 9, или имеющую гомологию 81% или более с SEQ ID NO: 9,
в качестве последовательности CDR-2 вариабельной области легкой цепи (CDR-L2), аминокислотную последовательность, полученную из SEQ ID NO: 11 путем замены любого одного аминокислотного остатка, или имеющую гомологию 85% или более с SEQ ID NO: 11,
в качестве последовательности CDR-3 вариабельной области легкой цепи (CDR-L3), аминокислотную последовательность, полученную из SEQ ID NO: 13 путем замены любых одного или двух аминокислотных остатков, или имеющую гомологию 77% или более с SEQ ID NO: 13.
[Аспект 6]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-5, которые специфически связываются с внеклеточным доменом рецептора IGF-1 человека, имеющим аминокислотную последовательность согласно SEQ ID NO: 71.
[Аспект 7]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-6, включающие
в качестве вариабельной области тяжелой цепи аминокислотную последовательность согласно SEQ ID NO: 43, 47, 49, 53, 55 или 59, аминокислотную последовательность, полученную из SEQ ID NO: 43, 47, 49, 53, 55 или 59 путем замены, делеции или добавления одного или нескольких аминокислотных остатков, или аминокислотную последовательность, имеющую гомологию 90% или более с SEQ ID NO: 43, 47, 49, 53, 55 или 59, и
в качестве вариабельной области легкой цепи аминокислотную последовательность согласно SEQ ID NO: 65, 67 или 69, аминокислотную последовательность, полученную из SEQ ID NO: 65, 67 или 69 путем замены, делеции или добавления одного или нескольких аминокислотных остатков, или аминокислотную последовательность, имеющую гомологию 90% или более с SEQ ID NO: 65, 67 или 69.
[Аспект 8]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-7, включающие в качестве константной области тяжелой и/или легкой цепей константную область тяжелой и/или легкой цепей иммуноглобулина человека любого класса.
[Аспект 9]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-8, в котором константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG4 человека или область, полученную из нее путем замены от 1 до 10 аминокислот.
[Аспект 10]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-8, в котором константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG1 человека или область, полученную из нее путем замены от 1 до 10 аминокислот.
[Аспект 11]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-10, которые связываются с рецептором IGF-1 с аффинностью, представленной константой равновесной диссоциации (KD) 1×10-7 М или меньше.
[Аспект 12]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-11, которые обладают способностью активировать передачу сигналов рецептором IGF-1.
[Аспект 13]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-12, которые проявляют пролиферативную активность в анализе пролиферации миобластов.
[Аспект 14]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-13, которые проявляют аффинность связывания, сравнимую с аффинностью мышиного родительского антитела IGF11-16 в анализе связывания BIACORE с рекомбинантным растворимым рецептором IGF-1.
[Аспект 15]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-14, которые имеют способность индуцировать эффект увеличения мышечной массы без индукции симптомов гипогликемии у здорового млекопитающего.
[Аспект 16]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-15, которые имеют способность индуцировать эффект удлинения хрящевой пластинки роста без индукции симптомов гипогликемии у гипофизэктомированной животной модели.
[Аспект 17]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-16, которые при введении позвоночному животному в дозе, которая вызывает увеличение мышечной массы и/или длины тела, не снижает уровень глюкозы в крови у позвоночного животного.
[Аспект 18]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-16, которые даже при выявленном в крови уровне, превышающем эффективную дозу в 10 раз, достаточную для индуцирования увеличения мышечной массы и/или длины тела, не снижает уровень глюкозы в крови у позвоночного животного.
[Аспект 19]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-18, которые имеют способность ингибировать активацию передачи сигналов рецептором IGF-1.
[Аспект 20]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-18, которые ингибируют пролиферативную активность по меньшей мере одного лиганда IGF-1, IGF-2 и инсулина, причем лиганд может активировать рецептор IGF-1 в анализе пролиферации миобластов.
[Аспект 21]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-18, которые обладают активностью ингибирования клеточной пролиферации в анализе пролиферации раковых клеток.
[Аспект 22]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-18, которые имеют по меньшей мере одну характеристику, выбранную из следующих:
(1) ингибирование пролиферации клеток, происходящих от позвоночного, индуцированной лигандом, активирующим рецептор IGF-1;
(2) ингибирование пролиферации клеток у позвоночного животного, индуцированной лигандом, активирующим рецептор IGF-1, при нарушении пролиферации клеток;
(3) не влияет на поглощение глюкозы дифференцированными мышечными клетками в дозе, достаточной для ингибирования пролиферации клеток, происходящих от позвоночного, индуцированной лигандом, активирующим рецептор IGF-1; и
(4) не влияет на уровень глюкозы в крови у позвоночных животных даже в дозе, достаточной для ингибирования клеточной пролиферации при нарушении пролиферации клеток позвоночного, вызванной лигандом, активирующим рецептор IGF-1.
[Аспект 23]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пп. 1-22, которое имеет способность индуцировать ингибирующее действие на пролиферацию раковых клеток без воздействия на уровень глюкозы в крови у животной модели ракового заболевания.
[Аспект 24]
Гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по п.23, которые даже при выявленном уровне в крови, превышающем эффективную дозу, достаточную для индукции ингибирующего действия на пролиферацию раковых клеток у животной модели ракового заболевания в 10 раз, не влияет на уровень глюкозы в крови у животной модели.
[Аспект 25]
Молекула нуклеиновой кислоты, включающая полинуклеотидную последовательность, кодирующую гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-24.
[Аспект 26]
Клонирующий вектор или вектор экспрессии, включающий по меньшей мере одну молекулу нуклеиновой кислоты по п.25.
[Аспект 27]
Рекомбинантная клетка, полученная из клетки-хозяина путем введения вектора по п.26.
[Аспект 28]
Способ получения гуманизированного антитела против рецептора IGF-1 или его фрагмента или его производного по любому из пп. 1-24, включающий
культивирование рекомбинантной клетки по п.27; и
очистку гуманизированного антитела против рецептора IGF-1 или его фрагмента или его производного, продуцированного рекомбинантной клеткой.
[Аспект 29]
Фармацевтическая композиция, включающая в качестве активного ингредиента гуманизированное антитело против рецептора IGF-1 или его фрагмент или его производное по любому из пунктов 1-24, молекулу нуклеиновой кислоты по п.25, вектор по п.26 или рекомбинантную клетку по п.27.
[Аспект 30]
Фармацевтическая композиция по п.29 для применения при лечении атрофического заболевания мышц или карликовости.
[Аспект 31]
Фармацевтическая композиция по п.30, причем атрофическим заболеванием мышц является атрофия мало работающих мышц, саркопения или кахексия.
[Аспект 32]
Фармацевтическая композиция по п.30, причем карликовость представляет собой карликовость типа Ларона или карликовость, устойчивую к гормону роста.
[Аспект 33]
Фармацевтическая композиция по п.29 для применения при лечении заболевания, связанного с рецептором IGF-1.
[Аспект 34]
Фармацевтическая композиция по п.33, причем заболевание, связанное с рецептором IGF-1, выбирают из группы, включающей рак печени, нейробластому, рабдомиосаркому, рак костей, детский рак, акромегалию, рак яичников, рак поджелудочной железы, доброкачественную гипертрофию предстательной железы, рак молочной железы, рак предстательной железы, рак костей, рак легких, колоректальный рак, рак шеи, синовиосаркому, рак мочевого пузыря, рак желудка, опухоль Вильмса, диарею, связанную с метастатическим карциноидом и вазоактивной опухолью, секретирующей кишечный пептид, випому, синдром Вернера-Моррисона, синдром Беквита-Видемана, рак почек, почечно-клеточный рак, переходноклеточный рак, саркому Юинга, лейкоз, острый лимфобластный лейкоз, опухоль головного мозга, глиобластому, неглиобластоматозную опухоль головного мозга, менингиому, аденому гипофиза, вестибулярную шванному, недифференцированную нейроэктодермальную опухоль, медуллобластому, астроцитому, олигодендроглиому, опухоль верхней части головного мозга, папиллому сосудистого сплетения, гигантизм, псориаз, атеросклероз, рестеноз гладкой мускулатуры сосудов, несоответствующий рост микрососудов, диабетическую ретинопатию, болезнь Грейвса, рассеянный склероз, системные эритематоды, миастению гравис, аутоиммунный тиреоидит, тиреоидит Хашимото, офтальмопатию щитовидной железы, гипертиреоз и болезнь Бехчета.
Полезные эффекты изобретения
Настоящее изобретение позволяет получить гуманизированное антитело против рецептора IGF-1, которое связывается с рецептором IGF-1 человека и которое можно использовать для лечения или предупреждения заболеваний, которые действуют через рецептор IGF-1 человека. Настоящее изобретение также позволяет получить гуманизированное антитело с низкой иммуногенностью и при этом физически стабильное, которое можно вводить людям.
Краткое описание чертежей
Фиг. 1А-1F показывают пролиферативную активность в отношении миобластов человека различных гуманизированных антител по настоящему изобретению в сравнении с мышиным родительским антителом IGF11-16.
Фиг. 1B - то же, что и выше.
Фиг. 1C - то же, что и выше.
Фиг. 1D - то же, что и выше.
Фиг. 1E - то же, что и выше.
Фиг. 1F - то же, что и выше.
Фиг. 2 представляет собой график, показывающий реактивность гуманизированных антител hIGF13_PS и hIGF25_PS по настоящему изобретению против IGF-1R каждого вида животных, измеренную методом ELISA с использованием клеток HEK293T, экспрессирующих IGF-1R животных разных видов, по сравнению с реактивностью химерного антитела IGF11-16 человека и мыши.
Фиг. 3А показывает изменение уровня глюкозы в крови со временем у морских свинок, обработанных гуманизированным антителом hIGF13_PS по настоящему изобретению.
Фиг. 3B показывает изменение уровня глюкозы в крови со временем у морских свинок, которым вводили гуманизированное антитело hIGF25_PS по настоящему изобретению.
Фиг. 4 показывает изменение концентрации в крови со временем у морских свинок, обработанных гуманизированным антителом hIGF13_PS или hIGF25_PS по настоящему изобретению, по сравнению с морскими свинками, обработанными мышиным родительским антителом IGF11-16.
Фиг. 5 показывает изменения массы длинного разгибателя пальца стопы после 2 недель однократного внутривенного введения гуманизированного антитела hIGF13_PS здоровым морским свинкам по сравнению с непрерывным подкожным введением IGF-1 и однократным внутривенным введением мышиного родительского антитела IGF11-16.
Фиг. 6 показывает изменение толщины эпифиза проксимального отдела большеберцовой кости после 2 недель однократного внутривенного введения гуманизированного антитела hIGF13_PS морским свинкам, подвергнутым гипофизарной эктомии, по сравнению с непрерывным подкожным введением IGF-1 и непрерывным подкожным введением препарата GH.
Фиг. 7 показывает изменение уровня глюкозы в крови у макак-крабоедов, обработанных путем введения гуманизированного антитела hIGF13_PS, по сравнению с обработанными путем введения IGF-1.
Фиг. 8 показывает изменение концентрации в крови у макак-крабоедов, обработанных путем введения гуманизированного антитела hIGF13_PS.
Фиг. 9 показывает зависящее от концентрации действие мышиного родительского антитела IGF11-16 на пролиферацию клеток HepG2.
Описание воплощений
Настоящее изобретение теперь будет описываться ниже со ссылкой на конкретные воплощения, хотя настоящее изобретение никоим образом не должно ограничиваться этими воплощениями. Все ссылки, цитированные в настоящем документе, включая патентные публикации, публикации патентных заявок и непатентные документы, включены в настоящее описание в качестве ссылок во всей полноте.
Единица измерения «М», которая относится к концентрации, используется в настоящем описании как синоним единицы измерения «моль/л», которая относится к молярной концентрации.
Настоящее изобретение относится к гуманизированному антителу против рецептора IGF-1, которое специфически связывается с рецептором IGF-1. Антитело по настоящему изобретению обладает функцией увеличения мышечной массы, действует через рецептор IGF-1 человека, не вызывая симптомов гипогликемии. Это делает возможным улучшение или лечение состояний или заболеваний, связанных с передачей сигналов рецептором IGF-1, таких как саркопения, атрофия мышц при неиспользовании и кератоконус. Кроме того, антитело по настоящему изобретению представляет собой гуманизированное антитело, что обеспечивает низкую иммуногенность и физическую стабильность.
IGF
В настоящем раскрытии IGF упоминается как инсулиноподобный фактор роста, который может являться или IGF-1, или IGF-2. Как IGF-1, так и IGF-2 являются биологическими лигандами, обладающими агонистической активностью, которые связываются с рецептором IGF-1 (рецептор инсулиноподобного фактора роста-I) и передают в клетку сигналы, такие как клеточное деление и метаболизм. Известно также, что IGF-1 и IGF-2 обладают перекрестной авидностью в отношении рецептора инсулина (INSR), который структурно схож с рецептором IGF-1. В настоящем описании в основном будет обсуждаться IGF-1, так как его свойства, такие как физиологические функции, известны больше, чем свойства IGF-2. Однако в контексте обсуждения различных эффектов и заболеваний, опосредованных связыванием лиганда с рецептором IGF-1, в совокупности могут упоминаться как IGF-1, так и IGF-2.
IGF-1, также называемый соматомедином С, представляет собой единственный полипептидный гормон, состоящий из 70 аминокислот. Последовательность человеческого IGF-1 доступна, например, на NCBI с номером эталонной последовательности NP_000609, или, на EMBL-EBI, с регистрационным номером UniProtKB P05019. Аминокислотная последовательность зрелого человеческого IGF-1 показана в SEQ ID NO: 83, и пример соответствующей нуклеотидной последовательности показан в SEQ ID NO: 84. Эта последовательность, состоящая из 70 аминокислот, консервативна у многих видов. В настоящем изобретении термин «IGF-1» без каких-либо ограничений означает белок IGF-1, обладающий такой гормональной активностью, если не указано иное.
IGF-1 продуцируется различными клетками живого организма, включая клетки печени, и содержится в крови и других жидкостях организма. Следовательно, IGF-1 дикого типа можно получить путем очистки из жидкости организма животного или из первичной культивируемой клетки или культивируемой клеточной линии, полученной от животного. Так как гормон роста индуцирует продукцию IGF-1 клетками, IGF-1 также можно очистить из жидкости организма животного, которому введен гормон роста, или из первичной культивируемой клетки животного или линии клеток животного, инкубированных в присутствии гормона роста. В качестве другого способа IGF-1 также можно получить из рекомбинантной клетки, полученной трансфекцией экспрессирующего вектора, несущего молекулу нуклеиновой кислоты, кодирующую аминокислотную последовательность IGF-1, в хозяина, такого как прокариотический организм (например, E. coli) или эукариотическая клетка, включая клетку дрожжей, насекомого, или культивируемая клетка, полученная от млекопитающего или от трансгенного животного или трансгенного растения, в которые трансфицирован ген IGF-1. Человеческий IGF-1 также доступен в качестве реагента для исследований (Enzo Life Sciences, каталог ADI-908-059-0100, Abnova, каталог P3452, и т.д.) или в виде фармацевтического продукта (сомазон® меказермин, ИНКРЕЛЕКС® и т.д.). Активность IGF-1 для использования in vivo и in vitro можно оценить как специфическую активность по отношению к стандартному веществу IGF-1 под кодом NIBSC 91/554, активность которого соответствует одной международной единице/микрограмм. Стандартное вещество доступно от Национального института биологических стандартов и контроля Всемирной организации здравоохранения (World Health Organization’s National Institute for Biological Standards and Control) (NIBSC). В контексте настоящего изобретения IGF-1 рассматривается как обладающий специфической активностью, эквивалентной IGF-1 с кодом NIBSC 91/554.
Рецептор IGF-1
В настоящем раскрытии термин «рецептор IGF-1» или «IGF-1R» относится к рецептору инсулиноподобного фактора роста-I. Термин «рецептор IGF-1», используемый в настоящем описании, означает белок рецептора IGF-1, если не указано иное. Рецептор IGF-1 представляет собой белок, образованный двумя субъединицами, каждая из которых состоит из альфа-цепи и бета-цепи. Аминокислотная последовательность человеческого рецептора IGF-1 указана в SEQ ID NO: 71, в которой последовательность, состоящая из аминокислотных остатков в позициях с 31 по 735, представляет альфа-цепь, в то время как последовательность, начинающаяся с аминокислотного остатка в позиции 740, представляет собой бета-цепь. Альфа-цепь рецептора IGF-1 имеет участок, с которым связывается IGF-1, в то время как бета-цепь имеет трансмембранную структуру и выполняет функцию передачи сигналов в клетку. Альфа-цепь рецептора IGF-1 можно разделить на домены L1, CR, L2, FnIII-1 и FnIII-2a/ID/FnIII-2b. Согласно аминокислотной последовательности рецептора IGF-1 человека, определенной в SEQ ID NO: 71, остатки с позиции 31 по позицию 179 соответствуют домену L1, остатки с позиции 180 по позицию 328 соответствуют домену CR, остатки с позиции 329 по позицию 491 соответствуют домену CR, остатки с позиции 329 по позицию 491 соответствуют домену L2, остатки с позиции с 492 по позицию 607 соответствуют домену FnIII-1, и остатки с позиции 608 по позицию 735 соответствуют домену FnIII-2a/ID/FnIII-2b. Аминокислотная последовательность человеческого рецептора IGF-1 доступна, например, на EMBL-EBI под инвентарным номером UniProtKB P08069, и также указана в списке последовательностей как SEQ ID NO: 71.
Известно, что рецептор IGF-1 экспрессируется в широком ряду тканей и клеток живого организма и получает различные стимулы через IGF-1, такие как индукция клеточной пролиферации и активация внутриклеточных сигналов. В частности, воздействие IGF-1 на миобласты через рецептор IGF-1 можно оценить с использованием активности клеточной пролиферации в качестве индикаторов. По этой причине миобласты полезны при анализе эффектов антител, связывающихся с рецептором IGF-1. Клетки, экспрессирующие рецептор IGF-1, полученный от человека или любого другого позвоночного, можно получить искусственно путем трансфекции вектора экспрессии, несущего молекулу нуклеиновой кислоты, кодирующей аминокислотную последовательность рецептора IGF-1, полученного от человека или любого другого позвоночного, в эукариотическую клетку-хозяина, такую как культивируемая клетка насекомого или клетка млекопитающего, и получить рекомбинантную клетку, экспрессирующую рецептор IGF-1, кодируемый трансфицированной нуклеиновой кислотой на ее клеточной мембране. Полученную клетку, экспрессирующую рецептор IGF-1, можно использовать для анализа связывающей способности и внутриклеточной передачи сигнала антител.
Мышиное родительское антитело IGF11-16
Аминокислотная последовательность CDR-H1 IGF11-16 показана в SEQ ID NO: 85, аминокислотная последовательность CDR-H2 в SEQ ID NO: 86, аминокислотная последовательность CDR-H3 в SEQ ID NO: 87, аминокислотная последовательность CDR-L1 в SEQ ID NO: 88, аминокислотная последовательность CDR-L2 в SEQ ID NO: 89 и аминокислотная последовательность CDR-L3 в SEQ ID NO: 90. Аминокислотная последовательность вариабельной области тяжелой цепи показана в SEQ ID NO: 39 (пример соответствующей нуклеотидной последовательности показан в SEQ ID NO: 40), и аминокислотная последовательность вариабельной области легкой цепи показана в SEQ ID NO: 41 (пример соответствующей нуклеотидной последовательности показан в SEQ ID NO: 42). Полноразмерная аминокислотная последовательность легкой цепи IGF11-16 показана в SEQ ID NO: 91 (пример соответствующей нуклеотидной последовательности показан в SEQ ID NO: 92), и полноразмерная аминокислотная последовательность тяжелой цепи показана в SEQ ID NO: 93 (пример соответствующей нуклеотидной последовательности показан в SEQ ID NO: 94). Все антитела, имеющие названия, включающие экспрессию IGF11-16, относятся к этому мышиному родительскому антителу IGF11-16.
Гуманизированное антитело против рецептора IGF-1
Один аспект настоящего изобретения относится к новому гуманизированному антителу против рецептора IGF-1 (далее в настоящем изобретении соответственно называется «антителом по настоящему изобретению»).
В настоящем раскрытии термин «антитело» обозначает гликопротеин, содержащий по меньшей мере две тяжелые (Н) цепи и две легкие (L) цепи, соединенные вместе посредством дисульфидных связей. Каждая тяжелая цепь имеет вариабельную область тяжелой цепи (сокращенно VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена, т.е. CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенно VL) и константную область легкой цепи. Константная область легкой цепи имеет один домен, т.е. CL. Существуют два типа константных областей легкой цепи, т.е. λ (лямбда) цепь и κ (каппа) цепь. Константные области тяжелой цепи классифицируются на γ (гамма) цепь, μ (мю) цепь, α (альфа) цепь, δ (дельта) цепь и ε (эпсилон) цепь, и различные типы константных областей тяжелой цепи приводят к различным изотипам антител, т.е. IgG, IgM, IgA, IgD и IgE, соответственно. Каждая из VH и VL также разделяется на четыре относительно консервативных участка (FR-1 (FR1), FR-2 (FR2), FR-3 (FR3) и FR-4 (FR4)), которые все вместе называются каркасными участками (FR), и три высоковариабельных участка (CDR-1 (CDR1), CDR-2 (CDR2) и CDR-3 (CDR3)), все вместе называются участками, определяющими комплементарность (CDR). Область VH включает три CDR и четыре FR, расположенные в порядке FR-1 (FR-H1), CDR-1 (CDR-H1), FR-2 (FR-H2), CDR-2 (CDR-H2), FR-3 (FR-H3), CDR-3 (CDR-H3) и FR-4 (FR-H4) от аминного конца к карбоксильному концу. VL включает три CDR и четыре FR, расположенных в порядке FR-1 (FR-L1), CDR-1 (CDR-L1), FR-2 (FR-L2), CDR-2 (CDR-L2), FR-3 (FR-L3), CDR-3 (CDR-L3) и FR-4 (FR-L4) от аминного конца к карбоксильному концу. Вариабельная область каждой тяжелой цепи и легкой цепи включает домен связывания, который взаимодействует с антигеном.
Антитело по настоящему изобретению может представлять собой фрагмент и/или производное антитела. Примеры фрагментов антител включают F(ab’)2, Fab и Fv. Примеры производных антител включают антитела, в которые введена аминокислотная мутация в его константной области; антитела, в которых изменено расположение доменов константных областей; антитела, имеющие два или больше Fc на молекулу; антитела, состоящие только из тяжелой цепи или только из легкой цепи; антитела с модифицированным гликозилированием; биспецифические антитела; конъюгаты антител или фрагментов антител с соединениями или белками иными, чем антитела; ферменты антител; нанотела; тандемные scFv; биспецифические тандемные scFv; диатела и VHH. Используемый в настоящем описании термин «антитело» охватывает такие фрагменты и/или производные антител, если не указано иное.
Термин «моноклональное антитело» классически относится к молекуле антитела, полученной из клона, полученного из единственной продуцирующей антитело клетки, но в настоящем раскрытии относится к молекуле антитела одного типа, содержащей комбинацию VH и VL, состоящую из специфической аминокислотной последовательности. Также возможно получить из моноклонального антитела молекулу нуклеиновой кислоты, имеющую последовательность гена, кодирующую аминокислотную последовательность белка антитела, и такую молекулу нуклеиновой кислоты можно использовать для получения генетически сконструированного антитела. Специалистам в данной области также хорошо известно об использовании подобной генетической информации о последовательностей H-цепи и L-цепи или их вариабельных областей или последовательностей CDR в целях модификации антитела для улучшения его связывающей способности и специфичности или для модификации антитела, полученного от животного, такого как мышь, в антитело человеческого типа, имеющего структуру, пригодную для использования в качестве терапевтического средства. Также возможно получить человеческое моноклональное антитело путем получения трансгенного животного, не являющегося человеком, в которое введен ген человеческого антитела, и сенсибилизации животного антигеном. Кроме того, в качестве способа, который не требует сенсибилизации животных, специалист в данной области может также использовать метод, включающий использование библиотеки фагов, экспрессирующих антигенсвязывающие участки человеческих антител или их части (фаговый дисплей человеческих антител), может быть использован для получения клонов фагов, представляющих антитела, которые специфически связываются с соответствующим антигеном или специфическими аминокислотными последовательностями, и получение человеческого антитела с использованием информации из полученных фазовых клонов (см., например, непатентную литературу 17). Специалист в данной области может также сконструировать антитело для введения животному, не являющемуся человеком, используя информацию об аминокислотных последовательностях CDR и вариабельных областей, в зависимости от обстоятельств, методами, подобными гуманизации.
Согласно одному аспекту, антитело по настоящему изобретению представляет собой гуманизированное антитело против рецептора IGF-1, которое содержит определяющие комплементарность участки (CDR) в каждой из тяжелых и легких цепей, полученных от мышиного родительского антитела IGF11-16, и каркасные участки (FR) в каждой из тяжелых и легких цепей, полученные из человеческого антитела, в котором по меньшей мере один из CDR содержит замену по меньшей мере одного аминокислотного остатка относительно соответствующего CDR мышиного родительского антитела IGF11-16.
В частности, согласно настоящему аспекту, каждый из определяющих комплементарность участков (CDR) тяжелой и легкой цепей получен от соответствующего CDR мышиного родительского антитела IGF11-16. Мышиное родительское антитело «IGF11-16» в настоящем описании относится к моноклональному мышиному антителу против рецептора IGF-1, полученному авторами изобретения ранее, как объяснено выше (патентная литература 1). Термин «полученный» из CDR мышиного родительского антитела в настоящем описании означает, что аминокислотная последовательность каждого CDR антитела данного аспекта гомологична (предпочтительно идентична) аминокислотной последовательности соответствующего CDR мышиного родительского антитела IGF11-16 с гомологией (предпочтительно идентичностью) обычно 75% или более, в частности 80% или более, или 85% или более, или даже, в частности, 90% или более, и/или за исключением различия, обычно составляющего четыре аминокислотных остатка или меньше, в частности, три аминокислотных остатка или меньше и даже, в частности, два аминокислотных остатка или меньше (непатентная литература 18). Однако антитело по настоящему аспекту требует, чтобы по меньшей мере один из его CDR содержал замену по меньшей мере одного аминокислотного остатка относительно соответствующего CDR мышиного родительского антитела IGF11-16. Кроме того, аминокислотная последовательность тяжелой цепи CDR-2 (CDR-H2) должна быть гомологичной (предпочтительно идентичной) только или аминокислотной последовательности CDR-H2 мышиного родительского антитела IGF11-16, или CDR-H2 гуманизированного антитела hIGF13_PS, полученного из мышиного родительского антитела IGF11-16, как описано ниже, с гомологией (предпочтительно идентичностью), обычно 75% или более, в частности 80% или более, или 85% или более, или даже, в частности, 90% или более, и/или за исключением различия, как правило, в четыре аминокислотных остатка или меньше, в частности, в три аминокислотных остатка или меньше и даже, в частности, в два аминокислотных остатках или меньше.
Кроме того, каждый каркасный участок (FR) тяжелой и легкой цепей получают из соответствующего FR иммуноглобулина человека каждого класса, соответственно. Термин «полученный из» FR иммуноглобулина человека в настоящем описании означает, что аминокислотная последовательность каждого FR антитела этой формы гомологична (предпочтительно идентична) аминокислотной последовательности соответствующего FR иммуноглобулина человека, с гомологией (предпочтительно идентичностью) обычно 80% или более, в частности 85% или более, или даже, в частности, 90% или более и/или за исключением различия обычно в четыре аминокислотных остатка или меньше, в частности, в три аминокислотных остатка или меньше и даже, в частности, в два аминокислотных остатка или меньше. Каркасы иммуноглобулинов человека доступны в общедоступных базах данных и могут использоваться для отбора каркасов с высокой гомологией каркасам иммуноглобулинов мыши. Аминокислотные последовательности, имеющие высокую гомологию, можно идентифицировать с использованием, например, IgBLAST (непатентная литература 16).
Аминокислотный остаток в позиции 25 FR1 тяжелой цепи в настоящем описании предпочтительно может представлять собой пролин. Хотя в FR1 тяжелой цепи мышиного родительского антитела IGF11-16 и FR1 тяжелой цепи гуманизированного антитела имеется несколько различных аминокислотных остатков, исследование авторов изобретения показало, что аминокислотный остаток в позиции 25 FR1 тяжелой цепи, который является серином в гуманизированном антителе, может быть заменен предпочтительно на пролин, как в мышином родительском антителе IGF11-16, так как, как описано далее в примере 3, гуманизированное антитело может проявлять активность, эквивалентную или превышающую активность мышиного родительского антитела IGF11-16 («эквивалентная» активность в настоящем описании означает, что отношение активности находится в диапазоне ±20%).
Тяжелые и легкие цепи, имеющие вышеуказанную гомологию, можно получить, например, путем эволюционной инженерии антител, используя в качестве матриц последовательности тяжелых и легких цепей, полученных из гуманизированных антител по настоящему изобретению. Конкретные примеры включают сайтнаправленный мутагенез, неспецифический мутагенез CDR, перестановку цепей, «прогулку» по CDR и т.д.
«Неспецифический мутагенез» представляет собой метод генерации мутантов путем введения случайных мутаций ДНК. Согласно ПЦР-мутагенезу, мутации вводятся путем амплификации ДНК в определенных условиях с низкой строгостью репликации (подверженная ошибкам ПЦР), в результате чего мутации вводятся в участках произвольно по всей ДНК, амплифицированной методом ПЦР. Согласно перетасовке ДНК, ген-мишень сначала фрагментируется, и мутации вводятся в полученные фрагменты таким же образом, как и при ПЦР-мутагенезе. Случайные мутации также можно вводить в предназначенном участке или сайт-специфически путем смешав нескольких оснований на определенной стадии синтеза во время синтеза ДНК.
«Перетасовка цепей» представляет собой метод, при котором один из генов вариабельных областей VH или VL антитела иммобилизуется, а другой объединяется с библиотекой генов V для создания библиотеки. Сконструированную библиотеку экспрессируют на фагах, и затем проводят скрининг на наличие комбинаций вариабельных областей антител, имеющих высокую специфичность в отношении исходного антигена. Такой метод является первым выбором для аффинного созревания in vitro антител, полученных из наивных/неиммунных библиотек.
«Прогулка по CDR» представляет собой метод, при котором случайные мутации вводятся в каждый CDR генов VH и VL, и полученную популяцию мутантов подвергают скринингу с использованием специфических условий для отбора антител, обладающих сильной активностью связывания. Затем выбранные CDR объединяют для получения клона, обладающего еще более сильной активностью связывания. В большинстве случаев для дальнейшего исследования случайные мутации можно ввести только в CDR3.
Как только получено гуманизированное исходное антитело, обладающее специфической активностью, данное исходное антитело можно использовать в качестве матрицы и модифицировать в новое гуманизированное антитело с сохранением его активности с использованием методологии, которая почти полностью установлена, и такой процесс может быть передан на аутсорсинг, например, CRO.
Согласно одному аспекту, антитело по настоящему изобретению может предпочтительно иметь определенную аминокислотную последовательность в качестве каждой последовательности CDR. Конкретные примеры описаны ниже. «Идентичность» между аминокислотными последовательностями в настоящем описании относится к процентному содержанию идентичных аминокислотных остатков в последовательностях, а «сходство» между аминокислотными последовательностями в настоящем описании относится к процентному содержанию идентичных или схожих аминокислотных остатков в последовательностях. Гомология и идентичность между аминокислотными последовательностями можно определить, например, методом BLAST (условия по умолчанию для PBLAST NCBI). Термин «схожие аминокислотные остатки» в настоящем описании относится к аминокислотным остаткам, которые имеют боковые цепи со схожими химическими свойствами (например, зарядом или гидрофобностью). Примеры групп схожих аминокислотных остатков приводятся ниже. Приведенные ниже группы означают, что в случае замены, например, остатка аланина схожим аминокислотным остатком его следует заменить остатком валина, лейцина, изолейцина или метионина.
(1) Аминокислотные остатки с алифатическими боковыми цепями: остатки аланина (Ala или A), валина (Val или V), лейцина (Leu или L), изолейцина (Ile или I) и метионина (Met или M).
(2) Аминокислотные остатки с алифатическими гидроксильными боковыми цепями: остатки серина (Ser или S) и треонина (Thr или T).
(3) Аминокислотные остатки с амидсодержащими боковыми цепями: остатки аспарагина (Asn или N) и глутамина (Gln или Q).
(4) Аминокислотные остатки с ароматическими боковыми цепями: остатки фенилаланина (Phe или F), тирозина (Tyr или Y), триптофана (Trp или W) и гистидина (His или H).
(5) Аминокислотные остатки с основными боковыми цепями: остатки лизина (Lys или K), аргинина (Arg или R) и гистидина (His или H).
(6) Аминокислотные остатки с кислотными боковыми цепями: остатки аспарагиновой кислоты (Asp или D) и глутаминовой кислоты (Glu или E).
(7) Аминокислотные остатки с серосодержащими боковыми цепями: остатки цистеина (Cys или C) и метионина (Met или M).
Последовательность CDR-1 вариабельной области тяжелой цепи (CDR-H1) предпочтительно может представлять собой аминокислотную последовательность SEQ ID NO: 1 или аминокислотную последовательность, полученную из SEQ ID NO: 1 путем замены одного аминокислотного остатка. С другой стороны последовательность CDR-H1 может предпочтительно иметь 80% или большую гомологию (предпочтительно идентичность) с SEQ ID NO: 1. Особенно предпочтительными среди них в качестве последовательности CDR-H1 являются аминокислотные последовательности, имеющие остаток Trp в позиции 3 SEQ ID NO: 1, сохраненный или замененный схожим аминокислотным остатком, а также имеющие любой один аминокислотный остаток иной, чем остаток в позиции 3, сохраненный или замененный схожим аминокислотным остатком, или также имеющий 80% или большую гомологию (предпочтительно идентичность) с SEQ ID NO: 1. Пример последовательности нуклеиновых кислот, соответствующей SEQ ID NO: 1, показан в SEQ ID NO: 2.
Последовательность CDR-2 вариабельной области тяжелой цепи (CDR-H2) может предпочтительно представлять собой аминокислотную последовательность SEQ ID NO: 3 или SEQ ID NO: 5, или аминокислотную последовательность, полученную из SEQ ID NO: 3 или SEQ ID NO: 5 путем замены одного, двух, или трех аминокислотных остатков. С другой стороны, последовательность CDR-H2 может предпочтительно иметь 82% или большую гомологию (предпочтительно идентичность) с SEQ ID NO: 3 или SEQ ID NO: 5. Особенно предпочтительными среди них в качестве последовательности CDR-H2 являются аминокислотные последовательности, имеющие остаток Glu в позиции 1 и остаток Asn в позиции 3 SEQ ID NO: 3, каждый из которых сохранен или заменен схожим аминокислотным остатком, и остаток Asn в позиции 6 SEQ ID NO: 3, сохраненный или замещенный Ser или Gln, и также имеющие любой один, два или три аминокислотных остатка иных, чем остатки в позициях 1, 3 и 6, каждый из которых сохранен или заменен схожим аминокислотным остатком, или также имеющие 82% или большую гомологию (предпочтительно идентичность) с SEQ ID NO: 3. С другой стороны особенно предпочтительными в качестве последовательности CDR-H2 являются аминокислотные последовательности, имеющие остаток Glu в положении 1 и остаток Asn в позиции 3 последовательности SEQ ID NO: 5, каждый из которых сохранен или заменен схожим аминокислотным остатком, и остаток Ser в позиции 6 последовательности SEQ ID NO: 5, сохраненный или замененный на Asn или Gln, а также имеющие любой один, два или три аминокислотных остатка иных, чем остатки в позициях 1, 3 и 6, каждый из которых сохранен или заменен схожим аминокислотным остатком, или также имеющие 82% или большую гомологию (предпочтительно идентичность) с SEQ ID NO: 5. Примеры последовательностей нуклеиновых кислот, соответствующих SEQ ID NO: 3 и SEQ ID NO: 5, показаны в SEQ ID NO: 4 и SEQ ID NO: 6 соответственно.
Последовательность CDR-3 вариабельной области тяжелой цепи (CDR-H3) предпочтительно может представлять собой аминокислотную последовательность SEQ ID NO: 7 или аминокислотную последовательность, полученную из SEQ ID NO: 7 путем замены одного или двух аминокислотных остатков. С другой стороны, последовательность CDR-H3 может предпочтительно иметь 75% или большую гомологию (предпочтительно идентичность) с SEQ ID NO: 7. Особенно предпочтительными среди них в качестве последовательности CDR-H3 являются аминокислотные последовательности, имеющие остаток Arg в позиции 4 SEQ ID NO: 7, сохраненный или замененный схожим аминокислотным остатком, и также имеющие любой один или два аминокислотных остатка иных, чем остаток в позиции 4, каждый из которых сохранен или заменен на схожий аминокислотный остаток, или также имеющие 75% или большую гомологию (предпочтительно идентичность) с SEQ ID NO: 7. Пример последовательности нуклеиновых кислот, соответствующей SEQ ID NO: 7, показан в SEQ ID NO: 8.
Последовательность CDR-1 вариабельной области легкой цепи (CDR-L1) предпочтительно может представлять собой аминокислотную последовательность SEQ ID NO: 9 или аминокислотную последовательность, полученную из SEQ ID NO: 9 путем замены одного или двух аминокислотных остатков. С другой стороны, последовательность CDR-L1 может предпочтительно иметь 81% или большую гомологию (предпочтительно идентичность) с SEQ ID NO: 9. Особенно предпочтительными среди них в качестве последовательности CDR-L1 являются аминокислотные последовательности, имеющие остаток Trp в позиции 9 SEQ ID NO: 9, сохраненный или замененный схожим аминокислотным остатком, а также имеющие любой один или два аминокислотных остатка иных, чем остаток в позиции 9, каждый из которых сохранен или заменен на схожий аминокислотный остаток, или также имеющие 81% или большую гомологию (предпочтительно идентичность) с SEQ ID NО: 9. Пример последовательности нуклеиновых кислот, соответствующей SEQ ID NO: 9, показан в SEQ ID NO: 10.
Последовательность CDR-2 вариабельной области легкой цепи (CDR-L2) предпочтительно может представлять собой аминокислотную последовательность SEQ ID NO: 11 или аминокислотную последовательность, полученную из SEQ ID NO: 11 путем замены одного аминокислотного остатка. С другой стороны, последовательность CDR-L2 может предпочтительно иметь 85% или большую гомологию (предпочтительно идентичность) с SEQ ID NO: 11. Пример последовательности нуклеиновых кислот, соответствующей SEQ ID NO: 11, показан в SEQ ID NO: 10.
Последовательность CDR-3 вариабельной области легкой цепи (CDR-L3) предпочтительно может представлять собой аминокислотную последовательность SEQ ID NO: 13 или аминокислотную последовательность, полученную из SEQ ID NO: 13 путем замены одного аминокислотного остатка. С другой стороны, последовательность CDR-L3 может предпочтительно иметь 77% или большую гомологию (предпочтительно идентичность) с SEQ ID NO: 13. Пример последовательности нуклеиновых кислот, соответствующей SEQ ID NO: 13, показан в SEQ ID NO: 14.
Антитело по настоящему изобретению может особенно предпочтительно иметь специфические комбинации последовательностей CDR, указанные ниже. В частности, антитело по настоящему изобретению может предпочтительно иметь комбинацию аминокислотной последовательности SEQ ID NO: 1 в качестве последовательности CDR-H1, аминокислотной последовательности SEQ ID NO: 3 или SEQ ID NO: 5 в качестве последовательности CDR-H2, аминокислотной последовательности SEQ NO: 7 в качестве последовательности CDR-H3, аминокислотной последовательности SEQ ID NO: 9 в качестве последовательности CDR-L1, аминокислотной последовательности SEQ ID NO: 11 в качестве последовательности CDR-L2 и аминокислотной последовательности SEQ ID NO: 13 в качестве последовательности CDR-L3.
Примеры способов идентификации последовательностей CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 и CDR-L3 в последовательностях антител включают метод Kabat (непатентная литература 13) и метод Chothia (непатентная литература 14), а также методы, улучшенные по сравнению с этими методами (непатентная литература 15). Эти методы хорошо известны специалистам в данной области техники, и с ними можно ознакомиться, например, на домашней странице Dr. Andrew C.R. Martin's Group в Интернете (http://www.bioinf.org.uk/abs /).
Кроме того, как показано в примере 4, можно выполнить аланиновое сканирование для идентификации сайтов в аминокислотной последовательности CDR, которые важны для активности связывания. Из результатов ясно, что аминокислотные остатки, приведенные в таблице 7 и таблице 8 ниже, являются крайне важными. Ожидается, что замена по меньшей мере этих аминокислотных остатков в соответствующем сайте аминокислотами, которые не обладают аналогичными свойствами, приведет к снижению связывающей способности. Напротив, замена аминокислотами, имеющими подобные свойства, может привести к увеличению аффинности связывания. С другой стороны, среди 54 сайтов CDR, замещенных аланином, 44 сайта сохраняют более 80% активности связывания даже после замены аланином. Это предполагает, что аминокислотные замены в этих сайтах существенно не влияют на активность связывания. Таким образом, сканирование аминокислотных последовательностей областей CDR для идентификации сайтов, играющих роль в связывании с антигеном, может использоваться для снижения иммуногенности, улучшения физических свойств и усиления связывания при сохранении свойства связывания.
Антитело по настоящему изобретению предпочтительно должно иметь специфические аминокислотные последовательности в качестве последовательностей вариабельных областей тяжелой цепи и легкой цепи. Конкретные примеры последовательностей приводятся ниже. Выражение «одна или несколько позиций» в настоящем описании относится к одной, двум, трем, четырем, пяти, шести, семи, восьми, девяти или десяти позициям, если не указано иное.
Антитело по настоящему изобретению может предпочтительно иметь в качестве вариабельной области тяжелой цепи аминокислотную последовательность SEQ ID NO: 47 или аминокислотную последовательность, полученную из SEQ ID NO: 47 путем замены, делеции или добавления одного или нескольких аминокислотных остатков. С другой стороны, антитело по настоящему изобретению может предпочтительно иметь в качестве вариабельной области тяжелой цепи аминокислотную последовательность, имеющую 90% или большую гомологию (предпочтительно идентичность) с SEQ ID NO: 47. Особенно предпочтительными среди них в качестве вариабельной области тяжелой цепи являются аминокислотные последовательности VH13_PN (SEQ ID NO: 43), VH13_PS (SEQ ID NO: 47), VH23_PN (SEQ ID NO: 49), VH23_PS (SEQ ID NO: 53), VH25_PN (SEQ ID NO: 55) или VH25_PS (SEQ ID NO: 59). Примеры последовательностей нуклеиновых кислот, соответствующих аминокислотным последовательностям SEQ ID NO: 43, 47, 49, 53, 55 и 59, показаны в SEQ ID NO: 44, 48, 50, 54, 56 и 60 соответственно.
Антитело по настоящему изобретению может предпочтительно иметь в качестве вариабельной области легкой цепи аминокислотную последовательность SEQ ID NO: 67 или аминокислотную последовательность, полученную из SEQ ID NO: 67 путем замены, делеции или добавления одного или нескольких аминокислотных остатков. С другой стороны, антитело по настоящему изобретению может предпочтительно иметь в качестве вариабельной области легкой цепи аминокислотную последовательность, имеющую 90% или большую гомологию (предпочтительно идентичность) с SEQ ID NO: 67. Особенно предпочтительными среди них в качестве вариабельной области легкой цепи являются аминокислотные последовательности VL13 (SEQ ID NO: 61), VL14 (SEQ ID NO: 63), VL22 (SEQ ID NO: 65), VL23 (SEQ ID NO: 67) или VL24 (SEQ ID NO: 69), как вариабельная область легкой цепи. Еще более предпочтительными являются аминокислотная последовательность VL22 (SEQ ID NO: 65), VL23 (SEQ ID NO: 67) или VL24 (SEQ ID NO: 69). Примеры последовательностей нуклеиновых кислот, соответствующих аминокислотным последовательностям SEQ ID NO: 61, 63, 65, 67 и 69, показаны в SEQ ID NO: 62, 64, 66, 68 и 70, соответственно.
Антитело по настоящему изобретению предпочтительнее может иметь любую из аминокислотных последовательностей, описанных выше в качестве вариабельной области тяжелой цепи и вариабельной области легкой цепи. Особенно предпочтительными в качестве антитела по настоящему изобретению являются антитело, имеющее аминокислотную последовательность VH13_PS (SEQ ID NO: 47) в качестве вариабельной области тяжелой цепи и аминокислотную последовательность VL23 (SEQ ID NO: 67) в качестве вариабельной области легкой цепи (называемое далее «IGF13_PS»); и антитело, имеющее аминокислотную последовательность VH25_PS (SEQ ID NO: 59) в качестве вариабельной области тяжелой цепи и аминокислотную последовательность VL23 (SEQ ID NO: 67) в качестве вариабельной области легкой цепи (называемое далее «hIGF25_PS»).
Аминокислотную последовательность каждой из константных областей тяжелой и легкой цепей антитела по изобретению можно выбрать, например, из аминокислотных последовательностей классов человеческих IgG, IgA, IgM, IgE и IgD, а также их вариантов. Согласно одному аспекту, аминокислотная последовательность константной области тяжелой цепи антитела по настоящему изобретению может предпочтительно иметь аминокислотную последовательность константной области тяжелой цепи человеческого иммуноглобулина класса IgG4 или аминокислотную последовательность, полученную из нее через посредство одного-десяти его аминокислотных остатков (непатентная литература 19 и 20). Согласно другому аспекту, аминокислотная последовательность константной области тяжелой цепи антитела по настоящему изобретению может предпочтительно иметь аминокислотную последовательность константной области тяжелой цепи человеческого иммуноглобулина класса IgG1 или аминокислотную последовательность, полученную из нее через посредство одного-десяти его аминокислотных остатков (непатентная литература 19 и 20).
Антитело по настоящему изобретению вызывает реакцию антиген-антитело с рецептором IGF-1 человека. Термин «реакция антиген-антитело» в настоящем описании относится к связыванию антитела с рецептором IGF-1 с аффинностью равновесной константы диссоциации (KD) 1×10-7 М или меньше. Антитела по настоящему изобретению обычно связываются с рецептором IGF-1 с KD 1x10-7 М или меньше, предпочтительно 1x10-8 М или меньше и даже 1x10-9 М или меньше. Наиболее предпочтительно она составляет 1x10-10 М или меньше.
Антитело по настоящему изобретению может предпочтительно обладать способностью специфически связываться с внеклеточным доменом рецептора IGF-1 человека, имеющим аминокислотную последовательность SEQ ID NO: 71. Термин «специфичность» антитела к антигену в настоящем описании означает, что между антителом и антигеном происходит интенсивная реакция антиген-антитело. Термин «антитело, специфичное к рецептору IGF-1» в настоящем описании относится к антителу, чья реактивность антиген-антитело к INSR с высоким сходством со структурой рецептора IGF-1 более высокого порядка составляет менее 1/100 при концентрации, которая вызывает значительную реакцию антиген-антитело с клетками, экспрессирующими рецептор IGF-1.
Специалист в данной области техники может измерить реакцию антиген-антитело, используя анализ связывания в твердофазной или жидкофазной системе, выбранной соответствующим образом. Примеры таких способов включают, но без ограничения, твердофазный иммуноферментный анализ (ELISA), иммуноферментный анализ (EIA), поверхностный плазмонный резонанс (SPR), резонансный перенос энергии флуоресценции (FRET), резонансный перенос энергии люминесценции (LRET) и т.д. Реакцию антиген-антитело также можно обнаружить путем мечения антитела и/или антигена соответствующим веществом для мечения, таким как ферменты, флуоресцентные вещества, люминесцентные вещества, радиоизотопы и т.д., и обнаружения реакции с использованием метода измерения, подходящего для физических и/или химических свойств вещества для мечения.
Согласно одному аспекту, антитело по настоящему изобретению может предпочтительно обладать активностью передачи сигналов рецептором IGF-1, эквивалентной или большей, чем у мышиного родительского антитела IGF11-16. Термин «эквивалентный» в связи с сигнальной активностью рецептора IGF-1 в настоящем описании означает, что величина находится в 2-кратном пределе, и/или значение Emax находится в пределах ±20%.
Согласно одному аспекту, антитело по настоящему изобретению может предпочтительно обладать пролиферативной активностью, эквивалентной или большей, чем у мышиного родительского антитела IGF11-16. Термин «эквивалентный» в связи с пролиферативной активностью в настоящем описании означает, что величина EC50 в анализе пролиферации миобластов находится в 2-кратном пределе и/или величина Emax находится в пределах ±20%.
Согласно одному аспекту, антитело по настоящему изобретению может предпочтительно иметь аффинность связывания с рекомбинантным растворимым рецептором IGF-1, которая эквивалентна или выше, чем у мышиного родительского антитела IGF11-16. Термин «эквивалентный» в связи с пролиферативной активностью в связи с аффинностью связывания с рекомбинантным растворимым рецептором IGF-1 в настоящем описании означает, что величина KD находится в диапазоне, в 1/3 и до 3 раз большем, чем у мышиного родительского антитела IGF11-16.
Согласно одному аспекту, антитело по настоящему изобретению может предпочтительно иметь длительное время полужизни в крови и проявлять эффект увеличения мышечной массы при однократном введении животному. Фактически, согласно исследованию авторов изобретения, гуманизированное антитело против рецептора IGF-1 по настоящему изобретению при введении в виде однократной дозы морской свинке или макаке-крабоеду проявляет эффект увеличения мышечной массы, эквивалентный эффекту, который достигается при непрерывном введении IGF-1, как разъясняется в приведенных ниже примерах.
Согласно одному аспекту, антитело по настоящему изобретению может предпочтительно индуцировать эффект увеличения мышечной массы у здорового млекопитающего, не вызывая симптомов гипогликемии. Согласно одному аспекту, антитело по настоящему изобретению может предпочтительно индуцировать эффект удлинения хрящевой пластинки роста без индукции симптомов гипогликемии у гипофизэктомированного модельного животного. Термин «гипогликемические симптомы» в настоящем описании в случае человека относится к таким симптомам, как холодный пот, учащенное сердцебиение, нарушение сознания, судороги и тремор конечностей, которые возникают при гипогликемии. В случае позвоночных животных, таких как обезьяны, как начальный симптом уменьшаются спонтанные движения, движения почти полностью исчезают по мере усиления симптомов, и сознание ухудшается по мере дальнейшего падения уровня глюкозы в крови, что приводит к смерти.
При введении позвоночному в дозе, которая вызывает увеличение мышечной массы, IGF-1 проявляет заметный гипогликемический эффект и обычно вызывает гипогликемические симптомы. Однако, согласно одному аспекту, антитело по настоящему изобретению может не вызывать такого гипогликемического эффекта у позвоночного даже при введении в дозе, которая вызывает увеличение мышечной массы и/или длины тела, или предпочтительнее в дозе, в 10 раз превышающей такую дозу. Согласно одному аспекту, антитело по настоящему изобретению может не оказывать эффекта снижения уровня глюкозы в крови у позвоночного даже при введении при уровне в крови, который в 10 раз превышает эффективную дозу, которая индуцирует увеличение мышечной массы и/или длины тела позвоночного. Фактически, согласно исследованию авторов изобретения, антитело по настоящему изобретению не вызывает симптомов гипогликемии у морских свинок или макак-крабоедов даже при введении в дозе 10 мг/кг, как показано в примерах ниже.
В итоге, гуманизированное антитело против рецептора IGF-1 по настоящему изобретению потенциально может быть терапевтическим или профилактическим средством в случае различных заболеваний, связанных с рецептором IGF-1, таких как атрофия неиспользуемых мышц и карликовость, причем в то же время преодолевается проблемный гипогликемический эффект, который, как ожидается, будет вызваться IGF-1, и тем самым допускается длительное время полужизни в крови.
Считается, что антитело по настоящему изобретению путем связывания с внеклеточным доменом IGF-1 молекулы(молекул) рецептора активирует как рецептор гомотипа, в котором молекулы рецептора IGF-1 образуют димер, так и рецептор гетеротипа, в котором димер образуют молекула рецептора IGF-1 и молекула INSR.
Оценка иммуногенности
Так как антитела против лекарственных средств (ADA) могут влиять на эффективность и фармакокинетику терапевтических антител и иногда приводить к серьезным побочным эффектам, в соответствии с этим полезность и эффективность терапевтических антител в клинической практике могут быть ограничены выработкой ADA против них. Хотя на иммуногенность терапевтических антител влияют многие факторы, имеется много сообщений о важности эпитопов эффекторных Т-клеток, присутствующих в терапевтических белках. Разработаны различные инструменты in silico для прогнозирования Т-клеточных эпитопов, такие как Epibase (Lonza), iTope/TCED (Antitope) и EpiMatrix (EpiVax). Использование этих инструментов in silico позволяет прогнозировать присутствие Т-клеточных эпитопов в каждой аминокислотной последовательности (непатентная литература 21), посредством чего можно оценить потенциальную иммуногенность. В случае гуманизированного антитела против рецептора IGF-1 по настоящему изобретению потенциальную иммуногенность оценивают с использованием Epibase (Lonza).
Риск деамидирования
Среди возможных последовательностей аминокислот, из которых состоят белки, известно, что NG, NT, NS и NN склонны к деамидированию. Присутствие любой из этих последовательностей может вызвать деамидирование в ней остатка аспарагина до остатка аспарагиновой кислоты, что приводит к возможному снижению активности антитела, а также к потере однородности по качеству. Для того, чтобы сохранить качество в процессе производства и хранения аминокислоты, подверженные риску деамидирования, можно заменить другими аминокислотами, чтобы тем самым предотвратить любую потерю их активности и сохранить их однородное качество. Что касается антитела по настоящему изобретению, то так как участок тяжелой цепи CDR-2 (CDR-H2) мышиного родительского антитела IGF11-16 включает последовательность NS (позиции 55 и 56 тяжелой цепи), остаток аспарагина (N) в позиции 55 тяжелой цепи заменен на серин (S), чтобы избежать риска деамидирования этого аспарагина (N) и превращения его в аспарагиновую кислоту (D).
Оценка стабильности физических свойств
В общем, для обеспечения стабильного поддержания активности антитела в течение длительного периода времени исследуют стабильность физических свойств путем повышения температуры или изменения рН. В случае гуманизированного антитела против рецептора IGF-1 по настоящему изобретению стабильность физических свойств подтверждают с использованием раствора этого антитела в PBS в качестве образца путем инкубации его в течение одного месяца при 37°C и подтверждения того, что чистота составляет 95% или больше и что агрегаты не продуцируются.
Эпитоп гуманизированного антитела против рецептора IGF-1
Согласно одному аспекту, антитело по настоящему изобретению распознает домен CR рецептора IGF-1 как эпитоп. Предпочтительно, чтобы антитело по настоящему изобретению могло связываться с эпитопом, который содержит пептид, имеющий аминокислотную последовательность, соответствующую аминокислотным остаткам от позиции 308 до позиции 319 (ProSerGlyPheIleArgAsnGlySerGlnSerMet) в аминокислотной последовательности человеческого рецептора IGF-1 (SEQ ID No: 71), или последовательность в непосредственной близости от нее. Считается, что антитело по настоящему изобретению активирует как рецептор гомотипа, в котором молекулы рецептора IGF-1 образуют димер, так и рецептор гетеротипа, в котором димер образуют молекула рецептора IGF-1 и молекула INSR, путем связывания с CR-доменом IGF-1 молекулы(молекул) рецептора.
Гуманизированное антитело-агонист против рецептора IGF-1
Антитело-агонист по настоящему изобретению предпочтительно может находиться в форме класса человеческого IgG или его вариантов, подкласса человеческого IgG4 или его вариантов или подкласса человеческого IgG1 или его вариантов. В одном примере стабилизированная константная область IgG4 содержит пролин в позиции 241 шарнирного участка по системе Kabat (непатентная литература 22). Эта позиция соответствует позиции 228 в шарнирном участке в соответствии со схемой нумерации ЕU (непатентная литература 13). В человеческом IgG4 этот остаток обычно представляет собой серин, в то время как стабилизация может быть индуцирована заменой этого серина на пролин. В одном примере мутация N297A может быть включена в константную область IgG1 для того, чтобы подавить, насколько это возможно, его способности связываться с Fc-рецептором и/или закреплять комплемент. Согласно другому аспекту, аминокислотную замену можно ввести в константную область для того, чтобы модулировать ее способность связываться с FcRn и тем самым увеличивать ее время полужизни в крови. Однако возможные аминокислотные замены, которые можно вводить в константную область, не ограничиваются этими примерами.
Антитело-агонист по настоящему изобретению может специфически и сильно связываться с рецептором IGF-1 и оказывать эффект увеличения пролиферации миобластов in vitro при очень низких концентрациях.
Антитело-агонист по настоящему изобретению может проявлять, при введении животному в виде однократной дозы, эффект увеличения мышечной массы, который сопоставим с эффектом непрерывного введения IGF-1. Антитело-агонист по настоящему изобретению может также иметь длительное время полужизни в крови и проявлять эффект увеличения мышечной массы после однократного введения животному. Фактически при введении в виде однократной дозы морской свинке или макаке-крабоеду антитело-агонист по настоящему изобретению проявляет эффект увеличения мышечной массы такого же уровня, который вызывается непрерывным введением IGF-1.
Антитело-агонист по настоящему изобретению также можно характеризовать по отсутствию вызывания гипогликемического эффекта в дозах, которые индуцируют увеличение мышечной массы. IGF-1 оказывает заметное гипогликемическое действие при введении в дозах, которые индуцируют увеличение мышечной массы. Однако антитело-агонист по настоящему изобретению может не оказывать гипогликемического действия на позвоночного в дозах, которые индуцируют у позвоночных увеличение мышечной массы и/или длины тела. Предпочтительно, чтобы антитело-агонист по настоящему изобретению могло не оказывать эффекта снижения уровня глюкозы в крови у позвоночного даже при введении при уровне воздействия в крови, который в 10 раз превышает эффективную дозу, которая индуцирует увеличение мышечной массы и/или длины тела у позвоночного. Фактически, даже когда антитело-агонист по настоящему изобретению вводят морской свинке или макаке-крабоеду при уровне воздействия в крови, который в 10 раз превышает эффективную дозу для индуцирования увеличения мышечной массы, не наблюдается симптомов, связанных со снижением уровня глюкозы в крови или гипогликемией.
На основании приведенных выше результатов антитело-агонист по настоящему изобретению потенциально может являться терапевтическим или профилактическим средством для различных заболеваний, связанных с рецептором IGF-1, таких как саркопения, мышечная атрофия при неиспользовании, катексис и карликовость, причем в то же время преодолевается проблемный гипогликемический эффект, который, как ожидается, будет вызваться IGF-1, и тем самым обеспечивается более длительное время полужизни в крови.
Гуманизированное антитело-антагонист против рецептора IGF-1
Гуманизированное антитело против рецептора IGF-1 по настоящему изобретению можно превратить в антитело-антагонист против рецептора IGF-1 с превосходной активностью и специфичностью, используя преимущества чрезвычайно высокой связывающей способности и специфичности его вариабельных областей. В таком аспекте антитело по настоящему изобретению можно использовать не только в виде IgG, но и в любой другой форме, такой как, хотя и без ограничения, Fab, Fv, scFv или VHH.
Антитела-антагонисты против рецептора IGF-1, полученные таким образом, можно оценить на основании, например, их способности ингибировать активность IGF-1-зависимой клеточной пролиферации в линии раковых клеток. Выбранное таким образом антитело-антагонист против рецептора IGF-1, как ожидается, будет использоваться в качестве противоракового средства и в качестве лекарственного средства для улучшения и лечения заболеваний и состояний, связанных с аномальной пролиферацией клеток.
Такое антитело также можно использовать для конструирования биспецифических или мультиспецифических антител путем слияния его непосредственно или через линкер с различными антителами, которые распознают другие антигены или эпитопы. В таком случае антитело можно использовать не только в виде IgG, но и в любых других формах, таких как, хотя и без ограничения, Fab, Fv, scFv или VHH.
Биспецифическое или мультиспецифическое антитело, содержащее антитело-антагонист против рецептора IGF-1, полученное таким образом, можно оценить на основании, например, его способности ингибировать активность IGF-1-зависимой клеточной пролиферации в линии раковых клеток. Ожидается, что биспецифическое или мультиспецифическое антитело, содержащее антитело-антагонист против рецептора IGF-1, полученное таким образом, будет использоваться в качестве противоракового средства и в качестве лекарственного средства для улучшения и лечения заболеваний и состояний, связанных с аномальной пролиферацией клеток.
Ожидается, что антитело-антагонист против рецептора IGF-1 по настоящему изобретению будет терапевтическим средством для лечения заболеваний, патологические состояния которых могут быть вызваны активацией передачи сигналов рецептором IGF-I. Лиганды, которые могут активировать рецепторы IGF-I, включают IGF-1, IGF-2 и инсулин, а также лиганды для RTK (тирозинкиназ рецепторного типа), которые образуют гетеродимеры с рецепторами IGF-1 (например, EGF) и лигандами для других рецепторов, которые имеют взаимное влияние (например, TSH). Антитело по настоящему изобретению может обладать активностью подавлять передачу сигналов рецептором IGF-1, активируемую этими лигандами (аллостерическое антагонистическое действие). Другими словами, антитело по настоящему изобретению может подавлять чрезмерно индуцированную активность передачи сигналов рецептором IGF-1 путем связывания с рецептором IGF-1 и может быть использовано для лечения или профилактики заболеваний, вызванных аномальной активацией рецептора IGF-1. Антитело по настоящему изобретению может предпочтительно обладать способностью подавлять активацию сигнала на уровне, который эквивалентен или превышает уровень у мышиного родительского антитела IGF11-16. Выражение «эквивалентно мышиному антителу IGF11-16» в настоящем описании относится к активности ингибирования на 10% или больше, предпочтительно на 25% или больше, особенно предпочтительно на 35% или больше максимальной активности клеточной пролиферации, которая может быть индуцирована лигандами, которые могут активировать рецепторы IGF-I, такие как IGF-1, IGF-2, или инсулин в анализе пролиферации миобластов.
Конкретные примеры заболеваний, вызванных аномальной активацией рецепторов IGF-1, включают рак печени, нейробластому, рабдомиосаркому, рак костей, детский рак, акромегалию, рак яичников, рак поджелудочной железы, доброкачественную гипертрофию предстательной железы, рак молочной железы, рак предстательной железы, рак костей, рак легких, колоректальный рак, рак шеи, синовиосаркому, рак мочевого пузыря, рак желудка, опухоль Вильмса, диарею, связанную с метастатическим карциноидом и опухолью, секретирующей вазоактивный кишечный пептид, випому, синдром Вернера-Моррисона, синдром Беквита-Видемана, рак почки, почечно-клеточный рак, переходноклеточный рак, саркому Юинга, лейкоз, острый лимфобластный лейкоз, опухоль головного мозга, глиобластому, неглиобластоматозную опухоль головного мозга, менингиому, аденому гипофиза, вестибулярную шванному, недифференцированную нейроэктодермальную опухоль, медуллобластому, астроцитому, олигодендроглиому, опухоль верхней части головного мозга, папиллому сосудистого сплетения, гигантизм, псориаз, атеросклероз, гладкомышечный сосудистый рестеноз, неправильный рост микрососудов, диабетическую ретинопатию, болезнь Грейвса, рассеянный склероз, системные эритематозы, миастению гравис, аутоиммунный тиреоидит, тиреоидит Хашимото, офтальмопатию, вызванную болезнью щитовидной железы, гипертиреоз и болезнь Бехчета. Эти эффекты можно подтвердить с помощью животной модели, несущей рак.
Гуманизированное антитело против рецептора IGF-1 в качестве средства для локальной доставки
Антитело против рецептора IGF-1 можно использовать для локальной доставки лекарств и антител к клеткам и тканям, экспрессирующим рецептор IGF-1, используя его чрезвычайно высокую связывающую способность и специфичность. В этом случае антитело можно использовать не только в виде IgG, но и в любых других формах, таких как, хотя и без ограничения, Fab, Fv, scFv или VHH. Конъюгат антитело-лекарственное средство, содержащий антитело против рецептора IGF-1 по настоящему изобретению, конъюгированное с лекарственным средством, может доставлять лекарственное средство к локальной мишени, в результате чего лекарственное средство может специфически проявлять свою эффективность при более низкой дозе, что приводит к уменьшению побочных эффектов.
Полученный таким образом конъюгат лекарственного средства или антитела с гуманизированным антителом против рецептора IGF-1 по настоящему изобретению в качестве средства доставки можно оценить, если лекарственное средство является агентом, индуцирующим апоптоз, на основании его способности индуцировать апоптоз в линии раковых клеток, экспрессирующих рецептор IGF-1. Выбранный таким образом конъюгат лекарственного средства или антитела с гуманизированным антителом против рецептора IGF-1 по настоящему изобретению, как ожидается, будет использоваться в качестве противоракового средства и в качестве лекарственного средства для улучшения и лечения заболеваний и состояний, связанных с аномальной пролиферацией клеток.
С другой стороны, антитело против рецептора IGF-1 по настоящему изобретению можно пометить радиоактивным или флуоресцентным соединением для использования при обнаружении раковых клеток, экспрессирующих рецепторы IGF-1. Использование такого диагностического метода позволяет проводить эффективное лечение с использованием антитела-антагониста против рецептора IGF-1.
Конкурентное связывание
Антитела, которые связываются с рецептором IGF-1 как конкуренты антитела против рецептора IGF-1 по настоящему изобретению, также включены в объем настоящего изобретения. Термин «конкурентное связывание» в настоящем изобретении относится к явлению, при котором, когда два или более моноклональных антител сосуществуют с антигеном, причем связывание одного из антител с антигеном ингибируется связыванием другого антитела с антигеном. В общем, его можно измерить путем добавления к фиксированному количеству (концентрации) моноклонального антитела другого моноклонального антитела с увеличением количества (концентрации) последнего антитела и измерения количества (концентрации) последнего антитела, при котором уменьшается связывание первого антитела с антигеном. Степень его ингибирования можно выразить в единицах IC50 или Ki.
Выражение «моноклональное антитело, которое связывается с антигеном как конкурент антитела против рецептора IGF-1 по настоящему изобретению» обозначает антитело, которое при обнаружении связывания антиген-антитело с использованием антитела против рецептора IGF-1 по настоящему изобретению при 10 нМ имеет IC50 обычно 1000 нМ или меньше, в частности, 100 нМ или меньше или даже, в частности, 10 нМ или меньше. При измерении конкурентного связывания одно или несколько используемых антител можно пометить соответствующим метящим веществом, таким как ферменты, флуоресцентные вещества, люминесцентные вещества, радиоизотопы и т.д., и реакцию можно обнаружить с использованием метода измерения, подходящего для физических и/или химических свойств метящего вещества.
Перекрестная реактивность
Антитело по настоящему изобретению может обладать перекрестной реактивностью с рецепторами IGF-1 других позвоночных. Термин «перекрестная реактивность» антитела в настоящем описании относится к способности антитела связываться с рецептором IGF-1 другого вида животных, отличного от целевого вида животных (например, человека), для которого предназначено антитело, чтобы вызывать реакцию антиген-антитело. Гуманизированное антитело против рецептора IGF-1 по настоящему изобретению может проявлять перекрестную реактивность, кроме рецептора IGF-1 человека, в отношении рецепторов IGF-1 других животных, таких как морские свинки, обезьяны, кролики и т.д. С другой стороны, оно не вызывает перекрестной реакции с рецепторами IGF-1 мыши и крысы.
Также возможно использование видов животных, которые не реагируют перекрестно с антителом по настоящему изобретению, и генетическое конструирование клетки или животного такого вида для получения клетки или животного, экспрессирующих рецепторы IGF-1, с которыми антитело по настоящему изобретению может вступать в перекрестную реакцию.
Оценка аффиности связывания
Гуманизированное антитело против рецептора IGF-1 по настоящему изобретению может обладать чрезвычайно сильной аффинностью связывания на уровне, эквивалентном или более высоком, чем у мышиного родительского антитела IGF11-16 (патентная литература 1). Аффинность связывания можно оценить, например, с помощью анализа SPR (поверхностного плазмонного резонанса) с использованием внеклеточного участка рекомбинантного рецептора IGF-1 в качестве антигена. В приведенных ниже примерах аффинность связывания моновалентного (антитела) анализируют с использованием BIACORE, повышая температуру реакции до 40°C и удерживая низкое количество фиксированных антигенов, хотя способы анализа аффинности связывания не ограничиваются этим конкретным методом, но могут быть любыми аналитическими методами, которые могут количественно оценить сильную аффинность связывания.
Оценка передачи сигналов рецептором IGF-1
Гуманизированное антитело против рецептора IGF-1 по настоящему изобретению получено путем отбора гуманизированных антител с уровнями, эквивалентными или превышающими уровни мышиного родительского антитела IGF11-16 (патентная литература 1), с использованием их способности активировать сигнал рецептора IGF-1 в качестве первичной системы оценки.
Для оценки активации сигнала рецептора IGF-1 авторы изобретения использовали коммерчески доступный функциональный анализ PathHunter® IGF1R (производства DiscoverX). Эта система позволяет оценивать фосфорилирование непосредственно под сигналом рецептора IGF-1 с точки зрения ферментативной активности с использованием хемилюминесцентного вещества в качестве субстрата и измерения интенсивности сигнала на основе интенсивности люминесценции.
В частности, используемой клеточной линией являются клетки HEK293, сконструированные для принудительной экспрессии белка-адаптера SHC1-акцептора фермента (EA), слитого белка с доменом SH2, который связывается с рецептором IGF-1 и внутриклеточной тирозинкиназой рецептора IGF-1. В этой клеточной линии связывание лиганда с рецептором IGF-1 приводит к димеризации рецептора с последующим фосфорилированием рецептора, которое рекрутирует белок-адаптер с доменом SH2 для образования рецепторного сигнального комплекса, в результате чего стимулируется связывание EA с пространственно смежной тирозинкиназой и восстанавливается активная β-галактозидаза. Уровень сигнала хемилюминесценции субстрата, гидролизованного активностью такой β-галактозидазы, можно измерить для идентификации действия лекарственного средства на тирозинкиназу рецепторного типа.
Отобраны варианты гуманизированных антител с активностью, индуцирующей сигнал, эквивалентной или более высокой, чем у мышиного родительского антитела IGF11-16, и затем подвергнуты вторичной оценке на основе пролиферации миобластов человека. Способ оценки передачи сигналов рецептором IGF-1 не ограничивается этим конкретным методом, но может представлять собой любую систему, которая может обнаруживать фосфорилирование тирозина рецептора IGF-1 прямо или косвенно и количественно.
Активность, вызывающая пролиферацию клеток, полученных от позвоночного, и активность увеличения массы
Анализ пролиферации миобластов человека выполняют как вторичную систему оценки для гуманизированного антитела по настоящему изобретению, при котором гуманизированные антитела с активностью агонистов, эквивалентной или более высокой, чем у мышиного родительского антитела IGF11-16 (патентный документ 1) в том же диапазоне концентрации сходят на нет. В выбранных таким способом гуманизированных антителах подтверждается отсутствие проявления гипогликемических эффектов in vivo, но наличие эффекта увеличения мышечной массы. Иными словами, гуманизированное антитело против рецептора IGF-1 по настоящему изобретению в одной форме обладает способностью вызывать пролиферацию клеток, полученных от позвоночного.
Термин «клетки, полученные от позвоночного» в контексте настоящего раскрытия предпочтительно должны являться клетками, полученными от млекопитающих, птиц, рептилий, земноводных или рыб, предпочтительнее клетками, полученными от млекопитающих или птиц, еще предпочтительнее клетками, полученными от человека, обезьяны, кролика, морской свинки, свиньи, коровы, овцы, лошади, собаки, крысы или мыши. Клетки, полученные от таких видов, которые экспрессируют рецептор IGF-1, с которым перекрестно реагирует антитело по настоящему изобретению, могут побуждаться к пролиферации антителом по настоящему изобретению. «Клетки, полученные от позвоночного» согласно настоящему раскрытию также охватывают клетки и животных видов, созданных для экспрессии рецептора IGF-1, с которым перекрестно реагирует антитело по настоящему изобретению; и модифицированные клетки животных, полученные от таких сконструированных клеток и животных.
Активность антитела, вызывающую пролиферацию полученных от позвоночного клеток, можно проанализировать in vitro с использованием первичных культивируемых клеток, установленных клеточных линий или трансформантов, полученных из таких клеток.
В настоящем раскрытии термин «первично культивируемые клетки» обозначает клетки, которые выделены из органа или ткани живого организма и, как правило, могут подвергаться пересеву в течение некоторого количества пассажей. Первичные культивируемые клетки, полученные от позвоночного, можно получить из органа или ткани позвоночного путем ферментативной обработки, диспергирования физическими средствами или методом эксплантации. Орган или ткань, или их фрагмент, полученные от позвоночного, также можно использовать для анализа вышеуказанной активности антитела. Предпочтительные примеры органов и тканей, из которых получают первичные клетки, включают эндокринные ткани, такие как щитовидная железа, паращитовидная железа и надпочечник; иммунные ткани, такие как аппендикс, миндалина, лимфатические узлы и селезенка; органы дыхания, такие как трахея и легкое; органы пищеварения, такие как желудок, двенадцатиперстная кишка, тонкий кишечник и толстая кишка; мочевыделительные органы, такие как почки и мочевой пузырь; мужские половые органы, такие как семявыносящий проток, яичко и предстательная железа; женские половые органы, такие как молочная железа и фаллопиева труба; и мышечные ткани, такие как сердечная мышца и скелетные мышцы. Более предпочтительные примеры включают печень, почки или органы пищеварения или мышечные ткани, среди которых мышечные ткани являются еще более предпочтительными. Первичные культивируемые клетки, которые можно использовать для анализа вызывающей пролиферацию активности антитела по настоящему изобретению, представляют собой клетки, которые экспрессируют рецептор IGF-1 и могут быть стимулированы к пролиферации посредством связывания IGF-1 с рецептором IGF-1. Типичными примерами этого являются миобласты скелетных мышц, которые являются первичными культивируемыми клетками, выделенными из мышечной ткани. Также можно получить и использовать первичные культивируемые клетки человеческого или животного происхождения, доступные по заданию или коммерчески доступные на рынке. Первичные культивируемые клетки человека доступны от различных учреждений и компаний, например, ATCC®, ECACC, Lonza, Gibco®, Cell Applications, ScienCell research laboratories и PromoCell.
Способы определения вызывающей клеточную пролиферацию активности антитела по настоящему изобретению в клетках позвоночных включают подсчет клеток, измерение синтеза ДНК и измерение изменения активности метаболического фермента. Способы подсчета клеток включают способы с использованием планшетов для подсчета клеток крови или устройства для подсчета клеток, такие как счетчики Coulter. Методы измерения синтеза ДНК включают методы, основанные на поглощении [3Н]-тимидина или 5-бром-2’-дезоксиуридина (BrdU). Способ измерения изменения активности метаболических ферментов включает колориметрические количественные методы, такие как метод MTT, метод XTT и метод WST. Специалист в данной области техники при необходимости может также использовать другие методы.
Активность, вызывающая клеточную пролиферацию, можно определить по тому, что пролиферация культивируемых клеток, реагирующих с антителом по настоящему изобретению, усиливается по сравнению с пролиферацией культивируемых клеток, не реагирующих с антителом. В таком случае индуцирующую активность можно благоприятно нормализовать путем измерения с использованием IGF-1, исходного лиганда рецептора IGF-1, который реагирует при тех же условиях, что и контроль. Величина EC50 указывает концентрацию, при которой обеспечивается 50% максимальной вызывающей пролиферацию активности в случае, когда антитело по настоящему изобретению и IGF-1 реагируют в различных концентрациях с культивируемыми клетками. В случае, когда активность, вызывающую пролиферацию, оценивают на клетках миобластов скелетных мышц человека, антитело по настоящему изобретению может предпочтительно иметь величину EC50 при активности, вызывающей пролиферацию клеток, эквивалентную или меньше, чем у IGF-1, предпочтительнее величину EC50 в 1/10 или меньше, еще предпочтительнее в 1/20 или меньше, наиболее предпочтительно в 1/50 или меньше от величины для IGF-1. Кроме того, в случае, когда вызывающую пролиферацию активность оценивают на клетках миобластов скелетных мышц человека, антитело по настоящему изобретению может предпочтительно иметь величину EC50 предпочтительно 0,5 нМ или менее, предпочтительнее 0,3 нМ или менее, наиболее предпочтительно 0,1 нМ или менее.
Способы измерения активности индукции роста клеток in vivo включают способ, включающий введение антитела по настоящему изобретению позвоночному и измерение изменений массы, размера, количества клеток и т.д. для всего тела индивидуума, получившего введение, или для органа или ткани, выделенных из индивидуума; и способ, включающий использование животного с трансплантатом клеток позвоночного и измерение изменений массы, размера, количества клеток и т.д. трансплантата, включающего клетки позвоночного. Измерения для всего тела индивидуума включают измерения массы тела, длины тела и окружностей четырех конечностей; измерение состава тела с использованием импедансного метода и измерение креатинина и коэффициента роста креатинина. Измерения для органа, ткани или трансплантата от индивидуума включают, в случае животного, не являющегося человеком, метод, включающий непосредственное извлечение целевого органа, ткани или трансплантата и измерение его массы, размера или количества заключенных в нем клеток. Неинвазивные измерения органа, ткани или трансплантата у человека включают анализ изображений с использованием рентгеновской фотографии, представленной двухэнергетической рентгеновской абсорбциометрией (DXA), КТ и МРТ, и контрастные методы с использованием индикаторов с изотопами или флуоресцентными веществами. Если целевой тканью является скелетная мышца, тогда в качестве индикатора также можно использовать изменение мышечной силы. Специалист в данной области техники может также использовать любые другие подходящие способы для анализа активности антитела по настоящему изобретению для стимуляции роста происходящих от позвоночного клеток in vivo. Способы измерения активности антитела по настоящему изобретению для индукции роста происходящих от позвоночного клеток in vivo включают проведение измерений с использованием, например, способов, упомянутых выше, для индивидуумов, которым вводили антитело по настоящему изобретению, и индивидуумов, которым вводили другое антитело, отличное от антитела настоящего изобретения, или любое другое контрольное вещество, и сравнение результатов измерений между этими индивидуумами.
Что касается гемодинамики антител, то пример 14 ниже показывает сравнение гемодинамики антител hIGF13_PS и hIGF25_PS морской свинки, которые являются антителами по настоящему изобретению, с гемодинамикой мышиного антитела IGF11-16 (патентная литература 1), которое стало основой для разработки антител по настоящему изобретению. В этом примере показано, что антитела по настоящему изобретению обладают улучшенной гемодинамикой по сравнению с IGF11-16.
Одним из эффектов in vivo, достигаемых антителом по настоящему изобретению, является эффект увеличения мышечной массы и/или длины тела. В частности, IGF-1 обладает эффектом индукции роста и дифференцировки миобластов в скелетных мышцах, как упоминалось выше, а также эффектом расширения мышечных волокон. Ожидается, что такие эффекты в совокупности приведут к эффекту увеличения мышечной массы. Подобно IGF-1, когда антитело по настоящему изобретению вводят животному, оно также проявляет эффект увеличения мышечной массы животного.
Способы измерения активности антитела по настоящему изобретению для увеличения мышечной массы включают, для всего тела индивидуума, который получил введение, измерение массы тела, длины тела и окружностей четырех конечностей; измерение состава тела с использованием импедансного метода; и измерение креатинина и коэффициента роста. Другие методы включают: анализ изображений с использованием рентгеновской фотографии, представленной двухэнергетической рентгеновской абсорбциометрией (DXA), КТ и МРТ; контрастные методы с использованием индикаторов с изотопами или флуоресцентными веществами и измерение изменения мышечной силы. В случае животного, не являющегося человеком, также может быть использован способ, включающий непосредственное извлечение органа-мишени, ткани или трансплантата и измерение его массы и/или размера.
Эффект увеличения мышечной массы можно оценить путем сравнения увеличения мышечной массы у индивидуума, которому вводили антитело по настоящему изобретению, и индивидуума, которому антитело не вводили; или сравнения мышечной массы индивидуума до и после введения антитела по настоящему изобретению. Эффект увеличения мышечной массы можно определить, если имеется какое-либо увеличение мышечной массы индивидуума после введения антитела по настоящему изобретению. IGF-1 также играет роль в росте костей и оказывает влияние на увеличение длины тела (рост тела в случае человека). Следовательно, антитело по настоящему изобретению также проявляет эффект увеличения длины тела при введении животному. Эффект антитела по настоящему изобретению в увеличении длины тела индивидуума можно определить путем измерения массы тела, длины тела и окружностей четырех конечностей индивидуума.
Влияние на уровни глюкозы в крови у животных
Согласно одному аспекту, антитело по настоящему изобретению может обладать особенностью отсутствия влияния на уровень глюкозы в крови у позвоночного. Известно, что IGF-1 обладает активностью снижения уровня глюкозы в крови как частью своего агонистического действия на рецептор IGF-1. Однако антитело-агонист по настоящему изобретению, которое функционирует как антитело-агонист рецептора IGF-1, при парентеральном введении животному проявляет свойство не изменять уровень глюкозы в крови даже при попадании в кровь количества, которое в 10 раз превышает эффективную дозу, которая вызывает увеличение мышечной массы.
Свойство не вызывать гипогликемию у позвоночного, которое является характеристикой антитела по настоящему изобретению, также можно оценить in vitro. Антитело по настоящему изобретению не влияет на поглощение in vitro глюкозы клетками, происходящими от позвоночного. Первичные культивируемые клетки, клетки штамма или трансформированные клетки таких клеток можно использовать в качестве клеток для оценки этой особенности антител по настоящему изобретению.
Примеры способов определения влияния антитела по настоящему изобретению на поглощение глюкозы клетками, происходящими от позвоночного, включают измерение внутриклеточной концентрации глюкозы, измерение внутриклеточного поглощения вещества-индикатора аналога глюкозы и измерение изменения количества переносчика глюкозы. Способы измерения концентрации глюкозы включают методы измерения поглощения, такие как ферментативный метод. Способы измерения количества внутриклеточного поглощения вещества-индикатора аналога глюкозы включают измерение количества поглощения, например, [3H]-2’-дезоксиглюкозы. Методы измерения изменения количества переносчика глюкозы включают иммуноцитоокрашивание и вестерн-блоттинг. Специалист в данной области техники также может использовать другие методы соответственно. Факт отсутствия влияния на внутриклеточное поглощение глюкозы можно подтвердить, если внутриклеточное поглощение глюкозы культивируемыми клетками, реагирующими с антителом по настоящему изобретению, почти такое же, как внутриклеточное поглощение глюкозы культивируемыми клетками в отсутствие антитела. В этом случае удобно также проводить измерение в тех же условиях, используя в качестве контроля IGF-1, который является оригинальным лигандом для рецептора IGF-1.
Способы определения поглощения глюкозы in vivo клетками, происходящими от позвоночного, включают способы, включающие парентеральное введение антитела по настоящему изобретению позвоночному и определение изменения содержания глюкозы в органе или ткани индивидуума. Методы измерения для всего организма индивидуума, получившего введение, включают измерение уровня глюкозы в крови и гемоглобина A1C с использованием гликозилированных белков в качестве индикаторов. Способы измерения поглощения глюкозы органом или тканью индивидуума включают, в случае животного, не являющегося человеком, непосредственное извлечение органа или ткани-мишени и вычисление концентрации глюкозы или индикатора. Неинвазивные методы измерения индивидуального поглощения глюкозы органом или тканью человека включают анализ изображений с использованием рентгеновской фотографии, КТ и МРТ и контрастные методы с использованием индикаторов с изотопами или флуоресцентными веществами. Если тканью-мишенью является скелетная мышца, тогда в качестве индикатора также можно использовать эугликемический гиперинсулинемический клемп-тест. Специалист в данной области техники может также использовать любые другие подходящие способы для анализа влияния антитела по настоящему изобретению на поглощение глюкозы in vivo клетками, происходящими от позвоночного.
Антитело по настоящему изобретению также характеризуется тем, что при введении позвоночному даже в эффективной дозе, достаточной для увеличения мышечной массы позвоночного, предпочтительно в дозе, в 10 раз или более превышающей эффективную дозу, оно не изменяет уровень глюкозы в крови позвоночного. При оценке влияния антитела по настоящему изобретению на изменение уровня глюкозы в крови позвоночного предпочтительно использовать животное, принадлежащее к млекопитающим, птицам, рептилиям, земноводным или рыбам, предпочтительнее животное, принадлежащее к млекопитающим или птицам, еще предпочтительнее человека, обезьяну, кролика, морскую свинку, корову, свинью, овцу, лошадь, собаку, крысу или мышь. Животное, сконструированное для экспрессии рецептора IGF-1 вида, который обладает перекрестной реактивностью с антителом по настоящему изобретению, также можно использовать в качестве животного для оценки влияния антитела по настоящему изобретению на изменение уровня глюкозы в крови. Инвазивные методы измерения уровня глюкозы в крови включают колориметрический метод и электродный метод. Примеры ферментативных методов, используемых для обнаружения, включают глюкозооксидазный метод (метод GOD) и глюкозодегидрогеназный метод (метод GDH). Неинвазивные методы включают оптические методы измерения. Специалист в данной области техники также может выбрать любой другой метод соответственно. В случае человека нормальный диапазон уровня глюкозы в крови натощак составляет от 100 мг/дл до 109 мг/дл. Что касается нежелательных явлений в уровне глюкозы в крови, возникающих в результате приема лекарственного средства (Common Terminology Criteria for Adverse Events, v4.0), то уровень глюкозы в крови ниже диапазона от 77 мг/дл до 55 мг/дл определяется как показатель низкого уровня глюкозы в крови, в то время как уровень глюкозы в крови, превышающий диапазон от 109 мг/дл до 160 мг/дл, определяется как показатель высокого уровня глюкозы в крови. Введение лекарственного средства считается не влияющим на уровень глюкозы в крови, когда уровень глюкозы в крови после введения лекарственного средства составляет выше 55 мг/дл и ниже 160 мг/дл, предпочтительнее выше 77 мг/дл и ниже 109 мг/дл. Однако нормальное значение уровня глюкозы в крови и диапазон его колебания варьируются в зависимости от животного, которому вводят лекарственное средство, и даже у человека уровень глюкозы в крови во время введения лекарственного средства не всегда может находиться в пределах нормального диапазона. Соответственно, в контексте настоящего изобретения антитело по настоящему изобретению предпочтительно следует рассматривать как не изменяющее уровень глюкозы в крови позвоночного, которому вводят антитело, когда изменение уровня глюкозы в крови позвоночного составляет предпочтительно 30% или менее, предпочтительнее 20% или менее, еще предпочтительнее 10% или менее по сравнению с контрольной группой, которой вводят растворитель.
Способ получения гуманизированного антитела против рецептора IGF-1
Антитело по настоящему изобретению можно получить гуманизацией мышиного моноклонального антитела против рецептора IGF-1 IGF11-16 (патентная литература 1). Гуманизация представляет собой способ использования моноклонального антитела, полученного от животного вида, не являющегося человеком, и пересадку его участков CDR в человеческие каркасы путем трансплантации CDR (непатентная литература 12). Затем, на основании трехмерного структурного анализа, полученное антитело подвергают введению аминокислотных замен, предназначенных для уменьшения иммуногенности у людей (Т-клеточной антигенности), и/или аминокислотных замен с целью избежать риска посттрансляционных модификаций, таких как деамидирование и окисление, при сохранении в то же время трехмерной структуры. Таким образом, можно получить гуманизированное антитело, которое сохраняет свою активность с обеспечением в то же время технологичности и клинической безопасности.
Очень важно для способа гуманизации получение информации о том, (1) какая конструкция человеческого каркаса требуется для того, чтобы сохранить его активность, и (2) какие аминокислоты в СDR являются незаменимыми. Примеры способа получения таких гуманизированных антител описаны ниже в примерах 1-9. Гуманизированные антитела, полученные таким образом, включают антитела, имеющие VH13_PN (SEQ ID NO: 43), VH13_PS (SEQ ID NO: 47), VH23_PN (SEQ ID NO: 49), VH23_PS (SEQ ID NO: 53), VH25_PN (SEQ ID NO: 55) или VH25_PS (SEQ ID NO: 59) в качестве вариабельной области тяжелой цепи, и VL13 (SEQ ID NO: 61), VL14 (SEQ ID NO: 63), VL22 (SEQ ID NO: 65), VL23 (SEQ ID NO: 67) или VL24 (SEQ ID NO: 69) в качестве вариабельной области легкой цепи, и предпочтительнее, VL22 (SEQ ID NO: 65), VL23 (SEQ ID NO: 67) или VL24 (SEQ ID NO: 69) в качестве вариабельной области легкой цепи. Однако антитела по настоящему изобретению не ограничиваются такими специфическими антителами.
Можно получить молекулу нуклеиновой кислоты, имеющую последовательность оснований, кодирующую аминокислотную последовательность белка полученного гуманизированного антитела против рецептора IGF-1, и такая молекула нуклеиновой кислоты также методами генетической инженерии может быть сконструирована для получения антитела. Цепь Н, L-цепь или их вариабельные области в гене кодирующем антитела можно модифицировать для улучшения авидности и специфичности антитела с учетом информации, например, о последовательностях СDR.
В способе получения антитела по настоящему изобретению, например, культивируют клетки млекопитающих, клетки насекомых и Escherichia coli, в которые вводят гены, кодирующие аминокислотные последовательности белков в целевых антителах, и посредством этого можно получить антитело через очистку полученного культурального супернатанта обычным способом. Конкретный метод поясняется ниже.
Для получения антитела по настоящему изобретению молекула нуклеиновой кислоты, кодирующей вариабельную область Н-цепи, связывается с молекулой нуклеиновой кислоты, кодирующей сигнальный пептид Н-цепи, и молекулой нуклеиновой кислоты, кодирующей константную область Н-цепи. Для получения антитела по настоящему изобретению молекула нуклеиновой кислоты, кодирующей вариабельную область L-цепи, связывается с молекулой нуклеиновой кислоты, кодирующей сигнальный пептид L-цепи, и молекулой нуклеиновой кислоты, кодирующей константную область L-цепи.
Эти ген H-цепи и ген L-цепи вводят в вектор, например, клонирующий вектор или экспрессирующий вектор, подходящий для экспрессии в выбранной клетке-хозяине. В таком случае, ген H-цепи и ген L-цепи можно вводить в один вектор или отдельные векторы, так что могут экспрессироваться оба гена.
Затем вектор, в который введены ген H-цепи и ген L-цепи, вводят в клетку-хозяина. Примеры клеток-хозяев включают эукариотические клетки, такие как клетки млекопитающих, клетки насекомых, дрожжевые клетки или клетки растений и бактериальные клетки. Способ введения генов в клетку-хозяина можно выбрать соответственно из химического способа, такого как кальций-фосфатный способ или липофекция, и физического метода, такого как процесс электропорации или процесс с использованием биобаллистической пушки, и способа, основанного на заражении вирусом или фагом. Клетку-хозяина, в которую вводят ген H-цепи и ген L-цепи, можно использовать при культивировании без какого-либо отбора, избирательно конденсируя рекомбинантные клетки, в которые вводят гены, с использованием свойств, например, лекарственной резистентности и ауксотрофии, или культивировании рекомбинантных клоновых клеток, сконструированных из одной клетки-хозяина, в которую введены гены.
Клетку-хозяина, в которую вводят ген H-цепи и ген L-цепи, культивируют в оптимальной среде и условиях культивирования. В этом процессе продукты гена H-цепи и гена L-цепи, экспрессируемые в клетке-хозяине, обычно секретируются в среду в виде белков-антител, и продуцируемые белки-антитела можно извлечь путем сбора среды. Однако из-за комбинации генов и клетки-хозяина белки-антитела, накопленные в клетке, можно извлечь при необходимости путем разрушения клетки-хозяина, или в случае прокариотической клетки белки-антитела можно извлечь из фракции периплазмы. Примеры способов, обычно используемых для очистки антител из образца, такого как среда, содержащая выделенные белки-антитела, включают осаждение солью; обогащение или обмен растворителем путем диализа и ультрафильтрации; и аффинную хроматографию с использованием носителя, который содержит, например, иммобилизованный белок А, белок G или антиген. Также доступны ионообменная хроматография, гидрофобная хроматография, смешанная хроматография и эксклюзионная хроматография. Разнообразие методов, используемых в этих способах, хорошо известно специалистам в данной области.
В этой связи специалист в данной области техники может получать различные антитела, такие как белки химерного антитела, низкомолекулярные антитела и каркасные антитела, используя известные методы, например, путем генетической модификации гена, кодирующего тяжелую цепь и/или легкую цепь иммуноглобулина, для введения желаемого признака, или с использованием информации о структуре вариабельных областей или участков CDR тяжелой цепи и/или легкой цепи иммуноглобулина. Кроме того, для того. чтобы улучшить характеристики антитела или избежать побочных эффектов, можно ввести модификацию в структуру константной области антитела или ввести сайты гликозилирования антитела, используя методы, хорошо известные специалистам в данной области техники, в зависимости от обстоятельств.
Лекарственное средство, содержащее гуманизированное антитело против рецептора IGF-1
Антитело по настоящему изобретению можно использовать в качестве терапевтического средства, или профилактического средства, или диагностического средства для состояний, связанных с IGF-1, или заболеваний, вызванных воздействием на рецепторы IGF-1. Терапевтические агенты, профилактические агенты или диагностические агенты будут все именоваться «лекарственными средствами» или «агентами».
В частности, состояния, связанные с IGF-1, или заболевания, которые могут быть целью терапии или профилактики с использованием антитела-агониста против рецептора IGF-1, включают, но без ограничения, заболевание мышечную атрофию (например, атрофию неиспользуемых мышц, саркопению и кахексию), карликовость (например, карликовость типа Ларона и карликовость, резистентную к гормону роста), цирроз печени, фиброз печени, диабетическую нефропатию, хроническую почечную недостаточность, старение, ограничение внутриутробного роста (IUGR), неврологические заболевания, инсульт, повреждение спинного мозга, защиту сердечно-сосудистой системы, диабет, инсулинорезистентность, метаболический синдром, нефропатию, остеопороз, муковисцидоз, заживление ран, миотоническую дистрофию, СПИД-ассоциированную саркопению, ВИЧ-ассоциированный синдром перераспределения жира, ожоги, болезнь Крона, синдром Вернера, Х-сцепленное комбинированное иммунодефицитное заболевание, потерю слуха, нервно-психическую анорексию и ретинопатию недоношенных, синдром Тернера, синдром Прадера-Вилли, синдром Сильвера-Рассела, идиопатическую карликовость, ожирение, рассеянный склероз, язвенный колит, низкую мышечную массу, ишемию миокарда и снижение плотности костной ткани.
Антитело по изобретению предпочтительно можно использовать в качестве терапевтического или профилактического средства при атрофическом заболевании мышц (например, атрофии мало работающих мышц, саркопении, кахексии и т.д.) и/или карликовости (например, карликовости по типу Ларона, низкорослости, устойчивой к гормону роста, и т.д.). Антитело по настоящему изобретению также может являться превосходным в том смысле, что оно при введении не вызывает колебаний уровня глюкозы в крови. Лекарственное средство с антителом, конъюгат антитело-лекарственное средство или диагностический агент, в котором часть или все антитело против рецептора IGF-1 присутствуют в качестве компонента, можно использовать для лечения или профилактики или диагностики заболеваний, включая нейробластому, рабдомиосаркому, рак костей, детский рак, акромегалию, рак яичников, рак поджелудочной железы, доброкачественную гипертрофию предстательной железы, рак молочной железы, рак предстательной железы, рак костей, рак легких, колоректальный рак, рак шеи, синовиосаркому, рак мочевого пузыря, рак желудка, опухоль Вильмса, диарею, связанную с метастатическим карциноидом и вазоактивной опухолью, секретирующей кишечный пептид, випому, синдром Вернера-Моррисона, синдром Беквита-Видемана, рак почки, почечно-клеточный рак, переходно-клеточный рак, саркому Юинга, лейкоз, острый лимфобластный лейкоз, опухоль головного мозга, глиобластому, неглиобластоматозную опухоль головного мозга, менингиому, аденому гипофиза, вестибулярную шванному, недифференцированную нейроэктодермальную опухоль, медуллобластому, астроцитому, олигодендроглиому, опухоль верхней части головного мозга, папиллому сосудистого сплетения, гигантизм, псориаз, атеросклероз, рестеноз гладкой мускулатуры сосудов, неадекватный рост микрососудов, диабетическую ретинопатию, болезнь Грейвса, системный эритематоз, тяжелую псевдопаралитическую миастению, аутоиммунный тиреоидит, тиреоидит Хашимото, офтальмопатию щитовидной железы, гипертиреоз и болезнь Бехчета.
Лекарственное средство, содержащее антитело по настоящему изобретению, можно получить в форме фармацевтической композиции, которая, кроме антитела по настоящему изобретению, содержит фармацевтически приемлемый носитель и/или любой другой эксципиент. Получение лекарственного средства с использованием фармацевтически приемлемого носителя и/или любого другого эксципиента можно выполнить в соответствии, например, со способом, описанным в University of the Sciences в Филадельфии, «Remington: The Science and Practice of Pharmacy, 20th EDITION», Lippincott Williams & Wilkins, 2000.
Такой агент может быть предоставлен в виде жидкого состава, полученного путем растворения, суспендирования или эмульгирования ингредиентов в стерильной водной среде или маслянистой среде, или в виде их лиофилизированных препаратов. Средой или растворителем для получения такой композиции может являться водная среда, примеры которой включают дистиллированную воду для инъекций и физиологический раствор, который необязательно можно использовать с добавлением осморегулирующего агента (например, D-глюкозы, D-сорбита, D-маннита и хлорида натрия), и/или в сочетании с подходящим способствующим растворению агентом, таким как спирт (например, этанол), многоатомный спирт (например, пропиленгликоль или полиэтиленгликоль) или неионогенное поверхностно-активное вещество (например, полисорбат 80 или полиоксиэтиленгидрированное касторовое масло 50). Такую композицию также можно получить с маслянистой средой или растворителем, примеры которых включают сезамовое масло и соевое масло, которые необязательно можно использовать в комбинации со способствующим растворению агентом, таким как бензилбензоат и бензиловый спирт. Такие жидкие лекарственные средства часто можно получить с использованием соответствующих добавок, таких как буферирующие агенты (например, фосфатные буферирующие агенты и ацетатные буферирующие агенты), успокаивающие агенты (например, хлорид бензалкония и гидрохлорид прокаина), стабилизаторы (например, человеческий сывороточный альбумин и полиэтиленгликоль), консерванты (например, аскорбиновая кислота, эриторбовая кислота и их соли), красители (например, β-каротин хлорофилла меди, красный №2 и синий №1), антисептические средства (например, эфиры параоксибензойной кислоты, фенол, хлорид бензетония и хлорид бензалкония), загустители (например, гидроксипропилцеллюлоза, карбоксиметилцеллюлоза и их соли), стабилизаторы (например, человеческий сывороточный альбумин, маннит и сорбит) и средства для коррекции запаха (например, ментол и цитрусовые ароматизаторы).
Другие альтернативные формы включают средства для нанесения на слизистые оболочки, такие препараты часто содержат добавки, такие как адгезивы, чувствительные к давлению усилители, регуляторы вязкости, загустители и т.п. (например, муцин, агар, желатин, пектин, каррагинан, альгинат натрия, камедь бобов саранчи, ксантановая камедь, трагакантовая камедь, гуммиарабик, хитозан, пуллулан, воскообразный крахмал, сукральфат, целлюлоза и ее производные (такие как гидроксипропилметилцеллюлоза), эфиры жирных кислот и полиглицерина, сополимеры акриловой кислоты и алкил(мет)акрилата, или их соли и полиглицериновые эфиры жирных кислот), главным образом с целью придания слизистой адсорбционных или удерживающих свойств. Однако форма, растворитель и добавки для терапевтического средства или профилактического средства для введения в организм этим не ограничиваются, и специалистом в данной области техники может быть сделан соответствующий выбор.
Лекарственное средство, содержащее антитело по настоящему изобретению, может дополнительно содержать, кроме антитела по настоящему изобретению, другое известное средство (активный ингредиент). Оно также может быть слито или связано с другими лекарственными средствами, такими как конъюгаты антитело-лекарственное средство или биспецифические или мультиспецифические антитела. Лекарственное средство, содержащее антитело против рецептора IGF-1 по настоящему изобретению, можно комбинировать с другим известным средством в форме набора. Примеры активных ингредиентов для комбинации с антителом-агонистом против рецептора IGF-1, включают гормон роста или его аналог, инсулин или его аналог, IGF-2 или его аналог, антитело против миостатина, антагонист миостатина, антитело против рецептора активина типа IIB, антагонист рецептора активина типа IIB, растворимый рецептор активина типа IIB или его аналог, грелин или его аналог, фоллистатин или его аналог, бета-2 агонист и селективный модулятор рецептора андрогена.
При получении лекарственного средства с антителом или конъюгата антитело-лекарственное средство, содержащего в качестве компонента антитело против рецептора IGF-1 по настоящему изобретению, примеры активных ингредиентов для комбинации с антителом против рецептора IGF-1 или включения в состав с антителом против рецептора IGF-1, включают кортикостероид, противорвотное средство, гидрохлорид ондансетрона, гидрохлорид гранисетрона, метоклопрамид, домперидон, галоперидол, циклизин, лоразепам, прохлорперазин, дексаметазон, левомепромазин, трописетрон, вакцину против рака, ингибитор GM-CSF, ДНК-вакцину GM-CSF, клеточную вакцину, вакцину против дендритных клеток, рекомбинантную вирусную вакцину, вакцину против белка теплового шока (HSP), гомологичную опухолевую вакцину, аутологичную опухолевую вакцину, анальгетик, ибупрофен, напроксен, трисалицилат магния холина, гидрохлорид оксикодона, антиангиогенное средство, антитромботическое средство, антитело против PD-1 ниволумаб, пембролизумаб, антитело против PD-L1 атезолизумаб, антитело против CTLA4 ипилимумаб, антитело против CD20 ритуксимаб, антитело против HER2 трастузумаб, антитело против CCR4 могамулизумаб, антитело против VEGF бевацизумаб, антитело против рецептора VEGF растворимый фрагмент рецептора VEGF, антитело против TWEAK, антитело против рецептора TWEAK растворимый фрагмент рецептора TWEAK, AMG 706, AMG 386, антипролиферативное средство, ингибитор фарнезилпротеинтрансферазы, ингибитор альфа-v-бета-3, ингибитор альфа-v-бета-5, ингибитор р53, ингибитор рецептора Kit, ингибитор рецептора ret, ингибитор PDGFR, ингибитор секреции гормона роста, ингибитор ангиопоэтина, ингибитор проникновения опухолевых макрофагов, ингибитор c-fms, антитело против c-fms, ингибитор CSF-1 антитело против CSF-1, растворимый фрагмент c-fms, пегвизомант, гемцитабин, панитумумаб, иринотекан и SN-38. Дозировка другого средства, используемого в комбинации с антителом, может находиться в пределах дозы, используемой для обычной терапии, но может быть увеличена или уменьшена в зависимости от ситуации.
Агенты согласно настоящему изобретению можно вводить парентерально с целью улучшения симптомов. Для парентерального введения можно получить трансназальное средство, и можно выбрать жидкий лекарственный препарат, суспензию или твердый состав. Инъекцию можно получить как другую форму парентерального введения, причем инъекцию выбирают в виде подкожной инъекции, внутривенной инъекции, инфузии, внутримышечной инъекции, внутримозговой желудочковой инъекции или внутрибрюшинной инъекции. Другие препараты, используемые для парентерального введения, включают суппозитории, сублингвальные средства, чрескожные средства и средства для трансмукозального введения, отличные от трансназальных средств. Кроме того, возможно внутрисосудистое местное введение путем добавления или нанесения покрытия на стент или внутрисосудистый обтуратор.
Доза для средства для лечения или профилактики согласно изобретению будет отличаться в зависимости от возраста пациента, пола, массы тела и симптомов, терапевтического эффекта, способа введения, времени лечения или типов активных ингредиентов в лечебной композиции, но обычно его можно вводить в диапазоне от 0,1 мг до 1 г и предпочтительно в диапазоне от 0,5 мг до 100 мг активного соединения на прием для взрослых, один раз в одну-четыре недели или один раз в один-два месяца. Однако, так как доза и частота введения будут варьироваться в зависимости от множества условий, для введения может быть достаточной меньшая доза и меньшая частота введения, чем упомянутые выше, или могут потребоваться доза и частота введения, превышающие эти диапазоны.
Примеры
Настоящее изобретение теперь будет описано подробнее посредством следующих далее примеров. Однако настоящее изобретение не следует толковать как ограниченное этими примерами, но может быть реализовано в любой форме без отступления от сущности настоящего изобретения.
Пример 1. Конструирование гуманизированных антител на основе мышиного антитела IGF11-16
*Выбор человеческих каркасов
Мышиное моноклональное антитело против рецептора IGF-1 IGF11-16 получают методом гибридом Kohler et al. (Nature, (1975), Vol.256, pp. 495-497) (патентная литература 1). Из полученного антитела аминокислоты определяющих комплементарность участков (CDR) в вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL) переносят в основу человеческих антител. В качестве основы человеческих антител получают два различных каркаса гуманизированных антител на основе зародышевых линий человеческих антител, имеющих аминокислотные последовательности, высоко гомологичные аминокислотным последовательностям VH и VL (SEQ ID NO: 39 и 41 соответственно) мышиного антитела IGF11-16 (мышиное родительское антитело), выбирая VH-1-46 (SEQ ID NO: 95) и VH-1-e (SEQ ID NO: 96) как последовательности тяжелых цепей, JH4 (SEQ ID NO: 97) как J-сегмент тяжелой цепи, VK1-L5 (SEQ ID NO: 98) и VK1-A20 (SEQ ID NO: 99) как последовательности легких цепей и JK2 (SEQ ID NO: 100) как J-сегмент легкой цепи, и комбинируя эти последовательности, как показано в таблице 1 ниже.
*Пересадка участков CDR и замены аминокислот FR
Последовательности незаменимых аминокислот из VH и VL мышиного антитела IGF11-16 переносят в FR основы человеческих антител, приведенные выше, и таким образом получают гуманизированные антитела.
Более подробно, аминокислотную последовательность последовательности VH мышиного антитела IGF11-16 гуманизируют, заменяя аминокислотные последовательности CDR и несколько аминокислот FR VH основы человеческих антител, упомянутых выше, соответствующими аминокислотными последовательностями в VH мышиного антитела IGF11-16, и также конструируют последовательность ДНК, кодирующую эти аминокислотные последовательности.
Аминокислотную последовательность последовательности VL мышиного антитела IGF11-16 гуманизируют путем замены аминокислотной последовательности CDR и нескольких аминокислот FR VL основы человеческого антитела, упомянутых выше, соответствующей аминокислотной последовательностью в VL мышиного антитела IGF11-16, и также создают последовательность ДНК, кодирующую эти аминокислотные последовательности.
Строение созданных тяжелых и легких цепей для гуманизированных антител показаны ниже в таблице 2.
В этой связи следует сказать, что в описаниях в приведенных ниже примерах и на соответствующих фигурах название(я) гуманизированной вариабельной области тяжелой цепи и/или гуманизированной вариабельной области легкой цепи, созданных как описано в настоящем описании, можно использовать для обозначения гуманизированной тяжелой цепи, состоящей из созданной гуманизированной вариабельной области тяжелой цепи, соединенной с константной областью тяжелой цепи, и/или гуманизированной легкой цепи, состоящей из созданной вариабельной области легкой цепи, связанной с константной областью легкой цепи, а также полного гуманизированного антитела путем объединения гуманизированной тяжелой цепи и гуманизированной легкой цепи. Например, «VL22/VH13_PS» на фиг. 1A относится к гуманизированному антителу, созданному путем объединения легкой цепи, состоящей из VL22 как вариабельной области легкой цепи и связанной с ней константной области каппа-цепи человека, и тяжелой цепи, состоящей из VH13_PS как вариабельной области тяжелой цепи и константной области тяжелой цепи IgG4S228P, связанной с ней. Примеры нуклеотидных последовательностей, соответствующих аминокислотным последовательностям SEQ ID NO: 15, 17, 19, 21, 23, 25, и 27, показаны в SEQ ID NO: 16, 18, 20, 22, 24, 26 и 28, соответственно.
(SEQ ID
NO: 21)
(SEQ ID
NO: 15)
(SEQ ID
NO: 23)
(SEQ ID
NO: 17)
(SEQ ID
NO: 25)
(SEQ ID
NO: 27)
(SEQ ID
NO: 19)
*1: Аминокислотные замены, введенные в легкие цепи FW1
- Аминокислотная замена для восстановления аминокислот мышиного родительского антитела: Y36C, A43I
- Аминокислотные замены для имитации последовательности зародышевой линии человека для снижения иммуногенности: K45R
*2: Аминокислотные замены, введенные в тяжелые цепи FW1
- Аминокислотные замены для имитации последовательности зародышевой линии человека для снижения иммуногенности: N61A, E62Q, K65Q и S66G
- Аминокислотные замены для снижения иммуногенности: V93T
*3: Аминокислотные замены, введенные в легкую цепь FW2
- Аминокислотная замена для восстановления аминокислот мышиного родительского антитела: V43I
*4: Аминокислотные замены, введенные в тяжелую цепь FW2
- Аминокислотные замены для имитации последовательности зародышевой линии человека для снижения иммуногенности: N61A, E62Q, K65Q и S66G
Пример 2. Получение гуманизированных антител
Синтезируют ДНК, которые кодируют каждую из созданных вариабельных областей тяжелых цепей для гуманизированных антител, связанных с константной областью тяжелой цепи мутанта IgG4S228P человека, который является стабилизированным мутантом подкласса IgG4 человека. Синтезированные ДНК интегрируют в и связывают с экспрессирующим вектором pcDNA3.4 для получения плазмид, экспрессирующих тяжелые цепи гуманизированных антител.
Также синтезируют ДНК, которые кодируют каждую из созданных вариабельных областей легкой цепи для гуманизированных антител, связанных с константной областью κ-цепи, и синтезированные ДНК включают в экспрессирующий вектор pcDNA3.4 для получения плазмид, экспрессирующих легкие цепи гуманизированных антител.
Такие плазмиды, экспрессирующие тяжелые цепи гуманизированных антител и легкие цепи гуманизированных антител, смешивают и вводят в клетки с использованием системы экспрессии ExpiCHO® (Thermo Fisher Scientific), чтобы побудить клетки экспрессировать различные антитела. В этой связи гуманизированное антитело, экспрессируемое комбинацией плазмиды, экспрессирующей тяжелую цепь, несущей FW1_VH1, и плазмиды, экспрессирующей легкую цепь, несущей FW1_VL1, называют антителом FW1_var1, и гуманизированное антитело, экспрессируемое комбинацией плазмиды, экспрессирующей тяжелую цепь, несущей FW2_VH1, и плазмиды, экспрессирующей легкую цепь, несущей FW2_VL2, называют антителом FW2_var2. Такую же процедуру и номенклатуру используют для FW1_var9, FW1_var10 и FW1_var14. Гуманизированные антитела получают из культурального супернатанта клеток, трансфицированных плазмидами, экспрессирующими тяжелую цепь гуманизированного антитела и легкую цепь гуманизированного антитела, путем аффинной очистки с использованием колонки с белком А.
Последующее получение гуманизированных антител также осуществляют в соответствии с описанным выше способом.
Пример 3. Эффект активации рецептора IGF-1 с использованием PathHunter®:
Для того, чтобы обнаружить эффект активации рецептора IGF-1 созданными гуманизированными антителами, используют функциональный анализ PathHunter® IGF1R (DiscoverX) для обнаружения активации передачи сигналов рецептором IGF-1 с помощью следующей процедуры.
Клетки, экспрессирующие рецептор IGF-1, высевают в 96-луночный планшет, сенсибилизированный поли-D-лизином или коллагеном I (черный/прозрачный или белый/прозрачный), в количестве 90 мкл/лунка (2×104 клетки/лунка или 5×103 клетки/лунка) и инкубируют при 37°C с 5% CO2. На следующий день добавляют по 10 мкл/лунка лекарственного средства в каждой концентрации и инкубируют при 37°C с 5% CO2. На следующий день отбирают 30 мкл культурального супернатанта, добавляют 15 мкл раствора субстрата и позволяют реакции продолжаться в течение 60 минут. Сигнал люминесценции (RLU) измеряют люминометром (Tristar, Berthold). Определяют интенсивность флуоресценции при добавлении 12,5 нМ антитела, из величины которой вычитают значение с 0,1 нМ антитела в качестве фона, и полученную величину используют в качестве уровня активности. Уровень активности мышиного родительского антитела IGF11-16 принимают за 1, и вычисляют относительную величину уровня активности каждого гуманизированного антитела
Результаты приводятся в таблице 3. Такие результаты указывают на то, что способность гуманизированных антител активизировать рецептор IGF-1 (FW1_var1, var9, var10, var14 и FW2_var2) ослабевает более чем на 20% по сравнению с мышиным родительским антителом IGF11-16.
(12,5 нМ) (RLU)
(RLU)
Затем гуманизированные антитела модифицируют в их участках CDR (антигенсвязывающих участках) путем замены A61, Q62, Q65 и G66 в участке CDR2 тяжелой цепи, которые отличаются от соответствующих остатков мышиного родительского антитела, на N61, E62, K65 и S66 соответственно, чтобы сделать их идентичными участкам мышиного родительского антитела. Полученные гуманизированные антитела с аминокислотными заменами (FW1_var10_NEKS, FW1_var14_NEKS) сравнивают на их способность активировать рецептор IGF-1 с помощью такой же процедуры, какая описана выше, используя мышиные родительские антитела IGF11-16 и FW1_var1 в качестве стандарта для сравнения.
Результаты приводятся в таблице 4. Такие результаты указывают на то, что никакого восстановления уровня активности не наблюдается.
(12,5 нМ)
(RLU)
(RLU)
(RLU)
Такие результаты показывают, что даже когда аминокислотные последовательности CDR снова заменяют на те же самые, что у CDR мышиного родительского антитела IGF11-16, уровень активности антитела не восстанавливается до того же уровня, что у мышиного родительского антитела IGF11-16 (отношение уровней активности в пределах ±20%). Поэтому сделан вывод, что FR (каркасные участки), а не CDR, ответственны за снижение уровня активности.
Поэтому гуманизированные антитела модифицируют, заменяя их FR1, FR2 и FR3 соответствующими FR мышиного антитела. Гуманизированные антитела, модифицированные с помощью замен мышиными FR, показаны в таблице 5. Активацию передачи сигналов рецептора IGF-1 такими модифицированными антителами оценивают с помощью системы PathHunter®, как описано выше. Человеческое химерное антитело IGF11-16 (химера), которое является химерой вариабельных областей мышиного родительского антитела IGF11-16 и константных областей человеческого IgG4 (S228P), используют в качестве положительного контроля, и сравнивают интенсивность сигнала при концентрации антитела 16,7 нМ, как описано выше. Результаты показаны в таблице 5. Примеры нуклеотидных последовательностей, соответствующих аминокислотным последовательностям SEQ ID NO: 29, 31, 33, 35 и 37, показаны в SEQ ID NO: 30, 32, 34, 36 и 38 соответственно.
(отношение к
IGF11-16)
IGF11-16
_VH
_VL
_mFR-H1
_mH1
(SEQ ID
NO: 29)
заменяют на
FR-H1 IGF11-16
_mFR-H2
_mH2
(SEQ ID
NO: 31)
FR-H2 IGF11-16
_mFR-H3
_mH3
(SEQ ID
NO: 33)
заменяют на
FR-H3 IGF11-16
_mFR-L1
_mL1
(SEQ ID
NO: 35)
легкой цепи заменяют на
FR-L1 of IGF11-16
_mFR-
L2+L3
_mL2+L3
(SEQ ID
NO: 37)
заменяют на
FR-L2 и L3 IGF11-16
Такие результаты указывают на то, что модифицированным антителом, интенсивность сигнала которого эквивалентна (в пределах ±20% величины) интенсивности сигнала человеческого химерного антитела IGF11-16, является FW1_var9_mFR-H1, причем предполагается, что для поддержания активности гуманизированных антител необходим FR1 мышиной тяжелой цепи.
Следующим этапом является идентификация аминокислот, необходимых для поддержания активности в FR1 мышиной тяжелой цепи. Так как существует семь различий в аминокислотах в последовательности FR1 тяжелой цепи между мышиным родительским антителом IGF11-16 и гуманизированными антителами, каждую из таких аминокислот заменяют по одной на соответствующую аминокислоту мышиного родительского антитела. Гуманизированные антитела, модифицированные с помощью аминокислотных замен на мышиный FR1, показаны в таблице 6. Измеряют интенсивность сигнала активации рецептора IGF-1 для таких гуманизированных антител с аминокислотными заменами мышиного FR1 с использованием системы PathHunter®, и интенсивность сигнала при концентрации антител 16,7 нМ сравнивают с интенсивностью сигнала мышиного родительского антитела IGF11-16. В результате только гуманизированное антитело, в котором серин в позиции 25 заменен на пролин, имеет уровень активности, эквивалентный (отношение активности в пределах ±20%) уровню мышиного родительского антитела IGF11-16. Результаты приводятся в таблице 6.
FW1_VH1
(сравнение с IGF11-16)
_hH1a
_hH1a
_hH2a
_hH2a
_hH3a
_hH3a
_hH4a
_hH4a
_hH5a
_hH5a
_hH6a
_hH6a
_hH7a
_hH7a
Такие результаты указывают на то, что пролин в позиции 25 участка FR1 тяжелой цепи является критичным для поддержания активности. Поэтому все последующие гуманизированные антитела, используемые в приведенных ниже примерах, включают замену на P (пролин, Pro) в позиции 25 тяжелой цепи.
Пример 4. Идентификация аминокислот в участке CDR, которые важны для поддержания активности, путем замены аланином
Для того, чтобы идентифицировать аминокислоты в участке CDR, требуемые для поддержания активности, каждую аминокислоту в мышином родительском антителе IGF11-16 заменяют по одной на аланин, и полученные замещенные антитела сравнивают по их способности активировать сигнал измеряя величины EC50 и Emax и также оценивают их активность связывания с антигеном в ELISA. Активность каждого антитела оценивают в сравнении с активностью мышиного родительского антитела IGF11-16, и определяют, что антитела, имеющие величину EC50 в 2-кратных пределах и величину Emax в пределах ±20% от величин у мышиного родительского антитела IGF11-16, имеют схожий уровень активности.
Способность активировать передачу сигналов рецептора IGF-1 оценивают в системе PathHunter®, описанной в примере 3. Величины EC50 и Emax рассчитывают с помощью программного обеспечения для анализа GraphPad Prism. Активность связывания измеряют ELISA с антигеном с использованием внеклеточного участка рекомбинантного рецептора IGF-1 в качестве антигена. Конкретно, получают раствор человеческого рекомбинантного IGF-1R (производства R&D SYSTEMS) в концентрации 0,5 мкг/мл в PBS (забуференном фосфатом физиологическом растворе). Полученный раствор человеческого рекомбинантного IGF-1R добавляют в планшет в количестве 50 мкл/лунка. Реакции позволяют протекать в течение ночи при 4°C, среду заменяют 3% BSA/PBS (содержащим 0,02% азида натрия), и раствор хранят при 4°C до использования в ELISA. Раствор испытываемого вещества (раствор антитела концентрации 5 нМ) добавляют в планшет в количестве 50 мкл/лунка. Реакции позволяют протекать в течение 1 часа при комнатной температуре, а затем лунки дважды промывают раствором для промывки (PBST; забуференный фосфатом физиологический раствор, содержащий 0,05% твина 20). Добавляют антитело против мышиного IgG, меченное щелочной фосфатазой (разведенное в 2000 раз в 3% BSA/PBS) в количестве 50 мкл/лунка. Реакции позволяют протекать в течение 45 минут при комнатной температуре, лунки трижды промывают раствором для промывки, и затем добавляют субстрат (pNPP; паранитрофенилфосфат) для начала реакции. После реакции в течение 1 часа при комнатной температуре измеряют поглощение при 405 и 550 нм и вычисляют различие поглощения при 405 нм и при 550 нм. Полученную величину анализируют как активность связывания.
Полученные антитела IGF11-16 с замещенными CDR- и результаты измерений активации сигнала и активности связывания показаны в таблицах 7 и 8. Эти результаты указывают на то, что в участках CDR произведено пять замен на аланин, которые снижают активность связывания примерно на 10-20%, т.е. триптофан в позиции 32 CDR-L1, триптофан в позиции 33 CDR-H1, глутамат в позиции 50 CDR-H2, аспарагин в позиции 52 CDR-H2 и аргинин в позиции 102 CDR-H3 являются критичными для поддержания активности. Кроме того, гистидин в позиции 35 CDR-H1, серин в позиции 54 CDR-H2, аспарагин в позиции 55 CDR-H2, серин в позиции 56 CDR-H2, аспарагин в позиции 59 CDR-H2 и фенилаланин в позиции 64 CDR-H2 также считаются вносящими вклад в сохранение активности, та как их активность снижается при замене на Ala.
С другой стороны, среди 54 аминокислотных остатков замененных на аланин в участке CDR 44 остатка демонстрируют 80% или большую активность связывания даже после замены аланином.
Таблица 7. Результаты оценки активации сигнала с аланиновыми заменами в участке CDR легкой цепи (показан только аминокислотный остаток, активность которого снижается при замене аланином)
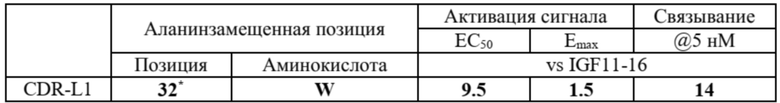
* Аминокислотный остаток, при замене аланином которого активность связывания снижается примерно на 10-20%.
Таблица 8. Результаты оценки активации сигнала с аланиновыми заменами в участке CDR тяжелой цепи (показаны только аминокислотные остатки, при замене которых аланином активность снижается)
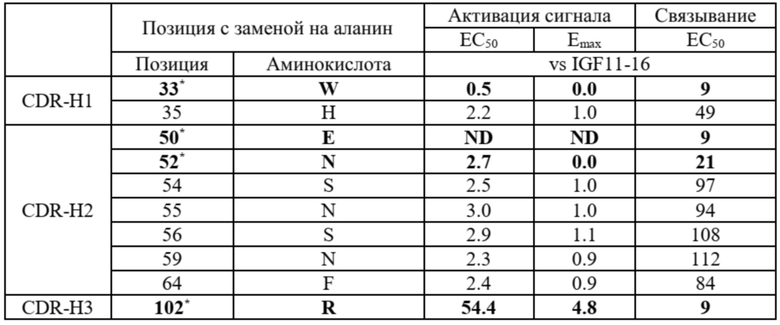
*Аминокислотные остатки, при замене аланином которых активность связывания снижается примерно на 10-20%.
Пример 5. Конструирование гуманизированных вариабельных областей тяжелой цепи
Так как результаты примера 3 показывают, что пролин в позиции 25 тяжелой цепи важен для поддержания активности, создают гуманизированные вариабельные области тяжелой цепи, имеющие P в позиции 25 тяжелой цепи, с использованием FW1_VH1 и FW2_VH1 в качестве базовых каркасов. Поскольку аминокислотные замены исследуют с использованием FR1 FW1_VH1 в качестве базовой последовательности, участок FR1 FW2_VH1 модифицируют для идентичности с FW1_FR1 путем введения замены S16A. Введение аминокислотных замен для снижения иммуногенности выполняют на основании результатов анализа оценки иммуногенности Epibase® (Lonza). Список созданных вариабельных областей тяжелой цепи приводится в таблице 9 ниже.
NO:
Примечание: V93T и K74T являются заменами, предназначенными для снижения иммуногенности.
Пример 6. Конструирование гуманизированных вариабельных областей легкой цепи
Гуманизированные вариабельные области легкой цепи создают с использованием FW1_VL1 и FW2_VL2 в качестве базовых каркасов. Введение аминокислотных замен для оценки снижения иммуногенности выполняют на основании результатов анализа Epibase® (Lonza). Список созданных вариабельных областей легкой цепи приводится в таблице 10 ниже.
NO:
Примечания: C36Y, I43A и I43V являются аминокислотными заменами, обратно к последовательности каркаса человека, которые предназначены для снижения иммуногенности;
K45R является аминокислотной заменой в последовательности зародышевой линии, предназначенной для снижения иммуногенности.
L54R является аминокислотной заменой, предназначенной для снижения иммуногенности.
Пример 7. Конструирование гуманизированных антител путем замены аминокислот с риском деамидирования
Если деамидирование происходит во время получения гуманизированных антител, контроль качества будет затруднен. Поэтому необходимо заранее заменить аминокислоты, подверженные риску деамидирования, другими аминокислотами, которые не влияют на активность. Распространенные последовательности, подверженные риску деамидирования, включают NG, NT, NS и NN. Последовательность NS присутствует в участке CDR-H2 тяжелой цепи гуманизированных антител по настоящему изобретению. Поэтому аминокислотные замены осуществляют с учетом риска деамидирования аспарагина (N) в позиции 55 и превращения его в аспарагиновую кислоту (D). Список замещенных тяжелых цепей приводится в таблице 11. Примеры нуклеотидных последовательностей, соответствующих аминокислотным последовательностям SEQ ID NO: 45, 51 и 57, показаны в SEQ ID NO: 46, 52 и 58, соответственно.
NO:
Пример 8. Выбор гуманизированных антител для активации передачи сигналов рецептором IGF-1
Гуманизированные антитела оценивали на основании их способности активировать рецептор IGF-1, и выбирали гуманизированные антитела, обладающие активностью, эквивалентной активности мышиного родительского антитела IGF11-16.
Для того, чтобы обнаружить активирующее действие антител-агонистов против рецептора IGF-1 на рецептор IGF-1, измеряют активацию передачи сигналов рецептором IGF-1 с использованием функционального анализа PathHunter® IGF1R (DiscoverX).
Клетки, экспрессирующие рецептор IGF-1, высевают в 96-луночные планшеты, сенсибилизированные поли-D-лизином или коллагеном I (черные/прозрачные или белые/прозрачные), в количестве 90 мкл/лунка (2×104 клетки/лунка или 5×103 клетки/лунка) и инкубируют при 37°C с 5% CO2. На следующий день добавляют по 10 мкл/лунка лекарственного средства каждой концентрации и инкубируют при 37°C с 5% CO2. На следующий день отбирают 30 мкл культурального супернатанта, добавляют 15 мкл раствора субстрата и позволяют реакции протекать в течение 60 минут, и измеряют сигнал люминесценции (RLU) с помощью люминометра (Tristar, Berthold).
В результате измерения в таблице 12 показаны гуманизированные антитела, активность которых, как подтверждается, эквивалентна активности мышиного родительского антитела IGF11-16 (величина EC50 в 2-кратном пределе и величина Emax в пределах ±20% по сравнению с мышиным родительским антителом IGF11-16).
(SEQ ID
NO: 47)
VH13_PS
VH13_PS
VH13_PS
VH13_PS
(SEQ ID
NO: 53)
VH23_PS
VH23_PS
VH23_PS
VH23_PS
(SEQ ID
NO: 59)
VH25_PS
VH25_PS
VH25_PS
VH25_PS
(SEQ ID
NO: 43)
VH13_PN
VH13_PN
VH13_PN
VH13_PN
VH13_PN
(SEQ ID
NO: 49)
VH23_PN
VH23_PN
VH23_PN
VH23_PN
VH23_PN
(SEQ ID
NO: 55)
VH25_PN
VH25_PN
VH25_PN
VH25_PN
VH25_PN
(SEQ ID
NO: 45)
VH13_PQ
VH13_PQ
VH13_PQ
VH13_PQ
VH13_PQ
(SEQ ID
NO: 51)
VH23_PQ
VH23_PQ
VH23_PQ
VH23_PQ
VH23_PQ
(SEQ ID
NO: 57)
VH25_PQ
VH25_PQ
VH25_PQ
VH25_PQ
VH25_PQ
Пример 9. Отбор гуманизированных антител по их пролиферативной активности в отношении миобластов человека
Гуманизированные антитела оценивают на основании их пролиферативной активности в отношении миобластов человека, в соответствии с чем отбирают гуманизированные антитела с активностью, эквивалентной активности мышиного родительского антитела IGF11-16.
Для того, чтобы проверить пролиферативную активность гуманизированных антител против рецептора IGF-1 против миобластов человека, добавляют лекарственное средство к миобластам человека, и через 4 дня измеряют в клетках количество АТФ.
Нормальные миобласты скелетных мышц человека (HSMM, Lonza) высевают в 96-луночные планшеты (сенсибилизированные коллагеном типа I) с использованием среды, содержащей 1% BSA в SkBM-2 (Lonza, CC-3246), в количестве 0,1 мл/лунка (2×103 клетки/лунка), и инкубируют при 37°C с 5% CO2. На следующий день после посева клеток добавляют различные лекарственные средства по 25 мкл/лунка и инкубируют в течение 4 дней при 37°C с 5% CO2. В качестве показателя клеточной пролиферации измеряют количество АТФ в клетках с помощью люминесцентного анализа жизнеспособности клеток CellTiter-Glo (зарегистрированная торговая марка) (Promega). После инкубации в течение 4 дней из каждой лунки удаляют супернатант так, чтобы питательная среда составляла 50 мкл/лунка, и 96-луночный планшет оставляют стоять при комнатной температуре в течение по меньшей мере 30 минут. Добавляют 50 мкл/лунка реагента CellTiter-Glo (зарегистрированная торговая марка) и оставляют реагировать в течение по меньшей мере 10 минут перед измерением сигнала люминесценции с помощью люминометра (Tristar, Berthold).
Как результат, в таблице 13 показаны гуманизированные антитела, активность которых, как подтверждается, эквивалентна активности мышиного родительского антитела IGF11-16 (величина EC50 в пределах 10 крат, Emax 90% или более по сравнению с мышиным родительским антителом IGF11-16). Графики результатов измерений приводятся на фиг. 1A-1F.
VH13_PS
VH13_PS
VH13_PS
VH23_PS
VH23_PS
VH23_PS
VH25_PS
VH25_PS
VH25_PS
VH13_PN
VH23_PN
VH25_PN
Пример 10. Оценка иммуногенности
Для анализа на иммуногенность гуманизированных антител для вычисления показателей иммуногенности используют Epibase® in Silico от Lonza. Платформа Epibase® in Silico от Lonza представляет собой метод прогнозирования иммуногенности, в котором используются структурные характеристики рецептора класса II HLA, а также экспериментально определенная аффинность связывания между 10-мерным пептидом и рецептором класса II HLA для прогнозирования потенциального связывания пептид /HLA, что является необходимым условием для Т-клеточной активации, в аминокислотной последовательности, содержащейся в антителе, и для вычисления ее как показателя иммуногенности. Оценка по 85 аллотипам HLA II класса (43 типа DRB1, 8 типов DRB3/4/5, 22 типа DQ и 12 типов DP) может охватить более 99% всей популяции. Показатели иммуногенности определяют с учетом частоты встречаемости, а также аффинности связывания аллотипов.
Результаты приводятся в таблицах 14 и 15. По сравнению с показателями иммуногенности мышиного родительского антитела IGF11-16 и химерного антитела мышь-человек (антитело с вариабельной областью мышиного родительского антитела IGF11-16 и константной областью IgG4 человека (S228P)), которые оценивают аналогичным образом, обнаружено, что иммуногенность гуманизированных антител более низкая.
IGF11-16,
константная область человеческого
IgG4 (S228P)
hIGF13_PS
VL23/VH13_PS,
константная область человеческого
IgG4(S228P)
hIGF25_PS
VL23/VH25_PS,
константная область человеческого
IgG4 (S228P)
Пример 11. Оценка активности связывания с рецепторами IGF-1 млекопитающих
Для того, чтобы исследовать активность связывания антител-агонистов против рецептора IGF-1 против рецепторов IGF-1 человека (SEQ ID NO: 71), макаки-крабоеда (SEQ ID NO: 73), кролика (SEQ ID NO: 75), морской свинки (SEQ ID NO: 77), крысы (SEQ ID NO: 79) и мыши (SEQ ID NO: 81), выполняют ELISA на основе клеток с использованием клеток, экспрессирующих различные рецепторы IGF-1.
Клетки HEK293T трансфицируют методом липофекции векторами экспрессии pEF1 (Thermo Fisher), объединенными с генами рецептора IGF-1 кролика (SEQ ID NO: 76), морской свинки (SEQ ID NO: 78), крысы (SEQ ID NO: 80) и мыши (SEQ ID NO: 82). После липофекции трансфицированным клеткам HEK293T дают возможность расти в течение ночи или дольше и затем добавляют в 96-луночный планшет (сенсибилизированный поли-D-лизином) в количестве 4×104 клеток на лунку. Затем клетки фиксируют в 10% забуференном формалине (Mildform® 10NM, Wako) и перед использованием для ELISA блокируют фосфатным буфером, содержащим 3% BSA.
ELISA выполняют следующим образом. В каждую лунку добавляют по 100 мкл каждого раствора гуманизированных антител, полученного при 5 нМ в смеси 1% BSA/1% FBS/PBS, и проводят реакцию при 37°C в течение примерно 1 часа. Раствор конъюгата HRP против человеческого IgG-антитела, полученный в каждой концентрации в смеси 1% BSA/1% FBS/PBS, добавляют по 100 мкл в каждую лунку, проводят реакцию при 37°C в течение примерно 1 часа и промывают три раза раствором для промывки. Реакцию инициируют, добавляя 100 мкл субстрата (TMB) в каждую лунку. Примерно через 30 минут в каждую лунку добавляют 100 мкл 1М серной кислоты, измеряют поглощение при 450 и 650 нм и вычисляют разность между поглощением при 450 нм и при 650 нм. Вычисленную разность сравнивают с разностью в поглощении при 450 нм и при 650 нм для клеток HEK293T без гена рецептора IGF-1 (контроль) для анализа активности связывания.
На фиг. 2 показаны результаты реактивности к IGF-R каждого млекопитающего: человека, морской свинки, макаки-крабоеда и кролика. Как результат, гуманизированные антитела hIGF13_PS и hIGF25_PS увеличивают активность связывания клеток, экспрессирующих рецептор IGF-1 человека, морской свинки, макаки-крабоеда и кролика, примерно в 2 раза по сравнению с контрольными клетками, и реактивность сопоставима с реактивностью химерного антитела IGF11-16 человек/мышь. С другой стороны, активность связывания с клетками, экспрессирующими рецепторы IGF-1 крыс и мышей, сопоставима с активностью контрольных клеток. Такие результаты указывают на то, что гуманизированные антитела hIGF13_PS и hIGF25_PS связываются с рецепторами IGF-1 человека, морской свинки, макаки-крабоеда и кролика, но не с рецепторами IGF-1 крысы и мыши.
Пример 12. Аффинность связывания с рецептором IGF-1 согласно методу поверхностного плазмонного резонанса
Для того, чтобы проверить свойства связывания (скорости связывания и диссоциации) лекарственного средства в отношении рецептора IGF-1, связывание измеряют методом поверхностного плазмонного резонанса (SPR).
В качестве измерительной системы используют систему BIACORE T200. Меченные антигистидином моноклональные антитела перед использованием фиксируют во всех проточных ячейках сенсорного чипа CM3 (BR-1005-36, GE) с помощью набора для соединения с амином Amine Coupling Kit (BR-1000-50, GE) и набора для захвата His Capture Kit (28-9950-56, GE) примерно при 3000 RU. В качестве рабочего буфера используют HBS-EP+ (BR-1006-69, GE). Рекомбинантная гистидиновая метка рецептора IGF-1 человека (305-GR-050, R&D SYSTEMS, далее IGF-1R-His) захватывается при измерении и используется в качестве лиганда. Каждую концентрацию лекарственного средства используют в качестве аналита. В качестве отрицательного контроля лиганда используют проточную ячейку без захвата IGF-1R-His. PBS (PBS pH 7,4 (1x), #10010049, Gibco) используют в качестве отрицательного контроля лекарственного средства.
Температуру измерительной системы при измерении устанавливают на уровне 40°C. Меченные антигистидином моноклональные антитела в проточных ячейках (2 и 4) вводят в реакцию с IGF-1R-His (<2×10-8 M) при менее чем 100 RU. Устанавливают скорость потока 30 мкл/мин, вводят в реакцию 10 нМ очищенный мышиный IgG2a, каппа, изотип Ctrl, клон MG2a-53 (401502, BioLegend, далее ctrl IgG2a) в течение 1 мин, и в течение по меньшей мере 10 мин пропускают HBS-EP+. Аналит разбавляют поэтапно (от 0,5 до 8×10-10 M) HBS-EP+ и вводят в реакцию во всех проточных ячейках.
В качестве условий измерения используют метод одноцикловой кинетики. Аналит в каждой концентрации вводят в реакцию в течение 600 секунд для получения кривой связывания, и затем вводят в реакцию HBS-EP+ в течение 1200 секунд для получения кривой диссоциации. После этой реакции для удаления IGF-1R-His из измерительной системы и промывки измерительной системы вводят во взаимодействие буфер для регенерации 1 (0,2% SDS), буфер для регенерации 2 (100 мМ трис-HCl (рН 8,5), 1 М NaCl, 15 мМ MgCl2) и буфер для регенерации 3 (10 мМ глицин-HCl (рН 1,5)) в течение 1 минуты каждый. Константу скорости диссоциации (kа, 1/мс), константу скорости связывания (kd, 1/с) и константу диссоциации (КD, М) вычисляют с использованием программного обеспечения Biacore T200 Evalution (верс. 2.0) с моделью связывания 1:1. Результаты приводятся в таблице 16.
Обнаружено, что величины KD hIGF13_PS и hIGF25_PS против человеческого рецептора IGF-1 меньше E-10, что соответствует наиболее благоприятному критерию для гуманизированных антител-агонистов против рецептора IGF-1.
Пример 13. Гипогликемический эффект in vivo (гипогликемический эффект у морских свинок)
Для того, чтобы подтвердить, оказывают ли антитела-агонисты против рецептора IGF-1 гипогликемический эффект in vivo, морским свинкам вводят однократную дозу hIGF13_PS или hIGF25_PS и измеряют уровни глюкозы в крови с течением времени для определения наличия или отсутствия гипогликемического эффекта. Термин «гипогликемический эффект» при использовании в настоящем описании относится к эффекту снижения уровня глюкозы в крови до 50 мг/дл или менее или вызыванию симптомов гипогликемии.
Морских свинок не кормят в течение 12 часов, и каждое из гуманизированных антител hIGF13_PS и hIGF25_PS вводят внутривенно в виде однократной дозы 10 мг/кг. Морских свинок не кормят в течение 24 часов после введения. Образцы крови берут у бодрствующих морских свинок до (0 ч) и через 1, 2, 4, 8, 24, 48, 72 и 144 часа после введения, и уровни глюкозы у них в крови измеряют с использованием сенсора Glutest (Sanwa Kagaku Kenkyusho). Результаты показаны на фиг. 3A и B.
Ни одно из гуманизированных антител не показывает какого-либо существенного различия в уровнях глюкозы в крови по сравнению с контрольной группой с растворителем, которая получала только растворитель, и уровни глюкозы в крови после введения все выше 50 мг/дл. Это указывает на то, что каждое гуманизированное антитело не обладает значительным гипогликемическим эффектом, подобным IGF-1, и не влияет на уровень глюкозы в крови, что указывает на его потенциал в качестве лекарственного средства для преодоления гипогликемии, которая является побочным эффектом IGF-1.
Пример 14. Гемодинамика гуманизированных антител у морских свинок
Морских свинок не кормят в течение 12 часов, и каждое из гуманизированных антител hIGF13_PS и hIGF25_PS или IGF11-16 (мышиное родительское антитело) вводят внутривенно в разовых дозах по 1 или 10 мг/кг. Морских свинок не кормят до 24 часов после введения, после чего их снова кормят. Образцы крови берут у бодрствующих морских свинок до (0 ч) и через 2, 4, 8, 24, 48, 72, 96, 120 и 144 часа после введения, и измеряют концентрацию гуманизированного антитела в плазме методом ELISA.
В частности, используют рекомбинантный IGF-1R (производства R&D SYSTEMS), и проводят измерение на антиген методом ELISA. Калибровочную кривую для количественного определения каждого антитела, введенного морским свинкам, получают путем серийного разведения известной концентрации антитела плазмой морской свинки с образованием серии стандартов. Для проведения измерения как стандарты, так и образцы плазмы разводят в 10-1000 раз.
Раствор в PBS (0,5 мкг/мл) рекомбинантного IGF-1R добавляют в 96-луночный планшет (MaxiSorp (NUNC)) и фиксируют при 4°C в течение ночи. Затем выполняют блокирование смесью 3% BSA/PBS для получения фиксированного планшета с рекомбинантным IGF-1R. С другой стороны, для получения серии стандартов используют для серийного разведения каждого введенного антитела плазму от морской свинки, которой не вводили антитело. Каждый из образцов плазмы и стандартов разводят 10-кратно и добавляют в фиксированный планшет с рекомбинантным IGF-1R в количестве 50 мкл/лунка. Реакцию проводят в течение 1 часа 30 минут при комнатной температуре с последующей промывкой PBS-T (PBS, 0,025% твина 20). Затем добавляют раствор конъюгированного с щелочной фосфатазой поликлонального антитела против человеческого IgG (H+L) (Southern Biotechnology Associates, кат. #2087-04), разведенного в 2000 раз смесью 3% BSA/PBS, в количестве 50 мкл на лунку. Клетки вводят во взаимодействие в течение 1 часа при комнатной температуре, после чего выполняют промывку PBS-T, добавляют 100 мкл/лунка pNPP (Wako, Cat# 149-02342) в качестве хромогенного субстрата и инкубируют в течение 1 часа при комнатной температуре. После этого измеряют поглощение при 405 нм и при 550 нм с использованием устройства для прочтения планшетов, и определяют различие между поглощениями при 405 нм и при 550 нм. Вычерчивают калибровочную кривую в диапазоне концентраций антитела с использованием серии стандартов, и вычисляют концентрацию антител в каждом образце плазмы.
Результаты показаны на фиг. 4. Концентрация каждого гуманизированного антитела в плазме увеличивается в зависимости от дозы, и даже в группе с низкими дозами концентрация гуманизированного антитела в плазме сохраняется до 144 часов после введения на уровне более 50% от концентрации через 24 часа после введения. Такие результаты указывают на то, что гемодинамика гуманизированных антител более стойкая, чем у мышиного родительского антитела IGF11-16.
Пример 15. Эффект увеличения мышечной массы у здоровых морских свинок за счет гуманизированных антител
Вводят однократную внутривенную дозу hIGF13_PS здоровым морским свинкам, и через 2 недели измеряют мышечную массу и сравнивают с эффектом увеличения мышечной массы при непрерывном введении IGF-1 и внутривенном введении антитела IGF11-16.
Здоровым морским свинкам вводят или hIGF13_PS или мышиное родительское антитело IGF11-16 в виде однократной дозы 0,1 мг/кг внутривенно. В качестве положительного контроля имплантируют человеческий IGF-1 (мекасермин) подкожно, используя осмотический насос (Alzette), и вводят непрерывно в дозе 1 мг/кг/сутки. В качестве контроля вводят внутривенно только растворитель. Через две недели после введения лекарственного средства каждой морской свинке дают анестезию и спускают кровь до смерти, удаляют длинный разгибатель пальцев стопы, и измеряют мышечную массу.
Результаты показаны на фиг. 5. Группа, которой вводили hIGF13_PS внутривенно в дозе 0,1 мг/кг, значительно увеличила мышечную массу по сравнению с контрольной группой, обработанной только растворителем. Эффект лекарства сравним по интенсивности с эффектом в группе, обработанной путем непрерывного введения человеческого IGF-1 в дозе 1 мг/кг/сутки, и в группе, обработанной путем введения внутривенно мышиного родительского антитела IGF11-16.
Такие результаты указывают на то, что можно ожидать, что однократная доза hIGF13_PS окажет лекарственный эффект, эквивалентный 2-недельному непрерывному введению человеческого IGF-1.
Пример 16. Эффект удлинения хряща пластинки роста у гипофизэктомированных морских свинок с помощью гуманизированных антител
Для того, чтобы оценить эффект пролиферации хряща пластинки роста с помощью hIGF13_PS, оценивают толщину эпифизарной линии проксимального отдела большеберцовой кости с использованием модели гипофизэктомированной морской свинки (HPX). Модель гипофизэктомированной морской свинки (HPX) находится в состоянии низкого уровня IGF-1, так как продукция гормона роста подавлена из-за удаления гипофиза.
Гипофизэктомированным морским свинкам вводят подкожно однократную дозу hIGF13_PS 0,3 мг/кг или 1,0 мг/кг, и 2 недели спустя собирают правые нижние конечности. Получают образцы ткани хряща пластинки роста из проксимальной части большеберцовой кости, и измеряют толщину хряща пластинки роста (эпифизарную толщину) с помощью толуидинового синего. В качестве положительного контроля непрерывно вводят подкожно препарат IGF-1 (мекасермин) по 1 мг/кг/сутки с использованием осмотического насоса, и препарат GH (соматропин) вводят подкожно один раз в сутки по 1 мг/кг/сутки.
Результаты показаны на фиг. 6. Такие результаты указывают на то, что увеличение толщины эпифиза наблюдается в каждой из групп IGF-1 и GH, что, предположительно, вызвано тем, что уровень IGF-1 в крови снижается из-за добавления HPX, или поскольку добавлен GH, потерянный из-за HPX. Показано, что в группе антител hIGF13_PS толщина эпифиза у особей с гипофизэктомией (HPX) увеличивается в зависимости от дозы без повышения уровня IGF-1 в крови.
Такие результаты указывают на то, что антитело hIGF13_PS способно восстанавливать окклюзию эпифизарной линии, вызванную снижением концентрации IGF-1 из-за лечения гипофизэктомией (HPX), через активацию передачи сигналов, опосредованных IGF-1R.
Пример 17. Гипогликемический эффект у макак-крабоедов за счет гуманизированных антител
Для того, чтобы подтвердить, оказывают ли антитела-агонисты против рецептора IGF-1 гипогликемическое действие на макак-крабоедов, макакам-крабоедам вводят однократную дозу hIGF13_PS, измеряют последовательно уровни глюкозы в крови, и гипогликемический эффект сравнивают с эффектом при однократной дозе IGF-1 (1 мг/кг). Гипогликемическим эффектом в настоящем описании называется эффект снижения уровня глюкозы в крови до менее чем 50% при сравнении с группой растворителя или эффектом, вызывающим гипогликемические симптомы.
Каждое гуманизированное антитело вводят макакам-крабоедам по 10 мг/кг в виде однократной внутривенной или подкожной дозы. Образцы крови берут до (0 часов) и через 5 и 30 минут и 1, 2, 4, 8 и 24 часа после введения, и измеряют уровни глюкозы в крови с использованием Medisafe Fit (Terumo Corporation).
Результаты показаны на фиг. 7. Ни одно гуманизированное антитело не показало различий в уровнях глюкозы в крови по сравнению с контрольной группой растворителя, которая получала только растворитель, и все уровни глюкозы в крови после введения были на том же уровне, что и в контрольной группе растворителя. С другой стороны, в группе IGF-1 через 2 часа наступает гипогликемия и появились симптомы гипогликемии, поэтому для восстановления вводят глюкозу.
Пример 18. Кинетика гуманизированных антител в крови у макак-крабоедов
Макакам-крабоедам вводят внутривенно или подкожно гуманизированное антитело hIGF13_PS в виде однократной дозы по 1 или 10 мг/кг. Образцы крови берут до (0 часов) и через 2, 4, 8, 24, 48, 72 и 144 часов после введения, и измеряют концентрацию гуманизированного антитела в плазме методом ELISA.
В частности, проводят измерение на антиген методом ELISA с использованием рекомбинантного IGF-1R (305-GR-050, R&D SYSTEMS). Калибровочную кривую для получения серии стандартных образцов для каждого антитела, вводимого макакам, получают путем серийного разведения раствора антитела известной концентрации. Каждый из стандартов и образцов плазмы для измерения разводят 10-1000 крат.
Добавляют 0,5 мкг/мл раствор рекомбинантного IGF-1R в PBS в 96-луночный планшет (MaxiSorp (NUNC)) и фиксируют при 4°C в течение ночи. Также выполняют блокирование раствором 3% BSA/PBS для получения фиксированного планшета с рекомбинантным IGF-1R. Плазму, взятую у макаки, которой не вводили антитело, используют для серийного разведения антител для получения серии стандартных образцов. Каждый из образцов плазмы и стандартных образцов разводят 10-кратно и добавляют в фиксированный планшет с рекомбинантным IGF-1R в количестве 50 мкл/лунка. Реакцию проводят в течение 1 часа 30 минут при комнатной температуре с последующей промывкой PBS-T (PBS, 0,025% твин 20). Затем добавляют раствор конъюгированного с щелочной фосфатазой поликлонального антитела против человеческого IgG (H+L) (Southern Biotechnology Associates, кат. #2087-04), разведенного в 2000 раз в 3% BSA/PBS, в количестве 50 мкл на лунку, и позволяют реакции протекать в течение 1 часа при комнатной температуре. Затем выполняют операцию промывки PBS-T, и добавляют pNPP (Wako, Cat# 149-02342) в качестве хромогенного субстрата в количестве 100 мкл/лунка с последующей инкубацией в течение 1 часа при комнатной температуре. После этого измеряют поглощение при 405 нм и 550 нм устройством для прочтения планшетов, и вычисляют разность между поглощением при 405 нм и при 550 нм. Строят калибровочную кривую в диапазоне концентраций антитела с использованием серии стандартов, и вычисляют концентрацию антител в каждом образце плазмы.
Результаты показаны на фиг. 8. Такие результаты показывают, что hIGF13_PS обладает превосходной кинетикой в крови у макак-крабоедов.
Пример 19. Эффект увеличения мышечной массы у макак-крабоедов за счет гуманизированных антител
Две макаки-крабоеда получают внутривенное введение … мг/кг hIGF13_PS. Мышечную массу измеряют методом DXA (двухэнергетическая рентгеновская абсорбциометрии) до и через 3-4 недели после введения.
В частности, макак подвергают общей анестезии путем внутримышечного введения (ягодицы) гидрохлорида кетамина (Arevipharma GmbH, 50 мг/мл, 0,2 мл/кг) и раствора гидрохлорида медетомидина (Domitor, Orion Corporation, 1 мг/мл, 0,08 мл/кг). Двухэнергетическую рентгеновскую абсорбциометрическую систему (Discovery-A, HOLOLOGIC) используют для измерения массы жира (г), мышечной массы тела без жира (без жира) (г) и содержания минеральных веществ в костях (BMC) (г), и мышечную массу без жира анализируют как мышечную массу. Измеряют BMC (содержание минеральных веществ в костной ткани) и мышечную массу без жира +BMC (г) правой и левой рук (верхних конечностей), вычисляют мышечную массу (г) и сравнивают с массой до введения.
В результате у обоих животных наблюдается увеличение мышечной массы по сравнению с измерением до введения, и скорость увеличения мышечной массы верхних конечностей составляет 7,4% и 10,9%, соответственно, по сравнению с величинами до введения. Такие результаты подтверждают эффект увеличения мышечной массы hIGF13_PS.
Кроме того, двум макакам-крабоедам подкожно вводят hIGF13_PS по 10 мг/кг. Мышечную массу измеряют методом DXA (двухэнергетическая рентгеновская абсорбциометрия) до и через 3-4 недели после введения.
В частности, макак подвергают общей анестезии путем внутримышечного введения (ягодицы) гидрохлорида кетамина (Arevipharma GmbH, 50 мг/мл, 0,2 мл/кг) и раствора гидрохлорида медетомидина (Domitor, Orion Corporation, 1 мг/мл, 0,08 мл/кг). Двухэнергетическую рентгеновскую абсорбциометрическую систему (Discovery-A, HOLOLOGIC) используют для измерения массы жира (г), мышечной массы тела без жира (без жира) (г) и содержания минеральных веществ в костях (BMC) г), и мышечную массу без жира анализируют как мышечную массу. Измеряют BMC (содержание минеральных веществ в костной ткани) и мышечную массу без жира +BMC (г) правой и левой нижних конечностей, вычисляют мышечную массу (г) и сравнивают с массой до введения.
В результате у обоих животных наблюдается увеличение мышечной массы по сравнению с измерением до введения, и скорость увеличения мышечной массы нижних конечностей составляет 3,3% и 12,7%, соответственно, по сравнению с величинами до введения. Эти результаты подтверждают эффект увеличения мышечной массы hIGF13_PS.
Пример 20. Влияние IGF11-16 на пролиферацию клеток HepG2
Оценивают зависящее от концентрации влияние мышиного родительского антитела IGF11-16 на пролиферацию клеток HepG2 с помощью анализа выживаемости клеток.
Клеточную линию HepG2 суспендируют в DMEM (Gibco, 11995) с 1% FBS и высевают в 96-луночный планшет, сенсибилизированный коллагеном I (Corning, 356650), в количестве 0,25×104 клеток на лунку. На следующий день в планшет добавляют каждое вещество из BSA/PBS, IGF-1 (мекасермин), контрольного мышиного антитела IgG1 (mIgG1), антитела IGF11-16 и циксутумумаба (антитело-антагонист рецептора IGF-1), разведенное от 50 нМ в постоянном соотношении 1/10. Через 2 дня определяют количество АТФ в клетках как показатель клеточной пролиферации. измеряя сигнал люминесценции с помощью устройства для прочтения микропланшетов с несколькими режимами обнаружения (SPARK, TECAN) методом анализа жизнеспособности люминесцентных клеток Luminescent Cell Viability Assay CellTiter-Glo® (Promega, G7571). Результат измерения, полученный для контрольного мышиного антитела IgG1 (mIgG1) в каждой точке концентрации, принимают за 100%, и результаты каждого измерения, полученные для других образцов в каждой точке концентрации, вычисляют в единицах % от контроля и наносят на график (фиг. 9).
Результаты показывают, что мышиное родительское антитело IGF11-16 обладает ингибирующим действием на пролиферацию клеток HepG2, что предполагает, что IGF11-16 обладает антагонистическим действием по меньшей мере в отношении некоторых типов раковых клеток.
Пример 21. Влияние IGF11-16 на пролиферативную активность клеточной линии рака молочной железы человека (MCF7), индуцированную IGF-1
Для того, чтобы оценить влияние IGF11-16 на пролиферативную активность клеточной линии рака молочной железы человека (MCF7), индуцированную IGF-1, измеряют зависящую от концентрации пролиферативную активность hIGF-1 (мекацермин) в присутствии 50 нМ IGF11-16 на основании количества АТФ в клетках через 2 дня после добавления.
Клеточную линию рака молочной железы человека (MCF7) культивируют в среде DMEM/F12, содержащей 10% FBS. На следующий день клетки высевают в количестве 0,1 мл/лунка (2,5×103 клетки/лунка) в 96-луночные планшеты (сенсибилизированные коллагеном I типа) с использованием среды DMEM/F12, содержащей 10% FBS, и инкубируют при 37°C с 5% CO2. На следующий день после посева клеток среду меняют на среду DMEM/F12, содержащую 1% BSA, и культуру инкубируют при 37°C и 5% CO2 в течение примерно 8 часов. Затем добавляют 50 нМ 0,1% BSA/PBS или антитело IGF11-16, и добавляют IGF-1, серийно разведенный последовательно от 50 нМ в общем соотношении 1/10, и культуру инкубируют в течение 2 дней при 37°C с 5% CO2. Количество внутриклеточного АТФ измеряют как показатель клеточной пролиферации с использованием люминесцентного анализа жизнеспособности клеток CellTiter-Glo (зарегистрированная торговая марка) (Promega, G7571) и обнаружения сигнала люминесценции с помощью устройств для прочтения микропланшетов с несколькими режимами обнаружения (SPARK, TECAN). Для каждой концентрации IGF-1 среднее значение для группы с 0,1% BSA/PBS принимают за 100%, и изменение в группе с 50 нМ IGF11-16 выражают путем вычисления % от контроля. Результаты приводятся в таблице 17.
Результаты показывают, что мышиное родительское антитело IGF11-16 обладает ингибирующим действием на снижение максимальной активности IGF-1 в отношении клеточной линии рака молочной железы человека (MCF7). Такие результаты предполагают, что IGF11-16 обладает эффектом аллостерического антагонизма.
Промышленная применимость
Настоящее изобретение может предоставить гуманизированные антитела против рецептора IGF-1, которые специфически связываются с рецепторами IGF-1 позвоночных и увеличивают мышечную массу через рецепторы IGF-1 без снижения уровня глюкозы в крови, и, таким образом, могут использоваться при лечении, профилактике или диагностике расстройств, связанных с рецептором IGF-1. Настоящее изобретение также можно использовать при лечении, профилактике или диагностике заболеваний, связанных с аномальной клеточной пролиферацией или активацией, путем подавления избыточной передачи сигналов рецепторами IGF-1. Следовательно, настоящее изобретение имеет чрезвычайно высокую ценность для промышленности.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ТЕЙДЗИН ФАРМА ЛИМИТЕД
<120> ГУМАНИЗИРОВАННОЕ АНТИТЕЛО ПРОТИВ РЕЦЕПТОРА IGF-1
<130>
<150> JP 2020-096344
<151> 2020-06-02
<160> 84
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR-H1
<400> 1
Ser Tyr Trp Met His
1 5
<210> 2
<211> 15
<212> DNA
<213> Artificial Sequence
<220>
<223> CDR-H1
<400> 2
agctactgga tgcac 15
<210> 3
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR-H2_1
<400> 3
Glu Thr Asn Pro Ser Asn Ser Val Thr Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Ser
<210> 4
<211> 51
<212> DNA
<213> Artificial Sequence
<220>
<223> CDR-H2_1
<400> 4
gaaacaaatc cttccaacag cgtgacaaac tataacgaga agttcaagag c 51
<210> 5
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR-H2_2
<400> 5
Glu Thr Asn Pro Ser Ser Ser Val Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 6
<211> 51
<212> DNA
<213> Artificial Sequence
<220>
<223> CDR-H2_2
<400> 6
gaaacaaacc caagcagctc cgtcactaac tacgcccaga agtttcaagg a 51
<210> 7
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR-H3
<400> 7
Gly Arg Gly Arg Gly Phe Ala Tyr
1 5
<210> 8
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> CDR-H3
<400> 8
ggaaggggaa ggggattcgc ttac 24
<210> 9
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR-L1
<400> 9
Arg Ala Ser Gln Asn Ile Asn Phe Trp Leu Ser
1 5 10
<210> 10
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> CDR-L1
<400> 10
agggcctccc agaacatcaa cttctggctc agc 33
<210> 11
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR-L2
<400> 11
Lys Ala Ser Asn Leu His Thr
1 5
<210> 12
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> CDR-L2
<400> 12
aaggccagca acctccacac t 21
<210> 13
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR-L3
<400> 13
Leu Gln Gly Gln Ser Tyr Pro Tyr Thr
1 5
<210> 14
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> CDR-L3
<400> 14
ctccaaggcc agtcctaccc ttacaca 27
<210> 15
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> FW1_VH1
<400> 15
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Thr Asn Pro Ser Asn Ser Val Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 16
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<223> FW1_VH1
<400> 16
caagttcagc tggtgcagtc cggcgctgag gtgaagaagc ccggcgcctc cgtgaaggtg 60
tcttgtaagg cctccggcta caccttcacc tcctactgga tgcactgggt gaggcaagct 120
cccggtcaag gtttagagtg gatgggcgag accaacccct ccaactccgt gaccaactac 180
gcccagaagt tccaaggtcg tgtgacttta accgtggaca cctccacctc caccgcctac 240
atggagctgt cctctttaag gtccgaggac accgccgtgt actactgtac catcggtcgt 300
ggccggggct ttgcttattg gggacaaggt actttagtga ccgtgagcag c 351
<210> 17
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> FW1_VH2
<400> 17
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Thr Asn Pro Ser Asn Ser Val Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 18
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<223> FW1_VH2
<400> 18
caagttcagc tggtgcagtc cggcgctgag gtgaagaagc ccggcgcctc cgtgaaggtg 60
tcttgtaagg cctccggcta caccttcacc tcctactgga tgcactgggt gaggcaagct 120
cccggtcaag gtttagagtg gatgggcgag accaacccct ccaactccgt gaccaactac 180
gcccagaagt tccaaggtcg tgtgacttta accgtggaca cctccacctc caccgcctac 240
atggagctgt cctctttaag gtccgaggac accgccacct actactgtac catcggtcgt 300
ggccggggct ttgcttattg gggacaaggt actttagtga ccgtgagcag c 351
<210> 19
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> FW2_VH1
<400> 19
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Thr Asn Pro Ser Asn Ser Val Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 20
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<223> FW2_VH1
<400> 20
caagttcagc tggtgcagtc cggcgctgag gtgaagaagc ccggctcctc cgtgaaggtg 60
tcttgtaagg cctccggcta caccttcacc tcctactgga tgcactgggt gaggcaagct 120
cccggtcaag gtttagagtg gatgggcgag accaacccct ccaactccgt gaccaactac 180
gcccagaagt tccaaggtcg tgtgacttta accgtggaca agtccacctc caccgcctac 240
atggagctgt cctctttaag gtccgaggac accgccgtgt actactgtac catcggtcgt 300
ggccggggct ttgcttattg gggacaaggt actttagtga ccgtgagcag c 351
<210> 21
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> FW1_VL1
<400> 21
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asn Ile Asn Phe Trp
20 25 30
Leu Ser Trp Cys Gln Gln Lys Pro Gly Lys Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Gly Gln Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 22
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> FW1_VL1
<400> 22
gacatccaga tgacacagtc ccccagctcc gtgtccgcta gcgtgggaga ccgggtgacc 60
attacttgtc gggcctccca gaacatcaac ttctggctga gctggtgtca gcagaagccc 120
ggcaagatcc ccaagttatt aatctacaag gccagcaatt tacacaccgg agtgccttct 180
cgtttctccg gcagcggcag cggaaccgac ttcactttaa ccatctcctc tttacagccc 240
gaggacttcg ccacctacta ttgtttacaa ggtcagtcct atccctacac cttcggcggc 300
ggaaccaagt tagaaatcaa g 321
<210> 23
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> FW1_VL3
<400> 23
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asn Ile Asn Phe Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Gly Gln Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 24
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> FW1_VL3
<400> 24
gacatccaga tgactcagag cccttcctcc gtcagcgctt ccgtgggaga tagggtgact 60
atcacttgta gggcctccca gaacatcaac ttctggctga gctggtatca gcagaagccc 120
ggcaaagccc ctaagctgct gatctacaag gctagcaatc tgcacactgg cgtcccttcc 180
agattcagcg gctccggcag cggcactgac ttcactctca caatcagctc tctgcagcca 240
gaggacttcg ctacatacta ctgcctccaa ggccagtcct atccttacac attcggaggc 300
ggcacaaagc tggagatcaa g 321
<210> 25
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> FW1_VL4
<400> 25
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asn Ile Asn Phe Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Gly Gln Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 26
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> FW1_VL4
<400> 26
gacatccaga tgactcagag cccttcctcc gtcagcgctt ccgtgggaga tagggtgact 60
atcacttgta gggcctccca gaacatcaac ttctggctga gctggtatca gcagaagccc 120
ggcaaagccc ctaggctgct gatctacaag gctagcaatc tgcacactgg cgtcccttcc 180
agattcagcg gctccggcag cggcactgac ttcactctca caatcagctc tctgcagcca 240
gaggacttcg ctacatacta ctgcctccaa ggccagtcct atccttacac attcggaggc 300
ggcacaaagc tggagatcaa g 321
<210> 27
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> FW2_VL2
<400> 27
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asn Ile Asn Phe Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Leu Gln Gly Gln Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 28
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> FW2_VL2
<400> 28
gatatccaga tgactcagag cccaagctct ctgagcgcta gcgtcggaga tagggtcaca 60
atcacttgta gggcctccca gaacatcaac ttctggctca gctggtacca gcagaaaccc 120
ggcaagatcc ctaagctgct gatctacaag gccagcaacc tccacactgg agtcccatct 180
aggtttagcg gatccggcag cggaactgac ttcactctca caatcagctc tctgcagcca 240
gaggacgtgg ctacatacta ctgcctccaa ggccagtcct acccttacac attcggcggc 300
ggcacaaaac tggagatcaa g 321
<210> 29
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> FW1_VH1_mH1
<400> 29
Gln Ile Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Pro Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Thr Asn Pro Ser Asn Ser Val Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 30
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<223> FW1_VH1_mH1
<400> 30
cagattcagc tgcagcagcc cggcgctgaa ctggtgaaac ccggcgcctc cgtgaaactc 60
agctgtaagg cccccggcta cactttcaca tcctactgga tgcactgggt gagacaagcc 120
cccggccaag gactggagtg gatgggcgag acaaacccta gcaactccgt cactaactac 180
gcccagaagt tccaaggaag ggtgactctc acagtggaca ctagcacatc cacagcctac 240
atggaactgt ccagcctcag atccgaggac actgctgtgt actactgcac aatcggcaga 300
ggaaggggat tcgcttactg gggccaaggc acactcgtga ctgtcagctc c 351
<210> 31
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> FW1_VH1_mH2
<400> 31
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Thr Asn Pro Ser Asn Ser Val Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 32
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<223> FW1_VH1_mH2
<400> 32
caagtgcagc tcgtccaaag cggcgctgaa gtgaagaaac ccggcgccag cgtgaaggtc 60
agctgcaaag cctccggcta cacattcaca tcctactgga tgcactgggt caagcagagg 120
cccggccaag gactggagtg gatcggcgaa acaaaccctt ccaacagcgt cactaactac 180
gcccagaagt ttcaaggaag ggtgacactg actgtcgaca ctagcactag cactgcctat 240
atggagctga gctctctgag gagcgaggac actgccgtct attactgcac tatcggaagg 300
ggcagaggat tcgcctactg gggccaaggc actctcgtga cagtcagcag c 351
<210> 33
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> FW1_VH1_mH3
<400> 33
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Thr Asn Pro Ser Asn Ser Val Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 34
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<223> FW1_VH1_mH3
<400> 34
caagtgcaac tggtgcagtc cggcgccgag gtgaagaagc ccggcgccag cgtgaaggtg 60
agctgtaaag ccagcggcta cacattcaca tcctactgga tgcactgggt gagacaagcc 120
cccggccaag gactggagtg gatgggcgaa actaaccctt ccaacagcgt cacaaattat 180
gctcagaaat tccagggaag ggtgacactg acagtcgaca aaagcagcag cacagcctat 240
atgcagctga gctctctgac tagcgaggac tccgccgtgt actactgcac aattggaagg 300
ggcagaggat tcgcctactg gggacaaggc actctggtga cagtcagcgc c 351
<210> 35
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> FW1_VL3_mL1
<400> 35
Asp Ile Gln Met Asn Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Thr Ile Thr Ile Thr Cys Arg Ala Ser Gln Asn Ile Asn Phe Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Gly Gln Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 36
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> FW1_VL3_mL1
<400> 36
gacatccaga tgaatcagag cccttcctcc ctctccgctt ctctgggcga cacaatcaca 60
atcacttgta gggccagcca gaacatcaac ttctggctga gctggtacca gcaaaagccc 120
ggcaaagccc ctaagctgct gatttacaag gcctccaacc tccacactgg agtgcctagc 180
agattctccg gcagcggcag cggaacagac ttcactctca caatcagctc tctgcagcca 240
gaggacttcg ctacatacta ctgcctccaa ggccagtcct atccttacac attcggcggc 300
ggcactaagc tggagatcaa g 321
<210> 37
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> FW1_VL3_mL2+L3
<400> 37
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asn Ile Asn Phe Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Gly Gln Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 38
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> FW1_VL3_mL2+L3
<400> 38
gacattcaga tgacacagtc cccaagctcc gtgtccgcta gcgtcggaga cagagtgaca 60
atcacatgta gggctagcca gaacatcaac ttctggctga gctggtacca gcagaagccc 120
ggcaacatcc ctaagctgct gatctacaag gcctccaatc tgcacactgg cgtgcctagc 180
agattcagcg gatccggctc cggaactgac ttcactctca caatcagctc tctgcagcca 240
gaggacatcg ctacatacta ctgcctccaa ggccagagct atccttacac attcggaggc 300
ggcacaaagc tggagatcaa g 321
<210> 39
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> IGF11-16_VH
<400> 39
Gln Ile Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Pro Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Thr Asn Pro Ser Asn Ser Val Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 40
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<223> IGF11-16_VH
<400> 40
cagatccagc tgcagcagcc cggtgctgag ctggtgaagc ccggtgccag cgtgaagctg 60
tcttgtaagg cccccggtta cactttcaca agctactgga tgcactgggt caagcagaga 120
cccggtcaag gtttagaatg gatcggcgaa acaaatcctt ccaacagcgt gacaaactat 180
aacgagaagt tcaagagcaa ggctactctg actgtggaca agagcagcag cactgcctat 240
atgcagctgt cctctttaac aagcgaggac agcgccgtgt actactgtac aatcggtcgt 300
ggtcgtggat ttgcctactg gggacaaggt acactggtga cagtgtccgc c 351
<210> 41
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> IGF11-16_VL
<400> 41
Asp Ile Gln Met Asn Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Thr Ile Thr Ile Thr Cys Arg Ala Ser Gln Asn Ile Asn Phe Trp
20 25 30
Leu Ser Trp Cys Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Gly Gln Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 42
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> IGF11-16_VL
<400> 42
gacatccaga tgaatcagag ccctagctct ttaagcgcct ctttaggaga cactatcact 60
atcacttgta gggccagcca gaacatcaac ttctggctga gctggtgcca gcagaagccc 120
ggtaacatcc caaagctgct gatctacaaa gccagcaatt tacacactgg tgtcccttct 180
cgttttagcg gctccggcag cggcacagac ttcactctga caatctcctc tttacagcca 240
gaggacatcg ccacttacta ctgtttacaa ggtcagagct acccttacac ttttggcggc 300
ggcactaaac tggagatcaa g 321
<210> 43
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> VH13_PN
<400> 43
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Pro Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Thr Asn Pro Ser Asn Ser Val Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 44
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<223> VH13_PN
<400> 44
caagtgcagc tggtccagag cggagccgaa gtgaaaaagc ccggcgcctc cgtcaaagtc 60
agctgcaagg cccctggcta caccttcacc tcctactgga tgcactgggt gaggcaagct 120
cccggtcaag gtttagagtg gatgggcgag accaacccct ccaactccgt gaccaactac 180
gcccagaagt tccaaggtcg tgtgacttta accgtggaca cctccacctc caccgcctac 240
atggagctgt cctctttaag gtccgaggac accgccacct actactgtac catcggtcgt 300
ggccggggct ttgcttattg gggacaaggt actttagtga ccgtgagcag c 351
<210> 45
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> VH13_PQ
<400> 45
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Pro Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Thr Asn Pro Ser Gln Ser Val Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 46
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<223> VH13_PQ
<400> 46
caagtgcagc tggtccagag cggagccgaa gtgaaaaagc ccggcgcctc cgtcaaagtc 60
agctgcaagg cccctggcta caccttcacc tcctactgga tgcactgggt gaggcaagct 120
cccggtcaag gtttagagtg gatgggcgag accaacccct cccagtccgt gaccaactac 180
gcccagaagt tccaaggtcg tgtgacttta accgtggaca cctccacctc caccgcctac 240
atggagctgt cctctttaag gtccgaggac accgccacct actactgtac catcggtcgt 300
ggccggggct ttgcttattg gggacaaggt actttagtga ccgtgagcag c 351
<210> 47
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> VH13_PS
<400> 47
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Pro Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Thr Asn Pro Ser Ser Ser Val Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 48
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<223> VH13_PS
<400> 48
caagtccaac tggtccagtc cggagccgaa gtgaagaaac ccggcgctag cgtcaaggtc 60
agctgtaagg cccccggcta cacattcact agctactgga tgcactgggt gaggcaagcc 120
cccggccaag gactggagtg gatgggcgaa acaaacccaa gcagctccgt cactaactac 180
gcccagaagt ttcaaggaag ggtgactctc acagtggaca catccacaag cactgcctat 240
atggagctca gctccctcag aagcgaggat acagccactt actactgcac tatcggaagg 300
ggaaggggat tcgcttactg gggccaaggc acactggtca cagtcagctc c 351
<210> 49
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> VH23_PN
<400> 49
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Pro Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Thr Asn Pro Ser Asn Ser Val Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 50
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<223> VH23_PN
<400> 50
caagtgcagc tggtccagag cggagccgaa gtgaaaaagc ccggcgcctc cgtcaaagtc 60
agctgcaagg cccctggcta caccttcacc tcctactgga tgcactgggt gaggcaagct 120
cccggtcaag gtttagagtg gatgggcgag accaacccct ccaactccgt gaccaactac 180
gcccagaagt tccaaggtcg tgtgacttta accgtggaca agtccacctc caccgcctac 240
atggagctgt cctctttaag gtccgaggac accgccgtgt actactgtac catcggtcgt 300
ggccggggct ttgcttattg gggacaaggt actttagtga ccgtgagcag c 351
<210> 51
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> VH23_PQ
<400> 51
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Pro Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Thr Asn Pro Ser Gln Ser Val Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 52
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<223> VH23_PQ
<400> 52
caagtgcagc tggtccagag cggagccgaa gtgaaaaagc ccggcgcctc cgtcaaagtc 60
agctgcaagg cccctggcta caccttcacc tcctactgga tgcactgggt gaggcaagct 120
cccggtcaag gtttagagtg gatgggcgag accaacccct cccagtccgt gaccaactac 180
gcccagaagt tccaaggtcg tgtgacttta accgtggaca agtccacctc caccgcctac 240
atggagctgt cctctttaag gtccgaggac accgccgtgt actactgtac catcggtcgt 300
ggccggggct ttgcttattg gggacaaggt actttagtga ccgtgagcag c 351
<210> 53
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> VH23_PS
<400> 53
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Pro Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Thr Asn Pro Ser Ser Ser Val Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 54
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<223> VH23_PS
<400> 54
caagtccaac tggtccagtc cggagccgaa gtgaagaaac ccggcgctag cgtcaaggtc 60
agctgtaagg cccccggcta cacattcact agctactgga tgcactgggt gaggcaagcc 120
cccggccaag gactggagtg gatgggcgaa acaaacccaa gcagctccgt cactaactac 180
gcccagaagt ttcaaggaag ggtgactctc acagtggaca agtccacaag cactgcctat 240
atggagctca gctccctcag aagcgaggat acagccgtgt actactgcac tatcggaagg 300
ggaaggggat tcgcttactg gggccaaggc acactggtca cagtcagctc c 351
<210> 55
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> VH25_PN
<400> 55
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Pro Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Thr Asn Pro Ser Asn Ser Val Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 56
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<223> VH25_PN
<400> 56
caagtgcagc tggtccagag cggagccgaa gtgaaaaagc ccggcgcctc cgtcaaagtc 60
agctgcaagg cccctggcta caccttcacc tcctactgga tgcactgggt gaggcaagct 120
cccggtcaag gtttagagtg gatgggcgag accaacccct ccaactccgt gaccaactac 180
gcccagaagt tccaaggtcg tgtgacttta accgtggaca cctccacctc caccgcctac 240
atggagctgt cctctttaag gtccgaggac accgccgtgt actactgtac catcggtcgt 300
ggccggggct ttgcttattg gggacaaggt actttagtga ccgtgagcag c 351
<210> 57
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> VH25_PQ
<400> 57
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Pro Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Thr Asn Pro Ser Gln Ser Val Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 58
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<223> VH25_PQ
<400> 58
caagtgcagc tggtccagag cggagccgaa gtgaaaaagc ccggcgcctc cgtcaaagtc 60
agctgcaagg cccctggcta caccttcacc tcctactgga tgcactgggt gaggcaagct 120
cccggtcaag gtttagagtg gatgggcgag accaacccct cccagtccgt gaccaactac 180
gcccagaagt tccaaggtcg tgtgacttta accgtggaca cctccacctc caccgcctac 240
atggagctgt cctctttaag gtccgaggac accgccgtgt actactgtac catcggtcgt 300
ggccggggct ttgcttattg gggacaaggt actttagtga ccgtgagcag c 351
<210> 59
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> VH25_PS
<400> 59
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Pro Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Thr Asn Pro Ser Ser Ser Val Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 60
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<223> VH25_PS
<400> 60
caagtccaac tggtccagtc cggagccgaa gtgaagaaac ccggcgctag cgtcaaggtc 60
agctgtaagg cccccggcta cacattcact agctactgga tgcactgggt gaggcaagcc 120
cccggccaag gactggagtg gatgggcgaa acaaacccaa gcagctccgt cactaactac 180
gcccagaagt ttcaaggaag ggtgactctc acagtggaca catccacaag cactgcctat 240
atggagctca gctccctcag aagcgaggat acagccgtgt actactgcac tatcggaagg 300
ggaaggggat tcgcttactg gggccaaggc acactggtca cagtcagctc c 351
<210> 61
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL13
<400> 61
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asn Ile Asn Phe Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Gly Gln Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 62
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> VL13
<400> 62
gacatccaga tgactcagag cccttcctcc gtcagcgctt ccgtgggaga tagggtgact 60
atcacttgta gggcctccca gaacatcaac ttctggctga gctggtatca gcagaagccc 120
ggcaaagccc ctaagctgct gatctacaag gctagcaatc tgcacactgg cgtcccttcc 180
agattcagcg gctccggcag cggcactgac ttcactctca caatcagctc tctgcagcca 240
gaggacttcg ctacatacta ctgcctccaa ggccagtcct atccttacac attcggaggc 300
ggcacaaagc tggagatcaa g 321
<210> 63
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL14
<400> 63
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asn Ile Asn Phe Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Gly Gln Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 64
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> VL14
<400> 64
gacatccaga tgactcagag cccttcctcc gtcagcgctt ccgtgggaga tagggtgact 60
atcacttgta gggcctccca gaacatcaac ttctggctga gctggtatca gcagaagccc 120
ggcaaagccc ctaggctgct gatctacaag gctagcaatc tgcacactgg cgtcccttcc 180
agattcagcg gctccggcag cggcactgac ttcactctca caatcagctc tctgcagcca 240
gaggacttcg ctacatacta ctgcctccaa ggccagtcct atccttacac attcggaggc 300
ggcacaaagc tggagatcaa g 321
<210> 65
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL22
<400> 65
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asn Ile Asn Phe Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Leu Gln Gly Gln Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 66
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> VL22
<400> 66
gatatccaga tgactcagag cccaagctct ctgagcgcta gcgtcggaga tagggtcaca 60
atcacttgta gggcctccca gaacatcaac ttctggctca gctggtacca gcagaaaccc 120
ggcaagatcc ctaagctgct gatctacaag gccagcaacc tccacactgg agtcccatct 180
aggtttagcg gatccggcag cggaactgac ttcactctca caatcagctc tctgcagcca 240
gaggacgtgg ctacatacta ctgcctccaa ggccagtcct acccttacac attcggcggc 300
ggcacaaaac tggagatcaa g 321
<210> 67
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL23
<400> 67
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asn Ile Asn Phe Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Val Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Leu Gln Gly Gln Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 68
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> VL23
<400> 68
gatatccaga tgactcagag cccaagctct ctgagcgcta gcgtcggaga tagggtcaca 60
atcacttgta gggcctccca gaacatcaac ttctggctca gctggtacca gcagaaaccc 120
ggcaaggtcc ctaagctgct gatctacaag gccagcaacc tccacactgg agtcccatct 180
aggtttagcg gatccggcag cggaactgac ttcactctca caatcagctc tctgcagcca 240
gaggacgtgg ctacatacta ctgcctccaa ggccagtcct acccttacac attcggcggc 300
ggcacaaaac tggagatcaa g 321
<210> 69
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL24
<400> 69
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asn Ile Asn Phe Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Val Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Leu Gln Gly Gln Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 70
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> VL24
<400> 70
gatatccaga tgactcagag cccaagctct ctgagcgcta gcgtcggaga tagggtcaca 60
atcacttgta gggcctccca gaacatcaac ttctggctca gctggtacca gcagaaaccc 120
ggcaaggtcc ctaagctgct gatctacaag gccagcaaca ggcacactgg agtcccatct 180
aggtttagcg gatccggcag cggaactgac ttcactctca caatcagctc tctgcagcca 240
gaggacgtgg ctacatacta ctgcctccaa ggccagtcct acccttacac attcggcggc 300
ggcacaaaac tggagatcaa g 321
<210> 71
<211> 1367
<212> PRT
<213> Homo sapiens
<220>
<223> Homo sapiens IGF-I receptor
<400> 71
Met Lys Ser Gly Ser Gly Gly Gly Ser Pro Thr Ser Leu Trp Gly Leu
1 5 10 15
Leu Phe Leu Ser Ala Ala Leu Ser Leu Trp Pro Thr Ser Gly Glu Ile
20 25 30
Cys Gly Pro Gly Ile Asp Ile Arg Asn Asp Tyr Gln Gln Leu Lys Arg
35 40 45
Leu Glu Asn Cys Thr Val Ile Glu Gly Tyr Leu His Ile Leu Leu Ile
50 55 60
Ser Lys Ala Glu Asp Tyr Arg Ser Tyr Arg Phe Pro Lys Leu Thr Val
65 70 75 80
Ile Thr Glu Tyr Leu Leu Leu Phe Arg Val Ala Gly Leu Glu Ser Leu
85 90 95
Gly Asp Leu Phe Pro Asn Leu Thr Val Ile Arg Gly Trp Lys Leu Phe
100 105 110
Tyr Asn Tyr Ala Leu Val Ile Phe Glu Met Thr Asn Leu Lys Asp Ile
115 120 125
Gly Leu Tyr Asn Leu Arg Asn Ile Thr Arg Gly Ala Ile Arg Ile Glu
130 135 140
Lys Asn Ala Asp Leu Cys Tyr Leu Ser Thr Val Asp Trp Ser Leu Ile
145 150 155 160
Leu Asp Ala Val Ser Asn Asn Tyr Ile Val Gly Asn Lys Pro Pro Lys
165 170 175
Glu Cys Gly Asp Leu Cys Pro Gly Thr Met Glu Glu Lys Pro Met Cys
180 185 190
Glu Lys Thr Thr Ile Asn Asn Glu Tyr Asn Tyr Arg Cys Trp Thr Thr
195 200 205
Asn Arg Cys Gln Lys Met Cys Pro Ser Thr Cys Gly Lys Arg Ala Cys
210 215 220
Thr Glu Asn Asn Glu Cys Cys His Pro Glu Cys Leu Gly Ser Cys Ser
225 230 235 240
Ala Pro Asp Asn Asp Thr Ala Cys Val Ala Cys Arg His Tyr Tyr Tyr
245 250 255
Ala Gly Val Cys Val Pro Ala Cys Pro Pro Asn Thr Tyr Arg Phe Glu
260 265 270
Gly Trp Arg Cys Val Asp Arg Asp Phe Cys Ala Asn Ile Leu Ser Ala
275 280 285
Glu Ser Ser Asp Ser Glu Gly Phe Val Ile His Asp Gly Glu Cys Met
290 295 300
Gln Glu Cys Pro Ser Gly Phe Ile Arg Asn Gly Ser Gln Ser Met Tyr
305 310 315 320
Cys Ile Pro Cys Glu Gly Pro Cys Pro Lys Val Cys Glu Glu Glu Lys
325 330 335
Lys Thr Lys Thr Ile Asp Ser Val Thr Ser Ala Gln Met Leu Gln Gly
340 345 350
Cys Thr Ile Phe Lys Gly Asn Leu Leu Ile Asn Ile Arg Arg Gly Asn
355 360 365
Asn Ile Ala Ser Glu Leu Glu Asn Phe Met Gly Leu Ile Glu Val Val
370 375 380
Thr Gly Tyr Val Lys Ile Arg His Ser His Ala Leu Val Ser Leu Ser
385 390 395 400
Phe Leu Lys Asn Leu Arg Leu Ile Leu Gly Glu Glu Gln Leu Glu Gly
405 410 415
Asn Tyr Ser Phe Tyr Val Leu Asp Asn Gln Asn Leu Gln Gln Leu Trp
420 425 430
Asp Trp Asp His Arg Asn Leu Thr Ile Lys Ala Gly Lys Met Tyr Phe
435 440 445
Ala Phe Asn Pro Lys Leu Cys Val Ser Glu Ile Tyr Arg Met Glu Glu
450 455 460
Val Thr Gly Thr Lys Gly Arg Gln Ser Lys Gly Asp Ile Asn Thr Arg
465 470 475 480
Asn Asn Gly Glu Arg Ala Ser Cys Glu Ser Asp Val Leu His Phe Thr
485 490 495
Ser Thr Thr Thr Ser Lys Asn Arg Ile Ile Ile Thr Trp His Arg Tyr
500 505 510
Arg Pro Pro Asp Tyr Arg Asp Leu Ile Ser Phe Thr Val Tyr Tyr Lys
515 520 525
Glu Ala Pro Phe Lys Asn Val Thr Glu Tyr Asp Gly Gln Asp Ala Cys
530 535 540
Gly Ser Asn Ser Trp Asn Met Val Asp Val Asp Leu Pro Pro Asn Lys
545 550 555 560
Asp Val Glu Pro Gly Ile Leu Leu His Gly Leu Lys Pro Trp Thr Gln
565 570 575
Tyr Ala Val Tyr Val Lys Ala Val Thr Leu Thr Met Val Glu Asn Asp
580 585 590
His Ile Arg Gly Ala Lys Ser Glu Ile Leu Tyr Ile Arg Thr Asn Ala
595 600 605
Ser Val Pro Ser Ile Pro Leu Asp Val Leu Ser Ala Ser Asn Ser Ser
610 615 620
Ser Gln Leu Ile Val Lys Trp Asn Pro Pro Ser Leu Pro Asn Gly Asn
625 630 635 640
Leu Ser Tyr Tyr Ile Val Arg Trp Gln Arg Gln Pro Gln Asp Gly Tyr
645 650 655
Leu Tyr Arg His Asn Tyr Cys Ser Lys Asp Lys Ile Pro Ile Arg Lys
660 665 670
Tyr Ala Asp Gly Thr Ile Asp Ile Glu Glu Val Thr Glu Asn Pro Lys
675 680 685
Thr Glu Val Cys Gly Gly Glu Lys Gly Pro Cys Cys Ala Cys Pro Lys
690 695 700
Thr Glu Ala Glu Lys Gln Ala Glu Lys Glu Glu Ala Glu Tyr Arg Lys
705 710 715 720
Val Phe Glu Asn Phe Leu His Asn Ser Ile Phe Val Pro Arg Pro Glu
725 730 735
Arg Lys Arg Arg Asp Val Met Gln Val Ala Asn Thr Thr Met Ser Ser
740 745 750
Arg Ser Arg Asn Thr Thr Ala Ala Asp Thr Tyr Asn Ile Thr Asp Pro
755 760 765
Glu Glu Leu Glu Thr Glu Tyr Pro Phe Phe Glu Ser Arg Val Asp Asn
770 775 780
Lys Glu Arg Thr Val Ile Ser Asn Leu Arg Pro Phe Thr Leu Tyr Arg
785 790 795 800
Ile Asp Ile His Ser Cys Asn His Glu Ala Glu Lys Leu Gly Cys Ser
805 810 815
Ala Ser Asn Phe Val Phe Ala Arg Thr Met Pro Ala Glu Gly Ala Asp
820 825 830
Asp Ile Pro Gly Pro Val Thr Trp Glu Pro Arg Pro Glu Asn Ser Ile
835 840 845
Phe Leu Lys Trp Pro Glu Pro Glu Asn Pro Asn Gly Leu Ile Leu Met
850 855 860
Tyr Glu Ile Lys Tyr Gly Ser Gln Val Glu Asp Gln Arg Glu Cys Val
865 870 875 880
Ser Arg Gln Glu Tyr Arg Lys Tyr Gly Gly Ala Lys Leu Asn Arg Leu
885 890 895
Asn Pro Gly Asn Tyr Thr Ala Arg Ile Gln Ala Thr Ser Leu Ser Gly
900 905 910
Asn Gly Ser Trp Thr Asp Pro Val Phe Phe Tyr Val Gln Ala Lys Thr
915 920 925
Gly Tyr Glu Asn Phe Ile His Leu Ile Ile Ala Leu Pro Val Ala Val
930 935 940
Leu Leu Ile Val Gly Gly Leu Val Ile Met Leu Tyr Val Phe His Arg
945 950 955 960
Lys Arg Asn Asn Ser Arg Leu Gly Asn Gly Val Leu Tyr Ala Ser Val
965 970 975
Asn Pro Glu Tyr Phe Ser Ala Ala Asp Val Tyr Val Pro Asp Glu Trp
980 985 990
Glu Val Ala Arg Glu Lys Ile Thr Met Ser Arg Glu Leu Gly Gln Gly
995 1000 1005
Ser Phe Gly Met Val Tyr Glu Gly Val Ala Lys Gly Val Val Lys
1010 1015 1020
Asp Glu Pro Glu Thr Arg Val Ala Ile Lys Thr Val Asn Glu Ala
1025 1030 1035
Ala Ser Met Arg Glu Arg Ile Glu Phe Leu Asn Glu Ala Ser Val
1040 1045 1050
Met Lys Glu Phe Asn Cys His His Val Val Arg Leu Leu Gly Val
1055 1060 1065
Val Ser Gln Gly Gln Pro Thr Leu Val Ile Met Glu Leu Met Thr
1070 1075 1080
Arg Gly Asp Leu Lys Ser Tyr Leu Arg Ser Leu Arg Pro Glu Met
1085 1090 1095
Glu Asn Asn Pro Val Leu Ala Pro Pro Ser Leu Ser Lys Met Ile
1100 1105 1110
Gln Met Ala Gly Glu Ile Ala Asp Gly Met Ala Tyr Leu Asn Ala
1115 1120 1125
Asn Lys Phe Val His Arg Asp Leu Ala Ala Arg Asn Cys Met Val
1130 1135 1140
Ala Glu Asp Phe Thr Val Lys Ile Gly Asp Phe Gly Met Thr Arg
1145 1150 1155
Asp Ile Tyr Glu Thr Asp Tyr Tyr Arg Lys Gly Gly Lys Gly Leu
1160 1165 1170
Leu Pro Val Arg Trp Met Ser Pro Glu Ser Leu Lys Asp Gly Val
1175 1180 1185
Phe Thr Thr Tyr Ser Asp Val Trp Ser Phe Gly Val Val Leu Trp
1190 1195 1200
Glu Ile Ala Thr Leu Ala Glu Gln Pro Tyr Gln Gly Leu Ser Asn
1205 1210 1215
Glu Gln Val Leu Arg Phe Val Met Glu Gly Gly Leu Leu Asp Lys
1220 1225 1230
Pro Asp Asn Cys Pro Asp Met Leu Phe Glu Leu Met Arg Met Cys
1235 1240 1245
Trp Gln Tyr Asn Pro Lys Met Arg Pro Ser Phe Leu Glu Ile Ile
1250 1255 1260
Ser Ser Ile Lys Glu Glu Met Glu Pro Gly Phe Arg Glu Val Ser
1265 1270 1275
Phe Tyr Tyr Ser Glu Glu Asn Lys Leu Pro Glu Pro Glu Glu Leu
1280 1285 1290
Asp Leu Glu Pro Glu Asn Met Glu Ser Val Pro Leu Asp Pro Ser
1295 1300 1305
Ala Ser Ser Ser Ser Leu Pro Leu Pro Asp Arg His Ser Gly His
1310 1315 1320
Lys Ala Glu Asn Gly Pro Gly Pro Gly Val Leu Val Leu Arg Ala
1325 1330 1335
Ser Phe Asp Glu Arg Gln Pro Tyr Ala His Met Asn Gly Gly Arg
1340 1345 1350
Lys Asn Glu Arg Ala Leu Pro Leu Pro Gln Ser Ser Thr Cys
1355 1360 1365
<210> 72
<211> 4101
<212> DNA
<213> Homo sapiens
<220>
<223> Homo sapiens IGF-I receptor
<400> 72
atgaagtctg gctccggagg agggtccccg acctcgctgt gggggctcct gtttctctcc 60
gccgcgctct cgctctggcc gacgagtgga gaaatctgcg ggccaggcat cgacatccgc 120
aacgactatc agcagctgaa gcgcctggag aactgcacgg tgatcgaggg ctacctccac 180
atcctgctca tctccaaggc cgaggactac cgcagctacc gcttccccaa gctcacggtc 240
attaccgagt acttgctgct gttccgagtg gctggcctcg agagcctcgg agacctcttc 300
cccaacctca cggtcatccg cggctggaaa ctcttctaca actacgccct ggtcatcttc 360
gagatgacca atctcaagga tattgggctt tacaacctga ggaacattac tcggggggcc 420
atcaggattg agaaaaatgc tgacctctgt tacctctcca ctgtggactg gtccctgatc 480
ctggatgcgg tgtccaataa ctacattgtg gggaataagc ccccaaagga atgtggggac 540
ctgtgtccag ggaccatgga ggagaagccg atgtgtgaga agaccaccat caacaatgag 600
tacaactacc gctgctggac cacaaaccgc tgccagaaaa tgtgcccaag cacgtgtggg 660
aagcgggcgt gcaccgagaa caatgagtgc tgccaccccg agtgcctggg cagctgcagc 720
gcgcctgaca acgacacggc ctgtgtagct tgccgccact actactatgc cggtgtctgt 780
gtgcctgcct gcccgcccaa cacctacagg tttgagggct ggcgctgtgt ggaccgtgac 840
ttctgcgcca acatcctcag cgccgagagc agcgactccg aggggtttgt gatccacgac 900
ggcgagtgca tgcaggagtg cccctcgggc ttcatccgca acggcagcca gagcatgtac 960
tgcatccctt gtgaaggtcc ttgcccgaag gtctgtgagg aagaaaagaa aacaaagacc 1020
attgattctg ttacttctgc tcagatgctc caaggatgca ccatcttcaa gggcaatttg 1080
ctcattaaca tccgacgggg gaataacatt gcttcagagc tggagaactt catggggctc 1140
atcgaggtgg tgacgggcta cgtgaagatc cgccattctc atgccttggt ctccttgtcc 1200
ttcctaaaaa accttcgcct catcctagga gaggagcagc tagaagggaa ttactccttc 1260
tacgtcctcg acaaccagaa cttgcagcaa ctgtgggact gggaccaccg caacctgacc 1320
atcaaagcag ggaaaatgta ctttgctttc aatcccaaat tatgtgtttc cgaaatttac 1380
cgcatggagg aagtgacggg gactaaaggg cgccaaagca aaggggacat aaacaccagg 1440
aacaacgggg agagagcctc ctgtgaaagt gacgtcctgc atttcacctc caccaccacg 1500
tcgaagaatc gcatcatcat aacctggcac cggtaccggc cccctgacta cagggatctc 1560
atcagcttca ccgtttacta caaggaagca ccctttaaga atgtcacaga gtatgatggg 1620
caggatgcct gcggctccaa cagctggaac atggtggacg tggacctccc gcccaacaag 1680
gacgtggagc ccggcatctt actacatggg ctgaagccct ggactcagta cgccgtttac 1740
gtcaaggctg tgaccctcac catggtggag aacgaccata tccgtggggc caagagtgag 1800
atcttgtaca ttcgcaccaa tgcttcagtt ccttccattc ccttggacgt tctttcagca 1860
tcgaactcct cttctcagtt aatcgtgaag tggaaccctc cctctctgcc caacggcaac 1920
ctgagttact acattgtgcg ctggcagcgg cagcctcagg acggctacct ttaccggcac 1980
aattactgct ccaaagacaa aatccccatc aggaagtatg ccgacggcac catcgacatt 2040
gaggaggtca cagagaaccc caagactgag gtgtgtggtg gggagaaagg gccttgctgc 2100
gcctgcccca aaactgaagc cgagaagcag gccgagaagg aggaggctga ataccgcaaa 2160
gtctttgaga atttcctgca caactccatc ttcgtgccca gacctgaaag gaagcggaga 2220
gatgtcatgc aagtggccaa caccaccatg tccagccgaa gcaggaacac cacggccgca 2280
gacacctaca acatcaccga cccggaagag ctggagacag agtacccttt ctttgagagc 2340
agagtggata acaaggagag aactgtcatt tctaaccttc ggcctttcac attgtaccgc 2400
atcgatatcc acagctgcaa ccacgaggct gagaagctgg gctgcagcgc ctccaacttc 2460
gtctttgcaa ggactatgcc cgcagaagga gcagatgaca ttcctgggcc agtgacctgg 2520
gagccaaggc ctgaaaactc catcttttta aagtggccgg aacctgagaa tcccaatgga 2580
ttgattctaa tgtatgaaat aaaatacgga tcacaagttg aggatcagcg agaatgtgtg 2640
tccagacagg aatacaggaa gtatggaggg gccaagctaa accggctaaa cccggggaac 2700
tacacagccc ggattcaggc cacatctctc tctgggaatg ggtcgtggac agatcctgtg 2760
ttcttctatg tccaggccaa aacaggatat gaaaacttca tccatctgat catcgctctg 2820
cccgtcgctg tcctgttgat cgtgggaggg ttggtgatta tgctgtacgt cttccataga 2880
aagagaaata acagcaggct ggggaatgga gtgctgtatg cctctgtgaa cccggagtac 2940
ttcagcgctg ctgatgtgta cgttcctgat gagtgggagg tggctcggga gaagatcacc 3000
atgagccggg aacttgggca ggggtcgttt gggatggtct atgaaggagt tgccaagggt 3060
gtggtgaaag atgaacctga aaccagagtg gccattaaaa cagtgaacga ggccgcaagc 3120
atgcgtgaga ggattgagtt tctcaacgaa gcttctgtga tgaaggagtt caattgtcac 3180
catgtggtgc gattgctggg tgtggtgtcc caaggccagc caacactggt catcatggaa 3240
ctgatgacac ggggcgatct caaaagttat ctccggtctc tgaggccaga aatggagaat 3300
aatccagtcc tagcacctcc aagcctgagc aagatgattc agatggccgg agagattgca 3360
gacggcatgg catacctcaa cgccaataag ttcgtccaca gagaccttgc tgcccggaat 3420
tgcatggtag ccgaagattt cacagtcaaa atcggagatt ttggtatgac gcgagatatc 3480
tatgagacag actattaccg gaaaggaggg aaagggctgc tgcccgtgcg ctggatgtct 3540
cctgagtccc tcaaggatgg agtcttcacc acttactcgg acgtctggtc cttcggggtc 3600
gtcctctggg agatcgccac actggccgag cagccctacc agggcttgtc caacgagcaa 3660
gtccttcgct tcgtcatgga gggcggcctt ctggacaagc cagacaactg tcctgacatg 3720
ctgtttgaac tgatgcgcat gtgctggcag tataacccca agatgaggcc ttccttcctg 3780
gagatcatca gcagcatcaa agaggagatg gagcctggct tccgggaggt ctccttctac 3840
tacagcgagg agaacaagct gcccgagccg gaggagctgg acctggagcc agagaacatg 3900
gagagcgtcc ccctggaccc ctcggcctcc tcgtcctccc tgccactgcc cgacagacac 3960
tcaggacaca aggccgagaa cggccccggc cctggggtgc tggtcctccg cgccagcttc 4020
gacgagagac agccttacgc ccacatgaac gggggccgca agaacgagcg ggccttgccg 4080
ctgccccagt cttcgacctg c 4101
<210> 73
<211> 1367
<212> PRT
<213> Macaca fascicularis
<220>
<223> Macaca fascicularis IGF-I receptor
<400> 73
Met Lys Ser Gly Ser Gly Glu Gly Ser Pro Thr Ser Leu Trp Gly Leu
1 5 10 15
Leu Phe Leu Ser Ala Ala Leu Ser Leu Trp Pro Thr Ser Gly Glu Ile
20 25 30
Cys Gly Pro Gly Ile Asp Ile Arg Asn Asp Tyr Gln Gln Leu Lys Arg
35 40 45
Leu Glu Asn Cys Thr Val Ile Glu Gly Tyr Leu His Ile Leu Leu Ile
50 55 60
Ser Lys Ala Glu Asp Tyr Arg Ser Tyr Arg Phe Pro Lys Leu Thr Val
65 70 75 80
Ile Thr Glu Tyr Leu Leu Leu Phe Arg Val Ala Gly Leu Glu Ser Leu
85 90 95
Gly Asp Leu Phe Pro Asn Leu Thr Val Ile Arg Gly Trp Lys Leu Phe
100 105 110
Tyr Asn Tyr Ala Leu Val Ile Phe Glu Met Thr Asn Leu Lys Asp Ile
115 120 125
Gly Leu Tyr Asn Leu Arg Asn Ile Thr Arg Gly Ala Ile Arg Ile Glu
130 135 140
Lys Asn Ala Asp Leu Cys Tyr Leu Ser Thr Val Asp Trp Ser Leu Ile
145 150 155 160
Leu Asp Ala Val Ser Asn Asn Tyr Ile Val Gly Asn Lys Pro Pro Lys
165 170 175
Glu Cys Gly Asp Leu Cys Pro Gly Thr Met Glu Glu Lys Pro Met Cys
180 185 190
Glu Lys Thr Thr Ile Asn Asn Glu Tyr Asn Tyr Arg Cys Trp Thr Thr
195 200 205
Asn Arg Cys Gln Lys Met Cys Pro Ser Ala Cys Gly Lys Arg Ala Cys
210 215 220
Thr Glu Asn Asn Glu Cys Cys His Pro Glu Cys Leu Gly Ser Cys Ser
225 230 235 240
Ala Pro Asp Asn Asp Thr Ala Cys Val Ala Cys Arg His Tyr Tyr Tyr
245 250 255
Ala Gly Val Cys Val Pro Ala Cys Pro Pro Asn Thr Tyr Arg Phe Glu
260 265 270
Gly Trp Arg Cys Val Asp Arg Asp Phe Cys Ala Asn Ile Leu Ser Ala
275 280 285
Glu Ser Ser Asp Ser Glu Gly Phe Val Ile His Asp Gly Glu Cys Met
290 295 300
Gln Glu Cys Pro Ser Gly Phe Ile Arg Asn Gly Ser Gln Ser Met Tyr
305 310 315 320
Cys Ile Pro Cys Glu Gly Pro Cys Pro Lys Val Cys Glu Glu Glu Lys
325 330 335
Lys Thr Lys Thr Ile Asp Ser Val Thr Ser Ala Gln Met Leu Gln Gly
340 345 350
Cys Thr Ile Phe Lys Gly Asn Leu Leu Ile Asn Ile Arg Arg Gly Asn
355 360 365
Asn Ile Ala Ser Glu Leu Glu Asn Phe Met Gly Leu Ile Glu Val Val
370 375 380
Thr Gly Tyr Val Lys Ile Arg His Ser His Ala Leu Val Ser Leu Ser
385 390 395 400
Phe Leu Lys Asn Leu Arg Leu Ile Leu Gly Glu Glu Gln Leu Glu Gly
405 410 415
Asn Tyr Ser Phe Tyr Val Leu Asp Asn Gln Asn Leu Gln Gln Leu Trp
420 425 430
Asp Trp Asp His Arg Asn Leu Thr Ile Lys Ala Gly Lys Met Tyr Phe
435 440 445
Ala Phe Asn Pro Lys Leu Cys Val Ser Glu Ile Tyr Arg Met Glu Glu
450 455 460
Val Thr Gly Thr Lys Gly Arg Gln Ser Lys Gly Asp Ile Asn Thr Arg
465 470 475 480
Asn Asn Gly Glu Arg Ala Ser Cys Glu Ser Asp Val Leu His Phe Thr
485 490 495
Ser Thr Thr Thr Trp Lys Asn Arg Ile Ile Ile Thr Trp His Arg Tyr
500 505 510
Arg Pro Pro Asp Tyr Arg Asp Leu Ile Ser Phe Thr Val Tyr Tyr Lys
515 520 525
Glu Ala Pro Phe Lys Asn Val Thr Glu Tyr Asp Gly Gln Asp Ala Cys
530 535 540
Gly Ser Asn Ser Trp Asn Met Val Asp Val Asp Leu Pro Pro Asn Lys
545 550 555 560
Asp Val Glu Pro Gly Ile Leu Leu His Gly Leu Lys Pro Trp Thr Gln
565 570 575
Tyr Ala Val Tyr Val Lys Ala Val Thr Leu Thr Met Val Glu Asn Asp
580 585 590
His Ile Arg Gly Ala Lys Ser Glu Ile Leu Tyr Ile Arg Thr Asn Ala
595 600 605
Ser Val Pro Ser Ile Pro Leu Asp Val Leu Ser Ala Ser Asn Ser Ser
610 615 620
Ser Gln Leu Ile Val Lys Trp Asn Pro Pro Ser Leu Pro Asn Gly Asn
625 630 635 640
Leu Ser Tyr Tyr Ile Val Arg Trp Gln Arg Gln Pro Gln Asp Gly Tyr
645 650 655
Leu Tyr Arg His Asn Tyr Cys Ser Lys Asp Lys Ile Pro Ile Arg Lys
660 665 670
Tyr Ala Asp Gly Thr Ile Asp Ile Glu Glu Val Thr Glu Asn Pro Lys
675 680 685
Thr Glu Val Cys Gly Gly Glu Lys Gly Pro Cys Cys Ala Cys Pro Lys
690 695 700
Thr Glu Ala Glu Lys Gln Ala Glu Lys Glu Glu Ala Glu Tyr Arg Lys
705 710 715 720
Val Phe Glu Asn Phe Leu His Asn Ser Ile Phe Val Pro Arg Pro Glu
725 730 735
Arg Lys Arg Arg Asp Val Met Gln Val Ala Asn Thr Thr Met Ser Ser
740 745 750
Arg Ser Arg Asn Thr Thr Val Ala Asp Thr Tyr Asn Ile Thr Asp Leu
755 760 765
Glu Glu Leu Glu Thr Glu Tyr Pro Phe Phe Glu Ser Arg Val Asp Asn
770 775 780
Lys Glu Arg Thr Val Ile Ser Asn Leu Arg Pro Phe Thr Leu Tyr Arg
785 790 795 800
Ile Asp Ile His Ser Cys Asn His Glu Ala Glu Lys Leu Gly Cys Ser
805 810 815
Ala Ser Asn Phe Val Phe Ala Arg Thr Met Pro Ala Glu Gly Ala Asp
820 825 830
Asp Ile Pro Gly Pro Val Thr Trp Glu Pro Arg Pro Glu Asn Ser Ile
835 840 845
Phe Leu Lys Trp Pro Glu Pro Glu Asn Pro Asn Gly Leu Ile Leu Met
850 855 860
Tyr Glu Ile Lys Tyr Gly Ser Gln Val Glu Asp Gln Arg Glu Cys Val
865 870 875 880
Ser Arg Gln Glu Tyr Arg Lys Tyr Gly Gly Ala Lys Leu Asn Arg Leu
885 890 895
Asn Pro Gly Asn Tyr Thr Ala Arg Ile Gln Ala Thr Ser Leu Ser Gly
900 905 910
Asn Gly Ser Trp Thr Asp Pro Val Phe Phe Tyr Val Gln Ala Lys Thr
915 920 925
Gly Tyr Glu Asn Phe Ile His Leu Ile Ile Ala Leu Pro Val Ala Val
930 935 940
Leu Leu Ile Val Gly Gly Leu Val Ile Met Leu Tyr Val Phe His Arg
945 950 955 960
Lys Arg Asn Asn Ser Arg Leu Gly Asn Gly Val Leu Tyr Ala Ser Val
965 970 975
Asn Pro Glu Tyr Phe Ser Ala Ala Asp Val Tyr Val Pro Asp Glu Trp
980 985 990
Glu Val Ala Arg Glu Lys Ile Thr Met Ser Arg Glu Leu Gly Gln Gly
995 1000 1005
Ser Phe Gly Met Val Tyr Glu Gly Val Ala Lys Gly Val Val Lys
1010 1015 1020
Asp Glu Pro Glu Thr Arg Val Ala Ile Lys Thr Val Asn Glu Ala
1025 1030 1035
Ala Ser Met Arg Glu Arg Ile Glu Phe Leu Asn Glu Ala Ser Val
1040 1045 1050
Met Lys Glu Phe Asn Cys His His Val Val Arg Leu Leu Gly Val
1055 1060 1065
Val Ser Gln Gly Gln Pro Thr Leu Val Ile Met Glu Leu Met Thr
1070 1075 1080
Arg Gly Asp Leu Lys Ser Tyr Leu Arg Ser Leu Arg Pro Glu Met
1085 1090 1095
Glu Asn Asn Pro Val Leu Ala Pro Pro Ser Leu Ser Lys Met Ile
1100 1105 1110
Gln Met Ala Gly Glu Ile Ala Asp Gly Met Ala Tyr Leu Asn Ala
1115 1120 1125
Asn Lys Phe Val His Arg Asp Leu Ala Ala Arg Asn Cys Met Val
1130 1135 1140
Ala Glu Asp Phe Thr Val Lys Ile Gly Asp Phe Gly Met Thr Arg
1145 1150 1155
Asp Ile Tyr Glu Thr Asp Tyr Tyr Arg Lys Gly Gly Lys Gly Leu
1160 1165 1170
Leu Pro Val Arg Trp Met Ser Pro Glu Ser Leu Lys Asp Gly Val
1175 1180 1185
Phe Thr Thr Tyr Ser Asp Val Trp Ser Phe Gly Val Val Leu Trp
1190 1195 1200
Glu Ile Ala Thr Leu Ala Glu Gln Pro Tyr Gln Gly Leu Ser Asn
1205 1210 1215
Glu Gln Val Leu Arg Phe Val Met Glu Gly Gly Leu Leu Asp Lys
1220 1225 1230
Pro Asp Asn Cys Pro Asp Met Leu Phe Glu Leu Met Arg Met Cys
1235 1240 1245
Trp Gln Tyr Asn Pro Lys Met Arg Pro Ser Phe Leu Glu Ile Ile
1250 1255 1260
Ser Ser Ile Lys Asp Glu Met Glu Pro Gly Phe Arg Glu Val Ser
1265 1270 1275
Phe Tyr Tyr Ser Glu Glu Asn Lys Leu Pro Glu Pro Glu Glu Leu
1280 1285 1290
Asp Leu Glu Pro Glu Asn Met Glu Ser Val Pro Leu Asp Pro Ser
1295 1300 1305
Ala Ser Ser Ser Ser Leu Pro Leu Pro Asp Arg His Ser Gly His
1310 1315 1320
Lys Ala Glu Asn Gly Pro Gly Pro Gly Val Leu Val Leu Arg Ala
1325 1330 1335
Ser Phe Asp Glu Arg Gln Pro Tyr Ala His Met Asn Gly Gly Arg
1340 1345 1350
Lys Asn Glu Arg Ala Leu Pro Leu Pro Gln Ser Ser Thr Cys
1355 1360 1365
<210> 74
<211> 4104
<212> DNA
<213> Macaca fascicularis
<220>
<223> Macaca fascicularis IGF-I receptor
<400> 74
atgaagtctg gctctggaga agggtccccg acctcgctgt gggggctcct gtttctctcc 60
gccgcgctct cgctctggcc gacgagtgga gaaatctgtg ggccgggcat cgacatccgc 120
aacgactatc agcagctgaa gcgcctggag aactgcacgg tgatcgaggg ctacctccac 180
atcctgctca tctccaaggc cgaggactac cgcagctacc gcttccccaa gctcacggtc 240
atcaccgagt acttgctgtt gttccgagtg gctggcctag agagcctcgg agacctgttc 300
cccaacctca cggtaatccg cggctggaaa ctcttctaca actacgccct ggtcatcttt 360
gagatgacca atctcaagga tattgggctt tacaacctga ggaacattac tcggggggcc 420
atcaggattg agaaaaatgc tgacctctgt tacctctcca ctgtggactg gtccctgatc 480
ctggatgcag tgtccaataa ctacattgtg gggaataagc ccccaaagga atgcggggac 540
ctgtgtccgg ggaccatgga ggagaagccg atgtgcgaga agaccaccat caacaatgag 600
tacaactacc gctgctggac cacaaaccgc tgccagaaaa tgtgcccgag tgcctgtggg 660
aagagggcat gcaccgagaa caacgagtgc tgccaccccg agtgcctggg cagctgcagc 720
gcgcctgaca acgacacggc ctgtgtagct tgccgccact actactacgc cggtgtctgc 780
gtgcctgcct gcccgcccaa cacctacagg tttgagggct ggcgctgtgt ggaccgtgac 840
ttctgcgcca acatcctcag tgccgagagc agcgactccg agggtttcgt gatccacgac 900
ggcgagtgca tgcaggagtg cccctcaggc ttcatccgca acggcagcca gagcatgtac 960
tgcatccctt gtgaaggtcc ttgccccaag gtctgtgagg aagaaaagaa aacaaagacc 1020
attgattctg ttacttctgc tcagatgctt caaggatgca ccatcttcaa gggcaatttg 1080
ctcattaaca tccgacgggg gaataacatt gcttcagaac tggagaactt catggggctc 1140
atcgaggtgg tgacgggcta cgtgaagatc cgccattccc atgccttggt ctccttgtcc 1200
ttcctaaaaa accttcgcct catcttagga gaggagcagc tagaagggaa ttactccttc 1260
tacgtcctcg acaaccagaa cttgcagcaa ctatgggact gggaccaccg caacctgacc 1320
atcaaagcag ggaaaatgta ctttgctttc aatcccaaat tgtgtgtttc ggaaatttac 1380
cgcatggagg aagtgacggg gactaaaggg cgccaaagca aaggggacat aaacaccagg 1440
aacaacgggg aaagagcctc ctgtgaaagt gacgtcctgc atttcacctc caccaccacg 1500
tggaagaatc gcatcatcat aacctggcac cggtaccggc cccctgacta cagggatctc 1560
atcagcttca ccgtttacta caaggaagca ccttttaaga atgtcacgga gtatgatggg 1620
caggatgcct gcggctccaa cagctggaac atggtggacg tggacctccc gcccaacaag 1680
gacgtggagc ccggcatctt actgcatggg ctgaagccct ggactcagta cgccgtttac 1740
gtcaaggctg tgaccctcac catggtggag aacgaccata tccgtggggc caagagtgag 1800
atcttgtaca ttcgcaccaa tgcttcagtt ccttccattc ccttggacgt tctttcagca 1860
tcgaactcct cttctcagtt aatcgtgaag tggaaccctc cctctctgcc caacggcaac 1920
ctgagttact acattgtgcg ctggcagcgg cagcctcagg acggctacct ttaccggcac 1980
aattactgct ccaaagacaa aatccccatc aggaagtatg ccgacggcac cattgacatt 2040
gaggaggtca cagagaaccc gaagactgag gtgtgtggtg gagagaaagg gccttgctgc 2100
gcctgcccca aaactgaagc tgagaagcag gccgagaagg aggaggctga gtaccgcaaa 2160
gtctttgaga atttcctgca caactccatc tttgtgccca gacctgaaag gaagcggaga 2220
gatgtcatgc aagtggccaa caccaccatg tccagccgaa gcaggaacac cacggtggca 2280
gacacctaca acatcacaga tctggaagag ctagagacag agtacccttt ctttgagagc 2340
agagtggata ataaggagag aactgtcatt tctaaccttc ggcctttcac attgtaccgc 2400
attgatatcc acagctgcaa ccacgaggct gagaaactgg gctgcagcgc ctccaacttt 2460
gtctttgcaa ggactatgcc tgcagaagga gcagatgaca ttcctgggcc agtgacctgg 2520
gagccaaggc ctgaaaactc catcttttta aagtggccag aacctgagaa tcccaatgga 2580
ttgattctaa tgtatgaaat aaaatacgga tcacaagttg aggatcagcg agaatgtgtg 2640
tccagacagg aatacaggaa gtatggaggg gccaagctaa accggctaaa cccggggaac 2700
tacacagccc ggattcaggc tacatctctc tctgggaatg ggtcgtggac agatcctgtg 2760
ttcttctatg tccaggccaa aacaggatac gaaaacttca tccatctgat catcgctctg 2820
cccgtcgctg tcctgttgat cgtgggaggg ttggtgatca tgctgtacgt cttccataga 2880
aagagaaata acagcaggct ggggaatgga gtgctgtacg cgtctgtgaa cccggagtac 2940
ttcagcgctg cggatgtgta cgttcctgat gagtgggagg tggctcggga gaagatcacc 3000
atgagccggg aacttgggca ggggtcgttt gggatggtct atgaaggagt tgccaagggt 3060
gtggtgaaag acgaacctga aaccagagtg gccattaaaa cagtgaacga ggccgcgagc 3120
atgcgtgaaa ggatcgagtt tctcaacgag gcttctgtga tgaaggagtt caattgtcac 3180
catgtggtgc ggttgctggg tgtggtgtcc cagggccagc caacgctggt catcatggaa 3240
ctgatgacgc ggggcgatct caaaagttat ctccggtctc tgaggccaga aatggagaat 3300
aatccagtcc tagcacctcc aagcctaagc aagatgattc agatggctgg agagattgca 3360
gacggcatgg catacctcaa cgccaacaag ttcgtccaca gagaccttgc tgcccggaat 3420
tgcatggtag ccgaggattt cacagtcaaa attggagatt ttgggatgac gcgagatatc 3480
tatgagacag actattaccg gaaaggaggg aaagggctgt tgcccgtgcg ctggatgtct 3540
cccgagtccc tcaaggatgg agtcttcacc acttactcgg acgtctggtc cttcggggtt 3600
gtcctctggg agatcgccac actggccgag cagccctacc agggcttgtc caacgagcaa 3660
gtccttcgct tcgtcatgga gggcggcctt ctggacaagc cagacaactg ccccgacatg 3720
ctgtttgaat tgatgcgcat gtgctggcag tacaacccca agatgaggcc ttccttcctg 3780
gagatcatca gcagcatcaa agacgagatg gagcctggct tccgggaggt ctccttctac 3840
tacagtgagg agaacaagct gcccgagccg gaggagctgg acctggagcc agagaacatg 3900
gagagcgtcc ccctggaccc ctcggcctcc tcgtcctccc tgccactgcc cgacagacac 3960
tcaggacaca aggccgagaa cggccccggc cctggagtgc tggtgctccg cgccagcttc 4020
gatgagagac agccttacgc acacatgaac ggtggccgca agaacgagcg ggccttgccg 4080
ctgccccagt cttcgacctg ctga 4104
<210> 75
<211> 1425
<212> PRT
<213> Oryctolagus cuniculus
<220>
<223> Oryctolagus cuniculus IGF-I receptor
<400> 75
Met Lys Ser Gly Ser Gly Gly Gly Ser Arg Thr Ser Ala Trp Gly Leu
1 5 10 15
Leu Phe Leu Ser Ala Ala Leu Ser Val Trp Pro Thr Ser Gly Glu Ile
20 25 30
Cys Gly Pro Gly Ile Asp Ile Arg Asn Asp Phe Gln Gln Leu Lys Arg
35 40 45
Leu Glu Asn Cys Thr Val Ile Glu Gly Phe Leu His Ile Leu Leu Ile
50 55 60
Ser Lys Ala Glu Asp Tyr Arg Asn Tyr Arg Phe Pro Lys Leu Thr Val
65 70 75 80
Ile Thr Glu Tyr Leu Leu Leu Phe Arg Val Ala Gly Leu Glu Ser Leu
85 90 95
Gly Asp Leu Phe Pro Asn Leu Thr Val Ile Arg Gly Trp Lys Leu Phe
100 105 110
Tyr Asn Tyr Ala Leu Val Ile Phe Glu Met Thr Asn Leu Lys Asp Ile
115 120 125
Gly Leu Tyr Asn Leu Arg Asn Ile Thr Arg Gly Ala Ile Arg Ile Glu
130 135 140
Lys Asn Ala Asp Leu Cys Tyr Leu Ser Thr Val Asp Trp Ser Leu Ile
145 150 155 160
Leu Asp Ala Val Ser Asn Asn Tyr Ile Val Gly Asn Lys Ser Pro Lys
165 170 175
Glu Cys Gly Asp Met Cys Pro Gly Thr Leu Glu Glu Lys Pro Leu Cys
180 185 190
Glu Lys Thr Ala Ile Asn Asn Glu Tyr Asn Tyr Arg Cys Trp Thr Thr
195 200 205
Asn Arg Cys Gln Lys Met Cys Pro Ser Ala Cys Gly Lys Arg Ala Cys
210 215 220
Thr Glu Asn Asn Glu Cys Cys His Pro Glu Cys Leu Gly Ser Cys His
225 230 235 240
Ala Pro Asp Asp Asp Thr Ala Cys Val Ala Cys Arg His Tyr Tyr Phe
245 250 255
Ser Gly Val Cys Val Pro Ala Cys Pro Pro Asn Thr Tyr Arg Phe Glu
260 265 270
Gly Trp Arg Cys Val Asp Arg Asp Phe Cys Ala Asn Ile Pro Asn Ala
275 280 285
Asp Gly Gly Asp Ser Glu Gly Phe Val Ile His Asp Gly Glu Cys Met
290 295 300
Gln Glu Cys Pro Ser Gly Phe Ile Arg Asn Gly Ser Gln Ser Met Phe
305 310 315 320
Cys Ile Pro Cys Glu Gly Pro Cys Pro Lys Val Cys Glu Glu Asp Lys
325 330 335
Lys Thr Lys Thr Ile Asp Ser Val Asn Ser Ala Gln Met Leu Gln Gly
340 345 350
Cys Thr Ile Phe Lys Gly Asn Leu Leu Ile Asn Ile Arg Arg Gly Asn
355 360 365
Asn Ile Ala Ser Glu Leu Glu Asn Phe Met Gly Leu Ile Glu Val Val
370 375 380
Thr Gly Tyr Val Lys Ile Ser His Ser His Ala Leu Val Ser Leu Ser
385 390 395 400
Phe Leu Lys Asn Leu Arg Gln Ile Leu Gly Glu Glu Gln Leu Glu Gly
405 410 415
Asn Tyr Ser Phe Tyr Val Leu Asp Asn Gln Asn Leu Gln Gln Leu Trp
420 425 430
Asp Trp Asp His Arg Asn Leu Thr Ile Lys Ala Gly Lys Met Tyr Phe
435 440 445
Ala Phe Asn Pro Lys Leu Cys Val Ser Glu Ile Tyr Arg Met Glu Asp
450 455 460
Val Thr Gly Thr Lys Gly Arg Gln Ser Lys Gly Asp Ile Asn Thr Arg
465 470 475 480
Asn Asn Gly Glu Arg Ala Ser Cys Glu Ser Asp Ile Leu His Phe Thr
485 490 495
Ser Thr Asn Thr Trp Lys Asn Arg Ile Ile Leu Thr Trp His Arg Tyr
500 505 510
Arg Pro Pro Asp Tyr Arg Asp Leu Ile Ser Phe Thr Val Tyr Tyr Lys
515 520 525
Glu Ala Pro Phe Lys Asn Val Thr Glu Tyr Asp Gly Gln Asp Ala Cys
530 535 540
Gly Ser Asn Ser Trp Asn Met Val Asp Val Asp Leu Pro Pro Asn Lys
545 550 555 560
Asp Leu Glu Pro Gly Ile Leu Leu Gln Gly Leu Lys Pro Trp Thr Gln
565 570 575
Tyr Ala Val Tyr Val Lys Ala Val Thr Leu Thr Met Val Glu Asn Asp
580 585 590
His Ile Arg Gly Ala Lys Ser Glu Ile Leu Tyr Ile Arg Thr Asn Ala
595 600 605
Ser Val Pro Ser Ile Pro Leu Asp Ile Leu Ser Ala Ser Asn Ser Ser
610 615 620
Ser Gln Leu Ile Val Lys Trp Ser Pro Pro Ser Leu Pro Asn Gly Asn
625 630 635 640
Leu Ser Tyr Tyr Ile Val Arg Trp Gln Arg Gln Pro Gln Asp Gly Tyr
645 650 655
Leu Tyr Arg His Asn Tyr Cys Ser Lys Asp Lys Ile Pro Ile Arg Lys
660 665 670
Tyr Ala Asp Gly Thr Ile Asp Val Glu Glu Val Thr Glu Asn Pro Lys
675 680 685
Thr Glu Val Cys Gly Gly Glu Lys Gly Pro Cys Cys Ala Cys Pro Lys
690 695 700
Thr Glu Ala Glu Lys Gln Ala Glu Lys Glu Glu Ala Glu Tyr Arg Lys
705 710 715 720
Val Phe Glu Asn Phe Leu His Asn Ser Ile Phe Val Pro Arg Pro Glu
725 730 735
Arg Lys Arg Arg Asp Val Ala Gln Val Ala Asn Thr Thr Leu Ser Gly
740 745 750
Arg Gly Arg Asn Gly Thr Ala Val Asp Met Tyr Asn Ser Thr Asp Leu
755 760 765
Glu Glu Leu Glu Thr Glu Tyr Pro Phe Phe Glu Thr Arg Val Asp Lys
770 775 780
Glu Ile Thr Val Ile Ser Asn Leu Arg Pro Phe Thr Ser Tyr Arg Ile
785 790 795 800
Asp Ile His Ser Cys Asn His Glu Ala Glu Lys Leu Gly Cys Ser Ala
805 810 815
Ser Asn Phe Val Phe Ala Arg Thr Lys Pro Ala Glu Gly Ala Asp Asp
820 825 830
Ile Pro Gly Pro Val Thr Trp Glu Ala Arg Pro Glu Asn Ser Ile Phe
835 840 845
Leu Lys Trp Pro Glu Pro Glu Asn Pro Asn Gly Leu Ile Leu Met Tyr
850 855 860
Glu Ile Lys Tyr Gly Ser Gln Ile Glu Asp Gln Arg Glu Cys Val Ser
865 870 875 880
Arg Gln Gln Tyr Arg Lys Tyr Gly Gly Ala Lys Leu Asn Arg Leu Asn
885 890 895
Pro Gly Asn Tyr Thr Ala Arg Ile Gln Ala Thr Ser Leu Ser Gly Asn
900 905 910
Gly Ser Trp Thr Glu Pro Val Phe Phe Tyr Val Pro Ala Lys Ala Thr
915 920 925
Tyr Glu Ser Phe Met His Leu Ile Ile Ala Leu Pro Val Ala Ile Leu
930 935 940
Leu Ile Val Gly Gly Leu Leu Ile Val Leu Tyr Val Phe His Arg Lys
945 950 955 960
Arg Ser Asn Ser Arg Leu Gly Asn Gly Val Leu Tyr Ala Ser Val Asn
965 970 975
Pro Glu Tyr Phe Ser Ala Ala Asp Val Tyr Val Pro Asp Glu Trp Glu
980 985 990
Val Ala Arg Glu Lys Ile Thr Met Ser Arg Glu Leu Gly Gln Gly Ser
995 1000 1005
Phe Gly Met Val Tyr Glu Gly Val Ala Lys Gly Val Val Lys Asp
1010 1015 1020
Glu Pro Glu Thr Arg Val Ala Ile Lys Thr Val Asn Glu Ala Ala
1025 1030 1035
Ser Met Arg Glu Arg Ile Glu Phe Leu Asn Glu Ala Ser Val Met
1040 1045 1050
Lys Glu Phe Asn Cys His His Val Val Arg Leu Leu Gly Val Val
1055 1060 1065
Ser Gln Gly Gln Pro Thr Leu Val Ile Met Glu Leu Met Thr Arg
1070 1075 1080
Gly Asp Leu Lys Ser Tyr Leu Arg Ser Leu Arg Pro Glu Val Glu
1085 1090 1095
Ala Glu Leu Gln Arg Glu Arg Gln Arg Gln Arg Gln Asn Phe Ile
1100 1105 1110
Arg Arg Phe Ala Pro Arg Met Ala Ala Thr Ala Arg Ala Gly Pro
1115 1120 1125
Gly Arg Ser Gln Gln Pro Gly Ala Ser Ser Gly Ser Pro Thr Arg
1130 1135 1140
Val Gln Gly Pro Lys Asp Leu Gly His Leu Pro Leu Pro Ser Gln
1145 1150 1155
Asn Arg Ala Pro Ala Pro Pro Ser Leu Ser Lys Met Ile Gln Met
1160 1165 1170
Ala Gly Glu Ile Ala Asp Gly Met Ala Tyr Leu Asn Ala Asn Lys
1175 1180 1185
Phe Val His Arg Asp Leu Ala Ala Arg Asn Cys Met Val Ala Glu
1190 1195 1200
Asp Phe Thr Val Lys Ile Gly Asp Phe Gly Met Thr Arg Asp Ile
1205 1210 1215
Tyr Glu Thr Asp Tyr Tyr Arg Lys Gly Gly Lys Gly Leu Leu Pro
1220 1225 1230
Val Arg Trp Met Ser Pro Glu Ser Leu Lys Asp Gly Val Phe Thr
1235 1240 1245
Thr His Ser Asp Val Trp Ser Phe Gly Val Val Leu Trp Glu Ile
1250 1255 1260
Ala Thr Leu Ala Glu Gln Pro Tyr Gln Gly Phe Ser Asn Glu Gln
1265 1270 1275
Val Leu Arg Phe Val Met Glu Gly Gly Leu Leu Asp Lys Pro Asp
1280 1285 1290
Asn Cys Pro Asp Met Leu Phe Glu Leu Met Arg Met Cys Trp Gln
1295 1300 1305
Tyr Asn Pro Lys Met Arg Pro Ser Phe Leu Glu Ile Ile Gly Ser
1310 1315 1320
Val Arg Asp Glu Met Glu Pro Gly Phe Arg Glu Val Ser Phe Tyr
1325 1330 1335
Tyr Ser Glu Glu Asn Lys Pro Pro Glu Ala Glu Glu Leu Asp Leu
1340 1345 1350
Glu Pro Glu Asn Met Glu Ser Val Pro Leu Asp Pro Ser Ala Asn
1355 1360 1365
Ala Ala Ala Ala Val Ala Ala Leu Gln Pro Asp Arg His Lys Ala
1370 1375 1380
Glu Asn Gly Pro Ser Ala Gly Ala Met Val Leu Arg Ala Ser Phe
1385 1390 1395
Asp Glu Arg Arg Pro Tyr Ala His Met Asn Gly Gly Arg Thr Asp
1400 1405 1410
Glu Arg Ala Leu Pro Leu Pro Gln Ser Ser Thr Cys
1415 1420 1425
<210> 76
<211> 4278
<212> DNA
<213> Oryctolagus cuniculus
<220>
<223> Oryctolagus cuniculus IGF-I receptor
<400> 76
atgaagtctg gctccggagg agggtcccgg acctcggcgt gggggctcct gtttctctcc 60
gccgcgctct cggtctggcc gacgagtgga gaaatctgcg ggccgggcat cgacatccgc 120
aatgacttcc agcagctgaa gcgcctggag aactgcacgg tgatcgaggg cttcctccac 180
atcctgctca tctccaaggc cgaggactac cgcaactacc gcttccccaa gctcaccgtc 240
atcaccgagt acctgctgct gttccgcgtg gccggcctgg agagcctcgg ggacctgttc 300
cccaacctca cggtcatccg cggctggaag ctcttctaca actatgccct ggtcattttc 360
gagatgacta acctcaaaga catagggctc tataacctga ggaacatcac ccggggggcc 420
atcaggatcg agaagaacgc cgacctctgc tacctctcca cggtggactg gtctctcatc 480
ctggacgccg tgtccaacaa ctacattgtg gggaacaagt ccccaaagga gtgcggggac 540
atgtgtccag ggaccttgga ggagaagccg ttgtgcgaga agaccgccat caacaacgag 600
tacaactacc gctgctggac caccaaccgc tgccagaaaa tgtgccccag cgcgtgcggg 660
aagcgggcat gcaccgagaa caacgaatgc tgccaccccg agtgcctggg cagctgccac 720
gcgcctgacg acgacacggc ctgcgtcgcc tgccgccact actatttctc cggcgtctgc 780
gtgcccgcct gcccgcccaa cacctaccga ttcgagggct ggcgctgcgt ggaccgcgac 840
ttctgcgcca acatccctaa cgccgatggc ggcgactccg agggctttgt catccacgac 900
ggcgagtgca tgcaggagtg cccgtcgggc ttcatccgca acggcagcca gagcatgttc 960
tgcattccct gtgaaggtcc gtgccccaag gtctgtgagg aagacaagaa aacaaagacc 1020
attgattctg ttaattctgc tcaaatgctc caaggctgca ccatcttcaa ggggaatctg 1080
ctcattaaca tccgacgagg caataacatt gcctcggagc tggagaactt catggggctc 1140
atcgaggtgg tgacgggcta cgtgaagatc agccactcgc acgccttggt ctccttgtcc 1200
ttcctgaaga acctccgcca gatcctaggg gaggagcagc tggaagggaa ctactccttc 1260
tacgtcctgg acaaccagaa cttgcagcag ctctgggact gggaccaccg caacctgacc 1320
atcaaagctg ggaagatgta cttcgccttc aaccccaaac tgtgcgtgtc ggaaatttac 1380
cgcatggagg acgtgacggg gacgaaagga cgccagagca agggcgacat aaacaccagg 1440
aacaacgggg agagagcctc ctgtgagagc gacatcctgc atttcacctc caccaacacg 1500
tggaagaacc gcatcatcct aacctggcac cgctaccgcc cccctgacta cagggatctc 1560
atcagcttca ccgtctacta caaggaggca ccctttaaaa atgtgacgga gtatgatggg 1620
caggacgcct gcggctccaa cagctggaac atggtggacg tggacctccc tcccaacaag 1680
gacctagagc ctggtattct actgcaaggg ctgaagccct ggactcagta cgccgtctac 1740
gtcaaggccg tgaccctcac catggtggag aatgaccaca tccgaggggc caagagtgaa 1800
atcttgtaca ttcgcaccaa cgcctcagtt ccttccatcc ccttggacat cctctcggca 1860
tccaactcct cgtctcagct gatcgtgaag tggagccccc cgtccctgcc caacgggaac 1920
ctgagctact acatcgtgag gtggcagcgg cagccccagg acggctacct gtaccggcac 1980
aactactgct ccaaagacaa aattcccatc aggaagtatg cggacggcac catcgacgtg 2040
gaggaggtga cggagaaccc caagacggag gtctgtggcg gagagaaggg gccttgctgc 2100
gcgtgcccca agaccgaagc cgagaagcag gctgagaagg aggaggcgga gtaccgcaag 2160
gtgttcgaga acttcctgca caactccatc ttcgtgccca gacccgagag gaagcggaga 2220
gatgtcgccc aggtggccaa caccacgctg tccggccgag gcaggaacgg cacggcggtg 2280
gacatgtaca acagcacgga cctggaggag ctggagacag aatacccttt ctttgagacc 2340
agagtggaca aggagataac ggtcatatct aacctgcggc cgtttacttc ctaccgcatc 2400
gatatccaca gctgcaacca cgaggcggag aagctggggt gcagtgcctc caactttgtc 2460
tttgcgagaa ccaagcctgc agaaggagcg gatgacattc cgggccctgt gacctgggaa 2520
gcaaggcctg aaaactccat ctttctgaag tggccggaac ctgagaaccc caacggattg 2580
atcctaatgt atgagataaa atacgggtct cagatcgagg accagaggga atgtgtgtcc 2640
agacagcagt accgaaagta tggaggagcc aagctcaacc ggctaaaccc ggggaactat 2700
acagcccgga ttcaggctac gtcgctctcc gggaacgggt cgtggacgga gcctgtgttc 2760
ttctatgtcc cagccaaagc cacctacgag agcttcatgc acctgatcat cgcgctgccg 2820
gtcgccatcc tgctcatcgt gggagggctg ctgatcgtgc tgtacgtctt ccacaggaag 2880
agaagtaaca gcagactggg gaacggagtg ctgtacgcct ctgtgaaccc ggagtacttc 2940
agtgcagccg acgtatacgt ccctgacgag tgggaggtgg cgcgggagaa gatcaccatg 3000
agccgcgagc ttggccaggg ctccttcggg atggtctacg aaggcgtcgc caagggcgtg 3060
gtaaaggatg agccggaaac cagggtggcc atcaagacgg tgaacgaggc cgccagcatg 3120
cgggagagga tcgagtttct caacgaggcg tctgtgatga aggagttcaa ttgtcaccac 3180
gtggtgcggt tgctgggggt ggtgtcccag ggccagccca ccctggtcat catggagctg 3240
atgacgcgag gggacctcaa gagctatctc aggtccctgc gaccggaagt ggaggctgaa 3300
ttacagagag aaagacagag acagagacag aacttcatcc gccggttcgc tcctcggatg 3360
gccgcaacag ccagggctgg gccaggccga agccaacagc caggagcttc ttctgggtct 3420
cccacgaggg tgcaggggcc caaggacctg ggccatcttc cgctgccttc ccagaatcgg 3480
gccccagccc ctccgagtct gagtaagatg atccaaatgg ccggggagat tgcagatggc 3540
atggcatacc tcaacgccaa caagttcgtg cacagagacc ttgctgcccg gaactgcatg 3600
gtggccgagg atttcacagt caagatcgga gatttcggaa tgacgcggga catctacgag 3660
acggactact accggaaagg ggggaaaggc ttgctgcccg tgcgctggat gtcccccgag 3720
tccctcaaag atggagtctt caccacccac tctgacgtct ggtccttcgg agtcgtcctc 3780
tgggagatcg ccacgctggc agagcagccg taccagggat tctccaacga gcaggtcctg 3840
cgcttcgtca tggagggcgg ccttctggac aagccggaca actgccccga catgctgttt 3900
gagctgatgc gcatgtgttg gcaatacaac cccaagatgc ggccttcctt cctggagatc 3960
atcggcagtg tcagagacga gatggagccc ggcttccgcg aggtctcctt ctactacagc 4020
gaggagaaca agccgcccga ggccgaggag ctcgacctgg agcccgagaa catggagagc 4080
gtgcccctgg acccctccgc gaacgccgct gccgccgtcg ccgccctgca gcccgacagg 4140
cacaaggccg agaacggccc gagtgcaggg gcgatggtcc tgcgagccag ctttgacgag 4200
aggcgaccct acgcgcacat gaatgggggc cgcacagacg agcgggccct gccgctgccg 4260
cagtcttcga cctgctga 4278
<210> 77
<211> 1367
<212> PRT
<213> Cavia porcellus
<220>
<223> Cavia porcellus IGF-I receptor
<400> 77
Met Lys Ser Gly Ser Gly Gly Gly Ser Pro Thr Ser Leu Trp Gly Leu
1 5 10 15
Leu Phe Leu Ser Ala Ala Leu Ser Leu Trp Pro Thr Ser Gly Glu Ile
20 25 30
Cys Gly Pro Gly Ile Asp Ile Arg Asn Asp Tyr Gln Gln Leu Lys Arg
35 40 45
Leu Glu Asn Cys Thr Val Ile Glu Gly Tyr Leu His Ile Leu Leu Ile
50 55 60
Ser Lys Ala Glu Asp Tyr Arg Ser Tyr Arg Phe Pro Lys Leu Thr Val
65 70 75 80
Ile Thr Glu Tyr Leu Leu Leu Phe Arg Val Ala Gly Leu Glu Ser Leu
85 90 95
Gly Asp Leu Phe Pro Asn Leu Thr Val Ile Arg Gly Trp Lys Leu Phe
100 105 110
Tyr Asn Tyr Ala Leu Val Ile Phe Glu Met Thr Asn Leu Lys Asp Ile
115 120 125
Gly Leu Tyr Asn Leu Arg Asn Ile Thr Arg Gly Ala Ile Arg Ile Glu
130 135 140
Lys Asn Ala Asp Leu Cys Tyr Leu Ser Thr Val Asp Trp Ser Leu Ile
145 150 155 160
Leu Asp Ala Val Ser Asn Asn Tyr Ile Val Gly Asn Lys Ser Pro Lys
165 170 175
Glu Cys Gly Asp Leu Cys Pro Gly Thr Met Glu Glu Lys Pro Leu Cys
180 185 190
Glu Lys Thr Thr Ile Asn Asn Glu Tyr Asn Tyr Arg Cys Trp Thr Thr
195 200 205
Asn Arg Cys Gln Lys Met Cys Pro Ser Ala Cys Gly Lys Arg Ala Cys
210 215 220
Thr Glu Tyr Gln Glu Cys Cys His Pro Glu Cys Leu Gly Ser Cys His
225 230 235 240
Ala Pro Asp Asp Asp Thr Ala Cys Val Ala Cys Arg His Phe Tyr Tyr
245 250 255
Ala Gly Ile Cys Val Pro Ala Cys Pro Pro Gly Thr Tyr Arg Phe Glu
260 265 270
Gly Trp Arg Cys Val His Arg Asp Phe Cys Ala Asn Ile Pro Asn Ala
275 280 285
Glu Ser Ser Asp Ser Glu Gly Phe Val Ile His Asp Gly Glu Cys Met
290 295 300
Gln Glu Cys Pro Ser Gly Phe Ile Arg Asn Gly Ser Gln Ser Met Tyr
305 310 315 320
Cys Ile Pro Cys Glu Gly Pro Cys Pro Lys Val Cys Glu Glu Glu Lys
325 330 335
Lys Thr Lys Thr Ile Asp Ser Val Thr Ser Ala Gln Met Leu Gln Gly
340 345 350
Cys Thr Ile Phe Lys Gly Asn Leu Leu Ile Asn Ile Arg Arg Gly Asn
355 360 365
Asn Ile Ala Ser Glu Leu Glu Asn Phe Met Gly Leu Ile Glu Val Val
370 375 380
Thr Gly Tyr Val Lys Ile Arg His Ser His Ala Leu Val Ser Leu Ser
385 390 395 400
Phe Leu Lys Asn Leu Arg Leu Ile Leu Gly Glu Glu Gln Leu Glu Gly
405 410 415
Asn Tyr Ser Phe Tyr Val Leu Asp Asn Gln Asn Leu Gln Gln Leu Trp
420 425 430
Asp Trp Asp His Arg Asn Leu Thr Ile Lys Ser Gly Lys Met Tyr Phe
435 440 445
Ala Phe Asn Pro Lys Leu Cys Val Ser Glu Ile Tyr Arg Met Glu Glu
450 455 460
Val Thr Gly Thr Lys Gly Arg Gln Ser Lys Gly Asp Ile Asn Thr Arg
465 470 475 480
Asn Asn Gly Glu Arg Ala Ser Cys Glu Ser Asp Val Leu Arg Phe Thr
485 490 495
Ser Thr Thr Thr Ser Lys Asn Arg Ile Ile Ile Thr Trp His Arg Tyr
500 505 510
Arg Pro Pro Asp Tyr Arg Asp Leu Ile Ser Phe Thr Val Tyr Tyr Lys
515 520 525
Glu Ala Pro Phe Lys Asn Val Thr Glu Tyr Asp Gly Gln Asp Ala Cys
530 535 540
Gly Ser Asn Ser Trp Asn Met Val Asp Val Asp Leu Pro Pro Asn Lys
545 550 555 560
Asp Ala Glu Pro Gly Ile Leu Leu His Gly Leu Lys Pro Trp Thr Gln
565 570 575
Tyr Ala Val Tyr Val Lys Ala Val Thr Leu Thr Met Val Glu Asn Asp
580 585 590
His Ile Arg Gly Ala Lys Ser Glu Ile Leu Tyr Ile Arg Thr Asn Ala
595 600 605
Ser Val Pro Ser Ile Pro Leu Asp Val Leu Ser Ala Ser Asn Ser Ser
610 615 620
Ser Gln Leu Ile Val Lys Trp Asn Pro Pro Ser Leu Pro Asn Gly Asn
625 630 635 640
Leu Ser Tyr Tyr Ile Val Arg Trp Gln Arg Gln Pro Gln Asp Ser Tyr
645 650 655
Leu Tyr Arg His Asn Tyr Cys Ser Lys Asp Lys Ile Pro Ile Arg Lys
660 665 670
Tyr Ala Asp Gly Thr Ile Asp Val Glu Glu Val Thr Glu Asn Pro Lys
675 680 685
Thr Glu Val Cys Gly Gly Glu Lys Gly Pro Cys Cys Ala Cys Pro Lys
690 695 700
Thr Glu Ala Glu Lys Gln Ala Glu Lys Glu Glu Ala Glu Tyr Arg Lys
705 710 715 720
Val Phe Glu Asn Phe Leu His Asn Ser Ile Phe Val Pro Arg Pro Glu
725 730 735
Arg Arg Arg Arg Asp Val Ala Gln Met Ala Asn Thr Thr Met Ser Ser
740 745 750
Arg Ser Arg Asn Thr Thr Val Ala Asp Thr Tyr Asn Ala Thr Asp Pro
755 760 765
Glu Glu Leu Glu Thr Glu Tyr Pro Phe Phe Glu Ser Arg Val Asp Asn
770 775 780
Lys Glu Arg Thr Val Ile Ser Asn Leu Arg Pro Phe Thr Leu Tyr Arg
785 790 795 800
Ile Asp Ile His Ser Cys Asn His Glu Ala Glu Lys Leu Gly Cys Ser
805 810 815
Ala Ser Asn Phe Val Phe Ala Arg Thr Met Pro Ala Glu Gly Ala Asp
820 825 830
Asp Ile Pro Gly Pro Val Thr Trp Glu Ala Arg Pro Glu Asn Ser Ile
835 840 845
Phe Leu Lys Trp Pro Glu Pro Glu Asn Pro Asn Gly Leu Ile Leu Met
850 855 860
Tyr Glu Ile Lys Tyr Gly Ser Gln Val Glu Asp Gln Arg Glu Cys Val
865 870 875 880
Ser Arg Gln Glu Tyr Arg Lys Tyr Gly Gly Ala Lys Leu Ser Arg Leu
885 890 895
Asn Pro Gly Asn Tyr Thr Ala Arg Ile Gln Ala Thr Ser Leu Ser Gly
900 905 910
Asn Gly Ser Trp Thr Asp Pro Val Phe Phe Tyr Val Pro Ala Lys Thr
915 920 925
Thr Tyr Glu Asn Phe Ile His Leu Ile Ile Ala Leu Pro Val Ala Ile
930 935 940
Leu Leu Ile Val Ala Gly Leu Ala Ile Met Leu Tyr Val Phe His Arg
945 950 955 960
Lys Arg Asn Ser Ser Arg Leu Gly Asn Gly Val Leu Tyr Ala Ser Val
965 970 975
Asn Pro Glu Tyr Phe Ser Ala Ala Asp Val Tyr Val Pro Asp Glu Trp
980 985 990
Glu Val Ala Arg Glu Lys Ile Thr Met Ser Arg Glu Leu Gly Gln Gly
995 1000 1005
Ser Phe Gly Met Val Tyr Glu Gly Val Ala Lys Gly Val Val Lys
1010 1015 1020
Asp Glu Pro Glu Thr Arg Val Ala Ile Lys Thr Val Asn Glu Ala
1025 1030 1035
Ala Ser Met Arg Glu Arg Ile Glu Phe Leu Asn Glu Ala Ser Val
1040 1045 1050
Met Lys Glu Phe Asn Cys His His Val Val Arg Leu Leu Gly Val
1055 1060 1065
Val Ser Gln Gly Gln Pro Thr Leu Val Ile Met Glu Leu Met Thr
1070 1075 1080
Arg Gly Asp Leu Lys Ser Tyr Leu Arg Ser Leu Arg Pro Glu Val
1085 1090 1095
Glu Asn Ser Pro Ile Leu Ala Pro Pro Ser Leu Ser Lys Met Ile
1100 1105 1110
Gln Met Ala Gly Glu Ile Ala Asp Gly Met Ala Tyr Leu Asn Ala
1115 1120 1125
Asn Lys Phe Val His Arg Asp Leu Ala Ala Arg Asn Cys Met Val
1130 1135 1140
Ala Glu Asp Phe Thr Val Lys Ile Gly Asp Phe Gly Met Thr Arg
1145 1150 1155
Asp Ile Tyr Glu Thr Asp Tyr Tyr Arg Lys Gly Gly Lys Gly Leu
1160 1165 1170
Leu Pro Val Arg Trp Met Ser Pro Glu Ser Leu Lys Asp Gly Val
1175 1180 1185
Phe Thr Thr His Ser Asp Val Trp Ser Phe Gly Val Val Leu Trp
1190 1195 1200
Glu Ile Ala Thr Leu Ala Glu Gln Pro Tyr Gln Gly Leu Ser Asn
1205 1210 1215
Glu Gln Val Leu Arg Phe Val Met Glu Gly Gly Leu Leu Asp Lys
1220 1225 1230
Pro Asp Asn Cys Pro Asp Met Leu Phe Glu Leu Met Arg Met Cys
1235 1240 1245
Trp Gln Tyr Asn Pro Lys Met Arg Pro Ser Phe Leu Glu Ile Ile
1250 1255 1260
Ser Ser Val Lys Asp Glu Leu Glu Ala Gly Phe Arg Glu Val Ser
1265 1270 1275
Phe Tyr Tyr Ser Glu Glu Asn Lys Pro Pro Glu Pro Glu Glu Leu
1280 1285 1290
Asp Leu Glu Pro Glu Asn Met Glu Ser Val Pro Leu Asp Pro Ser
1295 1300 1305
Ala Ser Ser Ser Ser Leu Pro Pro Pro Asp Arg His Ser Gly His
1310 1315 1320
Lys Gly Glu Asn Gly Pro Gly Pro Gly Val Leu Val Leu Arg Ala
1325 1330 1335
Ser Phe Asp Glu Arg Gln Pro Tyr Ala His Met Asn Gly Gly Arg
1340 1345 1350
Thr Asn Glu Arg Ala Leu Pro Leu Pro Gln Ser Ser Thr Cys
1355 1360 1365
<210> 78
<211> 4104
<212> DNA
<213> Cavia porcellus
<220>
<223> Cavia porcellus IGF-I receptor
<400> 78
atgaagtctg gctccggagg agggtccccg acctcgctgt gggggctcct gtttctctct 60
gctgcgctct cgctctggcc gacgagtgga gaaatctgtg ggccgggcat cgacatccgc 120
aatgactatc agcagctaaa acgcctggag aactgcacgg tgatcgaggg ctacctccac 180
atcctgctca tctccaaggc cgaggactac cgcagctacc gcttccccaa gctcaccgtc 240
atcaccgagt acttgctgct gttccgggtc gctggcctcg agagcctcgg agacctcttc 300
ccgaacctca ccgtcatccg cggctggaaa ctcttctata actacgccct ggtcatcttc 360
gagatgacca acctgaagga tattgggctt tacaacctga ggaacattac tcggggggcc 420
atcaggattg agaagaatgc tgacctgtgc tacctctcca cagtggactg gtcgctgatc 480
ctggatgcgg tgtccaataa ctacattgtg gggaacaagt ccccaaagga atgtggagac 540
ctgtgtccag ggaccatgga ggagaaacca ttgtgcgaga agaccaccat caacaatgag 600
tacaactacc gctgctggac cacaaatcgc tgccagaaaa tgtgcccaag tgcctgcggg 660
aagcgtgcgt gcaccgagta ccaggagtgc tgccatcctg agtgcctggg cagctgccat 720
gcacccgacg acgacacggc ctgtgtggcc tgcagacact tctactatgc tggcatctgc 780
gtgcccgcct gtccacccgg cacctaccgc ttcgagggct ggcgctgtgt gcaccgagac 840
ttctgcgcca acatccccaa tgctgagagc agtgactccg agggcttcgt catccatgac 900
ggggagtgca tgcaggagtg tccctcgggc ttcatccgca acggcagcca gagcatgtac 960
tgcatccctt gtgaaggtcc ttgccccaag gtctgcgagg aagaaaagaa gacgaaaacc 1020
attgactctg tgacttctgc tcagatgctc caagggtgca ccatcttcaa gggcaacctg 1080
ctcattaata tccgacgggg caataacatt gcgtcggaac tggagaactt catggggctc 1140
attgaggtgg tgactggcta cgtgaagatc cgccattccc atgccttggt ctccttgtcc 1200
ttcctgaaaa accttcgcct gatcctgggg gaggagcagc tggaagggaa ctactccttc 1260
tacgtcctgg acaaccagaa cctgcagcag ctgtgggatt gggaccaccg caacctcacc 1320
atcaaatctg ggaagatgta ctttgctttc aatcccaaac tgtgtgtctc tgaaatttac 1380
cgcatggaag aagtgacggg gacgaaaggg cgccagagca aaggggacat aaacaccagg 1440
aacaacgggg aacgagcctc ctgtgaaagt gacgtattgc gtttcacctc caccaccaca 1500
tcgaagaacc gcattatcat cacctggcac cggtaccggc ccccagacta cagggatctc 1560
atcagcttca ctgtttacta caaggaggca ccgtttaaaa atgtcaccga gtatgatggg 1620
caggatgctt gtggctccaa cagttggaac atggtggacg tggacctgcc tcctaacaag 1680
gacgcggagc ctggcatcct actgcatggg ctgaagccct ggacacagta cgcggtctat 1740
gtcaaggccg tgaccctcac catggtagag aacgaccaca tccgtggggc caagagtgaa 1800
atcttgtaca ttcgcaccaa tgcttcagtt ccttccattc ccctggatgt cctttcggca 1860
tccaactcct cttctcagct catcgtcaag tggaaccccc catctctgcc caacggaaac 1920
ctgagttatt atatcgtgcg gtggcagcgg cagcctcagg acagctacct ataccggcac 1980
aattactgct ccaaagacaa aatccccatc agaaagtatg cggatggcac catcgatgtc 2040
gaagaggtca ccgagaaccc caagactgaa gtatgtggtg gcgagaaagg gccttgctgc 2100
gcttgcccca aaaccgaagc cgagaagcag gccgagaagg aggaggccga gtaccggaaa 2160
gtgtttgaga atttcctgca caactccatc ttcgtgccga ggcctgaaag gaggcggcga 2220
gatgttgcgc agatggccaa caccaccatg tccagccgca gcaggaacac cacggtggct 2280
gatacctaca atgccacaga tccagaggag ctagagaccg aatacccttt ctttgagagc 2340
agagtggata acaaggaaag aactgtaatt tcaaacctcc ggccttttac cttgtaccgc 2400
attgacatcc acagctgtaa ccatgaggct gagaagctgg gctgcagcgc ttctaacttt 2460
gtttttgcaa gaaccatgcc cgcagaagga gcagatgaca ttcctggccc ggtgacgtgg 2520
gaagcaaggc ctgaaaactc catcttttta aagtggccag agcctgagaa tcctaatgga 2580
ttgattctaa tgtacgaaat aaaatacgga tcacaagttg aggatcagcg agaatgtgtg 2640
tccagacagg aatacaggaa atacggaggg gccaagctta gccggctaaa cccagggaac 2700
tatacagccc ggattcaagc tacctcgctc tctgggaatg ggtcgtggac agatcctgtg 2760
tttttctatg tcccagccaa aacaacgtat gaaaacttca tccatctgat catcgctctg 2820
ccagtcgcca tcctgttgat tgtggcaggc ttggcgataa tgctgtacgt cttccatagg 2880
aagagaaaca gcagcaggct ggggaatgga gtgttgtacg cctctgtgaa cccggagtac 2940
ttcagtgctg cggatgtgta cgttcctgat gagtgggagg tagcgcgaga gaagatcacc 3000
atgagccggg agctggggca aggctccttt gggatggtct acgaaggagt ggctaaaggt 3060
gtggtgaaag acgagcctga gacccgggta gccatcaaga cagtgaacga ggccgcaagc 3120
atgcgtgaaa ggatcgagtt tctcaatgag gcctctgtga tgaaggagtt caactgtcat 3180
catgtggtgc gactgctagg cgtggtgtcc cagggccagc ccacactggt catcatggag 3240
ctgatgacgc ggggggatct caagagctat ctcaggtctt tgaggccgga agtagagaat 3300
agccccatcc tggcacctcc aagcctcagc aagatgatcc agatggccgg agagattgca 3360
gatggcatgg catacctcaa cgccaacaag tttgtccaca gagaccttgc tgcccgcaat 3420
tgcatggtag ctgaagattt cacagtcaaa attggagatt ttgggatgac gcgagatatt 3480
tacgagacag actactaccg gaaaggaggg aaagggctgc tgcctgtgcg ctggatgtct 3540
cctgagtccc tcaaggatgg agtcttcacc actcattcgg acgtctggtc cttcggggtc 3600
gtcctctggg agatcgccac gctggctgag cagccatacc agggcttgtc caacgagcaa 3660
gtccttcgct tcgtcatgga gggtggcctc ctggacaaac ccgacaactg cccagacatg 3720
ctgtttgagc tgatgcgcat gtgctggcag tacaacccca agatgaggcc ttccttcctg 3780
gagatcatca gcagcgtcaa agacgagctg gaggccggct tccgggaggt ctccttctac 3840
tacagcgagg agaacaagcc gcccgagccg gaggagctgg acctggagcc cgagaacatg 3900
gagagcgtcc cgctggaccc atcagcctcc tcgtcctccc tgccgccgcc cgacagacac 3960
tcaggacaca agggcgagaa cggcccgggc cccggcgtgc tggtgctccg cgccagcttc 4020
gacgagagac agccttacgc gcacatgaac ggaggccgca cgaacgagag ggccttgccg 4080
ctgccccagt cgtcaacctg ctga 4104
<210> 79
<211> 1371
<212> PRT
<213> Rattus norvegicus
<220>
<223> Rattus norvegicus IGF-I receptor
<400> 79
Met Lys Ser Gly Ser Gly Gly Gly Ser Pro Thr Ser Leu Trp Gly Leu
1 5 10 15
Val Phe Leu Ser Ala Ala Leu Ser Leu Trp Pro Thr Ser Gly Glu Ile
20 25 30
Cys Gly Pro Gly Ile Asp Ile Arg Asn Asp Tyr Gln Gln Leu Lys Arg
35 40 45
Leu Glu Asn Cys Thr Val Ile Glu Gly Phe Leu His Ile Leu Leu Ile
50 55 60
Ser Lys Ala Glu Asp Tyr Arg Ser Tyr Arg Phe Pro Lys Leu Thr Val
65 70 75 80
Ile Thr Glu Tyr Leu Leu Leu Phe Arg Val Ala Gly Leu Glu Ser Leu
85 90 95
Gly Asp Leu Phe Pro Asn Leu Thr Val Ile Arg Gly Trp Lys Leu Phe
100 105 110
Tyr Asn Tyr Ala Leu Val Ile Phe Glu Met Thr Asn Leu Lys Asp Ile
115 120 125
Gly Leu Tyr Asn Leu Arg Asn Ile Thr Arg Gly Ala Ile Arg Ile Glu
130 135 140
Lys Asn Ala Asp Leu Cys Tyr Leu Ser Thr Ile Asp Trp Ser Leu Ile
145 150 155 160
Leu Asp Ala Val Ser Asn Asn Tyr Ile Val Gly Asn Lys Pro Pro Lys
165 170 175
Glu Cys Gly Asp Leu Cys Pro Gly Thr Leu Glu Glu Lys Pro Met Cys
180 185 190
Glu Lys Thr Thr Ile Asn Asn Glu Tyr Asn Tyr Arg Cys Trp Thr Thr
195 200 205
Asn Arg Cys Gln Lys Met Cys Pro Ser Val Cys Gly Lys Arg Ala Cys
210 215 220
Thr Glu Asn Asn Glu Cys Cys His Pro Glu Cys Leu Gly Ser Cys His
225 230 235 240
Thr Pro Asp Asp Asn Thr Thr Cys Val Ala Cys Arg His Tyr Tyr Tyr
245 250 255
Lys Gly Val Cys Val Pro Ala Cys Pro Pro Gly Thr Tyr Arg Phe Glu
260 265 270
Gly Trp Arg Cys Val Asp Arg Asp Phe Cys Ala Asn Ile Pro Asn Ala
275 280 285
Glu Ser Ser Asp Ser Asp Gly Phe Val Ile His Asp Gly Glu Cys Met
290 295 300
Gln Glu Cys Pro Ser Gly Phe Ile Arg Asn Ser Thr Gln Ser Met Tyr
305 310 315 320
Cys Ile Pro Cys Glu Gly Pro Cys Pro Lys Val Cys Gly Asp Glu Glu
325 330 335
Lys Lys Thr Lys Thr Ile Asp Ser Val Thr Ser Ala Gln Met Leu Gln
340 345 350
Gly Cys Thr Ile Leu Lys Gly Asn Leu Leu Ile Asn Ile Arg Arg Gly
355 360 365
Asn Asn Ile Ala Ser Glu Leu Glu Asn Phe Met Gly Leu Ile Glu Val
370 375 380
Val Thr Gly Tyr Val Lys Ile Arg His Ser His Ala Leu Val Ser Leu
385 390 395 400
Ser Phe Leu Lys Asn Leu Arg Leu Ile Leu Gly Glu Glu Gln Leu Glu
405 410 415
Gly Asn Tyr Ser Phe Tyr Val Leu Asp Asn Gln Asn Leu Gln Gln Leu
420 425 430
Trp Asp Trp Asn His Arg Asn Leu Thr Val Arg Ser Gly Lys Met Tyr
435 440 445
Phe Ala Phe Asn Pro Lys Leu Cys Val Ser Glu Ile Tyr Arg Met Glu
450 455 460
Glu Val Thr Gly Thr Lys Gly Arg Gln Ser Lys Gly Asp Ile Asn Thr
465 470 475 480
Arg Asn Asn Gly Glu Arg Ala Ser Cys Glu Ser Asp Val Leu Arg Phe
485 490 495
Thr Ser Thr Thr Thr Trp Lys Asn Arg Ile Ile Ile Thr Trp His Arg
500 505 510
Tyr Arg Pro Pro Asp Tyr Arg Asp Leu Ile Ser Phe Thr Val Tyr Tyr
515 520 525
Lys Glu Ala Pro Phe Lys Asn Val Thr Glu Tyr Asp Gly Gln Asp Ala
530 535 540
Cys Gly Ser Asn Ser Trp Asn Met Val Asp Val Asp Leu Pro Pro Asn
545 550 555 560
Lys Glu Gly Glu Pro Gly Ile Leu Leu His Gly Leu Lys Pro Trp Thr
565 570 575
Gln Tyr Ala Val Tyr Val Lys Ala Val Thr Leu Thr Met Val Glu Asn
580 585 590
Asp His Ile Arg Gly Ala Lys Ser Glu Ile Leu Tyr Ile Arg Thr Asn
595 600 605
Ala Ser Val Pro Ser Ile Pro Leu Asp Val Leu Ser Ala Ser Asn Ser
610 615 620
Ser Ser Gln Leu Ile Val Lys Trp Asn Pro Pro Thr Leu Pro Asn Gly
625 630 635 640
Asn Leu Ser Tyr Tyr Ile Val Arg Trp Gln Arg Gln Pro Gln Asp Gly
645 650 655
Tyr Leu Phe Arg His Asn Tyr Cys Ser Lys Asp Lys Ile Pro Ile Arg
660 665 670
Lys Tyr Ala Asp Gly Thr Ile Asp Val Glu Glu Val Thr Glu Asn Pro
675 680 685
Lys Thr Glu Val Cys Gly Gly Asp Lys Gly Pro Cys Cys Ala Cys Pro
690 695 700
Lys Thr Glu Ala Glu Lys Gln Ala Glu Lys Glu Glu Ala Glu Tyr Arg
705 710 715 720
Lys Val Phe Glu Asn Phe Leu His Asn Ser Ile Phe Val Pro Arg Pro
725 730 735
Glu Arg Arg Arg Arg Asp Val Leu Gln Val Ala Asn Thr Thr Met Ser
740 745 750
Ser Arg Ser Arg Asn Thr Thr Val Ala Asp Thr Tyr Asn Ile Thr Asp
755 760 765
Pro Glu Glu Phe Glu Thr Glu Tyr Pro Phe Phe Glu Ser Arg Val Asp
770 775 780
Asn Lys Glu Arg Thr Val Ile Ser Asn Leu Arg Pro Phe Thr Leu Tyr
785 790 795 800
Arg Ile Asp Ile His Ser Cys Asn His Glu Ala Glu Lys Leu Gly Cys
805 810 815
Ser Ala Ser Asn Phe Val Phe Ala Arg Thr Met Pro Ala Glu Gly Ala
820 825 830
Asp Asp Ile Pro Gly Pro Val Thr Trp Glu Pro Arg Pro Glu Asn Ser
835 840 845
Ile Phe Leu Lys Trp Pro Glu Pro Glu Asn Pro Asn Gly Leu Ile Leu
850 855 860
Met Tyr Glu Ile Lys Tyr Gly Ser Gln Val Glu Asp Gln Arg Glu Cys
865 870 875 880
Val Ser Arg Gln Glu Tyr Arg Lys Tyr Gly Gly Ala Lys Leu Asn Arg
885 890 895
Leu Asn Pro Gly Asn Tyr Thr Ala Arg Ile Gln Ala Thr Ser Leu Ser
900 905 910
Gly Asn Gly Ser Trp Thr Asp Pro Val Phe Phe Tyr Val Pro Ala Lys
915 920 925
Thr Thr Tyr Glu Asn Phe Met His Leu Ile Ile Ala Leu Pro Val Ala
930 935 940
Ile Leu Leu Ile Val Gly Gly Leu Val Ile Met Leu Tyr Val Phe His
945 950 955 960
Arg Lys Arg Asn Asn Ser Arg Leu Gly Asn Gly Val Leu Tyr Ala Ser
965 970 975
Val Asn Pro Glu Tyr Phe Ser Ala Ala Asp Val Tyr Val Pro Asp Glu
980 985 990
Trp Glu Val Ala Arg Glu Lys Ile Thr Met Asn Arg Glu Leu Gly Gln
995 1000 1005
Gly Ser Phe Gly Met Val Tyr Glu Gly Val Ala Lys Gly Val Val
1010 1015 1020
Lys Asp Glu Pro Glu Thr Arg Val Ala Ile Lys Thr Val Asn Glu
1025 1030 1035
Ala Ala Ser Met Arg Glu Arg Ile Glu Phe Leu Asn Glu Ala Ser
1040 1045 1050
Val Met Lys Glu Phe Asn Cys His His Val Val Arg Leu Leu Gly
1055 1060 1065
Val Val Ser Gln Gly Gln Pro Thr Leu Val Ile Met Glu Leu Met
1070 1075 1080
Thr Arg Gly Asp Leu Lys Ser Tyr Leu Arg Ser Leu Arg Pro Glu
1085 1090 1095
Val Glu Gln Asn Asn Leu Val Leu Ile Pro Pro Ser Leu Ser Lys
1100 1105 1110
Met Ile Gln Met Ala Gly Glu Ile Ala Asp Gly Met Ala Tyr Leu
1115 1120 1125
Asn Ala Asn Lys Phe Val His Arg Asp Leu Ala Ala Arg Asn Cys
1130 1135 1140
Met Val Ala Glu Asp Phe Thr Val Lys Ile Gly Asp Phe Gly Met
1145 1150 1155
Thr Arg Asp Ile Tyr Glu Thr Asp Tyr Tyr Arg Lys Gly Gly Lys
1160 1165 1170
Gly Leu Leu Pro Val Arg Trp Met Ser Pro Glu Ser Leu Lys Asp
1175 1180 1185
Gly Val Phe Thr Thr His Ser Asp Val Trp Ser Phe Gly Val Val
1190 1195 1200
Leu Trp Glu Ile Ala Thr Leu Ala Glu Gln Pro Tyr Gln Gly Leu
1205 1210 1215
Ser Asn Glu Gln Val Leu Arg Phe Val Met Glu Gly Gly Leu Leu
1220 1225 1230
Asp Lys Pro Asp Asn Cys Pro Asp Met Leu Phe Glu Leu Met Arg
1235 1240 1245
Met Cys Trp Gln Tyr Asn Pro Lys Met Arg Pro Ser Phe Leu Glu
1250 1255 1260
Ile Ile Gly Ser Ile Lys Asp Glu Met Glu Pro Ser Phe Gln Glu
1265 1270 1275
Val Ser Phe Tyr Tyr Ser Glu Glu Asn Lys Pro Pro Glu Pro Glu
1280 1285 1290
Glu Leu Glu Met Glu Leu Glu Leu Glu Pro Glu Asn Met Glu Ser
1295 1300 1305
Val Pro Leu Asp Pro Ser Ala Ser Ser Ala Ser Leu Pro Leu Pro
1310 1315 1320
Glu Arg His Ser Gly His Lys Ala Glu Asn Gly Pro Gly Val Leu
1325 1330 1335
Val Leu Arg Ala Ser Phe Asp Glu Arg Gln Pro Tyr Ala His Met
1340 1345 1350
Asn Gly Gly Arg Ala Asn Glu Arg Ala Leu Pro Leu Pro Gln Ser
1355 1360 1365
Ser Thr Cys
1370
<210> 80
<211> 4116
<212> DNA
<213> Rattus norvegicus
<220>
<223> Rattus norvegicus IGF-I receptor
<400> 80
atgaagtctg gctccggagg agggtccccg acctcgctgt gggggctcgt gtttctctcc 60
gccgcgctct cgctctggcc gacgagtgga gaaatttgtg ggcccggcat tgacatccgc 120
aacgactatc agcagctgaa gcgcctggaa aactgcacgg tgatcgaggg cttcctccac 180
atcctgctca tctccaaggc cgaggactac cgaagctacc gcttccccaa gctcacagtc 240
atcaccgagt acttgctgct gtttcgagtg gccggcctcg agagcctggg agacctcttc 300
ccgaacctca cagtcatccg tggctggaaa ctcttctaca attacgcact ggtcatcttc 360
gagatgacca atctcaagga tattgggctt tataatctga ggaacattac tcggggggcc 420
atcaggattg agaaaaacgc tgacctctgt tacctctcca ccatagactg gtctctcatc 480
ttggatgcgg tgtccaataa ctacattgtg gggaacaagc ccccaaagga atgtggggac 540
ctgtgtccag ggaccttgga ggagaagccc atgtgtgaga agaccaccat caacaatgag 600
tacaactacc gctgctggac cacaaatcgc tgccagaaaa tgtgcccaag tgtgtgtggg 660
aagcgagcct gcaccgagaa caatgagtgc tgccacccgg agtgcctagg cagctgccac 720
acaccggacg acaacacaac ctgcgtggcc tgccgacact actactacaa aggcgtgtgc 780
gtgcctgcct gcccgcctgg cacctacagg ttcgagggct ggcgctgtgt ggaccgggat 840
ttctgcgcca acatccccaa cgccgagagc agtgactcag atggcttcgt catccacgat 900
ggcgagtgca tgcaggagtg tccatcaggc ttcatccgca acagcaccca gagcatgtac 960
tgtatcccct gtgaaggccc ctgccccaag gtctgcggcg atgaagaaaa gaaaacgaaa 1020
accatcgatt ctgtgacgtc tgcccagatg ctccaagggt gcaccatttt gaagggcaat 1080
ctgcttatta acatccggcg aggcaataac attgcctcgg aattggagaa cttcatgggg 1140
ctcatcgagg tggtgactgg ctacgtgaag atccgccatt cccatgcctt ggtctccttg 1200
tccttcctga agaaccttcg tctcatctta ggagaggagc agctagaagg aaactactcc 1260
ttctatgtcc tggacaacca gaacttgcag cagctgtggg actggaacca ccggaacctg 1320
accgtcaggt cagggaaaat gtacttcgct ttcaatccca agctgtgtgt ctctgaaatt 1380
taccgaatgg aggaggtgac aggaacaaag ggacggcaga gcaaaggaga cataaacacc 1440
aggaacaacg gagagcgagc ttcctgtgaa agtgatgttc tccgtttcac ctccaccacc 1500
acctggaaga accgcatcat cataacgtgg caccggtacc ggccgccgga ctaccgggat 1560
ctcatcagtt tcacagtcta ctacaaggag gcacccttta aaaacgtcac ggaatacgac 1620
gggcaggatg cctgtggctc caacagctgg aacatggtgg acgtggacct gcctccgaac 1680
aaggaggggg agcctggcat tttgctgcat gggctgaagc cctggaccca gtatgcagtc 1740
tatgtcaagg ctgtgaccct caccatggtg gaaaacgacc acatccgtgg ggccaaaagt 1800
gaaatcttgt acattcgcac caacgcttca gttccttcca ttcctctaga tgtcctctcg 1860
gcatcaaact cctcctctca gctgatcgtg aagtggaacc ccccaactct gcccaatggt 1920
aacttgagtt actacattgt gaggtggcag cggcagccgc aggatggcta tctgttccgg 1980
cacaactact gctccaaaga caaaataccc atcagaaagt acgccgatgg taccatcgat 2040
gtggaggagg tgacagaaaa tcccaagaca gaagtgtgcg gtggtgataa agggccgtgc 2100
tgtgcctgtc ctaaaaccga agctgagaag caggctgaga aggaggaggc tgagtaccgt 2160
aaagtctttg agaatttcct tcacaactcc atctttgtgc ccagacctga gaggaggcgg 2220
agagatgtcc tgcaggtggc taacaccacc atgtccagcc gaagcaggaa caccacggta 2280
gctgacacct acaatatcac agacccggaa gagttcgaga cagaataccc tttctttgag 2340
agcagagtgg ataacaagga gaggactgtc atttccaacc tccggccttt cactctgtac 2400
cgtatcgata tccacagctg caaccacgag gctgagaagc tgggctgcag cgcctccaac 2460
tttgtctttg caagaaccat gccagcagaa ggagcagatg acattcctgg cccagtgacc 2520
tgggagccaa gacctgaaaa ctccatcttt ttaaagtggc cagaacccga gaaccccaac 2580
ggattgattc taatgtatga aataaaatac ggatcgcaag tcgaggatca gcgggaatgt 2640
gtgtccagac aggagtacag gaagtatgga ggggccaaac ttaaccgtct aaacccaggg 2700
aactatacgg cccggattca ggctacctcc ctctctggga atgggtcgtg gacagatcct 2760
gtgttcttct atgtcccagc caaaacaacg tatgagaatt tcatgcatct gatcattgct 2820
ctgccggttg ccatcctgct gattgtgggg ggcctggtaa tcatgctgta tgtcttccat 2880
agaaagagga ataacagcag attgggcaac ggggtgctgt acgcctctgt gaaccccgag 2940
tatttcagcg cagctgatgt gtacgtgcct gatgaatggg aggtagctcg ggagaagatc 3000
accatgaacc gggagctcgg acaagggtcc ttcgggatgg tctatgaagg agtggccaag 3060
ggcgtggtca aggacgagcc tgaaaccaga gtggccatca agacagtgaa tgaggctgca 3120
agtatgcgtg agagaattga gtttctcaac gaggcctcag tgatgaagga gttcaactgt 3180
caccatgtgg tccggttgct gggtgtagta tcccaaggcc agcccaccct ggtcatcatg 3240
gaactaatga cacgtggcga tctcaaaagt tatctccggt ctctaaggcc agaggtggag 3300
cagaataatc tagtcctgat tcctccgagc ttaagcaaga tgatccagat ggctggagag 3360
attgcagatg gcatggccta cctcaatgcc aacaagttcg tccacagaga cctggctgct 3420
cggaactgca tggtagctga agatttcaca gtcaaaattg gagattttgg tatgacacga 3480
gacatctacg agacggacta ctaccggaaa ggcgggaagg gcttgctgcc tgtgcgctgg 3540
atgtctcccg agtccctcaa ggatggcgtc ttcaccactc attccgatgt ctggtccttt 3600
ggggtcgtcc tctgggagat cgccactctg gctgagcagc cgtaccaggg cctgtccaac 3660
gagcaagttc ttcgtttcgt catggagggc ggccttctgg acaagccgga taactgcccc 3720
gatatgctgt ttgaacttat gcgcatgtgc tggcagtaca accccaagat gcggccctcc 3780
ttcctggaga tcatcggaag catcaaggat gagatggagc ccagtttcca ggaggtctcc 3840
ttctactaca gcgaggagaa caagcctcca gagccggagg agctggagat ggagctggag 3900
ctggagcccg agaacatgga gagcgtcccg ctggaccctt cggcctcctc agcctccctg 3960
cctctgcctg aaagacactc aggacacaag gctgagaacg gccctggcgt gctggttctc 4020
cgtgccagtt ttgatgagag acagccttac gctcacatga atgggggacg cgccaacgag 4080
agggccttgc ctctgcccca gtcctcaacc tgctga 4116
<210> 81
<211> 1373
<212> PRT
<213> Mus musculus
<220>
<223> Mus musculus IGF-I receptor
<400> 81
Met Lys Ser Gly Ser Gly Gly Gly Ser Pro Thr Ser Leu Trp Gly Leu
1 5 10 15
Val Phe Leu Ser Ala Ala Leu Ser Leu Trp Pro Thr Ser Gly Glu Ile
20 25 30
Cys Gly Pro Gly Ile Asp Ile Arg Asn Asp Tyr Gln Gln Leu Lys Arg
35 40 45
Leu Glu Asn Cys Thr Val Ile Glu Gly Phe Leu His Ile Leu Leu Ile
50 55 60
Ser Lys Ala Glu Asp Tyr Arg Ser Tyr Arg Phe Pro Lys Leu Thr Val
65 70 75 80
Ile Thr Glu Tyr Leu Leu Leu Phe Arg Val Ala Gly Leu Glu Ser Leu
85 90 95
Gly Asp Leu Phe Pro Asn Leu Thr Val Ile Arg Gly Trp Lys Leu Phe
100 105 110
Tyr Asn Tyr Ala Leu Val Ile Phe Glu Met Thr Asn Leu Lys Asp Ile
115 120 125
Gly Leu Tyr Asn Leu Arg Asn Ile Thr Arg Gly Ala Ile Arg Ile Glu
130 135 140
Lys Asn Ala Asp Leu Cys Tyr Leu Ser Thr Ile Asp Trp Ser Leu Ile
145 150 155 160
Leu Asp Ala Val Ser Asn Asn Tyr Ile Val Gly Asn Lys Pro Pro Lys
165 170 175
Glu Cys Gly Asp Leu Cys Pro Gly Thr Leu Glu Glu Lys Pro Met Cys
180 185 190
Glu Lys Thr Thr Ile Asn Asn Glu Tyr Asn Tyr Arg Cys Trp Thr Thr
195 200 205
Asn Arg Cys Gln Lys Met Cys Pro Ser Val Cys Gly Lys Arg Ala Cys
210 215 220
Thr Glu Asn Asn Glu Cys Cys His Pro Glu Cys Leu Gly Ser Cys His
225 230 235 240
Thr Pro Asp Asp Asn Thr Thr Cys Val Ala Cys Arg His Tyr Tyr Tyr
245 250 255
Lys Gly Val Cys Val Pro Ala Cys Pro Pro Gly Thr Tyr Arg Phe Glu
260 265 270
Gly Trp Arg Cys Val Asp Arg Asp Phe Cys Ala Asn Ile Pro Asn Ala
275 280 285
Glu Ser Ser Asp Ser Asp Gly Phe Val Ile His Asp Asp Glu Cys Met
290 295 300
Gln Glu Cys Pro Ser Gly Phe Ile Arg Asn Ser Thr Gln Ser Met Tyr
305 310 315 320
Cys Ile Pro Cys Glu Gly Pro Cys Pro Lys Val Cys Gly Asp Glu Glu
325 330 335
Lys Lys Thr Lys Thr Ile Asp Ser Val Thr Ser Ala Gln Met Leu Gln
340 345 350
Gly Cys Thr Ile Leu Lys Gly Asn Leu Leu Ile Asn Ile Arg Arg Gly
355 360 365
Asn Asn Ile Ala Ser Glu Leu Glu Asn Phe Met Gly Leu Ile Glu Val
370 375 380
Val Thr Gly Tyr Val Lys Ile Arg His Ser His Ala Leu Val Ser Leu
385 390 395 400
Ser Phe Leu Lys Asn Leu Arg Leu Ile Leu Gly Glu Glu Gln Leu Glu
405 410 415
Gly Asn Tyr Ser Phe Tyr Val Leu Asp Asn Gln Asn Leu Gln Gln Leu
420 425 430
Trp Asp Trp Asn His Arg Asn Leu Thr Val Arg Ser Gly Lys Met Tyr
435 440 445
Phe Ala Phe Asn Pro Lys Leu Cys Val Ser Glu Ile Tyr Arg Met Glu
450 455 460
Glu Val Thr Gly Thr Lys Gly Arg Gln Ser Lys Gly Asp Ile Asn Thr
465 470 475 480
Arg Asn Asn Gly Glu Arg Ala Ser Cys Glu Ser Asp Val Leu Arg Phe
485 490 495
Thr Ser Thr Thr Thr Trp Lys Asn Arg Ile Ile Ile Thr Trp His Arg
500 505 510
Tyr Arg Pro Pro Asp Tyr Arg Asp Leu Ile Ser Phe Thr Val Tyr Tyr
515 520 525
Lys Glu Ala Pro Phe Lys Asn Val Thr Glu Tyr Asp Gly Gln Asp Ala
530 535 540
Cys Gly Ser Asn Ser Trp Asn Met Val Asp Val Asp Leu Pro Pro Asn
545 550 555 560
Lys Glu Gly Glu Pro Gly Ile Leu Leu His Gly Leu Lys Pro Trp Thr
565 570 575
Gln Tyr Ala Val Tyr Val Lys Ala Val Thr Leu Thr Met Val Glu Asn
580 585 590
Asp His Ile Arg Gly Ala Lys Ser Glu Ile Leu Tyr Ile Arg Thr Asn
595 600 605
Ala Ser Val Pro Ser Ile Pro Leu Asp Val Leu Ser Ala Ser Asn Ser
610 615 620
Ser Ser Gln Leu Ile Val Lys Trp Asn Pro Pro Thr Leu Pro Asn Gly
625 630 635 640
Asn Leu Ser Tyr Tyr Ile Val Arg Trp Gln Arg Gln Pro Gln Asp Gly
645 650 655
Tyr Leu Tyr Arg His Asn Tyr Cys Ser Lys Asp Lys Ile Pro Ile Arg
660 665 670
Lys Tyr Ala Asp Gly Thr Ile Asp Val Glu Glu Val Thr Glu Asn Pro
675 680 685
Lys Thr Glu Val Cys Gly Gly Asp Lys Gly Pro Cys Cys Ala Cys Pro
690 695 700
Lys Thr Glu Ala Glu Lys Gln Ala Glu Lys Glu Glu Ala Glu Tyr Arg
705 710 715 720
Lys Val Phe Glu Asn Phe Leu His Asn Ser Ile Phe Val Pro Arg Pro
725 730 735
Glu Arg Arg Arg Arg Asp Val Met Gln Val Ala Asn Thr Thr Met Ser
740 745 750
Ser Arg Ser Arg Asn Thr Thr Val Ala Asp Thr Tyr Asn Ile Thr Asp
755 760 765
Pro Glu Glu Phe Glu Thr Glu Tyr Pro Phe Phe Glu Ser Arg Val Asp
770 775 780
Asn Lys Glu Arg Thr Val Ile Ser Asn Leu Arg Pro Phe Thr Leu Tyr
785 790 795 800
Arg Ile Asp Ile His Ser Cys Asn His Glu Ala Glu Lys Leu Gly Cys
805 810 815
Ser Ala Ser Asn Phe Val Phe Ala Arg Thr Met Pro Ala Glu Gly Ala
820 825 830
Asp Asp Ile Pro Gly Pro Val Thr Trp Glu Pro Arg Pro Glu Asn Ser
835 840 845
Ile Phe Leu Lys Trp Pro Glu Pro Glu Asn Pro Asn Gly Leu Ile Leu
850 855 860
Met Tyr Glu Ile Lys Tyr Gly Ser Gln Val Glu Asp Gln Arg Glu Cys
865 870 875 880
Val Ser Arg Gln Glu Tyr Arg Lys Tyr Gly Gly Ala Lys Leu Asn Arg
885 890 895
Leu Asn Pro Gly Asn Tyr Thr Ala Arg Ile Gln Ala Thr Ser Leu Ser
900 905 910
Gly Asn Gly Ser Trp Thr Asp Pro Val Phe Phe Tyr Val Pro Ala Lys
915 920 925
Thr Thr Tyr Glu Asn Phe Met His Leu Ile Ile Ala Leu Pro Val Ala
930 935 940
Ile Leu Leu Ile Val Gly Gly Leu Val Ile Met Leu Tyr Val Phe His
945 950 955 960
Arg Lys Arg Asn Asn Ser Arg Leu Gly Asn Gly Val Leu Tyr Ala Ser
965 970 975
Val Asn Pro Glu Tyr Phe Ser Ala Ala Asp Val Tyr Val Pro Asp Glu
980 985 990
Trp Glu Val Ala Arg Glu Lys Ile Thr Met Asn Arg Glu Leu Gly Gln
995 1000 1005
Gly Ser Phe Gly Met Val Tyr Glu Gly Val Ala Lys Gly Val Val
1010 1015 1020
Lys Asp Glu Pro Glu Thr Arg Val Ala Ile Lys Thr Val Asn Glu
1025 1030 1035
Ala Ala Ser Met Arg Glu Arg Ile Glu Phe Leu Asn Glu Ala Ser
1040 1045 1050
Val Met Lys Glu Phe Asn Cys His His Val Val Arg Leu Leu Gly
1055 1060 1065
Val Val Ser Gln Gly Gln Pro Thr Leu Val Ile Met Glu Leu Met
1070 1075 1080
Thr Arg Gly Asp Leu Lys Ser Tyr Leu Arg Ser Leu Arg Pro Glu
1085 1090 1095
Val Glu Gln Asn Asn Leu Val Leu Ile Pro Pro Ser Leu Ser Lys
1100 1105 1110
Met Ile Gln Met Ala Gly Glu Ile Ala Asp Gly Met Ala Tyr Leu
1115 1120 1125
Asn Ala Asn Lys Phe Val His Arg Asp Leu Ala Ala Arg Asn Cys
1130 1135 1140
Met Val Ala Glu Asp Phe Thr Val Lys Ile Gly Asp Phe Gly Met
1145 1150 1155
Thr Arg Asp Ile Tyr Glu Thr Asp Tyr Tyr Arg Lys Gly Gly Lys
1160 1165 1170
Gly Leu Leu Pro Val Arg Trp Met Ser Pro Glu Ser Leu Lys Asp
1175 1180 1185
Gly Val Phe Thr Thr His Ser Asp Val Trp Ser Phe Gly Val Val
1190 1195 1200
Leu Trp Glu Ile Ala Thr Leu Ala Glu Gln Pro Tyr Gln Gly Leu
1205 1210 1215
Ser Asn Glu Gln Val Leu Arg Phe Val Met Glu Gly Gly Leu Leu
1220 1225 1230
Asp Lys Pro Asp Asn Cys Pro Asp Met Leu Phe Glu Leu Met Arg
1235 1240 1245
Met Cys Trp Gln Tyr Asn Pro Lys Met Arg Pro Ser Phe Leu Glu
1250 1255 1260
Ile Ile Gly Ser Ile Lys Asp Glu Met Glu Pro Ser Phe Gln Glu
1265 1270 1275
Val Ser Phe Tyr Tyr Ser Glu Glu Asn Lys Pro Pro Glu Pro Glu
1280 1285 1290
Glu Leu Glu Met Glu Leu Glu Met Glu Pro Glu Asn Met Glu Ser
1295 1300 1305
Val Pro Leu Asp Pro Ser Ala Ser Ser Ala Ser Leu Pro Leu Pro
1310 1315 1320
Glu Arg His Ser Gly His Lys Ala Glu Asn Gly Pro Gly Pro Gly
1325 1330 1335
Val Leu Val Leu Arg Ala Ser Phe Asp Glu Arg Gln Pro Tyr Ala
1340 1345 1350
His Met Asn Gly Gly Arg Ala Asn Glu Arg Ala Leu Pro Leu Pro
1355 1360 1365
Gln Ser Ser Thr Cys
1370
<210> 82
<211> 4119
<212> DNA
<213> Mus musculus
<220>
<223> Mus musculus IGF-I receptor
<400> 82
atgaagtctg gctccggagg agggtccccg acctcgctgt gggggctcgt gtttctctcc 60
gccgcgctct ctctctggcc gacgagtgga gaaatctgtg ggcccggcat tgacatccgc 120
aacgactatc agcagctgaa gcgcctggaa aactgcacgg tgatcgaggg cttcctccac 180
atcctgctca tctccaaggc cgaggactac cgaagctacc gcttccccaa gctcaccgtc 240
atcactgagt acttgctgct cttccgagtc gctggcctcg agagcctggg agacctcttc 300
cccaacctca cagtcatccg tggctggaaa ctcttctaca actacgcact ggtcatcttc 360
gagatgacca atctcaagga tattgggctt tataatctga ggaacattac tcggggggcc 420
atcaggattg agaagaacgc cgacctctgt tacctctcca ccatagactg gtctctcatc 480
ttggatgcgg tgtccaataa ctacattgtg gggaacaagc ccccgaagga atgtggggac 540
ctgtgtccag ggacattgga ggagaagccc atgtgtgaga agaccaccat caacaatgag 600
tacaactacc gctgctggac cacaaatcgc tgccagaaaa tgtgcccaag tgtgtgcggg 660
aagcgagcct gcaccgagaa caacgagtgc tgccacccgg agtgcctggg cagctgccac 720
acaccggacg acaacacaac ctgcgtggcc tgcagacact actactacaa aggcgtgtgt 780
gtgcctgcct gcccgcctgg cacctacagg ttcgagggct ggcgctgtgt ggatcgcgat 840
ttctgcgcca acatccccaa cgctgagagc agtgactcgg atggcttcgt tatccacgac 900
gatgagtgca tgcaggagtg tccctcaggc ttcatccgca acagcaccca gagcatgtac 960
tgtatcccct gcgaaggccc ctgccccaaa gtctgcggcg atgaagagaa gaaaacgaaa 1020
accatcgatt cggtgacttc tgctcaaatg ctccaaggat gcaccatcct gaagggcaat 1080
ctgcttatta acatccggag aggcaataac attgcctcgg agttggagaa cttcatgggg 1140
ctcatcgagg tggtgaccgg ctacgtgaag atccgccatt ctcatgcctt ggtctccttg 1200
tccttcctga agaaccttcg tctcatctta ggagaggagc agctggaagg gaactactcc 1260
ttctatgtcc tagacaacca gaacttgcag cagctgtggg actggaacca ccggaacctg 1320
accgtcaggt ccggaaagat gtactttgct ttcaatccca agctgtgtgt ctccgaaatt 1380
taccgcatgg aggaagtgac cggaaccaag ggacgccaga gcaaagggga cataaacacc 1440
aggaacaacg gagagcgagc ttcctgtgaa agtgatgttc tccgtttcac ctccaccacg 1500
acctggaaga accgaatcat cataacgtgg caccggtacc ggccgccgga ctaccgggat 1560
ctcatcagct tcacagttta ctacaaggag gcaccattta aaaacgttac ggaatatgac 1620
gggcaggatg cctgtggctc caacagctgg aacatggtgg atgtagacct gcctccgaac 1680
aaggagggcg agcctggcat tttactgcat gggctgaagc cctggaccca gtatgctgtc 1740
tatgtcaagg ctgtgaccct caccatggtg gaaaacgacc atatccgtgg ggccaaaagt 1800
gaaatcttgt acattcgcac caatgcttca gtcccttcca ttcccctaga tgtcctctca 1860
gcatcaaact cttcctctca gctgattgtg aagtggaatc ctccaactct gcccaatggt 1920
aacttgagtt actacattgt gaggtggcag cggcagcccc aggatggtta cctgtaccgg 1980
cacaactact gctccaaaga caaaataccc atcagaaagt acgccgatgg taccatcgac 2040
gtggaggagg tgacggaaaa tcccaagaca gaagtgtgtg gtggtgataa agggccatgc 2100
tgcgcttgcc ctaaaactga agctgagaag caggctgaga aggaggaggc tgagtaccgt 2160
aaagtctttg agaatttcct tcacaattcc atctttgtgc ccaggcccga aaggaggcgg 2220
agagacgtca tgcaagtggc caacacgacc atgtccagcc gaagcaggaa caccacggta 2280
gctgacacct acaatatcac agacccggag gagttcgaga cagagtaccc tttctttgag 2340
agcagagtgg ataacaagga gaggactgtc atctccaacc tccggccttt cactctgtac 2400
cgcatcgata tccacagctg caaccacgag gctgagaagc tgggctgcag cgcctccaac 2460
ttcgtctttg cgagaaccat gccagcagaa ggagcagatg atatccctgg tccggtgacc 2520
tgggagccaa gacccgaaaa ctccatcttt ttaaagtggc cagaacccga gaaccccaac 2580
ggattgatcc taatgtatga aattaaatac gggtcgcaag tcgaggatca gcgggaatgt 2640
gtgtccagac aggagtacag gaagtacgga ggggccaaac tcaaccgtct aaacccaggg 2700
aactatacag cccggattca ggctacctcc ctctctggga atgggtcatg gacagatcct 2760
gtgttcttct atgtccccgc caaaacgacg tatgagaact tcatgcatct gatcattgct 2820
ctgccggttg ccatcctgct gatcgttggg gggctggtta tcatgctgta tgtcttccat 2880
agaaagagaa ataacagcag gttgggcaat ggagtgctgt atgcttctgt gaaccccgag 2940
tatttcagcg cagctgatgt gtacgtgcct gatgaatggg aggtagctcg agagaagatc 3000
accatgaacc gggagctcgg acaagggtcc tttgggatgg tctatgaagg agtggccaag 3060
ggtgtggtca aggatgaacc cgaaaccaga gtggccatca agacggtaaa cgaggctgca 3120
agtatgcgtg aaagaatcga gtttctcaac gaggcctcgg tgatgaagga gttcaattgt 3180
caccatgtgg tccggttgct gggtgtggta tcccaaggcc agcccaccct ggtcatcatg 3240
gaactaatga cacgcggtga tctcaaaagt tatctccggt ctctgaggcc agaagtggag 3300
cagaataatc tagtcctcat tcctccgagc ttaagcaaga tgatccagat ggctggagag 3360
attgcagatg gcatggccta cctcaatgcc aacaagttcg tccacagaga ccttgctgct 3420
aggaactgca tggtagccga agatttcaca gtcaaaattg gagatttcgg tatgacacga 3480
gacatctacg agacggacta ctaccggaaa ggcgggaagg ggttgctgcc tgtgcgctgg 3540
atgtctcccg agtccctcaa ggatggtgtc ttcactactc attctgatgt ctggtccttc 3600
ggggtcgtcc tctgggagat cgccacgctg gctgagcagc cctaccaggg cttgtccaac 3660
gagcaagttc ttcgtttcgt catggagggt ggccttctgg acaagccgga caactgccct 3720
gatatgctgt ttgaacttat gcgcatgtgc tggcagtata accccaagat gcggccctcc 3780
ttcctggaga tcatcggcag catcaaggat gagatggagc ccagcttcca ggaggtctcc 3840
ttctactaca gcgaggagaa caagcctccc gagccagagg agctggagat ggagctggag 3900
atggagcctg agaacatgga gagcgtccca ctggaccctt cggcctcctc agcctccctg 3960
cctctgcctg aaagacactc aggacacaag gctgagaatg gcccgggccc tggcgtgctc 4020
gttctccgcg ccagttttga tgagagacag ccttacgctc acatgaacgg gggacgcgcc 4080
aacgagaggg ccttgcctct gccccagtcc tcgacctgc 4119
<210> 83
<211> 70
<212> PRT
<213> Homo sapiens
<220>
<223> IGF-I
<400> 83
Gly Pro Glu Thr Leu Cys Gly Ala Glu Leu Val Asp Ala Leu Gln Phe
1 5 10 15
Val Cys Gly Asp Arg Gly Phe Tyr Phe Asn Lys Pro Thr Gly Tyr Gly
20 25 30
Ser Ser Ser Arg Arg Ala Pro Gln Thr Gly Ile Val Asp Glu Cys Cys
35 40 45
Phe Arg Ser Cys Asp Leu Arg Arg Leu Glu Met Tyr Cys Ala Pro Leu
50 55 60
Lys Pro Ala Lys Ser Ala
65 70
<210> 84
<211> 210
<212> DNA
<213> Homo sapiens
<220>
<223> IGF-I
<400> 84
ggaccggaga cgctctgcgg ggctgagctg gtggatgctc ttcagttcgt gtgtggagac 60
aggggctttt atttcaacaa gcccacaggg tatggctcca gcagtcggag ggcgcctcag 120
acaggcatcg tggatgagtg ctgcttccgg agctgtgatc taaggaggct ggagatgtat 180
tgcgcacccc tcaagcctgc caagtcagct 210
<210> 85
<211> 5
<212> PRT
<213> Mus musculus
<220>
<223> IGF11-16 CDR-H1
<400> 85
Ser Tyr Trp Met His
1 5
<210> 86
<211> 17
<212> PRT
<213> Mus musculus
<220>
<223> IGF11-16 CDR-H2
<400> 86
Glu Thr Asn Pro Ser Asn Ser Val Thr Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Ser
<210> 87
<211> 8
<212> PRT
<213> Mus musculus
<220>
<223> IGF11-16 CDR-H3
<400> 87
Gly Arg Gly Arg Gly Phe Ala Tyr
1 5
<210> 88
<211> 11
<212> PRT
<213> Mus musculus
<220>
<223> IGF11-16 CDR-L1
<400> 88
Arg Ala Ser Gln Asn Ile Asn Phe Trp Leu Ser
1 5 10
<210> 89
<211> 7
<212> PRT
<213> Mus musculus
<220>
<223> IGF11-16 CDR-L2
<400> 89
Lys Ala Ser Asn Leu His Thr
1 5
<210> 90
<211> 9
<212> PRT
<213> Mus musculus
<220>
<223> IGF11-16 CDR-L3
<400> 90
Leu Gln Gly Gln Ser Tyr Pro Tyr Thr
1 5
<210> 91
<211> 234
<212> PRT
<213> Mus musculus
<220>
<223> IGF11-16 Light chain
<400> 91
Met Lys Leu Leu Ala Glu Leu Leu Gly Leu Leu Leu Phe Cys Phe Leu
1 5 10 15
Gly Val Arg Cys Asp Ile Gln Met Asn Gln Ser Pro Ser Ser Leu Ser
20 25 30
Ala Ser Leu Gly Asp Thr Ile Thr Ile Thr Cys Arg Ala Ser Gln Asn
35 40 45
Ile Asn Phe Trp Leu Ser Trp Cys Gln Gln Lys Pro Gly Asn Ile Pro
50 55 60
Lys Leu Leu Ile Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Gly Gln
100 105 110
Ser Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
115 120 125
Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln
130 135 140
Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr
145 150 155 160
Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln
165 170 175
Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg
195 200 205
His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro
210 215 220
Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
225 230
<210> 92
<211> 705
<212> DNA
<213> Mus musculus
<220>
<223> IGF11-16 Light chain
<400> 92
atgaaactcc ttgctgagct cctggggctg ctgctgttct gctttttagg tgtgagatgt 60
gacatccaga tgaaccagtc tccatccagt ctgtctgcat ccctcggaga cacaattacc 120
atcacttgcc gtgccagtca gaacattaat ttttggttaa gctggtgcca gcagaaacca 180
ggaaatattc ctaaactatt gatctataag gcttccaact tgcacacagg cgtcccatca 240
aggtttagtg gcagtggatc tggaacagat ttcacattaa ccatcagcag tctgcagcct 300
gaagacattg ccacttacta ctgtctacag ggtcaaagtt atccgtacac gttcggaggg 360
gggaccaagc tggaaataaa acgggctgat gctgcaccaa ctgtatccat cttcccacca 420
tccagtgagc agttaacatc tggaggtgcc tcagtcgtgt gcttcttgaa caacttctac 480
cccaaagaca tcaatgtcaa gtggaagatt gatggcagtg aacgacaaaa tggcgtcctg 540
aacagttgga ctgatcagga cagcaaagac agcacctaca gcatgagcag caccctcacg 600
ttgaccaagg acgagtatga acgacataac agctatacct gtgaggccac tcacaagaca 660
tcaacttcac ccattgtcaa gagcttcaac aggaatgagt gttag 705
<210> 93
<211> 460
<212> PRT
<213> Mus musculus
<220>
<223> IGF11-16 Heavy chain
<400> 93
Met Gly Trp Ser Tyr Ile Ile Leu Phe Leu Val Ala Thr Val Thr Asp
1 5 10 15
Val His Ser Gln Ile Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Leu Ser Cys Lys Ala Pro Gly Tyr Thr Phe
35 40 45
Thr Ser Tyr Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu
50 55 60
Glu Trp Ile Gly Glu Thr Asn Pro Ser Asn Ser Val Thr Asn Tyr Asn
65 70 75 80
Glu Lys Phe Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser
85 90 95
Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Thr Ile Gly Arg Gly Arg Gly Phe Ala Tyr Trp Gly Gln
115 120 125
Gly Thr Leu Val Thr Val Ser Ala Ala Lys Thr Thr Pro Pro Ser Val
130 135 140
Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr
145 150 155 160
Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr
165 170 175
Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser
195 200 205
Ser Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala
210 215 220
Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys
225 230 235 240
Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe
245 250 255
Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val
260 265 270
Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe
275 280 285
Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro
290 295 300
Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro
305 310 315 320
Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val
325 330 335
Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
340 345 350
Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys
355 360 365
Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp
370 375 380
Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Ala Gln Pro
385 390 395 400
Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser
405 410 415
Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala
420 425 430
Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His
435 440 445
His Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
450 455 460
<210> 94
<211> 1383
<212> DNA
<213> Mus musculus
<220>
<223> IGF11-16 Heavy chain
<400> 94
atgggatgga gctatatcat cctctttttg gtagcaacag ttacagatgt ccactcccag 60
atccaactgc agcagcctgg ggctgagctt gtgaagcctg gggcttcagt gaagttgtcc 120
tgcaaggctc ccggctacac cttcaccagc tattggatgc actgggtgaa gcagaggcct 180
ggacaaggcc ttgagtggat tggagagact aatcctagca atagtgttac taactacaat 240
gagaagttca agagcaaggc cacactgact gtagacaaat cctccagcac agcctacatg 300
caactcagca gcctgacatc tgaggactct gcggtctatt actgtacaat agggagggga 360
cggggatttg cttactgggg ccaagggact ctggtcactg tctctgcagc caaaacgaca 420
cccccatctg tctatccact ggcccctgga tctgctgccc aaactaactc catggtgacc 480
ctgggatgcc tggtcaaggg ctatttccct gagccagtga cagtgacctg gaactctgga 540
tccctgtcca gcggtgtgca caccttccca gctgtcctgc agtctgacct ctacactctg 600
agcagctcag tgactgtccc ctccagcacc tggcccagcg agaccgtcac ctgcaacgtt 660
gcccacccgg ccagcagcac caaggtggac aagaaaattg tgcccaggga ttgtggttgt 720
aagccttgca tatgtacagt cccagaagta tcatctgtct tcatcttccc cccaaagccc 780
aaggatgtgc tcaccattac tctgactcct aaggtcacgt gtgttgtggt agacatcagc 840
aaggatgatc ccgaggtcca gttcagctgg tttgtagatg atgtggaggt gcacacagct 900
cagacgcaac cccgggagga gcagttcaac agcactttcc gctcagtcag tgaacttccc 960
atcatgcacc aggactggct caatggcaag gagttcaaat gcagggtcaa cagtgcagct 1020
ttccctgccc ccatcgagaa aaccatctcc aaaaccaaag gcagaccgaa ggctccacag 1080
gtgtacacca ttccacctcc caaggagcag atggccaagg ataaagtcag tctgacctgc 1140
atgataacag acttcttccc tgaagacatt actgtggagt ggcagtggaa tgcgcagcca 1200
gcggagaact acaagaacac tcagcccatc atggacacag atggctctta cttcgtctac 1260
agcaagctca atgtgcagaa gagcaactgg gaggcaggaa atactttcac ctgctctgtg 1320
ttacatgagg gcctgcacaa ccaccatact gagaagagcc tctcccactc tcctggtaaa 1380
tga 1383
<210> 95
<211> 98
<212> PRT
<213> Homo sapiens
<220>
<223> VH-1-46
<400> 95
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 96
<211> 98
<212> PRT
<213> Homo sapiens
<220>
<223> VH-1-e
<400> 96
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 97
<211> 15
<212> PRT
<213> Homo sapiens
<220>
<223> JH4
<400> 97
Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10 15
<210> 98
<211> 95
<212> PRT
<213> Homo sapiens
<220>
<223> VK1-L5
<400> 98
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro
85 90 95
<210> 99
<211> 95
<212> PRT
<213> Homo sapiens
<220>
<223> VK1-A20
<400> 99
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Val Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Lys Tyr Asn Ser Ala Pro
85 90 95
<210> 100
<211> 12
<212> PRT
<213> Homo sapiens
<220>
<223> JK2
<400> 100
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО ПРОТИВ РЕЦЕПТОРА IGF-1 | 2019 |
|
RU2784079C1 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ РАКА, ЭКСПРЕССИРУЮЩЕГО IGF-1R | 2016 |
|
RU2728568C2 |
| МЕТОДЫ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ СЕРДЕЧНЫХ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2830232C2 |
| АНТИТЕЛА К СОБАЧЬЕМУ АЛЬФА-РЕЦЕПТОРУ ИНТЕРЛЕЙКИНА-4 | 2020 |
|
RU2840044C1 |
| БИСПЕЦИФИЧНЫЙ СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2801528C2 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2837821C1 |
| АНТИТЕЛА К СОБАЧЬЕМУ АЛЬФА-РЕЦЕПТОРУ ИНТЕРЛЕЙКИНА-4 | 2020 |
|
RU2838943C1 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2808030C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СОДЕРЖАЩИЕ АНТИ-FAP КЛОН 212 | 2019 |
|
RU2799429C2 |
| БИСПЕЦИФИЧЕСКИЕ 2+1 КОНТОРСТЕЛА | 2018 |
|
RU2797305C2 |
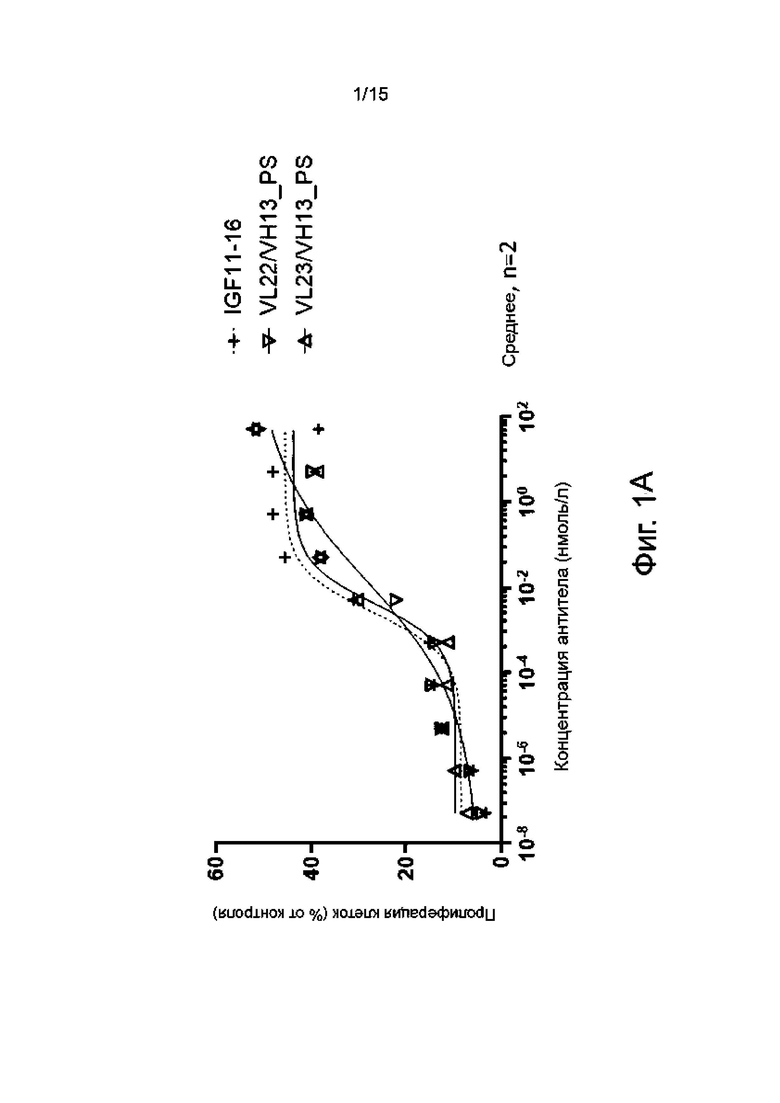
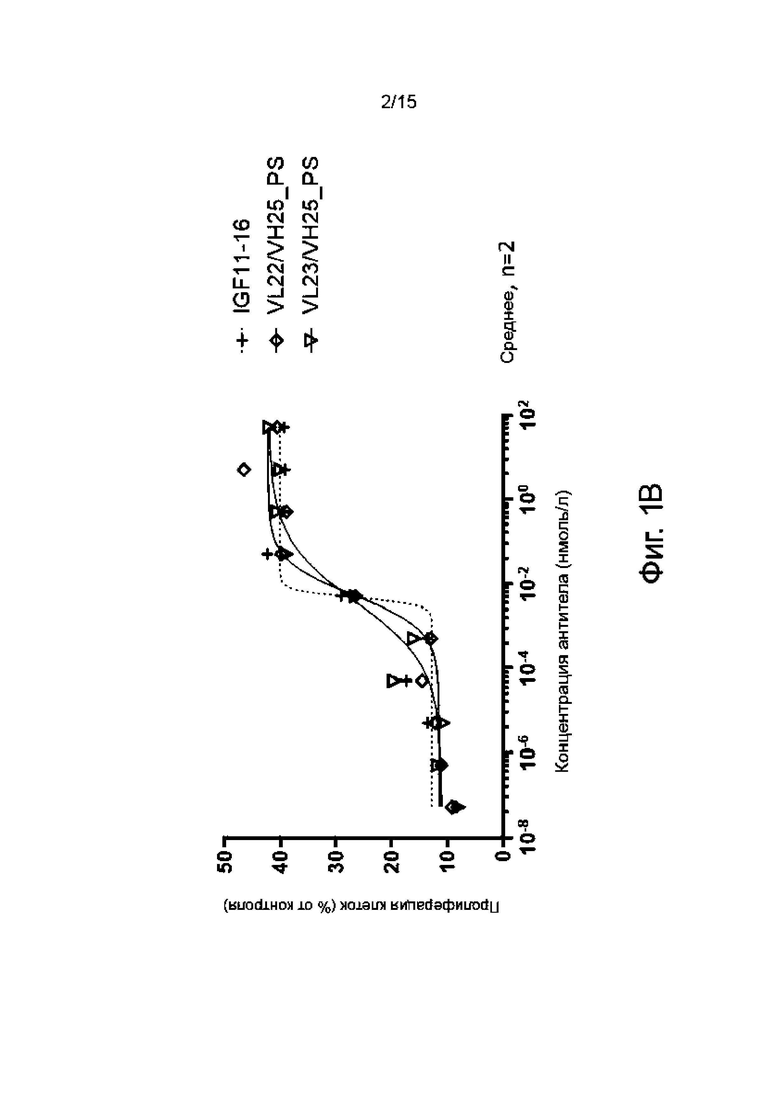
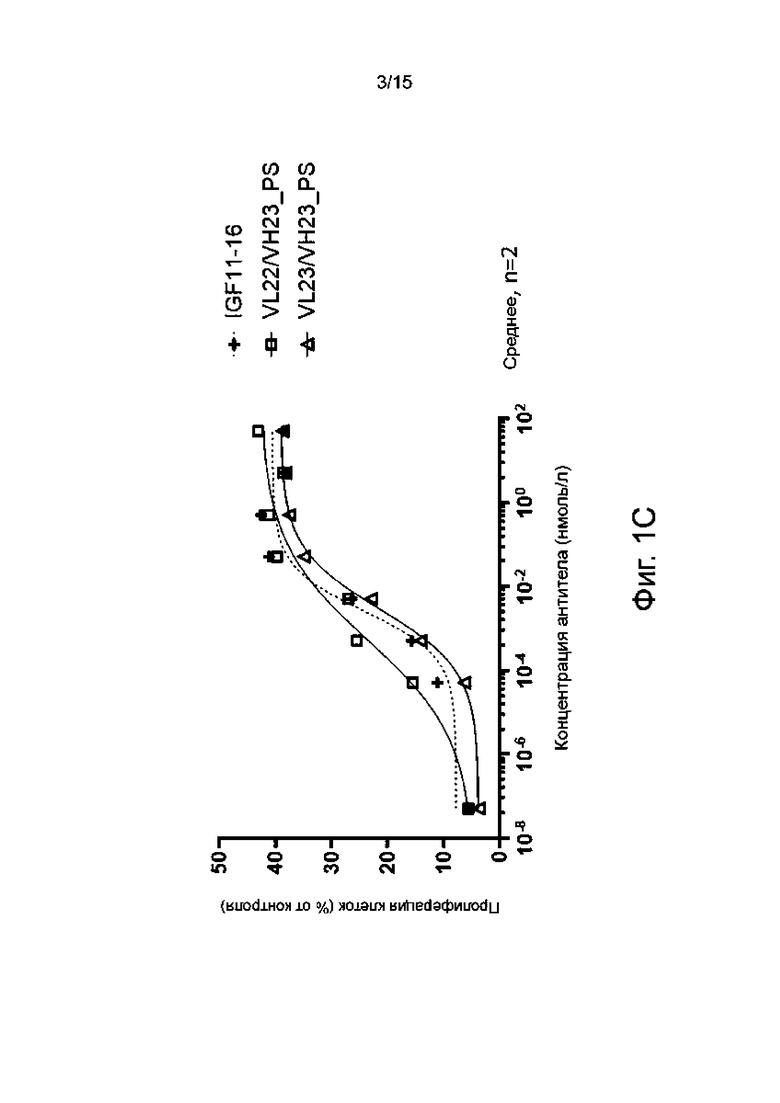
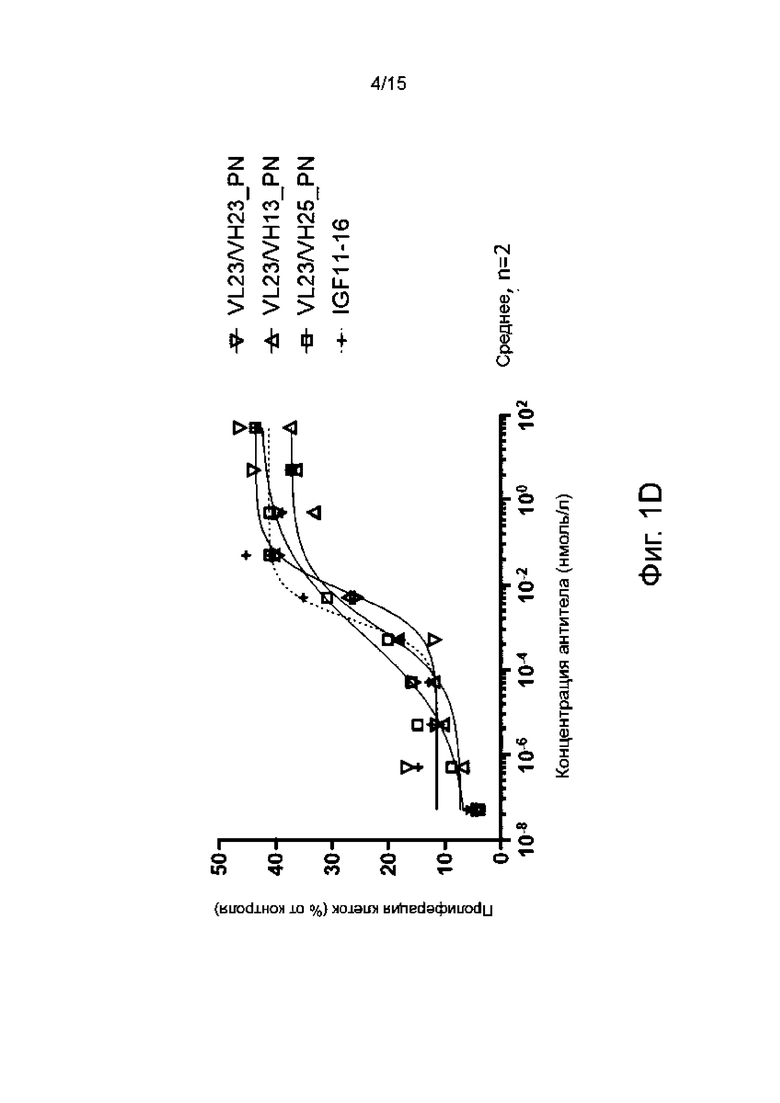
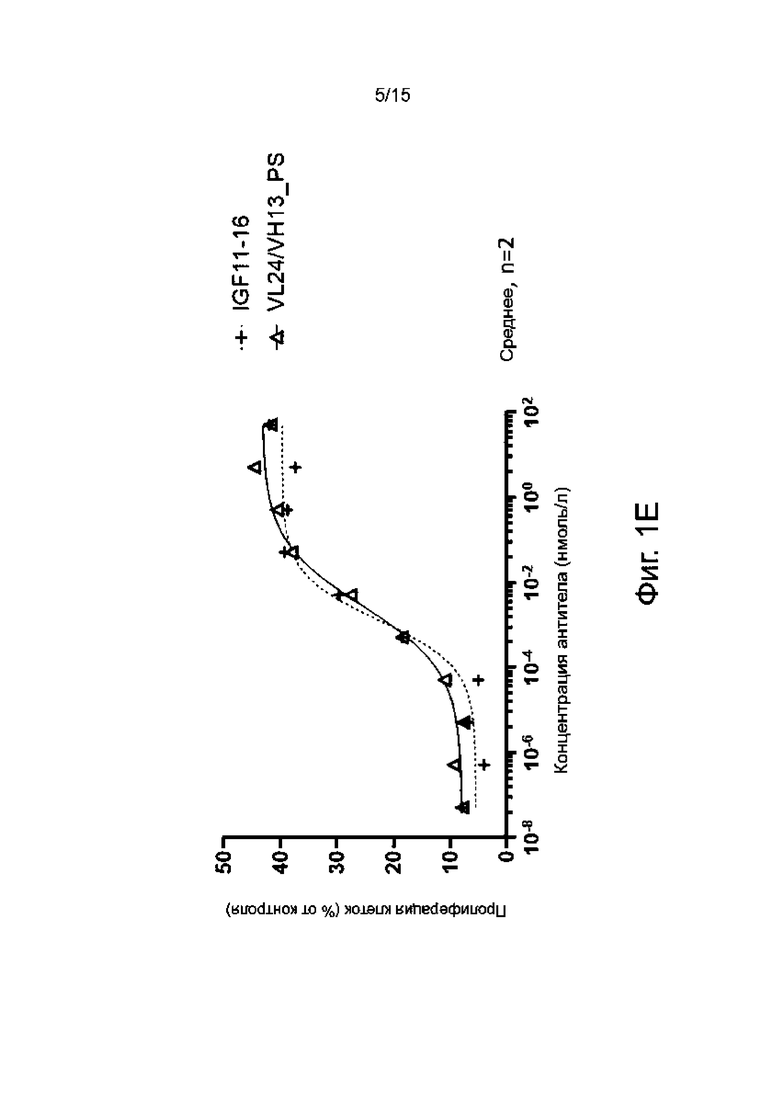
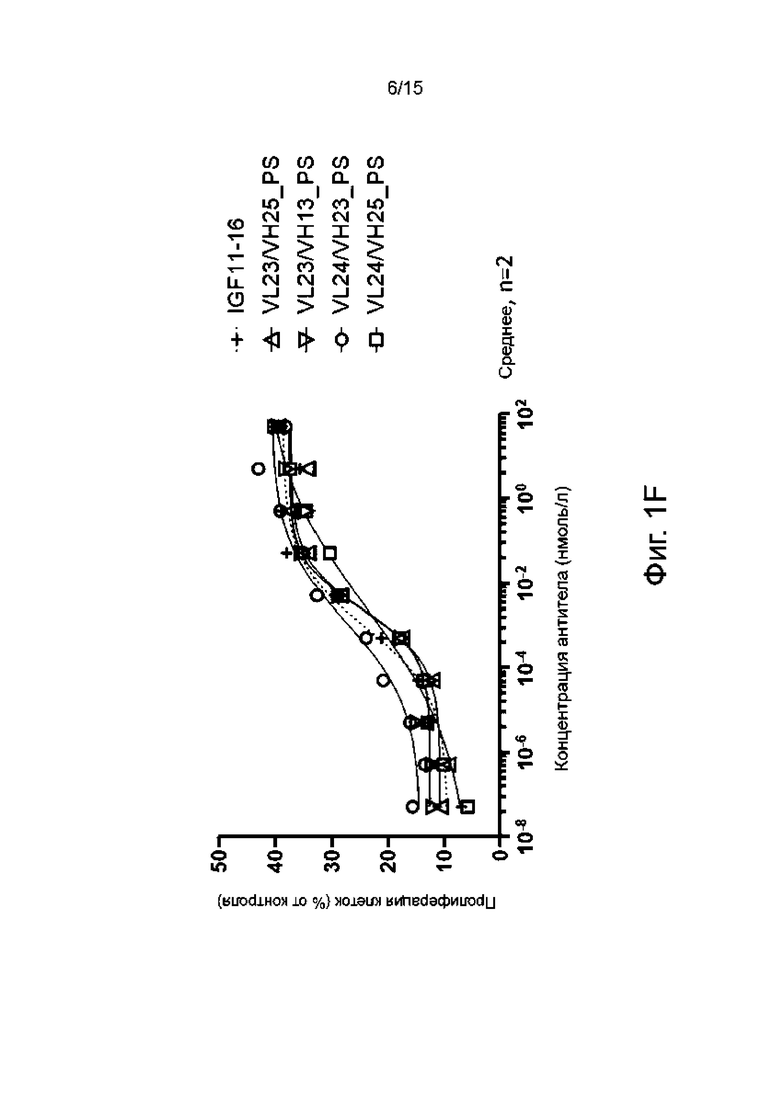
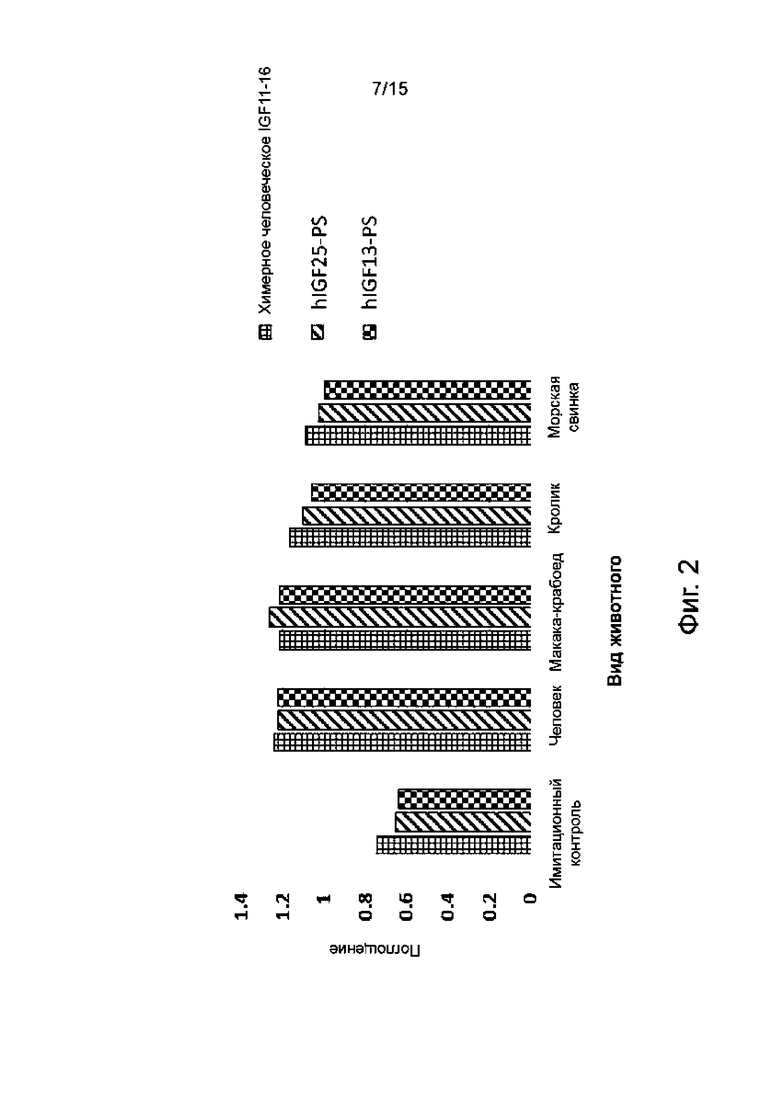
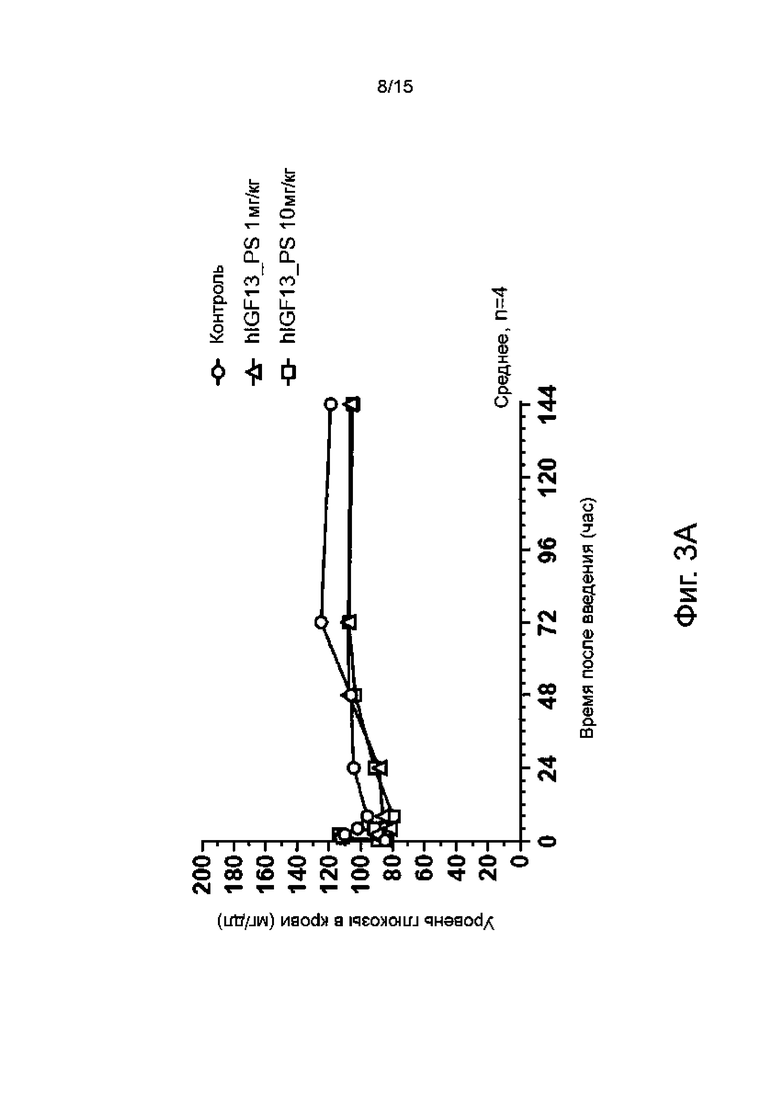
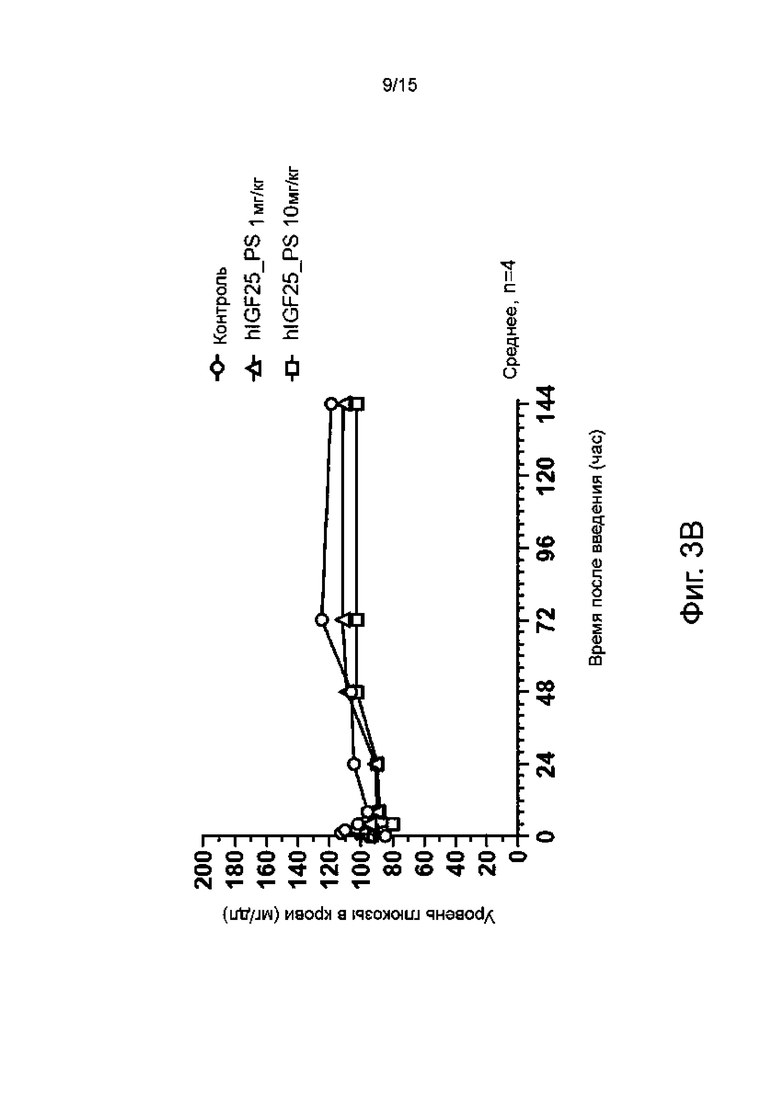
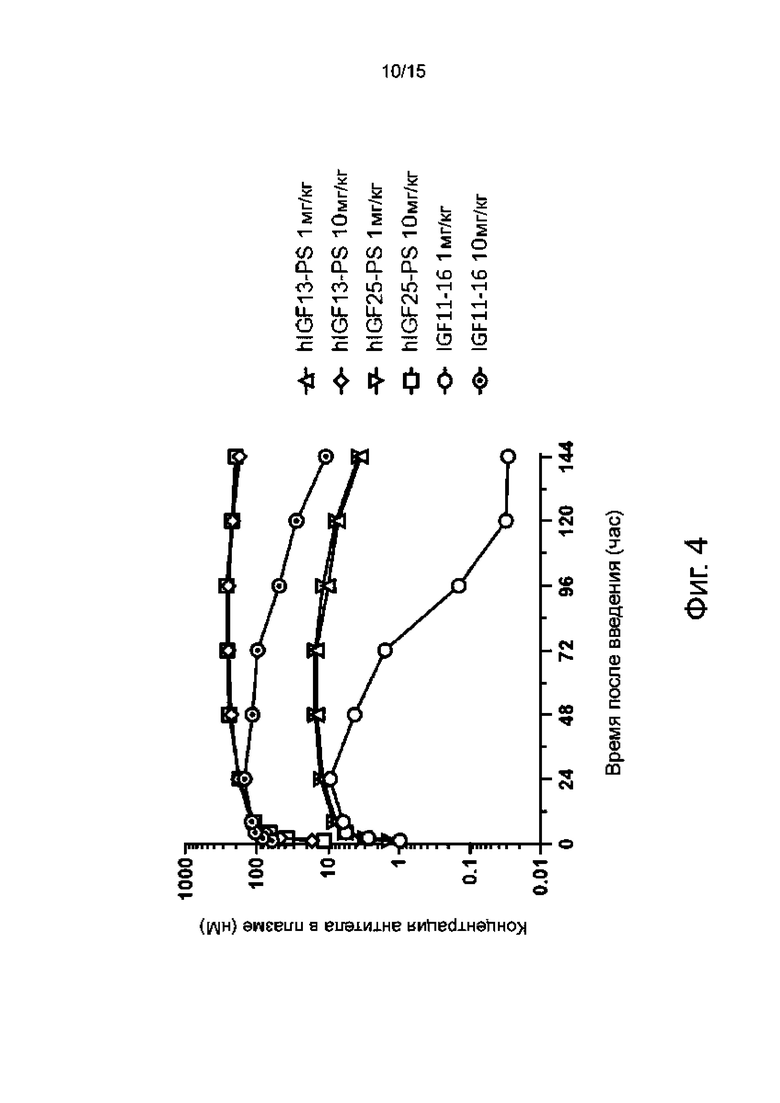
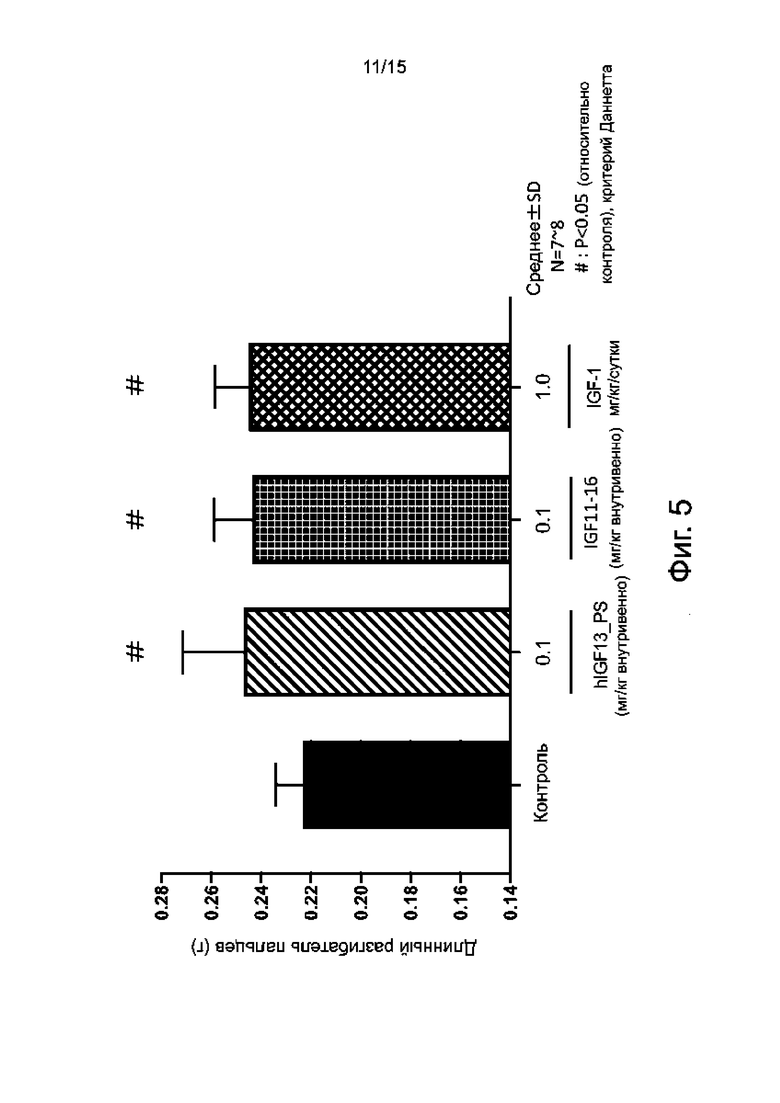
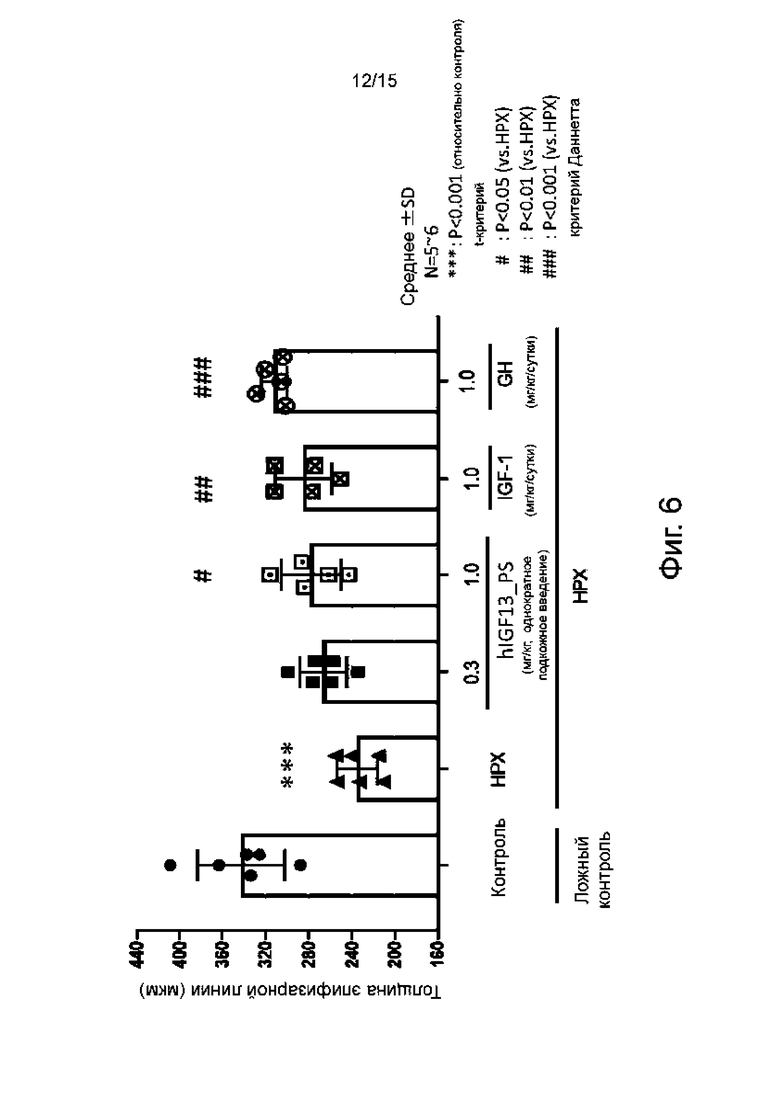
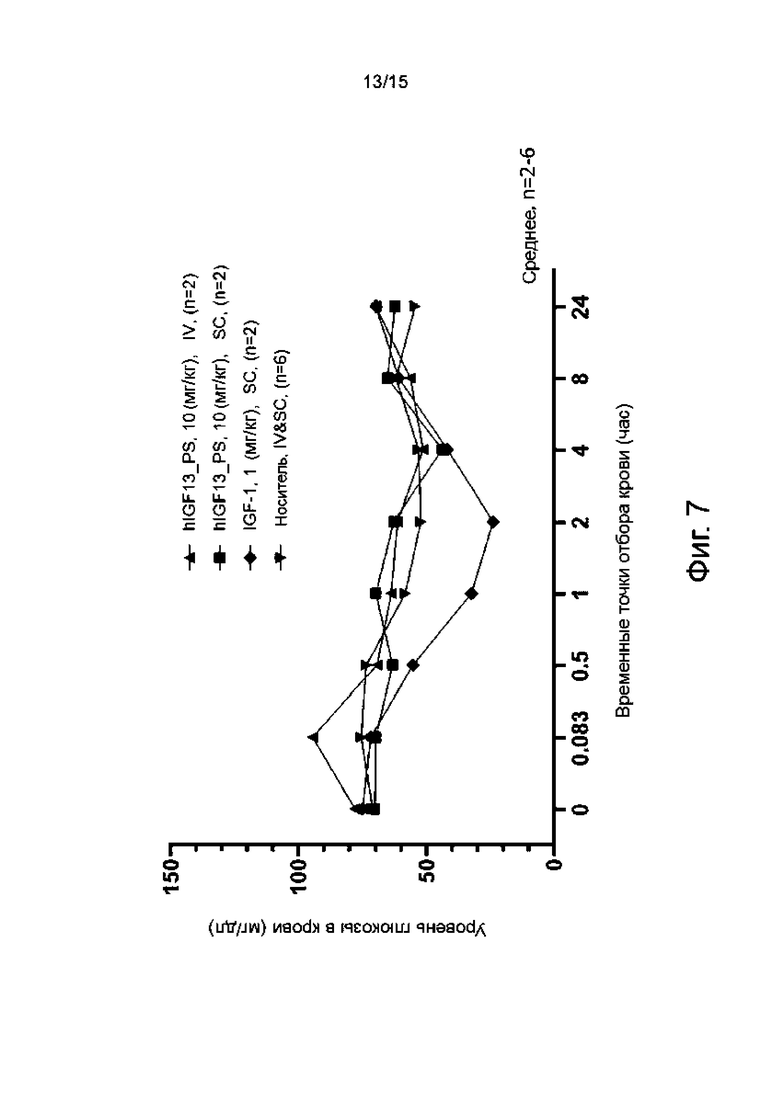
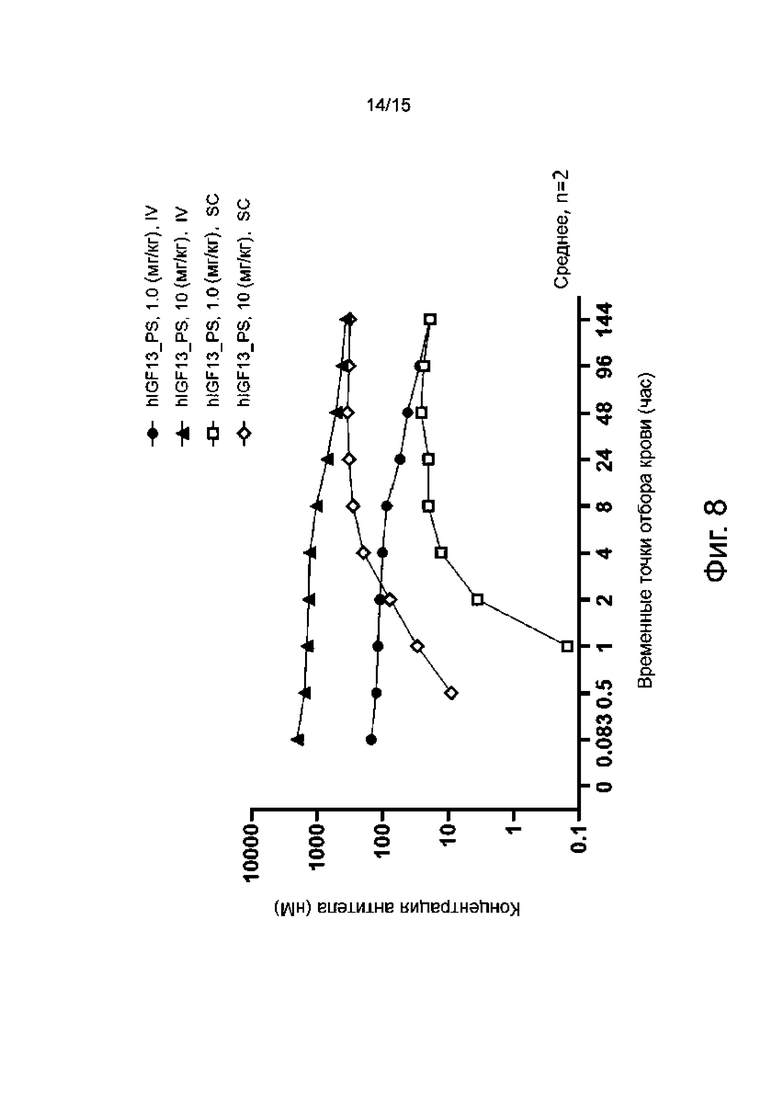
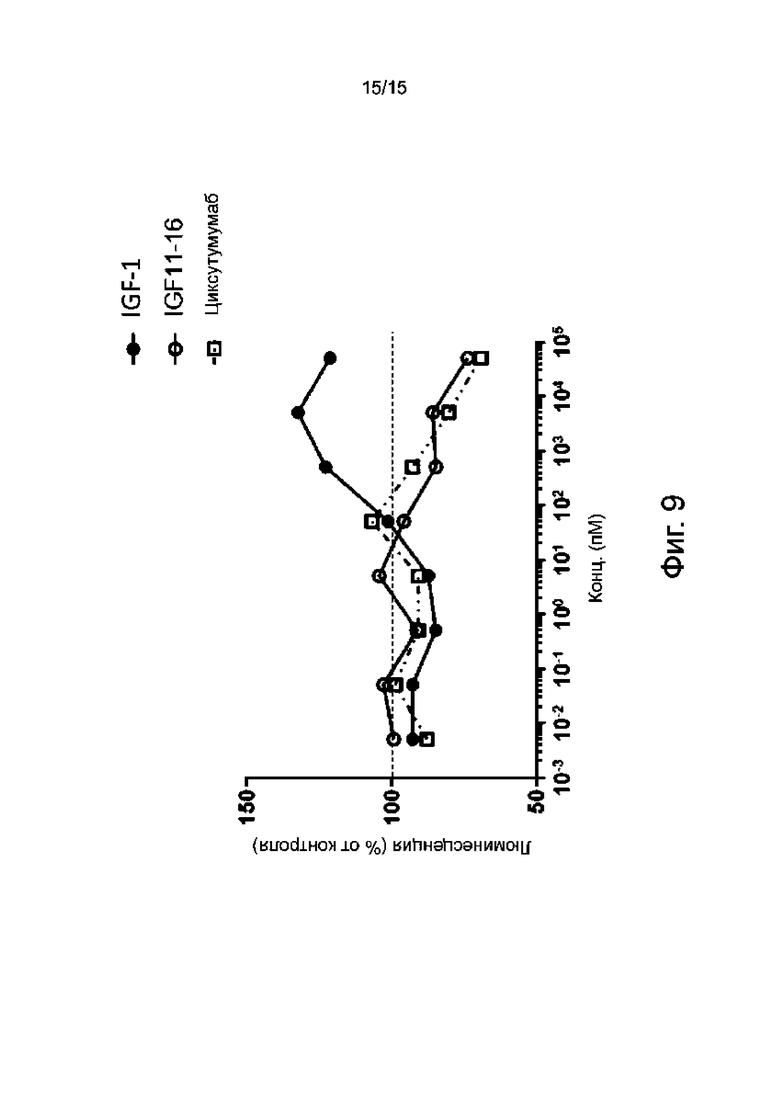
Изобретение относится к области биотехнологии. Предложены гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное, а также содержащие их фармацевтические композиции. Также изобретение относится к кодирующей указанное антитело нуклеиновой кислоте, векторам и клеткам, содержащим указанную нуклеиновую кислоту, способу получения антитела. Изобретение может найти дальнейшее применение в терапии связанных с рецептором IGF-1 заболеваний. 8 н. и 22 з.п. ф-лы, 15 ил., 17 табл., 21 пр.
1. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное, включающие
в качестве последовательности CDR-1 вариабельной области тяжелой цепи (CDR-H1) аминокислотную последовательность, определенную в SEQ ID NO: 1, или аминокислотную последовательность, полученную из SEQ ID NO: 1, в которой Trp в 3-й позиции SEQ ID NO: 1 сохраняется, причем указанная аминокислотная последовательность дополнительно включает замену любого одного аминокислотного остатка иного, чем аминокислотный остаток в 3-й позиции,
в качестве последовательности CDR-2 вариабельной области тяжелой цепи (CDR-H2)
аминокислотную последовательность, определенную в SEQ ID NO: 3, или аминокислотную последовательность, полученную из SEQ ID NO: 3, в которой Glu в 1-й позиции и Asn в 3-й позиции SEQ ID NO: 3, каждый, сохраняются и Asn в 6-й позиции сохраняется или замещается Ser или Gln, причем аминокислотная последовательность дополнительно включает замену любого одного аминокислотного остатка иного, чем аминокислотные остатки в 1-й позиции, 3-й позиции и 6-й позиции, или
аминокислотную последовательность, определенную в SEQ ID NO: 5, или аминокислотную последовательность, полученную из SEQ ID NO: 5, в которой Glu в 1-й позиции и Asn в 3-й позиции SEQ ID NO: 5, каждый, сохраняются и Ser в 6-й позиции SEQ ID NO: 5 сохраняется или заменяется Asn или Gln, причем аминокислотная последовательность дополнительно включает замену любого одного аминокислотного остатка иного, чем аминокислотные остатки в 1-й позиции, 3-й позиции и 6-й позиции,
в качестве последовательности CDR-3 вариабельной области тяжелой цепи (CDR-H3) аминокислотную последовательность, определенную в SEQ ID NO: 7, или аминокислотную последовательность, полученную из SEQ ID NO: 7, в которой Arg в 4-й позиции SEQ ID NO: 7 сохраняется, причем аминокислотная последовательность дополнительно включает замену любого одного аминокислотного остатка иного, чем аминокислотный остаток в 4-й позиции SEQ ID NO: 7,
в качестве последовательности CDR-1 вариабельной области легкой цепи (CDR-L1) аминокислотную последовательность, определенную в SEQ ID NO: 9, или аминокислотную последовательность, полученную из SEQ ID NO: 9, в которой Trp в 9-й позиции SEQ ID NO: 9 сохраняется, причем аминокислотная последовательность дополнительно включает замену любого одного аминокислотного остатка иного, чем аминокислотный остаток в 9-й позиции SEQ ID NO: 9,
в качестве последовательности CDR-2 вариабельной области легкой цепи (CDR-L2) аминокислотную последовательность, определенную в SEQ ID NO: 11, или аминокислотную последовательность, полученную из SEQ ID NO: 11 путем замены любого одного аминокислотного остатка,
в качестве последовательности CDR-3 вариабельной области легкой цепи (CDR-L3) аминокислотную последовательность, определенную в SEQ ID NO: 13, или аминокислотную последовательность, полученную из SEQ ID NO: 13 путем замены любого одного аминокислотного остатка; и
участки каркаса тяжелой цепи и легкой цепи (FR), каждый из которых получен из человеческого антитела,
причем заявленное антитело не является тем, в котором CDR-H1 представляет собой аминокислотную последовательность, определенную в SEQ ID NO: 1, CDR-H2 представляет собой аминокислотную последовательность, определенную в SEQ ID NO: 3, CDR-H3 представляет собой аминокислотную последовательность, определенную в SEQ ID NO: 7, CDR-L1 представляет собой аминокислотную последовательность, определенную в SEQ ID NO: 9, CDR-L2 представляет собой аминокислотную последовательность, определенную в SEQ ID NO: 11, и CDR-L3 представляет собой аминокислотную последовательность, определенную в SEQ ID NO: 13, и
где аминокислотный остаток в положении 25 участка каркаса 1 вариабельной области тяжелой цепи (FR-H1) является остатком пролина.
2. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по п. 1, которые специфически связываются с внеклеточным доменом рецептора IGF-1 человека, имеющим аминокислотную последовательность согласно SEQ ID NO: 71.
3. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по п. 1 или 2, включающие
в качестве вариабельной области тяжелой цепи аминокислотную последовательность согласно SEQ ID NO: 43, 47, 49, 53, 55 или 59, аминокислотную последовательность, полученную из SEQ ID NO: 43, 47, 49, 53, 55 или 59 путем замены, делеции или добавления одного или нескольких аминокислотных остатков, или аминокислотную последовательность, имеющую гомологию 90% или более с SEQ ID NO: 43, 47, 49, 53, 55 или 59, и
в качестве вариабельной области легкой цепи аминокислотную последовательность согласно SEQ ID NO: 65, 67 или 69, аминокислотную последовательность, полученную из SEQ ID NO: 65, 67 или 69 путем замены, делеции или добавления одного или нескольких аминокислотных остатков, или аминокислотную последовательность, имеющую гомологию 90% или более с SEQ ID NO: 65, 67 или 69.
4. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-3, включающие в качестве константной области тяжелой и/или легкой цепей константную область тяжелой и/или легкой цепей иммуноглобулина человека любого класса.
5. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-4, в которых константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG4 человека или область, полученную из нее путем замены от 1 до 10 аминокислот.
6. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-4, в которых константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG1 человека или область, полученную из нее путем замены от 1 до 10 аминокислот.
7. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-6, которые связываются с рецептором IGF-1 с аффинностью, представленной константой равновесной диссоциации (KD) 1×10-7 М или меньше.
8. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-7, которые обладают способностью активировать передачу сигналов рецептором IGF-1.
9. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-8, которые проявляют пролиферативную активность в анализе пролиферации миобластов.
10. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-9, которые проявляют аффинность связывания, эквивалентную или большую, чем аффинность мышиного родительского антитела IGF11-16, в анализе связывания BIACORE с рекомбинантным растворимым рецептором IGF-1.
11. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-10, которые имеют способность индуцировать эффект увеличения мышечной массы у здорового млекопитающего без индукции симптомов гипогликемии.
12. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-11, которые имеют способность индуцировать эффект удлинения хрящевой пластинки роста у гипофизэктомированной животной модели без индукции симптомов гипогликемии.
13. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-12, которые при введении позвоночному животному в дозе, которая вызывает увеличение мышечной массы и/или длины тела, не снижает уровень глюкозы в крови у позвоночного животного.
14. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-12, которые даже при уровне концентрации в крови, превышающем эффективную дозу, достаточную для индукции увеличения мышечной массы и/или длины тела, в 10 раз, не снижает уровень глюкозы в крови у позвоночного животного.
15. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-14, которые имеют способность ингибировать активацию передачи сигналов рецептором IGF-1.
16. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-14, которые в анализе пролиферации миобластов ингибируют пролиферативную активность по меньшей мере одного лиганда IGF-1, IGF-2 и инсулина, причем лиганд может активировать рецептор IGF-1.
17. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-16, которые обладают активностью ингибирования клеточной пролиферации в анализе пролиферации раковых клеток.
18. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-17, которые имеют по меньшей мере одну характеристику, выбранную из следующих:
(1) ингибирование пролиферации клеток, происходящих от позвоночного, индуцированной лигандом, активирующим рецептор IGF-1;
(2) ингибирование пролиферации клеток у позвоночного животного, индуцированной лигандом, активирующим рецептор IGF-1, при нарушении пролиферации клеток;
(3) не влияет на поглощение глюкозы дифференцированными мышечными клетками в дозе, достаточной для ингибирования пролиферации клеток, происходящих от позвоночного, индуцированной лигандом, активирующим рецептор IGF-1; и
(4) не влияет на уровень глюкозы в крови у позвоночного животного даже в дозе, достаточной для ингибирования клеточной пролиферации, при нарушении пролиферации клеток позвоночного, вызванной лигандом, активирующим рецептор IGF-1.
19. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-18, которые имеют способность индуцировать ингибирующее действие на пролиферацию раковых клеток без воздействия на уровень глюкозы в крови у животной модели ракового заболевания.
20. Гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по п. 19, которые даже при уровне концентрации в крови, в 10 раз превышающем эффективную дозу, достаточную для индукции ингибирующего действия на пролиферацию раковых клеток у животной модели ракового заболевания, не влияют на уровень глюкозы в крови у животной модели.
21. Молекула нуклеиновой кислоты, включающая полинуклеотидную последовательность, кодирующую гуманизированное антитело против рецептора IGF-1, или его фрагмент, или его производное по любому из пп. 1-20.
22. Клонирующий вектор, включающий по меньшей мере одну молекулу нуклеиновой кислоты по п. 21.
23. Вектор экспрессии, включающий по меньшей мере одну молекулу нуклеиновой кислоты по п. 21.
24. Рекомбинантная клетка для получения гуманизированного антитела против рецептора IGF-1, или его фрагмента, или производного по любому из пп. 1-20, полученная из клетки-хозяина путем введения вектора по п. 22 или 23.
25. Способ получения гуманизированного антитела против рецептора IGF-1, или его фрагмента, или его производного по любому из пп. 1-20, включающий
культивирование рекомбинантной клетки по п. 24 и
очистку гуманизированного антитела против рецептора IGF-1, или его фрагмента, или его производного, продуцированного рекомбинантной клеткой.
26. Фармацевтическая композиция для использования при лечении атрофического заболевания мышц или карликовости, включающая в качестве активного ингредиента эффективную дозу гуманизированного антитела против рецептора IGF-1, или его фрагмента, или его производного по любому из пп. 1-20.
27. Фармацевтическая композиция по п. 26, причем карликовость представляет собой карликовость типа Ларона или карликовость, устойчивую к гормону роста.
28. Фармацевтическая композиция по п. 26, причем атрофическим заболеванием мышц является атрофия мало работающих мышц, саркопения или кахексия.
29. Фармацевтическая композиция для использования при лечении заболевания, связанного с рецептором IGF-1, включающая в качестве активного ингредиента эффективную дозу гуманизированного антитела против рецептора IGF-1, или его фрагмента, или его производного по любому из пп. 1-20.
30. Фармацевтическая композиция по п. 29, причем заболевание, связанное с рецептором IGF-1, выбирают из группы, включающей: рак печени, нейробластому, рабдомиосаркому, рак костей, детский рак, акромегалию, рак яичников, рак поджелудочной железы, доброкачественную гипертрофию предстательной железы, рак молочной железы, рак предстательной железы, рак костей, рак легких, колоректальный рак, рак шеи, синовиосаркому, рак мочевого пузыря, рак желудка, опухоль Вильмса, диарею, связанную с метастатическим карциноидом и вазоактивной опухолью, секретирующей кишечный пептид, випому, синдром Вернера-Моррисона, синдром Беквита-Видемана, рак почек, почечно-клеточный рак, переходноклеточный рак, саркому Юинга, лейкоз, острый лимфобластный лейкоз, опухоль головного мозга, глиобластому, неглиобластоматозную опухоль головного мозга, менингиому, аденому гипофиза, вестибулярную шванному, недифференцированную нейроэктодермальную опухоль, медуллобластому, астроцитому, олигодендроглиому, опухоль верхней части головного мозга, папиллому сосудистого сплетения, гигантизм, псориаз, атеросклероз, рестеноз гладкой мускулатуры сосудов, несоответствующий рост микрососудов, диабетическую ретинопатию, болезнь Грейвса, рассеянный склероз, системные эритематоды, миастению гравис, аутоиммунный тиреоидит, тиреоидит Хашимото, офтальмопатию щитовидной железы, гипертиреоз и болезнь Бехчета.
| WO 2018221521 A1, 06.12.2018 | |||
| WO 2019156565 A1, 15.08.2019 | |||
| WO 2018154392 A1, 30.08.2018 | |||
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА С ПОВЫШЕННОЙ СТАБИЛЬНОСТЬЮ | 2015 |
|
RU2684703C2 |
Авторы
Даты
2025-03-24—Публикация
2021-06-01—Подача