Область техники
Избретение относится к области молекулярной биологии и генной инженерии, в частности к одновременному выявлению и идентификации митохондриальной ДНК животных в кормах, подвергшихся термической обработке, комбикормах, сухих и консервированных кормах для животных, а также в сырых мясных продуктах (части туши, фарш), мясных продуктах, подвергшихся кулинарной обработке.
Уровень техники
Выявление и идентификация митохондриальной ДНК животных в кормах для животных представляет актуальную проблему. Это связано с тем, что в 1986 г в Великобритании у крупного рогатого скота впервые была выявлена губчатая энцефалопатия (BSE), которая распространилась на 26 стран мира [1]. Быстрое распространение было вызвано применением для сельскохозяйственных животных белковых добавок в виде мяса и костной муки, которые использовались для обеспечения незаменимых аминокислот для кормящих и быстро растущих животных.
Для прекращения распространения болезней был введен запрет на использование белковых добавок. Так, в 2000 г. такой запрет был распространен в Европе на белковые добавки, полученные из млекопитающих, а также птиц и рыб для всех выращиваемых животных, которые будут использоваться в производстве продуктов питания.
В целях обеспечения действия запрета встала необходимость выявления белковых добавок в кормах для животных. Из всех известных методов диагностирования наибольшее распространение получил метод, основанный на применении методов ПЦР для выявления и идентификации митохондриальной ДНК животных в кормах и продуктах питания.
Известны изобретения [2-5] и ряд публикаций [6-8,] в которых рассматриваются вопросы применения метода ПЦР для диагностики ДНК животных в кормах для животных.
В последнее время фирмой ООО "Компания Биоком" выпускается набор реагентов для выявления и идентификации тканей животного происхождения [9], и в 2007 г. разработан ГОСТ Р 52723-2007 «Продукты пищевые и корма. Экспресс-метод определения сырьевого состава (молекулярный)» [10].
Наиболее близкими к настоящему изобретению являются наборы для диагностики, выпускаемые по ГОСТР 52723-2007 [9-10], позволяющие осуществить обнаружение только трех типов митохондриальных ДНК. В состав известных наборов входят смеси праймеров (олигонуклеотидов) для амплификации и выявления нуклеотидных последовательностей геномов крупного рогатого скота, свиньи, курицы.
К недостатку приведенных выше технических решений можно отнести малое число анализируемых типов ДНК. Кроме этого целесообразно выявление тех продуктов животного происхождения, которые входят в состав продуктов питания (колбас, сосисок, сарделек), с целью выявления включения в состав изделий мяса собак, кошек, мышей и крыс.
Технический результат, на достижение которого направлено данное изобретение, заключается в расширении типов исследуемых ДНК и в разработке технических решений по одновременной диагностике до 10 различных типов митохондриальных ДНК, что позволяет повысить надежность и эффективность проверки кормов и продуктов питания на наличие белковых добавок.
Для достижения данного технического результата в диагностический тест включен набор олигонуклеотидов-праймеров, позволяющих выявить не только геномы рогатого скота, свиньи, курицы, но и дополнительно выявить геномы овцы, индейки, собаки, кошки, мыши, крысы и человека. Кроме этого в рамках изобретения для осуществления эффективной мультиплексной ПЦР были разработаны новые конструкции праймеров, обладающие повышенной специфичностью к исследуемым ДНК. Благодаря включению в состав диагностического теста первого и второго наборов специфичных пар праймеров, приведенных в таблице №1, многократно повышается вероятность выявления, по меньшей мере, одного генома митохондриальных ДНК в случае его присутствия в исследуемой пробе. Первичная последовательность праймеров обеспечивает специфичность их взаимодействия с искомыми последовательностями ДНК.
Таким образом, снабжение диагностического теста первым и вторым наборами, содержащими специфичные пары праймеров , для обнаружения 10 различных типов митохондриальных ДНК, обеспечивает возможность выполнения поставленной технической задачи.
Сущностью изобретения является диагностический тест для выявления митохондриальной ДНК животных в кормах и мясных продуктах, содержащий первый комплект для выделения ДНК, второй комплект, включающий реагенты для проведения мультипраймерной реакции амплификации методом ПЦР, а также два набора праймеров, перечни последовательностей которых приведены соответственно на фиг.1 и фиг.2, а также третий комплект для проведения электрофореза в ПААГ. При этом в первый набор входят праймеры с нуклеотидной последовательностью SEQ ID NO: 1 по SEQ ID NO: 10, комплементарные к участкам ДНК, входящим в группу, состоящую из: Sus scrofa domesticus (свинья домашняя), Bos taurus taunts (домашний бык), Gallus gallus (домашняя курица), Ovis aries (домашняя овца), Meleagris gallopavo (обыкновенная индейка), и праймеры внутреннего контроля SEQ ID NO: 20 и SEQ ID NO: 21, а во второй набор входят олигонуклеотиды SEQ ID NO: 11 по SEQ ID NO: 19, комплементарные к участкам ДНК, входящим в группу, состоящую из: Mus musculus domesticus (мышь домовая), Rattus rattus (norvegicus) (крыса черная (серая)), Canis lupus familiaris (собака домашняя), Homo sapiens (человек разумный), Felis catus (домашняя кошка), и праймеры внутреннего контроля SEQ ID NO: 20 и SEQ ID NO: 21.
Краткое описание чертежей.
На фиг.1 приведен перечень праймеров первого набора, входящего во второй комплект диагностического теста для выявления митохондриальной ДНК животных в кормах и мясных продуктах.
На фиг.2 приведен перечень праймеров второго набора, входящего во второй комплект диагностического теста для выявления митохондриальной ДНК животных в кормах и мясных продуктах.
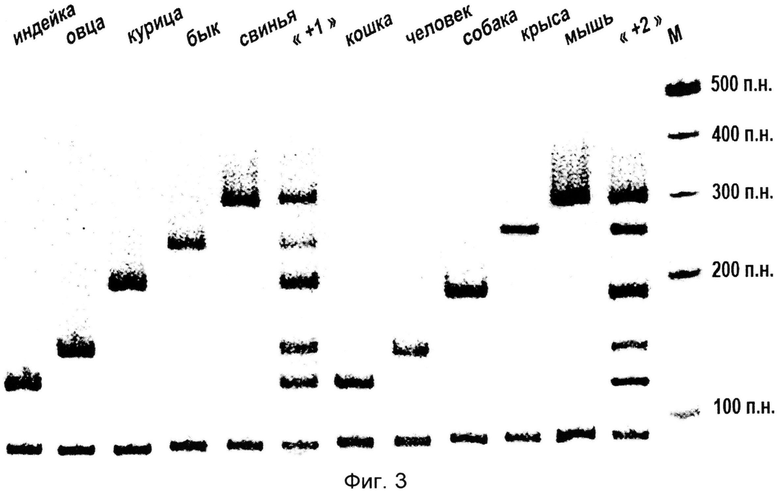
На фиг.3 приведена электрофореграмма мультипраймерного ПЦР-анализа ДНК, выделенной из образцов тканей индейки, овцы, курицы, быка, свиньи, кошки, человека, собаки, крысы, мыши.
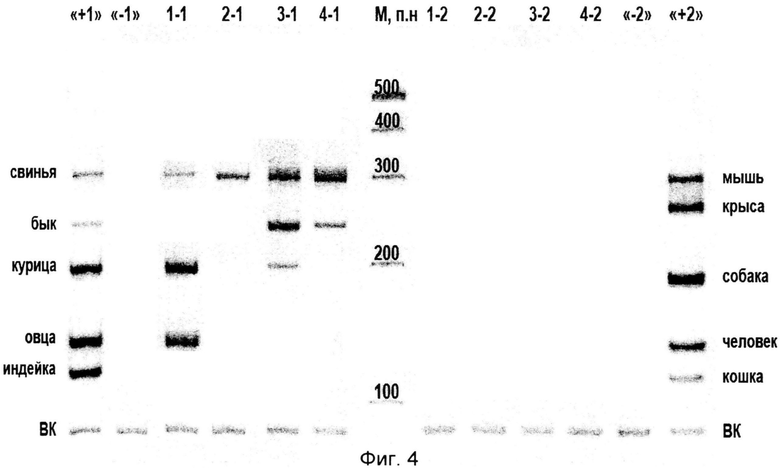
На фиг.4 приведен пример мультипраймерного ПЦР-анализа ДНК образцов коммерчески доступных колбас. В первом образце колбасы (поз.1-1) обнаружено мясо свиньи, курицы, овцы. Во втором образце колбасы (поз.2-1) обнаружено мясо свиньи. В третьем образце колбасы (поз.3-1) обнаружено мясо свиньи, курицы, быка. В четвертом образце колбасы (поз.4-1) обнаружено мясо свиньи, быка. В исследованных образцах колбасы отсутствует мясо кошки (поз.1-2), человека (поз.2-2), собаки (поз.3-2), крысы и мыши (поз 4-2).
Осуществление изобретения
Диагностический тест предназначен для одновременного выявления и идентификации в исследуемых пробах митохондриальной ДНК животных, а именно Bos taurus taurus (домашний бык), Sus scrofa domesticus (свинья домашняя), Ovis aries (домашняя овца), Gallus gallus (домашняя курица), Meleagris gallopavo (обыкновенная индейка), Canis lupus familiaris (собака домашняя), Felis catus (домашняя кошка), Mus musculus domesticus (мышь домовая), Rattus rattus (norvegicus) (крыса черная (серая)) и Homo sapiens (человек разумный).
Для проведения диагностики диагностический тест содержит три комплекта реагентов.
Первый комплект предназначен для выделения ДНК. В состав комплекта входят флаконы: с лизирующим буфером, с первым и вторым промывочным буфером, с элюирующим буфером, с деионизованой водой, с раствором контроля выделения ДНК, с сорбентом - С.
Второй комплект предназначен для проведения мультипраймерной реакции амплификации. В состав комплекта входят флаконы: с реакционным буфером, с Taq ДНК-полимеразой, с урацил гликозилазой, с раствором положительного контрольного образца, с раствором отрицательного контрольного образца, с маслом для ПЦР. Кроме этого во второй комплект включены два набора олигонуклеотидных праймеров. Первый набор содержит праймеры с нуклеотидной последовательностью SEQ ID NO: 1 по SEQ ID NO: 10 (см. фиг.1), комплементарные к участкам ДНК, входящим в группу, состоящую из: Sus scrofa domesticus (свинья домашняя), Bos taurus taurus (домашний бык), Gallus gallus (домашняя курица), Ovis aries (домашняя овца), Meleagris gallopavo (обыкновенная индейка,) и праймеры внутреннего контроля SEQ ID NO: 20 и SEQ ID NO: 21.
Второй набор, входящий во второй комплект, содержит праймеры с нуклеотидной последовательностью SEQ ID NO: 11 по SEQ ID NO: 19, комплементарные к участкам ДНК, входящим в группу, состоящую из: Mus musculus domesticus (мышь домовая), Rattus rattus (norvegicus) (крыса черная (серая)), Canis lupus familiaris (собака домашняя), Homo sapiens (человек разумный), Felis catus (домашняя кошка), и праймеры внутреннего контроля SEQ ID NO: 20 и SEQ ID NO: 21 (см. фиг.2). Следует отметить, что из-за близости ДНК у мышей и крыс, в набор включены не четыре праймера, а три. Праймер SEQ ID NO: 16 используется одновременно в двух парах праймеров как для идентификации ДНК мышей (SEQ ID NO: 19 и SEQ ID NO: 16), так и при идентификации ДНК крыс (SEQ ID NO: 15 и SEQ ID NO: 16).
В таблице №1 приведен общий перечень праймеров, используемых при формировании диагностического теста.
Дополнительно, в состав второго комплекта входят пробирки для ПЦР вместимостью по 0,5 мл.
Третий комплект предназначен для проведения электрофореза в ПААГ. В третий комплект входят флаконы, содержащие: 20% раствор акриламид/бис-акриламидом, 10×ТБЭ буфер для электрофореза, раствор ТЕМЕД, 5×буфер для нанесения на гель, раствор бромистого этидия, раствор маркеров молекулярных масс, а также порошок ПСА.
Все комплекты упакованы в отдельные емкости, выполненные из пластика.
Диагностику кормов и мясных продуктов проводят последовательно, используя первый, второй и третий комплекты на следующих этапах: 1) выделение нуклеиновых кислот из исследуемых проб, 2) проведение мультипраймерной реакции амплификации специфичных для каждого вида фрагментов ДНК, 3) проведение электрофоретической детекции продуктов ПЦР в полиакриламидном геле (ПААГ). Порядок проведения этапов описан в примерах 1-3. Продолжительность проведения пробоподготовки, ПЦР и электрофоретической детекции составляет 6 часов.
На фиг.3 приведена электрофореграмма мультипраймерного ПЦР-анализа ДНК, выделенной из образцов тканей индейки, овцы, курицы, быка, свиньи, кошки, человека, собаки, крысы, мыши.
На фиг.4 приведен пример мультипраймерного ПЦР-анализа ДНК образцов коммерчески доступных колбас.В первом образце колбасы (поз.1-1) обнаружено мясо свиньи, курицы, овцы. Во втором образце колбасы (поз.2-1) обнаружено мясо свиньи. В третьем образце колбасы (поз.3-1) обнаружено мясо свиньи, курицы, быка. В четвертом образце колбасы (поз.4-1) обнаружено мясо свиньи, быка. В исследованных образцах колбасы отсутствует мясо кошки (поз.1-2), человека (поз.2-2), собаки (поз.3-2), крысы и мыши (поз 4-2).
После трех этапов проводят этап интерпретации результатов, который проводят на основании сопоставления подвижности в геле ПЦР-фрагментов проб и положительного контроля ПЦР. Результаты анализа могут быть просканированы, математически обработаны и занесены в базу данных, хранящуюся в компьютере и/или. переданы в электронном виде заказчику, для которого проводился анализ, либо в более развитую электронную базу, в которой осуществляется сбор данных, анализ и выявление причин, вызывающих эпидемии у животных.
Примеры.
Данные примеры включают, но не ограничивают выбор значений параметров, характеризующих объемы, время проведения и температуры проведения операций с образцами при выделении ДНК из исследуемого материала и на этапе проведения электрофореза.
Пример 1. Выделение ДНК из исследуемого материала.
В промаркированные пробирки добавляют по 400 мкл лизирующего буфера и 5 мкл положительного контрольного образца. Затем, отдельными наконечниками с антиаэрозольными фильтрами в каждую пробирку добавляют по 100 мкл исследуемого материала, в пробирку отрицательного контроля выделения добавляют 100 мкл деионизованой воды. Перемешивают и инкубируют при 65°С в течение 5 минут. Если выделение ДНК проводят из твердого сухого материала, то термостатируют 30 минут.
После этого пробирки центрифугируют в течение 20 сек при 10 тыс.об/мин в том случае, если смесь содержит нерастворимый осадок. Аккуратно, не задевая осадок, переносят надосадочные жидкости в чистые промаркированные микропробирки. Отдельными наконечниками с антиаэрозольными фильтрами в каждую пробирку добавляют 20 мкл сорбента (непосредственно перед добавлением тщательно перемешать на вортексе содержимое флакона с сорбентом до гомогенного состояния). Пробирки помещают на ротатор и инкубируют при 10-20 об/мин при комнатной температуре в течение 10 мин. После этого пробирки центрифугируют в течение 20 сек при 10 тыс.об/мин. Аккуратно, не задевая осадок, максимально полно удаляют надосадочную жидкость с помощью водоструйного насоса или автоматической пипетки с одноразовыми наконечниками.
В каждую пробирку к осадку автоматической пипеткой с одноразовыми наконечниками добавляют по 750 мкл первого промывочного буфера, ресуспендируют осадок перемешиванием на вортексе в течение 30 сек. Затем центрифугируют в течение 20 сек при 10 тыс.об/мин. Не задевая осадок, удаляют надосадочную жидкость с помощью водоструйного насоса или автоматической пипетки с одноразовыми наконечниками.
В каждую пробирку к осадку автоматической пипеткой с одноразовыми наконечниками добавляют по 750 мкл второй промывочный буфер, ресуспендируют осадок перемешиванием на вортексе в течение 30 сек. Затем центрифугируют в течение 20 сек при 10 тыс.об/мин. Не задевая осадок, удаляют надосадочную жидкость с помощью водоструйного насоса или автоматической пипетки с одноразовыми наконечниками. Повторяют данную операцию дважды.
Подсушивают осадки в термостате при 55°C в течение 5 минут. К осадкам автоматической пипеткой добавляют по 50-100 мкл буфера для элюции, перемешивают на вортексе и инкубируют при 55°C в течение 10 минут. Для более эффективной элюции ДНК встряхивают пробирку каждые 2 минуты. Пробирки центрифугируют в течение 2 мин при 10 тыс.об/мин. Аккуратно, не задевая осадок, переносят надосадочные жидкости в чистые промаркированные микропробирки. Хранят выделенные ДНК при температуре минус 20°C в течение года. Допустимо хранение при комнатной температуре (от 18 до 25°C) не более 24 ч, при температуре от 4 до 8°C - не более 7 дней. Полученную ДНК используют для проведения этапа ПЦР.
Пример 2. Мультипраймерная полимеразная цепная реакция.
Для каждого исследуемого образца проводят две независимых ПЦР-реакции. Первую с первым набором олигонуклеотидных праймеров, вторую со вторым набором олигонуклеотидных праймеров. Для этого приготовляют две ПЦР-смеси. Примеры приготовления первой и второй ПЦР-смесей для одной или десяти реакций приведены в таблице 2 и 3.
праймеров
Перед началом этапа ПЦР маркируют микропробирки по номерам образцов и номерам «ПЦР-смесей», микропробирки для положительных и отрицательных контролей ПЦР. Вносят в микропробирки по 2 капли масла для ПЦР (~20-25 мкл), а затем по 15 мкл соответствующей «ПЦР-смеси».
Дополнительно в пробирки, маркированные знаком «+1» и «+2», вносят по 4 мкл положительного контрольного образца. Положительный контрольный образец - смесь рекомбинантных плазмид, полученных на основе pUC18 и содержащих последовательность маркерных генов, входящих в группу Sus scrofa domesticus, Bos taurus taurus, Gallus gallus, Ovis aries, Meleagris gallopavo Jidus musculus domesticus, Rattus rattus, Canis lupus familiaris, Homo sapiens, Felis catus в концентрации 5 пг/мкл (или 1,5×106) молекул ДНК в 1 мкл. В пробирки для исследуемых проб вносят пипеткой отдельными наконечниками по 4 мкл ДНК исследуемого образца. В пробирки, маркированные знаком «-1» и «-2», вносят по 4 мкл отрицательного контрольного образца (добавляется последним). Отрицательный элемент контроля ПЦР выполнен на основе рекомбинантной плазмиды, выполненной на основе pUC18 и содержащей искусственную последовательность. Далее центрифугируют микропробирки 10 сек при 10 тыс.об/мин. для осаждения капель жидкости, при этом ПЦР-масло должно полностью покрыть ПЦР-смесь.
Подготовленные для проведения реакции пробирки переносят в ДНК-амплификатор, и запускают программу амплификации в соответствии с режимами, приведенными в таблице 3-1.
При необходимости после этой стадии пробу можно хранить при минус 20°C в течение 3-х месяцев.
Пример 3. Электрофорез продуктов ПЦР в ПААГ.
После окончания программы амплификации добавляют к каждой пробе 5 мкл 5х буфера для нанесения на гель, перемешивают на вортексе в течение 15 сек и осаждают капли со стенок пробирки центрифугированием при 10 тыс.об/мин. в течение 10 сек. Наносят 3 мкл каждой пробы в отдельную лунку ПААГ, подготовленного, как описано выше. На каждый гель должно быть нанесено 3 мкл пробы положительного контроля ПЦР, а также 3 мкл маркеров длин фрагментов ДНК.
Проводят электрофорез ДНК образцов в 0,5×ТБЭ-буфере при напряжении электрического поля 100 В. При достижении лидирующего красителя (бромфеноловый синий) нижней границы геля остановливают электрофорез. Проводят фотодокументирование результатов электрофореза и последующее сканирование и запись данных на электронный носитель.
Пример 4. Учет результатов.
Интерпретацию результатов проводят на основании сопоставления подвижности в геле ПЦР-фрагментов проб и положительного контроля ПЦР (размеры ПЦР-фрагментов приведены в таблицах 4 и 5).
Учет результатов анализа следует начинать с результатов амплификации положительных и отрицательных контролей (см. таблицу 6). Положительные контроли ПЦР содержат ПЦР-фрагменты всех анализируемых последовательностей и внутреннего контроля, отрицательные контроли выделения ДНК и ПЦР должны содержать фрагмент внутреннего контроля. При отсутствии внутреннего контроля анализ считается недействительным. Если в пробах отрицательных контролей кроме внутреннего контроля содержатся ПЦР-фрагменты, соответствующие каким-либо анализируемым последовательностям, это свидетельствует о контаминации растворов для пробоподготовки и/или ПЦР. В этом случае анализ считается недействительным. Третий комплект дополнительно содержит графический планшет со схемой электофоретического разделения продуктов ПЦР в 6% ПААГ.
Далее учитывают результаты амплификации ДНК исследуемых образцов с ПЦР смесью-1 и ПЦР-смесью-2 (см. таблицу 7).
Каждая проба должна содержать фрагмент внутреннего контроля. При отсутствии внутреннего контроля в пробе анализ считается недействительным.
Предлагаемое изобретение, включающее новый набор из 11 пар праймеров, позволяет расширить типы исследуемых ДНК и проводить одновременную диагностику 10 различных типов митохондриальных ДНК, что позволяет повысить надежность и эффективность проверки кормов на наличие белковых добавок.
Высокие чувствительность и специфичность диагностического теста обусловлены тем, что для идентификации митохондриальных ДНК объединены преимущества двух наиболее чувствительных и специфичных способов анализа генома: полимеразной цепной реакции (ПЦР), которая увеличивает концентрацию искомых последовательностей ДНК в миллион и более раз, и гель-электрофореза, который дает результаты, достаточные для достоверной и количественной детекции.
Диагностический тест упакован в контейнере, в котором, кроме первого, второго и третьего комплекта дополнительно введены наклейки с названием торговой марки и штрихкодом, в котором указан номер серии и дата выпуска диагностического теста.
Промышленная применимость
Диагностический тест обеспечивает выявление 102-103 копий митохондриальной ДНК каждого животного, а именно Bos taurus taurus, Sus scrofa domesticus, Ovis aries, Gallus gallus, Meleagris gallopavo, Canis lupus familiaris, Felis catus, Mus musculus domesticus, Rattus rattus и Homo sapiens в 1 мл пробы.
Литература
1. Reaney Scott et al. DETECTION ASSAY FOR MEAT AND BONE MEAL IN FEED. US Patent Application №20090170107 (July 2, 2009).
2. Sinha Sudhir K. et al. Assay for species sources. US Patent №7,582,452 (September 1, 2009).
3. Rothschild Max F. et al Genetic markers for improved meat characteristics in animals. US Patent Application №20040261138 (December 23, 2004).
4. Kusama Toyoko et al. Oligonucleotide sequences that identify species of animal. US Patent Application №20050233334 (October 20, 2005).
5. Cullor James et al. Detection of ruminant DNA via PCR. US Patent Application №20050260618 (November 24, 2005).
6. PAVEL KRCMAR AND EVA RENCOVA Identification of Species-Specific DNA in Feedstuffs J. Agric. FoodChem. 51, 7655-7658 (2003).
7. Bellagamba F. et al. Application of Quantitative Real-Time PCR in the Detection of Prion-Protein Gene Species-Specific DNA Sequences in Animal Meals and Feedstuffs Journal of Food Protection. Volume 69, Number 4, pp.891-896 (6) (April 2006).
8. Комарова И.Н. Количественная оценка содержания компонентов животного происхождения в составе мясного сырья и готовой продукции с использованием метода конкурентной ПЦР. Материалы Третьего Московского международного конгресса "Биотехнология: состояние и перспективы развития", г. Москва (14-18 марта 2005).
9. Наборы реагентов для выявления и идентификации тканей животного происхождения. Техническое описание фирмы ООО "Компания Биоком" (2009) .
10. ГОСТ Р 52723-2007 Продукты пищевые и корма. Экспресс-метод определения сырьевого состава (молекулярный) (28.05.2007).
| название | год | авторы | номер документа |
|---|---|---|---|
| НАБОР ОЛИГОНУКЛЕОТИДОВ ДЛЯ ПОЛУКОЛИЧЕСТВЕННОЙ ОЦЕНКИ СОДЕРЖАНИЯ ДНК КУРИЦЫ В МЯСНОЙ ПРОДУКЦИИ МЕТОДОМ ПЦР В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2021 |
|
RU2769226C1 |
| Тест-система для идентификации видовой принадлежности баранины и говядины в продовольственном сырье, кормах и пищевых продуктах | 2018 |
|
RU2702858C1 |
| Способ определения видовой принадлежности тканей кур и свиней в продовольственном сырье, кормах и пищевых продуктах | 2018 |
|
RU2700479C1 |
| Тест-система для определения видовой принадлежности тканей кур и свиней в продовольственном сырье, кормах и пищевых продуктах | 2018 |
|
RU2700480C1 |
| НАБОР ДИФФЕРЕНЦИРУЮЩИХ И СПЕЦИФИЧЕСКИХ ОЛИГОНУКЛЕОТИДОВ ДЛЯ ИДЕНТИФИКАЦИИ ДНК ВОЗБУДИТЕЛЕЙ ОСТРЫХ КИШЕЧНЫХ ИНФЕКЦИЙ, СПОСОБ ИДЕНТИФИКАЦИИ ОКИ, МИКРОЧИП И ДИАГНОСТИЧЕСКАЯ СИСТЕМА ДЛЯ ОСУЩЕСТВЛЕНИЯ СПОСОБА | 2010 |
|
RU2509804C2 |
| Набор олигонуклеотидных праймеров и зондов и способ выявления пестивируса Н крупного рогатого скота | 2019 |
|
RU2728342C1 |
| Набор синтетических олигонуклеотидов для выявления ДНК представителей семейства Оленевые | 2018 |
|
RU2722758C1 |
| Лабораторный способ определения пола птиц по экспрессии гена Ribocomal Protein S6 | 2022 |
|
RU2804073C1 |
| РЕКОМБИНАНТНЫЕ АТТЕНУИРОВАННЫЕ МИКРООРГАНИЗМЫ CLOSTRIDIUM И ВАКЦИНА | 2007 |
|
RU2445364C2 |
| Способ установления половой принадлежности, оценки степени деградации ядерной и митохондриальной ДНК и наличия ингибиторов ПЦР с помощью фрагментного анализа | 2023 |
|
RU2826717C1 |


Изобретение относится к области биотехнологии и представляет собой набор олигонуклеотидных праймеров для идентификации ДНК животных, входящих в группу: свинья, бык, курица, овца, индейка, мышь, крыса, собака, кошка, и ДНК человека в сухих или консервированных кормах для животных и в сырых или подвергшихся кулинарной обработке мясных продуктах. Набор содержит первую и вторую композиции праймеров для идентификации митохондриальной ДНК, которые обеспечивают возможность одновременного проведения в одинаковых температурных режимах двух мультипраймерных реакций амплификации методом ПЦР с повышенной специфичностью к выявляемым митохондриальным ДНК. Для проведения мультипраймерных реакций ПЦР используют соответственно первую и вторую композиции праймеров, где в первую композицию входят праймеры, входящие в группу SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 21, а во вторую композицию входят праймеры, входящие в группу SEQ ID NO: 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21. 4 ил., 8 табл., 4 пр.
Набор олигонуклеотидных праймеров для идентификации ДНК животных, входящих в группу: свинья, бык, курица, овца, индейка, мышь, крыса, собака, кошка, и ДНК человека в сухих или консервированных кормах для животных и в сырых или подвергшихся кулинарной обработке мясных продуктах, где набор содержит первую и вторую композиции праймеров для идентификации митохондриальной ДНК, которые обеспечивают возможность одновременного проведения в одинаковых температурных режимах двух мультипраймерных реакций амплификации методом ПЦР с повышенной специфичностью к выявляемым митохондриальным ДНК, при этом для проведения мультипраймерных реакций ПЦР используют соответственно первую и вторую композиции праймеров, где в первую композицию входят праймеры, входящие в группу SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 21, а во вторую композицию входят праймеры, входящие в группу SEQ ID NO: 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21.
| Пильный диск для джина | 1937 |
|
SU52723A1 |
| KALENDAR R | |||
| et al., Java web tools for PCR, in silico PCR, and oligonucleotide assembly and analysis, Genomics, 2011 Aug; 98(2):137-44 | |||
| СИНТЕТИЧЕСКИЕ ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ И СПОСОБ ВЫЯВЛЕНИЯ ДНК ВИРУСА ИНФЕКЦИОННОГО РИНОТРАХЕИТА КРУПНОГО РОГАТОГО СКОТА С ПОМОЩЬЮ СПЕЦИФИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ В ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ (ПЦР) | 2003 |
|
RU2259398C1 |
| ГЕНЫ CORYNEBACTERIUM GLUTAMICUM, КОДИРУЮЩИЕ БЕЛКИ, УЧАСТВУЮЩИЕ В МЕТАБОЛИЗМЕ УГЛЕРОДА И ПРОДУЦИРОВАНИИ ЭНЕРГИИ | 2005 |
|
RU2321634C2 |
Авторы
Даты
2015-08-20—Публикация
2011-05-12—Подача