[0001] Данное изобретение относится к антителам (например, моноклональным антителам), фрагментам антител и их производным, которые специфически связывают TLR3, и которые факультативно, дополнительно модулируют, например, ингибируют, передачу сигнала. Изобретение также относится к клеткам, продуцирующим такие антитела; способам создания таких антител;
фрагментам, вариантам и производным антител; фармацевтическим композициям, содержащим их; способам применения антител для диагностики, лечения или профилактики заболеваний, например, аутоиммунных заболеваний, воспалительных заболеваний и подобных.
Предпосылки изобретения
[0002] Toll-белки дрозофилы контролируют дорсально-вентральное структурирование и считается, что они представляют древний механизм хозяйской защиты. У людей TLR считаются важным компонентом врожденного иммунитета. Последовательности Toll белков человека и дрозофилы показывают гомологию по всей длине белковых цепей. Семейство Toll-подобных рецепторов человека состоит из десяти высоко консервативных рецепторных белков, TLR1-TLR10. Подобно toll дрозофилы, TLR человека представляют собой I тип трансмембранных белков с внеклеточным доменом, состоящим из домена богатых лейцином повторностей (повторов) (LRR), которые распознают патоген-ассоциированные молекулярные паттерны (ПАМП, или РАМР), и цитоплазматический домен, который является гомологичным с цитоплазматическим доменом рецептора интерлейкина-1 (IL-1) человека. Подобно путям передачи сигнала как для toll дрозофилы, так и для IL-1 рецептора, Toll-подобные рецепторы человека передают сигнал через NF-кВ путь.
[0003] Хотя различные TLR млекопитающих имеют многие общие характеристики и механизмы передачи сигнала, их биологические функции являются весьма различными. Это возникает вследствие, частично, того факта, что четыре различные адапторные молекулы (MyD88, TIRAP, TRIF и TRAF) связываются в различных комбинациях с TLR и опосредуют различные пути передачи сигнала. Более того, различные лиганды для одного TLR могут предпочтительно активировать различные пути передачи сигнала. Более того, TLR дифференциально экспрессируются в различных гематопоэтических и не гематопоэтических клетках. Соответственно, ответ на TLR лиганд зависит не только от сигнального пути, активируемого с помощью TLR, но также от природы клеток, в которых экспрессируется отдельный TLR.
[0004] Toll-подобный рецептор 3 (TLR3) получил существенное внимание как терапевтическая мишень, так как TLR3 передача сигнала была вовлечена в воспалительные и аутоиммунные состояния. Патентная заявка W098/50547 обеспечивает последовательность нуклеиновой кислоты и аминокислотную последовательность hTLR3 белка. LeBouteiller et al. (2005) J. Biol. Chem. 280(46): 38133-38145) раскрывают применение bhth-tlrj антитела для связывания с TLR3 клеточной поверхности. Установлено, что антитело С1130 является активаторным по отношению к TLR3, и оно было описано в WO 2007/051164. Поликлональные антитела, которые ингибировали TLR3, были описаны в Cavassani et al. (2008) J. Exp.Med. 205: 2609-2621. WO 03/106499 и Matsumoto et al. (2003) J. Immunol. 171:3154-3162 описывает антитело, соответствующее клону антитела TLR3.7 (eBioScience Inc., San Diego), которое, как сообщалось, связывает и ингибирует TLR3 клеточной поверхности, но не TLR3 клеточного компартмента или в ДК (дендритная клетка) миелоидной линии. WO 06/060513 описывает антитело С 1068, которое, как сообщается, ингибирует цитокиновую продукцию в эпителиальных клетках, которые, как сообщается, экспрессируют TLR3 на клеточной поверхности. С 1068, как установлено, конкурируют с антителом TLR3.7 за связывание с TLR3 (смотри W02010/051470). РСТ патентная заявка W02010/051470 обеспечивает анти-TLR3 антитела. Такие антитела, как установлено, блокируют дсРНК и, как предполагают, предотвращают связывание дсРНК с TLR3. Другие анти-TLR3 антитела для использования в исследовании включают поликлональные aHTH-TLR3 антитела от R&D Systems Corp., антитело 40С1285 от Abeam и антитела 619F7, 713Е4, 716G10, IMG-5631 и -IMG-5348, все от Imgenex. Corp.
[0005] Тем не менее, несмотря на то, что к настоящему времени были созданы определенные aHTH-TLR3 антитела, эти антитела были предназначены, в общем, только для исследования, а не для терапевтического применения. Как дополнительно описано в данном документе, настоящее раскрытие показывает, что среди доступных в настоящее время aHTH-TLR3 антител, в то время как они могут быть пригодны в некоторых экспериментальных постановках для проведения экспериментальных наблюдений, они не являются оптимально пригодными для применения в качестве терапевтических агентов, например, для модулирования TLR3. Следовательно, существует необходимость обеспечить улучшенные антитела, направленные на TLR3.
Краткое описание изобретения
[0006] В одном аспекте данное изобретение обеспечивает новые композиции, содержащие, и способы применения моноклональных антител, включая, но, не ограничиваясь, фрагментами антител, и производными, которые специфически связывают TLR3 человека. В одном аспекте антитела ингибируют TLR3 передачу сигнала без блокирования связывания TLR3 лиганда с TLR3 полипептидом. В одном аспекте антитела связывают TLR3 человека в кислых условиях, и, в частности, в условиях, типичных для тех, которые встречаются в подкисленном субклеточном компартменте клетки (например, компартментах эндоцитозного пути: эндосомном, лизосомальном). Такие кислые условия, в общем, характеризуются рН ниже чем около рН 6,5, или от около рН 4,5 до 6,5, или около рН 5,6.
[0007] В одном аспекте любого из вариантов осуществления, описанных в данном документе, антитела модулируют, факультативно ингибируют, TLR3 передачу сигнала в подкисленном субклеточном компартменте клетки (например, компартментах эндоцитозного пути: эндосомном, лизосомальном).
[0008] В одном аспекте любого из вариантов осуществления, описанных в данном документе, антитела модулируют, факультативно ингибируют, TLR3 передачу сигнала в дендритной клетке (ДК, или DC) (например, миелоидной ДК, ДК моноцитарного происхождения).
[0009] В одном аспекте любого из вариантов осуществления, описанных в данном документе, антитела могут факультативно, быть охарактеризованы как не имеющее, в основном, более низкую аффинность для связывания TLR3 человека в кислых условиях, чем в нейтральных условиях, например, где KD для связывания с TLR3 снижается на не более чем 0,2-, 0,3-, -0,4, 0,5-, 1,0-, или 1,5-log10. Нейтральные условия, в общем, характеризуются рН от 6,6 до 7,4, например, слегка щелочным рН, равным 7,2, обнаруженным в клеточном цитозоле. Факультативно, антитела не имеют, в основном, разную (более низкую или более высокую) аффинность для связывания TLR3 человека в кислых условиях, чем в нейтральных условиях, например, где KD для связывания с TLR3 в нейтральных и кислых условиях отличается на не более чем 0,2-, 0,3-, 0,4-, 0,5-, 1,0-, или 1,5- log10.
[0010] В других аспектах любого из вариантов осуществления, описанных в данном документе, аффинность бивалентного связывания антител для TLR3 в кислых условиях может факультативно, характеризоваться средним KD которое
составляет не более чем около (т.е. лучшая аффинность чем) 100, 50, 10, 5 или 1 наномолярный, предпочтительно суб-наномолярный или факультативно, не более чем около 300, 200, 100 или 10 пикомолярный.
[0011] В других аспектах любого из вариантов осуществления, описанных в данном документе, антитела ингибируют TLR3 передачу сигнала без блокирования связывания TLR3 лиганда с TLR3 полипептидом. TLR3 лиганд будет, в общем, лигандом, отличным от анти-TLR3 антитела и может быть встречающимся в природе или не встречающимся в природе TLR3 лигандом, факультативно, лигандом на базе дсРНК, таким как полиAU (полиадениловая кислота:полиуридиловая кислота) или поли IC (полиинозиновая кислота:полицитидиловая кислота). В частности, авторы изобретения установили, что антитела согласно данному изобретению способны ингибировать TLR3 передачу сигнала даже когда TLR3 лиганд, такой как дсРНК уже связался с TLR3 полипептидом. Антитела согласно данному изобретению также способны ингибировать TLR3 передачу сигнала даже в предактивированном состоянии, например, в присутствии IFNa. Антитела согласно данному изобретению, как полагают, являются эффективными для лечения пациента, имеющего установленное аутоиммунное заболевание, например, встречающийся в природе TLR3 лиганд, такой как дсРНК и/или присутствие, и в частности, высоких уровней, IFNa в больных клетках.
Антитела будут также иметь преимущество в связывании TLR3, даже если сайт связывания TLR3 лиганда занят дсРНК молекулой, таким образом, потенциально делая возможным более широкое полное связывание.
[0012] Данное раскрытие показывает, что антитела, которые связывают TLR3 человека в кислых условиях, имеют сильную способность модулировать, в частности, ингибировать, TLR3 передачу сигнала в клетках (миелоидных дендритных клетках (MdDC); дендритные клетки моноцитарного происхождения (MoDC)), которые экспрессируют TLR3 исключительно или в первую очередь в их цитоплазматических компартментах, и в первую очередь в компартментах эндоцитозного пути (например, эндосомах). Антитела связываются с областью в TLR3, которая не вовлечена в связывание с дсРНК, и антитела не предотвращают дсРНК от связывания с TLR3 в кислых условиях. Композиции и способы пригодны для множества применений, и особенно хорошо пригодны для модулирования TLR3 передачи сигнала (например, in vivo), где цитозольный (например, локализованный в компартменте эндоцитозного пути) TLR3 является мишенью. Модулирование передачи сигнала цитозольного TLR3 может быть пригодно для лечения или профилактики заболевания, для которого модуляция TLR3 передачи сигнала в ДК или других клетках, которые экспрессируют TLR3 в кислых цитозольных компартментах (например, в эндосомах) является преимущественной. Например, ингибирование TLR3 передачи сигнала в ДК (например, как наблюдается при ингибировании цитокиновой продукции с помощью ДК) может быть полезным в лечении или профилактике воспалительных или аутоиммунных нарушений, поскольку ДК имеют хорошо документально подтвержденную способность поглощать антигены из апоптических или некротических клеток (Albert et al (2004) Nat. Rev. Immunol. 4: 223-231), включая таковые в ходе некроза ткани в процессе острого воспаления (Cavassani et al. (2008). Факультативно, антитела ингибируют TLR3 передачу сигнала, например, ингибируют цитокиновую продукцию (например, IP 10), индуцированную стимуляцией TLR3 рецептора с помощью TLR3 лиганда.
[0013] Эндосомы и лизосомы представляют собой связанные с мембраной компартменты внутри клеток, которые образуют часть эндоцитозного пути и обычно являются кислотными из-за действия протонного насоса АТРазы эндосомальной мембраны. Наиболее ранние измерения in situ лизосомального рН обнаружили рН 4,7-4,8 в макрофагах; рН эндосом фибробластов, вовлеченных в рецептор-опосредованный эндоцитоз, как определили, составляет около 5,5. Более ранние исследования TLR3 определили его как экспрессированного в цитозоле в дендритные клетки моноцитарного происхождения и что он, вероятно, связывает его лиганд в субклеточных компартментах эндоцитозного пути (Matsumoto et al. (2003) J. Immunol. 171:3154-3162). Сообщалось, что TLR3 экспрессируется в эндосомном компартменте клеток в дендритных клетках, астроцитах, макрофагах, Т клетках, эпителиальных клетках, фибробластах и гепатоцитах, хотя TLR3 был обнаружен на клеточной поверхности, в частности, на эпителиальных клетках, и также на макрофагах в некоторых случаях воспаления (Cavassani et al. 2008, выше). Эндосомальное закисление, как было показано, играет роль в TLR3 передаче сигнала, так как обработка хлорохином, ингибитором эндосомального закисления, ингибирует TLR3 передачу сигнала в ДК. Антитела, приведенные в данном документе, которые связывают TLR3 в кислых условиях, соответствующих подкисленному эндосомному компартменту (например, рН около 5,6, или менее чем около 6,5), имеют преимущество в том, что обеспечивают эффективную высокую аффинность связывания с TLR3, и факультативно, дополнительно модуляцию TLR3 в эндосомных компартментах по сравнению с антителами, которые теряют свою аффинность в кислых условиях и, таким образом, могут больше проявлять свои эффекты на TLR3 клеточной поверхности. Антитела, которые приведены для примера, имеют сильную ингибиторную активность на TLR3 в ДК, которые известны для экспрессирующих TLR3 первично в цитосомальных компартментах.
[0014] В одном варианте осуществления данное изобретение обеспечивает моноклональные антитела, которые специфически связывают TLR3 человека и ингибируют TLR3 передачу сигнала, например, ингибируют цитокиновую продукцию, индуцированную стимуляцией TLR3 рецептора с помощью TLR3 лиганда, без блокирования связывания лиганда TLR3 (например, натурального или синтетического лиганда TLR3, основанного на нуклеиновой кислоте лиганда, дсРНК, вирусной дсРНК, полиIC, полиAU) с TLR3 полипептидом. Когда TLR3 полипептиды связаны такими антителами, дсРНК может еще связывать TLR3 полипептиды, снижая дсРНК, доступную для связывания с оставшимся не связанным с антителом TLR3 и/или другими дсРНК рецепторами (т.е. RIG-I, MDA-5, TLR7 и т.д.), тем самым потенциально снижая нежелательные побочные эффекты, такие как повышенная токсичность, неадекватная активация каскада передачи сигнала и так далее, и полученные состояния, например, хроническое воспаление, которое возникает из дсРНК индуцированной передачи сигнала. Такие композиции антител и способы пригодны в многочисленных применениях, особенно для лечения или профилактики заболевания, связанного с TLR3 передачей сигнала, и в виду их механизма действия, антитела по данному изобретению могут быть использованы для включения или ингибирования TLR3 полипептидов. Факультативно, антитело может быть охарактеризовано как не явно снижающее связывание лиганда двухцепочечной РНК TLR3 с TLR3 полипептидом. Антитело может или также может не быть способным к связыванию с высокой аффинностью с TLR3 человека в кислых условиях, например, в условиях, типичных для тех, которые встречаются в подкисленном эндосомном компартменте. В одном варианте осуществления, где ищут антитело, которое может ингибировать передачу сигнала с помощью TLR3, оно будет предпочтительным в том, что антитело, которое специфически связывает TLR3 и ингибирует TLR3 передачу сигнала без блокирования связывания лиганда двухцепочечной РНК TLR3 с TLR3 полипептидом, может дополнительно быть способным к связыванию и ингибированию TLR3 человека в кислых условиях, как описано в данном документе, и, в частности, в условиях, типичных для тех, которые встречаются в подкисленном эндосомном компартменте клетки.
[0015] В одном аспекте любого из вариантов осуществления данного изобретения антитело конкурирует за связывание с TLR3 полипептидом с любым одним или любой комбинацией моноклональных антител 31C3, 29Н3, 23С8, 28F11 или 34А3, факультативно, в кислых и/или нейтральных условиях. В одном варианте осуществления антитело по данному изобретению конкурирует за связывание с TLR3 полипептидом, факультативно, в кислых и/или нейтральных условиях, с антителом, выбранным из группы, содержащей следующее:
(a) антитело, имеющее соответственно VH и VL область SEQ ID NOS 2 и 3 (31C3).
(b) антитело, имеющее соответственно а VH и VL область SEQ ID NOS 10 и 11 (29Н3),
(c) антитело, имеющее соответственно VH и VL область SEQ ID NOS 18 и 19 (28F11),
(d) антитело, имеющее соответственно VH и VL область SEQ ID NOS 26 и 27 (23С8) и
(e) антитело, имеющее соответственно VH и VL область SEQ ID NOS 34 и 35 (34А3).
[0016] В одном варианте осуществления антитело конкурирует за связывание с TLR3 полипептидом с антителами 31C3 и 29Н3; в одном варианте осуществления антитело конкурирует за связывание с TLR3 полипептидом с антителами 31C3 и 23С8; в одном варианте осуществления антитело конкурирует за связывание с TLR3 полипептидом с антителами 31C3 и 28F11; в одном варианте осуществления антитело конкурирует за связывание с TLR3 полипептидом с антителами 31C3 и 34А3. В одном варианте осуществления антитело конкурирует за связывание с TLR3 полипептидом с антителами 29Н3 и 23С8; в одном варианте осуществления антитело конкурирует за связывание с TLR3 полипептидом с антителами 29Н3 и 28F11; в одном варианте осуществления антитело конкурирует за связывание с TLR3 полипептидом с антителами 29Н3 и 34А3. В одном варианте осуществления антитело конкурирует за связывание с TLR3 полипептидом с антителами 23С8 и 28F11; в одном варианте осуществления антитело конкурирует за связывание с TLR3 полипептидом с антителами 23С8 и 34А3. В одном варианте осуществления антитело конкурирует за связывание с TLR3 полипептидом с антителами 28F11 и 34А3.
[0017] В одном варианте осуществления антитело данного изобретения содержит легкую цепь, содержащую следующее:
(a) аминокислотную последовательность CDR1 легкой цепи (LCDR1), выбранную из SEQ ID NOS:61, 64 и 65;
(b) аминокислотную последовательность CDR2 легкой цепи (LCDR2), выбранную из SEQ ID NOS:62, 66 и 67; и/или
(c) аминокислотную последовательность CDR3 легкой цепи (LCDR3), выбранную из SEQ ID NOS:63, 68, 69 и 70.
[0018] В одном варианте осуществления антитело данного изобретения содержит тяжелую цепь, содержащую следующее:
(a) аминокислотную последовательность CDR1 тяжелой цепи (HCDR1), выбранную из SEQ ID NOS:71-76;
(b) аминокислотную последовательность CDR2 тяжелой цепи (HCDR2), выбранную из SEQ ID NOS:77-81; и/или
(c) аминокислотную последовательность CDR3 тяжелой цепи (HCDR3), выбранную из SEQ ID NOS:82-85.
[0019] В одном варианте осуществления антитело данного изобретения выбрано из группы, содержащей следующее:
(a) антитело, имеющее (i) аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:4, 5 и 6, и (ii) аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:7, 8 и 9, соответственно;
(b) антитело, имеющее (i) аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:12, 13 и 14, и (ii) аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:15, 16 и 17, соответственно;
(c) антитело, имеющее (i) аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:20, 21 и 22, и (ii) аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3) как показано в SEQ ID NO:23, 24 и 25, соответственно;
(d) антитело, имеющее (i) аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2, HCDR3) как показано в SEQ ID NO:28, 29 и 30, и (ii) аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:31, 32 и 33, соответственно; и
(e) антитело, имеющее (i) аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:36, 37 и 38, и (ii) аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:39, 40 и 41, соответственно; факультативно, где одна, две, три или более аминокислот в любой из указанных последовательностей могут быть замещены другой аминокислотой.
[0020] В одном варианте осуществления данного изобретения антитело связывается с таким же TLR3 эпитопом, как любое одно или любая комбинация моноклональных антител 31C3, 29Н3, 23С8, 28F11 или 34А3. В другом варианте осуществления антитело содержит антигенсвязывающую область антитела 31C3. В другом варианте осуществления антитело содержит антигенсвязывающую область антитела 29Н3. В другом варианте осуществления антитело содержит антигенсвязывающую область антитела 23С8. В другом варианте осуществления антитело содержит антигенсвязывающую область антитела 28F11. В другом варианте осуществления антитело содержит антигенсвязывающую область антитела 34А3. В другом варианте осуществления антитело содержит легкую цепь, содержащую одну, две или все три CDR последовательности вариабельной области легкой цепи 31C3, 29Н3, 23С8, 28F11 или 34А3, и/или тяжелую цепь, содержащую одну, две или все три CDR последовательности вариабельной области тяжелой цепи 31C3, 29Н3, 23С8, 28F11 или 34А3. В другом варианте осуществления антитело представляет собой 31C3, 29Н3, 23С8, 28F11 или 34А3, или его фрагмент, или производное, факультативно, слитое с Fc областью человека. Антитела 29Н3.7 и 31С3.1 были депонированы в Национальной коллекции культур микроорганизмов (Collection Nationale de Culture de Microorganismes) (CNCM), Институт Пастера, 25 rue de Docteur Roux, F-75724 Париж 3 июля 2009, под номером CNCM 1-4187 и CNCM 1-4186, соответственно. Антигенсвязывающие области антител 31C3, 29Н3, 23С8, 28F11 или 34А3 также раскрыты в SEQ ID NOS 2-41.
[0021] В одном аспекте данного изобретения легкая цепь одного антитела, согласно данному изобретению, получают из или кодируют с помощью последовательности нуклеиновой кислоты, полученной из реаранжировки генов VL, выбранной из VK 19-14, VK aq4, VK 12-41 и VK 12-44 для V гена, и JK2 для J гена.
[0022] В одном аспекте данного изобретения тяжелая цепь одного антитела, согласно данному изобретению, получают из или кодируют с помощью последовательности нуклеиновой кислоты, полученной из реаранжировка генов VH, выбранной из VH36-60.al.85, VH L558.1 и VH J558.2 для V гена, и JH4 или JH2 для J гена.
[0023] В другом аспекте данного изобретения антитело имеет одну или более CDR последовательности, выбранной из группы, содержащей SEQ ID NOS:4-9, 12-17, 20-25, 28-33, 36-41, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой.
[0024] В другом аспекте данное изобретение представляет антитело, которое специфически связывает TLR3, где антитело имеет одно или более из следующих свойств:
а. имеет субнаномолярную аффинность к TLR3 полипептида при кислом рН, например, рН менее чем около 6,5, или от около 4,5 до 6,5 или около рН 5,6; или
b. способно ингибировать TLR3 передачу сигнала в присутствии TLR3 лиганда; или
с.способно ингибировать TLR3 передачу сигнала в воспалительном окружении, например, в присутствии воспалительных цитокинов, таких как IFNa; или
d. конкурирует за связывание с TLR3 полипептидом с 31C3, 29Н3, 28Р11, 23С8 или 34А3;
е. не конкурирует с дсРНК за связывание с TLR3 полипептидом.
[0025] В одном варианте осуществления антитело имеет вышеперечисленные свойства (а) и (b); (а), (b) и (с); (а), (b), (с) и (d); или (а), (b), (с), (d) и (е). В одном варианте осуществления антитело имеет свойства (а) и (с); (а), (с) и (d); или (а), (с), (d) и (е). В одном варианте осуществления антитело имеет свойства (а) и (d);
(а) и (е); или (а), (d) и (е). В одном варианте осуществления антитело имеет свойства (b) и (с); (b), (с) и (d); или (b), (с), (d) и (е). В одном варианте осуществления антитело имеет свойства (b) и (d); (b) и (е); или (b), (d) и (е). В одном варианте осуществления антитело имеет свойства (с) и (d); (с) и (е); или (с), (d) и (е). В одном варианте осуществления антитело имеет свойства (d) и (е). В другом варианте осуществления антитело дополнительно имеет любое из свойств aHTH-TLR3 антител, описанных в данном документе.
[0026] В другом варианте осуществления антитело любого из вариантов осуществления, описанных в данном документе, способно быть интенализированным клеткой, которая экспрессирует TLR3 полипептид на ее поверхности.
[0027] В варианте осуществления любого аспекта данного изобретения аминокислотные последовательности, перечисленные в SEQ IDs, содержат одну, две, три или более аминокислотных замен. В другом варианте осуществления в любом варианте осуществления данного изобретения вариант осуществления может включать аминокислотную последовательность, которая может иметь, по меньшей мере, 95%, 97%, 98% или 99% идентичность с аминокислотной последовательностью в конкретном SEQ ID NO.
[0028] В другом варианте осуществления данное изобретение представляет моноклональное анти-TLR3 антитело, которое имеет такую же эпитопную специфичность, как антитело, выбранное из группы, содержащей 31C3, 29Н3, 28F11, 23С8 и 34А3.
[0029] В одном варианте осуществления антитело является химерным, например, содержит немышиную, факультативно, константную область человека. В одном варианте осуществления антитело является антителом человека или гуманизировано. В другом варианте осуществления антитело является антителом мыши. В другом варианте осуществления антитело, в основном, не связывается с другими TLR человека (например, TLR4).
[0030] В одном аспекте любого из вариантов осуществления данного изобретения изотип антитела представляет собой IgG, факультативно, IgGI или IgG3. В одном варианте осуществления антитело содержит Fc домен или является изотипом, который связывается с помощью FcyR.
[0031] В одном аспекте любого из вариантов осуществления данного изобретения антитело представляет собой фрагмент антитела, выбранный из: Fab, Fab', Fab'-SH, F(ab')2, Fv, диател, одноцепочечного фрагмента антитела или мультиспецифичного антитела, содержащего множественные различные фрагменты антител. В одном аспекте любого из вариантов осуществления данного изобретения антитело не содержит Fc домен или принадлежит к изотипу, который, в основном, не связывается с помощью FcyR. В одном варианте осуществления антитело является IgG4 или IgG2 изотип.Как показано в Примерах, F(ab')2 фрагменты антител по данному изобретению сохраняли их способность к модулированию TLR3 передачи сигнала в ДК и были, таким образом, захвачены ДК, несмотря на то, что в них нет Fc домена. Как считалось, главным образом, ранее, антитела будут входить в эндосомальный путь в ДК, по меньшей мере, частично, с помощью Fc рецептор-опосредованного захвата (ДК человека экспрессируют несколько типов Fey рецепторов (FcyR), включая тип I (FcyRI, CD64) и тип II (FcyRII, CD32)). Открытие, что изотипы и конфигурации, которые не связывают FcyR, могут модулировать TLR3 в ДК, позволяет разработать антитела, которые сохраняют необходимые характеристики без риска индукции нежелательного истощения (например, посредством FcyR-опосредованной зависимой от антитела клеточной цитотоксичности) TLR3-экспрессирующих клеток. Например, изотипы IgG4 или другие изотипы IgG, модифицированные для снижения их FcyR связывания, могут быть использованы за их преимущественные фармакологические свойства, такие как время полужизни в сыворотке, при модулировании TLR3 передачи сигнала, например, в ДК, без индукции смерти клетки. В одном аспекте любого из вариантов осуществления данного изобретения анти-TLR3 антитело ингибирует TLR3 передачу сигнала и содержит константную область изотипа IgG4 или IgG2. В одном аспекте любого из вариантов осуществления данного изобретения анти-TLR3 антитело ингибирует TLR3 передачу сигнала и содержит константную область, которая, в основном, не связывает FcyR.
[0032] В другом варианте осуществления антитело конъюгировано или ковалентно связано с детектируемым или токсическим веществом.
[0033] В другом аспекте данное изобретение обеспечивает клетку, например, гибридому или рекомбинантную клетку-хозяина, продуцирующую bhth-tlrj антитело по данному изобретению. В одном варианте осуществления клетка представляет собой клон 31C3, 29Н3, 23С8, 28F11 или 34А3. В родственном аспекте данное изобретение обеспечивает гибридому, содержащую следующее:
а) В клетка из млекопитающего-хозяина, не человека, которая была иммунизирована антигеном, который содержит TLR3 эпитоп, который специфически распознается 31C3, 29Н3, 23С8, 28F11 или 34А3 антителом, слитым с b) иммортализованной клеткой, где гибридома продуцирует моноклональное антитело,- которое специфически связывается с эпитопом. В одном варианте осуществления этих аспектов моноклональное антитело связывается с таким же эпитопом, как антитело 31C3, 29Н3, 23С8, 28F11 или 34А3. Факультативно, клетка продуцирует антитело, имеющее антигенсвязывающую область антитела 31C3, 29Н3, 23С8, 28F11 или 34А3.
[0034] В другом аспекте данное изобретение обеспечивает способ испытания антитела, где способ включает этапы испытания антитела для определения того:
a) ингибирует ли оно TLR3 передачу сигнала, факультативно, без блокирования связывания TLR3 лиганда (например, дсРНК) с TLR3 полипептидом, и/или
b) конкурирует ли оно за связывание с TLR3 полипептидом с антителом 31C3, 29Н3, 23С8, 28F11 или 34А3, и/или
c) связывается ли оно с TLR3 человека в кислых условиях, и, в частности, в условиях, типичных для тех, которые встречаются в подкисленном субклеточном компартменте клетки, например, около рН 5,6, между около рН 4,5 и около 6,5; факультативно, где аффинность к TLR3 в кислых условиях не является, в основном, отличающейся, например, пониженной, по сравнению со связыванием в нейтральных условиях.
[0035] Факультативно, способ содержит испытание антитела согласно подэтапам (а) и (b), подэтапам (а) и (с), подэтапам (b) и (с) или подэтапам (а), (b) и (с).
[0036] Факультативно, способ дополнительно включает этап выбора антитела если определено, что оно ингибирует TLR3 передачу сигнала, если определено, что оно конкурирует за связывание с TLR3 полипептидом с антителом 31C3, 29Н3, 23С8, 28F11 или 34А3, и/или если определено, для связывания TLR3 человека в кислых условиях и/или без снижения в аффинности по сравнению с нейтральными условиями. Факультативно, антитело далее испытывают на его способность модулировать, например, ингибировать, TLR3 передачу сигнала в дендритной клетке, и выбирали, если определено, что антитело модулирует TLR3 передачу сигнала в ДК. Факультативно, антитело, выбранное таким образом, выбирают для применения в лечении или профилактике заболевания (например, антитело, которое ингибирует TLR3 передачу сигнала будет использоваться в воспалительных и аутоиммунных нарушениях). Факультативно, количество антитела, выбранного таким образом, продуцируется (например, в рекомбинантной клетке-хозяине).
[0037] В другом аспекте данное изобретение обеспечивает способ продукции антитела, которое специфически связывается с TLR3 в субъекте-млекопитающем, особенно в субъекте-человеке, где указанный способ включает этапы создания множества антител (например, путем иммунизации млекопитающего, не человека, с помощью иммуногена, содержащего TLR3 полипептид); и выбор антитела из указанного множества, которое:
a) ингибирует TLR3 передачу сигнала, факультативно, без блокирования связывания TLR3 лиганда (например, дсРНК) с TLR3 полипептидом, и/или
b) конкурирует за связывание с TLR3 полипептидом с антителом 31C3, 29Н3, 23С8, 28F11 или 34А3, и/или
c) связывает TLR3 человека в кислых условиях, и, в частности, в условиях, типичных для тех, которые встречаются в подкисленном субклеточном компартменте клетки, например, около рН 5,6, от около рН 4,5 до около 6,5; факультативно, где аффинность к TLR3 в кислых условиях, в основном, не отличается, например, снижена, по сравнению со связыванием в нейтральных условиях.
[0038] Факультативно, способ включает выбор антитела согласно подэтапам (а) и (b), подэтапам (а) и (с), подэтапам (b) и (с) или подэтапам (а), (b) и (с).
Факультативно, способ дополнительно включает выбор антитела, которое имеет способность модулировать, например, ингибировать, TLR3 передачу сигнала в дендритной клетке, и выбирали, если определено, что антитело модулирует TLR3 передачу сигнала в ДК.
[0039] В другом аспекте данное изобретение обеспечивает способ испытания антитела, включающий: а) обеспечение испытуемого антитела; и b) оценивание, вызывает ли указанное испытуемое антитело снижение в экспрессии TLR3 на поверхности клеток, с) если указанное антитело не вызывает снижения в экспрессии TLR3 на поверхности клеток, то выбор указанного испытуемого антитела как кандидата для лечения заболевания (например, любого из заболеваний, раскрытых в данном документе).
[0040] В другом аспекте данное изобретение обеспечивает способ испытания антитела, включающий: а) обеспечение испытуемого антитела; b) оценивание аффинности связывания указанного испытуемого антитела в кислых условиях, например, при рН 5,6; и с) если указанное антитело имеет аффинность связывания в кислых условиях (например, субнаномолярную аффинность, нет существенного снижения в аффинности по сравнению с нейтральными условиями и т.п.), то выбор указанного испытуемого антитела как кандидата для лечения заболевания.
[0041] В другом аспекте данное изобретение обеспечивает способ испытания антитела, включающий: а) обеспечение испытуемого антитела; b) оценивание, способно ли указанное испытуемое антитело связывать TLR3 белок в присутствии TLR3 лиганда, например, дсРНК; и с) если указанное антитело способно связывать TLR3 белок в присутствии TLR3 лиганда, то выбор указанного испытуемого антитела как кандидата для лечения заболевания.
[0042] В другом аспекте данное изобретение обеспечивает способ выбора антитела, включающий: а) обеспечение испытуемого антитела; b) оценивание, способно ли указанное испытуемое антитело связывать TLR3 белок в присутствии воспалительных цитокинов, т.е. IFNa; и с) выбор указанного испытуемого антитела как кандидата для лечения заболевания.
[0043] В другом аспекте данное изобретение обеспечивает способ испытания антитела, включающий: а) обеспечение испытуемого антитела; b) оценивание, способно ли указанное испытуемое антитело быть интенализированным, например, с помощью TLR3-экспрессирующей клетки; и с) если указанное антитело способно быть интенализированным, предпочтительно, где антитело быстро интенализировано, например, в течение 2 часов, то выбор указанного испытуемого антитела как кандидата для лечения заболеваний. В одном варианте осуществления заболевание представляет собой воспалительное нарушение. В одном варианте осуществления заболевание представляет собой рак.
[0044] В одном варианте осуществления полученные антитела представляют собой моноклональные антитела. В другом варианте осуществления способ дополнительно включает этап, на котором оценивают способность указанных антител к специфическому связыванию с TLR3 полипептидами человека. В одном варианте осуществления оценивают способность антител связываться с другими членами семейства TLR. В другом варианте осуществления способ дополнительно включает этап создания фрагментов или производных выбранных моноклональных антител. В одном варианте осуществления фрагменты или производные выбраны из группы, содержащей следующее: Fab, Fab', Fab'-SH, F (ab') 2, Fv, диатела, одноцепочечный фрагмент антитела, мультиспецифичные антитела, содержащие множественные различные фрагменты антител, гуманизированные антитела и химерные антитела. В другом варианте осуществления млекопитающее, не человеком, представляет собой мышь.
[0045] В другом аспекте данное изобретение обеспечивает способ лечения или профилактики заболевания у пациента, включающий введение TLR3 антитела по данному изобретению пациенту. В другом варианте осуществления способ дополнительно включает этап введения пациенту соответствующего дополнительного терапевтического агента, например, особенно когда TLR3 антитело ингибирует TLR3 передачу сигнала, дополнительный агент может быть выбран из группы, содержащей следующее: иммуномодулирующие агенты, кортикостероиды, иммуносупрессоры, антибиотики, противовоспалительные агенты и подобное. Особенно когда TLR3 антитело интенализировано TLR3-экпрессирующей клеткой и/или связано с токсином или цитотоксическим лекарством для устранения TLR3-экспрессирующей клетки (например, раковой клетки), дополнительный агент может быть выбран из группы, содержащей: противораковый агент, цитотоксический агент и подобное. В одном аспекте данное изобретение представляет способ лечения или профилактики заболевания, выбранного из: аутоиммунное заболевание, воспаление, аллергия, астма, инфекции, остеопороз, цирроз и сепсис, рак или другие заболевания, предусмотренные в данном документе, включающий введение терапевтически эффективного количества ингибирующего TLR3 антитела пациенту, нуждающемуся в этом. Антитело вводят в течение времени, достаточного для лечения или профилактики указанного заболевания.
[0046] В одном варианте осуществления антитела данного изобретения могут быть использованы в диагностических исследованиях или более широко в любых исследованиях для обнаружения TLR3 полипептидов in vitro. В одном аспекте данное изобретение обеспечивает in vitro способ обнаружения TLR3 полипептида (например, в биологическом образце), включающий приведение TLR3 полипептида (например, клетки, экспрессирующей TLR3 полипептид, очищенного TLR3 полипептида, биологического образца и т.п.) в контакт с моноклональным антителом по данному изобретению и обнаружение связывания антитела с TLR3 полипептидом.
[0047] Эти и дополнительные преимущественные аспекты и признаки изобретения могут быть дополнительно описаны где-либо в данном документе.
Краткое описание графических материалов
[0048] Фигура 1 показывает ингибирование маркеров TLR3 активации на миелоидной ДК, Фигура 1А: уровень экспрессии CD86, Фигура 1 В: секреция IL-6, Фигура 1C: секреция IP-10. Все фигуры показывают, что по сравнению с контролем антитело 31C3 ингибирует TLR3 лиганд-индуцированный ответ.
[0049] Фигура 2 показывает ингибирование маркеров TLR3 активации на MdDC, Фигура 2А: уровень экспрессии CD86, Фигура 2 В: секреция IP-10. Все Фигуры показывают, что по сравнению с контролем антитело 29Н3 ингибирует TLR3 лиганд-индуцированный ответ.
[0050] Фигура 3 показывает ингибирование маркеров TLR3.активации на миелоидной ДК, сравнивая F(ab)'2 фрагменты антитела 31C3 с очищенными целыми 31C3 антителами (обозначенными "Pur"). Фигура 3А: уровень экспрессии CD86, Фигура 3 В: секреция IP-10. Фигуры показывают, что F(ab)'2 фрагменты антитела 31C3 ингибируют TLR3 лиганд-индуцированный ответ, а также очищенные целые 31C3 антитела.
[0051] Фигура 4 показывает ингибирование маркеров TLR3 активации на MdDC, сравнивая F(ab)'2 фрагменты антитела 29Н3 с очищенными целыми 29Н3 антителами (обозначенными "Pur"). Фигура 4А: уровень экспрессии CD86, Фигура 4 В: секреция IP-10. Фигуры показывают, что F(ab)'2 фрагменты антитела 29Н3 ингибируют TLR3 лиганд-индуцированный ответ так же, как и очищенные целые 29Н3 антитела.
[0052] Фигура 5 показывает сравнение аффинности связывания, что антитела согласно данному изобретению имеют более сильное связывание с TLR3 чипом, чем коммерчески доступные антитела.
[0053] Фигура 6 показывает связывание антител, согласно данному изобретению, на TLR3 чипе в присутствии или в отсутствие полиAU, лиганда к TLR3 рецепторам. Фигура показывает, что связывание антител по данному изобретению не блокирует связывание дсРНК с сайтом фиксации дсРНК TLR3.
[0054] Фигура 7 показывает, что присутствие 29Н3 на TLR3 чипе блокирует связывание 31C3 и наоборот.Эти результаты имеют тенденцию показывать, что оба антитела конкурируют за перекрывающийся эпитоп или эпитоп с высоким сходством.
[0055] Фигура 8 показывает молекулярные карты поверхности экстраклеточных доменов TLR3 белка человека, созданные с помощью компьютерного моделирования.
[0056] Фигура 9 показывает результаты анализа ингибирования TLR3 передачи сигнала в активности репортерного гена на основе люциферазы (293T-TLR3-ISRE), где кратность увеличения люциферазы определяли как функцию дозы полиAU. Кратко, дсРНК TLR3 агонисты использовали для индукции TLR3 передачи сигнала в репортерном анализе в присутствии анти-TLR3 антитела 31C3, и оценивали TLR3 передачу сигнала. Антитело 31C3 сильно ингибировало TLR3 передачу сигнала дозо-зависимым образом, по сравнению с контрольным aHTH-TLR3 антителом, не имеющим TLR3 ингибирующую активность.
[0057] Фигура 10А показывает дозо-зависимое ингибирование TLR3 передачи сигнала, используя 293T-TLR3 анализ люциферазы, с коммерческим TLR3.7 антителом (черные кружки), 28F11 (незакрашенные треугольники), 23С8 (незакрашенные квадраты) и 31C3 (черные квадраты) антитела, согласно данному изобретению, по сравнению с контролем (нет AT (антитело): незакрашенные кружки). Фигура 10В показывает такие же результаты в анализе, сравнивающем 31C3 (черные квадраты), 23С8 и 34А3 (черные треугольники) антитела.
[0058] Фигура 11 показывает эффект 31C3 (незакрашенные квадраты) или 23С8 (черные закрашенные квадраты) антиTLR3 антител в различных условиях по сравнению с отсутствием антитела (черные кружки). Секрецию IP-10 определяют в нг/мл на оси ординат, добавленную дозу дсРНК определяют в мкг/мл по оси абсцисс.Фигура НА представляет ингибирование TLR3 передачи сигнала, в стандартных условиях (нет предактивации). Фигура 11 В представляет ингибирование TLR3 передачи сигнала, с полиAU предстимуляцией. Фигура НС представляет ингибирование TLR3 передачи сигнала с IFNa предстимуляцией.
[0059] Фигура 12 показывает результаты кинетических анализов. Фигура 12А представляет секрецию IP-10 в нг/мл (в зависимости от доз полиAU) для 31C3 антитела. Фигура 12 В представляет результаты для 23С8 антитела. TLR3 MAT (моноклональное антитело) добавляют либо за 1 час 30 мин. до (черные крестики), вместе с (черный плюс "+"), либо через 1 час 30 мин. после (незакрашенные квадраты) дсРНК, дсРНК отдельно (черные кружки) обеспечивается как положительный контроль).
[0060] Фигура 13 показывает специфическое распознавание TLR3 человека с помощью 31C3 MAT в TLR3 экспрессирующих клетках, in vitro. Профиль гистограммы для внутриклеточного FACS (сортировка клеток с активацией флюоресценции) окрашивания 31С1 MAT показаны для НЕК 293Т контрольных клеток и 293Т клеток, трансфектированных с TLR3 человека. «Неокрашенный» представляет диапазон интенсивности флюоресценции, полученный с контрольным изотипом IgGI
[0061] Фигура 14 показывает ингибирование TLR3 -индуцированных маркеров активации и цитокиновой секреции на миелоидной ДК, Фигура 14А: секреция IP-10, Фигура 14 В: уровень экспрессии CD86. Все Фигуры показывают, что по сравнению с контролем антитело 31C3 (черные кружки), 28F11 (черные треугольники) и 23 С 8 (черные квадраты) (в данном документе показано в дозе 50 мкг/мл) ингибируют TLR3 лиганд-индуцированный ответ.
[0062] Фигура 15А и 15В показывают аффинность связывания антител, согласно данному изобретению. Фигура 15А показывает, что антитела согласно данному изобретению имеют более сильное связывание для TLR3 чипа, чем коммерчески доступные (т.е. TLR3.7) антитела. Фигура 15В показывает связывание антител, согласно данному изобретению, на TLR3 чипе, когда указанный чип был предварительно насыщен 31C3 антителом. Сравнение уровней связывания, как изложено на Фигурах 15А и 15В, подчеркивает, что антитела, согласно данному изобретению, имеют улучшенное связывание с hTLR3, когда чип был предварительно насыщен 31C3 антителом, в отличие от этого, коммерческое TLR3.7 антитело сохраняет такой же уровень связывания в присутствии или в отсутствие 31C3 антитела.
[0063] Фигура 16А и 16В показывают связывание 28F11, 34А3 и 23С8 антител, согласно данномум изобретению, на TLR3 чипе в присутствии или в отсутствие полиAU, лиганда к TLR3 рецепторам. Фигуры показывают, что связывание антител по данному изобретению не блокирует дсРНК связывание с сайтом фиксации дсРНК TLR3.
[0064] Фигура 17 показывает связывание 34А3 антитела, либо отдельно на rhTLR3 (полужирная линия) или на чипе, насыщенном 31C3 (пунктирная линия). Фигура показывает, что два антитела конкурируют с 31C3 за связывание с hTLR3.
[0065] Фигура 18 показывает филогенетические древа CDR антител, согласно данному изобретению. Фигура 18А показывает филогенетическое древо для легких цепей CDR и фигура 18 В показывает филогенетическое древо для тяжелых цепей CDR. Фигуры показывают, что имеет место высокая CDR гомология между антителами 28F11 (28,2), 31C3 (31) и 23С8(23), и что 23Н3 (29) и 34А3 (34) имеют больше отличий в аминокислых последовательностях.
[0066] Фигура 19А и В показывают ингибирование маркеров TLR3 активации на миелоидной ДК с помощью 34А3 антитела. Фигура 19А: секреция IP-10, Фигура 19В: секреция IL-6. Все Фигуры показывают, что по сравнению с контролем (нет AT - незакрашенные кружки) и 31C3 (черные квадраты, как положительный контроль), антитело 34А3 (черные треугольники) ингибирует TLR3 лиганд-индуцированный ответ.
[0067] Фигура 20 показывает FACS анализ исследований интернализации, как описано в примере 8. Фигура 20А представляет отрицательный контроль, представляющий стандартную флюоресценцию 293T-ISRE/TLR3 клеток в отсутствие антитела, связывающего TLR3 белки. Фигура 20В представляет собой положительный контроль, определяющий уровень TLR3 экспрессии в 293T-ISRE/TLR3 клеточных линиях. Фигура 20С и D представляют пропорцию TLR3 белков, соединенных с 31C3 антителом после 24 часа или 2 часа инкубации, соответственно. Фигура 20D и 20F, показывающая сходную с фигурой 20В флюоресценцию, подтверждает, что связывание TLR3 антителом 31C3 не оказывает отрицательной модуляции на экспрессию TLR3 на 293T-ISRE/TLR3 клеточных линиях.
Детальное описание изобретения
Введение
[0068] Данное изобретение обеспечивает новые способы продукции и применения антител и особенно TLR3 - модулирующих антител, пригодных для профилактики и лечения нарушений, таких как аутоиммунное заболевание, воспаление, аллергия, астма, цирроз, остеопороз, инфекция, раковые образования и сепсис. Включены антитела, производные антител, фрагменты антител и клетки, продуцирующие их, а также способы их продукции и способы лечения или диагностики пациентов, используя антитела и соединения.
[0069] Несмотря на то, что в антителах была необходима высокая аффинность, в целом, все антитела, которые, как сообщалось, имеют аффинности в диапазоне от высоких пикомолярных до низких наномолярных, были подвергнуты аффинному созреванию in vitro. Научная литература предположила, что имеет место in vivo максимальный уровень аффинности при 100 пМ и что он должен повышаться, так как В клетки, продуцирующие антитела с аффинностями для антигена выше оцененного максимального значения не будут иметь селективного преимущества в ходе нормальных иммунных ответов. Тем не менее, существуют примеры антител с высокой аффинностью, включая анти-TNF-альфа антитело "TSK114", которое связывается с TNF-альфа человека с аффинностью связывания (K(D)) приблизительно 5,3 пМ, что, как установлено, является в около 1000- и 100-раз более высокой, чем те, которые присущи клинически релевантным MAT инфликсимабу (Remicade) и адалимумабу (Humira) (Song et al. (2008) Exp.Mol. Med. 40(1): 35-42. Возможно, что получение антител с высокой аффинностью зависит от антигена; но в то же время TLR3 антитела, доступные в настоящее время показывали в лучшем случае наномолярную аффинность. Данные анти-TLR3 антитела, тем не менее, демонстрировали очень высокую аффинность (порядка 10 пикомолярной и лучше чем 100 пикомолярной, включая для двух антител, которые сохраняют такую аффинность как в нейтральных, так и кислых условиях).
[0070] Данное изобретение основано, по меньшей мере, частично, на открытии моноклональных антител, которые специфически и эффективно связывают TLR3 в кислых условиях, соответствующие которым встречаются в подкисленном эндосомном компартменте. Среди многочисленных исследованных антител, определенные антитела, как выявлено, сохраняют связывание с TLR3 при высоких аффинностях в кислых условиях, тогда как другие антитела, такие как те, которые доступны коммерчески и другие, выбранные для TLR3 связывания или TLR3 модуляции, теряют аффинность, несмотря на то, что вначале проявляли более высокую (например, в 2-log10 более высокую) аффинность к TLR3, и/или имели низкую аффинность даже в нейтральных условиях. Используемые кислые условия представляли собой рН 5,6, что сходно с тем, что наблюдается в подкисленном эндосомном компартменте, соответствуя условиям, при которых, как полагают, имеет место TLR3 передача сигнала в воспалительных состояниях.
[0071] Кислые условия в общем, как известно, оказывают воздействие на структуру белков, а также воздействуют на белок-белковые взаимодействия. Известно, например, что пептиды класса II МНС (главный комплекс гистосовместимости), которые не связываются с другими пептидами, быстро распадаются в кислых условиях эндосомы. Тем не менее, в данном случае антитела, которые теряют их высокую аффинность связывания с иммобилизированным TLR3 в кислых условиях рН 5,6, были предварительно очищены в кислых условиях (рН 3). Не ограничиваясь теорией, предполагают, что потеря аффинности связывания возникала не из врожденной нестабильности (деградации) антитела в кислых условиях, а скорее благодаря модификациям во взаимодействии между антителами и их целевыми антигенами.
[0072] Модификации в антитело-TLR3 взаимодействиях, возникающие из изменений в рН, как полагают, воздействуют на взаимодействия дсРНК с TLR3, так как поли(1-С) лиганд TLR3 связывает и активирует TLR3 только при кислом рН. Исследования сообщали, что поли(1-С) (и другие дсРНК) связывают TLR3 в области TLR3 положительного электростатического потенциала при нейтральном рН, которая может подвергаться изменению в электростатическом потенциале в кислых условиях (то есть, кислые условия в диапазоне рН 4,5 - 6,5, или около 5,6). Данные антитела, тем не менее, как полагают, связывают эпитоп, который не подвергается существенному изменению в электростатическом потенциале (или подвергается меньшему изменению, чем, например, область положительного электростатического потенциала), когда условия являются подкисленными, так что аффинность связывания антител остается, в основном, неизменной. Это может, в одном аспекте, выражаться относительно аффинности антител для TLR3, так как антитела не имеют, в основном, различную (ниже и/или более высокую) аффинность для связывания TLR3 человека в кислых условиях, в отличии от связывания в нейтральных условиях, например, где KD для связывания с TLR3 отличается на не более чем 0,2-, 0,3-, 0,4-, 0,5-, 1,0- или 1,5-log10. KD для связывания с TLR3 в кислых и нейтральных условиях отличается на менее чем 0,5-log10 для антител 31C3 и 29Н7. Полагают, что эпитоп, с которым связываются антитела по данному изобретению, может иметь отрицательный электростатический потенциал при нейтральном рН. Области отрицательного, положительного или нейтрального электростатического потенциала на поверхности TLR3 белка показаны на Фигуре 8 или также показаны на Фигуре 5D Choe et al. (2005) Science 309:581-585, раскрытие которой включено в данный документ ссылкой. Поскольку антитела, которые ингибируют TLR3, препятствуя посредством связывания дсРНК лигандов с TLR3, будут, вероятно, связываться с областью положительного или нейтрального электростатического потенциала вблизи С-конца на не гликозилированной поверхности TLR3 и, тем самым, связываться в области TLR3, которая может подвергаться большему изменению в электростатическом потенциале, то данные антитела оказываются для связывания с областью в TLR3, не вовлеченной в связывание с дсРНК лигандами, при этом, тем не менее, сохраняя способность ингибировать передачу сигнала с помощью белка TLR3, например, путем ингибирования TLR3 от принятия конформации, необходимой для, в конечном счете, передачи сигнала.
[0073] Данное изобретение также основано, по меньшей мере частично, на открытии моноклональных антител высокой аффинности, которые специфически и эффективно ингибируют путь TLR3 передачи сигнала. Авторы изобретения определили эпитопы, присутствующие на TLR3 человека, включая эпитоп, распознанный с помощью антитела 31C3, 29Н3, 23С8, 28F11 или 34А3, которые особенно эффективны в ингибировании TLR3 передачи сигнала, и ингибировании высвобождения цитокина в ответ на стимуляцию с помощью TLR3 лиганда.
[0074] Антитела по данному изобретению, которые ингибируют TLR3 передачу сигнала, будут особенно пригодны в лечении и/или профилактике аутоиммунных заболеваний, воспалительного заболевания и других заболеваний, где ингибирование TLR3 передачи сигнала является преимущественным. Аутоиммунные и воспалительные заболевания возникают из-за сверхактивного иммунного ответа организма на вещества и ткани, присутствующие в норме в организме. Как в аутоиммунных, так и в воспалительных заболеваниях состояние возникает посредством измененных реакций приобретенной или врожденной иммунной системы человека. В аутоиммунном заболевании иммунная система пациента активируется против собственных белков организма. В воспалительных заболеваниях (включая инфекцию, которая может привести к воспалительным состояниям), это сверхреакция иммунной системы, и ее последующая передача сигнала в нисходящем направлении (TNF, IFN и т.д.), которая вызывает проблемы. Аутоиммунные заболевания происходят из размножения Т- и В-клеток, которые распознают собственные антигены и опосредуют разрушение ткани. Долгое время предполагалось, что вирусные инфекции инициируют или открыто вызывают аутоиммунное заболевание. В Lang et al. (J. Clin. Invest. 116:2456-2463, 2006) было продемонстрировано, что вирусы могут инициировать аутоиммунное повреждение посредством совсем другого механизма.
[0075] Недавно было показано, что дсРНК являются лигандами к TLR3 (Alexoupoulou et al. (2001), Nature 413: 732-738), также еще раньше показали, что РНК, высвобожденная или из поврежденной ткани или из тканей, которые могут также действовать как TLR3 лиганды (Kariko et al, (2004) J. Biol. Chem.). Неадекватная активация TLR их эндогенными РНК лигандами в иммунных комплексах почти наверняка представляет собой важный фактор, который вносит свой вклад в патогенез различных воспалительных и аутоиммунных заболеваний. Недавние статьи подтвердили роль TLR3 в воспалительных заболеваниях (Cavassani et al. 2008), так как TLR3 лиганды усиливали гипервоспалительный ответ, наблюдаемый в ходе сепсиса, или аутоиммунных заболеваний, таких как ревматоидный артрит (Bokarewa et al. (2008) Eur J. ImmunoL), системная красная волчанка (Rahman et al., (2006) Springer Sem. in Immunopathol.), и диабет (Nature Med. 2005). Также сообщалось, что TLR3 может играть пагубную роль в вирусных инфекциях, таких как Western Reserve вирус коровьей оспы, где TLR3 вносит вклад в вирусную репликацию, пагубное воспаление легкого и рекрутинг лейкоцитов в легкое, что приводит к повышенной заболеваемости или в вирусе Западного Нила (WNV), где TLR3 позволяет вирусу преодолеть гемато-энцефалический барьер (ВВВ) и вызвать летальный энцефалит. Антитела по данному изобретению, которые ингибируют TLR3 в рН условиях, соответствующих таковым в эндосомах (например, как в миелоидной ДК), будут пригодны в лечении и профилактике этих состояний, включая, но не ограничиваясь вирусными инфекциями как таковыми и состояниями (например, аутоиммунными или воспалительными состояниями), вызванными или усиленными вирусной инфекцией.
[0076] Zorde-Khvalevsky et al. (2009) Hepatology 49 сообщают, что пролиферация гепатоцитов возрастала после частичной гепатоэктомии в отсутствие TLR3, тогда как уровни IL-6 и растворимого рецептора интерлейкина-6 (sIL-6R) были значительно ниже, и, далее, что после частичной гепатоэктомии TLR3 передача сигнала индуцировалась в гепатоцитах, приводя к активации NF-kB, и что присутствие активного TLR3 в купферовских клетках ингибирует NF-kB активацию. Следовательно, было обнаружено, что TLR3 передача сигнала уменьшала инициацию регенерации печени; следовательно, aHra-TLR3 антитела по данному изобретению могут, использоваться в способе индукции регенерации печени, в частности, для лечения и профилактики заболеваний, включающих повреждение печени, например, цирроз, или заболеваний, которые, как известно, приводят к такому повреждению печени, таких как алкоголизм, инфекцию гепатита В или С или заболевания стеатоза печени.
[0077] Kim et al. (2009) Immunol. Lett. Сообщают, что TLR3 стимулирует остеокластогенез в синовиальной оболочке с RA (Rheumatoid arthritis (ревматоидным артритом)), как прямо, так и опосредованно путем стимуляции моноцитов человека напрямую активизировать дифференциацию остеокластов и путем индукции RANKL (Receptor activator of nuclear factor kappa-B ligand (лиганд рецептора активатора ядерного фактора каппа В)) экспрессии опосредованно в RA-FLS (Rheumatoid arthritis D fibroblast-like synoviocytes (фибробласто-подобные синовиациты ревматоидного артрита)). Экспрессия RANKL активирует дифференциацию остеокластов в синовиальной оболочке с ревматоидным артритом, и анти-RANKL антитела (деносумаб, Amgen Inc.) являются эффективными в лечении остеопороза. AHTH-TLR3 антитела по данному изобретению могут, следовательно, использоваться для лечения и профилактики воспалительного разрушения костей, например, остеопороза, особенно у пациентов с РА (ревматоидным артритом).
[0078] Wen et al. (2004). J. Immunol. 172: 3172-3180 предполагают, что аутоиммунные заболевания могут быть индуцированы вирусоподобным стимулом, и определяют TLR3 как способного опосредовать такую индукцию. Результаты показывают, что вместе с инсулином, но только не инсулин отдельно или другие TLR лиганды (CpG, LPS, PGN), могут индуцировать аутоиммунный диабет и апоптоз панкреатических островков в мышиной модели. Более того, TLR3 показали самый высокий уровень экспрессии у всех особей, по сравнению с другими TLR. Следовательно, анти-TLR3 антитела по данному изобретению могут использоваться для лечения и профилактики диабета и аутоиммунного заболевания островков поджелудочной железы.
[0079] Антитела по данному изобретению, которые связывают TLR3 в кислых условиях, будут, в общем, связывать как TLR3 клеточной поверхности, так и эндосомный TLR3 с высокой аффинностью, так что антитела будут пригодны в любой ситуации (например, лечение или профилактика заболевания), где полезна направленность (например, модулирование) на TLR3. TLR3 был обнаружен в некоторых случаях воспаления поверхности макрофагов и блокирования TLR3 при нейтрализации хлорохином эндосомального закисления, при этом проявлял некоторую противовоспалительную активность (Cavassani et al. 2008, ранее). Тем не менее, антитела по данному изобретению будут иметь большее преимущество по сравнению с другими антителами в лечении или профилактике заболеваний, где модулирование (например, ингибирование) передачи сигнала с помощью TLR3 в цитозольных (например, эндосомных) компартментах полезно или необходимо, и относительная важность модулирования передачи сигнала таких компартментных TLR3 может зависеть от заболевания. Один пример такого заболевания представляет собой ревматоидный артрит; TLR3, экспрессированный в эндосомном компартменте, как полагают, играет важную роль в ревматоидном артрите, так как обработка хлорохином, ингибитором эндосомального закисления, ингибирует TLR3 передачу сигнала и ингибирует продукцию воспалительных цитокинов из синовиальных культур от пациентов, имеющих ревматоидный артрит (Sacre et al. (2008) J. Immunol. 181:8002-8009). TLR3, экспрессированный в эндосомном компартменте, как полагают, играет важную роль в ряде других заболеваний, где ДК (например, миелоидные ДК) вовлечены в ухудшение заболевания, так миелоидные ДК имеют хорошо задокументированную способность захватывать антигены из апоптических или некротических клеток, включая таковые в ходе некроза ткани в ходе острого воспаления.
[0080] Поскольку данные антитела являются специфичными для TLR3, то они могут также использоваться для других целей, включая очищение TLR3 или ^Р3-экспрессирующих клеток, модулирование (например, активацию или ингибирование) TLR3 рецепторов in vitro, ex vivo, или in vivo, направленность TLR3-3KcnpeccHpyioumx клеток на разрушение in vivo, или специфическое мочение/связывание TLR3 in vivo, ex vivo или in vitro, включая для способов, таких как иммуноблоттинг, IHC (иммуногистохимический) анализ, а именно, на замороженных биоптатах, FACS анализ, и иммунопреципитация.
Определения
[0081] Как используется в данном документе, "TLR3 лиганды" относятся к любому соединению, которое может специфически связываться с и изменять активность TLR3 in vitro, ex vivo или in vivo. Соединение может быть встречающимся в природе лигандом, например, как правило, дсРНК или вирусной дсРНК, или синтетическим лигандом, таким как полиIC или полиAU. Соединение может быть любого типа молекулы, включая неорганические или органические соединения или элементы, включая белки (такие как антитела), нуклеиновые кислоты, углеводы, липиды или любую другую молекулярную единицу. Далее, такие соединения могут модулировать TLR3 рецепторы любым образом, включая активацию или ингибирование, и любым механизмом, включая путем связывания с рецептором и запуск или выключение активности таким образом, который сходен с встречающимся в природе лигандом, или путем связывания с рецептором и блокирования доступа к другим лигандам. Предпочтительно, лиганд активирует рецептор, и как таковой может быть использован для индукции продукции цитокинов TLR3-экспрессирующими клетками.
[0082] Выражение "антитело", как используется в данном документе, относится к поликлональным и моноклональным антителам. В зависимости от типа константного домена в тяжелых цепях, антитела относят к одному из пяти основных классов: IgA, IgD, IgE, IgG и IgM. Некоторые из них дополнительно делят на подклассы или изотипы, такие как IgGI, IgG2, IgG3, IgG4 и подобное. Иллюстративная структурная единица иммуноглобулина (антитела) содержит тетрамер. Каждая тетрамер состоит из двух идентичных пар полипептидных цепей, каждая пара имеет одну "легкую" (около 25 кДа) и одну "тяжелую" цепь (около 50-70 кДа). N-конец каждой цепи определяет вариабельную область, состоящую из от около 100 до 110 или более аминокислот, которая является, в первую очередь, ответственной за распознавание антигена. Выражения вариабельная легкая цепь (V^) и вариабельная тяжелая цепь (Уц) относятся к этим легким и тяжелым цепям, соответственно. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются "альфа", "дельта", "эпсилон", "гамма" и "мю", соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов являются хорошо известными. IgG и/или IgM являются предпочтительными классами антител, используемых в данном изобретении, причем IgG является особенно предпочтительным, так как они являются наиболее распространенными антителами в физиологической ситуации и так как их наиболее легко получить в лабораторной установке. Предпочтительно антитело, по этому изобретению, представляет собой моноклональное антитело. Особенно предпочтительними являются гуманизированные, химерные или иным образом пригодные для человека антитела. "Антитела" также включает любой фрагмент или производное любого из описанных в данном документе антител.
[0083] Выражение "специфически связывается с" означает, что антитело может связываться предпочтительно в исследовании конкурентного связывания с партнером по связыванию, например, TLR3, что оценивалось с применением либо рекомбинантных форм белков, эпитопов в них либо нативных белков, присутствующих на поверхности выделенных целевых клеток. Исследования конкурентного связывания и другие способы для определения специфического связывания дополнительно описаны ниже и хорошо известны в данной области техники.
[0084] Когда для антитела указывают, что оно "конкурирует с" конкретным моноклональным антителом (например, 31C3, 29Н3, 23С8, 28F11 или 34А3), то это означает, что антитело конкурирует с моноклональным антителом в исследовании связывания с применением либо рекомбинантных TLR3 молекул, либо молекул, экспрессирующих TLR3 поверхности. Например, если испытуемое антитело снижает связывание 31C3, 29Н3, 23С8, 28F11 или 34А3 с TLR3 полипептидом или ^Р3-экспрессирующей клеткой в исследовании связывания, то антитело, как указано, "конкурирует" соответственно с 31C3, 29Н3, 23С8, 28F11 или 34А3.
[0085] Выражение "аффинность", как используется в данном документе, означает силу связывания антитела с эпитопом. Аффинность антитела представлена в виде константы диссоциации Kd, определяемой как [AT]×[AT]/[АТ-АГ], где [АТ-АГ] представляет собой молярную концентрацию комплекса антитело-антиген, [AT] представляет собой молярную концентрацию несвязанного антитела и [АГ] представляет собой молярную концентрацию несвязанного антигена. Константа аффинности Ка определяется как 1/Kd. Предпочтительные способы для определения аффинности MAT могут быть обнаружены в Harlow, et al., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1988), Coligan et al., eds., Current Protocols in Immunology, Greene Publishing Assoc. and Wiley Interscience, N.Y., (1992, 1993), and Muller, Meth. Enzymol. 92:589-601 (1983), чьи ссылки в их полноте включены в данный документ ссылкой. Один предпочтительный и стандартный способ, хорошо известынй в данной области техники для определения аффинности MATs - это использование инструментов Biacore.
[0086] В контексте этого изобретения "детерминанта" обозначает сайт взаимодействия или связывания на полипептиде.
[0087] Выражение "эпитоп" определяется как антигенная детерминанта, и ее участок или область на антигене, с которой связывается антитело. Белковый эпитоп может содержать аминокислотные остатки, напрямую вовлеченные в связывание, а также аминокислотные остатки, которые эффективно блокируются специфическим антигенсвязывающим антителом или пептидом, т.е., аминокислотные остатки в пределах "отпечатка" антитела. Это простейшая форма или наименьший структурный участок на сложной молекуле антигена, который может соединяться, например, с антителом или рецептором. Эпитопы могут быть линейными или конформационными/структурными. Выражение "линейный эпитоп" определяется как эпитоп, состоящий из аминокислотных остатков, которые являются смежными на линейной последовательности аминокислот (первичная структура). Выражение "конформационный или структурный эпитоп" определяется как эпитоп, состоящий из аминокислотных остатков, которые не являются смежными и, таким образом, представляют выделенные части линейной последовательности аминокислот, которые были приближены друг к другу путем сворачивания молекулы (вторичная, третичная и/или четвертичная структуры). Конформационный эпитоп зависит от 3-мерной структуры. Выражение 'конформационный', таким образом, часто используется взаимозаменяемо со 'структурным'.
[0088] Под "иммуногенным фрагментом" в данном документе понимаю любой полипептидный или пептидный фрагмент, которые способен вызывать иммунный ответ, такой как (i) создание антител, связывающих указанный фрагмент и/или связывающий любую форму молекулы, содержащей указанный фрагмент, включая мембраносвязанный рецептор и мутанты, полученные из него, (ii) стимуляция Т-клеточного ответа, включающего Т-клетки, реагирующие с бимолекулярным комплексом, содержащим любую МНС молекулу и пептид, полученный из указанного фрагмента, (iii) связывание трансфектированных носителей, таких как бактериофаги или бактерии, экспрессирующие гены, кодирующие иммуноглобулины млекопитающих. Альтернативно, иммуногенный фрагмент также относится к любой конструкции, способной вызывать иммунный ответ, как определено выше, такой как пептидный фрагмент, конъюгированный с белком-носителем ковалентной связью, химерный рекомбинантный полипептидный конструкт, содержащий указанный пептидный фрагмент в его аминокислотной последовательности, и специфически включает клетки, трансфектированные с кДНК, последовательность которой содержит часть, кодирующую указанный фрагмент.
[0089] "Токсические" или "цитотоксические" пептиды или малые молекулы включают любое соединение, которое может замедлять, останавливать или реверсировать пролиферацию клеток, снижать их активность любым видимым образом, или прямо, или опосредованно убивать их. Предпочтительно, токсические или цитотоксические соединения работают путем прямого лизиса клеток, тем, что вызывают апоптоз или иным образом. Как используется в данном документе, токсический "пептид" может включать любой пептид, полипептид или их производное, включая пептидные или полипептидные производные с ненатуральными аминокислотами или модифицированными связями. Токсическая "малая молекула" может включать любое токсическое соединение или элемент, предпочтительно с размером менее чем 10 кДа, 5 кДа, 1 кДа, 750 Да, 600 Да, 500 Да, 400 Да, 300 Да или меньше.
[0090] "Пригодное для человека" антитело относится к любому антителу, производному антителу или фрагменту антитела, которое может быть безопасно использовано у людей для, например, терапевтических способов, описанных в данном документе. Пригодные для человека антитела включают все типы гуманизированных, химерных или полностью антител человека, или любых антител, в которых, по меньшей мере, часть антител получена от людей или иным образом модифицирована так, чтобы избежать иммунного ответа, который, как правило, вызывается, когда используют нативные антитела, не принадлежащие человеку.
[0091] Для целей данного изобретения "гуманизированное антитело" или "антитело человека" относится к антителу, в котором константная и вариабельная каркасная область одного или более иммуноглобулинов человека слита со связывающей областью, например, CDR, иммуноглобулина животного. Такие антитела сконструированы так, чтобы сохранять специфичность связывание антитела, не принадлежащего человеку, от которого получены связывающие области, но чтобы избежать иммунной реакции против антитела, не принадлежащего человеку. Такие антитела могут быть получены из трансгенных мышей или других животных, которые были "сконструированы с помощью генной инженерии" для производства специфических антител человека в ответ на антигенное заражение (смотри, например. Green et al. (1994) Nature Genet 7:13; Lonberg et al. (1994) Nature 368:856; Taylor et al. (1994) Int Immun 6:579, полные описания которые включены в данный документ с помощью ссылки). Полностью антитело человека также может быть сконструировано с помощью генетических или хромосомных способов трансфекции, а также с помощью технологии фагового дисплея, все из которых хорошо известны в данной области техники (смотри, например, McCafferty et al. (1990) Nature 348:552-553). Антитела человека могут также быть созданы с помощью in vitro активированных В-клеток (смотри, например, Патенты США №№5567610 и 5229275, которые включены в их полноте с помощью ссылки).
[0092] "Химерное антитело" представляет собой молекулу антитела, в которой (а) константная область или ее часть изменена, замещена или заменена, так что антигенсвязывающий сайт (вариабельная область) соединена с константной областью другого или измененного класса, эффекторной функции и/или вида, или полностью отличной молекулы, которая придает новые свойства химерному антителу, например, фермент, токсин, гормон, фактор роста, лекарство и т.п.;
или (b) вариабельная область или ее часть изменена, замещена или заменена вариабельной областью, имеющей другую или измененную специфичность антитигена.
[0093] Выражения "Fc домен", "Fc часть" и "Fc область" относятся к С-терминальному фрагменту тяжелой цепи антитела, например, от около аминокислоты (аа) 230 до около аа 450 у (гамма) тяжелой цепи человека или его соответствующей последовательности в других типах тяжелых цепей антитела (например, а, 5, е и ц для антител человека), или встречающемуся в природе его аллотипу. Если не установлено иное, то обычно используемая нумерация аминокислот Kabat для иммуноглобулинов используется в данном раскрытии (смотри Kabat et al. (1991) Sequences of Protein oflmmunological Interest, 5-е изд., United States Public Health Service, National Institute of Health, Bethesda, MD).
[0094] Выражения "выделенный", "очищенный" или "биологически чистый" относятся к материалу, который, в основном, или существенно является свободным от компонентов, которые в норме сопровождают его, как это обнаружено в нативном состоянии. Чистота и гомогенность типично определяются, применяя аналитические химические способы, такие как элекстрофорез в полиакриламидном геле или высокоэффективная жидкостная хроматография. Белок, который является преобладающим видом, присутствующим в препарате, является, в основном, очищенным.
[0095] Выражения "полипептид", "пептид" и "белок" используются взаимозаменяемо в данном документе для обозначения полимера аминокислотных остатков. Выражения применяют к аминокислотным полимерам, в которых один или более аминокислотных остатков представляют собой искусственный химический миметик соответствующей встречающейся в природе аминокислоты, а также встречающихся в природе аминокислотных полимеров и не встречающегося в природе аминокислотного полимера.
[0096] Выражение "рекомбинантная", когда используется со ссылкой, например, на клетку, или нуклеиновую кислоту, белок, или вектор, обозначает, что клетка, нуклеиновая кислота, белок или вектор, были модифицированы путем введения гетерологичной нуклеиновой кислоты или белка или изменения нативной нуклеиновой кислоты или белка, или что клетка получена от клетки, модифицированной таким способом. Таким образом, например, рекомбинантные клетки экспрессируют гены, которые не обнаруживаются в нативной (нерекомбинантной) форме клетки или экспрессируют нативные гены, которые иным образом аномально экспрессируются, недостаточно экспрессируются или вообще не экспрессируются.
[0097] В контексте этого изобретения выражение антитело, которое "связывает" обычную детерминанту, обозначает антитело, которое связывает указанную детерминанту со специфичностью и/или аффинностью.
Продукция анти-TLR3 антител
[0098] Антитела, по этому изобретению, специфически связывают TLR3. Более того, антитела по данному изобретению связывают TLR3 в кислых условиях, соответствующих тем, которое встречаются в подкисленном эндосомном компартменте. Более того, антитела по данному изобретению способны ингибировать TLR3 путь передачи сигнала. Способность ингибирующих антител специфически ингибировать TLR3 путь передачи сигнала делает их пригодными для различных применений, в частности, для лечения или профилактики заболеваний, где ингибирование TLR3 пути передачи сигнала является желательным, т.е. избегают дальнейшей секреции цитокинов и хемокинов, а также клеточной активации, как описано в данном документе.
[0099] В одном варианте осуществления данное изобретение обеспечивает антитело, которое связывает TLR3 человека, и конкурирует за связывание с TLR3 человека с моноклональным антителом 31C3, 29Н3, 23С8, 28F11 или 34А3. Антитело 31C3 продуцируется клеткой, депонированной как 31С3.1 в Collection Nationale de Culture de Microorganismes (CNCM), Institut Pasteur, 25 rue de Docteur Roux, F-75724 Париж на 3 июля 2009, под номером CNCM 1-4186. Антитело 29Н3 продуцируется клеткой, депонированной как 29Н3.7 в Collection Nationale de Культура de Microorganismes (CNCM), Institut Pasteur, 25 rue de Docteur Roux, F-75724 Париж на 3 июля 2009, под номером CNCM 1-4187.
[00100] "TLR3", "TLR3 полипептид" и "TLR3 рецептор", используемые взаимозаменяемо, используются в данном документе, чтобы обозначать Toll-подобный рецептор 3, член семейства Toll-подобных рецепторов (TLR). Аминокислотная последовательность TLR3 человека показана в SEQ ID NO:I (NCBI (Национальный центр биотехнологической информации) номер доступа NP_003256, раскрытие которого включено в данный документ ссылкой). мРНК последовательность TLR3 человека описана в NCBI номере доступа NM_003265. Последовательности TLR3 человека также описаны в Патентной публикации РСТ №WO 98/50547, раскрытие которой включено в данный документ ссылкой.
[00101] В одном аспекте данное изобретение обеспечивает антитело, которое конкурирует с моноклональным антителом 31C3, 29Н3, 23С8, 28F11 или 34А3 и распознает, связывается с, или имеет иммуноспецифичность для, в основном, или, главным образом, одинакового, или одинакового, эпитопа или "эпитопного сайта" на TLR3 молекуле, как моноклональное антитело 31C3, 29Н3, 23С8, 28F11 или 34А3. В других вариантах осуществления моноклональное антитело состоит из или представляет собой производное или фрагмент антитела 31C3, 29Н3, 23С8, 28F11 или 34А3.
[00102] Будет понятным, что в то время как предпочтительные антитела связываются с таким же эпитопом, что и антитело 31C3, 29Н3, 23С8, 28F11 или 34А3, данные антитела могут распознавать и вырабатываться против любой части TLR3 полипептида. Например, любой фрагмент TLR3, предпочтительно, но не исключительно TLR3 человека, или любая комбинация TLR3 фрагментов, могут быть использованы как иммуногены для выработки антител, и антитела по данному изобретению могут распознавать эпитопы в любом положении в TLR3 полипептиде, при условии, что они также могут действовать таким образом на TLR3 экспрессирующие клетки, такие как MdDC или MoDC, как описано в данном документе. В варианте осуществления распознанные эпитопы присутствуют на клеточной поверхности, т.е. они доступны для антител, присутствующих снаружи клетки. Наиболее предпочтительно, эпитоп является эпитопом, специфически распознанным антителом 31C3, 29Н3, 23С8, 28F11 или 34А3. Далее, антитела, распознающие отдельные эпитопы в TLR3, могут быть использованы в комбинации, например, для связывания с TLR3 полипептидами с максимальной эффективностью и широтой среди различных особей.
[00103] Антитела, по этому изобретению, могут продуцироваться разнообразием способов, известных в данной области техники. Типично, их получают путем иммунизации животного, не человека, предпочтительно мыши, с помощью иммуногена, содержащего TLR3 полипептид, предпочтительно TLR3 полипептид человека. TLR3 полипептид может содержать полномерную последовательность TLR3 полипептида человека, или ее фрагмент, или ее производное, типично иммуногенный фрагмент, т.е. часть полипептида, содержащего эпитоп, находящийся на поверхности клеток, экспрессирующих TLR3 полипептид, предпочтительно эпитоп, распознанный 31C3, 29Н3, 23С8, 28F11 или 34А3 антителом. Такие фрагменты типично содержат, по меньшей мере, около 7 последовательных аминокислот зрелой полипептидной последовательности, даже более предпочтительно, по меньшей мере, около 10 ее последовательных аминокислот.Фрагменты типично, главным образом, получены из экстраклеточного домена рецептора. В предпочтительном варианте осуществления иммуноген содержит TLR3 полипептид человека дикого типа в липидной мембране, типично на поверхности клетки. В специфическом варианте осуществления иммуноген содержит интактные клетки, особенно интактные клетки человека, факультативно, обработанные или лизированные. В другом предпочтительном варианте осуществления полипептид представляет собой рекомбинантный TLR3 полипептид.
[00104] Этап иммунизации млекопитающего, не человека, с помощью антигена может быть проведен любым способом, хорошо известным в данной области техники для стимуляции продукции антител у мыши (смотри, например, Е. Harlow и D. Lane, Antibodies: A Laboratory Manual., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (1988), полное раскрытие которой включено в данное описание с помощью ссылки). Иммуноген суспендируют или растворяют в буфере, факультативно, с адъювантом, таким как полный или неполный адъювант Фрейнда. Способы для определения количества иммуногена, типов буферов и количеств адъюванта являются хорошо известными специалистам в данной области техники и не ограничивают каким-либо образом данное изобретение. Эти параметры могут быть различными для различных иммуногенов, но их легко выяснить.
[00105] Сходным образом, место и частота иммунизации, достаточная, чтобы стимулировать продукцию антител, также хорошо известна в данной области техники. В типичном протоколе иммунизации животных, не людьей, инъецировали антигеном интраперитонеально на 1 день и снова около через неделю. За этим следуют вторичные инъекции антигена около 20 дня, факультативно, с адъювантом, таким как неполный адъювант Фрейнда. Вторичные инъекции проводят внутривенно и их могут повторить в течение нескольких последующих дней. За этим следует бу стер-доза инъекции на 40 день, или внутривенно, или интраперитонеально, типично без адъюванта. Этот протокол дает в результате продукцию В-клеток, продуцирующих антигенспецифические антитела через около 40 дней. Другие протоколы могут также использоваться, при условии, что они приводят к продукции В-клеток экспрессирующих антитело, направленное на антиген, используемый в иммунизации.
[00106] Для получения поликлональных антител сыворотку получают из иммунизированного животного, не человека, и антитела, присутствующие в ней, выделяют с помощью хорошо известных способов. Сыворотка может быть аффинно очищенной, применяя любой из иммуногенов, изложенных выше, связанный с твердой подложкой так, чтобы получить антитела, которые реагируют с TLR3 полипептидами.
[00107] В альтернативном варианте осуществления лимфоциты из неиммунизированного млекопитающего, не человека, выделяли, выращивали in vitro и затем подвергали действию иммуногена в клеточной культуре. Лимфоциты затем собирали и проводили этап слияния, описанный ниже.
[00108] Для предпочтительных моноклональных антител следующий этап представляет собой выделение спленоцитов из иммунизированного млекопитающего, не человека и последующее слияние этих спленоцитов с иммортализованной клеткой для того, чтобы образовать антитело-продуцирующую гибридому. Выделение спленоцитов из млекопитающего, не человека, является хорошо известным в данной области техники и типично включает удаление селезенки из анестезированного млекопитающего, не человека, разрезание ее на мелкие кусочки и выжимание спленоцитов из капсулы селезенки через нейлоновое сито клеточного фильтра в соответствующий буфер, так чтобы получить суспензию отдельных клеток. Клетки отмывают, центрифугируют и ресуспендируют в буфере, который лизирует любые эритроциты. Раствор снова центрифугируют и оставшиеся лимфоциты в осадке в итоге ресуспендируют в свежем буфере.
[00109] Как только выделены и присутствуют в суспензии отдельных клеток, лимфоциты могут быть слиты с иммортализованной клеточной линией. Она типично представляет собой клеточную линию миеломы мыши, хотя многие другие иммортализованные клеточные линии, пригодные для создания гибридом, являются хорошо известными в данной области техники. Предпочтительные линии миеломы мыши включают, но не ограничиваются следующим: те, которые получены из МОРС-21 и МРС-11 опухолей мышией, доступные от Salk Institute Cell Distribution Center, Сан Диего, США, Х63 Ag8653 и SP-2 клетки, доступные от Американской коллекции типовых культур, Rockville, Мэрилленд, США. Слияние осуществляется с применением полиэтиленгликоля или подобного. Полученные гибридомы затем выращивают в селективных средах, которые содержат одно или более веществ, которые ингибируют рост или выживание неслитых, родительских миеломных клеток. Например, если родительские миеломные клетки не имеют фермента гипоксантин гуанин фосфорибозил трансферазы (HGPRT или HPRT), то культуральная среда для гибридом типично будет включать гипоксантин, аминоптерин и тимидин (HAT среда), те вещества, которые предотвращают рост дефицитных по HGPRT клеток.
[00110] Гибридомы типично выращивают на фидере макрофагов. Макрофаги предпочтительно от детенышей одного помета млекопитающего, не человека, используемых для выделения спленоцитов и их типично примируют неполным адъювантом Фрейнда или подобным, за несколько дней до высева гибридом. Способы слияния описаны в Goding, " Monoclonal Antibodies: Principles and Practice", стр.59-103 (Academic Press, 1986), раскрытие которого включено в данный документ ссылкой.
[00111] Клетки выращивают в селективных средах в течение достаточного времени для образования колонии и продукции антитела. Это обычно составляет между около 7 до около 14 дней.
[00112] Гибридомные колонии затем исследуют в отношении продукции антител, которые специфически связываются с генными продуктами TLR3 полипептида, факультативно, эпитопом, специфически распознанным антителом 31C3, 29Н3, 23С8, 28F11 или 34А3. Исследование является типично исследование типа колориметрического ELISA (иммуносорбентный ферментный анализ), хотя любое исследование может быть использовано, которое может быть адаптировано для лунок, в которых выращивают гибридомы. Другие исследования включают радиоиммуноанализы или сортировку клеток с активацией флюоресценции. Лунки, положительные по продукции необходимого антитела, исследуют для определения того, присутствует ли одна или более отдельных колоний. Если присутствует более чем одна колония, то клетки могут быть заново клонированы и выращены, чтобы убедиться, что только одна клетка дала начало колонии, продуцирующей необходимое антитело. Типично, антитела будут также исследоваться на способность связываться с TLR3 полипептидами, например, ТbК3-экспрессирующими клетками, в зафиксированных в парафине срезах ткани, как описано ниже.
[00113] Гибридомы, которое, как подтвердилось, продуцируют моноклональное антитело, по этому изобретению, могут выращиваться в больших количествах в соответствующей среде, такой как DMEM или RPMI-1640. Альтернативно, гибридомные клетки могут быть выращены in vivo как асцитные опухоли у животного.
[00114] После достаточного роста для продукции необходимого моноклонального антитела ростовые среды, содержащие моноклональное антитело (или асцитную жидкость) отделяют от клеток и моноклональное антитело, присутствующее в них, очищают.Очищение типично выполняют с помощью гель-электрофореза, диализа, хроматографии с использованием белка А или белка G-Сефарозы, или анти-мышиного Ig, связанного с твердой подложкой, такой как агарозные или сефарозные гранулы (все описаны, например, в Antibody Purification Handbook, Biosciences, публикация №18-1037-46, Издание АС, раскрытие которого включено в данное описание ссылкой). Связанное антитело типично элюирует из колонок белка А/белка G с применением буферов с низким рН (глициновый или ацетатный буферы при рН 3,0 или меньше) с немедленной нейтрализацией антитело-содержащих фракций. Эти фракции собирают вместе, подвергают диализу и концентрируют при необходимости.
[00115] Положительные лунки с отдельной очевидной колонией типично повторно клонируют и повторно исследуют, чтобы убедиться, что только одно моноклональное антитело обнаруживается и продуцируется.
[00116] Антитела могут также быть получены путем селекции комбинаторных библиотек иммуноглобулинов, как описано, например, в (Ward et al. Nature, 341 (1989) стр.544, полное раскрытие которой включено в данный документ ссылкой).
[00117] Определение одного или более антител, которое(ые) связывается(ются) с TLR3, особенно, в основном, или, главным образом, с таким же эпитопом, как моноклональное антитело 31C3, 29Н3, 23С8, 28F11 или 34А3, может быть без труда определено, используя любой один из многочисленных анализов иммунобиологического скрининга, в которых может быть оценена конкуренция антитела. Многие такие исследования рутинно используются на практике и хорошо известны в данной области техники (смотри, например, Патент США №5660827, выданный 26 августа 1997, который специфически включен в данный документ ссылкой). Следует понимать, что фактическое определение эпитопа, с которым связывается антитело, описанное в данном документе, не является всегда необходимым для определения антитела, которое связывается с таким же или, в основном, таким же эпитопом, как моноклональное антитело, описанное в данном документе.
[00118] Например, когда испытуемые антитела, которые необходимо изучить, получены из различных исходных животных, или даже из различного Ig изотипа, может быть использовано простое исследование конкуренции, в котором контрольные (31C3, 29Н3, 23С8, 28F11 или 34А3, например) и испытуемые антитела смешаны (или предварительно адсорбированы) и нанесены на образец, содержащий TLR3 полипептиды. Протоколы, основанные на вестерн-блоттинге и использование BIACORE анализа являются пригодными для использования в таких конкурентных исследованиях.
[00119] В определенных вариантах осуществления предварительно смешивают контрольные антитела (31C3, 29Н3, 23С8, 28F11 или 34А3, например) с различными количествами испытуемых антител (например, около 1:10 или около 1:100) в течение определенного промежутка времени до нанесения на TLR3 антигенный образец. В других вариантах осуществления контроль и различные количества испытуемых антител могут быть просто смешаны в ходе воздействия на TLR3 антигенный образец. При условии, что можно отличить связанные от свободных антител (например, путем применения способов разделения и отмывки для удаления несвязанных антител) и 31C3, 29Н3, 23С8, 28F11 или 34А3 от испытуемых антител (например, путем применения видо-специфических или изотип-специфических вторичных антител или путем специфического мечения 31C3, 29Н3, 23С8, 28F11 или 34А3 с помощью детектируемой метки), то можно определить, снижают ли испытуемые антитела связывание 31C3, 29Н3, 23С8, 28F11 или 34А3 с антигенами, определяя, что испытуемое антитело распознает, в основном, такой же эпитоп, что и 31C3, 29Н3, 23С8, 28F11 или 34А3. Связывание (меченых) контрольных антител в отсутствие полностью несоответствующего антитела может служить в качестве контрольного высокого значения. Контрольное низкое значение может быть получено путем инкубации меченых (31C3, 29Н3, 23С8, 28F11 или 34А3) антител с немечеными антителами точно такого же типа (31C3, 29Н3, 23С8, 28F11 или 34А3), где будет возникать конкуренция и снижение связывания меченых антител. В тестовом исследовании значительное снижение в реактивности меченых антител в присутствии испытуемого антитела является признаком испытуемого антитела, которое распознает, в основном, такой же эпитоп, т.е., тот, который "перекрестие реагирует" или конкурирует с меченым (31C3, 29Н3, 23С8, 28F11 или 34А3) антителом. Любое испытуемое антитело, которое снижает связывание 31C3, 29Н3, 23С8, 28F11 или 34А3 с TLR3 антигенами на, по меньшей мере, около 50%, например, по меньшей мере, около 60%, или более предпочтительно, по меньшей мере, около 80% или 90% (например, около 65-100%), в любом соотношении 31C3, 29Н3, 23С8, 28F11 или 34А3:испытуемое антитело от около 1:10 до около 1:100 рассматривается как антитело, которое связывается с, в основном, таким же эпитопом или детерминантой, как 31C3, 29Н3, 23С8, 28F11 или 34А3. Предпочтительно, такое испытуемое антитело будет снижать связывание 31C3, 29Н3, 23С8, 28F11 или 34А3 с TLR3 антигеном на, по меньшей мере, около 90% (например, около 95%).
[00120] Конкуренция может также быть оценена с помощью, например, испытания проточной цитометрии. В таком испытании, клетки, несущие данный TLR3 полипептид, могут быть проинкубированы вначале с 31C3, 29Н3, 23С8, 28F11 или 34А3, например, и затем с испытуемым антителом, меченым флюорохромом или биотином. Как говорят, антитело конкурирует с 31C3, 29Н3, 23С8, 28F11 или 34А3, если связывание, полученное при прединкубации с насыщающим количеством 31C3, 29Н3, 23С8, 28F11 или 34А3, составляет около 80%, предпочтительно около 50%, около 40% или меньше (например, около 30%, 20% или 10%) от связывания (как измеряли путем среднего флюоресценции), полученного с помощью антитела без прединкубации с 31C3, 29Н3, 23С8, 28F11 или 34А3. Альтернативно, говорят, что антитело конкурирует с 31C3, 29Н3, 23С8, 28F11 или 34А3, если связывание, полученное с меченым 31C3, 29Н3, 23С8, 28F11 или 34А3 антителом (с помощью флюорохрома или биотина) на клетках, прединкубированных с насыщающим количеством испытуемого антитела составляет около 80%, предпочтительно около 50%, около 40%, или меньше (например, около 30%, 20% или 10%) от связывания, полученного без прединкубации с испытуемым антителом.
[00121] Может также использоваться простое исследование конкуренции, в котором испытуемое антитело предварительно адсорбируют и наносят в насыщающей концентрации на поверхность, на которой иммобилизован TLR3 антиген. Поверхность в простом исследовании конкуренции представляет собой предпочтительно BIACORE чип (или другие носители, пригодные для анализа поверхностного плазмонного резонанса). Контрольное антитело (например, 31C3, 29Н3, 23С8, 28F11 или 34А3) затем приводят в контакт с поверхностью в TLR3-насыщающей концентрации и измеряют связывание контрольного антитела с TLR3 и поверхностью. Это связывание контрольного антитела сравнивают со связыванием контрольного антитела с TLR3-содержащей поверхностью в отсутствие испытуемого антитела. В тестовом исследовании значительное снижение. в связывании TLR3-содержащей поверхности контрольным антителом в присутствии испытуемого антитела указывает на то, что испытуемое антитело распознает, в основном, такой же эпитоп, что и контрольное антитело, так что испытуемое антитело "вступает в перекрестную реакцию" с контрольным антителом. Любое испытуемое антитело, которое снижает связывание контрольного (такого как 31C3, 29Н3, 23С8, 28F11 или 34А3) антитела с TLR3 антигеном на, по меньшей мере, около 30% или более, предпочтительно около 40%, может рассматриваться как антитело, которое связывается, в основном, с таким же эпитопом или детерминантой, что и контроль (например, 31C3, 29Н3, 23С8, 28F11 или 34А3). Предпочтительно, такое испытуемое антитело будет снижать связывание контрольного антитела (например, 31C3, 29Н3, 23С8, 28F11 или 34А3) с TLR3 антигеном на, по меньшей мере, около 50% (например, по меньшей мере, около 60%, по меньшей мере, около 70%, или более). Очевидно, что порядок контрольных и испытуемых антител может быть обратным: то есть, контрольное антитело может вначале связываться с поверхностью и испытуемое антитело приводится в контакт с поверхностью после этого в исследовании конкуренции. Предпочтительно, антитело, имеющее более высокую аффинность к TLR3 антигена связывают с поверхностью вначале, так как предполагают, что снижение в связывании, наблюдаемое для второго антитела (при условии, что антитела являются перекрестие реагирующими) будет большей величины. Дополнительные примеры таких исследований представлены, например, в Saunal (1995) J. Immunol. Methods 183: 33-41, раскрытие которого включено в данный документ ссылкой.
[00122] Определение того, связывается ли антитело с эпитопной областью, может быть проведено путями, известными специалисту в данной области техники. В качестве одного примера таких способов картирования/определения характеристик, эпитопная область для анти-TLR3 антитела может быть определена с помощью определения "отпечатка" эпитопа, применяя химическую модификацию доступных аминов/карбоксилов в TLR3 белке. Один специфический пример такого способа отпечатка состоит в применении HXMS (обмен водорода на дейтерий, который обнаруживается с помощью масс-спектрометрии), где происходит обмен водород/дейтерий амидных протонов белка рецептора и лиганда, связывание и обратный обмен, где амидные группы скелета, принимающие участие в связывании белка защищены от обратного обмена и, тем самым, будут оставаться дейтерированными. Релевантные области могут быть определены в этом месте при помощи пепсинового протеолиза, быстрого разделения на микроколонке с помощью высоко эффективной жидкостной хроматографии и/или масс-спектрометрии с ионизацией распыления. Смотри, например, Ehring H, Analytical Biochemistry, Vol.267 (2) pp.252-259 (1999) Engen, J. R. и Smith, D. L. (2001) Anal. Chem. 73, 256A-265A. Другой пример способа определения пригодного эпитопа представляет собой картирование эпитопа с помощью ядерно-магнитного резонанса (ЯМР, или NMR), где типично сравнивают положение сигналов в двухмерном спектре ЯМР свободного антигена и антигена в комплексе с антигенсвязывающим пептидом, таким как антитело. Антиген типично является селективно изотопно меченым 15N, так что на ЯМР-спектре видны только сигналы, соответствующие антигену и нет сигналов от антигенсвязывающего пептида. Сигналы антигена, полученные от аминокислот, вовлеченных во взаимодействие с антигенсвязывающим пептидом, типично будут сдвигать положение в спектре комплекса по сравнению со спектром свободного антигена, и аминокислоты, вовлеченные в связывание, могут быть определены таким образом. Смотри, например, Ernst Schering Res Found Workshop.2004; (44): 149-67; Huang et Journal of Molecular Biology, Vol.281 (1) pp.61-67 (1998); и Saito и Patterson, Methods. 1996 Jun; 9 (3): 516-24.
[00123] Картирование/определение характеристик эпитопа также может быть проведено с применением масс-спектрометрических способов. Смотри, например. Downward, J Mass Spectrom. 2000 Apr; 35 (4): 493-503 и Kiselar и Downard, Anal Chem. 1999 May 1; 71 (9): 1792-801. Способы обработки протеазами также могут быть пригодными в контексте картирования и определения эпитопа. Области/последовательности, относящиеся к антигенной детерминанте, могут быть определены с помощью обработки протеазой, например, путем применения трипсина в соотношении около 1:50 к TLR3 или о/п обработки при рН 7-8, с последующей масс-спектрометрическим (MS) анализом для определения пептида. Пептиды, защищенные от расщепления трипсином анти-TLR3 связующим, могут после этого определены путем сравнения образцов, подвергнутых обработке трипсином, и образцов, проинкубированных с антителом и затем подвергнутых обработке, например, трипсином (тем самым, обнаруживая отпечаток для связующего). Другие ферменты, такие как химотрипсин, пепсин и т.п., также или альтернативно могут быть использованы в подобных способах определения характеристик эпитопа. Более того, ферментативная обработка может обеспечивать быстрый способ для анализа того, находится ли потенциальная последовательность антигенной детерминанты в области TLR3 полипептида, которая не расположена на поверхности и, соответственно, наиболее вероятно не релевантна в отношении иммуногенности/антигенности. Смотри, например, Manca, Ann 1st Super Sanita. 1991; 27: 15-9 для обсуждения подобных способов.
[00124] Сайт-направленный мутагенез представляет собой другой способ, пригодный для оценки.связывания эпитопа. Например, в "аланиновом сканировании", каждый остаток в белковом сегменте замещают на остаток аланина, и измеряют последовательности для аффинности связывания. Если мутация приводит к значительному снижению аффинности связывания, то она наиболее вероятно вовлечена в связывание. Моноклональные антитела, специфические для структурных эпитопов (т.е., антитела, которые не связывают несвернутый белок) могут быть использованы для подтверждения того, что замещение на аланин не влияет на полную упаковку белка. Смотри, например, Clackson и Wells, Science 1995; 267:383-386; и Wells, Proc Nati Acad Sci USA 1996; 93:1-6.
[00125] Электронная микроскопия может также использоваться для эпитопного "отпечатка". Например, Wang et al., Nature 1992; 355:275-278 использовали координированное применение криоэлектронной микроскопии, трехмерное восстановление изображения, и рентгенографическую кристаллографию для определения физического отпечатка Fab-фрагмента на капсидной поверхности нативного мозаичного вируса коровьего гороха.
[00126] Другие формы исследований "без меток" для изучения эпитопа включают поверхностный плазменный резонанс (SPR, BIACORE) и рефлектометрическую интерференционную спектроскопию (RifS). Смотри, например, Fagerstam et al.. Journal Of Molecular Recognition 1990;3:208-14; Nice et al., J. Chroma-togr. 1993; 646:159-168; Leipert et al., Angew. Chem. Int. Ed. 1998; 37:3308-3311; Kroger et al.. Biosensors and Bioelectronics 2002; 17:937-944.
[00127] Следует также отметить, что антитело, связывающее такой же или, в основном, такой же эпитоп, что и антитело по данному изобретению, может быть определено в одном или более из иллюстративных конкурентных анализов, описанных в данном документе.
[00128] Как только определяют, что антитела способны к связыванию TLR3 и/или имеют другие необходимые свойства, то их также типично оценивают, применяя стандартные способы, включая те, что описаны в данном документе, в отношении их способности связываться с другими полипептидами, включая неродственные полипептиды и другие члены семейства TLR (например, TLR1, 2, или 4-10 человека). Оптимально, антитела только связываются с существенной аффинностью с TLR3, например, TLR3 человека, и не связываются на значительном уровне с неродственными полипептидами или другими членами семейства TLR (например, TLR2 или TLR4; аминокислотная последовательность предшественника TLR4 человека, включающая сигнальный пептид на аминокислотных остатках 1-23, обнаружена в NCBI номер доступа NP_612564, раскрытие которого включено в данный документ ссылкой). Тем не менее, будет очевидно, что, поскольку аффинность к TLR3, в основном, больше (например, в 5х, 10х, 50х, 100х, 500х, 1000х, 10000х или более), чем таковая к другим членам семейства TLR (или другим, неродственным полипептидам), то антитела являются пригодными для применения в данных способах.
[00129] Связывание антител с Р3-экспрессирующими клетками может также быть оценено у приматов, не людей, например, макак-крабоедов, или других млекопитающих, таких как мыши. Данное изобретение, следовательно, обеспечивает антитело, а также их фрагменты и производные, где указанное антитело, фрагмент или производное специфически связывает TLR3, и которое более того связывает TLR3 от приматов, не людей, например, макак-крабоедов. Факультативно, клеточный захват или локализация, факультативно, локализация в субклеточном компартменте, таком как эндоцитозный путь, оценивают для того, чтобы выбрать антитело, которое легко захватывается в клетку и/или в клеточный компартмент, где его TLR3 экспрессируется. Клеточный захват или локализация будет, как правило, измерена в клетках, в которых антитело пытается или, как считают, проявляет свою активность, таких как ДК. Клеточный захват или локализация могут быть оценены стандартными способами, такими как с помощью конфокального окрашивания, применяя антитела, маркированные детектируемым веществом (например, флюоресцентным веществом).
[00130] При иммунизации и продукции антител у позвоночного или в клетке, конкретные этапы отбора могут быть проведены для выделения антител, как заявлено. В этом отношении, в специфическом варианте осуществления данное изобретение также относится к способам продукции таких антител, включающим следующее: (а) иммунизация млекопитающего, не человека, иммуногеном, содержащим TLR3 полипептид; и (b) получение антител от указанного иммунизированного животного; и (с) выбор антител из этапа (b), которые способны к связыванию TLR3. Антитела могут быть испытаны в отношении связывания с TLR3 в кислых условиях, соответствующих таковым в цитозольных компартментах (например, эндосомных компартментах), таких как при рН от около 5,5 до 6,5.
[00131] Может определяться аффинность бивалентного связывания антитела для TLR3 человека в кислых условиях. Антитела могут характеризоваться, например, средней KD не более чем около (т.е. лучшей аффинностью, чем) 100, 60, 10, 5, или 1 наномолярная, предпочтительно суб-наномолярная или факультативно не более чем около 300, 200, 100 или 10 пикомолярная. KD может быть определена, например, путем иммобилизации рекомбинантно полученных TLR3 белков человека на поверхности чипа, с последующим внесением антитела, которое необходимо испытать, в раствор, например, как показано в данных Примерах. Для отбора антител, которые сохраняют связывание, сходное со связыванием в кислых и нейтральных условиях, можно производить поиск для минимизации различия, наблюдаемого между связыванием при нейтральном рН (например, 7,2) и кислотном рН (например, рН в диапазоне 4,5-6-5), например, где аффинность связывания при кислотном рН, в основном, не ниже, например, где KD для связывания с TLR3 снижается на не более чем 0,2-, 0,3-, 0,5-, 1,0-, или 1,5- log10, чем та, которая наблюдается при не кислом рН. В одном варианте осуществления способ дополнительно включает этап (d), выбор антител из (b), которые способны конкурировать за связывание с TLR3 с антителом 31C3, 29Н3, 23С8, 28F11 или 34А3.
[00132] В одном аспекте любого из вариантов осуществления антитела, полученные согласно данным способам, являются моноклональными антителами. В другом аспекте животное, не человек, используемое для продукции антител согласно способам по данному изобретению, представляет собой млекопитающее, такое как грызун, бык, свинья, домашняя птица, лошадь, кролик, козел или овца. Антитела по данному изобретению включают 31C3, 29Н3, 23С8, 28F11 или 34А3. Тем не менее, будет очевидным, что другие антитела могут быть получены, применяя способы, описанные в данном документе, и, таким образом, антитела по данному изобретению могут быть антителами, отличными от 31C3, 29Н3, 23С8, 28F11 или 34А3. Дополнительно, антитела по данному изобретению могут факультативно, определяться как антитела, отличные от любого из следующих антител: TLR3.7 (eBioScience Inc., San Diego), антитело С1068 no WO 06/060513, антитело С1130 по WO 2007/051164, любое антитело, раскрытое в W02010/051470, например, антитела 1-19 и F17-F19, антитело 40С1285 (Abeam) или антитела 619F7, 713Е4, 716G10, IMG-5631, IMG-315 или IMG-5348 (все от Imgenex. Corp.) или производные вышеперечисленного, например, которые содержат антигенсвязывающую область полностью или частично.
[00133] Согласно альтернативному варианту осуществления, ДНК, кодирующая антитело, которое связывает эпитоп, присутствующий на TLR3 полипептидах, выделяют из гибридомы, по этому изобретению, и помещают в соответствующий вектор экспрессии для трансфекции в соответствующего хозяина. Хозяин затем используется для рекомбинантной продукции антитела или его вариантов, таких как гуманизированная версия такого моноклонального антитела, активные фрагменты антитела, химерные антитела, содержащие антиген-распознающую часть антитела или версии, содержащие детектируемую часть.
[00134] ДНК, кодирующая моноклональные антитела по данному изобретению, например, антитело 31C3, 29Н3, 23С8, 28F11 или 34А3, может быть легко выделена и секвенирвоана, применяя общепринятые процедуры (например, путем применения олигонуклеотидных зондов, которые способны к специфическому связыванию с генами, кодирующими тяжелые и легкие цепи мышиных антител). Будучи выделенной, ДНК может быть помещена в векторы экспрессии, которые затем трансфектируются в клетки-хозяины, такие как клетки Е. coli, COS клетки обезьяны, клетки яичника китайского хомяка (СНО) или миеломные клетки, которые не производят иным образом белок-иммуноглобулин, для получения синтеза моноклональных антител в рекомбинантных клетках-хозяинах. Как описано где-либо в данном описании изобретения, такие ДНК последовательности могут быть модифицированы для любой из большого числа целей, например, для гуманизации антител, продукции фрагментов или производных, или для модификации последовательности антитела, например, в антигенсвязывающем сайте для того, чтобы оптимизировать специфичность связывания антитела.
[00135] Рекомбинантная экспрессия в бактериях ДНК, кодирующих антитело, хорошо известна в данной области техники (смотри, например, Skerra et al., Curr. Opinion in Immunol., 5, стр.256 (1993); и Pluckthun, Immunol. 130, стр.151 (1992).
Оценка способности антител модулировать TLR3 передачу сигнала
[00136] В определенных вариантах осуществления антитела, по этому изобретению, способны модулировать, например, ингибировать передачу сигнала с помощью, TLR3 полипептидов, и, следовательно, модулировать активность или поведение ТbК3-экспрессирующих клеток. Например, антитела могут ингибировать активацию TLR3-экспрессирующих клеток, например, они могут ингибировать путь TLR3 передачи сигнала, факультативно, без блокирования связывания с натуральными или эндогенными лигандами TLR3, таких как дсРНК; факультативно, они могут блокировать способность TLR3 белка формировать гомодимеры в присутствии TLR3 лиганда, таким образом, блокируя инициацию каскада передачи сигнала. Эти антитела, таким образом, называются "нейтрализующие" или "ингибирующие" или "блокирующие" антитела. Такие антитела пригодны, среди прочего, для снижения активности ^К3-экспрессирующих иммунных клеток, например, для лечения или профилактики состояний, включающих чрезмерные активность или число TLR3-экспрессирующих клеток, или, где сниженная активность TLR3-экспрессирующих клеток может ослаблять, предотвращать, устранять или любым способом улучшать состояние или любой его признак.
[00137] Может быть использован диапазон клеточных исследований для оценки способности антител модулировать TLR3 передачу сигнала. Любое из большого числа исследований, включая молекулярные, клеточные и основанные на животных модели могут быть использованы для оценки способности анти-TLR3 антител модулировать активность TLR3-экспрессирующих клеток. Например, могут использоваться основанные на клетках исследования, в которых клетки, экспрессирующие TLR3, подвергают действию дсРНК, вирусной дсРНК, полиIC или поли AU или другого TLR3 лиганда, и оценивают способность антитела разрывать связывание лиганда или стимуляцию рецептора (как определено, например, путем исследования любой из активностей TLR3 клеток, которые освещаются в данном документе, такие как экспрессия интерферона, NFkB активность, NK клеточная активация и т.п.). TLR3 лиганд, используемый в исследованиях, может быть в любой пригодной форме, включая, но не ограничиваясь очищенной композицией лигандов, в смеси с HC-TLR3 лигандами, во встречающейся в природе композиции, в клетке или на поверхности клетки, или секретированный клеткой (например, клеткой, которая продуцирует лиганд, используется в исследовании), в растворе или на твердой подложке.
[00138] Активность ТLR3-экспрессирующих клеток может также быть оценена в отсутствие лиганда, путем воздействия на клетки антитела самого по себе и оценивания его действия на любой аспект клеточной активности или поведения. В таких исследованиях базовый уровень активности (например, цитокиновая продукция, пролиферация, смотри ниже) TLR3-экспрессирующих клеток получают в отсутствие лиганда, и определяют способность антитела или соединения изменять базовый уровень активности. В таком варианте осуществления подход высокоэффективного скрининга используют для определения соединений, способных воздействовать на активацию рецептора.
[00139] Любое пригодное физиологическое изменение, которое отражает TLR3 активность, может быть использовано для оценки испытуемых антител или производных антитела. Например, можно измерить разнообразие эффектов, таких как, изменения в генной экспрессии (например, NFkB-отвечающих генов), белковой секреции (например, интерферона), клеточного роста, клеточной пролиферации, рН, внутриклеточных вторичных мессенджерах, например, Са2+, IP3, cGMP, или сАМР или активность, такая, как способность активировать NK клетки. В одном варианте осуществления активность рецептора оценивают путем обнаружения продукции цитокинов, например, TLR3-чувствительных цитокинов, провоспалительных цитокинов.
[00140] TLR3 модуляция может быть оценена, применяя любую из ряда возможных систем считывания, наиболее часто основанных на пути передачи сигнала TLR/IL-1R, включающему, например, МуЭ88-независимый/ТР1Р зависимый путь передачи сигнала, включающему, например, IRF3, IRF7, IKKe и/или ТВК1 (Akira и Takeda (2004) Nature Review Immunol. 4:499-511). Эти пути активируют киназы, включая KB киназный комплекс.TLR3 активация может быть оценена путем изучения любого аспекта TLR передачи сигнала. Например, активация TLR передачи сигнала запускает изменения в белок-белковых ассоциациях (например, TRIF с ТВК и/или IKKe), во внутриклеточной локализации белков (например, движение NK-kB в ядре), и в генной экспрессии (например, в экспрессии NK-kB чувствительных генов), и цитокиновой продукции (например, продукции и секреции IFN-гамма, IL-6, IP10, МСР-1). Любое такое изменение может быть обнаружено и использовано для обнаружения TLR3 активации. В одном варианте осуществления TLR3 стимуляцию обнаруживают путем сбора супернатантов после 18-20 часов культивирования и измеряют уровни IFN-гамма, IL-6, IP-10 и/или МСР-1 с помощью сэндвич-анализа ELISA. В другом варианте осуществления TLR3 стимуляцию обнаруживают путем сбора супернантанов после 18-20 часов культивирования и измеряют уровни IFN-гамма, IL-6, IP-10 и/или МСР-1 в помощью сэндвич-анализа ELISA.
[00141] В одном варианте осуществления используют клетки, которые в естественных условиях экспрессируют TLR3, такие как ДК (например, миелоидные ДК или дендритные клетки моноцитарного происхождения. В другом варианте осуществления используют клетки, которые содержат конструкт, который вызывает экспрессию детектируемого генного продукта при TLR3 стимуляции и последующей активацией пути передачи сигнала. Репортерные гены и конструкты репортерных генов, особенно пригодные для исследований, включают, например, репортерный ген, функционально связанный с промотором, чувствительным к NF-kB или к передаче сигнала, опосредованной, особенно TRIF, IRF3, IRF7, IKKe, TBK1. Примеры таких промоторов включают, без ограничения, таковые для IL-1 альфа, IL-6, IL-8, IL-12 p40, IP-10, CD80, CD86 и TNF-альфа. Репортерный ген, функционально связанный с TLR-чувствительным промотором может включать, без ограничения следующее: фермент (например, люцифераза, щелочная фосфатаза, бета-галактозидаза, хлорамфинекол ацетилтрансфераза (CAT), и т.п.), биолюминесцентный маркер (например, зеленый флюоресцентный белок (GFP, например. Патент США №5491084), синий флюоресцентный белок (BFP, например. Патент США №6486382), и т.п.), экспрессированная на поверхности молекула (например, CD25, CD80, CD86), и секретированная молекула (например, IL-1, IL-6, IL-8, IL-12 p40, TNF-альфа). Смотри, например, Hcker H et а1. (1999) ЕМВО J. 18:6973-82; Murphy TL et al. (1995) Mol Cell Biol 15:5258-67, раскрытия которых включены в данный документ ссылкой. Репортерные плазмиды, пригодные для использования, являются коммерчески доступными (InvivoGen, Сан Диего, 'Калифорния). В одном варианте осуществления исследование включает определение, в клетке-хозяине, созданной для экспрессии TLR3 полипептида человека, того, вызывает ли испытуемая композиция экспрессию люциферазы (или другого репортера) под контролем промотора, чувствительного к TLR3 передаче сигнала (например, элемента ISRE, IFN-стимулированного ответа).
[00142] В исследованиях, основанных на считывании активности фермента, субстрат может поставляться как часть исследования, и обнаружение может включать измерение хемилюминесценции, флюоресценции, развития цвета, включения радиоактивной метки, устойчивости к лекарству, оптической плотности или другого маркера ферментативной активности. Для исследования опирающейся на поверхностную экспрессию молекулы, обнаружение может быть осуществлено с применением анализа проточной цитометрии (FACS) или функциональных исследований. Секретированные молекулы могут быть исследованы с применением фермент-связанного иммуносорбентного анализа (ELISA) или биоанализов. Многие из этих и других пригодных систем считывания хорошо известны в данной области техники и являются коммерчески доступными. Предпочтительно, репортерная система, какая бы ни использовалась, является количественно определяемой.
[00143] В другом варианте осуществления эффект антител на TLR3-экспрессирующие клетки оценивают у приматов, не людей, in vivo. Например, фармацевтическую композицию, содержащую анти-TLR3 антитело по данному изобретению, вводят примату, не человеку, который либо полностью здоров, либо поражен состоянием, например, аутоиммунным заболеванием или воспалением и оценивают эффект введения на, например, число или активность TLR3-экспрессирующих клеток у примата, присутствие и/или уровни цитокинов, или на развитие состояния. Любое антитело или производное антитела или фрагмент, который вызывает видимое изменение в любом из этих TLR3-связанных параметров, представляет собой кандидат для использования в описанных в данном документе способах.
[00144] В любом из описанных в данном документе исследований, увеличение или снижение на 5%, 10%, 20%, предпочтительно 30%, 40%, 50%, наиболее предпочтительно 60%, 70%, 80%, 90%, 95%, или больше в любом видимом измерении TLR3-стимулированной активности в клетках обозначает, что испытуемое антитело является пригодным для применения в данных способах.
[00145] Когда оценивают ингибирующие анти-TLR3 антитела, антитела могут быть преимущественно выбраны, чтобы модифицировать любой параметр, связанный с воспалением или аутоиммунным заболеванием. Например, антитела могут быть выбраны, чтобы снижать активацию, особенно продукцию провоспалительных цитокинов в клетках. Клетки могут быть, например, клетками, полученными из особи, страдающей от воспалительного или аутоиммунного нарушения.
Последовательности CDR антитела
[00146] В одном аспекте любого из вариантов осуществления данного изобретения антитело может содержать тяжелую и/или легкую цепь, имеющую CDR1, 2 и/или 3 последовательности согласно соответствующей формуле, выбранной из Формул (I) - (XX). В любом варианте осуществления в данном документе конкретная HCDR1-3 или LCDR-1-3 может быть определена как имеющая последовательность Формул (I) - (XX). В одном предпочтительном варианте осуществления антитело содержит легкую цепь, содержащую три LCDR и тяжелую цепь, содержащую три HCDR. Факультативно, обеспечивается антитело, где любая из вариабельных областей легкой и/или тяжелой цепи слита с иммуноглобулиновой константной областью IgG типа, факультативно, константной областью человека, факультативно, изотипом IgG1 или изотипом IgG4.
[00147] В одном варианте осуществления LCDR1 представлена Формулой (I):
R-A-S-E-N-I-Y-S-Xaa1-L-A (I) (SEQ ID NO:61),
где Xaa1 может быть консервативной или неконсервативной заменой или делецией, или вставкой, предпочтительно, где Xaa1 может быть Ser, Tyr или Asn.
[00148] В одном варианте осуществления LCDR2 представлена Формулой (II):
Xaa2-A-K-T-L-A-E (II) (SEQ ID NO:62),
где Хаа3 может быть консервативной или неконсервативной заменой или делецией, или вставкой, предпочтительно, где Хаа3 может быть Asn или Tyr.
[00149] В одном варианте осуществления LCDR3 представлена Формулой (III):
Q-H-H-Y-O-Т-Р-Хаа3-Т (III) (SEQ ID NO:63),
где Хааз может быть консервативной или неконсервативной заменой или делецией, или вставкой, предпочтительно, где Хаа3 может быть Tyr, Phe, Pro.
[00150] В одном варианте осуществления LCDR1 представлена Формулой (IV):
Xaa4-A-S-Xaa5-Xaa6-Xaa7-Xaa8-Xaa9-Xaa10-Xaa11-Xaa12 (IV) (SEQ ID NO:64),
где Хаа4 - Хаар может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Хаа4 может быть Arg, Ser или Lys, и/или Хаа3 может быть Glu, Ser или Gln, и/или Хаа6 может быть Asn или Ser, и/или Хаа7 может быть Не или Val, и/или Xaa9 может быть делецией. Tyr или Arg, и/или Хаа9 может быть Ser или Thr, и/или Хаа10 может быть Tyr, Asn или Ser, и/или Хаа11 может быть Leu, Met или Val, и/или Xaa12 может быть Ala или Phe.
[00151] В одном варианте осуществления LCDR1 представлена Формулой (V):
Xaa13-Xaa14-Xaa15-Xaa16-L-A-Xaa17 (V) (SEQ ID NO:65)
где Xaa13 - Xaa17 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Xaa13 может быть Leu, Asn или Tyr, и/или Xaa14 может быть Ala или Thr, и/или Xaa15 может быть Lys или Ser, и/или Xaa16 может быть Asn или Thr, и/или Хаар может быть Glu или Ser.
[00152] В одном варианте осуществления LCDR2 представлена Формулой (VI):
Xaa18-A-Xaa19-Xaa20-Xaa21-Xaa22-Xaa23 (VI) (SEQ ID NO:66)
где Xaa19-Хаа23 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Xaa18 может быть Tyr, Asn или Leu, и/или Xaa19 может быть Ser или Lys, и/или Хаа20 может быть Asn или Thr, и/или Xaa21 может быть Leu или Arg, и/или Хаа22 может быть Ala или His, и/или Хаа23 может быть Thr или Glu.
[00153] В одном варианте осуществления LCDR2 представлена Формулой (VII):
L-Xaa24-S-N-Xaa25-Xaa26-Xaa27 (VII) (SEQ ID NO:67)
где Хаа24 - Хаа27 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Xaa24 может быть Thr или Ala, и/или Хаа25 может быть Leu или Arg, и/или Хаагб может быть Ala или His, и/или Хаа27 может быть Ser или Thr.
[00154] В одном варианте осуществления LCDR3 представлена Формулой (VIII):
Q-Хаа28-Хаа29-Хаа30-O-Хаa31-Р-Хаа32-Т (VIII) (SEQ ID NO:68)
где Хаа28 - Хаа32 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Xaazg может быть His или Gln, и/или Хаа29 может быть His или Trp, и/или Хаазо может быть Tyr или Thr, и/или Хаа31 может быть Thr или Asn, и/или Хаа32 может быть Tyr, Phe или Pro.
[00155] В одном варианте осуществления LCDR3 представлена Формулой (IX):
Хаа33-Хаа34-Н-Хаа35-Хаа36-Хаа37-Р-Хаа38-Т (IX) (SEQ ID NO:69)
где Хаа33 - Хаа38 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Хаа33 может быть Gln или Leu, и/или Хаа34 может быть His или Gln, и/или Хаа35 может быть Trp или Tyr, и/или Хаа36 может быть Asn или Gly, и/или Хаа37 может быть Tyr или Thr, и/или Хаа38 может быть Tyr, Phe или Pro.
[00156] В одном варианте осуществления LCDR3 представлена Формулой (X):
Хаа39-O-Хаа40-Хаа41-Хаа42-Хаа43-Р-Хаа44-Т (X) (SEQ ID NO:70)
где Хаа40 - Хаа44 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Хаа39 может быть Gln или Leu, и/или Хаа40 может быть Trp или His, и/или Xaa41 может быть Thr или Trp, и/или Хаа42 может быть Gly или Asn, и/или Хаа43 может быть Asn или Tyr, и/или Хаа44 может быть Pro или Tyr.
[00157] В одном варианте осуществления HCDR1 представлена Формулой (XI):
G-Y-S-F-T-G-Y-Xaa45-Xaa46-H (XI) (SEQ ID NO:71)
где Хаа45 - Хаа46 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Хаа45 может быть Phe или Tyr, и/или Хаа46 может быть Met или Не.
[00158] В одном варианте осуществления HCDR1 представлена Формулой (XII):
G-Y-S-F-T-Xaa47-Y-Xaa48-M-H (XII) (SEQ ID NO:72)
где Хаа47 - Xaa48 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Хаа47 может быть Gly или Ala, и/или Хаа48 может быть Phe или Tyr.
[00159] В одном варианте осуществления HCDR1 представлена Формулой (XIII):
G-Y-S-F-T-Xaa49-Y-Y-Xaa50-H (XIII) (SEQ ID NO:73)
где Хаа49 - Хаа50 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Хаа49 может быть Gly или Ala, и/или Хаазо может быть Не или Met.
[00160] В одном варианте осуществления HCDR1 представлена Формулой (XIV):
G-Y-Xaa51-F-T-Xaa52-Y-Xaa53-Xaa54-Xaa55 (XIV) (SEQ ID NO:74)
где Хаа51 - Xaa55 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Xaa51 может быть Val или Ser, и/или Хаа52 может быть Thr, Gly или Ala, и/или Хаа53 может быть Ser, Tyr или Phe, и/или Хаа54 может быть Не или Met, и/или Хаа55 может быть Tyr или His.
[00161] В одном варианте осуществления HCDR1 представлена Формулой (XV):
G-Y-S-Xaa56-T-Xaa57-G-Y-Xaa58-Xaa59-H (XV) (SEQ ID NO:75)
где Хаа56 - Хаа59 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Хаа56 может быть Не или Phe, и/или Хаа57 может быть делецией или Ser, и/или Хаa58 может быть Ser, Tyr или Phe, и/или Хаа59 может быть Trp, Не или Met.
[00162] В одном варианте осуществления HCDR1 представлена Формулой (XVI):
G-Y-Xaa60-Xaa61-T-Xaa62-Xaa63-Y-S-Xaa64-Xaa65 (XVI) (SEQ ID NO:76)
где Хаа60 - Хаа65 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Хаа60 может быть Val или Ser и/или Хаа61 может быть Phe или Не и/или Хаа62 может быть Thr или Ser и/или Хаа63 может быть делецией или Gly и/или Хаа64 может быть Не или Trp и/или Хаа65 может быть Tyr или His.
[00163] В одном варианте осуществления HCDR2 представлена Формулой (XVII):
R-I-N-P-Y-Xaa66-G-A-T-S-Xaa67-N-Xaa68-N-F-K-D (XVII) (SEQ ID NO:77)
где Хаа66 - Xaa68 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Хаа66 может быть Asn или Tyr и/или Хаа67 может быть делецией или Tyr и/или Xaa68 может быть Arg или Gln.
[00164] В одном варианте осуществления HCDR2 представлена Формулой (XVIII):
R-I-N-P-Y-Xaa66-G-A-T-S-Y-N-Q-N-F-K-D (XVIII) (SEQ ID NO:78)
где Хаа66 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Хаа66 может быть Asn или Tyr
[00165] В одном варианте осуществления HCDR2 представлена Формулой (XIX):
R-I-N-P-Y-N-G-A-T-S-Y-N-Xaa68-N-F-K-D (XIX) (SEQ ID NO:79)
где Хаа68 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Xaa68 может быть Arg или Gln.
[00166] В одном варианте осуществления HCDR2 представлена Формулой (XX):
Y-I-Xaa69-Xaa70-Y-Xaa71-G-Xaa72-T-Xaa73-Y-N-Xaa74-Xaa75-Xaa76-Xaa77-Xaa78 (XX) (SEQ ID NO:80)
где Хаа69 - Xaa78 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Хаа69 может быть Asp или His и/или Хаа70 может быть делецией или Pro и/или Xaa71 может быть Ser или Asn и/или Хаа72 может быть Не или Asp и/или Хаа73 может быть Ser или Asn и/или Хаа74 может быть Gln или Pro и/или Хаа75 может быть Lys или Ser и/или Хаа76 может быть Phe или Leu и/или Хаа77 может быть Lys или Arg и/или Xaa78 может быть Gly или Ser.
[00167] В одном варианте осуществления HCDR2 представлена Формулой (XXI):
Xaa79-I-Xaa80-Xaa81-Y-Xaa82-G-Xaa83-T-Xaa84-Xaa85-N-Xaa86-Xaa87-Xaa88-Xaa89-Хаа90 (XXI) (SEQ ID NO:81)
где Хаа79 - Хаа90 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Хаа79 может быть Arg или Tyr и/или Хаа80 может быть Asn, Asp или His и/или Xaa81 может быть делецией или Pro и/или Хаа82 может быть Tyr, Asn или Ser и/или Хаа83 может быть Не, Asp или Ala и/или Хаа84 может быть Ser или Asn и/или Хаа85 может быть делецией или Tyr и/или Хаа86 может быть Pro, Arg или Gln и/или Хаа87 может быть Ser, Lys или Asn и/или Xaa88 может быть Phe или Leu и/или Хаа89 может быть Lys или Arg и/или Хаа90 может быть Asp или Gly.
[00168] В одном варианте осуществления HCDR3 представлена Формулой (XXII):
Xaa91-Xaa92-G-Xaa93-Xaa94-Y-Xaa95-F-D-Y (XXII) (SEQ ID NO:82)
где Xaa91 - Xaa95 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Xaa91 может быть Asp или Ser, и/или Хаа92 может быть Asp или Gly, и/или Хаа93 может быть Gly или Asn, и/или Хаа94 может быть Asn или Thr, и/или Xaa95 может быть Pro или делецией.
[00169] В одном варианте осуществления HCDR3 представлена Формулой (XXIII):
Xaa96-Xaa97-Xaa98-Xaa99-Xaa100-Y-Xaa101-Xaa102-D-Y (XXIII) (SEQ ID NO:83)
где Хаа96 - Хаа102 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Хаа96 может быть S или D, и/или Хаа97 может быть G, Т D, и/или Xaa98 может быть G, К или делецией, и/или Хаа99 может быть G, L, N или делецией, и/или Хаа100 может быть Y, Т, G, N, и/или Xaa101 может быть Р, G или делецией, и/или Хаа102 может быть М, F или L.
[00170] В одном варианте осуществления HCDR3 представлена Формулой (XXIV):
Xaa103-Xaa104-Xaa105-Xaa106-Xaa107-Xaa108-Xaa109-F-D-Y (XXIV) (SEQ ID NO:84)
где Хаа103 - Хаа109 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Хаа103 может быть Asp, Ser, Glu, и/или Хаа104 может быть Asp или Gly, и/или Хаа105 может быть Gly или Asn, и/или Хаа1006 может быть Asn, Tyr или Gly, и/или Хаа107 может быть Asn, Thr или Tyr, и/или Xaa108 может быть Tyr или Gly, и/или Хаа109 может быть Tyr, Pro или делецией
[00171] В одном варианте осуществления HCDR3 представлена Формулой (XXV):
Xaa110-G-Xaa111-Xaa112-Y-Xaa113-Xaa114-Xaa115-D-Y (XXV) (SEQ ID NO:85)
где Хаа110 - Хаа115 может быть консервативной или неконсервативной заменой, или делецией, или вставкой, предпочтительно, где Хаа110 может быть Glu или Asp, и/или Хаа111 может быть Asn или делецией, и/или Хаа112 может быть Tyr или делецией, и/или Хаа113 может быть Tyr, или Gly, и/или Хаа114 может быть Tyr или Gly, и/или Хаа115 может быть Met или Phe.
[00172] В одном варианте осуществления антитело данного изобретения может содержать легкую цепь, содержащую следующее:
а аминокислотную последовательность CDR легкой цепи 1 (LCDR1), выбранную из SEQ ID NOS:61, 64 и 65; и/или
b аминокислотную последовательность CDR легкой цепи 2 (LCDR2), выбранную из SEQ ID NOS:62, 66 и 67; и/или
с аминокислотную последовательность CDR легкой цепи 3 (LCDR3), выбранную из SEQ ID NOS:63, 68, 69 и 70.
[00173] В одном варианте осуществления антитело данного изобретения может содержать тяжелую цепь, содержащую следующее:
а аминокислотную последовательность CDR тяжелой цепи 1 (HCDR1), выбранную из SEQ ID NOS:71-76; и/или
b аминокислотную последовательность CDR тяжелой цепи 2 (HCDR2), выбранную из SEQ ID NOS:77-81; и/или
с аминокислотную последовательность CDR тяжелой цепи 3 (HCDR3), выбранную из SEQ ID NOS:82-85.
Антитело 29Н3
[00174] Клетки, продуцирующие антитело 29Н3 депонировались в CNCM под номером доступа 1-4187; антитело 29Н3 также было секвенировано. Аминокислотная последовательность вариабельной области тяжелой цепи приведена в виде SEQ ID NO:10, аминокислотная последовательность вариабельной области легкой цепи приведена в виде SEQ ID NO:11. Последовательность нуклеиновой кислоты, кодирующая вариабельные области тяжелой цепи и легкой цепи, приведена в SEQ ID NOS 53 и 54, соответственно. В одном варианте осуществления данное изобретение обеспечивает антитело, которое связывает, главным образом, такой же эпитоп или детерминанту, что и моноклональные антитела 29Н3; факультативно, антитело содержит антигенсвязывающую область антитела 29Н3. В любом из вариантов осуществления в данном документе антитело 29Н3 может характеризоваться его аминокислотной последовательностью и/или последовательностью нуклеиновой кислоты, кодирующей ее. В одном предпочтительном варианте осуществления моноклональное антитело содержит Fab или F(ab')2 часть 29Н3. Также обеспечивается моноклональное антитело, которое содержит вариабельную область тяжелой цепи 29Н3. Согласно одному варианту осуществления, моноклональное антитело содержит три CDR вариабельной области тяжелой цепи 29Н3. Также обеспечивается моноклональное антитело, которое дополнительно содержит вариабельную область вариабельной легкой цепи 29Н3 или одну, две или три из CDR вариабельной области легкой цепи 29Н3. Факультативно, любая одна или более из указанных CDR легкой или тяжелой цепи могут содержать одну, две, три, четыре или пять аминокислотных модификаций (например, замен, вставок или делеций). Факультативно, обеспечивается антитело, где любая из вариабельных областей легкой и/или тяжелой цепей, содержащая часть или всю антигенсвязывающую область антитела 29Н3, слита с иммуноглобулиновой константной областью IgG типа, факультативно, константной областью человека, факультативно, изотипом IgG1 или изотипом IgG4. В другом предпочтительном варианте осуществления антитело представляет собой 29Н3.
[00175] В другом аспекте данное изобретение обеспечивает очищенный полипептид, который кодирует антитело, где антитело содержит следующее:
VHCDR1 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:12, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; VHCDR2 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:13, где одна или более из этих аминокислот могут быть замещены другой аминокислотой;
VHCDR3 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:14, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; VLCDR1 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:15, где одна или более из этих аминокислот могут быть замещены другой аминокислотой;
VLCDR2 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:16, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; и/или VLCDR3 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:17, где одна или более из этих аминокислот могут быть замещены другой аминокислотой.
[00176] В еще одном аспекте данное изобретение обеспечивает антитело, которое содержит тяжелую цепь и/или легкую цепь, где каждая имеет, по меньшей мере, три CDR, где одна, две или три из, по меньшей мере, трех CDR имеет последовательность SEQ ID NO:12-14 и 15-17 для соответствующей тяжелой и легкой цепей, и где антитело специфически связывается с TLR3 в кислых условиях.
[00177]В другом аспекте данное изобретение обеспечивает антитело, которое связывает TLR3 человека, содержащее следующее:
а вариабельную область тяжелой цепи SEQ ID NO:10, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
b вариабельную область легкой цепи SEQ ID NO:11, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
с вариабельную область тяжелой цепи SEQ ID NO:10, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; и вариабельную область легкой цепи SEQ ID NO:11, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; или
d аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:12, 13 и 14, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
е аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:15, 16 и 17, соответственно, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
f аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:12, 13 и 14, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; и аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:15, 16 и 17, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
g вариабельную область тяжелой цепи, которая является по меньшей мере на 60%, 70%, 80%, 85%, 90% или 95% идентичной вариабельной области, имеющей аминокислотную последовательность SEQ ID NO:10, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
h вариабельную область легкой цепи, которая является по меньшей мере на 60%, 70%, 80%, 85%, 90% или 95% идентичной вариабельной области, имеющей аминокислотную последовательность SEQ ID NO:11, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой.
[00178] В другом аспекте любого из вариантов осуществления, описанных в данном документе, любая из CDR 1, 2 и 3 тяжелой и легкой цепей может быть охарактеризована как имеющая аминокислотную последовательность, которая разделяет по меньшей мере 50%, 60%, 70%, 80%, 85%, 90% или 95% идентичности последовательности с конкретной CDR или набором CDR, перечисленным в соответствующем SEQ ID NO.
[00179] В другом аспекте данное изобретение обеспечивает антитело, которое конкурирует за TLR3 связывание с моноклональным антителом согласно (а)-(h), вышеупомянутые.
Антитело 31C3
[00180] Клетки, продуцирующие антитело 31C3 депонировались в CNCM под номером доступа 1-4186, также антитело 31C3 было секвенировано. Аминокислотная последовательность вариабельной области тяжелой цепи приведена в виде SEQ ID NO:2, аминокислотная последовательность вариабельной области легкой цепи приведена в виде SEQ ID NO:3. Последовательность нуклеиновой кислоты, кодирующая вариабельные области тяжелой и легкой цепей, приведена в SEQ ID NOS 51 и 52, соответственно. В специфическом варианте осуществления данное изобретение обеспечивает антитело, которое связывает, главным образом, такой же эпитоп или детерминанту, что и моноклональные антитела 31C3; факультативно, антитело содержит антигенсвязывающую область антитела 31C3. В любом из вариантов осуществления в данном документе антитело 31C3 может характеризоваться его аминокислотной последовательностью и/или последовательностью нуклеиновой кислоты, кодирующей ее. В одном предпочтительном варианте осуществления моноклональное антитело содержит Fab или F(ab')2 часть 31C3. Также обеспечивается моноклональное антитело, которое содержит вариабельную область тяжелой цепи 31C3. Согласно одному варианту осуществления моноклональное антитело содержит три CDR вариабельной области тяжелой цепи 31C3. Также обеспечивается моноклональное антитело, которое дополнительно содержит вариабельную область вариабельной легкой цепи 31C3 или одну, две или три из CDR вариабельной области легкой цепи 31C3. Факультативно, любая одна или более из указанных CDR легкой или тяжелой цепи могут содержать одну, две, три, четыре или пять аминокислотных модификаций (например, замен, вставок или делеций). Факультативно, обеспечивается антитело, где любая из вариабельных областей легкой и/или тяжелой цепей, содержащая часть или всю антигенсвязывающую область антитела 31C3, слита с иммуноглобулиновой константной областью IgG типа, факультативно, константной областью человека, факультативно, IgG1 или IgG4 изотипом человека. В другом предпочтительном варианте осуществления антитело представляет собой 31C3.
[00181] В другом аспекте данное изобретение обеспечивает очищенный полипептид, который кодирует антитело, где антитело содержит следующее:
VHCDR1 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:4, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; VHCDR2 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:5, где одна или более из этих аминокислот могут быть замещены другой аминокислотой;
VHCDR3 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:6, где одна или более из этих аминокислот могут быть замещены другой аминокислотой;
VLCDR1 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:7, где одна или более из этих аминокислот могут быть замещены другой аминокислотой;
VLCDR2 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:8, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; VLCDR3 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:9, где одна или более из этих аминокислот могут быть замещены другой аминокислотой.
[00182] В еще одном аспекте изобретение обеспечивает антитело, которое содержит тяжелую цепь и/или легкую цепь, где каждая имеет, по меньшей мере, три CDR, где одна, две или три из, по меньшей мере, три CDR имеет последовательность SEQ ID NO:4-6 и 7-9 для соответствующих тяжелой и легкой цепей, и где антитело специфически связывается с TLR3 в кислых условиях.
[00183] В еще другом аспекте данное изобретение обеспечивает антитело, которое связывает TLR3 человека, содержащее следующее:
а вариабельную область тяжелой цепи SEQ ID NO:2, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
b вариабельную область легкой цепи SEQ ID NO:3, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
с вариабельную область тяжелой цепи SEQ ID NO:2, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; и вариабельную область легкой цепи SEQ ID NO:3, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
d аминокислотные последовательности CDR тяжелой цепи 1 и 2 (HCDR1, HCDR2), как показано в SEQ ID NO:4 и 5, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой, факультативно, где тяжелая цепь содержит аминокислотные последовательности CDR 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:4, 5 и 6, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
е аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:7, 8 и 9, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
f аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:4, 5 и 6, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; и аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:7, 8 и 9, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
g вариабельную область тяжелой цепи, которая является по меньшей мере на 60%, 70%, 80%, 85%, 90% или 95% идентичной вариабельной области, имеющей аминокислотную последовательность SEQ ID NO:2, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
h вариабельную область легкой цепи, которая является по меньшей мере на 60%, 70%, 80%, 85%, 90% или 95% идентичной вариабельной области, имеющей аминокислотную последовательность SEQ ID NO:3, где одна, две, три или более из этих аминокислот могут.быть замещены другой аминокислотой.
[00184] В другом аспекте любого из вариантов осуществления, описанных в данном документе, любая из CDR 1, 2 и 3 тяжелой и легкой цепей может быть охарактеризована как имеющая аминокислотную последовательность, которая разделяет по меньшей мере 50%, 60%, 70%, 80%, 85%, 90% или 95% идентичность последовательности с конкретной CDR или набором CDR, перечисленным в соответствующем SEQ ID NO.
[00185] В другом аспекте данное изобретение обеспечивает антитело, которое конкурирует за TLR3 связывание с моноклональным антителом согласно (а)-(h), вышеупомянутые.
Антитело 23С8
[00186] Антитело 23С8 было секвенировано. Аминокислотная последовательность вариабельной области тяжелой цепи приведена в виде SEQ ID NO:26, аминокислотная последовательность вариабельной области легкой цепи приведена в виде SEQ ID NO:27. Последовательность нуклеиновой кислоты, кодирующая вариабельные области тяжелой и легкой цепей, приведена в SEQ ID NOS 57 и 58, соответственно. В специфическом варианте осуществления данное изобретение обеспечивает антитело, которое связывает, главным образом, такой же эпитоп или детерминанту, что и моноклональные антитела 23С8; факультативно, антитело содержит антигенсвязывающую область антитела 23С8. В любом из вариантов осуществления в данном документе антитело 23С8 может характеризоваться его аминокислотной последовательностью и/или последовательностью нуклеиновой кислоты, кодирующей ее. В одном предпочтительном варианте осуществления моноклональное антитело содержит Fab или F(ab')2 часть 23С8. Также обеспечивается моноклональное антитело, которое содержит вариабельную область тяжелой цепи 23С8. Согласно одному варианту осуществления моноклональное антитело содержит три CDR вариабельной области тяжелой цепи 23С8. Также обеспечивается моноклональное антитело, которое дополнительно содержит вариабельную область вариабельной легкой цепи 23С8 или одну, две или три из CDR вариабельной области легкой цепи 23С8. Факультативно, любая одна или более из указанных CDR легкой или тяжелой цепи могут содержать одну, две, три, четыре или пять аминокислотных модификаций (например, замен, вставок или делеций). Факультативно, обеспечивается антитело, где любая из вариабельных областей легкой и/или тяжелой цепей, содержащая часть или всю антигенсвязывающую область антитела 23 С8, слита с иммуноглобулиновой константной областью IgG типа, факультативно, константной областью человека, факультативно, изотипом IgG1 или изотопом IgG4 человека. В другом предпочтительном варианте осуществления антитело представляет собой 23С8.
[00187] В другом аспекте данное изобретение обеспечивает очищенный полипептид, который кодирует антитело, где антитело содержит следующее:
VHCDR1 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:28, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; VHCDR2 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:29, где одна или более из этих аминокислот могут быть замещены другой аминокислотой;
VHCDR3 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:30, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; VLCDR1 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:31, где одна или более из этих аминокислот могут быть замещены другой аминокислотой;
VLCDR2 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:32, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; VLCDR3 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:33, где одна или более из этих аминокислот могут быть замещены другой аминокислотой.
[00188] В еще другом аспекте данное изобретение обеспечивает антитело, которое содержит тяжелую цепь и/или легкую цепь, где каждая имеет по меньшей мере три CDR, где одна, две или три из по меньшей мере трех CDR имеет последовательность SEQ ID NO:28-30 и 31-33 для соответствующих тяжелой и легкой цепей, и где антитело специфически связывается с TLR3 в кислых условиях.
[00189] В другом аспекте данное изобретение обеспечивает антитело, которое связывает TLR3 человека, содержащее следующее:
а вариабельную область тяжелой цепи SEQ ID NO:26, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
b вариабельную область легкой цепи SEQ ID NO:27, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
с вариабельную область тяжелой цепи SEQ ID NO:26, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; и вариабельную область легкой цепи SEQ ID NO:27, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
d аминокислотные последовательности CDR тяжелой цепи 1 и 2 (HCDR1, HCDR2), как показано в SEQ ID NO:28 и 29, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; факультативно, где тяжелая цепь содержит аминокислотные последовательности CDR 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:28, 29 и 30, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
е аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:31, 32 и 33, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
f аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:28, 29 и 30, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; и
аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:31, 32 и 33, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
g вариабельную область тяжелой цепи, которая является по меньшей мере на 60%, 70%, 80%, 85%, 90% или 95% идентичной вариабельной области, имеющей аминокислотную последовательность SEQ ID NO:26, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
h вариабельную область легкой цепи, которая является по меньшей мере на 60%, 70%, 80%, 85%, 90% или 95% идентичной вариабельной области, имеющей аминокислотную последовательность SEQ ID NO:27, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой.
[00190] В другом аспекте любого из вариантов осуществления, описанных в данном документе, любая из CDR 1, 2 и 3 тяжелой и легкой цепей может быть охарактеризована как имеющая аминокислотную последовательность, которая разделяет по меньшей мере 50% 60%, 70%, 80%, 85%, 90% или 95% идентичность последовательности с конкретной CDR или набором CDR, перечисленным в соответствующем SEQ ID NO.
[00191] В другом аспекте данное изобретение обеспечивает антитело, которое конкурирует за TLR3 связывание с моноклональным антителом согласно (а)-(h), вышеупомянутые.
Антитело 28F11
[00192] Антитело 28F11 было секвенировано. Аминокислотная последовательность вариабельной области тяжелой цепи приведена в виде SEQ ID NO:18, аминокислотная последовательность вариабельной области легкой цепи приведена в виде,SEQ ID NO:19. Последовательность нуклеиновой кислоты, кодирующая вариабельные области тяжелой и легкой цепей, приведена в SEQ ID NOS 55 и 56, соответственно. В специфическом варианте осуществления данное изобретение обеспечивает антитело, которое связывает, главным образом, такой же эпитоп или детерминанту, что и моноклональные антитела 28F11; факультативно, антитело содержит антигенсвязывающую область антитела 28F11. В любом из вариантов осуществления в данном документе антитело 28F11 может характеризоваться его аминокислотной последовательностью и/или последовательностью нуклеиновой кислоты, кодирующей ее. В одном предпочтительном варианте осуществления моноклональное антитело содержит Fab или F(ab')2 часть 28F11. Также обеспечивается моноклональное антитело, которое содержит вариабельную область тяжелой цепи 28F11. Согласно одному варианту осуществления моноклональное антитело содержит три CDR вариабельной области тяжелой цепи 28F11. Также обеспечивается моноклональное антитело, которое дополнительно содержит вариабельную область вариабельной легкой цепи 28F11 или одну, две или три из CDR вариабельной области легкой цепи 28F11. Факультативно, любая одна или более из указанных CDR легкой или тяжелой цепи могут содержать одну, две, три, четыре или пять аминокислотных модификаций (например, замен, вставок или делеций). Факультативно, обеспечивается антитело, где любая из вариабельных областей легкой и/или тяжелой цепей, содержащая часть или всю антигенсвязывающую область антитела 28F11, слита с иммуноглобулиновой константной областью IgG типа, факультативно, константной областью человека, факультативно, изотипом IgG1 или изотипом IgG4 человека. В другом предпочтительном варианте осуществления антитело представляет собой 28F11.
[00193] В другом аспекте данное изобретение обеспечивает очищенный полипептид, который кодирует антитело, где антитело содержит следующее:
VHCDR1 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:20, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; VHCDR2 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:21, где одна или более из этих аминокислот могут быть замещены другой аминокислотой;
VHCDR3 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:22, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; VLCDR1 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:23, где одна или более из этих аминокислот могут быть замещены другой аминокислотой;
VLCDR2 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:24, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; VLCDR3 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:25, где одна или более из этих аминокислот могут быть замещены другой аминокислотой.
[00194] В еще другом аспекте данное изобретение обеспечивает антитело, которое содержит тяжелую цепь и/или легкую цепь, где каждая имеет, по меньшей мере, три CDR, где одна, две или три из по меньшей мере трех CDR имеет последовательность SEQ ID NO:20-22 и 23-25 для соответствующих тяжелой и легкой цепей, и где антитело специфически связывается с TLR3 в кислых условиях.
[00195] В другом аспекте данное изобретение обеспечивает антитело, которое связывает TLR3 человека, содержащее следующее:
а вариабельную область тяжелой цепи SEQ ID NO:18, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
b вариабельную область легкой цепи SEQ ID NO:19, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
с вариабельную область тяжелой цепи SEQ ID NO:18, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; и вариабельную область легкой цепи SEQ ID NO:19, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
d аминокислотные последовательности CDR тяжелой цепи 1 и 2 (HCDR1, HCDR2), как показано в SEQ ID NO:20 и 21, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; факультативно, где тяжелая цепь содержит аминокислотные последовательности CDR 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:20, 21 и 22, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
е аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:23, 24 и 25, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
f аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:20, 21 и 22, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; и аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:23, 24 и 25, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
g вариабельную область тяжелой цепи, которая является по меньшей мере на 60%, 70%, 80%, 85%, 90% или 95% идентичной вариабельной области, имеющей аминокислотную последовательность SEQ ID NO:18, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
h вариабельную область легкой цепи, которая является по меньшей мере на 60%, 70%, 80%, 85%, 90% или 95% идентичной вариабельной области, имеющей аминокислотную последовательность SEQ ID NO:19, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой.
[00196] В другом аспекте любого из вариантов осуществления, описанных в данном документе, любая из CDR 1, 2 и 3 тяжелой и легкой цепей может быть охарактеризована как имеющая аминокислотную последовательность, которая разделяет, по меньшей мере, 50%, 60%, 70%, 80%, 85%, 90% или 95% идентичность последовательности с конкретной CDR или набором CDR, перечисленным в соответствующем SEQ ID NO.
[00197] В другом аспекте данное изобретение обеспечивает антитело, которое конкурирует за TLR3 связывание с моноклональным антителом согласно (а)-(h), вышеупомянутые.
Антитело 34А3
[00198] Антитело 34А3 было секвенировано. Аминокислотная последовательность вариабельной области тяжелой цепи приведена в виде SEQ ID NO:34, аминокислотная последовательность вариабельной области легкой цепи приведена в виде SEQ ID NO:35. Последовательность нуклеиновой кислоты, кодирующая вариабельные области тяжелой и легкой цепей, приведена в SEQ ID NOS 59 и 60, соответственно. В специфическом варианте осуществления данное изобретение обеспечивает антитело, которое связывает, главным образом, такой же эпитоп или детерминанту, что и моноклональные антитела 34А3; факультативно, антитело содержит антигенсвязывающую область антитела 34А3. В любом из вариантов осуществления в данном документе антитело 34А3 может характеризоваться его аминокислотной последовательностью и/или последовательностью нуклеиновой кислоты, кодирующей ее. В одном предпочтительном варианте осуществления моноклональное антитело содержит Fab или F(ab')2 часть 34А3. Также обеспечивается моноклональное антитело, которое содержит вариабельную область тяжелой цепи 34А3. Согласно одному варианту осуществления моноклональное антитело содержит три CDR вариабельной области тяжелой цепи 34А3. Также обеспечивается моноклональное антитело, которое дополнительно содержит вариабельную область вариабельной легкой цепи 34А3 или одну, две или три из CDR вариабельной области легкой цепи 34А3. Факультативно, любая одна или более из указанных CDR легкой или тяжелой цепи могут содержать одну, две, три, четыре или пять аминокислотных модификаций (например, замен, вставок или делеций). Факультативно, обеспечивается антитело, где любая из вариабельных областей легкой и/или тяжелой цепей, содержащая часть или всю антигенсвязывающую область антитела 34А3, слита с иммуноглобулиновой константной областью IgG типа, факультативно, константной областью человека, факультативно, изотипом IgG1 или изотипом IgG4 человека. В другом предпочтительном варианте осуществления антитело представляет собой 34А3.
[00199] В другом аспекте данное изобретение обеспечивает очищенный полипептид, который кодирует антитело, где антитело содержит следующее:
VHCDR1 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:36, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; VHCDR2 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:37, где одна или более из этих аминокислот могут быть замещены другой аминокислотой;
VHCDR3 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:38, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; VLCDR1 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:39, где одна или более из этих аминокислот могут быть замещены другой аминокислотой;
VLCDR2 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:40, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; VLCDR3 область, содержащая аминокислотную последовательность, как изложено в SEQ ID NO:41, где одна или более из этих аминокислот могут быть замещены другой аминокислотой.
[00200]В еще другом аспекте данное изобретение обеспечивает антитело, которое содержит тяжелую цепь и/или легкую цепь, где каждая имеет, по меньшей мере, три CDR, где одна, две или три из по меньшей мере трех CDR имеет последовательность SEQ ID NO:36 - 38 и 29-41 для соответствующих тяжелой и легкой цепей, и где антитело специфически связывается с TLR3 в кислых условиях.
[00201]В другом аспекте данное изобретение обеспечивает антитело, которое связывает TLR3 человека, содержащее следующее:
а вариабельную область тяжелой цепи SEQ ID NO:34, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
b вариабельную область легкой цепи SEQ ID NO:35, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
с вариабельную область тяжелой цепи SEQ ID NO:34, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; и вариабельную область легкой цепи SEQ ID NO:35, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
d аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:36, 37 и 38, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
е аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:39, 40 и 41, где одна или более из этих аминокислот могут быть замещены другой аминокислотой; или
f аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:36, 37 и 38, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; и аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:39, 40 и 41, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
g вариабельную область тяжелой цепи, которая является по меньшей мере на 60%, 70%, 80%, 85%, 90% или 95% идентичной вариабельной области, имеющей аминокислотную последовательность SEQ ID NO:34, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой; или
h вариабельную область легкой цепи, которая является по меньшей мере на 60%, 70%, 80%, 85%, 90% или 95% идентичной вариабельной области, имеющей аминокислотную последовательность SEQ ID NO:35, где одна, две, три или более из этих аминокислот могут быть замещены другой аминокислотой.
[00202] В другом аспекте - любого из вариантов осуществления, описанных в данном документе, любая из CDR 1, 2 и 3 тяжелой и легкой цепей может быть охарактеризована как имеющая аминокислотную последовательность, которая разделяет по меньшей мере 50%, 60%, 70%, 80%, 85%, 90% или 95% идентичность последовательности с конкретной CDR или набором CDR, перечисленным в соответствующем SEQ ID NO.
[00203]В другом аспекте данное изобретение обеспечивает антитело, которое конкурирует за TLR3 связывание с моноклональным антителом согласно (а)-(h), вышеупомянутые.
[00204] В любом антителе по данному изобретению, например, 31C3, 29Н3, 23С8, 28F11 или 34А3, определенные последовательности вариабельной области и CDR могут содержать консервативные модификации последовательности. Консервативные модификации последовательности относится к аминокислотным модификациям, которые не значительно воздействую или изменяют характеристики связывания антитела, содержащего аминокислотную последовательность. Такие консервативные модификации включают аминокислотные замены, добавления и делеции. Модификации могут быть встроены в антитело по данному изобретению путем стандартных способов, известных в данной области техники, таких как сайт-направленный мутагенез и РСК(полимеразная цепная реакция)-опосредованный мутагенез. Консервативные аминокислотные замены типично представляют собой те, в которых аминокислотный остаток замещен аминокислотным остатком, имеющим боковую цепь со сходными физико-химическими свойствами. Определенные последовательности вариабельной области и CDR могут содержать одну, две, три, четыре или более аминокислотных вставок, делеции или замен. Если производятся замены, то предпочтительными заменами будут консервативные модификации. Семейства аминокислотных остатков, имеющих сходные боковые цепи, были определены в данной области техники. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глютаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глютамин, серии, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или более аминокислотных остатков в CDR областях антитела по данному изобретению могут быть замещены другими аминокислотными остатками из такого же семейства боковых цепей и измененное антитело может быть испытано в отношении сохранения функции (т.е., свойства, перечисленных в данном документе), применяя исследования, описанные в данном документе.
[00205] Выражение "идентичность" или "идентичная", когда используются в отношении между последовательностями двух или более полипептидов, относится к степени родства последовательностей между полипептидами, что определяется с помощью числа совпадений между последовательностями двух или более аминокислотных остатков. "Идентичность" измеряет процент идентичных совпадений между меньшей из двух или более последовательностей с выравниваниями гэпов (если они есть), адресованными конкретной математической модели или компьютерной программе (т.е., "алгоритмы"). Идентичность родственных полипептидов может быть без труда рассчитана известными способами. Такие способы включают, но не ограничиваются теми, что описаны в Computational Molecular Biology, Lesk, A.M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D.W., ed.. Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part 1, Griffin, A.M., и Griffin, H.G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M. Stockton Press, New York, 1991; и Carillo et al., SIAM J.Applied Math. 48, 1073 (1988).
[00206] Предпочтительные способы для определения идентичности разработаны, чтобы давать наибольшее совпадение между испытуемыми последовательностями. Способы определения идентичности описаны в широкодоступных компьютерных программах. Предпочтительные способы с использованием компьютерной программы для определения идентичности между двумя последовательностями включают GCG пакет программ, включая GAP (Devereux et al., Nucl. Acid. Res. 12, 387 (1984); Genetics Computer Group, University of Wisconsin, Madison, Wis.), BLASTP, BLASTN, и FASTA (Altschul et al., J.Mol.Biol. 215, 403-410 (1990)). Программа BLASTX является широкодоступной от Национального центра биотехнологической информации (NCBI) и других источников (BLAST Manual, Altschul et al. NCB/NLM/NIH Bethesda, Md. 20894; Altschul et al., выше). Хорошо известный алгоритм Smith Waterman может также использоваться для определения идентичности.
[00207] Последовательности CDR антител согласно изобретению, согласно АbМ (Оксфордское молекулярное определение АbМ моделирования антител с программным обеспечением), Kabat и Chothia системам определения, были представлены суммарно в Таблице А ниже. Аминокислотные последовательности, описанные в данном документе, нумеруются согласно Abm, Kabat и Chothia системам нумерации. В то время как любая пригодная система нумерации может быть использована для обозначения CDR областей, в отсутствие любого другого указания, нумерация, используемая в данном документе, представляет собой Abm. Такая нумерация установила использование следующих обозначений: CDR-L1: Начало: прибл. остаток 24, остаток до: всегда Cys, остаток после: всегда Trp (типично Trp-Tyr-Gln, но также, Trp-Leu-Gln, Trp-Phe-Gln, Trp-Tyr-Leu), длина: 10-17 остатков; CDR-L2:
Начало: всегда 16 остатков после конца L1, Остатки до: как правило, Ile-Tyr (но также, Val-Tyr, Ile-Lys, Ile-Phe), Длина: всегда 7 остатков; CDR-L3, Начало: всегда 33 остатка после конца L2, Остаток до: всегда Cys, Остатки после: всегда Phe-Gly-Xaa-Gly, Длина: 7-11 остатков; CDR-H1, Начало: прибл. остаток 26 (всегда 4 после Cys) (Chothia/АbМ определение, Kabat определение начинается через 5 остатков). Остатки до: всегда Cys-Xaa-Xaa-Xaa, Остатки после: всегда Tip (типично Trp-Val, но также, Trp-Ile, Trp-Ala), Длина: 10-12 остатков (АbМ определение, Chothia определение исключает последние 4 остатка); CDR-H2, Начало: всегда 15 остатков после конца Kabat/АbМ определения CDR-H1, Остатки до: типично Leu-Glu-Trp-Ile-Gly (но ряд вариаций. Остатки после Lys/Arg-Leunie/Val/Phe/Thr/Ala-Thr/Ser/Ile/Ala), Длина: Kabat определение 16 -19 остатков; АbМ (и Chothia) определение заканчивается на 7 остатков раньше; CDR-H3, Начало: всегда 33 остатка после конца CDR-H2 (всегда 2 после Cys), Остатки до: всегда Cys-Xaa-Xaa (типично Cys-Ala-Arg), Остатки после: всегда Trp-Gly-Xaa-Gly, Длина: 3-25 остатков.
[00208] Последовательности вариабельных цепей антител, согласно данному изобретению, приведены в Таблице В ниже, отдельная пептидная последовательность представлена курсивом и CDR представлены полужирным шрифтом. Выражение х/х обозначает, что любая из двух обозначенных аминокислот может присутствовать в конкретном аминокислотном остатке, например, выражение F/S означает, что в данном положении, аминокислота может быть или фенилаланином, или серином. В любом варианте осуществления в данном документе VL или VH последовательность может быть определена или обозначена номером так, чтобы содержать или не содержать сигнальный пептид или любую его часть.
[00209] В варианте осуществления антитела по данному изобретению являются изотипом IgGI человека или мыши. В другом варианте осуществления антитела по данному изобретению являются изотипом IgG4 человека. В варианте осуществления антитела по данному изобретению являются фрагментами антител, которые сохраняют их связывание и/или функциональные свойства.
[00210] Секвенирование легких и тяжелых цепей анти-TLR3 антител, согласно данному изобретению, привело к определению генной реаранжировки, вовлеченной в создание таких антител, как суммировано в Таблице С ниже. (Указанные последовательности генов могут быть извлечены из http://www.ncbi.nlm.nih.gov/igblasVshowGermline.cgi). Фигуры 18А и 18 В представляют филогенетические древа (созданные с помощью Phylip's Drawtree) легких и тяжелых цепей, указывая на высокую степень гомологии между антителами 28F11, 31C3 и 23С8.
[00211] Таблица D ниже обеспечивает процентное соотношение идентичности последовательности между различными CDR для каждого антитела, в аминокислотах.
[00212] Таблица Е обеспечивает процентное соотношение идентичности, которая была подсчитана между различными нуклеотидными последовательностями VL и VH (курсив) для каждого антитела, применяя LALIGN программное обеспечение.
[00213] Таблица F обеспечивает процентное соотношение идентичности, которая была подсчитана между различными аминокислотные последовательностями VL и VH (курсив), применяя LALIGN программное обеспечение.
[00214] Фрагменты и производные антител, по этому изобретению, (которые включены в выражение "антитело" или "антитела", как используется в этом документе, если только иное не утверждается или точно не продиктовано контекстом), предпочтительно 31C3, 29Н3, 23С8, 28F11 или 34А3-подобное антитело, могут быть получены с помощью способов, которые хорошо известны в данной области техники. "Фрагменты" содержат часть интактного антитела, как правило, антигенсвязывающий сайт или вариабельную область. Примеры фрагментов антител включают Fab, Fab', Fab'-SH, F(ab')2 и Fv фрагменты; диатела; любой фрагмент антитела, который представляет собой полипептид, имеющий первичную структуру, состоящую из одной непрерывной последовательности смежных аминокислотных остатков (который имеет в данном документе название "одноцепочечный фрагмент антитела " или "одноцепочечный полипептид"), включая без ограничения (1) одноцепочечные Fv молекулы, (2) одноцепочечные полипептиды, содержащие только один вариабельный домен легкой цепи, или его фрагмент, в котором содержаться три CDR вариабельного домена легкой цепи, без соединенной части тяжелой цепи и (3) одноцепочечные полипептиды, содержащие только одну вариабельную область тяжелой цепи, или ее фрагмент, содержащий три CDR вариабельной области тяжелой цепи, без соединенной части легкой цепи; и мультиспецифичные антитела, образованные из фрагментов антител.
[00215] Фрагменты данных антител могут быть получены, применяя стандартные способы. Например, Fab или F(ab')2 фрагменты могут быть получены с помощью обработки протеазой выделенных антител, согласно общепринятым способам. Будет очевидно, что иммунореактивные фрагменты могут быть модифицированы, применяя известные способы, например для замедления клиренса in vivo и получения более желательного фармакокинетического профиля фрагмент может быть модифицирован с полиэтиленгликолем (ПЭГ, или PEG). Способы для объединения и сайт-специфического конъюгирования ПЭГ с Fab' фрагментом описаны в, например, Leong et al, 16 (3): 106-119 (2001) и Delgado et al, Br.J.Рак 73 (2): 175- 182 (1996), раскрытия которых включены в данный документ ссылкой.
[00216] Альтернативно, ДНК гибридомы, продуцирующей антитело по данному изобретению, предпочтительно 31C3, 29Н3, 23С8, 28F11 или 34А3-подобное антитело, может быть модифицирован так, чтобы кодировать фрагмент по данному изобретению. Модифицированная ДНК затем вводится в вектор экспрессии и используется для того, чтобы трансформировать или трансфектировать соответствующую клетку, которая затем экспрессирует необходимый фрагмент.
[00217] В определенных вариантах осуществления ДНК гибридомы, продуцирующей антитело, по этому изобретению, предпочтительно 31C3, 29Н3, 23С8, 28F11 или 34А3 - подобное антитело, может быть модифицирована до введения в вектор экспрессии, например, путем замещения кодирующей последовательности для константных доменов тяжелой и легкой цепей человека в месте гомологичных не принадлежащих человеку последовательностей (например, Morrison et al., PNAS pp.6851 (1984)), или путем ковалентного связывания с кодирующей иммуноглобулин последовательностью всей или части кодирующей последовательности для неиммуноглобулинового полипептида. Таким образом, получают "химерные" или "гибридные" антитела, которые имеют специфичность связывания исходного антитела. Типично, такие неиммуноглобулиновые полипептиды замещены по константным доменам антитела по данному изобретению.
[00218] Таким образом, согласно другому варианту осуществления антитело, по этому изобретению, предпочтительно 31C3, 29Н3, 23С8, 28F11 или 34А3-подобное антитело, является гуманизированным. "Гуманизированные" формы антител согласно этому изобретению являются специфическими химерными иммуноглобулинам, иммуноглобулиновыми цепями или их фрагментами (такими как Fv, Fab, Fab', F(ab')2, или другими антигенсвязывающими субпоследовательностями антител), которые содержат минимальную последовательность, полученную из мышиного иммуноглобулина. В большинстве случаев, гуманизированные антитела представляют собой иммуноглобулины человека (антитело-реципиент), в котором остатки из области, определяющей комплементарность (CDR) реципиента, замещены остатками из CDR исходного антитела (антитело-донор) при сохранении необходимой специфичности, аффинности и способность исходного антитела.
[00219] В некоторых случаях, Fv каркасные остатки иммуноглобулина человека могут быть замещены соответствующими не полученными от человека остатками. Более того, гуманизированные антитела могут содержать остатки, которое не обнаруживаются ни в антителе-реципиенте, ни в импортированных CDR или каркасных последовательностях. Эти модификации производят для того, чтобы дополнительно очистить и оптимизировать эффективность антитела. В общем, гуманизированное антитело будет содержать, в основном, все из по меньшей мере одного и, типично, двух вариабельных доменов, в которых все или, в основном, все из CDR областей соответствуют таковым исходного антитела, и все или, в основном, все из FR областей являются таковыми, как консесусная последовательность иммуноглобулина человека. Гуманизированное антитело оптимально также будет содержать, по меньшей мере, часть константной области иммуноглобулин (Fc), типично от иммуноглобулина человека. Для дополнительных деталей смотри Jones et al., Nature, 321, pp.522 (1986); Reichmann et al. Nature, 332, pp.323 (1988); Presta, Curr. Op.Struct. BioL, 2, pp.593 (1992); Verhoeyen et Science, 239, pp.1534; и Патент США №4816567, полные раскрытия которых в данный документ включены ссылкой.) Способы гуманизации антител, по этому изобретению, хорошо известны в данной области техники.
[00220] Выбор вариабельных доменов человека, как легких, так и тяжелых, которые используются в создании гуманизированных антител, является очень важным для снижения антигенности. Согласно так называемому способу "максимального соответствия", последовательность вариабельного домена антитела, по этому изобретению, подвергают скринингу против полной библиотеки известных последовательностей вариабельных доменов человека. Последовательность человека, которая является наиболее близкой к таковой у мыши, затем принимают как каркас человека (FR) для гуманизированного антитела (Sims et al., J.Immunol. 151, pp.2296 (1993); Chothia и Lesk, J.Mol. 196, pp.901). Другой способ использует конкретный каркас из консесусной последовательности всех антител человека конкретной подгруппы легких или тяжелых цепей. Одинаковый каркас может быть использован для нескольких различных гуманизированных антител (Carter et al., PNAS 89, pp.4285 (1992); Presta et J.Immunol., 51, p.1993)).
[00221] К тому же важным является то, чтобы антитела, будучи гуманизированными, сохраняли высокую аффинность к TLR3 рецепторам и другие предпочтительные биологические свойства. Для достижения этой цели, согласно предпочтительному способу, гуманизированные антитела получали путем процесса анализа родительских последовательностей и различных концептуальных гуманизированных продуктов, применяя трехмерные модели родительских и гуманизированных последовательностей. Трехмерные иммуноглобулиновые модели широкодоступны и являются знакомыми для специалистов в данной области техники. Доступны компьютерные программы, которые иллюстрируют и отображают вероятные трехмерные структуры выбранных кандидатных иммуноглобулиновых последовательностей. Проверка этих дисплеев позволяет анализировать вероятную роль остатков в функционировании кандидатной иммуноглобулиновой последовательности, т.е., анализировать остатки, которые влияют на способность кандидатного иммуноглобулина связывать его антиген. Таким образом, FR остатки могут быть выбраны и скомбинированы с консесусными и импортируемыми последовательностями, так чтобы необходимая характеристика антитела, такая как повышенная аффинность для целевого антигена(ов), была достигнута. В общем, CDR остатки напрямую и максимально, в основном, включены во влияние на связывание антигена.
[00222] Другой способ создания "гуманизированных" моноклональных антител состоит в использовании XenoMouse (Abgenix, Fremont, CA) в качестве мыши, используемой для иммунизации. XenoMouse представляет собой мышиного хозяина согласно этому изобретению, в котором его иммуноглобулиновые гены были замещены функциональными иммуноглобулиновыми генами человека. Таким образом, антитела, продуцируемые этой мышью или в гибридомах, созданных из В-клеток этой мыши, являются уже гуманизированными. XenoMouse описана в Патенте США №6162963, который в данной документ включен в своей полноте ссылкой.
[00223] Антитела человека могут также быть получены согласно различным другим способам, таким как путем применения, для иммунизации, других трансгенных животных, которые были сконструированы, чтобы экспрессировать репертуар антитела человека (Jakobovitz et Nature 362 (1993) 255), или путем выбора репорту аров антител, применяя способы фагового дисплея. Такие способы известны специалисту в данной области техники и могут быть осуществлены, начиная с моноклональных антител, как раскрыто в данной заявке.
[00224] Антитела по данному изобретению, предпочтительно 31C3, 29Н3, 23С8, 28F11 или 34А3-подобное антитело, могут также быть дериватизированы до "химерных" антител (иммуноглобулинов), в которых часть тяжелой/легкой цепи(ей) является идентичной или гомологичной соответствующим последовательностям в исходном антителе, тогда как остаток цепи(ей) является идентичным или гомологичным соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих другому классу или подклассу антитела, а также фрагментам таких антител, при условии, что они проявляют необходимую биологическую активность и специфичность связывания (Cabilly et al., выше; Morrison et al., Proc. Natl. Acad. Sci. U.S.A., pp.6851 (1984)).
[00225] В то время как данные антитела имеют способность связывать TLR3 и факультативно, дополнительно ингибировать TLR3 передачу сигнала, они могут также использоваться для других целей, например, конъюгация с токсином пригодна для направленного цитолиза клеток, экспрессирующих TLR3 полипептиды, например, определенных опухолевых клеток, таких как меланомы или клетки опухоли груди, легкого, пищевода, желудка, гортани, почки или шейки матки, или потенциально вирусно инфицированных клеток или клеток, вовлеченных в воспаление.' В таких вариантах осуществления, типично образец, полученный (например, с помощью биопсии опухолей) будут вначале проводить, чтобы оценить, экспрессируют ли TLR3 клетки (например, опухолевые клетки, инфицированные клетки, клетки, вовлеченные в воспаление и т.п.), например, применяя способы обнаружения, описанные в данном документе. Если TLR3 точно обнаружен на поверхности опухолевых клеток, то цитотоксические антитела могут быть введены. Цитотоксическое антитело затем интенализируется клеткой и токсин высвобождается внутри клетки, селективно убивая эту клетку. Такие антитела будут, следовательно, использоваться в способах лечения раковых образований и опухолей, включая, но не ограничиваясь следующим: рак желчных путей; рак мозга; рак груди; рак шейки матки; хориокарцинома; рак толстой кишки; рак эндометрия; эзофагеальный рак; рак желудка; интраэпителиальные новообразования; лейкемии; лимфомы; рак печени; рак легкого (например, мелкоклеточный и немелкоклеточный); меланома; нейробластомы; рак ротовой полости; рак яичника; рак поджелудочной железы; рак простаты; рак прямой кишки; рак почки; саркомы; рак кожи; рак яичка; рак щитовидной железы; а также другие карциномы и саркомы. Раковые опухоли могут быть первичными или метастазными.
[00226] Один эффективный подход для усиления противоопухолевого действия антител включает связывание цитотоксических лекарств или токсинов с MAT, которые способны быть интенализированными клеткой-мишенью. Эти агенты называются конъюгаты антитела и лекарства (АДК) и иммунотоксины, соответственно. При введении пациенту, АДК и иммунотоксины связываются с клетками-мишенями посредством их частей антитела и становятся интенализированными, позволяя лекарствам или токсинам проявлять свой эффект. Смотри, например, заявки на патент США №№US2005/0180972 А1, US2005/0123536 А1. Смотри также, например, Hamblett et al., Clin Cane Res, 10: 7063-7070, Oct. 15, 1999, Law et al., Clin Cane Res, 10:7842-7851, Dec. 1, 2004, Francisco et al., Neoplasia, 102(4): 1458-1465, Aug. 15, 2003, Russell et al., Clin Cane Res, 11:843-852, Jan. 15, 2005, Doronina et al., Nat Biotech, 21(7):778-784, Июль 2003, все из которых, тем самым, включены ссылкой в своей полноте в данный документ.
[00227] Цитотоксические антитела могут быть получены, применяя описанные способы (Carter et al. Рак Journal, Том 14, Номер 3, Май/Июнь 2008, или Ravi et al. Accounts of Chemical Research 98-107 Январь 2008 Том. 41, №1).
[00228] Предпочтительные токсические или цитотоксические пептиды или малые молекулы включают любое соединение, которое может замедлять, останавливать или реверсировать пролиферацию клеток, снижая их активность любым видимым способом, или напрямую, или опосредованно лизируя их. Предпочтительно, токсические или цитотоксические соединения действуют, напрямую лизируя клетки, вызывая ADCC или иным образом. Как используется в данном документе, токсический пептид может включать любой пептид, полипептид или их производные, включая пептидные или полипептидные производные с ненатуральными аминокислотами или модифицированными связями. Токсическая малая молекула может включать любое токсическое соединение или элемент, предпочтительно с размером менее чем 10 кДа, 5 кДа, 1 кДа, 750 Да, 600 Да, 500 Да, 400 Да, 300 Да или меньше.
[00229] Конъюгация с детектируемым веществом пригодна, среди прочего, когда антитело по данному изобретению используют для диагностических целей. Такие цели включают, но не ограничиваются следующим: исследование биологических образцов, например, образца крови или биопсии ткани, на присутствие TLR3-экспрессирующих клеток, и обнаружение присутствия, уровня или активности TLR3-экспрессирующих клеток у особи. Такие способы исследования и детекции могут быть использованы в диагностических/терапевтических способах по данному изобретению, например, включая обнаружение TLR3 экспрессии в клетках пациента и если определили, что клетки пациента экспрессируют TLR3, то последующее введение TLR3-модулирующего антитела по данному изобретению.
[00230] В определенных вариантах осуществления данные антитела используют для очищения TLR3-экспрессирующих клеток от биологического образца. Биологические образцы могут быть получены от пациента, например, для диагностики или ex vivo терапевтических целей, или от особей или приматов, не людей, чтобы получить источник таких клеток для исследовательских целей.
[00231] В одном таком варианте осуществления меченые антитела по данному изобретению могут быть использованы в FACS сортировке для очищения или выделения TLR3-экспрессирующих клеток из биологического образца. Альтернативно, в некоторых вариантах осуществления конъюгация антитела, по этому изобретению, с твердой подложкой может быть пригодна как инструмент для аффинной очистки клеток, несущих TLR3 рецептор на их клеточной поверхности, от биологического образца, такого как образец крови или клетки из биопсии тканей от особи. Этот способ очищения представляет собой другой альтернативный вариант осуществления данного изобретения, так как дают в результате очищенную популяцию клеток.
[00232] Независимо от способа, используемого для выделения или очищения TLR3-экспрессирующих клеток, способность делать это пригодна для многочисленных целей, например, для диагностики TLR3-ассоциированного нарушения путем оценивания числа или активности TLR3-экспрессирующих клеток, например, до введения анти-TLR3 антител, как описано в данном документе. Далее, очищенные TLR3-экспрессирующие клетки пригодны в контексте исследований, например, чтобы лучше охарактеризовать клетки и их различные свойства и типы поведения, а также для определения соединений или способов, которые могут быть использованы, чтобы модулировать их поведение, активность, выживание или пролиферацию.
Композиции и применения в терапии, диагностике и прогнозировании
[00233] Как показано в данном документе, антитела по данному изобретению особенно эффективны в модулировании активности TLR3-экспрессирующих клеток, содержащих полипептиды и, следовательно, активности или поведения клеток, экспрессирующих полипептиды, например, TLR3-экспрессирующие иммунные клетки, ДК, миелоидные ДК и т.п. В определенных вариантах осуществления антитела ингибируют TLR3, например, путем блокирования TLR3 передачи сигнала, факультативно, без блокирования взаимодействия антигена или лиганда, такого как дсРНК с рецептором, тем самым ингибируя пролиферацию или активацию клеток. Композиция дополнительно содержит фармацевтически приемлемый носитель. Такие композиции также называются "композиции антител" по данному изобретению. В одном варианте осуществления композиции антител, по этому изобретению, содержат антитело, раскрытое в вариантах осуществления антител вышеупомянутых. Антитело 31C3, 29Н3, 23С8, 28F11 или 34А3 включено в объем антител, которые могут присутствовать в композициях антител, по этому изобретению.
[00234] Изобретение дополнительно обеспечивает способ модулирования активности TLR3-экспрессирующей клетки у пациента, нуждающегося в этом, включающий этап введения указанному пациенту композиции согласно изобретению. В одном варианте осуществления ингибируют активность TLR3-экспрессирующей клетки, где пациент имеет заболевание или нарушение, где такое ингибирование может стимулировать, усиливать и/или индуцировать терапевтический эффект (или стимулирует, усиливает и/или вызывает такой эффект у по меньшей мере существенной части пациентов с заболеванием или нарушением и, в основном, со сходными характеристиками, как у пациента, как можно определить, например, клиническими испытаниями).
[00235] В других вариантах осуществления способ может включать дополнительный этап введения указанному пациенту соответствующего дополнительного терапевтического агента, пригодного в лечении или профилактике заболевания, от которого страдает пациент или которому подвержен; примеры таких агентов включают иммуномодулирующий агент, гормональный агент, противовоспалительное лекарство, стероид, супрессор иммунной системы, кортикостероид, антибиотик, противовирусное или вспомогательное соединение. Такие дополнительные агенты могут быть введены пациенту как единичная лекарственная форма вместе с указанным антителом, или как отдельная лекарственная форма. Дозировка антитела (или антитела и дозировка дополнительного терапевтического агента коллективно) является достаточной, чтобы видимым образом вызывать, стимулировать и/или усиливать терапевтический ответ у пациента. При введении отдельно, антитело, фрагмент или производное и дополнительный терапевтический агент желательно вводят в определенных условиях (например, в отношении временных промежутков, числа доз и т.п.), что приводит к видимому комбинированному терапевтическому преимуществу для пациента.
[00236] Фармацевтически приемлемые носители, которые могут быть использованы в этих композициях включают, но не ограничиваются следующим: ионообменные материалы, окись алюминия, стеарат алюминия, лецитин, белки сыворотки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицерин, сорбиновая кислота, сорбат калия, частичные глицеридные смеси насыщенных растительных жирных кислот, вода, соли или электролиты, такие как сульфат калия, двузамещенный фосфорнокислый натрий, двузамещенный фосфорнокислый калий, хлорид натрия, соли цинка, коллоидная окись кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, карбоксиметилцеллюлоза натрия, полиакрилаты, воски, полиэтлен-полиоксипропилен-блок-полимеры, полиэтиленгликоль и ланолин. Антитела, по этому изобретению, могут быть использованы в способе модулирования, например, ингибирования, активности TLR3-экспрессирующих клеток у пациента. Этот способ включает этап контакта указанной композиции с указанным пациентом. Такой способ будет пригоден как для профилактических, так и для терапевтических целей.
[00237] Для применения во введении пациенту, композиция будет составлена для введения пациенту. Композиции по данному изобретению могут быть введены перорально, парентерально, с помощью ингаляционного спрея, местно, ректально, назально, защечно, вагинально или посредством имплантированного резервуара. То, что используется в данном документе включает следующее: подкожный, внутривенный, внутримышечный, внутрисуставной, внутрисиновиальный, надчревный, интратекальный, внутрипеченачный, введение внутрь пораженных тканей и внутричерепной способы инъекций или инфузий.
[00238] Стерильные формы для инъекций композиций, по этому изобретению, могут быть водной или масляной суспензией. Эти суспензии могут быть составлены согласно способам, известным в данной области техники, применяя пригодные диспергирующие или увлажняющие агенты и суспендирующие агенты. Стерильный препарат для инъекции может также быть стерильным раствором или суспензией для инъекции в нетоксическом приемлемом для парентерального введения разбавителе или растворителе, например, как раствор в 1,3-бутандиоле. Среди приемлемых инертных носителей и растворителей, которые могут быть использованы, находится вода, раствор Рингера и изотонический раствор хлорида натрия. Более того, стерильные, жирные масла обычно применяются как растворитель или суспендирующая среда. Для этой цели, любая смесь жирного масла может быть использована, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные являются пригодными в приготовлении форм для инъекции, так они являются натуральными фармацевтически приемлемыми маслами, такими как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных формах. Эти масляные растворы или суспензии могут также содержать длинноцепочечный спиртовой разбавитель или диспергирующее вещество, такое как карбоксиметилцеллюлоза или подобные диспергирующие агенты, которые обычно используются в составе фармацевтически приемлемых лекарственных форм, включая эмульсии и суспензии. Другие обычно используемые поверхностно-активные вещества, такие как Твины, Спаны (Tweens, Spans) и другие эмульгаторы или усилители биодоступности, которые обычно используются в производстве фармацевтически приемлемых твердых, жидких или других лекарственных форм, могут также использоваться для целей составления.
[00239] Композиции, по этому изобретению, могут вводиться перорально в любой приемлемой для перорального введения лекарственной форме, включая, но не ограничиваясь следующим, капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального применения, носители, которые обычно используют, включают лактозу и кукурузный крахмал. Также типично добавляют смазывающие агенты, такие как стеарат магния. Для перорального введения в форме капсулы, пригодные разбавители включают, например, лактозу. Когда водные суспензии необходимы для перорального применения, то активный ингредиент комбинируют с эмульгаторами и суспендирующими агентами. При необходимости, могут также быть добавлены определенные подсластители, ароматизаторы или красители.
[00240] Альтернативно, композиции, по этому изобретению, могут быть введены в форме суппозиториев для ректального введения. Они могут быть приготовлены путем смешивания агента с пригодным не вызывающим раздражение вспомогательным веществом, которое является твердым при комнатной температуре, но является жидким при ректальной температуре и, следовательно, будет плавиться в прямой кишке для высвобождения лекарства. Такие материалы включают масло какао, пчелиный воск и полиэтиленгликоли.
[00241] Композиции, по этому изобретению, могут также быть введены местно, особенно когда мишень лечения включает области или органы, которые являются легко доступными для местного применения, включая заболевания глаза, кожи или нижние отделы кишечника. Пригодные местные составы легко приготовить для каждой из этих областей или органов. Для местных применений композиции могут быть составлены в пригодную мазь, содержащую активный компонент, суспендированный или растворенный в одном или более носителях. Носители для местного введения соединений, по этому изобретению, включают, но не ограничиваются следующим: минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропиленовое соединение, эмульгирующий воск и вода. Альтернативно, композиции могут быть составлены в пригодный лосьон или крем, содержащий активные компоненты, суспендированные или растворенные в одном или более фармацевтически приемлемых носителях. Пригодные носители включают, но не ограничиваются следующим: минеральное масло, моносреарат сорбитола, полисорбат 60, воск цетиловых сложных эфиров, цетиариловый спирт, 2-октилдодеканол, бензоловый спирт и вода.
[00242] Местное применение для нижних отделов кишечника может быть выполнено в составе ректального суппозитория (смотри выше) или в пригодном составе клизмы. Пластыри также могут быть использованы.
[00243] Композиции, по этому изобретению, могут также быть введены с помощью назального аэрозоля или ингаляции. Такие композиции получают согласно способам, хорошо известным в области фармацевтических составов и могут быть получены в виде растворов в солевом растворе, используя бензоловый спирт или другие пригодные консерванты, промоторы абсорбции для усиления биодоступности, фторуглероды и/или другие традиционные растворяющие и диспергирующие агенты.
[00244] Некоторые моноклональные антитела, как показали, являются эффективными в клинических ситуациях, такие как Ритуксан Герцептин (транстузумаб) или Xolair (Омализумаб), и сходные режимы введения (т.е., составы и/или дозы и/или протоколы введения) могут быть использованы с антителами, по этому изобретению. Схемы и дозировки для введения антитела в фармацевтических композициях по данному изобретению могут быть определены согласно известным способам для этих продуктов, например, применяя инструкции производителя. Например, антитело, присутствующее в фармацевтической композиции, по этому изобретению, может быть поставлено в концентрации 10 мг/мл в либо 100 мг (10 мл), либо 500 мг (50 мл) флаконах для однократного применения. Продукт составляют для внутривенного введения в 9,0 мг/мл хлориде натрия, 7,35 мг/мл дигидрате цитрата натрия, 0,7 мг/мл полисорбата 80, и стерильной воде для инъекций. рН доводят до 6,5. Иллюстративный пригодный режим дозировки для антитела в фармацевтической композиции, по этому изобретению, может составлять от около 1 мг/м2 до 500 мг/м2. Тем не менее, будет очевидно, что эти схемы являются иллюстративными и что оптимальная схема и режим могут быть адаптированы, принимая во внимание аффинность и переносимость конкретного антитела в фармацевтической композиции, что должно определяться в клинических испытаниях.
[00245] Согласно другому варианту осуществления композиции антител, по этому изобретению, могут дополнительно содержать другой терапевтический агент, включая агенты,. которые обычно используют для конкретной терапевтической цели, для которой вводится антитело. Дополнительный терапевтический агент будет в норме присутствовать в композиции в количествах, типично используемых для этого агента в монотерапии для конкретного заболевания или состояния, подлежащего лечению. Такие терапевтические агенты включают, но не ограничиваются следующим: противовоспалительные агенты, стероиды, супрессоры иммунной системы, антибиотики, противовирусные агенты и другие антитела и их фрагменты.
[00246] В другом варианте осуществления два или более антител, по этому изобретению, имеющее различные перекрестные реактивности, например, антитела, которые специфически связываются с отличными эпитопами в TLR3 полипептиде, комбинируют в отдельную композицию, так чтобы направляться на как можно больше отличных TLR3 генных продуктов, например, чтобы учесть разнообразие в полипептидах в пределах особи или у различных пациентов, и сделать это как можно эффективнее. Более того, композиция антител, по этому изобретению, может содержать множественные антитела, которые распознают отдельный TLR3 эпитоп.Такие комбинации будут снова обеспечивать более широкую применимость в терапевтической постановке.
[00247] Данное изобретение также обеспечивает способ модулирования активности TLR3-экспрессирующих клеток у пациента, нуждающегося в этом, включающий этап введения композиции, согласно этому изобретению, указанному пациенту. Способ более специфически направлен на снижение активности TLR3 клеток у пациентов, имеющих заболевание, при котором сниженная активность TLR3 клеток является преимущественной (например, аутоиммунные заболевания, воспалительные заболевания, инфекционное заболевание, вирусная инфекция), или которое вызывается или характеризуются излишней активностью TLR3 клеток.
[00248] Заболевания и состояния, при которых данные способы могут применяться, включают все заболевания, где модулирование TLR3 может быть преимущественным, включая, например, заболевания, опосредованные или обостренные частично или полностью TLR3 передачей сигнала или цитокинами, продуцируемыми при указанной TLR3 передаче сигнала. В частности, если используют антитела, которые ингибируют TLR3 передачу сигнала, то такие нарушения включают любые нарушения, опосредованные или обостренные частично или полностью TLR3 передачей сигнала или цитокинами, продуцируемыми при указанной TLR3 передаче сигнала, включая, среди прочего, иммунные нарушения, такие как воспалительные заболевания и аутоиммунные заболевания. Более специфически, способы по данному изобретению используются для лечения разнообразия иммунных нарушений и других заболеваний, включая, но не ограничиваясь следующим: аутоиммунное заболевание, воспаление, аллергия, астма, инфекции (например, хроническая инфекция, вирусная инфекция) и сепсис. Примеры заболеваний, которые могут лечиться с помощью антител, которые ингибируют TLR3 передачу сигнала, включают, но не ограничиваются следующим: артрит, системная красная волчанка, сепсис, астма, остеопороз, аутоиммунность к антигенам центральной нервной системы, аутоиммунный диабет, воспалительное заболевание кишечника, аутоиммунный кардит, аутоиммунный гепатит.
[00249] Другие иммунные нарушения, которые поддаются лечению с помощью антител, которые ингибируют TLR3 передачу сигнала, согласно данному изобретению, включают, среди прочего, аутоиммунные нарушения и воспалительные нарушения, включая, но не ограничиваясь следующим: болезнь Крона, глютенчувствительная целиакия, язвенный колит, синдром раздраженного кишечника, острый рассеянный энцефаломиелит (ADEM), аддисонова болезнь, синдром антифосфолипидных антител (APS), апластическая анемия, аутоиммунный гепатит, сахарный диабет, синдром Гудпасчера, базедова болезнь, синдром Гийена-Барре (GBS), тиреоидит Хашимото, красная волчанка, димиелинизирующее состояние, рассеянный склероз, миастения гравис, синдром опсоклонус-миоклонус (OMS), неврит зрительного нерва, тиреоидит Орта, пузырчатка, цирроз, псориаз, ревматоидный артрит, синдром Рейтера, артериит Такаясу, височный артериит, аутоиммунная гемолитическая анемия с синдромом тепловых агглютининов, гранулематоз Вегенера, аппендицит, артериит, артрит, блефарит, бронхиолит, бронхит, бурсит, цервицит, холангит, холецистит, хориоамнионит, колит, конъюнктивит, цистит, дакриоаденит, дерматит, дерматомиозит, энцефалит, эндокардит, эндометрит, энтерит, энтероколит, эпикондилит, эпидидимит, фасциит, фиброзит, гастрит, гастроэнтерит, гингивит, гепатит, гнойный гидраденит, илеит, ирит, ларингит, мастит, менингит, миелит, миокардит, миозит, нефрит, омфалит, оофорит, орхит, остеит, отит, панкреатит, паротит, перикардит, перитонит, фарингит, плеврит, флебит, пневмонит, проктит, простатит, пиелонефрит, ринит, сальпингит, синусит, стоматит, синовит, тендинит, тонзилит, увеит, вагинит, васкулит и вульвит.
[00250] Данные антитела могут быть включены в наборы. Наборы могут факультативно дополнительно содержать любое число антител и/или других соединений, например, 1, 2, 3, 4 или любое другое число терапевтических антител и/или соединений. Будет очевидно, что это описание содержимого наборов не является каким-либо образом ограничивающим. Например, набор может содержать другие типы терапевтических соединений. Предпочтительно, наборы также включают инструкции по применению антител, например, детализирующие, описанные в данном документе, способы.
[00251] Дополнительно аспекты и преимущества, по этому изобретению, будут раскрыты в следующем экспериментальном разделе, который должен рассматриваться как иллюстративный и не ограничивающий объем данной заявки.
ПРИМЕРЫ Материалы и способы
[00252] Интерферон-альфа (IntronA™) покупали у Schering Plough Corp.Опухолевые клеточные линии: А375 линии опухолевых клеток злокачественной меланомы (CRL-1619) покупают у АТСС. Антитела (антиген, поставщик, эталон): Анти-TLR3 антитело ПАТ, R&D Systems, ref. AF1487. Приборное обеспечение: FACSCalibur™ проточный цитометр (BD Biosciences).
Ингибирование с помощью shPHK лентивируса
[00253] Изготавливали и производили с помощью Vectalys (Toulouse, Франция), лентивирусную конструкцию, кодирующую короткую шпилечную РНК (shPHK), направленную на контроль TLR3 человека. Опухолевые клетки инфицировали лентивирусным препаратом и дополнительно подвергали селекции с пуромицином для получения устойчивых shTLR3 A375 опухолевых клеток.
Поверхностный плазменный резонанс (SPR)
[00254] (а) Общие Biacore T100 способы. SPR измерения проводили на Biacore Т100 приборе (Biacore GE Healthcare) при 25°С. Во всех Biacore экспериментах HBS-EP+буфер (Biacore GE Healthcare) или 10 мМ ацетат натрия рН 5,6, 150 мМ NaCl, 0,05% Р2O служил в качестве буфера обработки, и сенсограммы анализировали с помощью Biaevaluation 4.1 и Biacore T100 Evaluat10n программного обеспечения. Рекомбинантный TLR3 человека покупали у R&D Systems.
[00255] (b) Иммобилизация белка. Рекомбинантный TLR3 белок иммобилизировали ковалентно с карбоксильными группами в декстрановом слое Biacore Series 5 сенсорного чипа СМ5 (чип). Поверхность чипа активировали EDC/NHS (0,2М N-этил-N-(3-диметиламинопропил) карбодиимидгидрохлорид, 0,05 М N-гидроксисукцинимид (Biacore GE Healthcare)). Белки разводили до 10 мкг/мл в буфере связывания (10 мМ ацетата натрия, рН 5,6) и вводили инъекцией, пока не достигали соответствующего уровня иммобилизации (т.е. приблизительно 2000 RU (условных единиц) для экспериментов по связыванию и 600 RU для экспериментов по аффинности). Деактивацию оставшихся активированных групп проводили, применяя 100 мМ этаноламин рН 8 (Biacore GE Healthcare).
[00256] (с) Анализ связывания антител проводили, применяя HBS-EP+(нейтральный рН). Антитела в концентрации 10 мкг/мл вводили инъекцией в течение 2 мин при постоянной скорости потока 10 мкл/мин поверх иммобилизированных белков и оставляли диссоциировать в течение 3 мин. до регенерации с помощью десятисекундной инъекции 10 мМ NaOH, 500 мМ NaCl буфера регенерации. Поправку на контроль проводили он-лайн путем совместной инъекции растворимых антител на эталонную декстрановую проточную ячейку.
[00257] (d) Исследование конкуренции в кислотном буфере (рН 5,6). Скорость потока устанавливали на 10 мкл/мин, первое антитело в концентрации 50 мкг/мл (или полиAU в концентрации 100 мкг/мл) вводили инъекцией в течение 2 мин, 3 раза последовательно, чтобы насытить rhTLR3 поверхность. Второе антитело затем вводили инъекцией в течение 2 мин также в концентрации 50 мкг/мл и оставляли диссоциировать в течение 3 мин до регенерации путем 15 секундной инъекции 10 мМ NaOH, 500 мМ NaCl буфера регенерации. Поправку на контроль проводили также он-лайн и вычитали кривую, применяя насыщающее антитело (или нуклеиновую кислоту) с последующей инъекцией буфера, для удаления сигнала, вызванного диссоциацией первого комплекса. Полученный сигнал сравнивали с тем, который получали путем инъекции второго антитела непосредственно на rhTLR3 поверхность.
Исследование люциферазного репортера.
[00258] Проводили исследование репортерного гена, применяя в качестве промотора ISRE (элемент IFN-стимулированного ответа) и в качестве репортерного гена, и белка люциферазы. 293Т клеточную линию (АТСС, #CRL-1573) стабильно трансфектировали с pISRE-luc плазмидой (#219089 -Stratagene), далее отбирали как индуцирующую оптимальный ответ к IFN-альфа стимуляции и называли контролем 293T-ISRE. Эту клеточную линию далее стабильно трансфектировали с различными плазмидами: pUNO-hTLR3 плазмидой (#puno-htlr3 - InVivogen) и называли 293T-TLR3-ISRE. На 0 день, клетки высевали 4×105 клеток/мл в целую культуральную среду в 96-луночный культуральный планшет (100 мкл/лунка). Клетки вначале инкубировали при 37°С в течение 20 часов, затем 50 мкл среды удаляли и клетки активировали с помощью 100 мкл/лунка конечного из увеличенных количеств полиАU вместе с различными концентрациями анти-TLR3 антител. Клетки, проинкубированные в свежей среде, будут использоваться как фоновая люциферазная активность. Клетки инкубируют при 37°С в течение 6 часов. 100 мкл свеже-оттаянного Steady Glo (Promega) добавляли в каждую лунку, планшеты инкубировали 10 мин при комнатной температуре (КТ) в темноте и свет, излученный из каждой лунки посчитывали как число импульсов в секунду (CPS) на приборе гамма-счетчике (TopCount).
Пример 1 - Создание TLR3-специфических моноклональных антител
Иммунизация #7
[00259] Тесты первого уровня. Для получения анти-TLR3 антител Balb/c мышей иммунизировали рекомбинантным белком рекомбинантного His-меченого TLR3 экстраклеточного домена человека (R&D Systems, #1487-TR-050). Мыши получали одну первичную иммунизацию с эмульсией 50 мкг TLR3 белка и полного адьюванта Фрейнда, интраперитонеально, вторичную иммунизацию с эмульсией 50 мкг TLR3 белка и неполного адьюванта Фрейнда, интраперитонеально, и три вторичные дозы 10 мкг TLR3 белка, внутривенно. Иммунные клетки селезенки были слиты с X63.Ag8.653 иммортализованными В-клетками, и их культивировали в присутствии облученных клеток селезенки. 40 культуральных планшетов получали и оценивали в тестах первого уровня в отношении TLR3 связывания, применяя ELISA, разработанный для обнаружения связывания с TLR3. Кратко, His-меченый рекомбинантный TLR3 белок (R&D Systems, #1487-TR-050) наносили на Ni-NTA 96-луночные планшеты (Qiagen). Супернатант (SN) от гибридомных культуральных планшетов инкубировали в TLR3-планшетах, и присутствие TLR3 связывания Ig обнаруживали с помощью анти-мышиного F(ab) IgG-HRP козла. Положительные супернатанты собирали и испытывали на отсутствие связывания с TLR4. Кратко, His-меченый рекомбинантный TLR4 белок (R&D Systems, #3146-TR-050) наносили на Ni-NTA 96-луночные планшеты (Qiagen). SN от гибридомных культуральных планшетов инкубировали в TLR4-nnaHiueTax, и присутствие TLR4 связывания Ig обнаруживали с помощью анти-мышиного F(ab) IgG-HRP козла. TLR4 выбирали в качестве тестов второго уровня для того, чтобы различить среди лунок, выбранных в тестах первого уровня, где было использовано анти-His специфическое антитело от TLR3 специфического антитела. Во-вторых, принимая во внимание гомологию между TLR3 и другими членами TLR семейства, начальная оценка показала, что, по меньшей мере, одно коммерчески доступные моноклональное антитело (MAT), для которого указано на его упаковке, что оно специфично для TLR3 белка, тем не менее, распознавало погруженные в парафин 293Т клетки, стабильно трасфектированные с TLR4.
[00260] Тесты второго уровня; выбор гибридом, представляющих интерес. 168 супернатантов сохраняли и испытывали в дополнительном тесте в Biacore исследовании, применяя рекомбинантные TLR3 чипы, с последующими различными форматами исследований, основанными на связывании с TLR3 -экспрессирующими 293Т клетками человека. 293Т клеточную линию (АТСС, #CRL-1573), стабильно трансфектированную с pISRE-luc плазмидой (#219089 - StratareH), далее отбирали как индуцирующую оптимальный ответ на IFN-альфа стимуляцию и называли контрольными 293Т клетками. Эту клеточную линию далее стабильно трансфектировали pUNO-hTLR3 плазмидой (#puno-htlr3 - InVivogen), или pUNO-hTLR4 плазмидой (#puno-tlr4 - InVivogen) и называли соответственно 293T-TLR3 и 293T-TLR4. Супернатанты тестировали в основанном на FACS тесте для связывания с 293T-TLR3 клетками с отсутствием связывания с 293Т контрольными клетками, и в параллели в IHC тесте для связывания с 293T-TLR3 клетками в виде замороженного осадка клеток, с отсутствием связывания с 293T-TLR4 клетками. Лунки, отобранные в IHC тесте для связывания с 293T-TLR3 клетками в виде замороженного осадка клеток, также дополнительно испытывали в IHC тесте для связывания с 293T-TLR3 клетками в виде осадка клеток, погруженных в парафин. Кратко, для FACS скрининга, присутствие реагирующих антител в супернатантах обнаруживали с помощью анти-мышиного поликлонального антитела (ПАТ) козла, меченого биотином, меченых стрептавидином с РЕ (пероксидаза). Для IHC скрининга присутствие реагирующих антител (AT) в супернатантах обнаруживали с помощью анти-мышиного ПАТ осла, меченого биотином (#715-065-150, Jackson Immunoresearch Laboratories), меченых стрептавидином с пероксидазом (#Е2886, SIGMA) и обнаруженным с помощью DAB (#SK-4105, Vector Laboratories).
[00261] Клонирование гибридом, представляющих потенциальный интерес.42 представляющих потенциальный интерес гибридом, выбранных из тестов начального уровня, клонировали с помощью способов ограничивающего разведения в 96-лу ночных планшетах, и 304 субклонов испытывали в серии тестов, как описано ниже. 304 субклона вначале оценивались в тесте на TLR3 связывание, применяя такой же ELISA, разработанный для обнаружения связывания с TLR3, и положительные супернатанты выбирали и испытывали на отсутствие связывания с TLR4 в ELISA исследовании, которое дало 228 клонов, которые были селективными для TLR3. Все супернатанты, дающие соотношение выше 10 для DO, полученной в TLR3 ELISA, к DO, полученной в TLR4 ELISA, были отобраны как специфические для TLR3. Среди них были супернатанты из лунки C3 планшета 31 (31C3), лунки Н3 планшета 29 (29Н3), лунки Е7 планшета 23 (23Е7), лунки С8 планшета 23 (23С8) и лунки F11 планшета 28 (28F11). 31C3, 29Н3, 23С8 и 28F11 принадлежали изотипу IgGl.
[00262] Среди 304 клонов, 63 клонов, выбранных как происходящие от преклонов, испытанных положительно в замороженном IHC, также были испытаны в замороженном IHC тесте для связывания с 293T-TLR3 клетками в виде замороженного осадка клеток, с отсутствием связывания с 293T-TLR4 клетками, давая на выходе 31 положительный клон в замороженном IHC.
[00263] Среди 71 клонов, положительных в FACS окрашивания и 31 клонов, положительных в замороженном IHC, 41 клон был отобран для криоконсервации из 304 начальных клонов.
Иммунизация #2
[00264] Первоначальные тесты. Дополнительные серии иммунизации были проведены для того, чтобы создать различные антитела. Применяя экспериментальную установку, сходную с таковой для первых серий иммунизации, Balb/c мышей иммунизировали, иммунные клетки селезенки подвергли слиянию и их культивировали в присутствии облученных клеток селезенки. Культуральные планшеты получали и оценивали в тестах первого уровня на TLR3 связывание, применяя ELISA, разработанный для обнаружения связывания с TLR3. 263 клоны из 2840 были отобраны для тестов второго уровня.
[00265] Вторичные тесты; отбор гибридом, представляющих интерес. 263 супернатантов сохраняли и испытывали в дополнительном тесте в испытании ингибирования на 293T-TLR3 клетках. Клоны, имеющее ингибирующий эффект выше 95%, были отобраны. Среди них были супернатанты из лунки A3 планшета 34 (34А3).
Пример 2 - TLR3 модуляция
[00266] Миелоидные ДК (MdDC) были получены из РВМС (мононуклеаров периферической крови) путем выделения РВМС у нормальных здоровых доноров-людей. Моноциты были очищены от РВМС, применяя положительную селекцию с CD 14 микробусин человека (Miltenyi Biotech) согласно общим инструкциям. Из моноцитов далее получали ДК (MdDC) путем 5-6 дней инкубации в GM-CSF (гранулоцито-макрофаго-колониестимулирующий фактор) человека (Leucomax, SP) и IL-4 человека (R&D Systems) соответственно 200 нг/мл и 20 нг/мл.
[00267] Полученные MdDC затем высевали 106 клеток/мл, в двух повторностях, в 96-луночные планшеты с плоским дном. Клетки активировали в течение 20 часов в конечном объеме 200 мкл, вместе с анти-TLR3 антителами в установленных концентрациях. Увеличеные количества полиАП (30, 100, 300 и 900 мкг/мл) добавляли к лункам для получения считывания данных об эффекте дозы.
[00268] Супернатанты собирали через 20 часов стимуляции, замораживали при -20°С, и дополнительно исследовали на IL-6 и IP-10, применяя ферментный иммуносорбентный анализ. Клетки затем собирали, окрашивали для маркеров активации CD86 (с a.huCD86 мыши, IgGI, FITC, BD Biosciences, номер 555657), с обнаружением с применением FACSCanto™ проточного цитометра (BD Biosciences).
[00269] Фигуры 1 и 2 иллюстрируют ингибирующие свойства антител 31C3 и 29Н3 (оба принадлежат изотипу IgGI) относительно клеточной активации CD86 и секреции IL-6, IP-10. Анти-TLR3 антитела 31С3.1 и 29Н3.7 противодействуют, in vitro, TLR3-опосредованной активации миелоидной ДК, более того, эти антитела эффективно отрицательно регулируют TLR3-опосредованную CD83/CD86 экспрессию и аннулируют TLR3-опосредованную цитокиновую/хемокиновую секрецию, в частности IP-10 и IL-6.
[00270] F(ab)'2 фрагменты были созданы из антител 31С3.1 и 29Н3.7 с помощью папаинового отщепления и очищения с помощью ионообменной хроматографии на MonoQ 5/50 GL, анализируемой с помощью SDS-PAGE (электрофорез в полиакриламидном геле с применением додецилсульфата натрия), и испытывали на ингибирование в отношении CD86 клеточной активации и цитокиновой секреции. F(ab)'2 фрагменты обоих антител, 31С3.1 и 29Н3.7, эффективно отрицательно регулировали TLR3-опосредованную CD83/CD86 экспрессию и аннулировали TLR3-опосредованную цитокиновую/хемокиновую секрецию, в такой же степени, что и полноразмерные антитела. Фигура 3 показывает результаты для антитела 31C3, где F(ab)'2 фрагменты антитела 31C3 и целое 31C3 IgG аннулируют TLR3-опосредованную экспрессию CD86 и секрецию IP-10 в одинаковой степени; Фигура 4 показывает то же для F(ab)'2 фрагментов антитела 29Н3.
[00271] В сходном эксперименте способность 28F11 и 23С8 антител ингибировать TLR3 передачу сигнала была оценена по сравнению с антителом 31C3. Антитела испытывали в концентрации 50 мкг/мл в присутствии повышенной дозы полиAU. Результаты показаны на Фигурах 14А и 14 В, указывая на ингибирующие свойства антител согласно данному изобретению.
[00272] Антитело 34А3 было также испытано в сходной постановке. В этот раз клетки (MdDC) стимулировались с помощью фиксированной дозы полиАU (300 мкг/мл) и повышенные дозы антитела добавляли к среде. Фигуры 19А и 19В иллюстрируют результаты для антитела 34А3, в сравнении с 31C3 относительно секреции IL-6 и IP-10.
Пример 3 - Бивалентная аффинность
[00273] Свойства связывания антител 29Н3.7, 23Е7.3, 31С3.1 и коммерчески доступных антитела TLR3.7 (eBiosciences) и 40С1285 (Abeam) сравнивали, применяя способы, описанные для SPR, пункт с). Фигура 5 показывает, что аффинность связывания для TLR3 значительно лучше в случае с 29Н3.7 и 31С3.1, чем в случае коммерчески-доступных антител.
[00274] Связывание с TLR3 определяли в нейтральных (рН 7,2) и кислых (рН 5,6) условиях, и рассчитывали K(D) значения. Результаты (среднее от 2 или 3 экспериментов) показаны в Таблице 1. При нейтральном рН, 23Е7, 29Н3.7 и 31С3.1 все показывали сильную и сходную бивалентную аффинность (KD) для рекомбинантного TLR3 человека, лучше чем 100 пикомолярная (около 50 пикомолярная). Антитело TLR3.7 (eBiosciences) в сравнении показывало значительно более низкую аффинность связывания. При кислом рН, тем не менее, 23Е7 теряли значительную аффинность связывания и его KD составляла около 4 наномолярная. Аффинность 31C3, 23С8, 28F11 и 34А3 измеряли в таких же условиях в отдельном исследовании, результаты представлены в Таблице 1 и на Фигуре 15. Эти результаты показывают, что антитела согласно данному изобретению имеют высокую аффинность, особенно в кислотном рН.
Пример 4 - Картирование эпитопа
[00275] Картирование эпитопа в кислом рН. Конкурентные анализы проводили согласно способам, описанным для SPR, пункт d) при рН 5,6. Фигура 6 показывает, что антитела 29Н3.7 и 31С3.1 были способны связывать TLR3 без конкуренции с полиАU, сходным образом. Фигуры 16А и 16В показывают, что антитела 28F11, 34A3 и 23C8 были способны связывать TLR3 без конкуренции с полиAU. 29Н3.7, 31С3.1, 28F11, 34A3 и 23C8, таким образом, способны ингибировать дсРНК передачу сигнала без конкуренции с эпитопом дсРНК на TLR3. Фигура 7 показывает конкуренцию между антителами 29Н3.7 и 31С3.1. Так как связывание с TLR3 одним антителом ослабляет связывание с TLR3 других (около 90% ингибирования одним антителом других), то можно предположить, что эти два антитела конкурируют за сходный эпитоп на TLR3. Сходным образом. Фигуры 15А и 15В показывают конкуренцию между антителом 31C3 с антителами TLR307, 23C3, 28F11 и 29Н3. Фигура 15А показывает связывание в отсутствие любого конкурирующего антитела, тогда как Фигура 15В показывает уровень связывания после насыщения hTLR3 чипа 31C3. Потеря в уровне связывания отражает помеху, вызванную 31C3 антителом, и подчеркивает конкуренцию за связывание между испытуемыми антителами. TLR3.7 уровень связывания, будучи не затрагеваемым 31C3 конкуренцией, подчеркивает, что антитела конкурируют за различные эпитопы, тогда как снижение в уровне связывания для всех другие антитела подчеркивает, что они все конкурируют с 31C3 за одинаковый эпитоп.
[00276] Картирование эпитопа при нейтральном рН. Конкурентные анализы проводили согласно способам, описанным для SPR, при рН 7,2. Антитела 29Н3.7 и 31С3.1 конкурировали друг с другом за связывание с TLR3, поскольку связывание одним антителом снижало связывание с TLR3 других. Картирование эпитопа было проведено также с коммерческим антителом TLR3.7 и антителом 23Е7.3. Эти антитела не конкурировали за связывание с TLR3 с любым из антител: 29Н3.7 и 31C3. Тем не менее, антитело TLR3.7 не конкурирует за связывание с TLR3 с - антителом 23Е7.3, указывая, что они имеют перекрывающийся сайт связывания.
[00277] Аффинность связывания 34А3 антитела измеряли или отдельно на rhTLR3 чипе, или в условиях, где ATLR3 чип насыщали 31C3 антителом до добавления 34А3. Результаты показаны на фигуре 17, и обеспечивают доказательство, что два антитела конкурируют за связывание с hTLR3, таким образом, разделяя общую эпитопную детерминанту с учетом их перекрывающихся сайтов связывания.
[00278] Фигура 8 показывает молекулярные карты поверхности экстраклеточных доменов TLR3 белка человека, созданные компьютерным моделированием, применяя SwissPdb Viewer 4.0 (Guex и Peitsch (2007) Electrophoresis 18: 2714-2723), основанный на данных, общедоступных как файл данных 1ZIW из базы данных Ресурсов для исследования биологических макромолекул от проекта Банка данных о белках (PDB) Европейского института биоинформатики (Hinxton U.K.). С-конец находится слева и N-конец находится справа на данном изображении, показывая поверхность TLR3, которая, в основном, свободна от гликозилирования, при этом другая поверхность тщательно скрыта углеводами (смотри например, Choe et al. (2005) Science 309:581-585). Карта поверхности на правой стороне на Фигуре 8 показывает электростатический потенциал TLR3 полипептид человека в нейтральном рН, нанесенным на карту молекулярной поверхности. Главные области положительного электростатического потенциала указаны стрелками, образуя общую область положительного и нейтрального потенциала на свободной от гликозилирования поверхности С-концевой стороны. Свободная от гликозилирования поверхность, как полагают, доступна для взаимодействия со вспомогательными молекулами лигандов или TLR3 мономерами или другими олигомерными ансамблями, и область положительного электростатического потенциала на С-концевой стороне (в темной штриховке, главные положительные области обозначены стрелками), как считают, соответствует области дсРНК связывания. Эти области также показаны на Фигуре 5 Choe et al. (2005). Карта левой стороны показывает аминокислотные остатки, определенные путем исследований мутаций, которые вовлечены в дсРНК связывание, где остатки дсРНК связывания ингибировались (>80%) мутацией остатков Н539, N541, N466, R489, N517 или N540, и где дсРНК связывание ингибировалось (>80%) мутацией остатков К117, К137 и К139. Модель, предложенная в Choe et al. (2005), состоит в том, что TLR3 образует гомодимер, где граница димеризации лежит ближе к С-концевой области на поверхности, свободной от гликозилирования, и что дсРНК связывается только со свободной от гликозилирования поверхностью TLR3, так что два TLR3 мономера могут формировать сэндвич дсРНК в комплексе из двух TLR3 мономеров и одной дсРНК нити. Модель, включающая олигомерный комплекс TLR3, сформированный множественными димерами TLR3 связывания с более длинными дсРНК цепями, также была предложена (смотри например. Bell et al. (2006) PNAS USA 103(23): 8792-8797). Ranjith-Kumar et al. (2007) J.Biol. Chem. 282(10): 7668-7677 предположили, что TLR3 может существовать в
[00282] В следующем испытании ингибирующие свойства антител согласно изобретению были оценены в ситуации воспаления в присутствии IFNα. Кратко, испытывали три различных состояния. В состоянии 1 (фигура 11А), секрецию IP-10 оценивали без какой-либо предварительной обработки; в состоянии 2 (фигура 11В), секрецию IP-10 оценивали после 24 часобой предварительной обработки IFNα (1000 UI/мл); в состоянии 3 (фигура 11С), секрецию IP-10 оценивали после 24 часовой предварительной обработки полиАО (300 мкг/мл), затем добавляли диапазон доз дсРНК (поли 10 для Фигур 11А и 11 В, полиАП для Фигуры 11С) и анти-TLR3 антитело, либо 31C3, либо 23С8, в концентрации 50 мкг/мл, секрецию IP-10 оценивали количественно (в мкг/мл) через 24 часов, применяя ELISA.
[00283] Результаты, представленные на фигуре 11, освещают, что антитела согласно данному изобретению остаются хорошими ингибиторами TLR3 даже в присутствии стимулирующих молекул, либо дсРНК, либо воспалительных цитокинов. Такие условия воспроизводят ранее установленные воспалительные заболевания.
Пример 6 - FACS окрашивание
[00284] Кратко, 293Т или 293T-ISRE/TLR3 клеточные линии собирали, среду отмывали и клетки фиксировали и пермеабилизировали, применяя IntraPrep™ реагент для пермеабилизации от Beckman Coulter, следуя инструкции производителя. Пермеабилизированные клетки затем инкубировали при КТ в течение 20 мин с 25 мкг/мл 31C3 антитела, далее обнаруженные с помощью антимышиного антитела козла, меченого FITC. Графики представлены на Фигуре 13. Фигура 13А представляет отрицательный контроль на НЕК293Т клеточной линии. Фигура 13 В представляет окрашивание, полученное на HEK293T-TLR3 клетках. Клетки, инкубированные с контрольным изотипным антителом, вместо 31C3 анти-TLR3 антитела, были неокрашенными.
[00285] Окрашивание, полученное, применяя антитело 31C3 в пермеабилизированных клетках, указывает на то, что антитела специфически распознают и связывают внутриклеточный TLR3 человека в клетках.
Пример 7 - Кинетические исследования
[00286] Другой набор исследований был проведен для определения кинетики ингибирования антител согласно данному изобретению. Кратко, MdDC инкубировали с анти-TLR3 антителом (31C3 или 23С8, в концентрации 50 мкг/мл) и диапазоном доз полиAU в различных временных установках. Среду затем проинкубировали в течение 24 часов и секрецию IP-10 измеряли с помощью ELISA. Фигура 12А представляет секрецию IP-10 в нг/мл (в зависимости от доз полиAU) для 31C3 антитела; Фигура 12 В представляет результаты для 23С8 антитела.
[00287] Пре-стимуляция: Анти-TLR3 антитело инкубировали 1 час 30 мин. до добавления дсРНК.
[00288] Ко-стимуляция: Анти-TLR3 антитело и дсРНК добавляли одновременно.
[00289] Пост-стимуляция: дсРНК инкубировали 1 час 30 мин. до добавления анти-TLR3 антитела.
[00290] Эти результаты подчеркивают, что антитела согласно данному изобретению являются эффективными для TLR3 ингибирования вне зависимости от состояния связывания дсРНК с TLR3 белком. Антитела не конкурируют с сайтом связывания дсРНК, но еще способны ингибировать TLR3 передачу сигнала, даже когда дсРНК уже связалась с TLR3 белком.
Пример 8 - Исследования TLR3 интернализации
[00291] Кратко, либо без антитела, либо 50 мкг/мл aHTH-TLR3 антитела 31C3 инкубировали с живыми 293T-ISRE/TLR3 клеточными линиями, в течение 2 часов или 24 часов при 37°С. Клетки затем отмывали, фиксировали и пермеабилизировали, применяя IntraPrep реагент для пермеабилации от Beckman Coulter. Присутствие TLR3 -связанного анти-TLR3 31C3 AT обнаруживали с помощью анти-мышиного AT козла, меченного АРС. Альтернативно, пермеабилизированные клетки инкубировали либо с контрольным изотипом, либо с TLR3 специфическим MAT, эффективным в FACS, не конкурирующим с 31C3 AT за TLR3 связывание, оба меченые биотином, и дополнительно обнаруживали посредством инкубации клеток с флюоресцентным производным стрептавидина. Графики представлены на Фигуре 12. Фигура 12А представляет отрицательный контроль, представляющий интенсивность флюоресценции 293T-ISRE/TLR3 клеток в отсутствие антитела, связывающего TLR3 белки. Фигура 12В показывает устойчивый уровень TLR3 экспрессии в 293T-ISRE/TLR3 клеточных линиях, без прединкубации с 31C3 антителом.
[00292] Те результаты показывают, что антитела, согласно данному изобретению, быстро и эффективно интенализируются, более того без какой-либо hTLR3 отрицательной модуляции. Эти результаты подчеркивают эффективность связывания антител, согласно данному изобретению. Более того, эта быстрая интернализация обеспечивает доказательство того, что антитела являются перспективными кандидатами для терапии. Такие антитела также являются перспективными кандидатами для объединения с токсическим агентом, тем самым, позволяя проводить специфическую направленность на TLR3 экспрессирующие клетки.
[00293] Все заголовки и подзаголовки используются в данном документе только для удобства и не должны рассматриваться как ограничивающие данное изобретение киким-либо образом. Любая комбинация вышеописанных элементов во всех их возможных вариациях включена в данное изобретение, если только иное не указывается в данном документе или иное четко не противоречит контексту. Подразумевается, что перечисление диапазонов значений в данном документе служит лишь в качестве сокращенным способом сослаться индивидуально на каждое отдельное значение в пределах диапазона, если только обратное не указано в данном документе, и каждое отдельное значение включено в описание данного изобретения так, как если бы оно перечислено было в данном документе индивидуально. Если не указано иное, все точные значения, обеспеченные в данном документе, являются типичными для соответствующих приближенных значений (например, все точные иллюстративные значения, обеспеченные в отношении конкретного фактора или измерения, могу рассматриваться также как обеспечивающие соответствующее приближенное измерение, модифицированное с помощью «около», где это уместно).
[00294] Все способы, описанные в данном документе, могут быть проведены в любом пригодном порядке, если иное не указано в данном документе или иное четко не противоречит контексту.
[00295] Применение любого и всех примеров, или иллюстративного выражения (например, "такие как"), которые обеспечиваются в данном документе, подразумевается только для лучшего освещения данного изобретения и не представляет собой ограничение объема данного изобретения, если не определено иное. Ни одно выражение в описании данного изобретения не должно рассматриваться как указание, что любой элемент является существенным для практического осуществления данного изобретения, если только оно не сказано однозначно.
[00296] Цитирование и включение патентных документов в данный документ проведены только для удобства и оно не отражает какой-либо аспект действия патента, патентоспособности и/или обладания законной силой таких патентных документов. Описание в данном документе любого аспекта или варианта осуществления данного изобретения, применяя выражения, такие как ссылка на элемент или элементы подразумевается для обеспечения поддержки для сходного аспекта или варианта осуществления данного изобретения, который "состоит из", "состоит, главным образом, из" или "в основном, содержит" этот конкретный элемент или элементы, если иное не установлено или иное четко не противоречит контексту (например, композиция, описанная в данном документе, как содержащая конкретный элемент, должна пониматься как также описание композиции, состоящей из этого элемента, если иное не установлено или иное четко не противоречит контексту).
[00297] Это изобретение включает все модификации и эквиваленты цели, перечисленной в аспектах или формуле данного изобретения, присутствующей в данном документе для максимальной широты, допустимой применимым правом.
[00298] Все публикации и патентные заявки, цитируемые в этом описании данного изобретения, включены в данный документ ссылкой в их полноте так, как если бы для каждой отдельной публикации или патентной заявки было специфически и отдельно указано, что они включены ссылкой.
[00299] Хотя описанное выше изобретение было описано в некоторых деталях для иллюстрации и примера для целей простоты понимания, будет достаточно очевидно для специалиста в данной области техники в свете идей этого изобретения, что определенные изменения и модификации могут быть произведены, не отклоняясь от сущности и объема приложенной формулы данного изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ БЕЛКА РЕЦЕПТОРА С-МЕТ | 2011 |
|
RU2608644C2 |
| АНТИТЕЛА ПРОТИВ CD19 ЧЕЛОВЕКА, ОБЛАДАЮЩИЕ ВЫСОКОЙ АФФИННОСТЬЮ | 2016 |
|
RU2761077C1 |
| АНТИТЕЛА ПРОТИВ G-CSFR И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2605595C2 |
| ВАРИАНТЫ КОШАЧЬИХ АНТИТЕЛ | 2021 |
|
RU2840969C1 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ LIGHT И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2542394C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К ФАКТОРУ D И ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2474589C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНОЙ БОЛИ | 2009 |
|
RU2467765C2 |
| АНТИТЕЛА, РАСПОЗНАЮЩИЕ СОДЕРЖАЩИЙ УГЛЕВОДЫ ЭПИТОП НА CD-43 И СЕА, ЭКСПРЕССИРУЕМЫХ НА ЗЛОКАЧЕСТВЕННЫХ КЛЕТКАХ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2616868C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ АМИЛОИДА-БЕТА ПРИ ГЛАЗНЫХ ЗАБОЛЕВАНИЯХ | 2008 |
|
RU2571859C2 |
| АНТИКИНОВЫЕ АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТСЯ С НЕСКОЛЬКИМИ СС-ХЕМОКИНАМИ | 2010 |
|
RU2574786C2 |


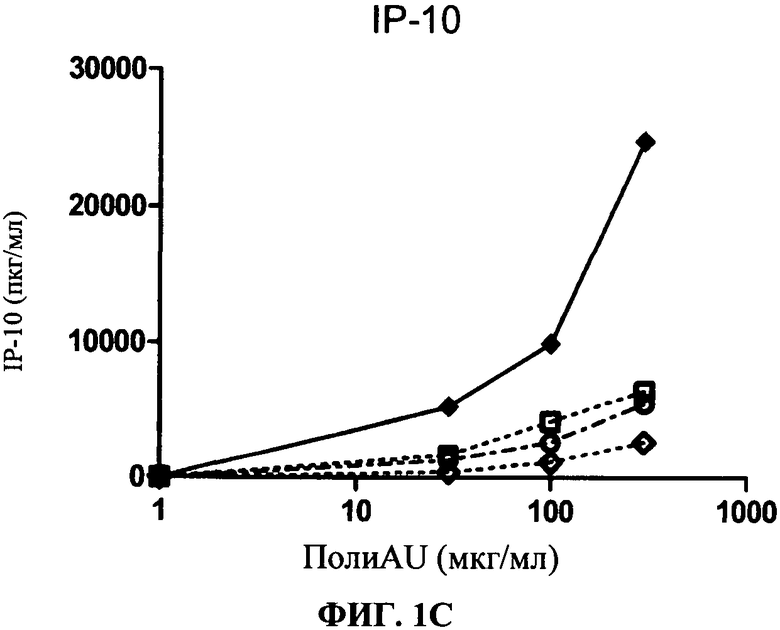

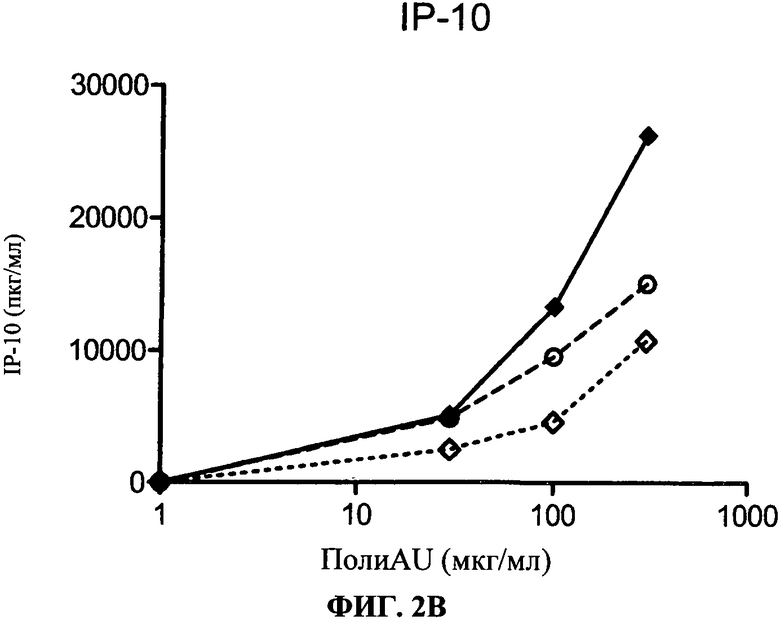

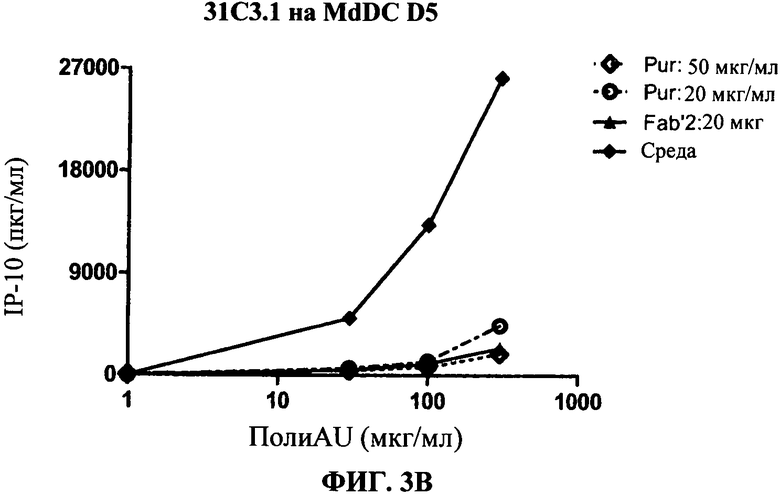
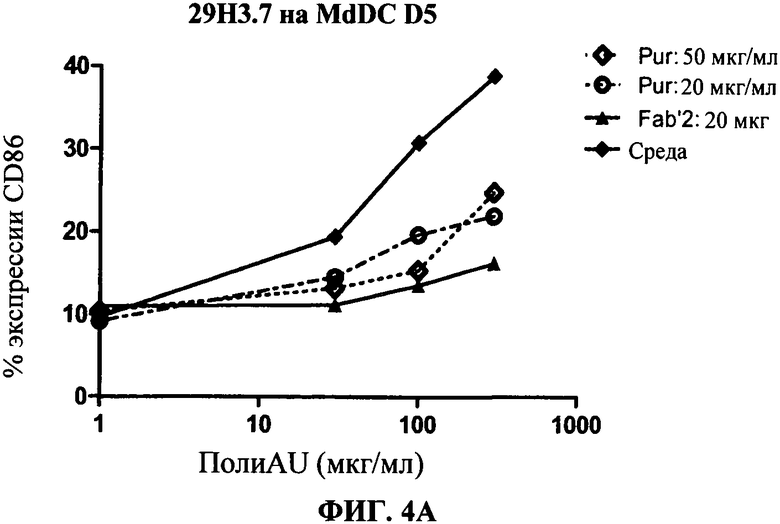
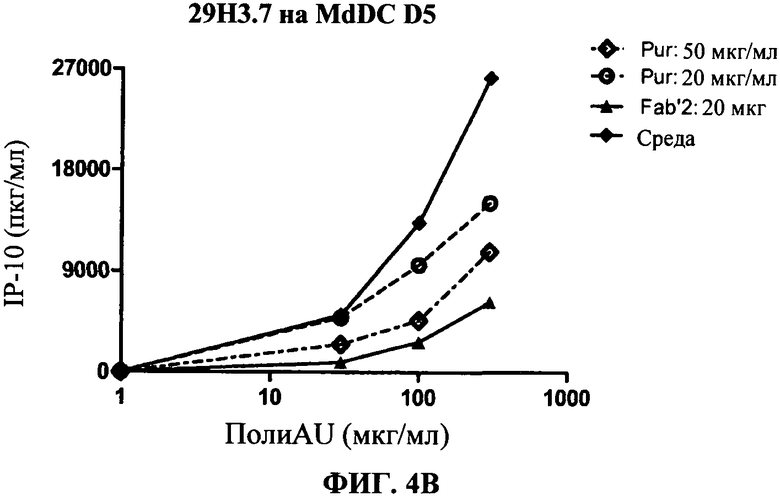

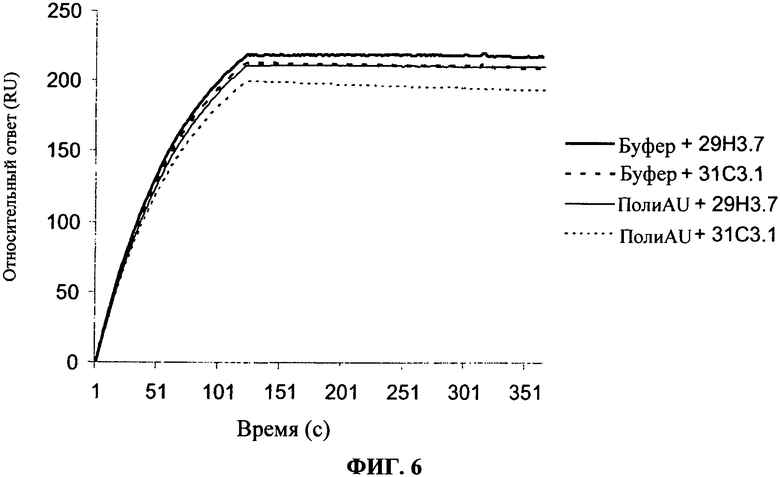
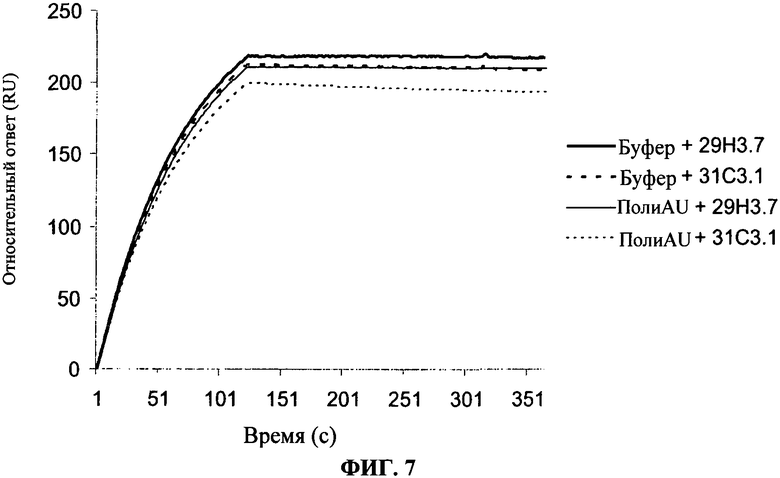



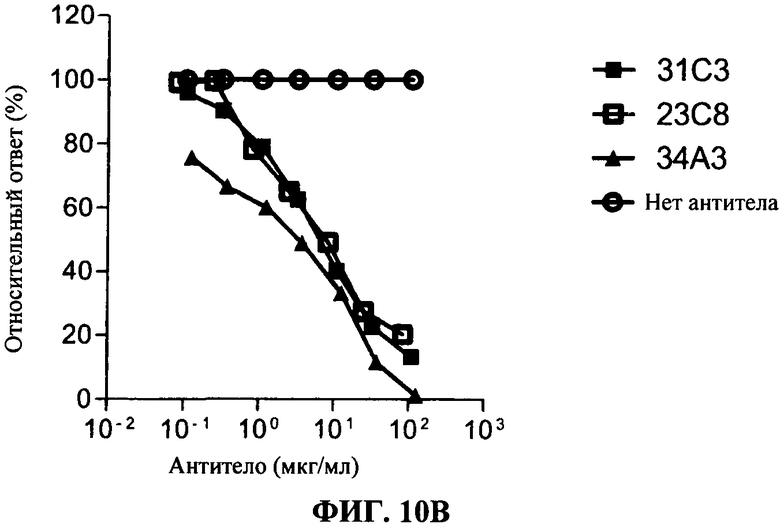


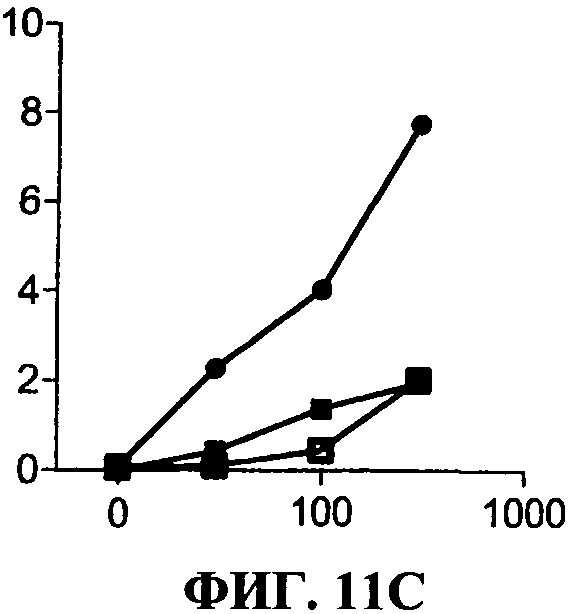
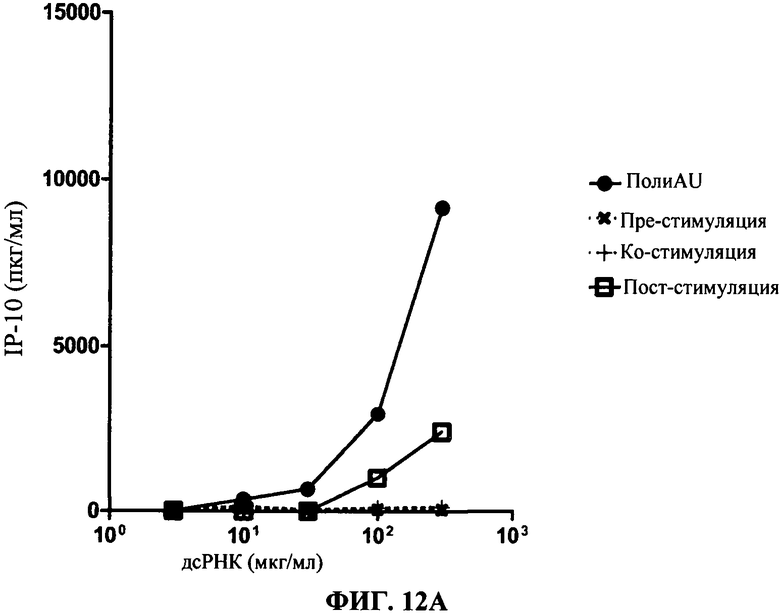

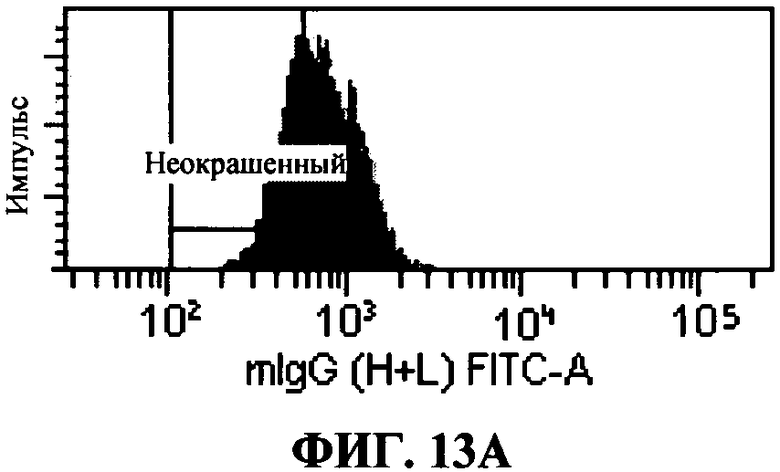


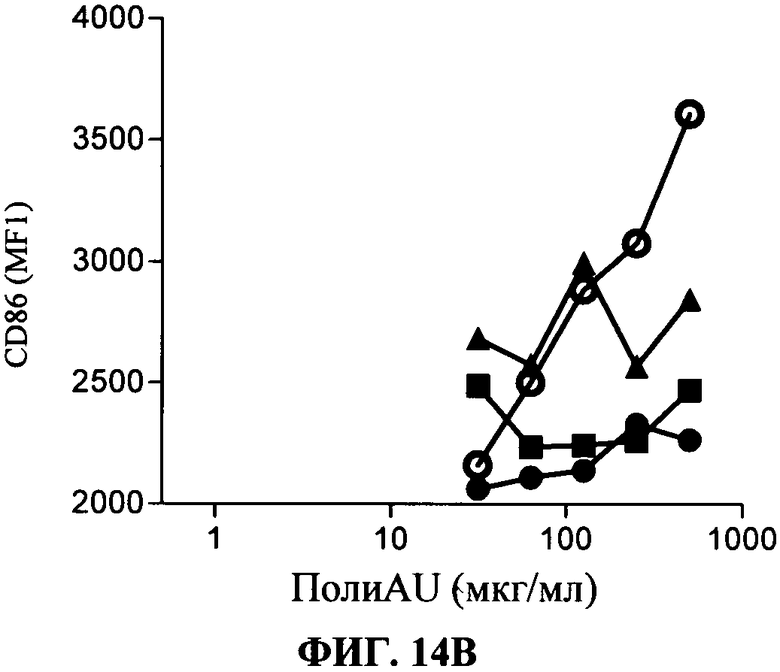
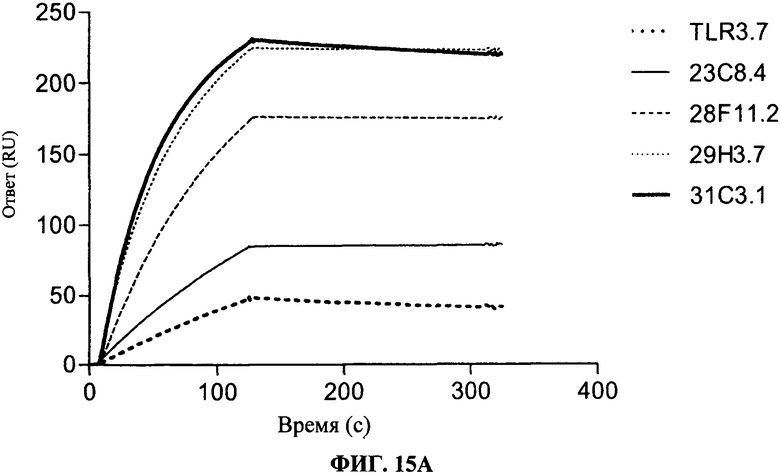
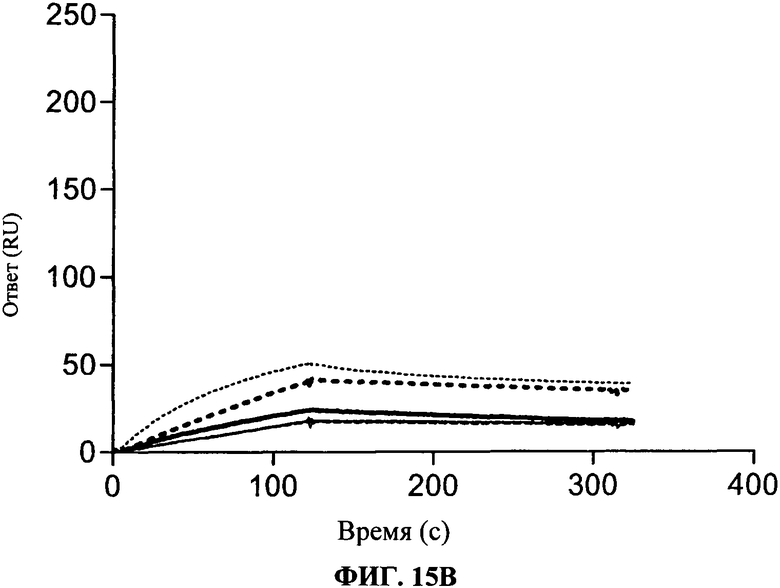


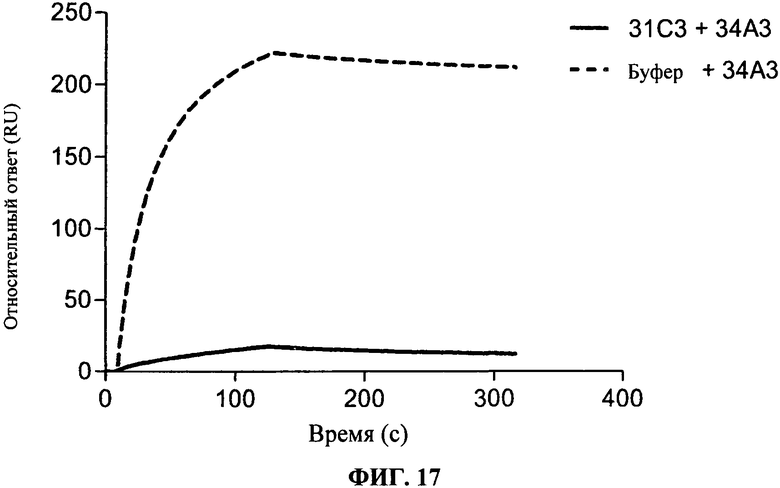


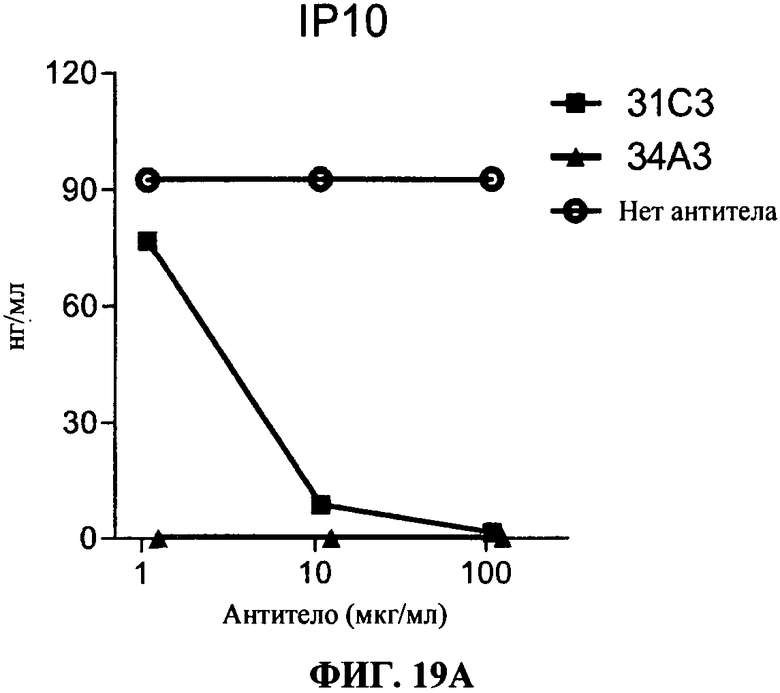


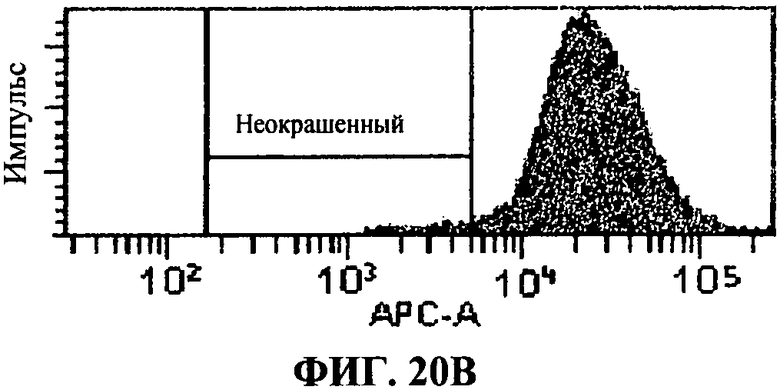


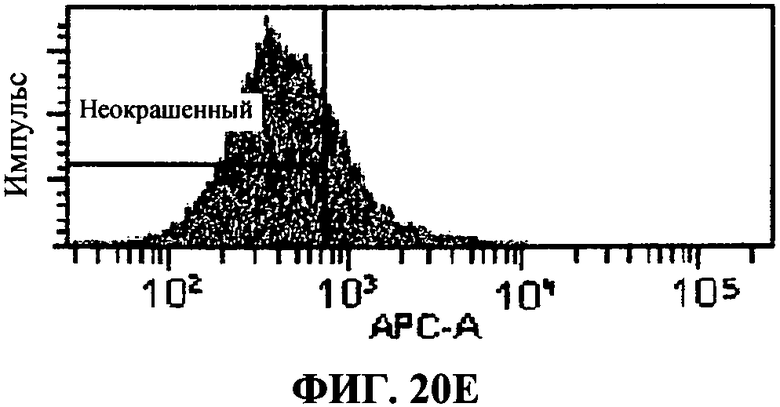
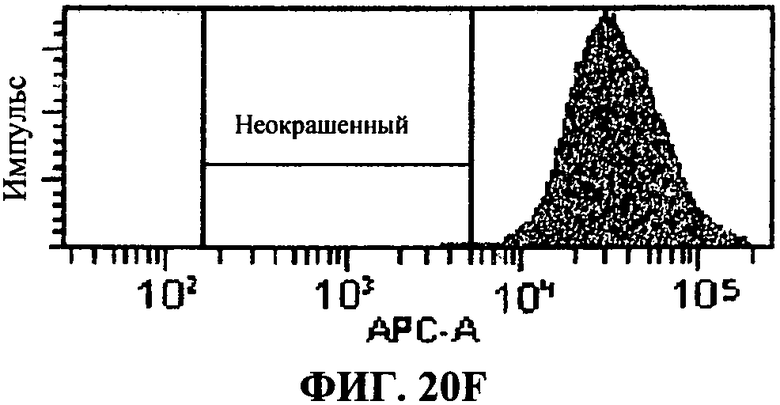
Изобретение относится к биохимии. Описано моноклональное антитело, которое специфически связывает TLR3 полипептид, где указанное антитело представляет собой тетрамер, состоящий из двух идентичных пар полипептидных цепей, причем каждая пара имеет одну легкую и одну тяжелую цепь изотипа IgG, и где указанное антитело ингибирует передачу сигнала TLR3 полипептидом без блокирования связывания дсРНК TLR3 лиганда с TLR3 полипептидом. Представлен способ получения такого антитела, а также фармацевтическая композиция, содержащая данное антитело, и способ лечения, использующий указанное антитело. Изобретение расширяет арсенал средств лечения таких заболеваний как: артрит, воспаление легких, астма, сепсис, ревматоидный артрит и воспалительное заболевание кишечника, рак. 9 н. и 33 з.п. ф-лы, 20 ил., 7 табл., 8 пр.
1. Моноклональное антитело, которое специфически связывает TLR3 полипептид, где указанное антитело представляет собой тетрамер, состоящий из двух идентичных пар полипептидных цепей, причем каждая пара имеет одну легкую и одну тяжелую цепь изотипа IgG, и где указанное антитело ингибирует передачу сигнала TLR3 полипептидом без блокирования связывания дсРНК TLR3 лиганда с TLR3 полипептидом,
где указанное антитело конкурирует за связывание с TLR3 полипептидом с антителом, выбранным из группы, содержащей следующее:
(a) антитело, имеющее соответственно VH и VL область SEQ ID NOS 34 и 35,
(b) антитело, имеющее соответственно VH и VL область SEQ ID NOS 10 и 11,
(c) антитело, имеющее соответственно VH и VL область SEQ ID NOS 18 и 19,
(d) антитело, имеющее соответственно VH и VL область SEQ ID NOS 26 и 27 и
(e) антитело, имеющее соответственно VH и VL область SEQ ID NOS 2 и 3,
причем антитело получено способом, включающим этапы, на которых: а) проводят иммунизацию млекопитающего, не человека, иммуногеном, содержащим TLR3 полипептид человека; и b) выбирают антитело из указанного иммунизированного животного, которое ингибирует TLR3 передачу сигнала без блокирования связывания дсРНК TLR3 лиганда с TLR3 полипептидом.
2. Антитело по п. 1, где указанное антитело содержит легкую цепь, содержащую следующее:
(a) аминокислотную последовательность CDR1 легкой цепи (LCDR1), выбранную из SEQ ID NOS:61, 64 и 65:
(b) аминокислотную последовательность CDR2 легкой цепи (LCDR2), выбранную из SEQ ID NOS:62, 66 и 67; и
(с) аминокислотную последовательность CDR3 легкой цепи (LCDR3), выбранную из SEQ ID NOS:63, 68, 69 и 70.
3. Антитело по п. 1, где указанное антитело содержит тяжелую цепь, содержащую следующее:
(a) аминокислотную последовательность CDR1 тяжелой цепи (HCDR1), выбранную из SEQ ID NOS:71-76;
(b) аминокислотную последовательность CDR2 тяжелой цепи (HCDR2), выбранную из SEQ ID NOS:77-81; и
(c) аминокислотную последовательность CDR3 тяжелой цепи (HCDR3), выбранную из SEQ ID NOS:82-85.
4. Антитело по п. 1, где указанное антитело модулирует TLR3 передачу сигнала в дендритной клетке.
5. Антитело по п. 1, где указанное антитело специфически связывается с TLR3 полипептидом в кислых условиях с суб-наномоляриой KD для его аффинности бивалентного связывания.
6. Антитело по п. 5, где указанные кислые условия включают pH от 4,5 до 6,5.
7. Антитело по п. 1, где указанное антитело специфически связывается с TLR3 полипептидом в нейтральных условиях с суб-наномолярной KD для аффинности бивалентного связывания.
8. Антитело по п. 7, где указанные нейтральные условия включают pH от 6,6 до 7,4.
9. Антитело по п. 1, где указанное антитело представляет собой мышиное антитело.
10. Антитело по п. 1, где указанное антитело представляет собой химерное антитело, антитело человека или гуманизированное антитело.
11. Антитело по п. 1, где изотип указанного антитела представляет собой IgG4.
12. Антитело по п. 11, где антитело содержит Fc область, которая, в основном, не связывает FcγR.
13. Антитело по п. 12, где указанное антитело представляет собой фрагмент антитела, выбранный из следующего: Fab, Fab′, Fab′-SH, F (ab′) 2, Fv, диатела, одноцепочечный фрагмент антитела или мультиспецифичное антитело, содержащее множественные различные фрагменты антител.
14. Антитело по п. 1, где указанное антитело конъюгировано или ковалентно связано с токсической частью.
15. Антитело по п. 1, где указанное антитело способно быть интенализированным TLR3-экспрессирующей клеткой, факультативно, раковой клеткой.
16. Антитело по п. 1, где указанное антитело конъюгировано или ковалентно связано с детектируемой частью.
17. Моноклональное антитело, которое специфически связывает TLR3 полипептид человека, где указанное антитело представляет собой тетрамер, состоящий из двух идентичных пар полипептидных цепей, причем каждая пара имеет одну легкую и одну тяжелую цепь изотипа IgG, и где указанное антитело специфически связывается с TLR3 полипептидом в кислых условиях с pH от 4,5 до 6,5 с суб-наномолярной KD для его аффинности бивалентного связывания, причем антитело получено способом, включающим этапы, на которых: а) проводят иммунизацию млекопитающего, не человека, иммуногеном, содержащим TLR3 полипептид человека; и b) выбирают антитело из указанного иммунизированного животного, которое связывается с TLR3 полипептидом, с суб-наномолярным KD для его аффинности бивалентного связывания в кислых, с pH от 4,5 до 6,5, и нейтральных условиях и которое ингибирует TLR3 передачу сигнала.
18. Антитело по п. 17, где указанное антитело модулирует TLR3 передачу сигнала без блокирования связывания дсРНК TLR3 лиганда с TLR3 полипептидом.
19. Антитело по п. 17, где указанное антитело ингибирует TLR3 передачу сигнала.
20. Антитело по п. 17, где антитело выбрано из группы, содержащей следующее:
(a) антитело, имеющее (i) аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:4, 5 и 6, и (ii) аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3). как показано в SEQ ID NO:7, 8 и 9, соответственно;
(b) антитело, имеющее (i) аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:12, 13 и 14, и (ii) аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:15, 16 и 17, соответственно;
(c) антитело, имеющее (i) аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:20, 21 и 22, и (ii) аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:23, 24 и 25, соответственно;
(d) антитело, имеющее (i) аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2. HCDR3). как показано в SEQ ID NO:28, 29 и 30, и (ii) аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:31, 32 и 33, соответственно; и
(е) антитело, имеющее (i) аминокислотные последовательности CDR тяжелой цепи 1, 2 и 3 (HCDR1, HCDR2, HCDR3), как показано в SEQ ID NO:36, 37 и 38, и (ii) аминокислотные последовательности CDR легкой цепи 1, 2 и 3 (LCDR1, LCDR2, LCDR3), как показано в SEQ ID NO:39, 40 и 41, соответственно; и где одна, две, три или более аминокислот в любой из указанных последовательностей могут быть замещены другой аминокислотой.
21. Способ продукции антитела по п. 17, которое специфически связывает TLR3 полипептид у субъекта-млекопитающего, где указанный способ включает этап, на котором: а) проводят иммунизацию млекопитающего, не человека, иммуногеном, содержащим TLR3 полипептид человека; и b) выбирают антитело из указанного иммунизированного животного, которое связывается с TLR3 полипептидом, с суб-наномолярным KD для его аффинности бивалентного связывания в кислых, с pH от 4,5 до 6,5, и нейтральных условиях и которое ингибирует TLR3 передачу сигнала.
22. Способ по п. 21, где выбранное антитело не имеет существенной потери аффинности связывания для TLR3 полипептида в кислых условиях по сравнению с нейтральными условиями.
23. Способ по п. 21, где выбирают антитело, ингибирующее TLR3 передачу сигнала без блокирования связывания дсРНК TLR3 лиганда с TLR3 полипептидом.
24. Способ по пп. 21-23, где антитела, полученные на этапе (b), являются моноклональными антителами.
25. Способ по пп. 21-23, дополнительно включающий этап, на котором оценивают способность указанных антител специфически связываться с TLR3 полипептидами человека.
26. Способ по пп. 21-23, дополнительно включающий этап, на котором оценивают способность указанных антител конкурировать за связывание с антителом 29Н3 и/или 31С3 с TLR3 полипептидами человека.
27. Способ по пп. 21-23, дополнительно включающий этап, на котором создают фрагменты или производные выбранных моноклональных антител.
28. Способ по п. 27, где указанные фрагменты или производные выбирают из группы, содержащей следующее: Fab, Fab′, Fab′-SH, F (ab′) 2, Fv, диатела, одноцепочечный фрагмент антитела, мультиспецифичные антитела, содержащие множественные различные фрагменты антител, гуманизированные антитела и химерные антитела.
29. Способ продукции антитела по п. 1, которое специфически связывает TLR3 полипептид у субъекта-млекопитающего, где указанный способ включает этапы, на которых: а) проводят иммунизацию млекопитающего, не человека, иммуногеном, содержащим TLR3 полипептид человека: и b) выбирают антитело из указанного иммунизированного животного, которое ингибирует TLR3 передачу сигнала без блокирования связывания дсРНК TLR3 лиганда с TLR3 полипептидом.
30. Способ по п. 29, где антитела, полученные на этапе (b), являются моноклональными антителами.
31. Способ по п. 29, дополнительно включающий этап, на котором оценивают способность указанных антител специфически связываться с TLR3 полипептидами человека.
32. Способ по п. 29, дополнительно включающий этап, на котором оценивают способность указанных антител конкурировать за связывание с антителом 29Н3 и/или 31С3 с TLR3 полипептидами человека.
33. Способ по п. 29, дополнительно включающий этап, на котором создают фрагменты или производные выбранных моноклональных антител.
34. Способ по п. 33, где указанные фрагменты или производные выбирают из группы, содержащей следующее: Fab, Fab′, Fab′-SH, F (ab′) 2, Fv, диатела, одноцепочечный фрагмент антитела, мультиспецифичные антитела, содержащие множественные различные фрагменты антител, гуманизированные антитела и химерные антитела.
35. Фармацевтическая композиция для лечения или профилактики заболевания, выбранного из группы, содержащей следующее: артрит, воспаление легких, астма, сепсис, ревматоидный артрит и воспалительное заболевание кишечника, содержащая антитело по п. 1 в эффективном количестве и фармацевтически приемлемый носитель.
36. Фармацевтическая композиция по п. 35, где антитело конъюгировано или ковалентно связано с токсической частью.
37. Фармацевтическая композиция для лечения или профилактики заболевания, выбранного из группы, содержащей следующее: артрит, воспаление легких, аллергия, астма, сепсис, ревматоидный артрит и воспалительное заболевание кишечника, содержащая антитело по п. 17 и фармацевтически приемлемый носитель.
38. Способ лечения или профилактики заболевания, выбранного из группы, содержащей следующее: артрит, воспаление легких, астма, сепсис, ревматоидный артрит и воспалительное заболевание кишечника, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества антитела по п. 1 или фармацевтической композиции по п. 35.
39. Способ по п. 38, дополнительно включающий этап введения пациенту соответствующего дополнительного терапевтического агента, выбранного из группы. содержащей: иммуномодулирующий агент, кортикостероид, иммуносупрессор, антибиотик, противовирусный и противовоспалительный агент.
40. Способ лечения или профилактики заболевания, выбранного из группы, содержащей следующее: артрит, воспаление легких, астма, сепсис, ревматоидный артрит и воспалительное заболевание кишечника, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества антитела по п. 17 или фармацевтической композиции по п. 37.
41. Способ по п. 40, дополнительно включающий этап введения пациенту соответствующего дополнительного терапевтического агента, выбранного из группы, содержащей: иммуномодулирующий агент, кортикостероид, иммуносупрессор, антибиотик, противовирусный и противовоспалительный агент.
42. Способ лечения или профилактики рака, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества антитела по п. 14 или фармацевтической композиции по п. 36.
| US 20070098716 A1, 03.05.2007 | |||
| РЫБАЛЬСКИЙ Н.Г., СЕРОВА М | |||
| А., ИГНАТЬЕВА Г.А., СТАРЧЕУС А.П | |||
| «Моноклональные антитела и гибридомы», Москва: ВАСХНИЛ, 1989 |
Авторы
Даты
2015-09-10—Публикация
2010-07-09—Подача