Уровень техники
G-CSF представляет собой 20кДа-гликопротеин, стабилизированный двумя внутрицепочечными дисульфидными связями и содержащий один O-связанный углеводный компонент. Зрелый G-CSF содержит 174 аминокислоты. G-CSF синтезируется клетками костного мозга, макрофагами и фибробластами. Его главная функция заключается в том, что он является фактором роста и дифференцировки нейтрофильных гранулоцитов и их клеток-предшественников. Также из уровня техники известно, что G-CSF активирует зрелые нейтрофилы. Кроме того, он стимулирует рост/дифференцировку разных других гемопоэтических клеток-предшественников (совместно с дополнительными гемопоэтическими факторами роста) и способствует пролиферации и миграции эндотелиальных клеток. В клинике G-CSF используется для лечения дефицита уровня нейтрофильных гранулоцитов (нейтропении, вызванной, например, раком/химиотерапией, ВИЧ, или трансплантацией костного мозга).
Сущность изобретения
С целью лечения пациентов с нейтропенией с помощью G-CSF, идентичного человеческому, человеческие клетки трансфицировали плазмидой, кодирующей человеческий G-CSF дикого типа. После очистки G-CSF из супернатанта клеточной культуры выбранных клонов, наблюдали, что существенное количество секретированного G-CSF составлял G-CSF, укороченный по N-концу на три аминокислоты. Это укорачивание не являлось клоноспецифичным и не могло быть исключено модификацией условий культивирования клеток.
На основе этого наблюдения заключили, что процессинг белка-предшественника G-CSF в клетках, особенно в клетках HEK293F, был неточным. Конкретнее, пришли к выводу, что комплекс сигнальной пептидазы отщеплял не только в ожидаемом положении с целью физиологического удаления сигнального пептида, но дополнительно еще в одном положении, что приводило к N-концевому укорачиванию.
Подробное описание изобретения
Неожиданно было обнаружено, что N-концевое укорачивание может быть уменьшено, если использовать модифицированный сигнальный пептид и соответствующий G-CSF-предшественник.
Таким образом, в одном воплощении изобретения предлагается G-CSF-предшественник, содержащий сигнальный пептид и G-CSF-пептид, где сигнальный пептид имеет последовательность человеческого сигнального пептида дикого типа молекулы человеческого G-CSF/b (SEQ ID NO:4), содержащего, по меньшей мере, одну из следующих мутаций:
- делению Glu29,
- вставку Glu26,
- замену Lys11Leu,
- замену His21Phe, и
- замену Gln28Leu.
В предпочтительном воплощении, G-CSF-предшественник содержит, по меньшей мере, 2, или, по меньшей мере, 3, или, по меньшей мере, 4, или все пять мутаций, упомянутых выше.
В следующем воплощении изобретения, G-CSF-предшественник содержит до 3 дополнительных мутаций, выбранных из вставки, делеции и замены.
Следующее воплощение изобретения представляет собой полинуклеотид, кодирующий G-CSF-предшественник по изобретению, и полинуклеотид, комплементарный вышеупомянутому полинуклеотиду.
Следующее воплощение изобретения представляет собой вектор, содержащий полинуклеотид по изобретению, и трансфицированную клетку, содержащую или полинуклеотид по изобретению или вектор по изобретению.
В предпочтительном изобретении, это эукариотическая клетка, предпочтительно, человеческая клетка, более предпочтительно, клетка HEK293 и, более предпочтительно, клетка HEK293F или клетка, произошедшая из клеток HEK293F.
В одном воплощении, трансфекция является транзиторной и, в другом воплощении, трансфекция является стабильной.
Следующее воплощение изобретения представляет собой способ экспрессии G-CSF, содержащий стадии
- культивирования трансфицированных клеток по изобретению в подходящей культуральной среде
- выделения G-CSF из культуральной среды.
В предпочтительном воплощении, культивирование осуществляют при рН в интервале 6,8-7,5, предпочтительно, 7,1-7,3, более предпочтительно, около 7,2. Предпочтительно, рН контролируют во время культивирования.
В следующем воплощении, культивирование осуществляют в присутствии инсулина с концентрацией в интервале 5-25 мг/мл, предпочтительно, 15-25 мг/мл, более предпочтительно, 15-20 мг/мл.
Неожиданно оказалось, что G-CSF, полученный вместе с модифицированным сигнальным пептидом по изобретению, имел очень маленькую степень укорачивания, предпочтительно менее 5% молекул, более предпочтительно, менее 1% от всего G-CSF. Предполагается, что 1% является пределом обнаружения.
Предпочтительно, культуральная среда является бессывороточной.
Профиль гликозилирования основного G-CSF оставался неизменным и активность оставалась такой же как у G-CSF дикого типа.
Таким образом, с помощью способа по настоящему изобретению получают G-CSF, предназначенный для фармацевтических применений.
Описание чертежей
Фигура 1 демонстрирует анализ человеческого G-CSF дикого типа с сигнальным пептидом дикого типа с использованием программы «TargetP».
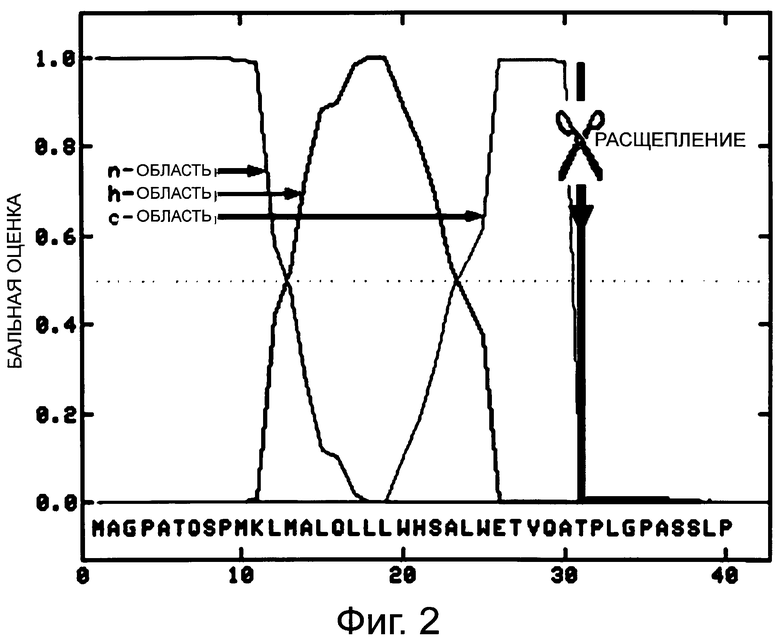
Фигура 2 демонстрирует анализ человеческого G-CSF дикого типа с сигнальным пептидом SP9 с использованием программы «TargetP».
Фигура 3 демонстрирует анализ человеческого G-CSF дикого типа с сигнальным пептидом SP10 с использованием программы «TargetP».
Фигура 4 демонстрирует экспрессию зрелого белка G-CSF в клетках HEK293F с использованием конструктов, кодирующих белки-предшественники с сигнальным пептидом дикого типа (уровень экспрессии 100%), с сигнальными пептидами SP9 или SP10, соответственно.
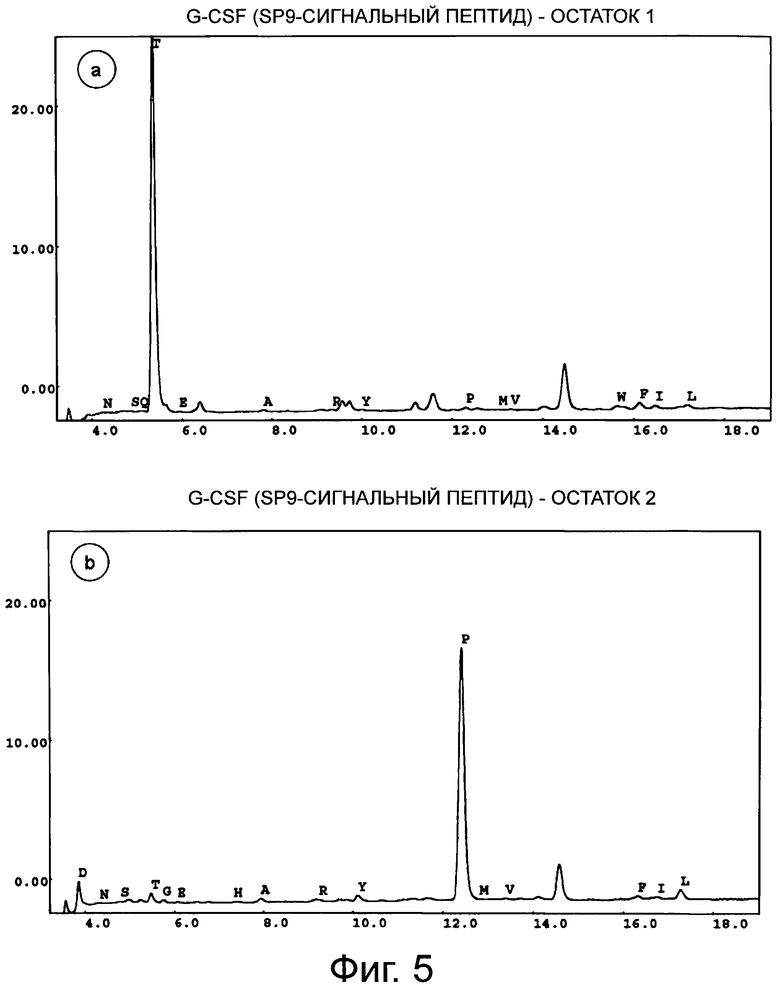
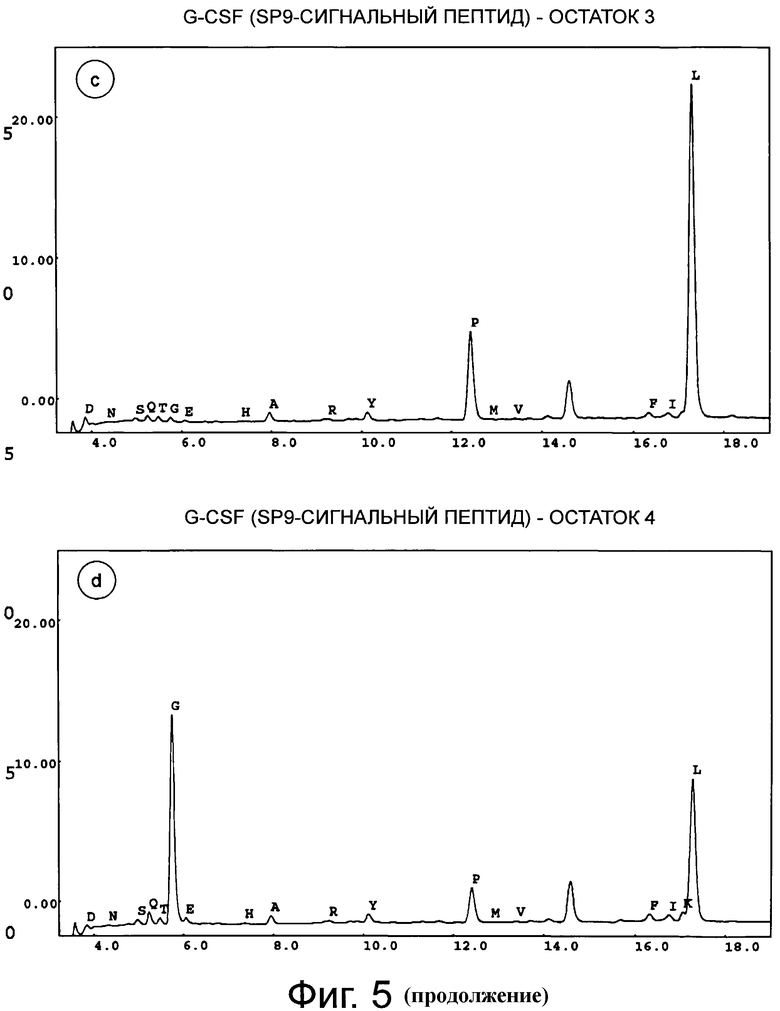
Фигура 5 демонстрирует хроматограмму аминоконцевого аминокислотного секвенирования (деградация Эдмана) человеческого G-CSF дикого типа с сигнальным пептидом SP9. Фигуры 5а-5е соответствуют остаткам 1-5. Результат анализа аминокислотной последовательности приведен в таблице ниже.
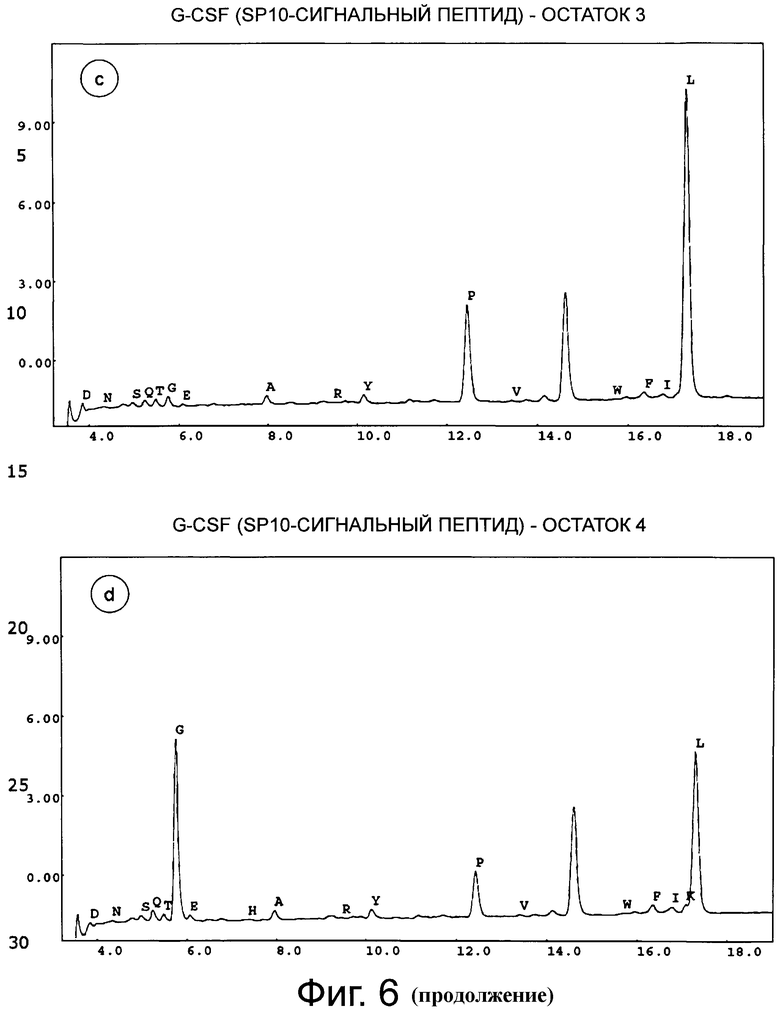
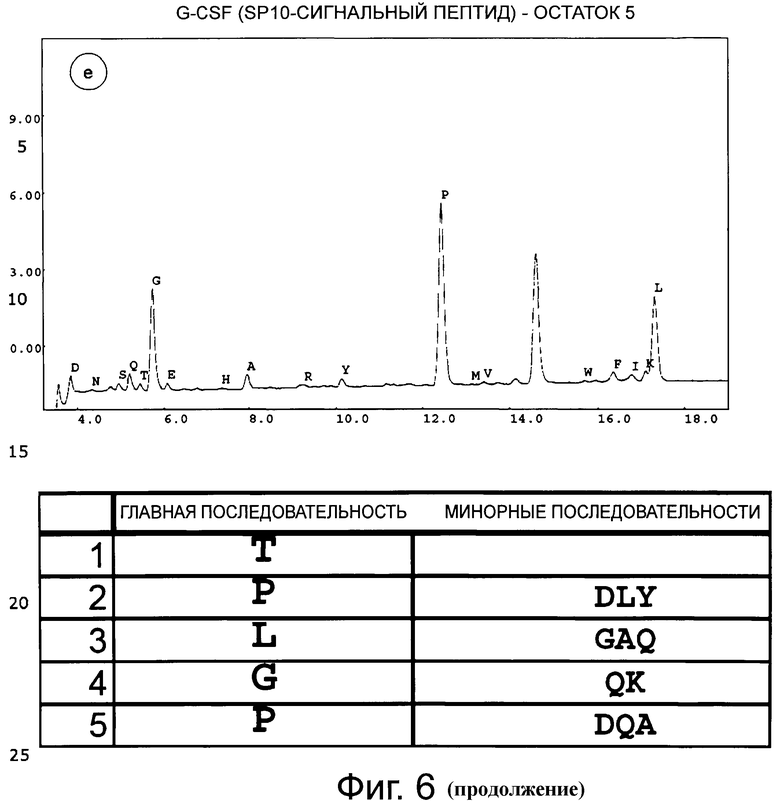
Фигура 6 демонстрирует хроматограмму аминоконцевого аминокислотного секвенирования (деградация Эдмана) человеческого G-CSF дикого типа с сигнальным пептидом SP10. Фигуры 6а-6е соответствуют остаткам 1-5. Результат анализа аминокислотной последовательности приведен в таблице ниже.
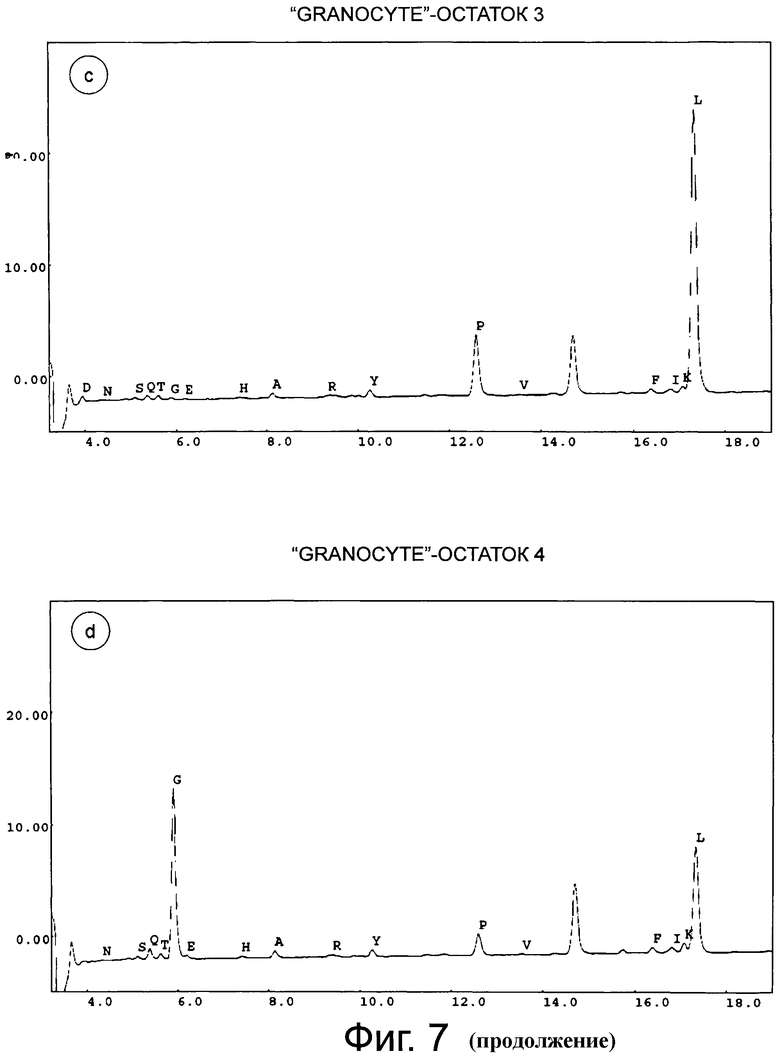
Фигура 7 демонстрирует хроматограмму аминоконцевого аминокислотного секвенирования (деградация Эдмана) «GRANOCYTE». Фигуры 7а-7е соответствуют остаткам 1-5. Результат анализа аминокислотной последовательности приведен в таблице ниже.
Фигура 8 демонстрирует хроматограмму аминоконцевого аминокислотного секвенирования (деградация Эдмана) человеческого G-CSF дикого типа с сигнальным пептидом дикого типа. Фигуры 8а-8е соответствуют остаткам 1-5. Результат анализа аминокислотной последовательности приведен в таблице ниже.
Фигура 9 демонстрирует сравнение количества полноразмерных G-CSF для 2 типичных клонов, полученных в результате выделения клонов при стабильной трансфекции с помощью G-CSF-SP9, Оставшаяся неполноразмерная фракция содержит по большей части G-CSF, укороченный на 3 аминокислоты по N-концу. Черта 99% коррелирует с N-концевым укорачиванием <1%, которое ниже предела обнаружения анализа.
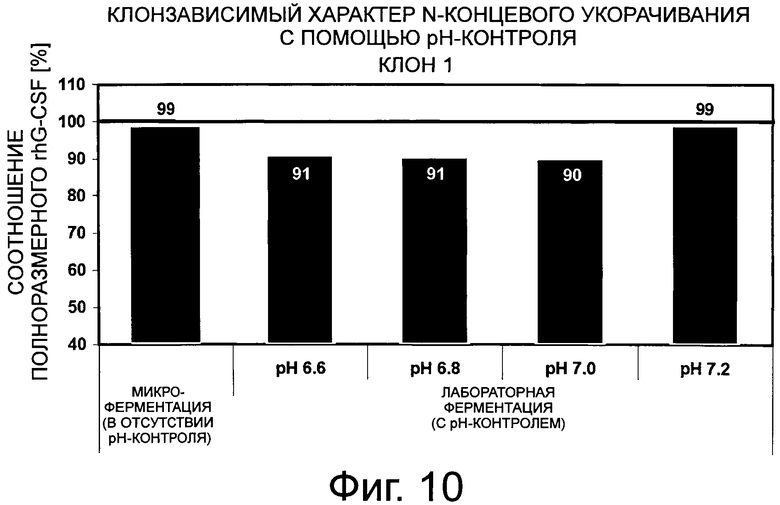
Фигура 10 демонстрирует сравнение количества полноразмерного G-CSF на примере клона 1 для различных рН культивирования в реакционном аппарате с мешалкой. Клон 1 был получен в результате выделения клона со стабильной трансфекцией вектора G-CSF-SP9.
Оставшаяся неполноразмерная фракция содержит, главным образом, G-CSF, укороченный по N-конпу на 3 аминокислоты. Количество полноразмерного G-CSF из эталонного культивирования для клона 1 во встряхиваемых флаконах (без рН-контроля) изображено на первой панели серым цветом. Черта 99% коррелирует с N-концевым укорачиванием <1%, которое ниже предела обнаружения анализа.
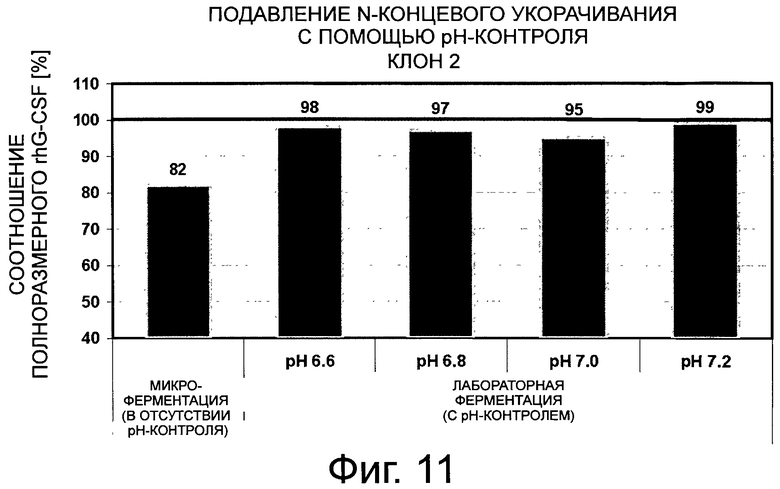
Фигура 11 демонстрирует сравнение соотношения полноразмерного G-CSF на примере клона 2 для различных рН культивирования при культивировании в реакционном аппарате с мешалкой. Клон 2 был получен в результате выделения клона со стабильной трансфекцией вектора G-CSF-SP9. Оставшаяся неполноразмерная фракция содержит, главным образом, G-CSF, укороченный по N-концу на 3 аминокислоты. Количество полноразмерного G-CSF из эталонного культивирования для клона 2 во встряхиваемых флаконах (без рН-контроля) изображено на первой панели серым цветом. Черта 99% коррелирует с N-концевым укорачиванием <1%, которое ниже предела обнаружения анализа.
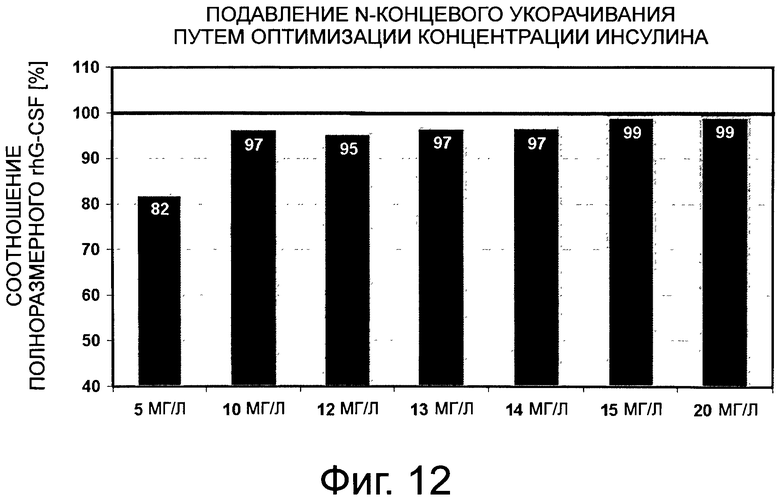
Фигура 12 демонстрирует сравнение количества полноразмерного G-CSF на примере клона 2 для различных концентраций инсулина в культуральной среде. Клон 2 получают в результате выделения клона после стабильной трансфекции с помощью G-CSF-SP9-вектора. Оставшаяся неполноразмерная фракция содержит, главным образом, G-CSF, укороченный по N-концу на 3 аминокислоты. Черта 99% коррелирует с N-концевым укорачиванием <1%, которое ниже предела обнаружения анализа.
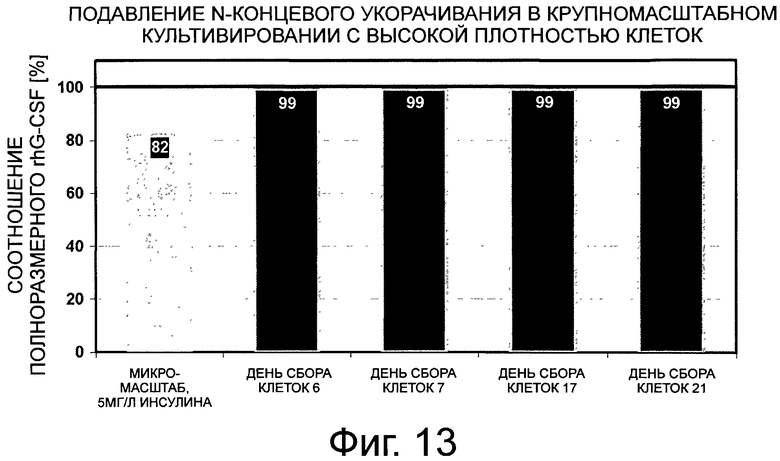
Фигура 13 демонстрирует сравнение количества полноразмерного G-CSF для различных дней культивирования на примере клона 2, культивированного крупномасштабным способом с высокой плотностью клеток с применением 15 мг/л инсулина в культуральной среде в отсутствие рН-контроля. Клон 2 был получен в результате выделения клона после стабильной трансфекции вектором G-CSF-SP9. Оставшаяся неполноразмерная фракция содержит, главным образом, G-CSF, укороченный по N-концу на 3 аминокислоты. Черта 99% коррелирует с N-концевым укорачиванием <1%, которое ниже предела обнаружения анализа.
Сведения, подтверждающие возможность осуществления измерения
Пример 1
Оптимизация пептида предшественника G-CSF для получения корректного белка кДНК изоформы b человеческого G-CSF дикого типа опубликована в базе данных GenBank (NM_172219). По существу любой белок предшественник G-CSF, содержащий любую последовательность с происхождением из NM_172219, используется для модификации последовательности сигнального пептида по настоящему изобретению. В типичном воплощении белок-предшественник содержит последовательность, представленную в настоящем документе в виде SEQ ID NO:1 (GenBank NP_757373):
MAGPATQSPMKLMALQLLLWHSALWTVQEATPLGPASSLPQSFLLKCLEQVRKIQGDGAALQEKLCATYKLCHPEELVLLGHSLGIPWAPLSSCPSQALQLAGCLSQLHSGLFLYQGLLQALEGISPELGPTLDTLQLDVADFATTIWQQMEELGMAPALQPTQGAMPAFASAFQRRAGGVLVASHLQSFLEVSYRVLRHLAQP
Непроцессированный белок-предшественник G-CSF дикого типа (SEQ ID NO:1) содержит 204 аминокислоты, включая 30 аминокислот сигнального пептида. Как опубликовано, процессинг осуществляется между остатками Ala30 и Thr31 (GenBank NP_757373).
Последние литературные данные описывают консенсусную последовательность эукариотического сигнального пептида и функцию комплекса сигнальных пептидаз (Rapoport, 2007, Nature 450 (29), 663-669; Tuteja, 2005, Arch Biochem Biophys 441, 107-111; Dalbey et al., 1997, Protein Science 6, 1129-1138).
Аминокислотную последовательность сигнального пептида G-CSF сравнивали с предполагаемыми особенностями консенсусного сигнального пептида, описанного выше. Было обнаружено, что несколько аминокислотных остатков не удовлетворяют предполагаемой модели. Подробно, предполагаемый мотив Ala-X-Ala в С-концевой области сигнального пептида, который, как предполагается, является критическим для точного отщепления, нарушается заряженной аминокислотой (Glu29) в пептиде-предшественнике G-CSF. Кроме того, заряженные остатки Lys11 и His21 локализованы в гидрофобном участке сигнального пептида и, таким образом, не согласуются с требованиями модели.
Сигнальный пептид G-CSF дикого типа анализировали in silico с помощью программного обеспечения «SignalP» и «TargetP» (www.cbs.dtu.dk/services; Emanuelsson et al., 2007, Nature Protocols 2, 953-971). Программное обеспечение продемонстрировало, что процессинг прогнозируется в корректном N-концевом положении G-CSF (Thr31), но также дополнительно в нескольких других сайтах (фиг.1). Однако процессинг в сайте укорачивания (Gly34), не был спрогнозирован с помощью этого программного обеспечения.
Пример 2
Сигнальный пептид G-CSF дикого типа моделировали in silico путем минимальных изменений в его аминокислотной последовательности по отношению к указанной выше модели гипотетической сигнальной пептидазы. Полученное в результате положение отщепления снова анализировали с использованием программного обеспечения «SignalP» и «TargetP». Прогноз несколько in silico разработанных моделей, названных, например, SP9 G-CSF и SP10 G-CSF, в результате дал только корректное положение (Thr31) для процессинга G-CSF, которое было принято в качестве подсказки для оптимизированного сигнального пептида (см. фиг.2 и фиг.3 для in silico анализа сайтов отщепления SP9 G-CSF и SP10 G-CSF, соответственно). Несколько таких конструктов выбирали для генного синтеза (GeneArt, Регенсбург, Германия). Синтетические гены, кодирующие пептиды SP9 G-CSF и SP10 G-CSF, соответственно, клонировали в эукариотический экспрессирующий вектор и использовали для трансфекции клеток HEK293F.
Пример 3
Белок-предшественник SP9 G-CSF
Белок-предшественник SP9 G-CSF был получен из последовательности сигнального пептида дикого типа человеческого белка-предшественника G-CSF (SEQ ID NO:1). Конкретно, глутаминовую кислоту в положении 29 (Glu29) сигнального пептида дикого типа удаляли и вставляли в положение 26 (Glu26). В типичном воплощении, белок-предшественник SP9 G-CSF содержит последовательность, представленную в настоящем документе в виде SEQ ID NO:2:
MAGPATQSPMKLMALQLLLWHSALWETVQATPLGPASSLPQSFLLKCLEQVRKIQGDGAALQEKLCATYKLCHPEELVLLGHSLGIPWAPLSSCPSQALQLAGCLSQLHSGLFLYQGLLQALEGISPELGPTLDTLQLDVADFATTIWQQMEELGMAPALQPTQGAMPAFASAFQRRAGGVLVASHLQSFLEVSYRVLRHLAQP
Пример 4
Белок-предшественник SP10 G-CSF
Белок-предшественник SP10 G-CSF получали из последовательности сигнального пептида дикого типа человеческого G-CSF (SEQ ID NO:1). Подробно, путем замены лизина в положении 11 на лейцин (Lys11Leu), гистидина 21 на фенилаланин (His21Phe) и глутамина 28 на лейцин (Gln28Leu). В типичном воплощении, пептид SP10 G-CSF содержит последовательность, представленную в настоящем документе в виде SEQ ID NO:3:
MAGPATQSPMLLMALQLLLWFSALWTVLEATPLGPASSLPQSFLLKCLEQVRKIQGDGAALQEKbCATYKLCHPEELVLLGHSLGIPWAPLSSCPSQALQLAGCLSQLHSGLFLYQGLLQALEGISPELGPTLDTLQLDVADFATTIWQQMEELGMAPALQPTQGAMPAFASAFQRRA GGVLVASHLQSFLEVSYRVLRHLAQP
Важно заметить, что несмотря изменения, сделанные в сигнальном пептиде, зрелый пептид G-CSF остается пептидом дикого типа (SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, остатки 31-204).
Пример 5
Транзиторные трансфекции экспрессирующими векторами, кодирующими SP9 G-CSF и SP10 G-CSF
Клетки HEK293F транзиторно трансфицировали экспрессирующими векторами, кодирующими SP9 G-CSF, или SP10 G-CSF, соответственно. Супернатанты собирали через три дня. Секрецию G-CSF измеряли с помощью ELISA. Данные демонстрировали уровни экспрессии, сравнимые с сигнальным пептидом G-CSF дикого типа, или даже демонстрировали более высокий уровень экспрессии (фиг.4).
G-CSF очищали до высокой степени чистоты. Очистку двух продуктов, SP9 G-CSF и SP10 G-CSF, соответственно, осуществляли подобно G-CSF дикого типа без какой-либо модификации протокола.
Пример 6
Концевые аминокислотные последовательности G-CSF дикого типа, коммерческого продукта GRANOCYTE (патент Chugai CA1341389, G-CSF, продуцированный в клетках СНО), SP9 G-CSF и SP100 G-CSF определяли с помощью деградации по Эдману (TopLab, Мартинсрид, Германия). Неожиданно, в данных двух продуктов экспрессии, SP9 G-CSF и SP10 G-CSF, обнаружили только корректный N-конец без какого-либо укорачивания (фиг.5 и фиг.6). То же самое наблюдали для «GRANOCYTE» (фиг.7). Напротив, укорачивание обнаружили для сигнального пептида G-CSF дикого типа (фиг.8) - и для нескольких других конструктов, хотя только один сайт отщепления был спрогнозирован in silico с помощью «SignalP» или «TargetP» (не показано).
Пример 7
Активность SP9 G-CSF и SP10 G-CSF измеряли с помощью анализа клеточной пролиферации и сравнивали с «GRANOCYTE». Активность клеточной пролиферации SP9 G-CSF и SP10 G-CSF была выше по отношению к «Granocyte».
Пример 8
Гликозилирование SP9 G-CSF и SP10 G-CSF определяли с помощью анализа «фингерпринта» массы пептида с использованием MALDI TOF (времяпролетный масс-анализатор с матрично-активированной лазерной десорбцией/ионизацией) с использованием матрицы после гидролиза GluC. Отражающий спектр продемонстрировал отсутствие какого-либо отличия SP9 G-CSF или SP10 G-CSF по отношению к G-CSF, продуцированному клетками HEK293F.
Пример 9
Оценка клонов, полученных в результате стабильной трансфекции экспрессирующим вектором, кодирующим SP9 G-CSF.
Клетки HEK293F стабильно трансфицировали экспрессирующим вектором, кодирующим SP9 G-CSF. Гомогенные клоны выделяли после стабильной трансфекции. Супернатанты выбранных клонов анализировали для различных масштабов ферментации. Для этого G-CSF очищали до высокой степени чистоты из собранных супернатантов и оценивали относительно их аминоконцевых последовательностей, профиля гликозилирования и активности.
Наблюдали, что хотя N-концевое укорачивание на 3 аминокислоты не наблюдалось для полученных в результате супернатантов SP9 G-CSP, которые анализировали в транзиторном пуле трансфекции, укорачивание на 3 аминокислоты не может быть полностью подавлено для некоторых клонов. Этот эффект носил клонозависимый характер и кроме того, зависел от масштаба культивирования и условий культивирования.
Клонозависимый характер (фиг.9) предполагал, что модификация последовательности сигнального пептида G-CSF, полученного из вектора SP9 G-CSF, по большей части поддерживает корректное отщепление сигнального пептида; тем не менее, на 100% корректное отщепление влияет клоноспецифичный метаболизм.
Главным способом влияния на клоноспецифичный метаболизм является применение оптимизированных условий культивирования.
Влияние рН культивирования на корректное отщепление последовательности сигнального пептида G-CSF оценивали для 2 типичных клонов. Оба клона культивировали в лабораторных реакционных аппаратах с мешалкой, каждый при определенном значении рН, составляющем 6,6; 6,8; 7 и 7,2. Супернатанты, содержащие G-CSF, очищали до высокой степени чистоты и оценивали относительно их аминоконцевой последовательности (фиг.10 и фиг.11). Для обоих типичных клонов наблюдали, что корректный процессинг последовательности сигнального пептида, который приводит в результате к получению соотношения полноразмерного G-CSF >99%, может быть достигнут путем контроля рН клеточного культивирования клонов G-CSF до значения рН 7,2. Значение >99% соответствует меньшему пределу обнаружения метода секвенирования, составляющему 1%.
Пример 10
Культивирование в колбах с мешалкой без контроля рН и с вариацией концентрации инсулина в культуральной среде осуществляли на примере одного клона. Концентрации инсулина изменяли в интервале от 5 мг/л инсулина до 20 мг/л инсулина. Супернатанты, содержащие G-CSF, очищали до высокой степени чистоты и оценивали их аминоконцевые последовательности (фиг.12). На примере оцениваемого клона наблюдали, что оптимизация концентрации инсулина в культуральной среде до интервала от 15 до 20 мг/л инсулина для случая условий культивирования рН-контроля привела в результате к получению корректного процессинга последовательности сигнального пептида.
Крупномасштабное культивирование с высокой плотностью клеток с использованием перфузионного способа обеспечения среды осуществляли на примере одного клона. рН культивирования не контролировали и оно изменялось во время культивирования в интервале от 6,8 до 7,2. Концентрацию инсулина в культуральной среде регулировали до оптимизированной концентрации, составляющей 15 мг/л инсулина. Супернатанты, содержащие G-CSF, из 4 выбранных моментов культивирования, соответствующих дням культивирования 6, 7, 17 и 21, очищали до высокой степени чистоты и оценивали их аминоконцевые последовательности (фиг.13). Корректного процессинга последовательности сигнального пептида, приводящий к получению >99% полноразмерного G-CSF, достигали для всех анализируемых супернатантов независимо от плотности клеток и продуктивности G-CSF. Применение оптимизированной концентрации инсулина, составляющей 15 мг/л, таким образом, эффективно для того, чтобы избежать N-концевого укорачивания при крупномасштабных культивированиях с высокой плотностью клеток.













Изобретение относится к области биохимии. Заявлен G-CSF-предшественник, содержащий сигнальный пептид и G-CSF-пептид, где сигнальный пептид имеет последовательность человеческого сигнального пептида дикого типа молекулы человеческого G-CSF/b, содержащего, по меньшей мере, одну из мутаций, включающих делецию Glu29, замену His21Phe и замену Gln28Leu. Также представлены полинуклеотид, кодирующий G-CSF-предшественник, экспрессирующий вектор, трансфицированная клетка и способ получения G-CSF с помощью указанной клетки. Изобретение позволяет сделать процессинг белка-предшественника G-CSF более точным и получить G-CSF с очень маленькой степенью укорачивания по N-концу. 5 н. и 8 з.п. ф-лы, 13 ил., 10 пр.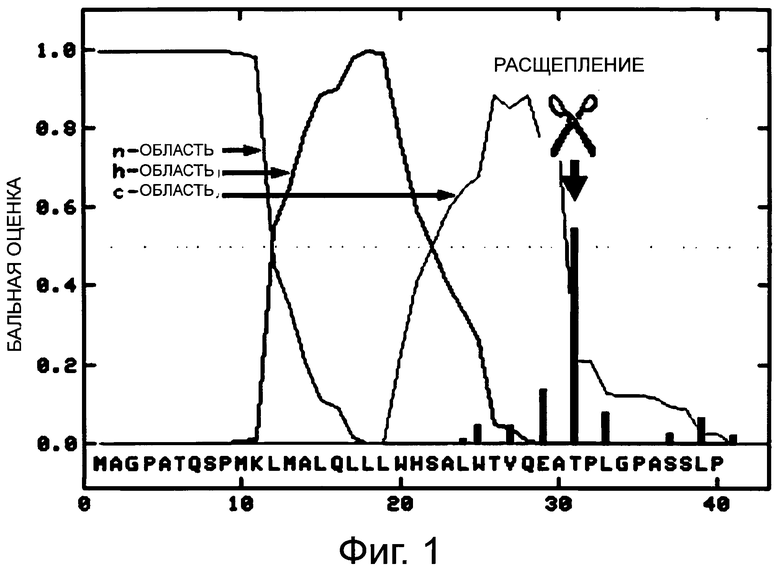
1. G-CSF-предшественник, содержащий сигнальный пептид и G-CSF-пептид, где сигнальный пептид содержит последовательность человеческого сигнального пептида дикого типа молекулы человеческого G-CSF/b SEQ ID NO: 4, содержащую, по меньшей мере, одну мутацию, выбранную из группы, состоящей из:
- делеции Glu29,
- замены His21Phe, и
- замены Gln28Leu.
2. G-CSF-предшественник по п.1, дополнительно содержащий по меньшей мере одну из следующих мутаций:
- вставки Glu26,
- замены Lys 11Leu.
3. G-CSF-предшественник по п.1, содержащий, по меньшей мере, две или, по меньшей мере, три мутации по п.1.
4. Полинуклеотид, кодирующий G-CSF-предшественник по любому из пп. 1-3.
5. Вектор, экспрессирующий G-CSF-предшественник по любому из пп. 1-3, содержащий полинуклеотид по п.4.
6. Трансфицированная клетка, экспрессирующая G-CSF-предшественник по любому из пп. 1-3, содержащая полинуклеотид по п.4 или вектор по п.5.
7. Трансфицированная клетка по п.6, которая представляет собой клетку НЕК293, более предпочтительно клетку HEK293F.
8. Трансфицированная клетка по п. 6 или 7, где трансфекция является транзиторной.
9. Трансфицированная клетка по п. 6 или 7, где трансфекция является стабильной.
10. Способ получения G-CSF, содержащий стадии:
- культивирования трансфицированных клеток по любому из пп. 6-9 в подходящей культуральной среде и
- выделение G-CSF из культуральной среды.
11. Способ по п.10, где культивирование осуществляют при pH в интервале 6,8-7,5, предпочтительно 7,1-7,3.
12. Способ по п.10, где культивирование осуществляют в присутствии инсулина с концентрацией в интервале 5-25 мг/мл, предпочтительно 15-25 мг/мл, более предпочтительно 15-20 мг/мл.
13. Способ по любому из пп. 10-12, где культуральная среда является бессывороточной.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| СПОСОБ ПОЛУЧЕНИЯ N-АЛКИЛЬНЫХ ПРОИЗВОДНЫХ 4-АМИНО-5-ГАЛОГЕНВЕРАТРОЛОВ | 1966 |
|
SU215126A1 |
| УСТРОЙСТВО для СПИРАЛЬНОЙ НАРЕЗКИ НЕПРОВОЛОЧНЫХ РЕЗИСТОРОВ | 0 |
|
SU256843A1 |
| КОНЪЮГАТЫ G-CSF | 2001 |
|
RU2290411C2 |
Авторы
Даты
2015-09-20—Публикация
2009-10-02—Подача