Область техники, к которой относится изобретение
Настоящее изобретение относится к офтальмологическим препаратам в форме капель для глаз, которые содержат нейротрофический фактор головного мозга (BDNF) и средство, регулирующее вязкость, предпочтительно галактоксилоглюкан, экстрагированный из семян индийского финика, также известный как TS-полисахарид или TSP.
Указанные препараты полезны для предотвращения и лечения нейродегенеративных нарушений сетчатки глаза, в особенности, пигментной дистрофии сетчатки, глаукомы (включая врожденную глаукому, инфантильную глаукому, юношескую глаукому, глаукому взрослых, первичную открытоугольную глаукому, первичную закрытоугольную глаукому, вторичную глаукому, ятрогенную глаукому и острую глаукому), старческих ретинопатий, таких как старческая дистрофия желтого пятна, сосудистых и пролиферативных нарушений сетчатки глаза, отслоения сетчатки, ретинопатии недоношенных (ROP) и диабетической ретинопатии, всех нарушений, которые приводят к слепоте.
Предшествующий уровень техники
Нейротрофины представляют собой белки, синтезируемые нервными клетками, которые контролируют жизнеспособность и нормальное питание различных клеток, присутствующих в нервной системе.
Наиболее известен фактор роста нервов (NGF), открытый R. Levi-Montalcini и S. Cohen в середине 20-го столетия.
Другие факторы, белковая структура которых представляет собой структурные аналоги NGF, были открыты позднее; таким образом, в данный момент авторы настоящего изобретения рассматривают класс NGF факторов (нейротрофинов), к которым относятся BDNF, NT-3, NT-4/5 и NT-6, а также NGF (первые три экспрессируются, главным образом, в нервной системе млекопитающих, в то время как NT-6 является новым представителем нейротрофинов, обнаруженным у костистых рыб и отсутствующим в мозге млекопитающих).
Нейротрофические факторы, включая нейротрофины, выделяются нервными клетками, которыми они синтезируются, и связываются со специфическими рецепторами на мембране.
Несмотря на структурное сходство, различные нейротрофины действуют через различные рецепторы и, следовательно, посредством различных механизмов действия.
Связывание нейротрофического фактора со своим специфическим рецептором (TrkA для NGF; TrkB для BDNF и частично для NT-4; TrkC для NT-3) инициирует каскад событий, который вызывает специфическую реакцию нервной клетки.
Различные нейротрофиновые рецепторы экспрессируются различными областями, и в пределах одной области - различными клетками, активируя специфические внутриклеточные пути передачи сигналов. Из этого логически следует, что не все области или нервные клетки могут отвечать на каждый из четырех нейротрофинов; ограничивающим фактором является клеточное распределение специфического рецептора для отдельно взятого нейротрофина.
Распределение клеток сетчатки глаза, способных к синтезу и выделению NGF, архетипа нейротрофинов, и распределение клеток сетчатки глаза, которые экспрессируют NGF рецептор (TrkA), по-видимому, очень ограничено, и на практике ограничено подгруппой ганглионарных клеток и астроцитарных глиальных клеток (Garcia et al., 2003).
В EP 1161256 B1 описаны офтальмологические препараты, содержащие от 200 до 500 мкг/мл NGF, для введения на исходную поверхность глаза для лечения и/или профилактики нарушений, влияющих на склеру, ресничные тела, хрусталик, сетчатку, зрительный нерв, стекловидное тело глаза и/или сосудистую оболочку глаза.
Как сообщает Lambiase et al., эти препараты повышают уровни NGF в сетчатке; однако можно продемонстрировать, что NGF не способен обеспечивать нейропротекторный эффект в сетчатке.
Это согласуется с результатами исследований, недавно описанными Shi et al. (2007). NGF может связываться с двумя типами рецепторов сетчатки глаза, TrkA и P75, которые оказывают противоположное воздействие на питание и выживаемость нервных клеток. Когда экзогенный NGF достигает сетчатки глаза, он может вызывать два противоположных эффекта у клеток сетчатки глаза, которые стремятся к взаимоуничтожению.
В противоположность этому, BDNF вместе со своим рецептором, TrkB, в большом количестве экспрессируется сетчаткой глаза млекопитающих. Сетчатка глаза состоит из множества типов клеток, упорядоченных в слои. В частности, BDNF синтезируется определенными ганглионарными клетками и амакринными клетками, такими как допаминергические клетки, присутствующие во внутреннем слое сетчатки (Henzog et al., 1994; Perez and Caminos, 1995; Hallbook et al.,1996; Herzog and von Bartheld, 1998; Karlsson and Hallbook, 1998; Bennett et al., 1999; Pollock and Frost, 2003; Seki et al., 2003; Chytrova and Johnson, 2004).
Рецептор BDNF, называемый TrkB, экспрессируется множеством типов клеток сетчатки глаза, включая ганглионарные клетки, амакринные клетки и глиальные клетки Мюллера (Jelsima et al., 1993; Cellerino and Kohler, 1997; Di Polo et al., 2000).
WO 97/45135 относится к стабильным фармацевтическим композициям BDNF в форме водного раствора или лиофилизата. В этом документе, в частности, в разделе, посвященном предшествующему уровню техники, BDNF приведен, как полезный в лечении различных нарушений, включая пигментную дистрофию сетчатки. Единственной явно приведенной лекарственной формой являются инъецируемые препараты.
JP 2003048851 относится к офтальмологическим препаратам на основе BDNF, вводимых в форме капель на конъюнктиву. Раскрываемые препараты содержат различные средства, регулирующее вязкость, описанные как одинаково эффективные при доставке BDNF к сетчатке.
Доказательство активности, описанной в указанных выше документах, является неубедительным, потому что диапазон концентраций, указанный для BDNF, очень широк: 0,001-1% масс./об., соответствуя диапазону концентраций от 1×10-2 до 10 мкг/мкл [пункт 3 формулы изобретения; согласно подробному описанию изобретения [0006], параграф 3], но в описанном примере используемая концентрация составляла 0,004% (масс./об.), соответствуя 4×10-2 мкг/мкл, то есть намного меньше, чем эффективные концентрации, способные увеличивать уровни BDNF в сетчатке и предотвращать изменения в сетчатке, вызванные продолжительным облучением светом, которые равны или больше чем 15 мкг/мкл, в диапазоне 15-200 мкг/мкл, согласно настоящему изобретению. Следует отметить, что в JP 2003048851 введение повторяли три раза в день (10 мкл/на введение, 0,004% масс./об.) в течение 5 дней, равное дозе 1,2 мкг/в день и общей дозе 6 мкг. Даже если принять во внимание ежедневную дозу и общую дозу, они слишком низки для проявления нейропротекторных эффектов; фактически, согласно настоящему изобретению, для получения нейропротекторных эффектов в сетчатке, подвергшейся световому повреждению, следует местно вводить минимальную общую дозу 150 мкг. Новые данные, полученные на другой экспериментальной модели, а именно, на мыши с проявлениями глаукомы, подтверждают, что из трех используемых концентраций BDNF (1, 5 и 15 мкг/мкл), только наивысшая (15 мкг/мкл) оказалась эффективной.
Более того, в JP 2003048851 упоминается об эффекте, предохраняющем сетчатку глаза, подтвержденном гистологическим методом (с прокрашиванием срезов сетчатки гематоксилин-эозиновым красителем), предназначенным для измерения толщины сетчатки, но не сопровождаемым демонстрацией восстановления функции сетчатки, измеряемой путем снятия импульсной электроретинограммы, как описано в настоящем изобретении. Хорошо известно, что для того чтобы продемонстрировать нейропротекторную эффективность на уровне сетчатки при любом способе обработки, недостаточно получить только результаты гистологических/морфологических методов; также требуется доказательство восстановления функций сетчатки. Таким образом, можно сделать заключение, что в JP 2003048851 офтальмологические композиции BDNF в концентрациях, указанных в примерах и вообще в предпочтительном диапазоне, вводимые наружно, не способны проходить от поверхности глаза к внутренней ткани в количествах, достаточных для проявления нейропротекторного эффекта, способного восстановить функцию сетчатки.
WO 2006/046584 относится к композициям с замедленным высвобождением, содержащим NGF, BDNF или PEDF, наполненным сшитым желатиновым гидрогелем, полезным для лечения нарушений, включающих повреждение зрительных клеток, таких как пигментная дистрофия сетчатки. В конкретных примерах композиции имеют форму микросфер, содержащих дозы BDNF в пределах 0,001-1000 мкг, и могут вводиться посредством внутриглазной инъекции или подсетчатного импланта.
В EP 0958831 описаны офтальмологические композиции, содержащие нейротрофический фактор, выбранный из группы факторов, включающих BDNF. Указанные композиции можно применять наружно, например, в форме офтальмологических мазей или растворов, и можно включить в состав препарата в виде контактных линз.
Концентрация нейротрофического фактора, раскрытая в EP0958831, составляет диапазон от 0,0001 до 0,5% (масс./об.), то есть от 1×10-3 до 5 мкг/мкл. Указанные диапазоны концентраций, таким образом, являются очень широкими. EP0958831 является крайне общим, потому что он касается различных нейротрофических факторов, включая BDNF, которые могут быть равноэффективными в данном диапазоне концентраций. Известно, что нейротрофические факторы не являются равноэффективными в одном диапазоне концентраций из-за различной плотности рецепторов и распределения рецепторов, которые определяют их биологические эффекты в различных участках мозга и отдельных нервных клетках.
Кроме того, EP0958831 является чрезвычайно неопределенным и неясным в отношении диапазона эффективных концентраций BDNF для местного применения: на стр. 3, строка 44 (см. параграфы 0022 и 0033, пункты 19 и 20 формулы изобретения) даны два диапазона концентраций, которые не совпадают (максимум диапазона А, от 0,0001 до 0,5% (масс./об.), равный диапазону концентраций от 10-3 до 5 мкг/мкл, и диапазон В, от 10-3 до 2×105 мкг/л; ясно, что два диапазона концентраций не соответствуют друг другу). Согласно настоящему изобретению, однако, эффективные концентрации BDNF равны/выше чем 15 мкг/мкл (диапазон 15-200 мкг/мкл), то есть, выше, чем диапазон A, указанный в EP 958831, а именно, максимальный диапазон концентраций. Примеры в EP 958831 касаются офтальмологических композиций, характеризуемых концентрацией BDNF 0,02, 0,04 и 10 мкг/л, то есть, концентрациями, которые намного ниже (в 1×106 раз ниже), чем минимальная концентрация, которая, согласно настоящему изобретению, обеспечивает эффективность для повышения уровней BDNF в сетчатке и предотвращения, как светового повреждения, так и повреждения при глаукоме, а именно, 15 мкг/мкл.
Можно, таким образом, заключить, что офтальмологические композиции с BDNF в концентрациях, указанных в EP 958831, вводимые наружно, не проходят через поверхность глаза к внутренним тканям в количествах, достаточных для повышения уровней BDNF в сетчатке и, следовательно, для осуществления терапевтического эффекта.
NT-4, другой нейротрофин, который связывается в TrkB, экспрессируется в сетчатке на низком уровне и действует только на подгруппу амакринных клеток, то есть, таких, которые синтезируют допамин (Calamusa et al., 2007).
Отсутствие BDNF или его рецепторов вызывает серьезные изменения в функционировании сетчатки; например, мышь, у которой отсутствует TrkB рецептор (нокаутированная мышь) характеризуется полной потерей реакции сетчатки глаза на свет (полное отсутствие b-волны в импульсной электроретинограмме; Rohrer et al.,1999).
Группа LaVail продемонстрировала, что внутриглазные инъекции BDNF, но не NGF, эффективно предотвращают морфологическую дегенерацию фоторецепторов, вызванную повреждением светом.
Внутриглазные инъекции BDNF совместно с другими нейротрофическими факторами понижали повреждение ганглионарных клеток сетчатки, которое представляло собой результат поражения зрительного нерва, хотя все еще не ясным остается, способен ли BDNF сам по себе осуществлять нейропротекторный эффект, то есть, независимо от других нейротрофических факторов (Watanabe et al., 2003; Yata et al., 2007).
Другие нейротрофические факторы, такие как FGF2, как было доказано, являются эффективными в предотвращении морфологических изменений, вызванных световым повреждением, но в противоположность BDNF, их введение имеет нежелательный эффект активации факторов, вовлеченных в вызов воспалительной реакции (LaVail et al., 1987).
Другой нейротрофический фактор, CNTF, также предотвращает морфологическую дегенерацию, являющуюся результатом светового повреждения (LaVail et al., 1978); к сожалению, недавние эксперименты продемонстрировали, что лечение на основе CNTF изменяет реакцию сетчатки глаза на свет, налагая, таким образом, серьезные ограничения на его потенциальное терапевтическое применение (McGill et al., 2007).
Эти результаты указывают на то, что для нейропротекторных целей у моделей с нарушениями сетчатки недостаточно оценивать морфологические эффекты нейроактивных молекул; прежде всего необходимо оценить, проявляют ли эти молекулы нейропротекторный эффект при функционировании сетчатки, и удостовериться в том, что они не ухудшают реакцию клеток сетчатки на зрительные раздражители. Существует потребность в разработке новых препаратов BDNF, которые можно вводить неинвазивными методами для доставки BDNF к сетчатке, избегая сильно инвазивных методов введения, таких как внутриглазные, субретинальные или ретробульбарные инъекции, которые не подходят для длительного лечения из-за риска вызвать, например, прободение глазного яблока, инфекцию или слепоту.
В настоящем изобретении предлагается местное введение на конъюнктиву различных препаратов, содержащих BDNF в диапазоне концентраций от 15 до 200 мкг/мкл, с общей дозой BDNF от 50 до 4000 мкг в расчете на введение, в соответствии с размером обрабатываемого глаза, который будет зависеть от вида животного, включая человека.
Препарат будет предпочтительно содержать средство, регулирующее вязкость. Указанное средство, регулирующее вязкость, предпочтительно представляет собой галактоксилоглюкан, экстрагируемый из семян индийского финика (TS-полисахарид или TSP), имеющий молекулярную массу от 500000 до 800000 Da и следующую структурную формулу:

Авторы изобретения показали, что указанный выше препарат в концентрациях и дозах, указанных для введения, значительно увеличивает уровни BDNF в сетчатке и предотвращает i) изменения в сетчатке, вызванные длительным воздействием света, и ii) изменения сетчатки при глаукоме.
Ранее было показано (Uccello-Barretta G et al., 2008; Ghelardi E et al., 2004; Burgalassi S et al., 2000; Ghelardi E et al. 2000), что TSP способен переносить фармакологически активные молекулы при местной обработке поверхности глаза. Путем увеличения времени удерживания препарата на поверхности глаза, наблюдается повышенная адсорбция активных молекул. Это свойство TSP было описано в комбинации с антибиотиками (руфлоксацином, гентамицином и офлоксацином), антигистаминами (кетотифеном) и противогипертоническими средствами (тимололом), которые представляют собой молекулы малого размера.
В случае фармакологических препаратов, содержащих рекомбинантные белки, такие как BDNF, активный ингредиент представляет собой белок, молекулу с высокой молекулярной массой, подвергаемую посттрансляционным модификациям и адаптации его пространственного изгибания до тех пор, пока он не достигнет активной трехмерной конфигурации. Биологическая активность белков сильно зависит от их трехмерной конфигурации, потому что от этого зависит взаимодействие со специфическими рецепторами и ферментами, которые распознают их, и, следовательно, способность вмешиваться в биологические процессы в клетках-мишенях. Конфигурация белка может значительно изменяться под действием среды, в которой находится рекомбинантный белок. Препараты, содержащие рекомбинантные белки, должны, таким образом, гарантировать, что белок поддерживается в растворе в своей активной конфигурации, и гарантировать его стабильность.
Настоящее изобретение показывает, что TSP гарантирует стабильность BDNF в препарате, повышая глазную адсорбцию благодаря продолжительному времени удерживания препарата на поверхности и, главным образом, поддерживая BDNF в его биологически активной конфигурации.
Сущность изобретения
Было обнаружено, что офтальмологические препараты, содержащие BDNF в концентрациях, по меньшей мере, 15 мкг/мкл предотвращают изменения в сетчатке, вызванные длительным воздействием света, а также изменения, которые связаны с повышенным внутриглазным давлением на модели глаукомы.
Изобретение, таким образом, относится к офтальмологическим препаратам в форме глазных капель, содержащих нейротрофический фактор головного мозга (BDNF). Согласно его предпочтительному аспекту, композиции согласно изобретению содержат галактоксилоглюкан, экстрагируемый из семян индийского финика, известный как TSP.
Изобретение также относится к применению BDNF для получения лекарственного препарата в форме глазных капель для предотвращения и/или лечения нейродегенеративных нарушений сетчатки глаза, зрительного нерва и латерального коленчатого тела.
Настоящее изобретение также относится к офтальмологическому препарату в форме глазных капель, содержащему BDNF для применения в предотвращении и/или лечении нейродегенеративных нарушений сетчатки глаза, зрительного нерва и латерального коленчатого тела.
Перечень фигур
На фиг.1 показано определение BDNF уровней в сетчатке (A), зрительном нерве (B) и в стекловидном теле глаза (C) после местного введения BDNF в физиологическом растворе. Уровни BDNF показаны на y-оси и измерены в глазу, обработанном BDNF, и в контрольном глазу, обработанном солевым раствором; * отмечена статистическая значимость различий.
На фиг.2 показано определение BDNF уровней в сетчатке (A), зрительном нерве (B) и в стекловидном теле глаза (C) после местного введения BDNF в растворе с натрийкарбоксиметилцеллюлозой. Для условных обозначений и символов см. фиг.1.
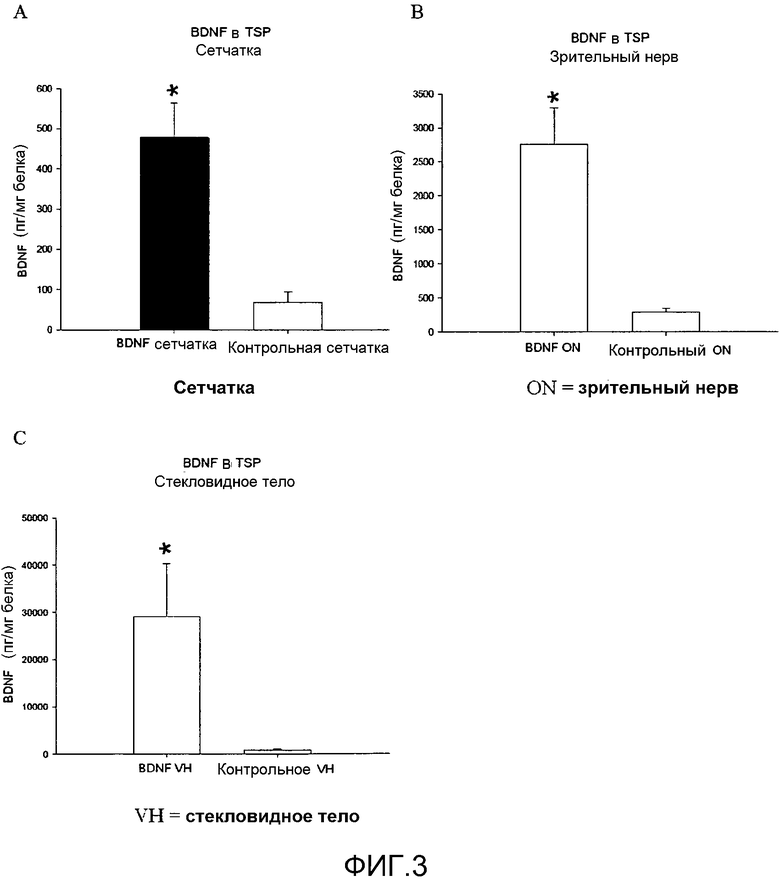
На фиг.3 показано определение BDNF уровней в сетчатке (A), зрительном нерве (B) и в стекловидном теле глаза (C) после местного введения BDNF в растворе с TSP. Для условных обозначений и символов см. фиг.1.
На фиг.4 показана сравнительная эффективность TSP, солевого раствора (NaCl) и натрийкарбоксиметилцеллюлозы (CMC) в переносе BDNF и увеличении его концентраций в сетчатке (пкг/мг белка, см. x-ось). Уровни BDNF в сетчатке после местной обработки BDNF в TSP (*) значительно повысились по сравнению с уровнем BDNF после местной обработки BDNF в физиологическом растворе и в натрийкарбоксиметилцеллюлозе. Данные взяты из графиков A на фиг.1, 2 и 3.
На фиг.5 показана кинетика уровней BDNF в сетчатке, зрительном нерве и в стекловидном теле глаза после местного введения BDNF в растворе с TSP. BDNF уровни остаются весьма высокими в первые 6 часов после обработки (*).
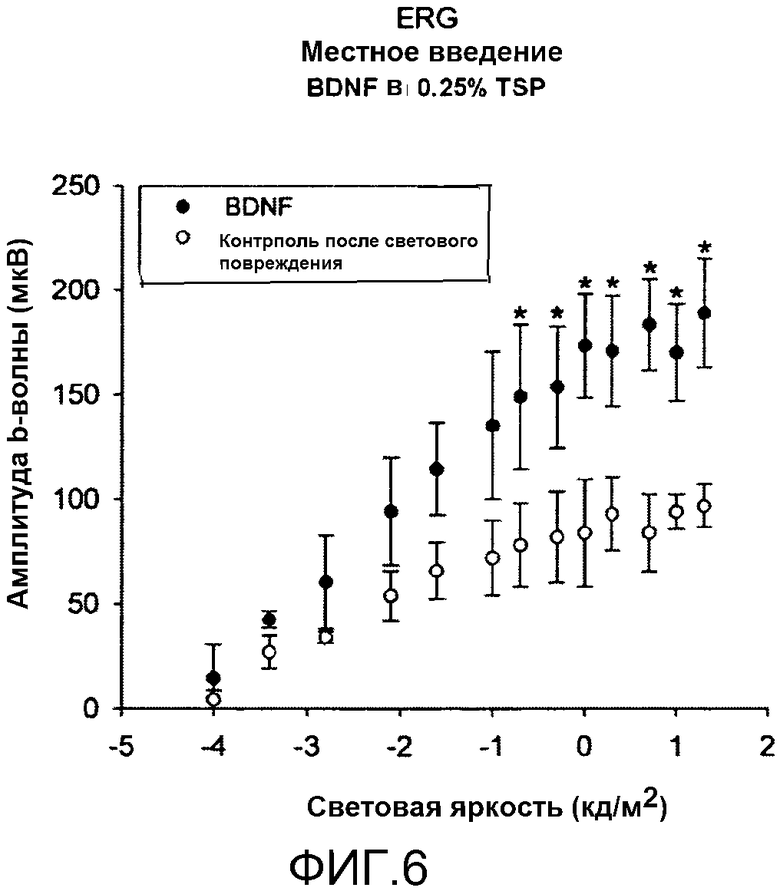
На фиг.6 показано, что местное введение BDNF в TSP уменьшает вызванные световым повреждением изменения ответа сетчатки на световую вспышку (flash ERG). Измеряли и записывали амплитуду (мкВ, см. y-ось) b-волны электроретинограммы, вызванную вспышками различной световой яркости (кд/м2, см. x-ось) для глаза, обработанного BDNF (черные символы), или контрольного глаза, обработанного только TSP (контроль со световым повреждением, белые символы); * означает, что разница является статистически значимой.
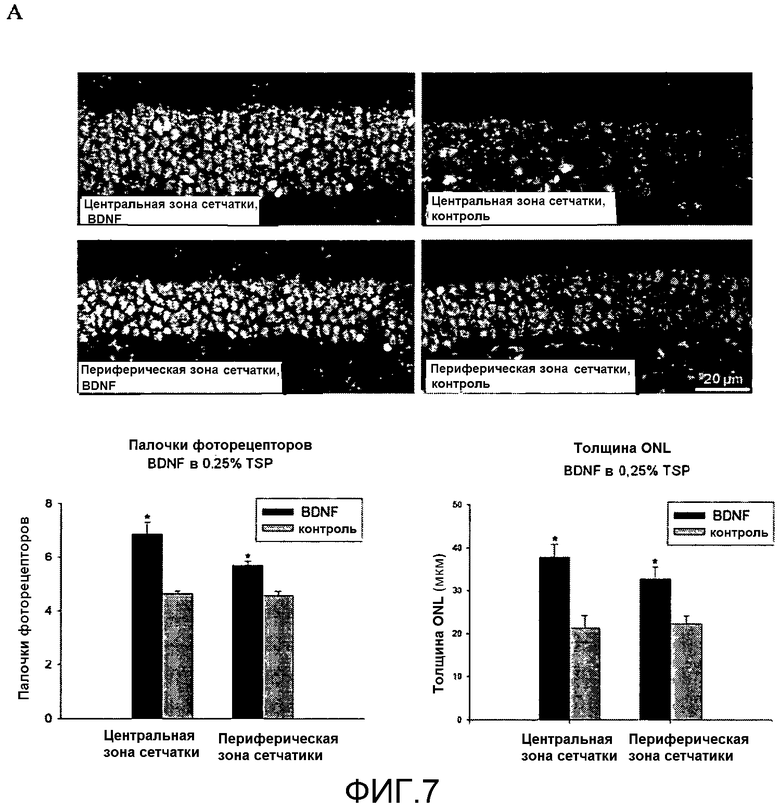
На фиг.7 показано, что местное введение BDNF в TSP увеличивает число фоторецепторов, выживающих после светового повреждения. Фоторецепторы метили пропидиййодидом в поперечном сечении сетчатки. Вне зависимости от используемого метода (прямой подсчет палочек фоторецепторных клеток (фиг.7B) или измерение толщины наружного зернистого слоя (ONL) (фиг.7C)), фоторецепторы, присутствующие в центральной и периферической зонах сетчатки, оказывались (*) значительно более многочисленными в глазу, обработанном BDNF, чем в глазу, обработанном носителем (контроль).
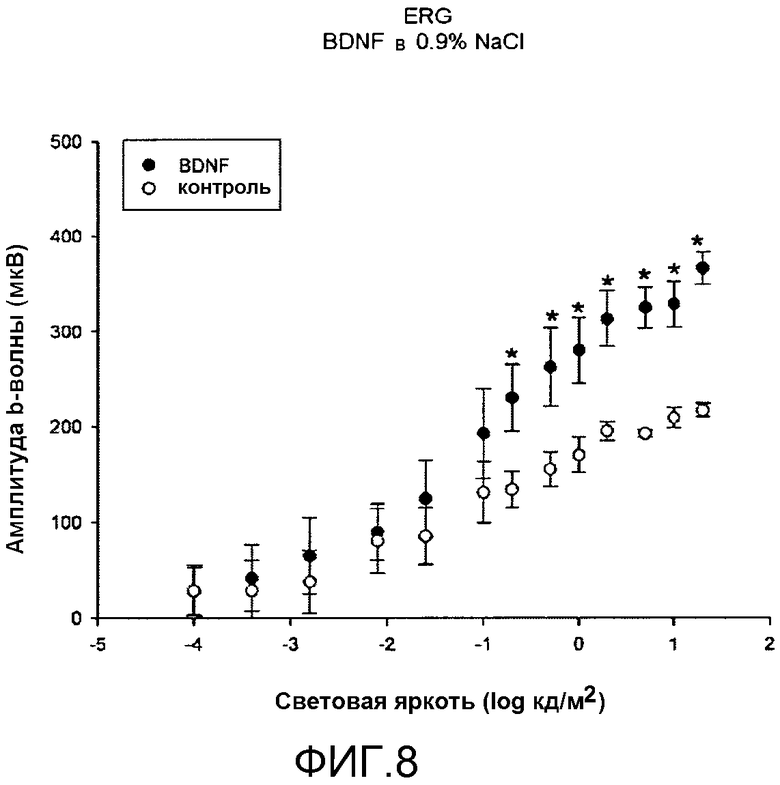
На фиг.8 показано, что местное введение BDNF в физиологическом растворе (NaCl) понижает вызванную световым повреждением ослабленную реакцию сетчатки на свет. Для условных обозначений и символов см. фиг.6.
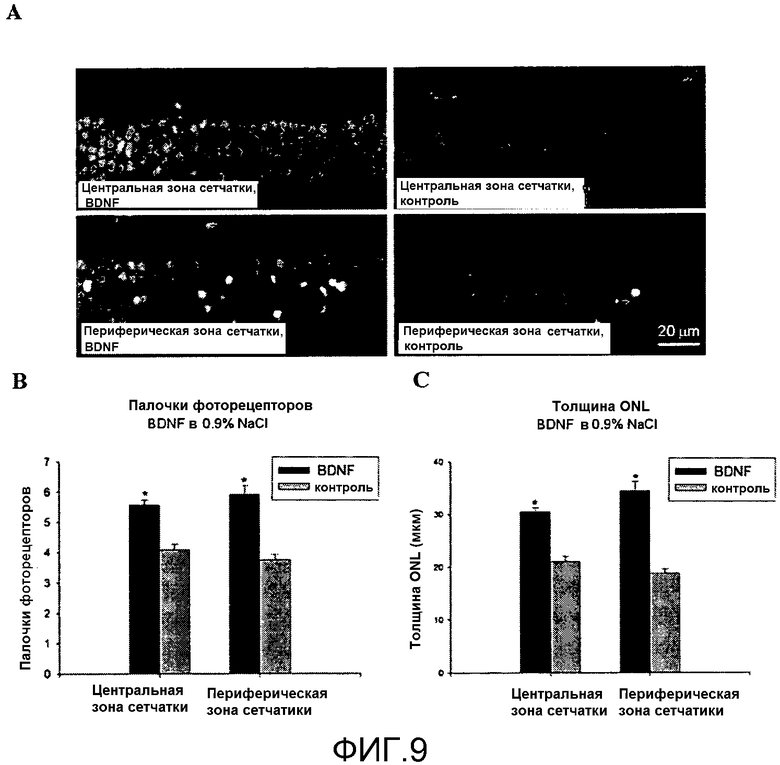
На фиг.9 показано, что местное введение BDNF в физиологическом растворе повышает выживаемость фоторецепторов после светового повреждения. Для условных обозначений и символов см. фиг.7.
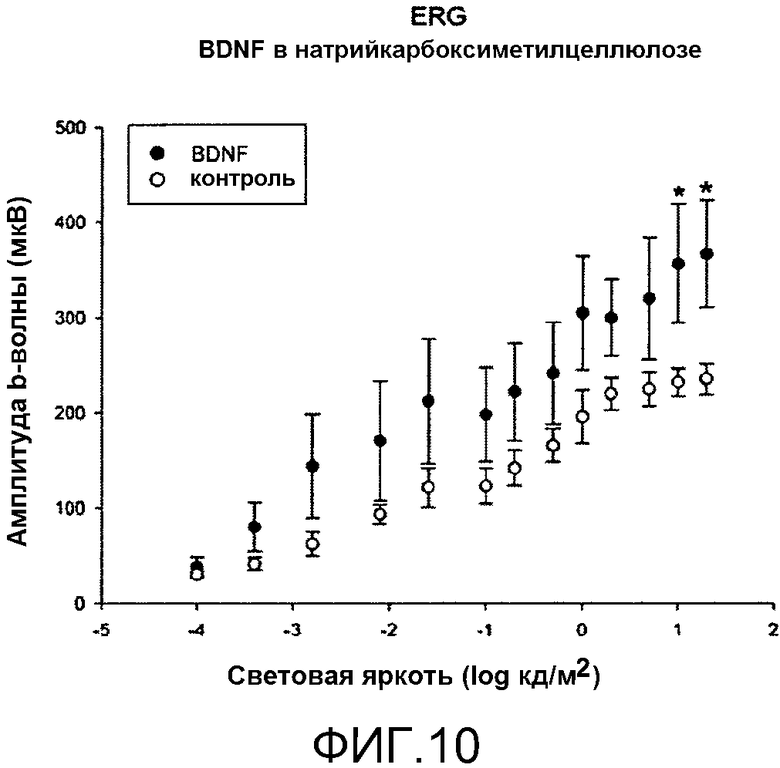
На фиг.10 показано местное введение BDNF в растворе с карбоксиметилцеллюлозой и ослабленную реакцию на свет, вызванную световым повреждением. Для условных обозначений и символов см. фиг.6.
На фиг.11 показаны эффекты местной обработки BDNF в растворе с карбоксиметилцеллюлозой на выживаемость фоторецепторов после светового повреждения глаза, обработанного BDNF, и глаза, обработанного носителем (контроль). Для условных обозначений и символов см. фиг.7.
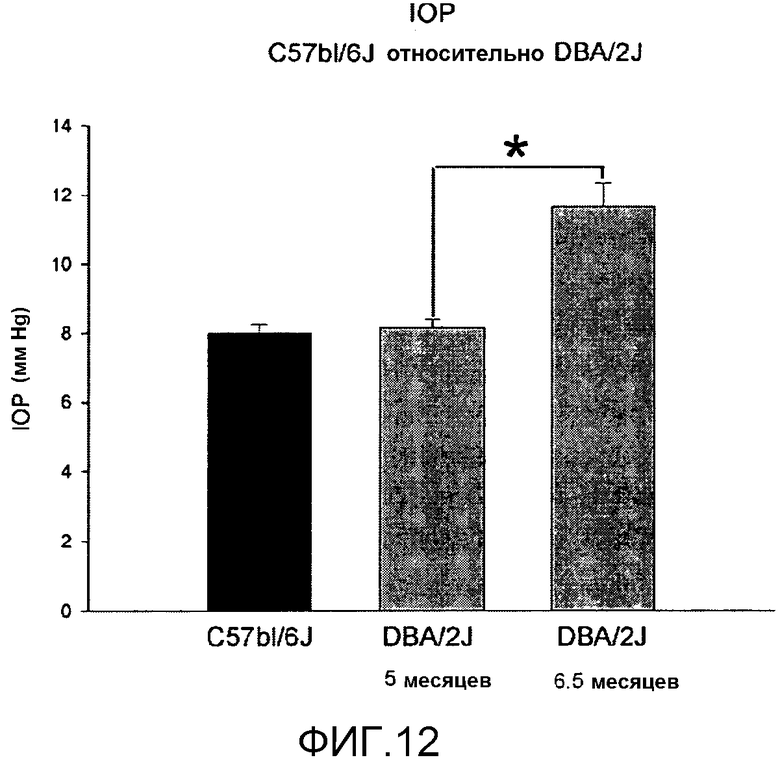
На фиг.12 показано повышение внутриглазного давления (IOP, мм рт. ст.) на экспериментальной мышиной модели глаукомы, DBA/2J мышь относительно нормальной мыши (C57bl/6J). Повышение IOP у DBA/2J является статистически значимым (*), начиная с возраста 6½ месяцев.
На фиг.13 показана реакция сетчатки на визуальные образы (образ ERG, P-ERG; стимул, состоящий из пространственной частоты =0,2 C/град, контраст 90%) регистрировали у нормальной мыши (C57bl/6J, темные символы) и у мыши с проявлениями глаукомы (DBA/2J); амплитуды ответов P-ERG (мкВ, см. y-ось) измеряли путем стимуляции глаза, обработанного в течение двух недель различными концентрациями BDNF (1, 5 и 15 мкг/мкл) и путем стимуляции глаза, обработанного носителем, рассматриваемого в качестве контрольного глаза (CTRL); * отмечена статистическая значимость различий. P-ERG регистрировали у мыши DBA/2J в возрасте 7 месяцев, то есть после повышения внутриглазного давления (IOP).
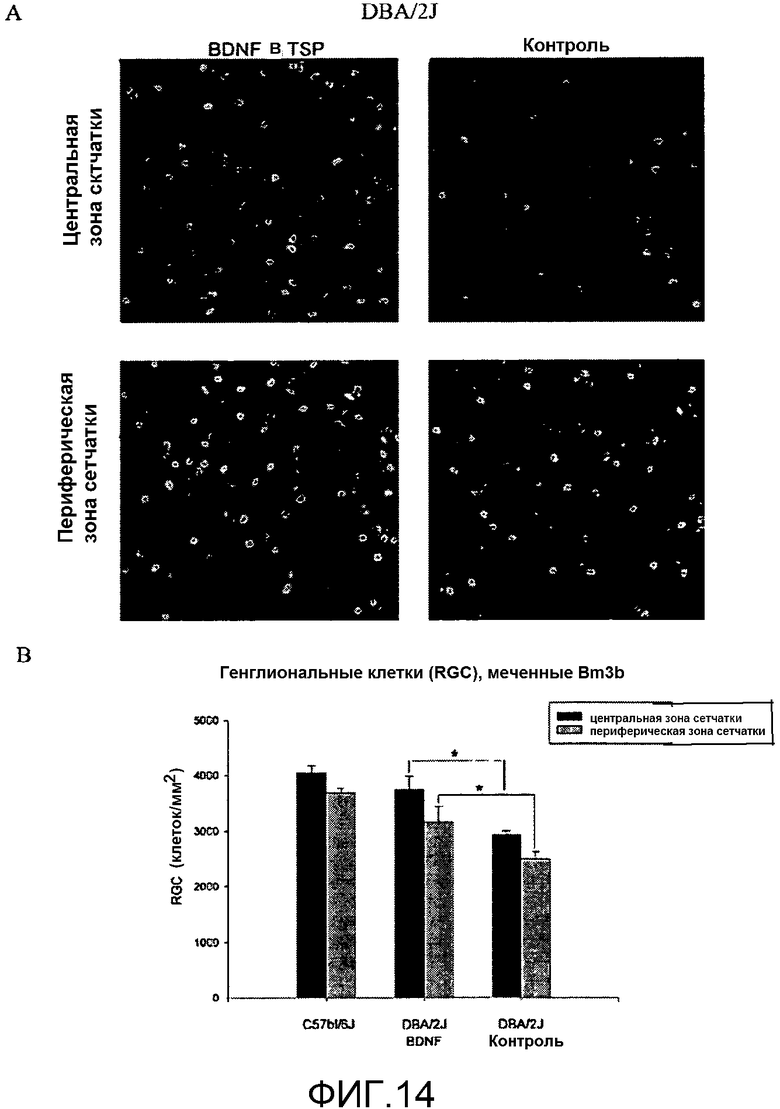
На фиг.14 показаны ганглионарные клетки сетчатки (методика тотального препарата) DBA/2J мыши с проявлениями глаукомы (в возрасте 7 месяцев), меченные флуоресцентным антителом, которое связывается с фактором транскрипции (Brn3b). A. Левая колонка показывает эффекты двухнедельной местной обработки BDNF в TSP центральной зоны сетчатки (верхний ряд) и периферической зоны сетчатки (нижний ряд). После обработки BDNF (левая колонка), меченые клетки оказывались более многочисленными, чем в сетчатке контрольного глаза (CTRL), которую обрабатывали только носителем (правая колонка). B. Количественные эффекты местной обработки BDNF ганглионарных клеток (плотность измерена как число клеток/мм2, представлена на y-оси), меченных Brn3b, у мыши с проявлениями глаукомы (DBA/2J; глаз, обработанный BDNF; глаз, обработанный носителем, CTRL) и у нормальной мыши (C57bl/6J).
Подробное описание изобретения
Неожиданно было обнаружено, что при введении экзогенного нейротрофического фактора головного мозга (BDNF), вводимого местно на исходную поверхность глаза, в частности в конъюнктивальный мешок, BDNF осуществляет нейропротекторный эффект в отношении клеток сетчатки как на функциональном, так и на морфологическом уровне, делая возможным, таким образом, предотвращение и/или лечение нейродегенеративных нарушений в сетчатке.
BDNF продемонстрировал нейропротекторную эффективность не только по отношению к фоторецепторам, но также по отношению к ганглионарным клеткам, то есть, к клеткам (i) глубинного слоя сетчатки, которые направляют свои волокна к зрительным центрам, (ii) к волокнам зрительного нерва, и (iii) к зрительным центрам, расположенным вне сетчатки, таким как латеральное коленчатое тело.
Настоящее изобретение относится к офтальмологическому препарату, содержащему BDNF (нейротрофический фактор головного мозга).
Указанный выше офтальмологический препарат содержит BDNF в концентрации, которая может составлять от нижнего предела 15 мкг/мкл до 200 мкг/мкл, предпочтительно от 20 до 100 мкг/мкл и даже более предпочтительно от 30 до 50 мкг/мкл. Общая биодоступная доза может составлять от 50 до 4000 мкг на введение, из расчета на объем вводимого офтальмологического препарата и в зависимости от вида, которому принадлежит обрабатываемый глаз, включая человека.
BDNF можно вводить отдельно или в комбинации с другими активными ингредиентами, такими как β-блокаторы, простагландины и ингибиторы карбоангидразы.
Препараты получают в форме глазных капель, и они могут представлять собой раствор, суспензию, гель или офтальмологическую мазь с активным ингредиентом BDNF или с активными ингредиентами в фармацевтически приемлемом носителе, совместимом с активным ингредиентом и переносимом глазами.
Фармацевтически приемлемый носитель может представлять собой физиологический раствор, предпочтительно содержащий 0,9% хлорида натрия.
Также было обнаружено, что уровни адсорбции улучшенного BDNF можно повысить, если в препарате используют, по меньшей мере, один фармацевтически приемлемый носитель, предпочтительно галактоксилоглюкан, экстрагированный из семян индийского финика (TSP), который благодаря своей вязкости делает возможным более длительное удерживание BDNF на поверхности глаза, чем введение в физиологическом растворе, который смывается с конъюнктивы более быстро.
Концентрацию TSP можно варьировать предпочтительно от 0,05 до 2% (масса/объем - масс./об.), и даже более предпочтительно от 0,25 до 0,5% (масс./об.).
TPS является прозрачным, вязкоупругим и стерильным, и используется для защиты роговицы. TSP также образует остающуюся на долго пленку на поверхности глаза, которая смазывает и увлажняет роговицу и конъюнктиву.
Согласно дополнительному предпочтительному аспекту, раствор, обладающий повышенной вязкостью, содержит гиалуроновую кислоту, и, даже более предпочтительно, гиалуроновую кислоту в комбинации с TSP.
Концентрацию гиалуроновой кислоты можно варьировать, предпочтительно от 0,05% до 0,8% (масс./об.), и даже более предпочтительно от 0,2 до 0,4% (масс./об.).
Согласно предпочтительному варианту осуществления препарат может содержать BDNF в концентрации 15 мкг/мкл в физиологическом растворе, содержащем 0,9% NaCl.
Согласно дополнительному предпочтительному варианту осуществления препарат может содержать BDNF в концентрации 15 мкг/мкл в физиологическом растворе с TSP, предпочтительно в 0,25% растворе.
Препарат глазных капель можно вводить местно непосредственно на исходную поверхность глаза, то есть неинвазивным способом, избегая применения инвазивных способов, таких как внутриглазные, подсетчатные и ретробульбарные инъекции. В частности, препараты можно вводить в конъюнктивальный мешок. Препарат также можно включить в состав препарата глазной повязки или контактных линз.
Сетчатка глаза представляет собой до некоторой степени отдельную часть центральной нервной системы; существуют различные типы барьеров, включая гематоретинальный барьер, который препятствует неспецифической диффузии соединений, таких как крупные молекулы, к сетчатке. Внутриглазное проникновение активных соединений, введенных местно, регулируется барьерами, расположенными в роговице и конъюнктиве, путем системной адсорбции и путем метаболического расщепления под действием ферментов, присутствующих в этих тканях. Сразу после закапывания фармакологически активные соединения должны пройти сложную систему гематобарьеров, включая гематоретинальный барьер, для того чтобы проникнуть в нижележащие ткани до самой сетчатки.
Кроме того, сетчатка, посредством ганглионарных клеток, из которых исходят волокна зрительного нерва, связана через зрительный нерв со зрительными центрами, такими как задний отдел латерального коленчатого тела (dLGN).
Как продемонстрировано в экспериментальной части, BDNF, если вводить его местно, согласно изобретению, может переноситься к сетчатке, вызывая повышение своей концентрации в сетчатке до уровней, которые осуществляют нейропротекторный эффект как с функциональной, так и с морфологической точки зрения.
Также неожиданно было обнаружено, как было продемонстрировано путем экспериментального доказательства, что ганглионарные клетки делают возможным антероградный (перемещающий вперед) транспорт BDNF, позволяя BDNF предотвращать и лечить дегенерацию не только ганглионарных клеток, но также волокон зрительного нерва, и распространяться на нарушения зрительных центров, лежащих вне сетчатки глаза, таких как латеральное коленчатое тело.
Настоящее изобретение также относится к применению BDNF для получения офтальмологического лекарственного препарата в форме глазных капель для местного введения на исходную поверхность глаз для предотвращения и/или лечения нейродегенеративных нарушений сетчатки, зрительного нерва и латерального коленчатого тела, в частности, дегенеративных ретинопатий (таких как пигментная дистрофия сетчатки и глаукома), старческих ретинопатий (таких как старческая дистрофия желтого пятна), сосудистых и пролиферативных нарушений сетчатки глаза, отслоения сетчатки, ретинопатии недоношенных (ROP) и диабетической ретинопатии, которые приводят к слепоте. Препараты по изобретению также полезны для предотвращения и/или лечения нейродегенеративных нарушений сетчатки, зрительного нерва и латерального коленчатого тела, в особенности, например, пигментной дистрофии сетчатки и глаукомы (включая врожденную глаукому, инфантильную глаукому, юношескую глаукому, глаукому взрослых, первичную открытоугольную глаукому, первичную закрытоугольную глаукому, острую глаукому, ятрогенную глаукому и вторичную глаукому).
Глаукома представляет собой одно из серьезных прогрессирующих нарушений, влияющих на глаза, которую, если не лечить соответствующим образом, ведет к слепоте из-за потери ганглионарных клеток и прогрессирующей атрофии волокон зрительного нерва.
Глаукома характеризуется повышением внутриглазного давления (IOP), которое может повредить ганглионарные клетки и волокна зрительного нерва либо непосредственно (механически), либо косвенно, вызывая ишемию сосудов сетчатки, которые питают внутреннюю зону сетчатки. На стадии прогрессирования, так же как и на сетчатку, глаукома может воздействовать на зрительные центры, такие как латеральное коленчатое тело, так что в конечном итоге вовлекается зрительная зона коры головного мозга.
Также было обнаружено, что обработка BDNF в эффективных концентрациях не только предотвращает и уменьшает дегенерацию фоторецепторов, вызванную продолжительным воздействием света (световым повреждением), но и сохраняет реакцию сетчатки глаза на свет; более того, использование экспериментальной модели глаукомы продемонстрировало, что местное введение BDNF предотвращает дегенерацию ганглионарных клеток сетчатки, которая приводит к повышению внутриглазного давления (IOP) на животной модели глаукомы; на обеих животных моделях BDNF не изменяет реакцию сетчатки глаза на зрительные раздражители.
Приведенные ниже примеры дополнительно иллюстрируют изобретение.
Примеры
Примеры препаратов
Препарат 1
BDNF в физиологическом растворе: 150 мкг BDNF растворяли в 10 мкл солевого раствора, содержащего 0,9% NaCl.
Препарат 2
BDNF в физиологическом растворе с натрийкарбоксиметилцеллюлозой: 150 мкг BDNF растворяли в растворе, состоящем из 5 мкл солевого раствора, содержащего 0,9% NaCl и 5 мкл 0,4% натрийкорбоксиметилцеллюлозы.
Препарат 3
BDNF в физиологическом растворе с TSP: 150 мкг BDNF растворяли в 5 мкл солевого раствора, содержащего 0,9% NaCl и 5 мкл 0,5% TSP.
Препарат 4
BDNF в физиологическом растворе с гиалуроновой кислотой (0,2%): 150 мкг BDNF растворяли в 5 мкл солевого раствора, содержащего 0,9% NaCl и 5 мкл 0,4% гиалуроновой кислоты.
Препарат 5
BDNF в физиологическом растворе с гиалуроновой кислотой (0,4%): 150 мкг BDNF растворяли в 5 мкл солевого раствора, содержащего 0,9% NaCl и 5 мкл 0,8% гиалуроновой кислоты.
Препарат 6
BDNF в физиологическом растворе с гиалуроновой кислотой и TSP (I): 150 мкг BDNF растворяли в 5 мкл солевого раствора, содержащего 0,9% NaCl и 5 мкл 0,4% гиалуроновой кислоты и 0,4% TSP.
Препарат 7
BDNF в физиологическом растворе с гиалуроновой кислотой и TSP (II): 150 мкг BDNF растворяли в 5 мкл солевого раствора, содержащего 0,9% NaCl и 5 мкл 0,8% гиалуроновой кислоты и 0,4% TSP.
Препарат 8
BDNF в физиологическом растворе с гиалуроновой кислотой и TSP (II): 150 мкг BDNF растворяли в 5 мкл солевого раствора, содержащего 0,9% NaCl и 5 мкл 0,4% гиалуроновой кислоты и 0,6% TSP.
Биоанализы
Пример 2.1- Определение уровней BDNF в стекловидном теле глаза, в сетчатке и в зрительном нерве спустя 6 часов после местной обработки глаза препаратами на основе BDNF.
Использовали описанные выше препараты 1, 2 и 3, содержащие BDNF:
Исследование проводили на крысах-альбиносах (крысы породы Wistar, Харлан, Италия); BDNF в физиологическом растворе с натрийкарбоксиметилцеллюлозой или в физиологическом растворе с TSP, вводили местно, закапывая в конъюнктивальный мешок одного глаза, в то время как другой глаз, используемый в качестве контроля, обрабатывали раствором («плацебо»), используемым для включения и доставки BDNF.
Определение уровней BDNF в сетчатке, стекловидном теле глаза и в зрительном нерве
Животных забивали спустя 6 часов после введения, после глубокой анестезии, вызванной внутрибрюшинной инъекцией уретана (20%). Затем удаляли глаза и измеряли уровень BDNF в стекловидном теле глаза, гомогенате сетчатки и гомогенате оптического нерва, как для глаза, обработанного BDNF, так и для другого глаза, обработанного только раствором носителей (контрольный глаз). Измерения проводили при помощи иммуноанализа (ELISA; BDNF Emax immunoassay system, Promega, Madison, WI, USA). Также определяли количество BDNF в зрительном нерве, для того чтобы установить, адсорбировался и перенесся ли BDNF привнесенный снаружи, путем местного введения, клетками сетчатки, в частности, ганглионарными клетками сетчатки, которые своими волокнами формируют зрительный нерв.
Результаты, представленные на графике на фиг.1, получали при местном введении BDNF из солевого раствора (0,9% NaCl) и выражали, как величины средних концентраций BDNF в сетчатке (A), зрительном нерве (B) и стекловидном теле глаза (C), в пересчете на пкг/мг белка.
Статистический анализ проводили согласно критерию Стьюдента, сравнивая глаз, обработанный BDNF, с контрольным глазом: во всех случаях, различия между обработанным глазом и контрольным глазом были статистически достоверными (*, p<0,05).
Результаты, представленные на графике на фиг.2, касаются местного введения BDNF в растворе с натрийкарбоксиметилцеллюлозой (0,2%), в то время как результаты, представленные на графиках на фиг.3, были получены при местном введении BDNF в растворе с TSP (0,25%); в обоих случаях статистический анализ проводили по критерию Стьюдента, сравнивая глаз, обработанный BDNF, с контрольным глазом. Во всех случаях различия между обработанным глазом и контрольным глазом оказывались статистически достоверными (*, p<0,05).
На фиг.4 показаны сравнительные уровни BDNF в сетчатке для каждого используемого типа раствор/носитель; этот анализ облегчает сравнение эффективности различных растворов/носителей при одной и той же концентрации BDNF (10 мкл раствора, содержащего 150 мкг BDNF). Местная обработка BDNF в TSP давала значительно более высокие уровни BDNF в сетчатке, чем два других используемых препарата, то есть, BDNF в физиологическом растворе и BDNF в растворе с натрийкарбоксиметилцеллюлозой (критерий Стьюдента *, p<0,05). Местная обработка BDNF в растворе с натрийкарбоксиметилцеллюлозой оказалась наименее эффективной в повышении уровня BDNF в сетчатке.
Пример 2.2 - Определение уровней BDNF в сетчатке, стекловидном теле глаза и в зрительном нерве в различное время после местной обработки глаза BDNF в TSP
Исследовали интервал, в течение которого BDNF оставался высоким в сетчатке, стекловидном теле глаза и в зрительном нерве после однократного местного введения. Это исследование проводили с носителем, содержащим TSP, который оказался наиболее эффективным в содействии транссклеральному прохождению BDNF к сетчатке, зрительному нерву и стекловидному телу глаза. Исследовали кинетику уровней BDNF в сетчатке, зрительном нерве и стекловидном теле глаза после местного введения на глаз, с использованием TSP. N=5 глаз обрабатывали в каждой исследуемой группе. Концентрацию BDNF в сетчатке, зрительном нерве и в стекловидном теле глаза измеряли в различные интервалы времени после введения 0,25% раствора TSP, содержащего BDNF (10 мкл раствора, содержащего 150 мкг BDNF). Контрольный глаз обрабатывали только раствором носителя, содержащим 0,25% TSP. Эти эксперименты выполняли для того, чтобы установить временной ход уровней BDNF после однократного местного введения. Графики показывают средние значения BDNF (y-ось; пкг/мл) в сетчатке, зрительном нерве и стекловидном теле глаза через 6, 12 и 24 часа после введения. На фиг.5 показано, что уровень BDNF в сетчатке остается статистически высоким, возвращаясь к базовым уровням после 12-24 часов. Статистический анализ проводили согласно критерию Стьюдента: в A *, p<0,01 в сравнении с контрольным глазом. Результаты этих экспериментов подтверждают, что для длительной обработки BDNF, включенного в состав искусственных слез, в частности, на основе TSP, одного местного введения каждые 12 часов достаточно для поддержания высоких уровней BDNF в сетчатке.
Пример 2.3 - Нейропротекторные эффекты местного введения препаратов на основе BDNF
Для установления нейропротекторных эффектов BDNF после обработки путем местного введения в конъюнктивальный мешок, использовали экспериментальную модель, на которой дегенерацию сетчатки вызывали световым повреждением у животных моделей; такую модель широко используют для изучения дегенерации фоторецепторов сетчатки, вызванной длительным воздействием сильного источника света (La Vail et al., 1987; Rex et al., 2003). Гибель фоторецепторов происходит путем апоптоза и вызывается избыточной адсорбцией фотонов зрительным пигментом родопсином, приводящей к изменению цикла регенерации пигмента, в который, в конечном счете, вовлекаются наполненные пигментом эпителиальные клетки. Исследуемая экспериментальная модель животного представляла собой крысу-альбиноса (Surace et al., 2005), принимая во внимание отчетливо выраженную чувствительность ее фоторецепторов к свету. Используемый протокол экспериментов модифицировали (Rex et al., 2003) и расширяли из протокола, который был исходно предложен группой LaVail (LaVail et al., 1987).
Использовали следующие препараты на основе BDNF:
a) BDNF в 0,25% растворе TSP (10 мкл раствора, содержащего 150 мкг BDNF).
b) BDNF в физиологическом растворе (0,9% NaCl - 10 мкл раствора, содержащего 150 мкг BDNF).
c) BDNF в 0,2% растворе натрийкарбоксиметилцеллюлозы (10 мкл раствора, содержащего 150 мкг BDNF).
Глаза крыс обрабатывали перечисленными выше препаратами, и крыс подвергали световому повреждению. Контрольные глаза обрабатывали только раствором носителя. N=4 глаза обрабатывали в каждой исследуемой группе. В частности, спустя 6 часов после обработки (глаза, обработанного BDNF и контрольного глаза, обработанного только раствором носителя), крыс подвергали длительному воздействию светом в течение 48 часов (животная модель светового повреждения, интенсивность источника света 1000 лк).
Такое длительное воздействие света вызывает дегенерацию многих из фоторецепторов в сетчатке крыс-альбиносов. Нейропротекцию, проявляемую BDNF, верифицировали морфологическими методами, созданными для оценки выживаемости фоторецепторов, и функциональными методами, путем регистрации реакции сетчатки на световой раздражитель (импульсной электроретинограммы [ERG], которую широко используют для оценки функционального состояния внешней сетчатки у пациентов, страдающих от нарушений в сетчатке глаза). С точки зрения малого числа углов у крысы, формирующих основу ERG ответа в условиях световой адаптации, и пониженной амплитуды ERG в условиях световой адаптации крыс-альбиносов, регистрировали только импульсную ERG в условиях адаптации в темноте, отображая реакцию палочек, из которых, главным образом, и состоит сетчатка крысы. Импульсную ERG (темновую) регистрировали через 7 дней после окончания периода светового повреждения.
Препарат a)
На фиг.6 показана амплитуда b-волны на импульсной ERG согласно освещенности в условиях адаптации в темноте. Как ясно показано на графике фиг.6, BDNF в TSP, нанесенный местно, значительно снижает эффекты светового повреждения на реакцию сетчатки на световые импульсы (импульсная ERG). Фактически, амплитуды (усредненные значения амплитуд, выраженные в мкВ) глаза, обработанного BDNF, оказывались существенно больше, чем амплитуды для контрольного глаза, *, p<0,05 (однофакторный дисперсионный анализ, one-way ANOVA).
Препарат b)
На фиг.8 показаны амплитуды b-волны на импульсной ERG согласно освещенности в условиях адаптации в темноте. Результаты показывают, что BDNF в физиологическом растворе, также способен снижать изменения реакции сетчатки на свет, вызванные световым повреждением (импульсная ERG). Амплитуды b-волны в поврежденных светом глазах крыс, обработанных BDNF, были больше, чем амплитуды, зарегистрированные для контрольного глаза; амплитуды (усредненные значения амплитуд, выраженные в мкВ) глаза, обработанного BDNF в физиологическом растворе, оказывались существенно больше, чем амплитуды для контрольного глаза, *, p<0,05 (Однофакторный дисперсионный анализ one-way ANOVA).
Препарат c)
На фиг.10 показаны амплитуды b-волны на импульсной ERG согласно освещенности в условиях адаптации в темноте. На фигуре показано, что амплитуды (усредненные значения амплитуд, выраженные в мкВ) глаза, обработанного BDNF в растворе натрийкарбоксиметилцеллюлозы, оказывались только незначительно больше, чем амплитуды для контрольного глаза, *, p<0,05 (однофакторный дисперсионный анализ one-way ANOVA) при наивысших значениях освещенности. В заключение, в терминах восстановления функции реакции сетчатки на свет, натрийкарбоксиметилцеллюлоза признана менее эффективной, чем TSP и физиологический раствор в предотвращении ухудшения реакции сетчатки на свет.
Далее оценивали эффекты местной обработки указанными выше препаратами на основа BDNF на дегенерацию фоторецепторов сетчатки в сетчатках глаз, для которых регистрировали импульсную ERG.
Эффекты местной обработки BDNF на дегенерацию фоторецепторов оценивали количественно путем подсчета палочковых клеточных тел фоторецепторов, которые выжили после светового повреждения, и измерения толщины наружного зернистого слоя сетчатки (ONL), который содержит тела клеток фоторецепторов. Для проведения этих измерений ядра фоторецепторов метили пропидиййодидом.
Препарат a)
Полученные результаты представлены на фиг.7. На фиг.7A показано поперечное сечение сетчатки глаза, обработанного BDNF (в 0,25% TSP), и контрольного глаза. Для проведения этих измерений ядра фоторецепторов метили пропидиййодидом. Безотносительно от используемого метода (подсчет палочковых клеточных тел фоторецепторов (фиг.7B) или измерения толщины наружного зернистого слоя сетчатки (ONL) (фиг.7C)), фоторецепторы, присутствующие в центральной и периферической зонах сетчатки, оказывались существенно (критерий Стьюдента*, p<0,001) более многочисленными в глазу, обработанном BDNF, чем в глазу, обработанном носителем (в контроле).
Кроме того, было показано, что BDNF в TSP, если его вводили местно в конъюнктивальный мешок, защищал сетчатку от светового повреждения.
Препарат b)
На фиг.9(A) показано поперечное сечение сетчатки правого глаза, обработанного BDNF (в физиологическом растворе, 0,9% NaCl) и левого (контрольного) глаза, обработанного только физиологическим раствором. Эффекты местной обработки BDNF на дегенерацию фоторецепторов оценивали количественно путем подсчета палочковых клеточных тел фоторецепторов, которые выжили после светового повреждения (фиг.9B), или, измеряя толщину наружного зернистого слоя сетчатки (ONL), который содержит тела клеток фоторецепторов (фиг.9C). Различия между сетчатками обработанного глаза и контрольного глаза (подсчет палочковых фоторецепторов или толщина ONL) оказывались статистически достоверными как для центральной, так и для периферической зоны сетчатки (критерий Стьюдента *, p<0.001).
Местная обработка BDNF в физиологическом растворе увеличивала число фоторецепторов, выживших при световом повреждении в глазу, по сравнению с контрольным глазом.
Препарат c)
Наконец, количественно оценивали эффекты местной обработки BDNF (в растворе с натрийкарбоксиметилцеллюлозой) на дегенерацию фоторецепторов путем измерения палочковых клеточных тел фоторецепторов, которые выжили после светового повреждения (фиг.11B), и толщины наружного зернистого слоя сетчатки (ONL), который содержит тела клеток фоторецепторов (фиг.11C).
Анализируя полученные результаты в условиях восстановления функции и предотвращения дегенерации фоторецепторов после светового повреждения, можно заключить, что местная обработка BDNF в TSP и в физиологическом растворе осуществляет нейропротекторное действие против светового повреждения, в то время как обработка BDNF в растворе с натрийкарбоксиметилцеллюлозой является менее эффективной при тех же концентрациях BDNF.
Также было показано, что обработка BDNF не вызывает функциональных изменений в сетчатке, ослабляющих ее реакцию на зрительные раздражители.
Пример 2.4 - Нейропротекторный эффект, вызванный повторным местным введением BDNF на экспериментальной модели глаукомы
Глаукома представляет собой дегенеративное нарушение сетчатки, которое имеет различные причины и представлено различными формами (ее классифицируют по возрастному признаку, как врожденную глаукому, инфантильную глаукому, юношескую глаукому и глаукому взрослых; и, в зависимости от этиопатогенеза, на первичную глаукому: первичную открытоугольную глаукому и первичную закрытоугольную глаукому; и вторичную глаукому, вызванную другими нарушениями, включая ятрогенную глаукому). Самая распространенная форма глаукомы, а именно, первичная открытоугольная глаукома (POAG), характеризуется повышением внутриглазного давления, которое вызывает дисфункцию и последующую дегенерацию ганглионарных клеток, связанную с атрофией зрительного нерва; симптомами является постепенное снижение зрения, завершающееся слепотой. Механизм, вызывающий дисфункцию и дегенерацию ганглионарных клеток с атрофией зрительного нерва, все еще полностью не выяснен, хотя общепринятая гипотеза заключается в том, что повышенное внутриглазное давление (IOP) вызывает механическое повреждение волокон зрительного нерва в решетчатой пластинке глаза и ишемическое изменение диска зрительного нерва и внутренней сетчатки. В последние годы фармакологическое лечение нацеливали на снижение IOP, хотя значительное число пациентов оказывалось резистентными к общепринятому фармакологическому лечению и страдало прогрессирующей, необратимой потерей зрительной функции. В настоящее время не существует лекарственных средств, созданных для того, чтобы обеспечить нейропротекцию ганглионарных клеток сетчатки и волокон оптического нерва, для того чтобы предотвратить снижение зрительной способности и восстановить нормальное зрение. Авторы настоящего изобретения предлагают применение местных обработок BDNF в конъюнктивальный мешок, для того чтобы стабильно повысить уровни BDNF в сетчатке, так чтобы противодействовать прогрессирующей дисфункции ганглионарных клеток, сопровождающейся их дегенерацией и гибелью. Это предложение частично основано на демонстрации того, что рецептор BDNF, называемый TrkB, экспрессируется в ганглионарные клетки (Jelsma et al., 1993). Для проверки своей гипотезы авторы использовали наиболее распространенную экспериментальную модель спонтанной глаукомы, мутантную мышь с двумя мутациями, называемую DBA/2J (John et al., 1998; Chang et al., 1999). DBA/2J мышь содержала гомозиготные мутации двух разных генов; первая представляла собой трипсин-связанный белок (Tyrpl-/-), кодируемый для меланопротеина, и вторая представляла собой мембранный гликопротеин (Gpnmb-/-). Эта мышь характеризовалась прогрессирующим повышением внутриглазного давления с прогрессирующей потерей реакции сетчатки на структурированные зрительные раздражители, которые зависели от внутренней сетчатки/ганглионарных клеток; у человека и животной модели эту реакцию сетчатки называют ритмической электроретинограммой (P-ERG; Domenici et al., 1991; Ventura and Porciatti, 2006; Falsini et al., 2008). Дисфункция ганглионарных клеток сопровождается дегенерацией указанных выше клеток с прогрессирующей атрофией волокон зрительного нерва (Ventura et al., 2006). Как показано на фиг.12, на данной мышиной модели глаукомы (DBA/2J), IOP начинает повышаться после 5 месяцев постнатального периода жизни: в 6½ месяцев IOP у DBA/2J мыши (N=10) уже становится существенно выше (критерий Стьюдента;* p<0,05), чем давление, измеренное у нормальной мыши (C57bl/6J;N=5) и у DBA/2J мыши в возрасте 5 месяцев (N=9). График на фиг.13 показывает амплитуды реакции внутренней сетчатки/ганглионарных клеток (P-ERG) на структурированный зрительный раздражитель (зрительные ритмы, используемые для стимуляции, представляли собой профили освещенности с пространственной частотой 0,2 C/град. и контрастом 90%), регистрируемые электродами, контактирующими с роговицей, подсоединенными к усилителю и компьютеру для анализа в режиме реального времени. Как показано на фиг.13, P-ERG уже изменилась у DBA/2J мыши (CTRL, N=4) в возрасте 7 месяцев (значительное понижение P-ERG амплитуд; критерий Стьюдента, * p<0,05). Начиная с возраста 6,5 месяцев, то есть, с момента времени, когда IOP стабильно увеличивается (фиг.12), проводили двухнедельную обработку, включающую повторные местные введения BDNF в TSP (одна обработка каждые 48 часов) на один глаз, и носитель на другой (контрольный глаз). Применяли три различные концентрации BDNF (N=4 DBA/2J мыши на группу): 1, 5 и 15 мкг/мкл. Как показано на гистограмме, местная обработка BDNF в концентрации 15 мкг/мкл (150 мкг в 10 мкл раствора, содержащего 0,25% TSP, офтальмологический препарат a), но не в концентрациях 1 и 5 мкг/мкл, предотвращала P-ERG изменения у DBA/2J мыши (сравнительные данные обработанного глаза с контрольным глазом; критерий Стьюдента, * p<0,05). Для того чтобы установить, соответствуют ли изменения P-ERG изменениям в ганглионарных клетках, меченных иммуногистохимическими методами, авторы использовали фактор транскрипции, Brn3b, экспрессируемый ганглионарными клетками; мутантные по этому фактору мыши (BrnSb -/-) связаны с изменением ганглионарных клеток (Badea et al., 2009). На фиг.14 A показано увеличение числа препаратов сетчатки, в которых ганглионарные клетки мечены зеленым флуоресцентным антителом и анализированы методом конфокальной микроскопии. Число меченых ганглионарных клеток явно меньше в глазу DBA/2J мыши, как в центральной, так и в периферической зонах сетчатки. На фиг.14B представлено количественное выражение меченых клеток в терминах плотности (число клеток/на мм2). Двухнедельная обработка BDNF в TSP в концентрации 15 мкг/мкл предотвратила уменьшение клеток, меченных Brn3b, по сравнению с контрольным глазом, обработанным только носителем (критерий Стьюдента, * p<0,05).
Представленные данные приводят к заключению, что повторная местная обработка BDNF предотвращает функциональные изменения ганглионарных клеток и восстанавливает зрительную способность на экспериментальной модели глаукомы. Минимальная эффективная концентрация BDNF, способная проявлять защитные эффекты на функцию ганглионарных клеток, составляет 15 мкг/мкл.
Библиография
Badea TC, Cahill H, Ecker J, Hattar S, Nathans J. Distinct roles of transcription factors brn3a and brn3b in controlling the development, morphology, and function of retinal ganglion cells. Neuron. 2009 Mar 26;61(6):852-64.
Bennett JL, Zeiler SR & Jones KR (1999) Patterned expression of BDNF and NT-3 in the retina and anterior segment of the developing mammalian eye. Invest Ophthalmol Vis Sci 40, 2996-3005.
Burgalassi S, Raimondi L, Pirisino R, Banchelli G, Boldrini E, Saettone MF. Effect of xyloglucan (tamarind seed polysaccharide) on conjunctival cell adhesion to laminin and on corneal epithelium wound healing. Eur J Ophthalmol. 2000 Jan-Mar; 10(1):71-6.
Calamusa M, Pattabiraman PP, Pozdeyev N, Iuvone PM, Cellerino A, Domenici L (2007) Specific alterations of tyrosine hydroxylase immunopositive cells in the retina of NT-4 knock out mice. Vision Res. 47, 1523-1536.
Caleo M, Medini P, von Bartheld CS, Maffei L (2003) Provision of Brain-Derived Neurotrophic Factor via Anterograde Transport from the Eye Preserves the Physiological Responses of Axotomized Geniculate Neurons. J Neurosci 23, 287-296.
Cellerino A, Carroll P, Thoenen H & Barde YA. (1997) Reduced size of retinal ganglion cell axons and hypomyelination in mice lacking brain-derived neurotrophic factor. Mol Cell Neurosci 9, 397-408.
Cellerino A & Kohler K (1997) Brain-derived neurotrophic factor/neurotrophin-4 receptor TrkB is localized on ganglion cells and dopaminergic amacrine cells in the vertebrate retina. J Comp Neurol 386, 149-160.
Chang B, Smith RS, Hawes NL, Anderson MG, Zabaleta A, Savinova O, Roderick TH, Heckenlively JR, Davisson MT, John SW. Interacting loci cause severe iris atrophy and glaucoma in DBA/2 J mice. Nat Genet. 1999 Apr; 21(4):405-9.
Chytrova G & Johnson JE (2004) Spontaneous retinal activity modulates BDNF trafficking in the developing chick visual system. Mol Cell Neurosci 25, 549-57.
Di Polo A, Cheng L, Bray GM & Aguayo AJ (2000) Colocalization of TrkB and brain-derived neurotrophic factor proteins in green-red-sensitive cone outer segments. Invest Ophthalmol Vis Sci 41, 4014-21.
Domenici L, Gravina A, Berardi N, Maffei L. Different effects of intracranial and intraorbital section of the optic nerve on the functional responses of rat retinal ganglion cells. Exp Brain Res. 1991; 86(3):579-84.
Falsini B, Marangoni D, Salgarello T, Stifano G, Montrone L, Campagna F, Aliberti S, Balestrazzi E, Colotto A. Structure-function relationship in ocular hypertension and glaucoma: interindividual and interocular analysis by OCT and pattern ERG. Graefes Arch Clin Exp Ophthalmol. 2008 Aug; 246(8): 1153-62.
Garcia M, Forster V, Hicks D, Vecino E. (2003) In vivo expression of neurotrophins and neurotrophin receptors is conserved in adult porcine retina in vitro. Investigative Ophthalmology and Visual Science 44, 4532-454155.
Ghelardi E, Tavanti A, Davini P, Celandroni F, Salvetti S, Parisio E, Boldrini E, Senesi S, Campa M. A mucoadhesive polymer extracted from tamarind seed improves the intraocular penetration and efficacy of rufloxacin in topical treatment of experimental bacterial keratitis. Antimicrob Agents Chemother. 2004 Sep; 48(9):3396-401.
Ghelardi E, Tavanti A, Celandroni F, Lupetti A, Blandizzi C, Boldrini E, Campa M, Senesi S. Effect of a novel mucoadhesive polysaccharide obtained from tamarind seeds on the intraocular penetration of gentamicin and ofloxacin in rabbits. J Antimicrob Chemother. 2000 Nov; 46(5):831-4.
Hallbook F, Backstrom A, Kullander K, Ebendal T & Carri NG. (1996) Expression of neurotrophins and trk receptors in the avian retina. J Comp Neurol 364, 664-76.
Harada T, Harada C, Kohsaka S Wada E, Yoshida k, Ohno S, Mamada H, Tanaka K, Parada LF Wada K (2002) Microglia-Miiller glia cell interactions control neurotrophic factor production during light-induced retinal degeneration. J. Neurosci 22, 9228-9236.
Herzog KH, Bailey K & Barde YA. (1994) Expression of the BDNF gene in the developing visual system of the chick. Development 120, 1643-9.
Herzog KH & von Bartheld CS (1998) Contributions of the optic tectum and the retina as sources of brain-derived neurotrophic factor for retinal ganglion cells in the chick embryo. J Neurosci 18, 2891-906.
Jelsma TN, Friedman HH, Berkelaar M, Bray GM & Aguayo AJ. (1993) Different forms of the neurotrophin receptor trkB mRNA predominate in rat retina and optic nerve. J Neurobiol 24, 1207-14.
John SW, Smith RS, Savinova OV, Hawes NL, Chang B, Turnbull D, Davisson M, Roderick TH, Heckenlively JR. Essential iris atrophy, pigment dispersion, and glaucoma in DBA/2J mice. Invest Ophthalmol Vis Sci. 1998 May; 39(6):951-62.
Karlsson M & Hallbook F. (1998) Kainic acid, tetrodotoxin and light modulate expression of brain-derived neurotrophic factor in developing avian retinal ganglion cells and their tectal target. Neuroscience 83, 137-50.
Lambiase A, Tirassa P, Micera A, Aloe L, Bonini S. (2005) Pharmacokinetics of conjunctivally applied nerve growth factor in the retina and optic nerve of adult rats. Invest Ophthalmol Vis Sci 46, 3800-6.
LaVail, M.M., Gorrin, G.M., Repaci, M.A., Thomas, L.A., and Ginsberg, H.M. (1987) Genetic regulation of light damage to photoreceptors. Invest. Ophthalmol. Visual Sci 28, 1043-1048.
Levi-Montalcini R. (1987) The nerve growth factor 35 years later. Science 237, 1154-1162.
McGill TG, Prusky GT, Douglas RM, Yasumura D, Matthes MT, Nune G, Donohue-Rolfe K, Yang H, Niculescu D, Hauswirth WW, Girman SV, Lund RD, Duncan JL, LaVail MM (2007) Intraocular CNTF Reduces Vision in Normal Rats in a Dose-Dependent Manner. IOVS 48, 5756-5765.
Perez MT & Caminos E (1995) Expression of brain-derived neurotrophic factor and of its functional receptor in neonatal and adult rat retina. Neurosci Lett 183, 96-99.
Pollock GS & Frost DO (2003) Complexity in the modulation of neurotrophic factor mRNA expression by early visual experience. Brain Res Dev Brain Res 143, 225-32.
Pollock GS, Robichon R, Boyd KA, Kerkel KA, Kramer M, Lyles J, Ambalavanar R, Khan A, Kaplan DR, Williams RW & Frost DO. (2003) TrkB receptor signalling regulates developmental death dynamics, but not final number, of retinal ganglion cells. J Neurosci 23, 10137-45.
Reichardt LF (2006) Neurotrophin-regulated signalling pathways. Phil Trans Royal Soc B 361, 1471-1492.
Rex T. S., Allocca M., Domenici L., Surace E. M., Maguire A. M., Lyubarsky A., Cellerino A., Auricchio A. (2004) Systemic but not intraocular Epo gene transfer protects the retina from light- and genetic-induced degeneration. Mol Ther 10, 855.
Rohrer B, Korenbrot JI, LaVail MM, Reichardt LF & Xu B (1999) Role of neurotrophin receptor TrkB in the maturation of rod photoreceptors and establishment of synaptic transmission to the inner retina. J Neurosci 19, 8919-8930.
Seki M, Nawa H, Fukuchi T, Abe H & Takei N (2003) BDNF is upregulated by postnatal development and visual experience: quantitative and immunohistochemical analyses of BDNF in the rat retina. Invest Ophthalmol Vis Sci 44, 3211-3218.
Shi Z-H, Birman E, Saragovi HU (2007) Neurotrophic rationale in glaucoma: A TrkA agonist, but not NGF or a p75 antagonist, protects retinal ganglion cells in vivo. Dev Neurobiol 67, 884-94.
Surace E.M., Domenici L., Cortese K., Cotugno G., Di Vicino U., Venturi C, Cellerino A., Marigo V., Tacchetti, C. Ballabio A., Auricchio A. (2005). Rescue of functional and morphological abnormalities in the retina of the type I ocular albinism mouse model following adeno-associated viral mediated gene transfer. Mol Ther 12, 652-658.
Uccello-Barretta G, Nazzi S, Balzano F, Di Colo G, Zambito Y, Zaino C, Sanso M, Salvadori E, Benvenuti M. Enhanced affinity of ketotifen toward tamarind seed polysaccharide in comparison with hydroxyethylcellulose and hyaluronic acid: a nuclear magnetic resonance investigation. Bioorg Med Chem. 2008 Aug 1; 16(15):7371-6.
Ventura LM, Porciatti V. Pattern electroretinogram in glaucoma. Curr Opin Ophthalmol. 2006 Apr; 17(2): 196-202.
Watanabe W, Tokita Y, Kato M, Fukuda Y (2003) Intravitreal injections of neurotrophic factors and forskolin enhance survival and axonal regeneration of axotomized ganglion cells in cat retina Neuroscience 116, 733-742.
Yata T, Nakamura Ma Sagawa H, Tokita Y, H. Terasaki H, Watanabe M (2007) Survival and axonal regeneration of OFF-center retinal ganglion cells of adult cats are promoted with an anti-glaucoma drug, Nipradolol, but not BDNF and CNTF. Neuroscience 148, 53-64.






Группа изобретений относится к медицине, а именно к офтальмологии, и предназначена для предотвращения и/или лечения нейродегенеративных заболеваний сетчатки глаза, зрительного нерва и латерального коленчатого тела. Обеспечивается офтальмологический препарат в форме глазных капель, содержащий нейротрофический фактор головного мозга (BDNF) в концентрации по меньшей мере 15 мкг/мкл. Использование группы изобретений повышает эффективность лечения и/или предотвращения нейродегенеративных заболеваний сетчатки глаза, зрительного нерва и латерального коленчатого тела. 2 н. и 10 з.п. ф-лы, 14 ил., 4 пр.
1. Офтальмологический препарат в форме глазных капель, содержащий нейротрофический фактор головного мозга (BDNF) в концентрации по меньшей мере 15 мкг/мкл.
2. Офтальмологический препарат по п.1, в котором концентрация BDNF составляет от 15 до 200 мкг/мкл.
3. Офтальмологический препарат по п.1 или 2, дополнительно содержащий физиологический раствор в качестве фармацевтически приемлемого носителя.
4. Офтальмологический препарат по п.1, в котором физиологический раствор содержит 0,9% хлорида натрия.
5. Офтальмологический препарат по п.1, дополнительно содержащий раствор с повышенной вязкостью в качестве дополнительного фармацевтически приемлемого носителя.
6. Офтальмологический препарат по п.1, в котором раствор с повышенной вязкостью представляет собой раствор, содержащий полисахарид, экстрагированный из семян индийского финика (TSP).
7. Офтальмологический препарат по п.1, в котором TSP концентрация составляет от 0,05 до 2% мас./об.
8. Офтальмологический препарат по п.1, дополнительно содержащий гиалуроновую кислоту.
9. Офтальмологический препарат по п.1, в котором раствор с повышенной вязкостью содержит TSP и гиалуроновую кислоту.
10. Офтальмологический препарат в форме глазных капель, содержащий BDNF в концентрации по меньшей мере 15 мкг/мкл, предназначенный для предотвращения и/или лечения нейродегенеративных заболеваний сетчатки глаза, зрительного нерва и латерального коленчатого тела.
11. Офтальмологический препарат по п.10, предназначенный для предотвращения и/или лечения пигментной дистрофии сетчатки.
12. Офтальмологический препарат по п.10, предназначенный для предотвращения и/или лечения хронической простой глаукомы.
| Теплообменник | 1980 |
|
SU958831A1 |
| WO 2009044423 A1, 09.04.2009 | |||
| JP 2003048851 A, 21.02.2003 | |||
| SACCHETTI M et al | |||
| Nerve Growth Factor Eye Drops Cross the Ocular"Blood Barrier Reaching the Retina and Optic Nerve in the Rat | |||
| Invest Ophthalmol Vis Sci, 2005, 46: E-Abstract 3955, найдено в Интернет, найдено 05.11.2014, http://abstracts.iovs.org/cgi/content/short/46/5/3955 | |||
Авторы
Даты
2015-10-10—Публикация
2010-11-12—Подача