Изобретение относится к биоорганической и медицинской химии, а именно к применению 5-замещенных 3-(3-пиридил)изоксазолов и их 4,5-дигидропроизводных в качестве средств, обладающих антиагрегационной активностью, что может быть использовано в клинических медицинских исследованиях и для дальнейшей разработки новых антиагрегационных средств.
Известны структурные аналоги заявляемых соединений, относящихся к классу 3,5-замещенных изоксазолов: 3-(пирид-3-ил)-5-фенилизоксазол [О.В. Демина, С.Д. Варфоломеев, П.В. Вржещ, А.В. Татаринцев. Антиагрегационные средства // Патент РФ №2088229, приоритет 26.05.1993, зарегистрирован 27.08.1997, БИ №24], 5-гидроксиметил-3-(пирид-2-ил)изоксазол и 5-гидроксиметил-3-(пирид-3-ил)изоксазол [Демина О.В., Вржещ П.В., Ходонов А.А., Козловский В.И., Варфоломеев С.Д. Синтез новых ингибиторов агрегации тромбоцитов - замещенных пиридилизоксазолов и их 4,5-дигидроаналогов // Биоорг. химия, 1995, 21(12), 933-940], синтезированные и протестированные нами ранее, причем два последних соединения менее активны, чем 3-(пирид-3-ил)-5-фенилизоксазол. Нами было установлено, что 3,5-замещенные изоксазолы, имеющие в С3-положении изоксазольного кольца 2-, 3- или 4-пиридиновый фрагмент, обладают антиагрегационной активностью [Демина О.В., Вржещ П.В., Ходонов А.А., Козловский В.И., Варфоломеев С.Д. Синтез новых ингибиторов агрегации тромбоцитов - замещенных пиридилизоксазолов и их 4,5-дигидроаналогов // Биоорг. химия, 1995, 21 (12), 933-940; Патент РФ №2088229 (прототип)]. Нами впервые были исследованы кинетические закономерности процесса агрегации тромбоцитов человека in vitro под действием ряда соединений этого класса, и было выявлено, что протестированные соединения обладают наибольшей антиагрегационной активностью при наличии 3-пиридинового фрагмента в С3-положении изоксазольного кольца. При поиске наиболее активных соединений этого класса нами были получены аналоги с различными заместителями по С5-положению 3-(пирид-3-ил)изоксазола или его 4,5-дигидропроизводного.
Так, синтезы 5-гексил-3-(пирид-3-ил)-4,5-дигидроизоксазола, 5-пентил- и 5-гексил-3-(пирид-3-ил)изоксазолов были выполнены нами ранее и описаны в статьях [Демина О.В., Вржещ П.В., Ходонов А.А., Козловский В.И., Варфоломеев С.Д. Синтез новых ингибиторов агрегации тромбоцитов - замещенных пиридилизоксазолов и их 4,5-дигидроаналогов // Биоорг. химия, 1995, 21 (12), 933-940; О.В. Демина, А.В. Лаптев, А.Ю. Лукин, Н.Е. Беликов, К.В. Звездин, М.А. Фомин, А.А. Ходонов, С.Д. Варфоломеев, В.И. Швец. Синтез новых 3,5-замещенных производных изоксазола, обладающих потенциальной антиагрегационной активностью // Вестник МИТХТ, 2010, 5(6), 47-51]. Биологическая активность 5-гексил-3-(пирид-3-ил)-4,5-дигидроизоксазола и 5-гексил-3-(пирид-3-ил)изоксазола была исследована и кратко указана в статье [Вестник МИТХТ, 2010, 5(6), 47-51].
Технический результат заявленного изобретения заключается в расширении арсенала средств, обладающих антиагрегационной активностью.
Технический результат достигается синтезом заявляемых соединений общей формулы:
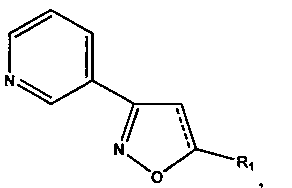
где для 5-алкил-3-(пирид-3-ил)изоксазолов (1-7) R1=СН3, С3Н7, С4Н9, C7H15, C8H17, а для их 4,5-дигидропроизводных (8-12) R1=СН3, С8Н17, С16Н33, проявляющих антиагрегационную активность.
Для синтеза набора заявляемых соединений был использован модифицированный нами подход с применением реакции [3+2]циклоприсоединения нитрилоксидов к терминальным алкинам или алкенам, позволяющий получать соединения с высокой региоселективностью и хорошими выходами [О.В. Демина, А.В. Лаптев, А.Ю. Лукин, Н.Е. Беликов, К.В. Звездин, М.А. Фомин, А.А. Ходонов, С.Д. Варфоломеев, В.И. Швец. Синтез новых 3,5-замещенных производных изоксазола, обладающих потенциальной антиагрегационной активностью // Вестник МИТХТ, 2010, 5(6), 47-51] (см. схему 1).
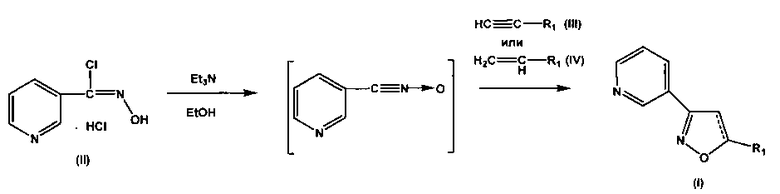
Схема 1. Реагенты: гидрохлорид хлорангидрида пиридин-3-гидроксимовой кислоты (II), триэтиламин, этанол, терминальные алкин или алкен, 0÷5°C, затем 20-25°C, 48 ч.
В качестве исходных веществ были взяты гидрохлорид хлорангидрида пиридин-3-гидроксимовой кислоты и терминальные алкины или алкены в соотношениях хлорангидрид: непредельное соединение 1:3÷5. Реакцию проводили в интервале температур -5÷5°C и медленном добавлении раствора триэтиламина в этаноле (30-60 мин) при интенсивном перемешивании, с последующей выдержкой реакционной смеси в течение 24-48 ч. Структуры полученных веществ были подтверждены современными методами физико-химического анализа: 1Н- и 13С-ЯМР спектроскопией и масс-спектрометрией, а также элементным анализом. Для всех синтезированных соединений выходы, температуры плавления, данные 1Н-ЯМР-спектров и масс-спектров приведены в таблице 1.
Синтезированные соединения были протестированы на антиагрегационную активность с помощью турбидиметрического метода на лазерном агрегометре «Биола» (Россия) в образцах суспензий отмытых тромбоцитов человека и плазмы крови человека, обогащенной тромбоцитами, с использованием арахидоновой кислоты в качестве индуктора агрегации. Активность данных соединений сравнивалась с активностью соединения - 3-(пирид-3-ил)-5-фенилизоксазола на одном и том же образце плазмы крови или суспензии тромбоцитов.
Все заявляемые соединения обладают антиагрегационной активностью в фармакологически приемлемом диапазоне концентраций 10-6÷10-4 М, что сопоставимо с активностью контрольного соединения, таким образом, расширяя количество перспективных кандидатов для создания новых антиагрегационньгх средств (см. табл. 2). Следовательно, заявляемое техническое решение соответствует критерию «положительный эффект».
Изобретение иллюстрируется следующими примерами.
Пример 1
Исходный хлорангидрид пиридин-3-гидроксимовой кислоты (II) получали следующим образом. К раствору 6.32 г (0.052 моль) коммерчески доступного 3-пиридинальдоксима в 150 мл свежеперегнанного дихлорметана при перемешивании и -15°-10°C пропускали сильный ток сухого хлора в течение 3 ч до появления устойчивой желто-зеленой окраски реакционной массы с выпадением осадка гидрохлорида 3-пиридилгидроксимоилхлорида (II). Затем реакционную массу разбавляли 250 мл сухого эфира и осадок отделяли на фильтре, промывали сухим диэтиловым эфиром 3 раза по 100 мл, сушили при 0.01 мм рт. ст. Выход: 9.5 г (49.0 ммоль, 95%), т.пл. 192°-193°C. 1Н-ЯМР спектр (δ, м.д.; ДМСО-d6): 7.98 (1Н; дд; J=8.2 Гц, J=5.0 Гц; 5-Н(пиридил)); 8.70 (1H; ддд; J=8.2 Гц, J=2.0 Гц, J=1.2 Гц; 4-Н(пиридил)); 8.94 (1H; дд; J=5.0 Гц, J=1.2 Гц; 6-Н(пиридил)); 9.10 (1Н; д; J=2.0 Гц; 2-Н (пиридил)); 9.64 (1H; сш; N-H); 13.26 (1H; сш;=N-OH).
Найдено %: С 36.95; Н 2.98; N 13.72; Cl 35.87. C6H6N2Cl2O. Вычислено %: С 37.33; Н 3.13; N 14.51; Cl 36.73.
Пример 2
Общая методика получения 5-алкил-3-(пирид-3-ил)изоксазолов или 5-алкил-3-(пирид-3-ил)-4,5-дигидроизоксазолов (I)
К перемешиваемому раствору 1.56 г (8.0 ммоль) гидрохлорида 3-пиридилгидроксимоилхлорида (II) и 24.0 ммоль терминального алкина (III) или алкена (IV) в 80 мл безводного этанола по каплям при 0°÷5°C прибавляли раствор 1.62 г (16.0 ммоль) триэтиламина в 30 мл этанола. Мониторинг реакции проводили при помощи ТСХ. Реакционную массу выдерживали 24-48 ч при 20°C, затем растворитель удаляли в вакууме. Полученный остаток суспендировали в 50 мл эфира, выпавший осадок гидрохлорида триэтиламина отделяли фильтрованием и промывали 3 раза по 10 мл эфира. Растворитель из объединенных фильтратов удаляли при пониженном давлении, полученный остаток разделяли при помощи колоночной хроматографии с использованием в качестве элюента системы хлористый метилен - этанол с градиентом этанола от 0 до 4% с получением нескольких фракций, содержащих продукт с небольшой долей примесей. Индивидуальный продукт получали очисткой фракций при помощи ВЭЖХ на хроматографе SmartLine 1000 (Knauer, Германия) (колонка Eurospher 100-10Si 20×250 мм (Knauer), скорость потока - 7 мл/мин, при длине волны детектирования 254 нм, элюент - 2% EtOH в CH2Cl2). Выходы, температуры плавления и данные физико-химического анализа даны в таблице 1.
Пример 3
3-(Пирид-3-ил)-5-пропил-изоксазол
К перемешиваемому раствору 1.50 г (7.8 ммоль) гидрохлорида 3-пиридилгидроксимоилхлорида и 1.59 г (23.4 ммоль) 1-пентина в 80 мл этанола по каплям при 0°÷5°C прибавляли раствор 1.58 г (15.6 ммоль) триэтиламина в 20 мл сухого этанола. Мониторинг реакции проводили при помощи ТСХ. Реакционную массу выдерживали 48 ч при 20°C, затем растворитель удаляли в вакууме. Полученный остаток суспендировали в 40 мл сухого эфира, выпавший осадок гидрохлорида триэтиламина отделяли фильтрованием, промыли 3 раза по 10 мл сухого эфира. Эфир из объединенного фильтрата удаляли при пониженном давлении, полученный остаток разделяли при помощи колоночной хроматографии с использованием в качестве элюента системы хлористый метилен - этанол с градиентом этанола от 0 до 4% с получением нескольких фракций, содержащих продукт и примеси. Индивидуальный продукт получали очисткой при помощи ВЭЖХ на хроматографе SmartLine 1000 (Knauer, Германия) (колонка Eurospher 100-10Si 20×250 мм (Knauer), скорость потока - 7 мл/мин, при длине волны детектирования 254 нм, элюент - 2% EtOH в CH2Cl2).
Пример 4
5-Метил-3-(пирид-3-ил)-4,5-дигидроизоксазол
Индивидуальное соединение получали согласно общей методике, из 1.0 г (5.2 ммоль) гидрохлорида 3-пиридилгидроксимоилхлорида (II) и раствора 0.66 г (15.6 ммоль) 1-пропена в этаноле, при медленном прикапывании раствора 1.14 г (11.0 ммоль) триэтиламина в 10 мл этанола. Полученный продукт - 5-метил-3-(пирид-3-ил)-4,5-дигидроизоксазол.
Пример 5
5-Метил-3-(пирид-3-ил)изоксазол
Индивидуальное соединение получали по общей методике, из 1.0 г (5.2 ммоль) гидрохлорида 3-пиридилгидроксимоилхлорида (II) и раствора 0.62 г (15.6 ммоль) 1-пропина в этаноле, при медленном добавлении 1.14 г (11.0 ммоль) триэтиламина в 10 мл этанола.
Пример 6
5-Бутил-3-(пирид-3-ил)изоксазол
Индивидуальное соединение получали по общей методике, из 1.5 г (7.8 ммоль) гидрохлорида 3-пиридилгидроксимоилхлорида и 1.92 г (23.4 ммоль) 1-гексина.
Пример 7
5-Гептил-3-(пирид-3-ил)изоксазол
Индивидуальное соединение получали по общей методике, из 2.0 г (10.4 ммоль) гидрохлорида 3-пиридилгидроксимоилхлорида и 3.88 г (31.2 ммоль) 1-нонина.
Пример 8
5-Октил-3-(пирид-3-ил)изоксазол
Индивидуальное соединение получали по общей методике, из 2.0 г (10.4 моль) гидрохлорида 3-пиридилгидроксимоилхлорида и 4.31 г (31.2 ммоль) 1-децина.
Пример 9
5-Октил-3-(пирид-3-ил)-4,5-дигидроизоксазол
Индивидуальное соединение получали по общей методике, из 2.0 г (10.4 ммоль) гидрохлорида 3-пиридилгидроксимоилхлорида и 4.38 г (31.2 моль) 1-децена.
Пример 10
5-Гексадецил-3-(пирид-3-ил)-4,5-дигидроизоксазол
Индивидуальное соединение получали по общей методике, из 1.0 г (5.2 ммоль) гидрохлорида 3-пиридилгидроксимоилхлорида и 3.93 г (15.6 ммоль) 1-октадецена.

Пример 11. Методика тестирования соединений (1-10) на антиагрегационную активность in vitro по методике [О.В. Демина, А.В. Лаптев, А.Ю. Лукин, Н.Е. Беликов, М.А. Фомин, И.В. Грибкова, А.А. Ходонов, В.И. Швец, С.Д. Варфоломеев. Сравнение антиагрегационной активности 3-(3-пиридил)-5-фенилизоксазола и 3-(3-пиридил)-5-фенил-1,2,4-оксадиазола // Биол. мембраны, 2011, т. 28, №4. С. 243-253]. Влияние потенциальных антиагрегационных соединений на агрегацию тромбоцитов в образцах плазмы крови и суспензий отмытых тромбоцитов человека исследовали по ранее отработанной методике на агрегометре "Биола" (Россия). В качестве природного индуктора процесса агрегации тромбоцитов человека использовали арахидоновую кислоту в концентрациях 500 мкМ (для плазмы) и 300 мкМ (для суспензий). Обогащенную тромбоцитами плазму крови человека (PRP) получали из образцов свежезабранной крови у добровольцев-мужчин не старше 40 лет с использованием в качестве антикоагулянта 3,8%-ного раствора цитрата натрия (pH 7.4). Соотношение кровь:антикоагулянт составляло 9:1. Кровь центрифугировали при 200 g в течение 15 мин при комнатной температуре на центрифуге MLW K70D (Германия), затем отбирали обогащенную тромбоцитами плазму (PRP). Обедненную тромбоцитами плазму (РРР) получали путем дополнительного центрифугирования PRP при 1000g в течение 15 мин при комнатной температуре на центрифуге ОПн-8-У 4.2 (Россия). Исходную концентрацию тромбоцитов в PRP определяли на приборе АВХ - MICROS (Австрия), затем доводили до стандартной концентрации 200000 клеток/мкл, разбавляя РРР. Суспензию отмытых тромбоцитов получали по описанной методике, используя в качестве антикоагулянта 3,8%-ный цитрат натрия с pH 6.0 с добавлением простагландина E1 (1 мкМ/мл) и апиразы (0.1 ед./мл) и изменением плотности конечного буфера при подборе условий измерения агрегации тромбоцитов на агрегометре «Биола» [S. Roger, М. Pawlowski, A. Habib, М. Jandrot-Perrus et al. Costimulation of the Gi-coupled ADP receptor and the Gq-coupled TXA2 receptor is required for ERK2 activation in collagen-induced platelet aggregation // FEBS Letters, 2004, 556(1), p.227-235]. Кровь центрифугировали при комнатной температуре в течение 8 мин при 100g, затем, отобрав слой обогащенной тромбоцитами плазмы, добавляли к нему тот же 3,8%-ный раствор цитрата натрия (соотношение плазма: цитрат - 3:1). Тромбоциты осаждали в течение 5 мин при 400g при комнатной температуре, удаляли супернатант, затем тромбоциты суспендировали в 1.5-2 мл 3,8%-ного цитрата натрия (pH 5.5), повторно осаждали при 400g в течение 5 мин и после удаления супернатанта ресуспендировали в буфере А (20 мМ HEPES, 150 мМ NaCl, 2.7 мМ КСl, 1 мМ MgCl2, 0.4 мМ NaH2PO4, 5 мМ глюкозы, 0.5% бычьего сывороточного альбумина, pH 7.4). После измерения исходной концентрации тромбоцитов образец разбавляли буфером А до концентрации 200000 клеток/мкл.
Калибровку прибора проводили с использованием PRP и РРР или суспензии отмытых тромбоцитов и буфера А.
В кювету агрегометра добавляли 245 мкл PRP или суспензии отмытых тромбоцитов и потенциальный ингибитор, инкубировали ее при постоянном перемешивании (1000 об/мин) и 37°C в течение 2 мин, затем добавляли индуктор агрегации - арахидоновую кислоту (конечная концентрация арахидоновой кислоты в кювете составляла 500 мкМ для PRP и 300 мкМ - для отмытых тромбоцитов). Измерения проводили в течение 10 мин после добавления индуктора агрегации при использовании PRP, или в течение 3-6 мин - при использовании суспензии отмытых тромбоцитов. Общий объем содержимого кюветы составлял 250 мкл.
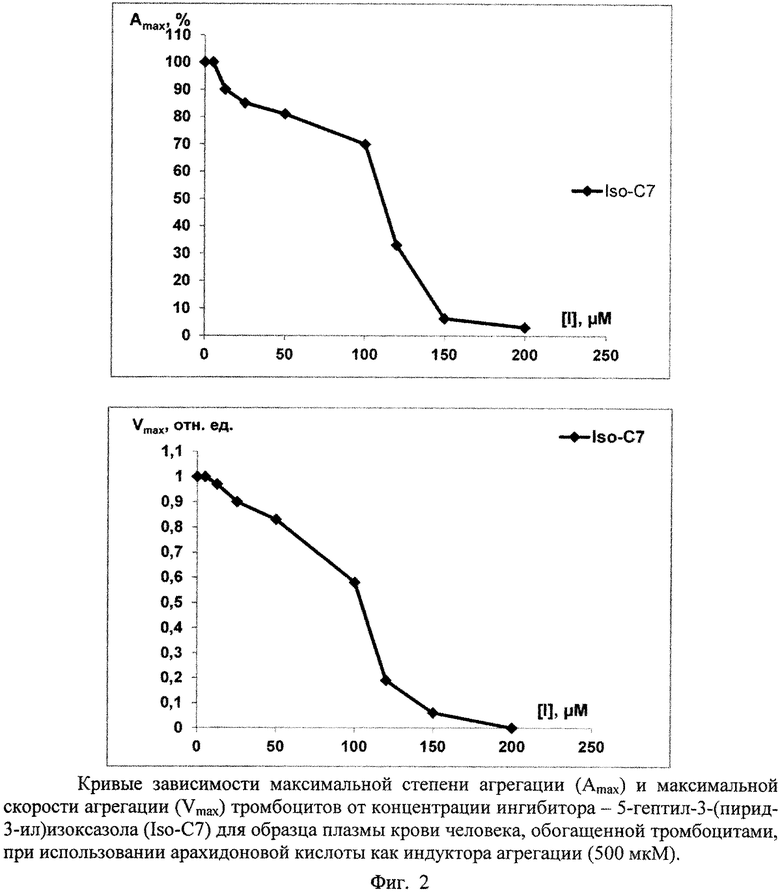
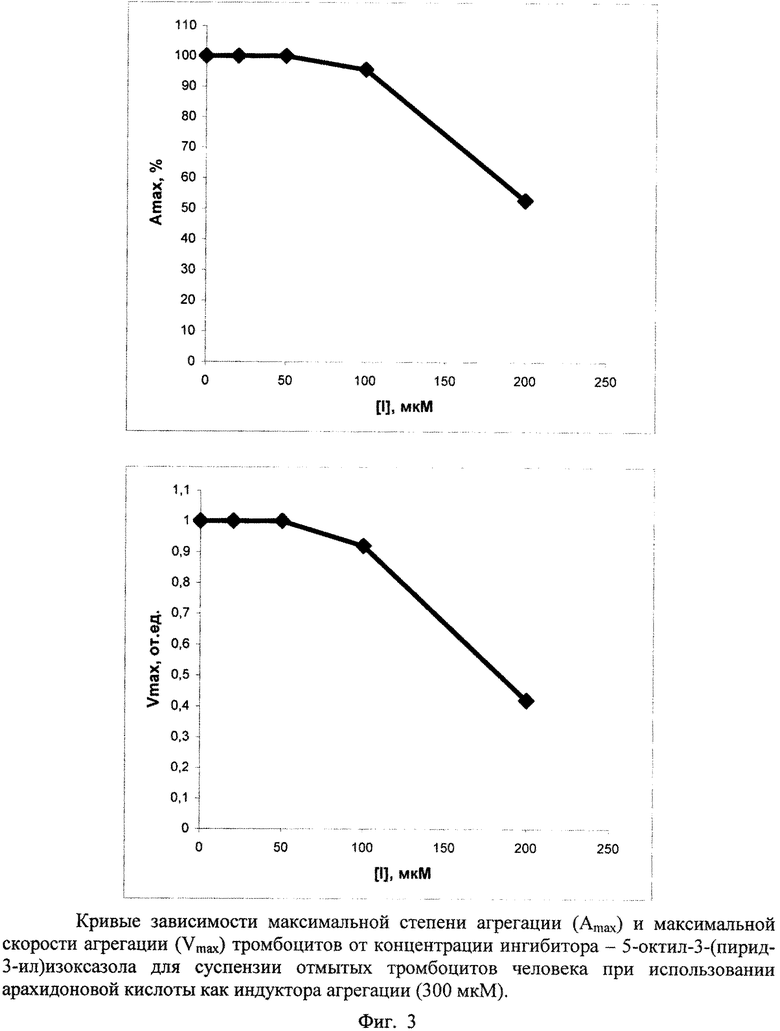
Для сравнения антиагрегационных свойств соединений в каждом опыте определяли следующие кинетические параметры: максимальную степень агрегации (Amax), максимальную скорость агрегации (Vmax). Количественной характеристикой антиагрегационной активности соединений служила концентрация соединения, вызывающая 50%-ное ингибирование агрегации тромбоцитов (IC50), которую определяли по получаемым в каждом опыте S-образным кривым зависимостей Amax и Vmax от концентрации исследуемого соединения ([Amax; [I]] и [Vmax; [I]]). Значение IC100 для каждого соединения означает 100%-ное ингибирование агрегации тромбоцитов человека при данной концентрации. Эти данные приведены в таблице 2.
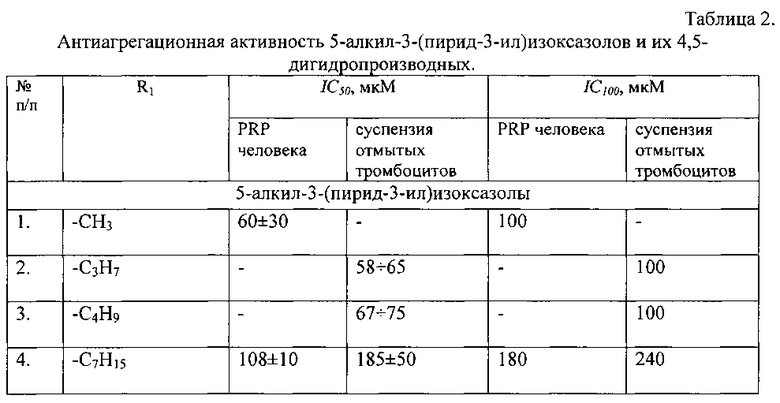

Показано, что заявляемые соединения подавляют полностью агрегацию тромбоцитов в диапазоне до 100 мкМ (с учетом разброса на образцах плазмы доноров). Наименее активными являются 5-гептил- и 5-октил-3-(пирид-3-ил)изоксазолы, однако они подавляют агрегацию полностью при 200-300 мкМ, превосходя по этому параметру ряд ранее тестированных соединений [Демина О.В., Ходонов А.А., Синауридзе Е.И., Швец В.И., Варфоломеев С.Д. 5-Замещенные пиридилизоксазолы - эффективные ингибиторы агрегации тромбоцитов // Изв. АН. Сер. Химическая, 2014, № 9, с. 2092-2113].
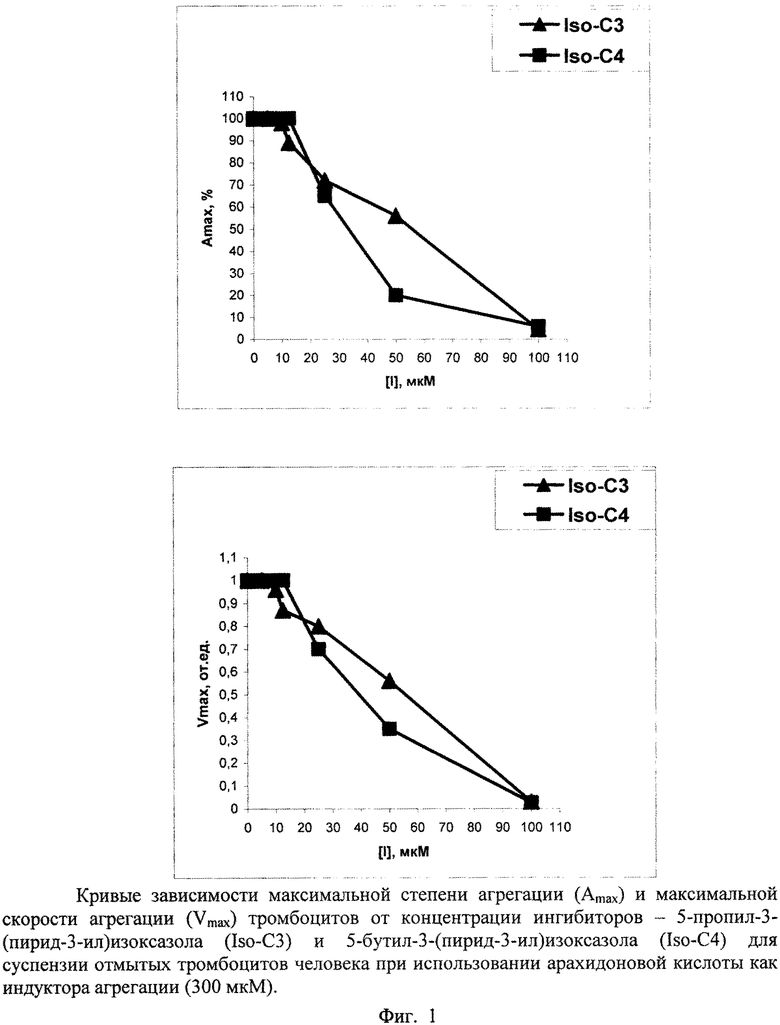
Приведенные данные по антиагрегационной активности подтверждают кривые зависимостей максимальной степени агрегации (Amax) и максимальной скорости агрегации (Vmax) от концентрации ингибитора ([I]), построенные по результатам обработки агрегатограмм опытов, представленные на фигурах 1-4.
Условия экспериментов, приведенных на фигурах 1-3, даны в таблицах 3-5.
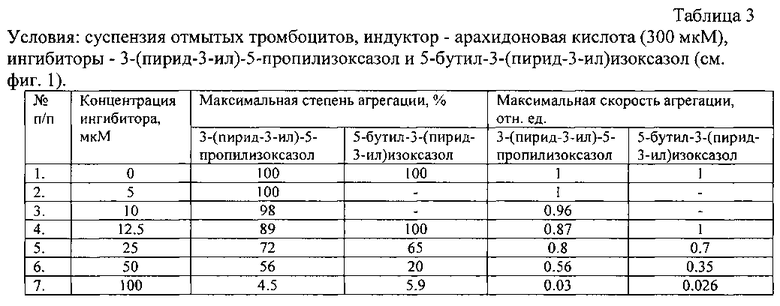
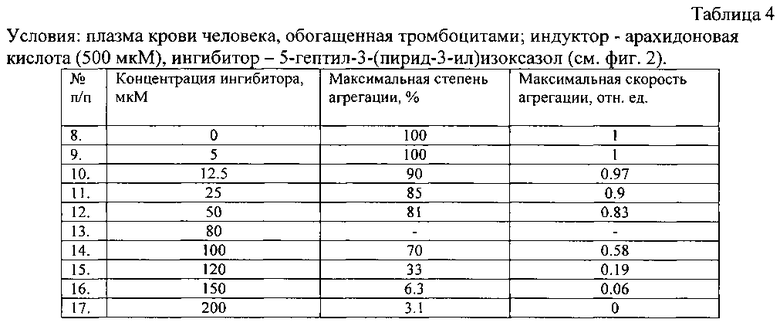
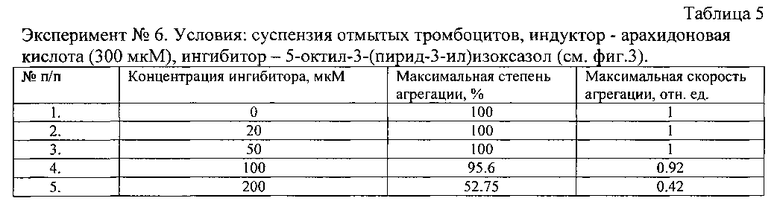
| название | год | авторы | номер документа |
|---|---|---|---|
| Производные изоксазола, обладающие антиагрегационной активностью | 2019 |
|
RU2726127C1 |
| ЗАМЕЩЕННЫЕ N-[ω-АЗОЛ-1-ИЛ)АЛКИЛ]БЕНЗОЛСУЛЬФАМИДЫ В КАЧЕСТВЕ СРЕДСТВ С АНТИАГРЕГАЦИОННОЙ АКТИВНОСТЬЮ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2006 |
|
RU2339625C2 |
| ЗАМЕЩЕННЫЕ ОМЕГА-АЗОЛИЛАЛКАНАНИЛИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТИАГРЕГАНТОВ | 2006 |
|
RU2322440C1 |
| АНТИАГРЕГАЦИОННЫЕ СРЕДСТВА | 1993 |
|
RU2088229C1 |
| 3-МЕТИЛ-8-ПИПЕРАЗИНО-7-(ТИЕТАНИЛ-3)-1-ЭТИЛКСАНТИНА ГИДРОХЛОРИД, ПРОЯВЛЯЮЩИЙ АНТИАГРЕГАЦИОННУЮ И ДЕЗАГРЕГАЦИОННУЮ АКТИВНОСТЬ | 2009 |
|
RU2404181C1 |
| ЗАМЕЩЕННЫЕ О-[ω-(АЗОЛ-1-ИЛ)АЛКИЛ]-N-ФЕНИЛКАРБАМАТЫ В КАЧЕСТВЕ СРЕДСТВ С АНТИАГРЕГАЦИОННОЙ АКТИВНОСТЬЮ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2009 |
|
RU2488583C2 |
| 5-(4'-ГИДРОКСИФЕНИЛ)- И 5-(2',5'-ДИГИДРОКСИФЕНИЛ)-6Н-1,3,4-ТИАДИАЗИН-2-АМИНЫ, ГИДРОГАЛАГЕНИДЫ, ИНГИБИРУЮЩИЕ АГРЕГАЦИЮ ТРОМБОЦИТОВ ПРИ ВНУТРИВЕННОМ ВВЕДЕНИИ | 2009 |
|
RU2458060C2 |
| ГИДРОХЛОРИДЫ 1-АЛКИЛ-3-МЕТИЛ-8-ПИПЕРАЗИНО-7-(ТИЕТАНИЛ-3)КСАНТИНА, ПРОЯВЛЯЮЩИЕ АНТИТРОМБОТИЧЕСКИЙ ЭФФЕКТ ПОСРЕДСТВОМ БЛОКИРОВАНИЯ РЕЦЕПТОРОВ ТРОМБОЦИТОВ ГП IIb-IIIa | 2017 |
|
RU2640579C1 |
| 2-ПИПЕРИДИНО-5-(ТИЕНИЛ-2)- И 2-ПИПЕРИДИНО-5-(ТИЕНИЛ-3)-6Н-1,3,4-ТИАДИАЗИНЫ ГИДРОБРОМИДЫ, ОБЛАДАЮЩИЕ АНТИАГРЕГАНТНЫМ ДЕЙСТВИЕМ | 2010 |
|
RU2445310C2 |
| СПОСОБ УСИЛЕНИЯ АНТИАГРЕГАНТНОЙ АКТИВНОСТИ | 2010 |
|
RU2440370C2 |
Изобретение относится к применению 5-алкил-3-(пирид-3-ил)изоксазолов и их 4,5-дигидропроизводных общей формулы
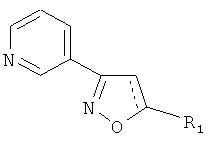 ,
,
где для 5-алкил-3-(пирид-3-ил)изоксазолов R1 представляет собой CH3, C3H7, C4H9, C7H15, C8H17, а для 4,5-дигидропроизводных R1 представляет собой CH3, C8H17, C16H33, в качестве средств, обладающих антиагрегационной активностью. Технический результат - применение 5-алкил-3-(пирид-3-ил)изоксазолов и их 4,5-дигидропроизводных в качестве антиагрегационных средств. 3 ил., 5 табл., 11 пр.
Применение 5-алкил-3-(пирид-3-ил)изоксазолов и их 4,5-дигидропроизводных формулы
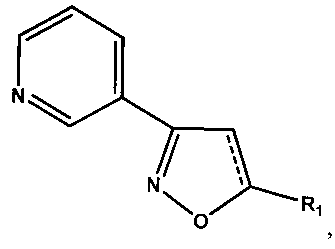
где R1 равно СН3, С3Н7, С4Н9, С7Н15, С8Н17, а для 5-алкил-3-(пирид-3-ил)-4,5-дигидроизокеазолов R1 равно СН3, С8Н17, С16Н33, в качестве средств, обладающих антиагрегационной активностью.
| ДЕМИНА О.В | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| ФОМИН М.А | |||
| и др., Антиагрегационные средства класса 3,5-замещенных изоксазолов и их 4,5-дигидропроизводных | |||
| "VI МОСКОВСКИЙ МЕЖДУНАРОДНЫЙ КОНГРЕСС | |||
| БИОТЕХНОЛОГИЯ: СОСТОЯНИЕ И ПЕРСПЕКТИВЫ РАЗВИТИЯ", 21-25 | |||
Авторы
Даты
2015-10-20—Публикация
2013-07-11—Подача