Изобретение относится к химии гетероциклических соединений, а именно к замещенным ω-азолилалкананилидам (ω-(1Н-азол-1-ил)-N-фенилалканамидам) общей формулы I:
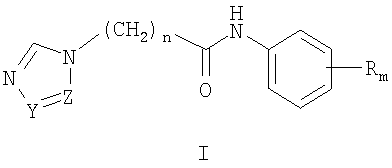
где Z и Y означают атом азота или СН-группу, или одновременно являются цепью С-СН=СН-СН=СН-С, составляющей вместе аннелированное кольцо; n означает целое число от 1 до 3; R одинаковые или разные означают атом водорода, галогена, алкильную группу с числом атомов углерода от 1 до 4, алкоксигруппу с числом атомов углерода от 1 до 4, алкилендиоксигруппу, бензилоксигруппу, перфторалкильную группу с числом атомов углерода от 1 до 4, нитрогруппу, алкоксикарбонильную группу, карбоксильную группу, галогенфенилтиогруппу, галогенбензоилгруппу, m означает целое число атомов от 0 до 5; к их солям с кислотами, обладающим антиагрегационной активностью.
Соединения общей формулы I могут найти применение в качестве медицинских, ветеринарных и фитотерапевтических препаратов, в первую очередь антиагрегантов.
Изобретение относится также к способам получения соединений общей формулы I и использованию этих соединений в качестве антиагрегантов.
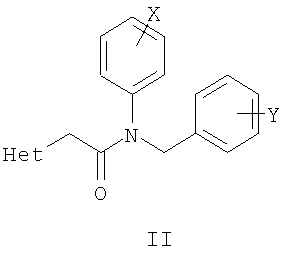
Известны многие продукты с азольными циклами, в частности N-фенил-N-бензил 2-гетерилацетамиды с бактерицидной активностью, применяемые в сельском хозяйстве и садоводстве, общей формулы II, где Х и Y атом означают атом водорода, низший алкил или атом галогена; Het означает пиперидино, метилпиперидино, диметилпиперидино, гексаметиленимино, пиразолил, имидазолил или 1,2,4-триазолил [патент Японии № 4145067, МКИ C07D 249/08. - Заявл. - 04.10.1990].
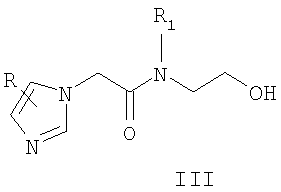
Известны 2-(азол-1-ил)-N-фенилацетамиды с противораковой активностью общей формулы III, где R означает атом водорода, метильную группу или нитрогруппу; R1 означает атом водорода или метильную группу [Kasai S., Nagasawa H., Yamashita M. New Antimetastatic Hypoxic Cell Radiosensitizers: Desing, Synthesis, and Biological Activities of 2-Nitroimidazole-acetamide, TX-1877, and its Analogues. // Bioorg. Med. Chem. - 2001. - No.9. - P.453-64].
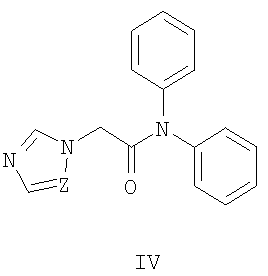
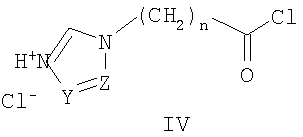
Известны 2-азолил-N,N-дифенилацетамиды общей формулы IV, где Z означает атом азота или СН-группу  S.Dalkara,
S.Dalkara,  A.Willke. Synthesis of Some N-Arylazole Acetamide Derivatives and Their Anticonvulsant and Antimicrobial Activities. // Arzneim. - Forsch. / Drug Res. - 1994. - Vol.44 (II). - № 8. - P.920-924], которые обладают противосудорожной активностью.
A.Willke. Synthesis of Some N-Arylazole Acetamide Derivatives and Their Anticonvulsant and Antimicrobial Activities. // Arzneim. - Forsch. / Drug Res. - 1994. - Vol.44 (II). - № 8. - P.920-924], которые обладают противосудорожной активностью.
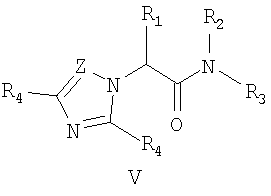
Наиболее близкими к заявленным замещенным ω-(1Н-азол-1-ил)-N-фенилалканамидам по структуре и по способу получения являются N-фенил-2-(азол-1-ил)-2-алканамиды общей формулы V, где R1 означает алкильную группу с числом атомов углерода от 1 до 10, фенильную или феноксигруппу; R2 означает атом водорода, алкильную группу с числом атомов углерода от 1 до 5, аллильную группу; R3 означает алкильную группу с числом атомов углерода от 1 до 8, аллильную группу, циклоалкильную группу, фенильную группу; R4 означает атом водорода, низшую алкильную группу или атом галогена [патент Японии №58052256, МКИ C07D 249/10. - Заявл. - 24.09.1981], применяемые как бактерициды промышленного или сельскохозяйственного назначения, гербициды или фунгициды. Соединения общей формулы V получают в две стадии, сначала взаимодействием 2-бромацилгалогенидов с аминами в инертном растворителе, например бензоле, толуоле или тетрагидрофуране в присутствии водного раствора карбоната или гидроксида натрия при температуре -10 - +10°C, получают 2-бромацетамиды, которыми алкилируют азолы в диметилсульфоксиде в присутствии 1,8-диазобицикло[5.4.0]ундец-7-ена (ДБУ) при нагревании до 60°C в течение 24 часов.
Первое место среди причин летального исхода занимают заболевания сердечно-сосудистой системы. Назначение антитромбоцитарных препаратов (антиагрегантов) предупреждает развитие тяжелых сосудистых осложнений, снижает риск тяжелых сосудистых исходов: инфаркта миокарда, инсультов. Данная группа препаратов является важной составной частью лечения и профилактики стенокардии, атеросклероза периферических артерий и проявлений атеротромбоза.
Антиагреганты ингибируют агрегацию тромбоцитов, уменьшают их способность к склеиванию и прилипанию (адгезии) к эндотелию кровеносных сосудов. Антиагреганты способны не только предупреждать агрегацию, но и вызывать дезагрегацию уже агрегированных кровяных пластинок. Применяют их для предупреждения образования послеоперационных тромбов, при тромбофлебитах, тромбозах сосудов сетчатки, нарушениях мозгового кровообращения, а также для предупреждения тромбоэмболических осложнений при ишемической болезни сердца, в том числе и при инфаркте миокарда [Харкевич Д.А. Фармакология. - М.: ГЭОТАР Медицина, 2000. - 664 с.].
Важное место среди антиагрегантов занимают производные азолов, в первую очередь имидазола, являющиеся ингибиторами тромбоксансинтетазы [Демина О.В., Ходонов А.А., Швец В.И., Варфоломеев С.Д. Агрегация тромбоцитов человека: молекулярно-кинетические механизмы и пути регуляции. // Биолог. мембраны. - 2002. - Т.19, № 2. - С.115-152].
После стимуляции клетки арахидоновая кислота высвобождается из мембранных фосфолипидов и превращается в результате последовательности ферментных реакций (каскад арахидоновой кислоты) во множество различных производных метаболитов по двум основным путям - липоксигеназному и циклооксигеназному. Продуктами циклооксигеназного пути являются широко распространенные простагландины, из устойчивого простациклина PGH2 образуется как простациклин (PGI2), образующийся в эндотелии сосудов, так и тромбоксан (ТхА2), который синтезируется в тромбоцитах. При ряде заболеваний наблюдается дисбаланс между этими двумя эйкозаноидами, перепроизводство тромбоксана А2 выявлено при многих паталогических состояниях. Ингибиторы тромбоксансинтетазы, например дазоксибен, блокируют биосинтез тромбоксана, при этом наблюдается конверсия тромбоцитарных эндоперекисей (PGH2) в простациклин PGI2, что способствует повышению атромбогенных свойств сосудистой стенки, ингибированию адгезии тромбоцитов, их агрегации и коагуляции, а также может сопровождаться понижением давления [Garsia-Szabo R.R., Peterson M.B., Watkins W.D. et. al. Thromboxane generation after thrombin. Protective effect of thromboxane synthetase inhibition on lang Huid balance. // Circ. Res. - 1983. - Vol.53, N2. - P.214-222].
Многие антиагреганты - ингибиторы тромбоксансинтетазы применяют в качестве вазодилаторов, антигипертензивных препаратов, антиангинальных средств, церебровазодилаторов, коронарных вазодилаторов, средств лечения бронхиальной астмы и ринита.
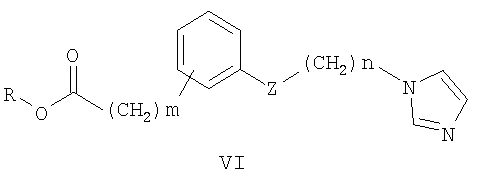
Наиболее близкими к заявленным замещенным ω-(1Н-азол-1-ил)-N-фенилалканамидам по применению в качестве антиагрегантов являются феноксиалкилимидазолы общей формулы IV, где R означает водород или алкил; с числом метиленовых групп n от 1 до 9; m от 0 до 8; Z означает атом О, S или NH группу [Патент США № 4632934. - Заявл. - 21.08.1979], которые ингибируют тромбоксансинтетазу и за счет этого находят применение как антигипертензивные противовоспалительные, противотромбоэлические средства [Cross P.E., Dickinson R.P., Parry M.J., Randall M.J. Selective tromboxane synthetase Inhibitors. I. 1-[(Aryloxy)alkyl]-1H-imidazoles. // J. Med. Chem. - 1985. - Vol.28. - P.1427-32]
Техническая задача данного изобретения состоит в увеличении эффективности антиагрегационных лекарственных средств и расширении ассортимента гематотропных препаратов.
Поставленная задача решается получением соединений общей формулы I, обладающих антиагрегационной активностью. Согласно настоящему изобретению ω-азолилалкананилиды (ω-(1Н-азол-1-ил)-N-фенилалканамиды) формулы I получают двумя способами. По первому способу взаимодействием ω-галогенацилгалогенидов, например хлорацетилхлорида с замещенными анилинами (VII) в среде органических растворителей, например хлористом метилене, хлороформе, толуоле и др., в присутствии водного раствора гидроксидов или карбонатов щелочных или щелочно-земельных металлов при температуре от 0 до 20°С по реакции Шоттена-Баумана получали ω-галогенациланилиды (VIII), которыми алкилировали азолаты щелочных металлов в среде полярного апротонного растворителя, например ацетонитрила, диметилформамида, диметилсульфоксида и др. при температуре от 40 до 150°С.
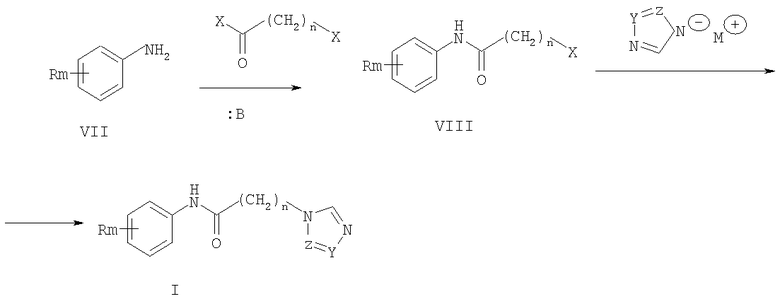
По второму способу получают соединения общей формулы I взаимодействием ω-азолилалкановых кислот (IX) с хлорирующими агентами, например хлоридом фосфора (V), хлоридом фосфора (III), тионилхлоридом, оксалилхлоридом, в инертном растворителе, например в диоксане, тетрагидрофуране, хлористом метилене и др., при температуре от 20 до 50°С получали гидрохлориды хлорангидридов ω-азол-1-илалкановых кислот (X), которые затем вводили в реакцию с замещенными анилинами (VII) в среде полярного апротонного растворителя, например ацетонитрила, диметилформамида, диметилсульфоксида либо хлористого метилена, диоксана в присутствии оснований, например триэтиламина, диазабициклооктана, ДБУ и др. при температуре от 20 до 60°С.
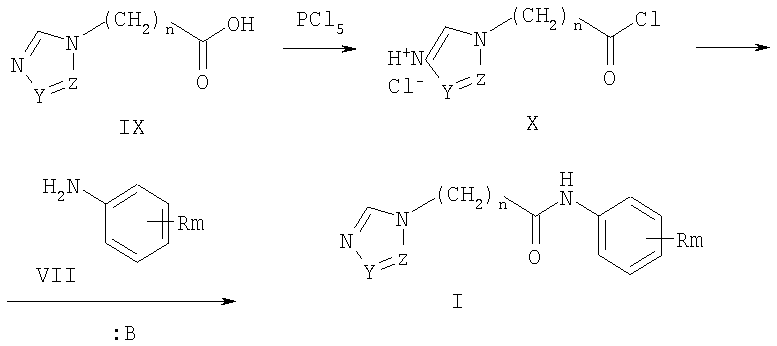
В приведенных схемах R, n, m, Z и Y имеют те же значения, что и в формуле I, X означает хлор, бром; М означает щелочной металл, например натрий, калий и т.п.; :В означает основание, например триэтиламин, ДБУ, гидроксид или карбонат щелочного или щелочно-земельного металлов.
Алкилированию азолов, в частности имидазола и 1,2,4-триазола, посвящено множество статей. Первоначально получают 1,2,4-триазолат щелочного металла, например, взаимодействием с гидридом натрия в ДМФА или с этилатом натрия в спирте, к которому затем прибавляют алкилгалогенид и получают 1-алкил-1,2,4-триазолы [Bergtrap M., Larsen P. Alkylation, acylation and silylation of azoles. // Acta Chem. Scand. - 1990. - Vol.44, № 10. - Р.1050-1057].
2-(Имидазол-1-ил)-N,N-дифенилацетамид получают взаимодействием 2-бром-N,N-дифенилацетамида с имидазолатом натрия в кипящем ДМФА в течение 48 ч [F.ÖzkanIi, S.Dalkara, Ü.Çaliş, A.Willke. Synthesis of Some N-Arylazole Acetamide Derivatives and Their Anticonvulsant and Antimicrobial Activities. // Arzneim.-Forsch. / Drug Res. - 1994. - Vol.44 (II). - № 8. - P.920-924].
Замещенные 2-галогенацетамиды (VIII), например бромацетамиды, получают взаимодействием анилинов (VII) с бромацилбромидом в эфире в присутствии водного раствора гидроксида натрия.  S.Dalkara,
S.Dalkara,  A.Willke. Synthesis of Some N-Arylazole Acetamide Derivatives and Their Anticonvulsant and Antimicrobial Activities. // Arzneim.-Forsch. / Drug Res. - 1994. - Vol.44 (II). - № 8. - P.920-924].
A.Willke. Synthesis of Some N-Arylazole Acetamide Derivatives and Their Anticonvulsant and Antimicrobial Activities. // Arzneim.-Forsch. / Drug Res. - 1994. - Vol.44 (II). - № 8. - P.920-924].
Техническим результатом изобретения являются новые вещества - замещенные ω-(1Н-азол-1-ил)-N-фенилалкиламиды общей формулы I и способ их получения. В указанном патенте [патент Япония № 58052256, - Заявл. - 24.09.1981] предлагают получать целевые 1-замещенные азолы в трудноудаляемых растворителях, например, в диметилсульфоксиде в течение длительного времени взаимодействия. Мы предлагаем проводить алкилирование в легко удаляемых растворителях, например в ацетонитриле, при существенно меньшем времени взаимодействия. Нами предложен альтернативный способ получения целевых соединений из азолилалкановых кислот в две стадии. Вначале взаимодействием с хлорирующими агентами с высоким выходом получали хлорангидриды кислот, которыми затем ацилировали анилины.
Технической результатом изобретения также является применение ω-(1Н-азол-1-ил)-N-фенилалкиламиды формулы I в качестве антиагрегантов, которые превосходят по активности известный антиагрегационный препарат дазоксибен (гидрохлорид 4-[2-(имидазол-1-ил)этокси]бензойной кислоты) [J. Med. Chem. - 1985. - Vol.28. - P.1427-32], что позволяет увеличить эффективность антиагрегационных лекарственных средств и расширить ассортимент гематотропных препаратов. Эффект ω-(1Н-азол-1-ил)-N-фенилалкиламидов формулы I в экспериментах in vitro проявлялся в диапазоне фармакологически приемлемых концентраций 10-4-10-6 M, при этом оптическая плотность плазмы снижалась до 7,7-42,6%. Исследуемые соединения, например, 30, 45, 47 превосходили эталон дазоксибен, как при агрегации вызываемой АДФ, так и коллагеном.
Сравнивая степень влияния соединения 30 на АДФ-индуцированную агрегацию тромбоцитов in vivo в концентрациях 11, 16, 21 мг/кг, установлено, что оно во всех изученных концентрациях в разной степени проявляло антиагрегационное действие, при этом максимум действия наступал через 7, 9 и 11 часов в зависимости от используемой дозы. Степень подавления агрегации также зависела от дозы, и значения оптической плотности составляли 26,5% (11 мг/кг), 18,8% (16 мг/кг) и 16,9% (21 мг/кг) соответственно. Продолжительность эффекта соединения 30 в концентрации 11 мг/кг наблюдалась в интервале от 1 до 13 часов, а под влиянием концентраций 16 и 21 мг/кг не значительное подавление АДФ-индуцированной агрегации тромбоцитов наблюдалось и спустя 24 часа после введения. В то время как сравнительное изучение влияния дазоксибена на АДФ-индуцированную агрегацию тромбоцитов in vivo в концентрациях 11, 16, 21 мг/кг позволило установить, что максимум действия при изучении всех концентраций наступал через 1 час после введения препарата, при этом значения оптической плотности плазмы составляли 31% при изучении концентрации 11 мг/кг, 29,4% при изучении концентрации 16 мг/кг и 29,3% при изучении концентрации 21 мг/кг соответственно.
Сопоставление данных, полученных при изучении влияния соединения 30 в концентрациях 11, 16, 21 мг/кг на плазменные факторы свертывания крови in vivo, позволило установить, что изучаемое соединение во всех концентрациях увеличивало время образования сгустка. На максимуме действия соединение 30 в концентрациях 16 и 21 мг/кг (28,9, 29,2 с) показывало примерно равные результаты, а в концентрации 11 мг/кг (22,7 с) несколько уступало им. Таким образом, все изученные концентрации (11, 16, 21 мг/кг) соединения увеличивали время образования сгустка при изучении действия на плазменные факторы свертывания крови. При этом на максимуме действия соединение 30 в концентрациях 16 и 21 мг/кг (28,9, 29,2 с) в равной степени увеличивало время образования сгустка, а в концентрации 11 мг/кг (22,7 с) несколько уступало более высоким концентрациям. Эффект при использовании концентрации 16 и 21 мг/кг длился более 12 часов, а под действием концентрации 11 мг/кг до 8 часов. В то время как сравнительное изучение влияния дазоксибена в концентрациях 11, 16, 21 мг/кг на плазменные факторы свертывания крови in vivo, позволило установить, что изучаемое соединение во всех концентрациях увеличивало значения АЧТВ. При этом не зависимо от концентрации значимое увеличение времени образования сгустка наблюдалось через 3 часа после введения. Таким образом, все изученные концентрации (11, 16, 21 мг/кг) дазоксибена увеличивали время образования сгустка при изучении действия на плазменные факторы свертывания крови. При этом на максимуме действия активность всех концентраций была примерно равной, но продолжительность максимального эффекта увеличивалась с увеличением концентрации изучаемого соединения (1 час при концентрации 11 мг/кг, 2 часа при концентрации 16 мг/кг и 4 часа при концентрации 21 мг/кг). Непосредственно сам эффект при использовании концентрации 11 и 16 мг/кг длился в промежутке между 1 и 7 часами, а под действием концентрации 21 мг/кг на 2 часа дольше (между 1 и 9 часами).
Изобретение может быть проиллюстрировано следующими примерами.
Пример 1. 2-Хлор-N-фенилацетамид (1).
К смеси 19,7 мл 20%-ного раствора гидроксида натрия, 9,3 г (0,1 моль) анилина и 100 мл хлористого метилена, охлаждаемой в бане со льдом и солью до 5°C, при перемешивании добавляют по каплям 13,56 г, 9,6 мл (0,12 моль) 2-хлорацетилхлорида так, чтобы температура смеси не превышала 10°C, а затем перемешивают при комнатной температуре еще 2 часа. Выпавший осадок отфильтровывают и промывают водой, фильтрат промывают насыщенным раствором гидрокарбоната натрия (2×15 мл), водой (3×20 мл), рассолом (15 мл) и сушат над сульфатом магния. После отгонки растворителя в вакууме водоструйного насоса полученный остаток перекристаллизовывают из смеси гексан:толуол (2:1) и получают 19,64 г (86%) 2-хлор-N-фенилацетамида (1) с т.пл. 129-131°C.
Аналогично получены замещенные 2-хлор-N-фенилацетамиды. Таблица 1.
Пример 2. 2-(1,2,4-Триазол-1-ил)-N-фенилацетамид (10).
К суспензии 2,73 г (0,03 моль) 1,2,4-триазолата натрия, в 30 мл ацетонитрила при перемешивании добавляют 5 г (0,03 моль) 2-хлор-N-фенилацетамида (1), кипятят реакционную массу в течение 10 часов, выпавший осадок отфильтровывают и промывают 5 мл дистиллированной воды и высушивают. Получают 5,628 г технического продукта, являющегося смесью изомеров 1- и 4-алкилирования триазола, из которой методом «сухой» флеш-хроматографии, используя в качестве элюента смесь метанол:хлороформ 1:10, выделяют 3,20 г (57%) 2-(1,2,4-триазол-1-ил)-N-фенилацетамид (10) с т.пл. 146-148°C.
Пример 3. 2-(1,2,4-Триазол-1-ил)-N-(4-трифторметилфенил)ацетамид (17).
К 1,61 г (0,01 моль) 4-1,1,1-трифторметиланилина в 20 мл абсолютного ацетонитрила при перемешивании добавляют 1,82 г (0,01 моль) гидрохлорида хлорангидрида 1,2,4-триазол-1-ил уксусной кислоты и 2,02 г (0,02 моль) триэтиламина. Перемешивают в течение двух часов. Выпавший осадок отфильтровывают, промывают 2 мл воды и 2 мл ацетонитрила. Осадок перекристаллизовывают из изопропилового спирта. Получают 2,16 г (41%) 2-(1,2,4-Триазол-1-ил)-N-(4-1,1,1-трифторметилфенил)ацетамида (17) с т.пл. 187-188°C.
Аналогично получены замещенные 2-(1,2,4-триазол-1-ил)-N-фенилацетамиды (таблица 2).
Пример 4. 2-(Имидазол-1-ил)-N-фенилацетамид (11).
К суспензии 2,70 г (0,03 моль) имидазолата натрия, в 25 мл ацетонитрила при перемешивании добавляют 5 г (0,03 моль) 2-хлор-М-фенилацетамида (1), кипятят в течение 10 часов, выпавший осадок отфильтровывают и промывают 5 мл дистиллированной воды, высушивают и перекристаллизовывают из изопропилового спирта, получают 2,64 г (64%) 2-(имидазол-1-ил)-N-фенилацетамид (2) с т.пл. 138-140°C.
Аналогично получены замещенные 2-(имидазол-1-ил)-N-фенилацетамиды (таблица 2).
Пример 5. Этил 4[(1Н-бензимидазол-1-ил ацетил)амино]бензоат (43).
К 1,65 г (0,01 моль) этил 4-аминобензоату в 10 мл абсолютного ацетонитрила при перемешивании добавляют порциями 2,37 г (0,01 моль) гидрохлорида хлорангидрида (бензимидазол-1-ил)уксусной кислоты и 2,02 г (0,02 моль) триэтиламина. Нагревают до 40°С и выдерживают при этой температуре при перемешивании в течение восемнадцати часов. Выпавший осадок отфильтровывают, промывают водой (2×3 мл), перекристаллизовывают из метилового спирта. Получают 1,03 г (32%) этил 4-[(1Н-бензимидазол-1-ил ацетил)амино]бензоата (43)с т.пл. 222-223°C.
Аналогично получены замещенные 2-(1Н-бензимидазол-1-ил ацетил)-N-фенилацетамиды (таблица 3).
Пример 6. 4-(1Н-имидазол-1-ил)-N-(3-нитрофенил)бутанамид (26).
К 1,38 г (0,01 моль) 3-нитроанилина в 10 мл абсолютного диметилформамида при перемешивании добавляют порциями 1,725 г (0,01 моль) гидрохлорида хлорангидрида 4-(имидазол-1-ил)бутановой кислоты и 2,02 г (0,02 моль) триэтиламина. Реакционную массу нагревают до 40°С в течение суток. Выпавший осадок отфильтровывают, промывают 5 мл воды и 1 мл изопропилового спирта, фильтрат упаривают в вакууме водоструйного насоса. К полученному остатку добавляют 10 мл воды и фильтруют. Полученный осадок перекристаллизовывают из изопропилового спирта. Получают 0,56 г (26%). 4-(1Н-имидазол-1-ил)-N-(3-нитрофенил)бутанамид (26) с т.пл. 145-7°C.
Пример 7. Этил 3-([4-(1Н-имидазол-1-ил)бутаноил]амино)бензоат (30).
а) Гидрохлорид хлорангидрида 4-(имидазол-1-ил)бутановой кислоты. К 1,16 г (0,0075 моль) 4-(имидазол-1-ил)бутановой кислоты в 5 мл абсолютного диоксана добавляют порциями при перемешивании 1,56 г (0,0075 моль) пятихлористого фосфора. Реакционную массу нагревают до 40°C в течение шести часов до полного растворения пятихлористого фосфора, охлаждают до комнатной температуры и перемешивают еще десять часов. Реакционную массу упаривают в вакууме водоструйного насоса. Получают 1,56 г (99%) гидрохлорид хлорангидрида 4-(имидазол-1-ил)бутановой кислоты в виде масла. По результатам потенциометрического аргентометрического титрования определяют содержание хлора. Найдено: Cl 34,35%; С7Н10Cl2N2O; вычислено: Cl 33,97%. В дальнейшем продукт используют без дополнительной очистки.
б) К 1,25 г (0,0075 моль) 3-этоксикарбониланилину в 10 мл абсолютного диоксана при перемешивании добавляют порциями 1,56 г (0,0075 моль) гидрохлорида хлорангидрида 1Н-имидазол-1-ил бутановой кислоты и 1,515 г (0,0075 моль) триэтиламина. Реакционную массу нагревают в течение сорока восьми часов. Выпавший осадок отфильтровывают, промывают 10 мл воды, перекристаллизовывают из изопропилового спирта. Получают 0,56 г (26%) этил 3-{[4-(1Н-имидазол-1-ил)бутаноил]амино}бензоата (30) с т.пл. 146-148°С.
Аналогично получены замещенные ω-(азол-1-ил)-N-фенилалканамиды.
ЯМР 1Н-спектры записаны на приборе «Bruker AC-200» (рабочая частота 200 МГц), сдвиги измерены относительно тетраметилсилана, в качестве растворителя использовали d6-ДМСО. ИК-спектры регистрировали с призмами NaCl в тонкой пленке в вазелиновом масле на спектрометре «Specord M80».
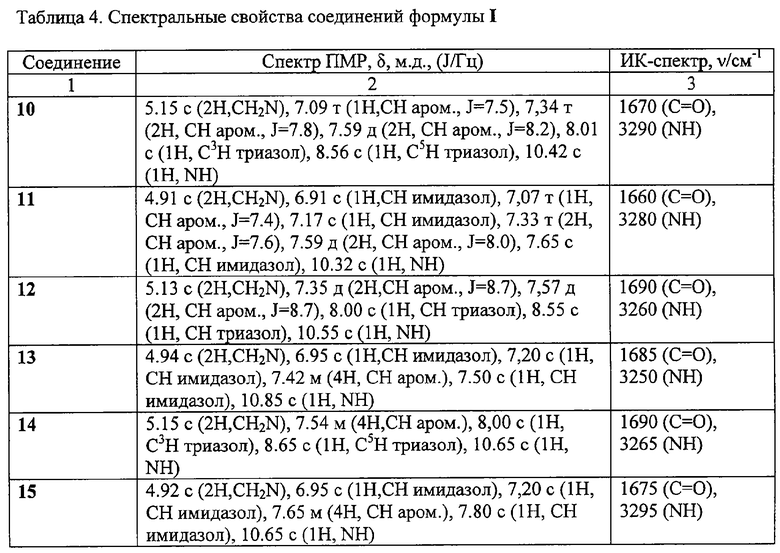
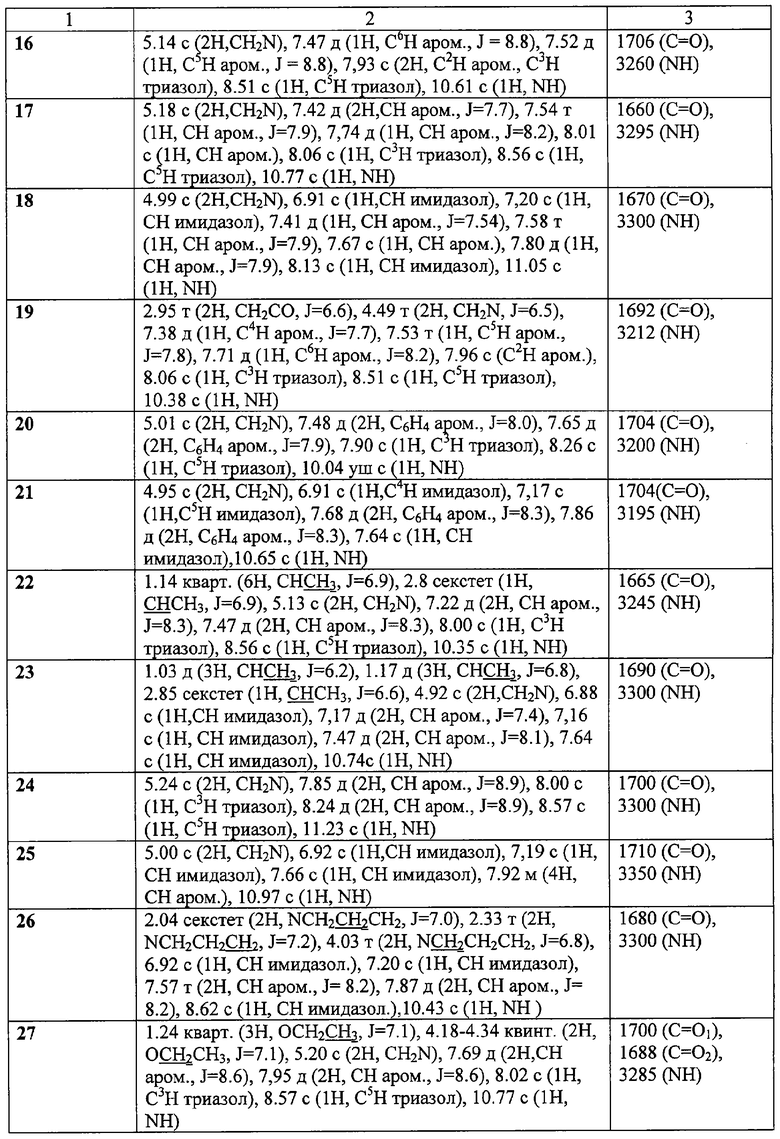
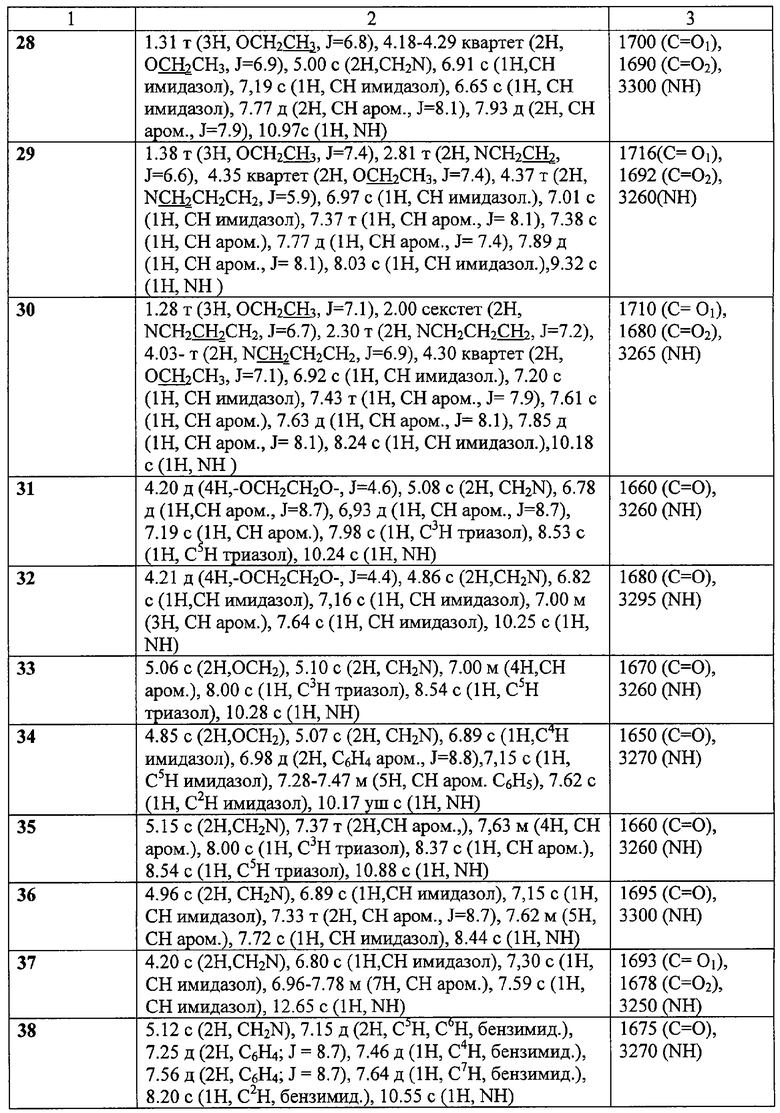
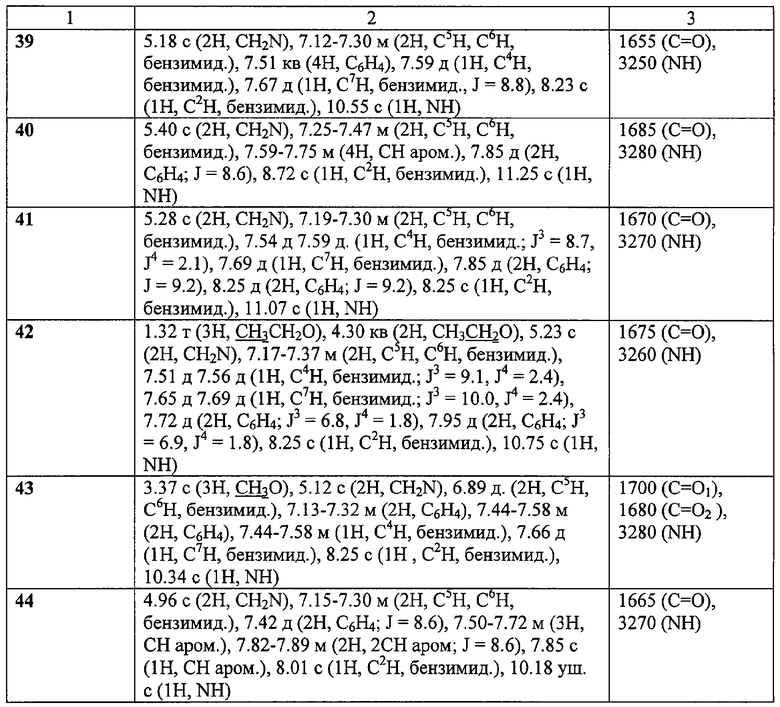
Пример 8. Гидрохлорид 2-(имидазол-1-ил)-N-(4-хлорофенил)ацетамида (45).
К раствору 0,326 г (1,38 ммоль) 2-(имидазол-1-ил)-N-(4-хлорофенил)ацетамида (13) в 5 мл метилового спирта при перемешивании добавляют 1,41 мл (2,08 ммоль) 1,47М раствора хлороводорода в метаноле. Растворитель отгоняют в вакууме водоструйного насоса досуха. Получают 0,373 г (98%) гидрохлорида 2-(имидазол-1-ил)-N-(4-хлорофенил)ацетамида (45) с т.пл. 216-217°C.
Аналогично получены гидрохлориды замещенных 2-(азол-1-ил)-N-фенилалканамидов: из этил 4-[2-(1Н-имидазол-1-ил)ацетиламино]бензоата (28) гидрохлорид этил 4-[2-(1Н-имидазол-1-ил)ацетиламино]бензоата (46) с т.пл. 105-106°С, из этил 4-[2-(1Н-1,2,4-триазол-1-ил)ацетиламино]бензоата (27) гидрохлорид 4-[2-(1Н-1,2,4-триазол-1-ил)ацетиламино]бензоата (47) с т.пл. 144-146°С.
Пример 9. Проведение испытаний ω-азол-1-илалкан анилидов на наличие антиагрегационной активности in vitro.
Методика проведения эксперимента. Богатую тромбоцитами плазму (в среднем 3×108 в 1 см3 тромбоцитов) получали центрифугированием свежеполученной крови здоровых доноров (стабилизатор - 3.8%-ный цитрат натрия, соотношение крови и раствора цитрата 9:1) в течение 10 минут при 1000 об/мин при комнатной температуре. До проведения эксперимента и в конце его в каждом образце подсчитывали количество тромбоцитов. В том случае, если плазма содержала большее количество кровяных пластинок, то ее разводили до необходимого количества безтромбоцитарной плазмой, полученной центрифугированием цитратной крови в течение 10 минут при 3000 об/мин. В качестве индуктора агрегации использовали АДФ, коллаген (НПО «РЕНАМ», Россия). Агрегацию тромбоцитов изучали методом светорассеяния по методу Born [Born J.V.R. Aggregation of blood platelets by adenosine diphosphate and its reversal. // Nature - 1962. - V.194, N5. - P.927-929. Born J.V.R. Quantitative investigation into the aggregation of blood platelets. // J. Physiol. - 1962. - V.162, N4. - P.487-511] на агрегометре фирмы «CHRONO-LOG» (США).
Условия проведения эксперимента: 37°C, объем богатой тромбоцитами плазмы 450 мкл, объем исследуемого раствора вещества 50 мкл, время прединкубации с препаратом ингибитора 5 минут при перемешивании, объем индуктора агрегации 50 мкл, конечная концентрация для АДФ 1×10-5 М, коллагена - 0,2 мг/мл. (В качестве контроля использовали богатую тромбоцитами плазму в объеме 450 мл). Количественной характеристикой степени агрегации служило относительное падение оптической плотности на максимуме амплитуды агрегатограммы. В процессе записи наблюдали изменение оптической плотности исследуемой плазмы в диапазоне 100% (богатой тромбоцитами плазмы) до 0% (безтромбоцитарная плазма) (длина волны зондированного светового потока 660 нм). Результат выражали в процентах падения оптической плотности на максимуме амплитуды агретограммы.
Были проведены эксперименты сравнения антиагрегационных свойств веществ и эталона, известного препарата дазоксибена.
Пример 10. Проведение биологических испытаний ω-азол-1-илалкан анилидов на наличие антиагрегационной активности in vivo.
Выбранные соединения вводились кроликам породы Шиншилла внутривенно в краевую вену уха в дозах 11, 16, 21 мг/кг. Первый забор крови для исследования осуществлялся через 30 мин после введения, далее через 1 час, 3, 5, 7, 9, 11 и 24 часа. В том случае если оптическая плотность плазмы через 11 часов после введения исследуемого соединения значительно отличалась от контрольных значений, то забор крови делали еще через 13 и 15 часов после введения. В качестве индуктора использовали АДФ в пороговой концентрации (1×10-5 М).
Полученные результаты суммированы и представлены в таблице 7.
Пример 11. Сравнительное изучение действия новых производных азолилалкановых кислот и дазоксибена на плазменные факторы свертывания крови in vivo.
Соединения вводились кроликам породы Шиншилла внутривенно в краевую вену уха, в дозах 11,16, 21 мг/кг. Полученные результаты суммированы и представлены в таблице 8. Первый забор крови для исследования осуществлялся до введения изучаемого соединения (контроль). Далее через 30 мин после введения, через 1 час, 3, 5, 7, 9, 11 и 24 часа. В том случае если получаемые результаты значительно отличалась от контрольных значений через 11 часов после введения исследуемого соединения, то забор крови делали еще через 13 и 15 часов после введения.
Применение ω-(1Н-азол-1-ил)-N-фенилалкиламидов формулы I в качестве антиагрегантов в медицине позволяет увеличить эффективность антиагрегационных лекарственных средств и расширить ассортимент гематотропных препаратов. По проявленному эффекту как в эксперементах in vitro, так и in vivo некоторые исследуемые соединения превосходили эталон дазоксибен, как при агрегации вызываемой АДФ, так и коллагеном, оказывали дозазависимое влияние на плазменные факторы свертываемости крови. Таким образом, указанные соединения могут расширить арсенал лекарственных препаратов? применяемых при заболеваниях сердечно-сосудистой системы.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ N-[ω-АЗОЛ-1-ИЛ)АЛКИЛ]БЕНЗОЛСУЛЬФАМИДЫ В КАЧЕСТВЕ СРЕДСТВ С АНТИАГРЕГАЦИОННОЙ АКТИВНОСТЬЮ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2006 |
|
RU2339625C2 |
| ЗАМЕЩЕННЫЕ О-[ω-(АЗОЛ-1-ИЛ)АЛКИЛ]-N-ФЕНИЛКАРБАМАТЫ В КАЧЕСТВЕ СРЕДСТВ С АНТИАГРЕГАЦИОННОЙ АКТИВНОСТЬЮ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2009 |
|
RU2488583C2 |
| ЗАМЕЩЕННЫЕ О-[ω-(АЗОЛ-1-ИЛ)АЛКИЛ]-N-ФЕНИЛТИОКАРБАМАТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФУНГИЦИДНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2007 |
|
RU2346937C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(АЗОЛ-1-ИЛ)ЭТАНАМИНОВ | 2006 |
|
RU2317984C2 |
| Способ получения 3-азолилпропанолов | 2022 |
|
RU2786670C1 |
| [2-(АЗОЛ-1-ИЛ)АЛКИЛБЕНЗИМИДАЗОЛ-1-ИЛ]АЛКАНОВЫЕ КИСЛОТЫ И ИХ ЭФИРЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И РОСТРЕГУЛЯТОРНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2008 |
|
RU2379294C1 |
| Замещенные 4-(азол-1-илметил)-1-фенил-5,5-диалкилспиро-[2.5]октан-4-олы, способ их получения (варианты), фунгицидная и рострегуляторная композиции на их основе | 2016 |
|
RU2648240C1 |
| ЗАМЕЩЕННЫЕ 1-(ПИРИДИНИЛ-2)-2-АЗОЛИЛЭТАНОЛЫ, ИХ СПОСОБ ПОЛУЧЕНИЯ И ФУНГИЦИДНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2004 |
|
RU2301227C2 |
| Замещенные 4-(азол-1-илметил)-1,6-бисфенилдиспиро[2.1.2.3]декан-4-олы, способ их получения и фунгицидная композиция на их основе | 2019 |
|
RU2730490C1 |
| 1-(ПИРИДИНИЛ-2)-2-АЗОЛИЛ-1-(ФТОРФЕНИЛ)ЭТАНОЛЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФУНГИЦИДОВ | 2004 |
|
RU2267483C2 |
Изобретение относится к замещенным ω-азолилалкананилидам. Описываются замещенные ω-(1Н-азол-1-ил)-N-фенилалканамиды общей формулы I:
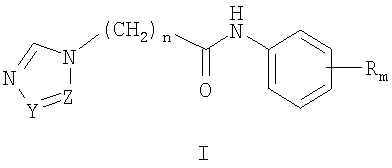
где Z и Y означают атом азота или СН-группу, или одновременно являются цепью С-СН=СН-СН=СН-С, составляющей вместе аннелированное кольцо, n означает целое число от 1 до 3, R одинаковые или разные означают атом водорода, галогена, алкильную группу с числом атомов углерода от 1 до 4, алкоксигруппу, алкилендиоксигруппу, бензилоксигруппу, перфторалкильную группу с числом атомов углерода от 1 до 4, нитрогруппу, алкоксикарбонильную группу, карбоксильную группу, галогенфенилтиогруппу, галогенбензоилгруппу, m означает целое число атомов от 0 до 5, их соли с кислотами. Также описываются способы получения соединений I и их применение в качестве антиагрегационных препаратов. Технический результат: получены новые соединения, обладающие полезными биологическими свойствами. 4 c.п. ф-лы, 8 табл.
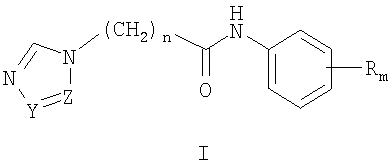
где Z и Y означают атом азота или СН-группу, или одновременно являются цепью С-СН=СН-СН=СН-С, составляющую вместе аннелированное кольцо, n означает целое число от 1 до 3, R одинаковые или разные означают атом водорода, галогена, алкильную группу с числом атомов углерода от 1 до 4, алкоксигруппу, алкилендиоксигруппу, бензилоксигруппу, перфторалкильную группу с числом атомов углерода от 1 до 4, нитрогруппу, алкоксикарбонильную группу, карбоксильную группу, галогенфенилтиогруппу, галогенбензоилгруппу, m означает целое число атомов от 0 до 5, их соли с кислотами.

где Z и Y означают атом азота или СН-группу, или одновременно являются цепью С-СН=СН-СН=СН-С, составляющую вместе аннелированное кольцо, n означает целое число от 1 до 3, R одинаковые или разные означают атом водорода, галогена, алкильную группу с числом атомов углерода от 1 до 4, алкоксигруппу, алкилендиоксигруппу, бензилоксигруппу, перфторалкильную группу с числом атомов углерода от 1 до 4, нитрогруппу, алкоксикарбонильную группу, карбоксильную группу, галогенфенилтиогруппу, галогенбензоилгруппу, m означает целое число атомов от 0 до 5, заключающийся в том, что ω-галогенацилгалогенидами ацилируют замещенные анилины в среде органических растворителей, в присутствии водного раствора гидроксидов или карбонатов щелочных или щелочноземельных металлов при температуре от 0 до 20°С с получением ω-галогенацетанилидов формулы II, где R, m, n имеют те же значения, что и в формуле I, X означает галоген, которые подвергают взаимодействию с азолатами щелочных металлов в среде полярного апротонного растворителя при температуре от 40 до 150°С.
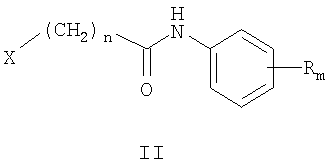

где Z и Y означают атом азота или СН-группу, или одновременно являются цепью С-СН=СН-СН=СН-С, составляющую вместе аннелированное кольцо, n означает целое число от 1 до 3, R одинаковые или разные означают атом водорода, галогена, алкильную группу с числом атомов углерода от 1 до 4, алкоксигруппу, алкилендиоксигруппу, бензилоксигруппу, перфторалкильную группу с числом атомов углерода от 1 до 4, нитрогруппу, алкоксикарбонильную группу, карбоксильную группу, галогенфенилтиогруппу, галогенбензоилгруппу, m означает целое число атомов от 0 до 5, заключающийся в том, что ω-азолилалкановые кислоты формулы III, где n, Z и Y имеют те же значения, что и в формуле I, вводят во взаимодействие с хлорирующими агентами в инертном растворителе при температуре от 20 до 50°С с получением гидрохлоридов хлорангидридов ω-азол-1-илалкановых кислот формулы IV, где n, Z и Y имеют те же значения, что и в формуле I, которыми ацилируют замещенные анилины в среде полярного апротонного растворителя, в присутствии оснований при температуре от 20 до 60°С
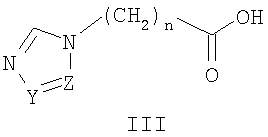

где Z и Y означают атом азота или СН-группу, или одновременно являются цепью С-СН=СН-СН=СН-С, составляющую вместе аннелированное кольцо, n означает целое число от 1 до 3, R одинаковые или разные означают атом водорода, галогена, алкильную группу с числом атомов углерода от 1 до 4, алкоксигруппу, алкилендиоксигруппу, бензилоксигруппу, перфторалкильную группу с числом атомов углерода от 1 до 4, нитрогруппу, алкоксикарбонильную группу, карбоксильную группу, галогенфенилтиогруппу, галогенбензоилгруппу, m означает целое число атомов от 0 до 5, и их солей с кислотами в качестве антиагрегационных препаратов.
| Способ получения производных1-карбамоилимидазола | 1974 |
|
SU509223A3 |
| ГЕТЕРОЦИКЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ АДГЕЗИИ ЛЕЙКОЦИТОВ И VLA-4-АНТАГОНИСТОВ | 1997 |
|
RU2220977C2 |
| RU 94021344 A1, 27.05.1996 | |||
| RU 95107652 A1, 20.03.1997 | |||
| Приспособление для загрузки наружных спичечных коробок в красильную машину | 1958 |
|
SU122693A1 |
| US 3912496 A, 14.10.1975. | |||
Авторы
Даты
2008-04-20—Публикация
2006-09-21—Подача