Изобретение в области биотехнологии относится к микробиологической промышленности и представляет собой способ получения комплексных мультиферментных препаратов с пектинлиазной целлобиогидролазной, эндоглюканазной и β-глюкозидазной (целлобиазной) активностями путем культивирования рекомбинантных штаммов мицелиальных грибов рода Penicillium verruculosum, трансформированных смесью двух плазмид, несущих гены гетерологичных β-глюкозидазы (целлобиазы) из Aspergillus niger и пектинлиазы из Penicillium canescens.
В последние десятилетия применение ферментных препаратов, полученных на основе грибных штаммов-продуцентов, в процессах получения вина, плодово-ягодных соков, джемов, пюре и других продуктов из плодово-ягодного сырья завоевало особую популярность среди производителей в пищевой промышленности.
Ферментативный гидролиз плодово-ягодного сырья происходит под действием карбогидразного комплекса - совокупности ферментов различной специфичности, расщепляющих полисахаридные молекулы с получением олиго- и моносахаридов. Качественный состав ферментных препаратов определяется составом плодово-ягодного сырья. Поскольку к числу основных компонентов плодово-ягодного сырья относятся пектиновые вещества и целлюлоза, то ферментные препараты для его гидролиза должны обладать, в основном, целлюлолитической и пектолитической активностью.
Лучшими продуцентами ферментов-карбогидраз, на сегодняшний день, являются микроскопические грибы, преимущественно относящиеся к родам Trichoderma, Penicillium, а также Aspergillus. Это связано с высоким уровнем секреции внеклеточных ферментов. Причем Trichoderma reesei обладает высокоэффективным комплексом целлюлолитических ферментов [Martinez D. et all. Nat. Biotechnol., 2008, v. 26, №5, page 553-560], в то время как грибы рода Aspergillus секретируют комплекс пектолитических ферментов [Martens-Uzimova E.S. et all. Fungal Genet. Biol., 2009, v. 46, p. 170-179].
Гриб P.verruculosum секретирует целлюлазный ферментный комплекс достаточно сбалансированного состава, основными компонентами которого являются целлобиогидролазы и эндоглюканазы, а также ксиланзы. Комплекс ферментов-карбогидраз данного состава позволяет эффективно осуществлять гидролиз целлюлозной и гемицеллюлозной компонент растительных материалов, в частности, плодово-ягодного сырья. Однако пектолитическая активность ферментного комплекса гриба P.verruculosum низка. В силу особенностей строения клеточной стенки растений с высоким содержанием пектиновых веществ низкая пектолитическая активность ферментных препаратов является существенным фактором, снижающим эффективность гидролиза плодово-ягодного сырья. Следовательно, создание ферментных препаратов с использованием продуцентов пектолитических ферментов, полученных на основе исходного штамма P.verruculosum BI-537 niaD(-), является актуальной задачей.
В качестве целевого пектолитического фермента была выбрана пектинлиаза А из P.canescens. Пектинлиаза (КФ 4.2.2.10, 1-я семья полисахарид-лиаз) катализирует реакцию расщепления α-1,4-D-гликозидной связи между метоксилированными остатками галактуроновой кислоты в составе пектиновых веществ. Этот фермент - один из немногих пектолитических ферментов, воздействующих на этерифицированный гомогалактуронан без предварительной деэтерификации, которая обычно предшествует гидролитическому расщеплению пектина. Поэтому пектинлиаза обеспечивает осветление соков без разрушения летучих эфирных компонентов, придающих соку специфический фруктовый запах.
В отличие от пектинлиаз из A.niger, оптимум активности которых составляет от 6,0 до 8,5 ед рН [Whitaker J.R. Voragen A.G., Wong D.W.S. Handbook of food enzymology. New York, Basel. (2003) 1108 p.], пектинлиаза А из P.canescens обладает более кислым оптимумом рН - 5,0 ед. Поскольку нативный рН фруктов и ягод составляет от 3,3 до 4,0 ед [Belitz H.-D., Grosch W., Schieberle P. Food Chemistry. 2009. Springer-Verlag Berlin Heidelberg, p. 815], то пектинлиаза А из P.canescens обладает большей активностью в условиях гидролиза плодово-ягодного сырья по сравнению с аналогичными ферментами грибов рода Aspergillus. Причем фермент стабилен при рН, близком к нативному рН различных фруктов и ягод. Так, пектинлиаза А из P.canescens после 3 ч инкубирования при рН 4,0 при комнатной температуре сохраняет более 90% активности, а при повышении температуры до 40°С и 50°С активность пектинлиазы сохраняется на уровне 70% и 40% от первоначальной активности. Следовательно, пектинлиаза А из P.canescens является активным и стабильным пектолитическим ферментом в условиях гидролиза плодово-ягодного сырья, а получение ферментных препаратов с высокой пектолитической и целлюлолитической активностями на основе штаммов P.verruculosum, секретирующих гетерологичную пектинлиазу А из P.canescens, является целесообразным.
Известно, что ферментные препараты с β-глюкозидазой способствуют улучшению органолиптических показателей продуктов, изготовленных из плодово-ягодного сырья. Например, под действием β-глюкозидазы происходит высвобождение соединений, способствующих усилению фруктово-цветочной нотки при изготовлении джема из вишни и сливы, β-глюкозидазу также используют для удаления горечи из цитрусовых соков и джемов [Belitz H.-D., Grosch W., Schieberle P. Food Chemistry. 2009. Springer-Verlag Berlin Heidelberg, 1070 р.]. Поэтому β-глюкозидаза в ферментных препаратах для обработки плодово-ягодного сырья является значимым компонентом, а получение ферментных препаратов с высокой β-глюкозидазной активностью также является актуальной задачей.
Таким образом, ферментные препараты для гидролиза плодово-ягодного сырья получают с использованием рекомбинантных штаммов P.verruculosum, трансформированных смесью двух плазмид, несущих гены гетерологичных β-глюкозидазы (целлобиазы) из A.niger и пектинлиазы из P.canescens.
Прототипом разработанного технического решения может служить патент РФ №2378372 «Генетическая конструкция для обеспечения экспрессии целевых гомологичных и гетерологичных генов в клетках мицелиального гриба Penicillium verruculosum, используемого в качестве хозяина, способ получения штамма гриба Penicillium verruculosum и способ получения ферментного препарата». Изобретение относится к биотехнологии и представляет собой способ получения фермента, предпочтительно целлюлазы или ксиланазы, расщепляющих целлюлозу или ксиланы, соответственно, путем культивирования штамма гриба P.verruculosum. При этом указанный штамм получают трансформацией клетки гриба P.verruculosum генетической конструкцией, содержащей целевую кодирующую последовательность фермента, функционально связанную с регуляторными элементами гена целлобиогидролазы I P.verruculosum, которые представляют собой промотор и терминатор гена целлобиогидролазы I, а также сигнальным пептидом соответствующего целевого гена.
Техническая задача, решаемая группой разработанных технических решений, состоит в создании способа получения ферментных препаратов с заданным соотношением ферментов карбогидразного комплекса при ферментации рекомбинантных штаммов, полученных при трансформации реципиентного высокопродуктивного штамма P.verruculosum смесью двух плазмид, несущих гены гетерологичных β-глюкозидазы (целлобиазы) из A.niger и пектинлиазы А из P.canescens.
Технический результат, получаемый при реализации разработанных технических решений, состоит в получении промышленных ферментных препаратов (ФП) сбалансированного состава с высокой пектолитической и целлюлолитической, в частности, β-глюкозидазной, активностью при культивировании новых мультикопийных штаммов грибов рода P.verruculosum, полученных с привлечением методов рекомбинантных ДНК и микробиологии.
Для получения указанного технического результата предложено провести трансформацию мицелиального гриба P.verruculosum, используемого в качестве хозяина, смесью двух плазмид, обеспечивающих экспрессию целевых гетерологичных генов. Целевые плазмиды содержат целевую кодирующую последовательность гена β-глюкозидазы (целлобиазы) из A.niger или пектинлиазы А из P.canescens, функционально связанную с регуляторными элементами, промотором и терминатором, гена целлобиогидролазы I из P.verruculosum.
Для получения указанного технического результата предложено также использовать способ получения штамма гриба P.verruculosum - продуцента карбогидразного комплекса ферментов, кодирующихся нуклеотидной последовательностью генов β-глюкозидазы (целлобиазы) из A.niger или пектинлиазы А из P.canescens, предусматривающей трансформацию клетки гриба P.verruculosum смесью двух плазмид, состоящих из целевой кодирующей последовательности, функционально связанной с регуляторными элементами, промотором и терминатором, гена целлобиогидролазы I P.verruculosum.
Кроме того, для получения указанного технического результата предложено использовать способ получения ферментных препаратов, включающих ферменты карбогидразного комплекса, расщепляющие растительные полисахариды, путем культивирования микроорганизмов, причем ранее указанным способом получают штаммы гриба P.verruculosum, осуществляют культивирование полученных штаммов и выделяют целевой продукт из культуральной жидкости гриба. При реализации указанного способа для получения комплексных ферментного препарата получают штаммы P.verruculosum РВ4 и PB7 (ВКМ F-4586D, ВКМ F-4587D), мультикопийные по гену pelA - пектинлиазы А из P.canescens и гену bglI - β-глюкозидазы (целлобиазы) из A.niger.
Указанные варианты не исчерпывают возможности разработанного способа.
Схема разработки способа получения каждого из ферментных препаратов, обладающего комплексом карбогидразных активностей, складывется из трех типовых этапов.
Этап 1. Амплифицируют целевые гены ферментов карбогидразного комплекса - pelA, кодирующий пектинлиазы А из P.canescens, и bglI, кодирующий β-глюкозидазу (целлобиазу) из A.niger, а также промоторную и терминаторную область гена cbhI P.verruculosum. Конструируют две плазмиды - pPelA и pBG, представляющие собой полинуклеотидные последовательности, состоящие из промоторной области гена cbhl, сигнального пептида соответствующего целевого гена, целевого гена pelA в составе плазмиды pPelA, целевого гена bglI в составе плазмиды pBG и терминаторной области гена cbhI.
Этап 2. Проводят трансформацию реципиентного высокопродуктивного штамма P.verruculosum 537 (niaD-) смесью плазмид pPelA и pBG, полученных на Этапе 1, в условиях котрансформации вместе с плазмидой, несущей последовательность niaD гена, как маркера селекции, и осуществляют отбор трансформантов, секретирующих в культуральную жидкость искомые ферменты карбогидразного комплекса. Проводят ферментацию отобранных трансформантов в качалочных колбах и среди них выбирают наиболее продуктивные варианты штаммов-продуцентов комплекса карбогидраз с искомым соотношением карбогидраз.
Этап 3 - Проводят процесс ферментации отобранного наиболее активных вариантов штаммов-продуцентов в ферментерах, получают и характеризуют ФП с высокой активностью искомых ферментов карбогидразного комплекса.
Целесообразность применения полученных ФП определялась эффективностью их воздействия на различные плодово-ягодные субстраты, позволяющего интенсифицировать процессы извлечения сусла и его дальнейшую обработку в ряде производств пищевой промышленности. Условия ферментативной обработки, в свою очередь, подбирались исходя из возможности получения плодового сусла, максимально сохранявшего вкусовые и ароматические свойства, характерные для используемого растительного сырья.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение целевых плазмид pPelA и pBG заключалось в клонировании генов bglI A.niger [(GenBank AN:DQ220304), 372] и pelA P.canescens в универсальный вектор, обеспечивающий экспрессию целевого гена под контролем промотора и терминатора гена cbhI P.verruculosum [РФ №2378372].
Амплификацию гена bglI и pelA проводили с использованием геномной ДНК A.niger и P.canescens, а также праймеров соответствующего состава:
BGA 5′ CACTGGTGGYGGYRNTGCYACCCCYGTCTACCC 3′
BGB 5′ GTAGTGGTAGCCATCGCAGGTGGCGGAGTA 3′
PELA 5′ CACTGGTGGYGGYRNTGCYACCCCYGTCTACCC 3′
PELB 5′ GTAGTGGTAGCCATCGCAGGTGGCGGAGTA 3′
Последовательность нуклеотидов в праймерах PELA и PELB вычисляют на основе консервативных нуклеотидных последовательностей грибных пектин-лиаз, имеющихся в GenBank Database.
Нуклеотидные последовательности полученных фрагментов определяют методом секвенирования по Сэнгеру по обеим цепям. Общая структура экспрессионных кассет представлена на фиг. 1. Полинуклеотидная последовательность генетических конструкций представлена на фиг. 2.
Первичные аминокислотные последовательности целевых ферментов представлены на фиг. 3.
Пример 2. Трансформация высокопродуктивного штамма-реципиента P.verruculosum 537 (niaD-) смесью плазмид, указанных в Примере 1 для получения набора рекомбинантных штаммов, обладающих карбогидразными активностями.
К смеси трех ДНК (1 мкг котрансформационной плазмиды PSTA10 (несущей ген niaD+ A.niger), 5 мкг плазмиды pPelA (несущей ген pelA из P.canescens) и 5 мкг плазмиды pBG (несущей ген β-глюкозидазы из A.niger)) объемом 20 мкл добавляют 200 мкл раствора протопластов штамма P.verruculosum 537 (niaD-), полученных по методике, описанной в статье [А. Y. Aleksenko, N. A. Makarova, I. V. Nikolaev, A. J. Clutterbuck Integrative and replicative transformation of Pénicillium canescens with a heterologous nitrate-reductase gene, Curr. Genet. - 1995. - V. 28. - P. 474-477] и 50 мкл буфера PCT1, содержащего: 50%-ный ПЭГ 4000 (по объему) + 0.01М трис-HCl рН 7.5 + 0.02М CaCl2. Смесь аккуратно перемешивают и оставляют на 20 мин во льду. Затем добавляют 500 мкл буфера РСТ1 и оставляют на 5 мин при комнатной температуре. Параллельно проводят эксперимент с контрольными протопластами без добавления ДНК. Далее пробирки со смесью протопластов и ДНК центрифугируют при 5000 об/мин в течение 20 мин. Супернатант сливают, а осадок ресуспендируют в 200 мкл стерильного раствора сорбитола (182,2 г/л). Трансформационную смесь стерильно переносят над пламенем горелки в 5 мл верхнего агара (для приготовления 100 мл верхнего агара берут 21,86 г 1,2 M сорбитола, 0,7 г агара, 0,8 г глюкозы, 1 мл 1М источника азота) перемешивают и распределяют агар по поверхности предварительно подготовленных чашек с нижним агаром (для приготовления 100 мл нижнего агара берут 21,86 г 1,2 M сорбитола, 2 г агара, 0,8 г глюкозы, 1 мл 1М источника азота). Так же переносят и контрольные смеси.
Готовят три чашки Петри с нижним агаром, две с селективной средой (источник азота: NaNO3 10 mM) и одна - с неселективной (источник азота: NH4Cl 10 mM). Чашки Петри помещают в инкубатор на 30°С и оставляют там на 6 дней. На шестой день роста трансформанты переносят на селективную минимальную среду (источник азота: NaNO3 10 mM). В результате трансформации реципиентного штамма P.verruculosum 537 смесью плазмид получают около 90 трансформантов на 10 мкг введенной целевой ДНК, что соответствует стандартной частоте трансформации грибных штаммов.
Для определения наличия встроенного экзогенного генетического материала в хромосому рекомбинантных штаммов проводят первичный скрининг трансформантов с использованием ПЦР-реакции. Поскольку целевая плазмида pBG содержит гетерологичный ген β-глюкозидазы (целлобиазы), то скрининг гена bglI осуществляют с использованием пары праймеров BGA и BGB. Полученный ПЦР-продукт, анализируемый методом электрофореза в агарозном геле, должен иметь размер ~3000 п.н., что соответствует размеру полинуклеотидной последовательности гена bglI из A.niger. Аналогичным образом скрининг гена pelA осуществляют с использованием пары праймеров PELA и PELB, получая ПЦР-продукт размером ~1500 п.н.
Пример 3. Получение ФП рекомбинантных штаммов РВ4 и PB7 P.verruculosum, мультикопийного по pelA гену пектинлиазы А из P.canescens (1-е семейство полисахарид-лиаз, молекулярная масса 38 кДа) и bglI гену β-глюкозидазы (целлобиазы) из A.niger (3-е семейство гликозид-гидролаз, молекулярная масса 120 кДа).
Полученные в Примере 2 позитивные по генам bglI и pelA трансформанты пересевают на чашки с минимальной средой и источником азота NaNO3 и инкубируют при 30°С в течение 140 часов до образования конидий. Затем трансформанты ферментируют в качалочных колбах, используя водную ферментационную среду следующего состава, в г/л: МКЦ - 40, пшеничные отруби - 10, дрожжевой экстракт - 10, (NH4)2SO4 - 5, KН2РО4 - 5, MgSO4×7H2O - 0,3, CaCl2×2H2O - 0,3, рН 4,5. Колбы инкубируют на качалке при 32°С и 200 об/мин в течение 144 ч. Далее отбирают трансформанты с увеличенной по сравнению с реципиентным штаммом P.verruculosum 537 пектинлиазной и β-глюкозидазной (целлобиазной) активностью.
Для отобранных штаммов определяют в культуральной жидкости (КЖ) активности по следующим субстратам: пектин цитрусовый (степень этерификации (СЭ) ~70%, растворимый субстрат), МКЦ (микрокристаллическая целлюлоза, нерастворимый субстрат), КМЦ (Na-соль карбоксиметилцеллюлозы, растворимый субстрат), глюкуроноксилану березы, ПНФГ (п-нитрофенил-β-D-глюкопиранозид). Активность по отношению к пектину цитрусовому (пектинлиазная активность, характеризует активность пектинлиазы) определяют при 40°С и рН=5,0 по начальной скорости образования Δ-4,5-ненасыщенного продукта реакции, регистрируя изменение оптической плотности реакционной смеси при 232 нм. Активность по отношению к МКЦ (авицелазная активность, характеризует активность целлобиогидролаз) определяют при 40°С и рН=5,0 по начальной скорости образования восстанавливающих сахаров (ВС). Активность по отношению к КМЦ (характеризует активность целлюлаз, преимущественно эндоглюканаз) и к глюкуроноксилану березы (характеризует активность ксиланаз) определяют при 50°С и рН=5,0 по начальной скорости образования ВС. Концентрация полисахаридных субстратов в реакционной смеси составляет 5 г/л. Концентрацию ВС определяют методом Шомоди-Нельсона [M. Somogui, 1945, JBC, №61, p 160].
Активность по пНФГ (характеризует активность β-глюкозидаз / целлобиаз) определяют по начальной скорости образования п-нитрофенола (ПНФ). Раствор 0,05 M субстрата в 0,1 М, Na-ацетатном буфере, рН 5,0, инкубируют с ферментом при 40°С в течение 10 мин. Реакцию останавливают добавлением раствора 1М Na2CO3. Образовавшийся в растворе ПНФ определяли спектрофотометрически при длине волны 400 нм, используя коэффициент молярного поглощения (ε=18300 моль*см-1).
Активность ферментов выражают в международных единицах: 1 единица соответствует образованию 1 мкмоль продукта за 1 мин при действии ферментов на соответствующий субстрат.
Для КЖ проводят ДДС-электрофорез в денатурирующих условиях для идентификации полос, соответствующих зонам, занимаемым пектинлиазой (38 кДа), целлобиогидролазой I (66 кДа), эндоглюканазой II (40 кДа) и β-глюкозидазой (120 кДа).
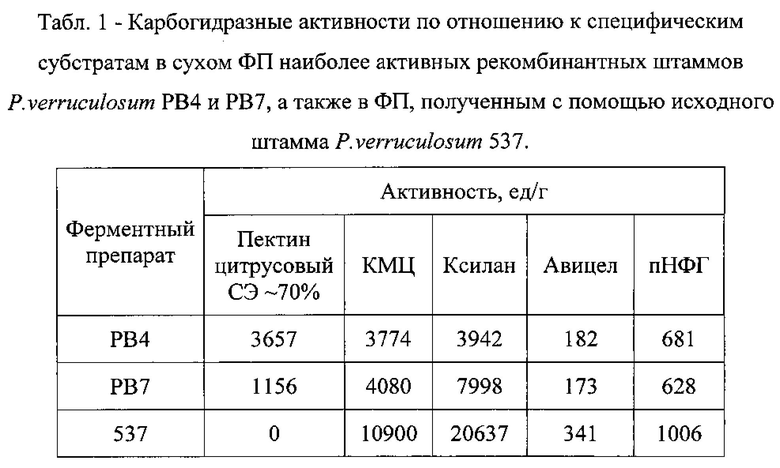
Проводят ферментацию наиболее продуктивных трансформантов P.verruculosum РВ4 и РВ7 (ВКМ F-4586D, ВКМ F-4587D) в 10-литровом ферментере, используя питательную среду того же состава, что в качалочных колбах, и проводя подпитку глюкозой, при рН 4,5 и 32°С в течение 144 час. После окончания ферментации с помощью ультрафильтрации КЖ на полых волокнах (с пределом отсечения 10 кDa) и последующего лиофильного высушивания получают сухой ФП и характеризуют их по уровню карбогидразных активностей (см. Табл. 1).
Карбогидразные активности отобранных наиболее активных трансформантов P.verruculosum РВ4 и PB7 (ВКМ F-4586D, ВКМ F-4587D) в КЖ после ферментации в 10-литровом ферментере составляют: 110 и 66 ед/мл пектинлиазной активности, 80 и 460 ед/мл ксиланазной активности, 133 и 325 ед/мл КМЦ-азной активности, 49 и 37 ед/мл β-глюкозидазной активности, соответственно. Активности полученных ферментных препаратов приведены в Табл. 1.
Пример 4. Получение сладкого виноградного сусла как полупродукта винодельческого производства с использованием ферментных препаратов РВ7, 537, а также без добавления ферментного препарата.
Виноградное сусло получали из технических сортов винограда «Ркацители» и «Каберне Совиньон» в соответствии с принципиальными технологическими схемами, представленными в Табл. 2.
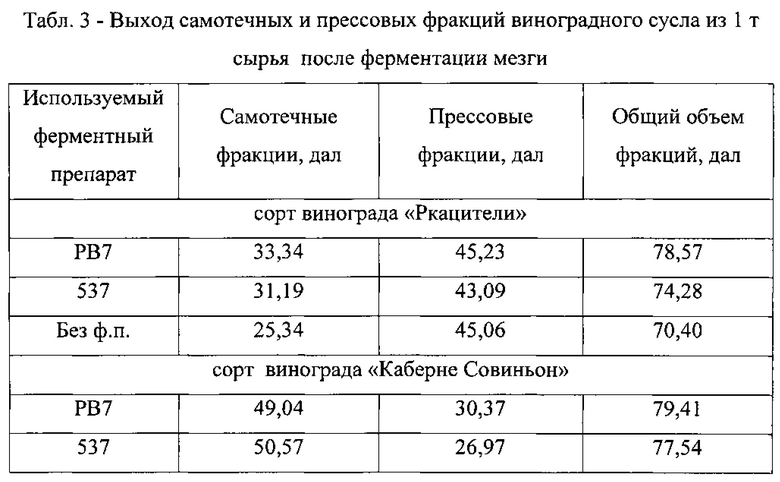
K2S2O5 вносили в образцы, растворяя его в небольшом количестве сусла. Ферментный препарат PB 7 обеспечивал наибольший выход самотечных фракций виноградного сусла после 1 часа обработки мезги при дозировке 0,03% от массы сырья (дозировка рассчитывалась исходя из содержания общего белка в сухом ФП).
В ходе работы велся контроль выхода самотечных и прессовых фракций сусла из образцов, по результатам которого можно судить о преимуществах обработки виноградной мезги ФП.
Анализируя данные, представленные в Табл. 3, можно заключить, что при ферментативной обработке виноградной мезги увеличивается выход самотечных фракций сусла, отличающихся наиболее высоким качеством (низкая массовая концентрация взвесей в сусле), а также общий выход сусла из мезги, что говорит о мацерирующем эффекте ФП.
Пример 5. Получение сусла из рябины сортов «Сказочная» и «Черноокая» как полупродукта соковой промышленности с использованием ферментных препаратов РВ4, 537, а также без добавления ферментного препарата.
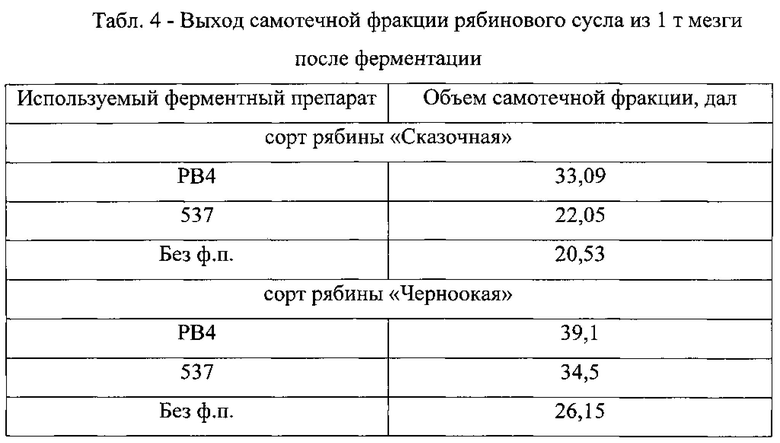
Мацерацию проводили в стандартных условиях при 40°С, титруемой кислотности 6,8 г/л и 900 об/мин в соответствии с принципиальной технологической схемой, представленной в Табл. 2. Через 3 часа определяли выход сока-самотека из субстрата через бумажный складчатый фильтр.
Каждая проба включала в себя рябиновое пюре, раствор ферментного препарата, дистиллированную воду. Разбавление пробы соответствовало заданной титруемой кислотности. Дозировка ферментных препаратов составляла 0,05% от массы субстрата и рассчитывалась с учетом содержания в препаратах общего белка.
В Табл. 4 представлены результаты контроля выхода самотечных фракций из образцов, исходя из которых можно судить о мацерирующих способностях ФП РВ4, позволившего увеличить выход сусла из рябиновой мезги на 50% в сравнении с контрольными образцами, не проходившими ферментативную обработку.
Приведенные параметры обработки растительного сырья были выбраны в результате предварительных экспериментов как наиболее оптимальные с точки зрения экономической эффективности и сохранения высокого качества получаемого полупродукта.
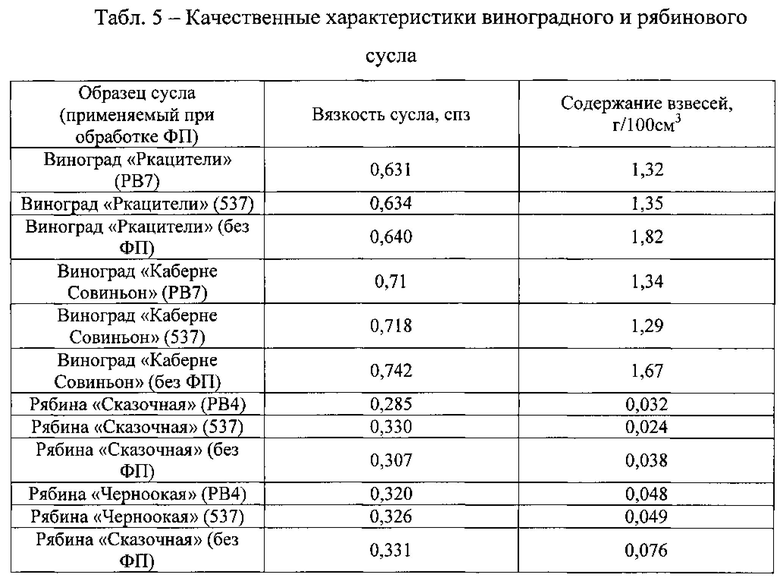
Пример 6. Определение вязкости сусла и содержания в нем взвесей после ферментативной обработки, как качественных характеристик полупродукта.
Самотечные и прессовые фракции виноградного сусла объединяли, после чего измеряли вязкость общего сусла и содержание в нем взвесей. Также эти параметры определяли в рябиновом сусле, прошедшем через складчатый фильтр.
Для определения вязкости образцы сусла предварительно центрифугировали при 8000 об/мин в течение 20 мин. Вискозиметр Оствальда термостатировали при 40°C, вносили 5 см3 анализируемого раствора и инкубировали 5 мин. Определяли время истечения раствора в трех повторностях, отличающихся не более чем на 0,1 секунды. Между определениями вискозиметр промывали дистиллированной водой и ацетоном.
Вязкость сока определяли в сП, исходя из калибровочного графика, построенного с использованием воды, ацетона, изобутанола и н-бутанола.
Содержание взвесей определяли гравиметрически, отделяя их центрифугированием.
В предварительно взвешенные центрифужные пробирки помещали по 5 см образца и центрифугировали при частоте вращения 8000 об/мин в течение 20 мин. Осветленный раствор сливали, оставляя пробирки с осадком в течение 3 дней высушиваться. Сухой осадок вместе с пробиркой взвешивали с точностью до четвертого знака.
Содержание взвесей рассчитывали по формуле:
C=(m2-m1)*100/V, где
m2 - масса центрифужной пробирки с осадком взвесей, г;
m1 - масса пустой центрифужной пробирки, г;
V - объем пробы, см3.
Результаты контроля данных качественных показателей полупродуктов винодельческой и соковой промышленности (Табл. 5) подтвердили положительный эффект, оказываемый используемыми ФП в процессе их получения.


| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕНЕТИЧЕСКАЯ ФЬЮЖН-КОНСТРУКЦИЯ ДЛЯ ОБЕСПЕЧЕНИЯ ЭКСПРЕССИИ МУЛЬТИФЕРМЕНТНОГО КОМПЛЕКСА КАРБОГИДРАЗ В КЛЕТКАХ МИЦЕЛИАЛЬНОГО ГРИБА Penicillium verruculosum, ИСПОЛЬЗУЕМОГО В КАЧЕСТВЕ ХОЗЯИНА, СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ШТАММА ГРИБА Penicillium verruculosum И СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА НА ЕГО ОСНОВЕ | 2013 |
|
RU2550044C2 |
| ШТАММ ГРИБА PENICILLIUM VERRUCULOSUM ПРОДУЦЕНТ КОМПЛЕКСА ФИТАЗЫ А И ЭНДО-1,4-β-ГЛЮКАНАЗЫ II И ФЕРМЕНТНЫЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ ДОБАВКИ В КОРМАХ | 2022 |
|
RU2810538C2 |
| РЕКОМБИНАНТНЫЙ ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM CANESCENS CL14, ПРОДУЦИРУЮЩИЙ КОМПОНЕНТ ЦЕЛЛЛЮЛОСОМЫ CLOSTRIDIUM THERMOCELLUM, И СПОСОБ ЕГО КУЛЬТИВИРОВАНИЯ | 2016 |
|
RU2646132C1 |
| ШТАММ ГРИБА PENICILLIUM VERRUCULOSUM ПРОДУЦЕНТ КОМПЛЕКСА ФИТАЗЫ А И ЭНДО-1,4-β-КСИЛАНАЗЫ Е И ФЕРМЕНТНЫЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ ДОБАВКИ В КОРМАХ | 2023 |
|
RU2819918C1 |
| ШТАММ ГРИБА PENICILLIUM CANESCENS mtCBHI ПРОДУЦЕНТ ТЕРМОСТАБИЛЬНОЙ ЦЕЛЛОБИОГИДРОЛАЗЫ I И ФЕРМЕНТНЫЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ БИОКОНВЕРСИИ ВОЗОБНОВЛЯЕМОГО РАСТИТЕЛЬНОГО СЫРЬЯ В САХАРА | 2019 |
|
RU2741078C1 |
| ШТАММ ГРИБА Penicillium verruculosum B10 EGII ПРОДУЦЕНТ ЭНДО-1.3/1.4-β-ГЛЮКАНАЗЫ, ЦЕЛЛЮЛАЗЫ, β-ГЛЮКОЗИДАЗЫ И КСИЛАНАЗЫ И СПОСОБ ПОЛУЧЕНИЯ КОРМОВОГО КОМПЛЕКСНОГО ФЕРМЕНТНОГО ПРЕПАРАТА | 2012 |
|
RU2532840C2 |
| ШТАММ ГРИБА PENICILLIUM VERRUCULOSUM MX-73 ПРОДУЦЕНТ МОДИФИЦИРОВАННОЙ КСИЛАНАЗЫ Е С ПОВЫШЕННОЙ ТЕРМОСТАБИЛЬНОСТЬЮ, ФЕРМЕНТНЫЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В ПИЩЕВОЙ И КОРМОВОЙ ПРОМЫШЛЕННОСТИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2018 |
|
RU2711578C1 |
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM VERRUCULOSUM - ПРОДУЦЕНТ КОМПЛЕКСА ЦЕЛЛЮЛАЗ, КСИЛАНАЗЫ И КСИЛОГЛЮКАНАЗЫ И СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА КОМПЛЕКСА ЦЕЛЛЮЛАЗ, КСИЛАНАЗЫ И КСИЛОГЛЮКАНАЗЫ ДЛЯ ГИДРОЛИЗА ЦЕЛЛЮЛОЗЫ И ГЕМИЦЕЛЛЮЛОЗЫ | 2008 |
|
RU2361918C1 |
| ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ ДЛЯ ОБЕСПЕЧЕНИЯ ЭКСПРЕССИИ ЦЕЛЕВЫХ ГОМОЛОГИЧНЫХ И ГЕТЕРОЛОГИЧНЫХ ГЕНОВ В КЛЕТКАХ МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM VERRUCULOSUM, ИСПОЛЬЗУЕМОГО В КАЧЕСТВЕ ХОЗЯИНА, СПОСОБ ПОЛУЧЕНИЯ ШТАММА ГРИБА PENICILLIUM VERRUCULOSUM И СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА | 2008 |
|
RU2378372C2 |
| ШТАММ ГРИБА PENICILLIUM VERRUCULOSUM B6/PMO-BG-25 И СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСНОГО ФЕРМЕНТНОГО ПРЕПАРАТА β-ГЛЮКОЗИДАЗЫ, ЦЕЛЛОБИОГИДРОЛАЗЫ И ПОЛИСАХАРИДМОНООКСИГЕНАЗЫ НА ЕГО ОСНОВЕ ДЛЯ БИОКОНВЕРСИИ ЦЕЛЛЮЛОЗОСОДЕРЖАЩИХ МАТЕРИАЛОВ | 2024 |
|
RU2836771C1 |




Группа изобретений относится к биотехнологии. Предложены рекомбинантные штамм гриба Penicillium verruculosum ВКМ F-4587D и штамм гриба Penicillium verruculosum ВКМ F-4586D, являющиеся продуцентами высокоактивного комплекса целлюлолитических ферментов гриба P. verruculosum и гетерологичных β-глюкозидазы из A. niger и пектинлиазы А из P. canescens. Штамм P. verruculosum ВКМ F-4587D и штамм P. verruculosum ВКМ F-4586D обладают соответственно сходной или преимущественной ферментативной активностью по березовому ксилану и пектину цитрусовому со степенью этерификации 70%. Предложены варианты способа получения ферментного препарата, обладающего ксиланолитической и пектолитической активностями, заключающийся в культивировании либо штамма P. verruculosum ВКМ F-4587D, либо штамма P. verruculosum ВКМ F-4586D. Ферментный препарат на основе штамма P. verruculosum ВКМ F-4587D или на основе штамма P. verruculosum ВКМ F-4586D используют соответственно в способах получения сусла из черноплодной рябины или винограда. Группа изобретений обеспечивает получение ферментных препаратов с высокими пектолитической и целлюлолитической активностями. 6 н.п. ф-лы, 3 ил., 5 табл., 6 пр.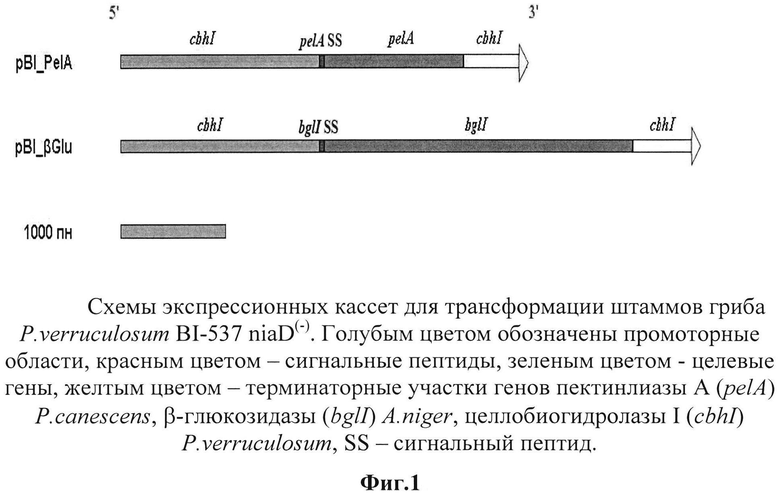
1. Рекомбинантный штамм гриба Penicillium verruculosum ВКМ F-4587D - продуцент высокоактивного комплекса целлюлолитических ферментов гриба Penicillium verruculosum и гетерологичных β-глюкозидазы (целлобиазы) из Aspergillus niger и пектинлиазы А из Penicillium canescens, обладающий сходной ферментативной активностью по березовому ксилану и пектину цитрусовому со степенью этерификации 70%.
2. Рекомбинантный штамм гриба Penicillium verruculosum ВКМ F-4586D - продуцент высокоактивного комплекса целлюлолитических ферментов гриба Penicillium verruculosum и гетерологичных β-глюкозидазы (целлобиазы) из Aspergillus niger и пектинлиазы А из Penicillium canescens, обладающий преимущественной ферментативной активностью по березовому ксилану и наличием гетерологичной активности по пектину цитрусовому со степенью этерификации 70%.
3. Способ получения ферментного препарата, обладающего ксиланолитической и пектолитической активностями, и заключающийся в культивировании штамма гриба Penicillium verruculosum ВКМ F-4587D, по п 1.
4. Способ получения ферментного препарата, обладающего ксиланолитической и пектолитической активностями, и заключающийся в культивировании штамма гриба Penicillium verruculosum ВКМ F-4586D, по п. 2.
5. Способ получения сусла из черноплодной рябины, заключающийся в ферментативном гидролизе растительного сырья рябины черноплодной ферментным препаратом, полученным по п. 3.
6. Способ получения виноградного сусла, заключающийся в ферментативном гидролизе растительного сырья винограда ферментным препаратом, полученным по п. 4.
| БУШИНА Е.В | |||
| Новые высокоэффективные ферментные препараты для гидролиза пектин- и целлюлозосодержащих субстратов на основе рекомбинантных штаммов грибов рода Penicillium | |||
| Автореферат диссертации на соискание ученой степени кандидата химических наук | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ ДЛЯ ОБЕСПЕЧЕНИЯ ЭКСПРЕССИИ ЦЕЛЕВЫХ ГОМОЛОГИЧНЫХ И ГЕТЕРОЛОГИЧНЫХ ГЕНОВ В КЛЕТКАХ МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM VERRUCULOSUM, ИСПОЛЬЗУЕМОГО В КАЧЕСТВЕ ХОЗЯИНА, СПОСОБ ПОЛУЧЕНИЯ ШТАММА ГРИБА PENICILLIUM VERRUCULOSUM И СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА | 2008 |
|
RU2378372C2 |
| ПРАВИЛЬНИКОВ А.Г | |||
| Состав и | |||
Авторы
Даты
2016-02-10—Публикация
2014-10-02—Подача