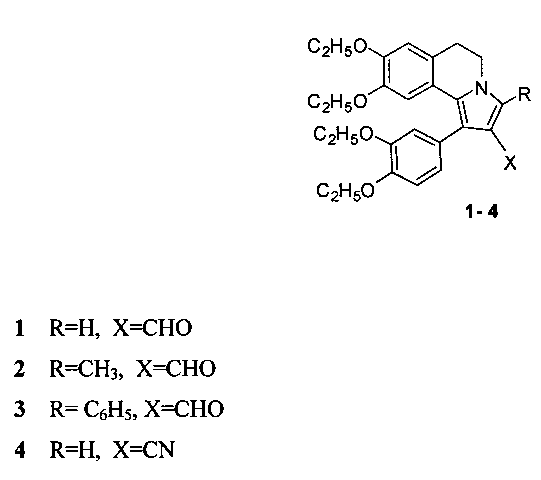
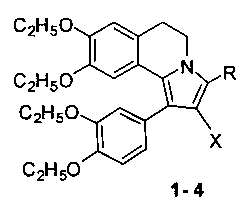
Изобретение относится к новому способу получения соединений с общей структурной формулой 1-4:
Синтез близких по строению соединений описан в N.N. Poligalova, A.G. Mikhailovskii, Е.V. Vikhareva, М.I. Vakhrin. Enamines of the 1,2,3,4-tetrahydroisoquinolines series in the Chichibabin synthesis of pyrrolo[2,1-a]isoquinolines and in reaction with oxalil chloride. Chemistry of Heterocyclic Compounds, 2007, Vol. 43, №7, 900-905: 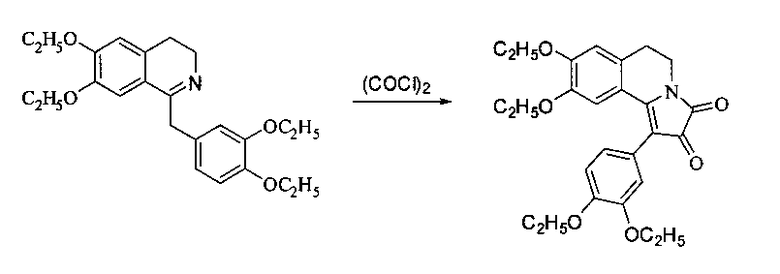 ,
,
а также в работе: Shun Su, John А. Porco и др. Synthesis of Pyrrolo-isoquinolines Related to the Lamellaris Using Silver-Catalyzed Cycloisomerisation/Dipolar Cycloaddition. Journal of American Chemical Societe, 2007, Vol. 129, №25, 7744-7745:
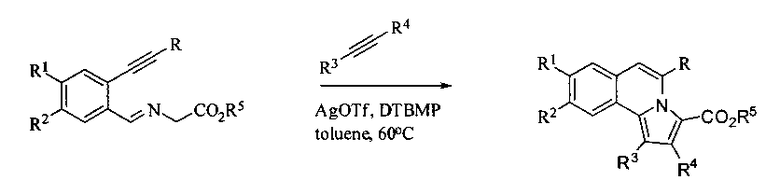 .
.
Описан синтез производных пирролоизохинолинов, являющихся ингибиторами топоизомеразы и проявляющих цитотоксическую активность в культурах с человеческими раковыми клетками: Samaneh Kakhki, Sorayya Shahosseini, Afshin Zarghi. Desing, Synthesis and Cytotoxity Evaluation of New 2-Aryl-5,6-Dihydropyrrolo[2,1-a]Isoquinoline Derivatives as Topoisomerase Inhibitors. Iranian Journal of Pharmaceutical Research (2014), 71-77.
Техническим результатом, на решение которого направлено изобретение, является разработка нового способа синтеза производных 5,6-дигидропирроло[2,1-а]изохинолинов, содержащих в положении 2 функциональную группу.
Технический результат достигается тем, что способ получения производных 5,6-дигидропирроло[2,1-а]изохинолинов с общей структурной формулой:
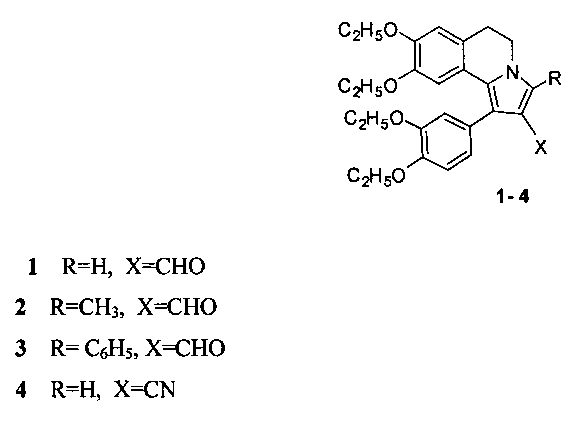
заключается в том, что 6,7-диэтокси-3,4-дигидро-1-(3,4-диэтоксибензоил)изохинолин растворяют в трифторэтаноле и добавляют акролеин, или кротоновый альдегид, или коричный альдегид, или акрилонитрил и перемешивают при температуре +70°С, остаток, полученный после окончания реакции и удаления реагентов, кристаллизуют в смеси эфира с гексаном.
Таким образом, предложенный способ позволяет действием акролеина, или кротонового альдегида, или коричного альдегида, или акрилонитрила на 6,7-диэтокси-3,4-дигидро-1-(3,4-диэтоксибензоил)изохинолин в трифторэтаноле получать 2-функциональнозамещенные производные 5,6-дигидропирроло[2,1-a]изохинолинов 1-4.
Способ осуществляется следующим образом. К раствору 6,7-диэтокси-3,4-дигидро-1-(3,4-диэтоксибензоил)изохинолина (1 моль) в трифторэтаноле добавляют 1,2 моль акролеина или кротонового альдегида, или коричного альдегида, или акрилонитрила, далее перемешивают при температуре +70°С. Ход реакции контролируют с помощью тонкослойной хроматографии на сорбфиле. Время реакции составляет 2 дня. После окончания реакции растворитель упаривают досуха, полученный остаток кристаллизуют в смеси эфира с гексаном. Таким образом, производные 5,6-дигидропирроло[2,1-а]изохинолинов 1-4 получают из 6,7-диэтокси-3,4-дигидро-1-(3,4-диэтоксибензоил)изохинолина при взаимодействии с акролеином, или кротоновым альдегидом, или коричным альдегидом, или акрилонитрилом при температуре +70°С:
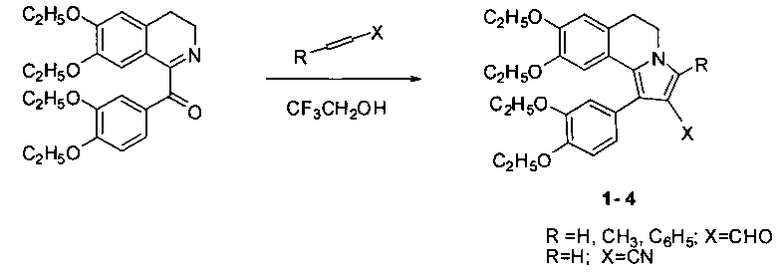
Выходы соединений 1-4 колеблются от 42 до 83% и зависят от природы алкена.
Строение полученных соединений подтверждено методами масс-спектрометрии, ИК спектроскопии и спектроскопии ПМР.
Пример №1
К раствору 0,15 г (0,36 ммоль) 6,7-диэтокси-3,4-дигидро-1-(3,4-диэтоксибензоил)изохинолина в 5 мл трифторэтанола добавляют 0,024 г (0,43 ммоль) акролеина. Реакцию проводят при 70°С в течение 2 дней. Контроль хода реакции осуществляют с помощью ТСХ (sorbfil, этилацетат-гексан, 2:1). Растворитель упаривают, полученную реакционную массу кристаллизуют в смеси эфира с гексаном. Получают 0,134 г соединения 1 в виде кристаллов белого цвета.
1-(3,4-Диэтоксифенил)-8,9-диэтокси-5,6-дигидропирроло[2,1-a]изохинолин-2-карбальдегид (1): выход 83%, белые кристаллы с т.пл. 107-109°С, Rf 0,58 (sorbfil, этилацетат-гексан, 1:1). ИК спектр, υ/см-1: 1661 (СО). Спектр 1Н ЯМР (CDCl3, 400 МГц): δ=1.18 (т, 3Н, J=6.9 Гц, О-CH2-СН 3), 1.37-1.44 (м, 6Н, О-СН2-СН 3), 146 (т, 3Н, J=6.9 Гц, О-CH2-CH 3), 3.01 (т, 2Н, J=6.2 Гц, 6-СН2), 3.59 (кв, 2Н, J=6.9 Гц, О-СН 2-СН3), 4.00-4.08 (м, 4Н, О-СН 2-СН3), 4.10 (т, 2Н, J=6.2 Гц, 5-СН2), 4.13 (кв, 2Н, J=6.9 Гц, O-СН 2-СН3), 6.65 (с, 1Н, 7-Н), 6.81 (с, 1Н, 10-Н), 6.89-6.98 (м, 3Н, СН-Ar), 7.37 (с, 1H, 3-Н), 9.61 (с, 1H, СНО). Найдено: С 72.34%, Н 7.02%, N 3.23%. M+ 449 (EI MS, 70 эВ). Вычислено: С 72.14%, H 6.95%, Ν 3.11%. C27H31NO5. M 449.
Пример №2
К раствору 0,15 г (0,36 ммоль) 6,7-диэтокси-3,4-дигидро-1-(3,4-диэтоксибензоил)изохинолина в 5 мл трифторэтанола добавляют 0,030 г (0,43 ммоль) кротонового альдегида. Реакцию проводят при 70°С в течение 2 дней. Контроль хода реакции осуществляют с помощью ТСХ, (sorbfil, этилацетат-гексан, 2:1). Растворитель упаривают, полученную реакционную массу кристаллизуют в смеси эфира с гексаном. Получают 0,070 г соединения 2 в виде кристаллов белого цвета.
1-(3,4-Диэтоксифенил)-8,9-диэтокси-3-метил-5,6-дигидропирроло[2,1-а]изохинолин-2-карбальдегид (2): выход 42%, белые кристаллы с т.пл. 123-124°С, Rf 0,48 (sorbfil, этилацетат-гексан, 2:1). ИК спектр, υ/см-1: 1654 (СО). Спектр 1Н ЯМР (CDCl3, 400 МГц): δ=1.18 (т, 3Н, J=6.9 Гц, O-CH2-CH 3), 1.38-1.45 (м, 6Н, О-СН2-CH 3), 1.48 (т, 3Н, J=6.9 Гц, О-СН2-СН 3). 2.64 (с, 3Н, 3-СН3), 3.01 (т, 2Н, J=6.2 Гц, 6-СН2), 3.60 (кв, 2Н, J=6.9 Гц, O-СН 2-СН3), 3.99 (т, 2Н, J=6.2 Гц, 5-СН2), 4.02-4.10 (м, 4Н, O-CH 2-CH3), 4.14 (кв, 2Н, J=6.9 Гц, О-CH 2-СН3), 6.61 (с, 1Н, 7-Н), 6.69 (с, 1H, 10-Н), 6.89-6.99 (м, 3Н, СН-Ar), 9.65 (с, 1Н, СНО). Найдено: С 72.62%, H 7.15%, N 3.08%. Масс-спектр, m/z: М+ 463 (EI MS, 70 эВ). Вычислено: С 72.55%, H 7.18%, N 3.02%. C28H33NO5. M 463.
Пример №3
К раствору 0,15 г (0,36 ммоль) 6,7-диэтокси-3,4-дигидро-1-(3,4-диэтоксибензоил)изохинолина в 5 мл трифторэтанола добавляют 0,056 г (0,43 ммоль) коричного альдегида. Реакцию проводят при 70°С в течение 2 дней. Контроль хода реакции осуществляют с помощью ТСХ, (sorbfil, этилацетат-гексан, 2:1). Растворитель упаривают, полученную реакционную массу кристаллизуют в смеси эфира с гексаном. Получают 0,102 г соединения 3 в виде кристаллов белого цвета.
1-(3,4-Диэтоксифенил)-8,9-диэтокси-3-фенил-5,6-дигидропирроло[2,1-а]изохинолин-2-карбальдегид (3): выход 54%, белые кристаллы с т.пл. 131-134°С, Rf 0,58 (sorbfil, этилацетат-гексан, 2:1). ИК спектр, υ/см-1: 1665 (СО). Спектр 1Н ЯМР (CDCl3, 400 МГц): δ=1.21 (т, 3Н, J=6.9 Гц, О-CH2-CH 3), 1.39-1.48 (м, 6Н, O-СН2-CH 3), 1.49 (т, 3Н, J=6.9 Гц, O-СН2-СН 3), 2.96 (т, 2Н, J=6.4 Гц, 6-СН2), 3.62 (кв, 2Н, J=6.9 Гц, O-СН 2-CH 3), 3.98 (т, 2Н, J=6.4 Гц, 5-СН2), 4.09 (кв, 4Н, J=6.9 Гц, O-СН 2-СН3), 4.16 (кв, 2Н, J=6.9 Гц, O-СН 2-CH 3), 6.67 (с, 1Н, 7-Н), 6.70 (с, 1Н, 10-Н), 6.93-7.00 (м, 2Н, СН-Ar), 7.02 (с, 1H, СН-Ar), 7.43-7.55 (м, 5Н, С6Н5), 9.66 (с, 1Н, СНО). Найдено: С 75.35%, Η 6.78%, N 2.69%. Масс-спектр, m/z: М+ 525 (EI MS, 70 эВ). Вычислено: С 75.40%, H 6.71%, N 2.66%. C33H35NO5. M 525.
Пример №4
К раствору 0,15 г (0,36 ммоль) 6,7-диэтокси-3,4-дигидро-1-(3,4-диэтоксибензоил)изохинолина в 5 мл трифторэтанола добавляют 0,028 г (0,43 ммоль) акрилонитрила. Реакцию проводят при 70°С в течение 2 дней. Контроль хода реакции осуществляют с помощью ТСХ, (sorbfil, этилацетат-гексан, 2:1). Растворитель упаривают, полученную реакционную массу кристаллизуют в смеси эфира с гексаном. Получают 0,117 г соединения 4 в виде кристаллов белого цвета.
1-(3,4-Диэтоксифенил)-8,9-диэтокси-5,6-дигидропирроло[2,1-а]изохинолин-2-карбонитрил (4): выход 73%, белые кристаллы с т.пл. 125-127°С. Rf 0,56 (sorbfil, этилацетат-гексан, 2:1). ИК спектр, υ/см-1: 2219 (CN). Спектр 1Н ЯМР (CDCl3, 400 МГц): δ=1.21 (т, 3Н, J=6.9 Гц, О-CH2-СН 3), 1.39-1.48 (м, 9Н, O-СН2-CH 3), 3.01 (т, 2Н, J=6.2 Гц, 6-СН2), 3.62 (кв, 2Н, J=6.9 Гц, О-CH 2-СН3), 4.03-4.09 (м, 6Н, O-СН 2-CH 3, 5-СН2), 4.12 (кв, 2Н, J=6.9 Гц, O-CH 2-CH3), 6.68 (с, 1Н, 7-Н), 6.81 (с, 1Н, 10-Н), 6.89-7.02 (м, 1H, СН-Ar), 6.97-7.01 (м, 2Н, СН-Ar), 7.17 (с, 1H, 3-Н). Найдено: С 72.62%, H 6.77%, Ν 6.27%. M+ 446 (EI MS, 70 эВ). Вычислено: С 72.62%, Η 6.77%, Ν 6.27%. C27H30N2O4. M 446.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5,6-ДИГИДРОПИРРОЛО[2,1-a]ИЗОХИНОЛИНОВ | 2014 |
|
RU2550366C1 |
| Способ получения производных пирроло[2,1-a]изохинолинов | 2017 |
|
RU2656225C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ХРОМАН-2-АМИНОВ | 2016 |
|
RU2652119C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 3,5-ДИГИДРО-1,11-ДИМЕТИЛФУРО[2`,3`:3,4]ЦИКЛОГЕПТА[C]ИЗОХИНОЛИН-5-ОНА | 2005 |
|
RU2282632C1 |
| [1,2,4]Триазоло[3,4-b][1,3,4]тиадиазины, проявляющие активность против вируса гриппа А, и способ их получения | 2022 |
|
RU2824814C2 |
| Способ получения замещенных 3-арилпирролов | 2024 |
|
RU2831117C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1,2-ДИГИДРОПИРРОЛО[1,2-a]ПИРАЗИН-3(4Н)-ОНА | 2012 |
|
RU2490271C1 |
| 7-АЦИЛАМИНОЦЕФАЛОСПОРИНЫ, ЗАМЕЩЕННЫЕ В ПОЛОЖЕНИИ 3 ЦИКЛИЧЕСКИМИ АМИНОГУАНИДИНОВЫМИ ГРУППАМИ | 1999 |
|
RU2245884C2 |
| ПРОИЗВОДНЫЕ 2-ИМИНОПИРРОЛИДИНА | 2002 |
|
RU2270192C2 |
| СЕЛЕКТИВНЫЕ ПРОТИВОТУБЕРКУЛЕЗНЫЕ АГЕНТЫ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ ЗАМЕЩЕННЫЕ 7-АРИЛ(ГЕТЕРИЛ)-6-КАРБЭТОКСИ-4,7-ДИГИДРО-1,2,4-ТРИАЗОЛО[1,5-a]ПИРИМИДИНЫ ИЛИ ЗАМЕЩЕННЫЕ 7-АРИЛ(ГЕТЕРИЛ)-4,7-ДИГИДРО-6-НИТРО-1,2,4-ТРИАЗОЛО[1,5-a]ПИРИМИДИНЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ АДДИТИВНЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 7-АРИЛ(ГЕТЕРИЛ)-6-КАРБЭТОКСИ-5-МЕТИЛ-4,7-ДИГИДРО-1,2,4-ТРИАЗОЛО[1,5-a]ПИРИМИДИНОВ | 2007 |
|
RU2360905C2 |
Изобретение относится к новому способу синтеза производных 5,6-дигидропирроло[2,1-a]изохинолинов, содержащих в положении 2 функциональную группу. Способ заключается в том, что 6,7-диэтокси-3,4-дигидро-1-(3,4-диэтоксибензоил)изохинолин растворяют в трифторэтаноле и добавляют акролеин, или кротоновый альдегид, или коричный альдегид, или акрилонитрил и перемешивают при температуре +70°С, остаток, полученный после окончания реакции и удаления реагентов, кристаллизуют в смеси эфира с гексаном. 4 пр.
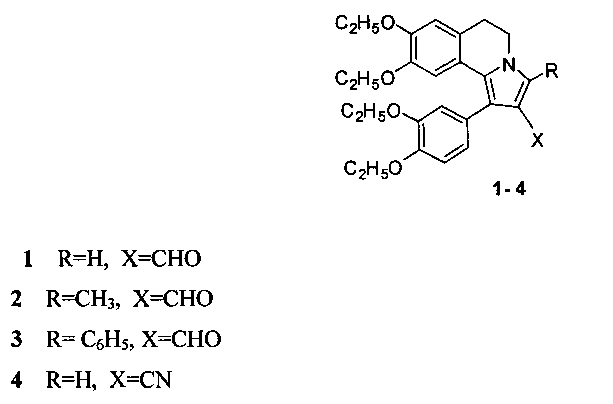
.
Способ получения производных 5,6-дигидропирроло[2,1-а]изохинолинов 1-4, содержащих в положении 2 функциональную группу, с общей структурной формулой:
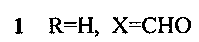
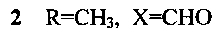
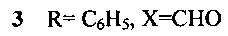
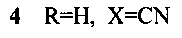
отличающийся тем, что 6,7-диэтокси-3,4-дигидро-1-(3,4-диэтоксибензоил)изохинолин растворяют в трифторэтаноле и добавляют акролеин, или кротоновый альдегид, или коричный альдегид, или акрилонитрил и перемешивают при температуре +70°С, остаток, полученный после окончания реакции и удаления реагентов, кристаллизуют в смеси эфира с гексаном.
| (ДИГИДРО)ПИРРОЛО[2,1-А]ИЗОХИНОЛИНЫ | 2009 |
|
RU2495037C2 |
| Машина для прядения искусственного шелка | 1929 |
|
SU12110A1 |
| WO 2003051877 A1, 26.06.2003 | |||
| WO 2003014117 A1, 20.02.2003 | |||
| WO 2006089815 A1, 31.08.2006. | |||
Авторы
Даты
2016-02-20—Публикация
2015-03-12—Подача