По настоящей заявке испрашивается приоритет временной заявки на патент США серийный номер 61/113552, поданной 11 ноября 2008 г., включенной в настоящее описание путем ссылки.
Область изобретения
Настоящее изобретение относится к варианту субтилизина, который является особенно подходящим для применения в очистке. В частности, настоящее изобретение относится к варианту субтилизина Bacillus sp. и чистящим композициям, включающим этот вариант.
Предпосылки создания изобретения
Как правило, обычные домашние и промышленные композиции для мытья посуды основаны на комбинации высокощелочного моющего средства и хлорного отбеливателя для чистки и дезинфекции посуды. Обычно такие системы хорошо работают на отбеливаемых пятнах. Однако удаление загрязнений, содержащих белки, которые часто присутствуют на посуде в домах, больницах, кафетериях и системе предприятий общественного питания, является проблематичным. Кроме того, высокощелочные и хлорсодержащие композиции потребителем не рассматриваются как безопасные для окружающей среды.
Предпринимались различные попытки получения композиций для мытья посуды, которые являлись бы эффективными для удаления белковых загрязнений. Эти композиции обычно включают протеазы, активные в щелочных условиях (например, рН по меньшей мере 9,5). Однако существенный недостаток таких композиций заключается в трудности их получения в виде жидкости или геля, обычно предпочитаемых покупателями средств для мытья посуды. Кроме того, щелочные моющие композиции часто рассматриваются как раздражающие.
Предпринимались попытки получения композиций для мытья посуды с низким рН (например, рН менее 9,5). Эти композиции являются более безопасными, более безвредные для окружающей среды и могут быть введены в состав рецептур гелей и жидкостей. Однако было доказано, что имеющиеся в настоящее время композиции для мытья посуды с низким значением рН являются очень неэффективными для удаления белковых загрязнений, даже при высоких концентрациях ферментов (например, протеаз).
Таким образом, в данной области сохраняется необходимость в композициях для мытья посуды, которые эффективно удаляют с посуды белковые загрязнения. Кроме того, сохраняется необходимость в композициях для мытья посуды, которые более безвредны для окружающей среды и для потребителя и существуют в том виде, который легко используется и выгоден по стоимости.
Аналогично, сохраняется необходимость в чистящих композициях для тканей, которые были бы эффективными для удаления с тканей белковых загрязнений.
Краткое изложение сущности изобретения
Настоящее изобретение относится к варианту субтилизина Bacillus sp., который является особенно подходящим для чистящих композиций. Кроме того, настоящее изобретение относится к чистящим композициях, включающим этот вариант субтилизина.
Настоящее изобретение относится к варианту субтилизина, включающему последовательность аминокислот, указанную в SEQ ID NO:5. В некоторых предпочтительных вариантах осуществления настоящее изобретение относится к композициям, включающим вариант субтилизина, имеющий последовательность аминокислот, указанную в SEQ ID NO:5. В некоторых особенно предпочтительных вариантах осуществления композиция представляет собой чистящую композицию. В некоторых предпочтительных альтернативных вариантах осуществления чистящая композиция представляет собой стиральный порошок, тогда как в некоторых других предпочтительных вариантах осуществления чистящая композиция представляет собой средство для мытья посуды. В некоторых вариантах осуществления средство для мытья посуды представляет собой моющее средство для автоматических посудомоечных машин, тогда как в других вариантах осуществления они представляют собой средства для мытья посуды вручную. В некоторых предпочтительных вариантах осуществления чистящие композиции представляют собой жидкие моющие средства, тогда как в некоторых других вариантах осуществления чистящие композиции представляют собой моющие средства в виде геля, таблетки, порошка или гранул. В некоторых вариантах осуществления чистящие композиции не содержат фосфата, тогда как в некоторых других вариантах осуществления чистящие композиции содержат фосфат. В некоторых предпочтительных вариантах осуществления чистящие композиции дополнительно включают по меньшей мере один отбеливающий агент. Еще в некоторых дополнительных предпочтительных вариантах осуществления чистящие композиции дополнительно включают по меньшей мере один дополнительный фермент. В некоторых вариантах осуществления дополнительный фермент выбирают из гемицеллюлаз, целлюлаз, пероксидаз, протеаз, металлопротеаз, ксиланаз, липаз, фосфолипаз, эстераз, пергидролаз, кутиназ, пектиназ, пектатлиаз, маннаназ, кератиназ, редуктаз, оксидаз, фенолоксилаз, липоксигеназ, лигниназ, паллуланаз, танназ, пентосаназ, маланаз, β-глюканаз, арабиносидаз, гуалуронидазы, хондроитиназы, лакказы и амилаз или их смесей.
Настоящее изобретение также относится к способам чистки, включающим обеспечение предмета для чистки и композиции, включающей вариант субтилизина, указанный в SEQ ID NO:5, и приведение в контакт указанного предмета и указанной композиции. В некоторых следующих вариантах осуществления способы дополнительно включают стадию споласкивания указанного предмета, предназначенного для чистки. В некоторых дополнительных вариантах осуществления предмет представляет собой посуду или изделие из ткани.
Описание изобретения
Настоящее изобретение относится к варианту субтилизина, который является особенно подходящим для применений в очистке. В частности, настоящее изобретение относится к варианту субтилизина Bacillus sp. и чистящим композициям, включающим этот вариант. Настоящее изобретение дополнительно относится к ферментативным композициям, обладающим сопоставимыми или улучшенными моющими характеристиками по сравнению с используемыми в настоящее время субтилизинпротеазами.
Если не указано иное, практическое осуществление настоящего изобретения включает обычные технологии, обычно используемые в молекулярной биологии, микробиологии, при очистке белков, в инжиниринге белков, секвенировании белков и ДНК, в области рекомбинантных ДНК и промышленного применения и разработки ферментов, все из которых известны специалисту в данной области.
Кроме того, приведенные в описании заголовки не являются ограничениями различных аспектов или вариантов осуществления изобретения, которые могут быть сделаны со ссылкой на описание в целом. Соответственно, термины, непосредственно определенные ниже, более полно определены при ссылке на описание в целом. Тем не менее, для облегчения понимания изобретения ниже приведены определения для ряда терминов.
Если не указано иное, все технические и научные термины, использованные в настоящем описании, имеют такие же значения, как обычно понимается обычным специалистом в данной области, к которой принадлежит изобретение. Хотя любые способы и материалы, аналогичные или эквивалентные здесь описанным, находят применение при практической реализации настоящего изобретения, в настоящем описании представлены предпочтительные способы и материалы. Соответственно, термины, непосредственно определенные ниже, более полно описаны путем ссылки на описание в целом. Также в настоящем описании термины, приведенные в единственном числе, включают отсылку на множественное число, если из контекста ясно не следует иное. Если не указано иное, нуклеиновые кислоты написаны слева направо в направлении от 5' к 3'; последовательности аминокислот написаны слева направо в направлении от амино к карбокси, соответственно. Следует понимать, что это изобретение не ограничивается описанными частными методологиями, протоколами и реагентами, поскольку они могут варьировать в зависимости от контекста, в котором они используются специалистом в данной области.
Подразумевается, что каждое максимальное числовое ограничение, приведенное в настоящем описании, включает каждый самый низкий числовой предел, как если бы такие более низкие числовые ограничения были ясно прописаны в настоящем описании. Каждое минимальное числовое ограничение, приведенное в настоящем описании, будет включать каждое более высокое числовое ограничение, как если бы такие более высокие числовые ограничения были ясно прописаны в настоящем описании. Каждый числовой диапазон, приведенный в настоящем описании, будет включать каждый более узкий числовой диапазон, который попадает в такой более широкий числовой диапазон, как если бы такие более узкие числовые диапазоны были ясно прописаны в настоящем описании.
В рамках изобретения термин «совместимый» означает, что вещества в чистящей композиции не уменьшают ферментативную активность протеазного фермента(ов), приведенного в настоящем описании, до той степени, что протеаза становится не эффективной, как это желательно при обычном использовании. Конкретные вещества чистящей композиции подробно проиллюстрированы далее в настоящем описании.
В рамках изобретения выражение «эффективное количество фермента» относится к количеству фермента, необходимому для достижения требуемой ферментативной активности в конкретном применении. Такие эффективные количества легко может оценить обычный специалист в данной области, и они основаны на множестве факторов, таких как конкретный использованный вариант фермента, применение чистящей композиции, конкретный состав чистящей композиции, и необходима ли жидкая или сухая (например, гранулированная) композиция и тому подобного.
В рамках изобретения выражение «обладающий улучшенными свойствами», использованное в сочетании со словами «вариант протеазы», относится к варианту протеазы с улучшенными эксплуатационными характеристиками и/или улучшенной стабильностью при сохраняющихся эксплуатационных характеристиках, по отношению к соответствующим протеазам дикого типа. В некоторых особо предпочтительных вариантах осуществления улучшенные свойства выбирают из группы, состоящей из улучшенных характеристик при мытье посуды и стирке и улучшенной стабильности, а также комбинации улучшенных характеристик при мытье посуды и стирке и улучшенной стабильности.
В рамках изобретения выражение «стабильность моющего средства» относится к стабильности композиций моющих средств. В некоторых вариантах осуществления, стабильность оценивают во время применения моющего средства, тогда как в других вариантах осуществления термин относится к стабильности композиции моющего средства во время хранения.
Термин «улучшенная стабильность» использован для указания лучшей стабильности варианта протеазы в композициях во время хранения и/или лучшей стабильности в мыльной пене. В предпочтительных вариантах осуществления вариант протеазы проявляет улучшенную стабильность при уходе за посудой и/или в стиральных порошках во время хранения и/или улучшенную стабильность в мыльной пене, которая включает стабильность против окислителей, секвенирующих агентов, к автолизу, поверхностно-активным веществам и высокой щелочности по сравнению с соответствующим ферментом дикого типа.
В рамках изобретения выражение «стабильность к протеолизу» относится к способности белка (например, фермента) выдерживать протеолиз. Не предполагается, что термин ограничен применением какой-либо конкретной протеазы для оценки стабильности белка.
В рамках изобретения выражение «окислительная стабильность» относится к стабильности белка функционировать в окислительных условиях. В частности, термин относится к способности белка функционировать в присутствии различных концентраций Н2О2, перкислот и других окислителей. Стабильность в различных окислительных условиях может быть измерена с помощью либо стандартных способов, известных специалистам в данной области, и/или с помощью способов, описанных в настоящем изобретении. Существенное изменение в окислительной стабильности рассматривается как повышение или понижение (в большинстве вариантов осуществления, предпочтительным является повышение) по меньшей мере приблизительно на 5% или более периода уменьшения наполовину ферментативной активности по сравнению с ферментативной активностью, имеющейся в отсутствие соединений-окислителей.
В рамках изобретения термин «рН стабильность» относится к способности белка функционировать при определенном рН. Обычно большинство ферментов имеет ограниченный диапазон рН, при котором они будут функционировать. Помимо ферментов, которые функционируют при среднем диапазоне рН (приблизительно рН 7), существуют ферменты, которые способны работать в условиях очень высокого или очень низкого рН. Стабильность при различных рН может быть измерена с помощью либо стандартных способов, известных специалистам в данной области, и/или с помощью способов, описанных в настоящем изобретении. Существенное изменение в рН стабильности рассматривается как повышение или понижение (в большинстве вариантов осуществления, предпочтительным является повышение) по меньшей мере приблизительно на 5% или более периода уменьшения наполовину ферментативной активности по сравнению с ферментативной активностью, ферментов при оптимальном рН. Однако предполагается, что настоящее изобретение не будет ограничено ни каким-либо уровнем рН стабильности, ни диапазоном рН.
В рамках изобретения термин «термическая стабильность» и «термостабильность» относится к способности белка функционировать при определенной температуре. В общем, большинство ферментов имеет ограниченный диапазон температур, при котором они будут функционировать. Помимо ферментов, которые функционируют при среднем диапазоне температур (например, комнатная температура), существуют ферменты, которые способны работать при очень высоких или очень низких температурах. Термическая стабильность может быть измерена либо с помощью известных способов и/или с помощью способов, описанных в настоящем изобретении. Существенное изменение в термической стабильности рассматривается как повышение или понижение (в большинстве вариантов осуществления, предпочтительным является повышение) по меньшей мере приблизительно на 5% или более периода уменьшения наполовину ферментативной активности при воздействии данной температуры. Однако предполагается, что настоящее изобретение не будет ограничено ни каким-либо уровнем термической стабильности, ни температурным диапазоном.
В рамках изобретения термин «химическая стабильность» относится к стабильности белка (например, фермента) по отношению к химическим реагентам, которые могут неблагоприятно влиять на его активность. В некоторых вариантах осуществления, такие химически реагенты включают, но не ограничиваются указанным, перекись водорода, перкислоты, анионные детергенты, катионные детергенты, неионные детергенты, комплексообразующие соединения и т.д. Однако не предполагается, что настоящее изобретение отграничивается ни каким-либо определенным уровнем химической стабильности, ни диапазоном химической стабильности.
В рамках изобретения термины «очищенный» и «выделенный» относятся к удалению загрязняющих примесей из образца. Например, представляющий интерес фермент очищают путем удаления загрязняющих ферментов и других соединений из раствора или препарата, которые не являются рассматриваемым ферментом. В некоторых вариантах осуществления представляющие интерес рекомбинантные ферменты экспрессируются в бактериальных или грибковых клетках-хозяевах, и эти представляющие интерес рекомбинантные ферменты очищают путем удаления других составляющих клеток-хозяев; тем самым в образце повышается процент полипептидов представляющего интерес рекомбинантного фермента.
В рамках изобретения выражение «представляющий интерес белок» относится к белку (например, ферменту, или «представляющему интерес ферменту»), который анализируют, идентифицируют и/или модифицируют. Природные, а также рекомбинантные (например, «мутант» или «вариант») белки находят применение в настоящем изобретении. В рамках изобретения термин «белок» относится к любой композиции, включающей аминокислоты и рассматриваемой в качестве белка специалистами в данной области. Термины «белок», «пептид» и «полипептид» используются в настоящем описании взаимозаменяемо. Когда пептид представляет собой часть белка, специалистам в данной области понятно применение термина в контексте.
В рамках изобретения термин «вектор экспрессии» относится к конструкции ДНК, которая является функционально связанной с подходящей контрольной последовательностью, способной к эффективной экспрессии ДНК в подходящем хозяине. Такие контрольные последовательности включают промотор для эффективной транскрипции, необязательную операторную последовательность для контроля такой транскрипции, последовательность, кодирующую походящие связывающие сайты рибосом мРНК, и последовательности, которые контролируют окончание транскрипции и трансляции. Вектор может представлять собой плазмиду, фаговую частицу или просто потенциальную геномную вставку. После трансформации в подходящем хозяине вектор может реплицировать и функционировать независимо от генома хозяина или может, в некоторых случаях, интегрироваться в сам геном. В настоящем описании термины «плазмида», «плазмида экспрессии» и «вектор» часто используются взаимозаменяемо, поскольку плазмида представляет собой наиболее обычно используемую форму вектора на сегодняшний день. Однако подразумевается, что изобретение включает другие формы векторов экспрессии, которые выполняют эквивалентные функции и которые известны или стали известными в данной области.
В некоторых предпочтительных вариантах осуществления ген протеазы лигируют в подходящую плазмиду экспрессии. Клонированный ген протеазы затем используют для трансформации или трансфекции клетки-хозяина для экспрессии гена протеазы. Эта плазмида может реплицировать в хозяевах в том смысле, что он содержит хорошо известные элементы, необходимые для репликации плазмиды, или плазмида может быть сконструирована для интеграции в хромосому хозяина. Необходимые элементы обеспечены для эффективной экспрессии гена (например, промотор, функционально связанный с рассматриваемым геном). В некоторых вариантах осуществления эти необходимые элементы обеспечиваются в качестве собственного гомологичного протомора гена, если он распознается (т.е. транскрибируется хозяином) и терминатора транскрипции, который является экзогенным или обеспечивается за счет эндогенной терминаторной области гена протеазы. В некоторых вариантах осуществления также включен селектируемый ген, такой как ген устойчивости к антибиотикам, который дает возможность непрерывного культурального поддержания клеток-хозяев, инфицированных плазмидами, посредством роста в среде, содержащей противомикробные агенты.
Следующий метод кассетного мутагенеза можно использовать для облегчения конструирования варианта протеазы по настоящему изобретению, хотя также можно использовать другие способы. Во-первых, как указано в настоящем описании, получают природный ген, кодирующий протеазу, и секвенируют полностью или частично. Затем последовательность сканируют до точек, в которых желательно провести мутацию (например, посредством делеции, инсерции или замещения) одной или нескольких аминокислот в кодируемой протеазе. Последовательности, примыкающие к этой точке, оценивают на присутствии сайтов рестрикции для замены короткого сегмента гена на олигонуклеотидный пул, который, при экспрессии, будет кодировать различные мутанты. Такие сайты рестрикции предпочтительно представляют собой единичные сайты в гене белка для облегчения замены сегмента гена. Однако можно использовать любой обычный сайт рестрикции, который не является чрезмерно дублируемым в гене протеазы, при условии, что фрагменты генов, генерируемые при рестрикционном расщеплении, могут повторно собираться в правильную последовательность. Если не имеется сайтов рестрикции, расположенных в пределах удобного расстояния от выбранной точки (от приблизительно 10 до приблизительно 15 нуклеотидов), такие сайты генерируют путем замещения нуклеотидов в гене таким образом, что ни рамка считывания, ни кодируемые аминокислоты не изменяются в конечной конструкции. Мутацию гена для изменения его последовательности, чтобы она соответствовала желаемой последовательности, проводят путем расширения праймера в соответствии с обычными известными способами. Задача расположения подходящих фланкирующих областей и оценки необходимых изменений для достижения по двум подходящим сайтам рестрикции последовательности стала общепринятой посредством сокращения генетического кода, рестрикции ферментативной карты гена и большого числа различных ферментов рестрикции. Следует отметить, что, если подходящий фланкирующий сайт рестрикции доступен, вышеуказанный способ требуется использовать только в связи с фланкирующей областью, которая не содержит сайта. После клонирования природной ДНК и/или синтетической ДНК, сайты рестрикции, расположенные сбоку от предназначенных для мутирования позиций, отщепляют с использованием родственных ферментов рестрикции и множество комплиментарных по концам олигонуклеотидных кассет лигируют в ген. Мутагенез упрощается при таком способе, поскольку все олигонуклеотиды могут быть синтезированы таким образом, чтобы иметь такие же сайты рестрикции, и синтетические линкеры не потребуются для создания сайтов рестрикции.
В рамках изобретения выражение «соответствующий» относится к остатку в нумерованном положении белка или пептида, или остатку, который является аналогичным, гомологичным или эквивалентным пронумерованному остатку в белке или пептиде. В рамках изобретения выражение «соответствующая область» обычно относится к аналогичному положению на протяжении цепи родственных белков или ссылочного белка.
Термины «молекула нуклеиновой кислоты, кодирующая», «последовательность нуклеиновых кислот, кодирующая», «последовательность ДНК, кодирующая», и «ДНК, кодирующая», относятся к порядку или последовательности дезоксирибонуклеотидов вдоль цепи дезоксирибонуклеиновой кислоты. Порядок этих дезоксирибонуклеотидов определяется порядком аминокислот вдоль полипепидной (белковой) цепи. Последовательность ДНК таким образом кодирует последовательность аминокислот.
В рамках изобретения белки «дикого типа» и «нативные» белки представляют собой те, которые существуют в природе. Термин «последовательность дикого типа» и «ген дикого типа» используются взаимозаменяемо для упоминания последовательности, которая является нативной или природной в клетке-хозяине. В некоторых вариантах осуществления выражение «последовательность дикого типа» относится к представляющей интерес последовательности, которая является отправным моментом в проекте инжиниринга белка. Гены, кодирующие природный белок, могут быть получены в соответствии с общими способами, известными специалистам в данной области. Способы обычно включают синтез меченых зондов, имеющих предполагаемые последовательности, кодирующие области целевого белка, получение геномных библиотек от организмов, экспрессирующих белок, и скрининг библиотек для выявления целевого гена посредством гибридизации зондов. Положительно гибридизируемые клоны затем картируют и секвенируют.
Термин «рекомбинантная молекула ДНК» в рамках изобретения относится к молекуле ДНК, которая состоит из сегментов ДНК, соединенных между собой с помощью методом молекулярной биологии. Термин «рекомбинантный олигонуклеотид» относится к олигонуклеотиду, созданному с использованием манипуляций молекулярной биологии, включая, но не ограничиваясь указанным, лигирование двух или более олигонуклеотидных последовательностей, генерированных с помощью рестрикционного ферментативного расщепления последовательности полинуклеотида, синтез олигонуклеотидов (например, синтез праймеров или олигонуклеотидов) и тому подобное.
В рамках изобретения термин «эквивалентные остатки» относится к белкам, которые используют совместно определенные аминокислотные остатки. Например, эквивалентные остатки могут быть выявлены путем определения гомологии на уровне третичной структуры белка (например, протеазы), чья третичная структура была определена методом рентгеноструктурной кристаллографии. Эквивалентные остатки определяют как те, для которых координаты атомов двух или более атомов основной цепи для конкретного остатка аминокислоты белка, имеющего предполагаемые эквивалентные остатки, и представляющего интерес белка, находятся в диапазоне 0,13 нм и предпочтительно приблизительно 0,1 нм после совмещения. Совмещение достигается после того, как лучшая модель была ориентирована и расположена так, чтобы давать максимальное перекрывание координат атомов для неводородных атомов белка в анализируемом белке. Предпочтительной моделью является кристаллографическая модель, дающая наиболее низкий R-фактор для экспериментальных дифракционных данных при наиболее высоком доступном разрешении, определенных с использованием методов, известных специалистам в области кристаллографии и характеризации/анализа белков.
Термин «регуляторный элемент» в рамках изобретения относится к генетическому элементу, который контролирует некоторые аспекты экспрессии последовательностей нуклеиновых кислот. Например, промотор представляет собой регуляторный элемент, который облегчает инициирование транскрипции функционально связанной кодирующей области. Дополнительные регуляторные элементы включают сигналы сплайсинга, сигналы полиаденилирования и сигналы завершения.
В рамках изобретения «клетки-хозяева» обычно представляют собой прокариотические или эукариотические хозяева, которые трансформируют или трасфектируют с использованием векторов, сконструированных с использованием методов рекомбинантной ДНК, известных в данной области. Трансформированные клетки-хозяева способны либо к репликации векторов, кодирующих вариант белка, либо к экспрессии желаемого варианта белка. В случае векторов, которые кодируют пред- или предпро-формы варианта белка, такой вариант, будучи экспрессированным, обычно секретируется из клетки-хозяина в среду клеток-хозяев.
Термин «введенный», в контексте вставки последовательности нуклеиновой кислоты в клетку, означает трансформацию, трансдукцию или трансфекцию. Способы трансформации включают, но не ограничиваются указанным, любые подходящие способы, известные в данной области, такие как трансформация протопласта, осаждение хлоридом кальция, электропорация, «голые» ДНК и тому подобные, как известно в данной области (см., например, Chang и Cohen, Mol Gen Genet, 168:111-115, 1979; Smith et al., Appl Env Microbiol, 51:634, 1986; и обзорная статья Ferrari et al., в Harwood, Bacillus. Plenum Publishing Corporation, pp. 57-72, 1989).
Термин «промотор/энхансер» означает сегмент ДНК, который содержит последовательности, способные обеспечивать как функции промотора, так и функции энхансера. Промотор/энхансер могут быть «эндогенными», или «экзогенными», или «гетерологичными». Эндогенный промотор/энхансер представляет собой тот, который природно связан с этим геном в геноме. Экзогенный (гетерологичный) промотор/энхансер представляет собой тот, который размещен в непосредственном соседстве с геном с помощью генетических манипуляций (т.е. методами молекулярной биологии).
Присутствие «сигналов сплайсинга» в векторе экспрессии часто приводит к более высокому уровню экспрессии рекомбинантного транскрипта. Сигналы сплайсинга опосредуют удаление интронов из первичного РНК транскрипта и состоят из донорного и акцепторного сайта сплайсинга (см., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory Press, New York, pp. 16.7-16.8, 1989).
Термин «стабильная трансфекция» или «стабильно трансфицированный» относится к введению и интегрированию чужеродной ДНК в геном трансфицированной клетки. Термин «стабильный трансфектант» относится к клетке, которая содержит стабильно интегрированную чужеродную или экзогенную ДНК в геномной ДНК трансфицированной клетки.
Термин «селектируемый маркер» или «селектируемый генный продукт» в рамках изобретения относится к применению гена, который кодирует ферментативную активность, которая придает резистентность к воздействию антибиотика или лекарственного средства на клетку, в которой экспрессируется селектируемый маркер.
В рамках изобретения термины «амплификация» и «амплификация гена» относится к процессу, посредством которого специфические последовательности ДНК реплицируют непропорционально, так что амплифицированный ген начинает присутствовать в большем числе копий, чем первоначально присутствовало в геноме. В некоторых вариантах осуществления селекция клеток по росту в присутствии лекарственного средства (например, ингибитора фермента, способного к ингибированию) приводит к амплификации или эндогенного гена, кодирующего генный продукт, требуемый для роста в присутствии лекарственного средства, или амплификации экзогенной (т.е. исходной) последовательности, кодирующей этот генный продукт, или к обоим. Селекция клеток по росту в присутствии лекарственного средства (например, ингибитора фермента, способного к ингибированию) приводит к амплификации либо эндогенного гена, кодирующего генный продукт, требуемый для роста в присутствии лекарственного средства, или амплификации экзогенной (т.е. исходной) последовательности, кодирующей этот генный продукт, или к обоим.
«Амплификация» представляет собой специальный случай репликации нуклеиновой кислоты, включающий темплатную специфичность. Она противопоставляется неспецифической темплатной репликации, т.е. репликации, которая является темплат-зависимой, но не зависит от конкретного темплата). Темплатная специфичность в рамках изобретения отличается от точности воспроизведения репликации (т.е. синтеза правильной последовательности нуклеотида) и нуклеотидной (рибо- или дезоксирибо-) специфичности. Темплатную специфичность часто описывают в терминах «мишень»-специфичности. Мишень-специфичность относится к «мишеням» в том смысле, что их пытаются отсортировать от других нуклеиновых кислот. Методы амплификации в первую очередь были разработаны для такой сортировки.
В рамках изобретения термин «амплифицируемый маркер», «амплифицируемый ген» и «вектор амплификации» относятся к маркеру, ген или вектору, кодирующим ген, который дает возможность амплификации такого гена при подходящих условиях роста.
В рамках изобретения термин «амплифицируемая нуклеиновая кислота» относится к нуклеиновым кислотам, которые могут быть амплифицированы с помощью любого из методов амплификации. Подразумевается, что «амплифицируемая нуклеиновая кислота» обычно будет включать «темплат образца».
В рамках изобретения термин «темплат образца» относится к нуклеиновой кислоте, происходящей из образца, который был проанализирован на присутствие «мишени» (определено ниже). В противоположность этому, термин «фоновый темплат» используется для упоминания нуклеиновой кислоты, отличающейся от нуклеиновой кислоты темплата образца, которая может присутствовать или не присутствовать в образце. Фоновый темплат наиболее часто является случайным. Он может быть результатом переходящего остатка, или он может возникать вследствие присутствия примесей нуклеиновых кислот, от которых, как предполагается, был очищен образец. Например, нуклеиновые кислоты организмов, отличающихся от тех, которые предназначены для обнаружения, могут присутствовать в качестве фона в тестируемом образце.
В рамках изобретения термин «праймер» относится к олигонуклеотиду либо существующему в природе, как в очищенном продукте рестрикции, либо получаемому синтетически, который способен действовать в месте инициирования синтеза, будучи помещен в условия, в которых индуцируется синтез продукта удлинения праймера, который является комплементарным цепи нуклеиновой кислоты (т.е. в присутствии нуклеотидов и индуцирующего агента, такого как ДНК полимераза и при подходящей температуре и рН). Праймер предпочтительно является одноцепочечным для максимальной эффективности в амплификации, но альтернативно может быть и двухцепочечным. Если он является двухцепочечным, праймер первоначально обрабатывают для разделения его цепей перед использованием для получения продуктов удлинения. Предпочтительно праймер представляет собой олигодезоксирибонуклеотид. Праймер должен быть достаточно длинным для начала синтеза продуктов удлинения в присутствии индуцирующего агента. Точная длина праймеров зависит от множества факторов, включая температуру, источник праймер и применяемого способа.
В рамках изобретения термин «зонд» относится к олигонуклеотиду (т.е. последовательности нуклеотидов) либо существующему в природе, как в очищенном продукте рестрикции, либо получаемому синтетически, рекомбинантно или методом ПЦР амплификации, который способен к гибридизации с другим представляющим интерес олигонуклеотидом. Зонд может быть одноцепочечным или двухцепочечным. Зонды используют для обнаружения, идентификации и выделения определенных последовательностей генов. Подразумевается, что любой зонд, используемый в настоящем изобретении, будет меченым какой-либо «репортерной молекулой», так что он обнаруживается в какой-либо системе детектирования, включая, но не ограничиваясь указанным, ферментативную (например, ELISA, а также ферментативный гистохимический анализы), флуоресцентную, радиоактивную и люминесцентную системы. Не предполагается, что настоящее изобретение ограничивается какой-либо конкретной системой детектирования или меткой.
В рамках изобретения термин «мишень» при использовании со ссылкой на способ амплификации (например, полимеразная цепная реакция) относится к области нуклеиновой кислоты, связанной с помощью праймеров, использованных для полимеразной цепной реакции. Таким образом, «мишень» пытаются отсортировать от других последовательностей нуклеиновых кислот. Под «сегментом» определяют область нуклеиновой кислоты внутри последовательности-мишени.
В рамках изобретения термин «полимеразная цепная реакция» и «ПЦР» относится к способам в патентах США №№ 4683195, 4683202 и 4965188, которые включают способы увеличения концентрации сегмента последовательности-мишени в смеси геномной ДНК без клонирования или очистки.
В рамках изобретения термин «реагенты амплификации» относится к тем реагентам (дезоксирибонуклеотидтрифосфаты, буферы и т.д.), которые необходимы для амплификации, за исключением праймеров, темплата нуклеиновой кислоты и фермента амплификации. Обычно реагенты амплификации наряду с другими реакционными компонентами помещают и содержатся в реакционном сосуде (тест-пробирка, микролунка и т.д.).
В рамках изобретения термин «рестрикционные эндонуклеазы» или «ферменты рестрикции» относится к бактериальным ферментам, каждый из которых отрезает двухцепочечную ДНК в месте или около определенной нуклеотидной последовательности.
В рамках изобретения термин «чистящая композиция» относится к любой композиции, которая находит применение для чистки. Предполагается, что этот термин охватывает (если не указано иное) гранулированные или порошкообразные моющие агенты для всех целей или «предназначенные для работы в тяжелом режиме» (например, стиральные порошки), моющие агенты для всех целей в виде жидкости, геля или пасты (например, жидкие моющие средства, «предназначенные для работы в тяжелом режиме»), жидкие и порошкообразные моющие средства для деликатных тканей, средства для ручного мытья посуды, легкие агенты для мытья посуды (например, высокопенящиеся моющие средства), моющие средства для посудомоечных машин (т.е. моющие средства для автоматических посудомоечных машин), включая таблетированные, гранулированные, жидкие моющие средства, моющие средства, добавляемые в воду, чтобы на поверхности посуды после мытья не оставалось капель, для домашнего применения и применения в лечебных учреждениях, жидкие чистящие и дезинфицирующие агенты (например, антибактериальное мыло для рук), мыло для стирки, ополаскиватели для полости рта, средства для чистки протезов, шампуни для машин, шампуни для ковров, чистящие средства для ванных комнат, шампуни для волос для людей и других животных, ополаскиватели для волос для людей и других животных, гели для душа, гели для ванной, пена для ванной и чистящие средств для металла и вспомогательные чистящие средства (например, вспомогательные отбеливающие добавки, добавки для стирки, композиции для предварительной обработки, включая «обработку пятна и другие форматы предварительной обработки).
В рамках изобретения термин «моющая композиция» и «моющий состав» используются для обозначения смесей, которые предназначены для применения в моющей среде для чистки загрязненных объектов. В предпочтительных вариантах осуществления термин используется для упоминания моющих средств для стирки, мытья посуды, ножевых изделий и т.д. (например, «средства для мытья посуды»). Не предполагается, что настоящее изобретение ограничено каким-либо конкретным моющим составом или композицией. Действительно, подразумевается, что в дополнение к моющим композициям, которые содержат по меньшей мере одну протеазу по настоящему изобретению, термин охватывает моющие средства, которые содержат поверхностно-активные вещества, трансферазу(ы), гидролитические ферменты, оксидоредуктазы, моющие средства, отбеливатели, активаторы отбеливания, подсинивающие агенты и флуоресцентные красители, ингибиторы затвердевания приставшей грязи, маскирующие агенты, активаторы ферментов, антиоксиданты и солюбилизаторы.
В рамках изобретения термин «композиция для мытья посуды» относится ко всем формам композиций для чистки посуды, включая столовые приборы, включая, но не ограничиваясь указанным, порошкообразные, таблетированные, гранулированные и жидкие формы. Не предполагается, что настоящее изобретение ограничено каким-либо конкретным типом композиции для мытья посуды. Действительно, настоящее изобретение находит применение для чистки посуды (например, кухонной посуды, включая, но не ограничиваясь указанным, тарелки, чашки, стаканы, миски и т.д.) и столовых приборов (например, посуда, включая, но не ограничиваясь указанным, ложки, ножи, вилки, сервировочная посуда и т.д.) из любого материала, включая, но не ограничиваясь указанным, керамику, пластик, металлы, фарфор, стекло, акрил и т.д. Термин «посуда» используется в настоящем описании применительно к посуде и столовым приборам.
Термин «значимые условия мытья» используется в настоящем описании для указания условий, в частности температуры мытья, времени, моющих механизмов, концентрации мыльной пены, типа моющего средства и жесткости воды, реально используемых в быту для сегмента рынка моющих средств для посуды и ткани.
Термин «улучшенные характеристики мытья» используется в настоящем описании для указания на то, что лучший конечный результат получают при удалении загрязнений с посуды, столовых приборов или ткани при значимых условиях мытья, или на то, что меньше мутантной протеазы, на весовой основе, необходимо для получения того же самого конечного результата по сравнению с соответствующим ферментом дикого типа.
Термин «остаточные моющие характеристики» используется для указания, что моющие характеристики мутантного протеазного фермента, на весовой основе, составляют по меньшей мере приблизительно 80% относительно соответствующей протеазы дикого типа при значимых условиях мытья.
Моющие характеристики протеаз обычно измеряют по их способности удалять некоторые иллюстративные загрязнения при подходящих условиях тестирования. В этих тест-системах другие значимые факторы, такие как моющая композиция, концентрация мыльной пены, жесткость воды, моющие механизмы, время, рН и/или температура, можно контролировать таким образом, что имитируются условия, типичные для применения в домашних условиях на некотором сегменте рынка (например, чистка посуды, ткани и т.д.). Описанная здесь лабораторная система тестирования применения является иллюстративной для применения в домашних условиях, когда используются протеолитические ферменты, модифицированные посредством ДНК мутагенеза. Таким образом, разработанные здесь способы облегчают тестирование большого количества различных ферментов и выбор тех ферментов, которые являются особенно подходящими для конкретного типа применения моющего средства. Таким путем легко выбирают «приспособленные для определенной цели» ферменты для конкретных условий применения.
Термин «чистящая активность» относится к чистящим характеристикам, достигаемым с помощью протеазы в условиях, доминирующих во время протеолитического, гидролитического, чистящего или других способов по изобретению. В некоторых вариантах осуществления чистящие характеристики определяются путем проведения различных анализов чистки, касающихся ферментативно-чувствительных загрязнений, например, трава, кровь, молоко или яичный белок, определенные с помощью различных хроматографических, спектрофотометрических или других количественных методологий, после того как загрязнения были подвергнуты стандартным моющим условиям. Иллюстративные анализы включают, но не ограничиваются указанным, те, которые описаны в WO 99/34011 и патенте США № 6605458 (которые включены в настоящее описание путем ссылки), а также методы, включенные в примеры изобретения.
Термин «эффективное чистящее количество» протеазы относится к количеству описанной ранее протеазы, которое достигает желаемого уровня ферментативной активности в конкретной чистящей композиции. Такие эффективные количества легко могут быть оценены обычным специалистом в данной области и основаны на многих факторах, таких как конкретная используемая протеаза, чистящее применение, конкретный состав чистящей композиции, и требуется ли жидкая, гелевая или сухая (например, гранулированная, в виде куска) композиция.
Термин «чистящие вспомогательные материалы» в рамках изобретения означает любые жидкие, твердые или газообразные материалы, выбранные для конкретного типа желаемой чистящей композиции и формы продукта (например, жидкий, гранулированный, порошкообразный, в виде куска, паста, спрей, таблетка, гель или пенистая композиция), при этом эти материалы также предпочтительно являются совместимыми с протеазным ферментом, используемым в композиции. В некоторых вариантах осуществления гранулированные композиции находятся в «компактной» форме, тогда как в других вариантах осуществления жидкие композиции находятся в «концентрированной» форме.
В рамках изобретения система с низкой концентрацией моющего средства включает моющие средства, в которых в воде при стирке присутствует менее приблизительно 800 ч.н.м. моющих компонентов. Японские моющие средства обычно рассматриваются как система с низкой концентрацией моющего средства, поскольку они обычно содержат приблизительно 667 ч.н.м. компонентов моющего средства в воде при стирке.
В рамках изобретения система со средней концентрацией моющего средства включает моющие средства, в которых в воде при стирке присутствует от приблизительно 800 ч.н.м. до 2000 ч.н.м. моющих компонентов. Моющие средства Северной Америки обычно рассматриваются как системы со средней концентрацией моющего средства, поскольку они содержат приблизительно 975 ч.н.м. моющих компонентов, присутствующих в воде при стирке. Бразильские моющие средства обычно содержат приблизительно 1500 ч.н.м. компонентов моющего средства в воде при стирке.
В рамках изобретения система с высокой концентрацией моющего средства включает моющие средства, в которых в воде при стирке присутствует более приблизительно 2000 ч.н.м. моющих компонентов. Европейские моющие средства рассматриваются как системы с высокой концентрацией моющего средства, поскольку они содержат приблизительно 3000-8000 ч.н.м. моющих компонентов, присутствующих в воде при стирке.
В рамках изобретения выражения «композиции для чистки ткани», «стиральные чистящие композиции» и «стиральный порошок» относятся к композиции для чистки загрязненной одежды и/или ткани. Предполагается, что любая форма, включая порошок, таблетку, гель, гранулированные и жидкие формы, охватывается настоящим изобретением. Не предполагается, что настоящее изобретение ограничивается каким-либо конкретным типом одежды и/или ткани. Эти термины охватывают моющие композиции для ручной и машинной стирки, включая вспомогательные композиции при стирке и композиции, подходящие для применения при замачивании и/или предварительной обработке испачканной ткани (например, одежда, белье и другие текстильные материалы).
В рамках изобретения выражение «чистящие композиции не для тканей» включают чистящие композиции для нетекстильной поверхности, включая, но не ограничиваясь указанным, композиции для мытья посуды, чистящие композиции для полости рта, чистящие композиции для зубных протезов и чистящие композиции для личной гигиены.
В рамках изобретения термин «дезинфицирующий» относится к удалению загрязнений с поверхности, а также к ингибированию или уничтожению микробов на поверхности предметов. Не предполагается, что настоящее изобретение будет ограничено какой-либо конкретной поверхностью, предметом или загрязняющим веществом(ами) или микробами, предназначенными для удаления.
В рамках изобретения термин «субтилизин» относится к любому члену семейства серинпротеаз S8, как описано в MEROPS: The Peptidase Data base (Rawlings et al., MEROPS: the peptidase database, Nucleic Acids Res, 34 Database issue, D270-272, 2006).
Подходящие штаммы-хозяева для продуцирования разработанного варианта протеазы включают способные к трансформации микроорганизмы, в которых может достигаться экспрессия протеазы. В частности, штаммы-хозяева того же вида или рода, из которого происходят протеазы, являются подходящими, такие как штамм Bacillus, предпочтительно алкалофильный штамм Bacillus и наиболее предпочтительно Bacillus nov. spec. PB92 или его мутант, обладающий по существу такими же свойствами. Также к числу предпочтительных штаммов относятся штаммы B. subtilis, B. licheniformis и B. Amyloliquefaciens. Другие подходящие и предпочтительные штаммы-хозяева включают штаммы, которые по существу не способны продуцировать межклеточные протеолитические ферменты перед трансформацией с использованием мутантного гена. Особый интерес представляют протеаза-дефицитные штаммы-хозяева Bacillus, такие как протеаза-дефицитное производное Bacillus nov. spec. PB92. Экспрессию протеаз получают с использованием сигналов экспрессии, которые функционируют в выбранном организме-хозяине. Сигналы экспрессии включают последовательности ДНК, регулирующие транскрипцию и трансляцию генов протеазы. Правильные векторы способны реплицировать при достаточно высоком числе копий в выбранном штамме-хозяине или дают возможность стабильного поддерживания гена протеазы в штамме-хозяине путем хромосомной интеграции.
Вариант протеолитического фермента (т.е. вариант протеазы) согласно изобретению получают путем культивирования, при подходящих условиях ферментирования, трансформированного штамма-хозяина, включающего целевой мутантный протеолитический ген или гены, и выделения продуцируемых ферментов. Предпочтительно, протеаза при экспрессии секретируется в культуральную среду, что облегчает ее выделение, или в случае грамотрицательных бактериальных штаммов-хозяев в периплазматическое пространство. Для секреции используется подходящая амино-терминальная сигнальная последовательность, предпочтительно сигнальная последовательность, кодируемая оригинальным генов, если она является функциональной в выбранном штамме-хозяине.
В некоторых вариантах осуществления объединяют несколько замещений для повышения стабильности и/или рабочих характеристики субтилизина в моющих композициях. Таким образом, настоящее изобретение относится к следующему варианту протеазы, который обеспечивает улучшенные эксплуатационные характеристики при стирке (например, вариант PB92, имеющий N76D+N87R+G118R+S128L+P129Q+S130A+S188D+N248R; с использованием нумерации BPN'; «PX3»). Этот вариант упоминается в настоящем описании как «вариант протеазы субтилизина», «мутантная протеаза», «вариант протеазы», «протеазный вариант», «протеаза Bacillus sp.», «вариант субтилизина Bacillus sp.» и «мутантный вариант протеазы». Последовательность аминокислот этого варианта указана в SEQ ID NO:5.
Соответственно, настоящее изобретение относится к этому варианту субтилизина, подходящему для использования в моющей композиции(ях) и/или процессах стирки. Следует понимать, что положения, гомологичные положениям аминокислот в упоминаемом PB92 субтилизине (и нумерация в соответствии с выравниванием по BPN'), будут входить в объем формулы изобретения.
Чистящие композиции
Если не указано иное, приведенные в настоящем описании уровни всех компонентов или композиций указаны со ссылкой на активный уровень такого компонента или композиции, и исключают примеси, например, остаточные растворители или побочные продукты, которые могут присутствовать в коммерчески доступных источниках. Вес ферментативных компонентов приведен из расчета на общий активный белок. Все проценты и соотношения рассчитаны по весу, если не указано иное. Все проценты и соотношения рассчитаны из расчета на общий вес композиции, если не указано иное. В иллюстративных моющих композициях уровни ферментов выражены из расчета на чистый фермент по весу от веса общей композиции, и, если не указано иное, моющие ингредиенты приведены по весу из расчета на общий вес композиции.
Как указано в настоящем описании, в некоторых вариантах осуществления чистящие композиции по настоящему изобретению дополнительно включают вспомогательные материалы, включая, но не ограничиваясь указанным, поверхностно-активные вещества, моющие компоненты, отбеливатели, активаторы отбеливания, катализаторы отбеливания, дополнительные ферменты, стабилизирующие ферменты системы, комплексообразующие агенты, добавки для придания блеска, высвобождающие загрязнения полимеры, агенты, ингибирующие перенос красителей, диспергирующие агенты, подавители образования мыльной пены, красители, отдушки, пигменты, соли-наполнители, гидротропные вещества, фотоактиваторы, флуоресцентные вещества, кондиционеры для ткани, гидролизуемые поверхностно-активные вещества, консерванты, антиоксиданты, агенты против усадочной деформации, агенты против образования складок, гермициды, фунгициды, цветные гранулы, агенты для ухода за серебром, агенты против потускнения металла и/или противокоррозионные агенты, источники щелочности, солюбилизирующие агенты, носители, вспомогательные добавки, пигменты и контролирующие рН агенты (см., например, патенты США №№ 6610642, 6605458, 5705464, 5710115, 5698504, 5695679, 5686014 и 5646101, все из которых включены в настоящее описание путем ссылки). Варианты конкретных материалов чистящих композиций подробно проиллюстрированы далее. В вариантах осуществления, в которых вспомогательные чистящие материалы не совместимы с вариантами протеаз по настоящему изобретению для чистящих композиций, используют подходящие методы хранения по отдельности вспомогательного чистящего материала и протеазы (т.е. они не контактируют друг с другом) до тех пор, пока комбинация двух компонентов не становится подходящей. Такие методы разделения включают любые способы, известные в данной области (например, капсулирование в геле, инкапсулирование, таблетки, физическое разделение и др.).
Вариант серинпротеазы по настоящему изобретению можно использовать для получения рецептур различных моющих композиций. Чистящие композиции по настоящему изобретению преимущественно можно использовать например, при стирке, для чистки твердых поверхностей, для автоматических посудомоечных машин, а также в косметических применениях, таких как для зубных протезов, зубов, волос и кожи. Вариант протеазы по настоящему изобретению находит применение в гранулированных, порошкообразных, гелевых и жидких композициях.
Вариант протеазы по настоящему изобретению также находит применение во вспомогательных продуктах для чистки. Вспомогательный продукт для чистки, включающий вариант протеазы по настоящему изобретению, идеально подходит для включения в процесс стирки, когда желательная дополнительная эффективность отбеливания. Такие случаи включают, но не ограничиваются указанным, чистящие применения при низкой температуре раствора. Вспомогательный продукт может представлять собой, в простейшей форме, вариант протеазы, как он разработан в настоящем изобретении. В некоторых вариантах осуществления добавку упаковывают в виде дозированной формы для добавления при процессе чистки, в которых используется источник перкислорода и желательно усиление эффективности отбеливания. В некоторых вариантах осуществления единичная дозированная форма включает пилюлю, таблетку, гелевую капсулу или другие варианты единичной дозировки, включающие предварительно измеренное количество порошков и/или жидкостей. В некоторых вариантах осуществления в композицию включают наполнитель и/или носитель для увеличения объема такой композиции. Подходящие материалы наполнителей или носителей включают, но не ограничиваются указанным, различные соли сульфата, карбоната и силиката, а также тальк, глину и тому подобное. В некоторых вариантах осуществления материалы наполнителя и/или носителя для жидких композиций включают воду и/или низкомолекулярные первичные и вторичные спирты, включают многоатомные спирты и диолы. Примеры таких спиртов включают, но не ограничиваются указанным, метанол, этанол, пропанол и изопропанол. В некоторых вариантах осуществления композиция включает от приблизительно 5% до приблизительно 90% подобных материалов. В дополнительных вариантах осуществления используются кислотные наполнители для снижения рН композиции. В некоторых альтернативных вариантах осуществления чистящие добавки включают по меньшей мере один источник активированного перкислорода, как описано ниже, и/или вспомогательные ингредиенты, как более подробно описано далее.
Для чистящих композиций и чистящих вспомогательных добавок по настоящему изобретению требуется эффективное количество серинпротеазного фермента, как он разработан в настоящем изобретении. В некоторых вариантах осуществления требуемый уровень фермента достигается путем добавления варианта серинпротеазы, разработанного в настоящем изобретении. Обычно чистящие композиции по настоящему изобретению включают по меньшей мере 0,0001 весовой процент, от приблизительно 0,0001 до приблизительно 10, от приблизительно 0,001 до приблизительно 1 или даже от приблизительно 0,01 до приблизительно 0,1 весового процента по меньшей мере одной серинпротеазы, разработанной в настоящем изобретении.
В некоторых предпочтительных вариантах осуществления, разработанные чистящие композиции обычно получают таким образом, чтобы, во время применения для чистки в водных условиях, используемая при стирки вода имела рН от приблизительно 5,0 до приблизительно 11,5, или, в альтернативных вариантах осуществления, даже от приблизительно 6,0 до приблизительно 10,5. В некоторых предпочтительных вариантах осуществления рецептуру жидких продуктов составляют таким образом, чтобы они имели рН в неразбавленном виде от приблизительно 3 до приблизительно 9, тогда как в некоторых альтернативных вариантах осуществления составы имели pH от от приблизительно 3 до приблизительно 5. В некоторых предпочтительных вариантах осуществления, гранулированные стиральные порошки обычно получают таким образом, чтобы они имели рН от приблизительно 8 до приблизительно 11. Методы контроля рН на рекомендуемом уровне включают применение буферов, щелочей, кислот и т.д., и хорошо известны специалистам в данной области.
В некоторых особенно предпочтительных вариантах осуществления, когда вариант протеазы используется в гранулированной композиции или в жидкости, вариант протеазы находится в виде инкапсулированной частицы для защиты фермента от других компонентов гранулированной композиции во время хранения. В дополнение, инкапсулирование может обеспечить средство контроля доступности серинпротеазы во время процесса чистки и может усилить эксплуатационные характеристики серинпротеазы. Подразумевается, что инкапсулированные серинпротеазы по настоящему изобретению будут находить применение в различных направлениях. Также предполагается, что инкапсулирование серинпротеазы можно проводить с использованием любого подходящего инкапсулирующего материала(ов) и способов, известных в данной области.
В других предпочтительных вариантах осуществления инкапсулированные материалы обычно инкапсулируют по меньшей мере часть серинпротеазного катализатора. В некоторых вариантах осуществления инкапсулирующий материал является водорастворимым и/или вододиспергируемым. В некоторых дополнительных вариантах осуществления инкапсулирующий материал имеет температуру стеклования 0°С или выше (см., например, WO 97/11151, в особенности со страницы 6, строка 25 до страницы 7, строка 2, в отношении более подробной информации, касающейся температур стеклования).
В некоторых вариантах осуществления инкапсулирующий материал выбирают из группы, состоящей из углеводов, природных или синтетических камедей, хитина и хитозана, целлюлозы и производных целлюлозы, силикатов, фосфатов, боратов, поливинилового спирта, полиэтиленгликоля, парафиновых восков и их комбинаций. В некоторых вариантах осуществления, в которых инкапсулирующий материал представляет собой углевод, его выбирают из группы, состоящей из моносахаридов, олигосахаридов, полисахаридов и их комбинаций. В некоторых предпочтительных вариантах осуществления инкапсулирующий материал представляет собой крахмал (см., например, ЕР 0922499 и патенты США №№ 4977252, 5354559, 5935826 в отношении описания некоторых иллюстративных подходящих крахмалов).
В других вариантах осуществления инкапсулирующий материал включает микросферы, полученные из пластика (например, термопластмассы, акрилонитрила, метаксилонитрила, полиакрилонитрила, полиметакрилонитрила и их смесей, коммерчески доступные микросферы, которые находят применение, включают, но не ограничиваются указанным, EXPANCEL® (Casco Products, Стокгольм, Швеция), PM 6545, PM 6550, PM 7220, PM 7228, EXTENDOSPHERES® и Q-CEL® (PQ Corp., Valley Forge, PA.), LUXSIL® и SPHERICELl® (Potters Industries, Inc., Carlstadt, N.J. and Valley Forge, PA.).
Как указано в настоящем описании, в некоторых вариантах осуществления вариант протеазы по настоящему изобретению находит применение в стиральных порошках. В этих применениях ферменты находятся под воздействием различного стресса со стороны окружающей среды. Вариант протеазы по настоящему изобретению обеспечивает преимущества по сравнению со многими использующимися в настоящее время ферментами благодаря своей стабильности при различных условиях.
Действительно, существует множество условий стирки, включая различные рецептуры моющих средств, объем воды для стирки, температура воды для стирки и продолжительность времени стирки, которые оказывает воздействие на протеазы, вовлеченные в процесс стирки. Дополнительно, составы моющих средств, используемые в различных географических областях имеют различные концентрации своих значимых компонентов, присутствующих в воде для стирки. Например, европейский стиральный порошок обычно содержит приблизительно 4500-5000 ч.н.м. компонентов моющего средства в воде при стирке, тогда как японское моющее средство обычно содержит приблизительно 667 ч.н.м. компонентов моющего средства в воде при стирке. В Северной Америке, в особенности в США, моющие средства обычно содержит приблизительно 975 ч.н.м. моющих компонентов в воде при стирке.
Система с низкой концентрацией моющего средства включает моющие средства, в которых в воде при стирке присутствует менее приблизительно 800 ч.н.м. моющих компонентов. Японские моющие средства обычно рассматриваются как система с низкой концентрацией моющего средства, поскольку они содержат приблизительно 667 ч.н.м. компонентов моющего средства в воде при стирке.
Система со средней концентрацией моющего средства включает моющие средства, в которых в воде при стирке присутствует от приблизительно 800 ч.н.м. до приблизительно 2000 ч.н.м. моющих компонентов. Моющие средства Северной Америки обычно рассматриваются как системы со средней концентрацией моющего средства, поскольку они содержат приблизительно 975 ч.н.м. моющих компонентов, присутствующих в воде при стирке. Бразилия имеет приблизительно 1500 ч.н.м. моющих компонентов, присутствующих в воде при стирке
Система с высокой концентрацией моющего средства включает моющие средства, в которых в воде при стирке присутствует более приблизительно 2000 ч.н.м. моющих компонентов. Европейские моющие средства рассматриваются как систему с высокой концентрацией моющего средства, поскольку они содержат приблизительно 4500-5000 ч.н.м. моющих компонентов, присутствующих в воде при стирке.
Моющие средства в Латинской Америке обычно представляют собой порошки с высоким содержанием фосфатных детергентов, образующих мыльную пену, и диапазон моющих средств, используемых в Латинской Америке, может попадать в средние и высокие концентрации моющего средства, поскольку они колеблются от 1500 до 6000 ч.н.м. моющих компонентов в воде при стирке. Как отмечено выше, Бразилия имеет приблизительно 1500 ч.н.м. моющих компонентов, присутствующих в воде при стирке. Однако в других географических районах фосфатные моющие компоненты с высоким уровнем мыльной пены, не ограничиваясь другими латиноамериканскими странами, могут иметь системы с высокой концентрацией моющего средства, содержащих вплоть до приблизительно 6000 ч.н.м. моющих компонентов, присутствующих в воде при стирке.
В свете вышесказанного, очевидно, что концентрации в моющих композициях в типичных растворах для стирки по всему миру изменяются от менее чем приблизительно 800 ч.н.м. моющей композиции («географические районы с низкой концентрацией моющего средства»), например, приблизительно 667 ч.н.м. в Японии, до от приблизительно 800 ч.н.м. до приблизительно 2000 ч.н.м. («географические районы со средней концентрацией моющего средства»), например, приблизительно 975 ч.н.м. в США и приблизительно 1500 ч.н.м. в Бразилии, до более приблизительно 2000 ч.н.м. («географические районы с высокой концентрацией моющего средства»), например, от приблизительно 4500 ч.н.м. до приблизительно 5000 ч.н.м. в Европе, и приблизительно 6000 ч.н.м. в географических районах с фосфатными моющими средствами с высоким уровнем мыльной пены.
Концентрации типичных моющих растворов определяют эмпирически. Например, в США типичная стиральная машина удерживает объем в 64,4 л моющего раствора. Соответственно для получения концентрации приблизительно 975 ч.н.м. моющего средства в моющем растворе приблизительно 62,79 г композиции моющего средства должно быть добавлено к 64,4 л моющего раствора. Данное количество представляет собой типичное количество, измеренное в воде для стирки потребителем с использованием измерительной ложки, прилагаемой к стиральному порошку.
В качестве следующего примера в различных географических районах используют различную температуру стирки. Например, температура воды для стирки в Северной Америке и Японии обычно составляет от 10 до 30°С (например, приблизительно 20°С), тогда как температура воды для стирки в Европе обычно составляет от 30 до 60°С (например, приблизительно 40°С). Кроме того, в некоторых других регионах холодную воду обычно используют для стирки, а также для мытья посуды. В некоторых вариантах осуществления при «стирке в холодной воде» по настоящему изобретению используют стирку при температуре от приблизительно 10°С до приблизительно 40°С, или от приблизительно 20°С до приблизительно 30°С, или от приблизительно 15°С до приблизительно 25°С, а также при других комбинациях температур в диапазоне от приблизительно 15°С до приблизительно 35°С и всех диапазонах в интервале 10°С-40°С.
В качестве следующего примера различные географические районы имеют воду с различной жесткостью. Жесткость воды обычно описывают в терминах гран на галлон смешанных Ca2+/Mg2+. Жесткость является мерой количества кальция (Ca2+) и магния (Mg2+) в воде. В большинстве вода в Соединенных Штатах Америки является жесткой, но степень жесткости варьирует. Вода, от умеренно жесткой (60-120 ч.н.м.) до жесткой (121-181 ч.н.м.), содержит от 60 до 181 частей на миллион (части на миллион, переведенные в граны на галлон США, составляют ч.н.м., деленные на 17,1, равно гранам на галлон) жестких минералов.
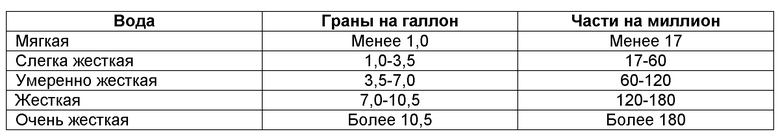
Жесткость воды в Европе обычно превышает 10,5 (например, 10,5-20,0) гран на галлон смешанных Ca2+/Mg2+ (например, приблизительно 15 гран на галлон смешанных Ca2+/Mg2+). Жесткость воды в Северной Америке обычно выше, чем жесткость воды в Японии, но меньше, чем жесткость воды в Европе. Например, жесткость воды в Северной Америке может быть от 3 до 10 гран, 3-8 гран или приблизительно 6 гран. Жесткость воды в Японии обычно ниже, чем жесткость воды в Северной Америке, обычно меньше 4, например 3 грана на галлон смешанных Ca2+/Mg2+.
Соответственно, в некоторых вариантах осуществления настоящее изобретение относится к варианту протеазы, который обеспечивает неожиданные моющие свойства по меньшей мере при одном наборе условий мытья (например, температура воды, жесткость воды и/или концентрация моющего средства). В некоторых вариантах осуществления вариант протеазы по настоящему изобретению сопоставим по моющим характеристикам с другими субтилизиновыми протеазами. В некоторых вариантах осуществления вариант протеазы по настоящему изобретению превосходит моющие характеристики по сравнению с субтилизиновыми протеазами, коммерчески доступными в настоящее время. Таким образом, в некоторых предпочтительных вариантах осуществления вариант протеазы, разработанный в настоящем изобретении, проявляет повышенную окислительную стабильность, повышенную термическую стабильность и/или повышенную стабильность к хелатообразованию. Дополнительно, вариант протеазы по настоящему применению находит применение в чистящих композициях, которые не включают ингредиентов моющих средств, при использовании самого по себе или в сочетании с моющими средствами и стабилизаторами.
В некоторых вариантах осуществления по настоящему изобретению чистящие композиции включают вариант протеазы по настоящему изобретению на уровне от приблизительно 0,00001% до приблизительно 10% по весу композиции, а баланс (например, от приблизительно 99,999% до приблизительно 90,0%) включает вспомогательные чистящие вещества по весу композиции. В других аспектах настоящего изобретения, чистящие композиции по настоящему изобретению включают вариант протеазы на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% по весу от веса композиции, а баланс чистящей композиции (например, от приблизительно 99,9999% до приблизительно 90,0%, от приблизительно 99,999% до приблизительно 98%, от приблизительно 99,995% до приблизительно 99,5% по весу) составляют вспомогательные чистящие материалы.
Как описано в настоящем описании далее, в некоторых вариантах осуществления, в дополнение к разработанному здесь варианту протеазы, предпочтительные чистящие композиции включают один или несколько дополнительных ферментов или производных ферментов, которые обеспечивают чистящие эксплуатационные характеристики или полезные качестве по уходу за тканью.
Способы получения и применения чистящих композиций
В некоторых предпочтительных вариантах осуществления получают составы композиций по настоящему изобретению в любом подходящем виде и получают их любым способом, выбранным составителем (см., например, некоторые неограничивающие примеры в патентах США №№ 5879584, 5691297, 5574005, 5569645, 5565422, 5516448, 5489392 и 5486303). В некоторых вариантах осуществления, в которых желательна чистящая композиция с низким рН, рН такой композиции регулируют путем добавления кислотного вещества, такого как HCl.
Вспомогательные вещества
Хотя это и не является существенным в целях настоящего изобретения, в некоторых вариантах осуществления неограничивающий перечень вспомогательных агентов, приведенных в настоящем описании, является подходящим для применения в чистящих композициях по настоящему изобретению. Действительно, в некоторых вариантах осуществления вспомогательные агенты включены в чистящие композиции по настоящему изобретению. В некоторых вариантах осуществления вспомогательные вещества способствуют и/или усиливают чистящие характеристики, обрабатывают основу, предназначенную для чистки, и/или модифицируют эстетические качества чистящей композиции (например, отдушки, пигменты, красители и т.д.). Следует понимать, что такие вспомогательные агенты предназначены в дополнение к варианту серинпротеазы по настоящему изобретению. Точная природа этих дополнительных компонентов и уровень их содержания зависят от физической формы композиции и природы чистящего процесса, для которого она предназначена. Подходящие вспомогательные вещества включают, но не ограничиваются указанным, поверхностно-активные вещества, моющие компоненты, комплексообразующие агенты, агенты, ингибирующие перенос красителей, вспомогательные средства против образования накипи, диспергирующие агенты, дополнительные ферменты и стабилизаторы ферментов, каталитические материалы, активаторы отбеливания, стимуляторы отбеливания, перекись водорода, источники перекиси водорода, предварительно полученные перкислоты, полимерные диспергирующие агенты, глинистые агенты удаления грязи/агенты против повторного осаждения грязи, агенты для придания блеска, подавители мыльной пены, красители, отдушки, агенты, придающие эластичность структуре, умягчители ткани, носители, гидротропные вещества, вспомогательные добавки для обработки и/или пигменты. Помимо тех, которые ясно указаны в настоящем описании, в данной области известны дополнительные примеры (см., например, патенты США №№ 5576282, 6306812 и 6326348). В некоторых вариантах осуществления вышеуказанные вспомогательные ингредиенты составляют баланс чистящих композиций по настоящему изобретению.
Поверхностно-активные вещества
В некоторых вариантах осуществления чистящие композиции по настоящему изобретению включают по меньшей мере одно поверхностно-активное вещество или поверхностно-активную систему, где поверхностно-активное вещество выбирают из неионных поверхностно-активных веществ, анионных поверхностно-активных веществ, катионных поверхностно-активных веществ, амфолитных поверхностно-активных веществ, цвиттерионных поверхностно-активных веществ, полуполярных неионных поверхностно-активных веществ и их смесей. В некоторых вариантах осуществления чистящей композиции с низким значением рН (например, композиции, имеющие в неразбавленном виде pH от приблизительно 3 до приблизительно 5), композиция обычно не содержит этоксилированного алкилсульфата, поскольку предполагается, что такое поверхностно-активное вещество может гидролизоваться кислыми составляющими таких композиций. В некоторых вариантах осуществления поверхностно-активное вещество присутствует на уровне от приблизительно 0,1% до приблизительно 60%, тогда как в альтернативных вариантах осуществления уровень составляет от приблизительно 1% до приблизительно 50%, тогда как в других вариантах осуществления уровень составляет от приблизительно 5% до приблизительно 40% по весу чистящей композиции.
Моющие компоненты
В некоторых вариантах осуществления чистящие композиции по настоящему изобретению включают один или несколько моющих компонентов детергента или систем моющих компонентов. В некоторых вариантах осуществления, включающих по меньшей мере один моющий компонент, чистящие композиции включают по меньшей мере приблизительно 1%, от приблизительно 3% до приблизительно 60% или даже от приблизительно 5% до приблизительно 40% моющего компонента по весу чистящей композиции. Моющие компоненты включают, но не ограничиваются указанным, соли щелочного металла, аммония и алканоламмония полифосфатов, силикаты щелочных металлов, карбонаты щелочноземельных и щелочных металлов, алюмосиликаты, поликарбоксилатные соединения, простые эфиры гидроксиполикарбоксилатов, сополимеры малеинового ангидрида с этиленом или винилметиловым эфиром, 1,3,5-тригидроксибензол-2,4,6-трисульфоновую кислоту и карбоксиметилоксиянтарную кислоту, различные соли щелочных металлов, аммония и замещенного аммония полиуксусных кислот, таких как этилендиаминтетрауксусная кислота и нитрилотриуксусная кислота, а также поликарбоксилаты, такие как меллитовая кислота, янтарная кислота, лимонная кислота, оксидиянтарная кислота, полималеиновая кислота, бензол-1,3,5-трикарбоновая кислота, карбоксиметилоксиянтарная кислота и их растворимые соли. Действительно, подразумевается, что любой подходящий моющий компонент будет находить применение в различных вариантах осуществления настоящего изобретения.
В некоторых вариантах осуществления моющие компоненты образуют водорастворимые прочные ионные комплексы (например, комплексообразующие моющие компоненты), такие как цитраты и полифосфаты (например, триполифосфат натрия и гексагидрат триполифосфата натрия, триполифосфат калия и смешанный триполифосфат натрия и калия и т.д.). Подразумевается, что любой подходящий моющий компонент будет находить применение в настоящем изобретении, включая известные в данной области (см., например, ЕР 2100949).
Комплексообразующие агенты
В некоторых вариантах осуществления чистящие композиции по настоящему изобретению содержат по меньшей мере один комплексообразующий агент. Подходящие комплексообразующие агенты включают, но не ограничиваются указанным, комплексообразующие агенты для меди, железа и/или марганца, и их смеси. В тех вариантах осуществления, где используется по меньшей мере один комплексообразующий агент, чистящие композиции по настоящему изобретению включают от приблизительно 0,1% до приблизительно 15% или даже от приблизительно 3,0% до приблизительно 10% комплексообразующего агента по весу от рассматриваемой чистящей композиции.
Вспомогательные средства против образования накипи
В некоторых вариантах осуществления чистящие композиции по настоящему изобретению включают по меньшей мере одно вспомогательное средство против образования накипи. Подходящие вспомогательные средства против образования накипи включают, но не ограничиваются указанным, полиэтиленгликоль, полипропиленгликоль, поликарбоксилат, удаляющие загрязнения полимеры, такие как полителефталевая кислота, глины, такие как каолинит, монтмориллонит, атапульгит, иллит, бентонит, галлоизит и их смеси.
Агенты против повторного осаждения
Как указано в настоящем описании, агенты против повторного осаждения находят применение в некоторых вариантах осуществления настоящего изобретения. В некоторых предпочтительных вариантах осуществления находят применение неионные поверхностно-активные вещества. Например, в вариантах осуществления для автоматических посудомоечных машин неионные поверхностно-активные вещества применяют с целью модификации поверхности, в частности, для образования защитного слоя, для предотвращения образования пленки и пятен и для улучшения блеска. Эти неионные поверхностно-активные вещества также находят применение для предотвращения повторного осаждения загрязнений. В некоторых предпочтительных вариантах осуществления агент против повторного осаждения представляет собой неионное поверхностно-активное вещество, как известно в данной области (см., например, ЕР 2100949).
Агенты, ингибирующие перенос красителей
В некоторых вариантах осуществления чистящие композиции по настоящему изобретению включают один или несколько агентов, ингибирующих перенос красителей. Подходящие полимерные агенты, ингибирующие перенос красителей, включают, но не ограничиваются указанным, поливинилпирролидоновые полимеры, полиамин-N-оксидные полимеры, сополимеры N-винилпирролидона и N-винилимидазола, поливинилоксазолидоны и поливинилимидазолы или их смеси. В тех вариантах осуществления, где используется по меньшей мере один агент, ингибирующий перенос красителей, чистящие композиции по настоящему изобретению включают от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,01% по приблизительно 5% или даже от приблизительно 0,1% до приблизительно 3% по весу от веса чистящей композиции.
Силикаты
В некоторых вариантах осуществления в композиции по настоящему изобретению включены силикаты. В некоторых таких вариантах осуществления находят применение силикаты натрия (например, дисиликат натрия, метасиликат натрия и кристаллические филлосиликаты). В некоторых вариантах осуществления силикаты присутствуют на уровне от приблизительно 1% до приблизительно 20%. В некоторых предпочтительных вариантах осуществления силикаты присутствуют на уровне от приблизительно 5% до приблизительно 15% по весу из расчета на вес композиции.
Диспергирующие агенты
В некоторых вариантах осуществления чистящие композиции по настоящему изобретению содержат по меньшей мере один диспергирующий агент. Подходящие водорастворимые органические вещества включают, но не ограничиваются указанным, гомо- и сополимерные кислоты или их соли, в которых поликарбоновая кислота включает по меньшей мере два карбоксильных радикала, отделенных друг от друга не более чем двумя атомами углерода.
Ферменты
В некоторых вариантах осуществления чистящие композиции по настоящему изобретению включают дополнительные очищающие ферменты, которые обеспечивают чистящие эксплуатационные характеристики, и/или уход за тканью, и/или суммарный полезный результат для посуды. Примеры подходящих ферментов включают, но не ограничиваются указанным, гемицеллюлазы, целлюлазы, пероксидазы, протеазы, металлопротеазы, ксиланазы, липазы, фосфолипазы, эстеразы, пергидролазы, кутиназы, пектиназы, пектатлиазы, маннаназы, кератиназы, редуктазы, оксидазы, фенолоксилазы, липоксигеназы, лигниназы, пуллуланазы, танназы, пентосаназы, маланазы, β-глюканазы, арабиносидазы, гуалуронидазу, хондроитиназу, лакказу и амилазы или их смеси. В некоторых вариантах осуществления используют комбинацию ферментов (т.е. «коктейль»), включающий общепринято применяемые ферменты, такие как протеаза, липаза, кутиназа, и/или используют целлюлазу в сочетании с амилазой.
Любые другие подходящие протеазы находят применение в композициях по настоящему изобретению. Подходящие протеазы включают ферменты животного, растительного или микробного происхождения. В некоторых особо предпочтительных вариантах осуществления используют микробные протеазы. В некоторые варианты осуществления включены химически или генетически модифицированные мутанты. В некоторых вариантах осуществления протеаза представляет собой серинпротеазу, предпочтительно щелочную микробную протеазу или трипсиноподобную протеазу. Примеры щелочных протеаз включают субтилизины, особенно полученные из Bacillus (например, субтилизин, lentus, amyloliquefaciens, субтилизин Carlsberg, субтилизин 309, субтилизин 147 и субтилизин 168). Дополнительные примеры включают мутантные протеазы, описанные в патентах США №№ RE 34606, 5955340, 5700676, 6312936 и 6482628, все из которых включены в настоящее описание путем ссылки. Дополнительные примеры протеаз включают, но не ограничиваются указанным, трипсин (например, свиного или бычьего происхождения) и протеазу Fusarium, описанную в WO 89/06270. Предпочтительные коммерчески доступные протеазные ферменты включают MAXATASE®, MAXACAL™ MAXAPEM™, OPTICLEAN®, OPTIMASE®, PROPERASE®, PURAFECT®, PURAFECT® OXP, PURAMAX®, PURAFAST™ и EXCELLASE® (Genencor); ALCALASE®, SAVINASE®, PRIMASE®, DURAZYM™, KANNASE®, POLARZYME®, LIQUANASE®, OVOZYME®, NEUTRASE®, RELASE® и ESPERASE® (Novozymes); и BLAP™ (Henkel Kommanditgesellschaft auf Aktien, Дюссельдорф, Германия). Различные протеазы описаны в WO 95/23221, WO 92/21760 и публикации патента США № 2008/0090747, патентах США №№ 5801039, 5340735, 5500364, 5855625, США RE 34606, 5955340, 5700676, 6312936 и 6482628 и различных других патентах. В некоторых дополнительных вариантах осуществления в настоящем изобретении находят применение металлопротеазы, включая, но не ограничиваясь указанным, нейтральные металлопротеазы, описанные в WO 07/044993.
Дополнительно, в настоящем изобретении находят применение любые подходящие липазы. Подходящие липазы включают, но не ограничиваются указанным, липазы бактериального или грибкового происхождения. Настоящее изобретение охватывает и химически или генетически модифицированные мутанты. Примеры пригодных липаз включают липазу Humicola lanuginosa (см., например, EP 258 068, EP 305 216 и патент США № 6939702), липазу Rhizomucor miehei (см., например, EP 238 023), липазу Candida, такую как липаза C. antarctica (например, липаза C. antarctica A или B; см., например, EP 214 761), липазу Pseudomonas, такую как P. alcaligenes и липаза P. pseudoalcaligenes (см., например, EP 218 272), липазу P. cepacia (см., например, EP 331 376), липазу P. stutzeri (см., например, патент Великобритании GB 1372034), липазу P. fluorescens, липазу Bacillus (например, липаза B. subtilis [Dartois et al., Biochem. Biophys. Acta 1131:253-260 [1993]); липазу B. stearothermophilus [см., например, патент Японии JP 64/744992]; и липазу B. pumilus [см., например, WO 91/16422]).
Кроме того, в некоторых вариантах осуществления настоящего изобретения находит применение ряд клонированных липаз, включая, но не ограничиваясь указанным, липазу Penicillium camembertii (см., Yamaguchi et al., Gene 103:61-67 [1991]), липазу Geotricum candidum (см., Schimada et al., J. Biochem., 106:383-388 [1989]), и различные липазы Rhizopus, такие как липаза R. delemar (см., Hass et al., Gene 109:117-113 [1991]), липаза R. niveus (Kugimiya et al., Biosci. Biotech. Biochem. 56:716-719 [1992]) и липаза R. oryzae.
Другие типы липолитических ферментов, такие как кутиназа, также находят применение в некоторых вариантах осуществления настоящего изобретения, включая, но не ограничиваясь указанным, кутиназу, полученную из Pseudomonas mendocina (см., WO 88/09367) и кутиназу, полученную из Fusarium solani pisi (см., WO 90/09446).
Дополнительные подходящие липазы включают коммерчески доступные липазы, такие как M1 LIPASETM, LUMA FASTTM и LIPOMAXTM(Genencor); LIPOLASE® и LIPOLASE® ULTRA (Novozymes); и LIPASE PTM "Amano" (Amano Pharmaceutical Co. Ltd., Япония).
В некоторых вариантах осуществления настоящего изобретения, чистящие композиции по настоящему изобретению дополнительно включают липазы на уровне от приблизительно 0,00001% до приблизительно 10% дополнительной липазы по весу от веса композиции и баланс чистящих вспомогательных веществ по весу от веса композиции. В других аспектах настоящего изобретения чистящие композиции по настоящему изобретению также включают липазы на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% липазы по весу от веса композиции.
Любая амилаза (альфа и/или бета), подходящая для использования в щелочных растворах, также находит применение в некоторых вариантах осуществления настоящего изобретения. В некоторые варианты осуществления включены химически или генетически модифицированные мутанты. Амилазы, которые находят применение в настоящем изобретении, включают, но не ограничиваются указанным, α-амилазы, полученные от B. licheniformis (см., например, патент Великобритании GB 1296839). Коммерчески доступные амилазы, которые находят применение в настоящем изобретении, включают, но не ограничиваются указанным, DURAMYL®, TERMAMYL®, FUNGAMYL®, STAINZYME®, STAINZYME PLUS®, STAINZYME ULTRA®, NATALASE® и BANTM (Novozymes), а также POWERASETM, RAPIDASE® и MAXAMYL® P (Genencor).
В некоторых вариантах осуществления настоящего изобретения чистящие композиции по настоящему изобретению дополнительно включают амилазы на уровне от приблизительно 0,00001% до приблизительно 10% дополнительной амилазы по весу от веса композиции и баланс чистящих вспомогательных веществ по весу от веса композиции. В других аспектах настоящего изобретения, чистящие композиции по настоящему изобретению также включают амилазы на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% амилазы по весу от веса композиции.
В некоторых дополнительных вариантах осуществления любая подходящая целлюлаза находит применение с чистящих композициях по настоящему изобретению. Подходящие целлюлазы включают, но не ограничиваются указанным, липазы бактериального или грибкового происхождения. В некоторые варианты осуществления включены химически или генетически модифицированные мутанты. Подходящие целлюлазы включают, но не ограничиваются указанным, целлюлазы Humicola insolens (см., например, патент США № 4435307). Особенно подходящими целлюлазами являются целлюлазы, обладающие эффектом по уходу за цветом (см., например, ЕР 0495257). Коммерчески доступные целлюлазы, которые находят применение в настоящем изобретении, включают, но не ограничиваются указанным, CELLUZYME® (Novozymes), и KAC-500(B)ТМ (Kao Corporation). В некоторых вариантах осуществления целлюлазы включены в виде частей или фрагментов зрелых дикого типа или вариантов целлюлаз, где часть N-конца удалена (см., например, патент США № 5874276). В некоторых вариантах осуществления, чистящие композиции по настоящему изобретению дополнительно включают целлюлазы на уровне от приблизительно 0,00001% до приблизительно 10% дополнительной целлюлазы по весу от веса композиции и баланс чистящих вспомогательных веществ по весу от веса композиции. В других аспектах настоящего изобретения, чистящие композиции по настоящему изобретению также включают целлюлазы на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% целлюлазы по весу от веса композиции.
Любые маннаназы, подходящие для применения в моющих композициях, также находят применение в настоящем изобретении. Подходящие маннаназы включают, но не ограничиваются указанным, те, которые имеют бактериальное или грибковое происхождение. В некоторые варианты осуществления включены химически или генетически модифицированные мутанты. Известны различные маннаназы, которые находят применение в настоящем изобретении (см., например, патент США № 6566114, патент США № 6602842 и патент США № 6440991, все из которых включены в настоящее описание путем ссылки). В некоторых вариантах осуществления чистящие композиции по настоящему изобретению дополнительно включают маннаназы на уровне от приблизительно 0,00001% до приблизительно 10% дополнительной маннаназы по весу от веса композиции и баланс чистящих вспомогательных веществ по весу от веса композиции. В других аспектах настоящего изобретения, чистящие композиции по настоящему изобретению также включают маннаназы на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% маннаназы по весу от веса композиции.
В некоторых вариантах осуществления в композициях по настоящему изобретению используют пероксидазы в комбинации с перекисью водорода или ее источником (например, перкарбонат, перборат или персульфат). В некоторых альтернативных вариантах осуществления оксидазы используют в комбинации с кислородом. Оба типа ферментов используют для «отбеливания раствора» (т.е. для предотвращения переноса текстильной краски от окрашенной ткани к другой ткани, когда ткани стирают одновременно в моющем растворе), предпочтительно вместе с усилителем (см., например, WO 94/12621 и WO 95/01426). Подходящие пероксидазы/оксидазы включают, но не ограничиваются указанным, ферменты растительного, бактериального или грибкового происхождения. В некоторые варианты осуществления включены химически или генетически модифицированные мутанты. В некоторых вариантах осуществления чистящие композиции по настоящему изобретению дополнительно включают пероксидазные и/или оксидазные ферменты на уровне от приблизительно 0,00001% до приблизительно 10% дополнительной пероксидазы и/или оксидазы по весу от веса композиции и баланс чистящих вспомогательных веществ по весу от веса композиции. В других аспектах настоящего изобретения чистящие композиции по настоящему изобретению также включают пероксидазные и/или оксидазные ферменты на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% пероксидазных и/или оксидазных ферментов по весу от веса композиции.
В некоторых вариантах осуществления находят применение дополнительные ферменты, включая, но не ограничиваясь указанным, пергидролазы (см., например, WO 05/056782). В дополнение, некоторые особенно предпочтительные варианты осуществления охватывают смеси вышеуказанных ферментов, в частности, одной или нескольких дополнительных протеаз, амилаз, липаз, маннаназ и/или по меньшей мере одной целлюлазы. Действительно, подразумевается, что различные смеси этих ферментов найдут применение в настоящем изобретении. Также подразумевается, что различные уровни варианта протеазы и одного или нескольких дополнительных ферментов могут, независимо, колебаться до приблизительно 10%, баланс чистящей композиции составляют чистящие вспомогательные вещества. Определенный выбор чистящих вспомогательных веществ легко совершается с учетом поверхности, изделия или ткани, предназначенных для чистки, и желаемой формы композиции для условий чистки во время использования (например, применение в качестве моющего средства).
Стабилизаторы ферментов
В некоторых вариантах осуществления настоящего изобретения ферменты, использованные в моющих композициях по настоящему изобретению, являются стабилизированными. В некоторых вариантах осуществления стабилизаторы ферментов включают олигосахариды, полисахариды и неорганические соли двухвалентных металлов, включая щелочноземельные металлы, такие как соли кальция. Подразумевается, что различные методы стабилизации ферментов будут находить применение в настоящем изобретении. Например, в некоторых вариантах осуществления использованные ферменты стабилизированы за счет присутствия водорастворимых источников ионов цинка(II), кальция(II) и магния(II) в конечных композициях, что обеспечивает такие ионы для ферментов, а также ионов других металлов (например, бария(II), скандия(II), железа(II), марганца(II), алюминия(III), олова(II), кобальта(II), меди(II), никеля(II) и оксованадия(IV). Хлориды и сульфаты также находят применение в настоящем изобретении. Примеры подходящих олигосахаридов и полисахаридов (например, декстринов) известны в данной области (см., например, WO 07/145964). В некоторых вариантах осуществления также находят применение обратимые ингибиторы протеазы, такие как борсодержащие соединения (например, борат, 4-формилфенилбороновая кислота), и/или, при желании, трипептидный альдегид находит применение для дополнительного улучшения стабильности.
Отбеливатели, активаторы отбеливания и катализаторы отбеливания
В некоторых вариантах осуществления в композициях по настоящему изобретению присутствуют отбеливатели, активаторы отбеливания и/или катализаторы отбеливания. В некоторых вариантах осуществления чистящие композиции по настоящему изобретению включают неорганическое и/или органическое отбеливающее соединение(я). Неорганические отбеливатели включают, но не ограничиваются указанным, пергидратные соли (например, перборатные, перкарбонатные, перфосфатные, персульфатные и персиликатные соли). В некоторых вариантах осуществления неорганические пергидратные соли представляют собой соли щелочных металлов. В некоторых вариантах осуществления неорганические пергидратные соли включены в виде кристаллического твердого вещества, без дополнительной защиты, хотя в некоторых других вариантах осуществления, соль покрыта оболочкой. Любая подходящая соль, известная в данной области, находит применение в настоящем изобретении (см., например, ЕР 2100949).
В некоторых вариантах осуществления в композициях по настоящему изобретению используют активаторы отбеливания. Активаторы отбеливания обычно представляют собой предшественники органических перкислот, которые усиливают отбеливающие действие в процессе чистке при температуре 60°С или ниже. Активаторы отбеливания, подходящие для применения в настоящем изобретении, включают соединения, которые в условиях пергидролиза, образуют алифатические пероксокарбоновые кислоты, имеющие, предпочтительно, от приблизительно 1 до приблизительно 10 атомов углерода, в частности, от приблизительно 2 до приблизительно 4 атомов углерода, и/или необязательно замещенную пербензойную кислоту. Дополнительные активаторы отбеливания известны в данной области и находят применение в настоящем изобретении (см., например, ЕР 2100949).
Дополнительно, в некоторых вариантах осуществления и как в дальнейшем будет описано, чистящие композиции по настоящему изобретению дополнительно включают по меньшей мере один катализатор отбеливания. В некоторых вариантах осуществления находят применение триазациклононан марганца и родственные комплексы, а также комплексы кобальта, меди, марганца и железа. Дополнительные катализаторы отбеливания находят применение в настоящем изобретении (см., например, патент США 4246612, 5227084, 4810410, WO 99/06521 и ЕР 2100949).
Каталитические комплексы металлов
В некоторых вариантах осуществления чистящие композиции по настоящему изобретению содержат один или несколько каталитических комплексов металлов. В некоторых вариантах осуществления находят применение металлосодержащие катализаторы отбеливания. В некоторых предпочтительных вариантах осуществления металлический катализатор отбеливания включает каталитическую систему, включающую катион переходного металла с определенной каталитической активностью при отбеливании (например, катионы меди, титана, рутения, вольфрама, молибдена или марганца), вспомогательный катион металла, обладающий слабой или не обладающий каталитической активностью при отбеливании (например, катионы цинка или алюминия), и комплексон, обладающий определенными константами стабильности для каталитических и вспомогательных катионов металлов, в частности, используются этилендиаминотетрауксусная кислота, этилендиаминтетра(метиленфосфоновая кислота) и их водорастворимые соли (см., например, патент США № 4430243). В некоторых вариантах осуществления чистящие композиции по настоящему изобретению катализируют с помощью соединения марганца. Такие соединения и уровни их содержания при применении хорошо известны в данной области (см., например, патент США № 5576282). В дополнительных вариантах осуществления кобальтовые катализаторы отбеливания находят применение в чистящих композициях по настоящему изобретению. Различные кобальтовые катализаторы отбеливания известны в данной области (см., например, патенты США №№ 5597936 и 5595967), и их легко получают с помощью известных способов.
В дополнительных вариантах осуществления чистящие композиции по настоящему изобретению включают комплекс переходного металла с макрополициклическим жестким лигандом (МЖЛ). В качестве практического момента, а не в качестве ограничения, в некоторых вариантах осуществления композиции и способы чистки, представленные в настоящем изобретении, регулируют таким образом, чтобы обеспечить по меньшей мере одну часть на сто миллионов активных видов МЖЛ в водной моющей среде, и в некоторых предпочтительных вариантах осуществления, обеспечивают от приблизительно 0,005 ч.н.м. до приблизительно 25 ч.н.м., более предпочтительно от приблизительно 0,05 ч.н.м. до приблизительно 10 ч.н.м. и наиболее предпочтительно от приблизительно 0.1 ч.н.м. до приблизительно 5 ч.н.м. МЖЛ в моющем растворе.
Предпочтительные переходные металлы в настоящих катализаторах отбеливания на основе переходных металлов включают, но не ограничиваются указанным, марганец, железо и хром. Предпочтительные МЖЛ также включают, но не ограничиваются указанным, ультра-жесткие лиганды, которые являются поперечно сшитыми (например, 5,12-диэтил-1,5,8,12-тетраазабицикло[6.6.2]гексадекан). Подходящие комплексы переходных металлов с МЖЛ легко получают известными способами (см., например, WO 2000/32601 и патент США № 6225464).
Агенты ухода за металлами
В некоторых вариантах осуществления чистящие композиции по настоящему изобретению включают агенты ухода за металлами. Агенты ухода за металлами находят применение для предотвращения и/или уменьшения потускнения, коррозии и/или окисления металлов, включая алюминий. Нержавеющую сталь и не железные металлы (например, серебро и медь). Подходящие агенты ухода за металлами включают описанные в ЕР 2100949, WO 9426860 и WO 94/26859). В некоторых вариантах осуществления агент ухода за металлами представляет собой соль цинка. В некоторых дополнительных вариантах осуществления чистящие композиции по настоящему изобретению. Включают от приблизительно 0,1% до приблизительно 5% по весу одного или нескольких агентов ухода за металлами.
Способы получения и применения чистящих композиций
В некоторых предпочтительных вариантах осуществления получают составы композиций по настоящему изобретению в любом подходящем виде и получают их любым способом, выбранным составителем (см., например, патенты США №№ 5879584, 5691297, 5574005, 5569645, 5565422, 5516448, 5489392, 5486303, 4515705, 4537706, 4515707, 4550862, 4561998, 4597898, 4968451, 5565145, 5929022, 6294514 и 6376445).
В некоторых вариантах осуществления чистящие композиции по настоящему изобретению разработаны в виде единичной дозированной формы, включая таблетки, капсулы, саше, мешочки и многокомпонентные мешочки. В некоторых вариантах осуществления формат дозированной формы разработан таким образом, чтобы обеспечить контролируемое высвобождение ингредиентов из многокомпонентного мешочка (или другого единичного дозированного формата). Подходящие форматы единичной дозировки и контролируемого высвобождения известны в данной области (см., например, EP 2100949, WO 02/102955, патенты США №№ 4765916 и 4972017 и WO 04/111178, касающиеся материалов, подходящих для применения в форматах единичной дозировки и контролируемого высвобождения).
Способ применения
В предпочтительных вариантах осуществления чистящие композиции по настоящему изобретению находят применение для чистки поверхностей (например, посуды) и/или ткани. В некоторых вариантах осуществления по меньшей мере одну часть поверхности и/или ткани приводят в контакт с по меньшей мере одним из вариантов осуществления чистящих композиций по настоящему изобретению, в неразбавленном или в разбавленном в моющем растворе виде, и затем поверхность и/или ткань необязательно промывают и/или ополаскивают. В целях настоящего изобретения «промывание» включает, но не ограничивается указанным, очистку жесткой щеткой или механическое встряхивание. В некоторых вариантах осуществления ткань включает любую ткань, которую можно стирать в обычных потребительских условиях. В предпочтительных вариантах осуществления чистящие композиции по настоящему изобретению используются в концентрациях от приблизительно 500 ч.н.м. (частей на миллион) до приблизительно 15000 ч.н.м. в растворе. В некоторых вариантах осуществления, промывающих растворителем является вода, температура воды обычно составляет от приблизительно 5°С до приблизительно 90°С. В некоторых предпочтительных вариантах осуществления для чистки тканей, отношение воды к массе ткани составляет обычно от приблизительно 1:1 до приблизительно 30:1.
Экспериментальная часть
Следующие примеры приведены для демонстрации и дополнительной иллюстрации некоторых предпочтительных вариантов осуществления и аспектов настоящего изобретения, и их не следует истолковывать в качестве ограничивающих объем изобретения.
В нижеследующем описании экспериментальной части используются следующие сокращения: ч.н.м. (части на миллион); M (молярный); мM (миллимолярный); мкM (микромолярный); нM (наномолярный); моль (моли); ммоль (миллимоли); мкмоль (микромоли); нмоль (наномоли); г (граммы); мг (миллиграммы); мкг (микрограммы); пг (пикограммы); л (литры); мл и мЛ (миллилитры); мкл и мкЛ (микролитры); см (сантиметры); мм (миллиметры); мкм (микрометры); нм (нанометры); Е (единицы); В (вольты); MW (молекулярная масса); сек (секунды); мин (минуты/минуты); ч и час (час/часы); °C (градусы Цельсия); QS (достаточное количество); ND (не делали); NA (не применимо); об/мин (обороты в минуту); вес/об (вес к объему); об/об (объем к объему); g (сила тяжести); ОП (оптическая плотность); АК (аминокислота); п.о. (комплементарная пара оснований нуклеиновых кислоты); т.п.о. (тысяча пар оснований нуклеиновых кислот); кД (килодальтоны); suc-AAPF-pNA (сукцинил-L-аланил-L-аланил-L-пролил-L-фенил-аланил-пара-нитроанилид); BPN' (субтилизин Bacillus amyloliquefaciens) ДМСО (диметилсульфоксид); кДНК (копия или комплементарная ДНК); ДНК (дезоксирибонуклеиновая кислота); оцДНК (одноцепочечная ДНК); дцДНК (двухцепочечная ДНК); dNTP (дезоксирибонуклеотид трифосфат); DTT (1,4-дитио-DL-треитол); H2O (вода); дH2O (деионизированная вода); HCl (хлористоводородная кислота); MgCl2 (хлорид магния); MOPS (3-[N-морфолино]пропансульфоновая кислота); NaCl (хлорид натрия); PAGE (электрофорез на полиакриламидном геле); PB92 (субтилизин Bacillus clausii); PBS (забуференный фосфатом физиологический раствор [150 мM NaCl, 10 мM натрийфосфатного буфера, pH 7,2]); ПЭГ (полиэтиленгликоль); ПЦР (полимеразная цепная реакция); PMSF (фенилметилсульфонилфторид); РНК (рибонуклеиновая кислота); SDS (додецилсульфат натрия); Tris (трис(гидроксиметил)аминометан); SOC (2% бактотриптон, 0,5% дрожжевой экстракт бакто, 10 мM NaCl, 2,5 мM KCl); Terrific Broth (TB; 12 г/л бактотриптон, 24 г/л глицерин, 2,31 г/л KH2PO4 и 12,54 г/л K2HPO4); ОП280 (оптическая плотность при 280 нм); ОП600 (оптическая плотность при 600 нм); A405 (поглощение при 405 нм); Vmax (максимальная первоначальная скорость фермент-катализируемой реакции); HEPES (N-[2-гидроксиэтил]пиперазин-N-[2-этансульфоновая кислота]); Tris-HCl (трис(гидроксиметил)аминометан-гидрохлорид); TCA (трихлоруксусная кислота); ВЭЖХ (жидкостная хроматография высокого давления); ОФ-ВЭЖХ (жидкостная хроматография высокого давления с обращенной фазой); ТСХ (тонкослойная хроматография); ЭДТА (этиендиаминтетрауксусная кислота); Taq (ДНК полимераза Therminus aquaticus), Klenow (крупный фрагмент (Кленова) ДНК полимеразы I), EtOH (этанол); SDS (додецилсульфат натрия); Tris (трис(гидроксиметил)аминометан); TAED (N,N,N'N'-тетраацетилэтилендиамин); PI (показатель эффективности); SR (удаление загрязнений или пятен soil); MS (масс-спектрометрия); AATCC (Американская ассоциация химиков-текстильщиков и колористов); Arzberg (Arzberg-Porzellan GmbH, Schirnding, Germany); BASF (BASF Corp., Florham Park, N.J.); BioRad (BioRad, Richmond, Calif.); Cognis (Cognis Corp, USA, Cincinnati, Ohio); Finnzymes (Finnzymes Oy, Espoo, Finland); Henkel (Henkel, GmbH, Dusseldorf, Germany); IKW (Industrieverband Kβrperflege und Waschmittel, = The German Cosmetic, Toiletry, Perfumery and Detergent Association, Frankfurt, Germany); Invitrogen (Invitrogen Corp., Carlsbad, Calif.); Kontron (Kontron Instruments, Zurich, Switzerland); Macherey-Nagel (Macherey-Nagel, Easton, Pa.); Miele (Miele, Princeton, N.J.) Merieux (Instirut Merieux, Codex, FR); QIAGEN® (Qiagen, Inc., Valencia, Calif.); (Reckitt Benckiser, Berks, United Kingdom); Sigma (Sigma Chemical Co., St. Louis, Mo.); Sorvall (Sorvall Instruments, a subsidiary of DuPont Co., Biotechnology Systems, Wilmington, Del.); и wfk Testmaterials (Testgewebe GmbH, Bruggen-Bracht, Germany).
Пример 1
Конструирование варианта субтилизина
Как описано в настоящем изобретении, вариант субтилизина был получен путем ПЦР слияния, как известно в данной области (см., например, опубликованная заявка на патент США 2006/0252155). В таблице 1-1 приведены последовательности праймеров, использованные для ПЦР слияния.
Праймеры, использованные для ПЦР слияния
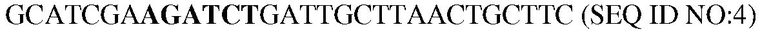
Темплат ДНК варианта PB92 B. clausii (содержащий следующие замещения N87R+G118R+S128L+P129Q+S130A+S188D+N248R; используется нумерация BPN', и обозначенный в настоящем описании как GCI-P039) использовали для генерирования варианта субтилизина, дополнительно включающего замещение N76D (обозначенное в настоящем описании как «РХ3»). Вариант, имеющий последовательность аминокислот, идентичную РХ3, также может быть получен из темплата ДНК варианта B. lentus GG36 (содержащего следующие замещения S87R+G118R+S128L+P129Q+S130A+S188D+N248R; используется нумерация BPN') путем введения замещения N76D.
Праймер BglII-Fw комбинировали с N76D-Rv в первой реакции для генерирования первого фрагмента, и второй фрагмент получали путем объединения праймера BglII-Rvc праймером N76D-Fw во второй реакции. Полимеразу PHUSIONTM (Finnzymes) использовали в ПЦР реакциях. В этих экспериментах 2 мкл прямого и обратного праймеров, 1 мкл 10 мМ dNTP, 10 мкл 5× буфера HF Phusion, 1,5 мкл ДМСО, 1 единицу полимеразы и 1 мкл темплата добавляли к объему в 50 мкл. Использовали следующую ПЦР программу: 3 минуты денатурирования при 95°С, 1 минуту отжига при 65°С и 1 мин 15 секунд удлинения при 72°С в течение 30 циклов и далее 7 минут при 72°С. После завершения продукты реакции хранили при комнатной температуре.
Фрагменты ДНК ожидаемого размера из двух ПЦР реакций очищали на агарозном геле с использованием колонок для ПЦР очистки (Macherey-Nagel). Два желаемых фрагмента сливали путем ПЦР амплификации с использованием прямого и обратного праймеров BglII и полимеразы PHUSIONTM с использованием следующей программы: 3 минуты денатурирования при 95°С, 1 минуту отжига при 65°С и 2 мин удлинения при 72°С в течение 25 циклов и далее 7 минут при 72°С. После завершения продукты реакции хранили при комнатной температуре.
Фрагменты ДНК из ПЦР реакции слияния получали путем расщепления с использованием фермента рестрикции BglII и очищали на агарозном геле. Фрагменты ДНК впоследствии лигировали с каркасом расщепленной BglII плазмиды pHPLT с использованием 1 мкл ДНК лигазы, 8 мкл 5× Е4 буфера лигирования в конечном объеме 40 мкл, в течение ночи при 14°С.
Соответствующие клетки B. subtilis (фенотип: ΔaprE, ΔnprE, oppA, ΔspoIIE, degUHy32, ΔamyE::[xylR,pxylA-comK]) трансформировали с использованием 10 мкл продукта лигирования для получения протеаза-положительных трансформантов, как известно в данной области (см., например, WO 02/14490). Бактерии делали компетентными путем индукции гена comK под контролем ксилоза-индуцируемого промотора (см., например, Hahn et al., Mol Microbiol, 21:763-775, 1996). Протеаза-положительные клоны отбирали на пластинах со снятым молоком/агаром, выделяли, секвенировали и получали белок в культурах в вибрационных колбах для накопления достаточных количеств образца фермента для характеризации.
Пример 2
Продуцирование варианта субтилизина в Bacillus subtilis
Вариант субтилизина получали путем выращивания трансформантов B. subtilis в течение ночи при 37°С в 10 мл среде TSB (триптон и бульон на основе сои). Аликвоту в 250 мкл культуры после ночи переносили в 25 мл заданной среды на основе MOPS в 100 мл встряхиваемой колбе и выращивали при 37°С в течение 68 часов. Заданную среду делали незаменимой, как известно в данной области (см. Neidhardt et al., J Bacteriol, 119: 736-747, 1974), за исключением того, что NH4Cl2, FeSO4 и CaCl2 не включали в основную среду, использовали 3 мМ K2HPO4 и основную среду дополняли 60 мМ мочевины, 75 г/л глюкозы и 1% сойтона. Также готовили питательные микроэлементы в виде 100× исходного раствора, содержащего в 1 литре 400 мг FeSO4·7H2O, 100 мг MnSO4·H2O, 100 мг ZnSO4·7H2O, 50 мг CuCl2·2H2O, 100 мг CoCl2·6H2O, 100 мг NaMoO4·2H2O, 100 мг Na2B4O7·10H2O, 10 мл 1M CaCl2 и 10 мл 0,5М цитрата натрия. Представляющую интерес протеазу (т.е. вариант протеазы) выделяли из культуральной среды.
Пример 3
Аналитические методы определения чистоты варианта субтилизина
В этом примере описаны способы, использованные для определения чистоты рекомбинантного субтилизина, полученного из культур B. subtilis. Протеазу считали чистой, когда одна полоса или пик были выявлены путем гель-электрофореза и высокоэффективной жидкостной хроматографии (ВЭЖХ), соответственно.
Электрофорез в полиакриламидном геле (PAGE) проводили в присутствии додецилсульфата натрия (SDS), как известно в данной области (Laemmli, Nature, 227:680-685, 1970). Однако перед денатурирование образцов белка (например, 10 минут в SDS-содержащем образце буфера при 100°С) была необходима деактивация активности протеазы для предотвращения авторазложения. Деактивацию протеазы проводили путем инкубирования образца белка с 1 мМ PMSF в течение 30 минут при комнатной температуре или путем осаждения белка с помощью 8% трихлоруксусной кислоты (TCA) в течение 30 минут на льду. Образцы белка подвергали нативному PAGE, проводимому при рН 7,45. Гелевый буфер состоял из 20 мМ гистидина и 50 мм 3-[N-морфолино]пропансульфоновой кислоты (MOPS), и 5% полиакриламидный гель имел соотношение акриламид:бисакриламид, равное 20:1. Образцы белка загружали на верх пластины геля и проводили электрофорез по отношению к катоду. Тот же буфер гистидин/MOPS использовали в качестве электрофоретического (емкость) буфера, но рН доводили до 6,3. После электрофореза (~1-2 ч при 350 В) гель замачивали в 8% уксусной кислоте для фиксации белков и геле и впоследствии окрашивали кумасси синим ярким R250 и снимали окрашивание, как известно в данной области, для локализации полос белка в геле.
Чистоту образца протеазы также подтверждали с помощью ВЭЖХ анализа с использованием катионообменной колонки MonoS с последующей гель-фильтрационной колонкой TSK 2000. Через первую пропускали 10 мМ натрий-фосфатный буфер, рН 5,5, при элюировании связанной протеазы с использованием линейного градиента 10-300 мМ натрий фосфата, рН 5,5. Гель-фильтрационную колонку проводили в 0,25 М ацетате натрия, рН 5,5. Профили элюирования белка контролировали при 280 нм для локализации целевой протеазы и определения процента чистоты образца.
Пример 4
Определение концентрации субтилизина
В этом примере описаны способы, использованные для определения концентраций субтилизина. В некоторых экспериментах измерения экстинкции проводили при 280 нм с использованием рассчитанного коэффициента экстинкции (D), и титрования активного сайта использовали для определения концентрации белка в очищенном растворе протеазы, как описано ниже.
Коэффициент экстинции при 280 нм рассчитывали от числа триптофанов (Trp, ε [эпсилон] = 5600 M-1·см-1) и тирозинов (Tyr, ε = 1,330 M-1·см-1) на молекулу фермента. Для протеазы PB92 молярный коэффициент экстинции составлял 26000 M-1·см-1 (3 Trp + 7 Tyr остатков), эквивалентный ε1%, измеренному при 280 нм = 9,7 (Mr=26729 Да). В случае мутантов с измененным числом триптофановых и/или тирозиновых остатков, делали соответствующие корректировки.
Оценку концентрации молекул активного фермента получали путем титрования активного сайта. Поскольку было показано, что широко используемый способ ацилирования N-трансциннамоилимидазола (Bender et al., J Am Chem Soc, 88:5890-5931, 1966) работает не удовлетворительно для протеазы РВ92, вместо него был разработан способ с использованием обратимого ингибитора PMSF. В этом способе раствор протеазы с оцененной концентрацией фермента (из поглощения при 280 нм) смешивали с 0,25, 0,50, 0,75, 1,00 и 1,25 эквивалентами PMSF, соответственно, и оставляли взаимодействовать в течение одного часа при комнатной температуре в 10 мМ натрий-фосфатном буфере, рН 6,5. Остаточную активность протеазы измеряли спектрофотометрически с использованием сукцинил-L-аланил-L-аланил-L-пролил-L-фенилаланил-паранитроанилида (suc-AAPF-pNA) в качестве субстрата. Для этих исследований чистоту (и следовательно концентрацию) PMSF определяли методом ЯМР спектроскопии и исходные растворы PMSF готовили в изопропаноле. Было установлено, что результаты титрования активного сайта согласуются с результатами определения концентрации белка при проверке его чистоты с использованием метода ВЭЖХ.
Пример 5
Тестирование эффективности мытья
В этом примере описаны способы, подходящие для оценки чистящих эксплуатационных характеристик при мытье посуды и стирке ткани для варианта РХ3 субтилизина и ссылочного субтилизина GCI-P038 в коммерчески доступных средствах для мытья посуды и стиральных порошках.
Последовательность аминокислот зрелого варианта протеазы РВ92, упоминаемого в настоящем описании как РХ3 и имеющего замещения N76D+N87R+G118R+S128L+P129Q+S130A+S188D+N248R (BPN' нумерация) следующая:

Последовательность аминокислот зрелого ссылочного субтилизина GCI-P037 (PB92) следующая:
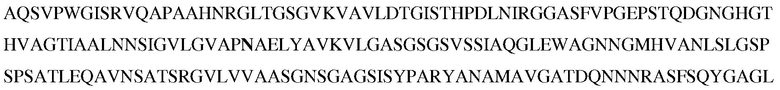
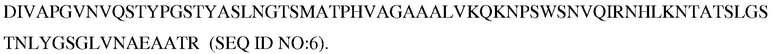
Последовательность аминокислот зрелого ссылочного субтилизина GCI-P038 следующая:

Эффективность при мытье посуды
В этом примере описаны способы, использованные для измерения эффективности при мытье посуды варианта РХ3 субтилизина и ссылочного субтилизина GCI-P038 в коммерчески доступных средствах для мытья посуды.
Эффективность варианта протеазы тестировали в различных условиях автоматической мойки посуды. Композиции моющих средств показаны в таблицах 5-1 и 5-2. Данные моющие средства являются коммерчески доступными от wfk Testmaterials и упоминаются под своими обозначениями в wfk Testmaterials. Данные моющие средства были получены из источника в отсутствие ферментов, чтобы иметь возможность анализа варианта протеазы.
Не содержащее фосфата моющее средство
IEC-60436 WFK тип В (рН 10,4 в 3 г/л)
Фосфат-содержащее моющее средство
IEC-60436 WFK тип С (рН 10,5 в 3 г/л)
Протоколы получения каждого из типов загрязнений (яичный желток, мясной фарш с яйцом и яйцо с молоком) приведены ниже. Перед нанесением индивидуальных типов загрязненений на тестируемую посуду, посуду тщательно мыли. Это было особенно необходимо поскольку остатки устойчивых загрязнений могут присутствовать на посуде из предшествующих тестов. Новую посуду также трижды тщательно мыли перед первичным использованием в тесте.
Получение загрязнений из яичного желтка на нержавеющей стали.
Листы нержавеющей стали (10×15 см; шероховатые с одной стороны), использованные в этих экспериментах, тщательно промывали при 95°С в лабораторной посудомоечной машине с использованием коммерческого высокощелочного моющего средства (например, моющее средство ECOLAB®, Henkel), для получения листов, которые были бы чистыми и не содержащими остатка жира. С этих листов снимали заусеницы перед первым применением. Листы сушили в течение 30 минут при 80°С в термическом шкафу перед нанесением загрязнения с использованием яичного желтка. Поверхности для обработки щеткой не трогали перед нанесением загрязнения. Также на поверхность не давали попадать воде или пушинкам. Охлажденные листы взвешивали перед нанесением загрязнений.
Яичные желтки получали путем отделения желтков из приблизительно 10-11 яиц (200 г яичного желтка) от белков. Желтки перемешивали вилкой в стеклянном стакане для гомогенизации суспензии желтка. Затем желтки процеживали (приблизительно 0,5 мм ячейки) для удаления крупных частиц и каких-либо остатков яичной скорлупы.
Плоскую щетку (2,5 дюйма) использовали для нанесения 2,0±0,1 г суспензии яичного желтка как можно более равномерно на площадь в 140 см2 шероховатой стороны каждого из листов из нержавеющей стали, оставляя незагрязненным кольцо шириной приблизительно 1 см (при необходимости использовали клейкую ленту). Загрязненные листы сушили в горизонтальном состоянии (для предотвращения образования капель на концах листов) при комнатной температуре в течение 4 часов (максимум 24 часа).
Для денатурации белков яичного желтка листы погружали на 30 секунд в кипящую деминерализованную воду (с использованием при необходимости удерживающего устройства). Затем листы опять сушили в течение 30 минут при 80°С. После сушки и охлаждения листы взвешивали. После взвешивания листы оставляли по меньшей мере на 24 часа (20°С, 40-60% относительная влажность) перед проведением теста на мытье. Для удовлетворения требованиям тестирования только листы с 1000±100мг/140 см2 (яичный желток после денатурации) использовали при тестировании. После проведения тестов на мытье листы сушили в течение 30 минут при 80°С в термическом шкафу и опять взвешивали после охлаждения. Процент эффективности очистки определяли путем деления мг яичного желтка, высвободившегося при мытье на мг нанесенного денатурированного яичного желтка и умножения на 100.
Получение загрязнений из мясного фарша и яйца на фарфоровых тарелках
Для этих экспериментов использовали десертные тарелки (Arzberg, диаметр 19 см, белый глазированный фарфор), удовлетворяющие EN 50242, форма 1495, No. 0219. Всего 225 г постной свинины и говядины (соотношение 50:50) мелко рубили и выдерживали на холоду. Смесь пропускали дважды через мясорубку. Поддерживали температуру выше 35°С. 225 г мясного фарша затем смешивали с 75 г яиц (белок и желток, смешанные вместе). Полученную смесь затем замораживали на срок до трех месяцев при -18°С перед применением. Если свинина была недоступна, использовали 100% говядину, поскольку они являются взаимозаменяемыми.
Смесь мясного фарша и яйца (300 г) доводили до комнатной температуры и смешивали с 80 мл деминерализованной воды. Смесь гомогенизировали в течение 2 минут с использованием кухонного ручного блендера. Для распределения 3 г смеси мясной фарш/яйцо/вода по каждой белой фарфоровой тарелке использовали вилку, оставляя не испачканной кромку шириной приблизительно 2 см вокруг круга. Нанесенное количество составляло 11,8±0,5 мг/см2. Тарелки сушили в течение 2 часов при 120°С в предварительно нагретом термическом шкафу. После того как тарелки охлаждались, они были готовы для использования.
После проведения испытаний на мытье посуды на тарелки распыляли раствор нингидрина (полученный в виде 1% раствор в этаноле) для лучшей идентификации остатков белка мясного фарша. Для промотирования цветной реакции тарелки нагревали в течение 10 минут при 80°С в термическом шкафу. Оценку эффективности мытья проводили путем визуального осмотра цветной реакции остатка мясного фарша со ссылкой на фотографический каталог IKW (IKW - Немецкая ассоциация производителей парфюмерно-косметических и моющих средств).
Получение загрязнений из яйца/молока на листах из нержавеющей стали
Листы нержавеющей стали (10×15 см; шероховатые с одной стороны), использованные в этих экспериментах, тщательно промывали при 95°С в лабораторной посудомоечной машине с использованием коммерческого высокощелочного моющего средства для удаления жирового налета и очистки листов. Листы вытирали досуха бумажным полотенцем. Поверхность, которая предназначена для обработки щеткой, не трогали перед нанесением загрязнения. Также на поверхность не давали попадать воде или пушинкам. Перед нанесением загрязнений листы помещали на 30 минут в термический шкаф при 80°С. Охлажденные листы взвешивали перед нанесением загрязнений.
Яичные желтки и белки от целых сырых яиц (3-4 яйца, приблизительно 160 г/яйцо) помещали в миску и взвивали венчиком для яиц. Затем к смеси добавляли 50 мл полуснятого молока (жирность 1,5%, ультравысокая температура, гомогенизированное). Молоко и яйца смешивали без вспенивания. Плоскую щетку использовали для равномерного распределения 1,0±0,1 г смеси яйцо/молоко на шероховатую сторону листов из нержавеющей стали с использованием баланса для контроля распределения. Вокруг короткой стороны листа оставляли границу приблизительно в 1,0 см. Загрязненные листы сушили в горизонтальном состоянии (для предотвращения образования капель на концах листов) при комнатной температуре в течение 4 часов (максимум 24 часа).
Для денатурации белков яичного желтка листы погружали на 30 секунд в кипящую деминерализованную воду (с использованием при необходимости удерживающего устройства). Затем листы опять сушили в течение 30 минут при 80°С. После сушки и охлаждения листы взвешивали. После взвешивания листы оставляли по меньшей мере на 24 часа (20°С, 40-60% относительная влажность) перед проведением теста на мытье. Для удовлетворения требованиям тестирования использовали только листы с 190±10мг смеси яйцо/молоко.
После проведения тестов на мытье листы сушили в течение 30 минут при 80°С в термическом шкафу и опять взвешивали после охлаждения. Процент эффективности очистки определяли путем деления мг смеси яйцо/молоко, высвободившегося при мытье на мг нанесенной смеси яйцо/молоко и умножения на 100.
Оборудования и условия для мытья
Тесты на мытье проводили в автоматической посудомоечной машине (Miele, модель G690SC), в которую закладывали загрязненную посуду и листы из нержавеющей стали, полученные, как описано выше. Температура теста составляли 50°С. Жесткость воды составляла 21°GH (немецкая жесткость).
Как описано выше, после мытья тарелки, испачканные мясным фаршем, оценивали визуально с помощью рейтинговой фотошкалы от 0 до 10, где «0» означает полностью грязную тарелку, и «10» означает чистую тарелку. Эти значения соответствуют способности ферментсодержащего моющего средства удалять грязь или загрязнения (SR).
Вымытые пластины из нержавеющей стали, испачканные яичным желтком или смесью яйцо/молоко, анализировали гравиметрически для определения количества остаточных загрязнений после мытья. Вариант субтилизина рХ3 и ссылочный субтилизин GCI-P038 тестировали на уровне от 0 до 30 мг/активного белка на одно мытье.
Результаты различных тестов для мытья посуды приведены ниже в таблицах от 5-3 до 5-6. В каждом из этих экспериментов использованы различные концентрации активной протеазы на одно мытье. Эффективности при мытье ссылочного субтилизина GCI-P038 приписывали значение «100», тогда как эффективность при мытье для варианта сравнивали с данным значением. Например, если ссылочный субтилизин GCI-P038 показывал результат удаления загрязнений в 45%, а вариант имел результат в 52% удаления загрязнений, то результат для варианта субтилизина, выраженный в виде индекса эффективности (PI), будет составлять 52/45×100=116. Таким образом для обоих вариантов протестированных моющих средств вариант субтилизина рХ3 был более или таким же эффективным, что и ссылочный субтилизин GCI-P038 при удалении белковых загрязнений применительно к мытью посуды.
Фосфатсодержащее моющее средство, 50°С, 21° GH, дозировано 0,05% активного белка
Фосфатсодержащее моющее средство, 50°С, 21°GH, дозировано 0,15% активного белка
Не содержащее фосфата моющее средство, 50°С, 21°GH, дозировано 0,05% активного белка
Не содержащее фосфата моющее средство, 50°С, 21°GH, дозировано 0,15% активного белка
Пример 6
Стабильность и чистящие характеристики варианта субтилизина
В этом примере описаны методы оценки стабильности и чистящих характеристик РХ3.
Метод анализа гидролиза AAPF
Термостабильность варианта серинпротеазы определяли путем анализа активности протеазы с использованием анализа AAPF после инкубирования варианта протеазы при 68°С в течение 1 часа. В условиях анализа, остаточная активность ссылочной протеазы (например, дикого типа GG36 = GCI-P036) составляла приблизительно 50%. Использованное оборудование: планшеты для микротитрования с F-дном (Costar No. 9017), робот Biomek FX и/или Biomek FXp (Beckman Coulter), ридер Spectramax Plus 384 MTP (Molecular Devices), инкубатор/шейкер iEMS (1 мм амплитуда) (Thermo/Labsystems), герметизирующая лента (Nunc No. 236366) и ледяная баня. Глициновый буфер получали путем растворения 3,75 г глицина (Merck No. 1.04201.1000) в 960 мл воды. К этому раствору добавляли 1 мл 5% TWEEN®-80 (Sigma No. P-8074) и 10 мл исходного раствора в 1000 мM CaCl2 (Merck No. 1.02382.1000) (29,4 г растворяли в 200 мл). рН доводили до 10,5 с использованием 4н NaOH и объем доводили до 1000 мл. Конечные концентрации глицина, CaCl2 и TWEEN®-80 составляли 50 мМ, 10 мМ и 0,005%, соответственно. Инкубаторы устанавливали при 68°С (для инкубирования) и при 25°С (для анализа AAPF). Добавляли в пустые планшеты для разведения и инкубирования 90 мкл и 190 мкл глицинового буфера соответственно. 10 мкл супернатанта затем добавляли в планшет разведения с последующим добавлением 10 мкл из планшета разведения в планшет инкубирования. Затем 100 мкл смеси из планшета инкубирования добавляли в предварительно нагретый планшет, содержащий suc-AAPF-pNA субстрат. Планшет с suc-AAPF-pNA считывали в ридере для микротитровальных планшетов при 410 нм (t=0 измерение). Планшет инкубирования закрывали лентой и инкубировали в течение 1 часа при 68°С и 400 об/мин. В конце инкубирования планшет удаляли из инкубатора и охлаждали на льду по меньшей мере в течение 5 минут. 10 мкл смеси из планшета инкубирования переносили в планшет, содержащий suc-AAPF-pNA субстрат и планшет считывали при 410 нм (t=60 измерение). Процент остаточной активности рассчитывался как:
% остаточной активности: (мОП.мин-1 при t=60)/ (мОП.мин-1) при t=0) × 100.
Анализ стабильности LAS/EDTA
Стабильность LAS/EDTA измеряли после инкубирования тестируемой протеазы в присутствии LAS/EDTA как функцию остаточной активности, определенной с использованием анализа AAPF.
Стабильность варианта протеазы и контрольной протеазы в присутствии иллюстративного поверхностно-активного вещества (LAS=линейный алкилбенсульфонат, натрийдодецилсульфонат - DOBS) и динатриевой соли EDTA измеряли после инкубирования при определенных условиях, и остаточную активность определяли с использованием анализа AAPF. Использованные реагенты представляли собой натриевую соль додецилбензолсульфоната (DOBS, Sigma No. D-2525), TWEEN®-80 (Sigma No. P-8074), динатрий EDTA (Siegfried Handel No. 164599-02), HEPES (Sigma No. H-7523), разгружающий буфер: 50 мM HEPES (11,9 г/л) + 0,005% TWEEN®-80, pH 8,0, стрессовый буфер: 50 мM HEPES (11,9 г/л), 0,1% (вес/об) DOBS (1 г/л), 10 мM EDTA (3,36 г/л), pH 8,0, культуральные супернатанты ссылочной протеазы и варианта протеазы, содержащие 200-400 мкг/мл белка. Использованное оборудование представляло собой микротитровальные планшеты с V- или U-дном в качестве планшетов для разведения (Greiner 651101 и 650161 соответственно), микротитровальные планшеты с F-дном (Corning 9017) для нестрессового и LAS/EDTA буфера, а также для suc-AAPF-pNA планшетов, Biomek FX (Beckman Coulter), ридер для микротитровальных планшетов Spectramax Plus 384 MTP (Molecular Devices), инкубатор/шейкер iEMS (1 мм амплитуда) от Thermo Electron Corporation, герметизирующая лента: Nunc (236366).
Инкубатор/шейкер iEMS (Thermo/Labsystems) устанавливали при 29°С. Супернатанты культур разводили в планшетах, содержащих разгрузочный буфер, до концентрации ~25 ч.н.м. (основной планшет для разведения). 20 мкл образца из основного планшета для разведения добавляли к планшетам, содержащим 180 мкл нестрессового буфера, получая конечную концентрацию для инкубирования в 2,5 ч.н.м. Содержимое смешивали и выдерживали при комнатной температуре, и в этом планшете проводили AAPF анализ. 20 мкл образца из основного планшета для разведения также добавляли в планшеты, содержащие 180 мкл стрессового буфера (50 мM HEPES (11,9 г/л), 0,1% (вес/об) DOBS (1 г/л), 10 мM EDTA (3,36 г/л), pH 8,0). Растворы смешивали и сразу же помещали в шейкер iEMS при 29°С на 20 минут при 400 об/мин. После инкубирования в течение 30 минут проводили AAPF анализ на планшете нагрузки. Стабильность образцов определяли путем расчета соотношения остаточной и первоначальной AAPF активности следующим образом: остаточная активность (%) = [мОП.мин-1 стресс]*100/[мОП.мин-1 отсутствие стресса].
Анализ микрообразца вареного яичного желтка
Эффективность удаления загрязнения варианта субтилизина определяли в масштабе планшетов для микротитрования (МТР) в коммерчески доступных моющих средствах (моющее средство CALGONIT® [Reckitt-Benckiser] и моющее средство CASCADE® [P&G]). Образцы для тестирования варианта субтилизина получали из профильтрованного культурального бульона для культур, выращенных в МТР планшетах в течение 3 дней при 37°С/300 об/мин /90% относительная влажность. Использованное оборудование включало: робот Biomek FX (Beckman Coulter), ридер SpectraMAX MTP (тип 340; Molecular Devices), инкубатор/шейкер iEMS (Thermo/Labsystems); МТР планшеты с F-дном (Costar type 9017) для считывания реакционных планшетов после инкубирования и МТП планшеты с V-дном (Greiner 651101) для предварительного разведения суператанта. CS-38 микрообразцы (яичный желток с пиментом, состаренный путем нагревания), полученные от CFT Vlaardingen, использовали в качестве субстрата. Два образца использовали для каждой лунки. Таблетки ADW от Calgonit 5 в 1 использовали для получения раствора моющего средства. Для деактивации активности протеазы, присутствующей в таблетках, 21 г таблетку растворяли в воде Milli-Q, нагретой на водяной бане до температуры 60°С. Раствор охлаждали до комнатной температуры и объем воды доводили до 700 мл. Раствор дополнительно разбавляли водой для достижения конечной концентрации 3 г/л. Жесткость воды доводили до 21°GH путем добавления 1,46 мл смеси Ca/Mg (Ca/Mg смесь [(3:1), 1,92 M CaCl2 = 282,3 г/л CaCl2·2H2O; 0,64 M MgCl2 = 130,1 г/л MgCl2·6H2O), 15000 гран на галлон]. Образцы фермента предварительно разводили в 10 мM NaCl, 0,1 мM CaCl2, 0,005% TWEEN®-80 растворе и тестировали при подходящих концентрациях.
Инкубатор устанавливали при желаемой температуре в 40°С или 50°С и 72 мкл буфера разведения добавляли в пустые планшеты с V-дном (= планшет разведения) с последующим добавлением 8 мкл супернатанта. Затем 9 мкл из планшета разведения добавляли в планшеты, содержащие микрообразцы, инкубированные в 171 мкл раствора моющего средства. Планшеты с микрообразцами (с моющим средством и ферментом) закрывали лентой и помещали в инкубатор/шейкер на 30 минут при 1400 об/мин. После инкубирования 75 мкл реакционной смеси переносили в пустые планшеты с F-дном и поглощение считывали в МТР ридере при 405 нм после удаления пузырьков с помощью фена. Пустые контроли, т.е. образцы, содержащие один или два микрообразца и моющее средство без добавления ссылочного субтилизина, также включали в данный тест.
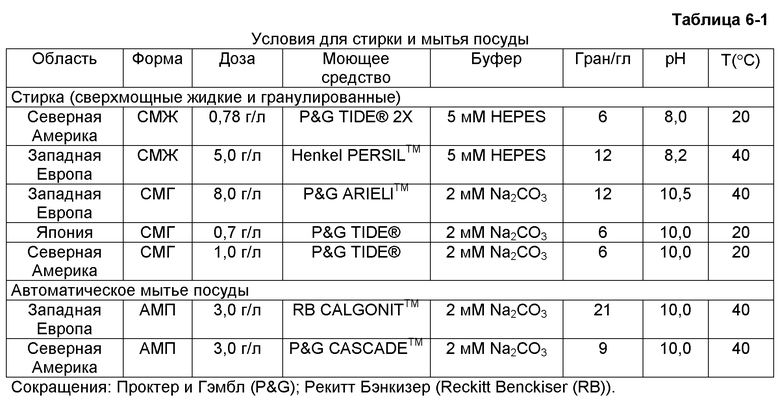
Анализ микрообразца кровь-молоко-чернила
Эффективность удаления загрязнения варианта субтилизина определяли в масштабе планшетов для микротитрования (МТР) в коммерчески доступных моющих средствах. Образцы ссылочного субтилизина и варианта субтилизина получали из профильтрованного культурального бульона для культур, выращенных в МТР планшетах в течение 3 дней при 37°С/300 об/мин /90% относительная влажность. Использованное оборудование включало: 96-луночные планшеты (Costar No. 9017 умеренного связывания с плоским дном), Biomek FX и/или Biomek FXp (Beckman Coulter), ридер Spectramax Plus 384 (Molecular Devices), инкубатор/шейкер iEMS c 1 мм амплитудой (Thermo/Labsystems) и герметизирующую ленту (Nunc No. 236366). Использованные регенты включали: 5 мM HEPES, pH 8,0 или 5 мM MOPS, pH 7 буфер, Ca:Mg в соотношении 3:1 для водной среды средней жесткости (CaCl2:MgCl2·6H2O); 15000 гран на галлон (гран/гл) исходный раствор, разведенный до 6 гран/гл, два образца КМЧ (кровь/молоко/чернила) на планшет: EMPA-116 BMI хлопковые образцы, обработанные CFT: предварительно промытые и перфорированные два образца на лунку, и термически деактивированное готовое моющее средство TIDE® 2X, для которого было подтверждено отсутствие протеазной активности. В этом анализе протеазы гидролизуют субстрат и высвобождают пигмент и нерастворимые частицы из субстрата.
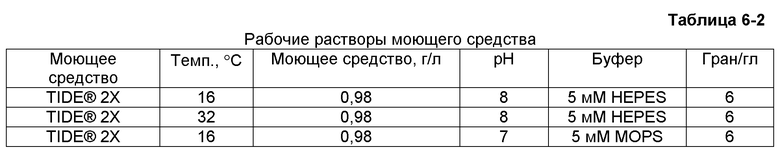
Инкубатор устанавливали при желаемой температуре (16°С или 32°С). Первоначально 10 мкл образцов из основного планшета разведения с ~10 ч.н.м. фермента добавляли в планшеты с 2 образцами КМЧ с использованием 190 мкл перечисленных выше рабочих растворов моющего средства. Объем доводили до конечной концентрации в 0,5 ч.н.м. для варианта в этих планшетах для анализа. Планшеты затем сразу же переносили в инкубаторы iEMS и инкубировали в течение 30 минут при 1400 об/мин, встряхивая при данной температуре. После инкубирования 100 мкл супернатанта переносили в новый 96-луночный планшет и поглощение измеряли в ридере для микротитровальных планшетов при 405 нм и/или 600 нм. Контрольные лунки, содержащие один или два микрообразца и моющее средство без добавления образцов протеазы, также включали в данный тест. Измерения при 405 нм давали более высокое значение и следы удаления пигмента, тогда как измерение при 600 нм отслеживало мутность и очистку.
Расчет активности удаления загрязнения
Полученное значение поглощения корректировали для «пустого» значения (субстрат без фермента), обеспечивая измерение гидролитической активности. Для каждого образца (варианта) рассчитывали показатель эффективности (PI). Показатель эффективности позволял сравнить эффективность варианта (действительное значение) и ссылочного фермента (теоретическое значение) при той же концентрации белка. В дополнение, могут быть рассчитаны теоретические значения с использованием параметров уравнения Лангмюра для стандартного фермента. Показатель эффективности, который больше 1 (PI>1), указывает на лучший вариант по сравнению со стандартом (например, диким типом), тогда как PI, равный 1 (PI=1), указывает, что вариант работает также как и стандарт, а PI, который меньше 1 (PI<1), указывает, что вариант работает хуже, чем стандарт. Таким образом, PI выявляет победителей, а также варианты, которые являются менее желательными для применения в определенных обстоятельствах.
Чистящая эффективность варианта субтилизина была определена с использованием анализа микрообразцов (образцы CS-38). Стабильность LAS/EDTA и термостабильность варианта также определяли с использованием вышеописанных способов. Результаты приведены в таблице 6-3.
Значения для РХ3, протестированного на эффективность удаления загрязнений на образцах CS-38, стабильность LAS/EDTA и термостабильность
40°С
50°С
50°С
В дополнение к этим экспериментам, были проведены эксперименты для определения эффективности очистки при стирке для варианта протеазы. Тестируемые моющие средства представляли собой термически деактивированные коммерчески полученные стиральные порошки (например, TIDE® 2X Free [P&G; "NA HDL"] TIDE® Free [P&G; "NA HDD"]). Эффективность очистки для загрязненных КМЧ микрообразцов тестировали с использованием 0,2 ч.н.м. варианта при 25°С в течение 30 минут при 1400 об/мин при встряхивании в объеме 200 мкл. Функциональность варианта оценивают количественно в виде показателя эффективности (PI), который представляет собой соотношение эффективности варианта относительно эффективности исходного белка GCI-P036.
Пример 7
Жидкие композиции моющего средства для стирки
В этом примере разработаны различные составы для жидких композиций моющего средства для стирки. Следующие жидкие композиции моющего средства для стирки по настоящему изобретению получают, как показано ниже. В каждый из этих составов включен по меньшей мере один разработанный в настоящем изобретении вариант протеазы а концентрации от приблизительно 0,0001 до приблизительно 10 весовых процентов. В некоторых альтернативных вариантах осуществления находят применение другие концентрации, как определено составителем на основании необходимости.
рН в примерах выше 7(I)-(II) составляет от приблизительно 5 до приблизительно 7, а в примерах 7(III)-(V) от приблизительно 7,5 до приблизительно 8,5.
Пример 8
Жидкая моющая композиция для ручного мытья посуды
В этом примере разработаны различные жидкие моющие составы для ручного мытья посуды. Следующие жидкие моющие композиции для ручного мытья посуды по настоящему изобретению приведены ниже. В каждый из этих составов включен по меньшей мере один вариант протеазы, разработанный в настоящем изобретении, в концентрации от приблизительно 0,0001 до приблизительно 10 весовых процентов. В некоторых альтернативных вариантах осуществления находят применение другие концентрации, как определено составителем на основании соответствующей необходимости.
рН примеров 8(I)-(VI) составляет от приблизительно 8 до приблизительно 11.
Пример 9
Жидкие моющие композиции для автоматических посудомоечных машин
В этом примере разработаны различные жидкие моющие составы для автоматических посудомоечных машин. Следующие жидкие моющие композиции для ручного мытья посуды по настоящему изобретению приведены ниже. В каждый из этих составов включен по меньшей мере один вариант протеазы, разработанный в настоящем изобретении, в концентрации от приблизительно 0,0001 до приблизительно 10 весовых процентов. В некоторых альтернативных вариантах осуществления находят применение другие концентрации, как определено составителем на основании соответствующей необходимости.
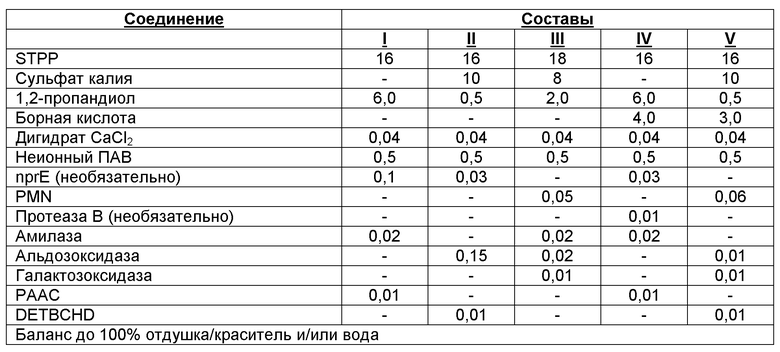
Пример 10
Гранулированные и/или таблетированные композиции для стирки
В этом примере приведены различные составы для применения в качестве гранулированных и/или таблетированных моющих составов для стирки. Следующие композиции для стирки по настоящему изобретению, которые могут находиться в виде гранул или таблеток, приведены ниже. В каждый из этих составов включен по меньшей мере один вариант протеазы, разработанный в настоящем изобретении, в концентрации от приблизительно 0,0001 до приблизительно 10 весовых процентов. В некоторых альтернативных вариантах осуществления находят применение другие концентрации, как определено составителем на основании соответствующей необходимости.
Пример 11
Жидкие моющие средства для стирки
В этом примере приведены различные составы жидких моющих средств для стирки. Следующие жидкие составы для стирки по настоящему изобретению приведены ниже. В каждый из этих составов включен по меньшей мере один вариант протеазы, разработанный в настоящем изобретении, в концентрации от приблизительно 0,0001 до приблизительно 10 весовых процентов. В некоторых альтернативных вариантах осуществления находят применение другие концентрации, как определено составителем на основании соответствующей необходимости.
Пример 12
Средства для мытья посуды высокой плотности
В этом примере приведены различные составы средств для мытья посуды высокой плотности. Следующие компактные средства для мытья посуды высокой плотности по настоящему изобретению приведены ниже. В каждый из этих составов включен по меньшей мере один вариант протеазы, разработанный в настоящем изобретении, в концентрации от приблизительно 0,0001 до приблизительно 10 весовых процентов. В некоторых альтернативных вариантах осуществления находят применение другие концентрации, как определено составителем на основании соответствующей необходимости.
рН в примерах 12(I)-(VI) составляет от приблизительно 9,6 до приблизительно 11,3
Пример 13
Таблетированные моющие композиции
В этом примере приведены различные таблетированные моющие составы. Следующие таблетированные моющие композиции по настоящему изобретению получают путем прессования гранулированной композиции для мытья посуды под давлением 13 КН/см2 с использованием стандартного 12-головочного роторного пресса. В каждый из этих составов включен по меньшей мере один вариант протеазы, разработанный в настоящем изобретении, в концентрации от приблизительно 0,0001 до приблизительно 10 весовых процентов. В некоторых альтернативных вариантах осуществления находят применение другие концентрации, как определено составителем на основании соответствующей необходимости.
рН в примерах 13(I)-13(VII) составляет от приблизительно 10 до приблизительно 11,5; рН в примере 13(VIII) составляет 8-10. Вес таблетки по примерам 13(I)-13(VIII) составляет от приблизительно 20 граммов до приблизительно 30 граммов.
Пример 14
Жидкие чистящие средства для твердой поверхности
В этом примере представлены различные составы для жидких чистящих средств для твердой поверхности. Следующие композиции жидких чистящих средств для твердой поверхности по настоящему изобретению приведены ниже. В каждый из этих составов включен по меньшей мере один вариант протеазы, разработанный в настоящем изобретении, в концентрации от приблизительно 0,0001 до приблизительно 10 весовых процентов. В некоторых альтернативных вариантах осуществления находят применение другие концентрации, как определено составителем на основании соответствующей необходимости.
В примерах с 14(I) по (VII) рН составляет от приблизительно 7,4 до приблизительно 9,5.
Все патенты и публикации, отмеченные в описании, являются показательными для уровня специалистов в той области, к которой относится изобретение. Специалисту в данной области легко будет понятно, что настоящее изобретение хорошо адаптируется для осуществления задач и получения отмеченных целей и преимуществ, а также неотъемлемых качеств. Описанные здесь композиции и способы представляют предпочтительные варианты осуществления, являются иллюстративными и не предназначены в качестве ограничения объема изобретения. Специалисту в данной области будет легко понятно, что варьирование замещений и модификаций описанного здесь изобретения может быть сделано, не отступая от объема и сути изобретения.
Изобретение, описанное здесь иллюстративно, подходящим образом может быть реализовано практически в отсутствие любого элемента или элементов, ограничения или ограничений, которые не раскрываются здесь специально. Использованные термины и выражения использованы в качестве терминов для описания, а не для ограничения, и не подразумевается, что применение таких терминов и выражения исключает какие-либо эквиваленты и показанные или описанные отличительные особенности или их части, но подразумевается, что возможны различные модификации в рамках объема заявленного изобретения. Таким образом, следует понимать, что хотя настоящее изобретение было конкретно описано с помощью предпочтительных вариантов осуществления и необязательных характерных признаков, специалисты в данной области могут прибегнуть к модификациям и вариациям раскрытой здесь концепции, и что такие модификации и вариации рассматриваются как входящие в объем настоящего изобретения, как здесь определено.
Изобретение было описано широко и в общих чертах. Каждая из более узких разновидностей и субгенерических группировок, попадающих в общее описание, также образует часть изобретения. Это включает общее описание изобретения при условии или при отрицательном ограничении, удаляющем любой предмет обсуждения из типа, вне зависимости от того, был или не был данный материал специально упомянут в настоящем описании.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ, ВКЛЮЧАЮЩИЕ ВАРИАНТЫ МИКРОБНЫХ ПРОТЕАЗ | 2009 |
|
RU2541786C2 |
| Способы и композиции, содержащие варианты сериновой протеазы | 2012 |
|
RU2663114C2 |
| ВАРИАНТЫ ПРОТЕАЗЫ КЛАДЫ APRL И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2733987C2 |
| ВАРИАНТЫ СЕРИНОВОЙ ПРОТЕАЗЫ С МНОЖЕСТВЕННЫМИ МУТАЦИЯМИ | 2007 |
|
RU2558261C2 |
| ПРИМЕНЕНИЕ ВАРИАНТОВ ПРОТЕАЗЫ | 2010 |
|
RU2639534C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ УЛУЧШЕННЫХ ВАРИАНТОВ БЕЛКА | 2008 |
|
RU2520808C2 |
| КОМПОЗИЦИИ И СПОСОБЫ, ВКЛЮЧАЮЩИЕ В СЕБЯ ПРИМЕНЕНИЕ ВАРИАНТНЫХ МИКРОБНЫХ ПРОТЕАЗ | 2009 |
|
RU2575073C2 |
| ПОВЕРХНОСТНО-АКТИВНЫЙ ОТБЕЛИВАТЕЛЬ И ДИНАМИЧЕСКИЙ pН | 2007 |
|
RU2431655C2 |
| ВАРИАНТЫ СУБТИЛАЗЫ И КОДИРУЮЩИЕ ИХ ПОЛИНУКЛЕОТИДЫ | 2015 |
|
RU2710720C2 |
| СПОСОБЫ УЛУЧШЕНИЯ МНОЖЕСТВЕННЫХ СВОЙСТВ БЕЛКА | 2008 |
|
RU2553550C2 |





Изобретение относится к биотехнологии и представляет собой вариант субтилизина для применения в очистке, представляющий собой последовательность аминокислот, указанную в SEQ ID NO: 5. Изобретение относится также к чистящей композиции, включающей эффективное количество варианта субтилизина, к способу чистки, включающему обеспечение предмета для чистки, и композиции, включающей вариант субтилизина, указанный в SEQ ID NO: 5, и приведение в контакт указанного предмета и указанной композиции. Изобретение позволяет получить эффективный вариант субтилизина с высокой моющей способностью. 3 н. и 11 з.п. ф-лы, 19 табл., 14 пр.
1. Вариант субтилизина для применения в очистке, представляющий собой последовательность аминокислот, указанную в SEQ ID NO: 5.
2. Чистящая композиция, включающая эффективное количество варианта субтилизина по по п. 1.
3. Чистящая композиция по п. 2, где указанная композиция представляет собой моющее средство для стирки белья.
4. Чистящая композиция по п. 2, где указанная композиция представляет собой моющее средство для посуды.
5. Чистящая композиция по п. 2, где указанная композиция представляет собой моющее средство для автоматических посудомоечных машин.
6. Чистящая композиция по п. 2, где указанная композиция представляет собой жидкое моющее средство.
7. Чистящая композиция по п. 2, где указанная композиция представляет собой моющее средство в виде геля, таблетки, порошка или гранул.
8. Чистящая композиция по п. 2, где указанная композиция не содержит фосфата.
9. Чистящая композиция по п. 2, дополнительно включающая по меньшей мере один отбеливающий агент.
10. Чистящая композиция по п. 2, дополнительно включающая по меньшей мере один дополнительный фермент.
11. Чистящая композиция по п. 10, где указанный по меньшей мере один дополнительный фермент выбирают из гемицеллюлаз, целлюлаз, пероксидаз, протеаз, металлопротеаз, ксиланаз, липаз, фосфолипаз, эстераз, пергидролаз, кутиназ, пектиназ, пектатлиаз, маннаназ, кератиназ, редуктаз, оксидаз, фенолоксилаз, липоксигеназ, лигниназ, пуллуланаз, танназ, пентосаназ, маланаз, β-глюканаз, арабиносидаз, гуалуронидазы, хондроитиназы, лакказы и амилаз или их смесей.
12. Способ чистки, включающий обеспечение предмета для чистки, и композиции, включающей вариант субтилизина, указанный в SEQ ID NO: 5, и приведение в контакт указанного предмета и указанной композиции.
13. Способ по п. 12, дополнительно включающий стадию ополаскивания указанного предмета, предназначенного для чистки.
14. Способ по любому из пп. 12, 13, где указанный предмет представляет собой посуду или изделие из ткани.
| WO2008010925 A2, 24.01.2008 | |||
| EP 0000571049 A1, 24.11.1993 | |||
| ВАРИАНТ СУБТИЛИЗИНА (ВАРИАНТЫ), КОДИРУЮЩАЯ ЕГО ДНК, ЭКСПРЕССИРУЮЩИЙ ВЕКТОР, ОЧИЩАЮЩАЯ КОМПОЗИЦИЯ, КОРМ ДЛЯ ЖИВОТНЫХ, КОМПОЗИЦИЯ ДЛЯ ОБРАБОТКИ ТКАНИ | 1998 |
|
RU2252958C2 |
Авторы
Даты
2016-02-20—Публикация
2009-11-10—Подача