Настоящее изобретение относится к очистке хиральных соединений, в частности, к очистке хирального соединения, которое можно использовать в качестве промежуточного продукта для получения фунгицидных средств, предпочтительно позаконазола.
Уровень техники
Позаконазол (регистрационный №CAS 171228-49-2; название CAS: 2,5-ангидро-1,3,4-тридезокси-2-С-(2,4-дифторфенил)-4-[[4-[4-[4-[1-[(1S,2S)-1-этил-2-гидроксипропил]-1,5-дигидро-5-оксо-4Н-1,2,4-триазол-4-ил]фенил]-1-пиперазинил]фенокси]метил]-1-(1Н-1,2,4-триазол-1-ил)-D-трео-пентит) является триазольным фунгицидным лекарственным средством, обладающим структурой:
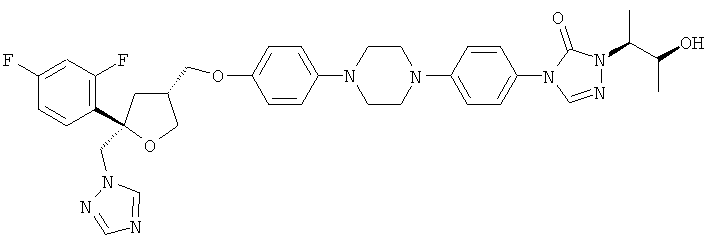 .
.
Позаконазол используется, например, для предупреждения и/или лечения инвазивных грибковых инфекций, вызванных штаммами Candida, штаммами Mucor, штаммами Aspergillus, штаммами Fusarium или штаммами Coccidioides, у пациентов с ослабленным иммунитетом и/или у пациентов, у которых заболевание устойчиво к воздействию других фунгицидных средств, таких как амфотерицин В, флуконазол или итраконазол, и/или у пациентов, которые не переносят эти фунгицидные средства.
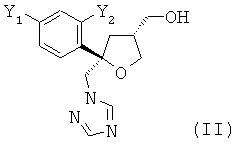
Одним из важных промежуточных продуктов для получения позаконазола является соединение формулы (II)
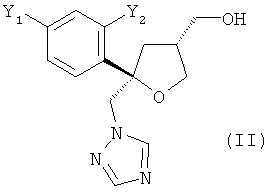 ,
,
где оба остатка Y1 и Y2 обозначают F. В возможной методике синтеза соединения формулы (II) путем циклизации с помощью йода образуется четвертичный стереоцентр, что дает искомый тетрагидрофуран в виде смеси диастереоизомеров. В этой смеси отношение количества молей цис-изомера к количеству молей транс-изомера (цис:транс) находится в диапазоне от 85:15 до 95:5, обычно примерно 9:1. Однако для превращения в позаконазол желателен только цис-изомер. Поэтому необходимо увеличение содержания желательного цис-изомера или его подходящей соли.
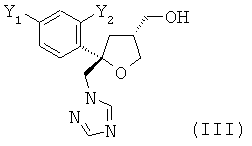
В соответствии с предшествующим уровнем техники, смесь диастереоизомеров, содержащую цис-изомер формулы (II) и транс-изомер формулы (III) в растворителе
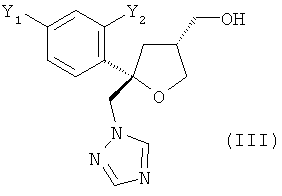
превращают на первой стадии в смесь диастереоизомеров соответствующих тозилатов соединений (II) и (III), обладающую таким же отношением цис:транс, как в исходной смеси, т.е. обычно отношением 9:1. Из этой смеси диастереоизомеров цис-изомер необходимо выделить на второй стадии с помощью трудоемкой колоночной хроматография на силикагеле в градиентном режиме с использованием больших объемов смеси гептана и этилацетата (см. US 5403937, ЕР 0736030 А1 и WO 95/17407). Однако колоночная хроматография в целом, и рассмотренная выше колоночная хроматография в частности, непригодны для промышленных технологий.
Поэтому объектом настоящего изобретения является разработка нового способа выделения цис-изомера формулы (II).
При поиске упрощенного и эффективного нового способа было установлено, что вероятнее всего, использование известной смеси диастереоизомеров тозилатов соединений (II) и (III) не является перспективной отправной точкой.
Поэтому другим объектом настоящего изобретения является получение нового промежуточного продукта, содержащего подходящие производные соединений формулы (II) и (III).
Согласно изобретению неожиданно было установлено, что рассмотренное выше выделение цис-изомера можно значительно упростить, если на основе смеси диастереоизомеров, содержащей соединения формулы (II) и (III), получить специальную соль. Согласно изобретению было установлено, что этой специальной солью является HCl соль соединений (II) и (III).
Краткое изложение сущности изобретения
Поэтому настоящее изобретение относится к способу получения гидрохлоридной соли (HCl) соединения формулы (I)
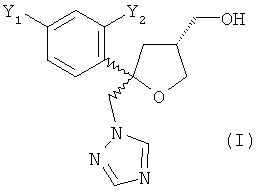
где Y1 и Y2 независимо обозначают F или Cl, предпочтительно F, где указанное соединение формулы (I) содержит цис-изомер формулы (II) и трансизомер формулы (III)
 ,
,  ,
,
который включает:
(1) использование соединения формулы (I), содержащегося в первом подходящем растворителе;
(2) обработку соединения формулы (I), содержащегося в первом подходящем растворителе, HCl, содержащегося во втором подходящем растворителе, с получением HCl соли соединения формулы (I).
Кроме того, настоящее изобретение относится к применению этого способа для очистки смеси диастереоизомеров цис-изомера формулы (II) и транс-изомера формулы (III)
 ,
, 
с получением очищенного цис-изомера.
Кроме того, настоящее изобретение относится к предпочтительно кристаллической гидрохлоридной соли (HCl) соединения формулы (I)
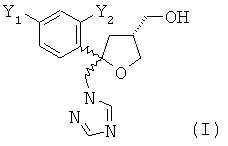
где Y1 и Y2 независимо обозначают F или Cl, предпочтительно F, где указанное соединение формулы (I) содержит цис-изомер формулы (II) и трансизомер формулы (III)
 ,
,  .
.
Кроме того, настоящее изобретение относится к применению указанной предпочтительно кристаллической HCl соли, содержащей по меньшей мере 99% HCl соли цис-изомера формулы (II)

для получения фунгицидного средства, предпочтительно позаконазола.
Перечень чертежей
На чертеже приведена порошковая рентгенограмма (XRD) соединения формулы (I), полученного в примере 6 настоящего изобретения. Отношение цис:транс, т.е. отношение соединение формулы (II): соединение формулы (III), в которой Y1=Y2=F, составляет 99,2:0,8. На чертеже на оси х приведены положения, выраженные в значениях 2-тета в градусах, на оси у приведены интенсивности, измеренные в импульсах в секунду (линейная шкала).
Подробное описание изобретения
Способом, предлагаемым в настоящем изобретении, получают гидрохлоридную соль (HCl) соединения формулы (I)
 ,
,
где Y1 и Y2 независимо обозначают F или Cl, предпочтительно F, и в котором указанное соединение формулы (I) содержит цис-изомер формулы (II) и транс-изомер формулы (III)
 ,
,  .
.
Способ, предлагаемый в настоящем изобретении, включает стадии (1) и (2):
(1) использование соединения формулы (I), содержащегося в первом подходящем растворителе;
(2) обработку соединения формулы (I), содержащегося в первом подходящем растворителе, HCl, содержащегося во втором подходящем растворителе, с получением HCl соли соединения формулы (I).
Обычно можно получить указанную соль с HCl на стадии (2) с использованием в качестве исходных веществ любых смесей, содержащих соединения формулы (II) и (III), и не налагают специальных ограничений на отношение количества молей соединения (II) к количеству молей соединения (III). В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I), представляющее собой указанную смесь, содержит от 80 до 95%, предпочтительно от 85 до 95% цис-изомера формулы (II) и от 20 до 5%, предпочтительно от 15 до 5% транс-изомера формулы (III). Поэтому обычно соединение формулы (I) содержит от 86 до 94% или от 87 до 93%, или от 88 до 92%, или от 89 до 91% цис-изомера формулы (II) и от 14 до 6% или от 13 до 7%, или от 12 до 8% или, от 11 до 9% транс-изомера формулы (III). НА основе этой предпочтительной смеси проводят предпочтительное выделение цис-изомера, предлагаемого в настоящем изобретении. Стадия (1)
На методику получения соединения формулы (I), получаемого на стадии (1), не налагают специальных ограничений. В основном можно получить соединение формулы (I), растворенное в растворителе, где указанный растворитель в случае, если он не является первым подходящим растворителем в соответствии со стадией (1) способа, предлагаемого в настоящем изобретении, можно заменить до проведения стадии (1). В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) получают способом, включающим стадии (i.1)-(vi.2), описанные ниже в настоящем изобретении. В другом варианте осуществления настоящего изобретения соединение формулы (I) получают в виде по меньшей мере частично кристаллического соединения способом, в дополнение к стадиям (i.1)-(vi.2) включающим дополнительную стадию (vii) по меньшей мере частичной кристаллизации соединения формулы (I). Затем полученное таким образом по меньшей мере частично кристаллическое соединение смешивают с первым подходящим растворителем.
Стадии (i.1)-(vi.2)
Поэтому в предпочтительном варианте осуществления настоящее изобретение относится к способу, определенному выше, в котором на стадии (1), соединение формулы (I) получают способом, включающим:
(i.1) реакцию соединения формулы (А)
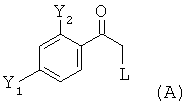
где L обозначает отщепляющуюся группу, предпочтительно галоген, более предпочтительно Cl, в растворителе с нуклеофильным соединением, содержащим нуклеофильный остаток RaRbRcSi-CH2, где Ra, Rb и Rc являются одинаковыми или разными и выбраны из группы, включающей необязательно подходящим образом замещенные алкильные и арильные остатки, с получением реакционной смеси, содержащей в качестве промежуточного продукта бета-гидроксисилан формулы
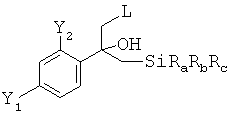
указанную реакцию предпочтительно проводят при температуре в диапазоне от -50 до +20°С, более предпочтительно от -30 до +10°С, еще более предпочтительно от -15 до +5°С;
(i.2) обработку полученной реакционной смеси, предпочтительно без замены растворителя, реагентом промотирующим реакцию элиминирования, с получением реакционной смеси, содержащей соединение формулы (В)
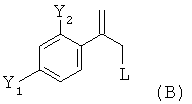
где обработку проводят при температуре в диапазоне от -20 до +70°С и где указанным реагентом предпочтительно является кислота, более предпочтительно неорганическая кислота, еще более предпочтительно серная кислота, где если используют серную кислоту, то температура при которой проводят указанную обработку, предпочтительно находится в диапазоне от 40 до 50°С;
(ii) реакцию соединения формулы (В) со сложным эфиром малоновой кислоты R1OOC-CH2-COOR2 с получением соединения формулы (С)
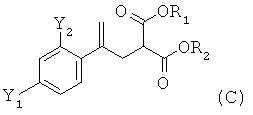 ,
,
где R1 и R2 независимо обозначают необязательно подходящим образом замещенную алкильную группу, содержащую от 1 до 5 атомов углерода, предпочтительно этил, в котором после стадии (ii) и до стадии (iii) соединение формулы (С) необязательно выделяют путем экстракции в подходящем растворителе, предпочтительно циклогексане;
(iii) восстановление соединения формулы (С) с получением соединения формулы (D)
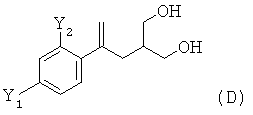 ,
,
где восстановительным реагентом предпочтительно является LiBH4, который используют в количестве, составляющем не более 2 мол.экв. в пересчете на соединение формулы (С), указанное восстановление предпочтительно проводят в подходящем растворителе, предпочтительно содержащем воду, растворитель предпочтительно выбран из группы, включающей воду, спирт и смесь воды и по меньшей мере одного спирта, более предпочтительно из группы, включающей воду, метанол, этанол, изопропанол и смесь воды и по меньшей мере одного из этих спиртов, более предпочтительно из группы, включающей воду, этанол, изопропанол и смесь воды и по меньшей мере одного из этих спиртов, более предпочтительно из группы, включающей воду, изопропанол и смесь воды и изопропанола, наиболее предпочтительно, если растворителем является смесь воды и изопропанола, где растворитель предпочтительно содержит от 1 до 20 об.%, более предпочтительно от 5 до 15 об.% воды;
(iv) ацилирование соединения формулы (D) изомасляным ангидридом с получением соединения формулы (Е)
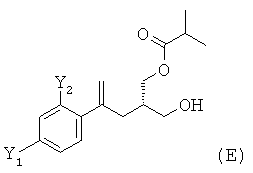 ,
,
указанное ацилирование предпочтительно проводят в присутствии подходящего фермента, предпочтительно фермента Novo SP 435, в подходящем растворителе, предпочтительно в ацетонитриле или толуоле, более предпочтительно в толуоле, в котором после стадии (iv) и до стадии (v) соединение формулы (Е) предпочтительно по меньшей мере частично кристаллизуют;
(v) реакцию соединения формулы (Е) с галогеном Hal2, выбранным из группы, включающей Cl2, Br2 и I2, предпочтительно I2, в присутствии основания в растворителе с получением соединения формулы (F)
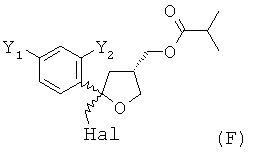
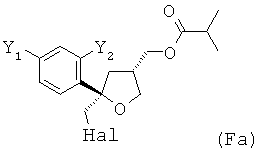
где предпочтительно от 80 до 95%, более предпочтительно от 85 до 95% молекул соединения (F) содержатся в виде цис-изомера формулы (Fa)
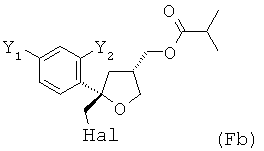
и предпочтительно от 20 до 5%, более предпочтительно от 15 до 5% молекул соединения (F) содержатся в виде транс-изомера формулы (Fb)
 ;
;
где растворителем предпочтительно является этилацетат и где основанием предпочтительно является гидрокарбонат натрия, и где температура при которой соединение формулы (Е) вводят в реакцию, предпочтительно ниже 0°С, более предпочтительно не выше -5°С и еще более предпочтительно не выше -10°С;
(vi.1) нагревание соединения формулы (F), предпочтительно при температуре в диапазоне от +70 до +100°С, более предпочтительно от+80 до +95°С, еще более предпочтительно от +85 до +90°С, предпочтительно при отсутствии DMPU (1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон), в растворителе предпочтительно в полярных апротонных растворителях, например, DMF (N,N-диметилформамид) и DMSO, более предпочтительно DMSO, с солью щелочного металла 1,2,4-триазола, предпочтительно натриевой солью, и обработку полученной реакционной смеси основанием, подходящим для промотирования омыления сложноэфирного фрагмента, таким как гидроксиды щелочных металлов, бикарбонаты щелочных металлов, карбонаты щелочных металлов, гидроксиды щелочноземельных металлов, бикарбонаты щелочноземельных металлов и карбонаты щелочноземельных металлов, предпочтительно основания щелочных металлов, указанное основание предпочтительно добавляют в водных и/или спиртовых средах, где подходящими спиртами являются спирты, содержащие от 1 до 6, предпочтительно от 1 до 4, более предпочтительно от 1 до 3, наиболее предпочтительно от 1 до 2 атомов углерода, указанным основанием еще более предпочтительно является гидроксид натрия, предпочтительно использующийся в виде водного раствора в присутствии метанола, с получением соединения формулы (I)

в котором предпочтительно от 80 до 95%, более предпочтительно от 85 до 95% молекул содержатся в виде цис-изомера формулы (II)

и предпочтительно от 20 до 5%, более предпочтительно от 15 до 5% молекул содержатся в виде транс-изомера формулы (III)
 ;
;
(vi.2) выделение соединения формулы (I) из реакционной смеси, полученной на стадии (vi.1), путем экстракции в подходящем растворителе, где растворителем предпочтительно являлся полярный не смешивающийся с водой растворитель, более предпочтительно сложный эфир, такой как этилацетат или изопропилацетат, простой эфир, такой как тетрагидрофуран или метилтетрагидрофуран, кетон, такой как метилизобутилкетон, галогенированный растворитель, такой как дихлорметан, толуол или смесь двух или более этих растворителей, более предпочтительно сложный или простой эфир, более предпочтительно простой эфир и еще более предпочтительно метилтетрагидрофуран.
Стадии (i.1)-(vi.2)
Стадии (i.1) и (i.2)
На стадии (i.1) способа, предлагаемого в настоящем изобретении, соединение формулы (А) содержит остатки Y1 и Y2. Согласно настоящему изобретению, Y1 и Y2 независимо обозначают F или Cl. Таким образом, Y1 может обозначать F или Cl и независимо от химической природы Y1, Y2 может обозначать F или Cl. Предпочтительно, если оба Y1 и Y2 обозначают F или Cl. Более предпочтительно, если оба Y1 и Y2 обозначают F.
Термин "отщепляющаяся группа L" при использовании на стадии (i.1) в настоящем изобретении означает любые химические фрагменты L, которые при подходящих условиях проведения реакции отщепляются отщепляется от соединения (А) с парой электронов путем гетеролитического расщепления связи. Для этой цели соединение (А), использующееся в настоящем изобретении, может содержать любую отщепляющуюся группу L. Предпочтительно, если отщепляющаяся группа L после отщепления является нейтральным или анионным фрагментом, более предпочтительно анионным фрагментом. Еще более предпочтительно, если L обозначает галоген, такой как, например Cl, Br, I. В еще более предпочтительном варианте осуществления настоящего изобретения L обозначает Cl.
Нуклеофильное соединение, с которым соединение (А) взаимодействует на стадии (i.1), содержит нуклеофильный остаток RaRbRcSi-CH2. На химическую природу этого остатка не налагают специальных ограничений при условии, что получают промежуточный бета-гидроксисилан формулы
 .
.
Термин "промежуточный продукт" при использовании в настоящем изобретении обычно означает бета-гидроксисилан, который содержится в реакционной смеси, полученной на стадии (i.1), и который образуется из реагентов стадии (i.1) и дополнительно реагирует на стадии (i.2). Термин "промежуточный продукт" при использовании здесь не исключает такие бета-гидроксисиланы, которые можно выделить из реакционной смеси, полученной на стадии (i.1)
Нуклеофильным соединением, использующимся на стадии (i.1), может быть любое подходящее соединение, содержащее нуклеофильный остаток RaRbRcSi-СН2, который при реакции с соединением (А) прямо или косвенно приводит к образованию промежуточного бета-гидроксисилана, обсужденного выше. Ra, Rb и Rc, содержащиеся в нуклеофильном соединении, являются одинаковыми или разными и выбраны из группы, включающей необязательно подходящим образом замещенные алкильные и арильные остатки. Термин "необязательно подходящим образом замещенный арильный остаток" при использовании в настоящем изобретении означает арильные остатки, которые содержат, например, до 6 или до 12 атомов углерода. Если такой арильный остаток представляет собой замещенный арильный остаток, то количество атомов углерода означает количество атомов углерода в соответствующем незамещенном арильном остатке. Термин "необязательно подходящим образом замещенный алкильный остаток" при использовании в настоящем изобретении означает алкильные остатки, которые содержат, например, от 1 до 20, предпочтительно от 1 до 10 атомов углерода. Если такой алкильный остаток представляет собой замещенный алкильный остаток, то количество атомов углерода означает количество атомов углерода в соответствующем незамещенном алкильном остатке.
В предпочтительном варианте осуществления настоящего изобретения Ra, Rb и Rc, содержащиеся в нуклеофильном соединении, являются одинаковыми или разными и выбраны из группы, включающей алкильные остатки, более предпочтительно незамещенные алкильные остатки, содержащие от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил, более предпочтительно 1 или 2 атома углерода, метил или этил, где Ra, Rb и Rc предпочтительно обозначают метил.
Предпочтительно, если нуклеофильным соединением, использующимся на стадии (i.1) является реагент Гриньяра. Термин "реагент Гриньяра" при использовании здесь означает любой подходящий нуклеофильный металлоорганический реагент, содержащий нуклеофильный остаток RaRbRcSi-СН2. Предпочтительно, если нуклеофильное соединение представляет собой соединение Гриньяра RaRbRcSi-CH2MgX, в котором Х обозначает подходящий анион, который предпочтительно выбран из группы, включающей Cl, Br и I. Более предпочтительно, если соединением Гриньяра является соединение RaRbRcSi-CH2MgCl.
В качестве растворителя, который используется на стадии (i.1), можно использовать любой растворитель или смесь растворителей, предпочтительно растворитель или смесь растворителей, в котором можно провести реакцию Гриньяра. Приемлемыми растворителями являются, например простые эфиры, такие как общеизвестные диэтиловый эфир и/или тетрагидрофуран (THF). Однако согласно изобретению неожиданно было установлено, что растворители, рассмотренные в предшествующем уровне техники для олефинирования по Петерсону, а именно диэтиловый эфир и THF, можно заменить на метил-трет-бутиловый эфир (МТВЕ). Этот растворитель обеспечивает значительное преимущество, поскольку по сравнению с соединениями, такими как диэтиловый эфир и THF, не образует пероксиды. Таким образом, применение МТВЕ является особенно подходящим в промышленных способах, для которых вопросы безопасности являются первостепенными по значению. Поэтому в особенно предпочтительном варианте осуществления растворитель, использующийся на стадии (i.1), является МТВЕ.
Поэтому в предпочтительном варианте осуществления настоящее изобретение относится к способу, определенному выше, в котором на стадии (i.1) соединением формулы (А) является соединение (Аа)
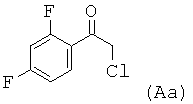
которое взаимодействует в МТВЕ в качестве растворителя с нуклеофильным соединением (H3C)3Si-CH2MgCl с получением реакционной смеси, содержащей в качестве промежуточного продукта бета-гидроксисилан формулы:
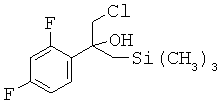
На температуру, при которой реакцию проводят на стадии (i.1), не налагают специальных ограничений при условии, что получают реакционную смесь, которая обеспечивает протекание реакции на стадии (i.2). Предпочтительно, если реакцию на стадии (i.1) проводят при температуре в диапазоне от -50 до +20°С, более предпочтительно от -40 до +15°С, еще более предпочтительно от -30 до +10°С, еще более предпочтительно от -20 до +10°С, еще более предпочтительно от -15 до +5°С, например, при температуре в диапазоне от -15 до -10°С или от -10 до -5°С, или от -5 до 0°С, или от 0 до +5°С.
В качестве общей методики олефинирования по Петерсону в литературе описана двухстадийная методика, в которой после проведения реакции Гриньяра проводят замену растворителя (см. Tetrahedron Letters 32 (1991), pp.7545-7548). Согласно изобретению неожиданно было установлено, что после стадии (i.1) настоящего изобретения не требуется замена растворителя и что промежуточный продукт, полученный на стадии (i.1), можно обработать подходящим реагентом, который промотирует реакцию элиминирования в значительно упрощенном способе.
Поэтому согласно настоящему изобретению, реакционную смесь, полученную на стадии (i.1), обрабатывают на стадии (i.2), предпочтительно без замены растворителя, реагентом промотирующим реакцию элиминирования, с получением реакционной смеси, содержащей соединение формулы (В)
 .
.
Поскольку по литературным данным вторая стадия олефинирования по Петерсону включает использование BF3*Et2O (эфират трифторида бора), другим важным преимуществом настоящего изобретения является то, что на этой стадии реакции полностью исключено использование потенциально опасных химикатов, таких как эфират BF3. Как отмечено выше, осуществление способа, предлагаемого в настоящем изобретении, без замены растворителя после стадии (i.1) особенно предпочтительно, если в качестве растворителя на стадии (i.1) используют МТВЕ.
На температуру, при которой реакцию проводят на стадии (i.2), не налагают специальных ограничений при условии, что получают реакционную смесь, содержащую соединение формулы (В). Предпочтительно, если обработку на стадии (i.2) проводят при температуре в диапазоне от -20 до +70°С. Предпочтительные диапазоны температуры составляют, например, от -20 до -10°С или от -10 до 0°С, или от 0 до +10°С, или от +10 до +20°С, или от +20 до +30°С, или от +30 до +40°С, или от +40 до +50°С, или от +50 до +60°С, или от +60 до +70°С.
На реагент, промотирующий реакцию элиминирования, использующийся на стадии (i.2), не налагают специальных ограничений при условии, что получают соединение формулы (В), предпочтительно без замены растворителя после стадии (i.1). Предпочтительным реагентом является кислота или смесь двух или более кислот. Более предпочтительным реагентом является неорганическая кислота или смесь двух или более неорганических кислот. Особенно предпочтительным является использование серной кислоты. Предпочтительно, если в качестве реагента используют серную кислоту, температура, при которой (i.2) находится в диапазоне от +40 до +50°С.
Поэтому в предпочтительном варианте осуществления настоящее изобретение относится к способу, определенному выше, в котором на стадии (i.2), реакционную смесь, полученную на стадии (i.1), без замены растворителя обрабатывают серной кислотой, промотирующей реакцию элиминирования, с получением реакционной смеси, содержащей в качестве соединения формулы (В) - соединение (Ва):
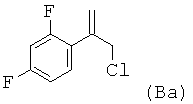
Таким образом, в еще более предпочтительном варианте осуществления настоящее изобретение относится к способу, определенному выше, который включает:
(i.1) реакцию соединения формулы (Аа)

с (H3C)3Si-CH2MgCl в МТВЕ в качестве растворителя с получением реакционной смеси, содержащей в качестве промежуточного продукта бета-гидроксисилан формулы

(i.2) обработку полученной реакционной смеси без замены растворителя МТВЕ серной кислотой, промотирующей реакцию элиминирования, с получением реакционной смеси, содержащей соединение формулы (Ва)
 .
.
В еще более предпочтительном варианте осуществления настоящее изобретение относится к способу, определенному выше, который включает
(i.1) реакцию соединения формулы (Аа)

с (H3C)3Si-CH2MgCl в МТВЕ в качестве растворителя при температуре в диапазоне от -15 до +5°С с получением реакционной смеси, содержащей в качестве промежуточного продукта бета-гидроксисилан формулы

(i.2) обработку полученной реакционной смеси без замены растворителя МТВЕ при температуре в диапазоне от +40 до +50°С серной кислотой, промотирующей реакцию элиминирования, с получением реакционной смеси, содержащей соединение формулы (Ва)
 .
.
Стадии (ii)-(vi.2)
Из соединения содержащегося в реакционной смеси, полученной на стадии (i.2), обсужденной выше, соединение формулы (I) предпочтительно получают на стадиях (ii)-(vi.2). Таким образом, способ, предлагаемый в настоящем изобретении, дополнительно включает:
(ii) реакцию соединения формулы (В) со сложным эфиром малоновой кислоты R1OOC-CH2-COOR2 с получением соединения формулы (С)

где R1 и R2 независимо обозначают необязательно подходящим образом замещенную алкильную группу, содержащую от 1 до 5 атомов углерода;
(iii) восстановление соединения формулы (С) с получением соединения формулы (D)
 ;
;
(iv) ацилирование соединения формулы (D) изомасляным ангидридом с получением соединения формулы (Е)
 ;
;
(v) реакцию соединения формулы (Е) с галогеном Hal2, выбранным из группы, включающей Cl2, Br2 и I2, предпочтительно I2, в присутствии основания в растворителе с получением соединения формулы (F)
 ;
;
(vi.1) нагревание соединения формулы (F), предпочтительно при отсутствии DMPU (1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон), в растворителе, предпочтительно DMSO (диметилсульфоксид), с солью щелочного металла 1,2,4-триазола, предпочтительно натриевой солью, и обработку полученной реакционной смеси основанием с получением соединения формулы (I)
 ;
;
(vi.2) выделение соединения формулы (I) из реакционной смеси,
полученной на стадии (vi.1), путем экстракции подходящим растворителем.
Стадия (ii)
На стадии (ii) настоящего изобретения соединение формулы (В) предпочтительно вводят в реакцию со сложным эфиром малоновой кислоты R1OOC-CH2-COOR2, в котором R1 и R2 независимо обозначают необязательно подходящим образом замещенную алкильную группу, содержащую от 1 до 5 атомов углерода. Количество атомов углерода означает количество атомов углерода в незамещенном алкильном остатке. Предпочтительные алкильлые группы R1 и R2 содержат от 1 до 4 атомов углерода, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил. Еще более предпочтительные алкильные группы R1 и R2 содержат 1 или 2 атома углерода, такие как метил или этил, и этил является особенно предпочтительным. Еще более предпочтительные алкильные группы R1 и R2 представляют собой незамещенные алкильные группы.
На стадии (ii) еще более предпочтительно вводить сложный эфир малоновой кислоты R1OOC-CH2-COOR2 в реакцию с соединением (В) в присутствии подходящего сильного основания, предпочтительно сильного основания щелочного металла, обеспечивающего реакцию соответствующего аниона CH(COOR1)(COOR2), полученного из сложного эфира малоновой кислоты R1OOC-CH2-COOR2. В качестве щелочного металла предпочтительным является натрий. Подходящими основаниями являются, например NaH или NaOH и NaOH является предпочтительным. NaOH можно использовать в любом подходящем виде. В предпочтительном варианте осуществления NaOH используют в виде твердого вещества, такого как, например чешуйки NaOH. Растворитель, в котором проводят стадию (ii), можно выбрать, например, в соответствии с конкретной химической природой сильного основания, обсужденного выше. Приемлемыми растворителями являются, например THF, DMSO и т.п. Согласно настоящему изобретению, DMSO является предпочтительным. Температуры, при которых проводят реакцию на стадии (ii), можно выбрать в соответствии с растворителем и основанием. Предпочтительные температуры находятся в диапазоне от 0 до 35°С, более предпочтительно от 25 до 30°С.
Продукт реакции на стадии (ii), соединение формулы (С)
 ,
,
предпочтительно подходящим образом выделять из реакционной смеси, полученной на стадии (ii). В предпочтительном варианте осуществления это выделение включает стадию, на которой соединение (С) выделяют путем экстракции подходящим растворителем. Согласно настоящему изобретению, из подходящих растворителей предпочтительным является циклогексан.
Органический слой, полученный в результате экстракции, можно промыть в одну или большее количество стадий. В качестве реагентов для промывки следует отметить воду и водные растворы щелочей, такие как, например водные растворы оснований щелочных металлов, таких как гидроксид щелочного металла, предпочтительно гидроксид натрия.
Стадия (iii)
В другом предпочтительном варианте осуществления настоящего изобретения соединение формулы (С), полученное на стадии (ii), предпочтительно восстанавливают и из него получают соединение формулы (D):

Восстановление на стадии (iii) можно провести по любой подходящей методике с использованием любого подходящего восстановительного реагента. Согласно настоящему изобретению, предпочтительным является использование гидридного восстановительного реагента. Такими гидридными восстановительными реагентами является, например борогидрид натрия (NaBH4), борогидрид лития (LiBH4), алюмогидрид лития (LiAlH4), диизобутилалюминийгидрид (ДИБАЛ) или триэтилборогидрид лития (LiEt3BH). В предпочтительном варианте осуществления настоящего изобретения на стадии (iii) в качестве восстановительного реагента используют LiBH4.
В соответствии с предшествующим уровнем техники, необходимо использовать по меньшей мере 3 мол.экв. LiBH4 в пересчете на соединение формулы (С) (см. WO 94/25452, стр.31 раздел "Получение 5"). Однако в отличие от данных предшествующего уровня техники, согласно изобретению неожиданно было установлено, что восстановительный реагент LiBH4 можно использовать в гораздо меньшем избытке в пересчете на сложный эфир малоновой кислоты (С). В улучшенном способе, предлагаемом в настоящем изобретении, используют не более 2 мол.экв. LiBH4 в пересчете на соединение формулы (С), что означает, что в отличие от предшествующего уровня техники можно сэкономить по меньшей мере 33% восстановительного реагента. Таким образом, в особенности для проводимого в промышленном масштабе способа, настоящее изобретение обеспечивает экономические и экологические преимущества. Таким образом, настоящее изобретение относится к способу, определенному выше, в котором LiBH4 используют в качестве восстановительного реагента и его предпочтительно используют в количестве, составляющем не более 2 мол.экв. в пересчете на соединение (С).
На растворитель, в котором проводят реакцию на стадии (in), не налагают специальных ограничений при условии, что соединение формулы (D) получают. Предпочтительные растворители выбраны из группы, включающей воду, спирт и смесь воды и по меньшей мере одного спирта. Предпочтительными спиртами являются метанол, этанол и изопропанол. Поэтому растворитель предпочтительно выбран из группы, включающей воду, метанол, этанол, изопропанол и смесь воды и по меньшей мере одного из этих спиртов, более предпочтительно из группы, включающей воду, этанол, изопропанол и смесь воды и по меньшей мере одного из этих спиртов, более предпочтительно из группы, включающей воду, изопропанол и смесь воды и изопропанола.
Согласно изобретению неожиданно было установлено, что в частности, для наиболее предпочтительного восстановительного реагента, использующегося на стадии (iii), LiBH4, смесь воды и изопропанола является наиболее подходящим растворителем. В отличие от известного факта, заключающегося в том, что вода разлагает гидридный восстановительный реагент, установлено, что присутствие воды благоприятно для стадии (iii) способа, предлагаемого в настоящем изобретении. Если не ограничиваться какой-либо теорией, то можно полагать, что это может быть обусловлено тем, что некоторое количество воды повышает растворимость реагента LiBH4 и/или его предшественников NaBH4 и LiCl и тем самым повышает скорость реакции и таким образом, в свою очередь, с избытком компенсирует разложение восстановительного реагента.
Поэтому в других предпочтительных вариантах осуществления растворитель, использующийся на стадии (iii), содержит воду, причем растворитель предпочтительно содержит от 1 до 20 об.%, более предпочтительно от 5 до 15 об.% воды.
Температуры, при которых проводят реакцию на стадии (iii), можно выбрать в соответствии с растворителем и восстановительным реагентом. Предпочтительные температуры находятся в диапазоне от 0 до 40°С, более предпочтительно от 20 до 35°С, еще более предпочтительно от 25 до 30°С.
Продукт восстановления на стадии (iii), соединение формулы (D), предпочтительно надлежащим образом выделяют из реакционной смеси, полученной на стадии (iii). В предпочтительном варианте осуществления это выделение включает стадию, на которой соединение (D) выделяют путем экстракции подходящим растворителем. Согласно настоящему изобретению, из подходящих растворителей предпочтительным является толуол.
Стадия (iv)
На стадии (iv) настоящего изобретения соединение формулы (D) предпочтительно ацилируют изомасляным ангидридом с получением соединения формулы (Е)
 .
.
Более предпочтительно, если ацилирование на стадии (iv) проводят в присутствии подходящего фермента, предпочтительно фермента Novo SP 435, в подходящем растворителе, предпочтительно в ацетонитриле или толуоле, более предпочтительно в толуоле, например по методике, аналогичной описанной в WO 97/22710. Выбор толуола в качестве растворителя также благоприятен для экстракционной обработки, поскольку не требуется дополнительный растворитель. При использовании ацетонитрила в качестве растворителя для экстракционной обработки требуется использование дополнительного несмешивающегося растворителя.
Температуры, при которых проводят ацилирование на стадии (iv), можно выбрать в соответствии с растворителем, ацилирующим реагентом и ферментом. Предпочтительные температуры находятся в диапазоне от -20 до -5°С, более предпочтительно от -15 до -10°С, еще более предпочтительно от 25 до 30°С.
Полученную реакционную смесь предпочтительно дополнительно обрабатывают подходящим основанием, таким как, например, гидрокарбонат натрия.
В особенно предпочтительном варианте осуществления настоящего изобретения соединение формулы (Е) предпочтительно кристаллизуют из реакционной смеси. Поэтому настоящее изобретение также относится к способу, описанному выше, в котором после стадии (iv) и до стадии (v), соединение формулы (Е) по меньшей мере частично кристаллизуют.Кристаллизацию можно провести по любой возможной методике. В предпочтительном варианте осуществления соединение формулы (Е) кристаллизуют из н-гептана.
Стадия (v)
На стадии (v) настоящего изобретения соединение формулы (Е) предпочтительно вводят в реакцию с галогеном Hal2, выбранным из группы, включающей Cl2, Br2 и I2, предпочтительно I2, в присутствии основания в растворителе с получением соединения формулы (Fa)
 .
.
Обычно можно провести реакцию на стадии (v) в присутствии основания, такого как пиридин, и в подходящем растворителе, таком как ацетонитрил, THF, EtOAc (этилацетат) или CH2Cl2 (дихлорметан, DCM) при температуре в диапазоне от -20 до +30°С (см. WO 94/25452 А1, стр.16 и 35). Однако согласно изобретению было установлено, что реакцию предпочтительно проводить в этилацетате в качестве растворителя, причем в качестве основания используют гидрокарбонат натрия. Таким образом, настоящее изобретение относится к способу, в котором можно заменить небезопасное основание, пиридин. Кроме того, согласно изобретению было установлено, что температура, при которой проводят реакцию, предпочтительно равна ниже 0°С, более предпочтительно не выше -5°С и еще более предпочтительно не выше -10°С.
После завершения реакции органический слой, необязательно после соответствующей остановки реакции, необязательно можно промыть по меньшей мере один раз. Остановку реакции можно провести, например с помощью 10% (мас./об.) водного раствора сульфита натрия.
В особенно предпочтительном варианте осуществления настоящее изобретение относится к способу, определенному выше, в котором соединение формулы (Fa), цис-изомер, получают на стадии (v) вместе с соединением формулы (Fb), соответствующим транс-изомером
 .
.
Эту смесь соединений формулы (Fa) и (Fb) ниже называют соединением формулы (F)
 .
.
Согласно настоящему изобретению, в указанном соединении (F) предпочтительно от 80 до 95%, более предпочтительно от 85 до 95% молекул содержатся в виде цис-изомера формулы (Fa) и предпочтительно от 20 до 5%, более предпочтительно от 15 до 5% молекул соединения (F) содержатся в виде транс-изомера формулы (Fb).
Поэтому настоящее изобретение также относится к способу, определенному выше, дополнительно включающему:
(v) реакцию соединения формулы (Е) с галогеном Hal2, выбранным из группы, включающей Cl2, Br2 и I2, предпочтительно I2, в присутствии основания в растворителе с получением соединения формулы (F)

где предпочтительно от 80 до 95%, более предпочтительно от 85 до 95% молекул соединения (F) содержатся в виде цис-изомера формулы (Fa) и предпочтительно от 20 до 5%, более предпочтительно от 15 до 5% молекул соединения (F) содержатся в виде транс-изомера формулы (Fb).
Стадия (vi.1)
На стадии (vi.1) настоящего изобретения соединение формулы (F), т.е. предпочтительно соединение формулы (Fa) и соединение формулы (Fb), предпочтительно соответствующим образом нагревают в подходящем растворителе с подходящей солью 1,2,4-триазола. Предпочтительными солями 1,2,4-триазола являются соли щелочных металлов и натриевая соль является особенно предпочтительной. Предпочтительными растворителями являются полярные апротонные растворители, например DMF (N,N-диметилформамид) и DMSO, и DMSO является предпочтительным.
Температура, до которой нагревают реакционную смесь на стадии (vi.1), предпочтительно находится в диапазоне от +70 до +100°С, более предпочтительно от +80 до +95°С, и еще более предпочтительно от +85 до +90°С.
По поводу таких реакций с солью 1,2,4-триазола в WO 94/25452 указано, что такое нагревание следует проводить в присутствии 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинона (DMPU) (см. стр.17 стадия (1) и стр.39 стадия (b) в WO 94/25452). В отличие от данных, приведенных в WO 94/25452, согласно изобретению неожиданно было установлено, что нагревание соединения формулы (F) на стадии (vi.1) можно провести при отсутствии DMPU. Таким образом, в значительно улучшенном способе, предлагаемом в настоящем изобретении, предложена упрощенная система растворителей, которая в предпочтительном варианте осуществления включает только DMSO, т.e. состоит только из одного растворителя в отличие от обязательной содержащей 2 соединения системы, указанной в WO 94/25452.
Затем смесь, полученную нагреванием, предпочтительно обрабатывают подходящим основанием для промотирования омыления сложноэфирного фрагмента. Такими основаниями являются, например, гидроксиды щелочных металлов, бикарбонаты щелочных металлов, карбонаты щелочных металлов, гидроксиды щелочноземельных металлов, бикарбонаты щелочноземельных металлов и карбонаты щелочноземельных металлов. Основания щелочных металлов являются предпочтительными. Предпочтительно, если основание добавляют в водных и/или спиртовых средах. Подходящими спиртами являются спирты, содержащие от 1 до 6, предпочтительно от 1 до 4, более предпочтительно от 1 до 3, наиболее предпочтительно от 1 до 2 атомов углерода. Согласно изобретению было установлено, что предпочтительным основанием является гидроксид натрия, предпочтительно использующийся в виде водного раствора в присутствии метанола.
Согласно настоящему изобретению, на стадии (vi.1) получают соединение формулы (I)
 ,
,
где предпочтительно от 80 до 95%, более предпочтительно от 85 до 95% молекул содержатся в виде цис-изомера формулы (II)

и предпочтительно от 20 до 5%, более предпочтительно от 15 до 5% молекул содержатся в виде транс-изомера формулы (III)
 .
.
В соответствии с предшествующим уровнем техники, необходимо выделить соединение формулы (I) и тем самым формулы (II) после проведения стадий реакции, соответствующих стадии (vi.1) настоящего изобретения, с помощью хроматографии (см. WO 94/25452, стр.39 стадия (b)). Таким образом, в предшествующем уровнем техники явно указано, что необходимо провести дорогостоящую и длительную очистку, которая делает известный способ убыточным при использовании в промышленном масштабе.
В отличие от предшествующего уровня техники, согласно изобретению было установлено, что не требуется проводить такое разделение с помощью хроматографии, если проводят определенную последовательность стадий (vi.1) и экстракции на стадии (vi.2), необязательно кристаллизацию на стадии (vii) и/или образование соли, предлагаемой в настоящем изобретении, на стадии (2), как это описано ниже. Таким образом, эта модификация обеспечивает значительное преимущество по сравнению со способами предшествующего уровня техники.
Стадия (vi.2)
На стадии (vi.2) настоящего изобретения соединение формулы (I)
 ,
,
предпочтительно соединение формулы (II)

и соединение формулы (III)

содержащиеся в смеси, полученной на стадии (vi.1), надлежащим образом выделяют, предпочтительно путем экстракции в подходящем растворителе.
Согласно настоящему изобретению, предпочтительными растворителями являются полярные не смешивающиеся с водой растворители. Более предпочтительным растворителем является сложный эфир, такой как этилацетат или изопропилацетат, простой эфир, такой как тетрагидрофуран или метилтетрагидрофуран, кетон, такой как метилизобутилкетон, галогенированный растворитель, такой как дихлорметан, толуол или смесь двух или более этих растворителей, более предпочтительно сложный или простой эфир, более предпочтительно простой эфир и еще более предпочтительно метилтетрагидрофуран.
Стадия (vii)
Как отмечено выше, способ, предлагаемый в настоящем изобретении, может дополнительно включать дополнительную стадию (vii) по меньшей мере частичной кристаллизации соединения формулы (I). Затем полученное таким образом по меньшей мере частично кристаллическое соединение смешивают с первым подходящим растворителем.
Поэтому настоящее изобретение также относится к способу, определенному выше, где на стадии (1) способ с помощью которого соединение формулы (I) получают на стадии (1), дополнительно включает:
(vii) по меньшей мере частичную кристаллизацию соединения формулы (I), предпочтительно соединения формулы (II) и соединения формулы (III), после стадии (vi.2), в котором соединение формулы (I) предпочтительно кристаллизуют из растворителя необязательно путем добавления подходящего антирастворителя, где растворителем предпочтительно является растворитель или смесь растворителей, использующаяся на стадии (vi.2), и где антирастворителем предпочтительно является насыщенный или ненасыщенный углеводород, такой как циклогексан, гексан или гептан, или смесь двух или более из них.
После кристаллизации закристаллизованное соединение (I), в частности, закристаллизованное соединение формулы (II) и закристаллизованное соединение формулы (III), предпочтительно выделяют из маточного раствора, например, с помощью подходящего фильтрования, и предпочтительно по меньшей мере один раз промывают подходящим промывочным реагентом. Предпочтительными промывочными реагентами являются смесь растворителей, использующаяся для кристаллизации, и антирастворителя, рассмотренная выше. После такого предпочтительного выделения закристаллизованное соединение формулы (I), в частности, закристаллизованное соединение формулы (II) и закристаллизованное соединение формулы (III), предпочтительно сушат при подходящих условиях сушки. Сушка в вакууме является предпочтительной и при этом температуры предпочтительно находятся в диапазоне от 20 до 50°С, более предпочтительно от 30 до 45°С.
В способе, предлагаемом в настоящем изобретении и описанном выше, кристаллическое хиральное соединение формулы (II), цис-изомер

получают в виде смеси с его диастереоизомерной формой, кристаллическим соединением формулы (III), а именно, с транс-изомером
 .
.
При предпочтительных условиях проведения способа, предлагаемого в настоящем изобретении, закристаллизованное соединение формулы (I), полученное после стадии (vii),

предпочтительно содержит от 80 до 95%, более предпочтительно от 85 до 95% цис-изомера (II) и предпочтительно от 20 до 5%, более предпочтительно от 15 до 5% транс-изомера (III).
Кроме того, на стадии (1) настоящего изобретения соединение формулы (1) получают в первом подходящем растворителе до обработки HCl, который содержится во втором подходящем растворителе.
Обычно на химическую природу первого подходящего растворителя не налагают специальных ограничений при условии, что обработка HCl, содержащегося во втором подходящем растворителе позволяет получить HCl соль соединения формулы (I). Согласно настоящему изобретению, предпочтительным растворителем, в котором соединение формулы (I) содержится в соответствии со стадией (1), является органический растворитель, предпочтительно спирт и/или предшественник спирта, простой эфир, кетон, сложный эфир или смесь двух или более из них. Термин "предшественник спирта" при использовании в настоящем изобретении означает соединение, из которого при условиях осуществления способа на стадии (1) или стадиях (1) и (2) образуется спирт. Например, для иллюстрации термина "предшественник спирта" следует отметить циклические простые эфиры диоксан, метилтетрагидрофуран или тетрагидрофуран, которые в кислой среде по меньшей мере частично содержатся в виде соответствующих спиртов с открытой цепью.
В других вариантах осуществления настоящего изобретения первый подходящий растворитель, в котором содержится соединение формулы (I), выбран из группы, включающей этилацетат, изопропилацетат, диэтиловый эфир, тетрагидрофуран (THF), метилтетрагидрофуран, диоксан, метанол, н-пропанол, 1-бутанол, 2-бутанол, 2-метил-1-бутанол, 3-метил-1-бутанол, ацетон, 2-бутанон и метилизобутилкетон (MIBKL), и в котором второй растворитель выбран из группы, включающей диоксан, тетрагидрофуран (THF), диэтиловый эфир, диизопропиловый эфир, метил-трет-бутиловый эфир (МТВЕ), этилацетат, метанол, н-пропанол, 1-бутанол, 2-бутанол, 2-метил-1-бутанол, 3-метил-1-бутанол и толуол.
Обычно в качестве первого подходящего растворителя также можно использовать смесь двух или более растворителей. Обычно в качестве второго подходящего растворителя также можно использовать смесь двух или более растворителей.
Стадия (2) - увеличение чистоты цис-изомера
Согласно изобретению неожиданно было установлено, что особые комбинации первого подходящего растворителя и второго подходящего растворителя позволяют увеличить отношение количества цис-изомера (II) к количеству транс-изомера (III) на стадиях (1) и (2), предпочтительно, если кристаллизацию проводят после стадии (2). Предпочтительно для случая, в котором соединение формулы (I), полученное на стадии (1), содержит от 80 до 95%, предпочтительно от 85 до 95% цис-изомера (II) и от 20 до 5%, предпочтительно от 15 до 5% транс-изомера (III), эта особая комбинация растворителей обеспечивает возможность того, что с помощью простых методик кристаллизации можно обеспечить указанное увеличение отношения количества цис-изомера (II) к количеству транс-изомера (III) без использования длительной и дорогостоящей колоночной хроматографии в градиентном режиме, описанной в предшествующем уровне техники. В этом конкретном варианте осуществления настоящего изобретения первый и/или второй растворитель включает спирт и/или предшественник спирта.
Поэтому настоящее изобретение также относится к способу, определенному выше, в котором первый и/или второй растворитель включает спирт и/или предшественник спирта.
Еще более предпочтительным является то, что согласно изобретению было установлено, что особенно предпочтительным вариантом осуществления является комбинация первого подходящего растворителя, которым является MIBK, и второго подходящего растворителя, которым является THF. Кроме того, согласно изобретению было установлено, что еще одним особенно предпочтительным вариантом осуществления является тот, в котором в качестве первого и второго подходящего растворителя используют н-бутанол.
Обычно на температуру, при которой проводят обработку на стадии (2), не налагают специальных ограничений. В зависимости от температур кипения использующихся растворителей предпочтительные температуры находятся в диапазоне от 20 до 100°С, предпочтительно от 40 до 80°С, более предпочтительно от 55 до 65°С. Температура смеси, полученной на стадии (1), может быть выше, ниже или практически такой же, как температура, при которой проводят стадию (2). В предпочтительном варианте осуществления настоящего изобретения смесь соединения формулы (I) и первого подходящего растворителя, полученную на стадии (1), нагревают при температуре, при которой проводят стадию (2), до добавления второго подходящего растворителя, содержащего HCl. Термин "второй подходящий растворитель, содержащий HCl" не обязательно исключает такой вариант осуществления, в котором по меньшей мере часть HCl добавляют к смеси, полученной на стадии (1) до добавления второго подходящего растворителя, или варианты осуществления, в которых по меньшей мере часть HCl добавляют к смеси, полученной на стадии (1), после добавления второго подходящего растворителя. В предпочтительном варианте осуществления настоящего изобретения HCl, необходимый для обработки на стадии (2), в основном полностью содержится во втором подходящем растворителе и, таким образом, его добавляют к смеси, полученной на стадии (1), вместе со вторым подходящим растворителем.
Обычно можно использовать HCl в любых количествах при условии, что после стадии (2), предпочтительно после кристаллизации после стадии (2), отношение количества цис-изомера (II) к количеству транс-изомера (III) увеличивается по сравнению с соответствующим отношением в соединении формулы (I), использующимся на стадии (1). В предпочтительном варианте осуществления настоящего изобретения HCl, содержащийся во втором растворителе, используют на стадии (2) вместе с соединением формулы (I) в молярном отношении HCl:(1), находящемся в диапазоне от 1,0:1 до 2,0:1, предпочтительно от 1,1:1 до 1,8:1, более предпочтительно от 1,2:1 до 1,7:1, еще более предпочтительно от 1,3:1 до 1,5:1.
Как отмечено выше, HCl содержится во втором растворителе, использующемся на стадии (2) способа, предлагаемого в настоящем изобретении. Согласно изобретению неожиданно было установлено, что HCl нельзя заменить другими кислотами, такими как H2SO4, HBr, HNO3, Н3РО4, трифторуксусная кислота или другие органические кислоты. Поэтому в возможном варианте осуществления настоящего изобретения стадию (2) проводят, когда второй растворитель содержит в качестве компонента-кислоты только HCl.
Как отмечено выше, после стадии (2) соль с HCl соединения формулы (I) предпочтительно по меньшей мере частично кристаллизуют. Поэтому в объем настоящего изобретения включают варианты осуществления, в которых указанная кристаллизация по меньшей мере частично протекает на стадии (2). Для соответствующего инициирования кристаллизации можно внести затравочные кристаллы. Однако в настоящем изобретении внесение затравочных кристаллов не является необходимым и кристаллизация без внесения затравочных кристаллов является предпочтительной.
Обычно температуры, при которых проводят указанную кристаллизацию, подбирают в соответствии с использующимися растворителями. В предпочтительном варианте осуществления настоящего изобретения температура находится в диапазоне от 20 до 100°С, предпочтительно от 40 до 80°С и более предпочтительно от 55 до 65°С. Затем полученную смесь предпочтительно непрерывно охлаждают до заранее заданной температуры, где охлаждение можно провести непрерывно или ступенчатым образом в две или большее количество стадий. В одном варианте осуществления настоящего изобретения заранее заданная температура, до которой в конечном счете охлаждают смесь, находится в диапазоне от 0 до 30°С, предпочтительно от 20 до 30°С.
После кристаллизации по меньшей мере частично закристаллизованную соль с HCl соединения формулы (I), обладающую увеличенным отношением количества цис-изомера (II) к количеству транс-изомера (III), предпочтительно выделяют из маточного раствора, например путем подходящего фильтрования, и предпочтительно промывают по меньшей мере один раз подходящим промывочным реагентом. Предпочтительным промывочным реагентом является, например, один из первых подходящих растворителей, описанных выше, и MIBK является особенно предпочтительным. Поэтому настоящее изобретение также относится к способу, определенному выше, способ дополнительно включает
2а) выделение по меньшей мере частично закристаллизованной HCl соли соединения формулы (I), предпочтительно фильтрованием, необязательно с последующей промывкой подходящим растворителем, предпочтительно MIBK.
После такого предпочтительного выделения по меньшей мере частично закристаллизованную соль с HCl соединения формулы (I) предпочтительно сушат при подходящих условиях сушки. Предпочтительной является сушка в вакууме, при которой температуры предпочтительно находятся в диапазоне от 30 до 55°С, более предпочтительно от 40 до 50°С.
Как отмечено выше, соединение формулы (I), использующееся в качестве исходного вещества на стадии (1), обычно содержит от 80 до 95%, предпочтительно от 85 до 95% цис-изомера (II) и от 20 до 5%, предпочтительно от 15 до 5% транс-изомера (III). Если используют такие соединения (I), то по меньшей мере частично закристаллизованная HCl соль соединения формулы (I), полученная после обработки HCl на стадии (2), и кристаллизации, определенной выше, содержит более 95%, предпочтительно по меньшей мере 96% HCl соли цис-изомера формулы (II) и менее 5%, предпочтительно не более 4% HCl соли транс-изомера формулы (III). Однако еще более предпочтительно, если по меньшей мере частично закристаллизованная HCl соль соединения формулы (I) содержит по меньшей мере 97%, предпочтительно по меньшей мере 98% и более предпочтительно по меньшей мере 99% HCl соли цис-изомера формулы (II) и не более 3%, предпочтительно не более 2% и более предпочтительно не более 1% HCl соли транс-изомера формулы (III).
Таким образом, в отличие от предшествующего уровня техники настоящее изобретение относится к значительно упрощенному способу очистки соединения формулы (I) с получением очищенного цис-изомера формулы (II). В частности применительно к предпочтительному применению такого очищенного соединения формулы (I) для получения фунгицидного средства, предпочтительно позаконазола, это улучшение способа, исключающее усложненную очистку, использовавшуюся в предшествующем уровне техники, обеспечивает эффективное изготовление в промышленном масштабе.
Стадия (3) - дополнительное повышение чистоты с помощью экстракционной обработки твердого вещества
В случае, если содержание цис-изомера формулы (II) в по меньшей мере частично закристаллизованной HCl соли соединения формулы (I), полученной на стадии (2) с последующей кристаллизацией, не отвечает требованиям последующего применения, такого как применение для получения фунгицидного средства, предпочтительно соединения формулы (VIII)
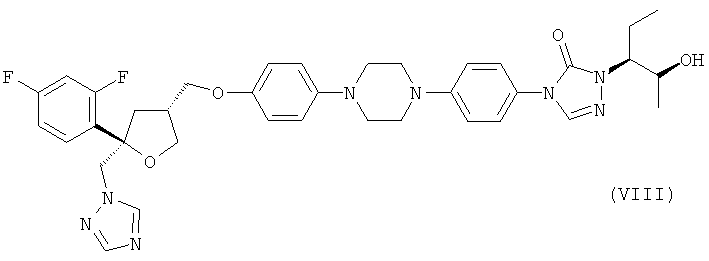 ,
,
настоящее изобретение относится к другой предлагаемой здесь стадии увеличения указанного содержания цис-изомера в соединении формулы (I). В этом варианте осуществления настоящего изобретения по меньшей мере частично закристаллизованную HCl соль соединения формулы (I) обрабатывают с помощью по меньшей мере одной стадии экстракционной обработки твердого вещества, в результате чего получают HCl соль соединения формулы (I) с дополнительно увеличенным содержанием цис-изомера формулы (II) и с дополнительно уменьшенным содержанием транс-изомера формулы (III).
Поэтому настоящее изобретение также относится к способу, определенному выше, дополнительно включающему:
(3) проведение для по меньшей мере частично закристаллизованной HCl соли соединения формулы (I) экстракционной обработки твердого вещества в подходящем растворителе, предпочтительно содержащем MIBK, с получением HCl соли соединения формулы (I), для увеличения содержания HCl соли цис-изомера формулы (II).
До подробного обсуждения предлагаемой в настоящем изобретении стадии проведения для по меньшей мере частично закристаллизованной HCl соли экстракционной обработки твердого вещества следует отметить, что обычно стадию (3) настоящего изобретения также можно провести на основе по меньшей мере частично кристаллической HCl соли соединения формулы (I) содержание цис-изомера в которой не увеличилось на стадиях (1) и (2). Кроме того, эта комбинация предлагаемого в настоящем изобретении получения HCl соли соединения формулы (I) и предлагаемой в настоящем изобретении экстракционной обработки твердого вещества позволяет легко получить соль с HCl соединения формулы (I) с повышенным содержанием цис-изомера формулы (II).
В частности, эта предлагаемая в настоящем изобретении комбинация стадий реакции позволяет использовать на стадии (1) исходное вещество, которое обычно содержит от 80 до 95%, предпочтительно от 85 до 95% цис-изомера (II) и от 20 до 5%, предпочтительно от 15 до 5% транс-изомера (III). Если используют такие соединения (I) и если на стадиях (1) и (2) не происходит увеличения чистоты по меньшей мере частично закристаллизованной HCl соли соединения формулы (I), то по меньшей мере частично закристаллизованная соль с HCl соединения формулы (I), полученная после обработки с помощью HCl на стадии (2) и кристаллизации, определенной выше, содержит от 80 до 95%, предпочтительно от 85 до 95% HCl соли цис-изомера (II) и от 20 до 5%, предпочтительно от 15 до 5% HCl соли транс-изомера (III). После предлагаемой в настоящем изобретении экстракционной обработки твердого вещества на стадии (3) по меньшей мере частично закристаллизованная соль с HCl соединения формулы (I), полученная на стадии (3), содержит по меньшей мере 97%, предпочтительно по меньшей мере 98% и более предпочтительно по меньшей мере 99% HCl соли цис-изомера формулы (II) и не более 3%, предпочтительно не более 2% и более предпочтительно не более 1% HCl соли транс-изомера формулы (III).
Если после стадии (3) содержание цис-изомера формулы (II) в по меньшей мере частично закристаллизованной HCl соли соединения формулы (I), полученной на стадии (3), с последующим выделением, не отвечает требованиям последующего применения, такого как применение для получения фунгицидного средства, предпочтительно соединения формулы (VIII), обычно можно провести одну или большее количество дополнительных стадий экстракционной обработки твердого вещества в соответствии со стадией (3).
Стадия (2) без увеличения или с несущественным увеличением чистоты (II)
Если на стадиях (1) и (2) не происходит или в основном не происходит увеличения содержания цис-изомера (II), то не налагают специальных ограничений на растворители, использующийся на стадии (1) и стадии (2). В частности, согласно изобретению было установлено, что в отличие от варианта осуществления настоящего изобретения, в котором увеличивается отношение цис:транс, необязательно, чтобы первый и/или второй растворитель, использующийся на стадиях (1) и (2), содержал спирт или предшественник спирта. Относительно возможных и предпочтительных растворителей, не являющихся спиртами или предшественниками спиртов, использующихся на стадиях (1) и (2), дается ссылка на соответствующее обсуждение, проведенное выше.
В предпочтительном варианте осуществления настоящего изобретения, в котором не происходит или в основном не происходит увеличения содержания цис-изомера (II) на стадии (2), соединение формулы (I) получают на стадии (1) в ацетоне в качестве первого подходящего растворителя. Если соединение формулы (I) получают способом, с помощью которого соединение получают в растворителе, отличном от ацетона, соответствующая замена растворителя является предпочтительной. Как описано выше, соединение формулы (I) предпочтительно получают способом, включающим стадии (i.1)-(vi.2), более предпочтительно без кристаллизации на стадии (vii), где в еще одном предпочтительном варианте осуществления соединение формулы (I) получают в метилтетрагидрофуране в качестве растворителя. Таким образом, предпочтительно заменять ацетон на метилтетрагидрофуран до направления соединения формулы (I) на стадию (2) настоящего изобретения.
Обычно на температуру, при которой проводят обработку на стадии (2), не налагают специальных ограничений, если не требуется увеличить содержание цис-изомера. В зависимости от температур кипения использующихся растворителей предпочтительные температуры находятся в диапазоне от 0 до 100°С. Температура смеси, полученной на стадии (1) может быть выше, ниже или практически такой же, как температура, при которой проводят стадию (2). В предпочтительном варианте осуществления настоящего изобретения смесь соединения формулы (I) и первого подходящего растворителя, полученную на стадии (1), нагревают при температуре, при которой проводят стадию (2), до добавления второго подходящего растворителя, содержащего HCl. Термин "второй подходящий растворитель, содержащий HCl", не обязательно исключает такой вариант осуществления, в котором по меньшей мере часть HCl добавляют к смеси, полученной на стадии (1), до добавления второго подходящего растворителя, или варианты осуществления, в которых по меньшей мере часть HCl добавляют к смеси, полученной на стадии (1), после добавления второго подходящего растворителя. В предпочтительном варианте осуществления настоящего изобретения HCl, необходимая для обработки на стадии (2), в основном полностью содержится во втором подходящем растворителе и, таким образом, добавляли к смеси, полученной на стадии (1), вместе со вторым подходящим растворителем.
Обычно можно использовать HCl в любых количествах. В предпочтительном варианте осуществления настоящего изобретения HCl, содержащаяся во втором растворителе используют на стадии (2) вместе с соединением формулы (I) в молярном отношении HCl: (1), находящемся в диапазоне от 1,0:1 до 3,0:1, предпочтительно от 1,5:1 до 2,5:1, более предпочтительно от 2,0:1 до 2,2:1.
Как уже отмечено выше, HCl содержится во втором растворителе, использующемся на стадии (2) способа, предлагаемого в настоящем изобретении. Согласно изобретению неожиданно было установлено, что HCl нельзя заменить другими кислотами, такими как H2SO4, HBr, HNO3, H3PO4, трифторуксусная кислота или другие органические кислоты. Поэтому в возможном варианте осуществления настоящего изобретения стадию (2) проводят, когда второй растворитель содержит в качестве компонента-кислоты только HCl.
Как отмечено выше, после стадии (2), соль с HCl соединения формулы (I) предпочтительно по меньшей мере частично кристаллизуют. Поэтому в объем настоящего изобретения включают варианты осуществления, в которых указанная кристаллизация по меньшей мере частично протекает на стадии (2). Для соответствующего инициирования кристаллизации можно внести затравочные кристаллы. Однако согласно настоящему изобретению внесение затравочных кристаллов не является необходимым и кристаллизация без внесения затравочных кристаллов является предпочтительной.
Обычно температуры, при которых проводят указанную кристаллизацию, подбирают в соответствии с использующимися растворителями. В предпочтительном варианте осуществления настоящего изобретения температура находится в диапазоне от 20 до 100°С, предпочтительно от 40 до 80°С и более предпочтительно от 55 до 65°С. Затем полученную смесь предпочтительно охлаждают до заранее заданной температуры, где охлаждение можно провести непрерывно или ступенчатым образом в две или большее количество стадий. В одном варианте осуществления настоящего изобретения заранее заданная температура, до которой в конечном счете охлаждают смесь, находится в диапазоне от 0 до 30°С, предпочтительно от 20 до 30°С.
После кристаллизации, по меньшей мере частично закристаллизованную HCl соль соединения формулы (I), обладающую таким же или в основном таким же отношением количества цис-изомера (II) к количеству транс-изомера (III), как в исходном веществе, т.е. где по меньшей мере частично закристаллизованная HCl соль содержит от 80 до 95%, предпочтительно от 85 до 95% HCl соли цис-изомера формулы (II) и от 20 до 5%, предпочтительно от 15 до 5% HCl соли транс-изомера формулы (III), предпочтительно выделяют из маточного раствора, например путем подходящего фильтрования, и предпочтительно промывают по меньшей мере один раз подходящим промывочным реагентом. Предпочтительным промывочным реагентом является, например один из растворителей, описанных выше, и метил-трет-бутиловый эфир (МТВЕ), ацетон или метилизобутилкетон (MIBK) является предпочтительным, и МТВЕ является особенно предпочтительным. Поэтому настоящее изобретение также относится к способу, определенному выше, способ дополнительно включает:
(2b) выделение по меньшей мере частично закристаллизованной HCl соли соединения формулы (I), предпочтительно фильтрованием, необязательно с последующей промывкой подходящим растворителем, предпочтительно метил-трет-бутиловым эфиром (МТВЕ), ацетоном или метилизобутилкетоном (MIBK), более предпочтительно МТВЕ.
После такого предпочтительного выделения по меньшей мере частично закристаллизованную соль с HCl соединения формулы (I) предпочтительно сушат при подходящих условиях сушки. Предпочтительной является сушка в вакууме, при которой температуры предпочтительно находятся в диапазоне от 30 до 55°С, более предпочтительно от 40 до 50°С.
Стадия (3) - подробное описание
Как отмечено выше, стадию (3) проведения для по меньшей мере частично закристаллизованной HCl соли соединения формулы (I) экстракционной обработки твердого вещества можно провести по меньшей мере один раз, если в способе, предлагаемом в настоящем изобретении, отношение цис:транс увеличивается на стадиях (1) и (2) и где это увеличенное содержание цис-изомера не отвечает требованиям последующего применения соединения формулы (I). Обычно, если на стадиях (1) и (2) отношение цис:транс увеличивается до составляющего не менее 97:3, предпочтительно не менее 98:2, более предпочтительно не менее 98,5:1,5 и еще более предпочтительно не менее 99:1, в большинстве случаев не требуется проведение одной или более дополнительных стадий (3). Если после стадий (1) и (2) не обеспечивается увеличение отношения цис:транс или его нужно увеличить, или если отношение цис:транс увеличивается до составляющего менее 97:3, особенно предпочтительным вариантом осуществления настоящего изобретения является проведение по меньшей мере одной стадии (3) после стадий (1) и (2). Как определено выше, такая стадия (3) включает:
(3) проведение для по меньшей мере частично закристаллизованной HCl соли соединения формулы (I) экстракционной обработки твердого вещества в подходящем растворителе, предпочтительно содержащем MIBK, с получением HCl соли соединения формулы (I) для увеличения содержания HCl соли цис-изомера формулы (II).
Обычно на стадии (3) можно использовать любой подходящий растворитель или смесь растворителей. В особенно предпочтительном варианте осуществления растворитель или смесь растворителей, использующаяся на стадии (3), включает MIBK. Поэтому на стадии (3) MIBK можно использовать в качестве единственного растворителя или в качестве растворителя в подходящей смеси растворителей. Поскольку на другие компоненты использующейся смеси растворителей не налагают специальных ограничений при условии, что можно провести предлагаемую в настоящем изобретении экстракционную обработку твердого вещества, предпочтительные смеси растворителей в дополнение к MIBK включают по меньшей мере один спирт или по меньшей мере один предшественник спирта, или по меньшей мере один спирт и по меньшей мере один предшественник спирта. Для термина "предшественник спирта" дается ссылка на соответствующее определение, приведенное выше. Еще более предпочтительно, если смесь растворителей, использующаяся на стадии (3), включает MIBK и по меньшей мере один спирт или по меньшей мере один предшественник спирта, или по меньшей мере один спирт и по меньшей мере один предшественник спирта. Более предпочтительно, если смесь растворителей, использующаяся на стадии (3), включает MIBK и по меньшей мере один спирт, еще более предпочтительно MIBK и один спирт. Поскольку на по меньшей мере один спирт не налагают специальных ограничений, особенно предпочтительным является бутанол, предпочтительно н-бутанол.
На отношение количества молей MIBK к количеству молей спирта, предпочтительно бутанола, еще более предпочтительно н-бутанола не налагают специальных ограничений. В предпочтительном варианте осуществления отношение количества молей MIBK к количеству молей спирта, использующегося в смеси растворителей, применяющейся на стадии (3), находится в диапазоне от 0,5:1 до 10:1, предпочтительно от 0,75:1 до 5:1 и более предпочтительно от 0,95:1 до 1,05:1.
Обычно концентрацию HCl соли соединения формулы (I) в растворителе или смеси растворителей, использующейся на стадии (3), можно подобрать в соответствии с требованиями, обеспечивающими проведение очистки. В предпочтительном варианте осуществления концентрация HCl соли соединения формулы (I) находится в диапазоне от 0,25 до 0,75, предпочтительно от 0,55 до 0,65 моль/л растворителя или смеси растворителей.
Обычно температуры, при которых проводят указанную экстракционную обработку твердого вещества, подбирают в соответствии с использующимся растворителем или смесью растворителей. В предпочтительном варианте осуществления настоящего изобретения экстракционную обработку твердого вещества на стадии (3) проводят при температуре в диапазоне от 20 до 100°С, предпочтительно от 40 до 80°С, и более предпочтительно от 55 до 65°С.
Затем полученную смесь предпочтительно охлаждают до заранее заданной температуры, где охлаждение можно провести непрерывно или ступенчатым образом в две или большее количество стадий. В одном варианте осуществления настоящего изобретения заранее заданная температура, до которой в конечном счете охлаждают смесь, находится в диапазоне от 0 до 30°С, предпочтительно от 20 до 30°С.
По меньшей мере частично закристаллизованная соль с HCl соединения формулы (I), обладающую увеличенным отношением количества цис-изомера (II) к количеству транс-изомера (III), предпочтительно выделяют из смеси, полученной с помощью экстракционной обработки твердого вещества, например, путем подходящего фильтрования, и предпочтительно промывают по меньшей мере один раз подходящим промывочным реагентом. Предпочтительным промывочным реагентом является, например, один из растворителей, описанных выше, диэтиловый эфир и/или метил-трет-бутиловый. эфир (МТВЕ) является особенно предпочтительным. Поэтому настоящее изобретение также относится к способу, определенному выше, способ дополнительно включает:
(3а) выделение по меньшей мере частично закристаллизованной HCl соли соединения формулы (I) из смеси, полученной на стадии (3), предпочтительно фильтрованием, необязательно с последующей промывкой подходящим растворителем, предпочтительно диэтиловым эфиром или метил-трет-бутиловый эфиром (МТВЕ).
После такого предпочтительного выделения по меньшей мере частично закристаллизованную соль с HCl соединения формулы (I) предпочтительно сушат при подходящих условиях сушки. Предпочтительной является сушка в вакууме, при которой температуры предпочтительно находятся в диапазоне от 30 до 55°С, более предпочтительно от 40 до 50°С.
До или после указанной стадии сушки способ, предлагаемый в настоящем изобретении, может включать по меньшей мере одну дополнительную стадию проведения для по меньшей мере частично закристаллизованной HCl соли, полученной на стадии (3) или стадии (3а), экстракционной обработки твердого вещества. Относительно общих и предпочтительных условий такой дополнительной экстракционной обработки твердого вещества или экстракционных обработок твердого вещества, дается ссылка на проведенное выше обсуждение стадий (3) и (3а). Поэтому настоящее изобретение также относится к способу, определенному выше, включающему стадии (3) и (3а), дополнительно включающему проведение для HCl соли, полученной на стадии (3а), экстракционной обработки твердого вещества определенным выше способом, предпочтительно с последующим выделением полученной таким образом HCl соли способом, рассмотренным в связи со стадией (3а).
Как отмечено выше, HCl соль соединения формулы (I), использующаяся в качестве исходного вещества на стадии (3), обычно содержит от 80 до менее 97%, предпочтительно от 85 до менее 97% HCl соли цис-изомера (II) и от 20 до более 3%, предпочтительно от 15 до более 3% HCl соли транс-изомера (III). Если используют такие соединения формулы (I), то по меньшей мере частично закристаллизованная HCl соль соединения формулы (I), полученная с помощью экстракционной обработки твердого вещества на стадии (3) и выделения, определенных выше, содержит по меньшей мере 97%, предпочтительно по меньшей мере 98% и более предпочтительно по меньшей мере 99% HCl соли цис-изомера формулы (II) и не более 3%, предпочтительно не более 2% и более предпочтительно не более 1% HCl соли транс-изомера формулы (III).
Таким образом, согласно изобретению было установлено, что или с помощью подходящей комбинации стадий (1) и (2) с последующей кристаллизацией, приводящей к значительно увеличенному отношению цис:транс, необязательно с последующей по меньшей мере одной предлагаемой в настоящем изобретении экстракционной обработкой твердого вещества, или с помощью относительно общей комбинации стадий (1) и (2), особенно предпочтительно с последующей по меньшей мере одной предлагаемой в настоящем изобретении экстракционной обработкой твердого вещества можно получить значительно упрощенный способ увеличения содержания цис-изомера формулы (II) в соединении формулы (I) на основе ключевого соединения, которым в обоих случаях является соль с HCl соединения формулы (I). В частности, применительно к предпочтительному применению такого очищенного соединения формулы (I) для получения фунгицидного средства, предпочтительно позаконазола, это улучшение способа, исключающее усложненную очистку, использовавшуюся в предшествующем уровне техники, обеспечивает эффективное изготовление в промышленном масштабе.
Следовательно, настоящее изобретение также относится к предпочтительно кристаллической гидрохлоридной соли (HCl) соединения формулы (I)

где Y1 и Y2 независимо обозначают F или Cl, предпочтительно F, где указанное соединение формулы (I) содержит цис-изомер формулы (II) и трансизомер формулы (III)
 ,
,  .
.
В предпочтительном варианте осуществления настоящего изобретения указанная предпочтительно кристаллическая HCl соль содержит по меньшей мере 97%, предпочтительно по меньшей мере 98% и более предпочтительно по меньшей мере 99% HCl соли цис-изомера формулы (II) и не более 3%, предпочтительно не более 2% и более предпочтительно не более 1% HCl соли транс-изомера формулы (III).
Таким образом, в частности, настоящее изобретение относится к по меньшей мере частично кристаллической, предпочтительно кристаллической HCl соли соединения формулы (I) с большим содержанием цис-изомера формулы (II), в которой Y1 и Y2 обозначают F, и в которой указанная по меньшей мере частично кристаллическая, предпочтительно кристаллическая соль с HCl содержит по меньшей мере 99% HCl соли цис-изомера формулы (II) и не более 1% транс-изомера формулы (III).
Кристаллическая соль с HCl соединения формулы (I), описанная в настоящем изобретении, в которой Y1 и Y2 обозначают F, предпочтительно обладает следующей рентгенограммой, содержащей по меньшей мере следующие отражения:
где 100% относится к интенсивности наиболее интенсивного пика на рентгенограмме.
Кроме того, настоящее изобретение относится к предпочтительно по меньшей мере частично кристаллической гидрохлоридной соли (HCl) соединения формулы (I)

где Y1 и Y2 независимо обозначают F или Cl, предпочтительно F, которую можно получить или получают способом, определенным выше в настоящем изобретении.
Как указано выше, такую по меньшей мере частично кристаллическую соль с HCl соединения формулы (I), обладающую указанным увеличенным отношением цис:транс, предпочтительно можно использовать в качестве исходного вещества для получения фунгицидного средства, предпочтительно для получения позаконазола - соединения формулы (VIII). В частности, такие по меньшей мере частично кристаллические IICl соли соединения формулы (I) являются особенно подходящими, если они содержат по меньшей мере 99% цис-изомера формулы (II).
Поэтому настоящее изобретение также относится к применению по меньшей мере частично кристаллической HCl соли соединения формулы (I), определенной выше, содержащей по меньшей мере 99% HCl соли цис-изомера формулы (II)
 ,
,
где оба Y1 и Y2 обозначают F, для получения фунгицидного средства, предпочтительно соединения формулы (VIII)
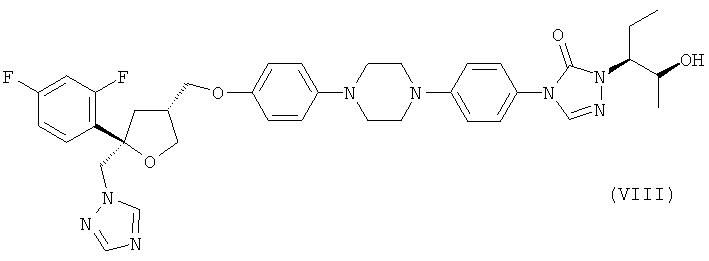 .
.
Кроме того, настоящее изобретение относится к способу применения по меньшей мере частично кристаллической HCl соли соединения формулы (I), определенной выше, содержащей по меньшей мере 99% HCl соли цис-изомера формулы (II)
 ,
,
где оба Y1 и Y2 обозначают F, для получения фунгицидного средства, предпочтительно соединения формулы (VIII)
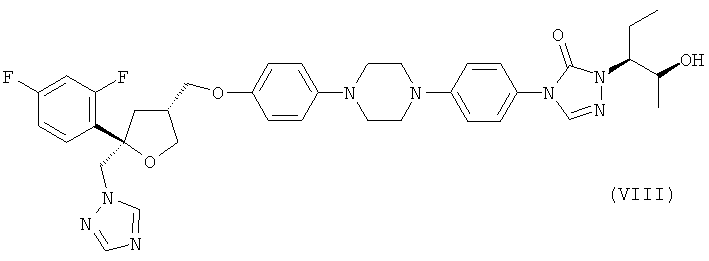 .
.
Кроме того, настоящее изобретение относится к способу получения фунгицидного средства, предпочтительно соединения формулы (VIII)
 ,
,
где по меньшей мере частично кристаллическую HCl соль соединения формулы (I), определенную выше, содержащую по меньшей мере 99% HCl соли цис-изомера формулы (II)

используют в качестве исходного вещества, где оба Y1 и Y2 предпочтительно обозначают F.
Настоящее изобретение предпочтительно относится к указанному применению, или к указанному способу применения, или к указанному способу, включающему превращение HCl соли соединения формулы (I) в соответствующий тозилат формулы (IV)
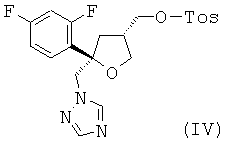 ,
,
путем взаимодействия соединения формулы (IV) с соединением формулы (V)
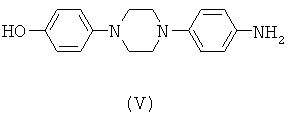
с получением соединения формулы (VI)
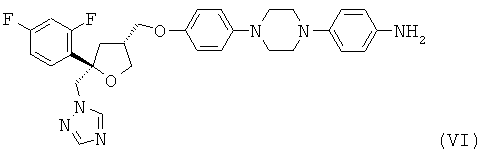 ,
,
и соответствующей реакции соединения формулы (VI) с соединением формулы (VII)
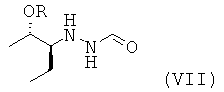
с получением соединения формулы (VIII), где R в соединении формулы (VII) обозначает Н или подходящую защитную группу гидроксигруппы, предпочтительно выбранную из группы, включающей -SiRaaRbbRcc и необязательно замещенные алкильные, арильные или алкиларильные остатки, где Raa, Rbb и Rcc являются одинаковыми или разными и выбраны из группы, включающей необязательно подходящим образом замещенные алкильные и арильные остатки, R предпочтительно обозначает Н.
На превращение HCl соли соединения формулы (I) в соответствующий тозилат формулы (IV)
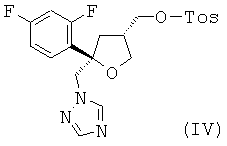 ,
,
не налагают специальных ограничений. В предпочтительном варианте осуществления настоящего изобретения по меньшей мере частично кристаллическую, предпочтительно кристаллическую соль соединения формулы (I) получают суспендированной в подходящей жидкости, наиболее предпочтительно в дихлорметане (DCM). К этой суспензии добавляют предпочтительно по меньшей мере одно подходящее органическое азотистое основание, такое как триэтиламин (TEA) и/или 4-диметиламинопиридин (DMAP). К полученной смеси добавляют подходящее содержащее п-толуолсульфонил соединение, такое как п-толуолсульфонилхлорид (TsCl), при предпочтительной температуре, равной от 10 до 40°С, и реакцию предпочтительно проводят в течение от 1 до 6 ч. Полученную реакционную смесь, содержащую соединение формулы (IV), предпочтительно соответствующим образом экстрагируют и из полученного органического слоя, необязательно после соответствующего концентрирования, соединение формулы (IV) получают в виде твердого вещества, которое необязательно можно соответствующим образом высушить и затем, предпочтительно без какой-либо дополнительной обработки промежуточного продукта, использовать в качестве исходного вещества для реакции с соединением формулы (V), описанным выше.
По сравнению с предшествующим уровнем техники значительно упрощенный способ очистки, предлагаемый в настоящем изобретении, путем получения предлагаемой в настоящем изобретении HCl соли соединения формулы (I), обладающей увеличенным отношением цис:транс, позволяет прямо использовать тозилат формулы (IV) для получения соединения формулы (VI) без проведения усложненной очистки тозилата с помощью колоночной хроматографии. Таким образом, путем соответствующего получения новой HCl соли соединения формулы (I), предлагаемого в настоящем изобретении, общий способ получения фунгицидного средства, предпочтительно позаконазола, упрощается, в особенности при получении больших количеств.
Следовательно, настоящее изобретение также относится к применению способа получения гидрохлоридной соли (HCl) соединения формулы (I), определенного выше, для очистки смеси диастереоизомеров цнс-изомера формулы (II) и транс-изомер формулы (III)
 ,
, 
для увеличения содержания цис-изомера, предпочтительно для очистки указанной смеси диастереоизомеров, содержащей от 80 до 95%, предпочтительно от 85 до 95% цис-изомера формулы (II) и от 20 до 5%, предпочтительно от 15 до 5% транс-изомера формулы (III) с получением очищенной смеси, содержащей по меньшей мере 97%, предпочтительно по меньшей мере 98% и более предпочтительно по меньшей мере 99% HCl соли цис-изомера формулы (II) и не более 3%, предпочтительно не более 2% и более предпочтительно не более 1% HCl соли транс-изомера формулы (III).
Настоящее изобретение дополнительно иллюстрируется приведенными ниже примерами.
Примеры
Пример 1: Получение соединения формулы (I)
(а) Получение соединения формулы (Ва)
В 20 мл МТВЕ суспендировали 3,8 г Mg. Температура суспензии равнялась 55°С. Затем добавляли 0,5 г реагента Гриньяра (СН3)3Si-CH2MgCl в МТВЕ из предыдущей партии для сушки системы (если не имелся такой реагент Гриньяра из первой партии, то можно использовать (СН3)3Si-CH2MgCl в диэтиловом эфире (регистрационный № CAS: 13170-43-9), продающийся в виде 1,0 М раствора фирмой Sigma-Aldrich), затем 1,0 мл хлорметилтриметилсилана (СМ-TMS; регистрационный №CAS: 2344-80-1; продающийся фирмой Sigma-Aldrich). В течение 2 ч при температуре, равной 55°С, медленно добавляли раствор 14 мл CM-TMS в 43 мл МТВЕ. Смесь перемешивали в течение 2 ч при температуре, равной 55°С, и затем охлаждали до температуры, равной -10°С. Затем добавляли 10,0 г имеющегося в продаже соединения формулы (1а) (регистрационный № CAS: 51336-94-8; продающийся фирмой Sigma-Aldrich) в 30 мл МТВЕ и температуру поддерживали в диапазоне от 0 до -10°С. Реакцию останавливали с помощью 20% (мас./об.) водного раствора хлорида аммония. Полученный органический слой промывали с помощью 20% (мас./об.) водного раствора хлорида аммония. Затем этот промытый органический слой промывали водой.
К органическому слою добавляли 11,0 мл концентрированной серной кислоты и температуру поддерживали равной от 25 до 30°С. Затем реакционную смесь перемешивали при температуре, равной от 45 до 50°С, в течение 3 ч. Затем реакционную смесь охлаждали до 20°С и добавляли 25 мл воды и органический слой отделяли. Полученный органический слой экстрагировали 9% (мас./об.) водным раствором бикарбоната натрия, затем промывали водой. Растворители из промытого органического слоя удаляли путем отгонки при пониженном давлении и соединение формулы (Ва) получали в виде масла. Выход составлял 9,4 г, что соответствовало 95% от теоретического значения.
(b) Получение соединения формулы (С), в которой Y1=Y2=F и R1=R2=СН2СН3
10,0 г Соединения формулы (Ва) (в виде масла, полученного на стадии (а)) при перемешивании растворяли в 20 мл DMSO. Затем добавляли 3,2 г чешуек NaOH и 24,0 мл диэтилмалоната. Полученную суспензию перемешивали в течение 5 ч при температуре, равной от 25 до 30°С. Затем, добавляли 100 мл воды и полученную смесь перемешивали в течение 30 мин. Полученный таким образом раствор экстрагировали с помощью 80 мл циклогексана при температуре, равной от 25 до 30°С. После разделения слоев водный слой экстрагировали с помощью 40 мл циклогексана при температуре, равной от 25 до 30°С. Объединенные органические слои промывали 5% (мас./об.) водным раствором NaOH, затем промывали водой. После промывки растворители из органического слоя удаляли путем отгонки при пониженном давлении и получали соединение формулы (Ва) в виде масла. Выход составлял 15,0 г, что соответствовало 90,0% от теоретического значения.
(c) Получение соединения формулы (D), в которой Y1=Y2=F
10,0 г Соединения формулы (С) (в виде масла, полученного на стадии (b)) растворяли в 120 мл изопропилового спирта и 13,0 мл воды при перемешивании при температуре, равной от 25 до 30°С. Полученную смесь охлаждали до температуры, равной от 0 до -5°С. Затем добавляли 2,3 г хлорида лития и 2,1 г борогидрида натрия при температуре, равной от 0 до -5°С. Полученную суспензию перемешивали при температуре, равной от 25 до 30°С в течение 20 ч. Значение рН перемешанной смеси устанавливали равным 1 (измеряли калиброванным рН-метром) путем добавления 4 н. водного раствора HCl. Затем добавляли 20% (мас./об.) водный раствор NaOH для установления значения рН равным 10 (измеряли калиброванным рН-метром). Полученную смесь перемешивали в течение 1 ч. Затем нижний водный слой сливали. Из отделенного органического слоя отгоняли изопропиловый спирт и получали масло. К этому маслу добавляли 100 мл толуола и 100 мл воды и продукт экстрагировали толуольным слоем. Растворители из полученного толуольного слоя удаляли путем отгонки при пониженном давлении получали и соединение формулы (D), в которой Y1=Y2=F, в виде масла. Выход составлял 6,0 г, что соответствовало 82,0% от теоретического значения.
(d) Получение соединения формулы (Е), в которой Y1=Y2=F
10,0 г Соединения формулы (D) (в виде масла, полученного на стадии (с)) растворяли в 80 мл толуола и охлаждали до -15°С. Затем добавляли 7,4 г бикарбоната натрия, 0,5 г фермента (Novo SP 435; Candida antarctica, Novozym 435, выпускающийся фирмой Novo Nordisk) и 7,9 мл ангидрида изомасляной кислоты. Полученную смесь перемешивали при -15°С в течение 24 ч. Затем твердые вещества отфильтровывали и фильтрат промывали 5% (мас./об.) водным раствором бикарбоната натрия, затем промывали водой. Растворители из полученного органического слоя удаляли путем отгонки при пониженном давлении и получали искомый продукт в виде масла. Это масло растворяли в 40 мл н-гептана при температуре, равной от 50 до 60°С. Прозрачный раствор постепенно охлаждали до температуры, равной 10°С. Соединение формулы (Va) кристаллизовали в виде бесцветных кристаллов. Полученное твердое вещество отфильтровывали и влажный осадок на фильтре промывали с помощью 20 мл н-гептана. Затем осадок на фильтре сушили при 40°С в вакууме и получали соединение формулы (Е), в которой Y1=Y2=F, в виде бесцветных кристаллов. Выход составлял 9,2 г, что соответствовало 70,0% от теоретического значения.
(e) Получение соединения формулы (F), в которой Y1=Y2=F и Hal=I
10,0 г Кристаллов, полученных на стадии (d), при перемешивании растворяли в 80 мл этилацетата. Полученный раствор охлаждали до -15°С и добавляли 21,5 г йода и 7,0 г бикарбоната натрия. Полученную суспензию перемешивали при -15°С в течение 5 ч. Реакцию останавливали с помощью 200 мл 10% (мас./об.) водного раствора сульфита натрия. Органический слой промывали с помощью 100 мл 10% (мас./об.) водного раствора сульфита натрия, затем промывали водой. Растворители из полученного таким образом промытого органического слоя удаляли путем отгонки при пониженном давлении и получали искомое соединение в виде масла. Выход составлял 13,5 г, что соответствовало 95,0% от теоретического значения.
(f) Получение соединения формулы (I), в которой Y1=Y2=F
10,0 г Соединения формулы (F) (в виде масла, полученного на стадии (е)) при перемешивании растворяли в 80 мл DMSO. Затем добавляли 10 г натриевой соли 1,2,4-триазола при температуре, равной от 25 до 30°С, и полученную реакционную смесь перемешивали в течение 24 ч при температуре, равной от 85 до 90°С. Затем смесь охлаждали до температуры, равной от 25 до 30°С, и добавляли 25 мл 5% (мас./об.) водного раствора гидроксида натрия. Затем смесь перемешивали в течение 3 ч при температуре, равной от 25 до 30°С. Добавляли 100 мл воды и продукт экстрагировали с помощью 150 мл метилтетрагидрофурана. Полученный таким образом органический слой промывали 10% (мас./об.) водным раствором хлорида натрия и затем растворители из полученного органического слоя удаляли путем отгонки при пониженном давлении и получали соединение формулы (I), в которой Y1=Y2=F, в виде неочищенного масла. Выход составлял 6,0 г, что соответствовало 86,0% от теоретического значения.
10,0 г Неочищенного масла при перемешивании при температуре, равной от 50 до 60°С, растворяли в 100 мл метилтетрагидрофурана. Затем в течение 30 мин добавляли 300 мл н-гептана при температуре, равной от 50 до 60°С. Мутный раствор охлаждали до температуры, равной от 25 до 30°С, и перемешивали в течение еще 30 мин. Полученную суспензию охлаждали до температуры, равной от 0 до -5°С, и перемешивали в течение 2 ч. Продукт отфильтровывали и влажный осадок на фильтре промывали с помощью 20 мл н-гептана. Промытый продукт сушили при 40°С в вакууме и получали кристаллическое соединение формулы (I), в которой Y1=Y2=F, в виде бесцветного твердого вещества. Выход составлял 7,0 г, что соответствовало 70,0% от теоретического значения.
Соединение формулы (I), в которой Y1=Y2=F, получали в виде смеси цис-изомера с соответствующим транс-изомером при отношении цис:транс, составляющем 9:1.
Пример 2: Получение HCl соли соединения (I), в которой Y1 и Y2=F, без экстракционной обработки твердого вещества с использованием HCl в THF в качестве второго растворителя
5 г Кристаллического соединения формулы (I), в которой Y1 и Y2=F, полученного в примере 1 (16,9 ммоля, цис:транс=9:1), растворяли в 75 мл MIBK и нагревали при 60°С. Затем одной порцией добавляли 7,2 мл HCl в THF (23,8 ммоля HCl; концентрация=3,3 моль/л). Затем смесь перемешивали в течение 60 мин при 60°С. Примерно через 5-10 мин смесь становилась мутной и происходила кристаллизация. Полученную таким образом суспензию охлаждали до температуры окружающей среды в течение 90 мин. Перемешивание продолжали в течение еще 60 мин при комнатной температуре. Полученное твердое вещество выделяли фильтрованием, дважды промывали с помощью MIBK (2×10 мл) и сушили в вакууме при 45°С.
Соль с HCl соединения формулы (I), в которой Y1 и Y2=F, получали в виде бесцветного твердого вещества с выходом, равным 78%, что соответствовало 3,95 г. Соль с HCl соединения формулы (I), в которой Y1 и Y2=F, содержала соль с HCl цис-изомера формулы (II), в которой Y1 и Y2=F, и соль с HCl трансизомера формулы (III), в которой Y1 и Y2=F, при отношении цис:транс, составляющем 98,6: 1,4, определенном с помощью ВЭЖХ.
Пример 3: Получение HCl соли соединения (I), в которой Y1 и Y2=F, без экстракционной обработки твердого вещества с использованием HCl в THF в качестве второго растворителя
20 г Кристаллического соединения формулы (I), в которой Y1 и Y2=F, полученного в примере 1 (66,7 ммоля, цис:транс=9:1), растворяли в 250 мл MIBK и нагревали при 60°С. Затем по каплям добавляли 34 мл HCl в THF (95,2 ммоля HCl; концентрация=2,8 моль/л). Затем смесь перемешивали в течение 60 мин при 60°С. Примерно через 10 мин смесь становилась мутной и происходила кристаллизация. Полученную таким образом суспензию охлаждали до температуры окружающей среды в течение 90 мин. Перемешивание продолжали в течение еще 60 мин при комнатной температуре. Полученное твердое вещество выделяли фильтрованием, промывали с помощью MIBK (10 мл) и сушили в вакууме при 45°С.
Соль с HCl соединения формулы (I), в которой Y1 и Y2=F, получали в виде бесцветного твердого вещества с выходом, равным 60%, что соответствовало 12,15 г. Соль с HCl соединения формулы (I), в которой Y1 и Y2=F, содержала соль с HCl цис-изомера формулы (II), в которой Y1 и Y2=F, и соль с HCl трансизомера формулы (III), в которой Y1 и Y2=F, при отношении цис:транс, составляющем 99,3: 0,7, определенном с помощью ВЭЖХ.
Пример 4: Получение HCl соли соединения (I), в которой Y1 и Y2=F, без экстракционной обработки твердого вещества с использованием HCl в н-бутаноле в качестве второго растворителя
0,5 г Кристаллического соединения формулы (I), в которой Y1 и Y2=F, полученного в примере 1 (1,6 ммоля, цис:транс=9:1), растворяли в 5 мл н-бутанола и нагревали при 60°С. Затем по каплям добавляли 386 мкл HCl в н-бутаноле (2,2 ммоля HCl; концентрация=5,7 моль/л). Затем смесь перемешивали в течение 60 мин при 60°С. Полученную таким образом суспензию охлаждали до температуры окружающей среды. Перемешивание продолжали в течение еще 60 мин при комнатной температуре. Полученное белое твердое вещество выделяли фильтрованием, промывали небольшим количеством диэтилового эфира и сушили в вакууме при 45°С.
Соль с HCl соединения формулы (I), в которой Y1 и Y2=F, получали в виде бесцветного твердого вещества с выходом, равным 47%, что соответствовало 241 мг. Соль с HCl соединения формулы (I), в которой Y1 и Y2=F, содержала соль с HCl цис-изомера формулы (II), в которой Y1 и Y2=F, и соль с HCl трансизомера формулы (III), в которой Y1 и Y2=F, при отношении цис:транс, составляющем 98,6: 1,4, определенном с помощью ВЭЖХ.
1Н-ЯМР (300 М Гц, CDCl3) δ част./млн 2,12-2,51 (m, 3H) 3,36-3,72 (m, 2H) 3,93-4,20 (m,2H) 4,74 (d, J=14,05 Гц, 1Н) 5,05 (d, J=13,81 Гц, 1Н) 6,56-6,94 (m,2H) 6,98-7,24 (m, 1H) 8,35-844 (m, 1H) 8,44-8,60 (m, 2H) 10,15 (s, 1H)
13С-ЯМР (75 МГц, CDCl3) δ част./млн 38,1, 41,2, 58,0, 62,3, 70,6, 82,6, 104,6, 111,3, 125,2, 128,0, 141,9, 142,5, 161,2.
Пример 5: Получение HCl соли соединения (Т), в которой Y1 и Y2=F, с использованием ацетона и HCl в МТВЕ
10,0 г Соединения формулы (I) в виде неочищенного масла, полученного в примере 1 (f), до кристаллизации при перемешивании при температуре, равной от 30 до 40°С, растворяли в 200 мл ацетона. Полученный раствор охлаждали до температуры, равной от 25 до 30°С. Затем в течение 15 мин при температуре, равной от 25 до 30°С, добавляли HCl в МТВЕ (10 мас.%). При перемешивании смеси в течение 15 мин кристаллизовалось твердое вещество. Затем медленно в течение 30 мин добавляли 200 мл МТВЕ. Суспензию охлаждали до температуры, равной от 0 до -5°С, и перемешивали в течение 2 ч. Продукт отфильтровывали и влажный осадок на фильтре промывали с помощью 20 мл МТВЕ. После сушки в вакууме при температуре, равной 70°С, соль с HCl соединения (I), в которой Y1=Y2=F, получали в виде бесцветного твердого вещества. Выход составлял 9,5 г, что соответствовало 85,0% от теоретического значения.
Соль с HCl соединения формулы (I), в которой Y1=Y2=F, получали в виде смеси цис-изомера с соответствующим транс-изомером при отношении цис:транс, составляющем 9:1.
Пример 6: Получение HCl соли соединения (I), в которой Y1 и Y2=F, c проведением экстракционной обработки твердого вещества с использованием MIBK и н-бутанола в качестве смеси растворителя
20,0 г Кристаллической HCl соли соединения формулы (I), в которой Y1 и Y2=F, содержащей соль с HCl цис-изомера формулы (II), в которой Y1 и Y2=F, и соль с HCl транс-изомера формулы (III), в которой Y1 и Y2=F, при отношении цис:транс, составляющем 9:1 (60 ммоля), полученной, как описано выше в примере 5, суспендировали в смеси н-бутанола (50 мл) и MIBK (50 мл). Смесь нагревали при 60°С и эту температуру поддерживали в течение 2 ч. Затем смесь охлаждали до комнатной температуры. Полученное твердое вещество отфильтровывали и промывали небольшим количеством диэтилового эфира.
Это твердое вещество (14,55 г, 43,9 ммоля) повторно суспендировали в смеси н-бутанола (36,4 мл) и MIBK (36,4 мл). Смесь нагревали при 60°С и эту температуру поддерживали в течение 2 ч. Затем, смесь охлаждали до комнатной температуры. Полученное твердое вещество отфильтровывали и промывали небольшим количеством диэтилового эфира.
После сушки в вакууме при 45°С соль с HCl соединения формулы (I), в которой Y1 и Y2=F, получали в виде бесцветного кристаллического твердого вещества с суммарным выходом за 2 стадии, равным 66%, что соответствовало 10,75 г. Под микроскопом кристаллы обнаруживали двулучепреломление. Соль с HCl соединения формулы (I), в которой Y1 и Y2=F, содержала соль с HCl цис-изомера формулы (II), в которой Y1 и Y2=F, и соль с HCl транс-изомера формулы (III), в которой Y1 и Y2=F, при отношении цис:транс, составляющем 99,2: 0,8, определенном с помощью ВЭЖХ.
Методика ВЭЖХ для определения чистоты и отношения цис/транс для соединения формулы (I), в которой Y1=Y2=F:
Порошковая рентгенограмма (XRD) этого соединения формулы (I), в которой Y1=Y2=F, приведена на фиг.1.
Методика регистрации рентгенограмм
Образцы анализировали в держателе с нулевым фоном в режиме вращения при условиях окружающей среды. Типичная точность определения значений 2-тета находится в диапазоне примерно ±0,2 °2-тета. Таким образом, при использовании большинства дифрактометров при стандартных условиях дифракционный пик, который появляется при 8,6 °2-тета может появиться в диапазоне от 8,4 до 8,8 °2-тета.
Параметры прибора:
Условия получения XRD:
Оптика падающего пучка
Оптика дифрагирующего пучка
Перечень цитированных документов
1. US 5403937.
2. ЕР 0736030 А1.
3. WO 95/17407 A1.
4. WO 94/25452 А1.
5. WO 97/22710.
6. Tetrahedron Letters 32 (1991), pp.7545-7548.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУЧЕНИЕ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ ДЛЯ СИНТЕЗА ПОЗАКОНАЗОЛА | 2011 |
|
RU2580318C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХИРАЛЬНЫХ ТРИАЗОЛОНОВ | 2011 |
|
RU2585760C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИС-НУКЛЕОЗИДНЫХ АНАЛОГОВ, ИХ СОЛЕЙ И СЛОЖНЫХ ЭФИРОВ | 1994 |
|
RU2139870C1 |
| ПРОЛЕКАРСТВА НА ОСНОВЕ ГИДРОГЕЛЯ | 2013 |
|
RU2647729C2 |
| СПОСОБ ХИРАЛЬНОГО РАЗДЕЛЕНИЯ 2,4-ДИЗАМЕЩЕННЫХ 1,3-ОКСАТИОЛАНОВ | 2008 |
|
RU2494098C2 |
| ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ПОЛУЧЕНИЯ ТРАНС-5-ХЛОР-2-МЕТИЛ-2,3,3f,12b-ТЕТРАГИДРО-1Н-ДИБЕНЗ[2,3:6,7]-ОКСЕПИНО[4,5-c]ПИРРОЛА | 2006 |
|
RU2397164C2 |
| аЭКЗО-АЗАСПИРО-ИНГИБИТОРЫ ВЗАИМОДЕЙСТВИЯ МЕНИН-MLL | 2018 |
|
RU2795096C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ С ИХ ИСПОЛЬЗОВАНИЕМ | 2001 |
|
RU2265598C2 |
| СПОСОБЫ ИНГИБИРОВАНИЯ АНГИОГЕНЕЗА И РОСТА ОПУХОЛЕЙ | 2001 |
|
RU2269339C2 |
| VEGF-НЕЙТРАЛИЗУЮЩИЕ ПРОЛЕКАРСТВА ДЛЯ ЛЕЧЕНИЯ ОФТАЛЬМОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2673881C2 |
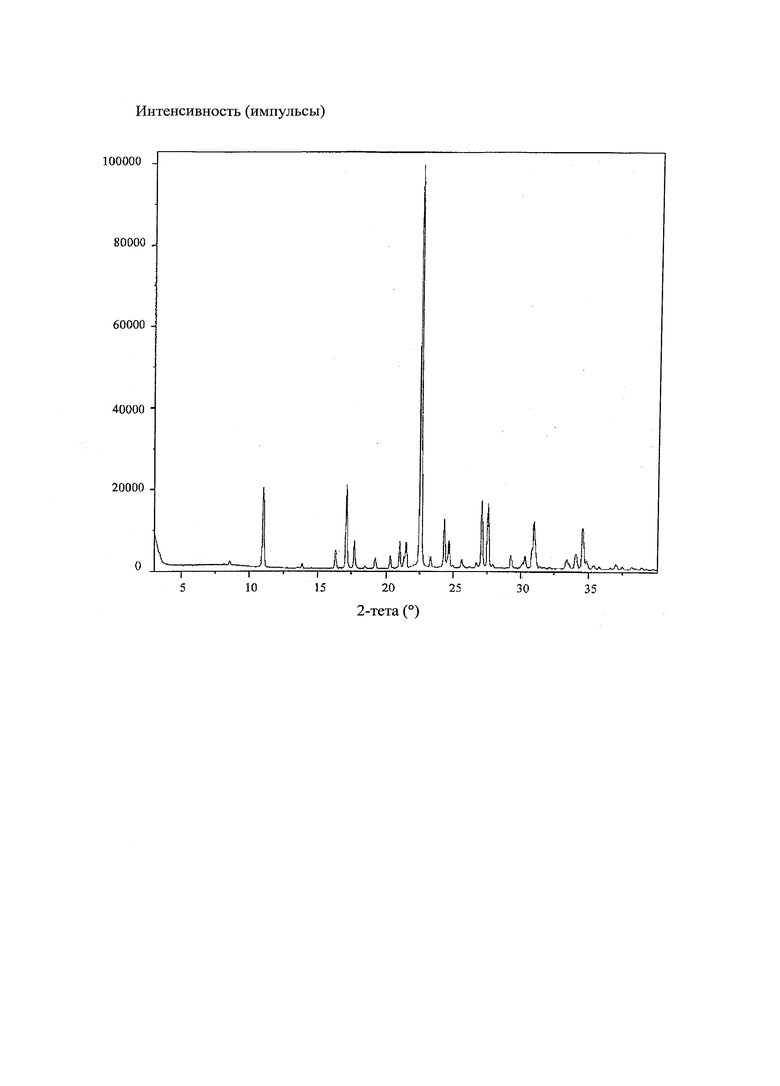
Настоящее изобретение относится к способу получения гидрохлоридной соли (HCl) соединения формулы (I), где Y1 и Y2 независимо обозначают F или Cl, предпочтительно F, где указанное соединение формулы (I) содержит цис-изомер и транс-изомер, который включает (1) использование соединения формулы (I), содержащегося в первом подходящем растворителе; и (2) обработку соединения формулы (I), содержащегося в первом подходящем растворителе, с помощью HCl, содержащегося во втором подходящем растворителе, с получением HCl соли соединения формулы (I). Изобретение также относится к кристаллической гидрохлоридной соли (НСI), содержащей цис-изомер (II) и транс- изомер (III), к применению указанной соли для получения фунгицида и к применению способа для очистки смеси диастереоизомеров цис-изомера (II) и транс-изомера(III). 5 н. и 27 з.п. ф-лы, 1 ил., 6 пр.

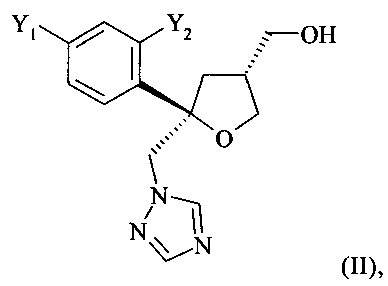
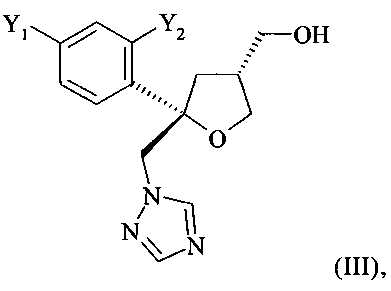
1. Способ получения гидрохлоридной соли (HCl) соединения формулы (I)
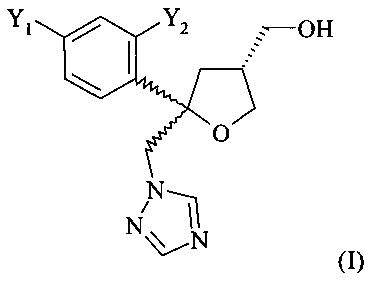
где Y1 и Y2 независимо обозначают F или Cl, предпочтительно F, указанное соединение формулы (I) содержит цис-изомер формулы (II) и транс-изомер формулы (III)


который включает:
(1) использование соединения формулы (I), содержащегося в первом подходящем растворителе;
(2) обработку соединения формулы (I), содержащегося в первом подходящем растворителе, HCl, содержащегося во втором подходящем растворителе, с получением HCl соли соединения формулы (I);
в котором первый растворитель представляет собой спирт и/или предшественник спирта, простой эфир, кетон, сложный эфир или смесь двух или более из них,
и в котором второй растворитель выбран из группы, состоящей из диоксана, тетрагидрофурана, диэтилового эфира, диизопропилового эфира, метил-трет-бутилового эфира, этилацетата, метанола, н-пропанола, 1-бутанола, 2-бутанола, 2-метил-1-бутанола, 3-метил-1-бутанола и толуола.
2. Способ по п. 1, в котором соединение формулы (I), полученное на стадии (1), содержит от 80 до 95%, предпочтительно от 85 до 95% цис-изомера формулы (II) и от 20 до 5%, предпочтительно от 15 до 5% транс-изомера формулы (III).
3. Способ по п. 1 или 2, в котором на стадии (1) соединение формулы (I) получают способом, включающим:
(i.1) реакцию соединения формулы (А)
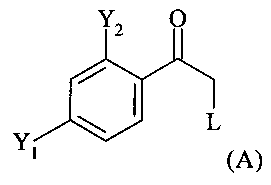
где L обозначает отщепляющуюся группу, предпочтительно галоген, более предпочтительно Cl, в растворителе с нуклеофильным соединением,
содержащим нуклеофильный остаток RaRbRcSi-CH2, где Ra, Rb и Rc являются одинаковыми или разными и выбраны из группы, включающей необязательно подходящим образом замещенные алкильные и арильные остатки, с получением реакционной смеси, содержащей в качестве промежуточного продукта бета-гидроксисилан формулы
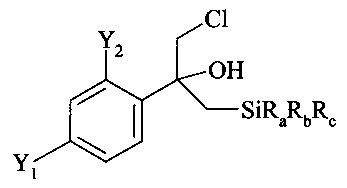
указанную реакцию предпочтительно проводят при температуре в диапазоне от -50 до +20°С, более предпочтительно от -30 до +10°С, еще более предпочтительно от -15 до +5°С;
(i.2) обработку полученной реакционной смеси, предпочтительно без замены растворителя, реагентом, промотирующим реакцию элиминирования, с получением реакционной смеси, содержащей соединение формулы (В)
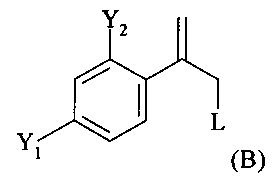
где обработку проводят при температуре в диапазоне от -20 до +70°С и где указанным реагентом предпочтительно является кислота, более предпочтительно неорганическая кислота, еще более предпочтительно серная кислота, где если используют серную кислоту, то температура, при которой проводят указанную обработку, предпочтительно находится в диапазоне от 40 до 50°С;
(ii) реакцию соединения формулы (В) со сложным эфиром малоновой кислоты R1OOC-CH2-COOR2 с получением соединения формулы (С)
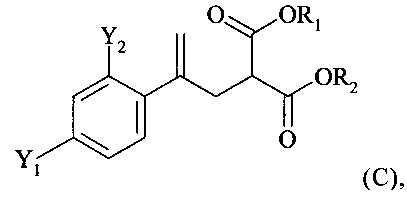
в которой R1 и R2 независимо обозначают необязательно подходящим образом замещенную алкильную группу, содержащую от 1 до 5 атомов углерода, предпочтительно этил, в котором после стадии (ii) и до стадии (iii) соединение формулы (С) необязательно выделяют путем экстракции в подходящем растворителе, предпочтительно циклогексане;
(iii) восстановление соединения формулы (С) с получением соединения формулы (D)
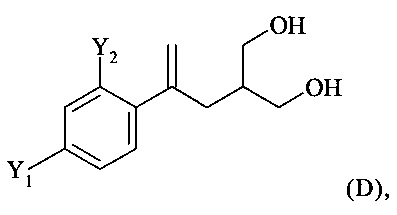
где восстановительным реагентом предпочтительно является LiBH4, который используют в количестве, составляющем не более 2 мол. экв. в пересчете на соединение формулы (С), указанное восстановление предпочтительно проводят в подходящем растворителе, предпочтительно содержащем воду, наиболее предпочтительно, если растворителем является смесь воды и изопропанола, где растворитель предпочтительно содержит от 1 до 20 об. %, более предпочтительно от 5 до 15 об. % воды;
(iv) ацилирование соединения формулы (D) изомасляным ангидридом с получением соединения формулы (Е)
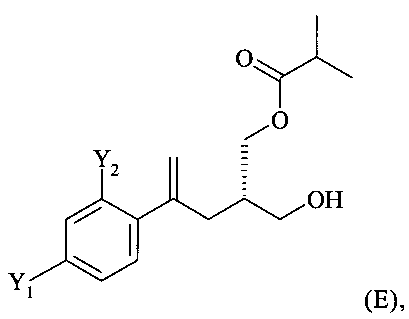
указанное ацилирование предпочтительно проводят в присутствии подходящего фермента, предпочтительно фермента Novo SP 435, в подходящем растворителе, предпочтительно в ацетонитриле или толуоле, более предпочтительно в толуоле, в котором после стадии (iv) и до стадии (v) соединение формулы (Е) предпочтительно по меньшей мере частично кристаллизуют;
(v) реакцию соединения формулы (Е) с галогеном Hal2, выбранным из группы, включающей Cl2, Br2 и I2, предпочтительно I2, в присутствии основания в растворителе с получением соединения формулы (F)
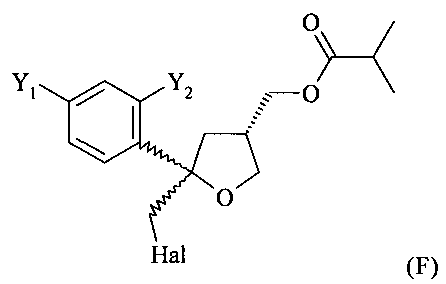
где предпочтительно от 80 до 95%, более предпочтительно от 85 до 95% молекул соединения (F) содержатся в виде цис-изомера формулы (Fa)
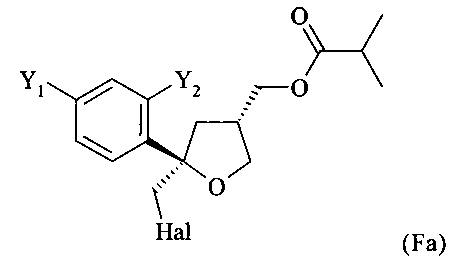
и предпочтительно от 20 до 5%, более предпочтительно от 15 до 5% молекул соединения (F) содержатся в виде транс-изомера формулы (Fb)
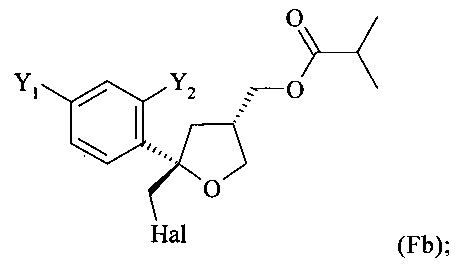
где растворителем предпочтительно является этилацетат, и где основанием предпочтительно является гидрокарбонат натрия, и где температура, при которой соединение формулы (Е) вводят в реакцию, предпочтительно ниже 0°С, более предпочтительно не выше -5°С и еще более предпочтительно не выше -10°С;
(vi.l) нагревание соединения формулы (F), предпочтительно при температуре в диапазоне от +70 до +100°С, более предпочтительно от +80 до +95°С, еще более предпочтительно от +85 до +90°С, предпочтительно при отсутствии DMPU (1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон), в растворителе, предпочтительно DMSO, с солью щелочного металла 1,2,4-триазола, предпочтительно натриевой солью, и обработку полученной реакционной смеси основанием, подходящим для промотирования омыления сложноэфирного фрагмента, предпочтительно основанием щелочных металлов, указанное основание предпочтительно добавляют в водных и/или спиртовых средах, еще более предпочтительно указанным основанием является гидроксид натрия, предпочтительно использующийся в виде водного раствора в присутствии метанола, с получением соединения формулы (I)
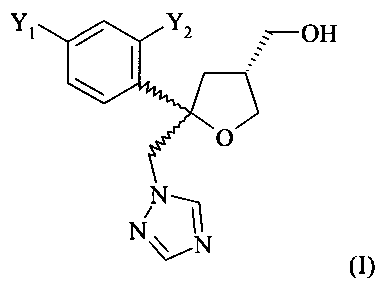
где предпочтительно от 80 до 95%, более предпочтительно от 85 до 95% молекул содержатся в виде цис-изомера формулы (II)
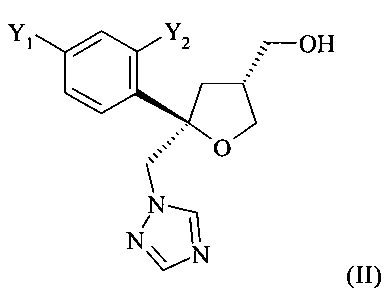
и предпочтительно от 20 до 5%, более предпочтительно от 15 до 5% молекул содержатся в виде транс-изомера формулы (III)
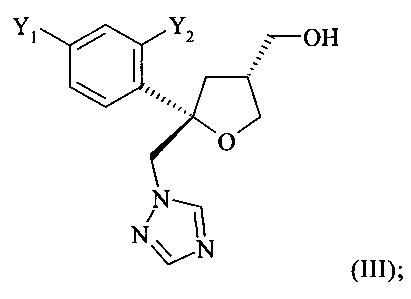
(vi.2) выделение соединения формулы (I) из реакционной смеси, полученной на стадии (vi.1), путем экстракции в подходящем растворителе, где растворителем предпочтительно являлся полярный не смешивающийся с водой растворитель, более предпочтительно метилтетрагидрофуран.
4. Способ по п. 3, в котором способ, согласно которому соединение формулы (I) получают на стадии (1), дополнительно включает:
(vii) по меньшей мере частичную кристаллизацию соединения формулы (I) после стадии (vi.2).
5. Способ по п. 1, в котором первым подходящим растворителем, в котором содержится соединение формулы (I), является органический растворитель, предпочтительно спирт и/или предшественник спирта, простой эфир, кетон, сложный эфир или смесь двух или более из них.
6. Способ по п. 1 или 2, в котором первый подходящий растворитель, в котором содержится соединение формулы (I), выбран из группы, включающей этилацетат, изопропилацетат, диэтиловый эфир, тетрагидрофуран (THF), метилтетрагидрофуран, диоксан, метанол, н-пропанол, 1-бутанол, 2-бутанол, 2-метил-1-бутанол, 3-метил-1-бутанол, ацетон, 2-бутанон и метилизобутилкетон (MIBK), и в котором второй растворитель выбран из группы, включающей диоксан, тетрагидрофуран (THF), диэтиловый эфир, диизопропиловый эфир, метил-трет-бутиловый эфир (МТВЕ), этилацетат, метанол, н-пропанол, 1-бутанол, 2-бутанол, 2-метил-1-бутанол, 3-метил-1-бутанол и толуол.
7. Способ по п. 5, в котором первый и/или второй растворитель включает спирт и/или предшественник спирта.
8. Способ по п. 7, в котором первым растворителем является MIBK и вторым растворителем является THF или в котором первым и вторым растворителем является н-бутанол.
9. Способ по п. 7, в котором обработку на стадии (2) проводят при температуре в диапазоне от 20 до 100°С, предпочтительно от 40 до 80°С, более предпочтительно от 55 до 65°С.
10. Способ по п. 7, в котором на стадии (2) HCl, содержащаяся во втором растворителе, используют вместе с соединением формулы (I) в молярном отношении HCl:(I) в диапазоне от 1,0:1 до 2,0:1, предпочтительно от 1,1:1 до 1,8:1, более предпочтительно от 1,2:1 до 1,7:1, еще более предпочтительно от 1,3:1 до 1,5:1.
11. Способ по п. 7, дополнительно включающий после стадии (2) по меньшей мере частичную кристаллизацию HCl соли соединения формулы (I).
12. Способ по п. 11, в котором по меньшей мере частично закристаллизованная соль с HCl соединения формулы (I) содержит по меньшей мере 97%, предпочтительно по меньшей мере 98% и более предпочтительно по меньшей мере 99% HCl соли цис-изомера формулы (II) и не более 3%, предпочтительно не более 2% и более предпочтительно не более 1% HCl соли транс-изомера формулы (III).
13. Способ по п. 11 или 12, дополнительно включающий:
(2а) выделение по меньшей мере частично закристаллизованной HCl соли соединения формулы (I), предпочтительно фильтрованием, необязательно с последующей промывкой подходящим растворителем, предпочтительно MIBK.
14. Способ по п. 1, в котором обработку на стадии (2) проводят при температуре в диапазоне от 0 до 100°С и в котором на стадии (2) HCl, содержащуюся во втором растворителе, используют вместе с соединением формулы (I) в молярном отношении HCl:(I) в диапазоне от 1,0:1 до 3,0:1, предпочтительно от 1,5:1 до 2,5:1, более предпочтительно от 2,0:1 до 2,2:1.
15. Способ по п. 14, дополнительно включающий после стадии (2) по меньшей мере частичную кристаллизацию HCl соли соединения формулы (I).
16. Способ по п. 15, в котором по меньшей мере частично закристаллизованная соль с HCl содержит от 80 до 95%, предпочтительно от 85 до 95% HCl соли цис-изомера формулы (II) и от 20 до 5%, предпочтительно от 15 до 5% HCl соли транс-изомера формулы (III).
17. Способ по п. 15, дополнительно включающий:
(2b) выделение по меньшей мере частично закристаллизованной HCl соли соединения формулы (I), предпочтительно фильтрованием, необязательно с последующей промывкой подходящим растворителем, предпочтительно метил-трет-бутиловым эфиром (МТВЕ), ацетоном или метилизобутилкетоном (MIBK), более предпочтительно МТВЕ.
18. Способ по п. 13, дополнительно включающий:
(3) проведение для по меньшей мере частично закристаллизованной HCl соли соединения формулы (I) экстракционной обработки твердого вещества в подходящем растворителе, предпочтительно содержащем MIBK, с получением HCl соли соединения формулы (I), увеличивая таким образом содержание HCl соли цис-изомера формулы (II).
19. Способ по п. 17, дополнительно включающий:
(3) проведение для по меньшей мере частично закристаллизованной HCl соли соединения формулы (I) экстракционной обработки твердого вещества в подходящем растворителе, предпочтительно содержащем MIBK, с получением HCl соли соединения формулы (I), увеличивая таким образом содержание HCl соли цис-изомера формулы (II).
20. Способ по п. 18 или 19, в котором подходящим растворителем является MIBK или смесь MIBK и спирта, предпочтительно н-бутанола, отношение количества молей MIBK к количеству молей спирта предпочтительно находится в диапазоне от 0,5:1 до 10:1, более предпочтительно от 0,75:1 до 5:1, еще более предпочтительно от 0,95:1 до 1,05:1.
21. Способ по п. 18 или 19, в котором экстракционную обработку твердого вещества проводят при температуре в диапазоне от 20 до 100°С, предпочтительно от 40 до 80°С, более предпочтительно от 55 до 65°С.
22. Способ по п. 18 или 19, в котором на стадии (3) концентрация HCl соли соединения формулы (I) находится в диапазоне от 0,25 до 0,75, предпочтительно от 0,55 до 0,65 моль/л растворителя.
23. Способ по п. 18 или 19, дополнительно включающий после стадии (3) выделение по меньшей мере частично закристаллизованной HCl соли соединения формулы (I).
24. Способ по п. 18 или 19, в котором по меньшей мере частично закристаллизованная соль с HCl соединения формулы (I), полученная на стадии (3), содержит по меньшей мере 97%, предпочтительно по меньшей мере 98% и более предпочтительно по меньшей мере 99% HCl соли цис-изомера формулы (II) и не более 3%, предпочтительно не более 2% и более предпочтительно не более 1% HCl соли транс-изомера формулы (III).
25. Способ по п. 18 или 19, дополнительно включающий:
(3а) выделение по меньшей мере частично закристаллизованной HCl соли соединения формулы (I) из смеси, полученной на стадии (3), предпочтительно фильтрованием, необязательно с последующей промывкой подходящим растворителем, предпочтительно диэтиловым эфиром или метил-трет-бутиловый эфиром (МТВЕ).
26. Способ по п. 18 или 19, дополнительно включающий:
(3а) выделение по меньшей мере частично закристаллизованной HCl соли соединения формулы (I) из смеси, полученной на стадии (3), предпочтительно фильтрованием, необязательно с последующей промывкой подходящим растворителем, предпочтительно диэтиловым эфиром или метил-трет-бутиловый эфиром (МТВЕ);
проведение для HCl соли, полученной на стадии (3а), экстракционной обработки твердого вещества способом по любому из пп. 18-23, предпочтительно с последующим выделением полученной таким образом HCl соли способом по п. 24.
27. Предпочтительно кристаллическая гидрохлоридная соль (HCl) соединения формулы (I)
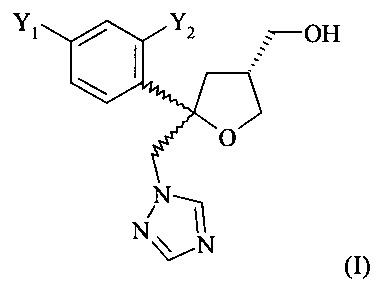
где Y1 и Y2 независимо обозначают F или Cl, предпочтительно F, указанное соединение формулы (I) содержит цис-изомер формулы (II) и транс-изомер формулы (III)
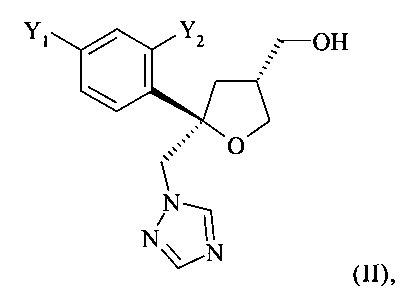
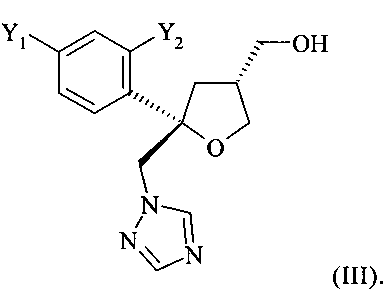
28. Кристаллическая соль с HCl по п. 27, содержащая по меньшей мере 97%, предпочтительно по меньшей мере 98% и более предпочтительно по меньшей мере 99% HCl соли цис-изомера формулы (II) и не более 3%, предпочтительно не более 2% и более предпочтительно не более 1% HCl соли транс-изомера формулы (III).
29. Предпочтительно по меньшей мере частично кристаллическая гидрохлоридная соль (HCl) соединения формулы (I)
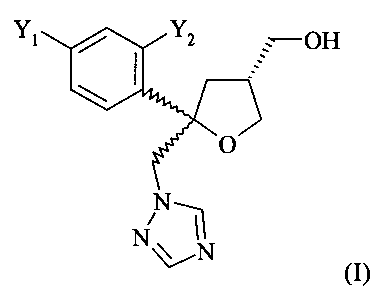
где Y1 и Y2 независимо обозначают F или Cl, предпочтительно F, которую можно получить или получают способом по любому из пп. 1-26.
30. Применение по меньшей мере частично кристаллической, предпочтительно кристаллической HCl соли по любому из пп. 27-29, содержащей по меньшей мере 99% HCl соли цис-изомера формулы (II)
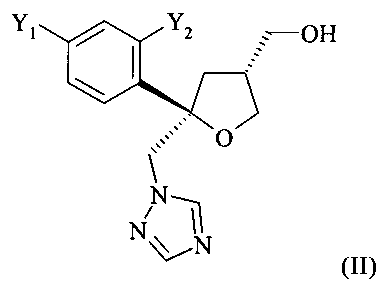
предпочтительно в которой оба Y1 и Y2 обозначают F, для получения фунгицидного соединения формулы (VIII)
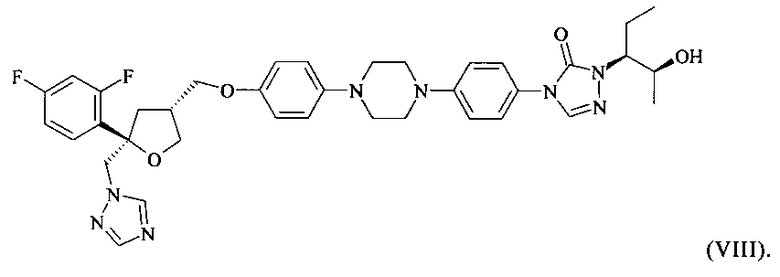
31. Применение по п. 30, включающее превращение HCl соли в соответствующий тозилат формулы (IV)
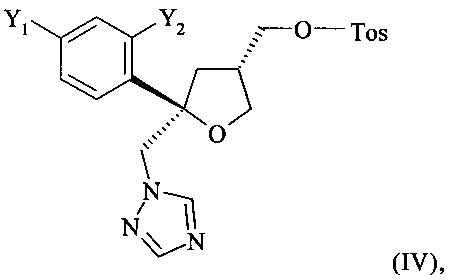
где превращение включает обработку HCl соли приемлемым содержащим п-толуолсульфонил соединением,
путем взаимодействия соединения формулы (IV) с соединением формулы (V)
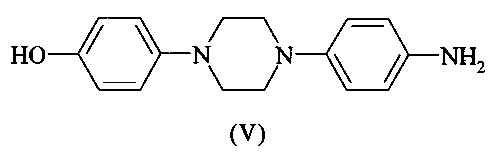
с получением соединения формулы (VI)
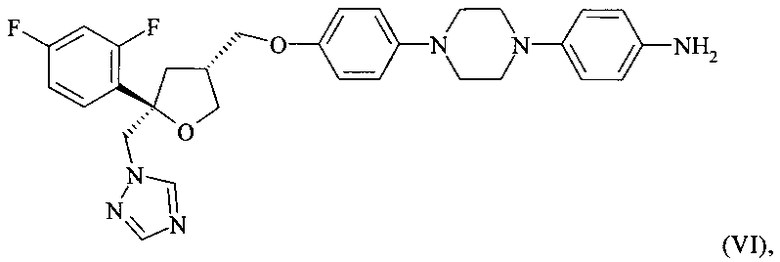
и соответствующей реакции соединения формулы (VI) с соединением формулы (VII)
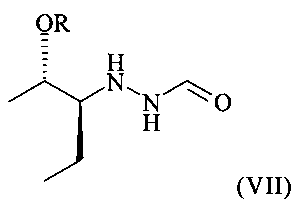
с получением соединения формулы (VIII), где R в соединении формулы (VII) обозначает Н или подходящую защитную группу гидроксигруппы, предпочтительно выбранную из группы, включающей -SiRaaRbbRcc и необязательно замещенные алкильные, арильные или алкиларильные остатки, где Raa, Rbb и Rcc являются одинаковыми или разными и выбраны из группы, включающей необязательно подходящим образом замещенные алкильные и арильные остатки, предпочтительно R обозначает Н.
32. Применение способа по любому из пп. 1-26, предпочтительно по любому из пп. 7-13 или 18-26 для очистки смеси диастереоизомеров цис-изомера формулы (II) и транс-изомера формулы (III)
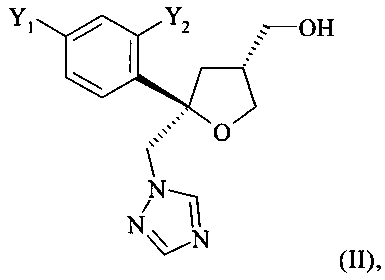
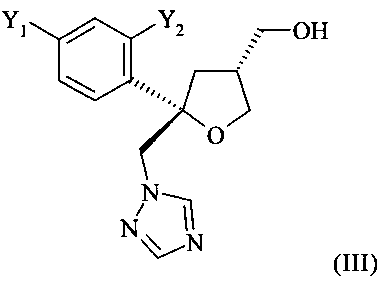
для увеличения содержания цис-изомера, предпочтительно для очистки указанной смеси диастереоизомеров, содержащей от 80 до 95%, предпочтительно от 85 до 95% цис-изомера формулы (II) и от 20 до 5%, предпочтительно от 15 до 5% транс-изомера формулы (III), с получением очищенной смеси, содержащей по меньшей мере 97%, предпочтительно по меньшей мере 98% и более предпочтительно по меньшей мере 99% HCl соли цис-изомера формулы (II) и не более 3%, предпочтительно не более 2% и более предпочтительно не более 1% HCl соли транс-изомера формулы (III).
| WO 9425452 A1, 10.11.1994 | |||
| WO 9700255 A1, 03.01.1997 | |||
| WO 9517407 A1, 29.06.1995 | |||
| Приспособление для проверки переходных вставок в кривых железнодорожного пути | 1925 |
|
SU2980A1 |
| Способ получения производных триазола | 1984 |
|
SU1251802A3 |
Авторы
Даты
2016-06-10—Публикация
2011-05-18—Подача