ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение связано с областью лечения рака предстательной железы и его метастазов. Более конкретно, настоящее изобретение связано с иммуногенными полипептидами, содержащими по меньшей мере часть ассоциированного с клетками опухоли предстательной железы (глико)протеина или его иммунологически активных вариантов, а также с нуклеиновыми кислотами, кодирующими такие полипептиды. Последовательности таких полипептидов и нуклеиновых кислот могут быть использованы в вакцинах и фармацевтических композициях для терапевтического и профилактического лечения рака предстательной железы и его метастазов.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Рак предстательной железы является четвертым по счету из самых распространенных видов рака у мужчин. В Северной Америке и Северной Европе он на сегодняшний день является наиболее распространенной формой рака у мужчин и является второй по счету причиной смерти от видов рака среди мужчин. В одних только Соединенных Штатах более 40000 человек ежегодно умирают от этой болезни, уступая только раку легких. Несмотря на масштабы этих цифр, до сих пор нет эффективного лечения метастазирующего рака предстательной железы. Подавляющее количество клинических данных показывает, что рак предстательной железы человека имеет склонность к метастазированию в кость и обнаруживается неизбежное прогрессирование заболевания от андрогензависимого статуса к невосприимчивому к андрогенам состоянию, что приводит к повышенной смертности пациентов.
Несмотря на значительные исследования в области терапии данного заболевания, рак предстательной железы остается трудно поддающимся лечению. Хирургическая простатэктомия, лучевая терапия, гормональная абляционная терапия, хирургическая кастрация и химиотерапия по-прежнему являются основными способами лечения. К сожалению, эти способы неэффективны в значительном проценте случаев. Возраст и исходное состояние здоровья человека, степень метастазирования, картина, которая видна под микроскопом, и реакция рака на начальную стадию лечения играют важную роль в определении исхода заболевания и потенциальной возможности его лечения. Решение о том, лечить или не лечить локализованный рак предстательной железы (опухоль, которая заключена внутри предстательной железы) с помощью лекарственных средств, связано для пациентов с принятием компромиссных решений между ожидаемыми полезным и вредным последствиями в плане выживаемости пациентов и качества их жизни.
Идентификация новых терапевтических мишеней имеет важное значение для улучшения текущего лечения людей, больных видами рака предстательной железы. Современные достижения в области молекулярной медицины привели к возросшему интересу к опухолеспецифическим антигенам клеточной поверхности, которые могут служить мишенями для различных иммунотерапевтических стратегий или стратегий применения низкомолекулярных соединений.
Среди различных элементов иммунной системы Т-лимфоциты являются, по-видимому, наиболее способными распознавать и устранять клетки, экспрессирующие чужеродные или ассоциированные с опухолью антигены. Цитотоксические Т-лимфоциты (ЦТЛ) экспрессируют маркер CD8 клеточной поверхности и специализированы в отношении индукции лизиса клеток-мишеней, с которыми они реагируют, посредством перфорин/гранзимного и/или Fas/Fas-L-путей. T-клеточный рецептор (TCR) для антигена на клетках ЦТЛ связывается с молекулярным комплексом на поверхности клетки-мишени, образованным низкомолекулярными пептидами (8-11 остатков), полученными из подвергнутых процессингу чужеродных или опухолеассоциированных антигенов, который ассоциирован с молекулами класса I главного комплекса гистосовместимости (MHC).
Другая важнейшая T-клеточная субпопуляция, хелперные T-лимфоциты (T-хелперы, или T-клетки-хелперы), характеризуется экспрессией поверхностного маркера CD4. T-клетки-хелперы распознают несколько более крупные пептиды (11-20 остатков), также полученные из чужеродных или опухолеассоциированных антигенов, но в контексте молекул MHC класса II, которые экспрессируются только специализированными антиген-представляющими клетками (АПК), такими как B-лимфоциты, макрофаги и дендритные клетки (ДК).
Вследствие стимуляции TCR наивных ЦТЛ и T-хелперов комплексами пептид/МНС на клетках АПК, ЦТЛ созревают в эффекторные клетки-киллеры, способные лизировать (опухолевые) клетки, которые экспрессируют соответствующий комплекс пептид/МНС класса I. Активированные T-хелперы усиливают ответы ЦТЛ, делая АПК более эффективными в стимуляции наивных ЦТЛ и в продуцировании лимфокинов, которые стимулируют созревание и пролиферацию ЦТЛ.
Потенцирующий эффект T-клеток-хелперов проявляется как во вторичных лимфоидных органах, в которых инициирован иммунный ответ, так и в опухоли, где ответы ЦТЛ должны быть устойчивыми, пока удаляются опухолевые клетки. Таким образом, можно предсказать, что для выработки эффективного противоопухолевого иммунитета вакцины должны стимулировать как опухолереактивные ЦТЛ, так и Т-хелперы.
Антигены, подходящие для иммунотерапевтических стратегий против рака, должны быть в высокой степени экспрессированы в тканях рака и, в идеале, не должны экспрессироваться в нормальных тканях взрослого человека. При этом, однако, может быть приемлема экспрессия в тканях, которые не являются необходимыми для жизни.
КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения неожиданно обнаружили, что антигены, подходящие для иммунотерапевтических стратегий при лечении рака предстательной железы и его метастазов, обеспечиваются (глико)протеинами блестящей оболочки (zona pellucida). В соответствии с настоящим изобретением, антигены zona pellucida (ZP-антигены), которые способны индуцировать ответ CD8+ и/или CD4+ T-клеток, также как и последовательности нуклеиновых кислот, кодирующие указанные антигены, могут, соответственно, быть использованы в иммунотерапевтической стратегии для терапевтического и/или профилактического лечения рака предстательной железы.
Настоящее изобретение состоит в обнаружении того, что клетки опухоли предстательной железы характеризуются значительной экспрессией ZP-(глико)протеинов, в такой степени, что указанные клетки являются мишенью для эффективного иммунного ответа, вызванного введением антигенов, полученных из ZP-(глико)протеина, что приводит к снижению роста или даже уменьшению размера первичной опухоли предстательной железы, а также метастазов, источником которых она является. Данная стратегия в равной степени подходит для предотвращения образования метастазов опухоли предстательной железы, а также для предотвращения рецидива опухолей предстательной железы у подвергнутых лечению пациентов.
ZP3 обычно обнаруживаются в так называемой “блестящей оболочке” («zona pellucida»), которая образует внеклеточный матрикс, окружающий развивающийся и овулировавший ооцит и предимплантационный эмбрион. Указанная блестящая оболочка вызывает акросомную реакцию спермы, определяет видоспецифичность при оплодотворении и предотвращает полиспермию у млекопитающих. Блестящая оболочка содержит четыре основных гликопротеина, ZP1, ZP2, ZP3 и ZP4.
Экспрессия (глико)протеина ZP в опухолевых клетках, (полученных) из предстательной железы, никогда прежде не была установлена. Таким образом, в предшествующем уровне техники нет никаких указаний на то, что клетки опухоли предстательной железы фактически могут стать мишенью клеточного иммунного ответа, развивающегося в ответ на введение (полученных из) ZP антигенов.
Таким образом, в настоящем изобретении впервые предложены способы лечения опухолей предстательной железы у человека, включающие в себя иммунизацию указанного человека источником полипептида, содержащего Т-клеточный эпитоп нативной блестящей оболочки, ограниченный классом I MHC или классом II MHC, или его иммунологически активные варианты, а также композициями, подходящими для применения в таких способах лечения. Более подробно настоящее изобретение будет описано ниже.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Первый аспект настоящего изобретения относится к способу лечения рака предстательной железы и его метастазов у субъекта путем индукции первичного иммунного ответа на ZP-(глико)протеины, при этом указанный способ включает в себя стадию введения указанному человеку источника полипептида, причем указанный полипептид содержит Т-клеточный эпитоп нативной блестящей оболочки, ограниченный классом I MHC или классом II MHC, который способен вызвать T-клеточно-опосредованный иммунный ответ in vivo, или его иммунологически активный вариант. В особенно предпочтительном воплощении настоящего изобретения указанный здесь способ является способом терапевтического лечения.
Информация, связанная с названными ZP-гликопротеиновыми компонентами, была весьма противоречива на протяжении многих лет в связи с использованием нескольких критериев, включая молекулярную массу, сравнение длины последовательности белка и идентичности последовательности, которое привело к запутанной номенклатуре. Harris с соавт. [(1994) ДНК seq. 96: 829-834] предложили единую систему номенклатуры, при которой ZP-гены были названы в соответствии с длиной кодируемой ими белковой последовательности, от самой длинной до самой короткой. Поскольку в соответствии с такими критериями мышиные гены ZP располагаются в порядке ZP2, затем ZP1, а потом уже ZP3, была введена новая система, в которой ZP2 обозначен как ZPA, ZP1 обозначен как ZPB, а ZP3 обозначен как ZPC. Позднее Hughes с соавт. [(1999) BBA-Gene Structure and Expression 1447: 303-306], помимо прочих, опубликовали сообщение, согласно которому истинный человеческий ортолог известного мышиного гена ZP1 представляет собой не ZPB, а является особым человеческим геном ZP1. В настоящее время, в общем, принято, что существует четыре (человеческих) семейства ZP-гликопротеинов, ZP1, ZP2, ZP3 и ZPB [ср. Lefievre с соавт. (2004) Hum. Reprod. 19: 1580-1586]. Согласно указанной номенклатуре, гликопротеин ZPB обозначают также ZP4. Такая номенклатура используется, например, в таких базах данных, как Uniprot/SWISSprot, ensEMBL, BLAST (NCBI), SOURCE, SMART, STRING, PSORT2, CD ART, UniGene и SOSUI, все из которых используются в системе Bioinformatic Harvester (http://harvester.embl.de).
В соответствии с этим, используемые здесь термины ZP1, ZP2, ZP3 и ZP4 означают четыре семейства ZP-гликопротеинов, где ZP2, ZP3 и ZP4 соответствуют ZPA, ZPC и ZPB, согласно номенклатуре, предложенной Harris с соавт. Более конкретно, используемые здесь термины hZP1, hZP2, hZP3 и hZP4 относятся к (глико)протеинам, имеющим, соответственно, полипептидные остовы последовательностей SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3 и SEQ ID NO. 4, а также их аллельным вариантам.
Таким образом, аллельные варианты последовательностей ZP1, ZP2, ZP3 и ZP4, которые могут встречаться у человека, также охвачены соответствующими терминами, (h)ZP1, (h)ZP2, (h)ZP3 и (h)ZP4. Аллельные варианты включают в себя, в частности, варианты, полученные в результате однонуклеотидных полиморфизмов (ОНП). ОНП могут попадать в число кодирующих последовательностей генов, некодирующих областей генов или межгенных областей между генами. ОНП в пределах кодирующей последовательности необязательно будет вызывать изменение аминокислотной последовательности продуцируемого белка. ОНП, при котором обе формы приводят к образованию одной и той же полипептидной последовательности, называют синонимичным (иногда их называют молчащей мутацией), а если продуцируются разные полипептидные последовательности, их называют несинонимичными. Для того чтобы вариант относился к разряду ОНП, он должен возникать по меньшей мере в 1% случаев в популяции. В контексте настоящего изобретения «аллельные варианты» также могут включать в себя варианты полипептидных последовательностей, происходящие в результате (несинонимичных) мутаций, то есть варианты полипептидов, происходящие в результате точечных мутаций, вставок, делеций, и т.д., возникающих менее чем в 1% случаев в популяции.
Таким образом, в соответствии с настоящим изобретением, используемые здесь термины (h)ZPl, (h)ZP2, (h)ZP3 и (h)ZP4 включают в себя ZP-(глико)протеины, которые отличаются, соответственно, от SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3 и SEQ ID NO. 4 минорными модификациями последовательности. Такие модификации включают в себя, но не ограничены изменениями на уровне одной или нескольких аминокислот, включая делеции (например, укороченная версия пептида), вставки и/или замены. Обычно при оптимальном выравнивании, таком как выравнивание с помощью программ GAP или BESTFIT, в которых используются значения параметров по умолчанию, аллельный вариант содержит по меньшей мере определенный процент идентичности последовательности по отношению к указанным выше последовательностям. Использование пробелов и алгоритма глобального выравнивания Needleman и Wunsch для выравнивания двух последовательностей по полной их длине максимизирует число совпадений и минимизирует число пробелов. Обычно используют параметры по умолчанию за пробелы, штраф за создание пробела=8, а штраф за расширение пробела=2. Для белков матрицей подсчета по умолчанию является Blosum62 (Henikoff & Henikoff, 1992, PNAS 89, 915-919). Выравнивание последовательности и оценки степени идентичности последовательностей могут быть определены с помощью компьютерных программ, таких как GCG Wisconsin Package, версия 10.3, доступных в Accelrys Inc., 9685 Scranton Road, San Diego, CA 92121-3752, USA. Альтернативно, процент сходства или идентичности может быть определен путем поиска в базах данных, таких как FASTA, BLAST, и т.д. Здесь под «аллельным вариантом» подразумевается по меньшей мере 90%, предпочтительно, по меньшей мере 95%, более предпочтительно, по меньшей мере 98%, еще более предпочтительно, по меньшей мере 98%, еще более предпочтительно, по меньшей мере 99%, еще более предпочтительно, по меньшей мере 99,5%, и наиболее предпочтительно, по меньшей мере 99,9% идентичность последовательности аминокислот последовательностям SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3 и SEQ ID NO. 4.
В данном документе и в формуле изобретения глагол "содержать" и его сочетания используются в неограничивающем смысле, чтобы указать, что элементы, следующие после данного глагола, включены, но при этом элементы, которые не упомянуты, не должны быть исключены. Кроме того, если какой-нибудь элемент указан в единственном числе, это не исключает возможности того, что это относится и к множественному числу, если в контексте специально не указано, что имеется в виду один и только один из таких элементов. Поэтому использование единственного числа обычно означает "по меньшей мере один".
Используемый здесь термин «рак предстательной железы» относится как к первичным опухолям предстательной железы, так и к метастазам указанных первичных опухолей предстательной железы, которые могут возникнуть в любой части организма.
Обычно в целях, преследуемых в настоящем изобретении, используемые здесь термины «рак предстательной железы» или «опухоль предстательной железы» являются синонимичными «неопластическому заболеванию предстательной железы» или «неоплазме предстательной железы». Указанные термины являются полностью взаимозаменяемыми, хотя и следует отметить, что в случае заболеваний определенных тканей, отличных от предстательной железы, используемые здесь термины «неоплазма» и «опухоль» могут считаться не полностью совпадающими. В соответствии с настоящим изобретением, используемый здесь термин «рак предстательной железы», обычно не включает в себя пред-неопластические состояния, такие как гиперплазия, метаплазия, дисплазия или т.п.
Важным аспектом настоящего изобретения является обнаружение экспрессии ZP-(глико)протеина на (опухолевой) клетке предстательной железы, что позволяет вызвать иммунный ответ против указанных клеток. Тем не менее, как будет понятно специалистам в данной области, поскольку разные опухоли могут иметь различный или измененный характер экспрессии генов, могут возникать также и определенные опухоли предстательной железы, не экспрессирующие в сколько-нибудь значительной степени ZP-(глико)протеины. Следовательно, обычно настоящее изобретение относится к лечению видов рака предстательной железы или их метастазов, экспрессирующих ZP-(глико)протеины, предпочтительно, ZP3.
Способ согласно настоящему изобретению может составлять первичное лечение или же может быть использован в качестве дополнительной терапии в процессе или после лечения пациентов с использованием любых общепринятых способов, включая, например, хирургический, криохирургический способы, лучевую терапию, включая брахитерапию и дистанционную лучевую терапию, высокоинтенсивное сфокусированное ультразвуковое воздействие (HIFU), гормональную терапию или химиотерапию, или же некоторые их комбинации. Однако общеизвестно, что многие из обычно используемых противораковых терапевтических воздействий, в частности химиотерапия и рентгенотерапия, могут вызывать высокую степень иммуносупрессии. Таким образом, специалистам в данной области должно быть понятно, что эффективность описанного здесь способа может быть снижена, если его использовать после указанных терапевтических воздействий.
В настоящем изобретении предложены способы, которые целесообразно использовать для лечения первичного рака предстательной железы и его метастазов, что считается здесь составляющим «терапевтическое воздействие» или «лечебное воздействие», а также для предотвращения метастазов и/или рецидива рака предстательной железы, необязательно после или в сочетании с другими способами лечения, такими как описанные ранее, что считается здесь составляющим «профилактическое воздействие». В особенно предпочтительном воплощении настоящего изобретения способ согласно настоящему изобретению применим в сочетании с хирургическим вмешательством, гормональной терапией и/или с лечением с помощью лекарственного средства, выбранного из доцетаксела, бевацизумаба, талидома, кабзитаксела, абиратерона, темозоломида.
В способах согласно настоящему изобретению субъектом, подвергающимся лечению, предпочтительно является мужчина.
В соответствии с настоящим изобретением, «источником полипептида», который вводят человеку, в соответствии со способом согласно настоящему изобретению, может служить, или же он может включать в себя, белок или гликопротеин, гидролизат такого белка или гликопротеина и/или их фрагментов, которые могут быть представлены в очищенной форме или могут входить в состав неочищенной композиции, предпочтительно, биологической природы, такой как лизаты, гомогенаты, полученные из клеток при воздействии ультразвука, или фиксаты прокариотических или эукариотических клеточных линий. Альтернативно, указанным источником полипептида может быть, или же он может включать в себя, синтезированные химическим путем (поли)пептиды или (поли)пептиды, которые получены энзиматическим путем in vitro, которые могут быть представлены в очищенной форме или могут входить в состав неочищенной композиции. Источником полипептида может также быть, или же он может включать в себя, нуклеиновая кислота, кодирующая указанный полипептид, из РНК- или ДНК-матрицы. Молекулы РНК или ДНК могут быть «голой» ДНК, предпочтительно, содержащейся в везикулах или липосомах, или могут быть в составе вектора. Вектором может быть любой (рекомбинантный) ДНК- или РНК-вектор, известный в данной области, и предпочтительно, чтобы он являлся плазмидой, в которой гены, кодирующие латентные антигены, были оперативно связаны с регуляторными последовательностями, придающими кодируемым посредникам способность к экспрессии и трансляции. Указанным вектором может быть любой ДНК- или РНК-вирус, такой, без ограничения, как аденовирус, адено-ассоциированный вирус (AAV), ретровирус, лентивирус, модифицированный вирус коровьей оспы Ankara (MVA) или вирус оспы птиц, или же любой другой вирусный вектор, способный обеспечивать экспрессию полипептидов, содержащих латентные эпитопы, хозяину. ДНК-векторы могут быть не интегрирующими, такими как эписомно реплицирующиеся векторы, или же могут быть векторами, интегрирующимися в хозяйский геном путем случайной интеграции или в результате гомологической рекомбинации. Пример плазмидной конструкции, в которую встроена человеческая кДНК ZP2, где указанная плазмида может быть подходящим образом использована в соответствии с настоящим изобретением, можно найти в публикации Martinez с соавт. [(1996) Journal of Reproduction and Fertility Supplement 50: 35-41], которая включена в настоящее описание в виде ссылки.
Молекулы ДНК, содержащие гены, кодирующие полипептиды согласно настоящему изобретению, необязательно встроенные в векторы, такие как вирусы или плазмиды, могут быть интегрированы в хозяйский геном. В предпочтительном воплощении настоящего изобретения таким хозяином может быть микроорганизм. Предпочтительно, чтобы таким рекомбинантным микроорганизмом была Mycobacterium, например, вида M. tuberculosis или M. Bovis, и наиболее предпочтительно, бацилла M. bovis Кальметта-Герена (БЦЖ), способная доставлять хозяину полипептиды или их фрагменты согласно настоящему изобретению. Рекомбинантная БЦЖ и способы рекомбинации известны в данной области, например, см. WO 2004094469. Такие рекомбинантные микроорганизмы могут быть получены в виде живой рекомбинантной и/или живой аттенуированной вакцины, как описано, например, у Jacobs с соавт., 1987, Nature, 327(6122): 532-5). Такой вектор может также находиться в организме хозяина бактериальной природы, таком как, без ограничения, живая аттенуированная и/или рекомбинантная бактерия Shigella или Salmonella.
Используемый здесь термин "эпитоп" относится к части антигена, обычно определяемой полипептидом, который способен вызвать клеточный или гуморальный иммунный ответ, когда он представлен в физиологически соответствующем контексте in vivo. "Т-клеточный эпитоп" относится к пептиду или его части, которая связывается с молекулой MHC и распознается T-клетками, когда представлена [совместно с] молекулами MHC. Т-клеточный эпитоп способен индуцировать клеточно-опосредованный иммунный ответ в результате прямого или опосредованного представления в виде гетеродимерных мембранных молекул MHC. Вкратце, молекулы MHC преимущественно связываются с конкретными аминокислотными остатками, известными как "заякоривающие" остатки (K. Falk с соавт., Nature 351: 290-96 (1991)). Такое свойство позволяет идентифицировать распознающие эпитопы молекул класса I и II MHC внутри любой известной пептидной последовательности. В данном контексте, используемые здесь термины "MHC-ограниченный эпитоп" является синонимом Т-клеточного эпитопа. Используемый здесь термин "эпитоп, ограниченный классом I MHC", относится к пептидной последовательности, распознаваемой цитотоксическими Т-лимфоцитами (также называемыми CD8+ клетками или ЦТЛ) в сочетании с молекулами класса I MHC. Используемый здесь термин "эпитоп, ограниченный классом II MHC" относится к пептиду, распознаваемому хелперными T-клетками (также называемыми CD4+ клетками или T-хелперами). "B-клеточный эпитоп" представляет собой часть антигена, обычно пептид, способный связываться с антиген-связывающим участком иммуноглобулина, а следовательно, способный стимулировать гуморальный ответ без презентации в сочетании с молекулой MHC. Объясняемый здесь ранее полипептид, применимый в настоящем изобретении, или нуклеиновая кислота, кодирующая указанный полипептид, содержит по меньшей мере один Т-клеточный эпитоп. Однако применение полипептидов, которые содержат также и B-клеточный эпитоп, не исключено в данном изобретении. Описанные здесь иммуногенные полипептиды могут включать в себя также множество Т-клеточных эпитопов и, необязательно, B-клеточный эпитоп. Когда в пептиде присутствует множество эпитопов, указанные эпитопы могут быть ориентированы в виде тандема или в виде разветвленной (гнездовой) пространственной структуры, или могут иметь перекрывающуюся конфигурацию, в которой по меньшей мере один аминокислотный остаток может быть общим для двух или более эпитопов.
Полипептид согласно настоящему изобретению предпочтительно включает в себя один или несколько эпитопов, связывающихся с молекулами класса I MHC. Как известно специалистам в данной области, антиген, содержащий один пептидный эпитоп, будет полезен при лечении только (малой) части пациентов, у которых экспрессируется аллельный продукт MHC, который способен связываться с конкретным пептидом. Было подсчитано, что у людей вакцины, содержащие эпитопы ЦТЛ, ограниченные HLA-A1,-А2,-A3, A24- и -B7, будут охватывать около 80% индивидов большинства этнических групп. Следовательно, если данное изобретение использовать для лечения мужской половины человечества, особенно предпочтительно, чтобы настоящий источник полипептида содержал эффективное количество одного или нескольких различных полипептидов, включающих в себя один, более предпочтительно, два, и наиболее предпочтительно, три связывающих молекулы MHC класса I нативных ZP-эпитопа, выбранные из числа эпитопов, ограниченных молекулами HLA-A1, HLA-A2, HLA-A3, HLA-A24 и HLA-B7; или их гомологов, или одной или нескольких последовательностей нуклеиновых кислот, кодирующих указанные один или несколько полипептидов или их гомологов.
В соответствии с другим воплощением, полипептид согласно настоящему изобретению предпочтительно включает в себя один или несколько эпитопов, связывающихся с молекулами MHC класса II. Наиболее часто обнаруживаемые у человека аллельные продукты MHC класса II включают в себя HLA-DR1, -DR3, -DR4 и -DR7. Соответственно, предпочтительно, чтобы настоящий источник полипептида содержал эффективное количество одного или нескольких различных полипептидов, где указанные один или несколько различных полипептидов включают в себя один, более предпочтительно, два, и наиболее предпочтительно, три связывающих молекулы MHC класса II нативных ZP-эпитопа, выбранных из числа эпитопов, ограниченных молекулами HLA-DR1, HLA-DR3, HLA-DR4 и HLA-DR7; или их гомологов или одной или нескольких последовательностей нуклеиновых кислот, кодирующих указанные один или несколько полипептидов или их гомологов.
В еще одном воплощении настоящий источник полипептида содержит эффективное количество одного или нескольких полипептидов, где указанные один или несколько полипептидов включают в себя один или несколько эпитопов, связывающихся с молекулами MHC класса I, и один или несколько эпитопов, связывающихся с молекулами MHC класса II, как описано здесь выше; их гомологов или одной или нескольких последовательностей нуклеиновых кислот, кодирующих указанные полипептиды или их гомологи. Даже более предпочтительно, чтобы указанный источник содержал эффективное количество одного или нескольких различных полипептидов, которые вместе включают в себя в основном все из эпитопов, связывающихся с молекулами MHC класса I и MHC класса II, содержащихся в одном из нативных ZP-гликопротеинов; или гомологов указанных одного или нескольких полипептидов, или одной или нескольких последовательностей нуклеиновых кислот, кодирующих указанные полипептиды или их гомологи.
В одном из воплощений настоящий источник полипептида содержит эффективное количество одного или нескольких различных иммуногенных полипептидов, где один или несколько различных полипептидов вместе включают в себя по меньшей мере 50%, более предпочтительно, по меньшей мере 70%, еще более предпочтительно, по меньшей мере 80%, еще более предпочтительно, по меньшей мере 90%, и наиболее предпочтительно, по меньшей мере 95% связывающихся эпитопов, ограниченных молекулами MHC класса I и MHC класса II, и содержащихся в нативном ZP-гликопротеине; или гомологов указанных одного или нескольких полипептидов, или одной или нескольких кодирующих их последовательностей нуклеиновых кислот.
В предпочтительным воплощении настоящий источник полипептида содержит эффективное количество иммуногенного полипептида, где указанный полипептид содержит по меньшей мере 50%, более предпочтительно, по меньшей мере 70%, еще более предпочтительно, по меньшей мере 80%, еще более предпочтительно, по меньшей мере 90%, и наиболее предпочтительно, по меньшей мере 95% полного аминокислотного остова ZP-гликопротеина, предпочтительно, hZP; или гомолога указанного полипептида, или последовательности нуклеиновой кислоты, кодирующей указанный полипептид или его гомолог.
В другом особенно предпочтительном воплощении, источник полипептида содержит эффективное количество множества различных перекрывающихся полипептидных фрагментов ZP-гликопротеина, предпочтительно, hZP, где указанные различные перекрывающиеся полипептидные фрагменты составляют в длину 18-60 аминокислот, предпочтительно, 18-45 аминокислот, которые вместе содержат по меньшей мере 50%, более предпочтительно, по меньшей мере 70%, еще более предпочтительно, по меньшей мере 80%, еще более предпочтительно, по меньшей мере 90%, и наиболее предпочтительно, по меньшей мере 95% полного аминокислотного остова указанных ZP-гликопротеинов; гомологов указанных полипептидов или одной или нескольких последовательностей нуклеиновых кислот, кодирующих указанные полипептиды или их гомологи. Обычно аминокислотное перекрывание между различными последовательными 16-80-членными полипептидными фрагментами составляет по меньшей мере 7 аминокислот, предпочтительно, по меньшей мере 8, более предпочтительно, по меньшей мере 9, и наиболее предпочтительно, по меньшей мере 10 аминокислот.
Описаны MHC-связывающие мотивы для большинства общих аллелей MHC класса I и класса II. Указанные мотивы уточняют аминокислотные остатки, которые служат в качестве MHC-связывающих якорей для специфических в отношении MHC класса I и класса II аллелей. Усовершенствованные алгоритмы, созданные на основе компьютеров, в которых учитываются MHC-связывающиеся якоря, а также аминокислотная последовательность пептида, используются для предсказания и количественной оценки аффинности связывания взаимодействия пептид/MHC. Таким образом, из введенной известной аминокислотной последовательности (глико)протеинов блестящей оболочки указанные алгоритмы создают список всех потенциальных T-клеточных эпитопов, каждого с его соответствующей предсказываемой оценкой связывания. Общеизвестный инструментарий по биоинформатике для подобных целей включает в себя HLA BIND, SYFPEITHI, NetMHC и TEPITOPE 2000 [см. ссылки 1-6]. Альтернативно, специалисты в данной области должны уметь определять экспериментально связывающие эпитопы T-хелперных лимфоцитов и ЦТЛ путем стандартных приемов экспериментирования (Current Protocols in Immunology, Wiley Interscience 2004).
В некоторых случаях наблюдалось, что один и тот же пептид может связываться с несколькими аллельными продуктами MHC класса I или класса II. В одном из воплощений применение таких «смешанных» MHC-связывающих пептидов в способе согласно изобретению является особенно предпочтительным.
В одном из воплощений в настоящем изобретении предложен способ индукции у человека мужского пола первичного иммунного ответа на гликопротеины нативной блестящей оболочки, при этом указанный способ включает в себя стадию введения указанному человеку источника полипептида, где указанный полипептид содержит ограниченный классом I MHC и/или классом II MHC Т-клеточный эпитоп нативной блестящей оболочки или его иммунологически активный вариант, причем указанный источник полипептида содержит эффективное количество иммуногенного полипептида, выбранного из (глико)протеинов блестящей оболочки, их гомологов, а также иммунологически активных фрагментов указанных (глико)протеинов и их гомологов; или последовательности нуклеиновой кислоты, кодирующей указанный иммуногенный полипептид. В соответствии с предпочтительным воплощением, указанный (глико)протеин блестящей оболочки выбран из группы ZP1, ZP2, ZP3 и ZP4, более предпочтительно, ZP2 и ZP3, и наиболее предпочтительно, ZP3.
В соответствии с особенно предпочтительным воплощением, указанный источник полипептида содержит эффективное количество иммуногенного полипептида, выбранного из (глико)протеинов блестящей оболочки человека, их гомологов, а также из иммунологически активных фрагментов указанных (глико)протеинов и их гомологов, или последовательности нуклеиновой кислоты, кодирующей указанный иммуногенный полипептид. Предпочтительно, чтобы указанный (глико)протеин блестящей оболочки человека ((глико)протеин hZP) был выбран из группы hZPl, hZP2, hZP3 и hZP4. В соответствии с еще более предпочтительным воплощением, указанный (глико)протеин выбран из группы hZP2 и hZP3, более предпочтительно, чтобы указанным (глико)протеином был hZP3.
Под термином «их иммунологически активные фрагменты» обычно в данной области подразумевается фрагмент полипептидного антигена, содержащего по меньшей мере эпитоп, что означает, что такой фрагмент по меньшей мере содержит 4, 5, 6, 7 или 8 смежных аминокислот из последовательности полипептидного антигена. В соответствии с настоящим изобретением, указанный фрагмент содержит по меньшей мере Т-клеточный эпитоп. Таким образом, «иммунологически активный фрагмент» согласно настоящему изобретению содержит по меньшей мере 8, 9, 10, 11, 12, 13 или 14 смежных аминокислот из последовательности ZP-(глико)протеинового антигена или его гомолога или аналога. Еще более предпочтительно, чтобы указанный фрагмент содержал как ЦТЛ-, так и T-хелперный эпитоп. Наиболее предпочтительно, однако, чтобы указанный фрагмент являлся пептидом, который требует процессинга со стороны антигенпредставляющей клетки, то есть указанный фрагмент имеет в длину по меньшей мере приблизительно 18 аминокислот, и при этом непрерывная последовательность из 18 аминокислот указанного полипептидного антигена не является необходимой.
Используемые здесь термины «их гомологи» относятся к полипептидам, которые отличаются от образующихся природным путем полипептидов в результате минорных модификаций, но в которых сохраняется структура основного полипептида и боковых цепей той формы, которая образуется природным путем. Такие изменения включают в себя, но не ограничены изменениями в одной или нескольких боковых цепях аминокислот; изменениями в одной или нескольких аминокислотах, включая делеции (например, укороченная версия пептида), вставки и/или замены; изменениями в стереохимии одного или нескольких атомов; дополнительные N- или C-концевые аминокислоты; и/или минорные дериватизации, включая, но не ограничиваясь метилированием, гликозилированием, фосфорилированием, ацетилированием, миристоилированием, пренилированием, пальмитированием, амидированием и/или добавлением гликозилфосфатидилинозита. Используемые здесь гомолог или аналог имеют либо повышенную, либо по существу сходную функциональную активность по сравнению с образующимся природным путем полипептидом.
Здесь подразумевается, что гомолог содержит иммуногенный полипептид, имеющий аминокислотную последовательность, по меньшей мере на 70%, предпочтительно, по меньшей мере на 80%, более предпочтительно, по меньшей мере на 90%, еще более предпочтительно, по меньшей мере на 95%, еще более предпочтительно, по меньшей мере на 98%, и наиболее предпочтительно, по меньшей мере на 99% идентичную аминокислотной последовательности образующихся природным путем полипептидов ZP3 согласно настоящему изобретению, при их оптимальном выравнивании, например, с помощью программ GAP или BESTFIT, в которых используются параметры по умолчанию, но при этом все еще способный вызывать по меньшей мере достижимый иммунный ответ. Обычно используются параметры по умолчанию за пробелы, со штрафом за создание пробела=8 и штрафом за расширение пробела=2. В случае белков матрицей подсчета по умолчанию является Blosum62 (Henikoff & Henikoff, 1992, PNAS 89, 915-919). Выравнивание последовательностей и оценки степени идентичности последовательностей могут быть определены с помощью компьютерных программ, таких как GCG Wisconsin Package, версия 10.3, доступных в Accelrys Inc., 9685 Scranton Road, San Diego, CA 92121-3752, USA. Альтернативно, процент сходства или идентичности может быть определен путем поиска в базах данных, таких как FASTA, BLAST, и т.д.
В соответствии с одним из воплощений настоящего изобретения, настоящие иммуногенные полипептиды, определяемые здесь выше, являются гликозилированными. Не желая ограничивать себя какой бы то ни было теорией, авторы изобретения, тем не менее, предполагают, что в результате гликозилирования указанных полипептидов их иммуногенность повышается. Следовательно, в соответствии с предпочтительным воплощением, указанный выше иммуногенный полипептид, как определено здесь выше, является гликозилированным, имеет содержание углеводного компонента, варьирующее от 10 до 80% по массе, если исходить из общей массы указанного гликопротеина или гликозилированного полипептида. Более предпочтительно, чтобы указанное содержание углеводного компонента варьировало от 15 до 70% по массе, еще более предпочтительно, чтобы варьировало от 20 до 60% по массе. В другом воплощении указанный гликозилированный иммуногенный полипептид имеет характер гликозилирования, который сходен с таковым соответствующего гликопротеина (или его фрагмента) блестящей оболочки человека. Предполагается, что это еще дополнительно повышает иммуногенность указанного полипептида. Таким образом, в определенном воплощении предпочтительно, чтобы указанный иммуногенный полипептид имел характер гликозилирования, который сходен с таковым соответствующего (фрагмента) человеческого ZP-гликопротеина. Тем не менее, как известно специалистам в данной области, рекомбинантная технология получения иммуногенного полипептида может обеспечивать выход полипептидов, которые не гликозилированы или которые содержат различный характер гликозилирования, помимо прочего, в зависимости от выбора хозяйских клеток, как будет пояснено здесь далее. Специалистам будет понятно, что применение рекомбинантных полипептидов, имеющих характер гликозилирования, не похожий на таковой соответствующего (фрагмента) hZP, также полностью входит в объем защиты настоящего изобретения и могло бы быть предпочтительным в определенных воплощениях, например, по практическим соображениям.
Предлагаемый здесь способ иммунизации предпочтительно включает в себя введение источника иммуногенности активных полипептидных фрагментов, причем указанные полипептидные фрагменты выбраны из белковых фрагментов блестящей оболочки и/или их гомологов, как было определено здесь выше, при этом указанные полипептидные фрагменты включают в себя доминантные эпитопы ЦТЛ и/или T-хелперного лимфоцита, и указанные фрагменты насчитывают от 18 до 45 аминокислот в длину. Как описано в WO 02/070006, пептиды, имеющие длину от 18 до 45 аминокислот, могут обеспечить превосходные иммуногенные свойства. Пептиды могут быть с успехом синтезированы химическим путем и могут быть необязательно (частично) перекрывающимися и/или могут быть также лигированы с другими молекулами, пептидами или белками. Пептиды могут быть также слиты, с образованием синтетических белков, как описано в PCT/NL03/00929 и у Welters с соавт. (Vaccine. 2004 Dec 2; 23(3): 305-11). Может быть также выгодно добавлять к амино- или карбокси-концу пептида химические фрагменты или дополнительные (модифицированные или D-) аминокислоты, чтобы повысить стабильность и/или уменьшить биодеградируемость пептида. Чтобы улучшить иммуногенность, к нему можно прикрепить иммуно-стимулирующие фрагменты, например, путем липидизации или гликозилирования. Для повышения растворимости пептида может быть использовано добавление заряженных или полярных аминокислот, с тем, чтобы увеличить его растворимость и повысить стабильность in vivo.
В целях иммунизации указанные выше иммуногенные полипептиды согласно настоящему изобретению могут быть также слиты с белками, но без ограничения указанными белками, такими как столбнячный токсин/токсоид, дифтерийный токсин/токсоид или другие молекулы-носители. Полипептиды согласно настоящему изобретению могут быть также с успехом слиты с белками теплового шока, такими как рекомбинантный эндогенный (мышиный) gp96 (GRP94) в качестве носителя для иммунодоминантных пептидов, как описано в публикациях Rapp UK and Kaufmann SH, Int Immunol. 2004 Apr; 16(4): 597-605; Zugel U, Infect Immun. 2001 Jun; 69(6): 4164-7, или со слитыми с Hsp70 белками (Triebel с соавт.; W0 9954464).
Индивидуальные аминокислотные остатки представленных здесь иммуногенных (поли)пептидов согласно изобретению могут быть встроены в пептид посредством пептидной связи или миметика пептидной связи. Миметик пептидной связи согласно настоящему изобретению включает в себя модификации пептидного остова, хорошо известные специалистам в данной области. Такие модификации включают в себя модификации амидного азота, α-углерод, амидный карбонил, полную замену амидной связи, удлинения, делеции или перекрестные связи остова. В общих чертах см. Spatola, Chemistry and Biochemistry of Amino Acids, Peptides and Proteins, Vol. VII (Weinstein ed., 1983). Известно несколько модификаций пептидного остова, они включают в себя ψ[CH2S], ψ[CH2NH], ψ[CSNH2], ψ[NHCO], ψ[COCH2] и ψ[(E) или (Z) CH=CH]. Номенклатура, используемая выше, соответствует таковой, предложенной Spatola, выше. В данном контексте ψ указывает на отсутствие амидной связи. Структура, которая заменяет амидную группу, уточняется в квадратных скобках.
Аминокислотные миметики могут быть также встроены в полипептиды. Используемый здесь термин "аминокислотный миметик" представляет собой фрагмент, отличный от образующейся природным путем аминокислоты, который конформационно и функционально служит заместителем аминокислоты в полипептиде согласно настоящему изобретению. Такой фрагмент служит заместителем аминокислотного остатка, если он не препятствует способности пептида вызывать иммунный ответ против Т-клеточных эпитопов нативного ZP. Аминокислотные миметики могут включать в себя небелковые аминокислоты, такие как β-, γ-, δ-аминокислоты, β-, γ-, δ-иминокислоты (такие как пиперидин-4-карбоновая кислота), а также многие производные L-α-аминокислот. Специалистам в данной области известен целый ряд подходящих аминокислотных миметиков, они включают в себя циклогексилаланин, 3-циклогексилпропионовую кислоту, L-адамантил-аланин, адамантил-уксусную кислоту и т.п. Пептидные миметики, подходящие для пептидов согласно настоящему изобретению, обсуждаются в публикации Morgan and Gainor, (1989) Ann. Repts. Med. Chem. 24: 243-252.
В соответствии с предпочтительным воплощением, настоящий способ включает в себя введение композиции, содержащей один или несколько из описанных здесь иммуногенных полипептидов, как описано здесь выше, и по меньшей мере один эксципиент. Эксципиенты хорошо известны в области фармации, и их можно найти в таких пособиях, например, как Руководство Remmington's pharmaceutical sciences, Mack Publishing, 1995.
Настоящий способ иммунизации может дополнительно включать в себя введение, предпочтительно совместное введение, по меньшей мере одного адъюванта. Адъюванты могут включать в себя любой адъювант, известный в области вакцинации, и могут быть выбраны с помощью таких руководств, как Current Protocols in Immunology, Wiley Interscience, 2004.
Здесь подразумевается, что адъюванты включают в себя любое вещество или соединение, которое, при его использовании в сочетании с антигеном для иммунизации человека или животного, стимулирует иммунную систему, провоцируя, таким образом, усиление или облегчение достижения иммунного ответа против антигена, предпочтительно, без выработки специфической иммунной реакции на адъювант как таковой. Предпочтительные адъюванты усиливают иммунный ответ против данного антигена по меньшей мере в 1,5, 2, 2,5, 5, 10 или 20 раз по сравнению с иммунным ответом, вырабатываемым против данного антигена в тех же самых условиях, но в отсутствие адъюванта. Тесты по определению статистически среднего усиления иммунного ответа против данного антигена, которое продуцируется адъювантом в группе животных или людей, по сравнению с соответствующей контрольной группой, доступны в данной области. Такой адъювант предпочтительно способен усиливать иммунный ответ по меньшей мере против двух различных антигенов. Адъювант согласно настоящему изобретению должен, как правило, быть соединением, которое является чужеродным для человека, что исключает, таким образом, иммуностимулирующие соединения, которые являются эндогенными для человека, такие, например, как интерлейкины, интерфероны и другие гормоны.
Целый ряд адъювантов хорошо известен специалистам в данной области. Подходящие адъюванты включают в себя, например, неполный адъювант Фрейнда, квасцы, фосфат алюминия, гидроокись алюминия, N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-нор-мурамил-L-аланил-D-изоглутамин (CGP 11637, обозначаемый здесь как nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидрокси-фосфорилокси)-этиламин (CGP 19835 A, обозначаемый как MTP-PE), DDA (2 диметилдиоктадециламмония бромид), полиIC, поли-A-поли-U, RIBITM, GERBUTM, Pam3TM, CarbopolTM, SpecolTM, TitermaxTM, столбнячный анатоксин, дифтерийный анатоксин, белки наружной мембраны менингококка, дифтерийный белок CRM197. Предпочтительные адъюванты включают в себя лиганд, который распознается Toll-подобным рецептором (TLR), присутствующим на антигенпредставляющих клетках. Различные лиганды, распознаваемые рецепторами TLR, известны в данной области и включают в себя, например, липопептиды (см., например, WO 04/110486), липополисахариды, пептидогликаны, липотейхоевые кислоты, липоарабиноманнаны, липопротеины (из микоплазмы или спирохет), двухцепочечные РНК (поли I:C), неметилированную ДНК, флагеллин, CpG-содержащую ДНК, и имидазохинолины, а также производные указанных лигандов, имеющие химические модификации.
Настоящий способ иммунизации может дополнительно включать в себя введение, предпочтительно совместное введение CD40-связывающей молекулы для того, чтобы усилить ответ ЦТЛ и, таким образом, повысить терапевтическую эффективность способов и композиций согласно настоящему изобретению. Применение CD40-связывающих молекул описано в публикации WO 99/61065, включенное в настоящее описание в виде ссылки. CD40-связывающая молекула предпочтительно является антителом или его фрагментом, или CD40-лигандом или его вариантом, и может быть добавлена отдельно или может содержаться в составе композиции согласно настоящему изобретению. Для терапевтических применений настоящие иммуногенные полипептиды или последовательности нуклеиновых кислот, кодирующие их или композиции согласно изобретению, содержащие указанные полипептиды или кодирующие их последовательности нуклеиновых кислот, вводят пациенту, страдающему злокачественной опухолью предстательной железы и, возможно, ее метастазами, или пациенту, который подвергался другим способам лечения злокачественных опухолей предстательной железы, например, любому из описанных здесь выше общепринятых способов, в количестве, достаточном для индукции первичного аутоиммунного ответа, направленного на нативные гликопротеины ZP и клетки тканей, экспрессирующие гликопротеины ZP. Количество, достаточное для осуществления этого, определяется как "терапевтически-" или "профилактически-эффективная доза". Такие эффективные дозировки будут зависеть от различных факторов, включая состояние и общий статус здоровья пациента. Таким образом, схемы дозирования могут быть определены и уточнены квалифицированным медицинским персоналом с целью достижения оптимального терапевтического или профилактического эффекта.
В способе согласно изобретению один или несколько иммуногенных полипептидов обычно вводят в дозе, приблизительно составляющей 1 мкг/кг массы тела пациента или более, по меньшей мере однократно. Часто дозировки превышают 10 мкг/кг. Согласно настоящему изобретению, дозировки предпочтительно варьируют от 1 мкг/кг до 1 мг/кг.
В соответствии с предпочтительным воплощением, типичная схема дозировок включает в себя введение дозы в 1-1000 мкг/кг, более предпочтительно, 10-500 мкг/кг, еще более предпочтительно, 10-150 мкг/кг, один, два или три раза в неделю в течение периода в одну, две, три, четыре или пять недель. В соответствии с предпочтительным воплощением, 10-100 мкг/кг вводят один раз в неделю в течение периода в одну или две недели.
Способ согласно изобретению предпочтительно включает в себя введение иммуногенных полипептидов согласно настоящему изобретению и содержащих их композиций парентеральным или оральным путем, предпочтительно, парентеральным путем.
Другое воплощение настоящего изобретения включает в себя введение ex vivo композиции, содержащей иммуногенные пептиды согласно изобретению в мононуклеарные клетки, полученные из крови пациентов, в частности, в выделенные из крови ДК. Может быть использовано фармацевтическое средство для облегчения сбора ДК, такое как Progenipoietin.TM. (Monsanto, St. Louis, Mo.) или GM-CSF/IL-4. После импульсной обработки ДК пептидами и их отмывки с целью удаления не связавшихся пептидов, ДК вновь инфузировали пациенту. Для случаев такого воплощения предложена композиция, содержащая импульсно обработанные пептидами ДК, на поверхности которых представлены эпитопы указанных пептидов в [ассоциации с] молекулами системы HLA. Способы индукции иммунного ответа, в которых используются ex vivo импульсно обработанные пептидами ДК, хорошо известны специалистам в данной области.
Другой аспект настоящего изобретения связан с фармацевтическим средством, содержащим в качестве активного ингредиента источник полипептида согласно изобретению, как здесь описано выше. Более предпочтительно, чтобы фармацевтическое средство включало в себя в качестве активного ингредиента один или несколько из указанных выше иммуногенных полипептидов, выбранных из группы белков ZP, их гомологов и фрагментов указанных белков ZP и их гомологов, или, альтернативно, вектора для генной терапии, как определено выше.
В соответствии с первым воплощением, предлагается фармацевтическое средство, содержащее один или несколько из иммуногенных полипептидов согласно настоящему изобретению. Концентрация указанного полипептида в фармацевтической композиции может широко варьировать, то есть от менее чем приблизительно 0,1% по массе, как правило, составляя по меньшей мере приблизительно от 1% по массе до 20% по массе или более.
Предпочтительно, чтобы композиция содержала, вдобавок к активному ингредиенту, по меньшей мере фармацевтически приемлемый носитель. Фармацевтическим носителем может быть любое совместимое нетоксичное вещество, подходящее для доставки иммуногенных полипептидов или векторов для генной терапии, пациенту. Для полипептидов в качестве носителя могут быть использованы стерильная вода, спирт, жиры, воски и инертные твердые вещества. Фармацевтически приемлемые адъюванты, забуферивающие вещества, диспергирующие вещества и т.п. также могут быть включены в фармацевтические композиции.
В соответствии с особенно предпочтительным воплощением, настоящая фармацевтическая композиция содержит адъювант, как более подробно было определено здесь выше. Адъюванты для включения в настоящую композицию предпочтительно выбраны из группы лигандов, которые распознаются Toll-подобным рецептором (TLR), присутствующим на антигенпредставляющих клетках, включая липопептиды (см., например, WO 04/110486), липополисахариды, пептидогликаны, липотейхоевые кислоты, липоарабиноманнаны, липопротеины (из микоплазмы или спирохет), двухцепочечные РНК (поли I:C), неметилированную ДНК, флагеллин, CpG-содержащую ДНК, и имидазохинолины, а также производные указанных лигандов, имеющие химические модификации. Специалисты в данной области смогут определить точные количества любого из указанных адъювантов для включения в настоящие фармацевтические препараты с целью придания им достаточной иммуногенности. В соответствии с другим предпочтительным воплощением, настоящая фармацевтическая композиция может включать в себя один или несколько дополнительных ингредиентов, которые, как было разъяснено здесь выше, используются для усиления иммунитета ЦТЛ. В соответствии с особенно предпочтительным воплощением, настоящий фармацевтический препарат содержит CD40-связывающую молекулу.
Способы продуцирования фармацевтических композиций, содержащих полипептиды, описаны в патентах США No. 5789543 и 6207718. Предпочтительная форма зависит от предлагаемого способа введения и терапевтического применения.
В случае генной терапии в фармацевтические композиции могут быть включены векторы, например, плазмида, фагемида, фаг, космида, вирус, ретровирус, эписома или транспонируемый элемент, включающие в себя последовательность нуклеиновой кислоты, кодирующую иммуногенный полипептид, как было определено здесь выше. Векторы для генной терапии могут быть доставлены субъекту, например, путем внутривенной инъекции, путем локального введения (см. патент США No. 5328470) или путем стереотаксической инъекции (см., например, Chen с соавт., PNAS 91: 3054-3057, 1994). Фармацевтическая композиция, содержащая вектор для генной терапии, может включать в себя вектор для генной терапии в подходящем разбавителе, или может включать в себя матрикс для замедленного высвобождения, в который встроен носитель для доставки гена. Альтернативно, когда может быть получен вектор доставки полного интактного гена из рекомбинантных клеток, например ретровирусные векторы, фармацевтическое средство может включать в себя одну или несколько клеток, которые продуцируют систему доставки генов.
Иммуногенные полипептиды предпочтительно вводят парентерально. Полипептиды для препаратов для парентерального введения должны быть стерильными. Стерилизация легко достигается путем фильтрации через стерильные фильтрационные мембраны, до или после лиофилизации и восстановления. Парентеральный путь введения согласуется с известными способами, например, инъекцией или инфузией путем внутривенного, внутрибрюшинного, внутримышечного, внутриартериального, подкожного или внутриочагового введения. Полипептид вводят непрерывно путем инфузии или с помощью болюсной инъекции. Типичная композиция для внутривенной инфузии может быть получена таким образом, чтобы она содержала вплоть до 10-50 мл стерильного 0,9% NaCl или 5% глюкозы, необязательно была бы обогащена 20% раствором альбумина и содержала бы от 10 мкг до 50 мг, предпочтительно, от 50 мкг до 10 мг полипептида. Типичная фармацевтическая композиция для внутримышечной инъекции может быть получена таким образом, чтобы она содержала, например, вплоть до 1-10 мл стерильной забуференной воды и от 10 мкг до 50 мг, предпочтительно, от 50 мкг до 10 мг, полипептида согласно настоящему изобретению. Способы получения парентерально вводимых композиций хорошо известны в данной области и более подробно описаны в различных источниках, включая, например, Руководство Remington's Pharmaceutical Science (15th ed., Mack Publishing, Easton, PA, 1980) (во всей полноте и для любых целей включенное в настоящее описание в виде ссылки).
Для орального введения активный ингредиент может быть введен в твердых дозированных формах, таких как капсулы, таблетки и порошки, или в жидких дозированных формах, таких как эликсиры, сиропы и суспензии. Активный компонент(компоненты) может быть инкапсулирован в желатиновые капсулы, вместе с неактивными ингредиентами и порошкообразными носителями, такими как глюкоза, лактоза, сахароза, маннит, крахмал, целлюлоза или производные целлюлозы, стеарат магния, стеариновая кислота, сахарин натрия, тальк, карбонат магния и т.п. Примерами дополнительных неактивных ингредиентов, которые могут быть добавлены для обеспечения требуемого цвета, вкуса, стабильности, буферной способности, дисперсии или других известных требуемых свойств, окись железа, силикагель, лаурилсульфат натрия, диоксид титана, пищевые съедобные белые чернила, и т.д. Сходные разбавители могут быть использованы для получения прессованных таблеток. Как таблетки, так и капсулы могут быть изготовлены в виде продуктов с непрерывным высвобождением, чтобы обеспечить постоянное высвобождение лекарственного средства в течение периода, насчитываемого часами. Прессованные таблетки могут быть покрыты сахарным слоем или пленкой с целью маскировки какого-нибудь неприятного вкуса и защиты таблетки от атмосферных явлений, или могут быть покрыты энтеросолюбильной оболочкой для селективной дезинтеграции в желудочно-кишечном тракте. Жидкие лекарственные формы для орального введения могут содержать красители и вкусовые добавки для повышения благожелательного к ним отношения со стороны пациентов.
Иммуногенные полипептиды для применения в настоящем изобретении могут быть получены с помощью рекомбинантных технологий, где нуклеотидная последовательность, кодирующая представляющий интерес полипептид, экспрессируется в подходящих хозяйских клетках, таких, как описано Ausubel с соавт., "Current Protocols in Molecular Biology", Greene Publishing and Wiley-Interscience, New York (1987), а также у Sambrook and Russell (2001) "Molecular Cloning: A Laboratory Manual (3rd edition), Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, New York; обе указанные публикации в полном объеме включены в настоящее описание в виде ссылок. См. также Kunkel (1985) Proc. Natl. Acad. Sci. 82: 488 (где описан сайт-направленный мутагенез), а также Roberts с соавт. (1987), Nature 328: 731-734, или Wells, J.A. с соавт., (1985) Gene 34: 315 (где описан кассетный мутагенез).
Пример получения рекомбинантного человеческого ZPA и ZPB с помощью бакуловирусов можно найти в указанной выше публикации Martinez с соавт., [(1996) Journal of Reproduction and Fertility Supplement 50: 35-41].
Примеры получения рекомбинантного человеческого ZPA и ZPB с помощью бактерий (E. coli), дрожжевых клеток (Pichia pastoris), клеток насекомых (многоядерный вирус полиэдроза Autographa californica) и клетки яичников китайского хомячка (CHO) в качестве экспрессирующих систем описаны в публикации Harris с соавт., [(1999) Protein Expression and Purification 16: 298-307], которая включена в настоящее описание в виде ссылки.
Аспект изобретения, таким образом, связан с вектором, содержащим молекулу нуклеиновой кислоты, кодирующую иммуногенный полипептид согласно изобретению, как описано здесь выше. Предпочтительно, чтобы вектор был репликативным вектором, содержащим ориджин репликации (или автономно реплицирующуюся последовательность), который обеспечивает размножение вектора в организме подходящего для такого вектора хозяина. Альтернативно, указанный вектор способен к интеграции в геном хозяйских клеток, например, путем гомологической рекомбинации или иным путем. Особенно предпочтительным вектором является экспрессирующий вектор, в котором нуклеотидная последовательность, кодирующая полипептид, как описано выше, оперативно связан с промотором, способным направлять экспрессию кодирующей последовательности в хозяйской для этого вектора клетке.
Используемый здесь термин "промотор" относится к фрагменту нуклеиновой кислоты, который функционирует, осуществляя контроль транскрипции одного или нескольких генов, локализованных выше по отношению к направлению транскрипции сайта инициации транскрипции указанного гена, и структурно идентифицируется по наличию связывающего участка для ДНК-зависимой РНК-полимеразы, сайтов инициации транскрипции и любых других последовательностей ДНК, включая, без ограничения, сайты связывания фактора транскрипции, сайты связывания белка-репрессора и белка-активатора, а также любые другие нуклеотидные последовательности, известные специалистам в данной области своим прямым или опосредованным действием в отношении регуляции уровня транскрипции с промотора. "Конститутивный" промотор является промотором, который является активным в большинстве физиологических условий и условий развития. "Индуцибельный" промотор является промотором, который регулируется, в зависимости от физиологических условий или условий развития. "Тканеспецифический" промотор является активным только в особых типах дифференцированных клеток/тканей.
Экспрессирующие векторы позволяют получать иммуногенные полипептиды, как определено выше, с помощью рекомбинантных технологий, где нуклеотидная последовательность, кодирующая представляющий интерес полипептид, экспрессируется в подходящих хозяйских клетках, например, в культивируемых клетках или в клетках многоклеточного организма, например, как описано Ausubel с соавт., "Current Protocols in Molecular Biology", Greene Publishing and Wiley-Interscience, New York (1987), а также Sambrook and Russell (2001, выше); обе указанные публикации в полном объеме включены в настоящее описание в виде ссылок. См. также Kunkel (1985) Proc. Natl. Acad. Sci. 82: 488 (где описан сайт-направленный мутагенез), а также Roberts с соавт. (1987), Nature 328: 731-734, или Wells, J.A. с соавт., (1985) Gene 34: 315 (где описан кассетный мутагенез).
Обычно в экспрессирующих векторах используются нуклеиновые кислоты, кодирующие требуемые полипептиды. Фраза "экспрессирующий вектор" обычно относится к нуклеотидным последовательностям, которые способны влиять на экспрессию гена в организме хозяев, совместимых с такими последовательностями. Такие экспрессирующие векторы обычно включают в себя по меньшей мере подходящие промоторные последовательности и необязательно сигналы терминации транскрипции. Как здесь описано, могут быть использованы также дополнительные факторы, необходимые или полезные в отношении эффективности экспрессии. ДНК, кодирующую полипептид, встраивают в ДНК-конструкции, способные к внедрению и к экспрессии в клеточной культуре in vitro. В частности, ДНК-конструкции являются подходящими для репликации в организме прокариотического хозяина, такого как бактерии, например, E. coli, или могут быть встроены в культуру клеток млекопитающих, растений, насекомых, например, Sf9, дрожжей, грибов или других эукариотических клеточных линий.
ДНК-конструкции, полученные для их встраивания в организм конкретного хозяина, обычно включают в себя систему репликации, распознаваемую хозяином, предполагаемый для использования сегмент ДНК, кодирующий требуемый полипептид, и регуляторные последовательности инициации и терминации транскрипции и трансляции, оперативно связанные с полипептид-кодирующим сегментом. Сегмент ДНК является "оперативно связанным", когда он находится в функциональной взаимосвязи с другим сегментом ДНК. Например, промотор или энхансер оперативно связан с кодирующей последовательностью, если он стимулирует транскрипцию с данной последовательностью. ДНК для сигнальной последовательности оперативно связана с ДНК, кодирующей полипептид, если она экспрессируется в виде пре-белка, который участвует в секреции указанного полипептида. Обычно последовательности ДНК, которые оперативно связаны, являются непрерывными, а в случае с сигнальной последовательностью как непрерывными, так и в фазе считывания. Однако энхансеры необязательно должны быть смежными с кодирующими последовательностями, транскрипцию которых они контролируют. Связывание достигается лигированием в соответствующих сайтах рестрикции или по адаптерам или линкерам, встроенным вместо них.
Выбор соответствующей промоторной последовательности обычно зависит от хозяйской клетки, выбранной для экспрессии сегмента ДНК. Примеры подходящих промоторных последовательностей включают в себя прокариотические и эукариотические промоторы, хорошо известные в данной области (см., например, Sambrook and Russell, 2001, выше). Транскрипционные регуляторные последовательности обычно включают в себя гетерологичный энхансер или промотор, который распознается хозяином. Выбор соответствующего промотора зависит от хозяина, но промоторы, такие как trp, lac и фаговые промоторы, промоторы тРНК и промоторы гликолитических ферментов, известны и доступны (см., например, Sambrook and Russell, 2001, выше). Экспрессирующие векторы, включающие в себя систему репликации и регуляторные последовательности транскрипции и трансляции, вместе с сайтом инсерции для сегмента, кодирующего полипептид, могут быть использованы. Примеры подходящих комбинаций клеточных линий и экспрессирующих векторов описаны у Sambrook and Russell (2001, выше) и у Metzger с соавт., (1988) Nature 334: 31-36. Например, подходящие экспрессирующие векторы могут быть экспрессированы в дрожжах, например, S. cerevisiae, например, в клетках насекомых, например, клетки Sf9, в клетках млекопитающих, например, клетки CHO, и в бактериальных клетках, например, E. coli. Поскольку у прокариот нет органелл, необходимых для гликозилирования, полипептиды, продуцируемые прокариотами, не будут иметь углеводных боковых цепей. Эукариоты имеют аппарат гликозилирования, но в дрожжевых клетках реализуется другой характер гликозилирования, нежели в клетках млекопитающих. Следовательно, предпочтительно использовать экспрессирующую систему, которая дает наиболее "естественный" характер гликозилирования. В этом отношении клетки млекопитающих являются наиболее предпочтительными. Клеточные линии, имеющие аппарат гликозилирования, сходный с таковым у человека, может быть особенно полезен, поскольку предполагается, что антигены согласно настоящему изобретению, имеющие характер гликозилирования, сходный с таковым соответствующего гликополипептида блестящей оболочки человека, может обладать повышенной иммуногенностью. Подходящие клеточные линии включают в себя клетки CHO, см., например, патент США No. 5272070, и, в частности, линии клеток яичника или фолликул человека, ср. WO 99/42581.
In vitro мутагенез и экспрессия мутантных белков в общем описаны у Ausubel с соавт. (1987, выше) и у Sambrook и Russell (2001, выше). См. также Kunkel (1985, выше; где описан сайт-направленный мутагенез), а также Roberts с соавт. (1987, выше; где описан кассетный мутагенез).
Другим способом получения описанных здесь иммуногенных полипептидов является использование системы транскрипции/трансляции in vitro. ДНК, кодирующую полипептид, клонируют в экспрессирующий вектор, как было описано выше. Затем экспрессирующий вектор подвергается транскрипции, и транслируется in vitro. Продукт трансляции может быть использован напрямую или же может быть сначала очищен. Полипептиды, полученные в результате трансляции in vitro, обычно не содержат посттрансляционные модификации, присутствующие на полипептидах, синтезируемых in vivo, хотя и в силу наследуемого наличия микросом некоторые посттрансляционные модификации могут появляться. Способы синтеза полипептидов путем трансляции in vitro описаны, например, в публикации Berger & Kimmel, Methods in Enzymology, Volume 152, Guide to Molecular Cloning Techniques, Academic Press, Inc., San Diego, CA, 1987 (в полном объеме включенной в настоящее описание в виде ссылки).
Таким образом, следующий аспект настоящего изобретения связан с хозяином, содержащим вектор, как определено выше. Хозяйские клетки могут быть прокариотическими или эукариотическими хозяйскими клетками, как указано выше. Хозяйская клетка может быть такой хозяйской клеткой, которая является подходящей для культивирования в жидкой или на твердой среде. Альтернативно, хозяйская клетка является клеткой, которая является частью многоклеточного организма, такого как трансгенное растение или животное, предпочтительно, животное, отличное от человека.
Следующий аспект настоящего изобретения связан со способом продуцирования иммуногенного полипептида согласно изобретению, как определено выше. Указанный способ включает в себя стадию культивирования хозяйской клетки, как определено выше, в условиях, способствующих экспрессии указанного полипептида. Необязательно, чтобы способ включал в себя стадию извлечения полипептида. Полипептид может быть, например, восстановлен из культуральной среды с помощью стандартных технологий очистки белка, включая различные хроматографические методы, как таковые известные в данной области.
Другой аспект настоящего изобретения связан с трансгенным животным, содержащим в своих соматических и гаметах вектор, как определено выше. Предпочтительно, чтобы такое трансгенное животное не являлось человеком. Способы получения трансгенных животных описаны, например, в документе WO 01/57079, а также в цитируемых здесь ссылках. Такие трансгенные животные могут быть использованы в способе продуцирования полипептида, как определено выше, при этом указанный способ включает в себя стадию получения жидкости из организма трансгенного животного, содержащего указанный вектор, или его потомка женского рода, причем жидкость организма содержит указанный полипептид, и, необязательно, выделение полипептида из жидкости организма. Такие способы описаны в документе WO 01/57079 и в цитируемых здесь ссылках. Жидкостью организма, содержащей указанный полипептид, предпочтительно является кровь или, более предпочтительно, молоко.
Еще один аспект настоящего изобретения связан с трансгенным растением, содержащим в своих клетках вектор, как определено выше. Способы получения трансгенных растений описаны, например, в патенте США 6359196 и в цитируемых здесь ссылках. Такие трансгенные растения могут быть использованы в способе получения полипептида, как определено выше, где указанный способ включает в себя стадию получения части трансгенного растения, содержащей в своих клетках указанный вектор, или части потомка женского рода такого трансгенного растения, в силу чего указанная часть растения содержит указанный полипептид, и, необязательно, выделение полипептида из указанной части растения. Такие способы описаны также в патенте США 6359196 и в цитируемых здесь ссылках.
Далее настоящее изобретение проиллюстрировано в следующих примерах, которые никоим образом не предусматривают ограничение объема, охватываемого настоящим изобретением.
ПРИМЕРЫ
Эксперимент 1: экспрессия ZP3 в образцах карциномы предстательной железы человека
Экспрессию ZP3 в опухолевой ткани предстательной железы человека определяли с использованием иммуногистохимических методов. Образцы из опухолевых тканей предстательной железы, полученные у разных пациентов, были доставлены из института патологии в Нидерландах. В общей сложности 16 образцов карцином предстательной железы человека и 6 других образцов опухоли предстательной железы из разных других источников окрашивали на предмет обнаружения ZP3 (IHC & IF), альфа-метил-CoA-рацемазы AMACR (IHC-маркер карциномы предстательной железы, присутствующий в 85% всех образцов рака предстательной железы, окрашенных на предмет его определения) и цитокератина 5/6 (для базальных клеток).
Иммуногистохимические определения производили с использованием человеческих антител против ZP3, кроличьих поликлональных антител против человеческих рекомбинантных ZP3 и козьих поликлональных антител.
Образцы нормальной ткани предстательной железы служили в качестве контроля. Незрелые ооциты, собранные из антральных фолликулов после стимуляции яичников для экстракорпорального оплодотворения (IVF), окрашивали в качестве положительных контролей. Кроме того, в качестве отрицательного контроля были использованы образцы тканей нормальной печени и нормального яичка.
Следующий IHC-протокол был использован для всех образцов День 1
1. Инкубация срезов при 57°C в течение 30 мин.
2. Депарафинизация и гидратация:
a) Ксилен - 2×5 мин,
b) Abs. EtOH - 2×5 мин,
c) 96% EtOH - 2×5 мин,
d) 70% EtOH - 2×5 мин, e) 50% EtOH - 2×5 мин,
f) dH2O - 1×5 мин, g) PBS - 1×5 мин.
3. Извлечение антигена:
a) 10 мМ натрий-цитратный буфер (pH 6,0) в микроволновой печи в течение 15 мин, b) охлаждение в течение 15-20 мин,
c) PBS - 3×5 мин.
4. Блокирование эндогенной пероксидазы (при комнатной температуре (RT), в темноте, 3% H2O2 в метаноле - рекомендованные 10 мин для парафиновых срезов)
5. PBS - 3×5 мин.
6. Блокирование - 15% NGS в TPBS - 90 мин (при комнатной температуре (RT), в темной/увлажняемой камере.
7. Первичное антитело 1:250 с 5% NGS в TPBS - в течение ночи/в холодной комнате/в увлажняемой камере.
В качестве положительного контроля (яичник дикого типа (WT)) использовали разведение первичного антитела 1:600. Для опухолевых срезов использовали более концентрированное антитело - 1:250.
День 2
8. PBS - 3×5 мин.
9. Вторичное антитело - козье антикроличье (1:1000) с 5% NGS в TPBS - 90 мин (комнатная температура /увлажняемая камера).
10. PBS - 3×5 мин.
11. Инкубация с ABC-реагентом, разведенным 1:50 в PBS (60 мин/при комнатной температуре (RT), в темной/увлажняемой камере).
12. PBS - 3×5 мин.
13. DBA.
14. Вода - 2×5 мин.
15. Гематоксилин - 60 сек.
16. Вода - 2×5 мин.
17. Дегидратация:
a) 50% EtOH - 2×5 мин.
b) 70% EtOH - 2×5 мин.
c) 96% EtOH - 2×5мин.
d) Абс. EtOH - 2×5 мин.
e) Ксилен - 2×5 мин (ультрачистый)
18. Подготовка препаратов с использованием DPX.
Клетки (50000) каждый раз высевали на покрытых стеклах (которые обычно используются для IHC). Через 24 ч или менее (в зависимости от конкретной клеточной линии) клетки промывали в PBS, и фиксировали в 4% PFA (15 мин). Затем клетки вновь промывали в PBS (3×5 мин). После промывания аутофлуоресценцию блокировали с помощью 100 мМ NH4Cl (3 мин при комнатной температуре). На следующей стадии использовали 15% NGS в комбинации с 5% BSA, в PBS с 0,1% Triton X-100 (90 мин/при комнатной температуре /в увлажняемой камере). Первичное антитело разводили 1:200 (можно и выше) в 5% NGS в T-PBS в течение ночи/в холодной комнате/в увлажняемой камере). После инкубации с первичным антителом клетки промывали (3×5 мин, T-PBS) и инкубировали с вторичным антителом AlexaFluor 594 (козье антикроличье антитело), разбавленным 1:100 (90 мин/при комнатной температуре /в увлажняемой камере). Конечные клетки промывали (3×5 мин; PBS) и осуществляли контрастное окрашивание (DAPI-Ultra Cruz).
Растворы и реагенты
- Ксилен (или Histoclear)
- Этанол
- Дистиллированная H2O
- Гематоксилин
- 10X PBS (забуференный фосфатом физиологический раствор):
- 0,58 M двухосновный фосфат натрия (Na2HPO4), 0,17 M одноосновный фосфат натрия (NaH2PO4), 0,68 M NaCl. Для получения 1 литра 10X PBS: объединяли 82,33 г Na2HPO4*4H2O, 23,45 г NaH2PO4*H2O и 40 г NaCl. pH доводили до 7,4.
- 10 мМ натрий-цитратный буфер:
Для приготовления 1 литра, к 1 литру dH2O добавляли 2,94 г цитрата натрия. pH доводили до 6,0
- буфер 1% перекиси водорода (окисляющей):
На 50 мл: 15 мкл Triton-X, 10 мл метанола, 40 мл 1% H2O2 (конечн. конц.)
- Блокирующий раствор:
10% FBS и 10% БСА в PBS
- Реагент ABC (Набор Vectastain ABC, Vector laboratories, Inc., Burlingame, CA):
Приготавливают в соответствии с инструкциями изготовителя за 30 минут до употребления.
- Реагент DAB:
Используют в соответствии с инструкциями изготовителя.
В образцах положительного контроля антитела обнаруживались белки в окрестности ZP ооцитов человека (результаты не показаны). Белки ZP3 также присутствовали в цитоплазме ооцита. Когда опускали стадию инкубации с первичным антителом, отсутствовало положительное окрашивание на срезах в образцах опухолевой ткани предстательной железы (результаты не представлены). Не обнаруживали положительного окрашивания никаким из ZP-антител ни в ткани печени (результаты не приведены), ни в ткани нормальной предстательной железы, ни в нормальной ткани яичек человека (фигуры 3C и 3D, соответственно).
В образцах опухолей предстательной железы присутствие ZP3 подтверждается зонами положительного окрашивания ткани на ZP3, с варьирующими интенсивностями в образцах, полученных у разных пациентов (фигуры 3A и 3B).
В итоге в случае карциномы предстательной железы ZP3-положительное окрашивание четко коррелировало с маркером видов рака предстательной железы альфа-метил-CoA-рацемазой (AMACR).
Указанные опухоли, положительно окрашивающиеся на предмет экспрессии ZP3, можно лечить, в соответствии с настоящим изобретением, путем иммунизации ZP3-антигенами.
Пример 2: экспрессия ZP3 в клеточной линии рака предстательной железы человека (PC-)
Экспрессия белка 3 блестящей оболочки (Zona Pellucida) (ZP3) линией клеток рака предстательной железы человека (PC-) и раком предстательной железы была продемонстрирована на уровне мРНК (A) и на белковом уровне (B) с помощью стандартных технологий ОТ-ПР и вестерн-блот-электрофореза. Как и ожидалось, были получены одиночные полосы продукта ОТ-ПР (183 п.н.) и вестерн-блот-электрофореза (55 кДа) (фигуры 4A и B). Тотальные мРНК и белок из нормального яичника (hOV) и яичка (hTE) человека использовали, соответственно, в качестве положительного и отрицательного контроля.
Цитоплазматическая локализация ZP3 была продемонстрирована в клетках PC-3 (фигура 5A) методом иммунофлуоресцентной визуализации с использованием козьего антикроличьего IgG-Alexa Flour 594 (красн).
Скрининг тотальных мРНК из образцов видов рака предстательной железы, оцениваемых, по системе оценки Глисона, как 6-9 (n=10), путем ОТ-ПЦР подтвердил наличие ДНК-продуктов (183 п.н.), эквивалентных фрагменту ZP3 (фигура 6). Кроме того, образцы предстательной железы проверяли на наличие экспрессии андрогенных рецепторов (AR) и рецепторов лютеинизирующего гормона-рилизинг-гормона (LHR), которое остается важным фактором в развитии (AR) и прогрессии (AR и LHR) рака предстательной железы (Heinlein and Chang7; Pinski et al.8).
Описание графического материала
Фигура 1: гистология (HE) аденокарциномы предстательной железы человека (A, B), нормальной предстательной железы (C) и нормального яичка человека (D). Раковые узлы показаны стрелками.
Фигура 2: двойное иммуногистохимическое окрашивание, на α- метилацил-коэнзим A-рацемазу (AMACR (красн.)) и цитокератин 5/6 (CK5/6 (коричн.)) в аденокарциноме предстательной железы человека (A, B), в нормальной предстательной железе (C) и в нормальном яичке человека (D). Двойное иммуноокрашивание было предпринято в качестве дополнительных маркеров в гистологическом анализе для точной оценки образцов предстательной железы (Trpkov et al.9). В цитоплазме секреторных эпителиальных клетках карциномы предстательных желез было продемонстрировано четкое круговое периферическое мелкозернистое окрашивание красным на AMACR (A, B, стрелки) и отрицательное в отношении CK5/6 (положительное в отношении базальных эпителиальных клеток нормальной предстательной железы). Типичное темно-коричневое окрашивание CK5/6 базальных клеток наблюдали в нормальном эпителии предстательной железы, который является отрицательным в отношении AMACR (L). Срезы яичка человека, используемые в качестве отрицательного контроля при двойном иммуноокрашивании, оставались отрицательными как в отношении AMACR, так и в отношении CK5/6 (D).
Фигура 3: иммуногистологическое ZP3-окрашивание (коричн.) в аденокарциноме предстательной железы человека (A, B), в нормальной предстательной железе (C) и в нормальном яичке человека (D). Положительное и специфическое цитоплазматическое окрашивание в отношении ZP3 в раковой ткани/узлах карциномы предстательной железы, положительно окрашивающейся в отношении AMACR и отрицательно - в отношении CK5/6 (A, B). Нормальная предстательная железа человека не окрашивалась ни в отношении ZP3, ни в отношении AMACR, в отличие от CK5/6 (C). Срезы яичка человека были отрицательны в отношении окрашивания ZP3 (D).
Фигура 4: Экспрессия белка 3 (ZP3) блестящей оболочки в клеточной линии (PC-) рака предстательной железы человека и в раке предстательной железы на уровне мРНК (A) и белка (B).
Фигура 5: Иммунофлуоресцентная визуализация цитоплазматической локализации ZP3 в клетках PC-3.
Фигура 6: тотальные мРНК из образцов видов рака предстательной железы, оцениваемые по системе Глисона как 6-9 (n=10), полученные путем ОТ-ПЦР с целью определения наличия ZP3, андрогенного рецептора (AR) и рецептора лютеинизирующего гормона-рилизинг-гормона (LHR).
ЦИТИРУЕМАЯ ЛИТЕРАТУРА
1. Parker, K. C, M. A. Bednarek, and J. E. Coligan. 1994. Scheme for ranking potential HLA-A2 binding peptides based on independent binding of individual peptide side-chains. J. Immunol. 152: 163. HLA BIND
(http://bimas.cit.nih.gov/molbio/hla_bind/).
2. Rammensee, Friede, Stevanovic, MHC ligands and peptide motifs: 1st listing, Immunogenetics 41, 178-228, 1995; SYFPEITHI (http://www.syfeithi.de/) and Rammensee, Bachmann, Stevanovic: MHC ligands and peptide motifs. Landes Bioscience 1997 (International distributor - except North America: Springer Verlag GmbH & Co. KG, Tiergartenstr. 17, D-69121 Heidelberg.
3. Buus S, Lauemoller SL, Worning P, Kesmir C, Frimurer T, Corbet S, Fomsgaard A, Hilden J, Holm A, Brunak S. Sensitive quantitative predictions of peptide-MHC binding by a 'Query by Committee' artificial neural network approach, in Tissue Antigens, 62: 378-84, 2003; NetMHC (http://www.cbs.dtu.dk/services/NetMHC/).
4. Nielsen M, Lundegaard C, Worning P, Lauemoller SL, Lamberth K, Buus S, Brunak S, Lund O., Reliable prediction of T-cell epitopes using neural networks with novel sequence representations. Protein Sci., 12: 1007-17, 2003.
5. Improved prediction of MHC class I and class II epitopes using a novel Gibbs sampling approach, Nielsen M, Lundegaard C, Worning P, Hvid CS, Lamberth K, Buus S, Brunak S, Lund O., Bioinformatics, 20(9): 1388-97, 2004.
6. Sturniolo, T. et al., Nature Biotechnology 17, 555-562, 1999, Generation of tissue-specific and promiscuous HLA ligand databases using DNA chips and virtual HLA class II matrices; TEPITOPE (http://www.vaccinome.com/pages/597444/).
7. Heinlein CA, Chang C. Androgen receptor in prostate cancer. Endocr Rev. 2004, 25(2): 276-308.
8. Pinski J, Xiong S, Wang Q, Stanczyk F, Hawes D, Liu SV. Effect of luteinizing hormone on the steroidogenic pathway in prostate cancer. Prostate. 2011, 71(8): 892-8.
9. Trpkov K, Bartczak-McKay J, Yilmaz A. Usefulness of cytokeratin 5/6 and AMACR applied as double sequential immunostains for diagnostic assessment of problematic prostate specimens. Am. J. Clin. Pathol. 2009; 132(2): 211-20.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИДЫ CDC45L И ВАКЦИНЫ, ВКЛЮЧАЮЩИЕ ТАКОВЫЕ | 2010 |
|
RU2562160C2 |
| МОДИФИЦИРОВАННЫЕ ПЕПТИДЫ MELK И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2011 |
|
RU2580035C2 |
| ИММУНОТЕРАПЕВТИЧЕСКИЙ СПОСОБ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ РАКА ЛЕГКИХ | 2018 |
|
RU2793972C2 |
| ВЫДЕЛЕННЫЙ ОПУХОЛЕВЫЙ ПОЛИПЕПТИД ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ И КОДИРУЮЩИЙ ЕГО ПОЛИНУКЛЕОТИД | 1999 |
|
RU2234942C2 |
| НЕОАНТИГЕННЫЕ КОМПОЗИЦИИ И ИХ ИСПОЛЬЗОВАНИЕ | 2020 |
|
RU2832574C2 |
| РЕЖИМЫ ПРАЙМ-БУСТ, ВКЛЮЧАЮЩИЕ ВВЕДЕНИЕ ПО МЕНЬШЕЙ МЕРЕ ОДНОЙ КОНСТРУКЦИИ мРНК | 2016 |
|
RU2742993C2 |
| КОМПОЗИЦИИ И СПОСОБЫ НАПРАВЛЕННОГО УСТРАНЕНИЯ МУТАЦИОННОГО УСКОЛЬЗАНИЯ В НАПРАВЛЕННОЙ ТЕРАПИИ РАКА | 2008 |
|
RU2505313C2 |
| CDCA1 ЭПИТОП-ПЕПТИДЫ И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2009 |
|
RU2502740C2 |
| ЭПИТОПНЫЕ ПЕПТИДЫ RAB6KIFL/KIF20A И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2009 |
|
RU2532105C2 |
| СОЧЕТАНИЕ РЕКОМБИНАНТНОЙ МИКРОБАКТЕРИИ И БИОЛОГИЧЕСКИ АКТИВНОГО СРЕДСТВА В КАЧЕСТВЕ ВАКЦИНЫ | 2005 |
|
RU2495677C2 |

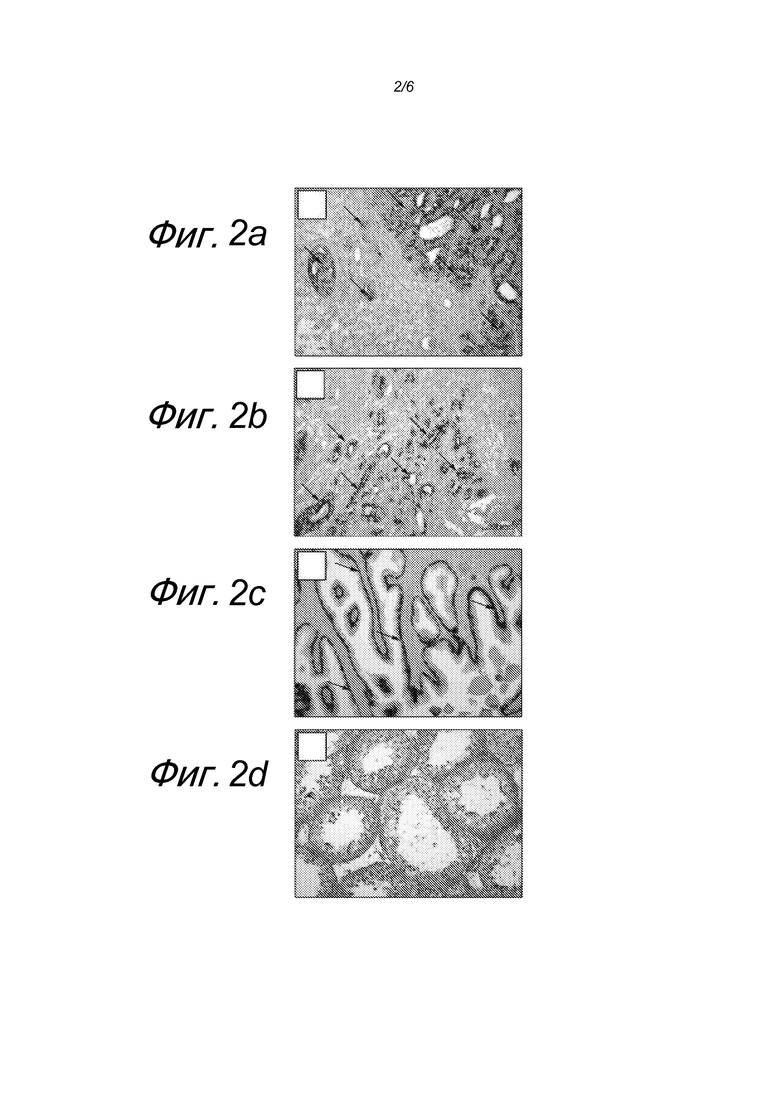


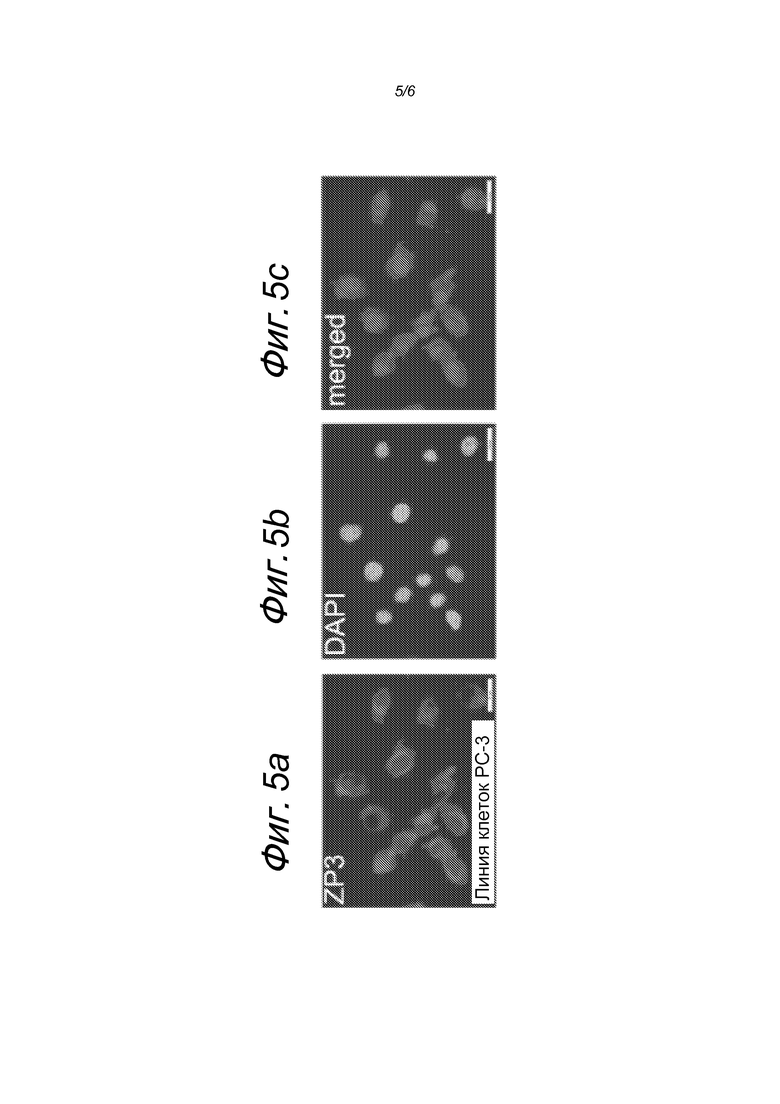
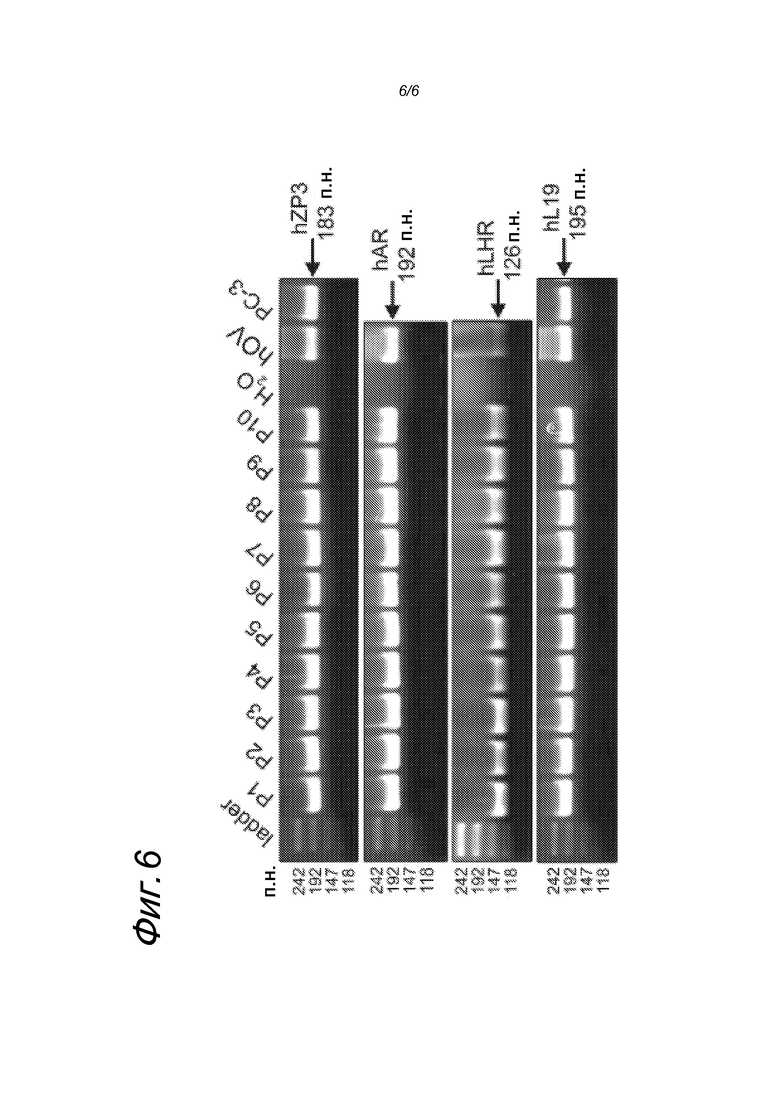








Настоящее изобретение относится к медицине, а именно онкологии, и может быть использовано для лечения рака предстательной железы. Для этого источник полипептида, содержащего ограниченный классом I МНС- и/или классом II МНС Т-клеточный эпитоп нативной блестящей оболочки (zona pellucida) 3 (ZP3) используют для изготовления лекарственного средства для лечения рака предстательной железы. Использование данного изобретения позволяет проводить иммунотерапию с использованием опухоль-ассоциированных антигенов у пациентов, страдающих раком предстательной железы, у которых раковые клетки предстательной железы экспрессируют ZP3. 13 з.п. ф-лы, 6 ил., 2 пр.
1. Применение источника полипептида, содержащего ограниченный классом I МНС- и/или классом II МНС Т-клеточный эпитоп нативной блестящей оболочки (zona pellucida) 3 (ZP3) для изготовления лекарственного средства для применения в способе терапевтического и/или профилактического лечения рака предстательной железы и/или его метастазов у человека.
2. Применение по п. 1, при котором указанный способ лечения является способом терапевтического воздействия.
3. Применение по п. 1, при котором указанный способ лечения является способом предотвращения метастазов и/или рецидива рака предстательной железы.
4. Применение по п. 3, при котором указанный способ комбинируют с хирургией, криохирургией, лучевой терапией, включая брахитерапию и дистанционную лучевую терапию, высокоинтенсивное сфокусированное ультразвуковое воздействие (HIFU), гормональную терапию или химиотерапию, или же их комбинацию.
5. Применение по п. 1, при котором указанный источник полипептида содержит эффективное количество иммуногенного полипептида, выбранного из hZP3 и его иммунологически активных фрагментов.
6. Применение по п. 5, при котором hZP3 содержит полипептидный остов внесенной в протокол последовательности SEQ ID NO. 3 или ее аллельного варианта, предпочтительно, аллельного варианта, полученного в результате однонуклеотидного полиморфизма.
7. Применение по п. 6, где hZP3 получают, используя рекомбинантные технологии.
8. Применение по п. 1, где используют эффективное количество иммуногенных полипептидных фрагментов, при этом указанные полипептидные фрагменты выбраны из белковых фрагментов блестящей оболочки 3 (ZP3), предпочтительно, фрагментов hZP3, причем фрагменты насчитывают в длину от 18 до 45 аминокислот.
9. Применение по п. 1, где используют эффективное количество одного или нескольких различных иммуногенных полипептидов, вместе включающих в себя по меньшей мере 50%, более предпочтительно, по меньшей мере 70% связывающихся эпитопов, ограниченных молекулами МНС класса I и МНС класса II и содержащихся в нативном ZP3-гликопротеине.
10. Применение по п. 1, где используют эффективное количество иммуногенного полипептида, включающего в себя по меньшей мере 50%, более предпочтительно, по меньшей мере 70% полного аминокислотного остова гликопротеина ZP3, предпочтительно, hZP3.
11. Применение по п. 1, где используют эффективное количество множества различных перекрывающихся полипептидных фрагментов гликопротеина ZP3, предпочтительно, hZP3, при этом указанные различные перекрывающиеся полипептидные фрагменты насчитывают в длину от 18 до 60 аминокислот, и которые вместе содержат по меньшей мере 50%, более предпочтительно, по меньшей мере 70% полного аминокислотного остова указанного гликопротеина ZP; гомологов указанных полипептидных фрагментов; или одной или нескольких последовательностей нуклеиновых кислот, кодирующих указанные полипептидные фрагменты или их гомологи.
12. Применение по любому из предшествующих пунктов, при котором указанный полипептид является гликозилированным.
13. Применение по п. 12, при котором указанный полипептид имеет характер гликозилирования, который сходен с таковым соответствующего нативного гликопротеина ZP3 или его фрагмента.
14. Применение по п. 1, при котором указанный способ включает в себя введение, предпочтительно, совместное введение, по меньшей мере одного адъюванта.
| WO 2007058536 A1, 24.05.2007 | |||
| ИМПУЛЬСНЫЙ ГЕНЕРАТОР ДЛЯ ЭЛЕКТРОЛОВА РЫБЫ | 0 |
|
SU212330A1 |
| Bukovsky A | |||
| et al.Production of monoclonal antibodies against recombinant human zona pellucida glycoproteins: utility in immunolocalization of respective zona proteins in ovarian follicles // J Reprod Immunol | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2016-06-10—Публикация
2011-08-29—Подача