Техническая область
Изобретение относится к нерасфасованной лекарственной форме Карримицина (Carrimycin) и его лекарственным препаратам, конкретно говоря, относится к макролидным антибиотикам в генной инженерии, а именно лекарственные средства левовращающего Карримицина (Carrimycin), их способу приготовления и их употреблению в приготовлении лечебных и профилактических средств против инфекционных заболеваний.
Техническая среда
Карримицин (Carrimycin) - дериват спирамицина нового поколения, разработанный с помощью генной инженерии, носил первоначальное название «Biotechspiramycin», также биотехмицин (Biotechmycin) [Номер патента: ZL97104440.6]. Согласно «Принципу выбора названий лекарственных препаратов Китая» в результате технической проверки и изучения Государственной фармакопейной комиссией Китая было принято решение переименовать Biotechspiramycin в Карримицин (Carrimycin), название на английском языке «Carrimycin».
Карримицин (Carrimycin) является продуктом сбраживания в генной инженерии, с точки зрения химической структуры его основным составом является 4′′-изовалерил-спирамицин, включающий 4′′-изовалерил-спирамицины I, II, III, кроме этого, Карримицин (Carrimycin) содержит и примерно 6 видов спирамицинов с ацилированной 4-оксигруппой, поэтому он носит общее химическое название 4′′-ацилированный спирамицин».
Химическая структура основного состава Карримицин (Carrimycin) показана на (I):
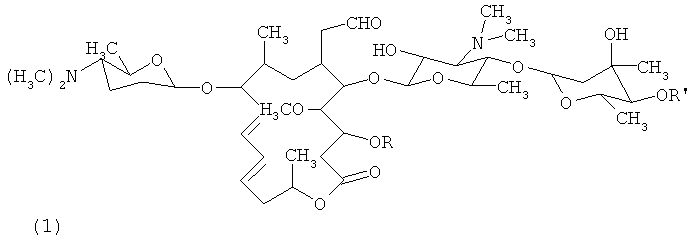
В том числе:
Карримицин (Carrimycin) представляет собой шестнадцатичленные макролидные антибиотики, механизм действия заключается в сочетании с тельцем Паладе бактерий для ингибирования синтеза белков.
Результаты теста in vitro показали, что Карримицин (Carrimycin) хорошо воздействует на грамм-положительные бактерии, особенно некоторые лекарственно-устойчивые микробы (к примеру, золотистый стафилококк, стойкий к β-лактаму, золотистый стафилококк, стойкий к эритромицину и т.д.), не имеет заметной перекрестной устойчивости к подобным лекарственным средствам. Тем временем, обладает хорошей антибактериальной активностью в отношении микоплазмы и хламидии, части грамм-отрицательных бактерий, обладает благоприятной антибактериальной активностью и проницаемостью тканей в отношении токсоплазм, легионеллы, а также потенциальной иммунологической регуляцией. Антибактериальная активность внутри организма превосходит активность вне организма (ZL200310122420.9). Клинические исследования показали, что прием таблеток Карримицин (Carrimycin) в течение 5-7 дней по 0,2 мг - 0,4 мг в день, дает положительные эффекты в лечении острого бактериального фарингита и острого гнойного тонзиллита, вызванного streptococcus pyogenes; бактериального хронического синусита и острого бронхита, вызванного сенситивными бактериями; не сильной пневмонии, вызванной пневмококком, гемофильной палочкой и микоплазмой пневмония; негонококкового уретрита, вызванного микоплазмой, хламидией; инфекции кожи и мягких тканей, периодонтита, тимпанита и других инфекционных болезней, вызванных сенситивными бактериями. Общий коэффициент полезного действия составляет 92,68%, Карримицин (Carrimycin) безопасен и эффективен.
Результаты фармакокинетических исследований показали, что в Карримицине (Carrimycin) самыми активными составами являются изовалерил-спирамицины I, II, III. После поступления в организм Карримицин (Carrimycin) быстро метаболирует с образованием спирамицина, расчет суммы AUC0-t материнских средств изовалерил-спирамицинов I, II, III и активных метаболитов - спирамицинов I, II, III показал, что при пероральном применении абсолютная биодоступность составляет в среднем 91,6%. По источникам, абсолютная биодоступность спирамицина при пероральном применении для человека составляет в пределах 30-40% (Frydman AM et al JAntimicrob Chemother. 1988, 22 (suppl B): 93-103). Чем доказано, что структура изовалерил-спирамицина в значительной степени улучшила биологическую доступность активного вещества - спирамицина. Разовый прием Карримицина (Carrimycin) медленно дает эффект, Т1/2β в пределах 23-27 ч.
В результате исследования эффективных составов Карримицина (Carrimycin) было обнаружено, что в молекулярной структуре самого активного состава Карримицина (Carrimycin) - изовалерил-спирамицина I, II, III существует несколько хиральных атомов углеводорода. Хиральность (Chirality) - основное свойство трехмерных предметов, является одним из основных свойств природы. В качестве важной основы жизненной деятельности, почти все биологические макромолекулы, как протеин, полисахарид, нуклеиновая кислота, ферменты и т.д., хиральные, и эти макромолекулы, как правило, исполняют важную физиологическую функцию внутри тела. Под хиральными лекарствами (chiral drug) понимаются пары оптических антиподов, являющихся зеркальными отражениями друг друга и полученных после ввода хирального центра в молекулярную структуру лекарства.
Эти оптические антиподы обладают принципиально аналогичными физико-химическими свойствами, отличаются только оптической активностью, откуда и выделились R (правовращающие) или S (левовращающие), рацемические.
За последние 20 лет углубленные изучения в фармации доказали различную стереоспецифичность (stereoselectivity) антиподов лекарственных веществ, они имеют различный аффинитет с рецепторами, в результате чего сильно отличаются фармакологические свойства.
Антиподы хиральных лекарств, имеющие повышенную активность, называют оптимальными антиподами (Eutomer); а антиподы, имеющие низкую активность или не имеющие активности, называют неактивными антиподами (Distomer).
В большинстве случаев, неактивные антиподы не дают эффективности, но они еще частично нейтрализуют эффективность оптимальных антиподов, иногда даже вызывают серьезные токсичные и побочные реакции, что доказало сложность в разнице эф4)ективности лекарственных средств и значительное отличие терапевтического индекса антипода одного антипода от его рацемата, как всем известно, что терапевтическая эффективность синтомицина DL-(+-) составляет только половину хлорамфеникола D(-); а активность L -изомера пропранолола (propranolol) в 100 раз больше чем D-изомер; (-) метадон представляет собой сильное болеутоляющее средство, а (+) не действующее.
Сильно отличается и токсичность, например, оба антипода талидомида (thalidomide) обладают аналогичным успокаивающим действием в отношении мышей, но только S(-) изомер и его метаболит обладают зародышевой токсичностью и тератогенезом; кетамин -широкораспространенные наркотические и болеутоляющие средства, но они дают галлюцинацию и другие побочные действия. Изучения показали, что S(+) дает эффект в 3-4 раза больше R(-), а токсичные и побочные действия явно связаны с последним.
Значительное различие в терапевтической эффективности хиральных лекарств стимулировало развитию работ по разработке, разделению и анализу хиральных лекарств.
Применение техники «Хиральность» позволило удалять из лекарственных средств антиподы, не дающие эффекта или имеющие токсичные и побочные действия, производить чистые хиральные лекарственные вещества, имеющие структуру с одним направлением, что позволило повышать чистоту состава препарата, быстро проявлять терапевтическую эффективность и сокращать курс лечения.
В связи с этим, разработка хиральных лекарств стала одним из новых направлений в разработке новых лекарственных средств мира. Правительства и крупные фармацевтические фирмы разных стран начали вносить большие средства в разработку хиральных лекарственных препаратов, хирального сырья и хиральных интермедиатов, чтобы завоевать фармацевтический рынок мира хиральных лекарственных веществ.
Более того, с непрерывным улучшением хиральной технологии и быстрым распространением жидкостной хроматографии была продвинута работа по разделению, анализу и определению антиподов хиральных лекарств. Хиральные моноэнантиомерные средства получили широкое применение.
В отношении вопроса, обладает ли Карримицин (Carrimycin) оптической активностью, изобретателями был проведен ряд исследований, им было приятно обнаружить, что путем регулирования и оптимизирования условий культивирования и сбраживания получали Карримицин (Carrimycin), который обладает оптической активностью и лучшей противоинфекционной активностью. Ввиду этого, изобретение относится к левовращающему Карримицину (Carrimycin), способу его приготовления, а также его употреблению в приготовлении лечебных и профилактических средств против инфекционных заболеваний.
Общее описание изобретения
Первый объект изобретения относится к левовращающему Карримицину (Carrimycin), который имеет оптическую активность и также отличную противоинфекционную активность.
Второй объект изобретения относится к лекарственной комбинации левовращающего Карримицина (Carrimycin), содержащей левовращающий Карримицин (Carrimycin) с оптической активностью и фармацевтически приемлемые носители.
Третьим объектом изобретения является способ приготовления левовращающего Карримицина (Carrimycin), отличающийся упрощенной технологией производства, удобством контролировать критерий качества. Приготовленный левовращающий Карримицин (Carrimycin) обладает отличной эффективностью, оптической активностью, а также отличной противоинфекционной активностью.
Четвертым объектом изобретения является употребление указанного левовращающего Карримицина (Carrimycin) и лекарственной комбинации левовращающего Карримицина (Carrimycin) в приготовлении лечебных и/или профилактических средств против инфекционных заболеваний, левовращающий Карримицин (Carrimycin) и его лекарственные комбинации высокоэффективны в отношении бактерий, хламидии и микоплазмы, могут использоваться для лечения инфекционных заболеваний.
Для осуществления первого объекта изобретения приняли следующие технические решения:
Левовращающий Карримицин (Carrimycin), отличающийся тем, что он является смесью изовалерил-спирамицинов III, II и I, содержит определенное количество изобутилил-спирамицинов III, II, бутирилспирамицинов III, II, пропионил-спирамицинов III, II и ацетилспирамицинов III, II, в т.ч. содержание изовалерил-спирамицина III не ниже 30% (масс.), общее содержание изовалерил-спирамицинов III, II, I не ниже 60% (масс.), содержание ацилированного спирамицина 80-98% (масс.), предпочтительно 85-98% (масс.), более предпочтительно 90-98% (масс.), еще более предпочтительно 95-98% (масс.); удельная постоянная вращения левовращающего Карримицина (Carrimycin) в хлороформном растворе составляет [α]D-52°~ -57° при 25°С и 0,02 г/мл, предпочтительно -54°~ -56°, более предпочтительно -55°.
Изобретатели проводили многочисленные исследования о Карримицине (Carrimycin), регулировали и оптимизировали условия культивирования и сбраживания, особенно регулировали уровень pH в процессе сбраживания с помощью средства для регулирования уровня pH, чтобы зависимость уровня pH от времени в процессе сбраживания показывала три непрерывных этапа, и каждый из этапов удовлетворял определенному уравнению, таким образом, получали левовращающий Карримицин (Carrimycin) с оптической активностью. Это может объясняться либо изменением содержания составов с оптической активностью в таких условиях культивирования и сбраживания, либо изменением оптической конфигурации в таких условиях культивирования и сбраживания.
Метод определения удельной постоянной вращения левовращающего Карримицина (Carrimycin): точно взвешивают левовращающий Карримицин (Carrimycin), полученный по настоящему изобретению, добавляют трихлорметан, растворяют и разбавляют до концентрации 20 мг / 1 мл, определяют постоянную вращения калиброванным поляриметром с разрешением до 0,0001° с помощью D-линии спектра натрия (589,3 нм), длина 1 дм, температура 25°С.
Точка плавления левовращающего Карримицина (Carrimycin) изобретения составляет: 112-122°C, предпочтительно 114-120°С, более предпочтительно 116-118°С.
Метод определения: взвешивают сухой указанный препарат в умеренном количестве, кладут в капилляр для определения точки плавления, повторяют определение три раза и принимают среднюю величину.
Карримицин (Carrimycin) изобретения имеет оптическую активность, согласно современной мармакологии в связи с различной стереоспецифичностью антипода лекарственных веществ, они имеют различный аффинитет с рецепторами, в результате чего сильно отличаются фармакологические свойства. Внутренняя и наружная эффективность препарата доказала, что левовращающий Карримицин (Carrimycin) изобретения обладает благоприятным антиинфекционным эффектом и сильной фармакологической активностью. Таким образом, предоставляли новые лекарственные средства для лечения инфекционных заболеваний и закладывали основу для разработки хиральных лекарственных препаратов Карримицин (Carrimycin).
Результаты тестов in vivo и in vitro доказали, что левовращающий Карримицин (Carrimycin) изобретения обладает высокой чувствительностью и низкой лекарственной устойчивостью, эффективен к золотистому Стафилококку, стойкому к лекарствам, кроме этого, он обладает неоценимой ценностью в отношении инфекций, вызванных в результате злоупотребления антибиотиков. Например, инфекции, вызванные Золотистым Стафилококком (MRSA), стойким к метицилину; инфекции, вызванные кишечной палочкой, продуцирующей β-лактамазы расширенного спектра действия (ESBL); инфекционные болезни, вызванные клостридиями диффициле (C-diff), все эти инфекции были вызваны в результате злоупотребления антибиотиков. Такая проблема может быть контролирована с выходом в свет левовращающего Карримицина (Carrimycin).
Указанный в изобретении левовращающий Карримицин (Carrimycin) также содержит спирамицин III и другие составы, в т.ч. содержание спирамицина III не более 1,0%, суммарное содержание других составов 2,0-19% (масс.), предпочтительно 2,0-14,0% (масс.), более предпочтительно 2,0-9,0% (масс.), еще более предпочтительно 2,0-4,0% (масс.).
Указанные в изобретении другие составы содержат не менее 3 улучшенных гомолога спирамицина.
Левовращающий Карримицин (Carrimycin) изобретения является смесью с изовалерил-спирамицинами III, II и I в качестве основных составов, указанный изовалерил-спирамицин III является кристаллом левовращающего изовалерил-спирамицина III, или указанный изовалерил-спирамицин II является кристаллом левовращающего изовалерил-спирамицина II, или указанный изовалерил-спирамицин I является кристаллом левовращающего изовалерил-спирамицина I.
Когда изовалерил-спирамицин III является кристаллом левовращающего изовалерил-спирамицина III, порошковая рентгеновская дифракция кристалла, измеренная Cu-Kα-лучами, показывает характеристический пик при 2θ, равном 8,0°, 10,0°, 11,2°, 11,7°, 16,4°, 19,1°, 19,6°, 20,0°, 21,4°, 22,9°, 23,6° и 29,4°;
Когда изовалерил-спирамицин II является кристаллом левовращающего изовалерил-спирамицина II, порошковая рентгеновская дифракция кристалла, измеренная Cu-Kα-лучами, показывает характеристический пик при 2θ, равном, 10,0°, 11,6°, 16,4°, 17,3°, 19,1°, 21,2°, 22,1°, 22,7°, 26,4°, 26,9°, 27,5° и 31,5°;
Когда изовалерил-спирамицин I является кристаллом левовращающего изовалерил-спирамицина I, порошковая рентгеновская дифракция кристалла, измеренная Cu-Kα-лучами, показывает характеристический пик при 2θ, равном, 7,6°, 8,0°, 10,0°, 11,4°, 16,4°, 17,0°, 17,5°, 17,9°, 19,5°, 22,7°, 23,7° и 24,4°.
В результате последующих исследований изобретатели обнаружили, что после очистки и выделения полученного левовращающего Карримицина (Carrimycin) получали однокомпонентный изовалерил-спирамицин I, П, или III, далее путем перекристаллизации одного из компонентов получали кристаллы изовалерил-спирамицина I, II, III, потом перемешивали с левовращающим Карримицином (Carrimycin), таким образом, получали левовращающий Карримицин (Carrimycin), изовалерил-спирамицин III, II, или I которого является кристаллом левовращающего изовалерил-спирамицина III, II, или I. Тест in vivo показал, что левовращающий Карримицин (Carrimycin), изовалерил-спирамицин III, II, или I которого является кристаллом левовращающего изовалерил-спирамицина III. II, или I, обладает лучшей эффективностью, чем простой левовращающий Карримицин (Carrimycin).
Для осуществления второго объекта изобретения приняли следующие технические решения:
Лекарственная комбинация левовращающего Карримицина (Carrimycin), в т.ч. указанная лекарственная комбинация левовращающего Карримицина (Carrimycin) содержит вышеуказанные левовращающий Карримицин (Carrimycin) и фармацевтически приемлемые носители.
В лекарственной комбинации, указанной в изобретении, содержание левовращающего Карримицина (Carrimycin) является безопасным и терапевтически эффективным количеством левовращающего Карримицина (Carrimycin), предпочтительное содержание левовращающего Карримицина (Carrimycin) в лекарственной комбинации составляет 10-90% (масс.) более предпочтительно 25-75% (масс.), еще более предпочтительно 40-60% (масс.)
Под термином «безопасное и терапевтически эффективное количество», указанным в изобретении, понимается доза лекарственного средства, соединения, комбинации, продукта или препарата, достаточная для облегчения, реверсирования или лечения заболеваний человека или других млекопитающих, при этом применение таких средств или препаратов не оказывает серьезного повреждающего действия на ткани млекопитающих.
Под термином «фармацевтически приемлемый носитель», указанным в изобретении, понимается обычный носитель лекарственного препарата в области фармацевтики, например разбавитель, воспринимающее средство, как вода; заполняющее вещество, как крахмал, сахароза; связитель, как производные фибрина, соль альгиновой кислоты, желатина и поливиниловый пирролидон; смачиватель как глицерин; дезинтегрирующее средство, как агар, углекислый кальций и натрия гидрокарбонат; активатор поглощения как четвертичные аммониевые соединения; поверхностно-активный агент как цетиловый спирт; адсорбционный носитель, как каолин и бентонит; мягчительное средство как тальковый порошок, стеариновый кальций и магний, полиэтиленгликоль и т.д.. Кроме этого, можно добавлять в комбинацию другие вспомогательные материалы как ароматизирующее вещество, сахаристое вещество и другие.
Для комбинации изобретения можно выбирать безопасное и терапевтически эффективное количество любых из разбавителя, дезинтегранта, мягчительного средства, наполнителя, заполняющего вещества, связителя, смачивателя, активатора поглощения, поверхностно-активного агента, воспринимающего средства или безопасное и терапевтически эффективное количество любого обычного фармацевтического носителя данной области.
Указанная в изобретении лекарственная комбинация левовращающего Карримицина (Carrimycin) приготовлена в формах, подходящих для фармацевтической цели, и может быть жидкими, твердыми, полутвердыми или газообразными препаратами, указанный жидкий препарат выбирают среди раствора для инъекции, трансфузионной среды, раствора, микстуры, сахарного сиропа, настойки, золи, ароматизированной воды, глицеринового раствора, коллоидального раствора, слизи, взвеси или эмульсии; указанный твердый препарат выбирают среди порошка для инъекций, лиофилизированного порошка, таблеток, желатиновых капсул, порошка, пилюль или пленок; указанный полутвердый препарат выбирают среди мази, пластыри, свечи; суппозитория, экстракта, желатин ирующего вещества; указанный газообразный препарат выбирают среди аэрозоли или распыляемого раствора.
В лекарственной комбинации левовращающего Карримицина (Carrimycin), доза применения левовращающего Карримицина (Carrimycin) составляет 10-1500 мг на единичную форму, предпочтительно 100-1000 мг, более предпочтительно 200-500 мг.
Для осуществления третьего объекта изобретения приняли следующие технические решения:
Способ приготовления левовращающего Карримицина (Carrimycin), включает культивирование, сбраживание и экстрагирование, в т.ч. указанное культивирование и сбраживание включают: культивирование клонированного штамма WSJ-195 бактерий, продуцирующих спирамицин, с содержанием гена 4”-изовалерил-трансферазы, на наклонной питательной среде, потом засев и культивирование на питательной среде семени, далее засев на питательную ферментационную среду, контролирование процесса сбраживания с помощью средства для регулирования уровня pH, сбраживание при уровне pH 6,0-9,0, предпочтительно 6,0-8,0, более предпочтительно 6,0-7,5, при этом зависимость уровня pH от времени показывает три непрерывных этапа, первый этап удовлетворял уравнению y1=k1x1+6,0, где 0,0227≤k1≤1364, 0<x1≤22; второй этап удовлетворял уравнению y2=k2x2+b2, где -0,0735≤k2<0, 6,5<b2≤10,62, 22≤x2≤56, третий этап удовлетворял уравнению y3=k3x3+b3, где 0<k3≤0,0078, 6,06≤b3<6,5, 56≤x3≤120.
Регулировали и оптимизировали условия культивирования и сбраживания, особенно регулировали уровень pH в процессе сбраживания с помощью средства для регулирования уровня pH, чтобы зависимость уровня pH от времени в процессе сбраживания показывала три непрерывных этапа, каждый из этапов удовлетворял определенному уравнению, таким образом, получали левовращающий Карримицин (Carrimycin) с оптической активностью.
В изобретении решающим фактором является процесс сбраживания, во всем процессе следует время от времени определять уровень pH, который контролируют путем добавки средства для регулирования уровня pH, в т.ч. в качестве которого выбирают любой среди глюкозы, лимоннокислоты, соляной кислоты, уксусной кислоты, нашатырного спирта, каустической соды, гидроокиси калия, или их комбинацию, предпочтительна глюкоза, лимоннокислота, уксусная кислота, нашатырный спирт или их комбинация, более предпочтительна глюкоза, нашатырный спирт или их комбинация.
Упомянутый в изобретении способ приготовления, в т.ч. указанное экстрагирование включает: обработку сбраживаемой жидкости сернокислым алюминием для получения фильтрата, регулирование уровня pH фильтрата до 8,5-9,0, экстрагирование бутилацетатом, промывку бутилацетатного экстракта обессоленной водой и 1% NaH2PO4 соответственно, экстрагирование водой pH 2,0-2,5 для получения водофазного экстракта, регулирование уровня pH до 4,5-5,5, удаление остаточного бутилацетата возгонкой для получения водного экстракта, фильтрование, регулирование уровня pH фильтрата до 8,5-9,0, осаждение, орошение очищенной воды для получения влажного вещества, далее осушение для получения левовращающего Карримицина (Carrimycin).
Упомянутый в изобретении способ приготовления, в т.ч. указанная наклонная питательная среда содержит муку из бобового жмыха 2%, глюкозу 1%, крахмал 3%, CaCO3 0,5%, NaCl 0,4% и агар 2%.
Упомянутый в изобретении способ приготовления, в т.ч. указанная питательная среда семени содержит муку из бобового жмыха 1,5%, крахмал 3%, NaCl 0,4%, СаСО3 0,5%, пептон 0,3% и KH2PO4 0,05%.
Упомянутый в изобретении способ приготовления, в т.ч. указанная питательная ферментационная среда содержит глюкозу 0,5%, крахмал 6,0%, сухие дрожжи 0,5%, рыбную муку 2,0%, NH4NO30,6%, NaCl 1,0%, CaCO3 0,5%, KH2PO4 0,05%, MgSO4 0,1%, бобовое масло 0,5% и противовспениватель 0,02%.
Упомянутый в изобретении способ приготовления, в т.ч. под упомянутым культивированием на наклонной питательной среде понимается культивирование в течение 8-15 сут. при 28-38°С.
Упомянутый в изобретении способ приготовления, в т.ч. под упомянутым культивированием на питательной среде семени понимается культивирование в течение 40-80 ч. при 25-30°С.
Упомянутый в изобретении способ приготовления, в т.ч. под упомянутым сбраживанием на питательной ферментационной среде понимается культивирование в течение 72-120 ч. при 26-30°С.
Когда левовращающий Карримицин (Carrimycin) содержит кристаллы изовалерил-спирамицина I, II или III, указанный способ приготовления также включает следующие шаги:
a) Выделение и очистка левовращающего Карримицина (Carrimycin) для получения левовращающего изовалерил-спирамицина I, II или III;
b) Перекристаллизация полученного левовращающего изовалерил-спирамицина I, II или III для получения кристаллов левовращающего изовалерил-спирамицина I, II или III;
c) Удаление ацетонитрила вращающим испарением из левовращающего Карримицина (Carrimycin), полученного по п. a) после выделения и очистки от левовращающего изовалерил-спирамицина I, II или III, потом экстрагирование однократным этилацетатом, удаление из экстракта этилацетата вращающим испарением для получения пастообразных проб; переплавление полученных проб петролейньш эфиром, далее удаление петролейного эфира вращающим испарением для получения левовращающего Карримицина (Carrimycin);
d) Смешивание кристаллов левовращающего изовалерил-спирамицина I, II или III, полученных по п. b), с левовращающим Карримицином (Carrimycin), полученным по п. c) для получения левовращающего Карримицина (Carrimycin), изовалерил-спирамицин I, II или III которого является кристаллом левовращающего изовалерил-спирамицина I, II или III.
Способ приготовления, согласно изобретению, в т.ч. указанные в п. a) выделение и очистка включают:
очистку левовращающего Карримицина (Carrimycin), полученного после предварительного выделения препаративной высокоэффективной жидкостной хроматографией, применяя хроматографическую колонну ODS, проведение градиентной элюции с помощью ацетонитрила и буферного раствора уксуснокислого амминия, ультрафиолетового контроля, регистрации ультрафиолетовой спектрограммы выделения, сбор целевого пика состава левовращающего изовалерил-спирамицина I, II или III:
Хроматографическая колонна: приготовление хроматографической колонны из ODS;
Подвижная фаза: ацетонитрил (А), 0,1 моль водный раствор уксуснокислого амминия (В);
Градиент: применяли линейный градиент 0-60 мин., А: 25% - 65%; 61-90 мин., А: 65%-90%;
Скорость потока: 260 мЛ/мин;
Объем вводимого образца: 10 мЛ;
Концентрация вводимого образца: 0,5 г/мЛ;
Контрольная длина волны: 231 нм;
Способ сбора: ультрафиолетовый пуск;
Собирают образцы левовращающего изовалерил-спирамицина I согласно времени выдержки левовращающего изовалерил-спирамицина I RT 44,759 мин; или собирают образцы левовращающего изовалерил-спирамицина II согласно времени выдержки левовращающего изовалерил-спирамицина II RT 43,34 мин; или собирают образцы левовращающего изовалерил-спирамицина III согласно времени выдержки левовращающего изовалерил-спирамицина III RT 48,009 мин. Далее удаляют ацетонитрил вращающим испарением, потом экстрагируют однократным этилацетатом, удаляют из экстракта этилацетат вращающим испарением для получения пастообразных проб; переплавливают полученные пробы петролейным эфиром, далее удаляют петролейный эфир вращающим испарением для получения белых порошковых частиц левовращающего изовалерил-спирамицина I, II или III.
Способ приготовления, согласно изобретению, в т.ч.
когда изовалерил-спирамицин I является кристаллом левовращающего изовалерил-спирамицина I, данный кристалл получается по следующему методу перекристаллизации: сначала растворяют полученные белые порошковые частицы левовращающего изовалерил-спирамицина I в смешанном растворителе безводного метанола, абсолютного этилового спирта и безводного ацетона, потом наливают очищенную воду с одновременным перемешиванием, после налива очищенной воды температура снижается до 5°С - 15°С, при этом продолжают перемешивание до получения кристаллов левовращающего изовалерил-спирамицина I. В примененном смешанном растворителе отношение объема этилацетата к объему абсолютного этилового спирта и к объему безводного ацетона составляет 1:0,1-10:0,5-1, предпочтительно 1:2-8:0,8-1.
В т.ч. первое предпочтительное техническое решение по перекристаллизации кристаллов левовращающего изовалерил-спирамицина I заключается в том, что объем вводимой очищенной воды в 2-9 раз больше суммы объема этилацетата, абсолютного этилового спирта и безводного ацетона, предпочтительно 2,5-7,5 раза; скорость ввода очищенной воды 4-10 мл/мин, предпочтительно 6-8 мл/мин.
Второе предпочтительное техническое решение по перекристаллизации кристаллов левовращающего изовалерил-спирамицина I заключается в том, что в примененной смеси растворителей отношение объема этилацетата к объему абсолютного этилового спирта и к объему безводного ацетона составляет 1: 0,1-10; 0,5-1, предпочтительно 1: 2-8: 0,8-1.
Третье предпочтительное техническое решение по перекристаллизации указанных кристаллов левовращающего изовалерил-спирамицина I заключается в том, что скорость перемешивания вводимой очищенной воды 30-60 р/мин, предпочтительно 45-60 р/мин; после ввода очищенной воды скорость перемешивания 10-30 р/мин, предпочтительно 10-20 р/мин.
Четвертое предпочтительное техническое решение по перекристаллизации указанных кристаллов левовращающего изовалерил-спирамицина I заключается в том, что скорость охлаждения после ввода очищенной воды 1-3°C /ч, предпочтительно 1-1.5°C /ч.
когда изовалерил-спирамицин II является кристаллом левовращающего изовалерил-спирамицина II, данный кристалл получается по следующему методу перекристаллизации: сначала растворяют полученные белые порошковые частицы левовращающего изовалерил-спирамицина II в смешанном растворителе безводного метанола, абсолютного этилового спирта и безводного ацетона, потом наливают очищенную воду с одновременным перемешиванием, после налива очищенной воды температура снижается до 5°С - 15°С, при этом продолжают перемешивание до получения кристаллов левовращающего изовалерил-спирамицина II. В примененном смешанном растворителе отношение объема этилацетата к объему абсолютного этилового спирта и к объему безводного ацетона составляет 1: 0,1-10: 0,5-1, предпочтительно 1: 2-8: 0,8-1;
В т.ч. первое предпочтительное техническое решение по перекристаллизации кристаллов левовращающего изовалерил-спирамицина II заключается в том, что объем вводимой очищенной воды в 2-9 раз больше суммы объема безводного метанола, абсолютного этилового спирта и безводного ацетона, предпочтительно 2,5-7,5 раза; скорость ввода очищенной воды 4-10 мл/мин, предпочтительно 6-8 мл/ мин.
Второе предпочтительное техническое решение по перекристаллизации кристаллов левовращающего изовалерил-спирамицина II заключается в том, что в примененной смеси растворителей отношение объема безводного метанола к объему безводного ацетона и к объему абсолютного этилового спирта составляет 1: 0,1-10: 0,5-1, предпочтительно 1: 2-8: 0,8-1.
Третье предпочтительное техническое решение по перекристаллизации указанных кристаллов левовращающего изовалерил-спирамицина II заключается в том, что скорость перемешивания вводимой очищенной воды 30-60 р/мин, предпочтительно 45-60 р/мин; после ввода очищенной воды скорость перемешивания 10-30 р/мин, предпочтительно 10-20 р/мин.
Четвертое предпочтительное техническое решение по перекристаллизации указанных кристаллов левовращающего изовалерил-спирамицина II заключается в том, что скорость охлаждения после ввода очищенной воды 1-3°С /ч, предпочтительно 1-1.5°С /ч.
Когда изовалерил-спирамицин III является кристаллом левовращающего изовалерил-спирамицина III, данный кристалл получается по следующему методу перекристаллизации: сначала растворяют полученные белые порошковые частицы левовращающего изовалерил-спирамицина III в смешанном растворителе безводного метанола, абсолютного этилового спирта и безводного ацетона, потом наливают очищенную воду с одновременным перемешиванием, после налива очищенной воды температура снижается до 5°С - 15°С, при этом продолжают перемешивание до получения кристалла левовращающего изовалерил-спирамицина III. В примененном смешанном растворителе отношение объема безводного метанола к объему абсолютного этилового спирта и к объему безводного ацетона составляет 1: 0,1-10: 0,5-1, предпочтительно 1: 2-8; 0,8-1.
В т.ч. первое предпочтительное техническое решение по перекристаллизации кристаллов левовращающего изовалерил-спирамицина III заключается в том, что объем вводимой очищенной воды в 2-9 раз больше суммы объема безводного метанола, абсолютного этилового спирта и безводного ацетона, предпочтительно 2,5-7,5 раза; скорость ввода очищенной воды 4-10 мл/мин, предпочтительно 6-8 мл/мин.
Второе предпочтительное техническое решение по перекристаллизации кристаллов левовращающего изовалерил-спирамицина III заключается в том, что в примененной смеси растворителей отношение объема безводного метанола к объему абсолютного этилового спирта и к объему безводного ацетона составляет 1: 0,1-10: 0,5-1, предпочтительно 1: 2-8: 0,8-1.
Третье предпочтительное техническое решение по перекристаллизации указанных кристаллов левовращающего изовалерил-спирамицина III заключается в том, что скорость перемешивания вводимой очищенной воды 30-60 р/мин, предпочтительно 45-60 р/мин; после ввода очищенной воды скорость перемешивания 10-30 р/мин, предпочтительно 10-20 р/мин.
Четвертое предпочтительное техническое решение по перекристаллизации указанных кристаллов левовращающего изовалерил-спирамицина III заключается в том, что скорость охлаждения после ввода очищенной воды 1-3°C /ч, предпочтительно 1-1,5°C /ч.
Изобретение также относится к употреблению левовращающего Карримицина (Carrimycin) или лекарственной комбинации левовращающего Карримицина (Carrimycin) в приготовлении лечебных средств против инфекционных заболеваний.
Указанные в изобретении инфекционные заболевания вызваны заражением грамм-положительными бактериями, золотистым Стафилококком, пневмококком, микоплазмой пневмония, хламидией пневмониз, уреаплазмой уреалитикум, трахоматозными хламидиями, streptococcus pyogenes, микрококком катаральным, нейссерией гонорея, гемофильной палочкой, легионеллой или анаэробными бактериями.
Изобретение также относится к употреблению указанного левовращающего Карримицина (Carrimycin) или указанной лекарственной комбинации левовращающего Карримицина (Carrimycin) в приготовлении антибактериальных средств, указанные бактерии:
пневмококк, стрептококк группы A, streptococcus pyogenes, энтерококк, золотистый стафилококк, эпидермальный стафилококк, микрококк катаральный, нейссерия гонорея, гемофильная палочка, колибацилла или кишечная палочка, энтеротоксигенные кишечные палочки, патогенная кишечная палочка, enteroinvasive escherichia coli, синегнойная палочка, клебсиелла пневмонии, протеус вульгарис, тифозная палочка, акинетобактерии, лимоннокислота, цитробактер, serratia marcescens, шигелла зонне, шигелла Флекснера, бацилла, tritirachium album; легионеллы. как легионеллезная пневмония, legionella gormanii, legionella bozemanii, legionella dumoifii, legionella jordanis, legionella micdadei; анаэробные бактерии, как бактероиды фрагилис, bacteroides thetaiotaomicron, бактероиды вульгатус, bacteroides distasonis, bacteroides ruminicola, prevotella asaccharolyticus, prevotella oralis, палочка Плаута, fusobacterium russii, бифидобактерии, лактобацилла, пептострептококки, пропионибактерии акне, клостридии перфрингенс, дрожжеподобный гриб.
Как правило, специалисты данной области понимают, что количество требуемого в лечении активного вещества зависит от многих факторов, включая характер болезни, возраст и состояние пациента, и в конце концов решение принимается ведущим врачом. При введении лекарственной комбинации левовращающего Карримицина (Carrimycin) данного изобретения на единичную форму, доза применения указанного левовращающего Карримицина (Carrimycin) составляет 10-1500 мг на единичную форму, предпочтительно 100-1000 мг, более предпочтительно 200-500 мг. Тотальная доза в сутки разделяется на унифицированные дозы или фракционированные дозы. Тесты фармакодинамические in vivo и vitro доказали, что активное вещество левовращающего Карримицина (Carrimycin) или лекарственной комбинации левовращающего Карримицина (Carrimycin) обладает оптической активностью и также относительно хорошей антиинфекционной эффектностью, имеет не только антибактериальную активность в отношении грамм-положительных бактерий, особенно золотистого стафилококка, стойкого к эритромицину и β-лактаму, пневмококка, streptococcus pyogenes, но и в отношении нескольких отрицательных бактерий, как микрококка катарального, нейссерии гонорея, гемофильной палочки, части легионеллов и анаэробных бактерий, особенно заметную активность в отношении микоплазмы пневмония, хламидии пневмониз.
По сравнению с существующей технологией, изобретение имеет следующие преимущества:
1) Левовращающий Карримицин (Carrimycin) изобретения имеет оптическую активность, согласно современной мармакологии, в связи с различной стереоспецифичностью антипода лекарственных веществ, они имеют различный аффинитет с рецепторами, в результате чего сильно отличаются фармакологические свойства. Результаты тестов in vivo и in vitro доказали, что левовращающий Карримицин (Carrimycin) данного изобретения имеет отличную антиинфекционную эффектность и весьма сильную фармакологическую активность, таким образом, получили новый препарат для лечения инфекционных заболеваний, что и заложило основание для исследования и разработки хиральных лекарственных препаратов Карримицина (Carrimycin); а в результате тестов in vivo было обнаружено, что левовращающий Карримицин (Carrimycin), изовалерил-спирамицин I II или III которого является кристаллом левовращающего изовалерил-спирамицина I II или III, при лечении мышей, зараженных 12 штаммами бактерий, проявлял более благоприятную защитную эффективность;
2) Согласно способу приготовления левовращающего Карримицина (Carrimycin), указанному в изобретении, регулировали и оптимизировали условия культивирования и сбраживания, особенно регулировали уровень pH в процессе сбраживания с помощью средства для регулирования уровня pH, чтобы зависимость уровня pH от времени в процессе сбраживания показывала три непрерывных этапа, каждый из этапов удовлетворял определенному уравнению, таким образом, получали левовращающий Карримицин (Carrimycin) с оптической активностью;
3) Указанный в изобретении способ приготовления левовращающего Карримицина (Carrimycin) отличается упрощенной технологией производства и рассчитан на масштабное промышленное производство. Список рисунков
Рис.1: Зависимость уровня pH от времени в процессе сбраживания по примеру 1 изобретения;
Рис.2: Зависимость уровня pH от времени в процессе сбраживания по примеру 2 изобретения;
Рис.3: Зависимость уровня pH от времени в процессе сбраживания по примеру 3 изобретения;
Рис.4: Жидкостная хроматограмма составов стандартного образца Карримицина (Carrimycin), в т.ч.
1 - Спирамицин III
2 - Монометиловый спирамицин II
3 - Монометиловый спирамицин III
4 - Пропионил-спирамицин II
5 - Пропионил-спирамицин III
6 - Изобутирил-спирамицин II
7 - Изовалерил-спирамицин I
8 - Изобутирил-спирамицин III
9 - Изовалерил-спирамицин II
10 - Изовалерил-спирамицин III
Рис.5: Жидкостная хроматограмма левовращающего Карримицина (Carrimycin), полученного по Примеру 4 изобретения.
Рис.6: Диаграмма порошковой рентгеновской дифракции кристаллов левовращающего изовалерил-спирамицина I изобретения;
Рис.7: Диаграмма порошковой рентгеновской дифракции кристаллов левовращающего изовалерил-спирамицина II изобретения;
Рис.8: Диаграмма порошковой рентгеновской дифракции кристаллов левовращающего изовалерил-спирамицина III изобретения.
Подробные примеры
Настоящее изобретение поясняется с помощью нижеследующих примеров, которые нужно рассматривать как пояснительные, а не ограничивающие объем охраны изобретения.
Пример 1. Приготовление левовращающего Карримицина (Carrimycin).
1) Культивирование и сбраживание
Культивировали клонированный штамм WSJ-195 бактерий, продуцирующих спирамицин, с содержанием гена 4”-изовалерил-трансферазы, на наклонной питательной среде, потом засевали на питательную среду семени, культивировали, далее засевали на питательную ферментационную среду, контролировали процесс сбраживания с помощью глюкозы и нашатырного спирта, проводили сбраживание при уровне pH 6,0-9,0, время сбраживания 120 и зависимость уровня pH от времени показывала три непрерывных этапа, первый этап удовлетворял уравнению y1=0,1364x1+6,0, где 0<x1≤22; второй этап удовлетворял уравнению y2=-0,0735x2+10,64, где 22≤x2≤56; третий этап удовлетворял уравнению y3=0,0078x3+6,06, где 56≤x3≤120, зависимость уровня pH от времени приведена на Рис.1, таким образом, получали сбраживаемую жидкость.
2) Экстрагирование
Обрабатывали сбраживаемую жидкость сернокислым алюминием для получения фильтрата, регулировали уровень pH фильтрата до 9,0, экстрагировали бутилацетатом, промывали бутилацетатный экстракт обессоленной водой и 1% NaH2PO4 соответственно, экстрагировали водой pH 2,5 для получения водофазного экстракта, регулировали уровень pH до 4,5, удаляли остаточный бутилацетат возгонкой для получения водного экстракта, фильтровали, регулировали уровень pH фильтрата до 8,5, осаждали, орошали осадок очищенной водой для получения влажного вещества, далее осушали и получали левовращающий Карримицин (Cammycin).
Пример 2. Приготовление левовращающего Карримицина (Cammycin).
1) Культивирование и сбраживание
Культивировали клонированный штамм WSJ-195 бактерий, продуцирующих спирамицин, с содержанием гена 4”-изовалерил-трансферазы, на наклонной питательной среде, потом засевали на питательную среду семени, культивировали, далее засевали на питательную ферментационную среду, контролировали процесс сбраживания с помощью глюкозы и каустической соды, проводили сбраживание при уровне pH 6,0-8,0, время сбраживания 110 ч, зависимость уровня pH от времени показывала три непрерывных этапа, первый этап удовлетворял уравнению y1=0,0909x1+6,4, где 0<x1<22; второй этап удовлетворял уравнению y2=-0,0441x2+7,8, где 22<x2<56; третий этап удовлетворял уравнению y3=0,0078x3+6,06, где 56≤x3≤110, зависимость уровня pH от времени приведена на Рис.2, таким образом, получали сбраживаемую жидкость.
2) Экстрагирование
Обрабатывали сбраживаемую жидкость сернокислым алюминием для получения фильтрата, регулировали уровень pH фильтрата до 8,9, экстрагировали бутилацетатом, промывали бутилацетатный экстракт обессоленной водой и 1% NaH2PO4 соответственно, экстрагировали водой pH 2,2 для получения водофазного экстракта, регулировали уровень pH до 4,2, удаляли остаточный бутилацетат возгонкой для получения водного экстракта, фильтровали, регулировали уровень pH фильтрата до 8,6, осаждали, орошали осадок очищенной водой для получения влажного вещества, далее осушали и получали левовращающий Карримицин (Carrimycin).
Пример 3. Приготовление левовращающего Карримицина (Carrimycin).
1) Культивирование и сбраживание
Культивировали клонированный штамм WSJ-195 бактерий, продуцирующих спирамицин, с содержанием гена 4”-изовалерил-трансферазы, на наклонной питательной среде, потом засевали на питательную среду семени, культивировали, далее засевали на питательную ферментационную среду, контролировали процесс сбраживания с помощью глюкозы и лимоннокислоты. проводили сбраживание при уровне pH 6,0-7,5, время сбраживания 115 ч, зависимость уровня pH от времени показывала три непрерывных этапа, первый этап удовлетворял уравнению y1=0,068x1+6,0, где 0<x1<22; второй этап удовлетворял уравнению y2=0,0294x2+8,147, где 22<x2<56; третий этап удовлетворял уравнению y3=0,0078x3+6,06, где 56<x3<115, зависимость уровня pH от времени приведена на Рис.3, таким образом, получали сбраживаемую жидкость.
2) Экстрагирование
Обрабатывали сбраживаемую жидкость сернокислым алюминием для получения фильтрата, регулировали уровень pH фильтрата до 8,6, экстрагировали бутилацетатом, промывали бутилацетатный экстракт обессоленной водой и 1% NaH2PO4 соответственно, экстрагировали водой pH 2,3 для получения водофазного экстракта, регулировали уровень pH до 5,2, удаляли остаточный бутилацетат возгонкой для получения водного экстракта, фильтровали, регулировали уровень pH фильтрата до 8,7, осаждали, орошали осадок очищенной водой для получения влажного вещества, далее осушали и получали левовращающий Карримицин (Carrimycin).
Пример 4. Приготовление левовращающего Карримицина (Carrimycin).
1) Культивирование и сбраживание
Клонированный штамм WSJ-195 бактерий, продуцирующих спирамицин, с содержанием гена 4”-изовалерил-трансферазы, культивировали в течение 15 сут. при 28°C на наклонной питательной среде, содержащей муку из бобового жмыха 2%, глюкозу 1%, крахмал 3%, CaCO3 0,5%, NaCl 0,4% и агара 2%, засевали на питательную среду семени, содержащую муку из бобового жмыха 1,5%, крахмал 3,0%, NaCl 0,4%, CaCO3 0,5%, пептон 0,3% и KH2PO4 0,05%, культивировали в течение 80 ч. при 25°C, далее засевали прививочную дозу 0,1% на питательную ферментационную среду, содержащую глюкозу 0,5%, крахмал 6,0%, сухие дрожжи 0,5%, рыбную муку 2,0%, NH4NO3 0,6%, NaCl 1,0%, CaCO3 0,5%, KH2PO4 0,05%, MgSO4 0,1%, бобовое масло 0,5% и противовспениватель 0,02%;
контролировали процесс сбраживания с помощью глюкозы и нашатырного спирта, проводили сбраживание при уровне рН 6,0-9,0, время сбраживания 120 ч, и зависимость уровня pH от времени показывала три непрерывных этапа, первый этап удовлетворял уравнению y1=0,1364x1+6,0, где 0<x1≤22; второй этап удовлетворял уравнению y2=-0,0735x2+10,64, где 22≤x2≤56; третий этап удовлетворял уравнению y3=0,0078x3+6,06, где 56≤x3≤120, таким образом, получали сбраживаемую жидкость.
2) Экстрагирование
Обрабатывали сбраживаемую жидкость сернокислым алюминием для получения фильтрата, регулировали уровень pH фильтрата до 8,5, экстрагировали бутилацетатом, промывали бутилацетатный экстракт обессоленной водой и 1% NaH2PO4 соответственно, экстрагировали водой pH 2,0 для получения водофазного экстракта, регулировали уровень pH до 4,5, удаляли остаточный бутилацетат возгонкой для получения водного экстракта, фильтровали, регулировали уровень pH фильтрата до 8,5, осаждали, орошали осадок очищенной водой для получения влажного вещества, далее осушали и получали левовращающий Карримицин (Cammycin).
Пример 5. Приготовление левовращающего Карримицина (Carrimycin).
1) Культивирование и сбраживание
Клонированный штамм WSJ-195 бактерий, продуцирующих спирамицин, с содержанием гена 4”-изовалерил-трансферазы, культивировали в течение 8 сут. при 38°С на наклонной питательной среде, содержащей муку из бобового жмыха 2%, глюкозу 1%, крахмал 3%, CaCO3 0,5%, NaCl 0,4% и агара 2%, засевали на питательную среду семени, содержащую муку из бобового жмыха 1,5%, крахмал 3,0%, NaCl 0,4%, CaCO3 0,5%, пептон 0,3% и KH2PO4 0,05%, культивировали в течение 40 ч. при 30°С, далее засевали прививочную дозу 20% на питательную ферментационную среду, содержащую глюкозу 0,5%, крахмал 6,0%, сухие дрожжи 0,5%, рыбную муку 2,0%, NH4NO3 0,6%, NaCl 1,0%, CaCO3 0,5%, KH2PO4 0,05%, MgSO4 0,1%, бобовое масло 0,5% и противовспениватель 0,02%; контролировали процесс сбраживания с помощью глюкозы и нашатырного спирта, проводили сбраживание при уровне pH 6,0-7,5 и 30°С, время сбраживания 115 ч, и зависимость уровня pH от времени показывала три непрерывных этапа, первый этап удовлетворял уравнению y1=0,0682x1+6,0, где 0<x1<22; второй этап удовлетворял уравнению y2=-0,0294x2+8,147, где 22<x2<56; третий этап удовлетворял уравнению y3=0,0078x3+6,06, где 56<x3<115, зависимость уровня pH от времени приведена на Рис.3, таким образом, получали сбраживаемую жидкость.
2) Экстрагирование
Обрабатывали сбраживаемую жидкость сернокислым алюминием для получения фильтрата, регулировали уровень pH фильтрата до 9,0, экстрагировали бутилацетатом, промывали бутилацетатный экстракт обессоленной водой и 1% NaH2PO4 соответственно, экстрагировали водой pH 2,5 для получения водофазного экстракта, регулировали уровень pH до 4,5-5,5, удаляли остаточный бутилацетат возгонкой для получения водного экстракта, фильтровали, регулировали уровень pH фильтрата до 9,0, осаждали, орошали осадок очищенной водой для получения влажного вещества, далее осушали и получали левовращающий Карримицин (Carrimycin).
Пример 6. Приготовление левовращающего Карримицина (Carrimycin).
1) Культивирование и сбраживание
Клонированный штамм WSJ-195 бактерий, продуцирующих спирамицин, с содержанием гена 4”-изовалерил-трансферазы, культивировали в течение 12 сут. при 30°С на наклонной питательной среде, содержащей муку из бобового жмыха 2%, глюкозу 1%, крахмал 3%, CaCO3 0,5%, NaCl 0,4% и агара 2%, засевали на питательную среду семени, содержащую муку из бобового жмыха 1,5%, крахмал 3,0%, NaCl 0,4%, СаСО3 0,5%, пептон 0,3% и KH2PO4 0,05%, культивировали в течение 60 ч. при 28°С, далее засевали прививочную дозу 10% на питательную ферментационную среду, содержащую глюкозу 0,5%, крахмал 6,0%, сухие дрожжи 0,5%, рыбную муку 2,0%, NH4NO3 0,6%, NaCl 1,0%, CaCO3 0,5%, KH2PO4 0,05%, MgSO4 0,1%, бобовое масло 0,5% и противовспениватель 0,02%; контролировали процесс сбраживания с помощью глюкозы и нашатырного спирта, проводили сбраживание при уровне pH 6,0-7,5 и 28°С, время сбраживания 90h, и зависимость уровня pH от времени показывала три непрерывных этапа, первый этап удовлетворял уравнению y1=0,0682x1+6,0, где 0<x1<22; второй этап удовлетворял уравнению y2=-0,0294x2+8,147, где 22<x2<56; третий этап удовлетворял уравнению y3=0,0078x3+6,06, где 56<x3<90, зависимость уровня pH от времени приведена на Рис.3, таким образом, получали сбраживаемую жидкость.
2) Экстрагирование
Обрабатывали сбраживаемую жидкость сернокислым алюминием для получения фильтрата, регулировали уровень pH фильтрата до 8,7, экстрагировали бутилацетатом, промывали бутилацетатный экстракт обессоленной водой и 1% NaH2PO4 соответственно, экстрагировали водой pH 2,2 для получения водофазного экстракта, регулировали уровень pH до 5,0, удаляли остаточный бутилацетат возгонкой для получения водного экстракта, фильтровали, регулировали уровень pH фильтрата до 8,7, осаждали, орошали осадок очищенной водой для получения влажного вещества, далее осушали и получали левовращающий Карримицин (Carrimycin).
Пример 7. Приготовление левовращающего Карримицина (Carrimycin).
1) Культивирование и сбраживание
Клонированный штамм WSJ-195 бактерий, продуцирующих спирамицин, с содержанием гена 4”-изовалерил-трансферазы, культивировали в течение 10 сут. при 35°С на наклонной питательной среде, содержащей муку из бобового жмыха 2%, глюкозу 1%, крахмал 3%, CaCO3 0,5%, NaCl 0,4% и агара 2%, засевали на питательную среду семени, содержащую муку из бобового жмыха 1,5%, крахмал 3,0%, NaCl 0,4%, СаСО3 0,5%, пептон 0,3% и KH2PO4 0,05%, культивировали в течение 55 ч. при 26°С, далее засевали прививочную дозу 15% на питательную ферментационную среду, содержащую глюкозу 0,5%, крахмал 6,0%, сухие дрожжи 0,5%, рыбную муку 2,0%, NH4NO3 0,6%, NaCl 1,0%, СаСО3 0,5%, KH2PO4 0,05%, MgSO4 0,1%, бобовое масло 0,5% и противовспениватель 0,02%; контролировали процесс сбраживания с помощью глюкозы и нашатырного спирта, проводили сбраживание при уровне pH 6,0-7,5 и 27°C, время сбраживания 115h, и зависимость уровня pH от времени показывала три непрерывных этапа, первый этап удовлетворял уравнению y1=0,0682x1+6,0, где 0<x1<22; второй этап удовлетворял уравнению y2=-0,0294x2+8,147, где 22<x2<56; третий этап удовлетворял уравнению y3=0,0078x3+6,06, где 56<x3<110, зависимость уровня pH от времени приведена на Рис.3, таким образом, получали сбраживаемую жидкость.
2) Экстрагирование
Обрабатывали сбраживаемую жидкость сернокислым алюминием для получения фильтрата, регулировали уровень pH фильтрата до 8,6, экстрагировали бутилацетатом, промывали бутилацетатный экстракт обессоленной водой и 1% NaH2PO4 соответственно, экстрагировали водой pH 2,3 для получения водофазного экстракта, регулировали уровень pH до 4,8, удаляли остаточный бутилацетат возгонкой для получения водного экстракта, фильтровали, регулировали уровень pH фильтрата до 8,8, осаждали, орошали осадок очищенной водой для получения влажного вещества, далее осушали и получали левовращающий Карримицин (Carrimycin).
Пример 8. Приготовление левовращающего Карримицина (Carrimycin).
1) Культивирование и сбраживание
Клонированный штамм WSJ-195 бактерий, продуцирующих спирамицин, с содержанием гена 4”-изовалерил-трансферазы, культивировали в течение 13 сут. при 36°C на наклонной питательной среде, содержащей муку из бобового жмыха 2%, глюкозу 1%, крахмал 3%, CaCO3 0,5%, NaCl 0,4% и агара 2%, засевали на питательную среду семени, содержащую муку из бобового жмыха 1,5%, крахмал 3,0%, NaCl 0,4%, CaCO3 0,5%, пептон 0,3% и KH2PO4 0,05%, культивировали в течение 75 ч. при 27°С, далее засевали прививочную дозу 0,5% на питательную ферментационную среду, содержащую глюкозу 0,5%, крахмал 6,0%, сухие дрожжи 0,5%, рыбную муку 2,0%, NH4NO3 0,6%, NaCl 1,0%, CaCO3 0,5%, KH2PO4 0,05%, MgSO4 0,1%, бобовое масло 0,5% и противовспениватель 0,02%; контролировали процесс сбраживания с помощью глюкозы и нашатырного спирта, проводили сбраживание при уровне pH 6,0-8,0 и 29°С, время сбраживания 98 ч, и зависимость уровня pH от времени показывала три непрерывных этапа, первый этап удовлетворял уравнению y1=0,0909x1+6,4, где 0<x1<22; второй этап удовлетворял уравнению y2=-0,0441x2+7,8, где 22<x2<56; третий этап удовлетворял уравнению y3=0,0078x3+6,06, где 56≤x3≤110, зависимость уровня pH от времени приведена на Рис.2, таким образом, получали сбраживаемую жидкость.
2) Экстрагирование
Обрабатывали сбраживаемую жидкость сернокислым алюминием для получения фильтрата, регулировали уровень pH фильтрата до 8,9, экстрагировали бутилацетатом, промывали бутилацетатный экстракт обессоленной водой и 1% NaH2PO4 соответственно, экстрагировали водой pH 2,4 для получения водофазного экстракта, регулировали уровень pH до 4,6, удаляли остаточный бутилацетат возгонкой для получения водного экстракта, фильтровали, регулировали уровень pH фильтрата до 8,6, осаждали, орошали осадок очищенной водой для получения влажного вещества, далее осушали и получали левовращающий Карримицин (Carrimycin).
Пример 9. Метод качественного определения по методу HPLC.
Проводили определение согласно высокоэффективной жидкостной хроматографии (Китайская фармакопея, 2005 г., выпуск 2, Приложение D).
Применяли хроматографическую колонну (AGELA TECHNOLOGIES) Venusil XBP 
Испытания на хроматографические условия и системную применимость проводили согласно жидкостной хроматограмме составов стандартного образца Карримицина (Carrimycin) (Рис.4), регулировали хроматографические условия, при необходимости можно изменять условия градиентной элюции подвижной фазы, чтобы диаграмма состава входного образца левовращающий Карримицин (Carrimycin) соответствовала диаграмме состава стандартного образца Карримицина (Carrimycin) (Рис.4).
Стандартный раствор: точно взвешивали стандартный образец в умеренном количестве, растворяли в смеси 0,01 мол/Л раствора уксуснокислого амминия (регулировали уровень рН до 7,0 с помощью нашатырного спирта) - ацетонитрила (65: 35) до 0,4 мг/мл - 0,6 мг/мл в качестве стандартного раствора, размешивали до полного растворения на дальнейшее использование.
Испытуемый раствор: точно взвешивали указанный раствор 50 мг, растворяли в смеси 0,01 мол/Л раствора уксуснокислого амминия (регулировали уровень рН до 7,0 с помощью нашатырного спирта) - ацетонитрила (65: 35) до 50 мл в качестве испытуемого раствора, размешивали до полного растворения на дальнейшее использование.
Рассчитывали по площади пика изовалерил-спирамицина III по методу внешнего стандарта. Изовалерил-спирамицин III не ниже 30%; изовалерил-спирамицин (I+II+III) не ниже 60%; общее содержание 9 компонентов ацилированного спирамицина не ниже 80%; содержание спирамицина III не более 1,0%, общее содержание других неизвестных компонентов не более 5,0%. Формула расчета:
Изовалерил-спирамицин III%=Aизовалерил III×Ws×P/(AS×WT)×100%
Изовалерил-спирамицин (I+II+III)%=(Aизовалерил I+Aизовалерил II+Aизовалерил III)×WS×P/(AS×WT)×100%
Общее содержание ацилированного спирамицина %=(Aацетил II+Aацетил III+Aпропионил II+ Aпропионил III+Aизобутилил II+Aизовалерил I+Aизобутилил III+Aизовалерил II+Aизовалерил III)×WS×P/(AS×WT)×100%
Изовалерил-спирамицин III%=Aизовалерил III×WS×P/(AS×WT)×100%
Неизвестные компоненты %=AW×WS×P/(AS×WT)×100%
Где: WS - масса стандартного образца, г;
AS - Площадь пика изовалерил-спирамицина III в стандартном образце;
WT - масса испытуемого образца, г;
AW - сумма площади пика неизвестных компонентов в испытуемом образце;
Р - Чистота изовалерил-спирамицина III в стандартном образце.
Пример 10. Контроль компонентов готового левовращающего Карримицина (Carrimycin) по методу HPLC.
Экстрагировали сбраживаемую жидкость из 8 сбраживаний левовращающего Карримицина (Carrimycin) согласно процессу экстрагирования левовращающего Карримицина (Carrimycin) по Примеру 4 и методу качественного определения по методу HPLC по Примеру 9, результаты контроля HPLC компонентов полученной продукции показаны на табл.1, жидкостная хроматограмма показана на Рис.5.
Проводили вышеуказанный контроль левовращающего Карримицина (Carrimycin), полученного по другим примерам, полученная жидкостная хроматограмма показана на Рис.5.
Пример 11. Определение удельной постоянной вращения левовращающего Карримицина (Carrimycin).
Точно взвешивали левовращающий Карримицин (Carrimycin), полученный по примерам изобретения, добавляли трихлорметан, растворяли и разбавляли до концентрации 20 мг / 1 мл, определяли постоянную вращения калиброванным поляриметром с разрешением до 0.0001° с помощью D-линии спектра натрия (589,3 нм), длина 1 дм, температура 25°С.
Пример 12. Таблетки-ядра Левовращающий Карримицин (Carrimycin) (10000 таблеток).
Рецептура:
Технология приготовления: взвешивали крахмал в подходящем количестве, растворяли до концентрации 15%, нагревали до пастообразного состояния, чтобы получить связитель; просеивали на сите в 100 меш основное сырье Карримицин (Carrimycin), вспомогательные материалы - крахмал, оксипропилцеллюлозу с низкой степенью замещения, карбоксиметил-крахмал натрия, и стеарат магния, взвешивали основное сырье и вспомогательные материалы в необходимом количестве согласно рецептуре; равномерно перемешивали Карримицин (Carrimycin), крахмал и оксипропилцеллюлозу с низкой степенью замещения, приготавливали мягкий агент с помощью крахмальной пасты концентрацией крахмала 15%, гранулировали на сите в 14 меш, осушали при 50-60°С, обеспечивали влажность в пределах 3-5%, формировали гранулы на сите в 14 меш, добавляли карбоксиметил-крахмал натрия и стеариновый магний, и перемешивали, определяли содержание частиц; согласно содержанию частиц рассчитывали вес таблетки, таблетировал (шампон диаметр 9 мм с неглубокой впадиной), проверяли разницу веса таблетки; после получения положительных результатов проводили упаковку.
Пример 13. Желатиновые капсулы Левовращающий Карримицин (Carrimycin) (10000 желатиновых капсул). Рецептура:
Технология приготовления: взвешивали основное сырье - Карримицин (Carrimycin) и вспомогательные материалы - фармацевтический крахмал согласно рецептуре, положили в миксер и равномерно перемешивали в течение 1,5-2 ч.; отобрали пробы и проверяли содержание, результаты должны принципиально соответствовать теоретическим данным (содержимое в каждой капсуле примерно 0,105 г), положили проверенные с положительными результатами фармацевтические капсулы #3 и перемешанную смесь в загрузочный аппарат для наполнения капсул согласно требованиям к эксплуатации автоматизированной капсулонаполнительной машины, проверяли разницу наполненных капсул (в пределах ±10%, менее 0,3 г), скорость растворения отвечала требованиям, потом положили проверенные с положительными результатами капсулы в фармацевтическую полировочную машину, куда наливали жидкий парафин для проведения полирования в течение 15-20 мин., далее вынимали, проводили упаковку конечных продуктов и проверку.
Пример 14. Дражированные таблетки Левовращающий Карримицин (Carrimycin) (10000 таблеток).
Рецептура: то же, как Пример 12.
Технология приготовления: согласно Примеру 12 положили годные таблетки-ядра в сосуд для нанесения сахарного слоя, медленно положили приготовленный сахарный сироп (концентрация 65-70%) в сосуд, постепенно повышали температуру до 40°С, добавляли умеренное количество талькового порошка, осушали несколько раз подачей воздуха по 25-30 мин., после выравнивания талькового слоя, покрывали сахарным слоем в течение 15-20 мин., после выравнивания сахарного слоя наносили покровный слой нужного цвета, положили приготовленную гестотертую краску в сахарный сироп, равномерно перемешивали и положили в сосуд, повторяли процесс перемешивания по 15-20 мин.
Пример 15. Сухой сахарный сироп Левовращающий Карримицин (Carrimycin) (10000 пакетов). Рецептура:
Технология приготовления: измельчали сырой порошок Карримицин (Carrimycin), лимонную кислоту и сахарозу высокоскоростным измельчителем до частицы, чтобы 85% частиц прошло через сито в 300 меш, 15% - через сито в 180 меш, далее взвешивали измельченный мелкозернистый порошок по рецептуре и равномерно перемешивали в течение 1-1,5 ч., определяли содержание и рассчитывали вместимость (теоретическая вместимость 500 мг /пакет), далее вмещали смесь в упаковочную машину, устанавливали алюминиевую фольгу, сортировали согласно требованиям к эксплуатации сортировочной машины, разница вместимости в пределах ±5%, после этого проверяли и проводили наружную упаковку.
Пример 16. Кишечно-растворимая таблетка Левовращающий Карримицин (Carrimycin) (10000 таблеток).
Рецептура: то же, как Пример 12.
Технология приготовления: таблетки-ядра приготавливали по Примеру 12, положили годные таблетки-ядра в сосуд для нанесения сахарного слоя, покрывали трем нижним слоем с помощью сахарного сиропа концентрацией 60~70% и талькового порошка, потом покрывали изоляционным слоем, добавляли 10%-спиртовый раствор зеина, продували вращением в течение 10-15 мин., далее закапывали в сосуд диэтилфталат, ацетон, ацетатфталат целлюлозы, спиртовой раствор, т.е. кишечно-растворимый раствор, 2-3 раза продували вращением по 10-15 мин. После проверки с получением положительных результатов покрывали слоем сахара по Примеру 7.
Пример 17. Желудочно-растворимая таблетка Левовращающий Карримицин (Carrimycin) (10000 таблеток).
Рецептура: то же, как Пример 12.
Технология приготовления: таблетки-ядра приготавливали по Примеру 12, положили годные таблетки-ядра в высокоэффективную машину для нанесения покровного слоя, потом приготавливали из годного порошка (включая липорастворимый и водорастворимый порошок) раствор для нанесения покровного слоя, далее положили раствор для нанесения покровного слоя в коллоид, измельчали и фильтровали. Подогревали высокоэффективный сосуд для нанесения покровного слоя с загруженными таблетками-ядрами при скорости вращения в пределах 5-10 р/мин и температуре в пределах 45-60°С, опрыскивали аэрозольным соплом (более 300 меш) раствор для нанесения покровного слоя в сосуд, потом осушали 8-12 раз по 25-35 мин. до равномерного нанесения, осушали естественным способом, проверяли и упаковывали.
Пример 18. Гранулы Левовращающий Карримицин (Carrimycin) (10000 пакетов).
Рецептура:
Технология приготовления: рассеивали сырой порошок Карримицина (Carrimycin), сахарную пудру и декстрин на сите в 120, взвешивали Карримицин (Carrimycin), сахарную пудру и декстрин согласно рецептуре и равномерно перемешивали, приготавливали мягкий агент из равномерно перемешенных вышеуказанных материалов с помощью плазмагеля 5%PVP-K30, осушали и формировали колеблющие гранулы при 70°C, проверяли с положительными результатами и проводили сортировку.
Пример 19. Лиофилизированный порошок для инъекций Левовращающий Карримицин (Carrimycin).
Взвешивали сырой порошок левовращающего Карримицина (Carrimycin) 500 мг, полученный по Примеру 6 и адипиновую кислоту эквимолекулярных количеств, после равномерного перемешивания, растворяли в 5 мл воды, получали желтоватый прозрачный раствор уровнем pH 4,6-5,6. Добавляли маннитол 40 мг в качестве расклинивающего агента лиофилизированного порошка, быстро замораживали в течение 9 ч в криогенном режиме, замораживали и осушали, получали желтоватый рыхлый массив, который перед применением растворяют в стерильной воде 10 мл.
Пример 20. Лиофилизированный порошок для инъекций Левовращающий Карримицин (Carrimycin).
Взвешивали сырой порошок левовращающего Карримицина (Carrimycin) 500 мг, полученный по Примеру 4 и лимоннокислоту эквимолекулярных количеств, после равномерного перемешивания, растворяли в 5 мл воды, получали желтоватый прозрачный раствор уровнем pH 4,6-5,6. Добавляли маннитол 40 мг в качестве расклинивающего агента лиофилизированного порошка, быстро замораживали в течение 9 ч. в криогенном режиме, замораживали и осушали, получали желтоватый рыхлый массив, который перед применением растворяют в стерильной воде 10 мл.
Пример 21. Лиофилизированный порошок для инъекций Левовращающий Карримицин (Carrimycin).
Взвешивали сырой порошок левовращающего Карримицина (Carrimycin) 500 мг, полученный по Примеру 5 и малеиновую кислоту эквимолекулярных количеств, после равномерного перемешивания, растворяли в 5 мл воды, получали желтоватый прозрачный раствор уровнем pH 4,6-5,6. Добавляли маннитол 40 мг в качестве расклинивающего агента лиофилизированного порошка, быстро замораживали в течение 9 ч. в криогенном режиме, замораживали и осушали, получали желтоватый рыхлый массив, который перед применением растворяют в стерильной воде 10 мл
Пример 22. Приготовление левовращающего Карримицина (Carrimycin), изовалерил-спирамицин I которого является кристаллом левовращающего изовалерил-спирамицина I.
Выделяли и очищали Левовращающий Карримицин (Carrimycin), полученный по Примеру 1.
Очистка левовращающего изовалерил-спирамицина I: очищали образцы, полученные после предварительного выделения, препаративной высокоэффективной жидкостной хроматографией, приготавливали хроматографическую колонну из ODS, проводили градиентную элюцию с помощью ацетонитрила и буферного раствора уксуснокислого амминия, ультрафиолетовый контроль, регистрировали ультрафиолетовую спектрограмму выделения, собирали целевой пик состава левовращающего изовалерил-спирамицина I.
Хроматографическая колонна: приготовление хроматографической колонны из ODS;
Подвижная фаза: ацетонитрил (А), 0.1 моль водный раствор уксуснокислого амминия (В);
Градиент: применяли линейный градиент 0-60 мин., А: 25%-65%; 61-90 мин., А:
65% - 90%;
Скорость потока: 260 мл/мин;
Объем вводимого образца: 10 мл.;
Концентрация вводимого образца: 0,5 г/мл;
Контрольная длина волны: 231 нм;
Способ сбора: ультрафиолетовый пуск;
Собирали образец левовращающего изовалерил-спирамицина I, согласно времени выдержки левовращающего изовалерил-спирамицина I - 44,759 мин, очищали его от ацетонитрила вращающим испарением, потом экстрагировали однократным этилацетатом, удаляли из экстракта этилацетат вращающим испарением для получения пастообразных проб; переплавливали полученные пробы петролейным эфиром, далее удаляли петролейный эфир вращающим испарением для получения белых порошковых частиц левовращающего изовалерил-спирамицина I.
Далее перекристаллизировали полученные белые порошковые частицы левовращающего изовалерил-спирамицина I, способ перекристаллизации как ниже следующее:
(1) Растворяли твердые частицы левовращающего изовалерил-спирамицина I, полученные по Примеру 1, в смеси растворителей этилацетата, абсолютного этилового спирта и безводного ацетона, в примененной смеси растворителей отношение объема этилацетата к объему абсолютного этилового спирта и к объему безводного ацетона составляло 1: 10: 1;
(2) Потом наливали очищенную воду с одновременным перемешиванием, объем налитой воды в 2,5 раза больше суммы объема этилацетата, абсолютного этилового спирта и безводного ацетона; скорость ввода очищенной воды 4 мл/мин; скорость перемешивания при наливе очищенной воды 30 р/мин;
(3) После налива очищенной воды температура снижалась до 5°С, скорость понижения температуры 1°С в час, при этом продолжали перемешивание скоростью 10 р/мин; таким образом, получали кристаллы левовращающего изовалерил-спирамицина I.
Порошковая рентгеновская дифракция полученных кристаллов левовращающего изовалерил-спирамицина I, измеренная Cu-Kα-лучами, показывала характеристический пик при 2θ равном, 7,6°, 8,0°, 10,0°, 11,4°, 16,4°, 17,0°, 17,5°, 17,9°, 19,5°, 22,7°, 23,7° и 24,4°, диаграмма порошковой рентгеновской дифракции показана на Рис.6.
Удаляли ацетонитрил вращающим испарением из вышеуказанного левовращающего Карримицина (Carrimycin), очищенного от левовращающего изовалерил-спирамицина I, потом экстрагировали однократным этилацетатом, удаляли из экстракта этилацетат вращающим испарением для получения пастообразных проб; переплавливали полученные пробы петролейным эфиром, далее удаляли петролейный эфир вращающим испарением для получения левовращающего Карримицина (Carrimycin); далее перемешивали полученный левовращающий Карримицин (Carrimycin) с вышеуказанным полученным кристаллом левовращающего изовалерил-спирамицина I для получения левовращающего Карримицина (Carrimycin), изовалерил-спирамицин I которого является кристаллом левовращающего изовалерил-спирамицина I.
Пример 23. Приготовление левовращающего Карримицина (Carrimycin), изовалерил-спирамицин I которого является кристаллом левовращающего изовалерил-спирамицина I.
Остальные шаги те же, как Пример 22, отличаются только методом перекристаллизации, а именно:
(1) Растворяли твердые частицы левовращающего изовалерил-спирамицина I в смеси растворителей этилацетата, абсолютного этилового спирта и безводного ацетона, в примененной смеси растворителей отношение объема этилацетата к объему абсолютного этилового спирта и к объему безводного ацетона составляло 1: 10: 1;
(2) Потом наливали очищенную воду с одновременным перемешиванием, объем налитой воды в 9 раз больше суммы объема этилацетата, абсолютного этилового спирта и безводного ацетона; скорость ввода очищенной воды 10 мл/мин; скорость перемешивания при наливе очищенной воды 60 р/мин;
(3) После налива очищенной воды температура снижалась до 15°С, скорость понижения температуры 3°С в час, при этом продолжали перемешивание скоростью 10 р/мин; таким образом, получали кристаллы левовращающего изовалерил-спирамицина I.
Диаграмма порошковой рентгеновской дифракции кристаллов левовращающего изовалерил-спирамицина I, измеренная Cu-Kα-лучами аналогична Рис.6.
Пример 24. Приготовление левовращающего Карримицина (Carrimycin), изовалерил-спирамицин I которого является кристаллом левовращающего изовалерил-спирамицина I.
Остальные шаги те же, как Пример 22, отличаются только методом перекристаллизации, а именно:
(1) Растворяли твердые частицы левовращающего изовалерил-спирамицина I в смеси растворителей этилацетата, абсолютного этилового спирта и безводного ацетона, в примененной смеси растворителей отношение объема этилацетата к объему абсолютного этилового спирта и к объему безводного ацетона составляло 1: 5: 0,8;
(2) Потом наливали очищенную воду с одновременным перемешиванием, объем налитой воды в 7.5 раза больше суммы объема этилацетата, абсолютного этилового спирта и безводного ацетона; скорость ввода очищенной воды 6 мл/мин; скорость перемешивания при наливе очищенной воды 40 р/мин;
(3) После налива очищенной воды температура снижалась до 10°С, скорость понижения температуры 2°С в час, при этом продолжали перемешивание со скоростью 115 р/мин; таким образом, получали кристаллы левовращающего изовалерил-спирамицина I.
Диаграмма порошковой рентгеновской дифракции кристаллов левовращающего изовалерил-спирамицина I, измеренная Cu-Kα-лучами аналогична Рис.6.
Пример 25. Приготовление левовращающего Карримицина (Carrimycin), изовалерил-спирамицин I которого является кристаллом левовращающего изовалерил-спирамицина I.
Остальные шаги те же, как Пример 22, отличаются только методом перекристаллизации, а именно:
(1) Растворяли твердые частицы левовращающего изовалерил-спирамицина I в смеси растворителей этилацетата, абсолютного этилового спирта и безводного ацетона, в примененной смеси растворителей отношение объема этилацетата к объему абсолютного этилового спирта и к объему безводного ацетона составляло 1: 2: 1;
(2) Потом наливали очищенную воду с одновременным перемешиванием, объем налитой воды в 7,5 раза больше суммы объема этилацетата, абсолютного этилового спирта и безводного ацетона; скорость ввода очищенной воды 8 мл/мин; скорость перемешивания при наливе очищенной воды 45 р/мин;
(3) После налива очищенной воды температура снижалась до 12°С, скорость понижения температуры 2,5°С в час, при этом продолжали перемешивание скоростью 20 р/мин; таким образом, получали кристаллы левовращающего изовалерил-спирамицина I.
Диаграмма порошковой рентгеновской дифракции кристаллов левовращающего изовалерил-спирамицина I, измеренная Cu-Kα-лучами аналогична Рис.6.
Пример 26 Приготовление левовращающего Карримицина (Carrimycin), изовалерил-спирамицин I которого является кристаллом левовращающего изовалерил-спирамицина I
Остальные шаги те же, как Пример 22, отличаются только методом перекристаллизации, а именно:
(1) Растворяли твердые частицы левовращающего изовалерил-спирамицина I в смеси растворителей этилацетата, абсолютного этилового спирта и безводного ацетона, в примененной смеси растворителей отношение объема этилацетата к объему абсолютного этилового спирта и к объему безводного ацетона составляло 1: 5: 0,8;
(2) Потом наливали очищенную воду с одновременным перемешиванием, объем налитой воды в 5 раз больше суммы объема этилацетата, абсолютного этилового спирта и безводного ацетона; скорость ввода очищенной воды 7 мл/мин; скорость перемешивания при наливе очищенной воды 60 р/мин;
(3) После налива очищенной воды температура снижалась до 12°С, скорость понижения температуры 1.2°С в час, при этом продолжали перемешивание скоростью 15 р/мин; таким образом, получали кристаллы левовращающего изовалерил-спирамицина I.
Диаграмма порошковой рентгеновской дифракции кристаллов левовращающего изовалерил-спирамицина I, измеренная Cu-Kα-лучами аналогична Рис.6.
Пример 27. Приготовление левовращающего Карримицина (Carrimycin), изовалерил-спирамицин II которого является кристаллом левовращающего изовалерил-спирамицина II.
Очищали левовращающий Карримицин (Carrimycin), полученный по Примеру 2, согласно Примеру 22, процесс отличался тем, что собирали образцы левовращающего изовалерил-спирамицина II согласно времени выдержки левовращающего изовалерил-спирамицина II RT 43.34.
Потом приготовляли кристаллы из полученныъ белых порошковых частиц левовращающего изовалерил-спирамицина II, способ приготовления как ниже следующее:
(1) Растворяли твердые частицы левовращающего изовалерил-спирамицина II, полученные по Примеру 2, в смеси растворителей безводного метанола, абсолютного этилового спирта и безводного ацетона, в примененной смеси растворителей отношение объема безводного метанола к объему безводного ацетона и к объему абсолютного этилового спирта составляло 1: 10: 1;
(2) Потом наливали очищенную воду с одновременным перемешиванием, объем налитой воды в 2,5 раза больше суммы объема безводного метанола, абсолютного этилового спирта и безводного ацетона; скорость ввода очищенной воды 4 мл/мин; скорость перемешивания при наливе очищенной воды 30 р/мин;
(3) После налива очищенной воды температура снижалась до 5°С, скорость понижения температуры 1°С в час, при этом продолжали перемешивание скоростью 10 р/мин; таким образом, получали кристаллы левовращающего изовалерил-спирамицина II.
Порошковая рентгеновская дифракция полученных кристаллов левовращающего изовалерил-спирамицина II, измеренная Cu-Kα-лучами, показывала характеристический пик при 2θ равном, 10,0°, 11,6°, 16,4°, 17,3°, 19,1°, 21,2°, 22,1°, 22,7°, 26,4°, 26,9°, 27,5° и 31,5°, диаграмма порошковой рентгеновской дифракции показана на Рис.7.
Удаляли ацетонитрил вращающим испарением из вышеуказанного левовращающего Карримицина (Carrimycin), очищенного от левовращающего изовалерил-спирамицина II, потом экстрагировали однократным этилацетатом, удаляли из экстракта этилацетат вращающим испарением для получения пастообразных проб; переплавливали полученные пробы петролейным эфиром, далее удаляли петролейный эфир вращающим испарением для получения левовращающего Карримицина (Carrimycin); далее перемешивали полученный левовращающий Карримицин (Carrimycin) с вышеуказанным полученным кристаллом левовращающего изовалерил-спирамицина II для получения левовращающего Карримицина (Carrimycin), изовалерил-спирамицин II которого является кристаллом левовращающего изовалерил-спирамицина II.
Пример 28. Приготовление левовращающего Карримицина (Carrimycin), изовалерил-спирамицин II которого является кристаллом левовращающего изовалерил-спирамицина II.
Остальные шаги те же, как Пример 27, отличаются только методом перекристаллизации, а именно:
(1) Растворяли твердые частицы левовращающего изовалерил-спирамицина II в смеси растворителей безводного метанола, абсолютного этилового спирта и безводного ацетона, в примененной смеси растворителей отношение объема безводного метанола к объему безводного ацетона и к объему абсолютного этилового спирта составляло 1: 10: 0,8;
(2) Потом наливали очищенную воду с одновременным перемешиванием, объем налитой воды в 9 раз больше суммы объема безводного метанола, абсолютного этилового спирта и безводного ацетона; скорость ввода очищенной воды 10 мл/мин; скорость перемешивания при наливе очищенной воды 60 р/мин;
(3) После налива очищенной воды температура снижалась до 15°С, скорость понижения температуры 3°С в час, при этом продолжали перемешивание скоростью 10 р/мин; таким образом, получали кристаллы левовращающего изовалерил-спирамицина II.
Диаграмма порошковой рентгеновской дифракции кристаллов левовращающего изовалерил-спирамицина II, измеренная Cu-Kα-лучами, аналогична Рис.7.
Пример 29. Приготовление левовращающего Карримицина (Carrimycin), изовалерил-спирамицин II которого является кристаллом левовращающего изовалерил-спирамицина II.
Остальные шаги те же, как Пример 27, отличаются только методом перекристаллизации, а именно:
(1) Растворяли твердые частицы левовращающего изовалерил-спирамицина II в смеси растворителей безводного метанола, абсолютного этилового спирта и безводного ацетона, в примененной смеси растворителей отношение объема безводного метанола к объему безводного ацетона и к объему абсолютного этилового спирта составляло 1: 5: 1;
(2) Потом наливали очищенную воду с одновременным перемешиванием, объем налитой воды в 7,5 раза больше суммы объема безводного метанола, абсолютного этилового спирта и безводного ацетона; скорость ввода очищенной воды 6 мл/мин; скорость перемешивания при наливе очищенной воды 40 р/мин;
(3) После налива очищенной воды температура снижалась до 10°С, скорость понижения температуры 2°С в час, при этом продолжали перемешивание скоростью 15 р/мин; таким образом, получали кристаллы левовращающего изовалерил-спирамицина II.
Диаграмма порошковой рентгеновской дифракции кристаллов левовращающего изовалерил-спирамицина II, измеренная Cu-Kα-лучами, аналогична Рис.7.
Пример 30. Приготовление левовращающего Карримицина (Carrimycin), изовалерил-спирамицин II которого является кристаллом левовращающего изовалерил-спирамицина II.
Остальные шаги те же, как Пример 27, отличаются только методом перекристаллизации, а именно:
(1) Растворяли твердые частицы левовращающего изовалерил-спирамицина II в смеси растворителей безводного метанола, абсолютного этилового спирта и безводного ацетона, в примененной смеси растворителей отношение объема безводного метанола к объему безводного ацетона и к объему абсолютного этилового спирта составляло 1: 3: 1;
(2) Потом наливали очищенную воду с одновременным перемешиванием, объем налитой воды в 7,5 раза больше суммы объема безводного метанола, абсолютного этилового спирта и безводного ацетона; скорость ввода очищенной воды 8 мл/мин; скорость перемешивания при наливе очищенной воды 45 р/мин;
(3) После налива очищенной воды температура снижалась до 12°С, скорость понижения температуры 2,5°С в час, при этом продолжали перемешивание скоростью 20 р/мин; таким образом, получали кристаллы левовращающего изовалерил-спирамицина II.
Диаграмма порошковой рентгеновской дифракции кристаллов левовращающего изовалерил-спирамицина II, измеренная Cu-Kα-лучами, аналогична Рис.7.
Пример 31. Приготовление левовращающего Карримицина (Carriniycin), изовалерил-спирамицин II которого является кристаллом левовращающего изовалерил-спирамицина II.
Остальные шаги те же, как Пример 27, отличаются только методом перекристаллизации, а именно:
(1) Растворяли твердые частицы левовращающего изовалерил-спирамицина II в смеси растворителей безводного метанола, абсолютного этилового спирта и безводного ацетона, в примененной смеси растворителей отношение объема безводного метанола к объему безводного ацетона и к объему абсолютного этилового спирта составляло 1: 6: 0,8;
(2) Потом наливали очищенную воду с одновременным перемешиванием, объем налитой воды в 5 раз больше суммы объема безводного метанола, абсолютного этилового спирта и безводного ацетона; скорость ввода очищенной воды 7 мл/мин; скорость перемешивания при наливе очищенной воды 60 р/мин;
(3) После налива очищенной воды температура снижалась до 12°С, скорость понижения температуры 1.2°С в час, при этом продолжали перемешивание скоростью 15 р/мин; таким образом, получали кристаллы левовращающего изовалерил-спирамицина II.
Диаграмма порошковой рентгеновской дифракции кристаллов левовращающего изовалерил-спирамицина II, измеренная Cu-Kα-лучами, аналогична Рис.7.
Пример 32. Приготовление левовращающего Карримицина (Carrimycin), изовалерил-спирамицин III которого является кристаллом левовращающего изовалерил-спирамицина III.
Очищали левовращающий Карримицин (Carrimycin), полученный по Примеру 3, согласно Примеру 22, собирали образцы левовращающего изовалерил-спирамицина III согласно времени выдержки левовращающего изовалерил-спирамицина III RT 48,009.
Потом приготовляли кристаллы из полученных белых порошковых частиц левовращающего изовалерил-спирамицина III, способ приготовления как ниже следующий:
(1) Растворяли твердые частицы левовращающего изовалерил-спирамицина III, полученные по Примеру 3, в смеси растворителей безводного метанола, абсолютного этилового спирта и безводного ацетона, в примененной смеси растворителей отношение объема безводного метанола к объему абсолютного этилового спирта и к объему безводного ацетона составляло 1: 10: 1;
(2) Потом наливали очищенную воду с одновременным перемешиванием, объем налитой воды в 2,5 раза больше суммы объема безводного метанола, абсолютного этилового спирта и безводного ацетона; скорость ввода очищенной воды 4 мл/мин; скорость перемешивания при наливе очищенной воды 30 р/мин;
(3) После налива очищенной воды температура снижалась до 5°С, скорость понижения температуры 1°С в час, при этом продолжали перемешивание скоростью 10 р/мин; таким образом, получали кристаллы левовращающего изовалерил-спирамицина III.
Порошковая рентгеновская дифракция полученных кристаллов левовращающего изовалерил-спирамицина III, измеренная Cu-Kα-лучами, показывала характеристический пик при 2θ, равном, 8,0°, 10,0°, 11,2°, 11,7°, 16,4°, 19,1°, 19,6°, 20,0°, 21,4°, 22,9°, 23,6° и 29,4°, диаграмма порошковой рентгеновской дифракции показана на Рис.8.
Удаляли ацетонитрил вращающим испарением из вышеуказанного левовращающего Карримицина (Carrimycin), очищенного от левовращающего изовалерил-спирамицина III, потом экстрагировали однократным этилацетатом, удаляли из экстракта этилацетат вращающим испарением для получения пастообразных проб; переплавливали полученные пробы петролейным эфиром, далее удаляли петролейный эфир вращающим испарением для получения левовращающего Карримицина (Carrimycin); далее перемешивали полученный левовращающий Карримицин (Carrimycin) с вышеуказанным полученным кристаллом левовращающего изовалерил-спирамицина III для получения левовращающего Карримицина (Carrimycin), изовалерил-спирамицин III которого является кристаллом левовращающего изовалерил-спирамицина III.
Пример 33. Приготовление левовращающего Карримицина (Carrimycin), изовалерил-спирамицин III которого является кристаллом левовращающего изовалерил-спирамицина III.
Остальные шаги те же, как Пример 32, отличаются только методом перекристаллизации, а именно:
(1) Растворяли твердые частицы левовращающего изовалерил-спирамицина III в смеси растворителей безводного метанола, абсолютного этилового спирта и безводного ацетона, в примененной смеси растворителей отношение объема безводного метанола к объему абсолютного этилового спирта и к объему безводного ацетона составляло 1: 10: 1;
(2) Потом наливали очищенную воду с одновременным перемешиванием, объем налитой воды в 9 раз больше суммы объема безводного метанола, абсолютного этилового спирта и безводного ацетона; скорость ввода очищенной воды 10 мл/мин; скорость перемешивания при наливе очищенной воды 60 р/мин;
(3) После налива очищенной воды температура снижалась до 15°С, скорость понижения температуры 3°С в час, при этом продолжали перемешивание скоростью 10 р/мин; таким образом, получали кристаллы левовращающего изовалерил-спирамицина III.
Диаграмма порошковой рентгеновской дифракции кристаллов левовращающего изовалерил-спирамицина III, измеренная Cu-Kα-лучами аналогична Рис.8.
Пример 34. Приготовление левовращающего Карримицина (Carrimycin), изовалерил-спирамицин III которого является кристаллом левовращающего изовалерил-спирамицина III.
Остальные шаги те же, как Пример 32, отличаются только методом перекристаллизации, а именно:
(1) Растворяли твердые частицы левовращающего изовалерил-спирамицина III в смеси растворителей безводного метанола, абсолютного этилового спирта и безводного ацетона, в примененной смеси растворителей отношение объема безводного метанола к объему абсолютного этилового спирта и к объему безводного ацетона составляло 1: 5: 0,8;
(2) Потом наливали очищенную воду с одновременным перемешиванием, объем налитой воды в 7,5 раза больше суммы объема безводного метанола, абсолютного этилового спирта и безводного ацетона; скорость ввода очищенной воды 6 мл/мин; скорость перемешивания при наливе очищенной воды 40 р/мин;
(3) После налива очищенной воды температура снижалась до 10°С, скорость понижения температуры 2°С в час, при этом продолжали перемешивание скоростью 15 р/мин; таким образом, получали кристаллы левовращающего изовалерил-спирамицина III.
Диаграмма порошковой рентгеновской дифракции кристаллов левовращающего изовалерил-спирамицина III, измеренная Cu-Kα-лучами, аналогична Рис.8.
Пример 35. Приготовление левовращающего Карримицина (Carrimycin), изовалерил-спирамицин III которого является кристаллом левовращающего изовалерил-спирамицина III.
Остальные шаги те же, как Пример 32, отличаются только методом перекристаллизации, а именно:
(1) Растворяли твердые частицы левовращающего изовалерил-спирамицина III в смеси растворителей безводного метанола, абсолютного этилового спирта и безводного ацетона, в примененной смеси растворителей отношение объема безводного метанола к объему абсолютного этилового спирта и к объему безводного ацетона составляло 1: 2: 1;
(2) Потом наливали очищенную воду с одновременным перемешиванием, объем налитой воды в 7,5 раза больше суммы объема безводного метанола, абсолютного этилового спирта и безводного ацетона; скорость ввода очищенной воды 8 мл/мин; скорость перемешивания при наливе очищенной воды 45 р/мин;
(3) После налива очищенной воды температура снижалась до 12°С, скорость понижения температуры 2,5°С в час, при этом продолжали перемешивание скоростью 20 р/мин; таким образом, получали кристаллы левовращающего изовалерил-спирамицина III.
Диаграмма порошковой рентгеновской дифракции кристаллов левовращающего изовалерил-спирамицина III, измеренная Cu-Kα-лучами, аналогична Рис.8.
Пример 36. Приготовление левовращающего Карримицина (Carrimycin), изовалерил-спирамицин III которого является кристаллом левовращающего изовалерил-спирамицина III.
Остальные шаги те же, как Пример 32, отличаются только методом перекристаллизации, а именно:
(1) Растворяли твердые частицы левовращающего изовалерил-спирамицина III в смеси растворителей безводного метанола, абсолютного этилового спирта и безводного ацетона, в примененной смеси растворителей отношение объема безводного метанола к объему абсолютного этилового спирта и к объему безводного ацетона составляло 1: 5: 0,8;
(2) Потом наливали очищенную воду с одновременным перемешиванием, объем налитой воды в 5 раз больше суммы объема безводного метанола, абсолютного этилового спирта и безводного ацетона; скорость ввода очищенной воды 7 мл/мин; скорость перемешивания при наливе очищенной воды 60 р/мин;
(3) После налива очищенной воды температура снижалась до 12°С, скорость понижения температуры 1.2°С в час, при этом продолжали перемешивание скоростью 15 р/мин; таким образом, получали кристаллы левовращающего изовалерил-спирамицина III.
Диаграмма порошковой рентгеновской дифракции кристаллов левовращающего изовалерил-спирамицина III, измеренная Cu-Kα-лучами, аналогична Рис.8.
Пример 37. Таблетки-ядра Левовращающий Карримицин (Carrimycin), содержащие кристалл левовращающего изовалерил-спирамицина I.
Рецептура и технология приготовления те же, как Пример 12, отличаются тем, что сырой порошок левовращающего Карримицина (Carrimycin) является сырым порошком левовращающего Карримицина (Carrimycin), полученным по Примеру 22, изовалерил-спирамицин I которого является кристаллом левовращающего изовалерил-спирамицина I.
Пример 38. Таблетки-ядра Левовращающий Карримицин (Carrimycin), содержащие кристалл левовращающего изовалерил-спирамицина II.
Рецептура и технология приготовления те же, как Пример 12, отличаются тем, что сырой порошок левовращающего Карримицина (Carrimycin) является сырым порошком левовращающего Карримицина (Carrimycin), полученным по Примеру 27, изовалерил-спирамицин II которого является кристаллом левовращающего изовалерил-спирамицина II.
Пример 39. Таблетки-ядра Левовращающий Карримицин (Carrimycin), содержащие кристалл левовращающего изовалерил-спирамицина III.
Рецептура и технология приготовления те же, как Пример 12, отличаются тем, что сырой порошок левовращающего Карримицина (Carrimycin) является сырым порошком левовращающего Карримицина (Carrimycin), полученным по Примеру 32, изовалерил-спирамицин III которого является кристаллом левовращающего изовалерил-спирамицина III.
Пример 40. Желатиновые капсулы Левовращающий Карримицин (Carrimycin), содержащие кристалл левовращающего изовалерил-спирамицина I.
Рецептура и технология приготовления те же, как Пример 13, отличаются тем, что сырой порошок левовращающего Карримицина (Carrimycin) является сырым порошком левовращающего Карримицина (Carrimycin), полученным по Примеру 23, изовалерил-спирамицин I которого является кристаллом левовращающего изовалерил-спирамицина I.
Пример 41. Желатиновые капсулы Левовращающий Карримицин (Carrimycin), содержащие кристалл левовращающего изовалерил-спирамицина II.
Рецептура и технология приготовления те же, как Пример 13, отличаются тем, что сырой порошок левовращающего Карримицина (Carrimycin) является сырым порошком левовращающего Карримицина (Carrimycin), полученным по Примеру 28, изовалерил-спирамицин II которого является кристаллом левовращающего изовалерил-спирамицина II.
Пример 42. Желатиновые капсулы Левовращающий Карримицин (Carrimycin), содержащие кристалл левовращающего изовалерил-спирамицина III.
Рецептура и технология приготовления те же, как Пример 13, отличаются тем, что сырой порошок левовращающего Карримицина (Carrimycin) является сырым порошком левовращающего Карримицина (Carrimycin), полученным по Примеру 33, изовалерил-спирамицин III которого является кристаллом левовращающего изовалерил-спирамицина III.
Аналогичны и вспомогательные материалы и способ приготовления других препаратов левовращающего Карримицина (Carrimycin), изовалерил-спирамицин I, II или III которого является кристаллом левовращающего изовалерил-спирамицина I, II или III.
Опытный пример 1. Эффективность препарата in vivo.
Метод испытания: приготовление раствора с заразными бактериями: взяли раствор с тестовыми бактериями, хранившийся в холодильнике при -80°С, оставили при комнатной температуре в течение 1 ч, взяли по 0,1 мл раствор с бактериями пневмококк, streptococcus pyogenes, энтерококк и засеяли в 2 мл раствор МН соответственно (с добавкой 10% инактивированной лошадиной сыворотки), засеяли раствор с золотистым стафилококком 0,1 мл в раствор МН 2 мл по вышеуказанному способу, положили в инкубатор 37°С и культивировали в течение 18 ч, получили основной раствор с бактериями, его растворяли 5% желудочной слизью и получили раствор с заразными бактериями, который стал летальной дозой (ЛД 100).
Предполагается пероральное применение левовращающего Карримицина (Carrimycin) в клинике, поэтому для испытания левовращающего Карримицина (Carrimycin) выбирают введение прямо в желудок. После введения в брюшную полость мышей 0,5 мл в летальной дозе животные проявляли заметное понижение двигательной активности, покой, взъерошенную шерсть и другие симптомы. После заражения ввели лекарства в дозе 0,2 мл прямо в желудок каждой мыши через 0,5-6 ч, не было никаких неблагоприятных воздействий. Наблюдали смертность особей в течение 7 дней, рассчитали среднюю эффективную дозу (ED50) лекарственных форм для зараженных мышей, используя программу Bliss, провели сравнение защитной эффективности с другими формами.
Результаты теста in vivo приведены на табл.3 и табл.4:
(µг/мл)
Результаты теста in vivo показали, что терапевтическая эффективность левовращающего Карримицина (Carrimycin) при лечении мышей, зараженных 12 штаммами бактерий, приведена на табл.3 и табл.4, что показало благоприятную защитную эффективность; а левовращающий Карримицин (Carrimycin), изовалерил-спирамицин I, II или III которого является кристаллом левовращающего изовалерил-спирамицина I, II или III, проявлял более благоприятную защитную эффективность.
Левовращающий Карримицин (Carrimycin) или препараты левовращающего Карримицина (Carrimycin), приготовленные для остальных примеров изобретения, прошли одинаковые испытания и дали аналогичные результаты.
Опытный пример 2. Эффективность препарата in vitro.
Определение клинически диссоцированных бактерий:
Метод испытания: применение метода двойного разбавления в плоскодонном сосуде: налили плавленый агар в определенном количестве в плоскодонный сосуд с различной концентрацией лекарственных средств, равномерно перемешали с лекарственным раствором (добавили стрептококк и энтерококк в 5% дефибринированную кровь овцы для получения кровяной питательной среды, гемофильную палочку в 7% дефибринированную кровь овцы для получения кровяной питательной среды, питательную среду с нейссерией гонорея в 7% дефибринированную кровь овцы для получения шоколадной питательной среды), после затвердения, растворили свежий культивированный раствор с бактериями до 106 CFU/мл, засеяли многоточечным шприцем в агар плоскодонного сосуда, содержащий левовращающий Карримицин (Carrimycin), полученный по Примеру 4, и контрольный азитромицин, ацетилспирамицин и эритромицин, культивировали в течение 18 ч при 37°С; культивировали нейссерию гонорея в 5% CO2 инкубаторе в течение 24 ч; культивировали легионеллу в 5% CO2 инкубаторе в течение 48 ч; культивировали анаэробную бактерию в анаэробной банке в течение 48 ч при 37°С. Наблюдали минимальную ингибирующую концентрацию, при которой антибактериальные средства смогут ингибировать выращивание бактерий, т.е. минимальную бактериостатическую концентрацию (MIC), рассчитали MIC50 и MIC90 средства и провели сравнение с контрольными лекарственными средствами.
Примечания:
MIC50 - 50% минимальная ингибирующая концентрация.
MIC90 - 90% минимальная ингибирующая концентрация,
Результаты испытания приведены на таблице:
Левовращающий Карримицин (Carrimycin) или препараты левовращающего Карримицина (Carrimycin), приготовленные для остальных примеров изобретения, прошли одинаковые испытания и дали аналогичные результаты.
Опытный пример 3.
Определение устойчивости к трахоматозным хламидиям и хламидии пневмониз во внешней среде
Метод испытания:
1. Засевали клетки HEp-2 и McCoy на пластине для культирования клеток с 96 дырочками (Фирмы Costar), 37°C, 5% CO2 культивировали в течение 48 ч., получали однослойные клетки.
2 Растворили вакцинируемые бактерии до 10000~20000 ifu (единица, формирующая хламидийное включение)/мл, засеяли по 0,1 мл/дырочка. Засеяли серотипные B/TW-5/OT, D/UW-3/Cx трахоматозных хламидии на пластину для культирования клеток McCoy, засеяли хламидию пневмониз CWL-029 на пластину для культирования клеток HEp-2. Сначала всосали раствор для культивирования клеток из пластины с 96 дырочками, потом засеяли по 0,1 мл/дырочка. В т.ч. не засевали в 4 дырочки (A11-D11) и 2 дырочки (С12 и D12).
3. После засева центрифугировали пластину для культивирования клеток с 96 дырочками на центрифуге J-6MC производства Компании Beckman-Coulter при центробежной силе x 1500 г и 35×С в течение 60 мин.
4. После центрифугирования брали засеянные трахоматозные хламидии или хламидии пневмониз, добавляли 4 вида разбавленных антибиотиковых средств (т.е. левовращающий Карримицин (Cammycin), полученный по Примеру 4, контрольный ацетилспирамицин, эритромицин и азитромицин) по 0,1 мл/дырочка соответственно.
5. Культивировали при 37°С в 5% CO2, далее культивировали на пластине для испытания на чувствительность к трахоматозным хламидиям в течение 48 ч., культивировали на пластине для испытания на чувствительность к хламидиям пневмониз в течение 72 ч. После культивирования взяли раствор с антибиотиковыми средствами и промыли два раза PBS (0,01 M, pH 7.4), обработали 100% метанолом при комнатной температуре в течение 15 мин.
6 Идентификация непрямым иммунофлюоресцентным окрашиванием: на пластину для испытания на чувствительность к трахоматозным хламидиям и к хламидиям пневмониз налили очищенные моноклональное антитело (N54 клонирование), устойчивое к трахоматозным хламидиям, и моноклональное антитело (P33 клонирование), устойчивое к хламидиям пневмониз по 50 мкл/дырочка, культивировали во влажной камере при 37°С в течение 30 мин., потом четыре раза промыли пластину с помощью специального аппарата, далее налили Rabbit anti rat fluorescent antibody (Фирма Sigma) по 50 мкл/дырочка, культивировали и промыли пластину по тому же методу и при тех же условиях. Налили глицерин с уплотнителем по 100 мкл/дырочка, наблюдали результаты под инвертированным флюоресцентным микроскопом Nikon (Diaphot-200).
7 Определение MIC: минимальная концентрация разбавленных антибиотиков на испытательной пластине с 96 дырочками, при которой полностью ингибировано выращивание тельца трахоматозных хламидий или хламидий пневмониз (во всех дырочках не было обнаружено включение с флюоресцентным окрашиванием).
Результаты испытания приведены ниже:
1. В отношении серотипных B/TW-5/OT трахоматозных хламидий, MIC Карримицина (Carrimycin) - 0,25 мкг/мл, далее идут эритромицин и азитромицин (0,5 мкг/мл), ацетилспирамицин (MIC - 4 мкг/мл) чуть хуже.
2. В отношении серотипных D/UW-3/Cx трахоматозных хламидий, Карримицин (Carrimycin), азитромицин обладают аналогичным внетелесным эффектом, MIC - 0.25 мкг/мл, относятся к чувствительным; далее идет эритромицин (0.5 мкг/мл), ацетилспирамицин (MIC - 2 мкг/мл) чуть хуже.
3. В отношении CWL-029 хламидий пневмониз, внетелесные эффекты Карримицина (Carrimycin) и эритромицина являются самыми чувствительными, MIC≤0,016 мкг/мл, азитромицин (MIC - 0,032 мкг/мл) относится к относительно чувствительному; ацетилспирамицин (MIC - 0,5 мкг/мл) чуть хуже.
4. В общем говоря, левовращающий Карримицин (Carrimycin), приготовленный согласно данному изобретению, обладает лучшим эффектом в отношении хламидий против других испытуемых лекарственных средств.
Левовращающий Карримицин (Carrimycin) или препараты левовращающего Карримицина (Carrimycin), приготовленные для остальных примеров изобретения, прошли одинаковые испытания и дали аналогичные результаты.
Опытный пример 4. Устойчивость к трахоматозным хламидиям и хламидии пневмониз во внешней среде.
1 Метод испытания: налили в дырочку стерильной пластины для культивирования клеток с 12 дырочками U-PPLO 0,8 мл (в контрольную дырочку для раствора с бактериями налили 0,9 мл, в контрольную дырочку для питательной среды налили 1,0 мл).
2 В тестовые дырочку налили 0,1 мл раствор с бактериями Uu 104CCU/мл, окончательное количество бактерий в дырочке 10 CCU3/мл (в контрольную дырочку для питательной среды не наливали раствор с бактериями).
3 Разбили на три группы (основной антибиотиковый раствор 100 мкг/мл, 10 мкг/мл, 1 мкг/мл), в экспериментальные дырочки, налили антибиотики (Левовращающий Карримицин (Carrimycin), полученный по Примеру 6, ацетилспирамицин, эритромицин и азитромицин) для испытания с помощью стерильного Tip по двукратно убывающей концентрации: 100 мкл, 50 мкл, 25 мкл, 12.5 мкл. (не наливали антибиотики в контрольные дырочки для раствора с бактериями, контрольные дырочки для питательной среды, тем временем, установили контрольные дырочки для антибиотика).
4 Равномерно перемешали вышеуказанные дырочки, уплотнили пластину клейкой лентой, положили в ингибитор для культивирования при 37°С.
5 Наблюдали и регистрировали результаты выращивания Uu в 17-24 ч. после испытания. Когда в контрольных дырочках для раствора с бактериями Uu показывает положительный рост, в этом случае под минимальной MIC данной формы понимается минимальная концентрация антибиотика, при которой можно ингибировать рост Uu, под окончательной MIC (24 ч) понимается MIC, измеренная по окончании испытания.
Четыре раза определяли MIC штаммов, устойчивых к уреаплазме уреалитикум, ниже приведены результаты определения:
Карримицин (Carrimycin): 0,025-0,125 мкг/мл,
Ацетилспирамицин: 0,5 мкг/мл,
Эритромицин: 5 мкг/мл,
Азитромицин: 0,025-0,125 мкг/мл.
Вышеприведенные результаты показали, что Карримицин (Carrimycin) обладают благоприятной устойчивостью к Uu, как азитромицин, превосходят ацетилспирамицин, в тесте данной группы эритромицин обладает наихудшей устойчивостью к Uu.
Левовращающий Карримицин (Carrimycin) или препараты Карримицина (Carrimycin), приготовленные для остальных примеров изобретения, прошли одинаковые испытания и дали аналогичные результаты.
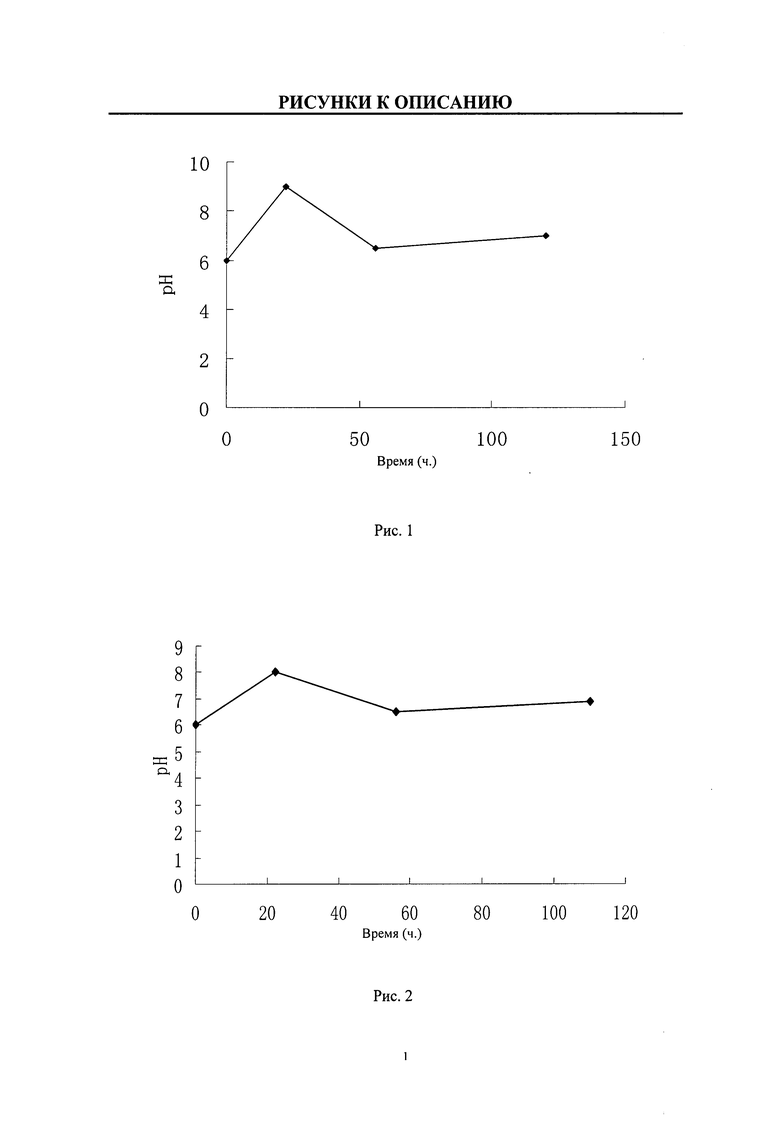
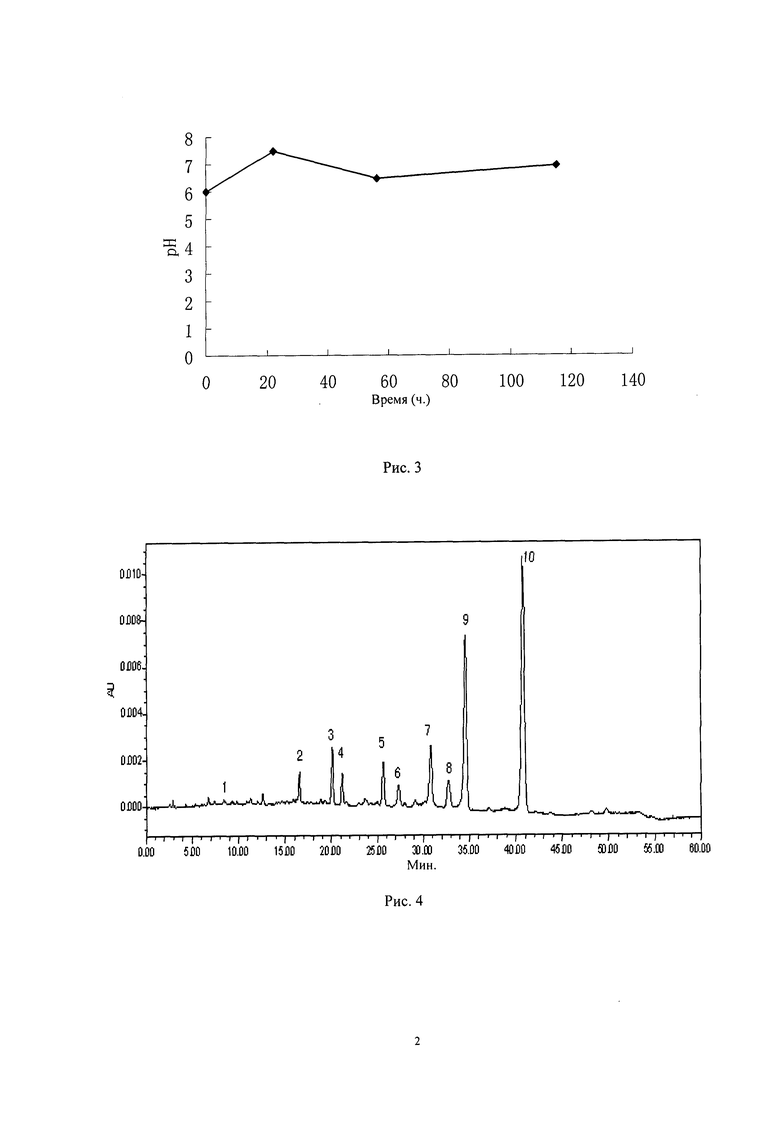
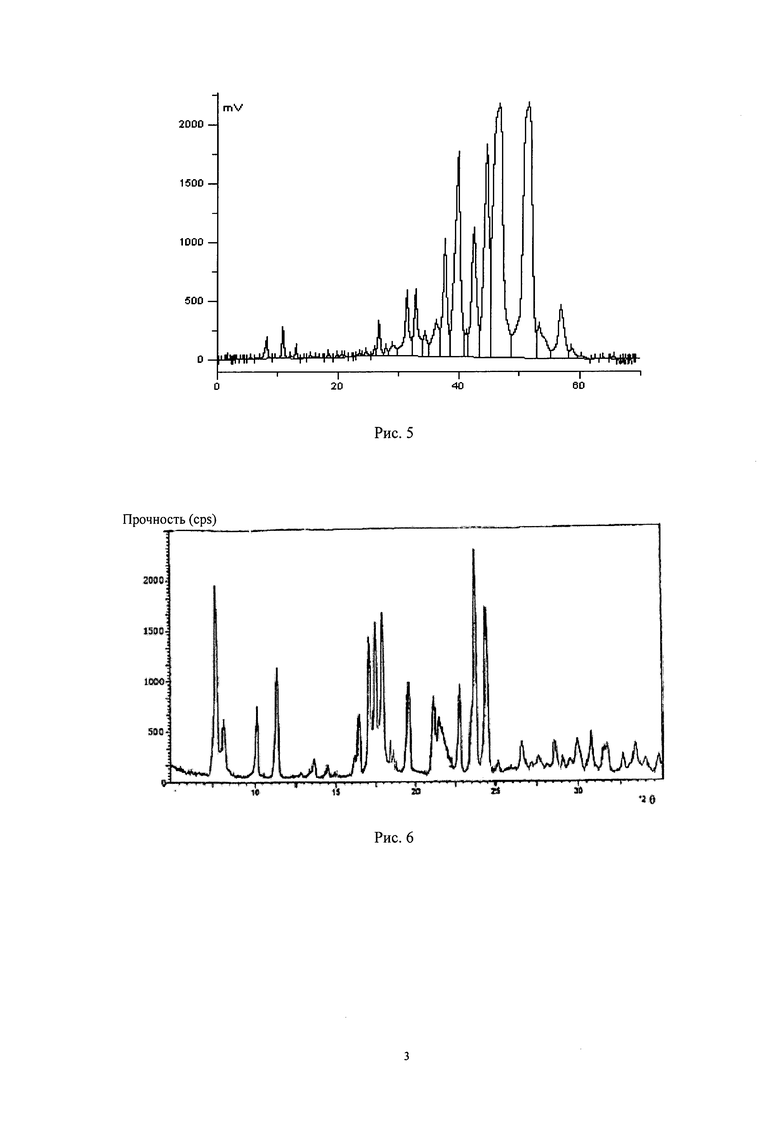
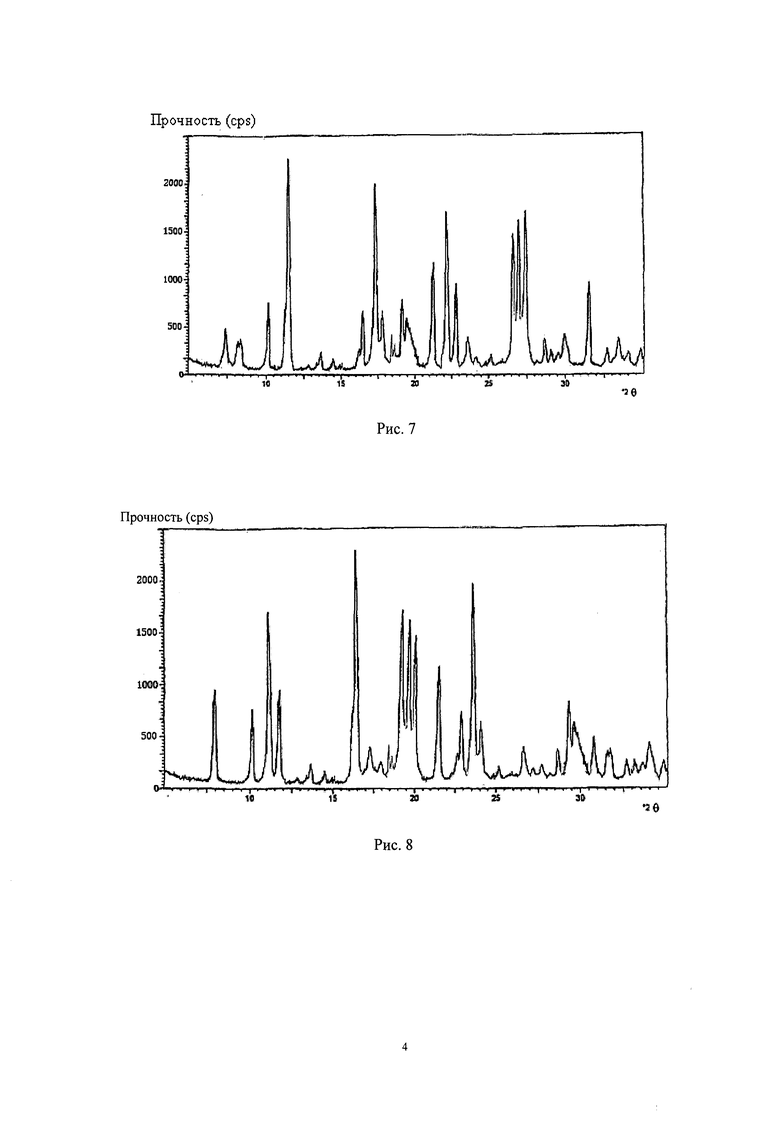
Изобретение относится к левокарримицину и его использованию для создания лекарств против инфекционных заболеваний. Предложенный левокарримицин представляет собой смесь изовалерилспирамицина III, II и I в качестве основного компонента и содержит один из следующих компонентов: изобутирилспирамицин III и II, бутирилспирамицин III и II, пропионилспирамицин III и II, а также ацетилспирамицин III и II, при этом содержание изовалерилспирамицина III не менее 30% по массе, суммарное содержание изовалерилспирамицина III, II и I не менее 60% по массе, а содержание ацилспирамицина от 80 до 98% по массе, и указанный левокарримицин также содержит спирамицин III и другие компоненты, среди которых содержание спирамицина III не превышает 1,0%, а суммарное содержание других компонентов составляет от 2,0 до 19% по массе, при этом изовалерилспирамицин III характеризуется пиками при 2θ=8,0°, 10,0°, 11,2°, 11,7°, 16,4°, 19,1°, 19,6°, 20,0°, 21,4°, 22,9°, 23,6° и 29,4°, изовалерилспирамицин II характеризуется пиками при 2θ=10,0°, 11,6°, 16,4°, 17,3°, 19,1°, 21,2°, 22,1°, 22,7°, 26,4°, 26,9°, 27,5° и 31,5° и изовалерилспирамицин I характеризуется пиками при 2θ=7,6°, 8,0°, 10,0°, 11,4°, 16,4°, 17,0°, 17,5°, 17,9°, 19,5°, 22,7°, 23,7° и 24,4° при дифракции рентгеновских лучей на порошке, измеренной с применением излучения Cu-Kα; причем указанный левокарримицин получен способом, включающим культивирование клонированного штамма WSJ-195 бактерий, продуцирующих спирамицин, сбраживание, экстракцию с последующей хроматографией и сбором целевого пика; перекристаллизацию левоизовалерилспирамицина I, II или III; смешивание полученного кристаллического левоизовалерилспирамицина I, II или III с левокарримицином, полученным в результате хроматографии. Предложен новый антибиотический состав, обладающий большей растворимостью и эффективностью. 4 н. и 14 з.п. ф-лы, 46 пр., 6 табл., 8 ил.
1. Левокарримицин для лечения и профилактики инфекционных заболеваний, отличающийся тем, что указанный левокарримицин представляет смесь изовалерилспирамицина III, II и I в качестве основных компонентов и содержит один из следующих компонентов: изобутирилспирамицин III и II, бутирилспирамицин III и II, пропионилспирамицин III и II, а также ацетилспирамицин III и II, при этом содержание изовалерилспирамицина III не менее 30% по массе, суммарное содержание изовалерилспирамицина III, II и I не менее 60% по массе, а содержание ацилспирамицина от 80 до 98% по массе, и указанный левокарримицин также содержит спирамицин III и другие компоненты, среди которых содержание спирамицина III не превышает 1,0%, а суммарное содержание других компонентов составляет от 2,0 до 19% по массе, при этом
угол оптического вращения указанного левокарримицина [α]D = -52° ~ -57° при растворении в хлороформе при температуре 25°С и концентрации 0,02 г/мл; и
указанный изовалерилспирамицин III является кристаллическим соединением левоизовалерилспирамицина III, дифракция рентгеновских лучей на порошке которого, измеренная с применением излучения Cu-Kα, имеет характерные пики при 2θ=8,0°, 10,0°, 11,2°, 11,7°, 16,4°, 19,1°, 19,6°, 20,0°, 21,4°, 22,9°, 23,6° и 29,4°;
изовалерилспирамицин II является кристаллическим соединением левоизовалерилспирамицина II, дифракция рентгеновских лучей на порошке которого, измеренная с применением излучения Cu-Kα, имеет характерные пики при 2θ=10,0°, 11,6°, 16,4°, 17,3°, 19,1°, 21,2°, 22,1°, 22,7°, 26,4°, 26,9°, 27,5° и 31,5°;
изовалерилспирамицин I является кристаллическим соединением левоизовалерилспирамицина I, дифракциия рентгеновских лучей на порошке которого, измеренная с применением излучения Cu-Kα, имеет характерные пики при 2θ=7,6°, 8,0°, 10,0°, 11,4°, 16,4°, 17,0°, 17,5°, 17,9°, 19,5°, 22,7°, 23,7° и 24,4°,
причем указанный левокарримицин получен способом, включающим культивирование клонированного штамма WSJ-195 бактерий, продуцирующих спирамицин, с содержанием гена 4″-изовалерилтрансферазы, 8~15 суток при 28~38°С на наклонной питательной среде, содержащей муку из бобового жмыха 2%, глюкозу 1%, крахмал 3%, СаСО3 0,5%, NaCl 0,4% и агар 2%, затем культивирование 40~80 часов при 25~30°С на питательной среде семени, где указанная среда семени содержит муку из бобового жмыха 1,5%, крахмал 3%, NaCl 0,4%, СаСО3 0,5%, пептон 0,3% и KH2PO4 0,05%, далее засев на питательную ферментационную среду, которая содержит глюкозу 0,5%, крахмал 6,0%, сухие дрожжи 0,5%, рыбную муку 2,0%, NH4NO3 0,6%, NaCl 1,0%, СаСО3 0,5%, KH2PO4 0,05%, MgSO4 0,1%, бобовое масло 0,5% и противовспениватель 0,02%, и проведение процесса сбраживания при рН 6,0~9,0 при 26-30°С в течение 72~120 часов, после чего осуществляют экстрагирование обработкой сбраживаемой жидкости сернокислым алюминием для получения фильтрата, стабилизируют уровень рН фильтрата до 8,5~9,0, экстрагируют бутилацетатом, промывают бутилацетатный экстракт обессоленной водой и 1% NaH2PO4, экстрагируют водой при рН 2,0~2,5 для получения водосодержащего экстракта, стабилизируют рН на уровне 4,5~5,5, удаляют остаточный бутилацетат с получением водного экстракта, который фильтруют и стабилизируют рН на уровне 8,5~9,0, после чего проводят осаждение осадка, промывают осадок и сушат для получения сырого левокарримицина; далее проводят
a) сепарирование и очищение левокарримицина с получением левоизовалерилспирамицина I, II или III, включающие очистку левокарримицина, полученного после предварительного выделения с применением препаративной высокоэффективной жидкостной хроматографии на колонке ODS с градиентным элюированием с помощью ацетонитрила и сбором целевого пика состава левоизовалерилспирамицина I, II или III;
b) перекристаллизация левоизовалерилспирамицина I, II или III с получением указанных кристаллического левоизовалерилспирамицина I, II или III;
причем кристаллы левоизовалерилспирамицина I получают растворением левоизовалерилспирамицина I в смешанном растворителе абсолютного метанола, абсолютного этилового спирта и безводного ацетона, в котором объемное соотношение метанола, абсолютного этилового спирта и безводного ацетона в смешанном растворителе составляет 1:0,1~10:0,5~1, с добавлением дистиллированной воды и охлаждением до 5°С~15°С;
кристаллы левоизовалерилспирамицина II получают растворением левоизовалерилспирамицина II в смешанном растворителе абсолютного метанола, абсолютного этилового спирта и безводного ацетона, в котором объемное соотношение метанола, абсолютного этилового спирта и безводного ацетона в смешанном растворителе составляет 1:0,1~10:0,5~1, с добавлением дистиллированной воды и охлаждением до 5°С~15°С;
кристаллы левоизовалерилспирамицина III получают растворением левоизовалерилспирамицина III в смешанном растворителе абсолютного метанола, абсолютного этилового спирта и безводного ацетона, в котором объемное соотношение метанола, абсолютного этилового спирта и безводного ацетона в смешанном растворителе составляет 1:0,1~10:0,5~1, с добавлением дистиллированной воды и охлаждением до 5°С~15°С;
c) удаление ацетонитрила из левокарримицина, полученного на этапе а), роторным испарением с последующим экстрагированием этилацетатом и устранение этилацетата из экстракта роторным испарением с получением пастообразной пробы, растворением такой пробы петролейным эфиром и удаление петролейного эфира роторным испарением;
d) смешивание кристаллического соединения левоизовалерилспирамицина I, II или III, полученного на этапе b), с левокарримицином, полученным на этапе с).
2. Левокарримицин по п. 1, отличающийся тем, что температура плавления указанного левокарримицина составляет от 112 до 122°С.
3. Левокарримицин по п. 1, отличающийся тем, что содержание ацилспирамицина составляет от 85 до 98% по массе.
4. Левокарримицин по п. 1, отличающийся тем, что содержание ацилспирамицина составляет от 90 до 98% по массе.
5. Левокарримицин по п. 1, отличающийся тем, что содержание ацилспирамицина составляет от 95 до 98% по массе.
6. Левокарримицин по п. 1, отличающийся тем, что угол оптического вращения указанного левокарримицина составляет -54°~-56°.
7. Левокарримицин по п. 1, отличающийся тем, что суммарное содержание других компонентов составляет 2,0~14,0% по массе.
8. Левокарримицин по п. 1, отличающийся тем, что суммарное содержание других компонентов составляет 2,0~9,0% по массе.
9. Левокарримицин по п. 1, отличающийся тем, что суммарное содержание других компонентов составляет 2,0~4,0% по массе.
10. Левокарримицин по п. 2, отличающийся тем, что температура плавления указанного левокарримицина составляет 114~120°С.
11. Левокарримицин по п. 2, отличающийся тем, что температура плавления указанного левокарримицина составляет 116~118°С.
12. Фармацевтическая композиция левокарримицина для лечения и профилактики инфекционных заболеваний, отличающаяся тем, что содержит левокарримицин по любому из пп. 1-11 и фармацевтически приемлемый носитель.
13. Композиция по п. 12, отличающаяся тем, что содержание указанного левокарримицина составляет 10~90% по массе фармацевтической композиции.
14. Композиция по п. 13, отличающаяся тем, что содержание указанного левокарримицина составляет 25~75% по массе фармацевтической композиции.
15. Композиция по п. 13, отличающаяся тем, что содержание указанного левокарримицина составляет 40~60% по массе фармацевтической композиции.
16. Применение указанного левокарримицина по любому из пп. 1-11 или указанной фармацевтической композиции левокарримицина по любому из пп. 12-15 для изготовления лекарственного средства для лечения и профилактики инфекционных заболеваний.
17. Применение по п. 16, отличающееся тем, что указанные инфекционные заболевания представляют заболевания, вызванные заражением грамположительными бактериями, золотистыми стафилококками, стрептококками пневмонии, микоплазмами пневмонии, хламидиями пневмонии, уреаплазмами уреалитикум, хламидиями трахоматис, пиогенными стрептококками, катаральными микрококками, гонококками, гриппозными бациллами, легионеллами или анаэробами.
18. Применение указанного левокарримицина по любому из пп. 1-11 или указанной фармацевтической композиции левокарримицина по любому из пп. 12-15 для изготовления бактерицидного лекарственного средства против указанных бактерий, включающих стрептококки пневмонии, стрептококки группы А, пиогенные стрептококки, энтерококки, золотистые стафилококки, эпидермальные стафилококки, катаральные кокки, гонококки, гриппозные бациллы, кишечные палочки, энтеротоксигенные кишечные палочки, энтеропатогенные кишечные палочки, энтероинвазивные кишечные палочки, синегнойные палочки, палочки Фридлиндера, вульгарный протей, брюшнотифозные палочки, ацинетобактерии, нитробактерии, серрации, шигеллы Зонне, шигеллы Флекснера, грибок Tritirachium album; легионеллы, такие как легионелла pneumophila, легионелла gormanii, легионелла bozemanii, легионелла dumoffii, легионелла jordanis и легионелла micdadei; анаэробы, такие как бактероиды фрагилис, бактероиды thetaiotaomicron, бактероиды vulgatus, бактероиды bacteroides, бактероиды prevotella, превотелла asaccharolyticus, превотелла oralis, палочка Плаута, фузобактерии russell, бифидобактерии, лактобациллы, пептострептококки, пропионовые бактерии акне, клостридии перфрингенс и дрожжеподобные грибки.
| JP 53034788 A, 31.03.1978 | |||
| CN 1554355 A, 15.12.2004 | |||
| CN 1405299 A, 31.03.1978 | |||
| Yang Ya-li et al, HPLC, 2009, 44(10), 1183-1186 | |||
| RU 2007108544 A, 20.09.2008. |
Авторы
Даты
2016-08-10—Публикация
2011-05-25—Подача