Область техники, к которой относится изобретение
Настоящее изобретение относится к применению амидов карбоновых кислот, таких как мочевина или ее производные, карбаматы, карбодиимиды и тиокарбамиды, в качестве азотных добавок в ферментационные среды для получения вторичных метаболитов, таких как правастатин, с целью достижения повышенных уровней биоконверсии, посредством ферментации подходящего экспрессирующего организма, таких как Е. coli, Streptomyces sp, Aspergillus sp, Rhizopus sp, Penicillium sp и Rhizomucor sp. Существенные аспекты изобретения, в частности, относятся к экспериментальному процессу ферментации с использованием оптимизированных параметров питательных сред, отвечающих за более высокий выход продукта в течение более коротких периодов образования.
Уровень техники
Экспрессирующие системы на основе дрожжей, таких как Pichia pastoris, обычно используют для экспрессии рекомбинантных белков, см. статью Cregg, J.М. et al., в Dev. fnd. Microbiol. 29:33-41; 1988. Экспрессирующая система P. pastoris использует индуцируемый метанолом промотор алкогольоксидазы (AO1), который контролирует ген, который кодирует экспрессию алкогольоксидазы, фермента, который катализирует первую стадию метаболизма метанола (см. статью Cregg J М. et al. в Bio/Technology 11:905-910; 1993). P. pastoris обладает потенциалом высоких уровней экспрессии, эффективной секреции внеклеточного белка, посттрансляционных модификаций, таких как гликозилирование, и роста до высоких значений густоты клеток на минимальной среде в биореакторных культурах.
Способ периодической ферментации с подпиткой с использованием Pichia pastoris описан в "Pichia fermentation Process Guidelines" (Руководство по процессу ферментации Pichia) фирмы Invitrogen Co. (San Diego, CA), далее его обозначают как контроль. Для получения рекомбинантных белков трансформированную Pichia pastoris выращивают до требуемой биомассы, соответствующей высокой густоте клеток, на глицерине в качестве источника углерода. Фазу образования продукта инициируют подпиткой метанолом, который служит индуктором и единственным источником углерода для культуры. Во время образования биомассы и фазы образования продукта аммиак, который служит источником азота, используют для контроля рН.
Несмотря на различные преимущества, даваемые дрожжевыми экспрессирующими системами, еще имеется необходимость в оптимизации испытывающей влияние питательных компонентов физико-химической среды для эффективной и максимальной продукции белка в биореакторах. Весьма необходимым является достижение высокой специфической продуктивности. Она может быть получена путем оптимизации исходного состава среды, стратегии подпитки метанолом и физико-химических параметров процесса. Имеются публикации, в которых сульфат аммония, фосфат аммония, диаммоний фосфат, нитрат калия, мочевину, кукурузный сироп, соевую муку, хлопковую муку, мелассы сахарного тростника и свеклы, пептоны, мучные гидролизаты и т.п. используют в качестве источника азота для выращивания бактерий, дрожжей и грибов. Использование различных источников углерода и азота для "роста" микроорганизмов представляет собой предшествующий уровень техники.
Однако оптимальная комбинация специально определенных источников углерода и азота для эффективной продукции вторичных метаболитов не раскрыта в литературе, соответствующей предшествующему уровню техники. Например, заявка WO/2007/005646 раскрывает продукцию этанола по сути путем культивирования рекомбинантных дрожжей на комплексной среде для роста, содержащей сложные углеводы, а также ряд более дешевых источников азота, таких как кукурузный сироп, кукурузный экстракт, дрожжевой автолизат и мочевина. Кроме того, в данном способе не используют индуцируемый метанолом механизм для роста или продукции в отличие от разработанного в настоящем изобретении способа получения рекомбинантных белков. Аналогично патент США 4288554 описывает непрерывный способ ферментации только для роста не-ГМО (негенномодифицированного) вида Candida с использованием мочевины в комбинации с другими источниками азота и основной солевой среды. В данном случае отсутствует какое-либо предположение или описание того, где мочевина может быть использована во время процесса ферментации (периодической, периодической с подпиткой, непрерывной) с использованием индуцируемой метанолом ГМО Pichia pastoris для эффективной продукции вторичных метаболитов и пептидов, например, правастатина, человеческого инсулина и его аналогов или ферментов, подобных липазе.
Неожиданно обнаружено, что использование описанной ферментационной среды, характеризующейся контролируемым добавлением некоторых богатых и легко растворимых источников азота, таких как мочевина, дополнительно в оптимизированных концентрациях относительно остаточных концентраций мочевины, а также остаточных концентраций аммиака, генерированных при гидролизе мочевины, дает повышенное образование продукта, продуктивность и, таким образом, уменьшенное время продукции.
Продукция рекомбинантных белков с использованием Е. coli давно известна, и экспрессирующая система хорошо изучена и понята. Экспрессирующую систему на основе Е. coli широко используют для получения таких молекул, как Г-КСФ (гранулоцитарный колониестимулирующий фактор), ГРЧ (человеческий гормон роста), стрептокиназа и многих других биологических продуктов. Для получения рекомбинантных белков трансформированную Е. coli выращивают до требуемой биомассы высокой густоты клеток на декстрозе в качестве источника углерода. Фазу образования продукта инициируют путем индукции с использованием требуемого индуктора и затем культуру только поддерживают с помощью минимального добавления питательных веществ до конца ферментации.
Многие годы культуры грибов используют для получения ценных биомолекул, например, ферментов, и других полезных молекул. Грибные культуры, например, Rhizopus, Aspergillus, Penicillium и т.п., используют в классической ферментации, предназначенной для получения широкого круга ферментов, например, липаз, амилаз, декстраназ и т.п., которые используют в пищевой, текстильной, кожевенной и других подобных отраслях промышленности. Актиномицеты, известные как основные компоненты для получения антибиотиков, широко используют для получения ряда вторичных метаболитов, полезных для человека. Одним из ключевых свойств грибов и актиномицетов является свойство "биоконверсии", например, гидроксилирования, эстерификации и т.п. Основное преимущество состоит в том, что биоконверсия специфична в отношении мишени, и можно получить продукты относительно высокой чистоты. Классическим примером является конверсия компактина в правастатин.
Методологические усовершенствования, известные в области техники, включают меры, относящиеся к технологии ферментации, такие как перемешивание или снабжение кислородом, либо модификацию, относящуюся к составу питательных сред, такую как модификация концентраций Сахаров во время ферментации, изменения обработки по ходу процесса или изменения, относящиеся к природным свойствам самого микроорганизма и т.п.
Неожиданно обнаружено, что использование ферментационной среды, характеризующейся контролируемым добавлением некоторых богатых илегко растворимых источников азота, таких как мочевина, дает повышенную продуктивность и/или повышенный уровень биоконверсии и, таким образом, уменьшенное время продукции.
Раскрытие изобретения
Главной целью настоящего изобретения является получение ферментационной среды для продукции вторичных метаболитов путем ферментации с использованием микроорганизмов.
Еще одной главной целью настоящего изобретения является разработка способа получения вторичных метаболитов.
Соответственно, настоящее изобретение относится к ферментационной среде, для получения вторичных метаболитов посредством повышения уровня потребления фосфата при ферментации с использованием микроорганизмов, характеризующаяся остаточной концентрацией мочевины в интервале от приблизительно 0,5 г/л до приблизительно 3 г/л и биоконверсией компактина в правастатин по меньшей мере на 35%.
Мочевина может выбираться из группы мочевины или ее производных, включающей диметилмочевину, диэтилмочевину, N-ацетилфенилмочевину, изопропилпилиденмочевину, фенилмочевину или их комбинации.
Мочевина может использоваться в форме жидкости, спрея, порошка или гранул.
Вышеупомянутые микроорганизмы согласно настоящему изобретению могут выбираться из группы микроорганизмов, включающей Е. coli, Streptomyces sp, Aspergillus sp, Rhizopus sp, Penicillium sp и Rhizomucor sp.
Соответственно, также настоящее изобретение раскрывает способ получения вторичных метаболитов путем ферментации с использованием микроорганизмов посредством повышения уровня потребления фосфата с помощью ферментационной среды, остаточная концентрация мочевины в которой лежит в интервале от приблизительно 3,5 г/л до приблизительно 3 г/л с получением биоконверсии компактина в правастатин по меньшей мере на 35%.
Изобретение предусматривает композицию питательных веществ, предназначенную для применения при разработке ферментационной среды, причем композиция содержит азотные компоненты, такие как амиды угольной кислоты, например, мочевину и вышеупомянутые родственные формы или производные, вместе с одним или более других компонентов ферментационной среды, которые специально оптимизированы для получения повышенного выхода инсулина или родственных аналогов производных продуктов за сокращенные периоды времени образования.
Неожиданно обнаружено, что использование определенной ферментационной среды с добавлением ряда азотсодержащих источников, таких как амиды угольной кислоты, например, мочевину и родственные формы или производные в специфических концентрациях не действует на рост дрожжевых клеток и не способствует повышению продуктивности.
Дополнительный азотный компонент, например, мочевину, можно добавить в форме жидкости, спрея, порошка или гранул.
Основная проблема изобретения состоит в том факте, что на продуктивность способа ферментации инсулина или аналога инсулина с помощью Pichia sp.сильно влияет содержание мочевины в среде для культивирования. Вследствие этого выход продукта значительно повышается, особенно при сокращенных периодах времени ферментации, при добавлении азотного компонента, такого как мочевина, в среду для культивирования.
Согласно наиболее предпочтительному варианту осуществления изобретения добавление мочевины в ферментационную среду повышает уровень потребления ключевого ингредиента "фосфата", который, в свою очередь, повышает продуктивность. Обнаружено, что чем быстрее происходит потребление фосфата, тем короче время цикла ферментации и, следовательно, выше продуктивность. Таким образом, впервые показан метаболизм мочевины наряду с фосфатом, который повышает уровень экспрессии вторичного метаболита, не воздействуя на профиль роста и сокращает время ферментации.
Согласно другому аспекту изобретения добавление мочевины обеспечивает повышенный уровень выделения продукта в конце ферментации при любом рН.
Таким образом, настоящее изобретение дает повышенные выходы вторичного метаболита, сокращенное время цикла конверсии, улучшенное использованием питательных веществ, вводимых в процесс, и в целом снижает капитальные затраты и себестоимость производства.
Подходящий микробный штамм для промышленного способа ферментации с использованием химически определенной среды может представлять собой штамм дикого типа, продуцирующий ценное соединение, представляющее интерес, при условии, что указанный штамм дикого типа имеет хорошие характеристики роста.
Предпочтительные микроорганизмы для применения в качестве организма-продуцента включают, например, Е. coli, Streptomyces sp, Aspergillus sp, Rhizopus sp, Penicillium sp и Rhizomucor sp.
Кроме того, подходящий микробный штамм для промышленного способа ферментации с использованием химически определенной среды может представлять собой штамм, который получают и/или усовершенствуют тем, что родительский штамм, представляющий интерес, подвергают классической мутагенной обработке или трансформации рекомбинантный ДНК, также при условии, что полученный в результате мутант или трансформированный микробный штамм имеет хорошие характеристики роста на химически определенной среде. Таким образом от характеристик роста родительского штамма на химически определенной среде будет зависеть, будут ли полученные в результате мутант или трансформированные штаммы иметь улучшенные или подобные характеристики роста на химически определенной среде по сравнению с характеристиками родительского штамма.
Как должен понимать компетентный специалист в области техники, оптимальная концентрация добавок амида угольной кислоты будет варьировать от клона к клону, хотя во всех случаях конечным результатом является получение более высокого титра за меньшее время.
Термин "ферментационные среды" или "ферментационная среда" относится к окружающей среде, в которой проводят ферментацию, который включает ферментационные субстраты и другое сырье, используемое ферментирующими микроорганизмами для образования специфического лекарственного продукта.
"Азотные компоненты" представляют собой субстраты, сырье или компоненты, которые являются источников ассимилируемого азота в ферментационной среде.
Согласно важному аспекту изобретения предпочтительным азотным компонентом в ферментационной среде являются амиды угольной кислоты, такие как мочевина. Они могут включать соединения, содержащие N-CO-N или родственные группы. Настоящее изобретение предусматривает использование производных мочевины, таких как диметилмочевина, диэтилмочевина, N-ацетил-N-фенилмочевина, изопропилиденмочевина, N-фенилмочевина и т.п., или их комбинаций.
Используемый термин "эффективное количество" представляет собой такое количество мочевины или ее производных, введение которого, согласно изобретению, в ферментационную среду приводит к образованию существенного количества/выхода белка, кроме того, за сокращенные периоды времени без воздействия на рост дрожжевых клеток.
Термин "ферментирующий организм" относится к любому микроорганизму, подходящему для использования в требуемом ферментационном процессе. Примеры ферментирующих организмов включают дрожжи. Примерами ферментирующих организмов в контексте настоящего изобретения являются Е. coli, Streptomyces sp, Aspergillus sp, Rhizopus sp, Penicillium sp и Rhizomucor sp., Pichia pastoris, Pichia sp., Saccharomyces sp., Saccharomyces cerevisiae, Kluyveromyces sp. или Hansenula polymorpha.
Изобретение может подойти для получения любого вторичного метаболита с использованием микроорганизма.
Термин "рекомбинантный", как используют в данном контексте для описания белка или полипептида, означает полипептид, продуцируемый путем экспрессии рекомбинантного полинуклеотида. Термин "рекомбинантный", как используют в данном контексте в отношении клеток, означает клетки, которые могут быть или были использованы в качестве реципиентов для рекомбинантных векторов или другой перенесенной ДНК, и включает потомство исходной клетки, которая была трансфицирована. Следует иметь в виду, что потомство одной родительской клетки может быть не полностью идентичными по морфологии или по комплементу геномной либо общей ДНК исходному родительскому организму вследствие случайной или направленной мутации.
Термин ”полипептид”, ”белок”, ”пептид” относится к полимеру аминокислот и не относится кспецифической длине продукта; таким образом, пептиды, олигопептиды и белки включены в определение полипептида. Данный термин также не относится к постэкспрессионным модификациям полипептида или исключает их, хотя химические или постэкспрессионные модификации данных полипептидов могут быть включены или исключены в качестве специфических вариантов осуществления. В одном варианте осуществления молекула представляет собой полипептид или его родственные аналоги либо их производные. Предпочтительно, когда полипептид представляет собой циклический пептид. Согласно другому предпочтительному варианту осуществления, полипептид представляетсобой нециклический пептид. В еще одном предпочтительном варианте осуществления полипептид выбран из группы, содержащей эксендин, эптифибатид, атосибан, ферменты, такие как липаза, карбоксипептидаза и т.п.
Инсулин представляетсобой полипептид из 51 аминокислоты, которые распределены между двумя цепями аминокислот: А-цепь из 21 аминокислоты и В-цепь из 30 аминокислот. Цепи соединены друг с другом 2 дисульфидными мостиками. Это определение включает использование не только природных инсулинов, но также инсулиновое производных и аналогов. Соединение инсулина может, например, представлять собой соединение инсулина млекопитающего, такое как человеческий инсулин, или производные либо аналоги соединения инсулина.
Инсулиновые производные представляют собой производные природных инсулинов, а именно человеческого инсулина или инсулинов животных, которые отличаются от соответствующего в других отношениях идентичного природного инсулина заменой по меньшей мере одного природного остатка аминокислоты и/или введением по меньшей мере одного остатка аминокислоты и/или органического остатка. Следует иметь в виду, что термин инсулин определяет полипептид, состоящий из В- и А-цепи. Инсулиновое производное может быть по меньшей мере на 60% гомологичным природному инсулину. Инсулиновое производное может быть даже в большей степени гомологичным, например, по меньшей мере приблизительно на 75%, или по меньшей мере приблизительно на 90% гомологичным природному инсулину. Как правило, инсулиновые производные имеют несколько модифицированное действие по сравнению с человеческим инсулином.
При получении инсулина и инсулиновых производных посредством генетической инженерии предшественник инсулина, часто экспрессируют "проинсулин", содержащий В-, С- и А-цепи. Данный проинсулин можно превратить в инсулин или инсулиновое производное путем ферментного или химического удаления С-цепи после соответствующей и правильной укладки и образования дисульфидных мостиков. Проинсулиновое производное может быть по меньшей мере на 60% гомологичным по В- и А-цепи природному проинсулину. Однако связывающий С-пептид может быть выбран как полностью отличающийся от любого известного С-пептида. Проинсулиновое производное может быть даже в большей степени гомологичным, например, по меньшей мере приблизительно на 75%, или по меньшей мере приблизительно на 90% гомологичным природному проинсулину.
Согласно ряду вариантов осуществления изобретения рекомбинантный продукт инсулина представляет собой IN-105. Полученный в результате лекарственный продукт специфически относится к молекуле IN-105. IN-105 представляет собой молекулу инсулина, конъюгированную по е-аминокислоте лизину в положении В29 В-цепи инсулина с амфифильным олигомером структурной формулы СН3О-(С4Н2O)3-СН2-СН2-СООН. Молекула может быть моноконъюгированной по А1, В1 и В29, диконъюгированной по различным комбинациям А1, В1 и В29 или триконъюгированной при различным комбинациям А1, В1 и В29.
Согласно другому аспекту изобретения рекомбинантный белок, полученный путем ферментации с использованием ферментационной среды, соответствующей настоящему изобретению, представляет собой циклический или нециклический пептид.
Согласно другому аспекту изобретения рекомбинантный белок, полученный путем ферментации с использованием ферментационной среды, соответствующей настоящему изобретению, представляет собой фермент.
В одном аспекте изобретения протокол ферментации может включать три фазы: загрузки, подпитки (необязательно) и фазу индукции метанолом.
Согласно наиболее существенному аспекту изобретения ферментационная среда, используемая в контексте данного изобретения, включает следующие компоненты. Кроме того, включен способ приготовления среды.
Отдельные компоненты растворяют в минимальном объеме воды в вышеуказанной последовательности и стерилизуют при 121ºС в течение 1 часа. Раствор микроэлементов и D-биотина (предварительно стерилизованного фильтрацией) асептически добавляют в среду, каждый со скоростью 4,35 мл/л среды (плотность раствора микроэлементов составляет 1,05, а D-биотина - 1,0.
Все соли растворяют одну за другой в питьевой воде и стерилизуют фильтрацией через устройство для стерилизации фильтрацией.
Приготовление раствора биотина:
Биотин растворяют в питьевой воде и стерилизуют фильтрацией через устройство для стерилизации фильтрацией.
Подпитка дрожжевым экстрактом и соевым пептоном:
Кроме того, подпитку дрожжевым экстрактом и соевым пептоном также
вводят во время ферментации. Ее следует готовить следующим образом:
Компоненты растворяют и с помощью питьевой воды получают необходимый объем. Затем раствор стерилизуют при 121º-123ºС в течение 90 мин. Плотность подпитки соевым пептоном составляет приблизительно 1,05.
Подпитка метанолом:
12,0 мл раствора микроэлементов, 12 мл растворов D-биотина и 40 г мочевины добавляют на литр метанола перед введением подпитки. Способ ферментации:
Способ ферментации включает фазу роста клеток в загрузке, необязательную фазу подпитки глицерином загрузки и фазу индукции метанолом. Фаза роста клеток в загрузке
Мониторирование и контроль загрузки
Параметры продукции ферментера задают исходно и контролируют следующим образом:
Фаза индукции метанола (ФИМ)
Подпитку метанолом начинают сразу после окончания фазы загрузки. Метанол стерилизуют (в режиме загрузки) путем фильтрации с использованием коммерчески доступного стерилизующего фильтра.
В начале ФИМ, рН подводят до значения 4,0±0,1 или 6,0±0,1 или 6,3±0,1 в зависимости от экспрессии белка в среду (варьирует от продукта к продукту, а также от клона к клону) и температуру доводят до приблизительно 18-24ºС (варьирует от продукта к продукту, а также от клона к клону).
Одновременно другую подпитку, подпитку дрожжевым экстрактом и соевым пептоном также начинают в ферментере со скоростью 0,4 г/л/час. исходного объема.
Мониторирование и контроль ФИМ
Согласно другому аспекту изобретения посевной материал готовят путем культивирования лиофилизированной глицериновой исходной культуры на минимальной глицериновой среде (МГС). Основные ферментационные среды, полученные из "Control Pichia process guidelines" (Руководство по контролю процессов с использованием Pichia), содержат ортофосфорную кислоту, дегидратированный сульфат кальция, сульфат калия, сульфат магния гептагидрат, гидроксид калия, глицерин, микроэлементы и D-биотин. Питательная среда для культивирования должна содержать также известные соединения в маленьких или следовых количествах, которые обычно вводят в ферментационную среду для культивирования, такие как водорастворимые соединения Са, Mg, Mn, Fe, К, Со, CU, Zn, В, Мо, BR и I. Могут также присутствовать другие микроэлементы. Раствор микроэлементов, соответствующий настоящему изобретению, в частности, включает сульфат меди пентагидрат, йодид натрия, сульфат марганца моногидрат, молибдат натрия дигидрат, борную кислоту, хлорид кобальта гексагидрат, хлорид цинка, сульфат двухвалентного железа гептагидрат. Хотя концентрация каждого ингредиента среды специально оптимизирована для каждого продукта, ниже приводят контрольные среды:
Контрольные среды
Ферментационная основная солевая среда:
На 1 литр смешивают следующие ингредиенты:
Добавляют в ферментер с водой до соответствующего объема и стерилизуют.
Микроэлементы РТМ1
Смешивают следующие ингредиенты:
Фильтруют, стерилизуют и хранят при комнатой температуре.
При смешивании данных ингредиентов может появиться мутный осадок. Среды можно профильтровать, стерилизовать и использовать.
В дополнение к вышеописанной контрольной среде включают мочевину в различных концентрациях.
Согласно еще одному аспекту изобретения образование биомассы во время фазы роста в загрузке происходит до тех пор, пока в исходной среде присутствует глицерин. Кроме того, образование биомассы не является важным фактором и его осуществляют только в немногих случаях.
Согласно следующему аспекту изобретения после достижения требуемой биомассы культуру индуцируют постоянной подпиткой метанолом и мочевиной. Во время подпитки метанолом проводят также подпитку дрожжевым экстрактом и раствором пептона.
Согласно еще одному аспекту скорость подпитки метанолом составляет до 20 г/л/час. Как понимает любой компетентный специалист, оптимизация скорости подпитки для дальнейшего повышения уровней продукции предусмотрена настоящим изобретением.
Наряду с этим изобретение будет теперь описано в связи с некоторыми предпочтительными вариантами осуществления в следующих примерах, чтобы можно было полнее понять и оценить его аспекты. Ограничить изобретение данными конкретными вариантами осуществления не предусматривают. Напротив, предполагают покрыть все альтернативные варианты, модификации и эквивалентные решения, поскольку они могут быть включены в объем изобретения, как определено в прилагаемой формуле изобретения. Таким образом, следующие примеры, которые включают предпочтительные варианты осуществления, будут служить для иллюстрации практической реализации данного изобретения, причем следует иметь в виду, что показанные подробности приведены только в качестве примера и с целью иллюстративного обсуждения предпочтительных вариантов осуществления настоящего изобретения и присутствуют для представления материала, который считают наиболее полезным и легко понимаемым описанием способов ферментации, а также принципов и концептуальных аспектов изобретения.
Изобретение предусматривает питательную композицию, предназначенную для использования при приготовлении ферментационной среды, причем композиция содержит азотные компоненты, такие как карбамиды, например, мочевину и родственные формы или производные, например, карбаматы, карбодиимиды, тиокарбамиды, вместе с одним или более других компонентов ферментационных сред, которые специально оптимизированы с целью получения повышенных выходов продукта за сокращенные периоды времени продукции.
Настоящее изобретение демонстрирует использование амидов угольной кислоты, таких как мочевина или ее производные карбаматы, кабодиимиды и тиокарбамиды, в качестве азотных добавок в ферментационные среды для получения белков с целью достижения повышенного уровней биоконверсии при использовании Е. coli, Actinomycetes и грибных культур. Существенные аспекты изобретения, в частности, относятся к экспериментальному процессу ферментации с использованием оптимизированных параметров питательных сред, отвечающих за повышенную продуктивность. Принцип настоящего изобретения можно применить для продукции широкого круга белков и вторичных метаболитов посредством ферментации подходящего экспрессирующего организма.
Изобретение предусматривает питательную композицию, предназначенную для использования при приготовлении ферментационной среды, причем композиция содержит азотные компоненты, такие как карбамиды, например, мочевину и родственные формы или производные, например, карбаматы, кабодиимиды и тиокарбамиды, вместе с одним или более других компонентов ферментационной среды, которые специально оптимизированы с целью получения повышенных выходов продукта за сокращенные периоды времени продукции.
Таким образом изобретение делает возможным повысить уровень биоконверсии для получения повышенных выходов продуктов, например, способ ферментации правастатина (периодической, периодической с подпиткой, непрерывной) с использованием актиномицетов и/или грибных культур.
Данное изобретение, кроме того, повышает уровень продукции ферментов, например, липазы, амилаз, целлюлаз в периодических или периодических с подпиткой процессах при использовании грибных культур.
Согласно одному аспекту изобретения азотным компонентом, который специфически воздействует на выходы и время продукции, являются амиды угольной кислоты, например, мочевина или ее производные и вышеупомянутые родственные соединения.
Согласно другому аспекту изобретения предпочтительными микроорганизмами являются штаммы семейства Enterobacteriaceae, предпочтительно, когда для использования в качестве организма-продуцента включают, но без ограничения перечисленным Е. coli.
Согласно другому аспекту изобретения предпочтительными микроорганизмами являются штаммы актиномицетов и/или семейства грибов, включая, но без ограничения Streptomyces sp, Actinoplanes sp, Aspergillus sp, Rhizopus sp и Penicillium sp.
Другие объекты, свойства, преимущества и аспекты настоящего изобретения будут очевидны для компетентных специалистов из следующего описания. Однако, следует иметь в виду, что следующее описание и специфические примеры, несмотря на то, что они показывают предпочтительные варианты осуществления изобретения, приведены только в качестве иллюстрации. Различные изменения и модификации, входящие в сущность и объем раскрытого изобретения, легко станут очевидными для компетентных специалистов в области техники из прочтения следующего описания и из прочтения других разделов настоящего описания.
Изобретение предусматривает питательную композицию, предназначенную для использования при приготовлении ферментационной среды, причем композиция содержит азотные компоненты, такие как амиды угольной кислоты, например, мочевину и родственные формы или вышеописанные производные, вместе с одним или более других компонентов ферментационных сред, которые специально оптимизированы с целью получения требуемого белкового продукта или вторичных метаболитов.
Неожиданно обнаружено, что использование определенной ферментационной среды с добавлением ряда азотсодержащих источников, таких как амиды угольной кислоты, например, мочевину и родственные формы или производные, в специфических концентрациях не воздействуют на рост ферментирующего организма, но способствует повышению продуктивности.
Дополнительный азотный компонент, например мочевину, можно добавить в форме жидкости, спрея, порошка или гранул.
Подходящий микробный штамм для промышленного способа ферментации может представлять собой любой штамм дикого типа, продуцирующий ценное соединение, представляющее интерес, при условии, что указанный штамм дикого типа имеет хорошие характеристики роста.
Кроме того, подходящий микробный штамм для промышленного способа ферментации может представлять собой штамм, который получают и/или усовершенствуют тем, что родительский штамм, представляющий интерес, подвергают классической мутагенной обработке или трансформации рекомбинантный ДНК, также при условии, что полученный в результате мутант или трансформированный микробный штамм имеет хорошие характеристики роста. Таким образом от характеристик роста родительского штамма будет зависеть, будут ли полученный в результате мутант или трансформированные штаммы иметь улучшенные или подобные характеристики роста по сравнению с характеристиками родительского штамма.
Способ ферментации с использованием данной ферментационной среды усовершенствован в отношении одного или более параметров, выбранных из группы, состоящей из концентрации продукта (продукт/объем), выхода продукта (образованный продукт/потребленный источник углерода) и образование продукта (образованный продукт/объем и время), или дополнительных других параметров способа и их комбинаций.
Как будет иметь в виду компетентный специалист в области техники, оптимальная концентрация подпиток амидами угольной будет варьировать от клона к клону, хотя конечным результатом во всех случаях является получение более высоких титров за меньшее время во кислоты.
Термин "ферментационные среды" или "ферментационная среда" относится к окружающей среде, в которой проводят ферментацию, который включает ферментационные субстраты и другое сырье, используемое ферментирующими микроорганизмами для образования специфического лекарственного продукта.
Ферментационная среда в настоящем изобретении должна содержать подходящие углеродные субстраты. Подходящие субстраты могут включать, но без ограничения перечисленных, моносахариды, такие как глюкоза и фруктоза, полисахариды, такие как крахмал или целлюлоза, либо их смеси и другие ингредиенты, кукурузный сироп, мелассу сахарной свеклы, глицерин и ячменный солод. Кроме того, углеродный субстрат может также представлять собой одноуглеродные субстраты, такие как диоксид углерода, или метанол, для которого показана метаболическая конверсия в ключевые биохимические промежуточные продукты. Следовательно, предусматривают, что источник углерода, используемый в настоящем изобретении, может охватывать широкий круг углеродсодержащих субстратов и будет ограничен только выбором организма. В дополнение к соответствующему источнику углерода ферментационные среды должны содержать подходящие минералы, соли, буферы и другие компоненты, известные компетентным специалистам в области техники, подходящим для роста культур и стимуляции экспрессии требуемого белка или конечного продукта.
"Азотные компоненты" представляют собой субстраты, сырье или компоненты, которые являются источником ассимилируемого азота в ферментационной среде.
Подходящие источники азота могут включать, но без ограничения перечисленных, соевую муку, хлопковую муку, пептоны, дрожжевой экстракт, казеин, гидролизаты казеина, кукурузный сироп и неорганические соли иона аммония, нитраты и нитриты.
Согласно существенному аспекту изобретения предпочтительной добавкой в ферментационную среду являются амиды угольной кислоты, такие как мочевина. Они будут включать соединения, содержащие N-CO-N или родственные группы. Настоящее изобретение предусматривает использование производных мочевины, таких как диметилмочевина, диэтилмочевина, N-ацетил-N-фенилмочевина, изопропилпилиденмочевина, N-фенилмочевина и т.п., или их комбинации.
Используемый термин "эффективное количество" представляет собой такое количество мочевины или ее производных, введение которого, согласно изобретению, в ферментационную среду приводит к образованию существенного количества/выхода образуемого продукта, кроме того, за сокращенные периоды времени без воздействия на рост дрожжевых клеток.
Термин "ферментирующий организм" относится к любому микроорганизму, подходящему для использования в требуемом ферментационном процессе. Согласно другому аспекту изобретения предпочтительными микроорганизмами являются штаммы бактерий, актиномицеты и/или виды грибов, предпочтительно для использования в качестве организма-продуцента включают, но без ограничения перечисленным, E.coli, Streptomyces sp, Actinoplanes sp, Aspergillus sp, Rhizopus sp, Penicillium sp и т.п.
Термин "рекомбинантный", как используют в данном контексте для описания белка или полипептида, означает полипептид, продуцируемый путем экспрессии рекомбинантного полинуклеотида. Термин "рекомбинантный", как используют в данном контексте в отношении клеток, означает клетки, которые могут быть или были использованы в качестве реципиентов для рекомбинантных векторов или другой перенесенной ДНК, и включает потомство исходной клетки, которая была трансфицирована. Следует иметь в виду, что потомство одной родительской клетки может быть не полностью идентичным по морфологии или по комплементу геномной либо общей ДНК исходному родительскому организму вследствие случайной или направленной мутации.
Термин "полипептид", "белок", "пептид" относится к полимеру аминокислот и не относится к специфической длине продукта; таким образом, пептиды, олигопептиды и белки включены в определение полипептида. Данный термин также не относится или исключает постэкспрессионные модификации полипептида, хотя химические или постэкспрессионные модификации данных полипептидов могут быть включены или исключены в качестве специфических вариантов осуществления. В одном варианте осуществления молекула представляет собой полипептид или его родственные аналоги либо их производные. Предпочтительно, когда полипептид представляет собой циклический пептид. Согласно другому предпочтительному варианту осуществления, полипептидпредставляетсобой нециклический пептид. В еще одном предпочтительном варианте осуществления рекомбинантный белок получают путем ферментации с использованием ферментационной среды, соответствующей настоящему изобретению.
Один из вариантов осуществления настоящего изобретения относится к получению гранулоцитарного колониестимулирующего фактора. Гранулоцитарный колониестимулирующий фактор представляет собой фармацевтически активный белок, который регулирует пролиферацию, дифференцировку и функциональную активацию нейтрофильных гранулоцитов (см. статьи Metcalf, Blood 67:257 (1986); Yan, et al. Blood 84(3): 795-799 (1994); Bensinger, et al. Blood 81(11): 3158-3163 (1993); Roberts, et al., Expt'I Hematology 22: 1156-1163 (1994); Neben, etal. Blood 81(7): 1960-1967(1993)). Г-КСФ означает природный или рекомбинантный белок, предпочтительно человеческий, как получают из традиционного источника, такого как ткани, синтез белка, клеточная культура с природными или рекомбинантными клетками. Включают любой белок, обладающий активностью Г-КСФ, например, мутеины или иным образом модифицированные белки.
"Вторичный метаболит" представляет собой соединение, полученное из первичных метаболитов, которые продуцирует организм, не является первичным метаболитом и не требуется для роста микроорганизма в стандартныхусловиях. Соединения вторичных метаболитов можно превратить в полезные соединения путем последующей химической конверсии или последующей биотрансформации. В таком случае обеспечение повышенной доступности данных промежуточных соединений привело бы, кроме того, к повышенной продукции конечного полезного соединения, которое само по себе можно рассматривать в данном контексте как вторичный метаболит.
В одном аспекте изобретения протокол ферментации может включать две фазы: периодическую и периодическую с подпиткой (необязательно).
Краткое описание чертежей
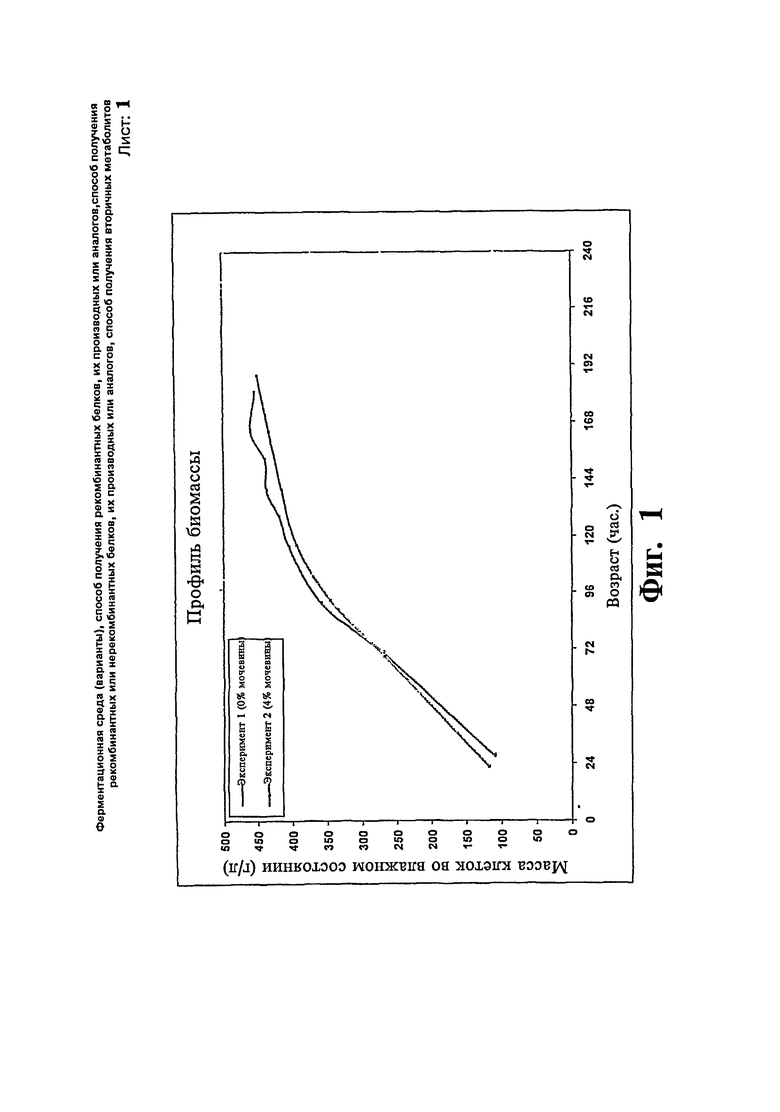
Фиг.1: Сравнение профиля биомассы предшественника IN-105 с добавлением/без добавления мочевины.
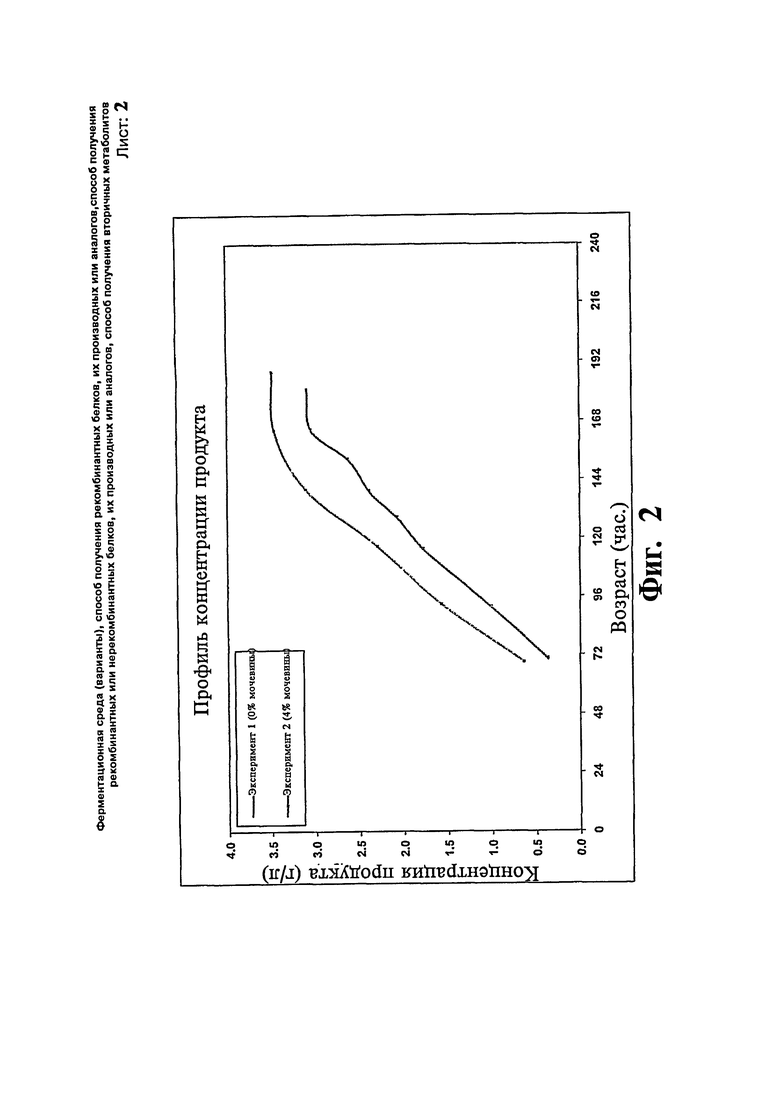
Фиг.2: Сравнение профиля концентрации продукта предшественника IN-105 с добавлением/без добавления мочевины.
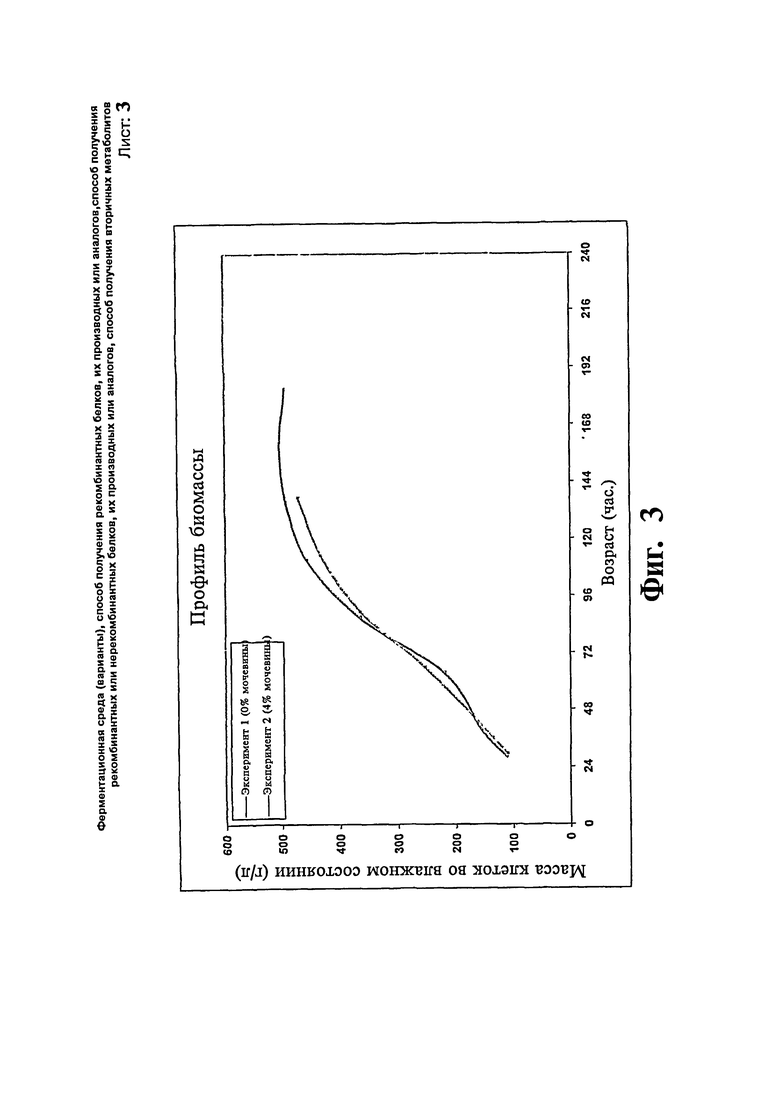
Фиг.3: Сравнение профиля биомассы предшественника инсулина с добавлением/без добавления мочевины.
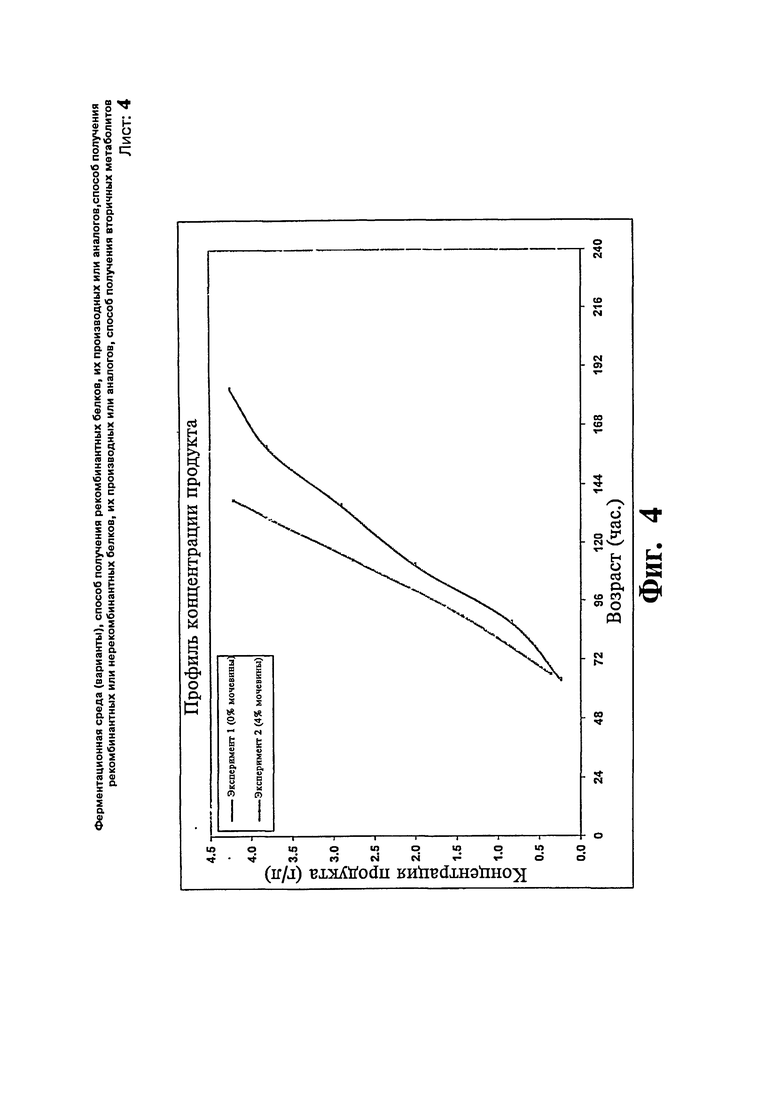
Фиг.4: Сравнение профиля концентрации продукта предшественника инсулина с добавлением/без добавления мочевины.
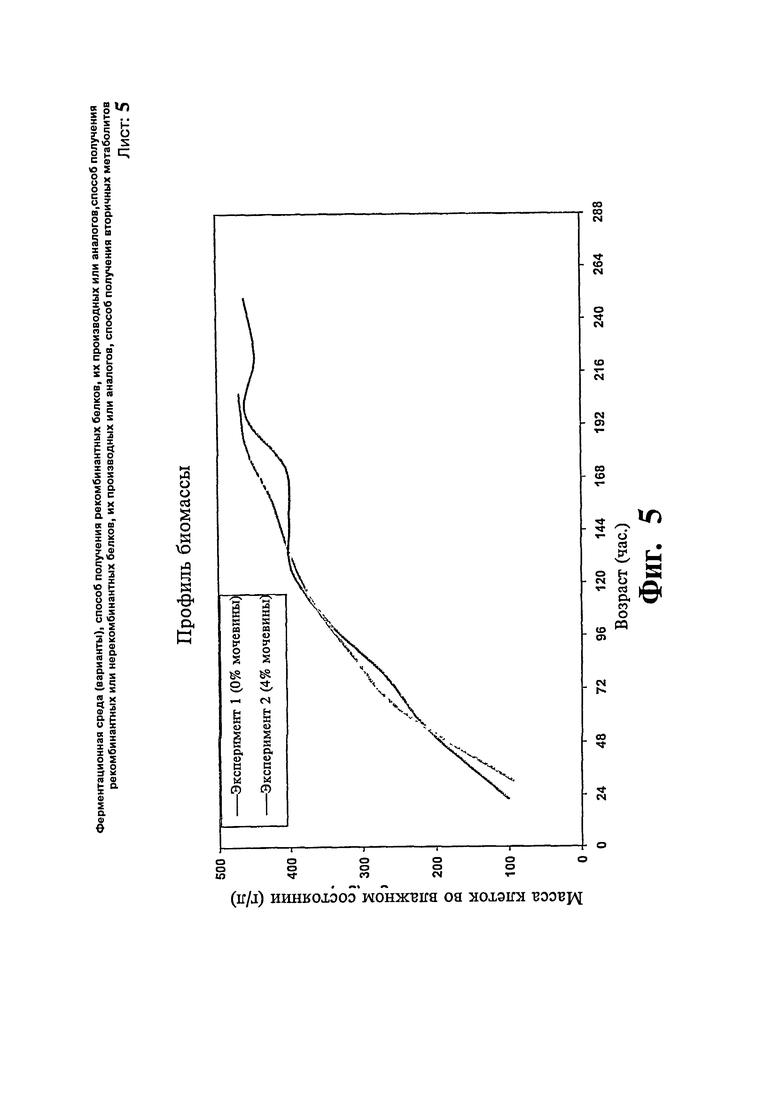
Фиг.5: Сравнение профиля биомассы предшественника гларгина с добавлением/без добавления мочевины.
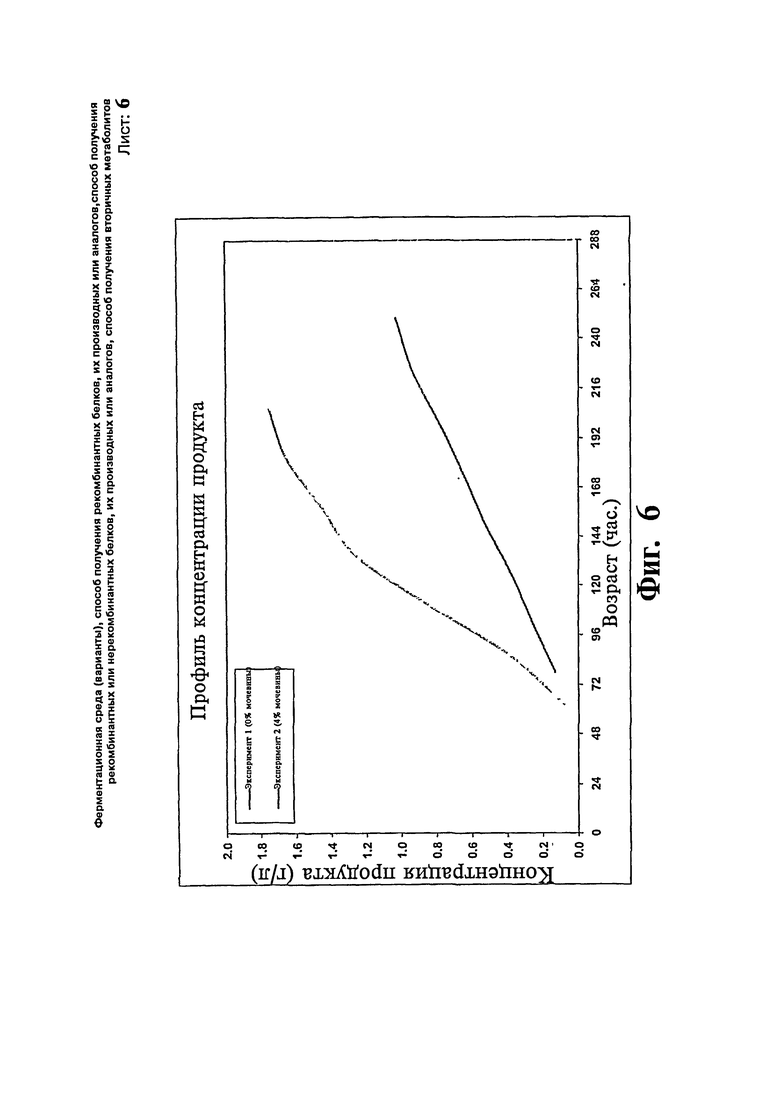
Фиг.6: Сравнение профиля концентрации продукта предшественника гларгина с добавлением/без добавления мочевины.
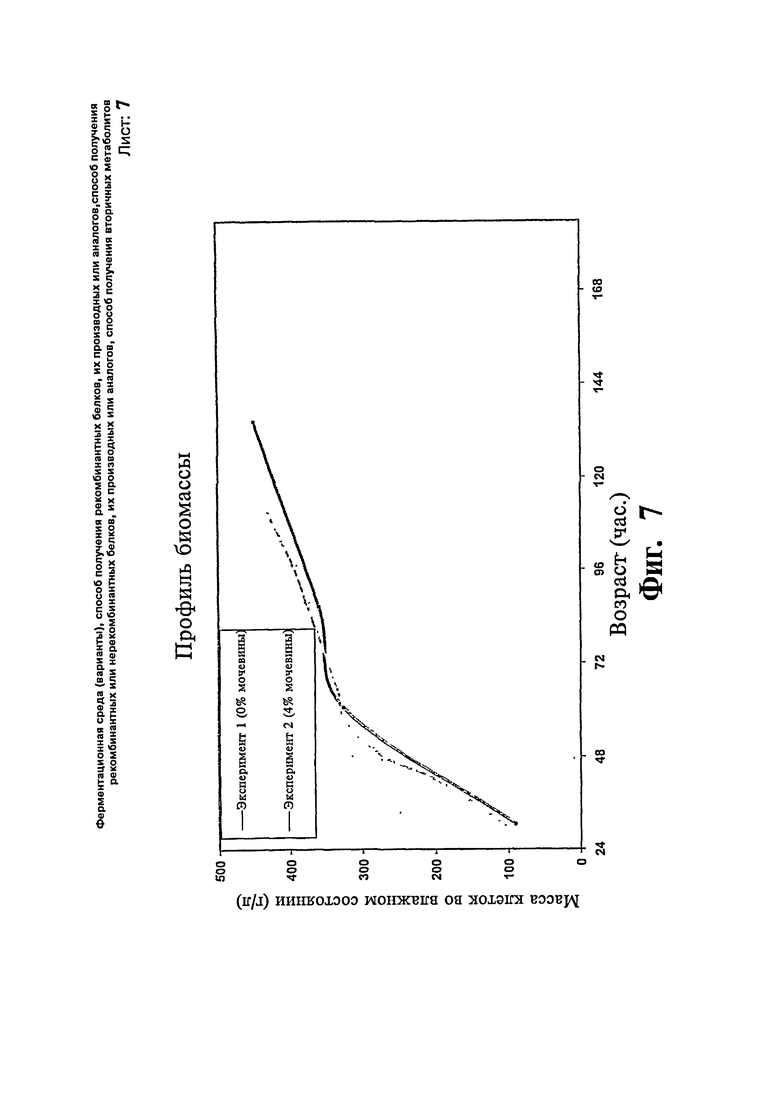
Фиг.7: Сравнение профиля биомассы предшественника эксендина с добавлением/без добавления мочевины.
Фиг.8: Сравнение профиля концентрации продукта предшественника эксендина с добавлением/без добавления мочевины.
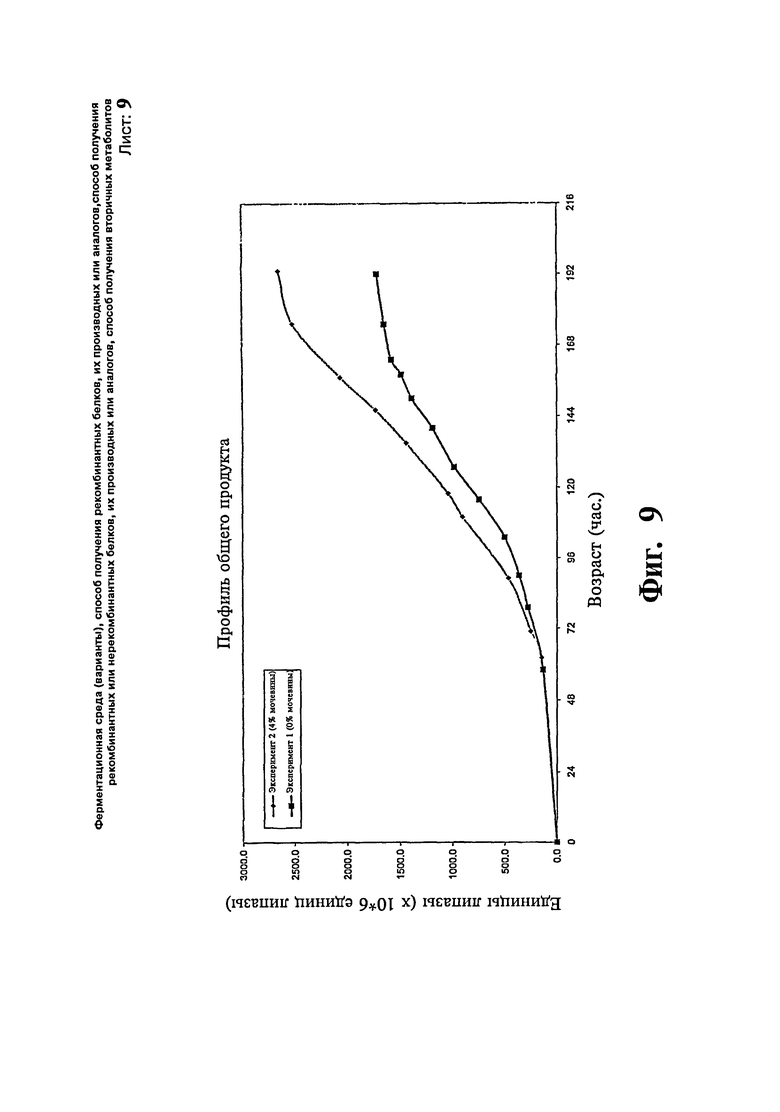
Фиг.9: Сравнение профиля концентрации продукта фермента липазы с добавлением/без добавления мочевины.
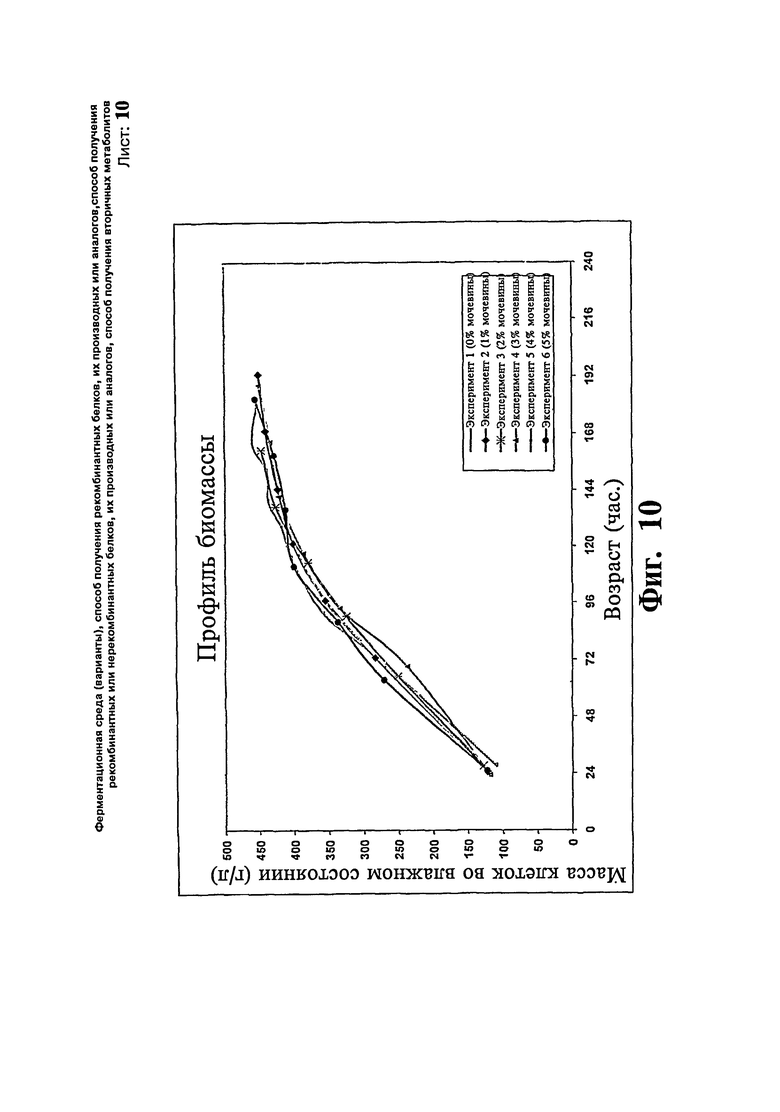
Фиг.10: Профили биомассы, полученные при различных концентрациях мочевины во время ферментации предшественника IN-105.
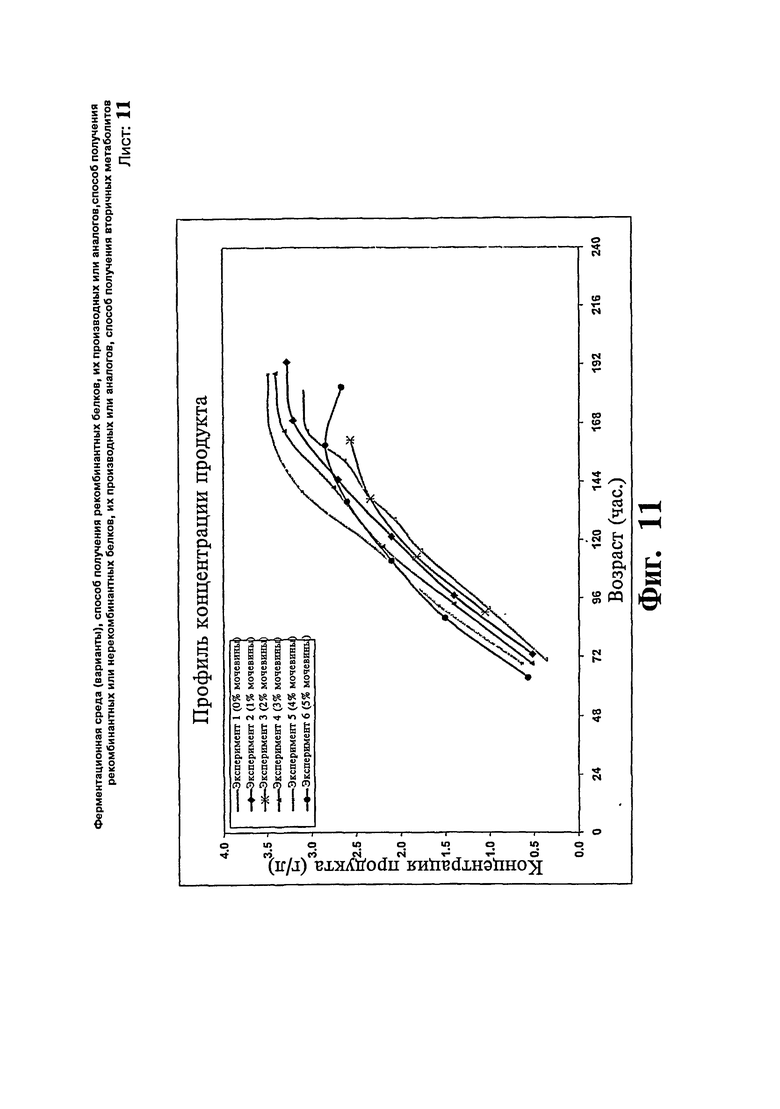
Фиг.11: Профили концентрации продукта, полученные при различных концентрациях мочевины во время ферментации предшественника IN-105.
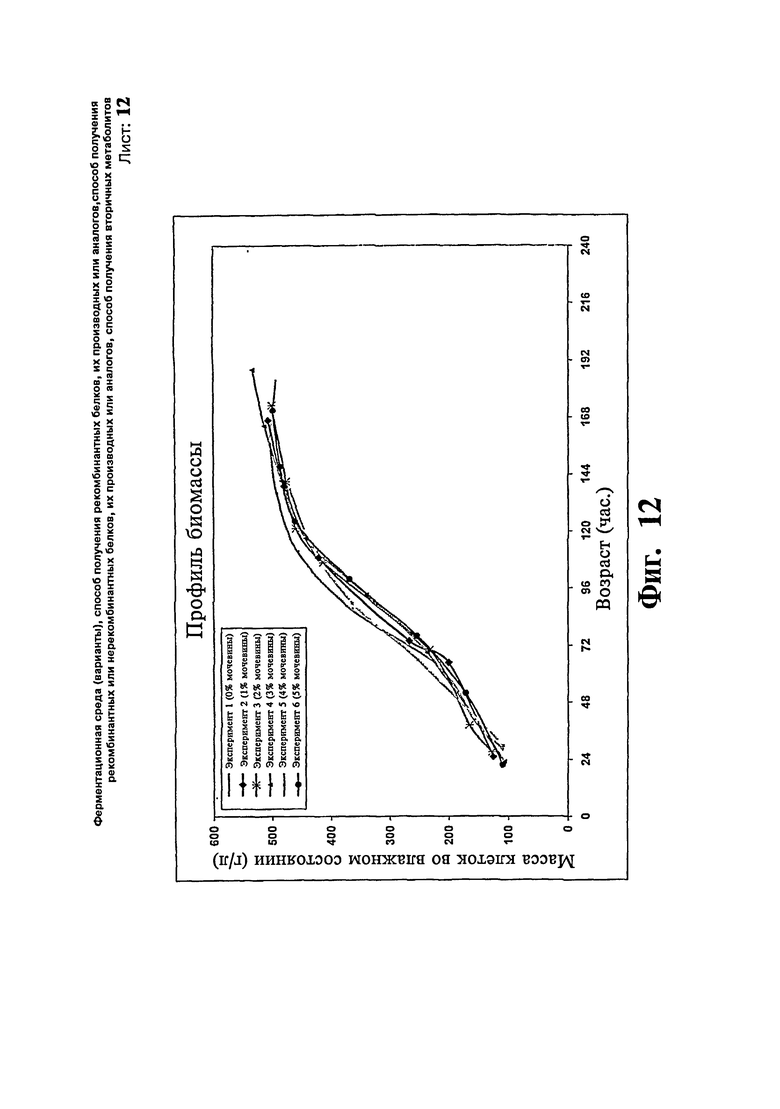
Фиг.12: Профили биомассы, полученные при различных концентрациях мочевины во время ферментации предшественника инсулина.
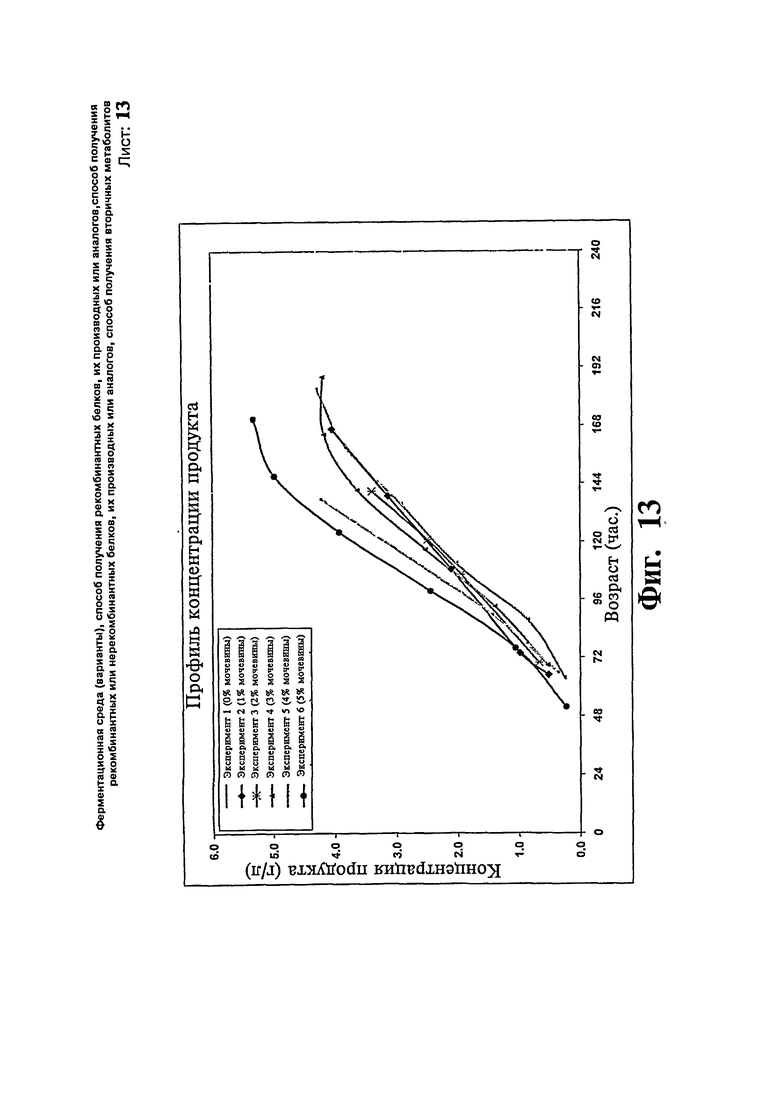
Фиг.13: Профили концентрации продукта, полученные при различных концентрациях мочевины во время ферментации предшественника инсулина.
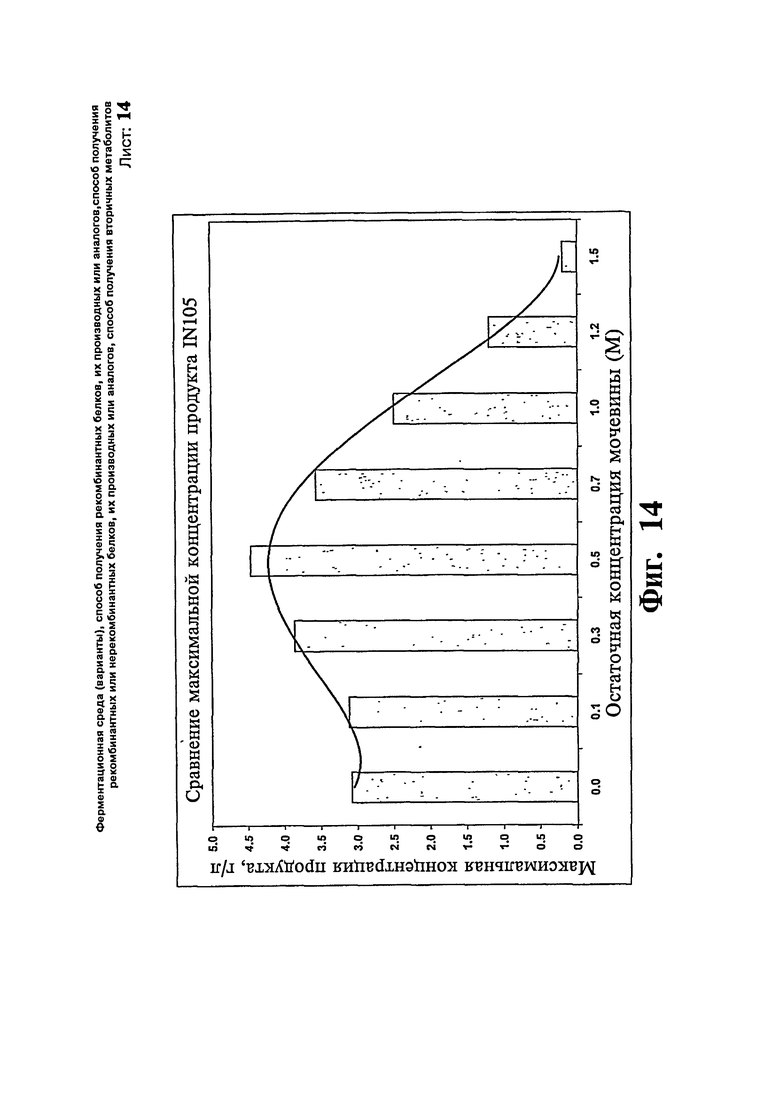
Фиг.14: Остаточная концентрация мочевины и максимальная концентрация продукта для получения IN-105.
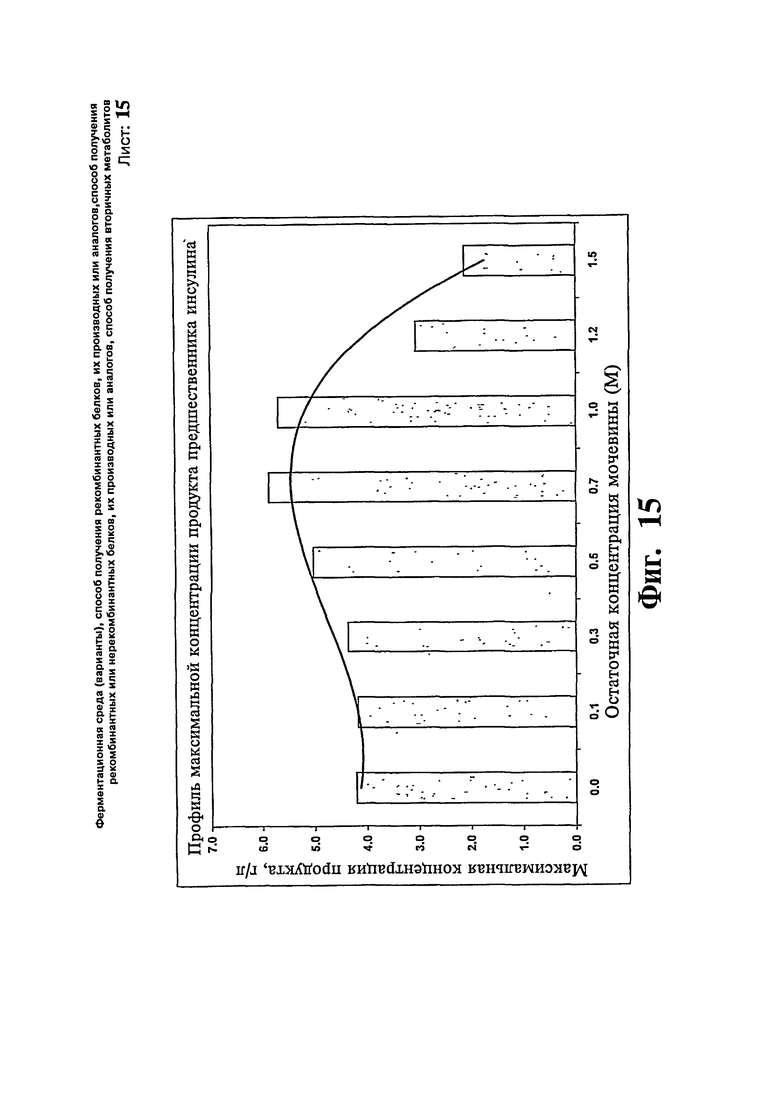
Фиг.15: Профиль остаточной концентрации мочевины и максимальной концентрации продукта для получения предшественника инсулина.
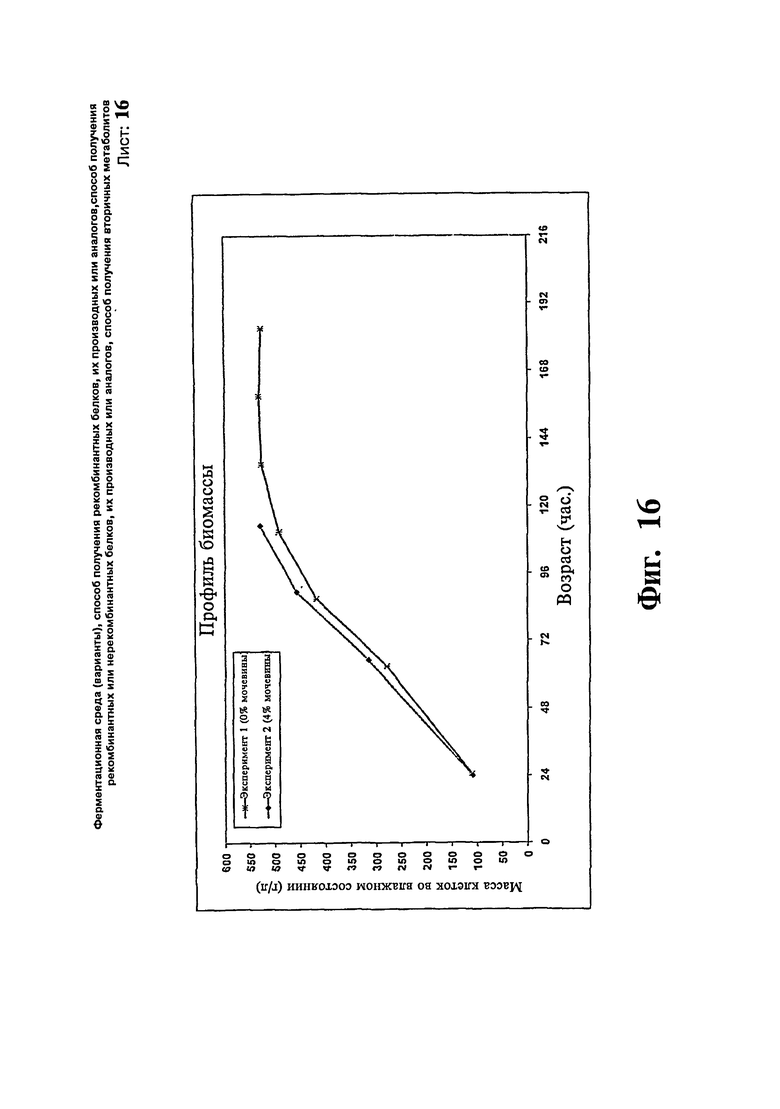
Фиг.16: Сравнение профиля биомассы предшественника IN-105 при уровне подпитки метанолом около 20 г/л/час.
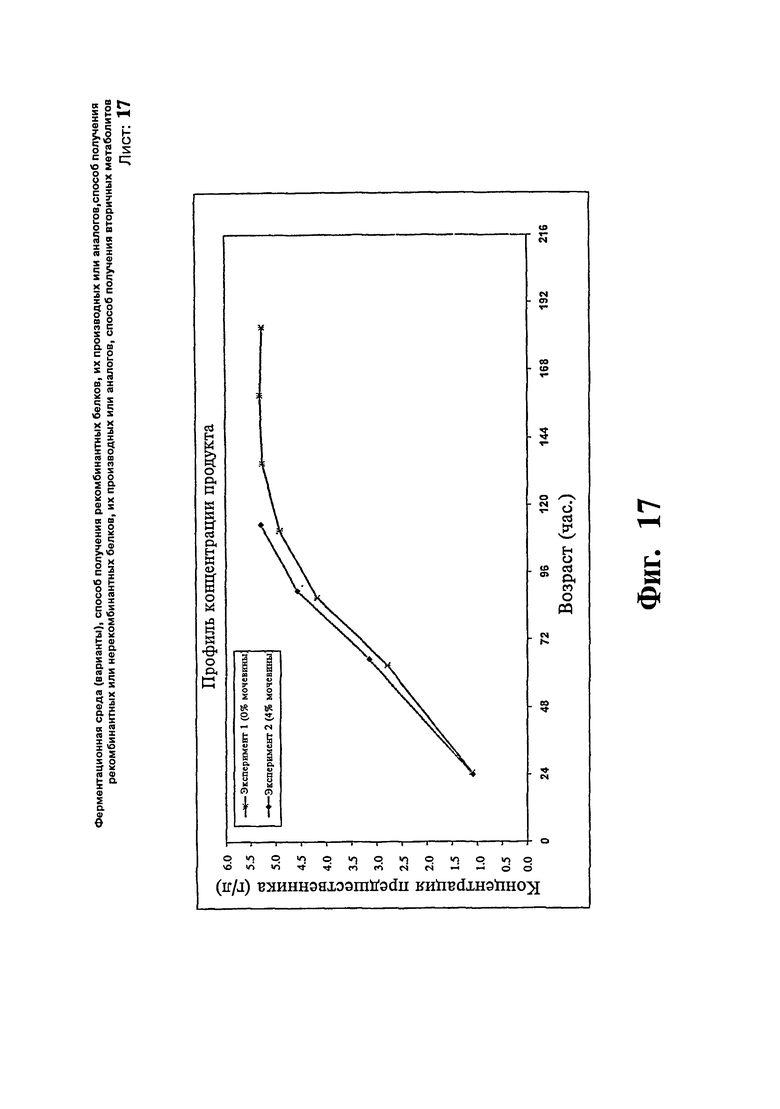
Фиг.17: Сравнение профиля концентрации продукта предшественника IN-105 при уровне подпитки метанолом около 20 г/л/час.
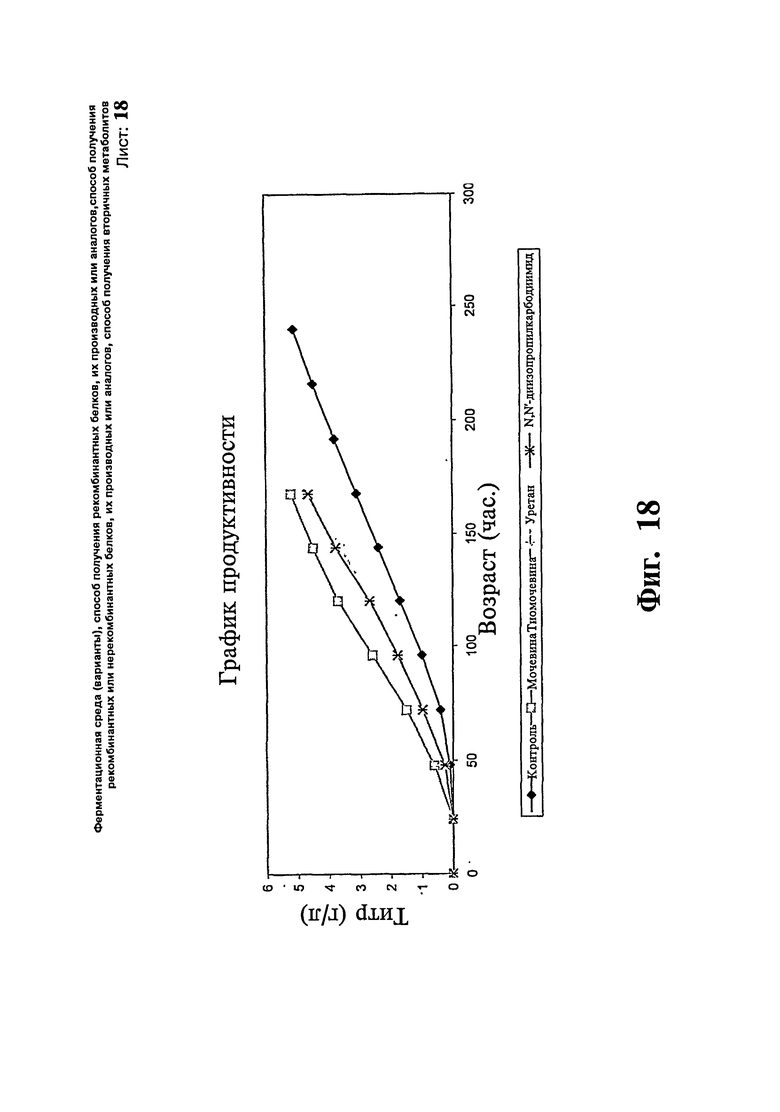
Фиг.18: Изучение соединений, отличных от мочевины, тестирование других родственных соединений в плане из воздействия на продуктивность ферментации Pichia.
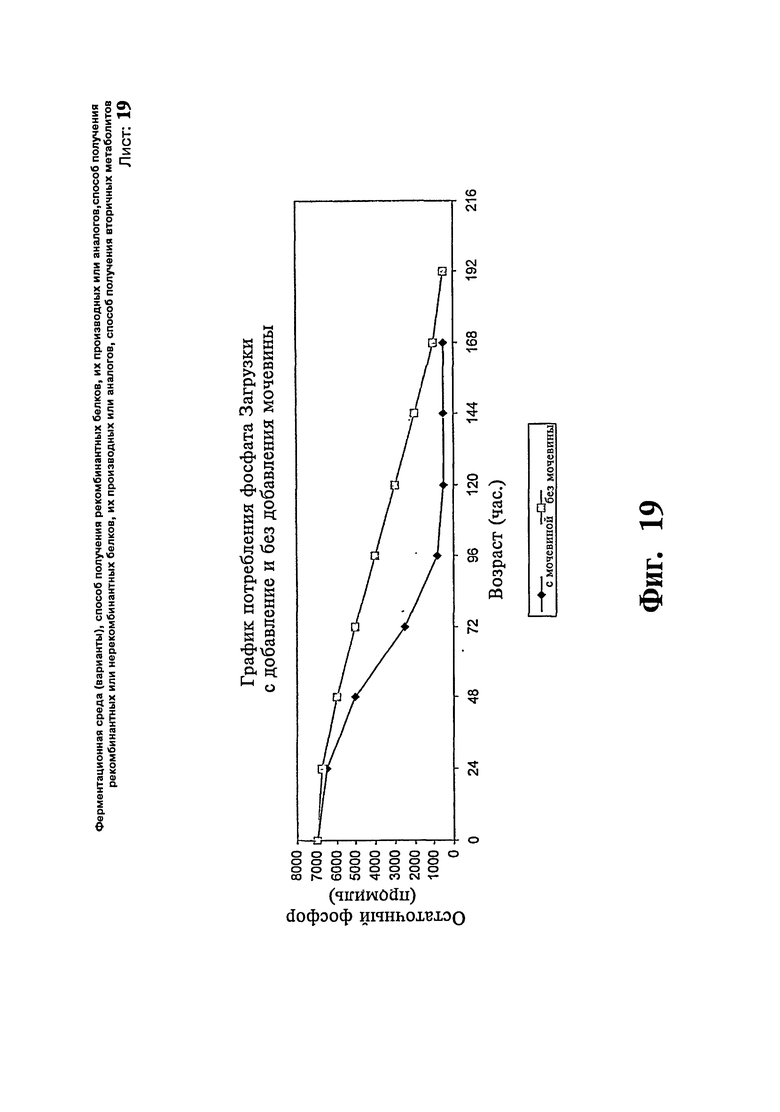
Фиг.19: Эффект мочевины на остаточную концентрацию ионов фосфата в бульоне. Эффект мочевины на метаболизм фосфата штаммом.
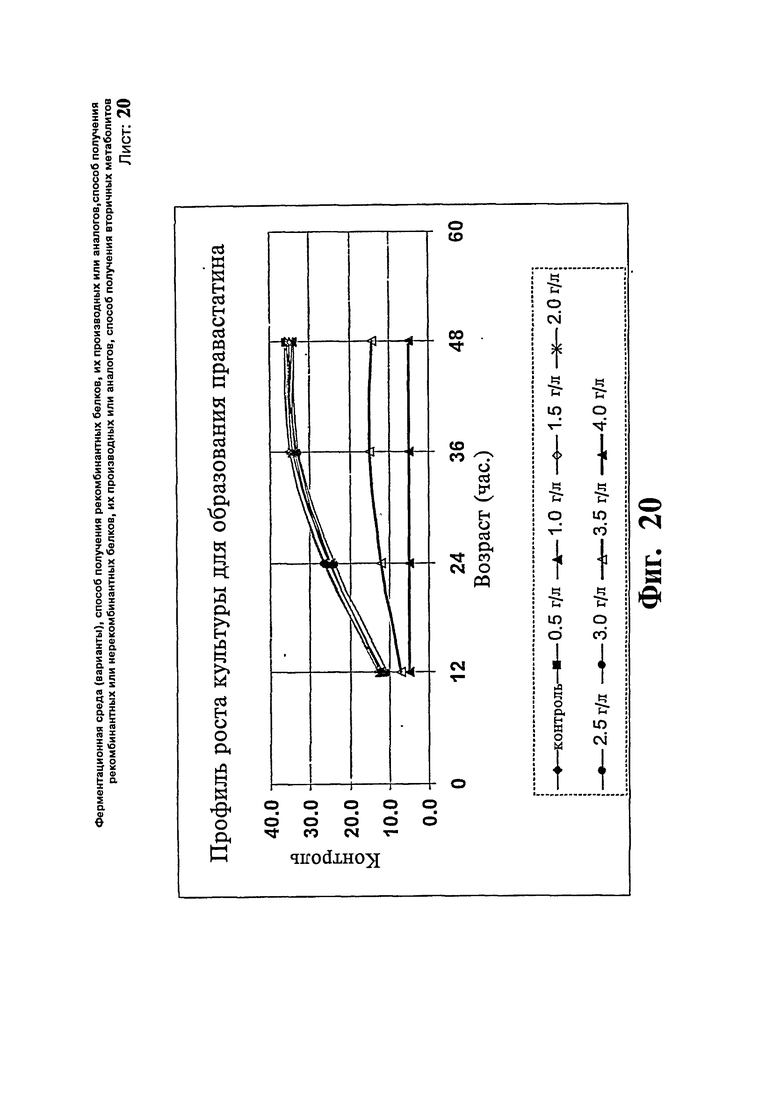
Фиг.20. Профиль роста культуры для образования правастатина.
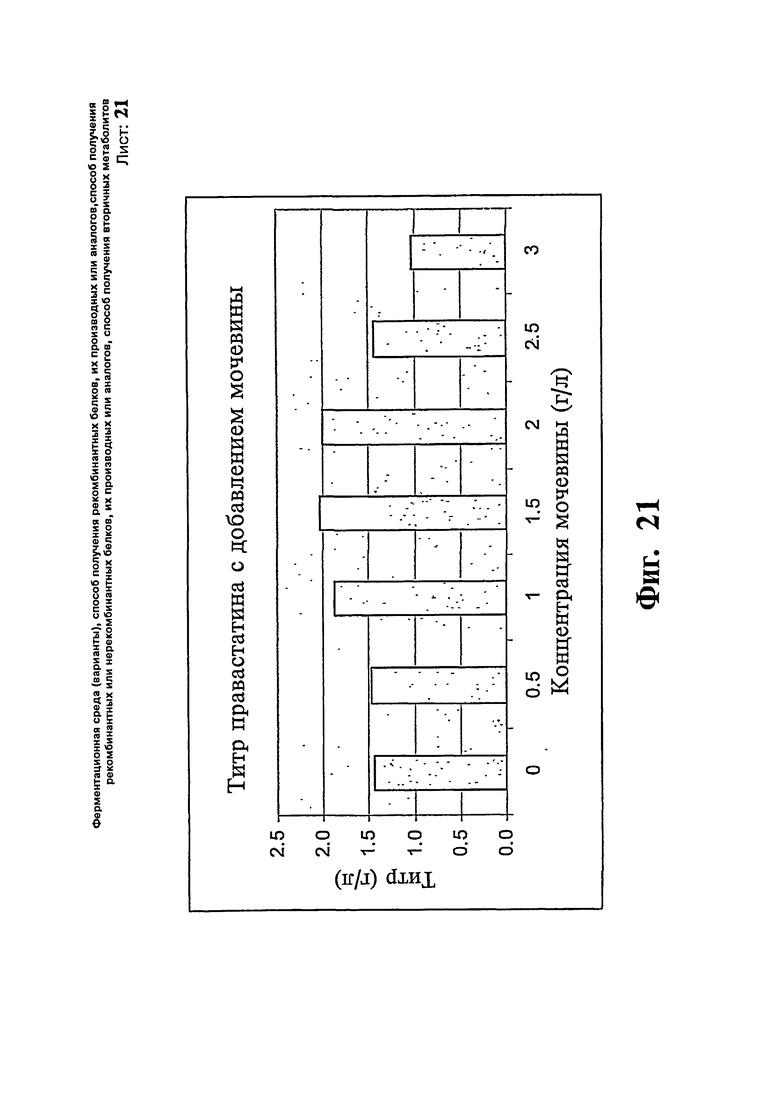
Фиг.21. Титр правастатина при добавлении мочевины.
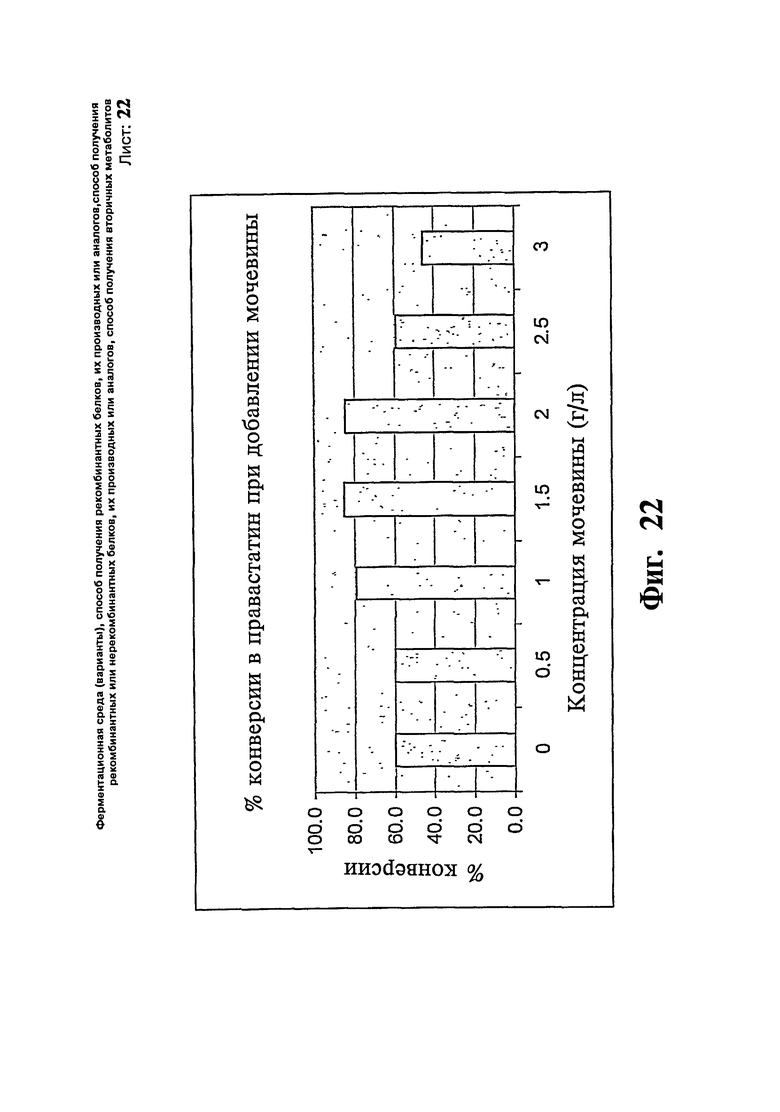
Фиг.22. Процент превращения компактина в правастатин при добавлении мочевины.
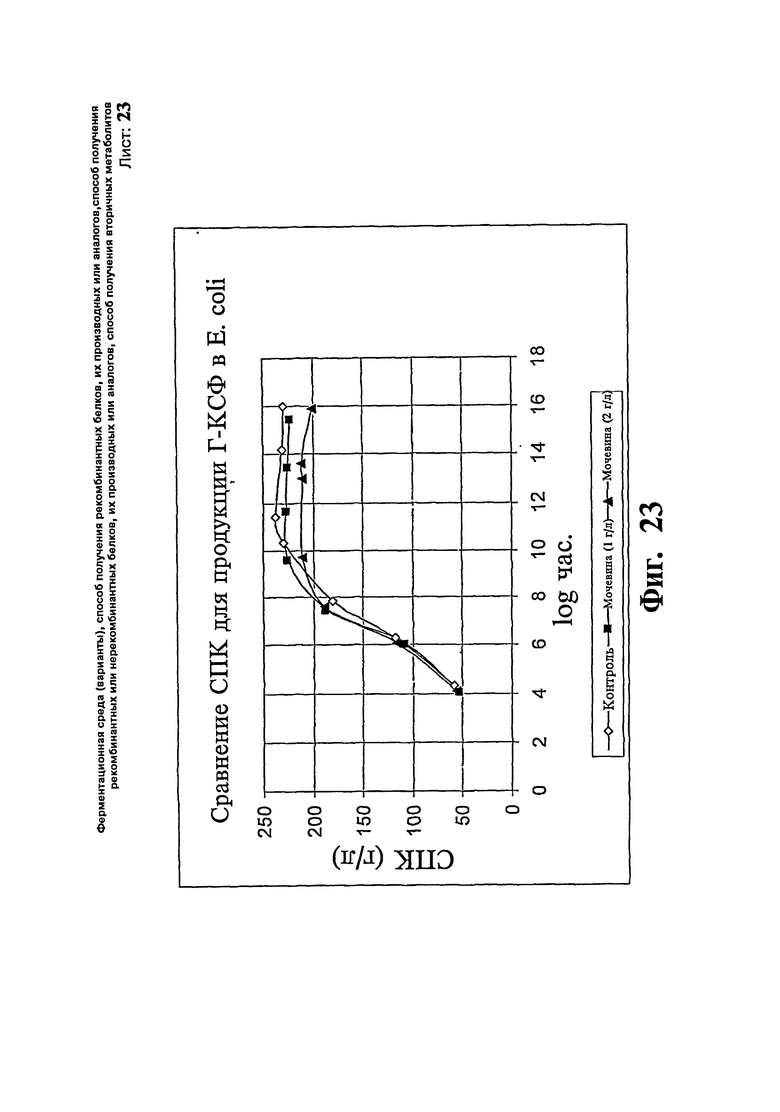
Фиг.23. Сравнение плотности среды культуры клеток (СПК) для образования Г-КСФ в Е. coli.
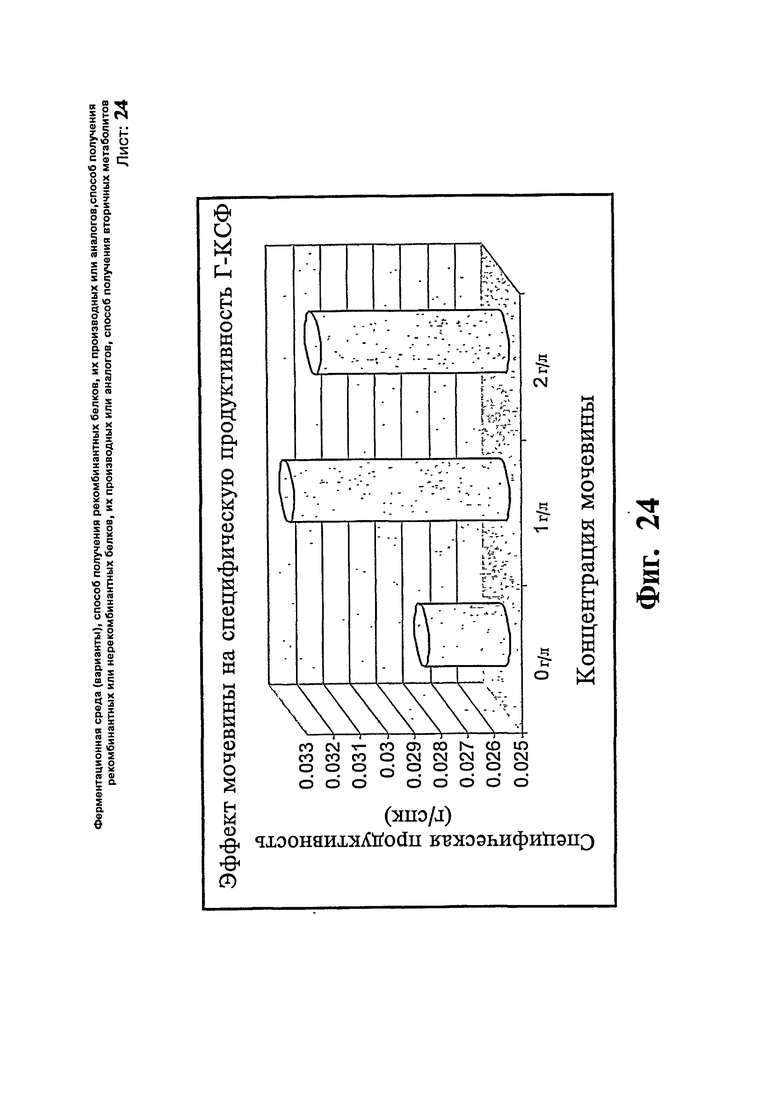
Фиг.24. Эффект мочевины на специфическую продуктивность Г-КСФ.
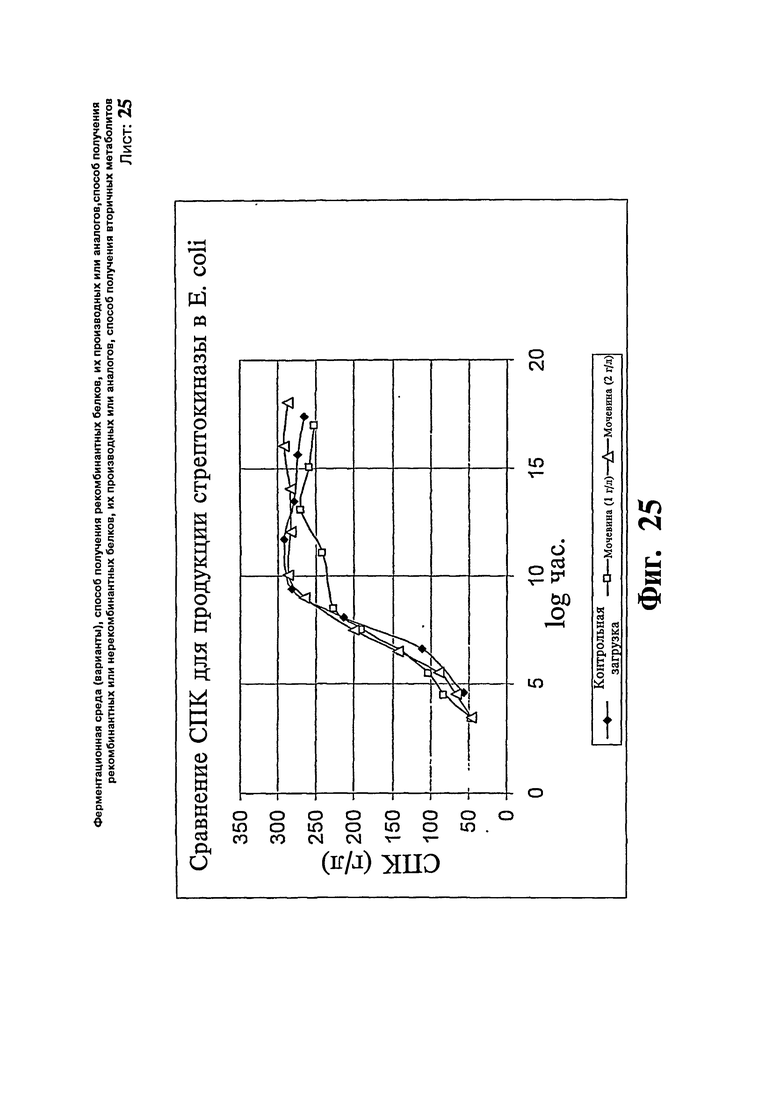
Фиг.25. Сравнение СПКдля образования стрептокиназы в Е. coli.
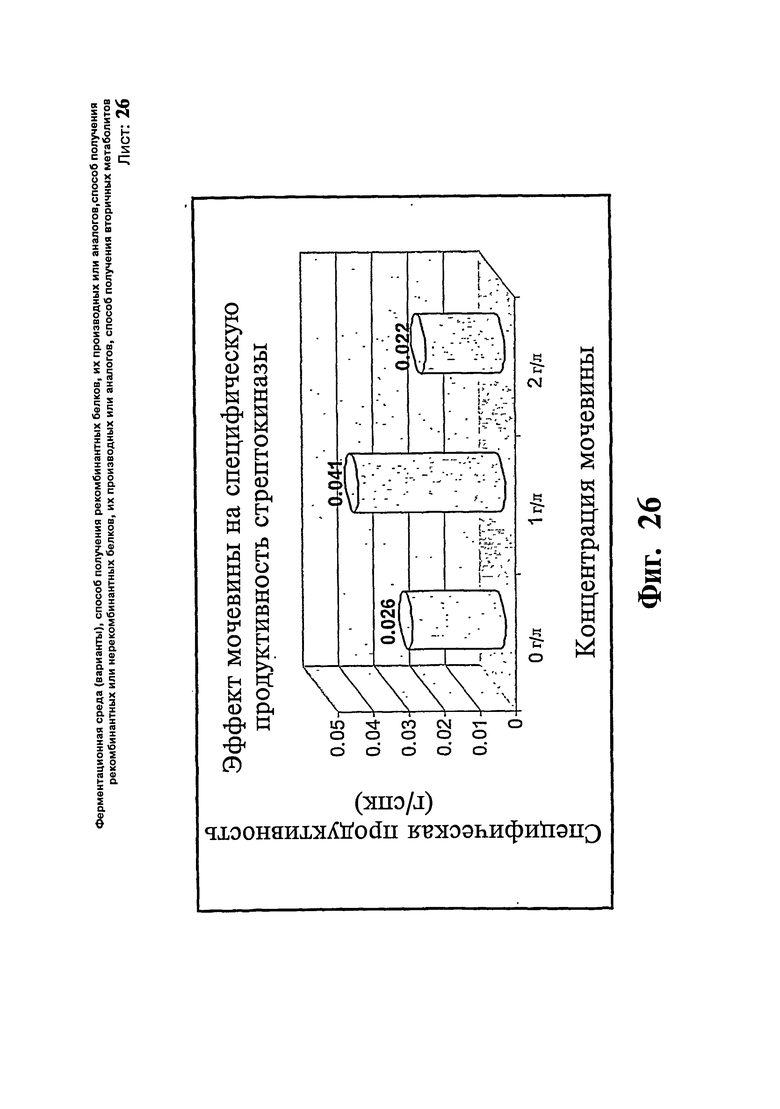
Фиг.26. Эффект мочевины на специфическую продуктивность стрептокиназы.
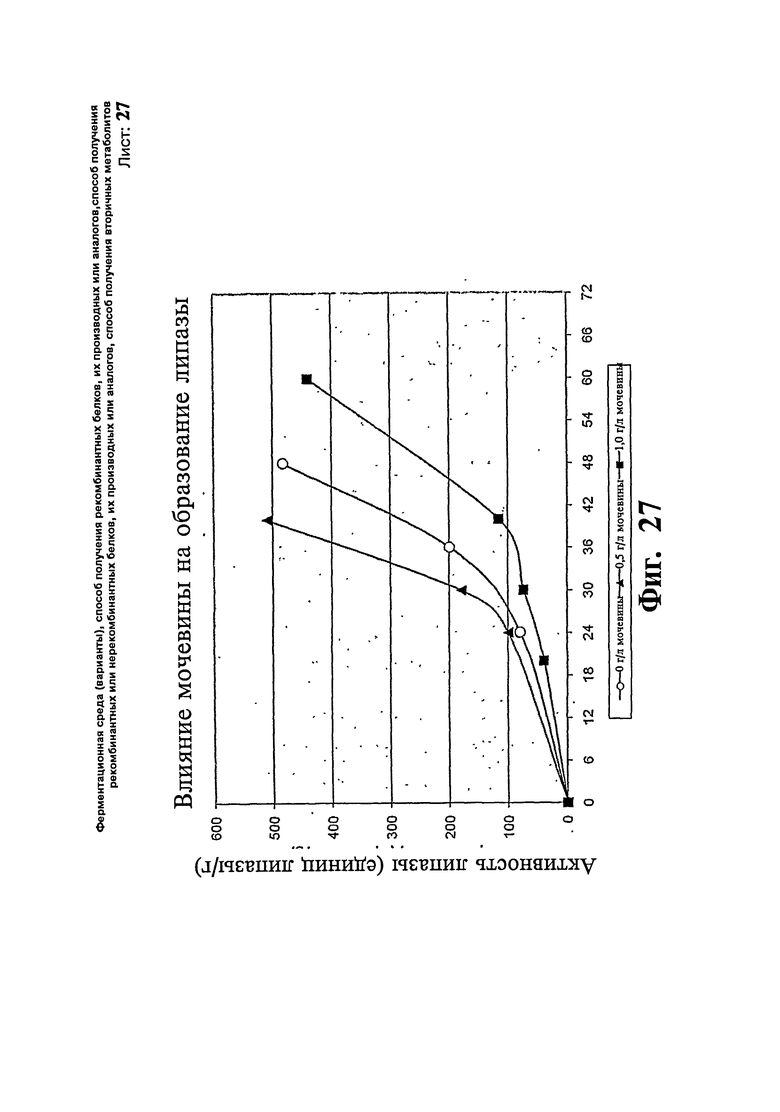
Фиг.27. Эффект мочевины на продукцию липазы при использовании Rhizomucor sp.
Осуществление изобретения Настоящее изобретение далее определяют в следующих примерах. Следует иметь в виду, что данные примеры, несмотря на то, что они показывают предпочтительные варианты осуществления, изобретения, приводят только с целью иллюстрации. Из вышеприведенного обсуждения и данных примеров компетентный специалист в области техники может установить основные признаки данного изобретения и, не выходя из его сущности и объема, может сделать различные изменения и модификации изобретения, чтобы адаптировать его к различным вариантам применения и условиям. Данные примеры не следует истолковывать как ограничивающие объем изобретения. Следующие примеры представляют предпочтительные варианты осуществления настоящего изобретения.
Пример 1:
Две загрузки ферментера проводят с использованием Pichia pastoris для экспрессии предшественника IN 105. В одной загрузке (эксперимент # 1) половину концентрации контрольной среды принимают за исходную среду за исключением глицерина. После стадии загрузки вводят метанол со скоростью подпитки приблизительно 8 г/л/час. Ферментацию продолжают в течение около 8 суток. Максимальная концентрация продукта достигает 3,0 г/л в течение 7 суток и стабилизируется. В другой загрузке (эксперимент # 2) используют среды такого же состава и дополнительно в ферментер добавляют 0,1 М мочевину. После стадии загрузки проводят подпитку метанолом вместе с 4% масс./об. мочевиной. Ферментацию продолжают в течение 8 суток. Максимальная концентрация продукта достигает 3,5 в течение 7 суток. Существенной разницы в отношении профиля роста клеток не наблюдают. Профили биомассы и концентрации продукта, полученные в результате вышеописанных экспериментов, представлены на Фиг.1 и 2, соответственно.
Пример 2:
Экспрессию предшественника инсулина при использовании мочевины исследуют с использованием ферментации Pichia pastoris для определения уровня экспрессии продукта. В данном исследовании используют состав контрольной среды и метанол с 4% мочевиной вводят на более высоком уровне 20 г/л/час. В данном исследовании максимальная концентрацию продукта достигает 4,21 г/л за 137 относительно 4,26 г/л за 182 часа, когда мочевину не добавляют в ферментер. Никакой разницы в профиле роста клеток не наблюдают, указывая на то, что добавление мочевины в ферментер повышает уровень экспрессии продукта без воздействия на профиль роста и сокращают время ферментации. Профили биомассы и концентрации продукта, полученные в результате вышеописанных экспериментов, представлены на Фиг.3 и 4, соответственно.
Пример 3:
Две загрузки ферментера проводят с использованием Pichia ра51опздля экспрессии предшественника гларгина. В одной загрузке (эксперимент # 1) половину концентрации контрольной среды принимают за исходную среду за исключением глицерина. После стадии загрузки вводят метанол со скоростью подпитки 8 г/л/час. Ферментацию продолжают в течение 10 суток. Максимальная концентрация продукта достигает 1,03 г/л в течение 10 суток и стабилизируется. В другой загрузке (эксперимент # 2) используют среды такого же состава и дополнительно к исходной ферментационной среде добавляют 0,1 М мочевину. После стадии загрузки проводят подпитку метанолом вместе с 4% мочевиной. Ферментацию продолжают в течение 9 суток. Максимальная концентрация продукта достигает 1,75 в течение 9 суток. Существенной разницы в отношении профиля роста клеток не наблюдают. Профили биомассы и концентрации продукта, полученные в результате вышеописанных экспериментов, представлены на Фиг.5 и 6, соответственно.
Пример 4:
Две загрузки ферментера проводят с использованием Pichia pastoris для экспрессии предшественника эксендина. В одной загрузке (эксперимент # 1) половину концентрации контрольной среды принимают за исходную среду за исключением глицерина при подпитке глицерином. После стадии подпитки глицерином вводят метанол со скоростью подпитки 11 г/л/час. Ферментацию продолжают в течение 6 суток. Максимальная концентрация продукта достигает 0,74 г/л в течение 6 суток и стабилизируется. В другой загрузке (эксперимент # 2) используют среды такого же состава и дополнительно добавляют в ферментер 0,1 М мочевину. После стадии загрузки проводят подпитку метанолом с 4% мочевиной. Ферментацию продолжают в течение 5 суток. Максимальная концентрация продукта достигает 0,78 в течение 5 суток. Существенной разницы в отношении профиля роста клеток не наблюдают. Профили биомассы и концентрации продукта, полученные в результате вышеописанных экспериментов, представлены на Фиг.7 и 8, соответственно.
Пример 5:
Две загрузки ферментера проводят с использованием Pichia раз1опздля экспрессии фермента липазы. В одной загрузке (эксперимент # 1) половину концентрации контрольной среды принимают за исходную среду за исключением глицерина. После стадии загрузки вводят метанол со скоростью подпитки приблизительно 6 г/л/час. Ферментацию продолжают в течение около 8 суток. Максимальная концентрация продукта достигает приблизительно 1650×106 единиц липазы в течение 7 суток и стабилизируется. В другой загрузке (эксперимент # 2} используют среды такого же состава и дополнительно в ферментер добавляют 0,1 М мочевину. После стадии загрузки проводят подпитку метанолом вместе с 4% масс./об. мочевиной. Ферментацию продолжают в течение 8 суток. Максимальное количество продукта достигает приблизительно 2500×106 единиц липазы в течение 7 суток и затем стабилизируется. Существенной разницы в отношении профиля роста клеток не наблюдают. Профиль общего продукта, полученный в результате вышеописанных экспериментов, представлен на Фиг.9.
Пример 6:
Исследуют эффект концентрации мочевины в загрузках с метанолом, используемых для получения предшественника IN 105, с 1, 2, 3 и 5% мочевины в метаноле во время загрузки в подпиткой метанолом. Остальные параметры сохраняют такие же, как в примере 1. Максимальная концентрация продукта достигает 3,0, 3,2, 2,5, 3,3, 3,5 и 2,8 г/л за 7 суток в загрузках с 0, 1, 2, 3, 4 и 5% мочевины, соответственно, в метаноле. Повышенную продуктивность наблюдают, когда используют 4% мочевину в метаноле во время фазы индукции метанолом. Профили биомассы и концентрации продукта иллюстрируют на Фиг.10 и 11, соответственно.
Пример 7:
В другом исследовании с уровнем подпитки метанолом 20 г/л/час. Концентрацию мочевины варьируют, чтобы определить наиболее эффективную концентрацию мочевины, обеспечивающую максимальную концентрацию предшественника инсулина. Максимальная концентрация продукта достигает 4,26, 4,03, 3,39, 4,16, 4,21 и 5,31 г/л за 182, 166, 140, 164, 137 и 170 часов, соответственно, в загрузках, где подпитку метанолом проводят с концентрацией мочевины 0, 1, 2, 3, 4 и 5%, соответственно. Профили биомассы и концентрации продукта иллюстрируют на Фиг.12 и 13, соответственно. Исследование показывает, что добавление мочевины повышает уровень продукции предшественника инсулина, уровень экспрессии является наиболее высоким, когда подпитку метанолом осуществляют с 5% мочевины.
Пример 8:
Исследуют экспериментальные загрузки, в которых во время фазы индукции метанолом поддерживают остаточную концентрацию мочевины на различных уровнях 0,1, 0,3,0,5, 0,7, 1,2 и 1,5 М в бесклеточном супернатанте, и изучают эффект на продуктивность. Берут все загрузки с параметрами и составом среды, подобными приведенным в примере 1. Остаточную мочевину поддерживают путем отдельной подпитки мочевиной. Результаты показывают, что максимум продукта достигают, когда уровень мочевины поддерживают в области 1 М в бесклеточном супернатанте во время ферментации на протяжении загрузки. Максимальную концентрацию продукта 4,46 г/л достигают, когда поддерживают уровень остаточной мочевины приблизительно 0,5 М. В данном эксперименте общая подпитка мочевиной эквивалентна 0, 0,2, 0,5, 0,9, 1,2, 1,8, 2,3 и 2,9 М конечного объема бульона в исследовании, где поддерживают уровень остаточной мочевины 0, 0,1, 0,3, 0,5, 0,7, 1,0, 1,2 и 1,5 М, соответственно. Результаты представляют на Фиг.14.
Пример 9:
Проводят также исследование ферментации предшественника инсулина. В данном исследовании подпитку метанолом осуществляют на уровне 20 г/л/час. В ферментации предшественника инсулина показано, что концентрация данного продукта максимальна, когда поддерживают остаточную концентрацию 0,7 М. В данном исследовании общая подпитка мочевиной эквивалента 0,0, 1,6, 2,7, 3,5, 7,0, 8,8, 11,7 и 13,3 М конечного объема бульона в исследовании, где поддерживают уровень остаточной мочевины 0, 0,1, 0,3, 0,5, 0,7, 1,0, 1,2 и 1,5 М, соответственно. Результаты показывают, что культура может потреблять существенные количества мочевины, как представляют на Фиг.15.
Пример 10:
Другую партию IN 105 проводят со стандартными контрольными средами и с добавлением около 20 г/л/час, метанола с 4% мочевины. В данном исследовании достигают концентрацию продукта 3,71 г/л за 113 часов относительно выхода 3,76 г/л за 183 часа, когда мочевину не вносят в ферментер. Результаты исследования иллюстрируют на Фиг.16 и 17.
Пример 11:
В следующей группе экспериментов мочевину заменяют различными другими соединениями, чтобы показать их эффекты на продуктивность ферментации. Таким образом, в отдельных загрузках тестируют тиомочевину, диимиды, карбодиимиды, тиокарбамиды в концентрации 1%. Показывают, что все из них повышают продуктивность относительно контроля, как показано на Фиг.18.
Пример 12:
В эксперименте показывают, что подпитка мочевиной во время ферментации повышает потребление фосфата дрожжами, приводя в результате к истощению фосфата в среде раньше, что в загрузке, где подпитку мочевиной не проводят. Таким образом, ускоренное фосфата и повышенная продуктивность (г/л/час.) представляют собой результат метаболического сдвига, достигаемого путем введения мочевины в стандартные или модифицированные протоколы ферментации Pichia с целью получения пептидов и белков.
Пример 13:
Готовят среду для роста, содержащую соевую муку 5,0 г, декстрозу моногидрат 20,0 г, соевый пептон 5,0 г, СаСО3 1,0 г, К2НРO4 0,1 г в 1000 мл воды. рН посевной среды подводят до 6,8±0,1 с использованием раствора NaOH. Стерилизованную среду для инокулюма инокулируют флаконом суспензии спор культуры Streptomyces sp (BICC 6826) и инкубируют при 28±1ºС в течение 48 часов в аэробных условиях. Затем выросший посевной материал переносят в ферментационную среду, содержащую соевую муку 37,5 г, декстрозу моногидрат 22,5 г, хлопковую муку 3,75 г, кукурузный сироп 7,5, NaCl 7,5 и пеногаситель SAG 0,5 г в 1000 мл воды (рН подводят до 7,0±0,1). Через 48 часов инкубирования добавляют стерильный раствор компактина вместе с маленькими количествами декстрозы. Через каждые 24 часа собирают одну из колб из нескольких аналогичных колб с целью проверки биоконверсии компактина в правастатин. Процедуру повторяют каждый 24 часа, пока общая подпитка компактном не составит 3,0 г/л.
Перед началом экспериментов с использованием модифицированной ферментационной среды в ферментационную среду добавляют различные уровни мочевины, чтобы установить уровень токсичности мочевины для организма. Концентрацию 0,0, 0,5, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5 и 4,0 г/л добавляют в колбу, содержащую ферментационную среду, затем инкубируют, как описано выше. Через 48 часов инкубирования мониторируют рост в каждой из колб. Данные представляют на Фиг.20.
Концентрации, превышающие 3,0 г/л мочевины, показывают ингибирование роста культуры. В повторностях исследование показывает близкие результаты. Вследствие этого концентрацию ниже 3,0 г/л берут для проверки эффекта мочевины на биоконверсию.
Как описано ранее, аналогичный опыт проводят со средой для образования продукта, содержащей мочевину в качестве дополнительного компонента. Концентрацию мочевины в среде для образования продукта поддерживают на уровне 0,0, 0,5, 1,0, 1,5, 2,0, 2,5 и 3,0 г/л и добавляют ее во время инокуляции.
Через 48 часов инкубирования вносят стерильный раствор компактна вместе с подпиткой декстрозой. Биоконверсию оценивают через 24 часа путем сбора одной из множества колб, которые проводят в аналогичных условиях. Данную процедуру повторяют каждые 24 часа, пока в целом не вносят подпитку компактина 3 г/л. Биоконверсию оценивают относительно общего количества компактина потребленного для образования правастатина. Результаты эксперимента относительно титра и процента конверсии показаны на Фиг.21 и 22, соответственно.
Колбы с концентрацией мочевины 1,5 г/л показывают максимальный уровень конверсии компактина в правастатин 85,4% по сравнению с контрольной колбой с уровнем конверсии 59,5%. Пример 14;
Экспрессию гранулоцитарного колониестимулирующего фактора при использовании мочевины изучают с помощью ферментации E.coli для определения уровня экспрессии продукта. Среда, используемая в исследовании, состоит из предпосевной среды, посевной среды и среды для образования продукта. Предпосевная среда состоит из соевого пептона 10,0 г, NaCl 10,0 г, дрожжевого экстракта 10,0 г в 1000 мл воды. Посевная среда состоит из 1,2 г сульфата аммония, 2,4 г сульфата магния, 10 г дрожжевого экстракта, 11 г DMH, 5 г К2НРO4, 40 мл микроэлементов в 1000 мл воды. Среда для образования продукта состоит из декстрозы моногидрата 11 г, сульфата аммония 2,4 г, сульфата магния 4,8 г, дрожжевого экстракта 20 г, К2НР04 10 г, микроэлементы 40 мл в 1000 мл воды. рН подводят до 7,0 аммиаком. После завершения фазы загрузки биомассу в ферментере увеличивают постоянной подпиткой декстрозой и дрожжевым экстрактом. Затем индуцируют клеточную массу и ведут процесс следующие 8 часов для получения продукта, представляющего интерес.
Проводят три загрузки ферментеров, чтобы установить эффект мочевины в ферментационных процессах с использованием Е. coli. Первая загрузка (эксперимент # 1) представляет собой контрольную загрузку, без добавления какой-либо мочевины. Используемые среды описаны выше. Загрузку индуцируют при около 180 г/л СПК. Ферментацию продолжают до 8 час. после индукции. Достигают максимума 6,6 г/л при специфической активность 0,028 г/СПК. Во второй загрузке (эксперимент # 2), в ферментер добавляют 1 г/л мочевины в дополнение в вышеописанным средам. В загрузку вносят подпитку, содержащую аналогичные количества мочевины (1 г/л). Загрузку индуцируют при около 180 г/л СПК и продолжают ферментацию в течение 8 часов после индукции и получают 7,4 г/л продукта со специфической активностью 0,033 г/СПК. Третью загрузку (эксперимент # 3) проводят аналогично эксперименту # 2, но с добавлением 2 г/л мочевины. Достигнутый конечный продукт составляет 6,58 г/л со специфической активностью 0,032 г/СПК.
Как показывают результаты, не наблюдают никакой существенной разницы в профиле роста клеток, указывающие на то, что добавление мочевины повышает уровень образования продукта без воздействия на профиль роста. В общем получают приблизительно 18% повышение специфической продуктивности. Профили СПК, полученные в результате проведения вышеописанных экспериментов, представлены на Фиг.23, и профиль специфической продуктивности - на Фиг.24. Пример 15:
Аналогичный эксперимент проводят с использованием Е. coli в качестве экспрессирующей системы для получения стрептокиназы. Используют такую же среду, как упомянута в примере 13, а также такую же тестируемую концентрацию мочевины. Как описано в примере 14, проводят аналогичные три загрузки с содержанием мочевины 0 г/л, 1 г/л и 2 г/л. Контрольная загрузка без мочевины (эксперимент # 1) дает конечную продуктивность 7,06 г/л через 8 часов индукции при специфической продуктивности 0,026 г/СПК. Максимальный титр достигают в загрузке с содержанием 1 г/л мочевины (эксперимент # 2), имеющей продуктивность 10,5 г/л и специфическую продуктивность 0,041 г/СПК. Неожиданно показано, что загрузка с 2 г/л мочевины (эксперимент # 3) дает только 6,56 г/л продукта со специфической продуктивностью 0,022 г/СПК. Для данного продукта повышение концентрации мочевины больше чем 1 г/л приводит в результате к резкому падению специфической продуктивности и титра.
Как в примере 2, отсутствуют существенные изменения в значениях СПК трех исследований, что ясно показывает, что повышение продуктивности является результатом повышенного уровня образования продукта и не связано с изменениями биомассы. В общем получают приблизительно 57% повышение специфической продуктивности. Профили СПК, полученные в результате проведения вышеописанных экспериментов, представлены на Фиг.25. Профиль титра представлен на Фиг.26.
Пример 16:
Rhizomucor sp (BICC 362), который, как известно, продуцирует фермент липазу, также показывает повышение продуктивности при добавлении мочевину в среду. Липазу, генерированную с помощью данной культуры, можно широко использовать для реакций биоконверсии, например, эстерификации и гидролиза. Для данного процесса берут две загрузки ферментера (объем 10 л), одну - без добавления мочевины и другую - с добавлением 0,5 г/л мочевины. Проводят также исследование с более высокой концентрацией мочевины (1 г/л), которое приводит в результате к более низкой продуктивности и очень высокому уровню потребления каустической соды для поддержания рН. Среда для роста для Rhizomucor sp (BICC 362) состоит из Maida 41,4 г, сахарозы 10 г, пептона 3,06 г, сульфата аммония 2 г, дрожжевого экстракта 2 г, фосфата калия 0,85 г, хлорида кальция, сульфата магния и хлорида натрия, по 1 г каждого. Полную среду доводят до 1 л водой. Выращенный посевной материал (10 об.%) переносят в среду для образования продукта, состоящую из декстрозы 12,5 г, соевого пептона 37,5 г, соевой муки 25, фосфата калия 2,5, сульфата магния 0,625, соевого масла 12,5 г в 1000 мл воды. рН среды подводят до 6,0 и затем поддерживают при 6,0 на протяжении загрузки добавлением каустической соды.
Добавление мочевины (0,5 г/л) показывает повышение уровня образования липазы по сравнению с контрольной загрузкой. Более высокая концентрация мочевины показывает более низкую продуктивность. Данные представляют на Фиг.27.
Следует иметь в виду, что данное изобретение не ограничено описанными конкретными способами, протоколами, клеточными линиями, видами или родами и компонентами сред, поскольку они могут варьировать. Кроме того, следует иметь в виду, что терминология, используемая в данном контексте, служит только для целей описания конкретных вариантов осуществления и не предназначена для ограничения объема настоящего изобретения, которое будет ограничено только прилагаемой формулой изобретения. Вышеприведенное описание служит для цели обучения обычного специалиста в области техники, как практически использовать настоящее изобретение, и оно не предназначено для детализации всех тех его очевидных модификаций и вариантов, которые будут очевидны компетентному специалисту при чтении описания.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФЕРМЕНТАЦИОННАЯ СРЕДА И СПОСОБ ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНЫХ БЕЛКОВ | 2009 |
|
RU2491345C2 |
| ФЕРМЕНТАЦИОННАЯ СРЕДА И СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНЫХ БЕЛКОВ | 2009 |
|
RU2556120C2 |
| МИКРОБНЫЙ СПОСОБ ПОЛУЧЕНИЯ ПРАВАСТАТИНА | 2000 |
|
RU2252258C2 |
| ГИДРОКСИЛИРОВАНИЕ КОМПАКТИНА ДО ПРАВАСТАТИНА С ПОМОЩЬЮ MICROMONOSPORA | 2000 |
|
RU2235780C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИНСУЛИНА ГЛАРГИНА | 2008 |
|
RU2495131C2 |
| БИОТРАНСФОРМАЦИЯ КОЛХИЦИНОИДНЫХ СОЕДИНЕНИЙ | 2004 |
|
RU2346050C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ СИМВАСТАТИНА | 2007 |
|
RU2447152C2 |
| ШТАММ БАКТЕРИЙ BREVIBACTERIUM SP. - ПРОДУЦЕНТ L-ЛИЗИНА | 1993 |
|
RU2034921C1 |
| Рекомбинантный штамм дрожжей Ogataea haglerorum - продуцент фитазы Escherichia coli | 2021 |
|
RU2785901C1 |
| ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ КОМПАКТИНА | 2013 |
|
RU2585233C2 |

Группа изобретений относится к биотехнологии. Предложены ферментационная среда и способ для получения правастатина. Осуществляют инкубирование микроорганизмов Streptomyces sp. в ферментационной среде, содержащей соевую муку, декстрозы моногидрат, хлопковую муку, кукурузный сироп, NaCl, пеногаситель SAG, воду и мочевину или ее производное в концентрации от 0,5 г/л до 3 г/л. Затем добавляют раствор компактина. Производное мочевины выбрано из группы, включающей диметилмочевину, диэтилмочевину, N-ацетилфенилмочевину, изопропилпилиденмочевину, фенилмочевину или их комбинации. Изобретения позволяют повысить уровень биоконверсии компактина в правастатин и уменьшить время продукции. 2 н. и 2 з.п. ф-лы, 27 ил., 16 пр.
1. Ферментационная среда для получения правастатина с использованием микроорганизмов Streptomyces sp., содержащая соевую муку, декстрозы моногидрат, хлопковую муку, кукурузный сироп, NaCl, пеногаситель SAG, воду и мочевину или ее производное в концентрации от приблизительно 0,5 г/л до приблизительно 3 г/л.
2. Среда по п.1, в которой производное мочевины выбрано из группы, включающей диметилмочевину, диэтилмочевину, N-ацетилфенилмочевину, изопропилпилиденмочевину, фенилмочевину или их комбинации.
3. Способ получения правастатина из компактина с использованием микроорганизмов Streptomyces sp., включающий инкубирование указанных микроорганизмов в ферментационной среде по п.1, в которую затем добавляют раствор компактина.
4. Способ по п.3, где производное мочевины в указанной ферментационной среде выбрано из группы, включающей диметилмочевину, диэтилмочевину, N-ацетилфенилмочевину, изопропилпилиденмочевину, фенилмочевину или их комбинации.
| ГИДРОКСИЛИРОВАНИЕ КОМПАКТИНА ДО ПРАВАСТАТИНА С ПОМОЩЬЮ MICROMONOSPORA | 2000 |
|
RU2235780C2 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| МИКРОБНЫЙ СПОСОБ ПОЛУЧЕНИЯ ПРАВАСТАТИНА | 2000 |
|
RU2252258C2 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
Авторы
Даты
2016-08-27—Публикация
2009-02-05—Подача