Область техники, к которой относится изобретение, и уровень техники, предшествующий изобретению
Настоящее изобретение, в некоторых вариантах его осуществления такового, относится к антителам к CEACAM1, клеткам гибридомы, продуцирующим таковые, и к способам использования таковых.
Трансмембранный белок CEACAM1 [известный также как желчный гликопротеин (BGP), CD66a и C-CAM1] является членом семейства канцероэмбриональных антигенов (CEA), которое также принадлежит к суперсемейству иммуноглобулинов. CEACAM1 взаимодействует с другими известными белками CD66, включая белки CD66a, CD66c и CD66e. Он экспрессируется в широком спектре клеток, варьирующихся от эпителиальных клеток до клеток гемопоэтического происхождения (например, иммунные клетки).
Белку CEACAM1 приписывают много различных функций. Было показано, что белок CEACAM1 проявляет противопролиферативные свойства в карциномах толстой кишки, предстательной железы, а также других типах рака. Дополнительные данные подтверждают важную роль CEACAM1 в ангиогенезе и метастазировании. CEACAM1 также играет роль в модуляции врожденного и адаптивного иммунных ответов. Например, было показано, что CEACAM1 является ингибирующим рецептором для активированных T-клеток, содержащихся в человеческом кишечном эпителии [см. W099/52552 и Morales et al. J. Immunol. 163 (1999), 1363-1370]. Дополнительные сообщения показали, что вовлечение CEACAM1 или в перекрестное TCR связывание с мАт, или во взаимодействие с белками Neisseria gonorrhoeae Opa ингибирует активацию и пролиферацию T-клеток.
Меланома - это злокачественное заболевание пигмент-продуцирующих клеток (меланоциты), ответственное за 75% связанных с раком кожных заболеваний во всем мире, в основном из-за обширного метастазирования. Метастатическая меланома (MM) плохо поддается большей части противораковых схем лечения, и средняя общая выживаемость для пациентов с MM составляет 8,5 месяцев. CEACAM1 редко экспрессируется нормальными меланоцитами, но часто обнаруживается на клетках меланомы. Экспрессия CEACAM1 на первичных кожных меланомных повреждениях однозначно прогнозирует развитие метастатического заболевания с неблагоприятным прогнозом. Кроме того, повышенная экспрессия CEACAM1 наблюдалась в NK-клетках, полученных от некоторых пациентов с метастатической меланомой по сравнению со здоровыми донорами.
WO2007/063424 и заявка на патент США № 20070110668 раскрывают способы регулирования иммунной системы и, в частности, способы регулирования специфического иммунного ответа, включая регулирование активности лимфоцитов. Эти способы содержат как негативную и позитивную модуляцию функции белка CEACAM1.
Заявка на патент США № 20070071758 раскрывает способы и композиции для лечения и диагностики рака. В частности, заявка на патент США № 20070071758 описывает способы и композиции для повышения эффективности противоопухолевой эффекторной лимфоцитной (ПЭЛ) терапии при лечении рака негативной модуляцией активности белка CEACAM1, такие как, например, использование иммуноглобулина, специфичного к CEACAM1.
Заявка на патент США № 20080108140 раскрывает способы модуляции специфических иммунных ответов для создания защитного иммунитета при лечении аутоиммунных заболеваний и заболеваний, требующих трансплантации ткани. В частности, заявка на патент США № 20080108140 относится к направленной супрессии иммунных ответов путем повышения функциональной концентрации белка CEACAM1 в целевой ткани.
Заявка на патент США № 20040047858 раскрывает специфические антитела (т.е. 34B1, 26H7 и 5F4), которые способны к модуляции T-клеточной активности посредством CEACAM1 и использование таковых, такие как при лечении заболеваний, связанных с иммунным ответом (например, реакция "трансплантат против хозяина", аутоиммунные заболевания, рак и т.д.).
Заявки на патенты США № 20020028203, 20050169922 и 20080102071 раскрывают композиции, которые связывают молекулы, ингибирующие T-клеточный рецептор, и модулируют (т.е. повышают или подавляют) T-клеточную активность (например, цитотоксичность и пролиферацию), такие как реагенты, связывающие желчный гликопротеин, и способы использования таких композиций, такие как лечение заболеваний (например, аутоиммунное заболевание, иммунодефицит, рак и т.д.).
Другие имеющие отношение к изобретению материалы:
5F4 мАт: Регулирование человеческой кишечной внутриэпителиальной лимфоидной цитолитической функции желчным гликопротеином (CD66a) [Morales VM et al., J Immunol. (1999) 163(3): 1363-70].
GM8G5 и 29H2 - оба коммерчески доступны от Abeam Inc. Abcamdotcomdotportal.
Сущность изобретения
В соответствии с одним из аспектов некоторых вариантов осуществления настоящего изобретения представлена клетка гибридомы, которая депонирована под ATCC номером доступа PTA-9974.
В соответствии с одним из аспектов некоторых вариантов осуществления настоящего изобретения представлено выделенное антитело или фрагмент антитела, содержащий домен распознавания антигена, имеющий CDR последовательности и ориентацию антитела, продуцируемого клеткой гибридомы.
В соответствии с одним из аспектов некоторых вариантов осуществления настоящего изобретения представлен способ иммуномодуляции, включающий контактирование CEACAM1-экспрессирующего лимфоцита с антителом или фрагментом антитела.
В соответствии с одним из аспектов некоторых вариантов осуществления настоящего изобретения представлен способ ингибирования миграции или пролиферации экспрессирующей CEACAM1 опухолевой клетки, включающий контактирование экспрессирующей CEACAM1 опухолевой клетки с антителом или фрагментом антитела, посредством чего ингибируется миграция или пролиферация экспрессирующей CEACAM1 опухолевой клетки.
В соответствии с одним из аспектов некоторых вариантов осуществления настоящего изобретения представлен способ диагностирования рака у индивидуума, нуждающегося в этом диагностировании, включающий контактирование биологического образца, полученного от индивидуума с антителом или фрагментом антитела, в котором комплексообразование, выходящее за пределы предопределенного порога, служит признаком рака у индивидуума.
В соответствии с одним из аспектов некоторых вариантов осуществления настоящего изобретения представлен способ лечения рака, включающий введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества антитела или фрагмента антитела с лечением посредством этого рака у индивидуума.
В соответствии с одним из аспектов некоторых вариантов осуществления настоящего изобретения представлен способ ингибирования CEACAM1 гомотипического или гетеротипического белок-белкового взаимодействия, включающий контактирование CEACAM1-экспрессирующего лимфоцита с антителом или фрагментом антитела, с ингибированием посредством этого CEACAM1 гомотипического или гетеротипического белок-белкового взаимодействия.
В соответствии с одним из аспектов некоторых вариантов осуществления настоящего изобретения представлена фармацевтическая композиция, содержащая в качестве активного ингредиента антитело или фрагмент антитела.
В соответствии с некоторыми вариантами осуществления изобретения к выделенному антителу или фрагменту антитела присоединена цитотоксичная группа.
В соответствии с некоторыми вариантами осуществления изобретения цитотоксичная группа содержит цитотоксин, хемокин, группу для химиотерапии, проапоптотическую группу, интерферон, радиоактивную группу или сочетания таковых.
В соответствии с некоторыми вариантами осуществления изобретения выделенное антитело или фрагмент антитела присоединены к идентифицируемой группе.
В соответствии с некоторыми вариантами осуществления изобретения клетки рака характеризуются сверхэкспрессией CEACAM1 по сравнению с непораженными клетками.
В соответствии с некоторыми вариантами осуществления изобретения способ лечения рака дополнительно включает введение индивидууму лимфоцитов.
В соответствии с некоторыми вариантами осуществления изобретения лимфоциты содержат T-клетки или NK-клетки.
В соответствии с некоторыми вариантами осуществления изобретения CEACAM1-экспрессирующий лимфоцит является противоопухолевым эффекторным лимфоцитом или NK-клеткой.
В соответствии с некоторыми вариантами осуществления изобретения CEACAM1-экспрессирующий лимфоцит является цитотоксической T-клеткой.
В соответствии с некоторыми вариантами осуществления изобретения опухолевая клетка содержит опухолевую клетку меланомы.
В соответствии с некоторыми вариантами осуществления изобретения рак является меланомой.
Если не оговорено иное, все технические и/или научные термины, используемые в настоящем документе, имеют значение, общепринятое у специалистов в области, к которой относится изобретение. Несмотря на то что способы и вещества, подобные или эквивалентные описанным в настоящем документе, могут быть использованы при осуществлении на практике или тестировании вариантов осуществления изобретения, примерные способы и/или вещества описаны далее. В случае противоречия, определяющим будет являться описание патента, включая определения. Кроме того, вещества, способы и примеры являются исключительно иллюстративными, и не подразумевается, что они являются лимитирующими в обязательном порядке.
Краткое описание чертежей
Некоторые варианты осуществления изобретения описаны в настоящем документе исключительно в качестве примеров со ссылкой на прилагаемые чертежи. Необходимо подчеркнуть, отдельно ссылаясь на подробные чертежи, что отдельные варианты показаны в качестве примеров и в целях иллюстративного рассмотрения вариантов осуществления изобретения. В связи с этим описание вместе с чертежами делает очевидным для специалиста в данной области то, как могут быть осуществлены на практике варианты осуществления изобретения.
На чертежах:
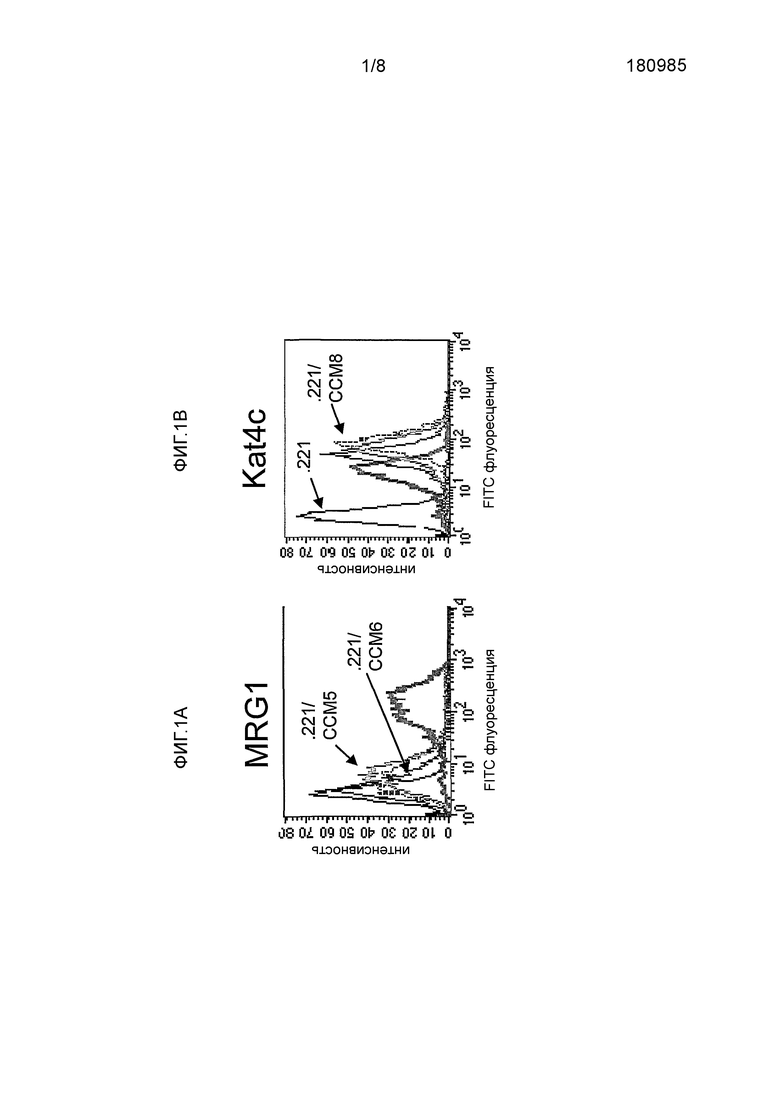
Фиг. 1A-B изображают специфичность мАт MRG1. 721.221 первичных клеток, стабильно трансфицированных CEACAM1 (зеленый), CEACAM5 (красный), CEACAM6 (пурпурный), CEACAM8 (синий) или имитация (черный), которые были подвергнуты FACS анализу с использованием различных антител против человеческого CEACAM: мАт MRG1 (Фигура 1A) и Kat4c мАт (Фигура 1B).
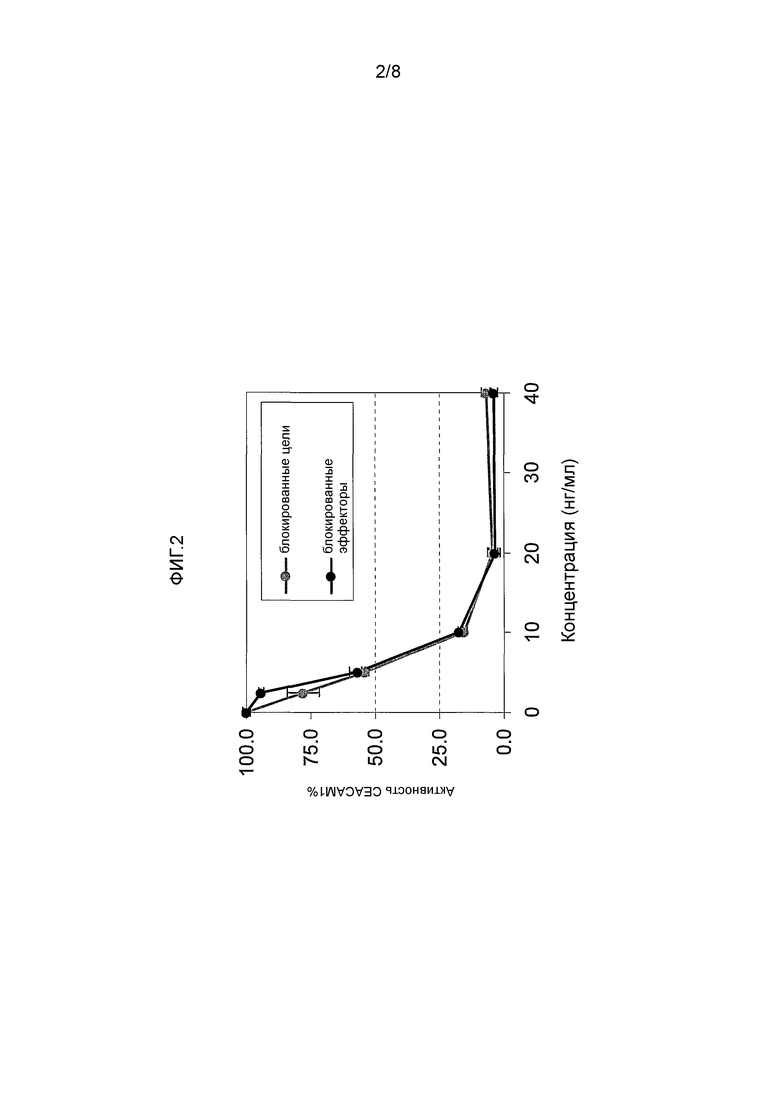
ФИГ. 2 иллюстрирует дозозависимое ингибирование CEACAM1 гомофильных взаимодействий мАт MRG1 к CEACAM1. мАт к CEACAM1 было добавлено или к BW/CEACAM1 (клетки-эффекторы), или к 221/CEACAM1 (целевые клетки) в различных концентрациях. После инкубирования в течение одного часа на льду, были добавлены соответствующие клетки (221/CEACAM1 или BW/CEACAM1) и с помощью ELISA была измерена секреция мышиного интерлейкина 2. 100% определяется как активность в отсутствие каких-либо антител. Представлены результаты показательного эксперимента из четырех серий, при этом каждый выполнен в трех повторах.
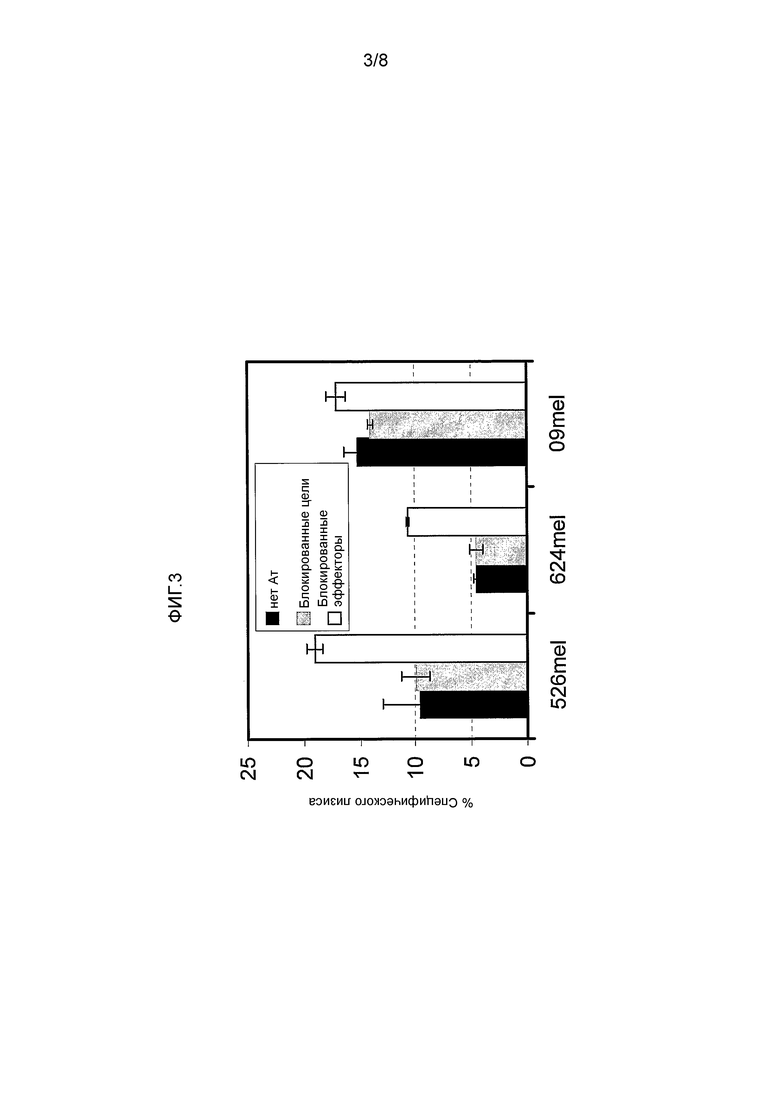
ФИГ. 3 иллюстрирует полное снижение CEACAM1-ингибирующей функции. мАт MRG1 было предварительно инкубировано с целевыми клетками (отображены серым) или с клетками-эффекторами (отображены белым). Клетки, инкубированные без добавления мАт, отображены черным. В качестве целевых клеток были использованы указанные линии меланомы (526mel, 624mel или 09mel). TIL014 клетки были использованы в качестве клеток-эффекторов в соотношении Э:Ц 10:1. После инкубирования в течение одного часа на льду были добавлены соответствующие клетки и инкубированы совместно в течение 5 часов при 37°C. Целевые клетки были предварительно помечены зеленым флуоресцентным красителем (CFSE), и наличие специфического лизиса было определено совместным окрашиванием Пропидий Йодидом (PI) с помощью проточной цитометрии. Спонтанная гибель была снижена. Анализ был выполнен в трех повторах.
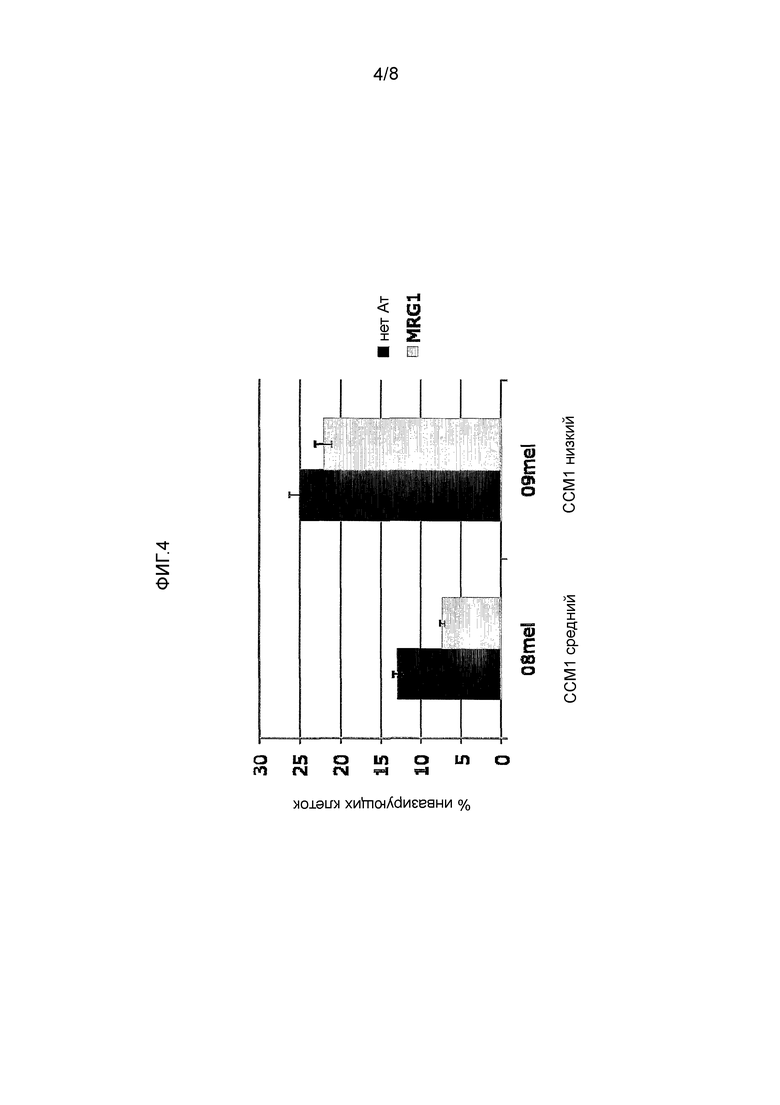
ФИГ. 4 иллюстрирует блокирование инвазии меланомы с помощью мАт MRG1. Клетки меланомы (08mel или 09mel) были предварительно инкубированы в отсутствие или присутствии 1 мкг/мл мАт MRG1 и после этого испытывались посредством анализов инвазии Матригель. Инвазия происходила в течение 24 часов, и было определено количество внедрившихся клеток стандартизованным набором XTT.
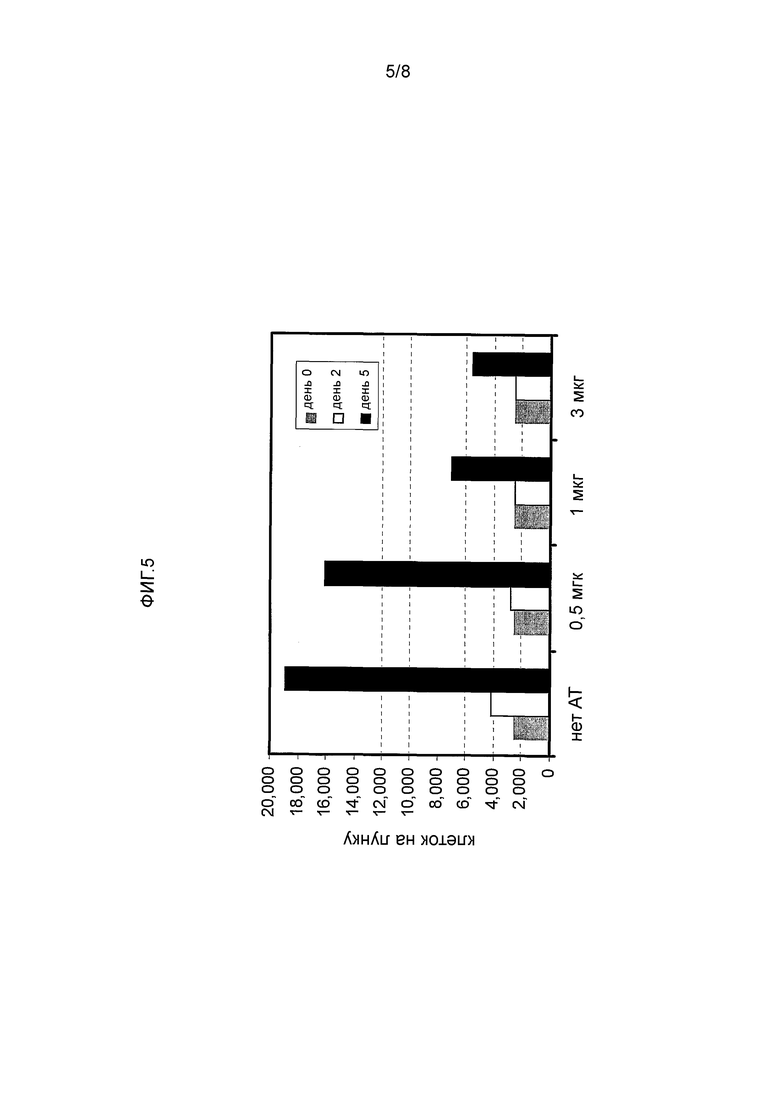
ФИГ. 5 иллюстрирует блокирование пролиферации сети клеток меланомы посредством мАт MRG1. Клетки меланомы 526mel были инкубированы с указанными дозами (0,5 мкг, 1 мкг или 3 мкг) мАт MRG1, и за профилерацией наблюдали в течение 2 дней или 5 дней после лечения.
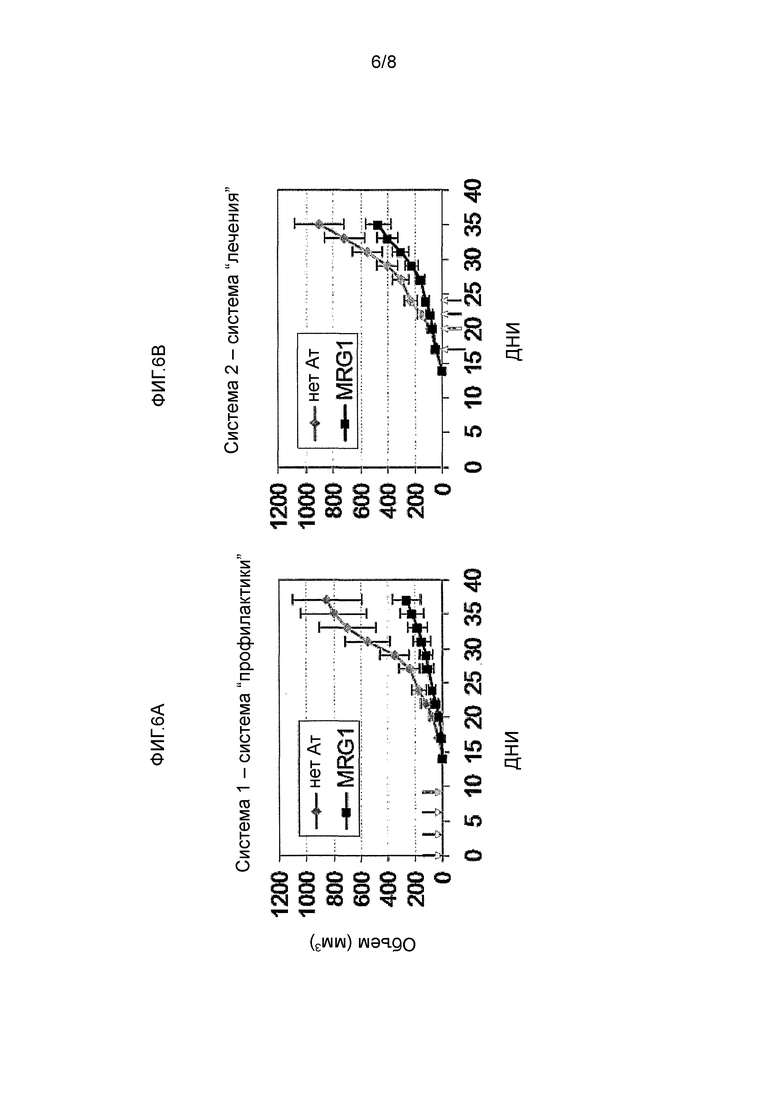
Фиг. 6A-B изображают ингибирование роста человеческой опухоли in vivo в мышах SCID систематическими инъекциями MRG1 по сравнению с инъекциями PBS. Эксперименты были выполнены в двух вариантах следующим образом: Фигура 6A: одновременные инъекции антитела (0,5 мг/мышь внутрибрюшинно) и инокулирование клеток рака (5,000,000 клетки подкожно); Фигура 6B: лечение опухолей, образовавшихся в SCID мышах (объем опухоли 75 мм3), инъекциями антитела MRG1 (как указано выше).
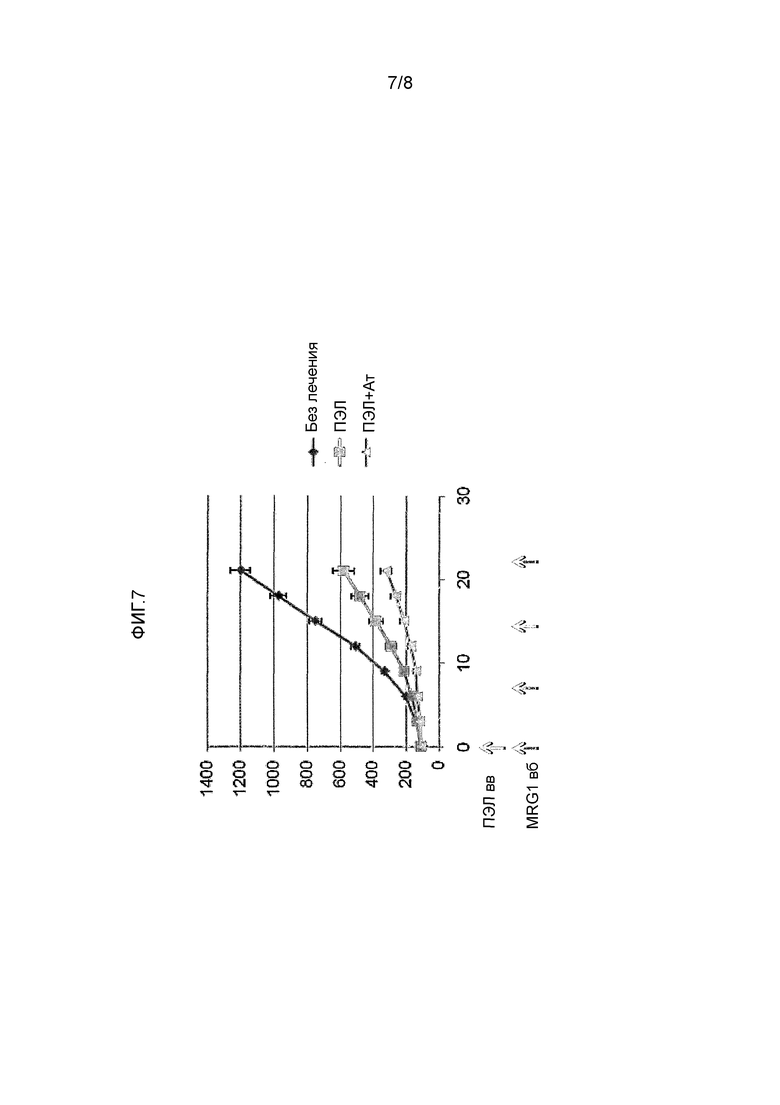
ФИГ. 7 иллюстрирует повышенную эффективность ингибирования роста опухоли сочетанием MRG1 с внутривенным введением человеческих активных ПЭЛ по сравнению с внутривенным введением только ПЭЛ.
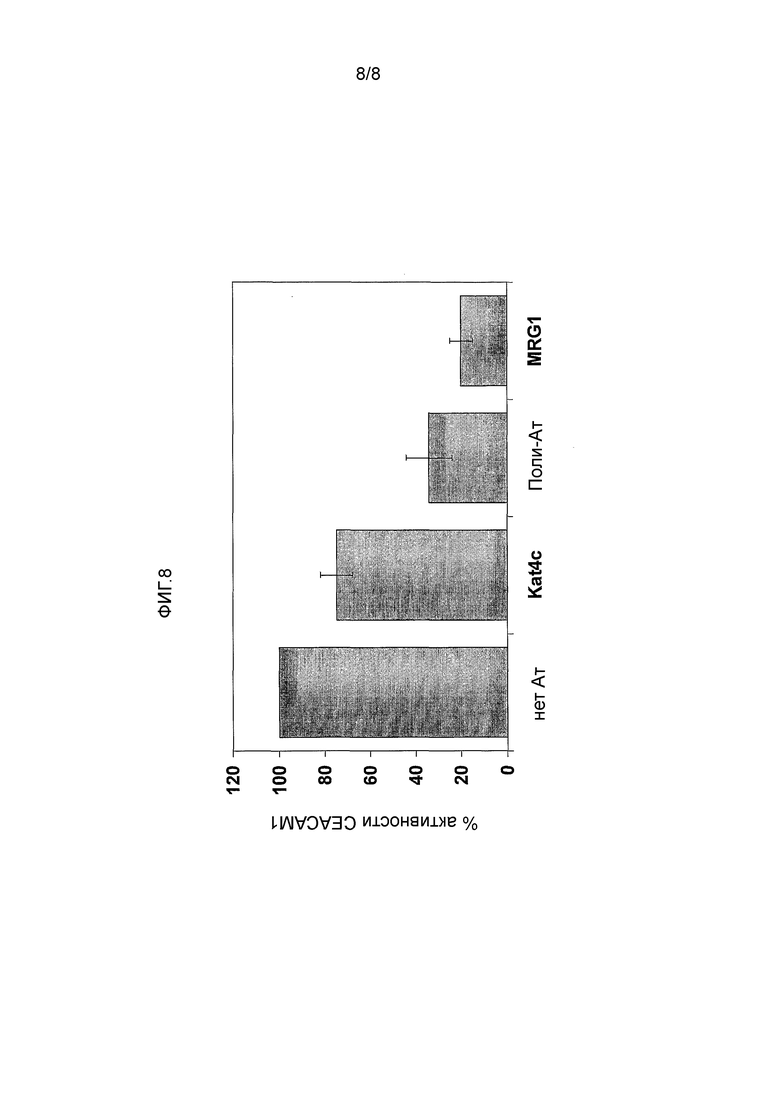
ФИГ. 8 иллюстрирует превосходящий эффект мАт MRG1 над предварительно описанными моноклональными антителами к CEACAM1, а также доступными для приобретения кроличьими поликлональными антителами к человеческому CEACAM1 (DAKO, Glostrup Denmark), как это определено функциональным блокирующим анализом. Различные антитела к CEACAM1 были испытаны на наличие блокирующей CEACAM1 активности, определяемой по выделению мышинного интерлейкина 2. 100% определялось как активность в отсутствие каких-либо антител. Представлены результаты показательного эксперимента, состоящего из трех вариантов, каждый из которых был выполнен в трех повторах.
Описание вариантов осуществления изобретения
Настоящее изобретение, в некоторых вариантах осуществления такового, относится к моноклональному антителу к CEACAM1 и клеткам гибридомы, продуцирующим таковое, а также к способам использования антитела при иммуномодуляции и лечении рака.
Перед подробным разъяснением, по меньшей мере, одного варианта осуществления изобретения также следует понимать, что изобретение не обязательно ограничено при его применении деталями, установленными далее в последующем описании или проиллюстрированных Примерами. Изобретение может быть воплощено в других вариантах осуществления, или использовано на практике, или реализовано различными путями.
Авторы настоящего изобретения посредством трудоемких экспериментальных работ и скрининга получили моноклональное антитело, селективное в отношении CEACAM1. Было показано, что это антитело является превосходящим по отношению к другим моноклональным антителам CEACAM1, как продемострировано посредством анализов функционального блокирования.
Как показано в настоящем документе далее, антитело MRG1, полученное в соответствии с идеями настоящего изобретения, селективно к CEACAM1 и не дает перекрестной реакции с другими членами CEACAM семейства (т.е. CEACAM 5, 6 и 8, см. Пример 2). Антитело ингибирует гомофильные взаимодействия CEACAM1, что установлено с помощью совместного инкубирования иммунных клеток-эффекторов и целевых клеток меланомы, анализом выделения интерлейкинов 2 и наличия клеточного лизиса (см. Пример 3). Кроме того, было показано, что антитело эффективно в ингибировании инвазии и пролиферации клеток меланомы. В заключение, было показано, что введение in vivo антитела, как отдельно, так и в сочетании с активными лимфоцитами, было эффективно в ингибировании роста меланомных опухолей. В целом, идеи настоящего изобретения предполагают, что антитело MRG1, фрагменты и производные могут быть использованы в качестве эффективного средства для иммуномодуляции и лечения рака.
Таким образом, в соответствии с одним из аспектов изобретения обеспечена клетка гибридомы, которая депонирована под ATCC номером доступа PTA-9974.
В соответствии с дополнительным аспектом изобретения представлено выделенное антитело или фрагмент антитела, содержащий домен распознавания антигена, имеющий CDR участки и ориентацию антитела, продуцируемого из клеток гибридомы, описанной выше.
Антитело, соответствующее идеям настоящего изобретения, способно к связыванию CEACAM1 с минимальной аффинностью 10-6,10-7,10-8,10-9 М.
В используемом в настоящем документе значении термин "CEACAM1" относится к белковому продукту гена CEACAM 1, например, NP_001020083.1, NP_001703.2.
Термин "антитело" в используемом в данном изобретении значении включает интактные молекулы, а также функциональные фрагменты, такие как Fab, F(ab')2 и Fv, которые способны к связыванию макрофагов. В соответствии с характерным вариантом осуществления антитело является моноклональным антителом, таким как обозначаемое в настоящем документе MRG1. Функциональные фрагменты антител определяются следующим образом: (1) Fab, фрагмент, который содержит моновалентный антиген-связывающий фрагмент молекулы антитела, который может быть получен расщеплением полноразмерного антитела ферментом папаином с получением интактной легкой цепи и участка одной тяжелой цепи; (2) Fab', фрагмент молекулы антитела, который может быть получен обработкой полноразмерного антитела пепсином, с последующим восстановлением, с получением в результате интактной легкой цепи и участка тяжелой цепи; получаются два Fab' фрагмента на одну молекулу антитела; (3) (Fab')2, фрагмент антитела, который может быть получен обработкой полноразмерного антитела ферментом пепсином без последующего восстановления; F(ab')2 - это димер двух Fab' фрагментов, связанных вместе двумя дисульфидными связями; (4) Fv, определяется как созданный методами генетической инженерии фрагмент, содержащий вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, экспрессированный в виде двух цепей; и (5) одноцепочечное антитело ("SCA"), сконструированная методами генетической инженерии молекула, содержащая вариабельный участок легкой цепи и вариабельный участок тяжелой цепи, соединенные соответствующим полипептидным линкером в виде объединенной генетическими методами одноцепочечной молекулы.
Как указано выше, антитело по настоящему изобретению имеет такую же ориентацию определяющих комплементарность участков (CDR), как у антитела, продуцируемого клеткой гибридомы, имеющей описанный выше номер доступа. То есть CDR1, CDR2, CDR3 расположены в одинаковой ориентации на VH и VL цепях.
Фрагменты антител в соответствии с настоящим изобретением могут быть получены протеолитическим гидролизом антитела или экспрессией в E. coli или в клетках млекопитающих (например, культура клетки яичника китайского хомячка или в другая система экспрессии белков) ДНК, кодирующей фрагмент. Фрагменты антител могут быть получены посредством расщепления пепсином или папаином полноразмерных антител общепринятыми способами. Например, фрагменты антител могут быть получены ферментативным расщеплением антитела пепсином для получения 5S фрагмента, обозначаемого F(ab')2. Этот фрагмент может быть дополнительно расщеплен с использованием восстанавливающего тиолы агента и, если требуется, блокирующей группы для сульфгидрильных групп, получающихся в результате расщепления дисульфидных связей, для получения 3.5S Fab' моновалентных фрагментов. В качестве альтернативы, ферментативное расщепление с использованием пепсина напрямую приводит к получению двух моновалентных Fab' фрагментов и одного Fc фрагмента. Эти способы описаны, например, Goldenberg, в патентах США № 4036945 и 4331647 и ссылках, содержащихся в этих документах, соответствующие патенты включены в настоящий документ во всей своей полноте путем ссылок. См. также Porter, R. R. [Biochem. J. 73: 119-126 (1959)]. Другие способы расщепления антител, такие как разделение тяжелых цепей с образованием моновалентных фрагментов объединенных легких и тяжелых цепей, дополнительное расщепление фрагментов, или также могут быть использованы другие ферментативные, химические или генетические технологии при условии, что фрагменты связывают антиген, который распознается неизмененным антителом.
Fv фрагменты содержат комплекс цепей VH и VL. Этот комплекс может быть нековалентным, как описано Inbar et al. [Proc. Nat'l Acad. Sci. USA 69:2659-62 (19720]. В качестве альтернативы, вариабельные цепи могут быть соединены межмолекулярной дисульфидной связью или поперечно сшиты химическими веществами, такими как глутаральдегид. Предпочтительно Fv-фрагменты содержат цепи VH и VL, соединенные пептидным линкером. Эти одноцепочечные антиген-связывающие белки (sFv) получены с помощью конструирования структурного гена, содержащего ДНК последовательности, кодирующей VH- и VL-домены, соединенные олигонуклеотидом. Структурный ген встраивают в вектор экспрессии, который в дальнейшем вводят в клетку-хозяин, такую как E. coli. Рекомбинантные клетки-хозяева синтезируют единичную полипептидную цепь с пептидным линкером, несущую два V-домена. Способы продуцирования sFv описаны, например, в Whitlow and Filpula, Methods 2: 97- 105 (1991); Bird et al., Science 242:423-426 (1988); Pack et al., Bio/Technology 11:1271-77 (1993); and U.S. Pat. No. 4,946,778, которые включены в настоящий документ полностью путем ссылок.
Другая форма фрагмента антитела является пептидом, обозначенным отдельным определяющим комплементарность участком (CDR). CDR-пептиды ("минимальные блоки распознавания") могут быть получены конструированием генов, кодирующих CDR-антитела, представляющие интерес. Такие гены получают, например, с использованием полимеразной цепной реакции для синтезирования вариабельного участка по РНК клеток, продуцирующих антитела. См., например, Larrick and Fry [Methods, 2: 106-10 (1991)]. В соответствии с некоторыми вариантами осуществления настоящего изобретения, области CDR антитела могут быть реализованы в любой форме, такой как, с использованием технологии рекомбинантных ДНК.
Гуманизированные формы не относящихся к человеку (например, мышиных) антител являются химерными молекулами иммуноглобулинов, иммуноглобулиновыми цепями или фрагментами таковых (такими как Fv, Fab, Fab', F(ab').sub.2, или другими антиген-связывающими частями последовательностей антител), которые содержат минимальную последовательность, полученную из не относящегося к человеку иммуноглобулина. Гуманизированные антитела включают человеческие иммуноглобулины (реципиентное антитело), в которых остатки, формирующие определяющий комплементарность участок (CDR) реципиента, замещены остатками CDR нечеловекоподобных видов (доноров антитела), таких как мыши, крысы или кролики, имеющими требуемую специфичность, аффинность и емкость. В некоторых вариантах, остатки Fv каркасного участка человеческого иммуноглобулина замещены соответствующими не относящимися к человеку остатками. Гуманизированные антитела могут также заключать в себе остатки, которые не обнаружены ни в реципиентном антителе, ни во введенной CDR или каркасном участке последовательности. В общем, гуманизированное антитело будет содержать практически весь, по меньшей мере, один, и, как правило, два вариабельных домена, в которых все или практически все CDR участки соответствуют участкам не относящегося к человеку иммуноглобулина и все или практически все FR участки являются участками человеческой консенсусной последовательности иммуноглобулинов. Гуманизированное антитело оптимально также будет содержать, по меньшей мере, один участок константного участка иммуноглобулина (Fc), как правило, участок человеческого иммуноглобулина [Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol., 2:593-596 (1992)].
Способы гуманизирования не относящихся к человеку антител хорошо известны в данной области. В общем, гуманизированное антитело имеет один или несколько аминокислотных остатков, введенных в него из другого источника, который не является человеческим. Эти не относящиеся к человеку аминокислотные остатки обычно называются привнесенными остатками, которые, как правило, взяты из привнесенного вариабельного домена. Фактически, гуманизация может быть выполнена следующим способом Winter and co-workers [Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)], замещением CDR грызунов или CDR последовательностей на соответствующие последовательности человеческого антитела. Такие гуманизированные антитела соответственно являются химерными антителами (патент США № 4816567), в которых практически менее чем интактный человеческий вариабельный домен был замещен соответствующей последовательностью из не относящихся к человеку видов. На практике, гуманизированные антитела являются, как правило, человеческими антителами, в которых некоторые CDR остатки и, возможно, некоторые FR остатки замещены остатками из аналогичных сайтов в антителах грызунов.
Человеческие антитела могут также быть получены с использованием различных технологий, известных в данной области, включая библиотеки фагового дисплея [Hoogenboom и Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581 (1991)]. Технологии Cole et al. и Boerner et al. также пригодны для получения человеческих моноклональных антител (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985) и Boerner et al., J. Immunol., 147(l):86-95 (1991)]. Схожим образом, человеческие антитела могут быть созданы введением локусов человеческого иммуноглобулина трансгенным животным, например мыши, в которых гены эндогенного иммуноглобулина были частично или полностью инактивированы. В результате стимула наблюдалось продуцирование человеческого антитела, которое было полностью похоже на антитело человека по всем параметрам, включая перегруппировку генов, самосборку и состав антитела. Этот подход описан, например, в патентах США № 5545807; 5545806; 5569825; 5625126; 5633425; 5661016 и в следующих научных публикациях: Marks et al., Bio/Technology 10,: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368 812-13 (1994); Fishwild et al., Nature Biotechnology 14, 845-51 (1996); Neuberger, Nature Biotechnology 14: 826 (1996); and Lonberg and Huszar, Intern. Rev. Immunol. 13, 65-93 (1995).
В соответствии с некоторыми вариантами осуществления изобретения к антителу присоединен цитотоксичный агент.
В соответствии с некоторыми вариантами осуществления изобретения к антителу присоединен идентифицируемый агент.
Идентифицируемый агент может быть частью связывающейся пары, которая идентифицируется посредством ее взаимодействия с дополнительной частью связывающейся пары и метки, которая визуализируется напрямую. В одном из примеров, часть связывающейся пары является антигеном, который идентифицируется соответствующим меченым антителом. В одном из примеров меткой является флуоресцентный белок или фермент, продуцирующий колориметрическую реакцию.
Нижеследующая Таблица 1 предоставляет примеры последовательностей идентифицируемых агентов.
Цитотоксический или терапевтический агент может быть, например, цитотоксическим агентом, токсичным агентом, цитокиновым агентом, специфичным к двум антителам агентом, цитотоксином, хемокином, агентом для химиотерапии, проапоптотическим агентом, интерфероном, радиоактивной группой или сочетанием таковых, примеры которых предоставлены ниже.
Нижеследующая Таблица 2 предоставляет примеры последовательностей терапевтических агентов.
Необходимо учитывать то, что такие объединения групп могут быть осуществлены с использованием химических методов соединения или с помощью технологии рекомбинантных ДНК.
Антитело по настоящему изобретению может снизить ингибирующие гомофильные (или гомотипические) или гетеротипические взаимодействия CEACAM1 с увеличением посредством этого активности лимфоцитов. Гомофильные взаимодействия CEACAM1 происходят посредством N-домена. Некоторые аминокислоты являются критическими для этого взаимодействия, в частности R43, Q44, D64 и R82. Взаимодействие вызывает фосфорилирование цитоплазматического остатка тирозина, в котором участвует SHP-1 фосфотаза. Это инициирует ингибирующий каскад в лимфоцитах, который направляет проксимальные переносчики, такие как ZAP70.
Таким образом, антитело по настоящему изобретению может быть использовано для блокирования CEACAM1 в любых из двух или в обеих вместе иммунных клетках-эффекторах (экспрессирующие CEACAM1 лимфоциты, например, противоопухолевые эффекторные клетки, T-клетки или NK-клетки) и целевых клетках (например, экспрессирующие CEACAM1 патологические клетки, такие как раковые клетки). Примеры раковых клеток, являющихся потенциально подходящими для использования этой терапии, включают, без ограничения, клетки меланомы, легких, щитовидной железы, молочной железы, толстой кишки, предстательной железы, печени, мочевого пузыря, почек, шейки матки, поджелудочной железы, лейкемии, лимфомы, миелоидные, яичниковые, матки, саркомы, желчные или внутриматочные.
В настоящем изобретении также рассматриваются выделенное антитело или фрагменты антитела, которые конкурируют за связывание с CEACAM1 с антителами, продуцируемыми вышеописанной клеткой гибридомы. Эти антитела могут быть гуманизированы при условии, что чужеродные или химерные антитела (как подробно описано выше) пригодны для, например, терапевтических применений. Фрагмент антитела может быть, например, одноцепочечным Fv-фрагментом, F(ab')-фрагментом, F(ab)-фрагментом и F (ab')2-фрагментом.
Таким образом, в соответствии с дополнительным аспектом изобретения представлен способ перевода экспрессирующей CEACAM1 опухолевой клетки в восприимчивое к иммуномодуляции состояние. Способ включает контактирование экспрессирующей CEACAM1 опухолевой клетки (например, клетки меланомы, легких, щитовидной железы, молочной железы, толстой кишки, простаты, печени, мочевого пузыря, почек, шейки матки, поджелудочной железы, лейкемии, лимфомы, миелоидные, яичниковые, матки, саркомы, желчные или внутриматочные) с антителом или фрагментом антитела, описанными выше, с переводом посредством этого экспрессирующей CEACAM1 опухолевой клетки в восприимчивое к иммуномодуляции состояние.
В используемом в настоящем документе значении термин "иммуномодуляция" относится к лимфоцит-зависимой иммуномодуляции (например, NK-клетками или противоопухолевыми эффекторными лимфоцитами).
Дополнительно или в качестве альтернативы, настоящее изобретение также предусматривает способ иммуномодуляции (например, ингибирование CEACAM 1 гомотипическим или гетеротипическим белок-белковым взаимодействием) посредством контактирования экспрессирующего CEACAM1 лимфоцита с антителом или фрагментом антитела, описанными в настоящем документе.
Способы, соответствующие идеям настоящего изобретения, могут быть осуществлены in vitro, ex vivo (например, с использованием основанной на T-клетке адоптивной иммунотерапии) или in vivo.
Как уже упомянуто, антитела по некоторым вариантам осуществления изобретения могут обладать противораковой активностью, которая не зависит от их иммуномодулирующей активности, описанной выше.
Таким образом, идеи настоящего изобретения дополнительно предоставляют способ ингибирования миграции или пролиферации экспрессирующей CEACAM1 опухолевой клетки, включающий контактирование экспрессирующей CEACAM1 опухолевой клетки с антителом или фрагментом антитела, описанными в настоящем документе, с ингибированием посредством этого миграции или пролиферации экспрессирующей CEACAM 1 опухолевой клетки.
В используемом в настоящем документе значении термин "ингибирование" относится к, по меньшей мере, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% 100% ингибирования пролиферации или миграции, которые могут быть подвергнуты оценке с использованием хорошо известных в данной области способов (см. раздел примеры далее).
Антитела по настоящему изобретению могут быть эффективно использованы для лечения рака.
Таким образом, в соответствии с дополнительным аспектом представлен способ лечения рака, включающий введение индивидууму, нуждающемуся этом, терапевтически эффективного количества антитела или фрагмента антитела, описанных в настоящем документе, с осуществлением лечения посредством этого, рака у индивидуума. Примеры рака, которые могут быть диагностированы или подвергаться лечению в соответствии с идеями настоящего изобретения, включают, без ограничения, меланому, саркому, рак легких, рак щитовидной железы, рак груди, рак толстой кишки, рак простаты, рак печени, рак мочевого пузыря, рак почек, цервикальный рак, рак поджелудочной железы, лейкемию, лимфому, рак клеток костного мозга, рак яичников, рак матки, рак желчных протоков или внутриматочный рак.
В соответствии с характерным вариантом осуществления настоящего изобретения рак является меланомой.
Термин "лечение" относится к ингибированию, предотвращению или остановке развития патологии (заболевание, расстройство или патологическое состояние) и/или инициированию восстановления, ремиссии или регрессии патологии. Специалистам в данной области необходимо понимать, что могут быть использованы различные методики и анализы для того, чтобы оценить развитие патологии и, схожим образом, различные методики и анализы могут быть использованы для того, чтобы оценить восстановление, ремиссию или регрессию патологии.
В используемом в настоящем документе значении термин "предотвращение" относится к предохранению от появления заболевания, расстройства или патологического состояния у индивидуума, который может быть подвержен риску заболевания, но у которого заболевание еще не диагностировано.
В используемом в настоящем документе значении термин" индивидуум" включает млекопитающих, предпочтительно людей любого возраста, которые страдают патологией. Предпочтительно этот термин охватывает индивидуумов, подверженных риску развития патологии.
Для того чтобы улучшить лечение (например, лечение рака), лимфоциты, такие как T-клетки (например, противоопухолевые эффекторные лимфоциты) или NK-клетки могут быть введены индивидууму перед, одновременно или после введения антител или фрагментов антител по настоящему изобретению. Соответственно, лимфоциты могут быть получены у индивидуума (например, из его периферической крови или опухоли) или у донора (аллогенного или изогенного донора лимфоцитов), обработаны способами размножения ex vivo по отношению к полученным жизнеспособным лимфоцитам [например, выращиванием на облученном питающем подслое, дополненном интерлейкинами 2, как это предварительно описано в Besser MJ et al., Clin Cancer Res (Epub ahead of print) 2010 May 1 and in Besser MJ et al., Journal of Immunotherapy (Epub ahead of print) 2009 Apr 1, полностью включенных в настоящий документ путем ссылки], и введены индивидууму.
Необходимо принимать во внимание то, что индивидуум может быть подвергнут любому другому противораковому лечению (например, химиотерапии, лучевой терапии, и т.д.) перед введением антитела или фрагмента антитела или перед введением лимфоцитов.
Антитело по настоящему изобретению может быть введено в организм в чистом виде или в фармацевтической композиции, в которой оно смешано с соответствующими носителями или эксципиентами.
В используемом в настоящем документе значении термин "фармацевтическая композиция" относится к препарату одного или нескольких активных ингредиентов, описанных в настоящем документе, с другими химическими компонентами, такими как физиологически пригодные носители и эксципиенты. Целью создания фармацевтической композиции является облегчение введения соединения в организм.
В настоящем документе термин "активный ингредиент" относится к антителу, ответственному за биологический эффект.
В дальнейшем в этом документе выражения "физиологически приемлемый носитель" и "фармацевтически приемлемый носитель", которые могут использоваться взаимозаменяемо, относятся к носителю или растворителю, который не вызывает существенной ирритации в организме и не аннулирует биологическую активность и свойства введенного соединения. Адъювант включается в состав значений этих выражений.
В настоящем документе термин "эксципиент" относится к инертной субстанции, добавляемой к фармацевтической композиции для дополнительного облегчения введения активного ингредиента. Нелимитирующие примеры эксципиентов включают карбонат кальция, фосфат кальция, различные сахара и типы крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли.
Технологии рецептуры и введения лекарственных препаратов можно найти в "Remington's Pharmaceutical Sciences," Mack Publishing Co., Easton, PA, latest edition, которое включено в настоящий документ путем ссылки.
Соответствующие пути введения могут включать, например, пероральную, ректальную, трансмукозальную, в особенности трансназальную, интестинальную или парентеральную доставку, включая внутримышечные, подкожные и интрамедуллярные инъекции, а также интратекальные, непосредственно интравентрикулярные, интракардиальные, например, инъекции в правую или левую полость желудочка, в коронарную артерию, внутривенные, интраперитонеальные, интраназальные или внутриглазные.
Общепринятые подходы доставки лекарств в центральную нервную система (ЦНС) включают: нейрохирургические подходы (например, интрацеребральная инъекция или интрацеребровентрикулярное вливание); молекулярную обработку агента (например, получение химерного белка, который содержит транспортный пептид, который обладает аффинностью к молекуле на поверхности эндотелиальной клетки, в сочетании с агентом, который сам по себе не способен проходить через гематоэнцефалический барьер) для того, чтобы попытаться использовать один из путей эндогенного транспорта через гематоэнцефалический барьер; фармакологические стратегии, разработанные для увеличения жирорастворимости агента (например, конъюгация водорастворимых реагентов с липоидным или холестериновыми носителями); и временное нарушение целостности гематоэнцефалического барьера посредством гиперосмотического разрушения (получающегося в результате вливания раствора маннитола в сонную артерию или использования биологически активного агента, такого как, пептид ангиотензин). Тем не менее, каждая из этих стратегий имеет ограничения, такие как неотъемлемые риски, связанные с инвазивной хирургической процедурой, ограничение по размеру, накладываемое ограничением, неотъемлемым для эндогенных транспортных систем, потециально нежелательные биологические побочные эффекты, связанные с систематическим введением химерной молекулы, содержащей фрагмент носителя, который может быть активен вне ЦНС, и возможный риск повреждения мозга в участках мозга, где разрушен гематоэнцефалический барьер, что дает возможность близкого к оптимальному способа доставки.
С другой стороны, возможно введение фармацевтической композиции локальным, а не систематическим образом, например посредством инъекции фармацевтической композиции непосредственно в участок ткани пациента.
Термин "ткань" относится к части организма, состоящей из совокупности клеток, имеющих схожую структуру и/или общую функцию. Примеры включают, без ограничения, ткань мозга, сетчатку, кожную ткань, печеночную ткань, ткань поджелудочной железы, костную, хрящевую, соединительную ткань, кровяную ткань, мышечную ткань, сердечную ткань, сосудистую ткань, почечную ткань, легочную ткань, гонадальную ткань, кроветворную ткань.
Фармацевтические композиции по настоящему изобретению могут быть получены с помощью хорошо известных в данной области процессов, например посредством общепринятых процессов смешивания, растворения, гранулирования, создания драже, отмучивания, эмульгирования, инкапсулирования, улавливания или лиофилизации.
Фармацевтические композиции для использования в соответствии с настоящим изобретением могут быть составлены общепринятым способом с использованием одного или нескольких физиологически приемлемых носителей, содержащих эксципиенты и вспомогательные вещества, которые облегчают переработку активных ингредиентов в препараты, которые могут быть использованы фармацевтически. Соответствующая рецептура зависит от выбранного пути введения.
Активные ингредиенты фармацевтической композиции могут быть составлены в водных растворах для инъекции, предпочтительно в физиологически совместимых буферах, таких как раствор Ханка, раствор Рингера или физиологический солевой буфер. Для трансмукозального введения при составлении используются пенетранты, соответствующие барьеру, который необходимо преодолеть. Такие пенетранты общеизвестны в данной области.
Для перорального введения фармацевтическая композиция может быть без труда приготовлена сочетанием активных соединений с хорошо известными в данной области фармацевтически приемлемыми носителями. Такие носители позволяют приготовить фармацевтическую композицию в виде таблеток, пилюль, драже, капсул, растворов, гелей, сиропов, взвесей, суспензий и тому подобного для перорального приема внутрь пациентом. Фармакологические препараты для перорального применения могут быть изготовлены с использованием твердого эксципиента, если требуется, измельчением получающейся в результате смеси и обработкой смеси гранул, после добавления соответствующих вспомогательных веществ, если это требуется, для получения таблеток или наполнителей драже. Подходящие эксципиенты являются, в частности, наполнителями, такими как сахара, включая лактозу, сахарозу, маннитол или сорбитол; целлюлозные препараты, такие как, например, маисовый крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрий карбометилцеллюлоза; и/или физиологически приемлемые полимеры, такие как поливинилпирролидон (ПВП). Если требуется, могут быть добавлены распадающиеся реагенты, такие как поперечно-связанный поливинилпирролидон, агар или альгиновая кислота или соль таковой, такая как альгинат натрия.
Наполнители драже обеспечены соответствующими покрытиями. Для этой цели концентрированные сахарные растворы, если требуется, могут содержать аравийскую камедь, тальк, поливинилпирролидон, карбополовый гель, полиэтиленгликоль, диоксид титана, лакирующие растворы и соответствующие органические растворители или смеси растворителей. Красящие вещества или пигменты могут быть добавлены к покрытиям таблеток или драже для идентификации или для того, чтобы охарактеризовать различные сочетания доз активного соединения.
Фармацевтические композиции, которые могут быть использованы перорально, включают плотные капсулы, изготовленные из желатина, а также мягкие, упакованные капсулы, изготовленные из желатина и смягчителя, такого как, глицерин или сорбитол. Плотные капсулы могут содержать активные ингредиенты в дополнение к наполнителю такому как, лактоза, связующим веществам, таким как крахмалы, смазочным веществам, таким как тальк или стеарат магния, и, по желанию, стабилизаторы. В мягких капсулах активные ингредиенты могут быть растворены или суспендированы в соответствующих растворах, таких как жирные масла, парафиновое масло или жидкие полиэтиленгликоли. Кроме того, могут быть добавлены стабилизаторы. Все рецептуры для перорального введения должны быть в дозировках, соответствующих выбранному пути введения.
Для трансбуккального введения композиции могут принимать форму таблеток или лекарственных леденцов, приготовленных общепринятым способом.
Для введения с помощью назальной ингаляции активные ингредиенты для применения в соответствии с настоящим изобретением удобно доставляются в форме подачи спрей-аэрозолем из герметичного контейнера или распылителя с использованием соответствующего распыляющего вещества, например дихлордифтормегана, трихлорфторметана, теграфтордихлорэтана или диоксида углерода. В случае герметичного аэрозоля, единица дозирования может быть определена обеспечением клапана для доставки дозированного количества. Капсулы и ампулы, например из желатина, для применения в распылителе могут быть сформулированы так, что они содержат порошковую смесь соединения и соответствующую порошковую основу, такую как лактоза или крахмал.
Фармацевтическая композиция, описанная в настоящем документе, может быть приготовлена для парентерального введения, например, посредством болюсного вливания или непрерывной инфузии. Рецептуры для инъекции могут быть представлены в штучной лекарственной форме, например в ампулах или в мультидозовых контейнерах, с добавлением консерванта, если требуется. Композиции могут быть суспензиями, растворами или эмульсиями в масляных или водных средах и могут содержат рецептурные реагенты, такие как суспендирующие, стабилизирующие и/или диспергирующие реагенты.
Фармацевтические композиции для парентерального введения включают водные растворы препарата активного вещества в водорастворимой форме. Кроме того, суспензии активных ингредиентов могут быть приготовлены в виде соответствующих жиро- или водно-основных инъекционных суспензий. Соответствующие липофильные растворители или среды включают жирные масла, такие как кунжутное масло, или синтетические эфиры жирных кислот, такие как этилолеат, триацилглицериды, или липосомы. Водные инъекционные суспензии могут содержать субстанции, которые повышают вязкость суспензии, такие как натрий карбоксиметилцеллюлоза, сорбитол или декстран. Если требуется, суспензия может также содержать соответствующие стабилизаторы или реагенты, которые повышают растворимость активных ингредиентов, чтобы позволить приготовление высококонцентрированных растворов.
В качестве альтернативы, активный ингредиент может быть в форме порошка для разбавления соответствующей средой, например стерильным, апирогенным водоосновным раствором, перед применением.
Фармацевтическая композиция по настоящему изобретению может также быть приготовлена в виде ректальной композиции, такой как суппозитории или удерживающие клизмы, с использованием, например, общепринятых суппозиторных основ, таких как какао-масло или другие глицериды.
Фармацевтические композиции, пригодные для применения в контексте настоящего изобретения, включают композиции, в которых активные ингредиенты содержатся в количестве, эффективном для достижения предполагаемой цели. Более конкретно, терапевтически эффективное количество означает количество активных ингредиентов эффективное для предотвращения, частичного снятия, или облегчения симптомов расстройства (например, рака), или продления продолжительности существования индивидуума, подвергающегося лечению.
Установление терапевтически эффективного количества входит в возможности специалистов в данной области, в особенности, в свете подробного описания изобретения, предоставленного в настоящем документе.
Для любого препарата, используемого в способах по изобретению, терапевтически эффективное количество или доза могут быть первоначально оценены исходя из анализов in vitro и анализа культуры клеток. Например, доза может быть оценена на животных моделях для достижения требуемой концентрации или титра. Такая информация может быть использована для более точного определения подходящих доз на людях.
Токсичность и терапевтическая эффективность активных ингредиентов, описанных в настоящем документе, могут быть определены стандартными фармацевтическими процедурами in vitro, в клеточных культурах или на экспериментальных животных. Данные, полученные из этих in vitro анализов и анализов в клеточной культуре, и исследование на животных могут быть использованы для определения пределов дозировок для использования по отношению к людям. Дозировка может изменяться в зависимости от применяемой формы дозировки и используемого пути введения. Точная рецептура, путь введения и дозировка могут быть выбраны лечащим врачом с учетом состояния пациента (см., например, Fingl, et al., 1975, in "The Pharmacological Basis of Therapeutics", Ch. 1 p.l).
Размер дозировки и интервал между введениями лекарственного средства могут быть установлены индивидуально для обеспечения уровней антител в активном ингредиенте на достаточном уровне для стимулирования или подавления биологического эффекта (минимальная эффективная концентрация, МЭК). МЭК будет варьироваться для каждого препарата, но может быть установлена исходя из данных in vitro. Дозировка, необходимая для достижения МЭК, будет зависеть от индивидуальных особенностей и пути введения. Детекционные анализы могут быть использованы для определения концентрации в плазме.
Терапевтическая эффективность может быть дополнительно проверена на соответствующих экспериментальных моделях на животных, которые хорошо известны в данной области, человеческие ксенотрансплантаты в иммунодефицитных мышах. В зависимости от опасности и чувствительности патологического состояния, которое должно быть подвергнуто лечению, введение доз может быть единичным или в виде множественных введений, с курсом лечения длительностью от нескольких дней до нескольких недель или пока курс лечения не будет осуществлен, или будет достигнуто уменьшение болезненного состояния.
Количество композиции, которое должно быть введено, будет, конечно, зависеть от индивидуума, повергающегося лечению, опасности заболевания, способа введения, оценки лечащего врача и т.д.
Композиции по настоящему изобретению могут, если требуется, быть представлены в упаковке или распылительном устройстве, таких как одобренный FDA набор, который может содержать одну или несколько единичных лекарственных форм, содержащих активный ингредиент. В упаковке может, например, содержаться металлическая фольга или полимерная пленка, как в блистерной упаковке. Упаковка или распылительное устройство могут дополняться инструкциями для введения. Упаковка или распылитель могут также дополняться примечаниями, связанными с контейнером в форме, предусмотренной государственным органом, регулирующим производство, применение или продажу лекарственных препаратов, замечания которого являются отражающими одобрение агентством формы композиции или введение людям или животным. Такое примечание, например, может быть меткой, одобренной Управлением по контролю за продуктами США и лекарствами рецептурных препаратов или одобренным листком-вкладышем. Композиции, содержащие препарат по изобретению, сформулированные в совместимом фармацевтическом носителе, могут также быть получены, помещены в подходящий контейнер и помечены для лечения указанного состояния здоровья, как дополнительно подробно описано выше.
Помимо терапевтического применения, антитела по настоящему изобретению могут также быть использованы для диагностического применения.
Таким образом, в соответствии с дополнительным аспектом представлен способ диагностирования рака у индивидуума, нуждающегося в этом, включающий контактирование биологического образца, полученного от индивидуума (in vivo или ex vivo) с антителом или фрагментом антитела, описанными в настоящем документе, в котором комплексообразование, выходящее за пределы предопределенного порога, служит признаком рака у индивидуума. В соответствии с некоторыми вариантами осуществления клетки рака характеризуются сверхэкспрессией CEACAM1 по сравнению с непораженными клетками.
Как уже упомянуто, способ по изобретению осуществлен при условиях, достаточных для образования иммунного комплекса; такие условия (например, соответствующие концентрации, буферы, температуры, время реакция), а также способы оптимизирования таких условий известны специалистам в данной области, и примеры раскрываются в настоящем документе. В используемом в настоящем документе значении выражение "иммунный комплекс" относится к комплексу, который содержит антитело по изобретению и CEACAM1.
Определение присутствия или уровня иммунного комплекса изобретения проводят непосредственно или посредством детектирования идентифицируемой (детектируемой) группы, которая может быть присоединена к антителу.
Уровень иммунного комплекса в тестируемой клетке (например, клетка индивидуума, нуждающегося в этом) сравнивается с заранее установленным порогом. Необходимо принимать во внимание то, что антитело по настоящему изобретению может также быть использовано для измерения количества сыворотки, растворяющей CEACAM1. В любом случае порог может быть определен на основании известного контрольного уровня и/или уровня в контрольной клетке или сыворотке. Контрольная клетка может быть получена из контрольного, здорового индивидуума (например, индивидуума, не страдающего раком) или из того же индивидуума перед инициацией заболевания или после лечения. В соответствии с некоторыми вариантами осуществления изобретения контрольный индивидуум принадлежит к тому же виду, например человеческому, предпочтительно имеет тот же возраст, вес, пол и т.д., как индивидуум, нуждающийся в лечении.
В используемом в настоящем документе значении термин "диагностирование" относится к определению наличия или отсутствия патологии, классифицированию патологии или симптома, определяющего опасность патологии, контролю за прогрессированием патологии, прогнозированию последствий патологии и/или шансов на выздоровление.
Для облегчения диагностики вышеупомянутые идеи можно сочетать с другими способами диагностирования рака, которые хорошо известны в данной области, включая, но не ограничиваясь, визуализацию, молекулярные тесты и виды хирургической биопсии.
Если диагноз установлен, индивидуум проинформирован о диагнозе, то могут быть инициированы соответствующие процедуры лечения.
Термины "содержит", "состоящий из", "включает", "включая", "имеющий" и родственные им по корню и значению слова означают "включая, без ограничения". Этот термин охватывает термины "состоящий из" и "по существу состоящий из".
Выражение "по существу состоящий из" означает, что композиция или способ могут включать дополнительные ингредиенты и/или этапы, но только если дополнительные ингредиенты и/или этапы не существенно изменяют основные и новые особенности заявленной композиции или способа.
В используемом в настоящем документе значении единственное число предмета означает и множественное число, если в контексте не оговаривается однозначно иное. Например, термины "соединение" или "по меньшей мере, соединение" могут включать некоторое количество соединений, включая смеси таковых.
Во всей заявке различные варианты осуществления этого изобретения могут быть представлены в виде диапазона. Следует понимать, что описание представлено в виде диапазона просто для удобства и не должно истолковываться как неизменяемые ограничения рамок изобретения. Соответственно, описание диапазонов следует рассматривать как, кроме того, раскрывающее все возможные поддиапазоны, а также отдельные численные значения внутри диапазона. Например, описание диапазона, такого как от 1 до 6, следует рассматривать как раскрывающее, кроме того, поддиапазоны, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.д., а также отдельные номера внутри этого диапазона, например 1, 2, 3, 4, 5 и 6. Это применимо независимо от широты диапазона.
Каждый раз, когда в настоящем документе указан численный диапазон, то подразумевается, что он включает любое приводимое число (дробное или целочисленное) в указанном диапазоне. Выражения "варьирующийся/изменяющийся в диапазоне между" первым указанным числом и вторым указанным числом и "варьирующихся/изменяющийся в диапазоне от" первого указанного числа "до" второго указанного числа используются в настоящем документе взаимозаменяемо, и подразумевается, что они включают первое и второе указанные числа и все дробные и целочисленные числа между ними.
В используемом в настоящем документе значении термин "способ" относится к методам, средству, технологиям и процедурам для выполнения данного задания включая, но не ограничиваясь, те методы, средство, технологии и процедуры, которые или известны, или без труда разрабатываются на основе известных методов, средств, технологий и процедур практикующими специалистами химической, фармакологической, биологической, биохимической и медицинской областей.
Слово "примерный" используется в настоящем документе для обозначения "служащего в качестве примера, образца или иллюстрации". Любой вариант осуществления, описываемый как "примерный", не должен обязательно истолковываться как предпочтительный или преимущественный по отношению к другим вариантам осуществления и/или исключающий добавление особенностей других вариантов осуществления.
Выражение "если требуется" используется в настоящем документе вместо выражения "обеспечено в некоторых вариантах осуществления и не обеспечено в других вариантах осуществления". Любой отдельный вариант осуществления изобретения может включать некоторое количество "необязательных" особенностей при условии, что эти особенности не противоречат друг другу.
Необходимо принимать во внимание, что определенные особенности изобретения, которые представлены для наглядности, описанные в контексте отдельных вариантов осуществления, могут также быть представлены в сочетании в одном варианте осуществления. И наоборот, различные особенности изобретения, которые для краткости описаны в контексте одного варианта осуществления, могут также быть представлены отдельно или в любой подходящей части сочетания или в соответствующем виде в любом другом описанном варианте осуществления изобретения. Определенные особенности, описанные в контексте различных вариантов осуществления, не должны рассматриваться как неотъемлемые особенности этих вариантов осуществления при условии, что вариант осуществления не становится нефункционирующим без этих элементов.
Различные варианты осуществления и аспекты настоящего изобретения, как описанные ранее в настоящем документе, так и заявленные далее в формуле изобретения, находят экспериментальное подтверждение в следующих примерах.
ПРИМЕРЫ
Ссылка дана на следующие примеры, которые вместе с вышеприведенным описанием иллюстрируют некоторые варианты осуществления изобретения в неограничивающей форме.
В целом, номенклатура, используемая в настоящем документе, и лабораторные процедуры, используемые в настоящем изобретении, включают молекулярные, биохимические, микробиологические технологии и технологию рекомбинантных ДНК. Такие технологии полностью разъяснены в литературе. См., например, "Molecular Cloning: A laboratory Manual" Sambrook et al., (1989); "Current Protocols in Molecular Biology" Volumes I-III Ausubel, R. M., ed. (1994); Ausubel et al., "Current Protocols in Molecular Biology", John Wiley and Sons, Baltimore, Maryland (1989); Perbal, "A Practical Guide to Molecular Cloning", John Wiley & Sons, New York (1988); Watson et al., "Recombinant DNA", Scientific American Books, New York; Birren et al. (eds) "Genome Analysis: A Laboratory Manual Series", Vols. 1-4, Cold Spring Harbor Laboratory Press, New York (1998); методика изложена в Патентах США № 4666828; 4683202; 4801531; 5192659 и 5272057; "Cell Biology: A Laboratory Handbook", Volumes I-III Cellis, J. E., ed. (1994); "Current Protocols in Immunology" Volumes I-III Coligan J. E., ed. (1994); Stites et al. (eds), "Basic and Clinical Immunology" (8th Edition), Appleton & Lange, Norwalk, CT (1994); Mishell and Shiigi (eds), "Selected Methods in Cellular Immunology", W. H. Freeman and Co., New York (1980); подходящие иммуноанализы подробно описаны в патентной и научной литературе, см., например, U.S. Pat. № 3791932; 3839153; 3850752; 3850578; 3853987; 3867517; 3879262; 3901654; 3935074; 3984533; 3996345; 4034074; 4098876; 4879219; 5011771 и 5281521; "Oligonucleotide Synthesis" Gait, M. J., ed. (1984); "Nucleic Acid Hybridization" Hames, B. D., and Higgins S. J., eds. (1985); "Transcription and Translation" Hames, B. D., and Higgins S. J., Eds. (1984); "Animal Cell Culture" Freshney, R. I., ed. (1986); "Immobilized Cells and Enzymes" IRL Press, (1986); "A Practical Guide to Molecular Cloning" Perbal, В., (1984) and "Methods in Enzymology" Vol. 1-317, Academic Press; "PCR Protocols: A Guide To Methods And Applications", Academic Press, San Diego, CA (1990); Marshak et al., "Strategies for Protein Purification and Characterization - A Laboratory Course Manual" CSHL Press (1996); все из которых включены в настоящий документ посредством ссылки. Другие общие ссылки предоставлены на протяжении всего документа. Предполагается, что процедуры в таковых хорошо известны в данной области и предоставлены для удобства читателя. Вся информация, содержащаяся в таких документах, включена в настоящий документ путем ссылки.
ПРИМЕР 1
Генерирование моноклональных антител
Генерирование моноклональных антител MRG1
Было генерировано моноклональное антитело, которое эффективно блокирует гомофильные взаимодействия CEACAM1 in vitro в наномолярных концентрациях. Мыши были иммунизированы 3 раза, с двухнедельными интервалами, 5 микрограммами рекомбинантного человеческого CEACAM1 (полный белок, доступный для приобретения от R&D Systems). Выращивались сплиноциты, и производилось их слияние с клетками SP2/0 для генерирования библиотеки гибридом.
Гибридома, продуцирующая CEACAM1-блокирующее антитело (мАт MRG1), была переклонирована несколько раз с получением в результате стабильного клона.
Другие моноклональные антитела
Kat4c мАт и кроличье поликлональное антитело к CEACAM были приобретены у DAKO (Глоструп, Дания).
ПРИМЕР 2
Специфичность мАт к CEACAM1
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ ПРОЦЕДУРЫ
Производство клеток, экспрессирующих CEACAM
CEACAM-негативные 721.221 человеческие клетки (первичные В клетки) были стабильно трансфицированы CEACAM 1, CEACAM5, CEACAM6 или CEACAM8 с помощью электропорации и селекции с G418.
Первичные клетки мышиной тимомы BW (клетки с недостатком альфа и бета цепей T-клеточных рецепторов, при этом с полным секреционным механизмом интерлейкинов 2) были трансфицированы химерной молекулой, содержащей внеклеточный участок человеческого CEACAM 1, слитый с трансмембранным и цитозольным концом мышиной зета цепи. Трансфекция была выполнена с помощью электропорации, а селекция с G418.
Скрининг антител с помощью FACS
Гибридомы были подвергнуты скринингу на CEACAM1 связывающую активность посредством проточной цитометрии следующим образом:
50,000 трансфицированных CEACAM клеток были помещены в 96 U-образных лунок.
Клетки были промыты холодным FACS буфером (PBS, BSA 0,5 %, азид 0,05 %).
Клетки были инкубированы с окрашивающими мАт (MRG1 или Kat4c): 0,1 микрограмма мАт на 100 микролитров, в течение 30 минут, на льду.
Клетки были осаждены центрифугированием, супернатанты были удалены и клетки были ресуспендированы в 100 микролитрах конъюгированных с ФИТЦ козьих антител к мышиным антителам (Jackson Imunoresearch) в разбавлении 1:200.
После 30 минут инкубирования (на льду, в темноте) клетки были осаждены центрифугированием, промыты и ресуспендированы в FACS буфере.
Клетки были проанализированы с использованием компьютерных программ FACScalibur and CellQuest.
РЕЗУЛЬТАТЫ
Так как первичные клетки 721.221 не экспрессируют какие-либо CEACAM белки, то эти клетки были стабильно трансфицированы CEACAM1, CEACAM5, CEACAM6 или CEACAM8 для того, чтобы проверить специфичность моноклональных антител (мАт) к CEACAM1. После этого гибридомы подвергались скринингу на CEACAM1 связывающую активность с помощью проточной цитометрии. Как показано на Фигуре 1A, мАт MRG1, генерированное в соответствии с идеями настоящего изобретения, специфично к человеческому CEACAM1. Оно обладает несущественной перекрестной активностью по отношению к CEACAM5 и не связывает CEACAM6 или CEACAM8. Фигура 1B показывает, что все трансфектанты экспрессировали CEACAM молекулы, при этом экспрессия CEACAM1 была самой низкой, что подчеркивает специфичность структуры MRG1.
ПРИМЕР 3
мАт способны к ингибированию CEACAM1 гомофильного связывавания
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ ПРОЦЕДУРЫ
Скрининг антител с помощью ELISA
Блокирующая CEACAM1 активность была проверена с использованием функциональной системы BW. Функциональная система BW содержит линию клеток мыши (BW), стабильно трансфицированную химерной молекулой, содержащей внеклеточный домен человеческого CEACAM1, слитого с мышиной зета цепью (BW/CEACAM1-зета, см. Пример 2, выше). Совместное инкубирование BW/CEACAM1-зета клеток с другими CEACAM1-позитивными клетками привело к секреции заметных концентраций мышиных интерлейкинов 2.
Таким образом, BW/CEACAM1-зета (клетки-эффекторы) или 221/CEACAM1 (целевые клетки) были предварительно отдельно инкубированы с 10-40 нг/мл мАт MRG1. После инкубирования в течение одного часа на льду были добавлены соответствующие клетки (221/CEACAM1 или BW/CEACAM1), и была измерена секреция интерлейкинов 2 мыши с помощью сэндвичевой ELISA (R&D systems).
Анализ цитотоксичности
Анализы цитотоксичности, тестирующие цитолиз различных линий меланомы противоопухолевыми эффекторными лимфоцитами, были выполнены в присутствии или отсутствие 1 мкг/мл мАт MRG1. CEACAM1High 526mel, 624mel и CEACAM1dim 09mel клетки меланомы были использованы в качестве целевых клеток. Клетки TIC014 были использованы в качестве клеток-эффекторов в соотношении Э:Ц 10:1. После инкубирования в течение одного часа с мАт MRG1 на льду соответствующие клетки были добавлены и инкубированы совместно в течение 5 часов при 37°C. Целевые клетки были предварительно мечены зеленым флуоресцентным красителем (CFSE) и наличие специфического лизиса было определено совместным окрашиванием пропидий йодидом (PI) в проточной цитометрии. Спонтанная гибель была снижена.
РЕЗУЛЬТАТЫ
Была подтверждена способность очищенного мАт MRG1 ингибировать CEACAM1 гомофильное связывание. Как показано на Фигуре 2, очищенное мАт MRG1 продемонстрировало дозозависимое ингибирование гомофильного связывания CEACAM1. В концентрации 10 нг/мл мАт эффективно понижало взаимодействия CEACAM 1, эффективность достигала плато при концентрации 20 нг/мл. Что важно - в двух экспериментах, т.е. при добавлении мАт MRG1 к клеткам-эффекторам, BW/CEACAM1-зета, или к целевым клеткам, 221/CEACAM1, были показаны схожие результаты (выделение мышиных интерлейкинов 2 было эффективно блокировано).
Блокирующий эффект мАт MRG1 был дополнительно продемонстрирован в анализах цитотоксичности. Как показано на Фигуре 3, цитолиз CEACAM1High 526mel и 624mel клеток был повышен посредством инкубирования антитела с клетками-эффекторами (но не на целевых клетках). Цитолиз клеток CEACAM1dim 09mel не изменялся в присутствии мАт MRG1 (Фигура 3).
ПРИМЕР 4
мАт к CEACAM1 ингибирует миграцию и пролиферацию клеток рака
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ ПРОЦЕДУРЫ
Анализ инвазии
Блокирующий эффект антител был проверен в анализе инвазии. Коротко говоря, клетки меланомы (08mel или 09mel) были предварительно инкубированы в присутствии или отсутствие 1 мкг/мл мАт MRG1 и после этого проверялись с помощью анализов инвазии Матригел. Инвазия происходила в течение 24 часов, и было оценено количество проникших клеток с использованием стандартизованного набора XTT.
Анализ общей пролиферации
CEACAM1High 526mel клетки были посеяны на день 0 в 48-луночные планшеты (2,500 клеток на лунку). К культурам был добавлен MRG1 в 3 различных концентрациях (0,5, 1 или 3 мкг/мл) или не добавлялся вообще. Количество полностью жизнеспособных клеток было посчитано через 2 дня или 5 дней после посева. Наличие пролиферации было определено с помощью стандартизованного набора XTT и непосредственным подсчетом клеток.
РЕЗУЛЬТАТЫ
Как показано на Фигуре 4, MRG1 блокировало инвазию CEACAM 1-позитивных клеток 08mel (уровень экспрессия CEACAM1 был средним, т.е. срединное значение интенсивности флуоресценции экспрессии CEACAM 1 составляло 50) и имело низкий эффект или не имело эффекта на CEACAM1dim 09mel клетки (уровень экспрессии CEACAM1 был низкий, т.е. срединное значение интенсивности флуоресценции экспрессии CEACAM1 составляло 15).
MRG1 также было проверено в анализах общей пролиферации. Наблюдали за дозозависимым ингибированием общей пролиферации 526mel клетки (Фигура 5). После 5 дней лечения пролиферация была снижена на более чем 60% (с 3 мкг мАт MRG1).
ПРИМЕР 5
MRG1 ингибирует рост раковой клетки в эспериментальных моделях на животных
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ ПРОЦЕДУРЫ
Модели ксенотрансплантата меланомы
5×106 клеток CEACAM1+ человеческой меланомы были введены подкожно в бок 7 недельной мыши SCID-NOD. Опухолевые образования сформировались на 100% поверхности тела мыши в течение 14-17 дней и продолжали расти. За размерами опухоли наблюдали неинвазивно с использованием кронциркуля 3 раза в неделю, и объемная величина была рассчитана как (d1×d2×d3/2).
Введение MRG1 было выполнено инъекцией 0,5 мг антитела, разбавленного 0,5 мл стерильного PBS, внутрибрюшинно. Инъекция PBS служила в качестве контроля.
Введение человеческих лимфоцитов, реакционно-способных по отношению к меланоме, было выполнено с помощью внутривенной инъекции в хвостовую вену 20×106 клеток, разбавленных 200 мкл стерильного PBS.
РЕЗУЛЬТАТЫ
В линии с блокированными функциями, продемонстрированной выше, введение MRG1 антитела ингибировало рост опухоли. Этот эффект был выражен, когда антитело было введено во время инокулирования опухолевой клетки (Фигура 6A, "Система предотвращения") или после того, как заметное опухолевое образование уже сформировалось (Фигура 6B, "Система лечения"). Эти эффекты были выражены после 4 инъекций за 8 дней, с последующим неинвазивным контролем (см. стрелки на Фигуре 6). Необходимо отметить, что этот эффект был независим от какого-либо эффекта иммуномодуляции, так как мыши SCID-NOD являются иммунодефицитными.
Имитация иммунного ответа к меланоме была выполнена посредством одиночной внутривенной инъекции активных по отношению к меланоме человеческих лимфоцитов, которые ингибировали рост опухоли (Фигура 7). Этот эффект существенно повышался посредством внутрибрюшинной инъекции MRG1 раз в неделю.
ПРИМЕР 6
MRG1 превосходит предварительно описанные антитела к CEACAM1
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ ПРОЦЕДУРЫ
Скрининг Антител с помощью ELISA
Блокирующая CEACAM1 активность была проверена с использованием функциональной системы BW, как подробно описано в Примере 3 ранее в настоящем документе.
100,000 BW/CEACAM1-зета клеток было предварительно инкубировано с 15 нг/мл мАт MRG1, 2600 нг/мл Kat4c мАт или 600 нг/мл кроличих поликлональных антител к CEACAM. После инкубирования в течение одного часа на льду было добавлено 50,000 721.221/CEACAM1 клеток, и была измерена секреция мышиных интерлейкинов 2 с помощью сэндвичевой панели ELISA (R&D Systems).
РЕЗУЛЬТАТЫ
Как показано в Примере 3 ранее в настоящем документе, авторы продемонстрировали почти полное блокирование CEACAM1 активности с использованием 15 нг/мл мАт MRG1. В отличие от этого моноклональное антитело Kat4c к CEACAM1 приводило к минимальному блокирующему эффекту только, когда были испытаны концентрации в 200 раз выше, поликлональные кроличие антитела к CEACAM давали в результате ингибирующий эффект при концентрации в 40 раз выше (2600 нг/мл и 600нг/мл, соответственно, Фигура 8).
Несмотря на то что изобретение было описано с использованием конкретных вариантов его осуществления, следует отметить, что много вариантов, модификаций и вариаций должно быть очевидно для специалистов в данной области. Соответственно, предполагается, что объяты все такие варианты, модификации и вариации, которые попадают в пределы основной идеи изобретения и находятся в рамках прилагаемой формулы изобретения.
Все публикации, патенты и заявки на патенты, упомянутые в описании, включены в описание настоящего документа во всей своей полноте путем ссылок, в такой же степени как, если бы было указано, что каждая из отдельных публикаций, патентов или заявок на патент была особым образом и отдельно включена в настоящий документ путем ссылки. Кроме того, упоминание или указание любого источника в данном документе не должно истолковываться как признание того, что такие источники доступны в качестве известного уровня техники для настоящего изобретения. В тех случаях, когда используются заголовки разделов, они не должны рассматриваться как лимитирующие в обязательном порядке.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА К РОДСТВЕННОЙ РАКОВО-ЭМБРИОНАЛЬНОМУ АНТИГЕНУ МОЛЕКУЛЕ КЛЕТОЧНОЙ АДГЕЗИИ (СЕАСАМ) | 2012 |
|
RU2650869C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АНТИ-СЕАСАМ 1 И АНТИ-PD АНТИТЕЛА ДЛЯ ТЕРАПИИ РАКА | 2014 |
|
RU2697522C1 |
| СОЧЕТАННЫЕ СПОСОБЫ ЛЕЧЕНИЯ С ИСПОЛЬЗОВАНИЕМ ИНГИБИТОРОВ ALK | 2015 |
|
RU2718914C2 |
| АНТИТЕЛО ПРОТИВ ЛИГАНДА 1 ЗАПРОГРАММИРОВАННОЙ ГИБЕЛИ КЛЕТОК (PD-L1), ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2727914C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К НЕКТИНУ-4 ЧЕЛОВЕКА | 2019 |
|
RU2825839C2 |
| АНТИТЕЛА, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩИЕ РЕЦЕПТОР 1 ТИПА ФАКТОРА РОСТА ФИБРОБЛАСТОВ, ПРИМЕНЕНИЕ АНТИТЕЛ ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ, СПОСОБ ПОЛУЧЕНИЯ АНТИТЕЛ | 2015 |
|
RU2638457C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ НЕКТИНА-2 ЧЕЛОВЕКА | 2020 |
|
RU2820275C2 |
| НОВЫЕ АНТИТЕЛА ПРОТИВ PD-L1 | 2016 |
|
RU2736151C2 |
| ЛЕЧЕНИЕ РАКА ПРИ ПОМОЩИ НАПРАВЛЕННЫХ НА МИШЕНЬ АНТИТЕЛ IN VIVO | 2011 |
|
RU2642305C2 |
| ПОЛИПЕПТИДЫ И ПОЛИНУКЛЕОТИДЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ИММУНОЛОГИЧЕСКИХ НАРУШЕНИЙ И РАКА | 2012 |
|
RU2623161C2 |
Настоящее изобретение относится к области биотехнологии и иммунологии. Предложена клетка гибридомы АТСС РТА-9974, а также выделенное антитело или его антигенсвязывающий фрагмент, где антитело получено из клетки гибридомы по изобретению и имеет СЕАСАМ1 ингибирующую активность. Кроме того, рассмотрены основанные на использовании антитела по изобретению или его антигенсвязывающего фрагмента: способ иммуномодуляции; способ ингибирования миграции или пролиферации экспрессирующей СЕАСАМ1 опухолевой клетки; способ диагностирования рака у индивидуума; способ лечения или ингибирования рака; а также способ ингибирования СЕАСАМ1 гомотипического или гетеротипического белок-белкового взаимодействия и фармацевтическая композиция для лечения или ингибирования рака. Антитело, полученное из гибридомы по настоящему изобретению, может найти дальнейшее применение в терапии и диагностике различных заболеваний, связанных с СЕАСАМ1. 8 н. и 10 з.п. ф-лы, 8 ил., 2 табл., 6 пр.
1. Клетка гибридомы, которая депонирована под номером доступа АТСС РТА-9974, где упомянутая клетка гибридомы продуцирует антитело против СЕАСАМ1.
2. Выделенное антитело или его антигенсвязывающий фрагмент, где антитело получено из клетки гибридомы по п.1 и имеет СЕАСАМ1 ингибирующую активность.
3. Выделенное антитело или антигенсвязывающий фрагмент по п.2, присоединенное к цитотоксичной группе.
4. Выделенное антитело или антигенсвязывающий фрагмент по п.3, в котором указанная цитотоксичная группа содержит цитотоксин, хемокин, группу для химиотерапии, проапоптотическую группу, интерферон, радиоактивную группу или их сочетания.
5. Выделенное антитело или антигенсвязывающий фрагмент по п.2, которое присоединено к идентифицируемой группе.
6. Способ иммуномодуляции, включающий контактирование экспрессирующего СЕАСАМ1 лимфоцита с антителом по п.2.
7. Способ ингибирования миграции или пролиферации экспрессирующей СЕАСАМ1 опухолевой клетки, включающий контактирование экспрессирующей СЕАСАМ1 опухолевой клетки с антителом или антигенсвязывающим фрагментом по п.2, с ингибированием посредством этого миграции или пролиферации экспрессирующей СЕАСАМ1 опухолевой клетки.
8. Способ диагностирования рака у индивидуума, нуждающегося в этом, включающий контактирование биологического образца, полученного от индивидуума, с антителом или антигенсвязывающим фрагментом по п.2 или 5, где комплексообразование, выходящее за пределы предопределенного порога, служит признаком рака у индивидуума.
9. Способ по п.8, в котором клетки рака характеризуются сверхэкспрессией СЕАСАМ1 по сравнению с непораженными клетками.
10. Способ лечения или ингибирования рака, включающий введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества антитела или антигенсвязывающего фрагмента по п.2, с лечением посредством этого рака у индивидуума.
11. Способ по п.10, дополнительно включающий введение индивидууму лимфоцитов.
12. Способ по п.11, в котором указанные лимфоциты содержат Т-клетки или NK-клетки.
13. Способ ингибирования СЕАСАМ1 гомотипического или гетеротипического белок-белкового взаимодействия, включающий контактирование экспрессирующего СЕАСАМ1 лимфоцита с антителом или антигенсвязывающим фрагментом по п.2, с ингибированием посредством этого СЕАСАМ1 гомотипического или гетеротипического белок-белкового взаимодействия.
14. Способ по п.6 или 13, в котором указанный экспрессирующий СЕАСАМ1 лимфоцит является противоопухолевым эффекторным лимфоцитом или NK клеткой.
15. Способ по п.6 или 13, в котором указанный экспрессирующий СЕАСАМ1 лимфоцит является цитотоксической Т-клеткой.
16. Способ по п.7, в котором упомянутая опухолевая клетка содержит опухолевую клетку меланомы.
17. Способ по п.8 или 10, в котором упомянутый рак является меланомой.
18. Фармацевтическая композиция для лечения или ингибирования рака, содержащая в качестве активного ингредиента терапевтически эффективное количество антитела или антигенсвязывающего фрагмента по п.2 или 3 и фармацевтически приемлемый носитель или эксципиент.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| IMAKIIRE T | |||
| et al., "Generation, immunologic characterization and antitumor effects of human monoclonal antibodies for carcinoembryonic antigen." International journal of cancer, 2004, 108(4): 564-570 | |||
| ФРАГМЕНТЫ АНТИТЕЛА, СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ ЧЕЛОВЕЧЕСКОГО РАКОВО-ЭМБРИОНАЛЬНОГО АНТИГЕНА (CEA) | 2003 |
|
RU2294939C2 |
Авторы
Даты
2016-09-27—Публикация
2010-04-29—Подача