ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее описание главным образом относится к новым антителам против PD-L1.
УРОВЕНЬ ТЕХНИКИ
[0002] Увеличивающееся число доказательств доклинических и клинических результатов показало, что нацеливание на иммунные контрольные точки становится наиболее перспективным подходом при лечении пациентов со злокачественными новообразованиями. Белок 1 запрограммированной гибели клеток, один из белков контрольной точки иммунного ответа, играет важную роль в ограничении активности Т-клеток, которые обеспечивают основной механизм иммунорезистентности, при котором опухолевые клетки ускользают от механизма иммунологического надзора. Взаимодействие PD-1, экспрессируемого на активированных Т-клетках, и PD-L1, экспрессируемого на опухолевых клетках, подавляет иммунный ответ и ослабляет противоопухолевый иммунитет. Экспрессия PD-L1 на опухолях коррелирует с пониженной выживаемостью при раковых заболеваниях пищевода, поджелудочной железы и других видах злокачественных новообразований, выделяя этот путь в качестве новой перспективной мишени иммунотерапии опухолей. Фармацевтическими компаниями, такими как Bristol-Myers Squibb (BMS), Merck, Roche и GlaxoSmithKline (GSK), были разработаны разнообразные агенты, нацеленные на путь PD-1. Данные клинических испытаний продемонстрировали первые свидетельства длительной клинической активности и обнадеживающий профиль безопасности у пациентов с различными типами опухолей. Ниволумаб, препарат PD-1, разработанный BMS, выделен как центральный в области препаратов следующего поколения. В настоящее время в 6 исследованиях поздних стадий лечение вызывало уменьшение размеров опухоли в трех из 5 исследовательских группах со злокачественными новообразованиями, включая 18% из 72 пациентов с раком легких, около трети из 98 пациентов с меланомой и 27% из 33 пациентов с раком почки. Разработанный Merck ламбролизумаб представляет собой полное моноклональное антитело IgG4 человека, действующее против PD-1, которому FDA присвоило статус «нового прорыва в терапии» после того, как были получены впечатляющие данные IB в отношении рака кожи. Результаты исследования фазы IB показали объективную противоопухолевую реакцию у 51% из 85 пациентов со злокачественным новообразованием и полный ответ у 9% пациентов. Экспериментальный MPDL3280A компании Roche продемонстрировал способность уменьшать размер опухоли у 29 из 140 (21%) пациентов со злокачественными опухолями на поздней стадии и различными размерами опухоли.
[0003] Однако существующие терапевтические методы не могут быть вполне удовлетворительными, и поэтому по-прежнему существует необходимость в новых антителах против PD-L1.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0004] Настоящее изобретение относится к новым моноклональным антителам против PD-L1 (в частности, полным антителам человека), к кодирующим их полинуклеотидам и к способам их применения.
[0005] В одном из аспектов настоящее изобретение относится к выделенным моноклональным антителам или их антигенсвязывающим фрагментам, которые способны специфически связываться с PD-L1 человека при значении Kd, равным не более 10-9 M (например, не более ≤9×10-10 M, ≤8×10-10 M, ≤7×10-10 M, ≤6×10-10 M, ≤5×10-10 M, ≤4×10-10 M, ≤3×10-10 M, ≤2×10-10 M или ≤10-10 M), как определено анализом связывания с плазмонным резонансом.
[0006] В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты связываются с PD-L1 обезьяны при EC50, равным не более 10 нМ (например, не более 1 нМ, 0,9 нМ, 0,8 нМ, 0,7 нМ, 0,6 нМ, 0,5 нМ, 0,4 нМ, 0,3 нМ, 0,2 нМ, 0,1 нМ, 0,09 нМ, 0,08 нМ, 0,07 нМ, 0,06 нМ, 0,05 нМ, 0,04 нМ, 0,03 нМ, 0,02 нМ или 0,01 нМ. В некоторых вариантах осуществления антитела и их антигенсвязывающие фрагменты не связываются с PD-L1 мыши, но связываются с PD-L1 обезьяны с аффинностью связывания, сходной с аффинностью связывания с PD-L1 человека. В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты эффективно ингибируют связывание PD-L1 человека или обезьяны с его рецептором (например, PD-1) при IC50, равным не более 100 нМ (например, не более 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 9 нМ, 8 нМ, 7 нМ, 6 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0,9 нМ, 0,8 нМ, 0,7 нМ, 0,6 нМ, 0,5 нМ, 0,4 нМ, 0,3 нМ, 0,2 нМ или 0,1 нМ). В некоторых вариантах осуществления EC50 или IC50 определяют анализом сортировки клеток на основе флуоресцентного сигнала (FACS).
[0007] В некоторых вариантах осуществления у антител или их антигенсвязывающих фрагментов существенно снижена эффекторная функция. В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты не опосредуют ADCC или CDC или оба эти процесса.
[0008] В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, предложенные в настоящем документе, содержат последовательности CDR тяжелой цепи, выбранные из группы, состоящей из: SEQ ID NO:1, 3, 5, 13, 15, 17, 25, 27, 29, 37, 39 и 41.
[0009] В одном аспекте антитела или их антигенсвязывающие фрагменты, предложенные в настоящем документе, содержат последовательности CDR легкой цепи, выбранные из группы, состоящей из: SEQ ID NO:7, 9, 11, 19, 21, 23, 31, 33 и 35.
[0010] В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, предложенные в настоящем документе, содержат по меньшей мере одну, две, три, четыре, пять или шесть CDR, выбранных из группы, состоящей из: SEQ ID NO:1, 3, 5, 7, 9, и 11; или выбранных из группы, состоящей из: SEQ ID NO:13, 15, 17, 19, 21 и 23; или выбранных из группы, состоящей из: SEQ ID NO:25, 27, 29, 31, 33 и 35; или выбранных из группы, состоящей из: SEQ ID NO:37, 39, 41, 19, 21 и 23.
[0011] В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, представленные в настоящем документе, содержат вариабельную область тяжелой цепи, выбранную из группы, состоящей из:
a) вариабельной области тяжелой цепи, содержащей SEQ ID NO:1, SEQ ID NO:3 и/или SEQ ID NO:5;
b) вариабельной области тяжелой цепи, содержащей SEQ ID NO:13, SEQ ID NO:15 и/или SEQ ID NO:17;
c) вариабельной области тяжелой цепи, содержащей SEQ ID NO:25, SEQ ID NO:27 и/или SEQ ID NO:29; и
d) вариабельной области тяжелой цепи, содержащей SEQ ID NO:37, SEQ ID NO:39 и/или SEQ ID NO:41.
[0012] В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, представленные в настоящем документе, содержат вариабельную область легкой цепи, выбранную из группы, состоящей из:
a) вариабельной области легкой цепи, содержащей SEQ ID NO:7, SEQ ID NO:9 и/или SEQ ID NO:11;
b) вариабельной области легкой цепи, содержащей SEQ ID NO:19, SEQ ID NO:21 и/или SEQ ID NO:23; и
c) вариабельной области легкой цепи, содержащей SEQ ID NO:31, SEQ ID NO:33 и/или SEQ ID NO:35.
[0013] В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, представленные в настоящем документе, содержат:
a) вариабельную область тяжелой цепи, содержащую SEQ ID NO:1, SEQ ID NO:3 и/или SEQ ID NO:5; и вариабельную область легкой цепи, содержащую SEQ ID NO:7, SEQ ID NO:9 и/или SEQ ID NO:11;
b) вариабельную область тяжелой цепи, содержащую SEQ ID NO:13, SEQ ID NO:15 и/или SEQ ID NO:17; и вариабельную область легкой цепи, содержащую SEQ ID NO:19, SEQ ID NO:21 и/или SEQ ID NO:23;
c) вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, SEQ ID NO:27 и/или SEQ ID NO:29; и вариабельную область легкой цепи, содержащую SEQ ID NO:31, SEQ ID NO:33 и/или SEQ ID NO:35; или
d) вариабельную область тяжелой цепи, содержащую SEQ ID NO:37, SEQ ID NO:39 и/или SEQ ID NO:41 и вариабельную область легкой цепи, содержащую SEQ ID NO:19, SEQ ID NO:21 и/или SEQ ID NO:23.
[0014] В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, представленные в настоящем документе, содержат вариабельную область тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:43, SEQ ID NO:47, SEQ ID NO:51 и SEQ ID NO:55.
[0015] В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, предложенные в настоящем документе, содержат вариабельную область легкой цепи, выбранную из группы, состоящей из: SEQ ID NO:45, SEQ ID NO:49 и SEQ ID NO:53.
[0016] В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, представленные в настоящем документе, содержат:
a) вариабельную область тяжелой цепи, содержащую SEQ ID NO:43; и вариабельную область легкой цепи, содержащую SEQ ID NO:45;
b) вариабельную область тяжелой цепи, содержащую SEQ ID NO:47; и вариабельную область легкой цепи, содержащую SEQ ID NO:49;
c) вариабельную область тяжелой цепи, содержащую SEQ ID NO:51; и вариабельную область легкой цепи, содержащую SEQ ID NO:53; или
d) вариабельную область тяжелой цепи, содержащую SEQ ID NO:55; и вариабельную область легкой цепи, содержащую SEQ ID NO:49.
[0017] В некоторых вариантах осуществления антитела, предложенные в настоящем документе, включают, например, 1.4.1, 1.14.4, 1.20.15 и 1.46.11.
[0018] В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, предложенные в настоящем документе, конкурируют за один и тот же эпитоп с антителами 1.4.1, 1.14.4, 1.20.15 и 1.46.11. В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, предложенные в настоящем документе, связываются с эпитопом, содержащим по меньшей мере один из следующих аминокислотных остатков PD-L1: E58, E60, D61, K62, N63 и R113.
[0019] В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты способны блокировать связывание PD-L1 человека с его рецептором и тем самым обеспечивать по меньшей мере одно из следующих действий:
a) индукцию продукции IL-2 в CD4+ T клетках;
b) индукцию продукции IFNγ в CD4+ T-клетках;
с) индукцию пролиферации CD4+ Т-клеток; и
d) восстановление супрессирующей функцию T reg.
[0020] В некоторых вариантах осуществления антитела, предложенные в настоящем документе, представляют собой моноклональное антитело, полное антитело человека, гуманизированное антитело, химерное антитело, рекомбинантное антитело, биспецифическое антитело, меченое антитело, бивалентное антитело или антиидиотипическое антитело.
[0021] В некоторых вариантах осуществления антигенсвязывающие фрагменты, предложенные в настоящем документе, представляют собой однодоменное антитело верблюда, диатело, scFv, димер scFv, BsFv, dsFv, (dsFv)2, dsFv-dsFv', фрагмент Fv, Fab, Fab', F(ab')2, ds-диатело, нанотело, доменное антитело или бивалентное доменное антитело.
[0022] В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, представленные в настоящем документе, дополнительно содержат константную область иммуноглобулина.
[0023] В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, представленные в настоящем документе, дополнительно содержат конъюгат.
[0024] В некоторых вариантах осуществления, конъюгат может быть детектируемой меткой, фармакокинетически модифицирующим фрагментом или фрагментом для очистки.
[0025] В другом аспекте настоящее изобретение относится к выделенным полинуклеотидам, кодирующим антитела или их антигенсвязывающие фрагменты, предложенные в настоящем документе. В некоторых вариантах осуществления предложены полинуклеотиды, которые кодируют аминокислотные последовательности антител или антигенсвязывающих фрагментов, описанных в настоящем документе. В некоторых других вариантах осуществления предложены векторы, которые содержат указанные полинуклеотиды, и в некоторых других вариантах осуществления предложены клетки-хозяева, которые содержат указанные векторы. В некоторых вариантах осуществления предложены способы экспрессии одного или нескольких антител или антигенсвязывающих фрагментов, описанных в настоящем документе, путем культивирования этих клеток-хозяев в условиях, при которых антитела или антигенсвязывающие фрагменты, кодируемые полинуклеотидами, экспрессируются из вектора. В некоторых вариантах осуществления полинуклеотиды, представленные в настоящем документе, функционально связаны с промотором, таким как промотор SV40, в векторе. В некоторых вариантах осуществления клетки-хозяева, содержащие указанные в настоящем документе векторы, представляют собой клетку яичника китайского хомяка или клетку 293F.
[0026] В другом аспекте в настоящем описании раскрыты наборы, содержащие антитело или его антигенсвязывающий фрагмент.
[0027] В другом аспекте представленные в настоящем документе антитела против PD-L1, такие как 1.4.1, 1.14.4, 1.20.15 и 1.46.11, обладают хорошей переносимостью и высокой in vivo противоопухолевой активностью у животного. В некоторых вариантах осуществления у животного с опухолевыми клетками, которому вводили предложенные в настоящем документе антитела против PD-L1, объем опухоли уменьшался по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 95% по сравнению с контрольным животным с подобным исходным объемом опухоли, но которому вводили только носитель.
[0028] В другом аспекте настоящее изобретение относится к способам определения наличия или уровня PD-L1 (например, человека или обезьяны) в биологическом образце, включающим воздействие на биологический образец антителом или его антигенсвязывающим фрагментом, предложенными в настоящем документе, и определение наличия или уровня PD-L1 в образце.
[0029] В другом аспекте настоящее изобретение относится к способам идентификации индивидуума с расстройством или состоянием, которое может отвечать на антагонист PD-L1, включающим: определение наличия или уровня PD-L1 (например, человека или обезьяны) в тестируемом биологическом образце индивидуума с помощью антитела или его антигенсвязывающего фрагмента, предложенными в настоящем документе, где присутствие или повышенный уровень PD-L1 в тестируемом биологическом образце указывает на вероятность ответа. В некоторых вариантах осуществления способы дополнительно включают введение эффективного количества антитела или его антигенсвязывающего фрагмента, предложенных в настоящем документе, индивидууму, который был идентифицирован как страдающий расстройством или состоянием, которое может отвечать на антагонист PD-L1.
[0030] Настоящее изобретение относится также к способам контроля терапевтического ответа или прогрессирования заболевания у индивидуума, получавшего лечение антагонистом PD-L1, включающим определение наличия или уровня PD-L1 (например, человека или обезьяны) в тестируемом биологическом образце индивидуума с помощью антитела против PD-L1 или его антигенсвязывающего фрагмента, предложенных в настоящем документе.
[0031] В другом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим антитело или его антигенсвязывающий фрагмент, предложенных в настоящем документе, и один или несколько фармацевтически приемлемых носителей. В некоторых из этих вариантов осуществления фармацевтические носители могут представлять собой, например, разбавители, антиоксиданты, адъюванты, эксципиенты или нетоксичные вспомогательные вещества.
[0032] В другом аспекте настоящее изобретение относится к способам лечения состояния у индивидуума, которому пойдет на пользу повышение иммунного ответа, включающим введение индивидууму эффективного количества антитела или его антигенсвязывающего фрагмента, предложенных в настоящем документе. В некоторых вариантах осуществления у индивидуума повышена экспрессия PD-L1.
[0033] В настоящем документе предложено применение антитела или его антигенсвязывающего фрагмента для получения лекарственного средства для лечения состояния, при котором пойдет на пользу повышение иммунного ответа. В некоторых вариантах осуществления таким заболеванием является злокачественное новообразование или хроническая вирусная инфекция.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0034] На фигуре 1 показано связывание полноразмерных антител человека против PD-L1 с клетками CHO, экспрессирующими PD-1, как определено с помощью анализа FACS.
[0035] На фигуре 2 представлены полные антитела человека против PD-L1, блокирующие связывание PD-1 с клетками CHO, трансфицированными PD-L1, как измерено с помощью анализа FACS.
[0036] На фигуре 3 показано, что полные антитела человека против PD-L1 специфически связываются с PD-L1, но не связываются с PD-L2, как измерено с помощью анализа FACS.
[0037] На фигуре 4 показано, что полные антитела человека против PD-L1 связываются с PD-L1 человека и яванского макака.
[0038] На фигуре 5 показана полная кинетика аффинности связывания антител против PD-L1 с PD-L1 человека в диапазоне от 2,26E-10 до 4,78E-10 моль/л, как определено с помощью поверхностного плазмонного резонанса.
[0039] На фигуре 6 проиллюстрировано влияние полных антител человека против PD-L1 на продукцию IFNγ при специфическом Т-клеточном ответе.
[0040] На фигуре 7 показано, что полные антитела человека против PD-L1 усиливают специфическую пролиферацию Т-клеток.
[0041] На фигуре 8 показано, что полные антитела человека против PD-L1 усиливают продукцию IFNγ в смешанной реакции лимфоцитов (MLR).
[0042] На фигуре 9 проиллюстрировано влияние полного антитела человека против PD-L1 на продукцию IL-2 в MLR.
[0043] На фигуре 10 показано, что антитела против PD-L1 способствуют пролиферации Т-клеток в MLR.
[0044] На фигуре 11 показано, что антитела против PD-L1 восстанавливают супрессорную функцию T reg.
[0045] На фигуре 12 показаны антитела против PD-L1 без ADCC в отношении активированных Т-клеток.
[0046] На фигуре 13 показаны антитела против PD-L1 без CDC в отношении активированных Т-клеток.
[0047] На фигурах 14А и 14В показана перекрестная реактивность антител против PD-L1 и PD-1 человека/мыши. В течение ночи на 96-луночный планшет наносили 2 мкг/мл антитела 1.14.4 и инкубировали с белком hPD-L1-His (фиг. 14А) и с белком mPD-L1-His (фиг.14В), затем для детекции добавляли HRP-анти-His антитело.
[0048] На фигуре 15 показаны остатки горячих точек, нанесенные на карте структуры hPD-L1. Связывающий сайт антитела 1.14.4. Данные взяты из таблицы 3. Цвета на фигурах помогают провести различие между эпитопами.
[0049] На фигуре 16 показана хорошая in vivo переносимость hPD-L1-антитела 1.14.4. Три дозы антитела 1.14.4 (3 мг/кг, 10 мг/кг и 30 мг/кг) вводили с помощью нескольких внутрибрюшных инъекций гуманизированной мыши B-hPD-1. Во время эксперимента достоверное изменение массы тела не отмечалось.
[0050] На фигуре 17 показано значительное in vivo ингибирование роста опухолевых клеток антителами против hPD-L1 1.14.4. Через 19 дней введения антител все три дозы антитела 1.14.4 (3 мг/кг, 10 мг/кг и 30 мг/кг) показали значительные противоопухолевые эффекты, что указывает на ингибирование опухолевого роста (TGI) >40%.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0051] Следующее далее описание изобретения предназначено просто для иллюстрации различных вариантов осуществления изобретения. Таким образом, обсуждаемые конкретные модификации не должны рассматриваться как ограничения объема изобретения. Специалисту в данной области техники будет очевидно, что могут быть сделаны различные эквивалентные варианты, изменения и модификации, не выходя за рамки изобретения, и понятно, что такие эквивалентные варианты осуществления должны быть включены в настоящий документ. Все приведенные в настоящем документе ссылки, включая публикации, патенты и патентные заявки, включены в настоящее описание посредством ссылки во всей их полноте.
[0052] Определения
[0053] Используемый в настоящем документе термин «антитело» включает любой иммуноглобулин, моноклональное антитело, поликлональное антитело, мультиспецифическое антитело или биспецифическое (двухвалентное) антитело, которое связывается со специфическим антигеном. Нативное интактное антитело содержит две тяжелые цепи и две легкие цепи. Каждая тяжелая цепь состоит из вариабельной области и первой, второй и третьей константных областей, а каждая легкая цепь состоит из вариабельной области и константной области. Тяжелые цепи млекопитающих классифицируют как α, δ, ε, γ и μ, и легкие цепи млекопитающих классифицируют как λ или κ. Антитело имеет форму «Y» со стволом Y, состоящим из второй и третьей константных областей двух тяжелых цепей, соединенных вместе посредством дисульфидного связывания. Каждое плечо Y включает вариабельную область и первую константную область одной тяжелой цепи, связанные с вариабельной и константными областями одной легкой цепи. Вариабельные области легкой и тяжелой цепей отвечают за связывание антигена. Вариабельная область обеих цепей обычно содержит три высоко вариабельные петли, называемые областями, определяющими комплементарность (CDR) (CDR легкой цепи (L), включая LCDR1, LCDR2 и LCDR3, CDR тяжелой цепи (H), включая HCDR1, HCDR2, HCDR3). Границы CDR для антител и антигенсвязывающих фрагментов, описанных в настоящем документе, могут быть определены или идентифицированы по методу Кабат, Чотия или Аль-Лазикани (Al-Lazikani, B., Chothia, C., Lesk, A. M., J. Mol. Biol., 273(4), 927 (1997); Chothia, C. et al., J Mol Biol. Dec 5; 186(3):651-63 (1985); Chothia, C. and Lesk, A.M., J. Mol. Biol., 196,901 (1987); Chothia, C. et al., Nature. Dec 21-28;342(6252):877-83 (1989); Kabat E.A. et al., National Institutes of Health, Bethesda, Md. (1991)). Три CDR расположены между фланкирующими участками, известными как каркасные области (FR), которые являются более высококонсервативными, чем CDR, и образуют остов для поддержания гипервариабельных петель. Константные области тяжелых и легких цепей не участвуют в связывании с антигеном, но проявляют различные эффекторные функции. Антитела разделяют на классы на основании аминокислотной последовательности константной области их тяжелой цепи. Пять основных классов или изотипов антител представляют собой IgA, IgD, IgE, IgG и IgM, которые характеризуются присутствием тяжелых цепей α, δ, ε, γ и μ, соответственно. Некоторые из основных классов антител разделяют на подклассы, такие как IgG1 (тяжелая цепь γ1), IgG2 (тяжелая цепь γ2), IgG3 (тяжелая цепь γ3), IgG4 (тяжелая цепь γ4), IgA1 (тяжелая цепь α1) или IgA2 (тяжелая цепь α2).
[0054] Используемый в настоящем документе термин «антигенсвязывающий фрагмент» относится к фрагменту антитела, образованному частью антитела, содержащей один или несколько CDR, или любым другим фрагментом антитела, который связывается с антигеном, но не содержит интактную нативную структуру антитела. Примеры антигенсвязывающего фрагмента включают, но ими не ограничиваются, диатело, Fab, Fab', F(ab')2, фрагмент Fv, стабилизированный дисульфидом фрагмент Fv (dsFv), (dsFv)2, биспецифический dsFv (dsFv-dsFv'), стабилизированное дисульфидом диатело (ds диатело), молекулу одноцепочечного антитела (scFv), димер scFv (двухвалентное диатело), мультиспецифическое антитело, верблюжье однодоменное антитело и бивалентное доменное антитело. Антигенсвязывающий фрагмент способен связываться с тем же антигеном, с которым связывается родительское антитело. В некоторых вариантах осуществления антигенсвязывающий фрагмент может содержать одну или несколько CDR конкретного антитела человека, привитого к каркасной области одного или нескольких разных антител человека.
[0055] «Fab» в контексте антитела относится к той части антитела, которая состоит из одной легкой цепи (как вариабельной, так и константной областей), соединенной с вариабельной областью и первой константной областью одной тяжелой цепи дисульфидной связью.
[0056] «Fab» относится к фрагменту Fab, который включает часть шарнирной области.
[0057] «F(ab')2» относится к димеру Fab'.
[0058] «Fc» в контексте антитела относится к той части антитела, которая состоит из второй и третьей константных областей первой тяжелой цепи, соединенной со второй и третьей константными областями второй тяжелой цепи посредством дисульфидного связывания. Часть Fc антитела отвечает за различные эффекторные функции, такие как ADCC и CDC, но не участвует в связывании антигена.
[0059] «Fv» в контексте антитела относится к минимальному фрагменту антитела и несет полный антигенсвязывающий сайт. Fv-фрагмент состоит из вариабельной области одной легкой цепи, связанной с вариабельной областью одной тяжелой цепи.
[0060] «Одноцепочечное антитело Fv» или «scFv» относится к сконструированному антителу, состоящему из вариабельной области легкой цепи и вариабельной области тяжелой цепи, связанных друг с другом непосредственно или через пептидную линкерную последовательность (Huston JS et al., Proc Natl Acad Sci USA, 85: 5879 (1988)).
[0061] «Одноцепочечное антитело Fv-Fc» или «scFv-Fc» относится к сконструированному антителу, состоящему из scFv, присоединенного к Fc-области антитела.
[0062] «Однодоменное антитело верблюда», «антитело, состоящее только из тяжелых цепей» или «HCAb» относится к антителу, которое содержит два домена VH и не содержит легких цепей (Riechmann L. and Muyldermans S., J Immunol Methods. Dec 10;231(1-2):25-38 (1999); Muyldermans S., J Biotechnol. Jun;74(4):277-302 (2001); WO94/04678; WO94/25591; патент США № 6005079). Антитела с тяжелыми цепями первоначально были получены у Camelidae (верблюды, дромадеры и ламы). Несмотря на то, что верблюжьи антитела лишены легких цепей, они имеют аутентичный антигенсвязывающий набор (Hamers-Casterman C. et al., Nature. Jun 3;363(6428):446-8 (1993); Nguyen VK. et al., «Heavy-chain antibodies in Camelidae; a case of evolutionary innovation», Immunogenetics. Apr;54(1):39-47 (2002); Nguyen VK. et al., Immunology. May;109(1):93-101 (2003)). Вариабельный домен антитела, состоящего только из тяжелых цепей (домен VHH) представляет собой минимальную известную антигенсвязывающую единицу, индуцирующую адаптивные иммунные ответы (Koch-Nolte F. et al., FASEB J. Nov;21(13):3490-8. Epub 2007 Jun 15 (2007)).
[0063] «Нанотело» относится к фрагменту антитела, который состоит из домена VHH антитела, состоящего только из тяжелых цепей и двух константных доменов, CH2 и CH3.
[0064] «Диатела» включают в себя небольшие фрагменты антител с двумя антигенсвязывающими участками, где фрагменты содержат домен VH, соединенный с доменом VL в той же полипептидной цепи (VH-VL или VH-VL) (см., например, Holliger P. et al., Proc Natl Acad Sci U S A. Jul 15;90(14):6444-8 (1993); EP404097; WO93/11161). Используя линкер, который является слишком коротким, чтобы обеспечить спаривание двух доменов в одной и той же цепи, домены вынуждены связываться с комплементарными доменами другой цепи, тем самым создавая два антигенсвязывающих сайта. Антигенсвязывающие сайты могут быть нацелены на одинаковые или различные антигены (или эпитопы).
[0065] «Доменное антитело» относится к фрагменту антитела, содержащему только вариабельную область тяжелой цепи или вариабельную область легкой цепи. В некоторых случаях два или более доменов VH ковалентно соединяются пептидным линкером с образованием бивалентного или мультивалентного доменного антитела. Два домена VH бивалентного доменного антитела могут нацеливаться на одни и те же или разные антигены.
[0066] В некоторых вариантах осуществления «(dsFv)2» содержит три пептидные цепи: два фрагмента VH, соединенные пептидным линкером и связанные дисульфидными мостиками с двумя фрагментами VL.
[0067] В некоторых вариантах осуществления «биспецифическое ds антитело» содержит VH1-VL2 (соединенные пептидным линкером), связанный с VL1-VH2 (также соединены пептидным линкером) посредством дисульфидного мостика между VH1 и VL1.
[0068] В некоторых вариантах осуществления «биспецифический ds Fv» или «dsFv-dsFv'» содержит три пептидные цепи: фрагмент VH1-VH2, где тяжелые цепи соединены пептидным линкером (например, длинный гибкий линкер) и связаны с фрагментами VL1 и VL2, соответственно, через дисульфидные мостики, где каждая спаренная дисульфидной связью тяжелая и легкая цепь имеет различную антигенную специфичность.
[0069] В некоторых вариантах осуществления «димер scFv» представляет собой бивалентное диатело или бивалентный ScFv (BsFv), содержащий VH-VL (соединенные пептидным линкером), димеризованный с другим фрагментом VH-VL, так что VH одного фрагмента координирована с VL другого фрагмента, и они образуют два сайта связывания, которые могут нацеливаться на одни и те же антигены (или эпитопы) или на разные антигены (или эпитопы). В других вариантах осуществления «димер scFv» представляет собой биспецифическое диатело, содержащее VH1-VL2 (соединенные пептидным линкером), связанные с VL1-VH2 (также соединенные пептидным линкером), так что VH1 и VL1 координированы, и VH2 и VL2 координированы, и каждая координированная пара имеет различную антигенную специфичность.
[0070] Используемый в настоящем документе термин «полное человеческое» применительно к антителу или антигенсвязывающему фрагменту означает, что антитело или антигенсвязывающий фрагмент имеют или состоят из аминокислотной(ых) последовательности(ей), соответствующей(их) антителу, продуцируемому человеком или иммунной клеткой человека, или получены не у человека, а из источника, такого как трансгенное животное, не относящееся к человеку, которое использует репертуары антител человека или другие последовательности, кодирующие антитела человека. В некоторых вариантах осуществления полное антитело человека не содержит аминокислотных остатков (в частности, антигенсвязывающих остатков), полученных из антитела, не являющегося человеческим.
[0071] Используемый в настоящем документе термин «гуманизированный» применительно к антителу или антигенсвязывающему фрагменту означает, что антитело или антигенсвязывающий фрагмент содержат CDR, полученные у животных, не относящихся к человеку, области FR, полученные у человека, и, если возможно, константные области, полученных у человека. В некоторых вариантах осуществления гуманизированное антитело или антигенсвязывающий фрагмент могут быть использованы в качестве средств для терапии человека, поскольку они снижают иммуногенность у человека. В некоторых вариантах осуществления животное, не относящееся к человеку, представляет собой млекопитающее, например, мышь, крысу, кролика, козу, овцу, морскую свинку или хомяка. В некоторых вариантах осуществления гуманизированное антитело или антигенсвязывающий фрагмент состоят по существу из всех человеческих последовательностей, за исключением последовательностей CDR, которые являются нечеловеческими. В некоторых вариантах осуществления области FR, полученные из человека, могут содержать такую же аминокислотную последовательность, что и человеческое антитело, из которого они получены, или они может содержать некоторые аминокислотные изменения, например, не более 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 изменений аминокислоты. В некоторых вариантах осуществления такое изменение в аминокислоте может присутствовать только в областях FR тяжелой цепи, только в областях FR легкой цепи или в обеих цепях. В некоторых предпочтительных вариантах осуществления гуманизированные антитела включают FR1-3 человека и JH и Jκ человека.
[0072] Используемый в настоящем документе термин «химерный» означает антитело или антигенсвязывающий фрагмент, имеющие часть тяжелой и/или легкой цепи, полученную от одного вида, и остальную часть тяжелой и/или легкой цепи, полученную от другого вида. В иллюстративном примере химерное антитело может содержать константную область, полученную у человека, и вариабельную область от других видов, например, мыши.
[0073] Используемый в настоящем документе термин «PD-L1» относится к лиганду белка 1 запрограммированной смерти клеток (PD-L1, смотри, например, Freeman et al., (2000) J. Exp. Med. 192:1027). Характерная аминокислотная последовательность PD-L1 человека раскрыта под номером доступа NCBI: NP_054862.1, и характерная последовательность нуклеиновой кислоты, кодирующая PD-L1 человека, показана под номером доступа NCBI: NM_014143.3. PD-L1 экспрессируется в плаценте, селезенке, лимфатических узлах, тимусе, сердце, печени плода, а также встречается во многих опухолевых или злокачественных клетках. PD-L1 связывается с своим рецептором PD-1 или B7-1, который экспрессируется на активированных Т-клетках, В-клетках и миелоидных клетках. Связывание PD-L1 и его рецептора вызывает передачу сигнала и подавляет TCR-опосредованную активацию продукции цитокинов и пролиферацию Т-клеток. Соответственно, PD-L1 играет важную роль в подавлении иммунной системы во время определенных событий, таких как беременность, аутоиммунные заболевания, тканевые аллотрансплантаты, и, как полагают, дает возможность опухолевым или злокачественным клеткам обходить иммунологическую контрольную точку и уклоняться от иммунного ответа.
[0074] «Антитело против PD-L1», как используется в настоящем документе, относится к антителу, которое способно специфически связываться с PD-L1 (например, PD-L1 человека или обезьяны) с аффинностью, которая достаточна для диагностического и/или терапевтического применения.
[0075] Используемый в настоящем документе термин «специфическое связывание» или «специфически связывается» относится к реакции неслучайного связывания между двумя молекулами, такими как, например, между антителом и антигеном. В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты, представленные в настоящем документе, специфически связываются с PD-L1 человека и/или обезьяны с аффинностью связывания (KD), равной ≤10-6 M (например, ≤5×10-7 M, ≤2×10-7 M, ≤10-7 M, ≤5×10-8 M, ≤2×10-8 M, ≤10-8 M, ≤5×10-9 M, ≤2×10-9 M, ≤10-9 M, около 10-10 M, от 10-10 M до 10-9 M, от 10-10 M до 10-8,5 M, или от 10-10 M до 10-8 M). Как используется в настоящем документе, КD относится к отношению скорости диссоциации к скорости ассоциации (koff/kon), может быть определено с использованием методов поверхностного плазмонного резонанса, например, с использованием такого инструмента, как Biacore.
[0076] Способность «блокировать связывание» или «конкурировать за один и тот же эпитоп», как используется в настоящем документе, относится к способности антитела или антигенсвязывающего фрагмента ингибировать связывание двух молекул (например, PD-L1 человека и антитело против PD-L1) до любой обнаруживаемой степени. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, которые блокируют связывание двух молекул, ингибирует связывание двух молекул по меньшей мере на 50%. В некоторых вариантах осуществления это ингибирование может составлять более 60%, более 70%, более 80% или более 90%.
[0077] Как используется в настоящем документе, термин «эпитоп» относится к специфической группе атомов или аминокислот на антигене, с которым связывается антитело. Два антитела могут связываться с одним и тем же эпитопом в пределах антигена, если они демонстрируют конкурентное связывание в отношение антигена. Например, если описанное в настоящем документе антитело или антигенсвязывающий фрагмент блокируют связывание антител, таких как, например, 1.4.1, 1.14.4, 1.20.15 и 1.46.11, с PD-L1 человека, то антитело или антигенсвязывающий фрагмент можно считать связывающимися с тем же эпитопом, что и антитела, приведенные в качестве примера.
[0078] Конкретный аминокислотный остаток в эпитопе может быть мутирован, например, путем сканирующего аланином мутагенеза, и могут быть идентифицированы мутации, которые снижают или предотвращают связывание белка. «Сканирующий аланином мутагенез» представляет собой метод, который может быть осуществлен для идентификации определенных остатков или областей белка, влияющих на взаимодействие эпитопа с другим соединением или белком, который с ним связывается. Остаток или группа мишеневых остатков в белке заменяют на нейтральную или отрицательно заряженную аминокислоту (наиболее предпочтительно, на аланин или полиаланин, или консервативная аминокислотная замена). Любая мутация аминокислотных остатков или их кодирующих кодонов, которая снижает связывание белка ниже порогового или снижает связывание белка с максимальной степенью относительно других мутаций, вероятно, находится в эпитопе, с которым связывается белок. В некоторых вариантах осуществления настоящего изобретения эпитоп, который является критическим для антитела PD-L1, содержит по меньшей мере один из аминокислотных остатков E58, E60, D61, K62, N63 и R113.
[0079] «1.4.1», как используется в настоящем документе, относится к полному моноклональному антителу человека с вариабельной областью тяжелой цепи SEQ ID NO:43, вариабельной областью легкой цепи SEQ ID NO:45 и константной областью изотипа IgG4 человека.
[0080] «1.4.4», как используется в настоящем документе, относится к полному моноклональному антителу человека с вариабельной областью тяжелой цепи SEQ ID NO:47, вариабельной областью легкой цепи SEQ ID NO:49 и константной областью изотипа IgG4 человека.
[0081] «1.20.15», как используется в настоящем документе, относится к полному моноклональному антителу человека с вариабельной областью тяжелой цепи SEQ ID NO:51, вариабельной областью легкой цепи SEQ ID NO:53 и константной областью изотипа IgG4 человека.
[0082] «1.46.11», как используется в настоящем документе, относится к полному моноклональному антителу человека с вариабельной областью тяжелой цепи SEQ ID NO:55, вариабельной областью легкой цепи SEQ ID NO:49 и константной областью изотипа IgG4 человека.
[0083] «Консервативная замена» применительно к аминокислотной последовательности относится к замене аминокислотного остатка другим аминокислотным остатком с боковой цепью с аналогичными физико-химическими свойствами. Например, консервативные замены могут быть сделаны среди аминокислотных остатков с гидрофобными боковыми цепями (например, Met, Ala, Val, Leu и Ile), среди остатков с нейтральными гидрофильными боковыми цепями (например, Cys, Ser, Thr, Asn и Gln), среди остатков с кислотными боковыми цепями (например, Asp, Glu), среди аминокислот с основными боковыми цепями (например, His, Lys и Arg) или среди остатков с ароматическими боковыми цепями (например, Trp, Tyr и Phe). Как известно в данной области, консервативная замена обычно не вызывает значительного изменения конформационной структуры белка и, следовательно, может сохранять биологическую активность белка.
[0084] «Процентная (%) идентичность по последовательности» в отношении к аминокислотной последовательности (или последовательности нуклеиновых кислот) определяется как процент остатков аминокислот (или нуклеиновых кислот) в кандидатной последовательности, которые идентичны остаткам аминокислот (или нуклеиновых кислот) в контрольной последовательности после выравнивания последовательностей и, при необходимости, введения пропусков, для достижения максимального числа идентичных аминокислот (или нуклеиновых кислот). Консервативная замена аминокислотных остатков может быть или может не быть рассмотрена в качестве идентичных остатков. Выравнивание для определения процентной идентичности последовательностей аминокислот (или нуклеиновых кислот) может быть достигнуто, например, с помощью общедоступных инструментов, таких как BLASTN, BLASTp (доступно на веб-сайте U.S. National Center for Biotechnology Information (NCBI), смотри также, Altschul S.F. et al., J. Mol. Biol., 215:403-410 (1990); Stephen F. et al, Nucleic Acids Res., 25:3389-3402 (1997)), ClustalW2 (доступен на веб-сайте European Bioinformatics Institute, см. также, Higgins D.G. et al, Methods in Enzymology, 266:383-402 (1996); Larkin M.A. et al, Bioinformatics (Oxford, England), 23(21): 2947-8 (2007)), или с помощью программного обеспечения ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут использовать параметры по умолчанию, предлагаемые инструментом, или могут настраивать параметры, подходящие для выравнивания, например, путем выбора подходящего алгоритма.
[0085] «Т-клетка», как используется в настоящем документе, включает CD4+ Т-клетки, CD8+ Т-клетки, Т-клетки Т-хелпера 1 типа, Т-клетки Т-хелпера 2 типа, Т-клетки Т-хелпера 17 типа и ингибирующие Т-клетки.
[0086] Как используется в настоящем документе, «эффекторные функции» относятся к биологической активности, присущей связыванию Fc-области антитела с его эффекторами, такими как комплекс C1 и Fc-рецептор. Примеры эффекторных функций включают: комплемент-зависимую цитотоксичность (CDC), индуцированную взаимодействием антител и C1q на комплексе C1; антитело-зависимую клеточную цитотоксичность (ADCC), индуцированную связыванием Fc-области антитела с Fc-рецептором на эффекторной клетке; и фагоцитоз.
[0087] «Злокачественное новообразование» или «раковое состояние», как используется в настоящем документе, относится к медицинскому состоянию, опосредованному ростом опухолевых или злокачественных клеток, пролиферации или метастазированием, и включает как солидные злокачественные образования, так и несолидные злокачественные образования, такие как лейкоз. «Опухоль», как используется в настоящем документе, относится к солидной массе неопластических и/или злокачественных клеток.
[0088] «Лечение» или «терапия» состояния, как используется в настоящем документе, включают в себя предотвращение или облегчение состояния, замедление начала или скорости развития состояния, снижение риска развития состояния, предотвращение или задержку развития симптомов, связанных с состоянием, уменьшение или прекращение симптомов, связанных с состоянием, получение полной или частичной регрессии состояния, лечение состояния или некоторые их комбинации. Что касается злокачественного новообразования, то «лечение» или «терапия» могут относиться к ингибированию или замедлению роста опухоли или злокачественных клеток, пролиферации или метастазирования, предотвращению или замедлению развития роста опухолевых или злокачественных клеток, пролиферации или метастазирования, или к некоторым их комбинациям. Что касается опухоли, то «лечение» или «терапия» включают избавление от всей или части опухоли, ингибирование или замедление роста опухоли и метастазирования, предотвращение или замедление развития опухоли, или некоторую их комбинацию.
[0089] «Выделенное» вещество изменено человеком по сравнению с его природным состоянием. Если в природе присутствует «выделенные» композиция или вещество, они была изменены или выделены из исходной среды, или то и другое. Например, полинуклеотид или полипептид, находящиеся в живом животном в природном состоянии, не являются «выделенными», но тот же полинуклеотид или полипептид является «выделенным», если он был в достаточной степени отделен от окружающих его веществ в природном состоянии и тем самым находится в практически в чистом состоянии. В некоторых вариантах осуществления антитела и антигенсвязывающие фрагменты имеют чистоту по меньшей мере 90%, 93%, 95%, 96%, 97%, 98%, 99%, как определено электрофоретическими методами (такими как SDS-PAGE, изоэлектрическая фокусировка, капиллярный электрофорез) или хроматографическими методами (такими как ионообменная хроматография или ВЭЖХ с обращенной фазой).
[0090] Используемый в настоящем документе термин «вектор» относится к носителю, в который может быть функционально встроен полинуклеотид, кодирующий белок, что обуславливает экспрессию этого белка. Вектор может быть использован для трансформации, трансдукции или трансфекции клетки-хозяина и тем самым вызывать экспрессию генетического элемента, который он несет в клетке-хозяине. Примеры векторов включают в себя плазмиды, фагемиды, космиды, искусственные хромосомы, такие как дрожжевая искусственная хромосома (YAC), бактериальную искусственную хромосому (BAC) или искусственную хромосому, полученную под действием Р1 (PAC), бактериофаги, такие как фаг лямбда или M13-фаг, и вирусы животных. Категории вирусов животных, используемых в качестве векторов, включают ретровирус (включая лентивирус), аденовирус, аденоассоциированный вирус, вирус герпеса (например, вирус простого герпеса), поксвирус, бакуловирус, папилломавирус и паповавирус (например, SV40). Вектор может содержать множество элементов для контроля за экспрессией, включая промоторные последовательности, последовательности инициации транскрипции, энхансерные последовательности, селектируемые элементы и репортерные гены. Кроме того, вектор может содержать точку начала репликации. Вектор может также включать в себя вещества, способствующие его проникновению в клетку, включая, но не ограничиваясь ими, вирусную частицу, липосому или белковое покрытие.
[0091] Используемая в настоящем документе фраза «клетка-хозяин» относится к клетке, в которую введен экзогенный полинуклеотид и/или вектор.
[0092] «Заболевание, вызванное или связанное с PD-L1», как используется в настоящем документе, относится к состоянию, которое вызвано, усугубляется или иным образом связано с повышением или снижением экспрессии или активности PD-L1 (например, PD-L1 человека).
[0093] Термин «терапевтически эффективное количество» или «эффективная доза», как используется в настоящем документе, относится к дозе или концентрации лекарственного средства, эффективной для лечения заболевания или состояния, связанного с PD-L1 человека. Например, в отношении применения антител или антигенсвязывающих фрагментов, описанных в настоящем документе, для лечения злокачественного новообразования терапевтически эффективное количество представляет собой дозу или концентрацию антитела или антигенсвязывающего фрагмента, способную устранять всю опухоль или ее часть, ингибируя или замедляя рост опухоли, ингибируя рост или пролиферацию клеток, опосредующих злокачественное состояние, ингибируя метастазирование опухолевых клеток, улучая симптом или маркер, связанный с опухолью или злокачественным состоянием, предотвращая или замедляя развитие опухоли или злокачественного состояния или некоторую их комбинацию.
[0094] Термин «фармацевтически приемлемый» означает, что указанный носитель, переносчик, разбавитель, эксципиент(ы) и/или соль обычно химически и/или физически совместимы с другими ингредиентами, входящими в состав, и физиологически совместимы с реципиентом состава.
[0095] Антитело против PD-L1
[0096] В одном аспекте настоящее изобретение относится к антителу против PD-L1 и его антигенсвязывающим фрагментам. PD-1, также называемый CD279, известен как основной рецептор иммунной контрольной точки, экспрессируемый активированными Т-клетками, которые опосредуют иммуносупрессию. Лиганд 1 PD-1 (PD-L1) представляет собой трансмембранный белок 40 кДа, экспрессируемый в различных опухолевых клетках, стромальных клетках или в обоих этих типах клеток, и связывается с PD-1. Ингибирование взаимодействия между PD-1 и PD-L1 может усилить ответные реакции Т-клеток и, таким образом, опосредует противораковую активность.
[0097] В некоторых вариантах осуществления в настоящем описании приведены примеры полных моноклональных антител человека 1.4.1, 1.14.4, 1.20.15 и 1.46.11, последовательности CDR которых показаны в таблице ниже, и последовательности вариабельной области тяжелой или легкой цепи также показаны ниже.
[0098] Таблица 1
[0099] 1.4.1-VH(30511): (SEQ ID NO:43 для аминокислоты и SEQ ID NO:44 для нуклеиновой кислоты) с CDR тяжелой цепи 1-3: SEQ ID NO:1, 3, 5 представляют собой аминокислотные последовательности, и SEQ ID NO:2, 4, 6 представляют собой последовательности нуклеиновых кислот, соответственно:
V сегмент: IGHV4-39*01
D сегмент: IGHD1-26*01
J сегмент: IGHJ4*02
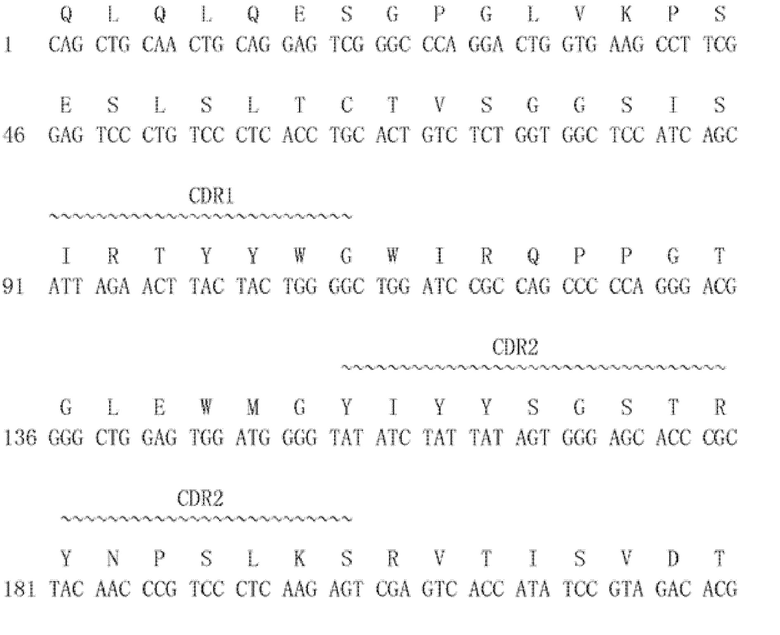

[0100] 1.4.1-VL(30027): (SEQ ID NO:45 для аминокислоты и SEQ ID NO:46 для нуклеиновой кислоты) с CDR 1-3 легкой цепи: SEQ ID NO:7, 9, 11 представляют собой аминокислотные последовательности, и SEQ ID NO:8, 10, 12 представляют собой последовательности нуклеиновых кислот, соответственно:
V сегмент: IGLV3-1*01
J сегмент: IGLJ2*01


[0101] 1.14.4-VH(29812): (SEQ ID NO:47 для аминокислоты и SEQ ID NO:48 для нуклеиновой кислоты) с CDR 1-3 тяжелой цепи: SEQ ID NO:13, 15, 17 представляют собой аминокислотные последовательности, и SEQ ID NO:14, 16, 18 представляют собой последовательности нуклеиновых кислот, соответственно:
V сегмент: IGHV3-23*01
D сегмент: IGHD5-5*01
J сегмент: IGHJ4*02
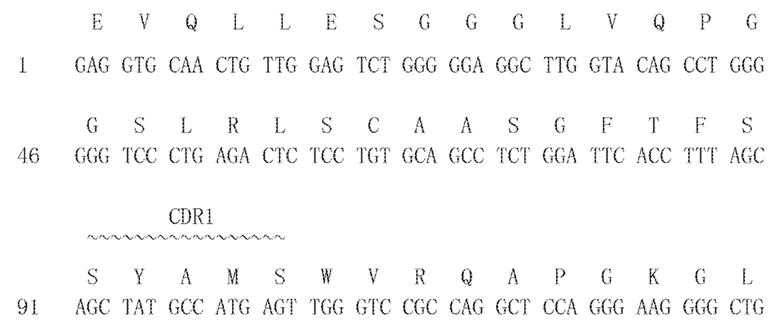

[0102] 1.14.4-VL и 1.46.11-VL (29841): (SEQ ID NO:49 для аминокислоты и SEQ ID NO:50 для нуклеиновой кислоты) с CDR 1-3 легкой цепи: SEQ ID NO:19, 21, 23 представляют собой аминокислотные последовательности, и SEQ ID NO:20, 22, 24 представляют собой последовательности нуклеиновых кислот, соответственно:
V сегмент: IGLV3-21*02
J сегмент: IGLJ2*01

[0103] 1.20.15-VH(30712): (SEQ ID NO:51 для аминокислоты и SEQ ID NO:52 для нуклеиновой кислоты) с CDR тяжелой цепи 1-3: SEQ ID NO:25, 27, 29 представляют собой аминокислотные последовательности, и SEQ ID NO:26, 28, 30 представляют собой последовательности нуклеиновых кислот, соответственно:
V сегмент: IGHV4-39*01
D сегмент: не определен
J сегмент: IGHJ4*02

[00104] 1.20.15-VL(29907): (SEQ ID NO:53 для аминокислоты и SEQ ID NO:54 для нуклеиновой кислоты) с CDR 1-3 легкой цепи: SEQ ID NO:31, 33, 35 представляют собой аминокислотные последовательности, и SEQ ID NO:32, 34, 36 представляют собой последовательности нуклеиновых кислот, соответственно:
V сегмент: IGLV3-1*01
J сегмент: IGLJ2*01
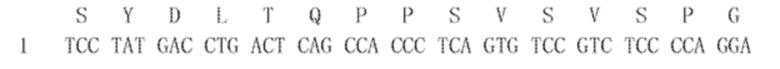

[00105] 1.46.11-VH(30626): (SEQ ID NO:55 для аминокислоты и SEQ ID NO:56 для нуклеиновой кислоты) с CDR тяжелой цепи 1-3: SEQ ID NO:37, 39, 41 представляют собой аминокислотные последовательности, и SEQ ID NO:38, 40, 42 представляют собой последовательности нуклеиновых кислот, соответственно:
V сегмент: IGHV3-23*01
D сегмент: IGHD5-5*01
J сегмент: IGHJ4*02

[00106] 1.46.11-VL(29841):(SEQ ID NO:49 для аминокислоты и SEQ ID NO:50 для нуклеиновой кислоты) с CDR 1-3 легкой цепи: SEQ ID NO:19, 21, 23 представляют собой аминокислотные последовательности, и SEQ ID NO:20, 22, 24 представляют собой последовательности нуклеиновых кислот, соответственно:
V сегмент: IGLV3-21*02
J сегмент: IGLJ2*01

[00107] В некоторых вариантах осуществления антитела против PD-L1 и их антигенсвязывающие фрагменты содержат последовательности CDR тяжелой цепи, выбранные из группы, состоящей из SEQ ID NO:1, 3, 5, 13, 15, 17, 25, 27, 29, 37, 39 и 41. В некоторых вариантах осуществления антитела против PD-L1 и их антигенсвязывающие фрагменты содержат последовательности CDR легкой цепи, выбранные из группы, состоящей из SEQ ID NO:7, 9, 11, 19, 21, 23, 31, 33 и 35.
[00108] В некоторых вариантах осуществления антитела против PD-L1 и их антигенсвязывающие фрагменты содержат вариабельную область тяжелой цепи, выбранную из группы, состоящей из вариабельной области тяжелой цепи, содержащей SEQ ID NO:1, SEQ ID NO:3 и/или SEQ ID NO:5; вариабельной области тяжелой цепи, содержащей SEQ ID NO:13, SEQ ID NO:15 и/или SEQ ID NO:17; вариабельной области тяжелой цепи, содержащей SEQ ID NO:25, SEQ ID NO:27 и/или SEQ ID NO:29; и вариабельной области тяжелой цепи, содержащей SEQ ID NO:37, SEQ ID NO:39 и/или SEQ ID NO:41.
[00109] В некоторых вариантах осуществления антитела против PD-L1 и их антигенсвязывающие фрагменты содержат вариабельную область легкой цепи, выбранную из группы, состоящей из вариабельной области легкой цепи, содержащей SEQ ID NO:7, SEQ ID NO:9 и/или SEQ ID NO:11; вариабельной области легкой цепи, содержащей SEQ ID NO:19, SEQ ID NO:21 и/или SEQ ID NO:23; и вариабельной области легкой цепи, содержащей SEQ ID NO:31, SEQ ID NO:33 и/или SEQ ID NO:35.
[00110] В некоторых вариантах осуществления антитела против PD-L1 и их антигенсвязывающие фрагменты, содержат: а) вариабельную область тяжелой цепи, содержащую SEQ ID NO:1, SEQ ID NO:3 и/или SEQ ID NO:5; и вариабельную область легкой цепи, содержащую SEQ ID NO:7, SEQ ID NO:9 и/или SEQ ID NO:11; b) вариабельную область тяжелой цепи, содержащую SEQ ID NO:13, SEQ ID NO:15 и/или SEQ ID NO:17; и вариабельную область легкой цепи, содержащую SEQ ID NO:19, SEQ ID NO:21 и/или SEQ ID NO:23; c) вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, SEQ ID NO:27 и/или SEQ ID NO:29; и вариабельную область легкой цепи, содержащую SEQ ID NO:31, SEQ ID NO:33 и/или SEQ ID NO:35; или d) вариабельную область тяжелой цепи, содержащую SEQ ID NO:37, SEQ ID NO:39 и/или SEQ ID NO:41; и вариабельную область легкой цепи, содержащую SEQ ID NO:19, SEQ ID NO:21 и/или SEQ ID NO:23.
[00111] Специалисту в данной области техники будет понятно, что последовательности CDR, представленные в таблице 1, могут быть модифицированы и, таким образом, содержать одну или несколько аминокислотных замен для улучшенной биологической активности, например улучшенной аффинности связывания с PD-L1 человека. Например, библиотека вариантов антител (таких как Fab или scFv-варианты) может быть получена и экспрессирована с помощью технологии фагового дисплея, а затем скринирована на аффинность связывания с PD-L1 человека. В еще одном примере, для виртуальной имитации связывания антител с PD-L1 человека и идентификации аминокислотных остатков на антителах, которые образуют поверхность связывания, можно использовать компьютерное обеспечение. Такие остатки можно либо пропустить при замене, и таким образом, предотвратить уменьшение аффинности связывания, либо нацелиться на их замещение с получением более сильного связывания. В некоторых вариантах осуществления по меньшей мере одна (или все) замена (замены) в последовательностях CDR представляют собой консервативную замену.
[00112] В некоторых вариантах осуществления антитела и их антигенсвязывающие фрагменты содержат одну или несколько последовательностей CDR, которые по меньшей мере на 80% (например, по меньшей мере на 85%, на 88%, на 90%, на 91%, на 92%, на 93%, на 94%, на 95%, на 96%, на 97%, на 98%, на 99%) идентичны последовательности (или последовательностям), которые перечислены в таблице 1, и при этом сохраняют аффинность связывания с PD-L1 человека на уровне, аналогичном или даже выше уровня их родительское антитела, имеющего по существу ту же последовательность, за исключением того, что соответствующая последовательность CDR на 100% идентична последовательности (или последовательностям), которые перечислены в таблице 1.
[00113] В некоторых вариантах осуществления антитела против PD-L1 и их антигенсвязывающие фрагменты являются полностью человеческими. У полностью человеческих антител отсутствуют проблемы с иммуногенностью у человека и/или со сниженной аффинностью связывания, как это часто наблюдается у гуманизированных антител.
[00114] В некоторых вариантах осуществления полные антитела человека против PD-L1 и их антигенсвязывающие фрагменты содержат вариабельную область тяжелой цепи, выбранную из группы, состоящей из: SEQ ID NO:43, SEQ ID NO:47, SEQ ID NO:51, SEQ ID NO:55 и гомологичной им последовательности, которая по меньшей мере на 80% (например, по меньшей мере на 85%, на 88%, на 90%, на 91%, на 92%, на 93%, на 94%, на 95%, на 96%, на 97%, на 98%, на 99%) идентична по последовательности; и/или вариабельную область легкой цепи, выбранную из группы, состоящей из: SEQ ID NO:45, SEQ ID NO:49, SEQ ID NO:53 и гомологичной им последовательности, которая по меньшей мере на 80% (например, по меньшей мере на 85%, на 88%, на 90%, на 91%, на 92%, на 93%, на 94%, на 95%, на 96%, на 97%, на 98%, на 99%) идентична по последовательности. Эти полные антитела человека сохраняют аффинность связывания с PD-L1 человека предпочтительно на уровне, сходном уровню одного из антител, например, 1.4.1, 1.14.4, 1.20.15 и 1.46.11.
[00115] В некоторых вариантах осуществления полные антитела человека против PD-L1 и их антигенсвязывающие фрагменты содержат: a) вариабельную область тяжелой цепи, содержащую SEQ ID NO:43; и вариабельную область легкой цепи, содержащую SEQ ID NO:45; b) вариабельную область тяжелой цепи, содержащую SEQ ID NO:47; и вариабельную область легкой цепи, содержащую SEQ ID NO:49; c) вариабельную область тяжелой цепи, содержащую SEQ ID NO:51; и вариабельную область легкой цепи, содержащую SEQ ID NO:53; или d) вариабельную область тяжелой цепи, содержащую SEQ ID NO:55; и вариабельную область легкой цепи, содержащую SEQ ID NO:49.
[00116] В настоящем документе также описаны антитела и антигенсвязывающие фрагменты, которые конкурируют за один и тот же эпитоп с антителами против PD-L1 и их антигенсвязывающими фрагментами, приведенными в настоящем документе. В некоторых вариантах осуществления антитела блокируют связывание 1,4.1, 1.14.4, 1.20.15 и 1.46.11 с PD-L1 человека или обезьяны, например, при значении IC50 (т.е. при концентрации, вызывающей 50% ингибирование) менее 10-6 M, менее 10-7 M, менее 10-7,5 M, менее 10-8 M, менее 10-8,5 M, менее 10-9 M или менее 10-10 M. Значения IC50 определяют на основе конкурентного анализа, такого как анализ ELISA, анализы конкурентного связывания радиолиганда и анализ FACS.
[00117] В некоторых вариантах осуществления антитела против PD-L1 и их антигенсвязывающие фрагменты, предложенные в настоящем документе, способны специфически связываться с PD-L1 человека с аффинностью связывания (Kd) ≤10-6 M (например, ≤5×10-7 M, ≤2×10-7 M, ≤10-7 M, ≤5×10-8 M, ≤2×10-8 M, ≤10-8 M, ≤5×10-9 M, ≤2×10-9 M, ≤10-9 М, около 10-10 M, от 10-10 M до 10-8,5 М или от 10-10 M до 10-8 М), как измерено с помощью анализа связывания с плазмонным резонансом. Аффинность связывания может быть представлена величиной KD, которая рассчитывается как отношение скорости диссоциации к скорости ассоциации (koff/kon), когда связывание между антигеном и антигенсвязывающей молекулой достигает равновесия. Аффинность связывания с антигеном (например, KD) может быть соответствующим образом определена с использованием подходящих способов, известных в данной области, включая, например, анализ связывания при помощи плазмонного резонанса с использованием таких приборов, как Biacore (см., например, Murphy, M. et al, Current protocols in protein science, Chapter 19, unit 19,14, 2006).
[00118] В некоторых вариантах осуществления антитела и их фрагменты, предложенные в настоящем документе, связываются с PD-L1 человека при EC50 (то есть концентрация, вызывающая 50% связывание) 0,1 нМ-100 нМ (например, 0,1 нМ-50 нМ, 0,1 нМ-30 нМ, 0,1 нМ-20 нМ, 0,1 нМ-10 нМ или 0,1 нМ-1 нМ. Связывание антител с PD-L1 человека может быть измерено способами, известными в данной области техники, например, сэндвич-анализом, таким как ELISA, Western Blot, FACS или иной анализ связывания. В иллюстративном примере тестируемое антитело (то есть первое антитело) оставляют связываться с иммобилизованным PD-L1 человека или клетками, экспрессирующими PD-L1 человека, после промывки несвязанного антитела вводят меченое вторичное антитело, которое может связываться и, таким образом, позволяет обнаружить связанное первое антитело. Обнаружение может проводиться помощью считывающего устройство для микропланшетов, если используют иммобилизованный PD-L1, или с помощью анализа FACS, если используют клетки, экспрессирующие PD-L1 человека. В некоторых вариантах осуществления антитела и их фрагменты, предложенные в настоящем документе, связываются с PD-L1 человека при EC50 (то есть, 50% эффективная концентрация) от 1 нМ до 10 нМ или от 1 нМ до 5 нМ, как определено с помощью анализа FACS.
[00119] В некоторых вариантах осуществления антитела и их фрагменты, предложенные в настоящем документе, ингибируют связывание PD-L1 человека с его рецептором при IC50 0,2 нМ-100 нМ (например, 0,2 нМ-50 нМ, 0,2 нМ-30 нМ, 0,2 нМ-20 нМ, 0,2 нМ-10 нМ или 1 нМ-10 нМ), как измерено в конкурентном анализе.
[00120] В некоторых вариантах осуществления антитела и их фрагменты, предложенные в настоящем документе, блокируют связывание PD-L1 человека с его рецептором и тем самым обеспечивают биологическую активность, включая, например, индукцию продукции цитокинов из активированных Т-клеток (таких как CD4+ Т-клетки и CD8+ Т-клетки), индукцию пролиферации активированных Т-клеток (таких как CD4+ Т-клетки и CD8+ Т-клетки) и восстановление супрессирующей функции T reg. Примеры цитокинов включают IL-2 и IFNγ. Термин «IL-2» относится к интерлейкину 2, типу сигнальной молекулы цитокинов в иммунной системе, которая регулирует активность белых кровяных клеток (например, лейкоцитов). Термин «интерферон-гамма (IFNγ)» обозначает цитокин, который продуцируется природным киллером (NK), NKT-клетками, CD4+ и CD8+ Т-клетками, и который является важнейшим активатором макрофагов и индуктором экспрессии молекул главного комплекса гистосовместимости (МНС). Продукцию цитокинов можно определить с использованием методов, известных в данной области, например, с помощью ELISA. Методы также могут быть использованы для детекции пролиферации Т-клеток, в том числе анализа включения [3H] тимидина.
[00121] Антитела против PD-L1 и их антигенсвязывающие фрагменты являются специфичными для PD-L1 человека. В некоторых вариантах осуществления антитела и их антигенсвязывающие фрагменты не связываются с PD-L2 (например, PD-L2 человека). Например, аффинность связывания с PD-L2 составляет менее 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1% от аффинности связывания с PD-L1 человека.
[00122] В некоторых вариантах осуществления антитела и их антигенсвязывающие фрагменты связываются с PD-L1 обезьяны, когда EC50 составляет не более 100 нМ, например, не более или около 10 нМ, 9 нМ, 8 нМ, 7 нМ, 6 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0,9 нМ, 0,8 нМ, 0,7 нМ, 0,6 нМ, 0,5 нМ, 0,4 нМ, 0,3 нМ, 0,2 нМ, 0,1 нМ, 0,09 нМ, 0,08 нМ, 0,07 нМ, 0,06 нМ, 0,05 нМ, 0,04 нМ, 0,03 нМ, 0,02 нМ или 0,01 нМ, как измерено с помощью ELISA. В некоторых вариантах осуществления антитела и их антигенсвязывающие фрагменты связываются с PD-L1 обезьяны при EC50 примерно 1 нМ-10 нМ.
[00123] В некоторых вариантах осуществления антитела и их антигенсвязывающие фрагменты не связываются с PD-L1 мыши, но связываются с PD-L1 обезьяны с аффинностью связывания, сходной с аффинностью связывания с PD-L1 человека. Например, связывание примеров антител 1.4.1, 1.14.4, 1.20.15 и 1.46.11 с PD-L1 мыши не обнаруживается в обычных анализах связывания, таких как ELISA или анализ FACS, тогда как связывание этих антител с PD-L1 обезьяны имеет сходные аффинность или значение EC50 с показателями для PD-L1 человека, как измерено с помощью ELISA или FACS.
[00124] В некоторых вариантах осуществления антитела против PD-L1 и их антигенсвязывающие фрагменты снижают или сокращают эффекторную функцию. В некоторых вариантах осуществления антитела против PD-L1 и их антигенсвязывающие фрагменты имеют константную область изотипа IgG4, которая обладает сниженной или сокращенной эффекторной функцией. Эффекторные функции, такие как ADCC и CDC, могут приводить к цитотоксичности клеток, экспрессирующих PD-L1. Многие клетки, включая нормальные клетки, могут экспрессировать PD-L1. Чтобы избежать возможной нежелательной токсичности для нормальных клеток, в некоторых вариантах осуществления антитела и антигенсвязывающие фрагменты, представленные в настоящем документе, могут обладать сниженными или сокращенными эффекторными функциями. Известно, что активность ADCC или CDC оценивается в различных анализах, например, в анализе связывания Fc-рецептора, анализе связывания C1q и анализе лизиса клеток, и анализы могут быть легко выбраны специалистами в данной области. Не желая быть связанным с теорией, полагают, что антитела со сниженными или сокращенными эффекторными функциями, такими как ADCC или CDC, не будут вызывать или будут вызывать минимальную цитотоксичность клеток, экспрессирующих PD-L1, например, в отношении нормальных клеток, и поэтому предохраняют их от нежелательных побочных эффектов, тогда как опухолевые клетки, экспрессирующие PD-L1, будут связываться с антителами против PD-L1 и поэтому не могут избежать иммунной контрольной точки и, следовательно, могут быть распознаны и уничтожены иммунной системой.
[00125] В некоторых вариантах осуществления антитела против PD-L1 и их антигенсвязывающие фрагменты, предложенные в настоящем документе, обладают пониженными побочными эффектами. Например, антитела и их антигенсвязывающие фрагменты, представленные в настоящем документе, могут иметь полную человеческую последовательность IgG и, следовательно, меньшую иммуногенность, чем гуманизированное антитело. В другом примере антитела и их антигенсвязывающие фрагменты, представленные в настоящем документе, могут быть в формате IgG4 для устранения ADCC и CDC.
[00126] В некоторых вариантах осуществления преимущества антител против PD-L1 и их антигенсвязывающих фрагментов, представленных в настоящем документе, состоят в том, что они могут использоваться в комбинации с иммуногенными средствами, такими как опухолевые клетки, очищенный опухолевый антиген, и клетки, трансфицированные генами, кодирующими иммуностимулирующие цитокины, противоопухолевые вакцины. Кроме того, антитела против PD-L1 и их антигенсвязывающие фрагменты могут быть включены в комбинированную терапию, включая стандартные способы химио- и радиотерапии, таргетную терапию низкомолекулярными молекулами, инновационные виды других способов терапии модуляторами иммунной контрольной точки. В некоторых вариантах осуществления антитела и их антигенсвязывающие фрагменты могут быть использованы в качестве основы конъюгатов антитело-лекарственное средство, биспецифических или мультивалентных антител.
[00127] Антитела против PD-L1 или их антигенсвязывающие фрагменты, представленные в настоящем документе, могут представлять собой моноклональное антитело, поликлональное антитело, полное антитело человека, гуманизированное антитело, химерное антитело, рекомбинантное антитело, биспецифическое антитело, меченое антитело, бивалентное антитело или антиидиотипическое антитело. Рекомбинантное антитело представляет собой антитело, полученное in vitro с использованием рекомбинантных технологий, а не животных. Биспецифическое или бивалентное антитело представляет собой искусственное антитело с фрагментами двух разных моноклональных антител, и может связываться с двумя разными антигенами. Антитело или его антигенсвязывающий фрагмент, которые являются «бивалентными», содержат два антигенсвязывающих сайта. Два сайта связывания антигена могут связываться с одним и тем же антигеном, или каждый из них может связываться с разными антигенами, и в этом случае антитело или антигенсвязывающий фрагмент характеризуются как «биспецифические».
[00128] В некоторых вариантах осуществления антитела против PD-L1 или их антигенсвязывающие фрагменты, представленные в настоящем документе, являются полными антителами человека. В некоторых вариантах осуществления полные антитела человека получают с использованием рекомбинантных технологий. Например, трансгенное животное, такое как мышь, может быть создано и, тем самым, нести трансгены или трансхромосы генов иммуноглобулина человека и, следовательно, после иммунизации соответствующим антигеном, таким как PD-L1 человека, оно способно продуцировать полные антитела человека. Полные антитела человека могут быть выделены из такого трансгенного животного или, альтернативно, могут быть получены с помощью гибридомной технологии путем слияния клеток селезенки трансгенного животного с иммортализованной линией клеток с получением гибридомных клеток, секретирующих полные антитела человека. Примеры трансгенных животных включают, но ими не ограничиваются, OmniRat, у которых экспрессия эндогенных генов иммуноглобулина крысы инактивирована и которые при этом содержат рекомбинантные локусы иммуноглобулина человека, что достигнуто методами генной инженерии; OmniMouse, у которых экспрессия эндогенных генов иммуноглобулина мыши инактивирована, и которые при этом содержат рекомбинантные локусы иммуноглобулина человека с делецией J-локуса и мутацией C-каппа, что достигнуто методами генной инженерии; OmniFlic, которые представляют собой трансгенную крысу, у которой экспрессия эндогенных генов иммуноглобулина крысы инактивирована, и которые при этом содержат рекомбинантные локусы иммуноглобулина человека, имеющие единую общую перестроенную легкую цепь VkJk и функциональную тяжелую цепь, что достигнуто методами генной инженерии. Более подробную информацию можно найти в работах: Osborn M. et al., Journal of Immunology, 2013, 190: 1481-90; Ma B. et al., Journal of Immunological Methods 400-401 (2013) 78-86; Geurts A. et al., Science, 2009, 325: 433; патент США 8907157; патент EP 2152880B1; патент EP 2336329B1, которые все включены в настоящий документ в качестве ссылки в полном объеме. Также могут быть использованы другие подходящие трансгенные животные, например, мыши HuMab (подробно смотри, Lonberg, N. et al., Nature 368 (6474): 856, 859 (1994)), ксеномыши (Mendez et al., Nat Genet., 1997, 15: 146-156), мышь TransChromo (Ishida et al., Cloning Stem Cells, 2002, 4: 91-102) и мышь VelocImmune (Murphy et al., Proc Natl Acad Sci USA, 2014, 111: 5153-5158), Kymouse (Lee et al., Nat Biotechnol, 2014, 32: 356-363) и трансгенный кролик (Flisikowska et al., PLoS One, 2011, 6:e21045).
[00129] В некоторых вариантах осуществления антитела против PD-L1 и их антигенсвязывающие фрагменты представляют собой однодоменное антитело верблюда, диатело, scFv, димер scFv, BsFv, dsFv, (dsFv)2, dsFv-dsFv', фрагмент Fv, Fab, Fab', F(ab')2, ds диатело, нанотело, доменное антитело или бивалентное доменное антитело.
[00130] В некоторых вариантах осуществления антитела против PD-L1 и их антигенсвязывающие фрагменты дополнительно содержат константную область иммуноглобулина. В некоторых вариантах осуществления константная область иммуноглобулина содержит константную область тяжелой цепи и/или легкой цепи. Константная область тяжелой цепи включает области CH1, CH1-CH2 или CH1-CH3. В некоторых вариантах осуществления константная область может дополнительно содержать одну или несколько модификаций для придания желаемых свойств. Например, константная область может быть модифицирована с сокращением или снижением одной или нескольких эффекторных функций, улучшением связывания рецептора FcRn или введением одного или нескольких остатков цистеина.
[00131] В некоторых вариантах осуществления антитела против PD-L1 и их антигенсвязывающие фрагменты дополнительно содержат конъюгат. Предполагается, что с антителами или антигенсвязывающими фрагментами, представленными в настоящем документе, могут быть связаны различные конъюгаты (см., например, «Conjugate Vaccines», Contributions to Microbiology and Immunology, J. M. Cruse and R. E. Lewis, Jr. (eds.), Carger Press, New York, (1989)). Эти конъюгаты могут быть связаны с антителами или антигенсвязывающими фрагментами путем ковалентного связывания, аффинного связывания, интеркаляции, координатного связывания, комплексообразования, ассоциации, смешивания или добавления, а также другими методами. В некоторых вариантах осуществления антитела и антигенсвязывающие фрагменты, описанные в настоящем документе, могут быть сконструированы и тем самым содержать определенные сайты вне участка связывания эпитопов, которые могут быть использованы для связывания с одним или несколькими конъюгатами. Например, такой сайт может включать один или несколько реакционноспособных аминокислотных остатков, таких как, например, цистеиновые или гистидиновые остатки, для облегчения ковалентной связи с конъюгатом. В некоторых вариантах осуществления антитела могут быть связаны с конъюгатом косвенно или через другой конъюгат. Например, антитело или антигенсвязывающие фрагменты могут быть конъюгированы с биотином, затем косвенно конъюгированы со вторым конъюгатом, который конъюгирован с авидином. Конъюгат может быть детектируемой меткой, фармакокинетическим модифицирующим фрагментом, фрагментом для очистки или цитотоксическим фрагментом. Примеры детектируемой метки могут включать флуоресцентные метки (например, флуоресцеин, родамин, дансил, фикоэритрин или техасский красный), фермент-субстратные метки (например, пероксидаза хрена, щелочная фосфатаза, люцереназы, глюкоамилаза, лизоцим, оксидазы сахаридов или β-D-галактозидаза), радиоизотопы (например, 123I, 124I, 125I, 131I, 35S, 3H, 111In, 112In, 14C, 64Cu, 67Cu, 86Y, 88Y, 90Y, 177Lu, 211At, 186Re, 188Re, 153Sm, 212Bi и 32P, другие лантаноиды, люминесцентные метки), хромофорный фрагмент, дигоксигенин, биотин/авидин, молекулу ДНК или золото для обнаружения. В некоторых вариантах осуществления конъюгат может представлять собой фармакокинетический модифицирующий фрагмент, такой как ПЭГ, который помогает повысить период полувыведения антитела. Другие подходящие полимеры включают, например, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, сополимеры этиленгликоля/пропиленгликоля и тому подобное. В некоторых вариантах осуществления конъюгат может представлять собой фрагмент для очистки, такой как магнитные бусы. «Цитотоксический фрагмент» может представлять собой средство, которое оказывает губительное действие на клетки или может повреждать или уничтожать клетки. Примеры цитотоксического фрагмента включают, но ими не ограничиваются, таксол, цитохалазин В, грамицидин D, этидиум бромид, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол, пуромицин и его аналоги, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацил декарбазин), алкилирующие агенты (например, мехлорэтамин, тиоэпа хлорамбуцил, мелфалан, кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромманнитол, стрептозотоцин, митомицин C и цис-дихлориамин платина (II) (DDP) цисплатин), антрациклины (например, даунорубицин (ранее дауномицин) и доксорубицин) антибиотики (например, дактиномицин (ранее актиномицин), блеомицин, митрамицин и антрамицин (AMC)) и антимитотические агенты (например, винкристин и винбластин).
[00132] Полинуклеотиды и рекомбинантные методы
[00133] В настоящем изобретении предложены выделенные полинуклеотиды, которые кодируют антитела против PD-L1 и их антигенсвязывающие фрагменты. В некоторых вариантах осуществления, выделенные полинуклеотиды содержат одну или несколько нуклеотидных последовательностей, показанные в таблице 1, которые кодируют последовательности CDR, представленные в таблице 1.
[00134] В некоторых вариантах осуществления выделенные полинуклеотиды кодируют вариабельный участок тяжелой цепи и содержат последовательность, выбранную из группы, состоящей из SEQ ID NO:44, SEQ ID NO:48, SEQ ID NO:52, SEQ ID NO:56 и гомологичной им последовательности, которая по меньшей мере на 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентична по последовательности. В некоторых вариантах осуществления, выделенные полинуклеотиды кодируют вариабельный участок легкой цепи и содержат последовательность, выбранную из группы, состоящей из SEQ ID NO:46, SEQ ID NO:50, SEQ ID NO:54 и гомологичной им последовательности, которая по меньшей мере на 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентична по последовательности. В некоторых вариантах осуществления процентная идентичность обусловлена вырожденностью генетического кода, при этом кодированная последовательность белка остается неизменной.
[00135] Выделенный полинуклеотид, который кодирует антитела против PD-L1 и их антигенсвязывающие фрагменты (например, включая последовательности, указанные в таблице 1), может быть встроен в вектор для дальнейшего клонирования (амплификации ДНК) или для экспрессии с использованием рекомбинантных технологий, известных в данной области. В другом варианте осуществления антитело может быть получено гомологичной рекомбинацией, известной в данной области. ДНК, кодирующую моноклональное антитело, легко выделяют и секвенируют с использованием обычных процедур (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела). Многие векторы являются доступными. Компоненты вектора обычно включают, но не ограничиваются ими, одно или несколько из следующих: сигнальная последовательность, источник репликации, один или несколько маркерных генов, энхансерный элемент, промотор (например, SV40, CMV, EF-1α) и последовательность терминации транскрипции.
[00136] В некоторых вариантах осуществления векторная система включает в себя системы млекопитающих, бактерий, дрожжей и тому подобное, и включает плазмиды, такие как, без ограничения, pALTER, pBAD, pcDNA, pCal, pL, pET, pGEMEX, pGEX, pCI, pCMV, pEGFP, pEGFT, pSV2, pFUSE, pVITRO, pVIVO, pMAL, pMONO, pSELECT, pUNO, pDUO, Psg5L, pBABE, pWPXL, pBI, p15TV-L, pPro18, pTD, pRS420, pLexA, pACT2.2 и тому подобное, а также другие лабораторные и коммерчески доступные векторы. Подходящие векторы могут включать плазмиду или вирусные векторы (например, ретровирусы с дефектом репликации, аденовирусы и аденоассоциированные вирусы).
[00137] Векторы, содержащие полинуклеотидную последовательность, кодирующую антитело или антигенсвязывающий фрагмент, могут быть введены в клетку-хозяина для клонирования или экспрессии гена. Подходящими клетками-хозяевами для клонирования или экспрессии ДНК в векторах согласно настоящему документу являются клетки прокариот, дрожжей или высших эукариот, описанные выше. Подходящие прокариоты для этой цели включают эубактерии, такие как грамотрицательные или грамположительные организмы, например, Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescans и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis, Pseudomonas, такие как P. aeruginosa и Streptomyces.
[00138] Кроме прокариот, подходящими хозяевами для клонирования или экспрессии векторов, кодирующих антитела против PD-L1, являются эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи. Среди низших эукариотических микроорганизмов-хозяев наиболее часто используемыми являются Saccharomyces cerevisiae, или обычные пекарские дрожжи. Однако, ряд других родов, видов и штаммов являются общедоступными и используются в настоящем изобретении, такие как Schizosaccharomyces pombe; хозяева Kluyveromyces, такие как, например, K. lactis, K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906), K. thermotolerans и K. marxianus; ярровия (EP 402226); Pichia pastoris (EP 183 070); кандида; Trichoderma reesia (EP 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и нитчатые грибы, такие как, например, Neurospora, Penicillium, Tolypocladium и Aspergillus, такие как A. nidulans и A. niger.
[00139] Подходящие клетки-хозяева для экспрессии гликозилированных антител или антиген-фрагмента, предложенные в настоящем документе, получают из многоклеточных организмов. Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы и варианты и соответствующие пермиссивные клетки-хозяева насекомых из таких хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypti (москит), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Различные вирусные штаммы для трансфекции являются общедоступными, например, вариант L-1 NPV Autographa californica и штамм Bm-5 Bombyx mori NPV, и такие вирусы могут быть использованы в качестве вируса в соответствии с настоящим изобретением, в частности, для трансфекции клеток Spodoptera frugiperda. В качестве хозяев также могут быть использованы культуры растительных клеток хлопка, кукурузы, картофеля, сои, петунии, томатов и табака.
[00140] Однако наибольший интерес представляют клетки позвоночных, и размножение клеток позвоночных в культуре (культуре ткани) стало обычной процедурой. Примерами используемых на практике линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны CV1, трансформированных SV40 (COS-7, ATCC CRL 1651); линия клеток эмбриональной почки человека (клетки 293 или 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки новорожденного хомяка (BHK, ATCC CCL 10); клетки яичника китайского хомяка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77: 4216 (1980)); клетки Сертоли мышей (TM4, Mather, Biol. Reprod. 23: 243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крыс линии Буффало (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC CCL51); TRI (Mather et al., Annals N.Y. Acad. Sci. 383: 44-68 (1982)); клетки MRC 5; клетки FS4; и линия клеток гепатомы человека (Hep G2). В некоторых предпочтительных вариантах осуществления клетка-хозяин представляет собой клетку 293F.
[00141] Клетки-хозяева трансформируют описанными выше экспрессирующими или клонирующими векторами для продукции антител против PD-L1 и культивируют в обычных питательных средах, модифицированных соответствующим образом для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих желаемые последовательности.
[00142] Клетки-хозяева, используемые для получения антител или антигенсвязывающих фрагментов, представленных в настоящем документе, могут быть культивированы в различных средах. Для культивирования клеток-хозяев пригодны коммерчески доступные среды, такие как среда Хэма F10 (Sigma), минимальная питательная среда (MEM), (Sigma), RPMI-1640 (Sigma) и среда Игла в модификации Дульбекко (DMEM), Sigma). Кроме того, любая среда, описанная в работах Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102: 255 (1980), патентах США №№ 4767704; 4657866; 4927762; 4560655 или 512469; WO 90/03430; WO 87/00195; или патенте США Re 30985 может быть использована в качестве культуральной среды для клеток-хозяев. Любая из этих сред по мере необходимости может быть дополнена гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальций, магний и фосфат), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как препарат GENTAMYCIN™), микроэлементами (определяемыми как неорганические соединения, обычно присутствующие при конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Также в соответствующих концентрациях могут быть включены какие-либо другие необходимые добавки, которые могут быть известны специалистам в данной области. Условиями культивирования, такие как температура, рН и тому подобное, являются условия, которые ранее использовались для клеток-хозяев, отобранных для экспрессии, и они будут очевидны среднему специалисту в данной области.
[00143] При использовании рекомбинантных технологий антитело может продуцироваться внутриклеточно, в периплазматическое пространство или непосредственно секретироваться в среду. Если антитело продуцируется внутриклеточно, то в качестве первой стадии удаляют дебрис либо клеток-хозяев, либо лизированных фрагментов, например, центрифугированием или ультрафильтрацией. Carter et al., Bio/Technology 10: 163-167 (1992) описывают способ выделения антител, которые секретируются в периплазматическое пространство E. coli. Коротко, осадок клеток оттаивают в присутствии ацетата натрия (рН 3,5), ЭДТА и фенилметилсульфонилфторида (PMSF) в течение примерно 30 мин. Клеточный дебрис можно удалить центрифугированием. Если антитело секретируется в среду, то супернатанты таких экспрессионных систем обычно сначала концентрируют с использованием коммерчески доступного фильтра для концентрирования белка, например, ультрафильтрационной установки Amicon или Millipore Pellicon. На любой из вышеперечисленных стадий может быть добавлен ингибитор протеаз, такой как PMSF, для ингибирования протеолиза, и могут быть внесены антибиотики для предотвращения роста случайных контаминатнов.
[00144] Антитело, полученное из клеток, может быть очищено с помощью, например, гидроксилапатитовой хроматографии, гель-электрофореза, диализа, ионообменной хроматографии на DEAE-целлюлозе, осаждения сульфатом аммония, высаливания и аффинной хроматографии, причем предпочтительным способом очистки является аффинная хроматография. Пригодность белка А в качестве аффинного лиганда зависит от вида и изотипа любого домена Fc иммуноглобулина, который находится в антителе. Белок А может быть использован для очистки антител, которые основаны на тяжелых цепях гамма 1, гамма 2 или гамма 4 человека (Lindmark et al., J. Immunol. Meth. 62: 1-13 (1983)). Белок G рекомендуется для всех изотипов мыши и гамма 3 человека (Guss et al., EMBO J. 5: 1567, 1575 (1986)). Матрицей, к которой присоединен аффинный лиганд, чаще всего является агароза, но доступны и другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемой пористостью или поли(стиролдивинил)бензол, обеспечивают более высокую скорость потока и сокращают время обработки, которое достигается при использовании агарозы. Если антитело содержит домен CH3, то для очистки подходит смола Bakerbond ABX.TM. (J.T. Baker, Phillipsburg, NJ). В зависимости от выделяемого антитела подходящими являются другие методики очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, ВЭЖХ с обращенной фазой, хроматография на диоксиде кремния, хроматография на гепарин-сефарозе™, хроматография на анионо- или катионообменной смоле (такой как колонка с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония.
[00145] После любой(ых) стадии(ий) предварительной очистки смесь, содержащую интересующее антитело и контаминанты, можно подвергнуть хроматографии гидрофобного взаимодействия с низким рН, используя буфер для элюирования при рН в диапазоне примерно от 2,5 до 4,5, предпочтительно осуществляемой при низких концентрациях солей (например, около 0-0,25 М соли).
[00146] Наборы
[00147] Настоящее изобретение относится к наборам, содержащим антитела против PD-L1 или их антигенсвязывающие фрагменты. В некоторых вариантах осуществления наборы могут быть использованы для обнаружения присутствия или уровня PD-L1 в биологическом образце. Биологический образец может содержать клетку или ткань.
[00148] В некоторых вариантах осуществления набор содержит антитело против PD-L1 или его антигенсвязывающий фрагмент, которые конъюгированы с детектируемой меткой. В некоторых других вариантах осуществления набор содержит немеченое антитело против PD-L1 или антигенсвязывающий фрагмент и дополнительно содержит второе меченое антитело, которое способно связываться с немеченым антителом против PD-L1. Набор может дополнительно содержать инструкцию по применению и упаковку, которая разделяет каждый из компонентов в наборе.
[00149] В некоторых вариантах осуществления антитело против PD-L1 или его антигенсвязывающий фрагмент связаны с субстратом или устройством, используемым в сэндвич-анализе, таком как ELISA, или в иммунографическом анализе. Используемым субстратом или устройством может являться, например, планшет для микротитрования и тест-полоска.
[00150] Фармацевтическая композиция и способ лечения
[00151] Настоящее изобретение относится, кроме того, к фармацевтическим композициям, содержащим антитела против PD-L1 или их антигенсвязывающие фрагменты и один или несколько фармацевтически приемлемых носителей.
[00152] Фармацевтические приемлемые носители для использования в фармацевтических композициях, описанных в настоящем документе, могут включать, например, фармацевтически приемлемые жидкие, гелеобразные или твердые носители, водные носители, неводные носители, противомикробные агенты, изотонические агенты, буферы, антиоксиданты, анестетики, суспендирующие/диспергирующие или хелатирующие агенты, разбавители, адъюванты, эксципиенты или нетоксичные вспомогательные вещества, другие компоненты, известные в данной области, или их различные комбинации.
[00153] Подходящие компоненты могут включать, например, антиоксиданты, наполнители, связующие вещества, разрыхлители, буферы, консерванты, смазывающие вещества, ароматизаторы, загустители, красители, эмульгаторы или стабилизаторы, такие как сахара и циклодекстрины. Подходящие антиоксиданты могут включать, например, метионин, аскорбиновую кислоту, ЭДТА, тиосульфат натрия, платину, каталазу, лимонную кислоту, цистеин, тиоглицерин, тиогликолевую кислоту, тиосорбит, бутилированный гидроксианизол, бутилированный гидрокситолуол и/или пропилгаллат. Как описано в настоящем документе, включение одного или нескольких антиоксидантов, таких как метионин, в композицию, содержащую антитело или антигенсвязывающий фрагмент и конъюгаты, предложенные в настоящем документе, уменьшает окисление антитела или антигенсвязывающего фрагмента. Это уменьшение окисления предотвращает или уменьшает потерю аффинности связывания, тем самым улучшая стабильность антитела и максимально увеличивая срок хранения. Поэтому в некоторых вариантах осуществления предложены композиции, которые содержат одно или несколько антител или антигенсвязывающих фрагментов, описанных в настоящем документе, и один или несколько антиоксидантов, таких как метионин. Далее представлены способы предотвращения окисления, увеличения срока хранения и/или повышения эффективности антитела или антигенсвязывающего фрагмента, предложенных в настоящем документе, путем смешивания антитела или антигенсвязывающего фрагмента с одним или несколькими антиоксидантами, такими как метионин.
[00154] В качестве дополнительной иллюстрации, фармацевтически приемлемые носители могут включать, например, водные носители, такие как хлорид натрия для инъекции, раствор Рингера для инъекции, изотонический раствор декстрозы для инъекции, стерильную воду для инъекции, или раствор декстрозы и лактата Рингера для инъекции, неводные носители, такие как твердые масла растительного происхождения, хлопковое масло, кукурузное масло, кунжутное масло или арахисовое масло, противомикробные средства в бактериостатических или фунгистатических концентрациях, изотонические агенты, такие как хлорид натрия или декстроза, буферы, такие как фосфатный или цитратный буферы, антиоксиданты, такие как бисульфат натрия, местные анестетики, такие как гидрохлорид прокаина, суспендирующие и диспергирующие агенты, такие как натрийкарбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза или поливинилпирролидон, эмульгаторы, такие как Polysorbate 80 (TWEEN-80), секвестрирующие или хелатирующие агенты, такие как ЭДТА (этилендиаминтетрауксусная кислота) или ЭГТА (этиленгликоль тетрауксусная кислота), этиловый спирт, полиэтиленгликоль, пропиленгликоль, гидроксид натрия, хлористоводородная кислота, лимонная кислота или молочная кислота. В фармацевтические композиции в контейнерах для многократного приема в качестве носителей могут быть добавлены противомикробные агенты, которые включают фенолы или крезолы, ртутьсодержащие соединения, бензиловый спирт, хлорбутанол, сложные метиловый и пропиловый эфиры п-гидроксибензойной кислоты, тимеросал, хлорид бензалкония и хлорид бензетония. Подходящие эксципиенты могут включать, например, воду, физиологический раствор, декстрозу, глицерин или этанол. Подходящие нетоксичные вспомогательные вещества могут включать, например, смачивающие или эмульгирующие агенты, рН-буферные агенты, стабилизаторы, усилители растворимости или агенты, такие как ацетат натрия, монолаурат сорбитана, олеат триэтаноламина или циклодекстрин.
[00155] Фармацевтические композиции могут представлять собой жидкий раствор, суспензию, эмульсию, пилюлю, капсулу, таблетку, состав с замедленным высвобождением или порошок. Пероральные составы могут включать стандартные носители, такие как маннит, лактоза, крахмал, стеарат магния, поливинилпирролидон, сахарин натрия, целлюлоза, карбонат магния и тому подобное, со степенью очистки, подходящей для фармацевтической композиции.
[00156] В вариантах осуществления фармацевтические композиции составлены в виде инъекционной композиции. Инъецируемые фармацевтические композиции могут быть получены в любой традиционной форме, такой как, например, жидкий раствор, суспензия, эмульсия, или в виде твердых форм, подходящих для получения жидкого раствора, суспензии или эмульсии. Препараты для инъекций могут включать стерильные и/или непирогенные растворы, готовые для инъекций, стерильные сухие растворимые продукты, такие как лиофилизированные порошки, готовые к смешиванию с растворителем непосредственно перед использованием, включая подкожные таблетки, стерильные суспензии, готовые для инъекций, стерильные сухие нерастворимые продукты, готовые к объединению со средой для лекарственного средства непосредственно перед использованием, и стерильные и/или непирогенные эмульсии. Растворы могут быть либо водными, либо неводными.
[00157] В некоторых вариантах осуществления стандартные дозы парентеральных препаратов помещают в ампулу, флакон или шприц с иглой. Как известно и практикуется в данной области, все препараты для парентерального введения должны быть стерильными и непирогенными.
[00158] В некоторых вариантах осуществления стерильный лиофилизированный порошок получают путем растворения антитела или антигенсвязывающего фрагмента, описанных в настоящем документе, в подходящем растворителе. Растворитель может содержать эксципиент, который улучшает стабильность или другие фармакологические компоненты порошка или восстановленного раствора, полученного из порошка. Вспомогательные вещества, которые могут быть использованы, включают, но не ограничиваются ими, воду, декстрозу, сорбит, фруктозу, кукурузный сироп, ксилит, глицерин, глюкозу, сахарозу или другой подходящий агент. В одном из вариантов осуществления растворитель может содержать буфер, такой как цитратный, фосфатный натриевый или калиевый, или другой такой буфер с нейтральным рН, известный специалистам в данной области. Последующая стерильная фильтрация раствора с последующей лиофилизацией в стандартных условиях, известных специалистам в данной области, дает желаемый состав. В одном варианте осуществления полученный раствор распределяют во флаконы для лиофилизации. Каждый флакон может содержать одну дозу или несколько доз антитела против PD-L1 или его антигенсвязывающего фрагмента или их композиции. Для облегчения точного отбора проб и точного дозирования подходящим является переполнение флаконов небольшим количеством относительно необходимого для дозы или набора доз (например, примерно на 10%). Лиофилизированный порошок можно хранить в подходящих условиях, например, при температуре от примерно 4°C до комнатной температуры.
[00159] Восстановление лиофилизированного порошка водой для инъекций дает препарат для применения путем парентерального введения. В одном из вариантов осуществления для восстановления к лиофилизированному порошку добавляют стерильную и/или непирогенную воду или другой жидкий подходящий носитель. Точное количество зависит от выбранной терапии и может быть определено эмпирически.
[00160] Также предложены терапевтические способы, включающие: введение терапевтически эффективного количества антитела или антигенсвязывающего фрагмента, предложенных в настоящем документе, индивидууму, нуждающемуся в этом, таким образом осуществляя лечение или профилактику состояния или заболевания, связанных с PD-L1. В другом аспекте предложены способы лечения состояния у индивидуума, которому пойдет на пользу повышение активности иммунного ответа, включающие введение терапевтически эффективного количества антитела или антигенсвязывающего фрагмента, предложенных в настоящем документе, индивидууму, нуждающемуся в этом.
[00161] Терапевтически эффективное количество антитела или антигенсвязывающего фрагмента, предложенных в настоящем документе, будет зависеть от различных факторов, известных в данной области, таких как, например, вес тела, возраст, анамнез заболевания, медикаментация, применяемая в настоящее время, общее состояние здоровья индивидуума и возможность перекрестной реакции, аллергия, чувствительность и неблагоприятные побочные эффекты, а также путь введения и степень развития опухоли. Дозы могут быть пропорционально уменьшены или увеличены специалистом в данной области (например, врачом или ветеринаром), как показано упомянутыми и другими обстоятельствами или необходимостью.
[00162] В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, предложенные в настоящем документе, могут быть введены в терапевтически эффективной дозе от примерно 0,01 мг/кг до примерно 100 мг/кг (например, около 0,01 мг/кг, около 0,5 мг/кг, около 1 мг/кг, около 2 мг/кг, около 5 мг/кг, около 10 мг/кг, около 15 мг/кг, около 20 мг/кг, около 25 мг/кг, около 30 мг/кг, около 35 мг/кг, около 40 мг/кг, около 45 мг/кг, около 50 мг/кг, около 55 мг/кг, около 60 мг/кг, около 65 мг/кг, около 70 мг/кг, около 75 мг/кг, около 80 мг/кг, около 85 мг/кг, около 90 мг/кг, около 95 мг/кг или около 100 мг/кг). В некоторых из этих вариантов осуществления антитело или антигенсвязывающий фрагмент вводят в дозе около 50 мг/кг или менее, а в некоторых из этих вариантов осуществления доза составляет 10 мг/кг или менее, 5 мг/кг или менее, 1 мг/кг или менее, 0,5 мг/кг или менее или 0,1 мг/кг или менее. В некоторых вариантах осуществления вводимая доза может изменяться в процессе лечения. Например, в некоторых вариантах осуществления первоначальная доза может быть выше, чем последующие дозы. В некоторых вариантах осуществления вводимая доза может изменяться в процессе лечения в зависимости от реакции индивидуума.
[00163] График введения дозы можно регулировать, тем самым получая оптимальный желаемый ответ (например, терапевтический ответ). Например, можно вводить единичную дозу или можно вводить несколько разделенных доз в течение времени.
[00164] Антитела и антигенсвязывающие фрагменты, описанные в настоящем документе, могут быть введены любым способом, известным в данной области, таким как, например, парентеральный (например, подкожный, внутрибрюшинный, внутривенный, включая внутривенную инфузию, внутримышечную или внутрикожную инъекцию) или непарентеральный (например, пероральный, интраназальный, внутриглазной, сублингвальный, ректальный или местный) пути введения.
[00165] Состояния и заболевания, связанные с PD-L1, могут представлять собой иммунное заболевание или расстройство. В некоторых вариантах осуществления состояния и заболевания, связанные с PD-L1, включают опухоли и злокачественные новообразования, такие как, например, немелкоклеточный рак легкого, мелкоклеточный рак легкого, почечно-клеточный рак, рак прямой кишки, рак яичников, рак молочной железы, рак поджелудочной железы, карцинома желудка, рак мочевого пузыря, рак пищевода, мезотелиома, меланома, рак головы и шеи, рак щитовидной железы, саркома, рак простаты, глиобластома, рак шейки матки, рак вилочковой железы, лейкоз, лимфома, миелома, грибовидный микоз, рак из клеток Меркеля и другие гематологические злокачественные новообразования, такие как классическая лимфома Ходжкина (CHL), первичная медиастинальная B-крупноклеточная лимфома, Т-клеточная/богатая гистиоцитами В-клеточная лимфома, EBV-положительный и отрицательный PTLD и EBV-ассоциированная диффузная крупноклеточная В-клеточная лимфома (DLBCL), плазмобластная лимфома, экстранодальная NK/Т-клеточная лимфома, назофарингеальная карцинома и HHV-8-ассоциированная первичная эффузионная лимфома, лимфома Ходжкина, новообразования центральной нервной системы (ЦНС), такие как первичная лимфома ЦНС, опухоль позвоночника, глиома ствола мозга. В некоторых вариантах осуществления опухоли и злокачественные новообразования являются метастатическими, в частности, метастатическими опухолями, экспрессирующими PD-L1. В некоторых вариантах осуществления состояния и заболевания, связанные с PD-L1, включают аутоиммунные заболевания, такие как системная красная волчанка (SLE), псориаз, системная склеродермия, аутоиммунный диабет и тому подобное. В некоторых вариантах осуществления состояния и заболевания, связанные с PD-L1, включают инфекционное заболевание, такое как хроническая вирусная инфекция, например, вирусная инфекция гепатита В, гепатит С, вирус герпеса, вирус Эпштейна-Барра, ВИЧ, цитомегаловирус, вирус простого герпеса типа I, вирус простого герпеса типа 2, вирус папилломы человека, аденовирус, эпидемический герпесвирус, ассоциированный с саркомой Капоши West, вирус «тонкого ожерелья» (Torque teno virus), вирус JC или вирус BK.
[00166] Способы применения
[00167] В настоящем изобретении, кроме того, предложены способы применения антител против PD-L1 или их антигенсвязывающих фрагментов.
[00168] В некоторых вариантах осуществления настоящее изобретение относится к способам лечения состояния или заболевания, связанного с PD-L1, у индивидуума, включающим введение терапевтически эффективного количества антитела против PD-L1 или его антигенсвязывающего фрагмента. В некоторых вариантах осуществления индивидуум идентифицирован как страдающий заболеванием или состоянием, которое может отвечать на антагонист PD-L1.
[00169] Присутствие или уровень PD-L1 в интересующем биологическом образце может свидетельствовать о том, отвечает ли индивидуум, у которого был получен биологический образец, на антагонист PD-L1. Для определения присутствия или уровня PD-L1 в тестируемом биологическом образце индивидуума могут быть использованы различные методы. Например, испытуемый биологический образец может быть подвергнут воздействию антитела против PD-L1 или его антигенсвязывающего фрагмента, которые связываются с экспрессированным белком PD-L1 и детектируют его. Альтернативно, PD-L1 также может быть обнаружен на уровне экспрессии нуклеиновой кислоты, используя такие методы, как qПЦР, ПЦР с обратной транскриптазой, микрочип, SAGE, FISH и тому подобное. В некоторых вариантах осуществления исследуемый образец получают из злокачественной клетки или ткани или из инфильтрирующих опухоль иммунных клеток. В некоторых вариантах осуществления присутствие или повышенный уровень PD-L1 в исследуемом биологическом образце указывает на вероятность отвечаемости. Термин «активированный», как используется в настоящем документе, относится к общему увеличению не менее чем на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80% или более уровня белка PD-L1 в исследуемом образце, как определено с использованием антител или антигенсвязывающих фрагментов, предложенных в настоящем документе, по сравнению с уровнем белка PD-L1 в эталонном образце, как определено с использованием того же антитела. Эталонным образцом может быть контрольный образец, полученный у здорового индивидуума или индивидуума, не страдающего заболеванием, или образец здорового материала, или образец материала без заболевания, взятый у того же индивидуума, у которого получен тестируемый образец. Например, эталонный образец может быть образцом материала без заболевания, образцом прилегающего материала или образцом соседнего материала по отношению к тестируемому образцу (например, опухоли).
[00170] Антитела или антигенсвязывающие фрагменты, описанные в настоящем документе, могут быть введены отдельно или в комбинации с одним или несколькими дополнительными терапевтическими средствами или агентами. Например, антитела или антигенсвязывающие фрагменты, описанные в настоящем документе, могут быть введены в комбинации с химиотерапией, лучевой терапией, хирургическим вмешательством для лечения злокачественного новообразования (например, туморэктомия), с одним или несколькими противоотечными средствами или с другими методами лечения осложнений, возникающих в результате химиотерапии, или с каким-либо иным терапевтическим средством для использования при лечении злокачественного новообразования или любого заболевания, опосредованного PD-L1. В некоторых из этих вариантов осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем документе, которые вводят в комбинации с одним или несколькими дополнительными терапевтическими средствами, могут быть введены одновременно с одним или несколькими дополнительными терапевтическими средствами, и в некоторых из этих вариантов осуществления антитело или антигенсвязывающий фрагмент и дополнительное(ые) терапевтическое(ие) средство(а) могут быть введены в составе той же фармацевтической композиции. Однако антитело или антигенсвязывающий фрагмент, вводимые «в комбинации» с другим терапевтическим средством, необязательно вводить одновременно или в том же составе, что и средство. Предполагается, что антитело или антигенсвязывающий фрагмент, вводимые до или после другого средства, вводят «в комбинации» с этим средством, как эта фраза используется в настоящем документе, даже если антитело или антигенсвязывающий фрагмент и второй агент вводятся разными путями. По возможности, дополнительные терапевтические средства, вводимые в комбинации с антителами или антигенсвязывающими фрагментами, описанными в настоящем документе, вводятся в соответствии с графиком, указанным в информационном листе продукта дополнительного терапевтического агента, или в соответствии с настольным справочником врача 2003 (Physicians' Desk Reference, 57th Ed; Medical Economics Company; ISBN: 1563634457; 57th edition (November 2002)) или протоколами, хорошо известными в данной области.
[00171] В некоторых вариантах осуществления терапевтические средства могут индуцировать или стимулировать иммунный ответ против злокачественного новообразования. Например, противоопухолевая вакцина может быть использована для индукции иммунного ответа на определенную опухоль или злокачественное новообразование. Для улучшения презентации опухолевого антигена в иммунной системе также может быть использована цитокиновая терапия. Примеры цитокиновой терапии включают, но ими не ограничиваются, интерфероны, такие как интерферон-α, -β и -γ, колониестимулирующие факторы, такие как макрофагальный КСФ, гранулоцитарно-макрофагальный КСФ и гранулоцитарный КСФ, интерлейкины, такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11 и IL-12, факторы некроза опухоли, такие как TNF-α и TNF-β. Также могут быть использованы средства, которые инактивируют иммуносупрессивные мишени, например, ингибиторы TGF-бета, ингибиторы IL-10 и ингибиторы Fas-лиганда. Другая группа средств включает такие средства, которые активируют иммунный ответ на опухолевые или злокачественные клетки, например, улучшают активацию Т-клеток (например, агонист костимулирующих молекул Т-клеток, таких как CTLA-4, ICOS и OX-40), и средства, которые усиливают функцию дендритных клеток и презентацию антигена.
[00172] Настоящее изобретение относится также к способам контроля терапевтического ответа или прогрессирования заболевания у индивидуума, получавшего лечение антагонистом PD-L1, включающим определение присутствия или уровня PD-L1 (например, человека или обезьяны) в исследуемом биологическом образце индивидуума с помощью антитела против PD-L1 или его антигенсвязывающего фрагмента, предложенных в настоящем документе. В некоторых вариантах осуществления способы дополнительно включают сравнение уровня PD-L1 в тестируемом биологическом образце с уровнем PD-L1 в сравниваемом образце, ранее полученном от того же индивидуума, где снижение, или замедление, или остановка увеличения уровня PD-L1 в исследуемом биологическом образце указывает на положительный терапевтический ответ или контролируемое прогрессирование заболевания. Сравниваемый образец может быть образцом того же типа, что и исследуемый образец, но полученным от того же индивидуума перед началом лечения или на более ранней стадии лечения.
[00173] Следующие примеры приведены для лучшей иллюстрации заявленного изобретения и не должны рассматриваться как ограничивающие объем изобретения. Все конкретные композиции, материалы и способы, описанные ниже, полностью или частично подпадают под объем настоящего изобретения. Эти конкретные композиции, материалы и способы не предназначены для ограничения изобретения, а даны просто для иллюстрации конкретных вариантов осуществления, подпадающих под объем изобретения. Специалист в данной области может создать эквивалентные композиции, материалы и способы без проявления изобретательской способности и не выходя за рамки изобретения. Понятно, что в способах, описанных в настоящем документе, может быть сделано большое число вариаций, которые остаются в пределах настоящего изобретения. Авторы изобретения предполагают, что такие вариации включены в объем изобретения.
[00174] ПРИМЕР 1. Получение гибридомы, продуцирующей антитела
[00175] 1.1 Иммунизация: Самок крыс OMT (полученные от компании Open Monoclonal Technology, Inc., Пало-Альто, США, в возрасте 8-10 недель) примировали 10 мкг белка PD-L1 ECD человека в TiterMax посредством инъекции в подушечку стопы, а затем делали бустер инъекцию каждый 3 дня белком PD-L1 ECD в адъюванте алюминиевом фосфатном геле посредством инъекции в подушечку стопы до момента слияния. Титры антител против PD-L1 в сыворотке каждую вторую неделю анализировали с помощью ELISA или FACS.
[00176] 1.2 Слияние клеток: За три дня до слияния животным вводили посредством внутрибрюшинной инъекции последнюю бустерную инъекцию 10 мкг белка PD-L1 ECD человека в PBS. В день слияния вырезали лимфатические узлы и готовили с получением суспензии отдельных клеток. Полученные лимфоциты смешивали с клетками миеломы (Р3) в соответствующей пропорции. Смесь клеток промывали и повторно суспендировали при 2,0×106 клеток/мл в растворе ECF. Слияние осуществляли, используя электрический аппарат BTX 2000.
[00177] 1.3 Первичный и вторичный скрининг супернатантов гибридомы: После культивирования в течение 7-14 дней при 37°C, часть супернатанта гибридомы исследовали с помощью анализа на Mirrorball. Коротко, супернатант гибридомы разводили 5 раз в 1×PBS. Клетки CHO-K1, экспрессирующие PD-L1, смешивали со вторичным антителом, меченным фторохромом, и DraQ5. В каждую лунку 384-луночного планшета добавляли 20 мкл клеточной смеси и 20 мкл разбавленного образца супернатанта гибридомы и инкубировали в течение по меньшей мере 2 часов при комнатной температуре в темноте до тех пор, пока они не были готовы для анализа на высокочувствительном микропланшетном цитометре Mirrorball®. Положительные результаты подтверждали с помощью FACS, используя клетки CHO-K1, экспрессирующие PD-L1. Клетки окрашивали образцами супернатантов гибридомы, затем окрашивали вторым антителом с FITC, конъюгированным с антителом козла к IgG Fc мыши. В качестве отрицательных контролей использовали соответствующие родительские клеточные линии. Окрашенные клетки анализировали с помощью BD Biosciences FACSCanto II и программного обеспечения FlowJo Version.
[00178] 1.4 Субклон: Для субклонирования использовали клеточные линии гибридомы с подтвержденным положительным связыванием с клетками, экспрессирующими PD-L1. Коротко, для каждой линии клеток подсчитывали гибридомы клетки и разводили, получая 5 или 1 клетку на 200 мкл в среде для клонирования. Помещали по 200 мкл/лунка в 96-луночные планшеты. Планшеты инкубировали при 37°C, 5% CO2, до готовности к следующему анализу.
[00179] 1.5 Тест изотипа: Планшеты ELISA покрывали по 50 мкл/лунка антителами козла против IgG1, IgG2a, IgG2b, IgG3, IgA и IgM крысы при 1 мкг/мл, соответственно. После блокирования в каждую лунку добавляли по 50 мкл образцов супернатантов гибридомы и инкубировали при комнатной температуре в течение 2 часов. В качестве детектирующего антитела использовали антитела козла против легкой цепи каппа-HRP крысы. Цветовую реакцию стимулировали с использованием субстрата TMB в течение 10 минут и останавливали с помощью 2М HCl. Затем планшеты считывали при 450 нм на считывателе микропланшетов ELISA.
[00180] 1.6 Анализ связывания на основе клеток: Для исследования активности связывания полных антител человека с мишенью, клетки CHO-K1, которые экспрессируют PD-L1 человека, или зрелые дендритные клетки (mDC) окрашивали полными антителами человека, затем окрашивали вторым антителом с FITC, конъюгированным с антителом козла к IgG Fc человека. В качестве отрицательных контролей использовали соответствующие родительские клеточные линии. Окрашенные клетки анализировали с помощью BD Biosciences FACSCanto II и программного обеспечения FlowJo Version.
[00181] Клетки СНО, трансфицированные полноразмерным PD-L1 человека, окрашивали антителами против PD-L1 человека из гибридомы крыс, затем окрашивали вторым антителом с FITC, конъюгированным с антителом козла к IgG Fc крысы, и анализировали с помощью FACS. Как показано на фигуре 1, антитела 1.4.1, 1.14.4, 1.20.15 и 1.46.11 специфически связываются с PD-L1, экспрессируемым на клетках CHO, со значениями EC50, равными приблизительно 1 нМ.
[00182] ПРИМЕР 2. Изменение части Fc и очистка
[00183] Затем антитела в супернатанте культуры клеток 293F очищали с использованием аффинной хроматографии на основе белка А.
[00184] ПРИМЕР 3. Характеристика полного антитела человека
[00185] 3.1 Конкурентный FACS-анализ: Для проверки того, могут ли полные антитела человека блокировать связывание PD-L1 с PD-1, клетки CHO-K1, экспрессирующие PD-L1 человека, инкубировали с полными антителами человека при различных концентрациях при 4°C в течение 1 часа. Несвязанные антитела смывали, и затем к клеткам добавляли PD-1 человека, с тагом Fc мыши. Связывание PD-1 человека с клеткой, экспрессирующей PD-L1, определяли с использованием антитела козла против IgG мыши, конъюгированного с FITC, а затем анализировали, используя BD Biosciences FACSCanto II и программное обеспечение FlowJo Version.
[00186] Клетки CHO, экспрессирующие PD-L1 человека, инкубировали с полными антителами человека при различных концентрациях (1.4.1, 1.14.4, 1.20.15 и 1.46.11). Затем к клеткам добавляли PD-1 человека с тагом Fc мыши. Связывание PD-1 человека с клеткой, экспрессирующей PD-L1, определяли с антителом козла против IgG мыши, конъюгированного с FITC, а затем FACS-анализом. Как показано на фигуре 2, все исследуемые полные антитела PD-L1 человека блокировали связывание PD-1 с PD-L1, экспрессируемым на трансфецированных клетках CHO, и 1.14.4, 1.20.15 и 1.46.11 показали значение IC50, равное приблизительно 10 нМ.
[00187] 3.2 Анализ аффинности методом поверхностного плазмонного резонанса (SPR): Аффинность и кинетика связывания с PD-L1 антител были охарактеризованы с помощью анализа SPRс использованием ProteOn XPR36 (Bio-Rad). Белок A (Sigma) иммобилизовали на сенсорный чип GLM (Bio-Rad) через аминную связь. Очищенные антитела пропускали через сенсорный чип и их захватывал белок А. Чип поворачивали на 90° и промывали электродным буфером (1×PBS/0,01% Tween20, Bio-Rad) до тех пор, пока исходный уровень не становился стабильным. Пять концентраций PD-L1 человека и электродный буфер пропускали против измерительной ячейки с антителом со скоростью потока 100 мкл/мин для фазы ассоциации за 240 сек с последующей диссоциацией 600 сек. Чип регенерировали при pH 1,7 H3PO4 после каждого прогона. Кривую ассоциации и диссоциации подгоняли под модель связывания Лангмюра 1:1, используя программное обеспечение ProteOn.
[00188] Как показано на фигуре 5, аффинность полных антител PD-L1 человека к рекомбинантным PD-L1 человека составила от 4,78E-10 до 2,26E-10 моль/л, как определено способом поверхностного плазмонного резонанса.
[00189] 3.3 Исследование аффинности с помощью FACS: Аффинность связывания антител к PD-L1 на поверхности клеток осуществляли с помощью анализа FACS, используя клетки CHO-K1, экспрессирующие PD-L1 человека. Тестируемые антитела последовательно разводили 1 в 2 в промывочном буфере (1×PBS/1% BSA) и инкубировали с клетками при 4°C в течение 1 часа. Добавляли второе антитело козла против IgG1 Fc человека FITC (Jackson Immunoresearch Lab) и инкубировали при 4°C в темноте в течение 1 часа. Клетки затем промывали один раз и ресуспендировали в 1×PBS/1% BSA и анализировали с помощью проточной цитометрии (BD). Интенсивность флуоресценции будет меняться при связывании молекул/клеток, располагающихся на количественно оцениваемых бусинах QuantumTM MESF Kits (Bangs Laboratories, Inc.). KD рассчитывали с использованием Graphpad Prism5.
[00190] 3.4 Функциональный анализ in vitro: Для оценки способности полных антител человека модулировать ответ Т-клеток, включая продукцию цитокинов и клеточную пролиферацию, проводили следующие три анализа.
[00191] 3.4.1 Аллогенная MLR: Моноциты выделяли у здоровых доноров с использованием набора для обогащения человеческих моноцитов в соответствии с инструкцией производителя. Клетки культивировали в течение 5-7 дней для дифференцировки в дендритные клетки (DC). За 18-24 часа перед использованием в культуру клеток добавляли 1 мкг/мл LPS для индукции созревания DC.
[00192] CD4+ Т-клетки выделяли, используя набор для обогащения CD4+ T-клеток человека в соответствии с протоколом производителя, и затем стимулировали зрелыми или незрелыми DC в присутствии или в отсутствие полных антител человека или контрольных Ab. Уровни IL-2 и IFNγ в супернатанте культуры измеряли с помощью ELISA на 3-й и 5-й день, соответственно. Пролиферацию CD4+ Т-клеток оценивали по включению [3H] тимидина.
[00193] Как показано на фигуре 9, все исследуемые полные антитела PD-L1 человека (1.4.1, 1.14.4, 1.20.15 и 1.46.11) повышали секрецию IL-2 дозозависимым образом. Как показано на фигуре 8, все исследуемые полные антитела PD-L1 человека (1.4.1, 1.14.4, 1.20.15 и 1.46.11) повышали секрецию IFNγ дозозависимым образом. Как показано на фигуре 10, все тестированные полные антитела PD-L1 человека (1.4.1, 1.14.4, 1.20.15 и 1.46.11) усиливали пролиферацию Т-клеток, зависящим от концентрации образом.
[00194] 3.4.2 Аутологичный Ag-специфический иммунный ответ: РВМС и моноциты выделяли у одного и того же донора. PBMC культивировали в присутствии пептида CMV pp65 и при низкой дозе IL2 (20 Ед/мл). Одновременно путем культивирования моноцитов получали DC, как уже упоминалось ранее. Через 5 дней в DC вводили пептид pp65 и затем добавляли к CD4+ Т-клеткам в присутствии или в отсутствие полных антител человека или контрольного Ab. Уровни IL-2 и IFNγ в супернатанте культуры измеряли с помощью ELISA на 3-й и 5-й день, соответственно. Пролиферацию CMVpp65-специфических CD4+ Т-клеток оценивали по включению [3H] тимидина.
[00195] Как показано на фигуре 6, продукция IFNγ при специфическом Т-клеточном ответе усиливалась под действием полных антител человека PD-L1 (1.4.1, 1.14.4, 1.20.15 и 1.46.11). На фигуре 7 показано, что полные антитела PD-L1 человека усиливали зависимым от концентрации образом пролиферацию CMV+-CD4+ T-клеток, стимулированную аутологичными DC, нагруженными pp65 CMV.
[00196] 3.4.3 Анализ супрессии T reg: Регуляторные Т-клетки (T reg) являются ключевым иммунным модулятором и играют основную роль в поддержании аутотолератности. CD4+CD25+ T reg связаны с опухолями, потому что увеличение числа T reg было обнаружено у пациентов с разными злокачественными заболеваниями и ассоциированы с неблагоприятным прогнозом. Для непосредственной оценки эффекта полных антител против PD-L1 человека на ингибирующую функцию T reg, авторы сравнивали функцию T reg в присутствии или в отсутствие полных антител человека или контрольного Ab. Коротко, CD4+CD25+ T reg и CD4+CD25- Т-клетки разделяли с помощью MACS. CD4+CD25+ T reg и CD4+CD25- Т-клетки (отношение T reg:T eff 1:1) совместно культивировали с аллогенными mDC в присутствии или в отсутствие полных антител человека или контрольного Ab при разных концентрациях. В качестве отрицательного контроля использовали либо антитело, либо изотипическое антитело. Продукцию цитокинов и пролиферацию Т-клеток измеряли, как упоминалось ранее.
[00197] Как показано на фигуре 11, антитело PD-L1 1.20.15 нейтрализовало супрессорную функцию T reg и восстанавливало ответную пролиферацию Т-клеток и секрецию IFNγ.
[00198] 3.5 Анализ антителозависимой клеточной цитотоксичности (ADCC) и комплементзависимой цитотоксичности (CDC): Так как PD-L1 человека экспрессируется различными типами клеток, а также здоровыми и опухолевыми клетками, то для того, чтобы минимизировать нежелательную токсичность на здоровые PD-L1+ клетки, подтверждали тот факт, что отобранные полные антитела против PD-L1 человека не обладают функциями ADCC и CDC.
[00199] 3.5.1 ADCC: Клетки-мишени (mDC) и полные антитела человека при различных концентрациях предварительно инкубировали в 96-луночных планшетах в течение 30 мин, затем добавляли PBMC, активированный IL-2, (эффектор) в соотношении эффектор/мишень 50:1. Планшеты инкубировали в течение 6 часов в инкубаторе при 37°C при 5% CO2. Лизис клеток-мишеней определяли с помощью набора для определения цитотоксичности (Roche). Оптическую плотность измеряли с помощью планшет-ридера Molecular Devices SpectraMax M5e. В качестве положительного и отрицательного контроля использовали контрольное hAb (IgG1) и контрольное hAb (IgG4), соответственно.
[00200] Используя PBMC, активированные IL-2, в качестве источника природных киллеров (NK) клеток и mDC, экспрессирующих высокие уровни клеточной поверхности PD-L1, в качестве клеток-мишеней, полные антитела PD-L1 человека (1.4.1, 1.14.4, 1.20.15 и 1.46.11) не опосредовали ADCC (фигура 12).
[00201] 3.5.2 CDC: Клетки-мишени (mDC), разбавленный комплемент сыворотки человека (Quidel-A112) и полные антитела человека при различных концентрациях смешивали в 96-луночном планшете. Планшет инкубировали в течение 4 ч при 37°C в инкубаторе с 5% СО2. Лизис цельных клеток определяли с помощью CellTiter glo (Promega-G7573). В качестве положительного контроля использовали Rituxan (Roche) и клеточную линию лимфомы человека Raji (CD20 положительный). Как показано на фигуре 13, полные антитела PD-L1 человека не опосредовали CDC.
[00202] 3.6 Анализ сортировки антитела в зависимости от связываемого эпитопа с помощью FACS: Чтобы проверить, находятся ли антитела человека в одной и той же группе по связыванию с эпитопом с контрольным антителом, клетки CHO-K1, экспрессирующие PD-L1 человека, инкубировали с различными концентрациями полностью человеческих антител при 4°C в течение 1 часа. Не связавшиеся антитела смывали, и затем к клеткам добавляли меченное биотином контрольное Ab. Связывание меченного биотином контрольного Ab с клетками, экспрессирующими PD-L1, определяли с использованием конъюгированного с PE стрептавидина с последующим анализом с использованием BD Biosciences FACSCanto II и программного обеспечения FlowJo Version.
[00203] Результаты исследования сортировки показали, что эпитоп человека PD-L1, связанный с полным антителом PD-L1 человека (то есть 1.4.1, 1.14.4, 1.20.15 и 1.46.11), отличается от существующих антител PD-L1 (то есть контрольное антитело).
[00204] 3.7 Анализ перекрестного связывания: Перекрестную реактивность Ab по отношению к PD-L1 яванского макака и мыши определяли с помощью ELISA. PD-L1 человека, яванского макака и мыши наносили на планшеты для ELISA, соответственно. После блокирования в планшеты добавляли полные антитела человека и инкубировали при комнатной температуре в течение по меньшей мере 2 часов. Связывание антител с покрытыми антигенами определяли с использованием антитела козла против IgG Fc-HRP человека. Цветовую реакцию стимулировали с помощью субстрата TMB и останавливали с помощью 2М HCl. Планшеты для ELISA анализировали при 450 нм, используя ридер для микропланшетов Molecular Device M5e.
[00205] Как показано на фигуре 4, результат эксперимента ELISA показал, что тестируемое полное антитело PD-L1 человека связывается с PD-L1 яванского макака зависимым от дозы образом. Однако ни одно из исследуемых антител (1.4.1, 1.14.4, 1.20.15 и 1.46.11) не связывалось с мышиным PD-L1.
[00206] 3.8 Анализ перекрестного связывания внутри семейства с помощью FACS: Для изучения активности перекрестного связывания внутри семейства полных антител человека, линии клеток, которые экспрессируют PD-L2, окрашивали полными антителами человека, затем окрашивали вторым антителом с FITC, конъюгированным с антителом козла к IgG Fc человека. В качестве положительного контроля использовали клетки, экспрессирующие PD-L1. В качестве отрицательных контролей использовали соответствующие родительские клеточные линии. Окрашенные клетки анализировали с помощью BD Biosciences FACSCanto II и программного обеспечения FlowJo Version.
[00207] Клетки СНО, трансфицированные PD-L1 или PD-L2, окрашивали полными антителами PD-L1 человека и анализировали с помощью FACS. Как показано на фигуре 3, полные антитела PD-L1 человека специфически связывались с PD-L1, но не связывались с PD-L2 семейства лигандов PD-1.
[00208] ПРИМЕР 4. Эпитопное картирование полного человеческого антитела
[00209] Для определения эпитопов антитело 1.14.4, предложенное в настоящем документе, исследовали с помощью аланинового сканирования на hPD-1 и осуществляли оценку эффекта связывания антитела с использованием 1.14.4.
[00210] Проводили исследования с помощью аланинового сканирования на hPD-L1 и оценивали его влияние на связывание антител. Аланиновые остатки на hPD-L1 мутировали в глициновые кодоны, а все остальные остатки мутировали в аланиновые кодоны. Для каждого остатка внеклеточного домена hPD-L1 (ECD) точечные аминокислотные замены выполняли с использованием двух последовательных этапов ПЦР. Плазмиду pcDNA3.3-hPD-L1_ECD.His, которая кодирует ECD PD-L1 человека и C-концевой His-tag, использовали в качестве матрицы, и набор мутагенного праймера использовали для первой стадии ПЦР с использованием набора для сайт-направленного мутагенеза QuikChange lightning multi (Agilent technologies, Palo Alto, CA). Эндонуклеазу Dpn I использовали для обработки родительской матрицы после реакции синтеза мутантных цепей. На второй стадии ПЦР линейную ДНК-экспрессионную кассету, которая состояла из промотора CMV, внеклеточного домена (ECD) PD-L1, His-tag и полиаденилирования тимидинкиназы (TK) вируса простого герпеса, амплифицировали и временно экспрессировали в клетки HEK293F (Life Technologies, Gaithersburg, MD).
[00211] Моноклональное антитело 1.14.4 наносили на планшеты для анализа связывания ELISA. После взаимодействия с супернатантом, который содержал определенное количество мутанта PD-L1 или PD-L1_ECD.His белка человека/мыши (Sino Biological, China), в качестве идентифицирующего антитела добавляли конъюгированное с HRP антитело против His (1:5000, Rockland Immunochemicals, Pottstown, PA). Поглощение нормализовали в соответствии со средним количеством контрольных мутантов. После определения дополнительного порогового значения кратности изменения связывания (<0,55) были идентифицированы конечные определяемые остатки эпитопа.
[00212] Проводили анализ активности связывания антител 1.14.4 как с человеческим, так и с мышиным PD-L1 (фигура 14). Было обнаружено, что ведущее в данном исследовании антитело 1.14.4 связывается с PD-L1 человека (фигура 14A), но не связывается с PD-L1 мыши (фигура 14B).
[00213] Эффект 131 точечных мутаций PD-L1 на связывание антитела показан в таблице 2. Проверка положения всех этих остатков на кристаллических структурах hPD-L1 (код PDB 3BIK и 4ZQK) показала, что некоторые аминокислоты (например, Gly159, Tyr160, Pro161) вряд ли могут напрямую контактировать с какими-либо антителами. Наблюдаемое сокращение связывания, скорее всего, было связано с нестабильностью или даже коллапсом структуры hPD-L1 после аланиновых замен. После определения дополнительного порогового значения кратности изменения связывания (<0,55) конечные определяемые остатки эпитопа представлены в таблице 3. В 1.14.4 имеется 6 положений.
[00214] Таким образом, все данные таблицы 3 были картированы на кристаллической структуре hPD-L1 для лучшей визуализации и сравнения (фигура 15).
[00215] Таблица 2. Влияние точечных мутаций PD-L1 на связывание антител
№ остатка
a Кратность изменения связывания относительно связывания с несколькими молчащими аланиновыми заменами.
[00216] Таблица 3. Идентификация возможных эпитопов
[00217] Как показано на фигуре 15, остатки активных участков, ответственных за связывание с hPD-L1, все собраны в цепи C, петле CC' и цепях F (фигура 15). Проверка положений остатков на кристаллических структурах комплекса hPD-1/hPD-L1 (код PDB 4ZQK, 4Å) выявила, что эти остатки в основном расположены в цепях A, C, F и G. Эпитопы антитела 1.14.4 в основном связаны с остатками на цепях С, которые имеют прямое перекрытие с сайтом взаимодействия с hPD-1 и hPD-L1, что указывает на механизмы в терминах связывания hPD-L1 и блокирования hPD-1.
[00218] ПРИМЕР 5: Ингибирование роста опухоли in vivo полным антителом hPD-L1 человека
[00219] Для оценки ингибирования антителом hPD-L1 роста опухоли, 42 самцам гуманизированных мышей B-hPD-1 инокулировали подкожно в переднее правое ребро 5×105 клеток/0,1 мл опухолевых клеток MC38-B7H1. Когда размер опухоли достигал приблизительно 100 мм3, мышей разделяли на группы (5 групп, 7 на группу) и вводили средства следующим образом: группа 1: носитель, группа 2: контрольное антитело BMK6 (см. подробное описание в WO2011066389A1), группа 3: 1.14.4, 3 мг/кг, группа 4: 1.14.4, 10 мг/кг и группа 5: 1.14.4, 30 мг/кг. Всем группам вводили внутрибрюшинную инъекцию один раз в два дня с шестью последовательными введениями. Животных непрерывно наблюдали еще две недели после окончания введения. Объем опухоли и вес тела измеряли два раза в неделю и регистрировали соотношение между изменением веса тела мыши и периодом введения, а также изменением объема опухоли и периодом введения. В конце эксперимента рассчитывали и статистически анализировали отношение объема опухоли в терапевтических группах и в контрольной группе, получавшей носитель, (T/C) и ингибирование роста опухоли (TGI). Т-тест выполняли с помощью Graphpad Prism 5, и статистически анализировали объем опухоли. P<0,05 рассматривали как имеющее существенную разницу.
[00220] Объем опухоли измеряли два раза в неделю, используя штангенциркуль, по длинному диаметру и короткому диаметру, и формула для расчета объема такая: объем опухоли=0,5×длинный диаметр×короткий диаметр2. Скорость роста опухоли рассчитывали на основе результатов измерения: T/C(%)=объем опухоли терапевтической группы/объем опухоли отрицательной контрольной группы×100%. Ингибирование роста опухоли TGI(%)=[1-(Ti-T0)/(Vi-V0)]×100, где Ti представляет собой средний объем опухоли терапевтической группы в день i, T0 представляет собой средний объем опухоли терапевтической группы в день 0, Vi представляет собой средний объем опухоли контрольной группы в день i, и V0 представляет собой средний объем опухоли контрольной группы в день 0.
[00221] Таблица 4. Противоопухолевые эффекты полного PD-L1-антитела человека 1.14.4 в отношении ксенотрансплантата рака толстой кишки у гуманизированных hPD-1 мышей MC38-B7H1
(мм3)
(%)
Примечания: a означает ± SE; b в сравнении с контролем.
[00222] Во время эксперимента вес животных в каждой группе не показывал значительного снижения (таблица 4 и фигура 16), что указывало на то, что исследуемые средства обладают хорошей переносимостью. Через 19 дней введения (то есть через 25 дней после инокуляции опухолевых клеток) объем опухоли в контрольной группе, получавшей носитель, достигал 2359 мм3, и по сравнению с контрольной группой, получавшей носитель, объемы опухолей в группах с высоким, средним и низким дозами антитела 1.14.4 показали значительное снижение (средний объем опухоли составил 949 мм3, 1416 мм3 и 1115 мм3, соответственно). Все три дозы антител проявляли значительные противоопухолевые эффекты, выраженные в TGI 62,8%, 42,0% и 55,4%, соответственно (таблица 4 и фигура 17). Контрольное антитело BMK6 также показало значительный противоопухолевый эффект (средний объем опухоли составил 1241 мм3, а TGI составил 49,7%). Таким образом, результаты показали, что антитело 1.14.4 проявляет значительный противоопухолевый эффект, а ингибирование для всех групп с высокими, средними и низкими дозами составляет более 40%.
[00223] Хотя данное изобретение было конкретно показано и описано со ссылкой на конкретные варианты осуществления (некоторые из которых являются предпочтительными вариантами осуществления), специалистам в данной области техники должно быть понятно, что в него могут быть внесены различные изменения по форме и в деталях, не отходя от духа и не выходя за рамки настоящего изобретения, описанного в настоящем документе.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> WuXi Biologics (Shanghai) Co. Ltd.
Open Monoclonal Technology, Inc
<120> НОВЫЕ АНТИТЕЛА ПРОТИВ PD-L1
<130> 053674-8006WO02
<160> 56
<170> PatentIn version 3.5
<210> 1
<211> 7
<212> Белок
<213> Homo sapiens
<400> 1
Ile Arg Thr Tyr Tyr Trp Gly
1 5
<210> 2
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 2
attagaactt actactgggg c 21
<210> 3
<211> 16
<212> Белок
<213> Homo sapiens
<400> 3
Tyr Ile Tyr Tyr Ser Gly Ser Thr Arg Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 4
<211> 48
<212> ДНК
<213> Homo sapiens
<400> 4
tatatctatt atagtgggag cacccgctac aacccgtccc tcaagagt 48
<210> 5
<211> 7
<212> Белок
<213> Homo sapiens
<400> 5
Leu Ser Tyr Phe Phe Asp Tyr
1 5
<210> 6
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 6
cttagctact tctttgacta c 21
<210> 7
<211> 11
<212> Белок
<213> Homo sapiens
<400> 7
Ser Gly Asp Lys Leu Gly Asp Lys Tyr Ala Cys
1 5 10
<210> 8
<211> 33
<212> ДНК
<213> Homo sapiens
<400> 8
tctggagata aattggggga taaatatgct tgc 33
<210> 9
<211> 7
<212> Белок
<213> Homo sapiens
<400> 9
Gln Asp Thr Lys Arg Pro Ser
1 5
<210> 10
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 10
caagatacca agcggccctc a 21
<210> 11
<211> 9
<212> Белок
<213> Homo sapiens
<400> 11
Gln Ala Trp Asp Ser Gly Thr Val Ile
1 5
<210> 12
<211> 27
<212> ДНК
<213> Homo sapiens
<400> 12
caggcgtggg acagcggcac tgtgata 27
<210> 13
<211> 5
<212> Белок
<213> Homo sapiens
<400> 13
Ser Tyr Ala Met Ser
1 5
<210> 14
<211> 15
<212> ДНК
<213> Homo sapiens
<400> 14
agctatgcca tgagt 15
<210> 15
<211> 17
<212> Белок
<213> Homo sapiens
<400> 15
Gly Ile Ser Gly Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 16
<211> 51
<212> ДНК
<213> Homo sapiens
<400> 16
ggtattagtg gtagtggtgg tttcacttac tacgcagact ccgtgaaggg c 51
<210> 17
<211> 12
<212> Белок
<213> Homo sapiens
<400> 17
Pro Pro Arg Gly Tyr Asn Tyr Gly Pro Phe Asp Tyr
1 5 10
<210> 18
<211> 36
<212> ДНК
<213> Homo sapiens
<400> 18
cctcctcgtg gatacaacta tggccctttt gactac 36
<210> 19
<211> 11
<212> Белок
<213> Homo sapiens
<400> 19
Gly Gly Asn Asn Ile Gly Ser Lys Ser Val His
1 5 10
<210> 20
<211> 33
<212> ДНК
<213> Homo sapiens
<400> 20
gggggaaaca acattggaag taaaagtgta cac 33
<210> 21
<211> 7
<212> Белок
<213> Homo sapiens
<400> 21
Asp Asp Ser Asp Arg Pro Ser
1 5
<210> 22
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 22
gatgatagcg accggccctc a 21
<210> 23
<211> 11
<212> Белок
<213> Homo sapiens
<400> 23
Gln Val Trp Asp Ser Ser Ser Asp His Val Val
1 5 10
<210> 24
<211> 33
<212> ДНК
<213> Homo sapiens
<400> 24
caggtgtggg atagtagtag tgatcacgtg gta 33
<210> 25
<211> 7
<212> Белок
<213> Homo sapiens
<400> 25
Ser Ile Ser Asn Tyr Trp Gly
1 5
<210> 26
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 26
agtattagta actactgggg c 21
<210> 27
<211> 16
<212> Белок
<213> Homo sapiens
<400> 27
Ser Ile Tyr Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Pro Leu Lys Ser
1 5 10 15
<210> 28
<211> 48
<212> ДНК
<213> Homo sapiens
<400> 28
agtatctatt atagtgggag cacgaactac aatccgcccc tcaagagt 48
<210> 29
<211> 7
<212> Белок
<213> Homo sapiens
<400> 29
Leu Thr Tyr Tyr Phe Asp Tyr
1 5
<210> 30
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 30
ctgacctact actttgatta c 21
<210> 31
<211> 11
<212> Белок
<213> Homo sapiens
<400> 31
Ser Gly Asp Lys Leu Gly Asp Lys Tyr Ala Cys
1 5 10
<210> 32
<211> 33
<212> ДНК
<213> Homo sapiens
<400> 32
tctggagata aattggggga taaatatgct tgc 33
<210> 33
<211> 7
<212> Белок
<213> Homo sapiens
<400> 33
Gln Asp Ser Lys Arg Pro Ser
1 5
<210> 34
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 34
caagatagca agcggccctc a 21
<210> 35
<211> 9
<212> Белок
<213> Homo sapiens
<400> 35
Gln Thr Trp Asp Ser Ser Thr Val Val
1 5
<210> 36
<211> 27
<212> ДНК
<213> Homo sapiens
<400> 36
cagacgtggg acagcagcac tgtggta 27
<210> 37
<211> 5
<212> Белок
<213> Homo sapiens
<400> 37
Ser Tyr Ala Met Ser
1 5
<210> 38
<211> 15
<212> ДНК
<213> Homo sapiens
<400> 38
agctatgcca tgagt 15
<210> 39
<211> 17
<212> Белок
<213> Homo sapiens
<400> 39
Gly Phe Ser Gly Ser Gly Phe Ile Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 40
<211> 51
<212> ДНК
<213> Homo sapiens
<400> 40
ggttttagtg gtagtggttt tattacatac tacgcagact ccgtgaaggg c 51
<210> 41
<211> 12
<212> Белок
<213> Homo sapiens
<400> 41
Pro Pro Arg Gly Tyr Asn Tyr Gly Pro Phe Asp Tyr
1 5 10
<210> 42
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Рекомбинантная
<400> 42
cctcctcgtg gatacaacta tggccctttt gactac 36
<210> 43
<211> 117
<212> Белок
<213> Homo sapiens
<400> 43
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ile Arg
20 25 30
Thr Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Thr Gly Leu Glu
35 40 45
Trp Met Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Leu Ser Tyr Phe Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 44
<211> 351
<212> ДНК
<213> Homo sapiens
<400> 44
cagctgcaac tgcaggagtc gggcccagga ctggtgaagc cttcggagtc cctgtccctc 60
acctgcactg tctctggtgg ctccatcagc attagaactt actactgggg ctggatccgc 120
cagcccccag ggacggggct ggagtggatg gggtatatct attatagtgg gagcacccgc 180
tacaacccgt ccctcaagag tcgagtcacc atatccgtag acacgtccaa gaaccagttc 240
tccctgaagc tgagctctgt gaccgccgca gacacggctg tgtattactg tgcgagactt 300
agctacttct ttgactactg gggccaggga accctggtca ccgtctcctc a 351
<210> 45
<211> 106
<212> Белок
<213> Homo sapiens
<400> 45
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Lys Leu Gly Asp Lys Tyr Ala
20 25 30
Cys Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Val Met Val Ile Tyr
35 40 45
Gln Asp Thr Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Leu Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ala Trp Asp Ser Gly Thr Val Ile
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 46
<211> 318
<212> ДНК
<213> Homo sapiens
<400> 46
tcctatgaac tgactcagcc accctcagtg tccgtgtccc caggacagac agccagcatc 60
acctgctctg gagataaatt gggggataaa tatgcttgct ggtatcagca gaagccaggc 120
cagtcccctg tgatggtcat ctatcaagat accaagcggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacagcc actctgacca tcagcgggac cctggctatg 240
gatgaggctg actattattg tcaggcgtgg gacagcggca ctgtgatatt cggcggaggg 300
accaagctga ccgtccta 318
<210> 47
<211> 121
<212> Белок
<213> Homo sapiens
<400> 47
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Gly Ser Gly Gly Phe Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Pro Pro Arg Gly Tyr Asn Tyr Gly Pro Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 48
<211> 363
<212> ДНК
<213> Homo sapiens
<400> 48
gaggtgcaac tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agctatgcca tgagttgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcaggt attagtggta gtggtggttt cacttactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gaaacctcct 300
cgtggataca actatggccc ttttgactac tggggccagg gaaccctggt caccgtctcc 360
tca 363
<210> 49
<211> 108
<212> Белок
<213> Homo sapiens
<400> 49
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 50
<211> 324
<212> ДНК
<213> Homo sapiens
<400> 50
tcctatgtgc tgactcagcc accctcggtg tcagtggccc caggacagac ggccaggatt 60
acctgtgggg gaaacaacat tggaagtaaa agtgtacact ggtaccagca gaagccaggc 120
caggcccctg tgctggtcgt ctatgatgat agcgaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacggcc accctgacca tcagcagggt cgaagccggg 240
gatgaggccg actattactg tcaggtgtgg gatagtagta gtgatcacgt ggtattcggc 300
ggagggacca agctgaccgt ccta 324
<210> 51
<211> 117
<212> Белок
<213> Homo sapiens
<400> 51
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Ile
20 25 30
Ser Asn Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Pro
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Thr Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Leu Thr Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly Met Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 52
<211> 351
<212> ДНК
<213> Homo sapiens
<400> 52
cagctgcagc tgcaggagtc gggcccagga ctggtgaagc cttcggagac cctgtccctc 60
acctgcactg tctctggtgg ctccatcagc agtattagta actactgggg ctggatccgc 120
cagcccccag ggaaggggct ggagtggatt gggagtatct attatagtgg gagcacgaac 180
tacaatccgc ccctcaagag tcgagtcacc atatccgtag acacgaccaa gaaccagttc 240
tccctgaagc tgagctctgt gaccgccgca gacacggctg tgtattactg tgcgagactg 300
acctactact ttgattactg gggccaggga atgctggtca ccgtctcctc a 351
<210> 53
<211> 106
<212> Белок
<213> Homo sapiens
<400> 53
Ser Tyr Asp Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Lys Leu Gly Asp Lys Tyr Ala
20 25 30
Cys Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Leu Leu Val Ile Gln
35 40 45
Gln Asp Ser Lys Arg Pro Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Phe Cys Gln Thr Trp Asp Ser Ser Thr Val Val
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 54
<211> 318
<212> ДНК
<213> Homo sapiens
<400> 54
tcctatgacc tgactcagcc accctcagtg tccgtctccc caggacagac agccagcatc 60
acctgctctg gagataaatt gggggataaa tatgcttgct ggtatcagca gaagccaggc 120
cagtcccctt tgctggtcat ccagcaagat agcaagcggc cctcagggat ccctgcgcga 180
ttctctggct ccaactctgg gaacacagcc actctgacca tcagcgggac ccaggctatg 240
gatgaggctg actatttctg tcagacgtgg gacagcagca ctgtggtatt cggcggaggg 300
accaagctga ccgtccta 318
<210> 55
<211> 121
<212> Белок
<213> Homo sapiens
<400> 55
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Phe Ser Gly Ser Gly Phe Ile Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Met Pro Pro Arg Gly Tyr Asn Tyr Gly Pro Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 56
<211> 363
<212> ДНК
<213> Homo sapiens
<400> 56
gaggtgcagt tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agctatgcca tgagttgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcaggt tttagtggta gtggttttat tacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa tacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gatgcctcct 300
cgtggataca actatggccc ttttgactac tggggccagg gaaccctggt caccgtctcc 360
tca 363
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ АНТИ-PD-1 АНТИТЕЛА | 2016 |
|
RU2729830C2 |
| НОВЫЕ АНТИ-CD19-АНТИТЕЛА | 2018 |
|
RU2791445C2 |
| НОВЫЕ МОЛЕКУЛЫ АГОНИСТИЧЕСКИХ АНТИ-TNFR2 АНТИТЕЛ | 2019 |
|
RU2840049C2 |
| PD-L1 специфические антитела | 2017 |
|
RU2756236C2 |
| Анти-PD-L1 и IL-2 цитокины | 2017 |
|
RU2769282C2 |
| СПЕЦИФИЧЕСКИЕ АНТИТЕЛА К PD-L1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2749109C2 |
| АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ ILT2, И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2832673C2 |
| АНТИ-TIGIT АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2732591C2 |
| АНТИТЕЛА К PD-1 И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2761640C2 |
| НОВЫЕ БИСПЕЦИФИЧНЫЕ ПОЛИПЕПТИДНЫЕ КОМПЛЕКСЫ ПРОТИВ CD3/CD19 | 2018 |
|
RU2788127C2 |
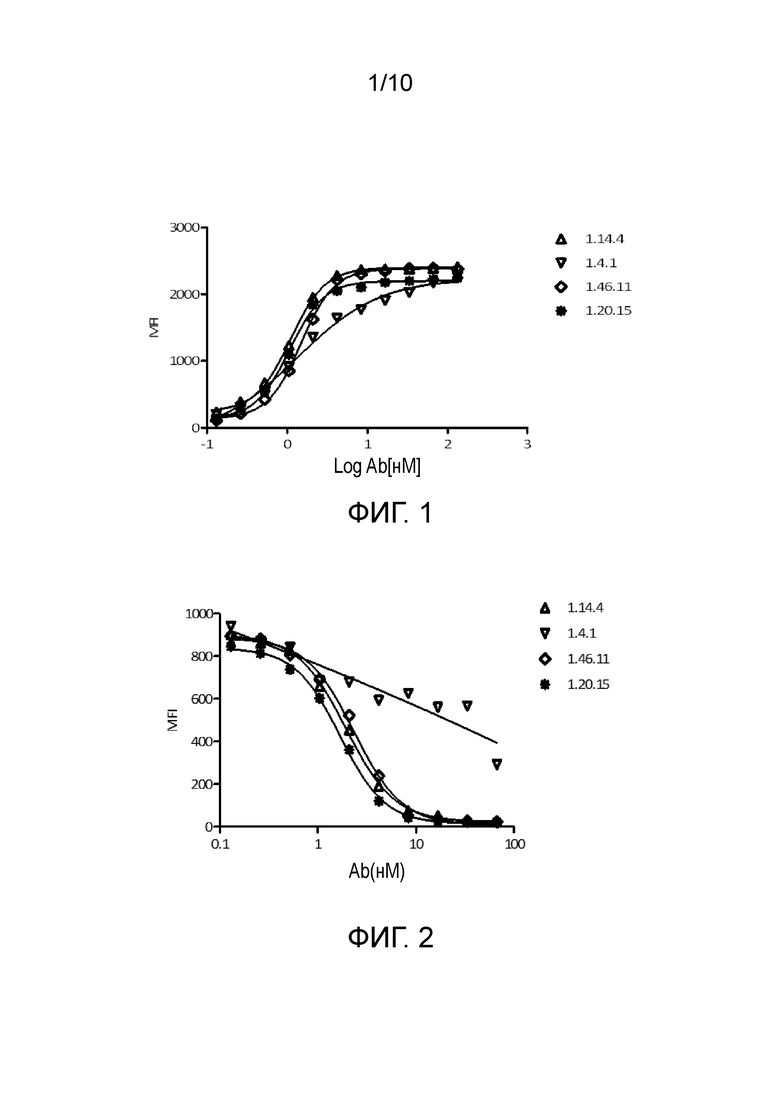
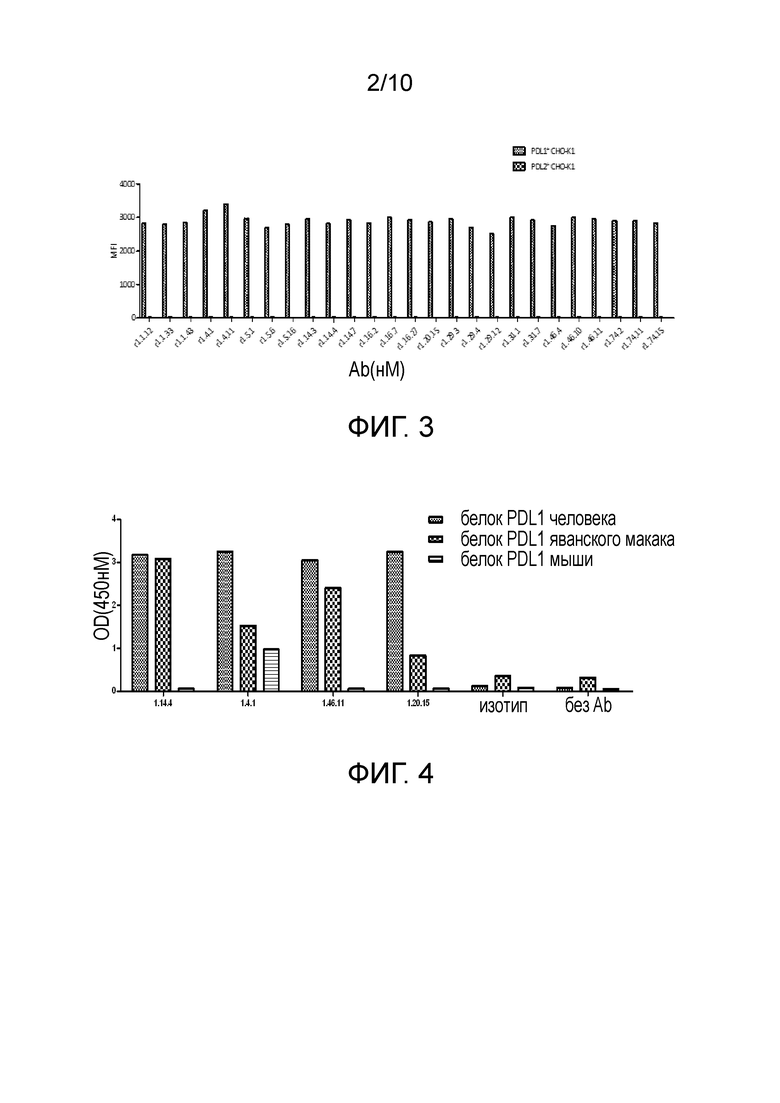
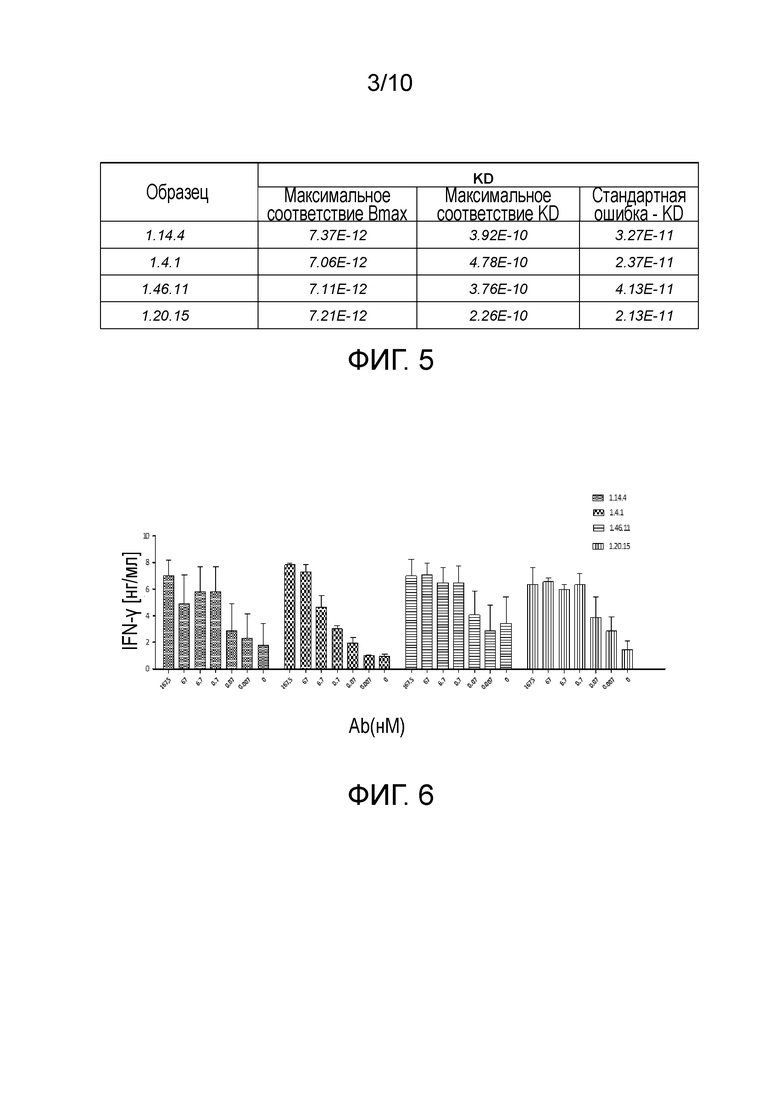
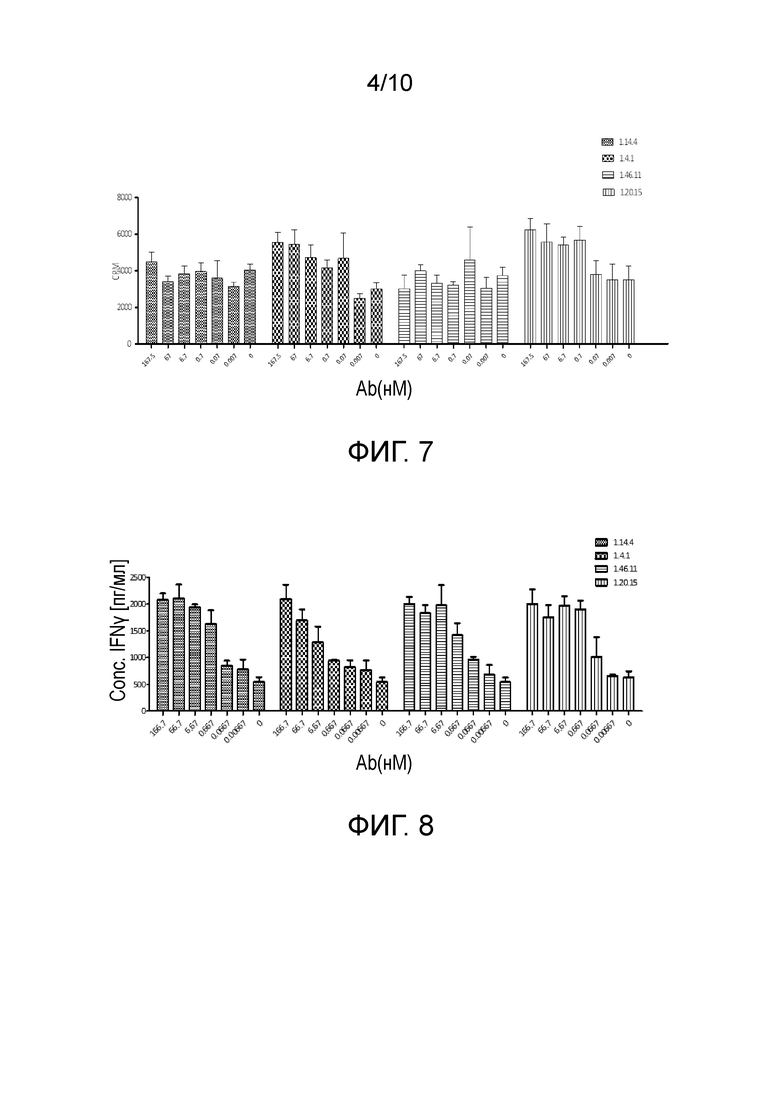
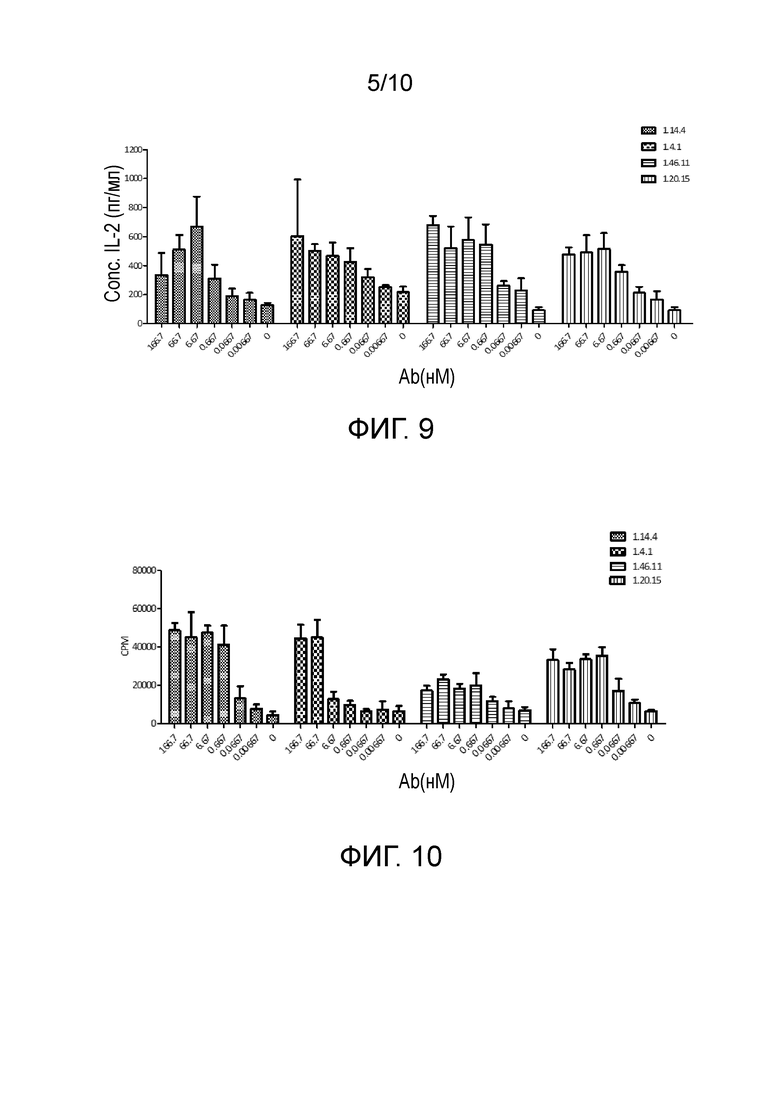
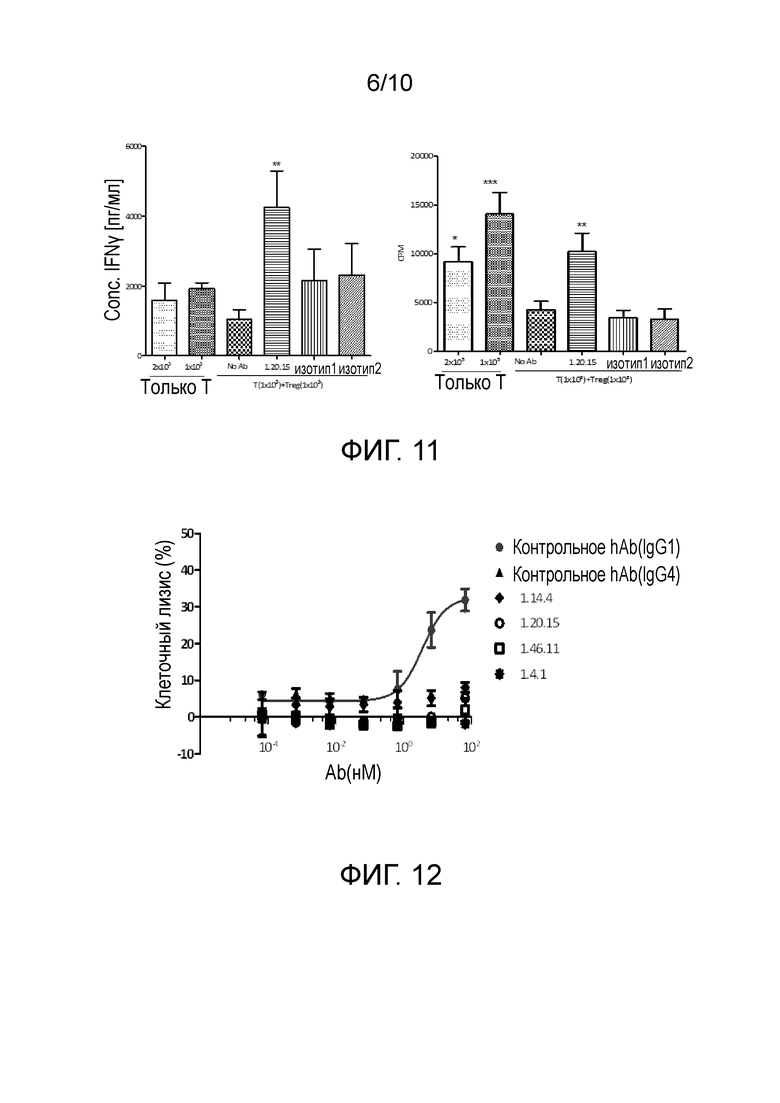
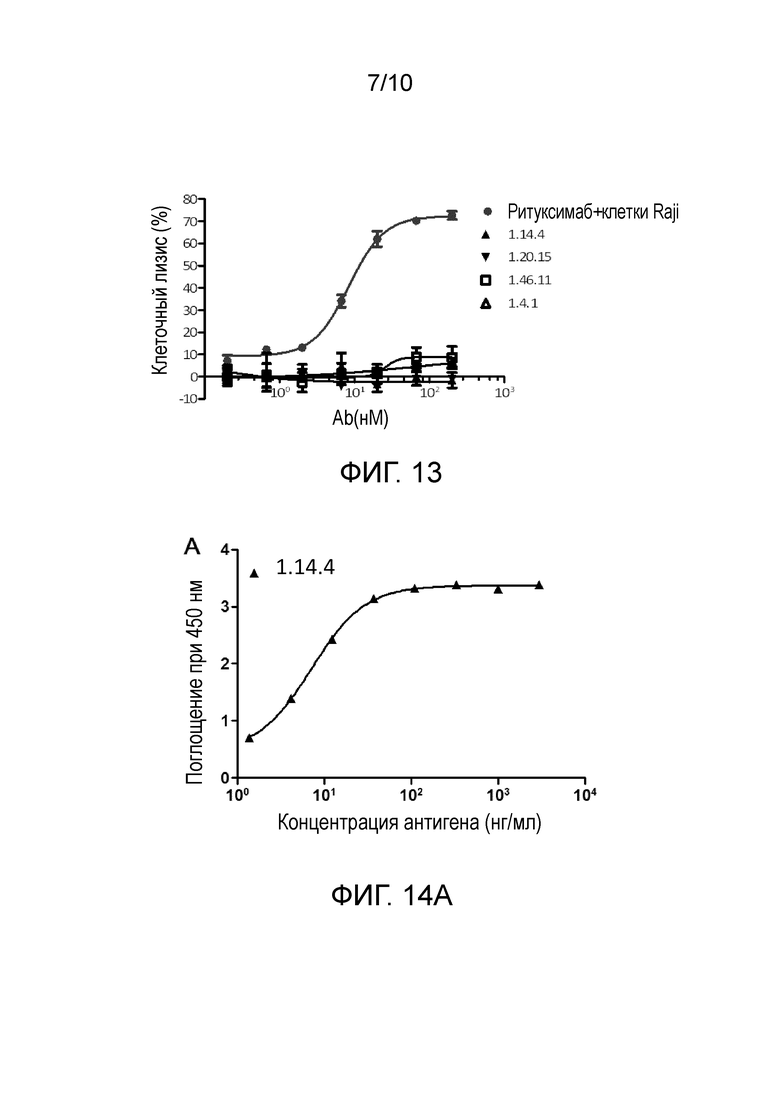
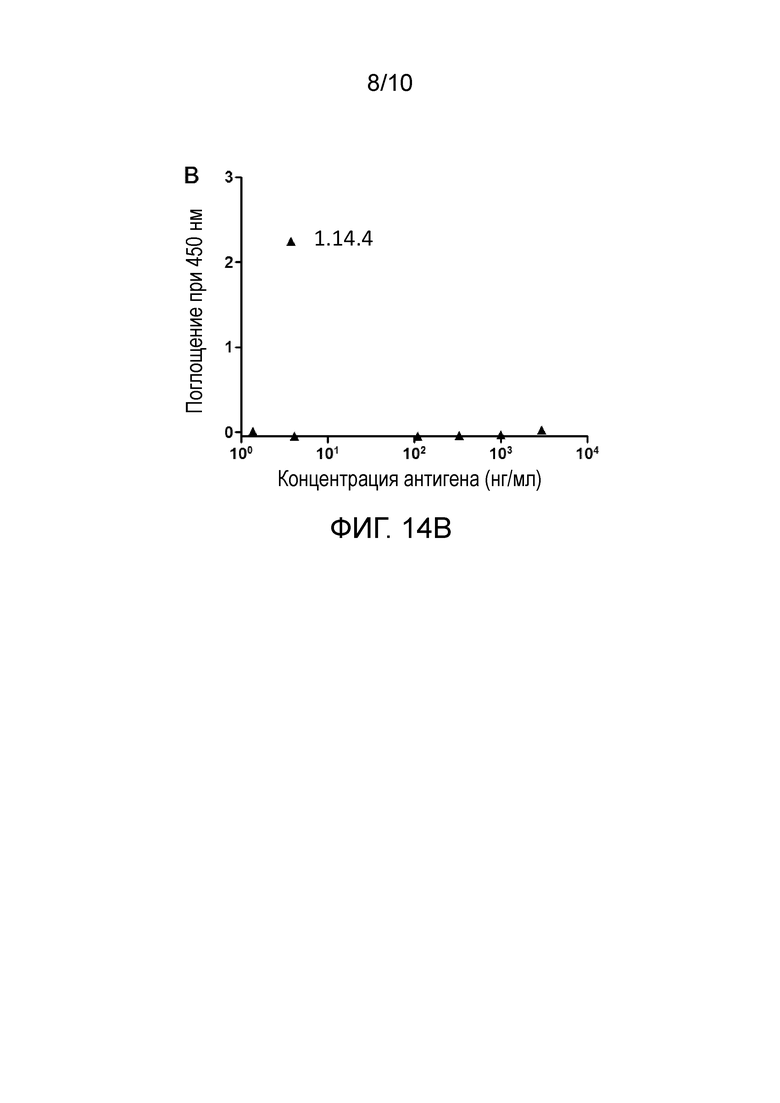

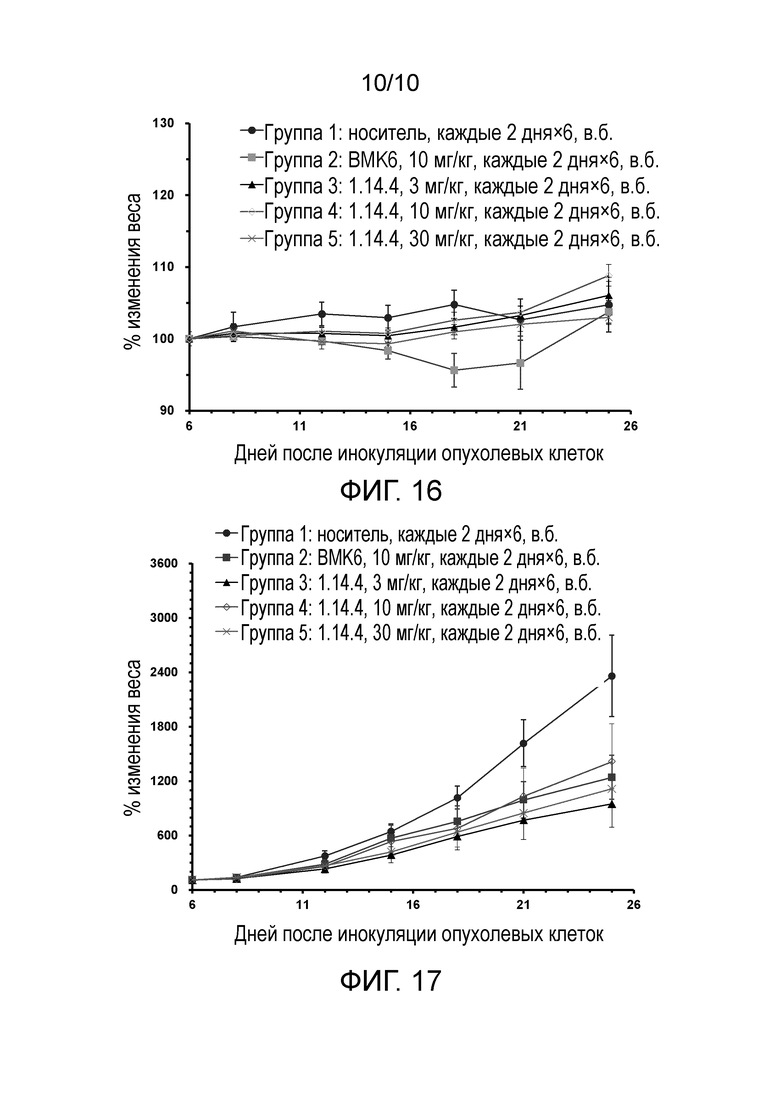
Настоящее изобретение относится к области иммунологии. Предложено анти-PD-L1-антитело или его антигенсвязывающий фрагмент, полинуклеотид, вектор экспрессии, клетка-хозяин. Также рассмотрен способ экспрессии антитела или его антигенсвязывающего фрагмента, набор, способ определения наличия или уровня PD-L1, способ идентификации индивидуума с расстройством или состоянием, которое может отвечать на антагонист PD-L1. Кроме того, предложен способ контроля терапевтического ответа или прогрессирования заболевания, фармацевтическая композиция, способ лечения, применение антитела или его антигенсвязывающего фрагмента. Данное изобретение может найти дальнейшее применение в терапии злокачественного новообразования или хронической вирусной инфекции, связанных с PD-L1. 12 н. и 18 з.п. ф-лы, 18 ил., 4 табл., 5 пр.
1. Выделенное анти-PD-L1 антитело или его антигенсвязывающий фрагмент, содержащее:
a) вариабельную область тяжелой цепи, содержащую CDR1 c SEQ ID NO:1, CDR2 c SEQ ID NO:3 и CDR3 c SEQ ID NO:5; и вариабельную область легкой цепи, содержащую CDR1 с SEQ ID NO:7, CDR2 c SEQ ID NO:9 и CDR3 c SEQ ID NO:11;
b) вариабельную область тяжелой цепи, содержащую CDR1 c SEQ ID NO:13, CDR2 c SEQ ID NO:15 и CDR3 c SEQ ID NO:17; и вариабельную область легкой цепи, содержащую CDR1 c SEQ ID NO:19, CDR2 с SEQ ID NO:21 и CDR3 c SEQ ID NO:23;
c) вариабельную область тяжелой цепи, содержащую CDR1 c SEQ ID NO:25, CDR2 с SEQ ID NO:27 и CDR3 c SEQ ID NO:29; и вариабельную область легкой цепи, содержащую CDR1 c SEQ ID NO:31, CDR2 с SEQ ID NO:33 и SEQ ID NO:35; или
d) вариабельную область тяжелой цепи, содержащую CDR1 c SEQ ID NO:37, CDR2 с SEQ ID NO:39 и CDR3 c SEQ ID NO:41, и вариабельную область легкой цепи, содержащую CDR1 c SEQ ID NO:19, CDR2 с SEQ ID NO:21 и CDR3 c SEQ ID NO:23.
2. Антитело или его антигенсвязывающий фрагмент по п.1, содержащее:
a) вариабельную область тяжелой цепи, содержащую SEQ ID NO:43; и вариабельную область легкой цепи, содержащую SEQ ID NO:45;
b) вариабельную область тяжелой цепи, содержащую SEQ ID NO:47; и вариабельную область легкой цепи, содержащую SEQ ID NO:49;
c) вариабельную область тяжелой цепи, содержащую SEQ ID NO:51; и вариабельную область легкой цепи, содержащую SEQ ID NO:53; или
d) вариабельную область тяжелой цепи, содержащую SEQ ID NO:55; и вариабельную область легкой цепи, содержащую SEQ ID NO:49.
3. Антитело или его антигенсвязывающий фрагмент по п.1 или 2, способное специфически связываться с PD-L1 человека при значении Kd не более 10-8 M, как измерено с помощью анализа плазменного резонансного связывания.
4. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих пунктов, которое связывается с PD-L1 обезьяны при EC50 не более 10 нМ или не более 1 нМ и/или не связывается с PD-L1 мыши.
5. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих пунктов, способное ингибировать связывание PD-L1 человека или обезьяны с его рецептором при IC50 не более 100 нМ.
6. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих пунктов, которое по существу не связывается с PD-L2.
7. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих пунктов, которое не опосредует ADCC или CDC, или и то, и другое.
8. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих пунктов, которое является полноразмерным моноклональным антителом человека.
9. Антитело или его антигенсвязывающий фрагмент по п.8, где полное моноклональное антитело человека получают с помощью трансгенной крысы.
10. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих пунктов, способное блокировать связывание PD-L1 человека с его рецептором и тем самым обеспечивать по меньшей мере одно из следующих действий:
a) индукцию продукции IL-2 в CD4+ T клетках;
b) индукцию продукции IFNγ в CD4+ T клетках;
с) индукцию пролиферации CD4+ T клеток и
d) восстановление супрессирующей функции T reg.
11. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих пунктов, которое представляет собой диатело, scFv, димер scFv, BsFv, dsFv, (dsFv)2, dsFv-dsFv', фрагмент Fv, Fab, Fab', F(ab')2, ds диатело.
12. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих пунктов, дополнительно содержащее константную область иммуноглобулина.
13. Антитело или его антигенсвязывающий фрагмент по любому из предшествующих пунктов, дополнительно содержащее конъюгат.
14. Выделенный полинуклеотид, кодирующий антитело или его антигенсвязывающий фрагмент по пп.1-13.
15. Вектор экспрессии, содержащий выделенный полинуклеотид по п.14.
16. Клетка-хозяин для экспрессии антитела или его антигенсвязывающего фрагмента, содержащая вектор по п.15.
17. Способ экспрессии антитела или его антигенсвязывающего фрагмента по любому из пп.1-13, включающий культивирование клетки-хозяина по п.16 в условиях, при которых экспрессируется полинуклеотид по п.14.
18. Набор для определения наличия или уровня PD-L1 в биологическом образце, отличающийся тем, что содержит антитело или его антигенсвязывающий фрагмент по любому из пп.1-13.
19. Набор по п.18, дополнительно содержащий инструкцию по применению и упаковку, которая разделяет каждый компонент в наборе.
20. Способ определения наличия или уровня PD-L1 человека или обезьяны в биологическом образце, включающий воздействие на биологический образец антителом или его антигенсвязывающим фрагментом по любому из пп.1-13 и определение наличия или уровня PD-L1 человека или обезьяны в образце.
21. Способ идентификации индивидуума с расстройством или состоянием, которое может отвечать на антагонист PD-L1, включающий: определение наличия или уровня PD-L1 в тестируемом биологическом образце индивидуума с помощью антитела или его антигенсвязывающего фрагмента по любому из пп.1-13, где присутствие или повышенный уровень PD-L1 в тестируемом биологическом образце указывает на вероятность ответа.
22. Способ по п.20, дополнительно включающий введение индивидууму терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп.1-13.
23. Способ контроля терапевтического ответа или прогрессирования заболевания у индивидуума, получающего лечение антагонистом PD-L1, включающий определение наличия или уровня PD-L1 в исследуемом биологическом образце индивидуума с помощью антитела против PD-L1 или антигенсвязывающего фрагмента по любому из пп.1-13.
24. Фармацевтическая композиция для лечения злокачественного новообразования или хронической вирусной инфекции, связанных с PD-L1, у пациента, содержащая эффективное количество антитела или его антигенсвязывающего фрагмента по любому из пп.1-13 и один или несколько фармацевтически приемлемых носителей.
25. Способ лечения состояния, связанного с PD-L1, у индивидуума, включающий введение индивидууму терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп.1-13.
26. Способ по п.24, где у индивидуума повышена экспрессия PD-L1.
27. Способ по п.24, где индивид страдает злокачественным новообразованием или хронической вирусной инфекцией.
28. Применение антитела или его антигенсвязывающего фрагмента по любому из пп.1-13 для получения лекарственного средства для лечения состояния, связанного с PD-L1.
29. Применение по п.28, где состоянием является злокачественное новообразование или хроническая вирусная инфекция.
30. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-13, где антитело или его антигенсвязывающий фрагмент связывается с эпитопом, содержащим по меньшей мере один из следующих аминокислотных остатков PD-L1: E58, E60, D61, K62, N63 и R113.
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| CN 101104640 A, 16.01.2008 | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Резиновая заготовка для подошв | 1929 |
|
SU19344A1 |
Авторы
Даты
2020-11-12—Публикация
2016-08-05—Подача