Область техники, к которой относится изобретение
Изобретение относится к противоопухолевой терапии. В одном аспекте настоящее изобретение относится к конъюгатам аматоксина и связывающей мишень части, например, антитела, соединенные линкером, включающим остаток мочевины, которые применимы при лечении рака. В другом аспекте изобретение относится к фармацевтическим композициям, включающим такие конъюгаты.
Предпосылки создания изобретения
Аматоксины представляют собой циклические пептиды, состоящие из 8 аминокислот. Их можно выделить из грибов Amanita phalloides или получить синтетически. Анатоксины специфически ингибируют ДНК-зависимую РНК-полимеразу II клеток млекопитающих и посредством этого также транскрипцию и биосинтез белка пораженных клеток. Ингибирование транскрипции в клетках вызывает остановку роста и пролиферации. Хотя ковалентной связи нет, комплекс между аманитином и РНК-полимеразой II является весьма прочным (KD=3 нМ). Отсоединение аманитина от фермента является очень медленным, причем таким образом восстановление пораженной клетки становится невозможным. Когда ингибирование транскрипции слишком запаздывает, клетка будет подвержена запрограммированной гибели (апоптоз).
Использование аматоксинов в качестве цитотоксических частей для противоопухолевой терапии уже исследовалось в 1981 путем соединения антитела против Thy 1.2 с α-аманитином с использованием линкера, присоединенного к индольному циклу Trp (аминокислота 4; см. фигуру 1) через диазотирование (Davis & Preston, Science, 1981, 213, 1385-1388).
В заявке на патент ЕР 1859811 А1 (опубликованной 28 ноября 2007) описываются конъюгаты, в которых γ-атом С аминокислоты 1 аматоксина β-аманитина соединен непосредственно, т.е. без линкерной структуры, с альбумином или моноклональным антителом НЕА125, ОКТ3 или РА-1. Кроме того, показано ингибирующее действие таких конъюгатов на пролиферацию клеток рака молочной железы (MCF-7), клеток лимфомы Беркитта (Raji) и клеток Т-лимфомы (Юрката). Предлагалось использование линкеров, в том числе линкеров, включающих такие элементы, как амид, сложный эфир, простой эфир, простой тиоэфир, дисульфид, мочевина, тиомочевина, углеводородные группы и т.п., но такие конструкции фактически не показаны и не приводятся такие детали, как места присоединения на аматоксинах.
Известно, что аматоксины относительно нетоксичны, когда соединены с носителями крупными биомолекулами, такими как молекулы антител, и что они проявляют свою цитотоксическую активность только после отщепления носителя-биомолекулы. В свете токсичности аматоксинов, в частности, для клеток печени, важно, что конъюгаты аматоксинов для таргетной противоопухолевой терапии остаются весьма устойчивыми после введения в плазму, и что высвобождение аматоксина происходит после интернализации в клетках-мишенях. В таком контексте небольшие улучшения устойчивости конъюгатов могут иметь радикальные последствия для терапевтического окна и безопасности конъюгатов аматоксинов для терапевтических целей.
Цель изобретения
Таким образом, на известном уровне технике имелась высокая потребность в конъюгатах связывающей мишень части и аматоксина, которые устойчивы в плазме, так что вредное побочное действие на клетки-не-мишени минимизируется.
Сущность изобретения
В первом аспекте настоящее изобретение относится к конъюгату, включающему связывающую мишень часть, соединенную через линкер L с аматоксином, где линкер L соединен с аматоксином через
(i) γ-атом С аминокислоты 1 аматоксина, в частности, через амидную связь;
(ii) атом кислорода, связанный с δ-атомом С аминокислоты 3 аматоксина, в частности, через сложноэфирную связь, простую эфирную связь или уретановую связь; или
(iii) 6'-атом С аминокислоты 4 аматоксина, в частности, через атом кислорода, связанный с 6'-атомом С аминокислоты 4 аматоксина;
где в каждом случае линкер L соединен с частью, связывающей мишень, через остаток мочевины.
Во втором аспекте настоящее изобретение относится к фармацевтической композиции, включающей конъюгат по настоящему изобретению.
В еще одном аспекте настоящее изобретение относится к конъюгирующей молекуле аматоксина, включающей линкер L, соединенный с аматоксином через
(i) γ-атом С аминокислоты 1 аматоксина, в частности, через амидную связь;
(ii) атом кислорода, связанный с δ-атомом С аминокислоты 3 аматоксина, в частности, через сложноэфирную связь, простую эфирную связь или уретановую связь; или
(iii) 6'-атом С аминокислоты 4 аматоксина, в частности, через атом кислорода, связанный с 6'-атомом С аминокислоты 4 аматоксина;
где в каждом случае линкер L включает производное карбаминовой кислоты -NH-C(O)-X, где Х представляет собой удаляемую группу, которую можно заменить первичным амином части, связывающей мишень.
В еще одном аспекте настоящее изобретение относится к способу синтеза конъюгата по настоящему изобретению, включающему стадию осуществления реакции конъюгирующей молекулы аматоксина по настоящему изобретению со связывающей мишень частью, включающей первичную аминогруппу.
Краткое описание чертежей
Фиг. 1 показывает структурные формулы различных аматоксинов. Цифры, выделенные жирным шрифтом (1-8), обозначают стандартную нумерацию восьми аминокислот, образующих аминотоксин. Также показаны стандартные обозначения атомов в аминокислотах 1, 3 и 4 (греческие буквы α-γ, греческие буквы α-δ и числа от 1' до 7', соответственно).
Фиг. 2 показывает цитотоксическую активность различных конъюгатов аманитин-герцептин с различными линкерными группами на клетках SKOV-3 в анализе с BrdU после инкубации в течение 72 час.
Фиг. 3 показывает цитотоксическую активность различных конъюгатов аманитин-герцептин с различными линкерными группами на клетках SK-BR-3 в анализе с BrdU после инкубации в течение 72 час.
Фиг. 4 показывает цитотоксическую активность различных конъюгатов аманитин-герцептин с различными линкерными группами на клетках NCI-N87 в анализе с BrdU после инкубации в течение 72 час.
Фиг. 5 показывает цитотоксическую активность различных конъюгатов аманитин-герцептин с различными линкерными группами на клетках MDA-MB231 в анализе с BrdU после инкубации в течение 72 час.
Фиг. 6 и фиг. 7 показывают количество аманитина, высвобожденного из различных конъюгатов аманитин-герцептин с различными линкерными группами после инкубации в плазме до 14 суток.
Фиг. 8 показывает сравнение цитотоксической активности различных конъюгатов аманитин-герцептин с различными линкерными группами на клетках SKOV-3 в анализе с BrdU до и после инкубации в плазме.
Фиг. 9 показывает сравнение активности двух различных конъюгатов аманитин-герцептин с различными линкерными группами in vivo на модели с ксенотрансплантатом SKOV-3.
Подробное описание изобретения
Перед обращением к приведенному ниже подробному описанию настоящего изобретения следует иметь в виду, что данное изобретение не ограничивается определенной методологией, протоколами и реагентами, описанными в данном описании, так как они могут изменяться. Также следует иметь в виду, что терминология, используемая в данном описании, используется только с целью описания определенных воплощений и не предназначена для ограничения объема настоящего изобретения, который будет ограничиваться только прилагаемой формулой изобретения. Если не дается иного определения, все технические и научные термины, используемые в данном описании, имеют те же значения, какие им обычно придают специалисты в данной области техники.
Предпочтительно, термины, используемые в данном описании, определяются так, как описано в «A multilingual glossary of biotechnological terms: (IUPAC Recommendations)», Leuenberger H.G.W., Nagel B. and Kölbi H., eds. (1995), Helvetica Chimica Acta, CH-4010 Basel, Switzerland).
В данном описании и следующей за ним формуле изобретения, если не указано иное, слово «включать» и такие варианты, как «включает» и «включающий», будут пониматься как подразумевающие включение указанных целого числа или стадии или группы целых чисел или стадий, но не исключающие какое-либо другое целое число или стадию или группу целых чисел или стадий.
В тексте данного описания цитируются некоторые документы. Каждый из документов, цитированных в данном описании (включая все патенты, заявки на патент, научные публикации, предписания изготовителей, инструкции, представления инвентарных номеров последовательностей GenBank и т.д.) выше или ниже, включен в данное описание в качестве ссылки в степени, возможной в связи с соответствующим законом о патентах. Ничего в данном описании не следует истолковывать как признание, что изобретение не дает права датировать задним числом такое раскрытие на основании предшествующего изобретения.
Теперь настоящее изобретение будет описываться дополнительно. В последующих разделах различные аспекты изобретения определяются подробнее. Каждый аспект, определенный таким образом, может быть объединен с любым другим аспектом или аспектами, если четко не указано иное. В частности, любая особенность, указанная как предпочтительная или выгодная, может быть объединена с любой другой особенностью или особенностями, указанными как предпочтительные или выгодные.
В первом аспекте настоящее изобретение относится к конъюгату, включающему часть, связывающую мишень соединенную через линкер L с аматоксином, при этом линкер L соединяется с аматоксином через
(iv) γ-атом С аминокислоты 1 аматоксина, в частности, через амидную связь;
(v) атом кислорода, связанный с δ-атомом С аминокислоты 3 аматоксина, в частности, через сложноэфирную связь, простую эфирную связь или уретановую связь; или
(vi) 6'-атом С аминокислоты 4 аматоксина, в частности, через атом кислорода, связанный с 6'-атомом С аминокислоты 4 аматоксина;
где в каждом случае линкер L соединен с частью, связывающей мишень, через остаток мочевины.
В контексте настоящего изобретения термин «конъюгат» относится к молекуле, включающей, по меньшей мере, две различные молекулы, соединенные ковалентной связью.
Термин «часть, связывающая мишень», используемый в данном описании, относится к любой молекуле или части молекулы, которая может специфически связываться с молекулой-мишенью или эпитопом-мишенью. Предпочтительными частями, связывающими мишень, в контексте настоящей заявки являются (i) антитела или их антигенсвязывающие фрагменты; (ii) антителоподобные белки и (iii) аптамеры нуклеиновой кислоты. «Части, связывающие мишень», подходящие для применения в настоящем изобретении, обычно имеют молекулярную массу 40000 Да (40 кДа) или более.
Используемое в данном описании первое соединение (например, антитело) считают «специфически связанным» со вторым соединением (например, антигеном, таким как белок-мишень), если оно имеет константу диссоциации KD ко второму соединению 100 мкМ или менее, предпочтительно 50 мкМ или менее, предпочтительно 30 мкМ или менее, предпочтительно 20 мкМ или менее, предпочтительно 10 мкМ или менее, предпочтительно 5 мкМ или менее, предпочтительно 1 мкМ или менее, предпочтительнее 900 нМ или менее, предпочтительнее 800 нМ или менее, предпочтительнее 700 нМ или менее, предпочтительнее 600 нМ или менее, предпочтительнее 500 нМ или менее, предпочтительнее 400 нМ или менее, предпочтительнее 300 нМ или менее, предпочтительнее 200 нМ или менее, даже предпочтительнее 100 нМ или менее, даже предпочтительнее 90 нМ или менее, даже предпочтительнее 80 нМ или менее, даже предпочтительнее 70 нМ или менее, даже предпочтительнее 60 нМ или менее, даже предпочтительнее 50 нМ или менее, даже предпочтительнее 40 нМ или менее, даже предпочтительнее 30 нМ или менее, даже предпочтительнее 20 нМ или менее, и даже предпочтительнее 10 нМ или менее.
В контексте настоящей заявки термины «молекула-мишень» и «эпитоп-мишень», соответственно, относятся к антигену и эпитопу антигена, соответственно, которые специфически связываются частью, связывающей мишень. Предпочтительно, молекула-мишень представляет собой опухолеспецифический антиген, в частности, антиген или эпитоп, который присутствует на поверхности опухолевых клеток одного или нескольких типов в повышенной концентрации и/или в другой пространственной конфигурации по сравнению с поверхностью неопухолевых клеток. Предпочтительно указанный антиген или эпитоп присутствует на поверхности опухолевых клеток одного или нескольких типов, но не на поверхности неопухолевых клеток. В отдельных воплощениях часть, связывающая мишень, специфически связывается с эпитопом HER-2/neu или молекулой фактора адгезии эпителиальных клеток (ЕрСАМ). В других воплощениях указанный антиген или эпитоп преимущественно экспрессируется на клетках, вовлеченных в аутоиммунные заболевания. В таких частных воплощениях часть, связывающая мишень, специфически связывается с эпитопом рецептора IL-6 (IL-6R).
Термин «антитело или его антигенсвязывающий фрагмент», используемый в данном описании, относится к молекулам иммуноглобулинов и иммунологически активным частям молекул иммуноглобулинов, т.е. молекулам, которые содержат антигенсвязывающий сайт, который иммуноспецифически связывает антиген. Также включаются иммуноглобулиноподобные белки, которые отбираются методами, включающими, например, фаговый дисплей к специфической связи с молекулой-мишенью, например, с белком-мишенью Her-2/neu или ЕрСАМ. Молекулы иммуноглобулинов по изобретению могут представлять собой молекулу иммуноглобулина любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса. «Антитела и их антигенсвязывающие фрагменты», подходящие для применения в настоящем изобретении, включают, но не ограничиваются указанным, поликлональные, моноклональные, одновалентные, биспецифические, гетероконъюгатные, полиспецифические, человеческие, гуманизированные (в частности, CDR-привитые), деиммунизированные или химерные антитела, одноцепочечные антитела (например, scFv), фрагменты Fab, фрагменты F(ab')2, фрагменты, полученные Fab-экспрессирующей библиотекой, диатела или тетратела (Holliger P. et al., 1993), нанотела, антиидиотипические (анти-id) антитела (включая, например, анти-id антитела к антителам по изобретению) и эпитопсвязывающие фрагменты любых из вышеуказанных антител и фрагментов.
В некоторых воплощениях антигенсвязывающие фрагменты являются антигенсвязывающими фрагментами человеческих антител по настоящему изобретению и включают, но не ограничиваются указанным, Fab, Fab' и F(ab')2, Fd, одноцепочечные Fv (scFv), одноцепочечные антитела, дисульфидсвязанные Fv (dsFv) и фрагменты, включающие или VL-, или VH-домен. Антигенсвязывающие фрагменты антител, в том числе одноцепочечных антител, могут включать вариабельный(ые) домен(ы) один(одни) или в сочетании с полным или частью следующего: шарнирный участок, CL, домены CH1, CH2 и СН3. В изобретение также включены антигенсвязывающие фрагменты, также включающие любую комбинацию вариабельного(ых) домена(ов) с шарнирным участком, CL, доменами CH1, CH2 и СН3.
Антитела, применимые в изобретении, могут происходить от любого животного, включая птиц и млекопитающих. Предпочтительно антитела происходят от человека, грызуна (например, мыши, крысы, морской свинки или кролика), курицы, свиньи, овцы, козы, верблюда, коровы, лошади, осла, кошки или собаки. Особенно предпочтительно, когда антитела имеют человеческое или мышиное происхождение. Как используется в данном описании, термин «человеческие антитела» включает антитела с аминокислотной последовательностью человеческого иммуноглобулина и включают антитела, изолированные из библиотек человеческих иммуноглобулинов или из животных, трансгенных в отношении одного или нескольких человеческих иммуноглобулинов, и которые не экспрессируют эндогенные иммуноглобулины, как описано, например, в патенте США № 5939598, Kucherlapati & Jakobovits.
Термин «антителоподобный белок» относится к белку, который создан методами инженерии (например, мутагенезом петель) для специфического связывания с молекулой-мишенью. Обычно такой антителоподобный белок включает, по меньшей мере, одну вариабельную пептидную петлю, присоединенную к обоим концам каркаса белка. Такое двойное структурное ограничение значительно повышает аффинность связывания антителоподобного белка до уровней, сравнимых с уровнями антитела. Длину вариабельной пептидной петли обычно составляют 10-20 аминокислот. Каркасный белок может представлять собой любой белок с хорошими свойствами растворимости. Предпочтительно каркасный белок представляет собой небольшой глобулярный белок. Антителоподобные белки включают, без ограничения, аффинные антитела, антикалины и сконструированные белки анкиринового повтора (для общего представления см. Binz et al., 2005). Антителоподобные белки можно получить из больших библиотек мутантов, например, извлечь из больших библиотек фаговых дисплеев, и можно выделить по аналогии с регулярными антителами. Также антителоподобные связывающие белки можно получить комбинаторным мутагенезом выставленных на поверхность остатков в глобулярных белках.
Термин «аптамер нуклеиновой кислоты» относится к молекуле нуклеиновой кислоты, которая создана методами инженерии через повторные циклы отбора in vitro или SELEX (систематическое изменение лигандов путем экспоненциального обогащения) на связывание с молекулой-мишенью (для общего представления см. Brody and Gold, 2000). Нуклеотидный аптамер может представлять собой молекулу ДНК или РНК. Аптамеры могут содержать модификации, например, модифицированные нуклеотиды, такие как 2'-фторзамещенные пиримидины.
Используемое в данном описании определение «химическое производное» (или коротко «производное») соединения относится к разновидности, имеющей химическую структуру, схожую со структурой соединения, содержащую также по меньшей мере одну химическую группу, не присутствующую в соединении, и/или с отсутствием, по меньшей мере, одной химической группы, которая в соединении присутствует. Соединение, с которым сравнивают производное, известно как «исходное» соединение. Обычно «производное» можно получить из исходного соединения в одну или несколько химических реакционных стадий.
«Аналог» соединения, как используется в данном описании, структурно родственен, но не идентичен соединению и проявляет по меньшей мере одну активность соединения. Соединение, с которым сравнивают аналог, известно как «исходное» соединение. Вышеуказанные активности включают, без ограничения, активность связывания с другим соединением; активность ингибирования, например, активность ингибирования фермента; токсичное действие; активность, например, фермент-активирующую активность. Не требуется, чтобы аналог проявлял такую активность в такой же степени, как исходное соединение. Соединение рассматривают как аналог в контексте настоящей заявки, если оно проявляет релевантную активность в степени, по меньшей мере, 1% (предпочтительнее, по меньшей мере, 5%, предпочтительнее, по меньшей мере, 10%, предпочтительнее, по меньшей мере, 20%, предпочтительнее, по меньшей мере, 30%, предпочтительнее, по меньшей мере, 40%, предпочтительнее, по меньшей мере, 50%) от активности исходного соединения. Таким образом, термин «аналог аматоксина», используемый в данном описании, относится к соединению, которое структурно родственно любому соединению из α-аманитина, β-аманитина, γ-аманитина, ε-аманитина, аманина, аманинамида, амануллина и амануллиновой кислоты, показанных на фиг. 1, и проявляет активность на уровне, по меньшей мере, 1% (предпочтительнее, по меньшей мере, 5%, предпочтительнее, по меньшей мере, 10%, предпочтительнее, по меньшей мере, 20%, предпочтительнее, по меньшей мере, 30%, предпочтительнее, по меньшей мере, 40%, предпочтительнее, по меньшей мере, 50%) ингибирующей активности против РНК-полимеразы II млекопитающих по сравнению с, по меньшей мере, одним соединением из α-аманитина, β-аманитина, γ-аманитина, ε-аманитина, аманина, аманинамида, амануллина и амануллиновой кислоты. «Аналог аматоксина», подходящий для применения в настоящем изобретении, даже может проявлять большую ингибирующую активность против РНК-полимеразы II млекопитающих, чем любое одно соединение из α-аманитина, β-аманитина, γ-аманитина, ε-аманитина, аманина, аманинамида, амануллина или амануллиновой кислоты. Ингибирующую активность можно измерить, определяя концентрацию, при которой происходит ингибирование на 50% (величина IC50). Ингибирующую активность против РНК-полимеразы II млекопитающих можно определить косвенно путем измерения ингибирующей активности в отношении пролиферации клеток. Подходящий анализ для измерения пролиферации клеток описан в примерах.
Термин «полусинтетический аналог» относится к аналогу, который получают химическим синтезом с использованием в качестве исходного материала соединений из природных источников (например, растительных материалов, бактериальных культур или клеточных культур). Обычно «полусинтетический аналог» по настоящему изобретению синтезируют, исходя из соединения, выделенного из гриба семейства Amanita. Напротив, термин «синтетический аналог» относится к аналогу, синтезированному так называемым полным синтезом из небольших (типично нефтехимических) строительных блоков. Обычно такой полный синтез выполняют без помощи биологических процессов.
Используемый в данном описании термин «конъюгат аптамера» относится к конъюгату связывающей мишень части с токсином, в котором часть, связывающая мишень, представляет собой аптамер нуклеиновой кислоты согласно указанной выше альтернативе (iii).
Термин «линкер» в контексте настоящего изобретения относится к молекуле, которая соединяет два компонента, причем каждый присоединяется к одному концу линкера, и которая увеличивает расстояние между двумя компонентами и уменьшает пространственное взаимное влияние между указанными компонентами, например, в данном случае, между частью, связывающей мишень, и аматоксином. В отсутствие линкера прямая связь аматоксина с частью, связывающей мишень, может снизить возможность взаимодействия аматоксина с РНК-полимеразой II. В отдельных воплощениях линкер имеет длину своей основной цепи в 1-30 атомов (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 атомов), т.е. длина линкера определяется как самое короткое соединение, измеренное числом атомов или связей между аматоксиновой группой и частью, связывающей мишень, при этом одна сторона основной цепи линкера прореагировала с аматоксином и другая сторона с частью, связывающей мишень. В контексте настоящего изобретения линкер предпочтительно представляет собой С1-20-алкиленовую, С1-20-гетероалкиленовую, С2-20-алкениленовую, С2-20-гетероалкениленовую, С2-20-алкиниленовую, С2-20-гетероалкиниленовую, циклоалкиленовую, гетероциклоалкиленовую, ариленовую, гетероариленовую, аралкиленовую или гетероаралкиленовую группу, необязательно замещенную. Линкер может содержать один или несколько структурных элементов, таких как карбоксамидные, сложноэфирные, простые эфирные, простые тиоэфирные, дисульфидные, мочевинные, углеводородные группы и т.п. Линкер также может содержать комбинации из двух или большего числа таких структурных элементов. Каждый из указанных структурных элементов может присутствовать в линкерной группе более одного раза, например, дважды, три раза, четыре раза, пять раз или шесть раз. В некоторых воплощениях линкер может включать дисульфидную связь. Следует представлять, что линкер должен быть присоединен к аматоксину и к части, связывающей мишень, или в одну стадию или две или больше последовательных стадий. С такой целью линкер должен будет иметь две группы, предпочтительно, у проксимального и дистального конца, которые могут (i) образовывать ковалентную связь с группой, присутствующей в одном из соединяемых компонентов, предпочтительно, активированной группой на аматоксине или части, связывающей мишень, или (ii) которые активированы или могут быть активированы для образования ковалентной связи с группой на аматоксине. Соответственно, предпочтительно, что у дистального и проксимального конца линкера находятся химические группы, которые являются результатом такой реакции сочетания, например, сложноэфирная, простая эфирная, уретановая, пептидная связь и т.д.
В контексте настоящего изобретения термин «аматоксин» включает все циклические пептиды, состоящие из 8 аминокислот, выделенные из рода Amanita и описанные Wieland T. и Faulstich H. (Wieland T., Faulstich H., CRC Crit. Rev. Biochem., 1978, Dec, 5(3): 185-260), и кроме того, включает все их химические производные; а также все их полусинтетические аналоги, также их синтетические аналоги, построенные из строительных блоков в соответствии с главной структурой природных соединений (циклическая, 8 аминокислот), также все синтетические и полусинтетические аналоги, содержащие негидроксилированные аминокислоты вместо гидроксилированных аминокислот, также все синтетические и полусинтетические аналоги, в которых простая тиоэфирная сульфоксидная группа заменена сульфидной, сульфоновой или атомами иными, чем сера, например, атомом углерода, как в карба-аналогах аманитина, при этом в каждом случае любое такое производное или аналог является функционально активным, ингибируя РНК-полимеразу II млекопитающих.
Функционально аматоксины определяют как пептиды или депсипептиды, которые ингибируют РНК-полимеразу II млекопитающих. Предпочтительными являются аматоксины с функциональной группой (например, карбоксильной группой, аминогруппой, гидроксигруппой, тиольной или тиолозахватывающей группой), которую можно ввести во взаимодействие с молекулами линкера или частями, связывающими мишень, как определено выше. Аматоксинами, которые особенно подходят для конъюгатов по настоящему изобретению, являются α-аманитин, β-аманитин, γ-аманитин, ε-аманитин, аманин, аманинамид, амануллин и амануллиновая кислота, показанные на фиг. 1, а также их соли, химические производные, полусинтетические аналоги и синтетические аналоги. Особенно предпочтительными аматоксинами для применения в настоящем изобретении являются α-аманитин, β-аманитин и аманинамид.
В контексте настоящего изобретения термин «соединенный с частью, связывающей мишень через мочевинную группу» относится к соединению между линкером и частью, связывающей мишень, где часть, связывающая мишень, непосредственно присоединена к линкеру через группу -NH-C(O)-NH-.
В отдельных воплощениях настоящего изобретения конъюгат имеет структуру, выбранную из одной из следующих структур:
аматоксин-γС(О)-NH-L-NH-C(O)-NH-(часть, связывающая мишень);
аматоксин-δС-О-С(О)-L-NH-C(O)-NH-(часть, связывающая мишень);
аматоксин-δС-О-L-NH-C(O)-NH-(часть, связывающая мишень);
аматоксин-δС-О-С(О)-NH-L-NH-C(O)-NH-(часть, связывающая мишень) и
аматоксин-6'С-О-L-NH-C(O)-NH-(часть, связывающая мишень).
В отдельных воплощениях настоящего изобретения часть, связывающая мишень, соединяется с линкером L через аминогруппу, присутствующую в части, связывающей мишень, при этом аминогруппа образует часть указанной мочевинной группы.
В отдельных воплощениях настоящего изобретения аматоксин выбирают из α-аманитина, β-аманитина, γ-аманитина, ε-аманитина, аманина, аманинамида, амануллина или амануллиновой кислоты или их солей или аналогов.
В отдельных воплощениях настоящего изобретения линкер L включает одну или несколько групп, в частности, одну, две или три группы, выбранные из списка, включающего алкиленовую, алкениленовую, алкиниленовую, циклоалкиленовую, гетероалкиленовую, гетероалкениленовую, гетероалкиниленовую, гетероциклоалкиленовую, ариленовую, гетероариленовую, аралкиленовую и гетероаралкиленовую группу, при этом каждая группа может быть необязательно независимо замещенной.
Термин «алкилен» относится к двухвалентным линейным насыщенным углеводородным группам с 1-20 атомами углерода, включая группы с 1-10 атомами углерода. В некоторых воплощениях алкиленовые группы могут представлять собой низшие алкиленовые группы. Термин «низшие алкиленовые группы» относится к алкиленовым группам с 1-6 атомами углерода, и в некоторых воплощениях с 1-5 или 1-4 атомами углерода. Примеры алкиленовых групп включают, но не ограничиваются указанным, метилен (-СН2-), этилен (-СН2-СН2-), н-пропилен, н-бутилен, н-пентилен и н-гексилен.
Термин «алкенилен» относится к двухвалентным линейным группам с 2-20 атомами углерода, при этом, по меньшей мере, одна из углерод-углеродных связей представляет собой двойную связь, в то время как другие связи могут быть простыми или также двойными связями. Термин «алкинилен» в данном описании относится к группам с 2-20 атомами углерода, при этом, по меньшей мере, одна из углерод-углеродных связей представляет собой тройную связь, в то время как другие связи могут быть простыми, двойными или тройными связями. Примеры алкениленовых групп включают этенилен (-СН=СН-), 1-пропенилен, 2-пропенилен, 1-бутенилен, 2-бутенилен, 3-бутенилен и т.п. Примеры алкиниленовых групп включают этинилен, 1-пропинилен, 2-пропинилен и т.д.
Предполагается, что «циклоалкилен», когда используется в данном описании, относится к двухвалентному циклу, являющемуся частью любой устойчивой моноциклической или полициклической системы, где такой цикл имеет от 3 до 12 атомов углерода, но не имеет гетероатомов, и где такой цикл является полностью насыщенным, и предполагается, что термин «циклоалкенилен» относится к двухвалентному циклу, являющемуся частью любой устойчивой моноциклической или полициклической системы, где такой цикл имеет от 3 до 12 атомов углерода, но не имеет гетероатомов, и где такой цикл является, по меньшей мере, частично ненасыщенным (но за исключением любого ариленового цикла). Примеры циклоалкиленов включают, но не ограничиваются указанным, циклопропилен, циклобутилен, циклопентилен, циклогексилен и циклогептилен. Примеры циклоалкениленов включают, но не ограничиваются указанным, циклопентенилен и циклогексенилен.
Предполагается, что используемые в данном описании термины «гетероциклоалкилен» и «гетероциклоалкенилен» относятся к двухвалентному циклу, являющемуся частью любой устойчивой моноциклической или полициклической системы, где такой цикл имеет от 3 до примерно 12 атомов, и где такой цикл состоит из атомов углерода и, по меньшей мере, одного гетероатома, в частности, по меньшей мере, одного гетероатома, независимо выбранного из группы, состоящей из N, O и S, причем гетероциклоалкилен относится к такому циклу, который является полностью насыщенным, и гетероциклоалкенилен относится к циклу, который является, по меньшей мере, частично ненасыщенным (но за исключением любого ариленового или гетероариленового цикла).
Предполагается, что термин «арилен» обозначает двухвалентный цикл или циклическую систему, являющуюся частью любой устойчивой моноциклической или полициклической системы, где такой цикл или циклическая система имеет от 3 до 20 атомов углерода, но не имеет гетероатомов, и такой цикл или циклическая система состоит из ароматической группы, определяемой правилом «4n+2» π-электронов, включая фенилен.
Используемый в данном описании термин «гетероарилен» относится к двухвалентному циклу или циклической системе, являющейся частью любой устойчивой моно- или полициклической системы, где такой цикл или циклическая система имеет от 3 до 20 атомов, и такой цикл или циклическая система состоит из ароматической группы, определяемой правилом «4n+2» π-электронов, и содержит атомы углерода и один или несколько гетероатомов азота, серы и/или кислорода.
В контексте настоящего изобретения термин «замещенный» предназначается для того, чтобы показать, что один или несколько атомов водорода, присутствующих в основной цепи линкера, заменены на выбор указанной(ыми) группой(ами), при условии, что нормальная валентность указанного атома или соответствующего атома группы, который замещен, не превышается, и что замещение приводит к устойчивому соединению. Термин «необязательно замещенный» предназначается для обозначения того, что линкер является или незамещенным или замещен, как определено в данном описании, одним или несколькими заместителями, как определено в данном описании. Когда заместителем является кетогруппа (или оксогруппа, т.е. =О), тио- или иминогруппа или подобная группа, тогда замещаются два атома водорода в основной цепи линкера. Примеры заместителей включают, например, алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, гетероарил, аралкил, гетероаралкил, ацил, ароил, гетероароил, карбоксил, алкокси, арилокси, ацилокси, ароилокси, гетероароилокси, алкоксикарбонил, галоген, (тио)сложноэфирную группу, циано, фосфорил, амино, имино, (тио)амидо, сульфгидрил, алкилтио, ацилтио, сульфонил, сульфатную группу, сульфонатную группу, сульфамоил, сульфонамидо, нитро, азидо, галогеналкил, включая перфторалкил (такой как трифторметил), галогеналкокси, алкилсульфанил, алкилсульфинил, алкилсульфонил, алкилсульфониламино, арилсульфониламино, фосфорил, фосфатную группу, фосфонатную группу, фосфинатную группу, алкилкарбокси, алкилкарбоксиамидную группу, оксо, гидрокси, меркапто, амино (необязательно моно- или дизамещенный, например, алкилом, арилом или гетероарилом), имино, карбоксамидную группу, карбамоил (необязательно моно- или дизамещенный, например, алкилом, арилом или гетероарилом), амидино, аминосульфонил, ациламино, ароиламино, (тио)уреидо, арил(тио)уреидо, алкил(тио)уреидо, циклоалкил(тио)уреидо, арилокси или -О(СН2)n-OH, -O(CH2)n-NH2, -O(CH2)nCOOH, -(CH2)nCOOH, -C(O)O(CH2)nR, -(CH2)nN(H)C(O)OR или - N(R)S(O)2R, где n равен 1-4, и R независимо выбирают из водорода, -алкила, -алкенила, -алкинила, -циклоалкила, -циклоалкенила, -(С-присоединенного гетероциклоалкила), -(С-присоединенного гетероциклоалкенила), -арила и -гетероарила, причем допускается несколько степеней замещения. Специалистам в данной области техники будет понятно, что заместители, такие как гетероциклоалкил, арил, гетероарил, алкил и т.д., или функциональные группы, такие как -ОН, -NHR и т.д., сами могут быть замещенными в соответствующем случае. Специалистам в данной области техники также будет понятно, что сами замещенные группы также могут быть замещены в соответствующем случае.
В отдельных воплощениях настоящего изобретения линкер L, в частности, линкер L, показанный в абзаце [0042] или абзаце [0081], включает m групп, выбранных из следующего списка: алкиленовая, алкениленовая, алкиниленовая, циклоалкиленовая, гетероалкиленовая, гетероалкениленовая, гетероалкиниленовая, гетероциклоалкиленовая, ариленовая, гетероариленовая, аралкиленовая и гетероаралкиленовая группы, при этом каждая группа может быть, необязательно, независимо замещенной, линкер также включает n групп, выбранных независимо из одной из следующих групп: дисульфидная (-S-S-), простая эфирная (-О-), простая тиоэфирная (-S-), аминная (-NH-), сложноэфирная (-О-С(=О)- или -С(=О)-О-), карбоксамидная (-NH-C(=О)- или -C(=O)-NH-), уретановая (-NH-C(=O)-O- или -О-С(=О)-NH-) и мочевинная (-NH-C(=O)-NH-) группы, при этом m=n+1. В отдельных воплощениях m равен 2 и n равен 1, или m=3 и n равен 2. В отдельных воплощениях линкер включает 2 или 3 незамещенные алкиленовые группы, и 1 или 2, соответственно, дисульфидные, простые эфирные, простые тиоэфирные, аминные, сложноэфирные, карбоксамидные, уретановые или мочевинные группы, соединяющие незамещенные алкиленовые группы.
В отдельных воплощениях линкер L, в частности, линкер L, показанный в абзаце [0042], представляет собой линейную цепь с 2-20 атомами, выбранными независимо из C, O, N и S, в частности, с 2-16 атомами, в более частном случае, с 5-14 атомами, и даже в более частном случае, с 6-12 атомами. В отдельных воплощениях, по меньшей мере, 60% атомов в линейной цепи являются атомами С. В отдельных воплощениях атомы в линейной цепи соединяются простыми связями.
В отдельных воплощениях атомы С в линейной цепи являются независимо частью необязательно замещенных метиленовых групп (-СН2-). В отдельных таких воплощениях необязательные заместители выбирают независимо из галогена и С1-6-алкила, в частности, метила.
В отдельных воплощениях линкер L, показанный в абзаце [0042] или абзаце [0081], выбирают из следующей группы линкеров:
сторона аматоксина: -(СН2)2- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)3- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)4- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)5- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)6- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)7- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)8- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)9- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)10- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)11- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)12- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)16- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)2-S-S-(СН2)2- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)3-S-S-(СН2)2- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)2-S-S-(СН2)3- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)3-S-S-(СН2)3- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)4-S-S-(СН2)4- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)2-CMe2-S-S-(СН2)2- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)2-S-S-CMe2-(СН2)2- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)2-О-(СН2)2- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)2-О-(СН2)2-О-(СН2)2- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)2-О-(СН2)2-О-(СН2)2-О-(СН2)2- сторона части, связывающей мишень;
сторона аматоксина: -(СН2)2-О-(СН2)2-О-(СН2)2-О-(СН2)2-О-(СН2)2- сторона части, связывающей мишень.
В отдельных воплощениях настоящего изобретения часть, связывающая мишень, специфически связывается с эпитопом, который присутствует на опухолевой клетке.
В отдельных воплощениях настоящего изобретения часть, связывающая мишень, специфически связывается с эпитопом HER-2/neu или молекулой фактора адгезии эпителиальных клеток (ЕрСАМ).
В отдельных воплощениях настоящего изобретения часть, связывающую мишень, выбирают из группы, состоящей из антитела или его антигенсвязывающего фрагмента, антителоподобного белка и аптамера нуклеиновой кислоты.
В отдельных воплощениях настоящего изобретения антитело или его антигенсвязывающий фрагмент выбирают из диатела, тетратела, нанотела, химерного антитела, деиммунизированного антитела, гуманизированного антитела или человеческого антитела.
В отдельных воплощениях настоящего изобретения антигенсвязывающий фрагмент выбирают из группы, включающей Fab, F(ab')2, Fd, Fv, одноцепочечный Fv и дисульфидсвязанный Fv (dsFv).
В отдельных воплощениях настоящего изобретения антитело представляет собой герцептин или НЕА125 или фрагмент антитела, включающий антигенсвязывающий фрагмент герцептина или НЕА125.
В отдельных воплощениях настоящего изобретения с частью, связывающей мишень, соединяют более одной молекулы аматоксина. Возрастание числа молекул аматоксина на конъюгат также будет повышать токсичность. Соответственно, в отдельных воплощениях отношение части, связывающей мишень, к аматоксину составляет от 1 части, связывающей мишень, к 2-15 молекулам аматоксина, в частности, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15. С целью вычисления отношения в случае димеров антител, таких как IgG, димер рассматривают как одну часть, связывающую мишень.
В отдельных воплощениях настоящего изобретения конъюгат является конъюгатом для применения в качестве лекарственного средства.
В отдельных воплощениях настоящего изобретения конъюгат является конъюгатом для лечения рака у пациента, при этом рак выбирают из группы, состоящей из рака поджелудочной железы, холангиокарциномы, рака молочной железы, колоректального рака, рака легких, рака предстательной железы, рака яичников, рака желудка, рака почек, злокачественной меланомы, лейкоза и злокачественной лимфомы.
Используемый в данном описании термин «пациент» обозначает любое млекопитающее или птицу, которые могут получить пользу от лечения конъюгатами части, связывающей мишень, и токсина, описанными в данном описании. Предпочтительно «пациента» выбирают из группы, состоящей из лабораторных животных (например, мышей или крыс), домашних животных (включая, например, морских свинок, кроликов, кур, свиней, овец, коз, верблюдов, коров, лошадей, ослов, кошек или собак) или приматов, включая людей. Особенно предпочтительно, когда «пациентом» является человек.
При использовании в данном описании «лечить», «лечащий» или «лечение» заболевания или расстройства обозначает выполнение одного или более из следующего: (а) уменьшение тяжести расстройства; (b) ограничение или предупреждение развития симптомов, характерных для расстройства (расстройств), которое(ые) лечат; (с) ингибирование ухудшения симптомов, характерных для расстройства (расстройств), которое(ые) лечат; (d) ограничение или предупреждение рецидива расстройства (расстройств) у пациентов, которые прежде имели расстройство(а); и (е) ограничение или предупреждение рецидива симптомов у пациентов, у которых прежде были симптомы расстройства (расстройств).
В данном описании лечение может включать введение пациенту конъюгата или фармацевтической композиции по настоящему изобретению, при этом «введение» включает введение in vivo, а также введение непосредственно в ткань ex vivo, такое как трансплантаты вен.
В отдельных воплощениях используют терапевтически эффективное количество конъюгата по настоящему изобретению.
«Терапевтически эффективное количество» является количеством терапевтического средства, достаточным для достижения преполагаемой цели. Эффективное количество данного терапевтического средства будет изменяться в связи с такими факторами, как характер средства, способ введения, величина и вид животного, получающего терапевтическое средство, и цель введения. Эффективное количество в каждом отдельном случае может быть определено эмпирически специалистом в данной области техники согласно методам, принятым в технике.
Во втором аспекте настоящее изобретение относится к фармацевтической композиции, включающей конъюгат по настоящему изобретению, также включающей один или несколько фармацевтически приемлемых разбавителей, носителей, эксципиентов, наполнителей, связующих веществ, смазывающих веществ, глидантов, веществ, способствующих рассыпанию, адсорбентов и/или консервантов.
«Фармацевтически приемлемый» означает одобрение регулирующего органа федерального правительства или правительства штата или указание в фармакопеи США или другой общеизвестной фармакопеи для применения для животных, и конкретнее, для людей.
В отдельных воплощениях фармацевтическую композицию используют в форме системно вводимого лекарственного средства. Такое средство включает парентеральные средства, которые включают, среди прочего, средства для инъекции и инфузии. Средства для инъекции получают или в форме ампул, или в виде так называемых инъекций, готовых к применению, например, готовых к применению шприцев или одноразовых шприцев, и помимо этого, в капельницах для многократной подачи. Введение инъекций может быть в форме подкожного (s.c.), внутримышечного (i.m.), внутривенного (i.v.) или внутрикожного (i.c.) применения. В частности, возможно получение соответствующих подходящих композиций для инъекций в виде суспензии кристаллического вещества, растворов, дисперсных систем наночастиц или коллоидных дисперсных систем, подобных, например, гидрозолям.
Композиции для инъекций также можно получить в виде концентратов, которые можно растворить или диспергировать водными изотоничными разбавителями. Инфузию также можно получить в форме изотоничного раствора, масляных эмульсий, липосомных композиций и микроэмульсий. Подобно композициям для инъекции, композиции для инфузии также можно получить в форме концентратов для разбавления. Композиции для инъекций также можно применять в форме перманентных инфузий как при больничном, так и при амбулаторном лечении, например, с помощью мининасосов.
К композициям парентеральных лекарственных средств возможно добавление, например, альбумина, плазмы, средства, увеличивающего объем, поверхностно-активных веществ, органических разбавителей, веществ, влияющих на рН, комплексообразующих веществ или полимеров, в частности, как веществ, влияющих на адсорбцию белками или полимерами конъюгатов частей, связывающих мишень, и токсинов по изобретению, или их также можно добавлять с целью уменьшения адсорбции конъюгатов частей, связывающих мишень, и токсинов по изобретению материалами, подобными инструментам для инъекции или упаковочным материалам, например, пластикам или стеклу.
Конъюгаты связывающих мишень частей и токсинов по изобретению можно связывать в парентеральных композициях с микроносителями или наночастицами, подобных, например, мелкодиспергированным частицам на основе поли(мет)акрилатов, полилактатов, полигликолятов, полиаминокислот или полиэфируретанов. Парентеральные композиции также можно модифицировать в виде композиций пролонгированного действия, например, на основе «принципа многих единиц», если конъюгаты связывающих мишень частей и токсинов вводятся в мелкодисперсной, дисперсной или суспендированной форме, соответственно, или в виде суспензии кристаллов в лекарственном средстве, или на основе «принципа одной единицы», если конъюгаты части, связывающих мишень, и токсинов заключены в композиции, например, в таблетке или стержне, которые затем имплантируют. Такие импланты или лекарственные средства пролонгированного действия в композициях одной единицы или многих единиц часто состоят из так называемых биоразлагаемых полимеров, подобных, например, полиэфирам молочной кислоты и гликолевой кислоты, полиэфируретанам, полиаминокислотам, поли(мет)акрилатам или полисахаридам.
Адъюванты и носители, добавляемые во время получения фармацевтических композиций по настоящему изобретению, получаемых в виде парентеральных композиций, предпочтительно представляют собой aqua sterilisata (стерилизованную воду), вещества, влияющие на рН, такие как, например, органические или неорганические кислоты или основания, а также их соли, буферирующие вещества для подгонки величин рН, вещества для придания изотоничности, такие как, например, хлорид натрия, гидрокарбонат натрия, глюкоза и фруктоза, вещества, влияющие на поверхностное натяжение, и поверхностно-активные вещества, соответственно, и эмульгаторы, такие как, например, неполные эфиры жирных кислот и полиоксиэтиленсорбитана (например, твин®), или, например, эфиры жирных кислот и полиоксиэтиленов (например, кремофор®), жирные масла, такие как, например, арахисовое масло, соевое масло или касторовое масло, синтетические эфиры жирных кислот, такие как, например, этилолеат, изопропилмиристат, и нейтральное масло (например, миглиол®), а также полимерные адъюванты, такие как, например, желатин, декстран, поливинилпирролидон, добавки, которые повышают растворимость органических растворителей, такие как, например, пропиленгликоль, этанол, N,N-диметилацетамид, пропиленгликоль, или комплексообразующие вещества, такие как, например, цитрат и мочевина, консерванты, такие как, например, гидроксипропиловый эфир и метиловый эфир бензойной кислоты, бензиловый спирт, антиоксиданты, такие как, например, сульфит натрия, и стабилизаторы, такие как, например, ЭДТК.
Когда фармацевтические композиции по настоящему изобретению получают в виде суспензий, в предпочтительном воплощении добавляют загустители для предотвращения оседания конъюгатов связывающих мишень частей и токсинов по изобретению или вещества, влияющие на поверхностное натяжение, и полиэлектролиты для возможности ресуспендирования осадка и/или комплексообразующие вещества, такие как, например, ЭДТК. Также возможно образование комплексов активного ингредиента с различными полимерами. Примерами таких полимеров являются полиэтиленгликоль, полистирол, карбоксиметилцеллюлоза, плюроники или полиэтиленгликольсорбитовый эфир жирной кислоты. Конъюгаты связывающих мишень частиц и токсинов по изобретению также могут быть включены в жидкие композиции в форме соединений включения, например, с циклодекстринами. В отдельных воплощениях могут добавляться диспергирующие вещества как дополнительные адъюванты. Для получения основ лиофилизатов можно использовать такие вещества, как маннит, декстран, сахароза, человеческий альбумин, лактоза, PVP или разновидности желатина.
В другом аспекте настоящее изобретение относится к способу лечения рака поджелудочной железы, холангиокарциномы, рака молочной железы, колоректального рака, рака легких, рака предстательной железы, рака яичников, рака желудка, рака почек, злокачественной меланомы, лейкоза или злокачественной лимфомы у пациента, нуждающегося в этом, включающему введение пациенту эффективного количества конъюгата или фармацевтической композиции по настоящему изобретению.
В другом аспекте настоящее изобретение относится к конъюгирующей молекуле аматоксина как промежуточному соединению для синтеза конъюгата по настоящему изобретению, при этом конъюгирующая молекула аматоксина включает линкер L, соединенный с аматоксином через
(i) γ-атом С аминокислоты 1 аматоксина, в частности, через амидную связь;
(ii) атом кислорода, связанный с δ-атомом С аминокислоты 3 аматоксина, в частности, через сложноэфирную связь, простую эфирную связь или уретановую связь; или
(iii) 6'-атом С аминокислоты 4 аматоксина, в частности, через атом кислорода, связанный с 6'-атомом С аминокислоты 4 аматоксина;
где в каждом случае линкер L включает производное карбаминовой кислоты -NH-C(O)-X, где Х представляет собой удаляемую группу, которую можно заменить первичным амином или частью, связывающей мишень.
В одном воплощении конъюгирующая молекула аматоксина имеет структуру, выбранную из одной из следующих структур:
(i) аматоксин-γС(О)-NH-L-NH-C(O)-Х;
(ii) аматоксин-δС-О-С(О)-L-NH-C(O)-Х;
(iii) аматоксин-δС-О-L-NH-C(O)-Х;
(iv) аматоксин-δС-О-С(О)-NH-L-NH-C(O)-Х; и
(v) аматоксин-6'С-О-L-NH-C(O)-Х.
В некоторых воплощениях аматоксин выбирают из α-аманитина, β-аманитина, γ-аманитина, ε-аманитина, аманина, аманинамида, амануллина или амануллиновой кислоты или их солей или аналогов.
В некоторых воплощениях линкер L представляет собой алкиленовую, гетероалкиленовую, алкениленовую, гетероалкениленовую, алкиниленовую, гетероалкиниленовую, циклоалкиленовую, гетероциклоалкиленовую, ариленовую, гетероариленовую, аралкиленовую или гетероаралкиленовую группу, необязательно замещенную.
В некоторых воплощениях линкер L включает группу, выбранную из одной из следующих групп: дисульфидная, простая эфирная, аминная, сложноэфирная, карбоксамидная, уретановая и мочевинная группа.
В некоторых воплощениях функциональную группу Х выбирают из -трет-бутилокси, -сукцинимидилокси, -1-О-сукцинимидилокси-3-сульфонатной группы (-сульфо-NHS), -О-(4-нитрофенилокси), -О-(3-нитрофенилокси), -О-(2,4-динитрофенилокси), -О-(2,4-дихлор-6-нитрофенилокси), -пентафторфенилокси, -пентахлорфенилокси, -О-(2,4,5-трихлорфенилокси), -О-(3,4-дигидро-3-гидрокси-4-оксо-1,2,3-бензотриазин-3-ила), -О-(эндо-1-гидрокси-5-норборнен-2,3-дикарбоксимид-1-ила), -1-фталимидоилокси, 1-бензотриазолилокси, -1-(7-азабензотриазолил)окси и -N-имидазолила.
В еще одном аспекте настоящее изобретение относится к способу синтеза конъюгата аматоксина по настоящему изобретению, включающему стадию взаимодействия конъюгирующей молекулы анатоксина по настоящему изобретению с частью, связывающей мишень, включающей первичную аминогруппу.
Примеры
Далее изобретение поясняется подробнее неограничительными примерами.
Пример 1
Синтез конъюгата α-аманитина и антитела герцептина Her-DSC-30.0134
1.1. Синтез 6'-NH-boc-(6-аминогексил)-α-аманитина HDP 30.0132
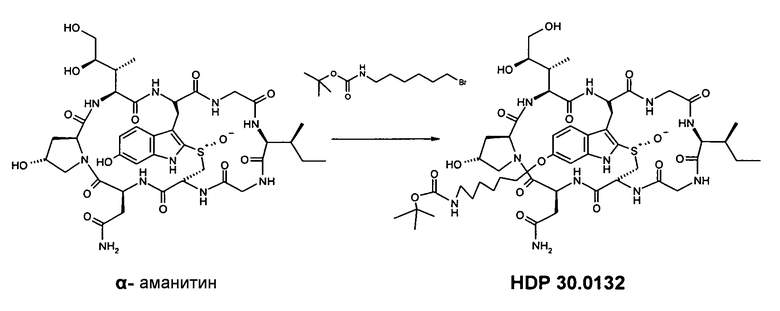
В атмосфере аргона и при комнатной температуре 30,00 мг (32,6 мкмоль), высушенного в вакууме α-аманитина, растворяют в 900 мкл сухого диметилсульфоксида (ДМСО). Добавляют 3,66 мг (32,6 мкмоль) трет-бутилата калия и 73,18 мг (261,2 мкмоль, 8 экв.) NH-Boc-аминогексилбромида (Fluka 89171). Через 6 час при комнатной температуре реакционную смесь подкисляют до рН=5 50 мкл 0,33 М раствора уксусной кислоты в ДМСО. Летучие вещества выпаривают в вакууме, и остаток растворяют в 1000 мкл метанола и разбавляют 20 мкл диэтилового эфира. Выпавшее в осадок вещество собирают и растворяют в 1000 мкл метанола. Полученный раствор разбавляют 1000 мкл воды и используют для очистки на установке ВЭЖХ LaPrep:
(колонка Kromasil 100-C18, 250×20 мм, 10 мкм, метанол/вода (0,05% ТФК), поток 26 мл/мин, детекция при λ=295 нм).
Растворитель А: 95% воды:5% метанола:0,05% трифторуксусной кислоты.
Растворитель В: 10% воды:90% метанола:0,05% трифторуксусной кислоты.
Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-40 мин 0% А.
Фракцию со временем удерживания 19,8 мин собирают, и растворители выпаривают.
Получают 15,9 мг порошка (выход 43%). МС: 1119 (М+Н+); 1141 (M+Na+).
1.2. Синтез 6'-(6-аминогексил)-α-аманитина HDP 30.0134
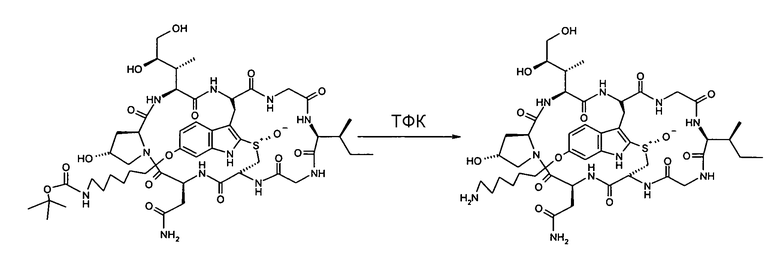

Растворяют 9,90 мг (8,85 мкмоль) 6'-NH-boc-(6-аминогексил)- α-аманитина HDP 30.0132 в 250 мкл трифторуксусной кислоты. Реакционную смесь перемешивают в атмосфере аргона при температуре окружающей среды. Через 2 мин кислоту удаляют в вакууме при 20ºС и остаток сушат. Сырой простой эфир аманитина очищают на установке ВЭЖХ LaPrep:
(колонка Kromasil 100-C18, d=10 мм, 10 мкм, метанол/вода (0,05% ТФК), поток 6 мл/мин, детекция при λ=295 нм).
Растворитель А: 95% воды:5% метанола:0,05% трифторуксусной кислоты.
Растворитель В: 10% воды:90% метанола:0,05% трифторуксусной кислоты.
Градиент: 0-5 мин 100% А; 5-25 мин 50% А; 25-30 мин 0% А; 30-35 мин 0% А; 35-40 мин 100% А; 40-45 мин 100% А.
Фракции с одинаковым временем удерживания (14,5 мин) собирают, и растворители выпаривают.
Получают 9,10 мг белого порошка (выход 99%). МС: 1019 (М+Н+); 1041 (M+Na+).
1.3. Синтез производного антитела с HDP 30.0134 Her-DSC-30.0134
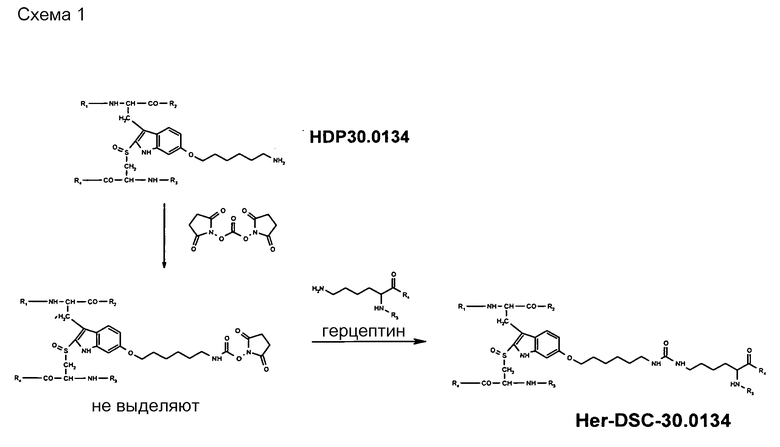
На схеме 1 (и других схемах, показанных в примерах) герцептин представлен схематической формулой, показывающей одну лизиновую боковую цепь, причем R3 и R4 представляют остальную часть белка антитела герцептина.
1.3.1. Синтез конъюгата 6'-(6-аминогексил-6-гидроксисукцинимидил)-α-аманитин-герцептин Her-DSC-30.0134 с различными полезными нагрузками токсина (таблица 2)
Растворяют 5,00 мг 6'-(6-аминогексил)-α-аманитина HDP 30.0134 в 538 мкл сухого диметилформамида (ДМФА). В атмосфере аргона и при перемешивании при комнатной температуре сразу же добавляют 18,6 мкл раствора дигидроксисукцинимидокарбоната (DSC) в ДМФА (2,56 мг в 100 мкл ДМФА) и 10 мкл триэтиламина. Реакционную смесь перемешивают при комнатной температуре. Через 12 час добавляют 60 мл холодного диэтилового эфира. Выпавший в осадок α-аманитин-6'-(6-аминогексил-6-гидроксисукцинимидилкарбонат) собирают, промывают несколько раз диэтиловым эфиром и сушат в вакууме. Оставшееся твердое вещество растворяют в 750 мкл ДМФА = раствор А.
Растворяют 114,0 мг герцептина в 19,0 мл забуференного фосфатом физиологического раствора (PBS, pH=7,4) = раствор В.
Обрабатывают 3 образца раствора герцептина различными количествами растворов α-аманитин-6'-(6-аминогексил-6-гидроксисукцинимидилкарбоната)
образца
Три раствора герцептин-аманитин-линкер встряхивают при 4°С в течение 14 час, и каждый разделяют фильтрационной гель-хроматографией на сефадексе G-25 (колонка ХК-16; 2 мл/мин). Колонку с G-25 предварительно промывают 500 мл раствора PBS, рН=7,4. Фракцию конъюгата Her-DSC-30.0134 детектируют по поглощению УФ. Концентрацию белка определяют анализом RotiQuant (Carl Roth; Германия). Полезную нагрузку аманитина на герцептин определяют путем определения поглощения УФ при А=280 нм и А=310 нм.
Пример 2
Синтез конъюгата α-аманитина и антитела герцептина Her-DSC-30.0256
2.1. Получение 1-изоцианато-6-BocNH-аминогексана HDP 30.0247

Растворяют 2,50 г (11,56 ммоль) NH-Вос-1,6-гексаметилендиамина (Aldrich 79229) в 35 мл дихлорметана. Добавляют 35 мл насыщенного раствора NaHCO3 в воде. После добавления 1,143 г (3,85 ммоль) бис(трихлорметил)карбоната (трифосгена) реакционную смесь энергично перемешивают при 0°С в течение 30 мин. Органический слой отделяют, и водную фазу экстрагируют три раза 15 мл дихлорметана. Объединенные органические фазы сушат над MgSO4 и упаривают. Маслянистый остаток фракционируют при 150°С и давлении 0,059 кПа (0,59 мбар) в печи Kugelrohr. Получают 2,23 г (80%) прозрачного масла. МС: 242 (М+).
2.2. Синтез δ-O-(NH-boc-6-аминогексилкарбамоил)-α-аманитина HDP 30.0253
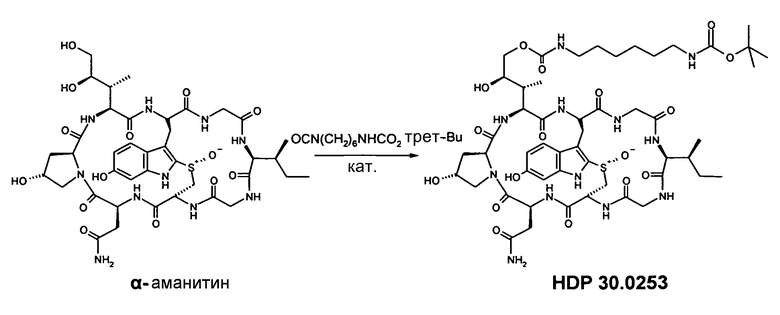
Кат. дибутилдилаурилстаннат н-Bu2Sn[OCO(CH2)10CH3]2
В атмосфере аргона 13,43 мг (14,6 мкмоль), высушенного в вакууме α-аманитина, растворяют в 1000 мкл сухого диметилформамида (ДМФА). Добавляют 7,08 мг (29,2 мкмоль) NH-Boc-6-изоцианатоаминогексана и 18,46 мг (29,2 мкмоль) дибутилдилаурилстанната и реакционную смесь перемешивают при температуре окружающей среды. Через 23 часа добавляют еще 13,43 мг (14,6 мкмоль) NH-Boc-6-изоцианатоаминогексана. Через 52 часа реакционную смесь гидролизуют 200 мкл метанола и упаривают досуха. Остаток растворяют в 1200 мкл ДМСО и очищают на колонке ВЭЖХ LaPrep Kromasil 100-C18, 10 мкм, 250 мм×20 мм, метанол/вода (0,05% ТФК), поток 26 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды:5% метанола. Растворитель В: 5% воды 95% метанола. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-25 мин 0% А; 25-27 мин 100% А; 27-35 мин 100% А. Фракции с одинаковым временем удерживания собирают и растворители выпаривают.
Получают 9,06 мг (выход 53%) белого твердого вещества. МС: 1161 (М+Н+); 1183 (М+Na+).
2.3. Синтез δ-O-(6-аминогексилкарбамоил)-α-аманитина HDP 30.0256
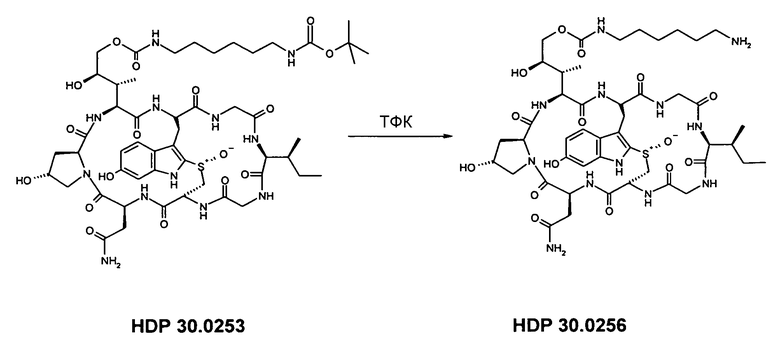
Растворяют 9,06 мг (7,8 мкмоль) HDP 30.0253 в 250 мкл трифторуксусной кислоты и перемешивают в течение 2 мин при температуре окружающей среды. Реакционную смесь упаривают досуха и остаток выпаривают 2 раза вместе с 1,5 мл ацетонитрила. Твердое вещество очищают на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, ацетонитрил/вода, поток 26 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды:5% ацетонитрила. Растворитель В: 5% воды:95% ацетонитрила. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-25 мин 0% А; 25-27 мин 100% А; 27-35 мин 100% А.
Фракции со временем удерживания 12-17 мин собирают и упаривают до белого твердого вещества.
Получают 8,75 мг (выход 95%). МС: 1061 (М+Н+); 1083 (M+Na+).
2.4. Синтез производного HDP 30.0256-антитело Her-DSC-30.0256
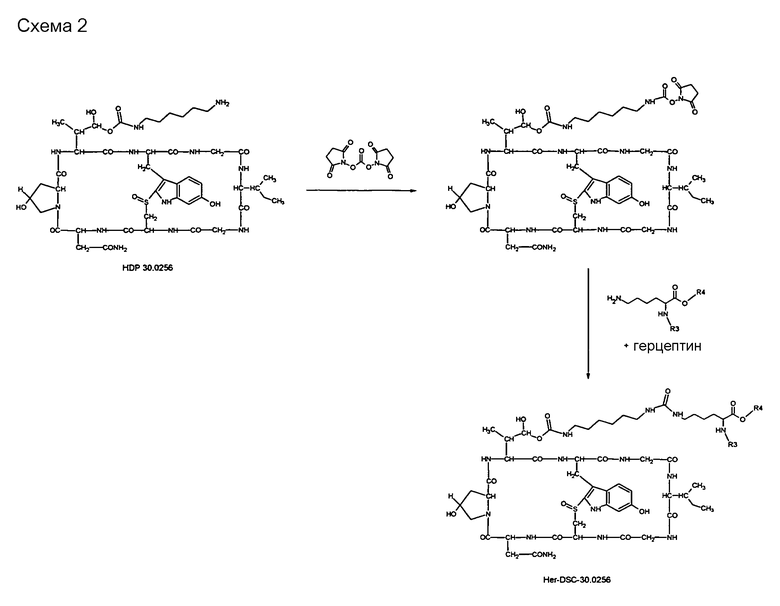
2.4.1. Синтез конъюгата HDP-30.0256-герцептин Her-DSC-30.0256 [3.3]
Растворяют 1,00 мг HDP 30.0256 в 108 мкл сухого диметилформамида (ДМФА). В атмосфере аргона и при перемешивании при комнатной температуре сразу же добавляют 10,0 мкл раствора дигидроксисукцинимидокарбоната (DSC) в ДМФА (2,56 мг в 100 мкл ДМФА) и 2,0 мкл триэтиламина. Реакционную смесь перемешивают при комнатной температуре. После инкубации в течение ночи добавляют 30 мл холодного диэтилового эфира. Вещество, выпавшее в осадок, собирают, промывают несколько раз диэтиловым эфиром и сушат в вакууме. Оставшееся твердое вещество растворяют в 143 мкл ДМФА = раствор А. Растворяют 12,0 мг герцептина в 6,0 мл забуференного фосфатом физиологического раствора (PBS, pH=7,4) = раствор В. Раствор А и раствор В объединяют. Раствор герцептин-аманитин-линкера встряхивают при 4°С в течение 14 час и разделяют фильтрационной гель-хроматографией на сефадексе G-25 (колонка ХК-16; 2 мл/мин). Колонку с G-25 предварительно промывают 500 мл раствора PBS, рН=7,4. Фракцию конъюгата Her-DSC-30.0256 детектируют по поглощению УФ. Концентрацию белка определяют анализом RotiQuant (Carl Roth; Германия). Полезную нагрузку аманитина на герцептин определяют путем определения поглощения УФ при А=280 нм и А=310 нм. Вычисляют полезную нагрузку токсина как 3,3 молекулы аманитина на каждую молекулу герцептина.
Пример 3
Синтез конъюгата β-аманитина и антитела герцептина Her-DSC-30.0304
3.1. Амид BocNH-гексаметилендиамино-6-β-аманитина HDP 30.0299
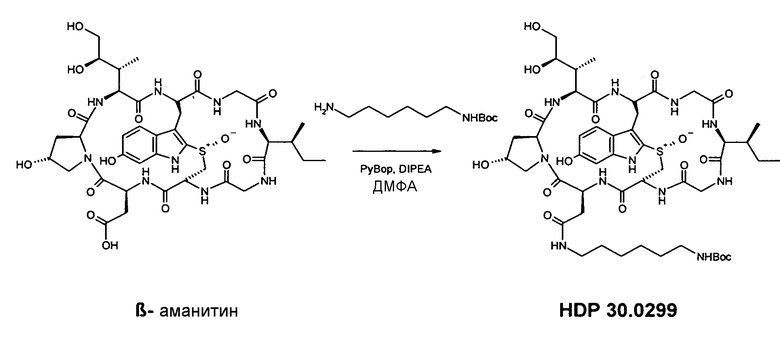
В атмосфере аргона 4,65 мг (5,05 мкмоль), высушенного в вакууме β-аманитина, растворяют в 1000 мкл сухого диметилформамида (ДМФА). При температуре окружающей среды добавляют 100 мкл 0,15 М раствора BocNH-гексаметилендиамина в ДМФА и 100 мкл 0,15 М раствора диизопропилэтиламина (DIPEA) в ДМФА. После последнего добавления 100 мкл 0,30 М раствора гексафторфосфата бензотриазол-1-ил-окситрипирролидинофосфония (PyBOP) в ДМФА реакционную смесь перемешивают в течение 20 час и гидролизуют 100 мкл воды. Реакционную смесь упаривают досуха в вакууме и остаток растворяют в 1000 мкл диметилсульфоксида (ДМСО). Очистку осуществляют на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, метанол/вода (0,05% ТФК), поток 26 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды:5% метанола. Растворитель В: 5% воды:95% метанола. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-25 мин 0% А; 25-27 мин 100% А; 27-35 мин 100% А.
Фракции с одинаковым временем удерживания собирают и растворители выпаривают.
Получают 4,45 мг белого твердого вещества (выход 80%). МС: 1119 М+Н+; 1141 M+Na+.
3.2. Амид 6'-гексаметилендиамино-β-аманитина HDP 30.0304
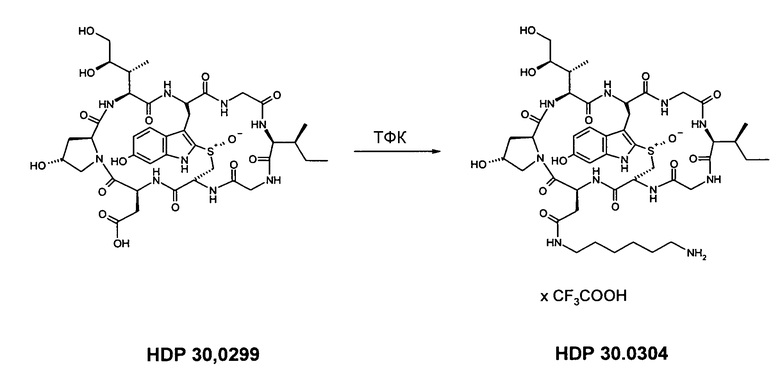
Растворяют 4,14 мг (3,70 мкмоль) амида BocNH-гексаметилендиамино-β-аманитина HDP 30.0299 в 500 мкл трифторуксусной кислоты (ТФК) и перемешивают в течение 2 мин. Избыток ТФК выпаривают в вакууме и остаток выпаривают вместе с 2 порциями ацетонитрила по 1000 мкл. Оставшееся твердое вещество очищают на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, метанол/вода (0,05% ТФК), поток 26 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды:5% метанола. Растворитель В: 5% воды:95% метанола. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-25 мин 0% А; 25-27 мин 100% А; 27-35 мин 100% А.
Фракции с одинаковым временем удерживания 13,43-14,02 мин собирают и растворители выпаривают. Остаток растворяют в 2000 мкл воды, раствор замораживают жидким азотом и сушат вымораживанием в течение ночи.
Получают 4,00 мг белой пены (выход 95%). МС: 1018 (М+Н+); 1041 (M+Na+).
3.3. Синтез производного HDP 30.0304-антитело Her-DSC-30.0304
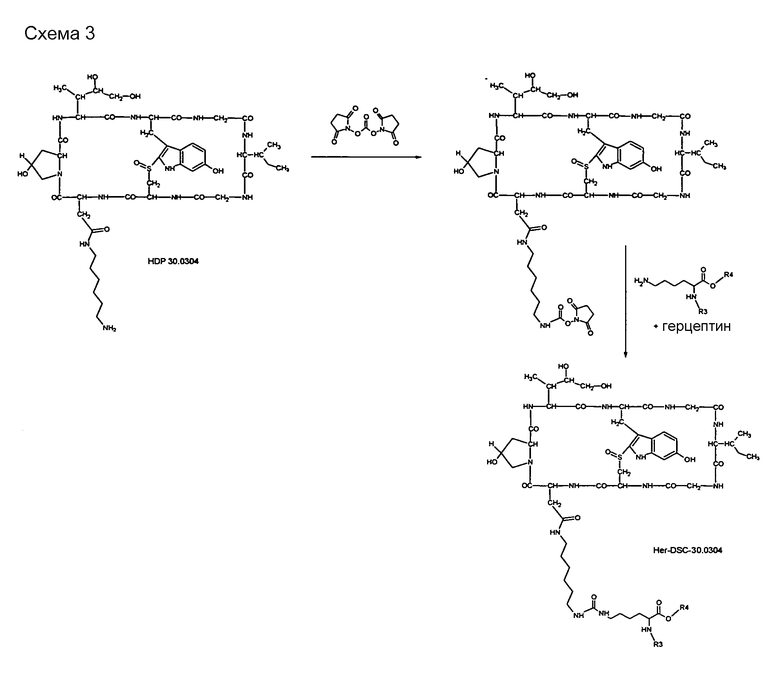
3.3.1. Синтез конъюгата HDP-30.0304-герцептин Her-DSC-30.0304 [4.7]
Растворяют 1,33 мг HDP 30.0304 в 144 мкл сухого диметилформамида (ДМФА). В атмосфере аргона и при перемешивании при комнатной температуре сразу же добавляют 13,4 мкл раствора дигидроксисукцинимидокарбоната (DSC) в ДМФА (2,56 мг в 100 мкл ДМФА) и 2,6 мкл триэтиламина. Реакционную смесь перемешивают при комнатной температуре. Через 12 час добавляют 30 мл холодного диэтилового эфира. Вещество, выпавшее в осадок, собирают, промывают несколько раз диэтиловым эфиром и сушат в вакууме. Оставшееся твердое вещество растворяют в 200 мкл ДМФА = раствор А. Растворяют 12,0 мг герцептина в 4,0 мл забуференного фосфатом физиологического раствора (PBS, pH=7,4) = раствор В. Раствор А и раствор В объединяют. Раствор герцептин-аманитин-линкера встряхивают при 4°С в течение 14 час и разделяют фильтрационной гель-хроматографией на сефадексе G-25 (колонка ХК-16; 2 мл/мин). Колонку с G-25 предварительно промывают 500 мл раствора PBS, рН=7,4. Фракцию конъюгата Her-DSC-30.0304 детектируют по поглощению УФ. Концентрацию белка определяют анализом RotiQuant (Carl Roth; Германия). Полезную нагрузку аманитина на герцептин определяют путем определения поглощения УФ при А=280 нм и А=310 нм. Вычисляют полезную нагрузку токсина как 4,7 молекулы аманитина на каждую молекулу герцептина.
Пример 4
Другие структуры конъюгатов аманитина и герцептина

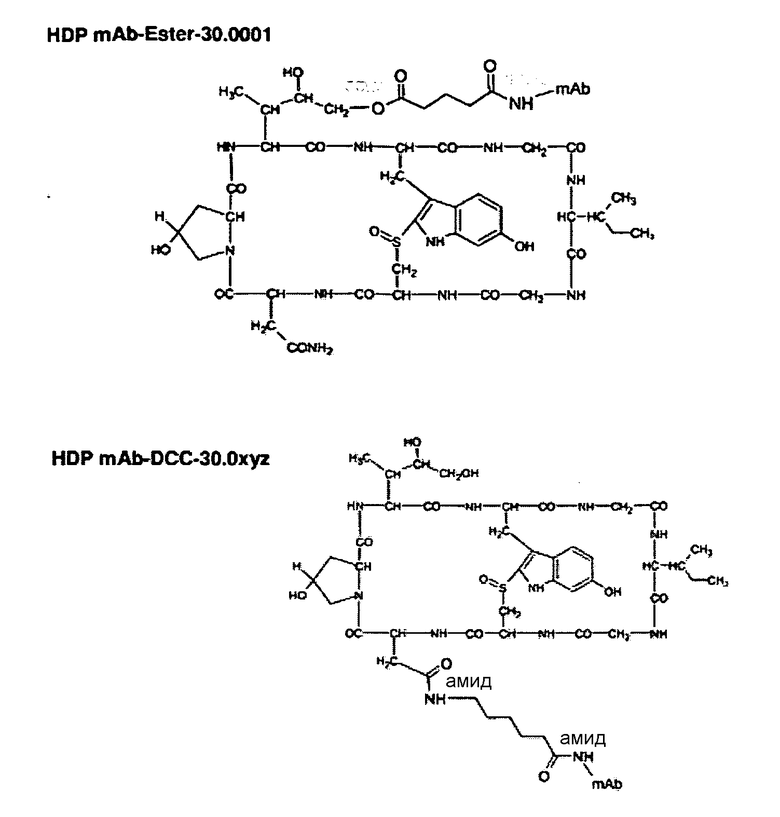
Пример 5
Цитотоксичность in vitro конъюгатов герцептин-аманитин на различных линиях HER2-положительных и HER2-отрицательных опухолевых клеток
Цитотоксическую активность Her-DSC-30.0134, Her-DSC-30.0256, Her-сложный эфир-30.00001, Her-DSC-30.0252 и Her-DSC-30.0127 оценивают in vitro с помощью линий HER2-положительных опухолевых клеток SKOV-3 (яичники), SK-BR-3 (молочная железа), NCI-N87 (желудок) и линии HER2-отрицательных опухолевых клеток MDA-MB231 (молочная железа) и хемилюминесцентного анализа включения BrdU (Roche Diagnostics). Жизнеспособность клеток определяют после 72-96 часов инкубации с различными концентрациями конъюгатов герцептин-аманитин при 37°С и 5% СО2 путем измерения фиксированных и свободных клеток с помощью антител анти-BrdU-HRP в спектрофотометре для прочтения микропланшетов BMG Labtech Optima. Величины ЕС50 из кривых дозовой зависимости вычисляют с помощью программы Graphpad Prism 4.0 (см. фигуры 2- 5).
Устойчивость конъюгатов герцептин-аманитин в плазме in vitro
5.1. Высвобождение аманитина после инкубации в плазме
Инкубируют 35 мкМ конъюгатов герцептин-аманитин в течение до 14 суток в мышиной плазме на водяной бане при 37°С. Берут образцы в различные моменты времени и анализируют на высвобожденные низкомолекулярные соединения аманитина методом ELISA. Для этого высвобожденный аманитин и метаболиты аманитина экстрагируют в различные моменты времени 80% EtOH. Растворы осветляют центрифугированием при 10000 g в течение 5 мин и супернатанты хранят при -70°С. Микролуночный планшет с прозрачными лунками Lumitrac (Greiner) сенсибилизируют кроличьей антиаманитиновой антисывороткой в течение ночи при 4°С. Планшет блокируют 3% BSA в PBS в течение 1 часа при 37°С и промывают три раза 0,05% раствором Твина в PBS. Образцы аманитина и растворы аманитина с определенной концентрацией смешивают с 1 нМ раствором биотиниламанитина в 1% BSA/PBS и инкубируют в сенсибилизированных лунках в течение 1 часа при 37°С. Лунки промывают три раза 0,05% раствором твина в PBS. Исходный раствор стрептавидин-HRP (Sigma-Aldrich) (1 мг/мл в PBS) разбавляют 1:1000 3% BSA/PBS и добавляют по 50 мкл в каждую лунку. После инкубации в течение 1 часа при 37°С лунки промывают три раза 0,05% раствором Твина в PBS. В каждую лунку добавляют 50 мкл раствора люминола (Appelichem), и измеряют сигнал люминесценции спектрофотометром BMG Labtech Optima. Количества высвобожденных соединений аманитина вычисляют методом линейной регрессии (см. фигуры 6-7).
5.2. Цитотоксическая активность после инкубации в плазме
Конъюгаты герцептин-аманитин инкубируют на протяжении до 11 суток в человеческой плазме на водяной бане при 37°С. Берут образцы в различные моменты времени и анализируют на оставшуюся цитотоксическую действенность на HER2-положительных клетках SKOV-3 хемилюминесцентным анализом включения BrdU (Roche Diagnostics) in vitro. Жизнеспособность клеток определяют после 72-часовой инкубации с различными концентрациями конъюгатов герцептин-аманитин при 37°С и 5% СО2 путем измерения фиксированных и свободных клеток с помощью антител анти-BrdU-HRP в спектрофотометре для прочтения микропланшетов BMG Labtech Optima. Величины ЕС50 из кривых дозовой зависимости вычисляют с помощью программы Graphpad Prism 4.0 (см. фигуру 8).
Противоопухолевая активность конъюгатов герцептин-аманитин на мышиных моделях с ксенотрансплантатами с HER2-положительными раковыми клетками
Шестинедельных самок атимичных мышей BALB/c nu/nu закупают (Janvier) и произвольно делят на три группы по восемь мышей в каждой. Каждой мыши инъецируют s.c. в бок 2,5×106 клеток SKOV-3. На 19 день после инокуляции опухоли инъецируют один раз i.v. конъюгаты герцептин-аманитин в дозе 50 мкг/кг, в то время как отрицательной контрольной группе инъецируют носитель (буфер NaCl). Регистрируют такие параметры, как выживаемость, масса и размер опухоли (см. фигуру 9).
Пример 6
Получение дополнительных соединений α-аманитин-линкер HDP 30.0353, HDP 30.0354, HDP 30.0355, HDP 30.0409, HDP 30.0410, HDP 30.0411 и HDP 30.0412
6.1. Аманитин-линкер HDP 30.0353
6.1.1. Синтез 6'-O-(NH-boc-6-амино-3,4-дитиагексил)-α-аманитина HDP 30.0341
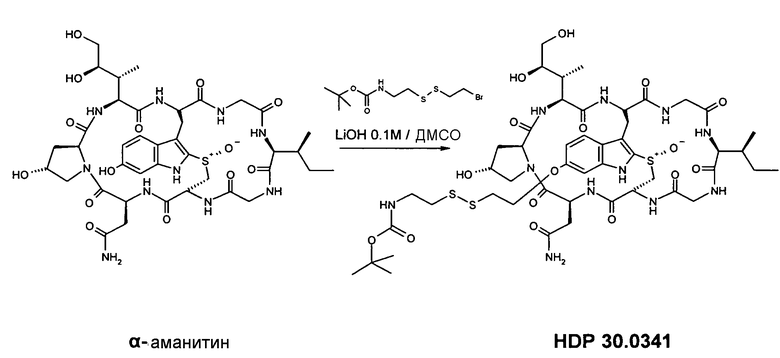
Растворяют 6,78 мг (7,38 мкмоль) высушенного в вакуме α-аманитина в 500 мкл диметилсульфоксида (ДМСО). В атмосфере аргона добавляют 18,67 г (59,02 мкмоль, 8 экв.) NH-boc-амино-3,4-дитиагексилбромида и 73,8 мкл 0,1 М раствора LiOH (7,38 мкмоль, 1 экв.) в смеси вода/ДМСО (1:1). Через 1 час, 3,5 часа, 4,5 часа, 6,5 час и 8 час добавляют дополнительные эквиваленты 0,1 М раствора LiOH. Сырую реакционную смесь очищают на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, метанол/вода (0,05% ТФК), поток 6,5 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды:5% метанола:0,05% трифторуксусной кислоты. Растворитель В: 10% воды:90% метанола:0,05% трифторуксусной кислоты. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-25 мин 0% А; 25-27 мин 100% А; 27-35 мин 100% А.
Фракцию со временем удерживания 20,8-21,4 мин собирают и растворители выпаривают в вакууме.
Получают 1,29 мг (выход 15%) белого твердого вещества. МС: 1154 М+Н+.
6.1.2. Синтез 6'-O-(6-амино-3,4-дитиагексил)-α-аманитина HDP 30.0353
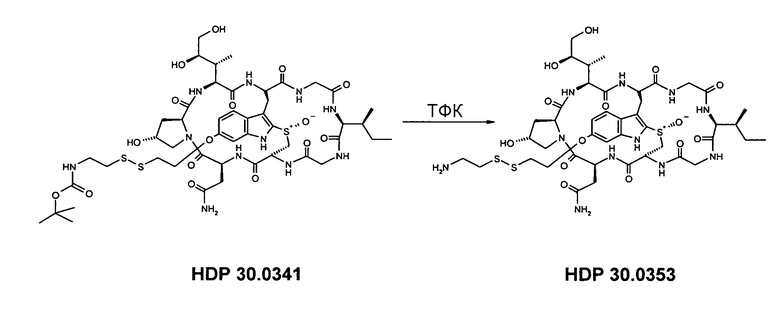
Растворяют 1,29 мг (1,12 мкмоль) 6'-O-(NH-boc-6-амино-3,4-дитиагексил)-α-аманитина HDP 30.0341 в 200 мкл трифторуксусной кислоты (ТФК). Реакционную смесь перемешивают в атмосфере аргона при комнатной температуре. Через 1 час трифторуксусную кислоту разбавляют 1000 мкл толуола и выпаривают досуха. Температура не должна превышать 20°С. Такой процесс повторяют с 1000 мкл толуола и 1000 мкл ацетонитрила (2×). Сырой простой эфир α-аманитина очищают на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, метанол/вода (0,05% ТФК), поток 6,5 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды:5% метанола, 0,05% трифторуксусной кислоты. Растворитель В: 10% воды:90% метанола, 0,05% трифторуксусной кислоты. Градиент: 0-5 мин 100% А; 5-25 мин 50% А; 25-30 мин 0% А; 30-35 мин 0% А; 35-40 мин 100% А; 40-45 мин 100% А.
Фракцию со временем удерживания 16,1-17,0 мин собирают и растворители выпаривают. Остаток сушат вымораживанием в воде.
Получают 0,39 мг желтого твердого вещества (выход 30%, соль ТФК). МС: 1054 М+Н+.
6.2. Аманитин-линкер HDP 30.0354
6.2.1. Синтез 6'-O-(NH-boc-7-амино-4,5-дитиагептил)-α-аманитина HDP 30.0349
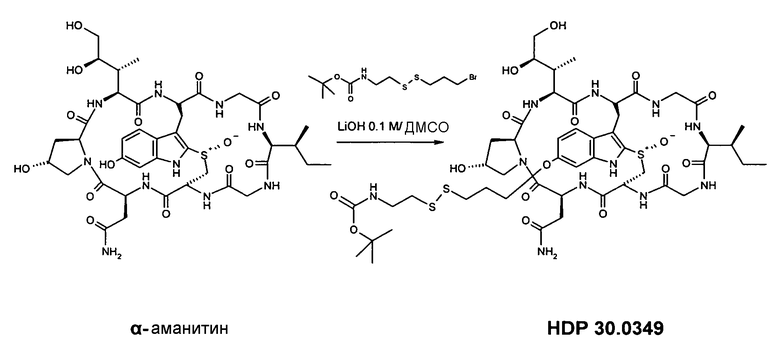
Растворяют 5,67 мг (6,17 мкмоль) высушенного в вакуме α-аманитина в 250 мкл сухого диметилсульфоксида (ДМСО). В атмосфере аргона при комнатной температуре добавляют 19,00 мг (58,00 мкмоль, 9,3 экв.) NH-boc-7-амино-4,5-дитиагептилбромида HDP 30.0345. Сразу добавляют 61,7 мкл 0,1 М раствора LiOH (6,10 мкмоль, 1 экв.) в смеси вода/ДМСО (1:1). Реакционную смесь перемешивают в течение 3,5 час, и добавляют еще 10 мкл (13,00 мг; 39,7 мкмоль; 6,3 экв.) NH-boc-7-амино-4,5-дитиагептилбромида HDP 30.0345 и 61,7 мкл 0,1 М раствора LiOH в смеси вода/ДМСО (1:1). Через 8 час сырую реакционную смесь очищают на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, метанол/вода (0,05% ТФК), поток 26 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды: 5% метанола, 0,05% трифторуксусной кислоты. Растворитель В: 10% воды: 90% метанола, 0,05% трифторуксусной кислоты. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-30 мин 0% А; 30-35 мин 100% А; 35-40 мин 100% А.
Фракцию со временем удерживания 19,4-21,0 мин собирают и упаривают досуха при комнатной температуре.
Получают 4,83 мг (выход 67%) белого порошка. МС: 1168 М+Н+.
6.2.2. Синтез 6'-O-(7-амино-4,5-дитиагептил)-α-аманитина HDP 30.0354
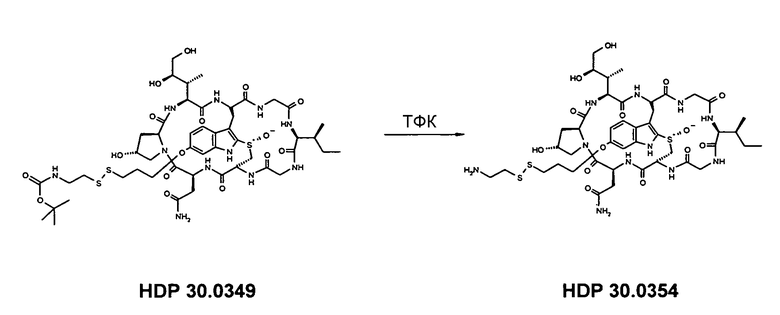
Растворяют 4,83 мг (4,13 мкмоль) 6'-O-(NH-boc-7-амино-4,5-дитиагептил)-α-аманитина HDP 30.0349 в 200 мкл трифторуксусной кислоты (ТФК). Реакционную смесь перемешивают в атмосфере аргона в течение 1 мин и упаривают досуха при температуре окружающей среды. Остаток упаривают вместе с 1000 мкл толуола и 1000 мкл ацетонитрила. Оставшееся твердое вещество очищают на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, метанол/вода (0,05% ТФК), поток 6,5 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды: 5% метанола, 0,05% трифторуксусной кислоты. Растворитель В: 10% воды: 90% метанола, 0,05% трифторуксусной кислоты. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-25 мин 0% А; 25-27 мин 100% А; 27-35 мин 100% А.
Фракцию со временем удерживания 17,1-17,5 мин собирают и упаривают. Остаток сушат вымораживанием в воде.
Получают 0,36 мг желтого твердого вещества (выход 7,0%, соль ТФК). МС: 1068 М+Н+.
6.3. Аманитин-линкер HDP 30.0355
6.3.1. Синтез 6'-O-(NH-boc-7-амино-3,3-диметил-4,5-дитиагептил)-α-аманитина HDP 30.0350

Растворяют 5,67 мг (6,17 мкмоль) высушенного в вакуме α-аманитина в 250 мкл сухого диметилсульфоксида (ДМСО). В атмосфере аргона добавляют 18,00 мг (51,62 мкмоль, 9,8 экв.) NH-boc-7-амино-3,3-диметил-4,5-дитиагептилбромида HDP 30.0348 и 61,7 мкл 0,1 М раствора LiOH (6,10 мкмоль, 1 экв.) в смеси вода/ДМСО (1:1). Через 2 часа реакционную смесь повторно обрабатывают 10 мкл (12,00 мг; 34,4 мкмоль; 5,6 экв.) NH-boc-7-амино-3,3-диметил-4,5-дитиагептилбромида HDP 30.0345 и 61,7 мкл 0,1 М раствора LiOH. Через 8 час смесь разбавляют ДМСО и очищают на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, метанол/вода (0,05% ТФК), поток 26 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды: 5% метанола, 0,05% трифторуксусной кислоты. Растворитель В: 10% воды: 90% метанола, 0,05% трифторуксусной кислоты. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-30 мин 0% А; 30-35 мин 100% А; 35-40 мин 100% А.
Фракцию со временем удерживания 20,5-21,0 мин собирают и растворители выпаривают.
Получают 0,51 мг (выход 7%, выход 48% относительно конвертированного α-аманитина). МС: 1196 М+Н+.
6.3.2. Синтез 6'-O-(7-амино-3,3-диметил-4,5-дитиагептил)-α-аманитина HDP 30.0355
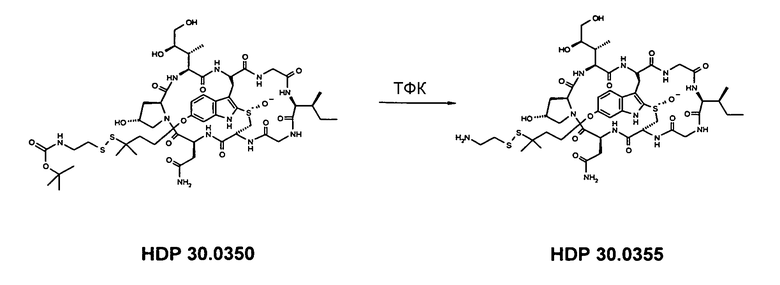
Растворяют 0,51 мг (0,43 мкмоль) HDP 30.0350 в 200 мкл трифторуксусной кислоты (ТФК) и перемешивают в течение 1 мин и при температуре окружающей среды. Трифторуксусную кислоту разбавляют 1000 мкл толуола и упаривают при 20°С досуха. Такой процесс повторяют с 1000 мкл толуола и 1000 мкл ацетонитрила (2×). Реакционную смесь очищают на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, метанол/вода (0,05% ТФК), поток 6,5 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды: 5% метанола, 0,05% трифторуксусной кислоты. Растворитель В: 10% воды: 90% метанола, 0,05% трифторуксусной кислоты. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-25 мин 0% А; 25-27 мин 100% А; 27-35 мин 100% А.
Фракцию со временем удерживания 18,2-18,6 мин собирают и растворители выпаривают. Остаток сушат вымораживанием в воде.
Получают 0,15 мг желтого твердого вещества (выход 27%, соль ТФК). МС: 1096 М+Н+.
6.4. Аманитин-линкер HDP 30.0409
6.4.1. Синтез 6'-O-(NH-boc-12-аминододецил)-α-аманитина HDP 30.0404

Растворяют 6,67 мг (7,26 мкмоль) высушенного в вакуме α-аманитина в 250 мкл сухого диметилсульфоксида (ДМСО). Добавляют 21,00 мг (58,10 мкмоль, 8 экв.) NH-boc-12-аминододецилбромида HDP 30.0383 и 72,6 мкл 0,1 М раствора LiOH (7,26 мкмоль, 1 экв.) в смеси вода/ДМСО (1:1). Через 6 час добавляют 36,5 мкл 0,1 М раствора LiOH, и двумя часами позже смесь гасят 72,6 мкл 0,1 М раствора уксусной кислоты в ДМСО. Сырую реакционную смесь очищают на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, метанол/вода (0,05% ТФК), поток 26 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды:5% метанола. Растворитель В: 5% воды:95% метанола. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-25 мин 0% А; 25-27 мин 100% А; 27-35 мин 100% А.
Фракцию со временем удерживания 22,0-22,7 мин собирают, и растворители выпаривают.
Получают 5,96 мг (выход 68%) белого твердого вещества. МС: 1202 М+Н+.
6.4.2. Синтез 6'-O-(12-аминододецил)-α-аманитина HDP 30.0409

Растворяют 5,96 мг (4,96 мкмоль) HDP 30.0404 в 200 мкл трифторуксусной кислоты (ТФК) и перемешивают в течение 1 мин и при температуре окружающей среды. Реакционную смесь упаривют вместе с 1000 мкл толуола и ацетонитрила и оставшееся твердое вещество очищают на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, ацетонитрил/вода, поток 26 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды: 5% ацетонитрила. Растворитель В: 5% воды: 95% ацетонитрила. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-25 мин 0% А; 25-27 мин 100% А; 27-35 мин 100% А.
Фракцию со временем удерживания 18,6-19,2 мин собирают и упаривают до белого твердого вещества.
Получают 6,03 мг (выход 99%, соль ТФК). МС: 1102 М+Н+.
6.5. Аманитин-линкер HDP 30.0410
6.5.1. Синтез 6'-O-(NH-boc-11-амино-3,6,9-триоксаундецил)-α-аманитина HDP 30.0405
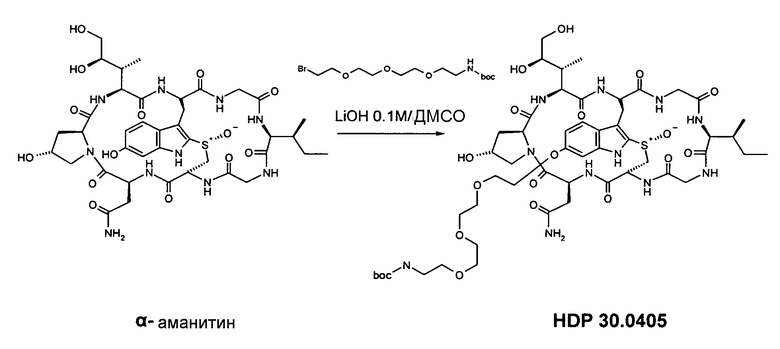
Растворяют 6,67 мг (7,26 мкмоль) высушенного в вакуме α-аманитина в 250 мкл сухого диметилсульфоксида (ДМСО). Добавляют 20,51 мг (58,10 мкмоль, 8 экв.) NH-boc-11-амино-3,6,9-триоксаундецилбромида HDP 30.0391 и 72,6 мкл 0,1 М раствора LiOH (7,26 мкмоль, 1 экв.) в смеси вода/ДМСО (1:1). Реакцию выполняют при температуре окружающей среды в атмосфере аргона. Через 6 час добавляют еще основание LiOH (0,5 экв.). Через 8 час смесь гасят 72,6 мкл 0,1 М раствора уксусной кислоты в ДМСО и очищают на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, метанол/вода (0,05% ТФК), поток 26 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды: 5% метанола. Растворитель В: 5% воды: 95% метанола. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-25 мин 0% А; 25-27 мин 100% А; 27-35 мин 100% А.
Фракцию со временем удерживания 18,1-18,6 мин собирают и растворители выпаривают.
Получают 4,68 мг (выход 54%) твердого вещества. МС: 1194 М+Н+.
6.5.2. Синтез 6'-O-(11-амино-3,6,9-триоксаундецил)-α-аманитина HDP 30.0410
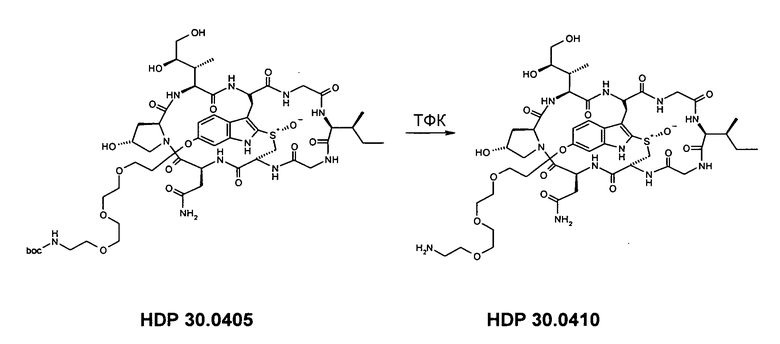
Растворяют 4,68 мг (3,92 мкмоль) HDP 30.0405 в 200 мкл трифторуксусной кислоты (ТФК) и перемешивают в течение 1 мин при температуре окружающей среды. Реакционную смесь упаривют вместе с толуолом и ацетонитрилом и сырое твердое вещество очищают на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, метанол/вода (0,05% ТФК), поток 26 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды: 5% метанола. Растворитель В: 5% воды: 95% метанола. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-25 мин 0% А; 25-27 мин 100% А; 27-35 мин 100% А.
Фракцию со временем удерживания 18,6-19,2 мин собирают и упаривают. Оставшееся твердое вещество сушат вымораживанием в воде.
Получают 2,44 мг вещества (выход 52%, соль ТФК). Белый порошок. МС: 1102 М+Н+.
6.6. Аманитин-линкер HDP 30.0411
6.6.1. Синтез 6'-O-(NH-boc-16-аминогексадецил)-α-аманитина HDP 30.0406
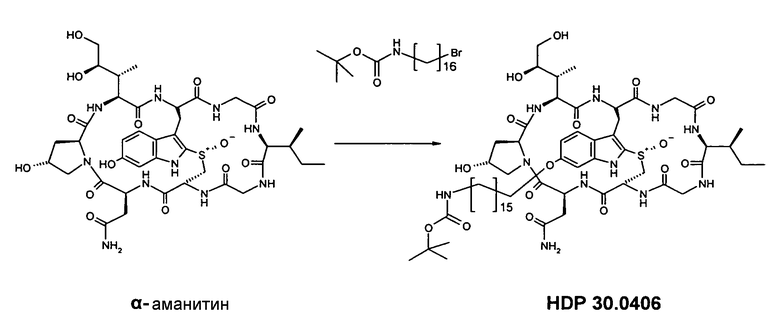
Растворяют 6,67 мг (7,26 мкмоль) высушенного в вакуме α-аманитина в 750 мкл сухого диметилсульфоксида (ДМСО). При комнатной температуре в атмосфере аргона добавляют 24,00 мг (58,10 мкмоль, 8 экв.) NH-boc-16-аминогексадецилбромида HDP 30.0398. Добавляют 72,6 мкл 0,1 М раствора LiOH (7,26 мкмоль, 1 экв.) в смеси вода/ДМСО (1:1) и реакционную смесь нагревают до 50°С. Через 6 час добавляют еще основание LiOH (36,5 мкл) и через 8 час смесь гасят 72,6 мкл 0,1 М раствора уксусной кислоты в ДМСО. Затвердевшую реакционную смесь разбавляют ДМСО и очищают на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, метанол/вода (0,05% ТФК), поток 26 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды: 5% метанола. Растворитель В: 5% воды: 95% метанола. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-25 мин 0% А; 25-27 мин 100% А; 27-35 мин 100% А.
Фракцию со временем удерживания 23,4-24,1 мин собирают и растворители выпаривают.
Получают 4,41 мг (выход 48%) белого твердого вещества. МС: 1258 М+Н+.
6.6.2. Синтез 6'-O-(16-аминогексадецил)-α-аманитина HDP 30.0411

Растворяют 4,41 мг (3,50 мкмоль) HDP 30.0406 в 200 мкл трифторуксусной кислоты (ТФК) и перемешивают в течение 2 мин при температуре окружающей среды. Реакционную смесь упаривают два раза вместе с 1000 мкл толуола и 1000 мкл ацетонитрила, и твердый остаток очищают на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, метанол/вода (0,05% ТФК), поток 26 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды: 5% метанола. Растворитель В: 5% воды: 95% метанола. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-25 мин 0% А; 25-27 мин 100% А; 27-35 мин 100% А.
Фракцию со временем удерживания 20,5-21,2 мин собирают и упаривают. Остаток сушат вымораживанием в воде.
Получают 2,44 мг (выход 52%, соль ТФК). МС: 1102 М+Н+.
6.7. Аманитин-линкер HDP 30.0412
6.7.1. Синтез 6'-O-(NH-boc-2-аминоэтил)-α-аманитина HDP 30.0317
Растворяют 20,00 мг (21,8 мкмоль) высушенного в вакуме α-аманитина в 900 мкл сухого диметилсульфоксида (ДМСО). При комнатной температуре добавляют 100,0 мкл 0,218 М раствора трет-бутилата калия (21,8 мкмоль, 1 экв.) в ДМСО и 39,00 мг (174,1 мкмоль, 8 экв.) NH-boc-2-аминоэтилбромида (полученного от Fluka). Через 4 и 6 час добавляют еще 1 и 2 эквивалента трет-бутилата калия и NH-boc-2-аминоэтилбромида. Через 23 часа смесь гасят 72,6 мкл 0,1 М раствора уксусной кислоты в ДМСО и очищают на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, метанол/вода (0,05% ТФК), поток 26 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды: 5% метанола. Растворитель В: 5% воды: 95% метанола. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-25 мин 0% А; 25-27 мин 100% А; 27-35 мин 100% А.
Фракцию со временем удерживания 13,2-14,5 мин собирают, и растворители выпаривают.
Получают 3,86 мг (выход 16%) белого твердого вещества. МС: 1062 М+Н+.
6.7.2. Синтез 6'-O-(2-аминоэтил)-α-аманитина HDP 30.0412
Растворяют 3,86 мг (3,36 мкмоль) HDP 30.0317 в 200 мкл трифторуксусной кислоты (ТФК) и перемешивают в течение 2 мин при комнатной температуре. Реакционную смесь упаривают вместе с 1000 мкл толуола и 1000 мкл ацетонитрила, и твердое вещество очищают на установке ВЭЖХ LaPrep:
колонка Kromasil 100-C18, 10 мкм, 250×20 мм, метанол/вода (0,05% ТФК), поток 26 мл/мин, детекция при λ=295 нм. Растворитель А: 95% воды: 5% метанола. Растворитель В: 5% воды: 95% метанола. Градиент: 0-5 мин 100% А; 5-20 мин 0% А; 20-25 мин 0% А; 25-27 мин 100% А; 27-35 мин 100% А.
Фракцию со временем удерживания 20,5-21,2 мин собирают и упаривают. Остаток сушат вымораживанием в воде.
Получают 1,54 мг (выход 44%, соль ТФК) белого твердого вещества. МС: 962 М+Н+.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТЫ АМАТОКСИНА С УЛУЧШЕННЫМИ СВЯЗЯМИ | 2012 |
|
RU2575854C2 |
| ПРОИЗВОДНЫЕ АМАТОКСИНА | 2014 |
|
RU2695370C2 |
| НОВЫЙ СПОСОБ СИНТЕЗА АМАНИТИНОВ | 2018 |
|
RU2792210C2 |
| КОНЪЮГАТЫ АМАТОКСИН - АНТИТЕЛО | 2016 |
|
RU2724328C2 |
| СИНТЕЗ (S)-6-ГИДРОКСИТРИПТОФАНА И ЕГО ПРОИЗВОДНЫХ | 2019 |
|
RU2810786C2 |
| КОНЪЮГАТ АНТИТЕЛА С АМАТОКСИНОМ НЕПРИРОДНОГО ТИПА | 2018 |
|
RU2840926C2 |
| КОНЪЮГАТ АНТИТЕЛА С АМАТОКСИНОМ НЕПРИРОДНОГО ТИПА | 2018 |
|
RU2798981C2 |
| СПОСОБЫ СИНТЕЗА АМАТОКСИНОВОГО СТРУКТУРНОГО БЛОКА И АМАТОКСИНОВ | 2013 |
|
RU2637924C2 |
| КОНЪЮГАТ АМАНТИНА С АНТИТЕЛОМ | 2018 |
|
RU2809116C2 |
| СИСТЕМЫ ДОСТАВКИ ДЛЯ КОНТРОЛИРУЕМОГО ВЫСВОБОЖДЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2016 |
|
RU2748992C2 |

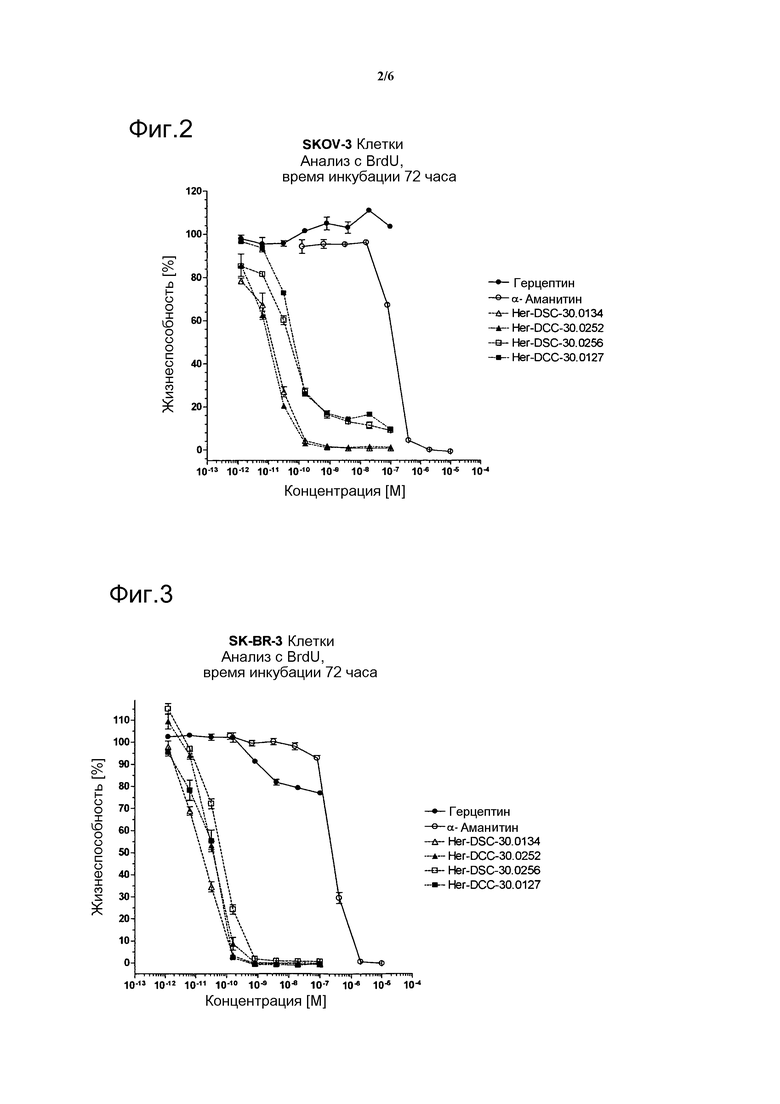

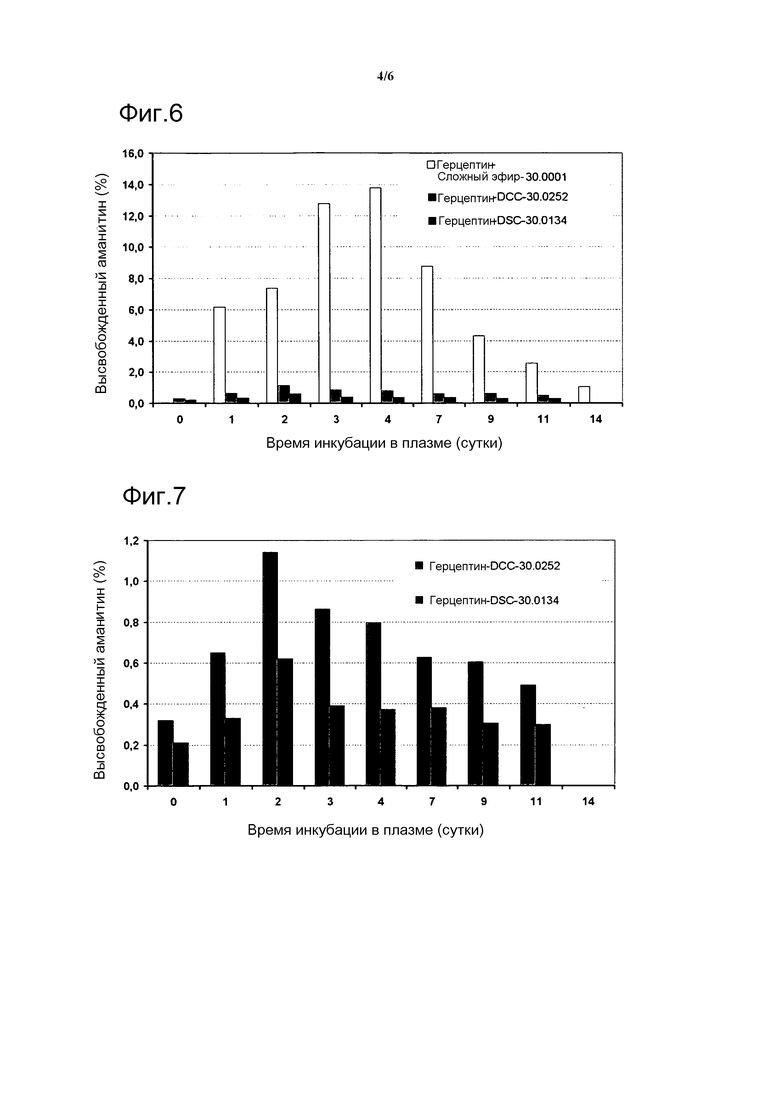

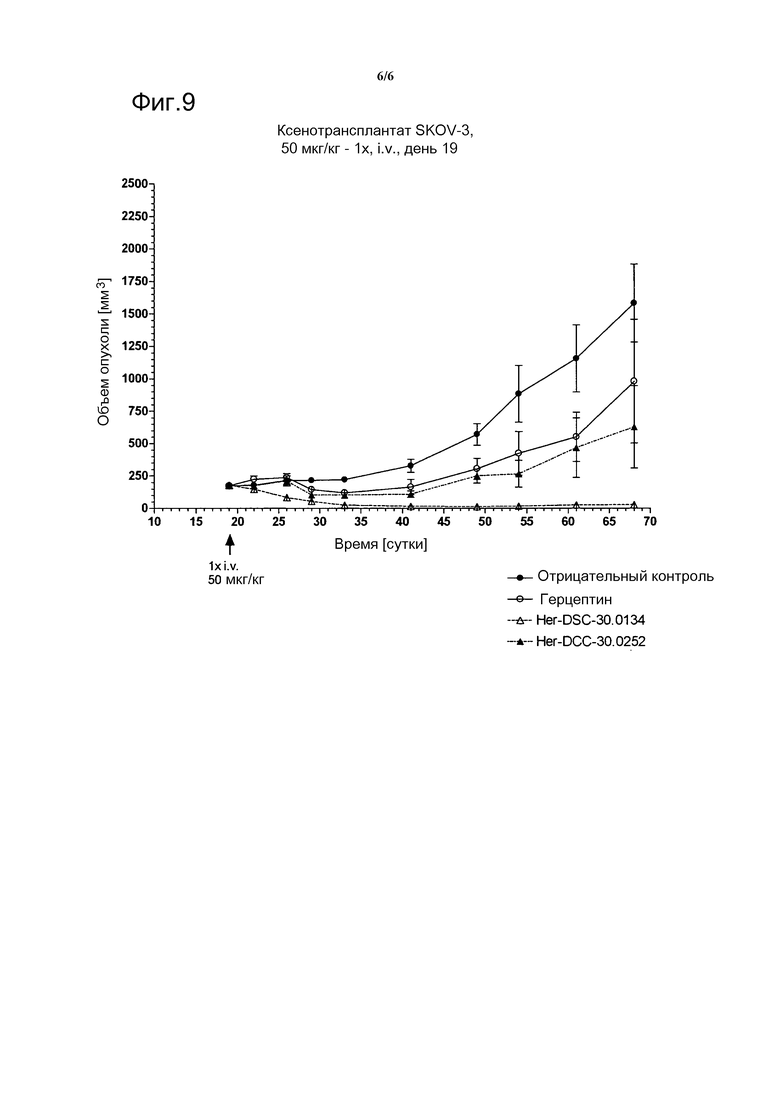
Изобретение относится к противоопухолевой терапии. В одном аспекте настоящее изобретение относится к конъюгатам аматоксина и части, связывающей мишень, например, антитела, соединенные линкером, включающим остаток мочевины, которые предназначены для лечения рака. В другом аспекте изобретение относится к фармацевтическим композициям, включающим такие конъюгаты, и способу получения указанных конъюгатов. Конъюгаты имеют высокую стабильность в плазме, что приводит к уменьшению вредного побочного действия на клетки. 4 н. и 10 з.п. ф-лы, 9 ил., 6 пр.
1. Конъюгат, включающий связывающую мишень часть, выбранную из группы, состоящей из:
(i) антитела или его антигенсвязывающего фрагмента;
(ii) антителоподобного белка; и
(iii) аптамеры нуклеиновой кислоты;
соединенную через линкер L с аматоксином, выбранным α-аманитина, β-аманитина, γ-аманитина, ε-аманитина, аманина, аманинамида, амануллина и амануллиновой кислоты или фармацевтически приемлемых солей или их функционально активных аналогов, где линкер L соединяется с аматоксином через
(i) γ-атом С аминокислоты 1 аматоксина через амидную связь;
(ii) атом кислорода, связанный с δ-атомом С аминокислоты 3 аматоксина через сложноэфирную связь, простую эфирную связь или уретановую связь; или
(iii) 6′-атом С аминокислоты 4 аматоксина через атом кислорода, связанный с 6′-атомом С аминокислоты 4 аматоксина;
где в каждом случае линкер L соединен с частью, связывающей мишень, через остаток мочевины.
2. Конъюгат по п. 1, где конъюгат имеет структуру, выбранную из следующих структур:
(i) аматоксин-γС (О)-NH-L-NH-C(О)-NH-(часть, связывающая мишень);
(ii) аматоксин-δС-O-С(О)-L-NH-C(О)-NH-(часть, связывающая мишень);
(iii) аматоксин-δС-O-L-NH-C(О)-NH-(часть, связывающая
мишень);
(iv) аматоксин-δС-O-С(О)-NH-L-NH-C(О)-NH-(часть, связывающая мишень) и
(v) аматоксин-6′C-O-L-NH-C(О)-NH-(часть, связывающая мишень).
3. Конъюгат по п. 1 или 2, где часть, связывающая мишень, соединена с линкером L через аминогруппу, присутствующую в указанной части, связывающей мишень, где указанная аминогруппа образует часть указанного остатка мочевины.
4. Конъюгат по п. 1, где линкер L представляет собой алкиленовую, гетероалкиленовую, алкениленовую, гетероалкениленовую, алкиниленовую, гетероалкиниленовую, циклоалкиленовую, гетероциклоалкиленовую, ариленовую, гетероариленовую, аралкиленовую или гетероаралкиленовую группу, необязательно замещенную.
5. Конъюгат по п. 1, где линкер L включает группу, выбранную из следующих групп: дисульфидная, простая эфирная, аминная, сложноэфирная, карбоксамидная, уретановая и мочевинная группа.
6. Конъюгат по п. 1, где часть, связывающая мишень, специфически связывается с эпитопом, который присутствует на опухолевой клетке, в частности, где часть, связывающая мишень, специфически связывается с эпитопом молекулы фактора адгезии эпителиальных клеток (ЕрСАМ).
7. Конъюгат по п. 1, где антитело или его антигенсвязывающий фрагмент выбирают из диатела, тетратела, нанотела, химерного антитела, деиммунизированного антитела, гуманизированного антитела или человеческого антитела.
8. Конъюгат по п. 1, где антигенсвязывающий фрагмент выбирают из группы, состоящей из Fab, F(ab′)2, Fd, Fv, одноцепочечного Fv и дисульфидсоединенного Fv (dsFv).
9. Конъюгат по п. 1 для применения в качестве лекарственного средства.
10. Конъюгат по п. 1 для лечения рака у пациента, где рак выбирают из группы, состоящей из рака поджелудочной железы, холангиокарциномы, рака молочной железы, колоректального рака, рака легких, рака предстательной железы, рака яичников, рака желудка, рака почек, злокачественной меланомы, лейкоза и злокачественной лимфомы.
11. Фармацевтическая композиция для лечения рака, включающая эффективное количество конъюгата по любому из пп. 1-8 и дополнительно включающая один или более фармацевтически приемлемых разбавителей, носителей, эксципиентов, наполнителей, связующих веществ, смазывающих веществ, глидантов, веществ, способствующих рассыпанию, адсорбентов и/или консервантов.
12. Конъюгирующая молекула аматоксина, включающая линкер L, соединенный с аматоксином, выбранным α-аманитина, β-аманитина, γ-аманитина, ε-аманитина, аманина, аманинамида, амануллина и амануллиновой кислоты или фармацевтически приемлемых солей или их функционально активных аналогов, через
(i) γ-атом С аминокислоты 1 аматоксина через амидную связь;
(ii) атом кислорода, связанный с δ-атомом С аминокислоты 3 аматоксина через сложноэфирную связь, простую эфирную связь или уретановую связь; или
(iii) 6′-атом С аминокислоты 4 аматоксина через атом кислорода, связанный с 6′-атомом С аминокислоты 4 аматоксина;
где в каждом случае линкер L включает производное карбаминовой кислоты -NH-C(O)-X, где X представляет собой удаляемую группу, которую можно заменить первичным амином или частью, связывающей мишень.
13. Конъюгирующая молекула аматоксина по п. 12, где X выбирают из -трет-бутилокси, -сукцинимидилокси, -1-O-сукцинимидилокси-3-сульфонатной группы (-сульфо-NHS), -О-(4-нитрофенилокси), -О-(3-нитрофенилокси), -О-(2,4-динитрофенилокси), -О-(2,4-дихлор-6-нитрофенилокси), пентафторфенилокси, -пентахлорфенилокси, -О-(2,4,5-трихлорфенилокси), -О-(3,4-дигидро-3-гидрокси-4-оксо-1,2,3-бензотриазин-3-ила), -О-(эндо-1-гидрокси-5-норборнен-2,3-дикарбоксимид-1-ила), -1-фталимидоилокси, 1-бензотриазолилокси, -1-(7-азабензотриазолил)окси и -N-имидазолила.
14. Способ синтеза конъюгата по любому из пп. 1-10, включающий стадию осуществления реакции конъюгирующей молекулы аматоксина по п. 12 или 13 со связывающей мишень частью, включающей первичную аминогруппу.
| WO 2007121326 A2, 25.10.2007;EP 1661584 A1, 31.05.2006;RU 2011145038 A, 20.05.2013 | |||
| WO 2010115629 A2, 14.10.2010. |
Авторы
Даты
2016-11-10—Публикация
2011-09-29—Подача