ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к штамму Bacillus sp.
Настоящее изобретение также относится к биосурфактантам, продуцируемым штаммом Bacillus sp, и к их применению. Оно также относится к композиции, содержащей указанные биосурфактанты, а также к способу получения указанных биосурфактантов.
Настоящее изобретение также относится к способу получения биосурфактанта, а также к устройству для реализации указанного способа.
Настоящее изобретение, в частности, находит применение в производстве биопестицидов или биосурфактантов для индустрии жизнестойкости растений, а также в области пищевой, косметической, химической, фармацевтической и нефтяной промышленности и охраны окружающей среды.
В последующем описании ссылки между ([]) относятся к библиографии, представленной в конце раздела "Примеры".
УРОВЕНЬ ТЕХНИКИ
Традиционная система сельскохозяйственного производства использует продукты для повышения жизнестойкости растений типа пестицидов с целью обеспечить достаточное с точки зрения количества и качества производство, в соответствии с рыночными ожиданиями и по стоимости, приемлемой для потребителя. Хотя применение этих продуктов дает преимущества для сельскохозяйственных систем, оно может, тем не менее, привести к негативным последствиям для здоровья человека и для окружающей среды. Ухудшение качества подземных и поверхностных вод и сокращение биоразнообразия в агробиоценозах являются наиболее часто упоминаемыми последствиями.
Известно, что биосурфактанты, в частности, таковые бактериального происхождения, обладают многими интересными свойствами, в частности, поверхностной активностью, противовирусными, антибактериальными и противогрибковыми свойствами, которые можно использовать в области повышения жизнестойкости растений. Указанные биосурфактанты можно применять по отдельности или в смеси нескольких биосурфактантов. При применении биосурфактантов в виде смесей продемонстрированы синергетические эффекты (Ongena and Jacques, 2008 Bacillus lipopeptides: versatile weapons for plant disease biocontrol. Trends Microbiol. 16, 115-125 [1]; CZ20011620 [2]; DE 102005050123 [3]).
Указанные биосурфактанты обладают лучшей биоразлагаемостью, более низкой токсичностью и большей физико-химической устойчивостью по сравнению с пестицидами химического происхождения. Кроме того, особую ценность на косметическом рынке имеют молекулы биологического происхождения, которые сочетают антимикробную активность и физико-химические свойства, например, эмульгаторов.
Биосурфактанты также применяются при принудительном извлечении нефти из отложений, где введение биосурфактантов снижает вязкость нефти и существенно повышает долю извлекаемой нефти. Они также применяются для борьбы с загрязнением воды углеводородами и являются гораздо более эффективными, чем химические поверхностно-активные вещества. Кроме того, указанные биосурфактанты не являются токсичными для обрабатываемых водных экосистем.
Таким образом, в течение нескольких последних лет потребность в биосурфактантах возросла, в частности, в области пищевой, косметической, химической, фармацевтической и нефтяной промышленности и охраны окружающей среды. Исследованы и применялись многие способы получения, являвшиеся предметом публикаций или патентных заявок (FR 2578552 [4]).
Тем не менее, биосурфактанты, доступные в настоящее время, не очень эффективны и обладают ограниченными биологическими и/или химическими свойствами.
Следовательно, существует реальная потребность в альтернативных биосурфактантах, предпочтительно обладающих улучшенными свойствами в сравнении с биосурфактантами известного уровня техники.
Кроме того, в настоящее время существует реальная потребность в доступных эффективных средствах для получения биосурфактантов.
В частности, исследовали способы получения биосурфактантов, продуцированных Bacillus sp.Однако указанные способы приводят к образованию пены, вызванной добавлением кислорода, в виде пузырьков. Первый подход состоит в использовании аэрируемых реакторов с механическим перемешиванием и непрерывным удалением пены, вызываемой наличием биосурфактанта и содержащей биосурфактант.Указанный способ является трудоемким и не очень годится, в частности, для крупномасштабного применения (Guez et аl., 2007. Setting up and modelling of overflowing fed-batch cultures of Bacillus subtilis for the production and continuous removal of lipoeptides. J Biotechnol, 131, 67-75 ([5]).
Для устранения проблемы пены были предприняты попытки работы в анаэробных условиях и использовании нитрата в качестве конечного акцептора электронов (Davis, Lynch and Varley. 1999. The production of surfactin in batch culture by Bacillus subtilis ATCC 21332 is strongly influenced by the conditions of nitrogen metabolism. Enzyme Microb. Technol. 25, 322-329. [6]; WO 0226961 [7]; EP 1320595 [8]). Производство биосурфактантов в значительной степени зависит от способности штаммов адаптироваться или не адаптироваться к указанным анаэробным условиям. До настоящего времени не разработано эффективного решения, обеспечивающего производство биосурфактантов в промышленных количествах. Кроме того, поскольку применение пестицидов химического происхождения все более и более оспаривается, необходимо исследовать и использовать молекулы биологического происхождения с целью замены пестицидов химического происхождения и разрабатывать способы получения указанных молекул биологического происхождения в промышленных масштабах.
Таким образом, существует реальная потребность в разработке способа и устройства, известных из уровня техники, для преодоления указанных недостатков, помех и препятствий, и в том числе способа непрерывного получения биосурфактантов в больших количествах при низких производственных затратах.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение точно соответствует вышеуказанным требованиям, обеспечивая штамм Bacillus subtilis, микосубтилины, композицию, содержащую указанные микосубтилины, и способ получения указанных микосубтилинов.
Настоящее изобретение также обеспечивает способ и устройство для получения биосурфактанта в промышленных масштабах, в частности, путем устранения или ограничения образования пены.
Предметом настоящего изобретения, таким образом, является способ получения биосурфактанта, включающий этап (а) культивирования микроорганизма, способного продуцировать биосурфактант в культуральной среде, содержащей органический субстрат, причем культивирование микроорганизма выполняется на поверхности мембранного контактора воздух/жидкость.
Изобретатели фактически впервые внедрили указанный способ и, как ни странно, обнаружили, что иммобилизация клеток на мембранном контакторе воздух/жидкость, в частности, благоприятна для непрерывного получения биосурфактантов без образования пены. Кроме того, способ в соответствии с изобретением повышает выход продукции биосурфактанта. Кроме того, применение мембранного контактора воздух/жидкость в способе в соответствии с настоящим изобретением позволяет получать биосурфактант непрерывно.
Здесь и далее "биосурфактант" означает поверхностно-активное вещество, являющееся амфифильным и продуцируемое микроорганизмом. Это может быть, например, соединение, выбранное из группы, включающей липопептид, фосфолипид, гликолипид, липопротеин или эфир жирной кислоты. Например, липопептид выбран из группы, включающей итурин, сурфактин, микосубтилин, сирингомицин, фенгицин (или плипастатин), лихенизин, бацилломицин, курстакин, толаасин, артрофактин, серраветтин, путисолвин и массетолид. Фосфолипид можно, например, выбрать из группы, включающей фосфатидилхолин. Эфир можно, например, выбрать из группы, включающей сорбитан или эфир рамнозы, мономиристин, монолинолеин и монолиноленин. Гликолипид может, например, являться рамнолипидом.
"Культивирование микроорганизма" означает все методики, используемые для выращивания микроорганизма и/или процесса продуцирования одного или более веществ микроорганизмом.
"Микроорганизм, способный продуцировать биосурфактант" означает любой одноклеточный или многоклеточный микроскопический организм, лишенный тканевой дифференциации и обладающий способностью синтезировать биосурфактант. Он может являться, например, бактерией, дрожжами, плесневым грибом и водорослью.
Бактерия, например, может принадлежать к роду, выбранному из группы, включающей Bacillus, Pseudomonas, Rhodococcus, Acinetobacter, Serratia, Burkholderia, Mycobacterium, Nocardia, Flavobacterium, Corynebacterium, Clostridium, Thiobacillus, Arthrobacter, Alcanivorax и Paenibacillus. Дрожжи, например, могут принадлежать к роду, выбранному из группы, включающей Candida, Pseudozyma, Ustilago, Schizonella, Kurtzmanomyces, Torulopsis, Rhodotorula и Wickerhamiella. Предпочтительно микроорганизм, способный продуцировать биосурфактант, принадлежит к роду Bacillus.
Если микроорганизм, способный продуцировать биосурфактант, принадлежит к роду Bacillus, он может быть, например, выбран из группы, включающей Bacillus subtilis, Bacillus thuringiensis, Bacillus licheniformis, Bacillus amyloliquefaciens, Bacillus cereus, Bacillus pumilus и Bacillus mojavensis. Он может, например, представлять собой штамм, выбранный из группы, включающей Bacillus subtilis, например, штамм, поданный 10 марта 2011 года под номером CNCM 1-4451 в Национальную коллекцию культур микроорганизмов (CNCM) Института Пастера (Париж, Франция). Кроме того, называют Bacillus subtilis BBG125, а также Bacillus subtilis АТСС 21332, Bacillus subtilis BBG21, Bacillus subtilis АТСС 6633, Bacillus subtilis BBG100, Bacillus subtilis ATCC 9943, Bacillus subtilis S499, Bacillus subtilis BBG116, Bacillus subtilis BBG131, Bacillus licheniformis BAS50, штамм, являющийся производным Bacillus licheniformis АТСС 14580, и Bacillus thuringiensis BBG300.
В предпочтительном случае, для получения микосубтилина, микроорганизм, способный продуцировать биосурфактант, выбран из группы, включающей Bacillus subtilis BBG125, Bacillus subtilis BBG100 и Bacillus subtilis BBG1116, предпочтительно - из группы, включающей Bacillus subtilis BBG125 и Bacillus subtilis BBG100.
В предпочтительном случае, для получения сурфактина, микроорганизм, способный продуцировать биосурфактант, является Bacillus subtilis BBG131.
В предпочтительном случае, для получения фенгицина, микроорганизм, способный продуцировать биосурфактант, выбран из группы, включающей Bacillus subtilis АТСС 21332 и Bacillus subtilis BBG21.
В предпочтительном случае, согласно изобретению, микроорганизм, способный продуцировать биосурфактант, является Bacillus subtilis BBG125.
Если микроорганизм, способный продуцировать биосурфактант, принадлежит к роду Pseudomonas, он может быть, например, выбран из группы, включающей Pseudomonas aeruginosa, Pseudomonas cichorii, Pseudomonas putida, Pseudomonas fluorescens, Pseudomonas stutzeri, Pseudomonas syhngae и Pseudomonas tolaasii.
Здесь и далее "органический субстрат" означает любое вещество или смесь веществ, обеспечивающих рост микроорганизма и/или добиться продуцирования одного или более веществ микроорганизмом. Органический субстрат, например, может быть выбран из группы, включающей крахмал, глюкозу, глутамат, сахарозу, ксилозу, глицерин, органические кислоты, аминокислоты и смесь указанных органических субстратов. Органический субстрат, например, может являться средой Лэнди со следующим составом: глюкоза, 20 г/л; глутаминовая кислота, 5 г/л; дрожжевой экстракт, 1 г/л, К2НРО4, 1 г/л; MgSO4, 0,5 г/л, KCl, 0,5 г/л, CuSO4, 1,6 мг/л; Fe2(SO4)3, 1,2 мг/л, MnSO4, 0,4 мг/л (Landy et al., 1948. Bacillomycin; an antibiotic from Bacillus subtilis active against pathogenic fungi. Proc. Soc. Exp. Biol. Med. 67, 539-541) [9]. Органический субстрат может также являться, например, модифицированной средой Лэнди, например, средой Лэнди с добавлением 2,3 г/л сульфата аммония и/или концентрации глутаминовой кислоты 2 г/л (Guez et al., 2008. Respiration activity monitoring system (RAMOS), an efficient tool to study the influence of the oxygen transfer rate on the synthesis of lipopeptide by Bacillus subtilis. J. Biotechnol. 134, 121-126 [10]).
Здесь и далее "контактор воздух/жидкость" означает устройство для оксигенации жидкой среды с использованием газа, содержащего кислород. Контактор воздух/жидкость включает, в частности, мембранный контактор воздух/жидкость. Он может являться, например, реактором, содержащим мембранный контактор воздух/жидкость. В качестве примера контакторов воздух/жидкость можно упомянуть следующие: "Картриджи из пустотелых волокон" ("Hollow fibre cartridges") от компании GE Healthcare в соответствии с моделями, определенными посредством ссылок, начиная с CFP, и "модули из пустотелых волокон" ("Hollow fibre modules") от компании Spectrum Labs в соответствии с моделями, определенными посредством ссылок, начиная с КМ.
Мембранный контактор воздух/жидкость также отделяет жидкую фазу от газовой фазы: газовая фаза циркулирует по одну сторону мембраны, а жидкая фаза протекает с другой стороны (Remize and Cabassud 2003, A novel bubble-free oxidation reactor: the G/L membrane contactor. Recent progress in method engineering. Integration of membranes in the methods 2. Lavoisier Tec and Doc. [11]), без смешивания двух указанных фаз.
"Мембранный контактор воздух/жидкость" означает пористую мембрану, обеспечивающую диффузию кислорода в культуральную среду.
Например, мембранный контактор воздух/жидкость может быть мембраной, изготовленной из полых волокон или плоских мембран.
Мембранный контактор воздух/жидкость может, например, иметь поры размером от 0,01 до 2 мкм, например, от 0,01 до 1 мкм, например, от 0,1 до 0,65 мкм.
Мембранный контактор воздух/жидкость может, например, обладать площадью поверхности от 0,1 до 20 м2. Площадь поверхности мембранного контактора воздух/жидкость предпочтительно составляет более 1 м2.
Мембранный контактор воздух/жидкость может, например, являться гидрофобной мембраной, что гарантирует лучшее разделение между указанными двумя фазами. Например, мембранный контактор воздух/жидкость может быть выполнен из материала, выбранного из группы полимеров, включающей полиэфирсульфон, полипропилен, полисульфон, регенерированную целлюлозу и эфиры целлюлозы.
Мембранный контактор воздух/жидкость может, например, быть плоским, цилиндрическим, цилиндроконическим или иметь любую геометрическую форму, оптимизирующую культивирование микроорганизма и обмен кислорода.
В качестве примера мембранного контактора воздух/жидкость можно упомянуть, в частности, следующие мембраны:
- (CFP-6-D-45) от GE-Healthcare Europe GmbH (Мюнхен, Германия);
- модули фильтрации из пустотелых волокон (картриджи из пустотелых волокон) от компании GE Healthcare в соответствии с моделями, определенными посредством ссылок, начиная с CFP;
- модули фильтрации из пустотелых волокон (модули из пустотелых волокон) от компании Spectrum Lab в соответствии с моделями, определенными посредством ссылок, начиная с КМ.
В соответствии с изобретением микроорганизмы, способные продуцировать биосурфактант, можно, полностью или частично, активно иммобилизовать на поверхности мембранного контактора воздух/жидкость. Другими словами, основную часть микроорганизмов, присутствующих в контакторе воздух/жидкость, иммобилизуют на поверхности мембраны указанного контактора, а другая часть находится в суспензии в культуральной среде после ее высвобождения.
Таким образом, способ в соответствии с настоящим изобретением может включать этап (а) культивирования микроорганизма, способного продуцировать биосурфактант в культуральной среде, содержащей органический субстрат, причем микроорганизм культивируют на поверхности мембранного контактора воздух/жидкость. Другими словами, способ по настоящему изобретению дает выгодную возможность обойтись без чашки для культивирования или ферментера. Способ по настоящему изобретению дает выгодную возможность непрерывного получения микосубтилинов в весьма удовлетворительных количествах. Способ по настоящему изобретению выгодно обеспечивает непрерывное применение. Можно добавить чашки для культивирования или ферментер, однако они не являются обязательными. Добавление чашек для культивирования или ферментера весьма нежелательно, так как это приведет к снижению выхода продукции. Таким образом, способ по настоящему изобретению выгодно осуществляется в устройстве, не содержащем чашек для культивирования или ферментера. Другими словами, в соответствии со способом по изобретению, культивирование микроорганизмов, способных продуцировать биосурфактант, можно проводить только на поверхности мембранного контактора воздух/жидкость.
Кислород, необходимый для микроорганизмов, способных продуцировать биосурфактант, проникает путем диффузии через поры мембранного контактора воздух/жидкость, где иммобилизованы указанные микроорганизмы. Другими словами, в соответствии с изобретением, оксигенация среды с микроорганизмами осуществляется не с помощью системы продувки, расположенной в реакторе, и не с помощью системы оксигенации, расположенной вне реактора для культивирования микроорганизмов.
Поток кислорода в мембранном контакторе воздух/жидкость можно настроить на любую скорость потока, обеспечивая оксигенацию микроорганизмов, способных продуцировать биосурфактант. Специалист в данной области техники может определить скорость потока кислорода в мембранном контакторе воздух/жидкость в соответствии с требуемым добавлением кислорода. Авторы изобретения обнаружили, что поток аэрации от 0,2 до 2 объемов воздуха на объем жидкости в минуту (vvm) является особенно эффективным для оксигенации культуральной среды и микроорганизмов. Таким образом, поток воздуха в контакторе воздух/жидкость может составлять, например, от 1,5 до 2 vvm. Поток аэрации в контакторе воздух/жидкость для получения микосубтилина предпочтительно составляет 0,25 vvm. Скорость потока аэрации в контакторе воздух/жидкость для получения сурфактина предпочтительно составляет 1 vvm. Скорость потока аэрации в контакторе воздух/жидкость для получения фенгицина предпочтительно составляет 0,5 vvm.
В соответствии со способом по изобретению этап культивирования (а) можно проводить на поверхности множества мембранных контакторов воздух/жидкость. Например, этап культивирования (а) можно проводить на поверхности двух мембранных контакторов воздух/жидкость, например, 3, 4, 5, 6, 7, 8, 9, 10 или даже более мембран воздух/жидкость. Специалист в данной области техники может определить количество мембранных контакторов воздух/жидкость в соответствии с получаемым количеством биосурфактанта.
Одной из целей настоящего изобретения является повышение количества микроорганизмов, иммобилизованных на поверхности мембранного контактора воздух/жидкость. Это можно сделать путем увеличения площади поверхности мембранного контактора воздух/жидкость и/или количества мембранных контакторов воздух/жидкость.
Если этап культивирования (а) проводят на поверхности множества мембранных контакторов воздух/жидкость, мембранные контакторы воздух/жидкость можно располагать, например, последовательно или параллельно. Предпочтительно, если этап культивирования (а) проводят на поверхности множества мембранных контакторов воздух/жидкость и мембранные контакторы воздух/жидкость располагают параллельно.
Способ по настоящему изобретению может дополнительно включать этап отделения биосурфактанта от культуральной среды, содержащей его. Этот этап отделения можно выполнить любым способом, известным специалистам в данной области техники, который позволяет отделить вещества, содержащиеся в жидкой среде.
Например, этап отделения биосурфактанта от культуральной среды, содержащей его, может включать один или более этапов, выбранных из группы, включающей микрофильтрацию, ультрафильтрацию, нанофильтрацию и центрифугирование.
Например, этап отделения биосурфактанта от культуральной среды, содержащей его, включает следующие этапы:
(б) микрофильтрации культуральной среды, полученной на этапе (а), для отделения микроорганизма от культуральной среды, и/или
(в) ультрафильтрации культуральной среды, полученной на этапе (а) или (б), для отделения биосурфактанта от культуральной среды, полученной на этапе (а) или (б).
Предпочтительно этап отделения включает каждый из этапов (б) и (в).
Этапы микрофильтрации (б) и ультрафильтрации (в) позволяют непрерывно выделять биосурфактант из культуральной среды, полученной на этапе (а) и/или (б).
Сочетание мембранного контактора воздух/жидкость с этапами микрофильтрации (б) и ультрафильтрации (в), таким образом, позволяет непрерывно продуцировать и отделять биосурфактант от микроорганизма, способного продуцировать его.
Этап микрофильтрации (б) можно выполнить с помощью любых средств микрофильтрации, позволяющих отделить микроорганизм от культуральной среды, содержащей его. Например, приспособление для микрофильтрации может являться мембраной для микрофильтрации. Например, приспособление для микрофильтрации может являться органической или минеральной мембраной для микрофильтрации, например, мембраной из пустотелых волокон.
Этап микрофильтрации (б) можно, например, выполнить с помощью мембраны из пустотелых волокон с размером пор от 0,1 до 0,45 микрометров (мкм). Предпочтительно мембрана из пустотелых волокон, используемая на этапе (б), имеет размер пор 0,2 мкм.
В качестве примера мембран, которые можно использовать для выполнения этапа микрофильтрации (б), можно привести следующие мембраны:
- пустотелые полисульфоновые или полиэфирсульфоновые волокна с размером пор 0,2 мкм, идентификационный номер CFP-2-E-4X2MA (GE-Healthcare Europe GmbH, Мюнхен, Германия);
- пустотелые полисульфоновые или полиэфирсульфоновые волокна с размером пор 0,45 мкм, идентификационный номер CFP-4-E-4X2MA, или с размером пор 0,56 мкм, идентификационный номер CFP-2-E-6X2MA (GE-Healthcare Europe GmbH, Мюнхен, Германия);
- модуль микрофильтрации или ультрафильтрации из пустотелых волокон (картриджи из пустотелых волокон) от компании GE Healthcare в соответствии с моделями, определенными посредством ссылок, начиная с CFP;
- модуль фильтрации из пустотелых волокон (модули из пустотелых волокон) от компании Spectrum Lab (Ранчо-Домингес, штат Калифорния, США) в соответствии с моделями, определенными посредством ссылок, начиная с КМ;
- кассеты для микрофильтрации Sartocon от компании Sartorius Stedim (Обань, Франция) в соответствии с моделями, определенными посредством ссылок, начиная с SPC20.
Этап ультрафильтрации (в) можно выполнить с помощью любых средств фильтрации, позволяющих отделить биосурфактант от культуральной среды, содержащей его, и концентрировать биосурфактант.Например, приспособление для ультрафильтрации может являться мембраной для ультрафильтрации, например, мембраной для ультрафильтрации из регенерированной целлюлозы.
Этап ультрафильтрации (в) можно, например, выполнить с помощью мембраны с порогом отсечки от 5 до 50 килодальтон (кДа), например, от 5 до 30 кДа, например, от 5 до 20 кДа. Предпочтительно мембрана, используемая на этапе (в), имеет порог отсечки 10 кДа.
В качестве примера мембран, которые можно использовать для выполнения этапа ультрафильтрации (в), можно привести следующие:
- мембрана для ультрафильтрации с порогом отсечки 10 кДа из регенерированной целлюлозы, идентификационный номер 3051443901E-SW (Sartorius, Геттинген, Германия);
- мембрана для ультрафильтрации с порогом отсечки 10 кДа из регенерированной целлюлозы, идентификационный номер Р2С010С01 (Millipore Headquarters, 290, Конкорд-роад, Биллерика, штат Массачусетс, США).
Мембраны, используемые на этапе (а), (б) и (в) предпочтительно являются стерилизуемыми при 121°C в течение 20 минут.
Способ по настоящему изобретению отличается от известных способов биологического разложения органических материалов микроорганизмами, которые выделяют биосурфактанты, тем, что можно повторно использовать или не использовать все микроорганизмы после отделения от них остатков органических веществ из культуральной среды и полученных биосурфактантов. Это позволяет получить высокий уровень концентрации микроорганизмов в биореакторе.
Он также отличается от известных способов биологического разложения органических материалов микроорганизмами, которые выделяют биосурфактанты, тем, что приблизительно 95% полученных биосурфактантов остаются в культуральной среде по меньшей мере без образования пены. Приблизительно 5% биосурфактантов адсорбируются на границе раздела воздух/жидкость мембранного контактора, однако их можно десорбировать, например, путем промывки мембраны.
Мембранный контактор воздух/жидкость можно промывать с помощью любых средств, известных специалистам в данной области техники, с целью извлечения полученных и адсорбированных на границе раздела воздух/жидкость мембранного контактора биосурфактантов. Например, промывку мембранного контактора воздух/жидкость можно выполнить с использованием одного или более моющих растворов, выбранных из группы, включающей дистиллированную воду, раствор NaOH, раствор NaOCl, раствор гидрокарбоната натрия или калия или раствор карбоната натрия или калия. Раствор для промывки можно довести до любого pH, обеспечивая увеличение количества выделенных биосурфактантов. Например, раствор для промывки доводят до pH=10.
Раствор для промывки можно довести до любой температуры, обеспечивая увеличение количества выделенных биосурфактантов. Например, раствор для промывки доводят до температуры от 20°C до 50°C.
В соответствии с настоящим изобретением температуру культуральной среды можно регулировать с помощью любых нагревательных средств, известных специалистам в данной области техники. Например, нагревательное приспособление может являться теплообменником. Теплообменник, например, можно выбрать из группы, включающей теплообменник с U-образной трубкой, теплообменник с горизонтальным трубчатым кластером, теплообменник с вертикальным трубчатым кластером, спиральный теплообменник, пластинчатый теплообменник, колонку Буи или блоковый теплообменник. Нагревательное приспособление предпочтительно является трубчатым теплообменником.
Таким образом, способ по настоящему изобретению можно осуществлять при любой температуре, позволяющей продуцировать биосурфактант микроорганизму, способному его продуцировать. Например, указанный способ можно осуществлять при температуре от 0°C до 70°C, преимущественно между 20°C и 37°C. Предпочтительно указанный способ получения микосубтилина можно осуществить при температуре 22°C. Предпочтительно указанный способ получения фенгицина можно осуществить при температуре 30°C. Предпочтительно указанный способ получения сурфактина можно осуществить при температуре 37°C.
Кроме того, способ по настоящему изобретению можно осуществлять при любом pH, позволяющем продуцировать биосурфактант микроорганизму, способному его продуцировать. pH можно регулировать за счет контролируемого добавления основного раствора или кислого раствора в культуральную среду.
Основной раствор, например, можно выбрать из группы, включающей гидроксид натрия, карбонат калия и аммиак.
Основной раствор, например, можно выбрать из группы, включающей гидроксид натрия, гидроксид калия и аммиак.
pH можно, например, регулировать до любого значения, позволяющего выжить микроорганизмам, способным продуцировать биосурфактант. Его можно, например, регулировать в диапазоне значений от pH 6 до pH 8, предпочтительно до значения pH 7. Специалист в данной области техники может определить количество основного раствора и кислого раствора для регулировки pH до требуемого значения.
Преимуществом способа по настоящему изобретению является то, что его можно осуществлять непрерывно, то есть подпитку мембранного контактора воздух/жидкость и выделение биосурфактантов, продуцируемых микроорганизмами, можно проводить без перерыва. Способ по настоящему изобретению можно осуществлять с любой почасовой скоростью, позволяющей выделять биосурфактант из микроорганизма, способного его продуцировать. Специалист в данной области техники может легко адаптировать скорость осуществления указанного способа, то есть скорость потока культуральной среды, вносимой в мембранный контактор воздух/жидкость. Авторы изобретения обнаружили, что осуществление непрерывного способа при скорости разбавления от 0,05 ч-1 до 0,5 ч-1 является особенно эффективным для продуцирования биосурфактантов микроорганизмами. Скорость разбавления определяют как скорость подачи или выделения, разделенную на объем культуры. Таким образом, способ по изобретению можно, например, выполнять с почасовой скоростью циркуляции, соответствующей степени разбавления от 0,05 ч-1 до 0,5 ч-1, предпочтительно с почасовой скоростью 0,1 ч-1.
Еще одной из целей настоящего изобретения является устройство для осуществления способа, описанного здесь, причем указанное устройство включает мембранный контактор воздух/жидкость. Например, устройство согласно изобретению включает по меньшей мере один контактор воздух/жидкость, включающий мембранный контактор воздух/жидкость.
Мембранный контактор воздух/жидкость и контактор воздух/жидкость могут соответствовать определению, приведенному выше.
Количество мембранных контакторов воздух/жидкость и контакторов воздух/жидкость может соответствовать определению, приведенному выше.
Устройство согласно изобретению не включает никаких средств для аэрации, кроме мембран или множества мембранных контакторов воздух/жидкость. Другими словами, устройство согласно изобретению не включает системы продувки, расположенной в реакторе. Оно также не включает системы оксигенации, расположенной вне реактора с культурой микроорганизма. Устройство в соответствии с настоящим изобретением может дополнительно включать приспособления для микрофильтрации и/или приспособления для ультрафильтрации. Устройство в соответствии с настоящим изобретением предпочтительно включает приспособления для микрофильтрации и приспособления для ультрафильтрации. Приспособления для микрофильтрации и приспособления для ультрафильтрации могут, например, соответствовать вышеприведенному описанию.
Преимущество устройства согласно изобретению состоит в том, что оно включает приспособления, необходимые для непрерывного осуществления способа согласно изобретению. Другими словами, устройство предпочтительно включает приспособление для внесения культуральной среды и приспособление для забора биосурфактанта, продуцируемого микроорганизмом. При получении устройства для непрерывного осуществления способа в соответствии с изобретением можно использовать любые приспособления для внесения и забора, известные специалистам в данной области техники.
Устройство согласно изобретению может дополнительно включать приспособление для выпаривания. Здесь и далее "приспособление для выпаривания" означает любое устройство для концентрирования биосурфактанта в среде, содержащей его. Оно может являться, например, приспособлением для выпаривания, выбранным из группы, включающей вакуумный испаритель типа Rotavapor VV000 (Heidolph Instruments GmbH & Co, Швабах, Германия) и испаритель с поднимающейся пленкой. Устройство в соответствии с настоящим изобретением может дополнительно включать нагреватель для регулирования температуры культуральной среды. Нагреватель может, например, являться одним из нагревателей, описанных выше. Систему нагревания можно подключить к контактору воздух/жидкость через систему труб.
"Система труб" означает любое приспособление, в котором может циркулировать текучая среда или газ. Например, текучая среда может являться жидкостью или гелем. Система труб позволяет, в частности, объединить различные элементы устройства согласно изобретению. Например, система труб может являться гибким или жестким силиконовым трубопроводом любого типа. (Cole Parmer, Верной Хиллс, штат Иллинойс, США), либо быть изготовлена из нержавеющей стали 316S (Swagelok Company, Солон, штат Огайо, США).
Циркуляцию текучей среды или газа по системе труб можно регулировать одним или более насосами и/или одним или более клапанами.
Устройство согласно настоящему изобретению может дополнительно включать по меньшей мере один насос.
В свете настоящего изобретения "насос" означает приспособление для придания скорости потоку жидкости, например, культуральной среды, в устройстве согласно настоящему изобретению. Он может являться, например, перистальтическим насосом, лопастным насосом или мембранным насосом. Можно упомянуть, например, перистальтические насосы с компактным приводом Masterflex L/S (Cole Parmer, Верной Хиллс, штат Иллинойс, США), Millipore Corporation (Millipore, Бедфорд, штат Массачусетс, США), насос Sartojet (Сарториус, Sartorius Stedim France SAS, Обань) и Watson-Marlow 323 (Watson Marlow, Фалмут, Корнуолл, Соединенное Королевство). Кроме того, насосом можно управлять вручную или автоматически.
Устройство согласно изобретению может дополнительно включать по меньшей мере один клапан.
Здесь и далее "клапан" означает приспособление для остановки или изменения потока жидкости, например, культуральной среды, в устройстве согласно настоящему изобретению. Он может являться, например, регулирующим клапаном, двухпозиционным клапаном или соленоидным клапаном. Можно упомянуть, например, регулирующие клапаны из поливинилиденфторида (ПВДФ), полипропилена (ПП), перфторалкокси (ПФА) или нержавеющей стали. Кроме того, клапаном можно управлять вручную или автоматически.
Авторы настоящего изобретения описывают в настоящем документе использование устройства согласно изобретению для осуществления способа по изобретению.
Еще одним предметом настоящего изобретения является штамм Bacillus subtilis, полученный из штамма Bacillus subtilis АТСС 6633, в котором оперон srfA, кодирующий синтетазу сурфактина, разорван и где промотор оперона туе, кодирующего микосубтилинсинтетазу, заменен конститутивным сильным промотором PrepU.
Предпочтительно указанный штамм Bacillus subtilis является штаммом Bacillus subtilis, поданным 10 марта 2011 года под номером CNCM I-4451 в Национальную коллекцию культур микроорганизмов (CNCM) Института Пастера (Париж, Франция). Этот штамм также называется Bacillus subtilis BBG125.
Еще одним предметом настоящего изобретения является способ получения микосубтилинов, включающий этап культивирования штамма Bacillus subtilis в соответствии с изобретением и этап извлечения полученных микосубтилинов.
Штамм Bacillus subtilis BBG125 можно, например, использовать в любом способе получения биосурфактантов, в частности, в способе получения микосубтилинов С18 и С17 Gln3, описанном выше. Например, способ получения биосурфактантов может включать этап культивирования штамма Bacillus subtilis BBG125 и этап извлечения полученных биосурфактантов. Способ получения биосурфактантов может, например, являться одним из способов по настоящему изобретению, описанных выше.
Штамм Bacillus subtilis BBG125, разработанный изобретателями, обладал неожиданными свойствами. Этот штамм позволял продуцировать микосубтилины, не продуцируя сурфактин. Кроме того, он позволял продуцировать ранее не описанные микосубтилины.
Таким образом, настоящее изобретение также относится к следующим микосубтилинам:
- С18-микосубтилину: микосубтилину, цепь жирной кислоты которого содержит 18 атомов углерода, представленному следующей формулой (I):
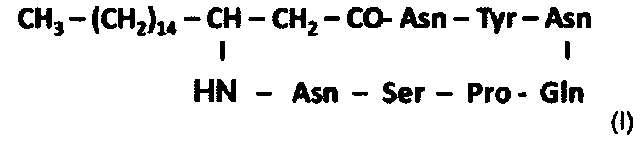 ;
;
- С17-микосубтилину Gln3: микосубтилину, цепь жирной кислоты которого содержит 17 атомов углерода, пептидный цикл которого содержит глутамин вместо аспарагина в положении 3, представленному следующей формулой (II):
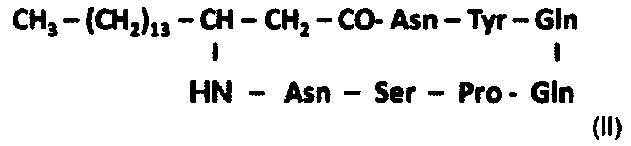 .
.
Микосубтилины С18 и С17 Gln3, описанные выше, можно применять в качестве противогрибкового агента. Они, кроме того, обладают противогрибковым действием, эквивалентным или даже превосходящим действие микосубтилинов, применяемых в настоящее время в качестве противогрибковых агентов.
Здесь и далее "противогрибковые агенты" означают вещества, обладающие способностью лечить и/или предотвращать инфекции, вызванные грибками и/или дрожжами.
Авторы изобретения также получили композицию, содержащую смесь микосубтилинов.
Таким образом, еще одним предметом настоящего изобретения является композиция, содержащая по меньшей мере один С18-микосубтилин и/или по меньшей мере один С17-микосубтилин Gln3.
Например, указанная композиция может дополнительно содержать один или более других микосубтилинов, выбранных из группы, включающей изо-С16-микосубтилин, n-С16-микосубтилин, антеизо-С17-микосубтилин и изо-С17-микосубтилин.
Если в композиции присутствует С18-микосубтилин, он может присутствовать в концентрации от 1% до 5% массы композиции.
Если в композиции присутствует С17-микосубтилин Gln3, он может присутствовать в концентрации от 1% до 20% массы композиции.
Если в композиции присутствует изо-С16-микосубтилин, он может присутствовать в концентрации от 1% до 60% массы композиции.
Если в композиции присутствует n-С16-микосубтилин, он может присутствовать в концентрации от 1% до 10% массы композиции.
Если в композиции присутствует антеизо-С17-микосубтилин, он может присутствовать в концентрации от 20% до 95% массы композиции.
Если в композиции присутствует изо-С17-микосубтилин, он может присутствовать в концентрации от 5% до 30% массы композиции.
Композиция согласно настоящему изобретению может, например, содержать, в процентах от массы композиции: от 1% до 60% изо-С16-микосубтилина, от 1% до 20% С17-микосубтилина Gln3, от 1% до 10% n-С16 микосубтилина, от 20% до 95% антеизо-С17-микосубтилина, от 5% до 30% изо-С17-микосубтилина и от 1% до 5% С18-микосубтилина.
Указанная композиция предпочтительно содержит в процентах от массы композиции: 26% изо-С16-микосубтилина, 1% С17-микосубтилина Gln3, 2% n-С16-микосубтилина, 44% антеизо-С17-микосубтилина, 23% изо-С17-микосубтилина и 1% С18-микосубтилина.
Указанную композицию можно, например, использовать в качестве противогрибковой композиции. Другими словами, она может являться композицией для применения в качестве противогрибкового агента.
Композиция, содержащая смесь микосубтилинов в соответствии с настоящим изобретением, обладает противогрибковой способностью с минимальной ингибирующей концентрацией в диапазоне от 4 до 32 мкм.
Микосубтилины и композицию, содержащую смесь микосубтилинов согласно настоящему изобретению, можно смешивать с раствором, выбранным из группы, включающей воду, этанол, метанол, диметилсульфоксид (ДМСО), карбонат натрия, трис-HCl и смесь указанных растворов.
Смесь указанных растворов может являться двух- или трехкомпонентной смесью. Если смесь растворов является двухкомпонентной, соотношение вода/этанол, вода/метанол, вода/ДМСО, вода/карбонат натрия, вода/трис-HCl, этанол/метанол, этанол/ДМСО, этанол/карбонат натрия, этанол/трис-HCl, метанол/ДМСО, метанол/карбонат натрия или метанол/трис-HCl может, например, находиться между 4/1 и 1/4, например, между 3/1 и 1/3, например, между 2/1 и 1/2, например, составлять 1/1, 2/1, 3/1 или 4/1. Если смесь растворов является трехкомпонентной, соотношение вода/этанол/метанол, вода/этанол/ДМСО, вода/этанол/карбонат натрия, вода/этанол/трис-HCl, вода/метанол/ДМСО, вода/метанол/карбонат натрия, вода/метанол/трис-HCl, этанол/метанол/ДМСО, этанол/метанол/карбонат натрия, этанол/метанол/трис-HCl или ДМСО/карбонат натрия/трис-HCl может, например, составлять 1/1/1, 2/1/1, 1/2/1, 1/1/2, 3/1/1, 1/3/1, 1/1/3, 3/2/1, 3/1/2, 2/3/1, 2/1/3, 1/2/3 или 1/3/2.
Микосубтилины и композицию, содержащую смесь микосубтилинов в соответствии с настоящим изобретением, можно, например, применять в качестве противогрибкового агента.
Следовательно, настоящее изобретение также относится к микосубтилину согласно изобретению или к композиции согласно изобретению для применения в качестве противогрибкового агента.
Таким образом, авторы изобретения представляют способ непрерывного производства биосурфактантов, позволяющий избежать образования пены и повысить выход продукции. Они также представляют устройство для осуществления указанного способа, а также штамм Bacillus subtilis, примечательный тем, что он способен продуцировать, в рамках указанного способа, микосубтилины, не описанные ранее и обладающие противогрибковым действием, эквивалентным или даже превосходящим действие микосубтилинов, применяемых в настоящее время в качестве противогрибковых агентов. Авторы изобретения также представляют противогрибковую композицию, обладающую противогрибковым действием, превосходящим действие микосубтилинов, применяемых в настоящее время.
Другие преимущества также могут быть очевидны для специалиста в данной области техники при прочтении следующих примеров, продемонстрированных прилагаемыми фигурами, приведенными в качестве иллюстраций.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 представляет собой схему устройства для непрерывного производства, без образования пены, и извлечения липопептидов, продуцируемых микроорганизмом. На этой фигуре М1 представляет собой мембранный контактор воздух/жидкость, изготовленный из полых волокон, содержащий отсеки С1 и С2, соответственно, представляющие собой внешний отсек, в котором циркулирует воздух, и внутренний отсек, в котором циркулирует культуральная среда. М2 представляет собой микрофильтрационный узел устройства микрофильтрации, имеющий отсеки С3 и С4. М3 представляет собой ультрафильтрационный узел устройства ультрафильтрации, имеющий отсеки С5 и С6. Каждый из В1, В2 и В3 представляет собой весы. В представляет собой мотор для приведения в движение мешалки в емкости 2. Р1, Р2, Р3, Р4, Р5, Р6 и Р7 представляют собой волюметрические насосы. "Mi" означает "культуральная среда". "De" означает "отходы", a "Et" означает "теплообменник".
Фигура 2 представляет собой схему устройства для непрерывного получения, без образования пены, извлечения и очистки липопептидов, продуцируемых микроорганизмом. На данной фигуре С1, С2, С3, С4, С5, С6, М1, М2, М3, В1, В2, В3, Р1, Р2, Р3, Р4, Р5, Р6, Р7, "Mi", "De" и "Et" имеют то же значение, что и на фигуре 1. М4 представляет собой ультрафильтрационный узел устройства ультрафильтрации, имеющий отсеки С7 и С8. Каждый из В4, В5, В6 и В7 представляет собой весы. В представляет собой мотор для приведения в движение мешалки в емкости 2 или емкости 4. Р8, Р9, Р10, Р11 и Р12 представляют собой волюметрические насосы. V1, V2, V3, V4 и V5 представляют собой клапаны. "Со" означает "конденсатор", а "X" соответствует жидкому раствору, содержащему липопептиды, продуцируемые микроорганизмом.
Фигура 3 представляет собой схему устройства, изображенного на фигуре 1, в котором альтернативная цепь показана пунктиром. Р13 и Р14 представляют собой волюметрические насосы. V6, V7 и V8 представляют собой клапаны. В7 представляет собой весы.
Фигура 4 представляет собой схему устройства, изображенного на фигуре 2, в котором альтернативная цепь показана пунктиром. Р13 и Р14 представляют собой волюметрические насосы. V6, V7 и V8 представляют собой клапаны. В7 представляет собой весы. На фигуре 5 показаны первые части устройства, описанного на фигурах 1-4, в которых есть множество контакторов воздух/жидкость, расположенных параллельно. На данной диаграмме показаны три контактора воздух/жидкость.
Фигура 6 представляет собой схематическое представление гомологичной рекомбинации фрагмента размером 2,6 т.п.о, несущего последовательность εpbp-PrepU-neo-εfenF плазмиды pBGB106, причем фрагменты εpbp и εfenF получены с помощью ПЦР из Bacillus subtilis АТСС 6633, за счет чего образуется плазмида pBG200. На данной фигуре "SphI", "XbaI", "BspEI" и "XmaI" представляют собой сайты рестрикции соответствующих одноименных ферментов, "εpbp" и "εfenF" представляют собой кассеты для гомологичной рекомбинации, "pbp" представляет собой ген, кодирующий пенициллин-связывающий белок. "Pmyc" представляет собой исходный промотор В. subtilis АТСС 6633. "fenF", "mycA", "mucB" и "mycC представляют собой четыре гена, которые составляют оперон микосубтилина. "yngL" представляет собой ген, кодирующий белок с неизвестной функцией. "PrepU" представляет собой промотор гена репликации pUB110. "neo" представляет собой ген, придающий устойчивость неомицину/канамицину.
Фигура 7 представляет собой схематическое изображение рекомбинации плазмиды pBG144 по оперону srfA штамма BBG116, что приводит к образованию штамма BBG125. "EcoRi", "BsfEII" и "MfeI" представляют собой сайты рестрикции соответствующих одноименных ферментов. "εsrfAA" и "εsrfAA" представляют собой кассеты для гомологичной рекомбинации. "hxIR" представляет собой ген, расположенный выше оперона srfA. "PsrfA" представляет собой нативный промотор оперона srfA. "cat представляет собой ген устойчивости к хлорамфениколу. "tef представляет собой ген устойчивости к тетрациклину.
ПРИМЕРЫ
Пример 1: Конструирование штамма Bacillus subtilis BBG125
Штамм Bacillus subtilis BBG125 был подан 10 марта 2011 года под номером CNCM I-4451 в Национальную коллекцию культур микроорганизмов (CNCM) Института Пастера (Париж, Франция).
Он сконструирован из штамма Bacillus subtilis АТСС 6633 дикого типа (Duitman et al., 1999. The mycosubtilin synthetase of Bacillus subtilis ATCC 6633: a multifunctional hybrid between a peptide synthetase, an amino transferase, and a fatty acid synthase. Proc. Natl. Acad. Sci. USA, 96, 13294-13299 [12]) согласно протоколу, описанному ниже.
1.1 Протокол конструирования гибридной плазмиды pBG200, содержащей εphp-PrepU-neo-εfenF и rep(R6K)
Плазмиду pBG106 (Leclere et al., 2005. Mycosubtilin overproduction by Bacillus subtilis BBG100 enhances the organism's antagonistic and biocontrol activities. Appl. Environ. Microbiol., 71, 4577-4584 [13]), гидролизовали ферментами рестрикции SphI (Fermentas, Вильбон-сюр-Ивет, Франция; идентификационный номер ER0601) и Sacl (Fermentas, Вильбон-сюр-Ивет, Франция; идентификационный номер ER1131) для выделения и очистки фрагмента εpbp-PrepU-neo-εfenF размером 2,6 тысяч пар оснований (т.п.о.) последовательности SEQ ID NO: 11, в соответствии с протоколом, описанным в Sambrook and Russell, 2001. Molecular cloning: a laboratory manual, 3rd ed., Cold Spring Harbor Laboratory, Cold Spring Harbor, New York [14].
Указанная последовательность несла две кассеты (εpbp и εfenF) для проведения гомологичной рекомбинации с хромосомой штамма Bacillus subtilis АТСС 6633.
В то же время пласпозон pTnMod-RKm′ (Dennis and Zylstra, 1998. Plasposons: modular self-cloning minitransposon derivatives for rapid genetic analysis of gram-negative bacterial genomes. Appl. Environ. Microbiol. 64, 2710-2715 [15]) обрабатывали ферментами рестрикции Nspl (Fermantas, Вильбон-сюр-Ивет, Франция; идентификационный номер ER1471) и Sad (Fermentas, Вильбон-сюр-Ивет, Франция; идентификационный номер ER1131), получая смесь пяти фрагментов, включая фрагмент, несущий rep(R6K) из 451 пар оснований (п.о.), последовательность которого выделяли и очищали (Sambrook and Russell, 2001 [14]).
Затем фрагменты, содержащие последовательности εpbp-PrepU-neo-εfenF и rep(R6K), лигировали воедино (Sambrook and Russell, 2001 [14]).
Использовали следующие сайты ферментов рестрикции:
- SphI: GCATGC (в положении 1 последовательности SEQ ID NO: 11);
- XbaI: TCTAGA (в положениях 743 и 2088 последовательности SEQ ID NO: 11); и
- Sacl GAGCTC (в положении 2630 последовательности SEQ ID NO: 11).
Кассеты εpbp, PrepU-neo и εfenF составляли следующим образом:
- кассета εpbp: от Sphl до Xbal (SEQ ID NO: 12),
- кассета PrepU-neo: от Xbal до Xbal (SEQ ID NO: 13),
- кассета εfenF: от XbaI до SacI (SEQ ID NO: 14).
Полученный результат лигирования использовали для трансформации штамма Escherichia coli CC118 (λpir) (Herrero, de Lorenzo and Timmis, 1990. Transposon vectors containing non-antibiotic resistance selection markers for cloning and stable chromosomal insertion of foreign genes in gram-negative bacteria. J. Bacteriol. 172: 6556-67 [16]) с селекцией на среде Лурия-Бертани (или LB, или бульоне Лурия) (Bertani, 2003, Lysogeny at mid-twentieth century: P1, P2 and other experimental systems. J. Bacteriol. 186, 595-600 [17]), содержавшей 20 мкг/мл неомицина. Плазмиду, полученную в Е. coli (λpir), назвали pBG200 (3,1 т.п.о.)
На фигуре 6 схематически изображено указанное конструирование.
1.2 Протокол получения BBG116
Штамм В. subtilis RFB102 (штамм, происходящий от В. subtilis АТСС 6633, полученный путем инсерции кассеты Pspac-comK в amyE. Pspac) обозначает ИПТГ-индуцибельный промотор, полученный из плазмиды pA-spac (Bacillus Genetic Stock Center, Колумбус, штат Огайо, США), comK обозначает ген, необходимый для естественной компетенции Bacillus. Он связан с геном устойчивости к спектиномицину (Pspac-comk-spc), интегрированным в хромосомный ген anyЕ. Штамм RFB103 обладает увеличенной способностью к трансформации за счет естественной компетенции, которая индуцируется ИПТГ (изопропил-β-O-галактопиранозидом). Его трансформировали pBG200, предварительно обработанной системой амплификации плазмид TempliPhi (GE Healthcare), а затем селектировали на устойчивость к неомицину в соответствии с протоколом, описанным в Dubnau, 1982 (Genetic transformation of Bacillus subtilis p 148-178. In D. Dubnau (Ed) The molecular biology of the Bacilli, vol. I. Bacillus subtilis. Academic Press, Inc. New York [18]).
Среди клонов Nm-R выполняли проверку инсерции кассеты εpbp-PrepU-neo-εfenF в хромосому RFB102 путем двойного кроссинговера с помощью ПЦР, используя праймеры PBP-F02:
AATAACGGACATGCCGAAGTG (SEQ ID NO: 1) и FENF-REF2: AATAGGCCGACCAAGACGTTC (SEQ ID NO: 2).
Сверхпродуцирование микосубтилина в среде Лэнди/MOPS при 22°C проверяли в соответствии с рабочим способом, описанным ниже в примере 2.
Таким образом получили штамм В. subtilis BBG116.
1.3 Протокол конструирования плазмиды PBG144
Плазмиду PBG212 размером 6,5 т.п.о., специализированную для инсерционной инактивации ("нокаута") оперона srfA В. subtilis, конструировали следующим образом:
кассету εsrfAA (2,2 т.п.о.) получили с помощью ПЦР, используя праймеры SRF-FO ACAGGAATATGCTCAATCGAAG (SEQ ID NO: 3) и SRF-REV AAATTCGCTTCCAGGCTTCTG (SEQ ID NO: 4), из геномной ДНК штамма В. subtilis subsp. subtilis 168 (номер доступа в NCBI PRJNA76), ранее введенного в плазмиду pGEM-T Easy (Promega Corp, Шарбоньер, Франция).
Затем указанный ампликон субклонировали в сайт EcoRI (Fermentas, Вильбон-сюр-Ивет, Франция; идентификационный номер ER0271) вектора pUC19 (New England Biolabs, Ипсвич, штат Массачусетс, США).
Затем кассету εsrfAA размыкали в сайте Mfel (идентификационный номер в Fermentas ER0751) путем инсерции гена tet, предварительно полученного с помощью ПЦР с использованием праймеров ТЕТР1 GTTGTATCGATGATGAAATACTGAATTTTAAACTTAG (SEQ ID NO: 5) и ТЕТТ1 TTTAATGGATCTAGAAGATTTGAATTCCTGTTAT (SEQ ID NO: 6) из плазмиды рВС16 (DSMZ GmbH, Брауншвейг, Германия), источником которой являлась Bacillus cereus (номер доступа: NC_001705.1).
Плазмиду pBG144 получили путем инсерции в сайт SsfEII (Fermentas, Вильбон-сюр-Ивет, Франция; идентификационный номер ER0391), расположенный в конце гена tet, гена cat, предварительно полученного с помощью ПЦР с использованием праймеров pC194cmfwd AGAAAGCAGACAGGTAACCCTCCTAA (SEQ ID NO: 7) и pC194cmrev GCAGGTTAGTGACATTAGGTAACCGA (SEQ ID NO: 8) плазмиды pC194, источником которой является Staphylococcus aureus (DSMZ GmbH, Брауншвейг, Германия, номер доступа: NC_002013.1).
На фигуре 7 схематически изображено указанное конструирование.
1.4 Протокол получения b. subtilis BBG125
Новая трансформация В. subtilis BBG116 плазмидой pBG144, ранее линеаризованной с помощью AatII (Fermentas, Вильбон-сюр-Иветт, Франция; ссылка ER0991), в соответствии с протоколом, описанным в Dubnau, 1982 (Genetic transformation of Bacillus subtilis p 148-178. In D.A. Dubnau (Ed) The molecular biology of the Bacilli, vol I. Bacillus subtilis. Academic Press, Inc. New York [18]).
Шесть клонов Cm-R Tc-R выделили на агаризованной среде LB, содержащей соответствующие антибиотики. Проверку с помощью ПЦР выполняли с использованием праймеров SRFAA5-FWD; AAGGAATCTCGCAATCATTTATCG (SEQ ID NO: 9) и SRFAA5REV; CTTGGTGTAAGCGGAATTTCTGTC (SEQ ID NO: 10). Отсутствие продуцирования сурфактина в среде Лэнди/MOPS при 37°C проверяли в соответствии с рабочим способом, описанным ниже в примере 2.
Мутант В. subtilis BBG125 приняли в качестве штамма-монопродуцента микосубтилина.
Два штамма В. subtilis BBG116 и BBG125 обладали гемолитической активностью на агаре, содержащем 5% крови, а также противогрибковой активностью по отношению к дрожжам и плесневым грибкам на среде PDA.
Указанные виды активности были более выражены в случае штамма В. subtilis BBG 116 из-за синергии между продуцированным сурфактантом и сверхпродуцированием микосубтилинов. Указанные свойства тесно связаны с их способностью колонизировать поверхность агаризованной среды в силу снижения ее поверхностного натяжения.
Обобщенные характеристики В. subtilis BBG125 и его родительских штаммов представлены ниже в таблице 1:

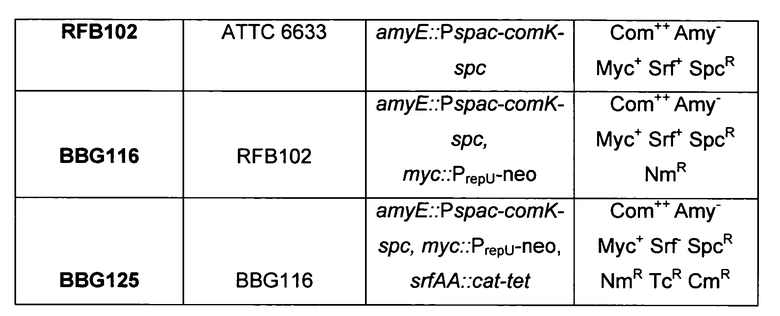
[Com: естественная компетенция по отношению к трансформации; Мус: продуцирование микосубтилина; Srf: продуцирование сурфактина; Amy: амилолитическая активность; SpcR, NmR, TcR, CmR: устойчивость к спектиномицину, неомицину/канамицину, тетрациклину и хлорамфениколу, соответственно]
По сравнению со штаммом Bacillus subtilis АТСС 6633, штамм Bacillus subtilis BBG125 продуцирует большее количество микосубтилинов и не продуцирует сурфактина.
Пример 2: Изготовление культуральной среды
2.1 Среда Лэнди
Среда Лэнди имеет следующий состав: глюкоза, 20 г/л; глутаминовая кислота, 5 г/л, дрожжевой экстракт, 1 г/л; К2НРO4, 1 г/л; MgSO4, 0,5 г/л; KCl, 0,5 г/л; CuSO4, 1,6 мг/л; Fe2(SO4)3, 1,2 мг/л; MnSO4, 0,4 мг/л.
2.2 Исходные растворы
В целях обеспечения воспроизводимости состава среды изготовили стерильные концентрированные растворы. 10Х раствор глюкозы (200 г/л) стерилизовали в автоклаве при 121°C в течение 20 минут. 4Х раствор глутаминовой кислоты (20 г/л) доводили до pH 8 с помощью 5 М раствора КОН и стерилизовали путем фильтрации на фильтре с размером пор 0,2 мкм. 20Х раствор дрожжевого экстракта (20 г/л) стерилизовали в автоклаве при 121°C в течение 20 минут. 40Х раствор минеральных компонентов №1 (К2НРO4, 40 г/л; MgSO4, 20 г/л; KCl, 20 г/л) подкисляли концентрированной H2SO4 до полного растворения солей и стерилизовали фильтрованием через 0,2-мкм фильтр. 40Х раствор минеральных солей №2 (CuSO4, 64 мг/л; Fe2(SO4)3, 48 мг/л; MnSO4, 16 мг/л) подкисляли концентрированной серной кислотой до полного растворения солей и стерилизовали фильтрованием через фильтр с размером пор 0,2 мкм.
2.3 Изготовление одного литра среды Лэнди
Используемый материал, кроме пипеток, которые являлись стерильными и предназначенными для одноразового использования, предварительно стерилизовали в автоклаве при 121°C в течение 20 минут, стерильно отобрали 250 мл раствора глутаминовой кислоты, а затем выливали в колбу Эрленмейера. Стерильно добавили 100 мл раствора глюкозы, а затем 50 мл раствора дрожжевого экстракта и, наконец, 25 мл каждого из растворов минеральных солей. pH доводили до 7,0 с помощью стерильного 5М раствора КОН. Объем доводили до 1 л стерильной водой.
2.4 Получение среды Лэнди, забуференной 200 мМ MOPS
20Х MOPS-буфер (2 М) получали путем растворения 20,93 г 3-[N-морфолин]пропансульфоновой кислоты (MOPS) (М1254, Sigma, Сент-Луис, штат Миссури, США) в 50 мл воды. Раствор стерилизовали на фильтре с размером пор 0,2 мкм в ламинарном шкафу. Для получения 1 литра среды Лэнди, забуференной до 100 мМ MOPS, к смеси, полученной в примере 2.3, добавляли 50 мл 20Х MOPS.
Пример 3: Культивирование В. subtilis BBG125 в колбах Эрленмейера
3.1 Получение коллекции штаммов
Завинчивающиеся пробирки, содержащие 5 мл модифицированной среды Е (среды Кларка Е, модифицированной путем снижения концентрации глюкозы с 40 до 20 г/л. Среда имела следующий состав: КН2РО4, 2,7 г/л; К2НРО4, 18,9 г/л; дрожжевой экстракт, 0,5 г/л; глюкоза, 20 г/л; ЭДТА, 0,05 г/л; MgSO4, 0,61 г/л; MnSO4, 0,056 г/л; NaCl, 0,1 г/л; CaCl2, 0,012 г/л; ZnZO4, 0,018 г/л; FeSO4, 0,018 г/л; CuSO4, 0,002 г/л; Na2MoO4, 0,001 г/л; Н3ВO3, 0,001 г/л; Na2SO3, 0,001 г/л; NiCl2, 0,0037 г/л; NH4NO3, 4 г/л; MgSO4, 1 г/л. pH раствора доводили до 6,5 с помощью 10% раствора HCl, засевали колонией штамма первичной коллекции В. subtilis BBG125 и инкубировали при 30°C в течение 24 часов при перемешивании со скоростью 300 оборотов в минуту (об/мин). Затем раствор гомогенизировали на вортексе. 1,5 мл ранее полученной культуры добавляли к 48,5 мл модифицированной среды Е, содержащейся в 500-мл колбе Эрленмейера. Полученный раствор инкубировали при 30°C в течение 12-24 часов при перемешивании со скоростью 120 об/мин. Указанную первую предварительную культуру Р1 дублировали.
Затем культуру гомогенизировали на вортексе и измеряли ОП600нм на спектрофотометре (SECOMAN Prim, SECOMAN, Домон, Франция) до момента перехода штамма В. subtilis BBG125 в начало/середину фазы экспоненциального роста.
Предварительную культуру Р2 засевали 0,5 мл культуры из лучшей колбы Р1 и дублировали. Конечный объем в 500-мл колбах Эрленмейера составлял 50 мл модифицированной среды Е; колбы инкубировали при 30°C при перемешивании со скоростью 120 об/мин. Рост останавливали, когда ОП600нм показывала, что культура находилась в начале/середине экспоненциальной фазы роста (1<ОП600нм<5). Чистоту и качество Р2 проверяли путем наблюдения под микроскопом и путем посева на питающий агар Лурия-Бертани (триптон, 10 г/л; дрожжевой экстракт, 5 г/л; NaCl, 10 г/л; pH 7,2 и агар Мосселя (мясной экстракт, 1 г/л; пептон, 10 г/л; D-маннит, 10 г/л; NaCl, 10 г/л; феноловый красный, 0,025 г/л, агар, 12 г/л; яичный желток, 10 мл/л; полимиксин, 5 мл/л; pH 7,1)), более специфичный для бацилл, с добавлением спектиномицина в концентрации 100 мкг/мл. Чашки инкубировали при 30°C в течение 24 ч.
Следует отметить, что В. subtilis образует колонии неправильной формы (контуры волнистые и могут образовывать филаменты), кремообразной консистенции, диаметром между 2 и 4 мм. В старых культурах колонии принимают сухой, грубый вид и проникают в агар.
Наконец, 2-литровую колбу, содержащую 200 мл модифицированной среды Е, описанной выше, инокулировали 5% объема из лучшей колбы Р2. Указанную колбу инкубировали при 30°C и перемешивании со скоростью 120 об/мин; рост останавливали, когда ОП600нм показывала, что культура находилась в начале/середине экспоненциальной фазы роста (1<ОП600нм<5). Качество и чистоту культуры проверяли, как показано для Р2. Культуру центрифугировали при 2000 g в течение 10 минут при 25°C. Остатки промыли стерильным физиологическим раствором и затем суспензии центрифугировали при 2000 g в течение 10 мин при 25°C. Остатки переносили в объем среды Е без антибиотика, получая, таким образом, конечную ОП600нм=25 на пробирку. Суспензию распределяли по криопробиркам из расчета 0,9 мл культуры и 0,6 мл глицерина. Пробирки гомогенизировали на вортексе и хранили при минус 80°C. В среду Е добавляли спектиномицин в концентрации 100 мкг/мл.
3.2 Получение посевного материала
Посевной материал получали из коллекции штамма, содержавшей клетки, хранившиеся при минус 80°C в 40% глицерине. Пробирку, содержавшую 5 мл модифицированной среды Е, описанной ниже, доводили до pH 7,0 10% (объем/объем) раствором HCl и засевали 0,5 мл бактериальной суспензии коллекции штамма. Полученный раствор инкубировали при 30°C в течение 10-14 часов при перемешивании со скоростью 300 об/мин. Затем пробирку гомогенизировали на вортексе и измеряли ОП600нм. Затем получали предварительную культуру Р1 в конечном объеме 50 мл модифицированной среды Е при pH 7,0, содержащейся в 500-мл колбе Эрленмейера. Полученный объем инкубировали при 30°C и перемешивании со скоростью 140 об/мин; предварительное культивирование останавливали, когда штамм находился в начале/середине экспоненциальной фазы роста (1<ОП600нм<5). Указанную первую предварительную культуру Р1 дублировали.
Вторую предварительную культуру Р2 получали аналогично предварительной культуре Р1, засевая материалом из первой колбы Р1, и дублировали. Затем объем, необходимый для запуска культивирования в колбах, центрифугировали при 2000 g в течение 10 мин при 25°C. Затем остаток вновь переводили в суспензию в 10 мл стерильного физиологического раствора. Полученную суспензию повторно однократно центрифугировали при 2000 g в течение 10 минут. На конечном этапе остаток переносили в 10 мл стерильного физиологического раствора. После этого суспензию считали готовой для засева.
3.3 Культивирование в колбах Эрленмейера
Эксперименты продолжались не менее 72 часов и из указанных культур отобрали несколько образцов. Исходная ОП600нм составляла от 0,1 до 0,4. Объем колб Эрленмейера составлял 500 мл, а объем питательной среды составлял 100 мл. Следующие измерения выполняли на образцах, стерильно отобранных в ламинарном шкафу: проверка на чистоту с помощью выделения на питательном агаре и агаре Мосселя со спектиномицином (100 мкг/мл), измерение оптической плотности при 600 нм, измерение pH, измерение сухого веса и отбор надосадочной жидкости культуры для количественного ВЭЖХ-анализа липопептидов: 3 мл культуры центрифугировали в течение 10 минут при 10000 g и 4°C; супернатант культуры хранили при минус 20°C.
Пример 4: Очистка и анализ липопептидов
4.1 Очистка липопептидов
Липопептиды выделяли на картриджах, содержащих 1 г геля Maxi-clean С18 (Grace Davison-Alltech, Дирфилд, штат Иллинойс, США).
Картридж с 1 г ODS кондиционировали 100% метанолом, 20 мл при первом проходе, а затем 8 мл. Затем картридж промывали 8 мл воды milli-Q (Millipore). Затем на колонку загружали 1 мл надосадочной жидкости культуры с pH 6,5±0,1. Затем картридж промывали 8 мл воды milli-Q. После сушки картриджа 20 мл воздуха элюировали липопептиды с использованием 4 мл 100% метанола. Элюат высушивали с помощью вакуумного концентратора. Затем образец перемещали в 200 мкл 100% метанола при 4°C для возможности проведения ВЭЖХ-анализа.
4.2 Анализ посредством высокоэффективной жидкостной хроматографии (ВЭЖХ)
Образец анализировали с помощью полной системы ВЭЖХ марки Waters (онлайн-дегазатор, автоматический пробоотборник 717, контроллер 660S, насос 626, светодиодная матрица 2996) (Waters SAS, Гвианкур, Франция) с использованием колонки С18 (5 мкм, 250x2,5 мм, VYDAC 218 TP). Проводили два анализа.
При первом анализе анализировали микосубтилины: 10 мкл очищенного образца вводили и сравнивали со стандартом (итурин А) при 500 мг/мин (11774, Sigma-Aldrich, Сент-Луис, штат Миссури, США), при скорости потока 0,6 мл/мин. Элюирование проводили в изократическом режиме с использованием 60/40/0,1 (об./об./об.) растворителя вода/ацетонитрил/трифторуксусная кислота.
При втором анализе анализировали сурфактины. 10 мкл очищенного образца вводили и сравнивали со стандартом сурфактина в концентрации 500 мг/л (S3523, Sigma-Aldrich, Сент-Луис, штат Миссури, США) при скорости потока 0,6 мл/мин. Элюирование проводили в изократическом режиме с использованием 20/80/0,1 (об./об./об.) растворителя вода/ацетонитрил/трифторуксусная кислота.
Время удерживания и вторую производную каждого пика спектра между 200 и 400 нм (диодная матрица, PDA 2996, Waters) анализировали автоматически с помощью программного обеспечения Millennium для идентификации элюированных молекул.
4.3 Анализ посредством полупрепаративной ВЭЖХ
Образец получали с помощью применения протокола очистки, описанного в примере 4.1 выше, используя 10-г картриджи с гелем Maxi-clean С18 (Grace Davison-Alltech, Дирфилд, штат Иллинойс, США). Использование 10-г картриджей позволило загрузить 10 мл надосадочной жидкости культуры вместо 1 мл, как делали раньше. Все объемы умножали на 10, за исключением объемов метанола. Минимальный объем метанола, используемый для кондиционирования картриджа, а затем для элюирования липопептидов, составлял 10 мл. Образец (100 мкл) вручную загружали в инжектор полупрепаративной ВЭЖХ марки Waters (контроллер 660, насос 626, детектор поглощения 486). Используемая колонка представляла собой С18 (5 мкм, 300×10 мм, АСЕ). Элюирование проводили со скоростью 3 мл/мин в соответствии с градиентом, представленным в таблице 2 ниже:
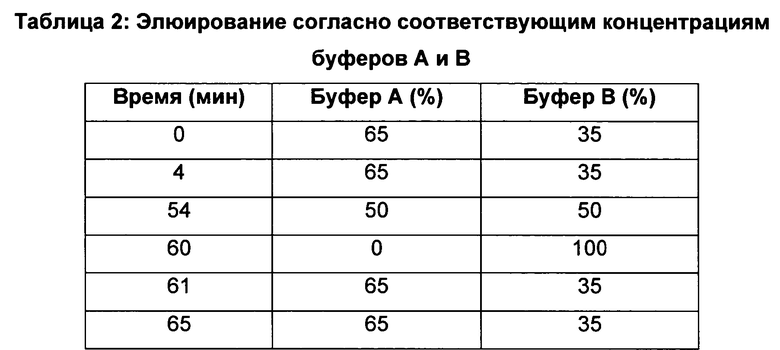
Использовали следующие растворители: растворитель А, состоявший из воды и трифторуксусной кислоты в соотношении 99,9/0,1 (объем/объем), и растворитель В, состоявший из ацетонитрила и трифторуксусной кислоты в соотношении 99,9/0,1 (об./об.).
4.4 Анализ посредством масс-спектрометрии MALDI-TOF Анализы посредством масс-спектрометрии MALDI-TOF (Bruker Ultaflex) проводили согласно требованиям с использованием: надосадочной жидкости культуры или образцов, очищенных с помощью картриджа ODS (Grace Davison-Altech, Дирфилд, штат Иллинойс, США), или образцов, очищенных с помощью картриджа ODS и полупрепаративной ВЭЖХ. ТА-буфер был приготовлен путем получения смеси 33/67/0,1 (об./об./об.) СНзСН/вода/трифторуксусная кислота. Буфер СНСА являлся насыщенным раствором альфа-циан-4-гидроксикоричной кислоты в ТА-буфере. Указанный буфер получали путем восстановления надосадочной жидкости после центрифугирования альфа-циан-4-гидроксикоричной кислоты/ТА-буфера. Образцы для анализа получали путем смешивания 1 мкл образца с 9 мкл НСА-буфера. Объем раствора образца, внесенного с помощью анализа MALDI-TOF, составлял 0,5 мкл. Высушивание проводили на открытом воздухе. Массы калибровали смесью стандартных пептидов.
Рассчитанные массы ионов [М+Н]+, [M+Na]+, [М+К]+ различных полученных гомологов микосубтилинов и сурфактинов указаны ниже в таблице 3:
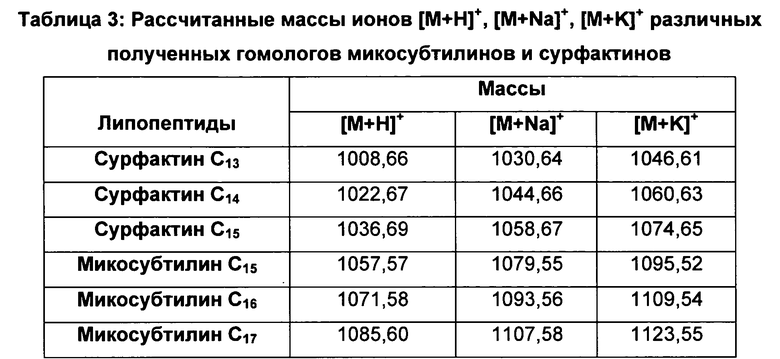
ВЭЖХ-анализ выявил 10 пиков, для которых молекулярные массы обнаруженных молекул представлены в таблице 4 ниже:
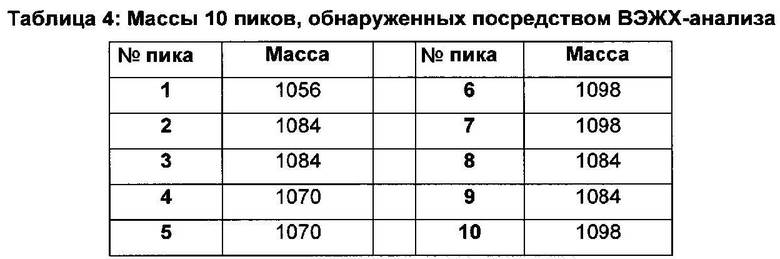
4.5 Анализ структуры новых микосубтилинов посредством МС-МС Для точного определения структуры различных форм микосубтилинов, продуцируемых штаммом BBG125, выполнили анализ очищенных образцов посредством тандемной масс-спектрометрии (MS-MS) с ионизацией электрораспылением (ионная ловушка Finnigan MAT LCQ) в режиме прямой инфузии после начала пептидного цикла посредством обработки N-бромсукцинимидом в концентрации, эквивалентной микосубтилину в 70% растворе уксусной кислоты.
Во время первого анализа анализировали очищенный антеизо-С17-микосубтилин (пик 8). Полученный спектр (MS1) был усложнен за счет двух изотопов Br. Спектр MS2 был усложнен за счет присутствия фрагментов с 1, 2 или 3 отсутствующими -МН3-группами вследствие наличия аминокислот Asn и Gin. MS спектр исходного продукта характеризовался пиками 1085 [М+Н]+, 1107 [M+Na]+ и 1123 [М+К]+, четко соответствовавшими С17-микосубтилину.
Из-за присутствия изотопов 79 Br и 81 Br в аналогичных количествах наблюдали распределение пиков вблизи 1260, что фактически соответствовало ожидаемому дрейфу. Например, пик при 1257,4 соответствует [М+Н]+ двух 79 Br, пик при 1259,4 соответствует [М+Н]+ 79 Br и 81 Br или [М+Н]+ двух 13С и двух 79 Br и т.д.
Порядок увеличения масс, полученных при фрагментации иона при 1257,4, приведен в таблице 5 ниже:
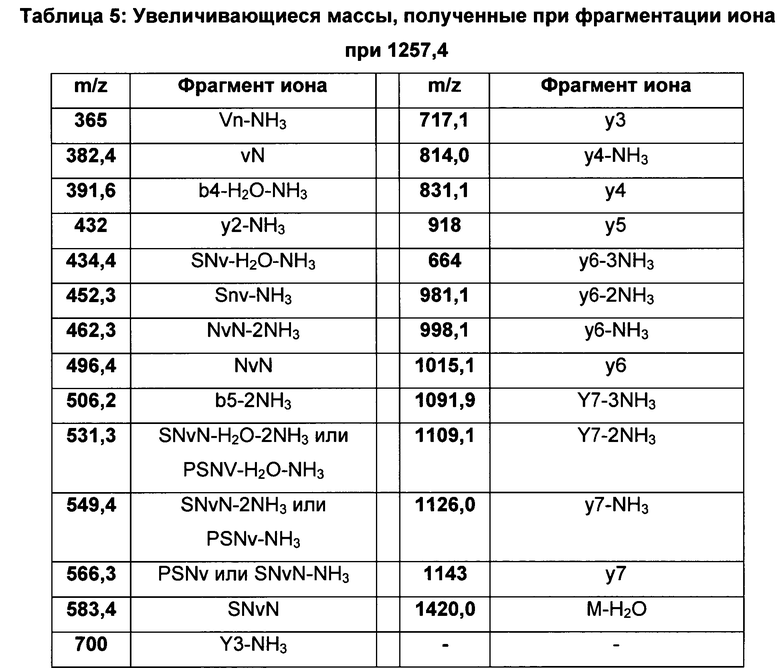
В вышеприведенной таблице "m/z" означает отношение массы к заряду.
4.6 MS-MS-анализ пика при 1274,4, содержавшегося в пике 6
Масса изотопа до обработки: М=1098,6.
Масса изотопа после обработки с 79BR2: М=1270,4.
Фрагмент у идентичен антеизо-С17-микосубтилину.
Фрагменты b превышают фрагменты b антеизо-С17-микосубтилина более чем на 14.
Это означает, что, по всей вероятности, одна из первых двух аминокислот открытой последовательности (N или Q NQPSNvNw) изменена.
4.7 MS/MS-анализ пика при 1274,4, содержавшегося в пике 10
Масса изотопа до обработки: М=1098,6.
Масса изотопа после обработки с 79 Вr1:М=1270,4.
Фрагменты у идентичны антеизо-С17-микосубтилину, однако сдвинуты на 14 в большую сторону, включая интенсивный пик у6 при 1029 вместо 1015 для всех остальных образцов.
Фрагменты b, меньшие, чем b6, идентичны антеизо-С17-микосубтилину.
Фрагменты b, большие или равные b6, идентичны микосубтилину, но сдвинуты на 14 в большую сторону.
Данные результаты показывают, что молекула является микосубтилином с C18-, а не С17-жирной кислотой.
На основании порядка элюирования различных пиков выводим существование 5 новых форм микосубтилинов: форм Gln3, изо-С16, nС16, антеизо-C-17, изо-С17 и C18. Соответствие указанных форм десяти пикам с молекулярными массами молекул, обнаруженных посредством ВЭЖХ-анализа по примеру 4.5, представлены в таблице 6 ниже:
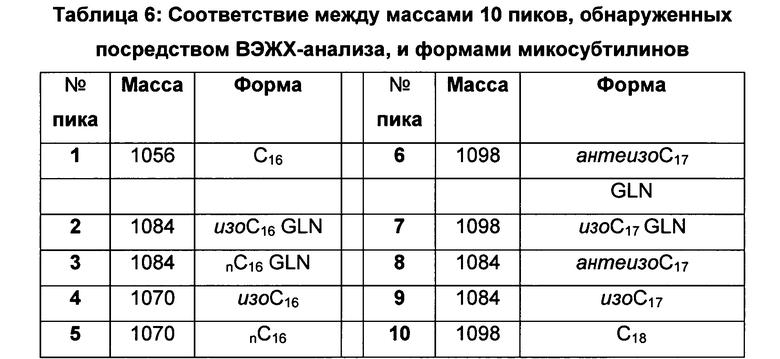
Формула данного нового Cie-микосубтилина приведена ниже:
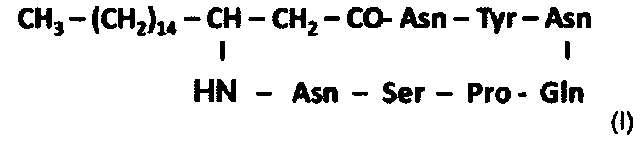 .
.
Формула данного нового С17-микосубтилина Gln3 приведена ниже:
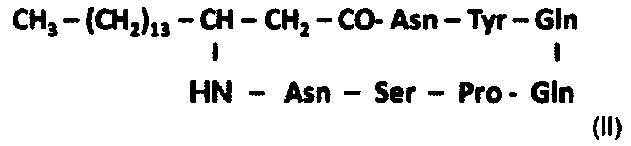 .
.
Пример 5: Биологическая активность различных изоформ микосубтилина (МС) по отношению к различным микроорганизмам
Тесты противогрибковой активности проводили путем последовательного разведения изоформы C18 (C18-MC) в жидкой среде согласно протоколу, описанному в Besson et al. (Besson et al., 1979. Antifungal activity upon Saccharomyces cerevisiae of iturin A, mycosubtilin, bacillomycin L and of their derivatives; inhibition of this antifungal activity by lipid antagonists. J. Antiobiot. (Tokyo) 32, 828-833) [19]. Культивирование в 96-луночных микропланшетах проводили в богатой среде: глюкоза, 40 г/л; пептон, 10 г/л; дрожжевой экстракт, 2 г/л; pH 7,2. Посев Saccharomyces cerevisiae проводили при ОП600нм=0,55 и считывали оптическую плотность через 24 часа, а затем определяли минимальную ингибирующую концентрацию (МИК).
Данный эксперимент также проводили со следующими изоформами микосубтилинов (МС): изо-С16-МС, n-С16-МС, антеизо-С17-МС, изо-С17-МС. Кроме того, его проводили с композицией микосубтилинов (комп. МС), включающей, в процентах по отношению к массе композиции, 26% изо-С16-МС, 1% С17-МС Gln3, 2% n-С16-МС, 44% антеизо-С17-МС, 23% изо-С17-МС и 1% C18-MC.
Данный эксперимент также проводили с каждой из вышеупомянутых изоформ микосубтилинов и композиций в отношении следующих микроорганизмов: Botrytis cinerea, Aspergillus niger, Sclerotinia sclerotium, Candida albicans.
МИК, полученные в каждом из указанных экспериментов, представлены ниже в Таблице 7:
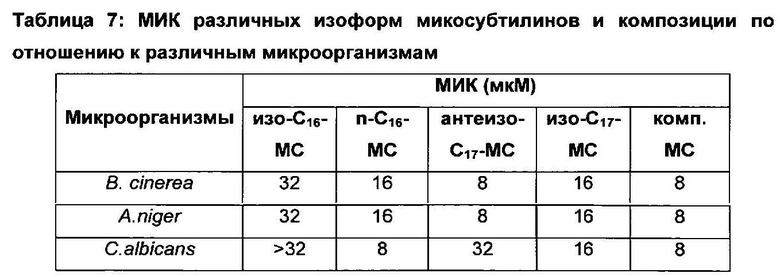
Данные результаты показывают, что состав ком п.МС оказывает действие, эквивалентное или даже превосходящее действие микосубтилинов, применяемых в настоящее время.
Пример 6: Осуществление интегрированного способа получения, выделения и концентрирования липопептидов, продуцируемых В. subtilis в мембранном контакторе воздух/жидкость
Описание данного примера относится к фигурам 1-5.
В данном примере:
- насосы Р1, Р2, Р3, Р4, Р5, Р6, Р7, Р8, Р9, Р10, Р11, Р12, Р13 и Р14 являлись перистальтическими насосами Masterflex L/S с компактным приводом (Cole Parmer, Верной Хиллс, штат Иллинойс, США);
- насос Р11 являлся насосом типа N820.3 FT.18 (KNF Neuberger Laboport, Фрайбург, Германия);
- клапаны V1, V4 и V5 являлись запорными клапанами из ПТФЭ (W3250Y, Thermo Fisher Scientific, Роскилле, Германия);
- клапаны V2, V3, V6 и V7 являлись трехходовыми запорными клапанами из ПТФЭ (W3250Z, Thermo Fisher Scientific, Роскилле, Германия);
- баки бак 2 и бак 4 представляли собой баки Nalgene, изготовленные из полипропилена высокой плотности с полезным объемом 4 л (2125-4000 Heavy Duty Bottles, Nalgene, Thermo Fisher Scientific, Роскилле, Германия);
- баки бак 1, бак 3, бак 5, бак 6 и бак 7 представляли собой баки Nalgene, изготовленные из полипропилена высокой плотности с полезным объемом 10 или 20 л (2250 Autoclavable Carboys, Nalgene, Thermo Fisher Scientific, Роскилле, Германия);
- весы B1, В2, В3, В4, В5, В6 и В7 являлись весами типа CKW-55; Ohaus Corporation, Пайн-Брук, штат Нью-Джерси, США);
- штамм Bacillus subtilis являлся штаммом В. subtilis BBG125.
6.1 Условия окружающей среды и датчики, используемые для культивирования
Если не указано иное, pH доводили до 7+/-0.1 путем регулируемого добавления, соответственно, с помощью насосов Р2 и РЗ, растворов 0,66 М Н3РО4 или 3М NaOH, предварительно стерилизованных в автоклаве при 121°C в течение 20 минут.
pH-электрод калибровали перед автоклавированием резервуара с использованием коммерческих растворов, забуференных до pH 4,0 и pH 7,0, и хранили при 4°C. Процесс проводили при 22°+/-0,1°С с помощью 1 м2 трубчатого теплообменника Alpha Laval (104878, Alpha Laval Corporate AB, Лунд, Швеция). Концентрацию растворенного кислорода pO2 измеряли с помощью датчика кислорода (Mettler Toledo, Вирофле, Франция). Электролит датчика кислорода обновляли при каждом эксперименте. Кислородный датчик калибровали после автоклавирования бака, когда культуральная среда достигала заданных в эксперименте температуры и pH. 0% pO2 получали, подключив кабель датчика к заземлению, а 100% pO2 получали путем насыщения среды воздухом (1000 об/мин и 1 vvm).
Скорость аэрации (Fe) фиксировали при 0,25 объемах воздуха на объем жидкости в минуту (vvm), то есть 0,75 л/мин на 3 литра среды Лэнди (пример 2.1). Поступающий воздух фильтровали через 0,2-мкм стерилизующий фильтр.
Для управления процессом и считывания данных использовали программное обеспечение AFS Biocommand (New Brunswick Scientific, Эдисон, штат Нью-Джерси, США). Чистоту культуры контролировали через 48 часов и в конце культивирования. Образцы культуры объемом 10 мл регулярно отбирали и центрифугировали, определяли оптическую плотность и сухую массу, а надосадочную жидкость хранили до анализа. Поступающие и выходящие газы анализировали с целью получения данных о дыхании микроорганизма. Парамагнитный датчик позволял анализировать количество кислорода, а инфракрасный датчик - диоксида углерода (Xentra 4400; Servomex Company Inc., Шугар-Ленд, штат Техас, США). Анализатор интегрировали в мультиплексное устройство, обеспечивавшее последовательный анализ по шести каналам, высушивание газов на мембране Naflon (Permapur, Сен-Леонар, Квебек) и автоматическую калибровку.
6.2 Мембранный контактор воздух/жидкость
Мембранный контактор воздух/жидкость М1, используемый в данном примере, поставляли из GE Healthcare, идентификационный номер CFP-6-D-45 (GE Healthcare Europe GmbH, Мюнхен, Германия). Он состоит из внешнего модуля, включающего два отсека С1 и С2. В отсеке С1 циркулировал стерильный газ, содержавший кислород. В отсеке С2 циркулировала культуральная среда, содержавшая инокулят, со скоростью 24 л/ч/м2 мембраны, вводимая посредством насоса Р4.
Площадь поверхности мембраны М1 составляла 2,5 м2; мембрану стерилизовали перед использованием в автоклавировании при 121°C в течение 20 минут (этот критерий не является исчерпывающим). Мембрана состояла из набора пустотелых полиэфирсульфоновых волокон с размером пор 0,65 мкм.
6.3. Устройство для непрерывного культивирования Bacillus subtilis: сопряжение системы для выделения/концентрирования биосурфактантов с мембранным контактором воздух/жидкость
6.3.1. Сопряжение системы для выделения/концентрирования липопептидов с мембранным контактором воздух/жидкость
Устройство, используемое для непрерывного культивирования В. subtilis, включало мембранный контактор воздух/жидкость М1, изготовленный из пустотелых волокон, в котором культивировали В. subtilis BBG125 в среде Лэнди. В. subtilis BBG125, иммобилизованная на поверхности мембраны М1, разлагала указанный субстрат, выделяя биосурфактанты. Устройство также содержало приспособление для непрерывной подачи и отвода потока указанного субстрата с заданной скоростью в устройство для продуцирования, включающее мембрану М1.
Мембрана М1 обеспечивала стерильную подачу кислорода, необходимого для роста микроорганизма в культуральной среде, посредством диффузии кислорода через ее поры.
Перистальтический насос Р1 непрерывно снабжал мембрану М1, со скоростью F1, свежей средой Лэнди, хранящейся в баке 1; аналогично перистальтический насос Р5 непрерывно удалял культуральную среду из устройства для продуцирования, включающего мембрану М1, описанную выше, со скоростью F2.
Посевной материал и условия ферментации оставались эквивалентными описанным ранее. Для поддержания стерильности окружающей среды все используемые составные части устройства и различные мембраны стерилизовали при 121°C в течение 20 минут.
Одна из особенностей данного устройства проистекала из факта возможности повторного использования или неиспользования в устройстве для продуцирования, включающем мембрану М1, всех клеток микроорганизмов после удаления из них остатков органических веществ и биосурфактантов, что позволяло получить высокую скорость роста микроорганизмов в устройстве для продуцирования.
Кроме того, указанное устройство позволяло кислороду диффундировать в культуральную среду без образования пузырьков или пены.
6.3.2. Выделение липопептидов и повторное использование клеток путем микрофильтрации
Устройство, описанное ранее, таким образом, характеризуется тем, что оно включает приспособление для тангенциальной микрофильтрации и ультрафильтрации, расположенное на выходе устройства для продуцирования и разделяющее жидкость на несколько фракций.
Первый этап микрофильтрации проводили на мембране М2, изготовленной из пустотелых полиэфирсульфоновых волокон с размером пор 0,2 мкм (GE Healthcare) и площадью поверхности 0,4 м2, в которой циркулировала культуральная среда, содержащая клетки, с помощью волюметрического насоса Р4, описанного выше, в отсеке С3 мембраны М2, называемом остатком. Под действием волюметрического насоса Р5 среда проходила посредством тангенциальной фильтрации через поры мембраны М2 в отсек С4 мембраны М2. Посредством этого из культуральной среды, содержащей биосурфактанты, удаляли клетки, среду выделяли, а затем собирали в бак 2 при перемешивании лопастями, приводимыми в движение двигателем В, или магнитной мешалкой (магнитная мешалка W10512, Thermo Fisher Scientific, Роскилле, Германия) со скоростью 160 об/мин.
Культуральную среду устройства для изготовления, включающего мембрану М1, непрерывно удаляли в бак 2. Для компенсации указанного отбора и поддержания постоянного объема в мембране М1 насос Р1 снабжал биореактор новой средой, содержавшейся в баке 1.
Кроме того, бак 2 и бак 3 размещали, соответственно, на весах В2 и В3. Это контролировало выход перистальтического насоса Р1 (CKW-55; Ohaus Corporation, Пайн-Брук, США), позволяя поддерживать постоянный объем внутри мембраны М1 и тем самым обеспечивая F1=F2. В каждом из проведенных экспериментов степень разбавления менялась после прохождения по меньшей мере четырех объемов мембранных контакторов воздух/жидкость, содержащих мембрану М1.
Выходы насосов Р1 и Р5 были равны и отрегулированы так, чтобы получить в устройстве, содержащем мембрану М1, степень разбавления 0,1 ч-1, то есть почасовую скорость потока, равную 0,1 объема водной фазы, содержавшейся в устройстве для продуцирования, включающем мембрану М1.
Кроме того, осуществили вариант данного способа. Он состоял из повторного использования или неиспользования клеток в мембране М1. Он представлял собой открытый непрерывный режим, представленный пунктирными линиями на фигурах 3 и 4. В случае отсутствия повторного использования с помощью набора клапанов V6, V7 и V8 культуральную среду можно откачать насосом Р13 из мембраны М1 и собрать в бак 7. Сливной клапан позволял периодически удалять концентрат клеток. В этом случае этап микрофильтрации посредством мембраны М1 выполняли непосредственно в среде, содержащейся в баке 7, и затем концентрировали клетки в баке 7, а не в устройстве для продуцирования, включавшем мембрану М1.
6.3.3. Концентрирование липопептидов путем ультрафильтрации
Фильтрат, содержавшийся в баке 2, на конечном этапе перекачивали с помощью насоса Р6 в отсек С5 системы тангенциальной ультрафильтрации из нержавеющей стали (Sartocon 2 plus, 17546-202, Sartorius, Геттинген, Германия), содержащей ультрафильтрационную мембрану МЗ с порогом отсечки 10 кДа, выполненную из регенерированной целлюлозы (Hydrosart Ultrafilter, 3021443930Е-BSW, Sartorius, Геттинген, Германия). Биосурфактанты концентрировали в отсеке С5, называемом остатком, выше критической концентрации мицеллообразования, и, таким образом, возвращали в бак 2. Культуральную среду выделяли под контролем насоса Р7 со скоростью, эквивалентной скорости насоса Р5, в отсек С6, называемый ультрафильтратом, и собирали в бак 3. Скорость потока зависела от скорости потока, задаваемой с помощью насоса Р7, и регулировалась в соответствии с информацией, собранной различными весами В2, В3 и В4.
6.4. Очистка липопептидов
6.4.1. Очистка путем ультрафильтрации/диафильтрации Очистку липопептидов, представленных в данном примере, основывали на последовательном соединении этапов ультрафильтрации посредством системы тангенциальной ультрафильтрации из нержавеющей стали (Sartocon 2 plus, 17546-202, Sartorius, Геттинген, Германия), содержащей ультрафильтрационную мембрану М4 с порогом отсечки 10 кДа, выполненную из регенерированной целлюлозы (Hydrosart Ultrafilter, 3021443930E-BSW, Sartorius, Геттинген, Германия). Данный этап был направлен на удаление из культуральной жидкости основной части остаточных веществ, например, глюкозы, глутамата и различных первичных метаболитов. Образование мицелл и комплексов мицелл микосубтилином, содержавшемся в количестве выше ККМ, позволяло удерживать и, следовательно, концентрировать его в остатке за счет использования ультрафильтрационной мембраны М4.
Данный этап выполняли при 25°C и при давлении 0,5 бар. Данный этап очистки выполняли по отношению к концентрированным липопептидам в баке 2. После открытия клапана V1 насос Р8 перекачивал концентрат в бак 4 (Nalgene, изготовленный из полипропилена высокой плотности, с полезным объемом 4 л (2125-4000 Heavy Duty Bottles, Nalgene, Thermo Fisher Scientific, Роскилле, Германия)), перемешиваемый лопастями с приводом от двигателя С или магнитной мешалкой (магнитная мешалка W10512, Thermo Fisher Scientific, Роскилле, Германия), идентичной двигателю В.
Следующие этапы выполняли последовательно:
- Ультрафильтрация: концентрат переносили в бак 4 под контролем перистальтического насоса Masterflex US Р8 с компактным приводом (Cole Parmer, Верной Хиллс, штат Иллинойс, США), а затем очищали на мембране М4 под контролем перистальтического насоса Masterflex US Р9 с компактным приводом (Cole Parmer, Верной Хиллс, штат Иллинойс, США) и собирали в бак 4. Перистальтический насос Masterflex L/S Р10 с компактным приводом (Cole Parmer, Верной Хиллс, штат Иллинойс, США) позволял перенести оставшиеся составные части среды в отсек С8 и бак 5 (Nalgene, выполненный из полипропилена высокой плотности, с полезным объемом 10 или 20 литров (2250 Autoclavable Carboys, Nalgene, Thermo Fisher Scientific, Роскилле, Германия)). Данный процесс продолжали до снижения объема, содержащегося в баке 4, до 10% от исходного объема бака 4.
- Диафильтрация: на данном этапе разбавляли культуральную жидкую среду для облегчения прохождения остаточных веществ через ультрафильтрационную мембрану М4. Затем в бак 4 добавляли воду путем открытия клапана V2 до восстановления объема бака 4 до первоначального уровня. Затем проводили этап ультрафильтрации, как описано выше. Данный этап диафильтрации проводили четыре раза подряд.
- Ультрафильтрация в присутствии метанола (МеОН): После этапов диафильтрации из бака 6 (Nalgene, выполненного из полипропилена высокой плотности, с полезным объемом 10 или 20 литров (2250 Autoclavable Carboys, Nalgene, Thermo Fisher Scientific, Роскилле, Германия)) добавляли МеОН в бак 4 посредством перистальтического насоса Masterflex US Р12 с компактным приводом (Cole Parmer, Верной Хиллс, штат Иллинойс, США) и клапана V2.
Данное добавление МеОН контролировали с помощью весов В4, В5 и В6, так что раствор, присутствующий в это время в баке 4, содержал 70% МеОН (объем/объем). Затем проводили этап ультрафильтрации, как описано выше. На данном этапе мицеллы разрушались, а мономеры микосубтилина проходили через поры мембраны М4.
После фильтрации раствор, состоявший из микосубтилина и 70% метанола, собирали на стороне ультрафильтрата, однако на этот раз ультрафильтрат собирали в сосуд испарителя Rotavapor W2000 (испарение) (Heidolph Instruments GmbH & Со, Швабах, Германия) с помощью набора клапанов V3 и V4.
В конце каждого этапа на стороне фильтрата и на стороне остатка отбирали образцы. Таким образом может быть установлен баланс очистки. Это позволяло определить потери микосубтилина, вызванные этапами ультрафильтрации и диафильтрации, вычисляя соотношение количества концентрированного микосубтилина, полученного после ультрафильтрации, с количеством микосубтилина, исходно присутствовавшего в баке 4. Выход этих шагов составил более 70%.
6.4.2. Концентрирование липопептидов путем выпаривания Испаритель (Испарение) концентрировал микосубтилины, удаляя весь
метанол и часть воды. Это испарение происходило при остаточном давлении 50 мбар, задаваемом вакуумным насосом Р11 типа N820.3 FT.18 (KNF Neuberger Laboport, Фрайбург, Германия), и при 50°C. На данном этапе выпаривали метанол, конденсировали его пары с помощью конденсатора и возвращали в бак 6.
6.4.3. Лиофильная сушка липопептидов
Необязательный этап лиофильной сушки добавили в данный способ для улучшения сохранности продукта. Лиофильную сушки липопептидов выполняли непосредственно с использованием концентрированного раствора X, выходящего из испарителя и отводимого с помощью клапана V5. Раствор прежде всего замораживали при минус 20°C, а затем лиофилизировали с помощью лиофилизатора Heto Power Dry PL 9000 (Jouan Nordic, Аллеред, Дания), в соответствии со следующими этапами: 1 час при минус 30°C, 5 часов при минус 10°C, 5 часов при 0°C, 5 часов при минус 20°C, 5 часов при 35°C. Лиофильную сушку проводили при остаточном давлении 15 мбар.
Пример 7: Промывка мембран и выделение липопептидов Из-за сродства липопептидов с границами раздела изучили и оптимизировали протокол промывки мембран. Указанный протокол принимает во внимание характер мембран и согласуется с недавней работой, опубликованной по этому вопросу (Chen, Chen and Juang, 2007. Separation of surfactin from fermentation broths by acid precipitation and two-stage dead-end ultrafiltration processes. J. Membr. Sci. 299, 114-121 [20]; Chen, Chen and Juang, 2008. Flux decline and membrane cleaning in cross-flow ultrafiltration of treated fermentation broths for surfactin recovery. Sep. Purif. Technol. 62, 47-55 [21]). Указанные этапы промывки не приводят к денатурации ни липопептидов, ни мембран. Применение растворителей запрещено, хотя некоторые из них, например, метанол, очень эффективны при отделении липопептидов. Тесты чувствительности к pH позволили определить, что pH=10 является пределом возможности разложения липопептидов. Промывки выполняли при перемешивании и в условиях ферментации. Указанный протокол осуществлялся в семь этапов промывки водными растворами.
- Две промывки выполняли с использованием 3 литров дистиллированной воды при 30°C в течение 30 минут. Указанные промывки отделяли непрочно иммобилизованную биомассу.
- Вторая промывка дистиллированной водой при 30°C позволяла измерить коэффициент передачи кислорода.
- Две промывки выполняли с использованием 3 литров 0,1 М NaOH при 50°C в течение 1 часа. Указанные промывки отделяли прочно иммобилизованную биомассу и десорбировали большую часть липопептидов.
- Затем мембрану регенерировали 0,5 М раствором NaOH при 50°C в течение 1 часа, затем - 100 м.д. раствором NaOCl при 50°C в течение 1 часа, а затем очищали дистиллированной водой при 25°C до достижения нейтральной реакции мембраны.
Весь вышеупомянутый способ также осуществляли посредством дублирования каждой мембраны, так что их можно было промывать и регенерировать последовательно. Это позволяло осуществлять указанный способ беспрерывно. Для осуществления данного альтернативного способа к устройству добавили баки (не показаны), содержащие 0,1 и 0,5 М раствор гидроксида натрия.
Пример 8: Количественное определение продуцированных биосурфактантов
В данном примере проводили несколько тестов для продуцирования биосурфактантов В. subtilis путем ферментации глюкозы в концентрации 20 г/л в устройстве для продуцирования, содержавшем 3 л культуральной среды и имевшем общую площадь поверхности мембранного контактора воздух/жидкость 2,5 м2, соответствующего мембранному контактору воздух/жидкость, описанному в примере 6. Каждый из экспериментов повторяли дважды. Ниже представлены только средние значения по указанным повторам. Стандартное отклонение составило между 5% и 15%.
Условия эксперимента регулировали следующим образом:
- pH поддерживали при 7;
- поток воздуха в мембранном контакторе воздух/жидкость составлял 1 vvm;
- объем культуральной среды, циркулирующей в волокнах указанной мембраны со скоростью 0,021 м/с, составлял 3 литра;
- давление всей системы было равно атмосферному давлению, за исключением поступающего воздуха, давление которого могло незначительно превышать атмосферное давление на 0,4 бар;
- условия оксигенации культуральной среды фиксировали при коэффициенте объемной передачи кислорода приблизительно 40 ч-1.
Хроматографический анализ с помощью ВЭЖХ позволял выполнить количественное определение субстратов и биосурфактантов в различных баках.
Анализ потребленного кислорода позволил определить количество клеток, иммобилизованных на мембране.
Для определения биомассы, иммобилизованной на мембране с течением времени в (г м-2), с учетом того, что свободные и иммобилизованные клетки обладают различной удельной скоростью потребления кислорода, и большей доступности кислорода для клеток, иммобилизованных на мембране, по сравнению с клетками в суспензии, использовали следующую формулу:
биомасса, иммобилизованная на мембране в данный момент времени в (г м-2)=(OUR-(X*OURspe cl))*V/(OURspe cl*а),
где:
OUR = скорость потребления кислорода;
OURspe cl = удельная скорость потребления кислорода свободными клетками;
OURspe ci = удельная скорость потребления кислорода иммобилизованными клетками;
V = объем реакционной среды;
X = концентрация свободной биомассы;
а = площадь поверхности мембраны.
Этапы промывки мембран, описанные в указанных примерах, выполняли в соответствии со способом, описанным в примере 7.
8.1 Продуцирование микосубтилина В. subtilis BBG125, периодический режим
В данном примере штамм В. subtilis BBG125 культивировали в периодическом режиме при температуре 30°C в течение 48 часов в мембранном контакторе воздух/жидкость М1.
8.1.1 Анализ продуцированной биомассы
В данном способе наблюдалось два типа биомассы: один - в свободной суспензии в культуральной среде, а другой - в иммобилизованном виде на мембранном контакторе воздух/жидкость.
Свободные клетки экспоненциально культивировали с удельной скоростью роста 0,2 ч-1 до 18-го часа. Свободная биомасса достигла максимума 2,6 г л-1 через одни сутки культивирования, а затем оставалась на постоянном уровне до конца культивирования.
Анализ газов выявил наличие биомассы, иммобилизованной на мембране. Рост данной биомассы имел место в первый день культивирования до достижения 1,2 г м-2. В первые сутки культивирования скорость потребления глюкозы, согласно измерению, составляла 1,61 г л-1 ч-1, а затем уменьшалась по мере исчерпания глюкозы в среде.
8.1.2 Анализ продуцированного микосубтилина
Продуцирование микосубтилина достигало 10 мг л-1 через два дня культивирования. Во время промывки мембраны десорбировали 45 мг, что соответствовало общему объему продукции 25 мг л-1 и средней производительности 0,5 мг л-1 ч-1. После очистки посредством этапов микрофильтрации, ультрафильтрации/диафильтрации и высушивания получили смесь микосубтилинов в виде порошка, содержащего новые формы микосубтилина. Чистота указанной смеси составила более 94%.
8.2 Непрерывное продуцирование, выделение и очистка микосубтилина В. subtilis BBG125 с помощью полностью повторно используемых клеток
В данном примере штамм В. subtilis BBG125 (поданный 10 марта 2011 года под номером CNCM 1-4451 в Национальную коллекцию культур микроорганизмов (CNCM) Института Пастера (Париж, Франция)), способный конститутивно продуцировать только микосубтилин, непрерывно культивировали при 22°C в течение 72 часов в мембранном контакторе воздух/жидкость М1.
В дополнение к мембранному контактору воздух/жидкость, обеспечивавшему рост и иммобилизацию клеток, способ, представленный в данном примере, также характеризовался наличием:
- устройств непрерывной подачи и отвода из указанного реактора заданного потока указанного субстрата, в соответствии с описанием в примере 6;
- микрофильтрационной мембраны М2 с площадью поверхности 0,45 м2 и размером пор 0,2 мкм, в соответствии с описанием в примере 6;
- трех баков: подачи (бак 1), концентрирования (бак 2) и отходов (бак 3), в соответствии с описанием в примере 6; и
- ультрафильтрационной мембраны М3 с площадью поверхности 0,1 м2 и порогом отсечки 10 кДа, в соответствии с описанием в примере 6.
Кроме того, скорости подачи и оттока насосов Р1 и Р5, в соответствии с описанием в данном примере, были равны и отрегулированы так, чтобы получить степень разбавления около 0,1 ч-1, то есть почасовую скорость потока, равную 0,1 объема водной фазы, содержавшейся в устройстве для продуцирования.
Одна из особенностей данного способа, в соответствии с настоящим изобретением состоит в повторном использовании в устройстве для продуцирования всех клеток микроорганизмов после удаления остатков органических веществ и биосурфактантов, что позволяет получить высокую скорость роста микроорганизмов на мембране. Перед непрерывным культивированием проводили 20-часовое периодическое культивирование.
8.2.1 Анализ биомассы
В течение первых 40 часов непрерывного культивирования при степени разбавления 0,1 ч-1 концентрация свободной биомассы в жидкой среде продолжала увеличиваться до 7,2 г л-1. В дальнейшем ее концентрация оставалась постоянной, что ясно указывало на присутствие ингибитора. С другой стороны, анализ газов выявил значительную иммобилизацию клеток на мембране, концентрация которых достигала 3,1 г м-2 через три дня культивирования. В течение первых двух дней культивирования концентрация глюкозы уменьшилась со скоростью потребления глюкозы 1,5 г л-1 час-1.
8.2.2 Анализ продуцированного сурфактина
Микосубтилин, таким образом, выделяли через микрофильтрационную мембрану и концентрировали с помощью 10-кДа ультрафильтрационной мембраны; наблюдалось его накопление в промежуточном баке. Продуктивность микосубтилина возрастала в течение первых 40 часов культивирования и достигала максимального значения 1,5 мг л-1 ч-1. После данного эксперимента промывка мембран позволяла выделить 84 мг микосубтилина. В конце данного эксперимента непрерывная культура продуцировала 895 мг микосубтилина в растворе, что соответствовало средней концентрации 48 мг продуцированного микосубтилина на литр потребленной среды. Этапы ультрафильтрации/диафильтрации позволили получить сурфактин в растворе с чистотой 90%. Этот непрерывный способ продемонстрировал производительность, в три раза превосходящую производительность в периодическом режиме, описанную в примере 8.1.
БИБЛИОГРАФИЯ
[1] Ongena, М. and Jacques, P. 2008. Bacillus lipopeptides: versatile weapons for plant disease biocontrol. Trends Microbiol. 16, 115-125.
[2] CZ 20011620
[3] DE 102005050123
[4] FR 2578552
[5] Guez, J.S. et al., 2007. Setting up and modelling of overflowing fed-batch cultures of Bacillus subtilis for the production and continuous removal of lipopeptides, J. Biotechnol., 131, 67-75.
[6] Davis, D.A., Lynch, H.C. and Varley, J., 1999. The production of Surfactin in batch culture by Bacillus subtilis ATCC 21332 is strongly influenced by the conditions of nitrogen metabolism. Enzyme Microb. Technol. 25, 322-329.
[7] WO 0226961
[8] EP 1320595
[9] Landy, M. et al. 1948. Bacillomycin; an antibiotic from Bacillus subtilis active against pathogenic fungi. Proc. Soc. Exp.Biol. Med. 67, 539-541.
[10] Guez, J.S. et al., 2008. Respiration activity monitoring system (RAMOS), an efficient tool to study the influence of the oxygen transfer rate on the synthesis of lipopeptide by Bacillus subtilis. J. Biotechnol. 134, 121-126.
[11] Remize, P.J. and Cabassud, C. 2003. A novel bubble-free oxidation reactor: the G/L membrane contactor. Recent progress in process engineering. Integration of membranes in the processes 2. Lavoisier Tec et Doc.
[12] Duitman, E.H. et al., 1999. The mycosubtilin synthetase of Bacillus subtilis ATCC 6633: a multifunctional hybrid between a peptide synthetase, an amino transferase and a fatty acid synthase. Proc. Natl. Acad. Sci. U.S.A., 96, 13294-13299.
[13] Leclere, V. et al., 2005. Mycosubtilin overproduction by Bacillus subtilis BBG100 enhances the organism′s antagonistic and biocontrol activities. Appl. Environ. Microbiol. 71,4577-4584.
[14] Sambrook, J. and Russell, D.W. 2001. Molecular cloning: a laboratory manual, 3-rd ed., Cold Spring Harbor Laboratory, Cold Spring Harbor, New York.
[15] Dennis, J.J. and Zylstra, G.J. 1998. Plasposons: modular self-cloning minitransposon derivatives for rapid genetic analysis of gram-negative bacterial genomes. Appl. Environ. Microbiol. 64, 2710-2715.
[16] Herrero, M., de Lorenzo, V. and Timmis, K.N. 1990. Transposon vectors containing non-antibiotic resistance selection markers for cloning and stable chromosomal insertion of foreign genes in gram-negative bacteria, J. Bacteriol. 172, 6557-6567.
[17] Bertani, G. 2004. Lysogeny at mid-twentieth century: P1, P2, and other experimental systems. J. Bacteriol. 186, 595-600.
[18] Dubnau, D.A. 1982. Genetic transformation of bacillus subtilis p148-178. In D.A. Dubnau (Ed) The molecular biology of the Bacilli, vol I. Bacillus subtilis. Academic Press, Inc. New York.
[19] Besson, F. et al. 1979. Antifungal activity upon Saccharomyces cerevisiae of iturin A, mycosubtilin, bacillomycin L and of their derivatives; inhibition of this antifungal activity by lipid antagonists. J. Antibiot. (Tokyo) 32, 828-833.
[20] Chen, H.L., Chen, Y.S. and Juang, R.S. 2007. Separation of surfactin from fermentation broths by acid precipitation and two-stage dead-end ultrafiltration processes. J. Membr. Sci. 299, 114-121.
[21] Chen, H.L., Chen, Y.S., and Juang, R.S. 2008. Flux decline and membrane cleaning in cross-flow ultrafiltration of treated fermentation broths for surfactin recovery. Sep.Purif. Technol. 62, 47-55.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОСТИМУЛИРУЮЩАЯ КОМПОЗИЦИЯ ДЛЯ РОСТА РАСТЕНИЙ, СОДЕРЖАШАЯ ЛИПОПЕПТИДЫ | 2017 |
|
RU2760289C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ ИЗ БАКТЕРИЙ РОДА BACILLUS | 1997 |
|
RU2112035C1 |
| Штамм бактерий Bacillus subtilis subspecies subtilis krd-20 - продуцент фунгистатических липопептидов | 2022 |
|
RU2802234C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТЕОЛИТИЧЕСКОГО ФЕРМЕНТНОГО ПРЕПАРАТА И ПРОТЕОЛИТИЧЕСКИЙ ФЕРМЕНТНЫЙ ПРЕПАРАТ | 2004 |
|
RU2285038C2 |
| КОМПОЗИЦИЯ, ИМЕЮЩАЯ ВЫСОКУЮ КОНЦЕНТРАЦИЮ ИТУРИНОВЫХ ЛИПОПЕПТИДОВ | 2018 |
|
RU2801578C1 |
| ШТАММ Bacillus licheniformis БСТ-1-ПРОДУЦЕНТ ПЕНИЦИЛЛИНАЗЫ И СПОСОБ ПОЛУЧЕНИЯ ПЕНИЦИЛЛИНАЗЫ | 2002 |
|
RU2221041C1 |
| Способ получения фунгистатических липопептидов | 2023 |
|
RU2825156C1 |
| СПОСОБ ПРОИЗВОДСТВА ПРОБИОТИЧЕСКОГО ПРЕПАРАТА НА ОСНОВЕ СПОРООБРАЗУЮЩИХ ШТАММОВ Bac. subtilis И Bac. licheniformis | 2010 |
|
RU2432392C1 |
| Питательная среда для культивирования бактерий родов Paenibacillus и Bacillus | 2024 |
|
RU2829228C1 |
| Метабиотическая композиция на основе метаболитов Bacillus subtilis | 2022 |
|
RU2803259C1 |
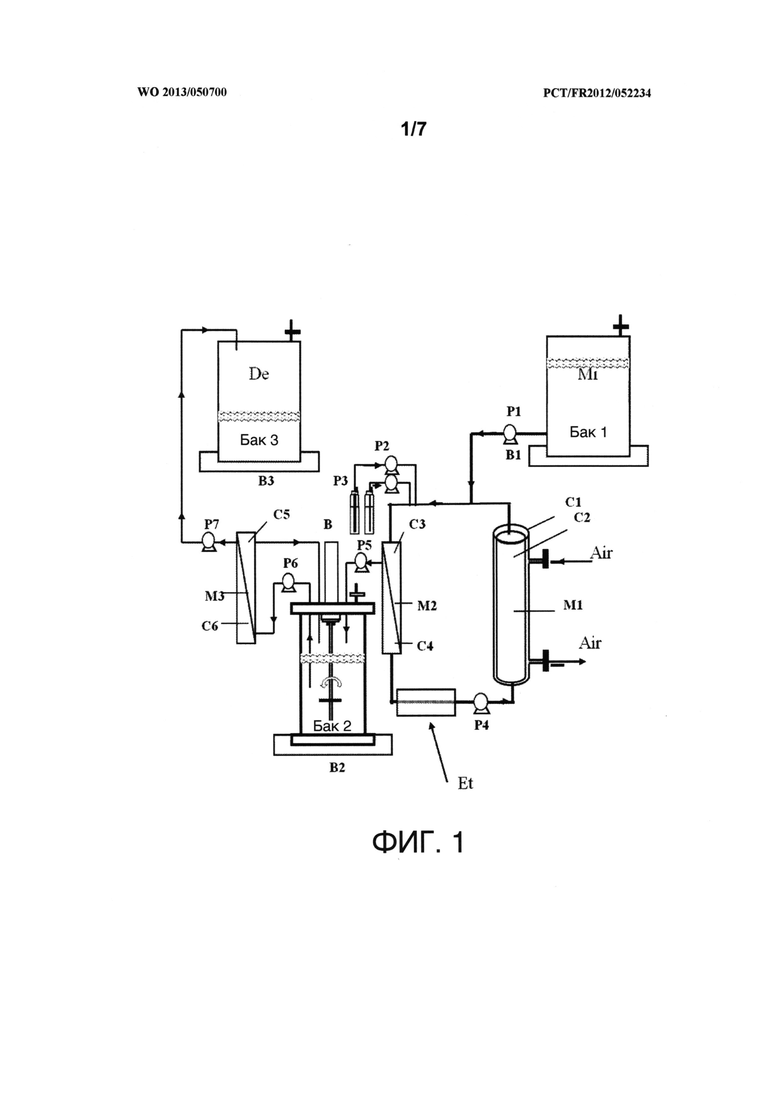
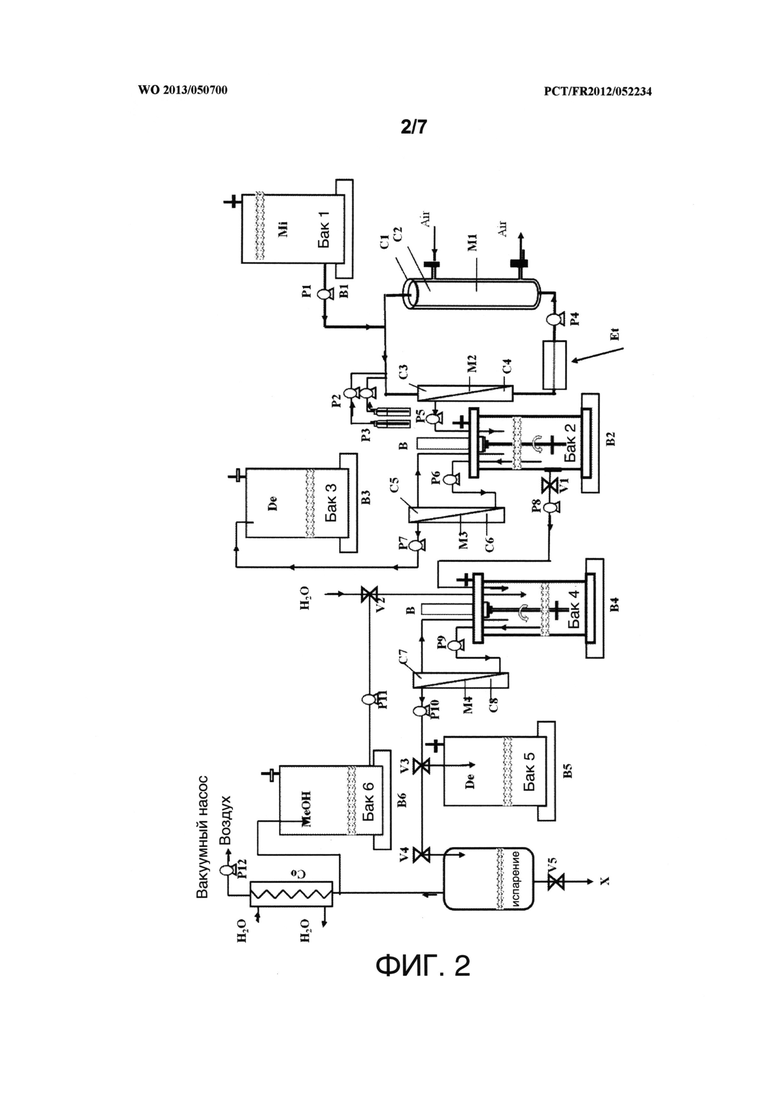
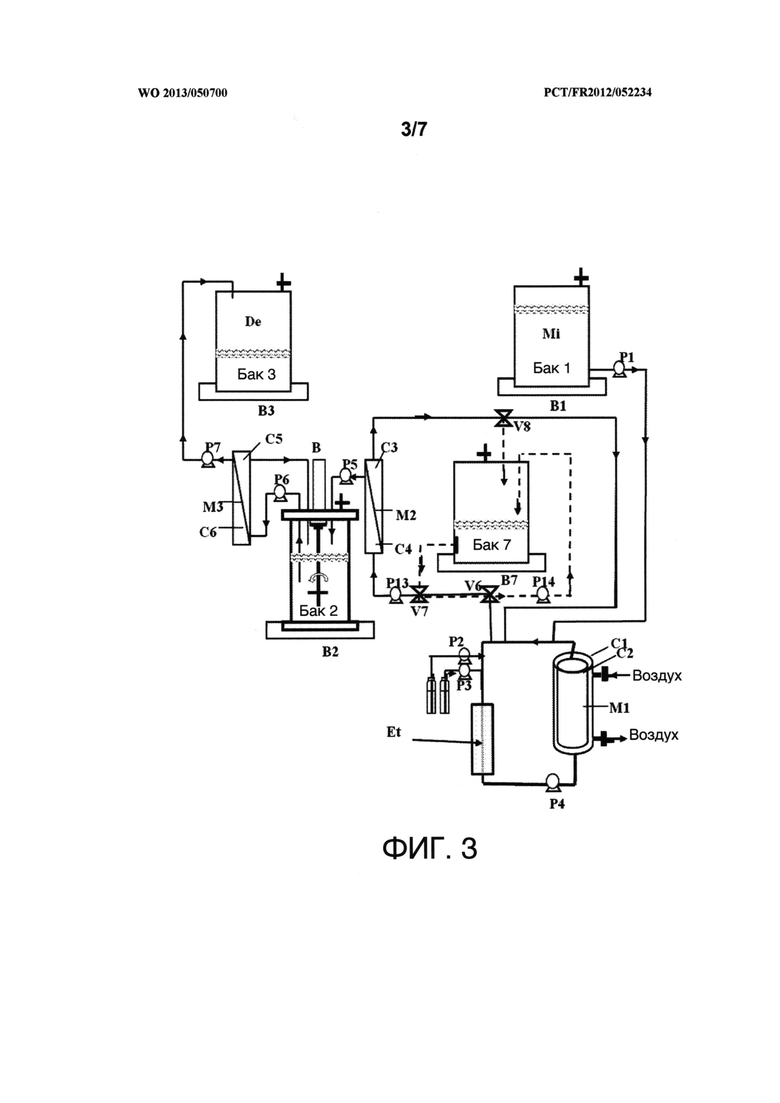
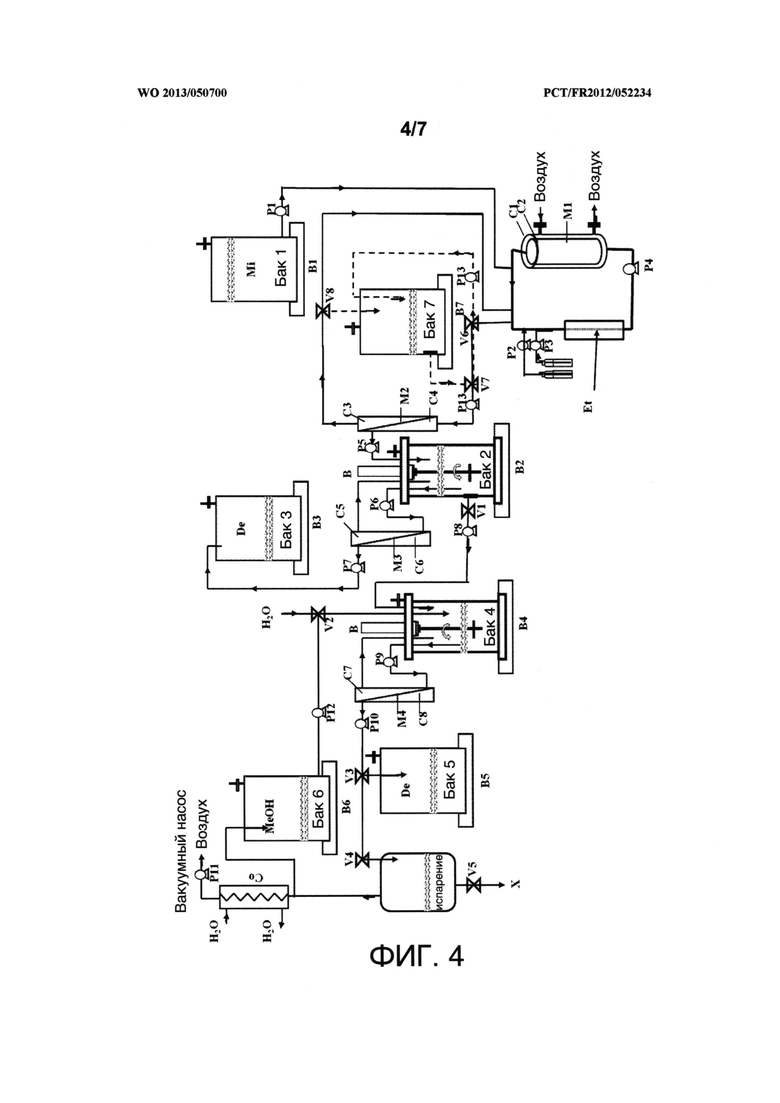
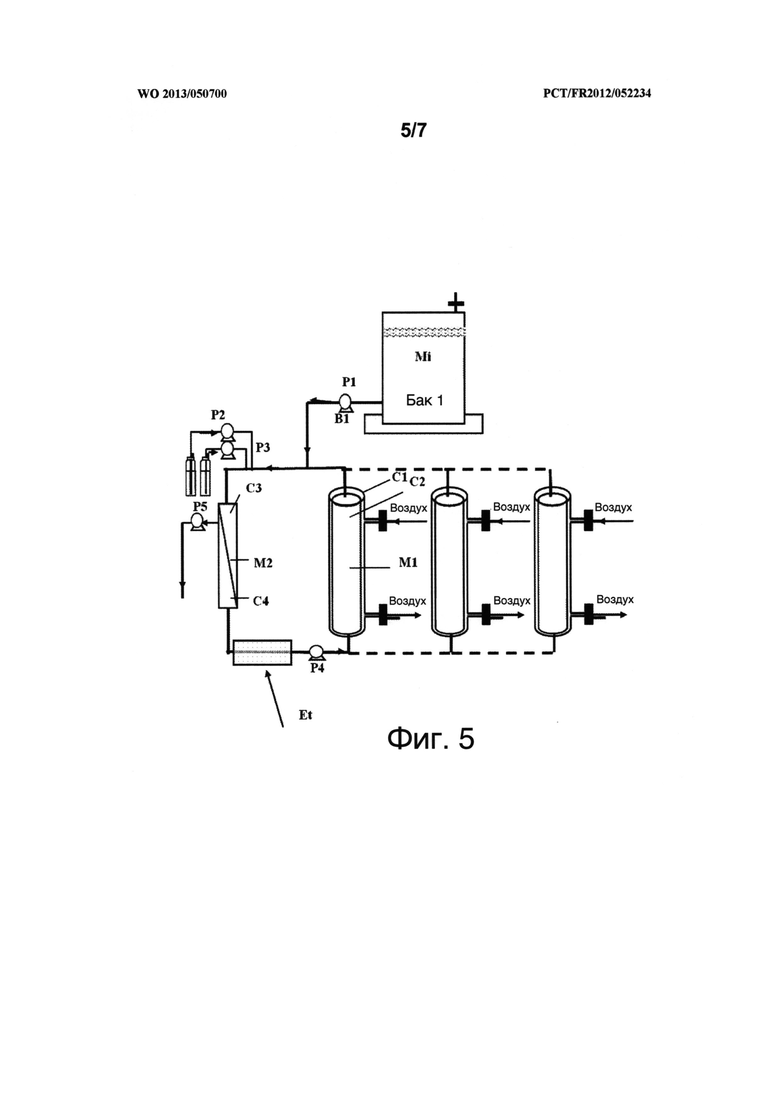
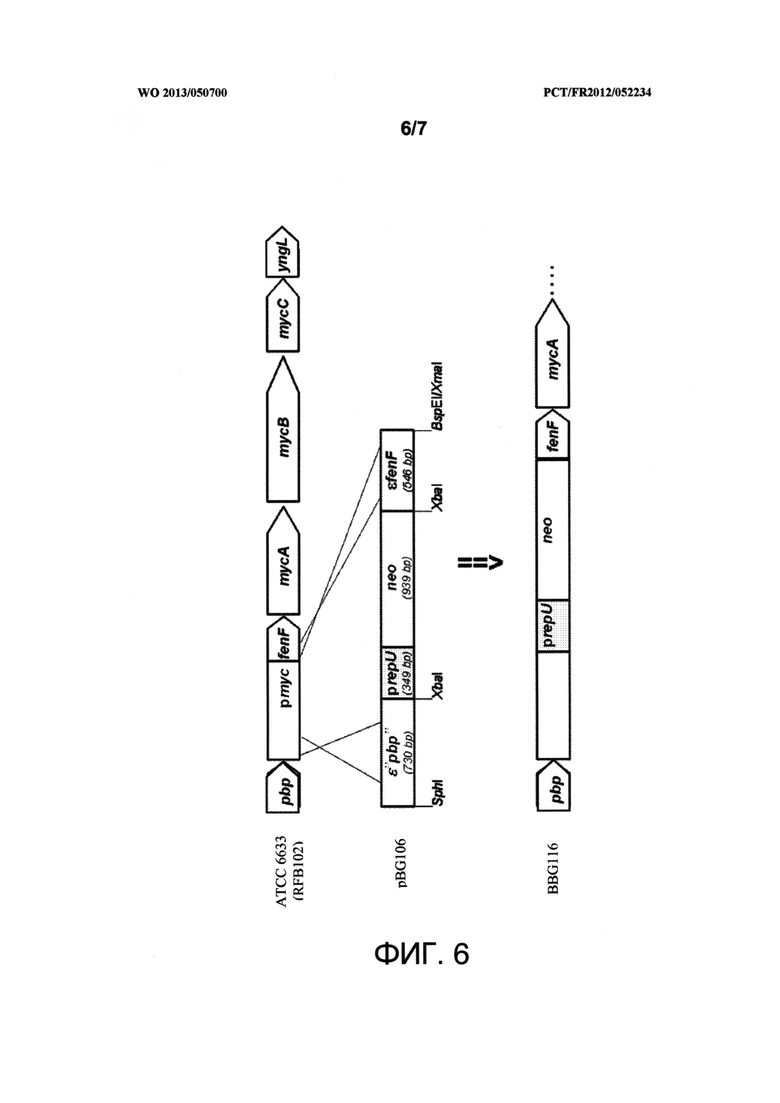
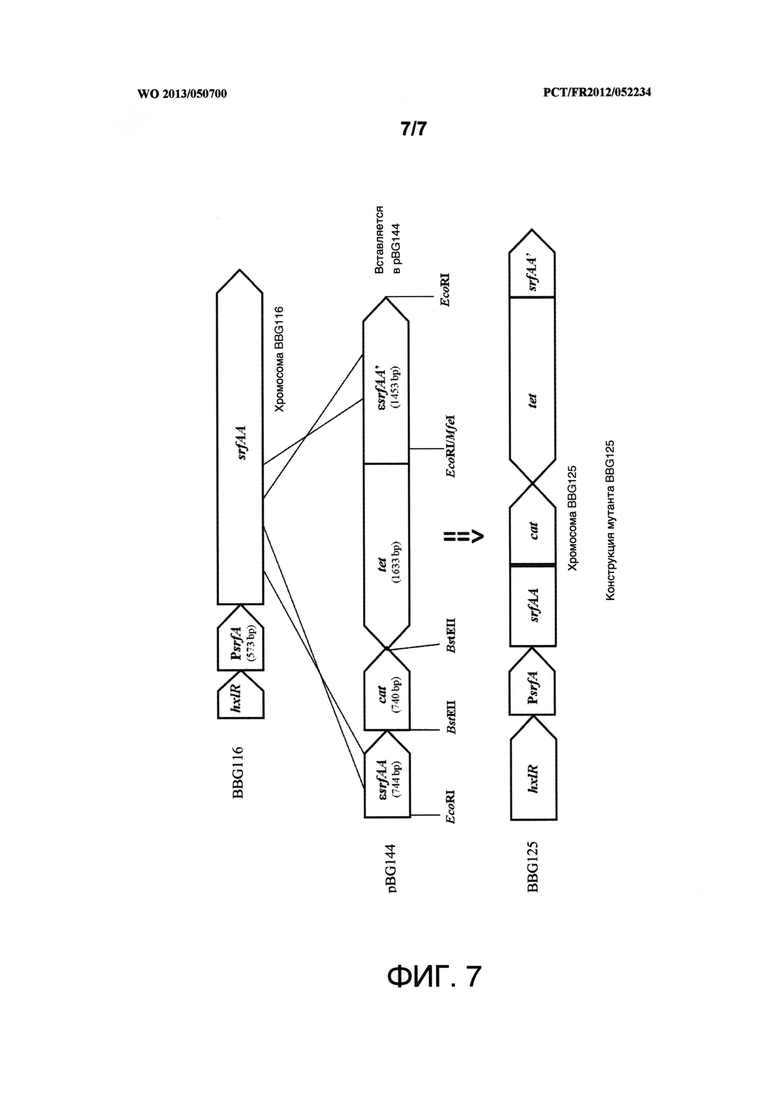
Изобретение относится к области биохимии, в частности к микосубтилину, цепь жирной кислоты которого содержит 18 атомов углерода (С18-микосубтилин), и к микосубтилину, цепь жирной кислоты которого содержит 17 атомов углерода (С17-микосубтилин Gln3). Пептидный цикл указанного С17-микосубтилина имеет глутамин вместо аспарагина в положении 3. Настоящее изобретение относится также к композиции для применения в качестве противогрибкового агента. Указанная композиция содержит по меньшей мере один С18-микосубтилин и/или по меньшей мере один С17-микосубтилин Gln3 в эффективном количестве. Настоящее изобретение позволяет получать композицию для применения в качестве противогрибкового агента. 3 н. и 3 з.п. ф-лы, 7 ил., 7 табл., 8 пр.
1. Микосубтилин, цепь жирной кислоты которого содержит 18 атомов углерода (С18-микосубтилин), представленный следующей формулой (I):

2. Микосубтилин, цепь жирной кислоты которого содержит 17 атомов углерода, пептидный цикл которого имеет глутамин вместо аспарагина в положении 3 (С17-микосубтилин Gln3), представленный следующей формулой (II):
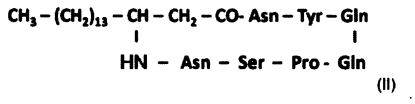
3. Микосубтилин по п. 1 или 2 для применения в качестве противогрибкового агента.
4. Композиция для применения в качестве противогрибкового агента, содержащая по меньшей мере один С18-микосубтилин по п. 1 и/или по меньшей мере один С17-микосубтилин Gln3 по п. 2 в эффективном количестве.
5. Композиция по п. 4, отличающаяся тем, что дополнительно содержит по меньшей мере один микосубтилин, выбранный из группы, включающей изо-С16-микосубтилин, n-С16-микосубтилин, антеизо-С17-микосубтилин, изо-С17-микосубтилин и их смеси.
6. Композиция по п. 5, отличающаяся тем, что содержит от 1% до 60% изо-С16-микосубтилина, от 1% до 20% С17-микосубтилина Gln3, от 1% до 10% n-С16 микосубтилина, от 20% до 95% антеизо-С17-микосубтилина, от 5% до 30% изо-С17-микосубтилина и от 1% до 5% С18-микосубтилина.
| PEYPOUX F et al., Revised structure of mycosubtilin, a peptidolipid antibiotic from Bacillus subtilis, THE JOURNAL OF ANTIBIOTICS, 1986, vol | |||
| Машина для изготовления проволочных гвоздей | 1922 |
|
SU39A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| LECLERE V et al., The lipopeptides mycosubtilin and surfactin enhance spreading of Bacillus subtilis strains by their surface-active properties, ARCHIVES OF | |||
Авторы
Даты
2016-12-27—Публикация
2012-10-03—Подача