Изобретение относится к способу получения перфторуглеродов, содержащих в составе молекулы атомы брома. Перфторалкилбромиды являются эффективными пламегасителями и используются для защиты персонала или ценного электронного оборудования при возгорании в замкнутых объемах. Лабильность атома брома как в радикальных, так в ионных реакциях, позволяет использовать его перфторалкильные соединения при синтезе новых фторорганических соединений. Перфтороктилбромид используют в качестве рентгеноконтрастного компонента газопереносящих жидкостей в медицине, а также в качестве промежуточного продукта для получения новых потенциальных мезоморфных [1], биологически и каталитически активных соединений [2, 3], перфторированных тетрафенилпорфиринов.
Для получения перфторалкилбромидов разработано несколько способов.
Известен способ получения перфторалкилбромидов реакцией бромистого водорода с перфторалкансульфонилхлоридом в присутствии катализатора (третфосфина, третамина) при 100-200°С [4]. Выход перфторалкилбромидов составляет 86-95%. Использование в качестве исходного реагента перфторалкансульфонилхлорида, который необходимо получать дополнительно, является недостатком данного способа.
Известен способ получения трифторметилбромида и перфторбутилбромида, основанный на декарбонилировании соответствующих бромангидридов перфторкарбоновых кислот в угольной трубе при 250-500°С. При этом конверсия бромангидрида перфторвалериановой кислоты составила 60%, выход перфторбутилбромида - 40%. Недостатками известного способа являются низкая конверсия исходных реагентов, низкий выход перфторалкилбромидов, и высокая температура реакционной среды (до 500°С).
Наиболее близким к предлагаемому техническому решению является предложенный О.Н. Чечиной способ получения перфторалкилбромидов электросинтезом Кольбе, который не требует высоких температур и давлений и обеспечивает хорошую воспроизводимость результатов в мягких условиях электролиза. Известно, что при электролизе растворов частично нейтрализованных перфторкарбоновых кислот и галогена в среде смеси ацетонитрил-вода (1:1) реализуется электрохимческий вариант реакции Бородина-Хунсдикера с образованием соответствующих перфторалкилгалогенидов. Использование перфторнонановой кислоты в присутствии элементного брома на платиновом анода при плотности тока 0,01-0,03 А/см2 позволило получить перфтороктилбромид с выходом до 94% [5]. В данной методике используется электрохимический синтез и в качестве исходных продуктов применяются перфторкарбоновые кислоты, ацетонитрил (прошедший очистку), натрий бромистый в качестве источника брома. Недостатком данного метода является сложность аппаратурного оформления процесса и использование гепатотоксичного исходного сырья (перфторпеларгоновой кислоты), производство и использование которого запрещено.
Целью данного изобретения является упрощение способа синтеза перфторалкилбромидов, его аппаратурного оформления, замена исходного токсичного сырья, в частности перфторпеларгоновой кислоты, с сохранением высокого выхода целевого продукта.
Цель изобретения достигается тем, что синтез проводится с применением обычной лабораторной посуды без использования сложного оборудования, а в качестве исходного реагента применяется перфторгептановый спирт.
Сущность предлагаемого способа заключается в следующем. Перфторалкилбромид получали путем химических превращений из трифенилфосфиндибромида, полученного взаимодействием трифенилфосфина с бромом в ацетонитриле
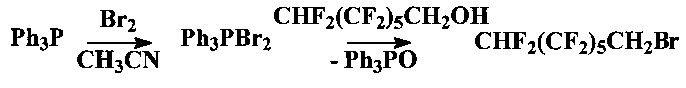
С этой целью трифенилфосфин растворяли в ацетонитриле при 0°С и медленно добавляли бром в течение 20-30 мин, получая трифенилфосфиндибромид. Затем охлаждение удаляли, добавляли 1,1,3-H-перфтогептанол и кипятили смесь при 170-180°С в течение 90 минут для прохождения реакции синтеза перфторалкилбромида. В дальнейшем осуществляли отгонку ацетонитрила. Полученное вещество перемешивали с 10%-ным раствором гидроксида калия для удаления спирта, затем разбавляли хлористым метиленом, промывали водой, высушивали хлоридом кальция и перегоняли, собирая фракцию с температурой кипения ~155°С.
Время синтеза 90 мин является оптимальным для осуществления реакции синтеза перфторалкилбромида с достаточно высоким выходом 90…95%. Увеличение длительности процесса сверх 90 мин увеличивает выход продукта незначительно (на 0,3…0,5%). Уменьшение времени синтеза менее 90 мин более существенно снижает выход продукта (на 2,0…2,4%).
Температура проведения реакции 170…180°С является необходимой и достаточной, чтобы поддержать максимальный выход продукта 90…95%.
Таким образом, заявляемыми признаками изобретения являются:
- упрощение способа синтеза;
- упрощение аппаратурного оформления процесса;
- замена исходного гепатотоксичного сырья (перфторпеларгоновой кислоты) на менее токсичный перфторированный спирт теломер, который производится промышленностью и является коммерчески доступным.
Способ получения перфторалкилбромида в соответствии с предлагаемым изобретением иллюстрируют следующие примеры.
Пример 1. К смеси 7,6 г (29,0 ммоль) трифенилфосфина (Мм - 262,29) и 10 мл ацетонитрила при перемешивании и охлаждении льдом прибавляли по каплям 1,5 мл (29,0 ммоль) брома (Мм - 159,82, d - 3,102) за 15 мин, затем охлаждение удаляли и добавляли 5,0 мл (26,5 ммоль) 1,1,3-H-перфтогептанола (Мм - 330,09; d - 1,75, Ткип - 170°С) и смесь кипятили 80 мин. Затем ацетонитрил отгоняли. Полученное вещество перемешивали с 10%-ным раствором гидроксида калия для удаления спирта, затем разбавляли хлористым метиленом, промывали водой, высушивали хлоридом кальция и перегоняли, собирая фракцию с температурой ~155°С. Выход 1,1,7-H-перфторгептил бромид составил 7,9 г (75,4%).
1Н ЯМР (вн.ст. ТМС) δ, м.д.: 6,02tt (1Н, J=5,2 Hz, 1J=52,0 Hz, CHF2); 3,76t (2H, 2J=15,7 Hz, CH2) (CDCl3)
Пример 2. К смеси 7,6 г (29,0 ммоль) трифенилфосфина (Мм - 262,29) и 10 мл ацетонитрила при перемешивании и охлаждении льдом прибавляли по каплям 1,5 мл (29,0 ммоль) брома (Мм - 159,82, d - 3,102) за 15 мин, затем охлаждение удаляли и добавляли 5,0 мл (26,5 ммоль) 1,1,3-H-перфтогептанола (Мм - 330,09; d - 1,75, Ткип - 180°С) и смесь кипятили 100 мин. Затем ацетонитрил отгоняли. Полученное вещество перемешивали с 10%-ным раствором гидроксида калия для удаления спирта, затем разбавляли хлористым метиленом, промывали водой, высушивали хлоридом кальция и перегоняли, собирая фракцию с температурой ~155°С. Выход 1,1,7-H-перфторгептил бромид составил 9,7 г (94,2%).
Пример 3. К смеси 7,6 г (29,0 ммоль) трифенилфосфина (Мм - 262,29) и 10 мл ацетонитрила при перемешивании и охлаждении льдом прибавляли по каплям 1,5 мл (29,0 ммоль) брома (Мм - 159,82, d - 3,102) за 15 мин, затем охлаждение удаляли и добавляли 5,0 мл (26,5 ммоль) 1,1,3-H-перфтогептанола (Мм - 330,09; d - 1,75, Ткип - 190°С) и смесь кипятили 90 мин. Затем ацетонитрил отгоняли. Полученное вещество перемешивали с 10%-ным раствором гидроксида калия для удаления спирта, затем разбавляли хлористым метиленом, промывали водой, высушивали хлоридом кальция и перегоняли, собирая фракцию с температурой ~155°С. Выход 1,1,7-H-перфторгептил бромид составил 9,7 г (93,7%).
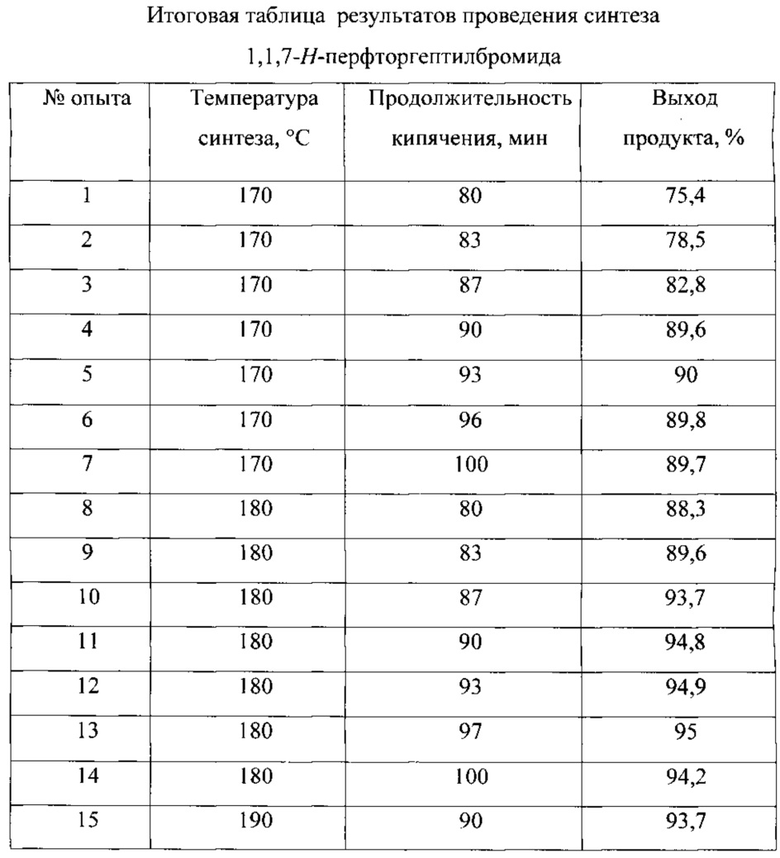
Предлагаемые технические решения позволяют упростить способ синтеза и аппаратурное оформление процесса по сравнению с прототипом, исключить использование токсичного исходного сырья с выходом готового продукта 90…95%.
Структура и состав синтезирванного продукта подтверждена методами ИК- и ЯМР-спектроскопии, что дает возможность использовать его по назначению, в частности для синтеза перфторированных тетрафенилпорфиринов.
Литература
1. Быкова В.В., Усольцева Н.В., Ананьева Г.А., Семейкин А.С., Карманова Т.В. [Текст]: - // Жидкие кристаллы и их практическое использование. 2007. Т. 22. Вып. 4. С. 67-74.
2. «Успехи химии порфиринов» СПб.: НИИ химии СПбГУ. Под ред. Голубчикова О.А. 1999. [Текст]: - Т. 2. 337 с.
3. «Успехи химии порфиринов» СПб.: НИИ химии СПбГУ. Под ред. Голубчикова О.А. 2001. [Текст]: - Т. 3. 359 с.
4. Пат. СССР (51)5, С07С 17/33, 19/08. Способ получения хлор-, бром-, йодперфторалканов или бром-, йодперфторалкоксиланов.
5. О.Н. Чечина, В.В. Беренблит, С.В. Соколов. О механизме электрохимического синтеза перфторалкилбромидов / Журнал “Фторные заметки”, № 2 (81) 2012.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПЕРФТОРАЛКИЛЙОДИДОВ И БРОМИДОВ | 2020 |
|
RU2739762C1 |
| Способ получения хлор-, бром-, йодперфторалканов или бром-, йодперфторалкоксиалканов | 1990 |
|
SU1745715A1 |
| НОВЫЕ СМЕСИ ПЕРФТОР-, АЛЬФА-ХЛОРПЕРФТОР- И АЛЬФА, ОМЕГА-ДИХЛОРПЕРФТОРАЛКАНОВ, СПОСОБ ПОЛУЧЕНИЯ И ОБЛАСТЬ ПРИМЕНЕНИЯ | 2004 |
|
RU2264375C2 |
| Способ получения (S)-(+)-2-хлор-или (R)-(-)-2-хлороктана | 1989 |
|
SU1710539A1 |
| Способ получения 4'-(трифторметил)-2,2':6',2''-терпиридина | 2020 |
|
RU2723682C1 |
| ПРОИЗВОДНЫЕ БИС-БЕНЗО- ИЛИ БЕНЗОПИРИДО-ЦИКЛОГЕПТАПИПЕРИДИНА, ПИПЕРИДИЛИДЕНА И ПЕПЕРАЗИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1991 |
|
RU2086549C1 |
| ИНГИБИТОРЫ ПРОТЕИН-ТИРОЗИНФОСФАТАЗЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2799446C2 |
| ИНГИБИТОРЫ БЕЛКОВЫХ ТИРОЗИНФОСФАТАЗ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2833220C2 |
| СПОСОБ АДДИТИВНОЙ ПОЛИМЕРИЗАЦИИ НОРБОРНЕНА И ЕГО ПРОИЗВОДНЫХ | 2015 |
|
RU2626745C2 |
| ПРОИЗВОДНОЕ 2-ЗАМЕЩЕННОГО САХАРИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОЯВЛЯЮЩАЯ ИНГИБИТОРНУЮ АКТИВНОСТЬ ПРОТИВ ЭЛАСТАЗЫ | 1992 |
|
RU2101281C1 |
Изобретение относится к способу получения перфторалкилбромида из трифенилфосфиндибромида, полученного взаимодействием трифенилфосфина с бромом в ацетонитриле при 0°С, и 1,1,3-H-перфтогептанола при температуре 170-180°С в течение 90 минут. Технический результат – упрощение аппаратурного оформления, замена исходного токсичного сырья, с сохранением высокого выхода целевого продукта. 1 табл., 3 пр.
Способ получения перфторалкилбромида из фторсодержащих углеводородов и галогена в среде ацетонитрила, отличающийся тем, что синтез проводят химическим превращением при температуре 170-180°C в течение 90 минут, а в качестве фторсодержащего углеводорода используют перфторгептанол.
| Warren G.Duncan et al., Conversion of primaru fluoro alcohols to bromides, Journal of Chemical and Engineering Data, 1966, vol.11, 129-130 | |||
| Запевалов А.Я | |||
| и др., α , α -дизамещенные полифторалканы, Журнал органической химии, 1988, том.24, 8, 1626-1633 | |||
| Чечина О.Н | |||
| и др., О механизме электрохимического синтеза перфторалкилбромидов, Журнал фторные заметки, 2012, том.81, N2. |
Авторы
Даты
2017-01-10—Публикация
2015-05-20—Подача