ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
В соответствии с 119 (e) Раздела 35 Свода законов США по настоящей заявке испрашивается приоритет предварительной заявки на патент США №62/150,138, поданной 20 апреля 2015, содержание которой полностью включено в настоящую заявку посредством ссылки.
Область изобретения
Настоящее изобретение относится к способам лечения рака с помощью назначения схемы лечения, включающей прием альвоцидиба, пациенту, имеющему высокую вероятность ответа на схему лечения, включающую прием альвоцидиба. В некоторых вариантах осуществления способы включают прогнозирование ответа пациента на схему лечения, включающую прием альвоцидиба.
УРОВЕНЬ ТЕХНИКИ
Использование предиктивных и прогностических биомаркеров в сочетании с таргетной терапией рака может позволить сократить время разработки лекарственных средств, повысить эффективность лекарственных средств и стать основой в принятии клинических решений. Несмотря на прогресс в лечении рака, химиотерапия остается в значительной степени неэффективной и безрезультатной. Одной из причин общей низкой эффективности химиотерапии является то, что выбранное лечение часто плохо соответствует заболеванию индивидуального пациента. Персонализированный подход в медицине, сочетающий точную диагностику с терапией, может облегчить эту проблему.
На сегодняшний день существует лишь несколько биомаркеров, имеющих ценность для клинической онкологической практики. Частично это объясняется тем, что выявленные маркеры обычно связаны с механизмом действия лекарственного средства не причинно-следственными связями, а только на уровне корреляции. Даже когда биологические особенности "биомаркера" непосредственно связаны с фармакологическими особенностями сопутствующей терапии, тем не менее прогнозирование ответа пациента на лекарственное средство остается сложной задачей. Помимо этого, клинические исследования требуют участия врачей-ученых, которые видят ценность теста и считают, что он может принести пользу их пациентам.
Антиапоптотические белки семейства Bcl-2 являются ключевыми причинными факторами ответа раковых клеток на химиотерапию. Показано, что активности этих белков в регуляции митохондриального пути апоптоза можно использовать в качестве предиктивных биомаркеров ответа больных раком пациентов на лечение. В основе эффективности многих химиотерапий лежит эффективность апоптоза и в некоторых случаях модуляция апоптоза специфическими антиапоптотическими белками коррелирует с восприимчивостью пациента к конкретному лечению. Таким образом, измерение особенностей конкретного белка выступает в качестве биомаркера ответа на лекарственное средство. Следовательно, существует необходимость в дальнейшем поиске биомаркеров, позволяющих предсказывать ожидаемый ответ на терапевтическое средство.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Соответственно, в одном варианте осуществления настоящее изобретение предоставляет способ лечения рака у нуждающегося в этом пациента, при этом способ содержит:
a) запрос данных о профиле BH3 в образце раковых клеток, полученном из костного мозга пациента; и
b) назначение пациенту схемы лечения, включающей прием альвоцидиба, если ответ на обработку NOXA (NOXA priming) в образце раковых клеток составил по меньшей мере 15%.
В другом варианте осуществления изобретение относится к способу лечения рака у нуждающегося в этом пациента, при этом способ содержит:
a) запрос данных об уровне экспрессии MCL-1 в образце раковых клеток, полученном из костного мозга пациента; и
b) назначение пациенту схемы лечения, включающей прием альвоцидиба, если уровень экспрессии MCL-1 в образце раковых клеток превышает по меньшей мере в 1,1 раз уровень экспрессии MCL-1 в нормальных клетках.
В других вариантах осуществления изобретение относится к способу определения вероятности ответа пациента на схему лечения, включающую прием альвоцидиба, при этом способ содержит:
контактирование образца пермеабилизированных раковых клеток из костного мозга пациента с одним или несколькими пептидами, содержащими домен BH3;
измерение ответа клеток на обработку NOXA в образце; и
классификацию пациента как вероятно восприимчивого к схеме лечения, если ответ на обработку NOXA в образце составляет не менее 15%.
В других близких вариантах осуществления изобретение предоставляет способ определения вероятности ответа пациента на схему лечения, включающую прием альвоцидиба, при этом способ содержит:
определение уровня экспрессии MCL-1 в образце раковых клеток из костного мозга пациента; и
классификацию пациента как вероятно восприимчивого к схеме лечения, если уровень экспрессии MCL-1 в образце раковых клеток превышает по меньшей мере в 1,1 раз уровень экспрессии MCL-1 в нормальных клетках.
В другом аспекте изобретение относится к способу выбора способа лечения рака для пациента, при этом способ содержит определение ответа на средства, нарушающие функционирование подавляющих проапоптотические белки белков MCL1 и BFL1, за счет получения BH3 профиля раковых клеток пациента, оценку одного или более клинических факторов у пациента и классификацию пациента на основании вероятности клинического ответа на один или несколько способов лечения рака, направленных на нарушение функционирования MCL1.
В некоторых вариантах осуществления и как описано в настоящем документе образец рака больного представляет собой раковые клетки, очищенные из аспирата костного мозга. Раковые клетки обрабатывают средствами, которые избирательно нарушают связывание MCL1 или MCL1 и BFL1 с проапоптотическими белками Bim, Bid, Bax или Bak, что определяют с помощью пептидов, таких как содержащий только BH3 домен NOXA или миметики BH3, обладающих селективным действием на MCL1 или на MCL1 и BFL1.
В некоторых вариантах осуществления и как описано в настоящем документе сравниваются показания анализа BH3 в образцах рака больного, состоящих из раковых клеток, очищенных из аспиратов костного мозга, и показания анализа BH3, полученных из анализа профиля BH3 в периферической крови. Различные показания предсказывают ответ на различные параметры лечения. Кроме того, показано, что на основании профиля BH3 в клетках острого миелоидного лейкоза (ОМЛ), полученных из костного мозга пациентов, можно прогнозировать результат лечения по схеме FLAM, тогда как на основании профиля BH3 в клетках ОМЛ из периферической крови нельзя прогнозировать результат лечения по схеме FLAM, но можно прогнозировать результат применения схемы 7+3.
В некоторых вариантах осуществления и как описано в настоящем документе можно использовать различные клинические факторы, в том числе не связанные с апоптозом или связь которых с апоптозом не установлена, для улучшения предсказательной способности анализа профиля BH3 и перевода теста с уровня прогностического теста до уровня предиктивного теста.
В некоторых вариантах осуществления описанные в настоящем документе способы предоставляют диагностический тест, предсказывающий ответ пациента с лейкозом на соединение, ингибирующее CDK-9. В некоторых аспектах ингибитор CDK-9 представляет собой флавопиридол (альвоцидиб). В дополнительных аспектах ингибитор CDK-9 можно применять совместно с одним или несколькими дополнительными соединениями в рамках схемы лечения. Например, схема лечения может включать применение альвоцидиба в комбинации с ara-C и митоксантроном (FLAM). Можно также учитывать дополнительные данные для повышения чувствительности анализа. Например, цитогенетический профиль пациента или его состояние, и/или возраст можно учитывать в прогнозирующем алгоритме. В некоторых вариантах осуществления диагностический тест включает в себя измерение функционирования MCL1, включая измерение изменения потенциала митохондриальной мембраны в ответ на BH3 пептид Noxa или селективные к MCL1/Bfl-1 миметики BH3, такие как EU5346 (соединение 9 в D. Richard et al. Molecular Cancer Therapeutics, 2013).
В другом аспекте изобретение относится к способу определения способа лечения рака для пациента, при этом способ содержит контактирование пермеабилизированных раковых клеток пациента с одним или несколькими пептидами, содержащими домен BH3, для определения интенсивности ответа клеток; определение наличия или отсутствия одного или нескольких клинических факторов у раковых клеток пациента с помощью иммуногистохимии и/или флуоресцентной гибридизации in situ (FISH); и классификацию пациента на основе вероятности клинического ответа на один или несколько способов лечения рака.
В другом аспекте изобретение относится к способу прогнозирования ответа пациента с ОМЛ на лечение альвоцидибом или по схеме FLAM, при этом способ содержит: определение профиля BH3 в образце раковых клеток ОМЛ пациента, полученном из костного мозга; определение одного или нескольких клинических факторов у пациента, при этом один или более клинических факторов выбирают из возраста и/или цитогенетического статуса; и классификацию пациента на основе вероятности клинического ответа на один или несколько способов лечения рака.
В другом аспекте изобретение относится к способу прогнозирования ответа пациента с ОМЛ на лечение альвоцидибом или по схеме FLAM, или на лечение на основе только цитарабина, при этом способ содержит: определение профиля BH3 в образце раковых клеток ОМЛ пациента, полученном из костного мозга; определение одного или нескольких клинических факторов у пациента, при этом один или более клинических факторов выбирают из возраста и/или цитогенетического статуса; и классификацию пациента на основе вероятности клинического ответа на один или несколько способов лечения рака. Затем показания этого анализа сравнивают с показаниями анализа профиля BH3 в образцах периферической крови. В частности, продемонстрировано, что показания анализа профиля BH3 при обработке BH3 пептидом Bim в количестве 0,1 пмоль имеют предиктивное значение для лечения на основе ara-C без назначения альвоцидиба.
В другом аспекте настоящее изобретение относится к способу прогнозирования ответа пациента с ОМЛ на терапию антогонистами ИЛ-6 (интерлейкин-6), или селективным к MCL1 миметиком BH3, при этом способ содержит: определение профиля BH3 в образце раковых клеток ОМЛ пациента, полученном из костного мозга; определение одного или нескольких клинических факторов пациента, при этом один или более клинических факторов выбирают из возраста и/или цитогенетического статуса; и классификацию пациента на основе вероятности клинического ответа на один или несколько способов лечения рака. Затем показания этого анализа сравнивают с показаниями анализа профиля BH3 в образцах периферической крови.
Подробности вариантов осуществления изобретения изложены далее в прилагаемом описании. Хотя в настоящем документе далее описаны иллюстративные способы и материалы, при этом в практическом осуществлении или для испытания настоящего изобретения можно использовать способы и материалы, аналогичные или эквивалентные описанным здесь. Остальные признаки, объекты и преимущества изобретения станут понятны из описания и формулы изобретения. В описании и прилагаемой формуле изобретения употребление форм единственного числа также охватывает множественное число, если из контекста явно не следует иное. Если не указано иное, то все технические и научные термины, используемые здесь, имеют то же значение, которое обычно понимается специалистом в области техники, к которой относится настоящее изобретение.
Кроме того, окружение раковой клетки in vivo влияет на степень, в которой белок MCL1 участвует в возникновении и поддержании рака, и на эффективность таргетных терапий, направленных на MCL1. В частности, выживание тех клеток миелоидного лейкоза и клеток миеломы, которые находятся в строме костного мозга, в большей степени зависит от MCL1, чем тех, которые циркулируют в периферической крови. Кроме того, было установлено, что BH3 пептид BIM в образцах периферической крови коррелирует с ответом пациента с ОМЛ на ara-c с антрациклином по схеме 7+3. Однако ни это показание, ни какие-либо другие показания анализа профиля BH3 в лейкозных клетках из периферической крови не предсказывают ответ пациента с ОМЛ на схему FLAM или другие способы лечения ингибиторами MCL1.
Известно, что анализ профиля BH3 сам по себе дает общее представление о чувствительности или восприимчивости к химиотерапии. В этом случае нахождение параметров, специфически коррелирующих с процессами в которых участвует белок MCL1, обеспечивает уникально чувствительный метод прогнозирования ответа пациента на лечение, воздействующее на MCL1. Однако для некоторых способов лечения, направленно действующих на MCL1, это справедливо только в том случае, когда раковые клетки выделены из стромы костного мозга.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фиг. 1А-E показаны характерные данные профиля BH3 в образцах костного мозга, полученных у пациентов, прошедших лечение по схеме FLAM. На рисунке показаны различия в ответе бластных клеток с высоким и низким апаптотическим порогом, полученных у пациентов с ОМЛ. Наиболее оптимальный порог уровня сигнала, определенный с помощью ROC-анализа, в случае обработки NOXA образцов костного мозга составил около 10,7%. На панелях A-C показаны примеры из всех групп цитогенетического риска (Fav-благоприятный, adv-неблагоприятный и int-промежуточный), показавшие более сильный ответ на обработку NOXA и достигнувшие полной ремиссии. На панелях D-E показаны примеры из промежуточной и неблагоприятной групп риска с низким ответом на обработку NOXA, для которых терапия оказалась неэффективной.
На фиг. 2A-F показана корреляция ответа на обработку BH3 пептидами с ответом на лечение для всех образцов пациентов, проходящих лечение по схеме FLAM, оцененная с помощью анализа кривой зависимости чувствительности от частоты ложно положительных заключений (ROC). На панелях A, C и E показан анализ кривых зависимости чувствительности от частоты ложно положительных заключений (ROC) для BAD, BIM 100 и PUMA в сочетании с клиническими переменными, а именно группой цитогенетического риска и наличием в анамнезе МДС. На панелях B, D и F показаны соответствующие точечные диаграммы, где каждая точка иллюстрирует значение комбинированной метрики для каждого пациента, сравнивающие пациентов, достигших полной ремиссии, и пациентов, не достигших полной ремиссии.
На фиг. 3A-C показана корреляция ответа на обработку BH3 пептидами с ответом на лечение для всех образцов пациентов, проходящих лечение по схеме FLAM, оцененная с помощью анализа точечных диаграмм. Ответ на обработку NOXA сам по себе демонстрирует прогностическую ценность в случае образцов костного мозга. На панелях A-C показаны точечные графики, иллюстрирующие ответ на обработку NOXA, измеренный во всех образцах (A), в образцах из костного мозга (B) и в образцах из периферической крови (C). В образцах, полученных из костного мозга, показана значимая корреляция с достижением полной ремиссии, такая корреляция не наблюдается в образцах, полученных из периферической крови.
На фиг. 4A-D показана корреляция ответа на обработку BH3 пептидом NOXA с ответом на лечение для всех образцов, выделенных из костного мозга пациентов, проходящих лечение по схеме FLAM, оцененная с помощью анализа кривой зависимости чувствительности от частоты ложно положительных заключений (ROC). На панелях A и B показан анализ кривых зависимости чувствительности от частоты ложно положительных заключений (ROC) для ответа на обработку пептидом NOXA в сочетании с группой цитогенетического риска и наличием в анамнезе МДС, учитывающий все образцы. На панелях C и D показан такой же анализ, но учитывающий только образцы, полученный из костного мозга, без включения образцов из периферической крови. Добавление учета группы цитогенетического риска и наличия в анамнезе МДС улучшает предсказательную силу теста, повышая значение площади под кривой (AUC) до 0,92 в случае ответа на обработку NOXA в образцах костного мозга с учетом группы цитогенетического риска и наличия в анамнезе МДС.
На фиг. 5А-В показаны примеры анализа профиля BIM 0,1 и NOXA.
На фиг.6 показан способ формулирования алгоритма выбора способа лечения рака для пациентов с ОМЛ, еще не получавших лечения. За счет сравнения относительных профилей BIM 0,1 и NOXA пациенту можно назначить лечение по схеме FLAM, лечение по схеме 7+3, или определить его как невосприимчивого к любой из этих схем лечения.
На фиг. 7А-В представлены данные, показывающие, что альвоцидиб подавляет онкогенную мРНК в клетках MV-4-11, при этом эффект является дозазависимым и времязависимым.
На фиг. 8 представлены данные, показывающие, что альвоцидиб подавляет онкогенную мРНК в клетках A549, при этом эффект является дозазависимым и времязависимым.
На фиг. 9А-В представлены изображения гель-электрофореграмм, показывающие, что альвоцидиб подавляет экспрессию MCL-1 времязависимым образом, при этом обработка может проходить со стадией промывки (фиг. 9А) или без стадии промывки (фиг. 9В).
На фиг. 10A-B представлены дополнительные изображения гель-электрофореграмм, показывающие, что альвоцидиб подавляет экспрессию ключевых онкогенных белков в клетах MV-4-11, при этом эффект является дозазависимым и времязависимым.
На фиг. 11 показано, что альвоцидиб подавляет экспрессию N-Myc времязависимым образом в клетках SK-N-AS (солидная опухоль, нейробластома).
На фиг. 12 показано, что альвоцидиб подавляет экспрессию онкогенных белков времязависимым образом в клетках A549 при использовании схемы с повторным дозированием.
На фиг. 13A-B показано, что альвоцидиб подавляет экспрессию онкогенных белков времязависимым образом в клетках Panc-1, при этом обработка может проходить со стадией промывки (фиг. 13А) или без стадии промывки (фиг. 13В).
На фиг. 14 показано, что альвоцидиб подавляет экспрессию онкогенных белков времязависимым образом в клетках Panc-1 при использовании схемы с повторным дозированием.
На фиг. 15A-B оказано, что альвоцидиб подавляет экспрессию онкогенных белков времязависимым образом в клетках Yugen8, при этом обработка может проходить со стадией промывки (фиг. 15А) или без стадии промывки (фиг. 15B).
На фиг. 16 показано, что альвоцидиб подавляет экспрессию онкогенных белков времязависимым образом в клетках Yugen8 при использовании схемы с повторным дозированием.
На фиг.17A-B показано, что альвоцидиб подавляет MCL-1 при использовании в комбинации ACM (или FLAM). Кроме того, предоставлена схема лечения (фиг. 17А), а также результаты иммуноблоттинга (фиг. 17В).
В таблице 1 приведена общая информация о клиническом исследовании FLAM на пациентах. В таблице предоставлено краткое резюме данных о пациентах, включая отношение числа положительных с точки зрения каждой из вышеупомянутых метрик пациентов к общему числу пациентов для которых получено значение данной метрики.
В таблице 2 показан сводный анализ пациентов, проходивших лечение по схеме FLAM. В таблице перечислены все полученные образцы. Пациенты были зарегистрированы по трем различным протоколам (J0669, J0856 и J01101) и в основном представляли собой пациентов с впервые диагностированным ОМЛ. Образцы получали либо из периферийной крови, либо из аспиратов костного мозга. Возраст рассчитывали на момент постановки диагноза. Группу цитогенетического риска определяли, следуя рекомендациям CALGB. Для исследования получали данные о цитогенетическом статусе, мутационном статусе FLT-3 и NPM1, наличии в анамнезе МДС, истории химиотерапии, проценте бластных клеток в костном мозге, количестве лейкоцитов (WBC), способах лечения и ответе на лечение. У образцов, окрашенных в серый цвет, не удалось успешно получить результаты обработки BH3 пептидами, поэтому эти образцы были исключены из всех последующих анализов (MRD-минимальное остаточное заболевание, TF-неэффективность терапии, PR-частичный ответ, CR-полная ремиссия).
В таблице 3 показаны корреляции клинических характеристик с ответом на схему лечения FLAM. Статистический анализ проводили для оценки значимости корреляции клинических переменных с ответом на лечение. Значимость корреляции каждой из указанных метрик оценивали с помощью критерия Манна-Уитни и логистического регрессионного анализа. AUC (площадь под кривой) получали из анализа ROC-кривой.
В таблице 4 показаны данные о профилях BH3, полученные в ходе клинического исследования FLAM на пациентах. Получение профилей BH3 проводили для всех образцов пациентов, перечисленных в таблице 2. Строки, окрашенные в серый цвет, относятся к образцам, которые во время обработки оказались не соответствующими критериям принятия профиля BH3. Ячейка содержит тире (-) в том случае, если образец не содержал достаточного количества клеток для проведения соответствующего анализа воздействия BH3 пептидами. Отношение сигнал/шум оценивали из отношения средней интенсивности флуоресценции (MFI) в красной области спектра JC-1 в DMSO и MFI JC-1 c добавлением CCCP. Количество клеток и процент живых клеток определяли ручным подсчетом клеток с окрашиванием трипановым синим. Процент бластных клеток представляет собой процент пермеабилизированных жизнеспособных клеток с фенотипом CD45-dim, CD3/CD20 отрицательный и SSC-low. Все профили BH3 оценивали у таких отобранных бластных клеток.
В таблице 5 показаны корреляции профилей отдельных BH3 пептидов с достижением полной ремиссии. Статистический анализ проводили для оценки значимости корреляции профиля BH3 пептидов с ответом на лечение, при этом образцы пациентов с полной ремиссией сравнивали сразу со всеми образцами пациентов с частичным ответом, пациентов с минимальным остаточным заболеванием и пациентов для которых терапия оказалась неэффективной (NR-пациент без ответа на терапию). Значимость корреляции каждой из указанных метрик оценивали с помощью критерия Манна-Уитни и логистического регрессионного анализа. AUC (площадь под кривой) получали из анализа ROC-кривой.
В таблице 6 показан результат многофакторного анализа корреляций профилей BH3 пептидов с другими клиническими переменными в клиническом исследовании FLAM. Статистический анализ проводили для оценки значимости корреляции профиля BH3 пептидов с ответом на лечение, при этом сравнивали образцы CR с образцами NR. К комбинациям переменных применяли логистическую регрессию, находя таким образом коэффициенты и константы модели логистической регрессии, и затем эти коэффициенты и константы тестировали с помощью критерия Манна-Уитни и анализа ROC-кривой.
В таблице 7 показаны корреляции профилей отдельных BH3 пептидов в образцах костного мозга с достижением полной ремиссии. Статистический анализ профилей BH3 пептидов проводили способом, аналогичным приведенному в описании таблицы 5, но использовали только образцы, полученные из костного мозга. Значимость корреляции каждой из указанных метрик оценивали с помощью критерия Манна-Уитни и логистического регрессионного анализа. AUC (площадь под кривой) получали из анализа ROC-кривой. Этот анализ показал, что ответ на обработку NOXA значимо выше у пациентов, которые показали ответ на лечение, по сравнению с пациентами, не ответившими на лечение.
В таблице 8 показан результат статистического анализа профилей BH3 пептидов в образцах, полученных из костного мозга. Статистический анализ профилей BH3 пептидов проводили способом, аналогичным приведенному в описании таблицы 6, но использовали только образцы, полученные из костного мозга. К комбинациям переменных применяли логистическую регрессию, находя таким образом коэффициенты и константы модели логистической регрессии, и затем эти коэффициенты и константы тестировали с помощью критерия Манна-Уитни и анализа ROC-кривой. Этот анализ показал, что комбинация ответов образцов костного мозга на BAD, BIM 100 и PUMA также коррелирует с ответом на лечение. Как ответ на NOXA, так и ответ на указанные три пептида можно объединить с группой цитогенетического риска и наличием в анамнезе МДС, таким образом получая более высокую значимость корреляции и значение площади под кривой (AUC).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее описание основано, в частности, на обнаружении того, что анализ профиля BH3 может представлять медицинскую полезность для прогнозирования ответа на ингибиторы CDK, такие как ингибитор CDK-9 (например, альвоцидиб), применяемые в виде монотерапии или в виде комбинированной терапии, в случае измерения такого профиля в раковых клетках, полученных исключительно из аспирата костного мозга пациента. Чувствительность и/или специфичность такого анализа профиля BH3 значительно выше, чем у анализа образцов крови, полученных из периферической крови, или анализа комбинации образцов периферической крови и образцов костного мозга. Показано, что происходит резкое увеличение значимости корреляции сигнала от обработки Noxa, характеризуемое изменением p-значения с 0,445 до 0,0007, при анализе образцов, полученных исключительно из костного мозга, по сравнению с анализом образцов периферической крови, полученных у того же пациента. (Таблицы 6 и 7). В случае учета в анализе клинических переменных, а именно цитогенетического статуса и возраста, чувствительность анализа возрастает с 0,805 (AUC) до 0,91 (AUC).
Приведенные здесь способы диагностики предоставляют новый способ прогнозирования ответа на лечение, направленное на нарушение функционирования MCL1.
В одном аспекте настоящее изобретение относится к способу подбора способа лечения рака для пациента, при этом способ содержит определение степени зависимости опухоли пациента или образца раковых клеток, выделенных исключительно из костного мозга, от MCL1; определение одного или нескольких клинических факторов у пациента и классификацию пациента на основе вероятности клинического ответа на один или несколько способов лечения рака; при этом один или несколько клинических факторов выбирают для увеличения специфичности и/или чувствительности способа прогнозирования клинического ответа на основании анализа профиля специфичных к MCL1 BH3 пептидов.
В другом аспекте настоящее изобретение относится к способу подбора способа лечения рака для пациента, при этом способ содержит контактирование пермеабилизированных раковых клеток пациента с содержащими домен BH3 пептидом Noxa для определения интенсивности ответа клеток; определение наличия или отсутствия одного или нескольких клинических факторов у раковых клеток пациента с помощью иммуногистохимии и/или флуоресцентной гибридизации in situ (FISH); и классификацию пациента на основе вероятности клинического ответа на один или несколько способов лечения рака.
В другом аспекте настоящее изобретение относится к способу прогнозирования ответа пациента с ОМЛ на цитарабин и/или FLAM, при этом способ содержит: определение профилей BH3 в образах раковых клеток ОМЛ пациента, взятых из костного мозга и из периферической крови; сравнение профилей, полученных при анализе образцов из этих двух источников раковых клеток, и использование этой информации для выбора между лечением по схеме FLAM, и лечением, основанным на цитарабине.
В различных вариантах осуществления клинический фактор представляет собой один или более фактор, выбранный из возраста, цитогенетического статуса, состояния пациента, гистологического подкласса, пола и стадии заболевания. В другом варианте осуществления способ дополнительно содержит измерение дополнительного биомаркера, выбранного из мутационного статуса, однонуклеотидных полиморфизмов, стационарных уровней белков и динамических уровней белков, что может увеличить специфичность и/или чувствительность теста. В другом варианте осуществления способ дополнительно содержит прогнозирование клинического ответа пациента. В другом варианте осуществления клинический ответ представляет собой по меньшей мере примерно 1, примерно 2, примерно 3 или примерно 5 лет выживаемости без прогрессирования заболевания/бессобытийной выживаемости.
В некоторых вариантах осуществления ответ клеток определяют с помощью следующего уравнения: в котором AUC обозначает либо площадь под кривой, либо интенсивность сигнала; DMSO относится к характеризующему базовое значение отрицательному контролю; и CCCP (карбонил цианид м-хлорфенил гидразон) относится к положительному контролю, так как CCCP нарушает синтез белка, выступая в качестве разобщающего агента, нарушающего протонный градиент, возникающий при нормальном функционировании переносчиков электронов в электронно-транспортной цепи в митохондрии. В некоторых вариантах осуществления область под кривой определяют из измерений гомогенной флуоресценции с временным разрешением (HTRF). В некоторых вариантах осуществления время наблюдения попадает в промежутки, варьирующие от промежутка от примерно 0 до примерно 300 мин до промежутка от примерно 0 до примерно 30 мин. В некоторых вариантах осуществления область под кривой определяют с помощью сортировки клеток с активированной флуоресценцией (FACS). В некоторых вариантах осуществления интенсивность сигнала представляет собой результат измерения в одной временной точке, попадающей в интервал от примерно 5 мин до примерно 300 мин.

Примеры клинических решений
В некоторых вариантах осуществления описанные здесь способы применимы для оценки пациента, например, для определения диагноза, прогноза и ответа на лечение. В различных аспектах настоящее изобретение относится к оценке опухоли или гематологического рака. В различных вариантах осуществления оценка может представлять собой постановку диагноза, прогноз или предсказание ответа на лечение.
Постановка диагноза относится к процессу попытки определения или идентификации возможного заболевания или расстройства, такого как, например, рак. Прогноз относится к прогнозированию вероятного исхода заболевания или расстройства, такого как, например, рак. Полный прогноз обычно включает ожидаемую продолжительность, проявления и описание течения заболевания, например прогрессирующий спад, перемежающийся кризис или внезапный непредсказуемый кризис. Ответ на лечение относиться к предсказанию медицинского результата у пациента, получающего лечение. Неограничивающие примеры ответов на лечение включают полный патологический ответ, выживаемость и выживаемость без прогрессирования заболевания, время до прогрессирования заболевания, вероятность рецидива.
В различных вариантах осуществления настоящие способы помогают принять клиническое решение о том, стоит ли пациенту получать конкретное лечение. В одном варианте осуществления настоящие способы позволяют прогнозировать положительный ответ на неоадъювантную и/или адъювантную химиотерапию или отсутствие ответа на неоадъювантную и/или адъювантную химиотерапию. В одном варианте осуществления настоящие способы позволяют прогнозировать положительный ответ на проапоптотическое средство или средство, оказывающее действие через апоптоз, и/или средство, оказывающее действие не через апоптоз, или отсутсвие ответа на средство, оказывающее действие через апоптоз, и/или средство, оказывающее действие не через апоптоз. В различных вариантах осуществления настоящее изобретение позволяет регулировать схему лечения больного раком, включая, например, выбор типа лечения, которое следует назначить или отменить.
В одном варианте осуществления настоящие способы помогают принять клиническое решение о том, стоит ли пациенту получать адъювантную терапию после первичного, основного или начального лечения, включая, в качестве неограничивающего примера, назначение одного курса адъювантной монотерапии. Адъювантная терапия, также называемая вспомогательной терапией, представляет собой лечение, назначаемое в дополнение к первичному, основному или начальному лечению. В качестве неограничивающего примера адъювантная терапия может представлять собой дополнительное лечение, обычно назначаемое после операции, в ходе которой были удалены все обнаруживаемые очаги заболевания, но при этом остался статистический риск рецидива из-за не выявленных очагов заболевания.
В некоторых вариантах осуществления настоящие способы помогают принять решение о необходимости включения адъювантной терапии в схему лечения пациента. Например, пациенту, который оценивается как восприимчивый к конкретному лечению, может быть назначено такое лечение в виде адъювантной терапии. Кроме того, настоящие способы могут помочь выбрать тип адъювантной терапии, включая, в качестве неограничивающих примеров, терапию, которая индуцирует и/или оказывает проапоптотическое действие, или терапию, не оказывающую такого действия. В одном варианте осуществления настоящие способы могут показать, что пациент не будет восприимчивым или будет недостаточно восприимчивым к конкретному лечению и поэтому такому пациент не следует назначать такое лечение в качестве адъювантной терапии. Соответственно, в некоторых вариантах осуществления настоящие способы позволяют принять решение о назначении или отмене адъювантной терапии в зависимости от вероятного ответа пациента. Таким образом, можно улучшить качество жизни пациента и снизить стоимость лечения.
В некоторых вариантах осуществления настоящие способы помогают принять клиническое решение о том, стоит ли пациенту получать конкретный тип лечения. Соответственно, в некоторых вариантах осуществления настоящие способы представляют собой тест для принятия решений о схеме лечения пациента.
В некоторых вариантах осуществления настоящие способы предоставляют информацию о вероятном ответе пациента на конкретное лечение. В некоторых вариантах осуществления настоящие способы показывают высокую вероятность ответа на лечение и могут направлять лечение, включая агрессивное лечение. В некоторых вариантах осуществления настоящие способы показывают низкую вероятность ответа на лечение и могут способствовать принятию решения о прекращении лечения, в том числе агрессивного лечения, и о назначении паллиативной терапии, чтобы избежать токсичного эффекта от неэффективной химиотерапии для улучшения качества жизни пациента.
В иллюстративном варианте осуществления настоящий способ показывает вероятность ответа на конкретное лечение. Например, в некоторых вариантах осуществления настоящие способы показывают высокую или низкую вероятность ответа на проапоптотическое средство и/или средство, оказывающее действие через апоптоз, и/или средство, оказывающее действие через апоптоз посредством непосредственного воздействия на белок. В различных вариантах осуществления проапоптотические средства и/или средства, оказывающие действие через апоптоз, и/или средства, оказывающие действие через апоптоз посредством непосредственного воздействия на белок, в качестве примеров включают ABT-263 (Навитоклакс), обатоклакс, WEP, бортезомиб и карфилзомиб. В некоторых вариантах осуществления настоящие способы показывают высокую или низкую вероятность ответа на средство, не оказывающее действие через апоптоз, и/или средство, не оказывающее действие через апоптоз посредством непосредственного воздействия на белок. В различных вариантах осуществления примеры средств, не оказывающих действие через апоптоз, включают ингибиторы белка веретена деления кинезина, ингибиторы циклинзависимой киназы, триоксид мышьяка (TRISENOX), ингибиторы МЕК, помалидомид, азацитидин, децитабин, вориностат, энтиностат, динацилиб, гемтузумаб, ингибиторы BTK, ингибиторы дельта субъединицы фосфатидилинозитол-3-киназы, леналидомид, антрациклины, цитарабин, мелфалан, ингибиторы Akt, ингибиторы mTOR.
В иллюстративном варианте осуществления настоящий способ показывает следует ли пациенту для лечения рака получать проапоптотическое средство или средство, оказывающее действие через апоптоз. В другом иллюстративном варианте осуществления настоящий способ показывает следует ли пациенту для лечения рака получать средство, не оказывающее действие через апоптоз.
В конкретном варианте осуществления настоящие способы применимы для прогнозирования реакции пациента с раком на любое из описанных в настоящем документе лечений (включая средства). В иллюстративном варианте осуществления настоящее изобретение позволяет предсказывать вероятность ответа пациента с ОМЛ на цитрабин и азацитидин и включает оценку профиля BH3, возрастного профиля и цитогенетических факторов у пациента.
В различных вариантах осуществления лечение рака назначают или отменяют на основании описанных здесь способов. Примеры лечения включают хирургическую резекцию, лучевую терапию (включая использование описанных здесь соединений в качестве или в сочетании с радиосенсибилизирующими средствами), химиотерапию, фармакодинамическую терапию, таргетную терапию, иммунотерапию и вспомогательную терапию (например, обезболивающие, диуретики, антидиуретики, антивирусные препараты, антибиотики, пищевые добавки, препараты против анемии, препараты для свертывания крови, препараты для лечения костей, психиатрическую и психологическую помощь).
В различных других вариантах осуществления изобретение относится к способу лечения рака у нуждающегося в этом пациента, при этом способ содержит:
a) запрос данных профиля BH3 в образце раковых клеток, полученном из костного мозга пациента; и
b) назначение пациенту схемы лечения, включающей прием альвоцидиба, если ответ на обработку NOXA в образце раковых клеток составил по меньшей мере 15%.
В некоторых вариантах осуществления вышеизложенного схему лечения назначают пациенту только в том случае, если ответ на обработку NOXA в образце раковых клеток составил по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35% или по меньшей мере 40%.
В других вариантах осуществления уровень экспрессии MCL-1 в образце раковых клеток также используют для определения того, подходит ли пациенту схема лечения, включающая прием альвоцидиба, при этом способ дополнительно содержит запрос данных об уровне экспрессии MCL-1, измеренном в образцах раковых клеток, и назначение схемы лечения пациенту, только если уровень экспрессии MCL-1 в образце раковых клеток превышает по меньшей мере в 1,1 раз уровень экспрессии MCL-1 в нормальных клетках. В других вариантах осуществления схему лечения назначают пациенту только в том случае, если уровень экспрессии MCL-1 в образце раковых клеток превышает по меньшей мере в 1,5 раза, в 2 раза, в 3 раза, в 4 раза, в 5 раз или даже в 10 раз уровень экспрессии MCL-1 в нормальных клетках.
В других вариантах осуществления схему лечения назначают пациенту только в том случае, если у пациента высокий цитогенетический фактор риска.
В других вариантах осуществления вышеизложенного схему лечения назначают пациенту только в том случае, если у пациента в предыдущем анамнезе имеется миелодиспластический синдром (МДС).
В других вариантах вышеизложенного данные о профиле BH3 получают с помощью способа, содержащего пермеабилизацию образца раковых клеток, определение изменения потенциала на митохондриальной мембране при контакте пермеабилизированной клетки с одним или несколькими пептидами, содержащими домен BH3; и соотнесение уменьшения потенциала на митохондриальной мембране с хемочувствительностью клетки к апоптоз-индуцирующим химиотерапевтическим средствам.
В других иллюстративных вариантах осуществления пептид, содержащий домен BH3, представляет собой BIM, BIM2A, BAD, BID, HRK, PUMA, NOXA, BMF, BIK, или PUMA2A, или их комбинации. Например, в некоторых вариантах осуществления пептид, содержащий домен BH3, используют в концентрации от 0,1 мкМ до 200 мкМ.
В других вариантах осуществления уровень экспрессии MCL-1 используют в качестве основного показателя для определения, подходит ли пациенту для лечения схема, включающая прием альвоцидиба. Например, в некоторых вариантах осуществления изобретение относится к способу лечения рака у нуждающегося в этом пациента, при этом способ содержит:
a) запрос данных об экспрессии MCL-1 в образце раковых клеток, полученном из костного мозга пациента; и
b) назначение пациенту схемы лечения, включающей прием альвоцидиба, если уровень экспрессии MCL-1 в образце раковых клеток превышает по меньшей мере в 1,1 раз уровень экспрессии MCL-1 в нормальных клетках. В некоторых вариантах осуществления раковая клетка является опухолевой клеткой.
В других вариантах осуществления вышеизложенного схему лечения назначают пациенту только в том случае, если уровень экспрессии MCL-1 в образце раковых клеток превышает по меньшей мере в 1,5 раза, в 2 раза, в 3 раза, в 4 раза, в 5 раз или даже в 10 раз уровень экспрессии MCL-1 в нормальных клетках.
В других вариантах осуществления вместе с уровнем экспрессии MCL-1 учитывается ответ на обработку NOXA, такой способ дополнительно содержит запрос данных о профиле BH3 в образце раковых клеток и назначение схемы лечения только в том случае, если ответ на обработку NOXA в образце опухолевых или раковых клеток составляет по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, или по меньшей мере 40%.
В других вариантах осуществления схему лечения назначают пациенту только в том случае, если у пациента высокий цитогенетический фактор риска. В других вариантах осуществления схему лечения назначают пациенту только в том случае, если у пациента в предыдущем анамнезе имеется миелодиспластический синдром (МДС).
В любом из вышеперечисленных способов лечения рак представляет собой гематологический рак. Например, в некоторых вариантах осуществления гематологический рак может представлять собой острый миелоидный лейкоз (ОМЛ), множественную миелому, фолликулярную лимфому, острый лимфобластный лейкоз (ОЛЛ), хронический лимфоцитарный лейкоз или неходжкинскую лимфому. В некоторых конкретных вариантах осуществления гематологический рак представляет собой острый миелоидный лейкоз (ОМЛ).
В некоторых других вариантах осуществления вышеизложенного гематологический рак представляет собой миелодиспластический синдром (МДС). В других вариантах осуществления вышеизложенного гематологический рак представляет собой хронический лимфоцитарный лейкоз (ХЛЛ).
В других или любых из вышеперечисленных вариантов осуществления схема лечения, включающая прием альвоцидиба, может включать прием альвоцидиба, цитарабина и митоксантрона (FLAM).
В некоторых других вариантах осуществления вышеизложенного образец раковых клеток получают с помощью биопсии не солидной опухоли. Например, в некоторых вариантах осуществления образец раковых клеток получают с помощью взятия биопсии у пациента с множественной миеломой, острым лимфоцитарным лейкозом, хроническим миелоидным лейкозом, мантийноклеточной лимфомой, диффузной В-крупноклеточной лимфомой или неходжкинской лимфомой.
В некоторых других вариантах осуществления образец раковых клеток представляет собой клетки множественной миеломы, обогащенные путем отбора из биопсийного образца с помощью антител к CD138, прикрепленных к твердой матрице или шарикам. Например, в некоторых вариантах осуществления образец раковых клеток представляет собой клетки острого миелоидного лейкоза, обогащенные за счет связывания с антителами к CD45. В других вариантах осуществления образец раковых клеток представляет собой клетки хронического миелоидного лейкоза или диффузной В-крупноклеточной лимфомы, обогащенные с помощью деплеции не В-клеток.
В некоторых других вариантах осуществления изобретение относится к способу определения вероятности ответа пациента на схему лечения, включающую прием альвоцидиба, при этом способ содержит:
контактирование образца пермеабилизированных раковых клеток из костного мозга пациента с одним или несколькими пептидами, содержащими BH3 домен;
измерение ответа клеток на обработку NOXA в образце; и
классификацию пациента как вероятно восприимчивого к схеме лечения, если ответ на обработку NOXA в образце составляет не менее 15%.
Сочетание «вероятно восприимчивый» обозначает пациента, имеющего более чем 50% вероятность положительно ответить на лечение (например, частичная или полная ремиссия).
В других вариантах осуществления изобретение обеспечивает способ определения вероятности ответа пациента на схему лечения, включающую прием альвоцидиба, при этом способ содержит:
определение уровня экспрессии MCL-1 в образце раковых клеток из костного мозга пациента; и
классификацию пациента как вероятно восприимчивого к схеме лечения, если уровень экспрессии MCL-1 в образце раковых клеток превышает по меньшей мере в 1,1 раз уровень экспрессии MCL-1 в нормальных клетках.
В других вариантах осуществления вышеизложенного способ дополнительно содержит назначение схемы лечения пациенту, классифицированному как вероятно восприимчивый пациент.
В некоторых других вариантах осуществления изобретение относится к способу выбора между стратегиями лечения рака для пациента с ОМЛ, прошедшего подготовку к лечению, при этом способ содержит
(a) запрос результатов теста, измеряющего ответ на обработку NOXA в образце костного мозга (BM) пациента;
(b) запрос результатов теста, измеряющего ответ на обработку BIM 0,1 в образце периферической крови (PB) пациента;
(c) сравнение ответа на обработку NOXA и ответа на обработку BIM 0,1; и
(i) назначение пациенту схемы лечения, включающей прием альвоцидиба (например, FLAM), если BM NOXA > 10,8% и BM/PB BIM 0,1<35%;
(ii) назначение пациенту схемы лечения 7+3, если BM NOXA < 10,8% и BM/PB BIM 0,1 > 15%;
(iii) назначение пациенту схемы лечения 7+3, если BM NOXA < 10,8% и BM/PB BIM 0,1 > 35%; или
(iv) назначение другого лечения пациенту, если BM NOXA < 10,8% и BM/PB BIM 0,1<15%.
Примеры лечения
В иллюстративном варианте осуществления изобретение помогает выбрать лечебное средство. Неограничивающие примеры таких средств включают один или несколько противоопухолевых препаратов, химиотерапию, хирургию, адъювантную терапию и неоадъювантную терапию. В одном варианте осуществления лечение рака представляет собой прием одного или нескольких миметиков BH3, средств влияющих на эпигенетические модификации, ингибиторов топоизомеразы, ингибиторов циклинзависимой киназы и средств, связывающих белок веретена деления кинезин. В другом варианте осуществления лечение рака представляет собой ингибитор протеасом; и/или средство, воздействующее на регуляцию клеточного цикла (неограничивающий пример включает ингибитор циклинзависимой киназы); и/или средство, влияющее на эпигенетические механизмы в клетке (неограничивающие примеры включают одно или несколько средств, таких как гистондезацетилаза (HDAC) (например, одно или несколько средств, включающих вориностат или энтиностат), азацитидин, децитабин); и/или антрациклин или антрацендион (неограничивающие примеры включают одно или несколько средств, таких как эпирубицин, доксорубицин, митоксантрон, даунорубицин, идарубицин); и/или терапевтические средства на основе платины (неограничивающие примеры включают одно или несколько средств, таких как карбоплатин, цисплатин и оксалиплатин); цитарабин или химиотерапию на основе цитарабина; миметик BH3 (неограничивающие примеры включают один или несколько средств, таких как BCL2, BCLXL или MCL1); и ингибитор MCL1.
В различных вариантах осуществления изобретение относится к способам лечения рака, включая, без ограничения, описанные в патентной публикации США № 2012-0225851 и в международной патентной публикации № WO 2012/122370, содержание которых включено в настоящее описание посредством ссылки во всей их полноте.
В различных вариантах осуществления изобретение относится к лечению рака, включая, без ограничения, прием одного или нескольких средств, таких как алкилирующие средства, такие как тиотепа и циклофосфамид CYTOXAN; алкилсульфонаты, такие как бусульфан, имсульфан и пиросульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетогенины (например, буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; CC-1065 (включая синтетические аналоги, такие как адозелезин, карцелезин и бизелезин); криптофицины (например, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, такие как KW-2189 и CB 1-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид мехлорэтамин оксида, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как ендииновые антибиотики (например, калихеамицин, особенно калихеамицин гамма II и калихеамицин омега II (см., например, Agnew, Chem. Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин А; бисфосфонаты, такие как клодронат; эсперамицин; а также хромофор неокарциностатина и родственные хромофоры хромопротеинов ендииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин ADRIAMYCIN (включая морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; средства, подавляющие функции надпочечников, такие как аминоглютетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фолиновая кислота; ацеглатон; альдофосфамид гликозид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; демеколцин; диазиквон; элформитин; ацетат эллиптиния; эпотилон; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; мейтанзиноиды, такие как мейтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK (JHS Natural Products, Eugene, Oreg.); разоксан; ризоксин; сизофуран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2''-трихлортриэтиламин; трихотецины (в частности, токсин T-2, верракурин A, роридин A и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); циклофосфамид; тиотепа; таксаны, например паклитаксел TAXOL (Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANE, не содержащий Cremophor препарат паклитаксела на основе сконструированных связанных с альбумином наночастиц (American Pharmaceutical Partners, Schaumberg, 111.), и доксетаксел TAXOTERE (Rhone-Poulenc Rorer, Antony, France); хлорамбуцил; гемцитабин GEMZAR; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин, оксалиплатин и карбоплатин; винбластин; платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; винорелбин NAVELBINE; новантрон; тенипозид, эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; иринотекан (Camptosar, CPT-11) (включая комбинированную схему лечения иринотеканом с 5-FU и лейковорином); ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин; комбретастатин; лейковорин (LV); оксалиплатин, включая схему лечения с оксалиплатином (FOLFOX); лапатиниб (Tykerb); ингибиторы PKC-Į, Raf, H-Ras, EGFR (например, эрлотиниб (Tarceva)) и VEGF-A, снижающие уровень пролиферации клеток, дакоген, велкейд, а также фармацевтически приемлемые соли, кислоты и производные любых из указанных выше средств.
Примеры способов обнаружения
В различных вариантах осуществления настоящие способы содержат оценку наличия, отсутствия, или уровня белка и/или нуклеиновой кислоты. В различных вариантах осуществления настоящие способы содержат оценку наличия, отсутствия, или уровня белка и/или нуклеиновой кислоты, учет которой может увеличить специфичность и/или чувствительность анализа профиля BH3. В некоторых воплощениях оценивается маркер ответа пациента. В некоторых вариантах осуществления настоящие способы содержат измерение с использованием одного или нескольких способов, таких как иммуногистохимическое окрашивание, вестерн-блоттинг, способ In-Cell Western, иммунофлуоресцентное окрашивание, ИФА и сортировка клеток с активированной флуоресценцией (FACS), или любых других способов, описанных в настоящем документе или известных в данной области. Настоящие способы могут содержать контактирование антител с образцом опухоли (например, биопсийным образцом или тканью, или жидкостью организма) для идентификации эпитопа, который является специфичным для ткани или жидкости организма, и который указывает на форму рака.
В общем существует два типа способов для обнаружения эпитопов на антигенах в жидкостях или тканях организма, а именно прямые и косвенные способы. Прямой способ содержит одностадийное окрашивание и может содержать меченое антитело (например, антисыворотку, конъюгированную с флуоресцеин изотиацианатом), непосредственно взаимодействующее с антигеном в образце жидкости или ткани организма. Косвенный способ содержит немеченое первичное антитело, которое реагирует с антигеном в жидкости или ткани организма, и меченое вторичное антитело, которое реагирует с первичным антителом. Метки могут включать радиоактивные метки, флуоресцентные метки, гаптеновые метки, такие как биотин или ферментативные метки, такие как пероксидаза хрена или щелочная фосфатаза. Способы проведения таких анализов хорошо известны в данной области. См., Например, Harlow et al. (Antibodies, Cold Spring Harbor Laboratory, NY, 1988), Harlow et al. (Using Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, NY, 1999), Virella (Medical Immunology, 6th edition, Informa HealthCare, New York, 2007) и Diamandis et al. (Immunoassays, Academic Press, Inc., New York, 1996). Наборы для проведения таких анализов коммерчески доступны, например Clontech Laboratories, LLC. (Mountain View, CA).
В различных вариантах осуществления антитела включают целые антитела и/или любой антигенсвязывающий фрагмент (например, антигенсвязывающий участок), и/или отдельные цепи антител (например, антитело, содержащее по меньшей мере две тяжелые (H) цепи и две легкие (L) цепи, связанные между собой дисульфидными связями, Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1, фрагмент F(ab)2, двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области, Fd-фрагмент, состоящий из доменов VH и CH1, Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела, и тому подобное). В различных вариантах осуществления применимы поликлональные и моноклональные антитела, а также изолированные человеческие или гуманизированные антитела, или их функциональные фрагменты.
Стандартные анализы для оценки связывающей способности антител с мишенями различных типов известны в данной области и включают, например, ИФА, вестерн-блот и радиоиммунный анализ. Кинетику связывания (например, аффинность связывания) антител также можно оценить стандартными анализами, известными в данной области, такими как анализ Biacore.
В другом варианте осуществления измерение включает в себя оценку наличия, отсутствия или уровня нуклеиновой кислоты. Специалисту в данной области техники известно, что можно использовать множество разных методов для нахождения или количественного определения уровней ДНК/РНК подходящих маркеров.
Уровень экспрессии гена можно измерить с использованием, например, способов с низкой или средней производительностью, в качестве неограничивающих примеров включающих анализ гена-репортера, нозерн-блоттинг, флуоресцентную гибридизацию in situ (FISH) и ПЦР с обратной транскрипцией (ОТ-ПЦР). Уровень экспрессии гена также можно измерить с использованием, например, более высокопроизводительных способов, в качестве неограничивающих примеров включающих серийный анализ экспрессии генов (SAGE), ДНК-микрочипы, микрочипы высокой плотности, секвенирование РНК/полное секвенирование транскриптома (WTSS), высокопроизводительное секвенирование, мультиплексную ПЦР, мультиплексную амплификацию лигированных зондов (MLPA), секвенирование ДНК путем лигирования и Luminex/XMAP. Специалисту в данной области известно, что для нахождения или количественного определения уровня РНК биомаркеров в образце можно использовать ряд способов, включая чипы, такие как микрочипы, ОТ-ПЦР (включая количественную ПЦР), анализ РНК, специфически защищенной от нуклеаз, и анализ с помощью нозерн-блоттинга.
Примеры рака и пациентов
В некоторых вариантах осуществления изобретение обеспечивает способ выбора лечения рака и/или содержит анализ опухоли пациента или образца раковых клеток. Термины рак или опухоль относятся к клеткам с неконтролируемым ростом и/или с аномально повышенной выживаемостью, и/или с нарушенным механизмом апоптоза, которые препятствуют нормальному функционированию органов и систем организма. Субъект с раком или опухолью представляет собой субъекта, в теле которого имеются объективно детектируемые раковые клетки. Настоящее изобретение охватывает доброкачественные и злокачественные раковые образования, а также опухоли в неактивной стадии и микрометастазы. Раки, которые мигрируют из своего первоначального очага и формируют очаги в жизненно важных органах, могут в конечном итоге привести к смерти субъекта из-за нарушения функционирования пораженных органов.
В различных вариантах осуществления изобретение применимо к преметастатическому раку или к метастатическому раку. Термин метастазирование относится к миграции рака из его первичного очага в другие области организма. В таких случаях раковые клетки способны отделиться от первичной опухоли, проникнуть в лимфатические и кровеносные сосуды, переноситься кровотоком и формировать вторичные очаги (метастазы) в нормальных тканях в других областях тела. Метастазы могут быть локальными или отдаленными. Метастазирование представляет собой последовательный процесс, зависящий от отрыва опухолевых клеток от первичной опухоли, перемещения через кровоток и закрепления на удаленном участке. На новом участке клетки стимулируют рост кровеносных сосудов и могут разрастаться, формируя опасную для жизни клеточную массу. В регуляции такого поведения участвуют как стимулирующие, так и ингибирующие молекулярные пути внутри опухолевых клеток, кроме того крайне важно взаимодействие между опухолевой клеткой и клетками хозяина на удаленном участке. Метастазы часто обнаруживают, применяя один или несколько способов, таких как магнитно-резонансная томография (МРТ), компьютерная томография (КТ), подсчет форменных элементов крови, в том числе подсчет тромбоцитов, биохимический показатель функции печени, рентгенография грудной клетки и сканирование костей, в дополнение к мониторингу конкретных симптомов.
Описанные здесь способы направлены на прогнозирование рака, диагностику рака, лечение рака и/или диагностику, прогнозирование, лечение, профилактику или уменьшение интенсивности роста, прогрессирования и/или метастазирования злокачественных новообразований и пролиферативных расстройств, связанных с увеличением клеточной выживаемости или ингибированием апоптоза. В некоторых вариантах осуществления изобретения рак представляет собой гематологический рак, неограничивающие примеры которого включают острый миелоидный лейкоз (ОМЛ), множественную миелому, фолликулярную лимфому, острый лимфобластный лейкоз (ОЛЛ), хронический лимфоцитарный лейкоз или неходжкинскую лимфому, включая, без ограничений, мантийноклеточную лимфому и диффузную В-крупноклеточную лимфому. В некоторых вариантах осуществления изобретения рак представляет собой солидную опухоль, включая, без ограничений, немелкоклеточную карциному легких, рак яичников и меланому.
В некоторых вариантах осуществления изобретение относится к одному или нескольким из следующих видов рака: острый лимфобластный лейкоз (ОЛЛ), острый миелоидный лейкоз (ОМЛ), адренокортикальная карцинома, СПИД-ассоциированный рак, рак анального канала, рак аппендикса, астроцитома (например, детская мозжечковая или церебральная), базальноклеточная карцинома, рак желчных протоков, рак мочевого пузыря, накостная опухоль (например, остеосаркома, злокачественная фиброзная гистиоцитома), глиома головного мозга, рак мозга, опухоли головного мозга (например, астроцитома мозжечка, астроцитома головного мозга/злокачественная глиома, эпендимома, медуллобластома, супратенториальная примитивная нейроэктодермальная опухоль, глиома зрительного нерва и гипоталамическая глиома), рак молочной железы, бронхиальные аденомы/карциноиды, лимфома Беркитта, карциноидная опухоль, лимфомы центральной нервной системы, астроцитома мозжечка, рак шейки матки, хронический лимфоцитарный лейкоз (ХЛЛ), хронический миелолейкоз (ХМЛ), хронические миелопролиферативные расстройства, рак толстой кишки, кожная Т-клеточная лимфома, десмопластическая мелкокруглоклеточная опухоль, рак эндометрия, эпендимома, рак пищевода, саркома Юинга, экстракраниальная герминогенная опухоль, внегонадная герминогенная опухоль, рак внепеченочного желчного протока, рак глаз, рак желчного пузыря, рак ЖКТ (желудка), желудочно-кишечная стромальная опухоль (GIST), герминогенная опухоль (например, экстракраниальная, внегонадная, яичниковая), гестационная трофобластическая опухоль, глиомы (например, глиома ствола мозга, астроцитома мозга, глиома зрительного нерва и гипоталамическая глиома), карциноид желудка, рак головы и шеи, рак сердца, гепатоцеллюлярный рак (печени), гипофарингиальный рак, глиома зрительного нерва и гипоталамическая глиома, интраокулярная меланома, карцинома из клеток островков Лангерганса (эндокринная часть поджелудочной железы), рак почек (почечно-клеточный рак), рак гортани, лейкемии (например, острый лимфоцитарный лейкоз, острый миелогенный лейкоз, хронический лимфоцитарный лейкоз, хронический миелоидный лейкоз, волосатоклеточный лейкоз), рак губ и полости рта, липосаркома, рак печени, рак легкого (например, немелкоклеточный или мелкоклеточный), лимфома (например, СПИД-ассоциированная, Беркитта, кожная T-клеточная, ходжкинская, неходжкинская, первичная лимфома центральной нервной системы), медуллобластома, меланома, карцинома из клеток Меркеля, мезотелиома, метастатический плоскоклеточный рак шеи, рак полости рта, синдром множественной эндокринной неоплазии, множественная миелома, грибовидный микоз, миелодиспластический синдром, миелодиспластические/миелопролиферативные заболевания, миелобластный лейкоз, миелолейкоз, миелопролиферативные расстройства, хронический лейкоз, рак носовой полости и придаточных пазух носа, назофарингеальная карцинома, нейробластома, неходжкинская лимфома, немелкоклеточный рак легкого, рак полости рта, рак ротоглотки, остеосаркома, рак яичников, рак поджелудочной железы, рак паращитовидной железы, рак полового члена, фарингеальный рак, феохромоцитома, астроцитома и/или герминома шишковидной железы, пинеалобластома и супратенториальные примитивные нейроэктодермальные опухоли, аденома гипофиза, неоплазия/множественная миелома плазматических клеток, плевролегочная бластома, первичная лимфома центральной нервной системы, рак предстательной железы, рак прямой кишки, почечно-клеточная карцинома (рак почек), рак почечной лоханки и мочеточника, ретинобластома, рабдомиосаркома, рак слюнной железы, саркома (например, Юинга, Капоши, мягких тканей, матки), синдром Сезари, рак кожи (например, немеланоцитарный, меланома, из клеток Меркеля), мелкоклеточный рак легкого, рак тонкой кишки, саркома мягких тканей, плоскоклеточный рак, плоскоклеточный рак шеи, рак желудка, супратенториальная примитивная нейроэктодермальная опухоль, Т-клеточная лимфома, рак яичек, рак горла, тимома и рак вилочковой железы, рак щитовидной железы, трофобластические опухоли, рак мочеточника и почечной лоханки, рак уретры, рак матки, саркома матки, рак влагалища, глиома зрительного нерва и гипоталамическая глиома, рак вульвы, макроглобулинемия Вальденстрема и опухоль Вильмса.
В одном варианте осуществления настоящего изобретения рак представляет собой ОМЛ. ОМЛ является вторым по распространенности лейкозом, ежегодно в США регистрируют около 13000 впервые диагностированных случаев и 9000 смертей из-за ОМЛ. Несмотря на то, что существует одобренное лечение, прогноз для многих пациентов с лейкозом является плохим, а вероятность успешного лечения является низкой. Нынешним стандартом лечения ОМЛ является введение цитозин арабинозида (ara-C) в сочетании с антрациклиновым средством (таким как даунарубицин, идарубицин или митоксантрон). После указанной схемы лечения обычно назначают введение высокой дозы цитарабина и/или пересадку стволовых клеток. Эти способы лечения показывают лучший результат при назначении молодым пациентам. Также достигнут прогресс в лечении острого промиелоцитарного лейкоза, в случае которого применение таргетной терапии полностью транс-ретиноевой кислотой (ATRA) или триоксидом мышьяка привело к хорошему уровню выживаемости. Однако пациенты старше 60 лет, составляющие подавляющее большинство случаев ОМЛ, представляют собой терапевтическую трудность. Хотя 65-85% пациентов первоначально отвечают на существующие способы лечения, 65% таких ответчиков подвергаются рецидиву и многие пациенты погибают из-за заболевания. По этой причине и потому, что вышеупомянутые способы лечения могут давать серьезные побочные эффекты, предлагаемый в настоящем изобретении прогностический тест может регулировать подбор схем лечения, которые уменьшают указанные проблемы. В некоторых вариантах осуществления настоящее изобретение увеличивает вероятность успешного лечения путем подбора подходящему пациенту подходящего лечения. Кроме того, в настоящее время нет тестов для прогнозирования ответа пациента с ОМЛ на лечение.
Используемый в настоящем документе термин субъект представляет собой, если не указано иначе, млекопитающее, например, человека, мышь, крысу, хомяка, морскую свинку, собаку, кошку, лошадь, корову, козу, овцу, свинью или примата, отличного от людей, такого как мартышка, шимпанзе или бабуин. Термины «субъект» и «пациент» используются в настоящем документе взаимозаменяемо.
Примеры образцов
В некоторых вариантах осуществления изобретения образец представляет собой линию клеток, выделенных из опухоли человека. В некоторых вариантах осуществления образец является раковой стволовой клеткой. В других вариантах осуществления образец получают из биопсии солидной опухоли, такой как, например, биопсия первичной опухоли толстой и прямой кишки, груди, предстательной железы, легких, поджелудочной железы, почек или яичников.
В некоторых вариантах осуществления образец получают из биопсии не солидной опухоли, такой как, например, один из описанных в настоящем документе раков. В конкретных вариантах осуществления образец получают из биопсии пациента с множественной миеломой, острым миелоидным лейкозом, хроническим миелоидным лейкозом, мантийноклеточной лимфомой, диффузной В-крупноклеточной лимфомой или неходжкинской лимфомой. В конкретном варианте осуществления образец представляет собой клетки множественной миеломы, обогащенные путем отбора из биопсийного образца с помощью антител к CD138, прикрепленных к твердой матрице или шарикам. В конкретном варианте осуществления образец представляет собой клетки острого миелоидного лейкоза, обогащенные за счет связывания с антителами к CD45. В конкретном варианте осуществления образец представляет собой клетки хронического миелоидного лейкоза или диффузной В-крупноклеточной лимфомы, обогащенные с помощью деплеции не В-клеток.
В некоторых вариантах осуществления образец получают из циркулирующих в крови опухолевых клеток.
Получение профиля BH3
В различных вариантах осуществления изобретение включает анализ профиля BH3. В различных вариантах осуществления изобретение включает анализ профиля BH3, в котором оцениваются по меньшей мере два, или три, или четыре, или пять, или шесть, или семь, или восемь, или девять, или десять BH3 пептидов. В некоторых вариантах осуществления настоящие способы содержат анализ множества пептидов, а не одного BH3 пептида. В некоторых вариантах осуществления проводят скрининг образца пациента против панели BH3 пептидов.
Способы получения профиля BH3 и реагенты, применяемые в таких способах, описаны в патентных публикациях США №№ 7,868,133; 8221966; и 8,168,755 и патентной публикации США № 2011/0130309, содержание которых включено в настоящее описание посредством ссылки во всей их полноте.
Вкратце, не связываясь с какой-либо конкретной теорией отметим, что в результате развития аберрантных фенотипов раковые клетки формируют блоки в пути апоптоза. Благодаря этим блокам раковые клетки становятся устойчивыми к некоторым способам лечения, но, что неожиданно, некоторые раковые клетки становятся чувствительными к другим способам лечения. Понятие «онкогенная зависимость» описывает явления приобретенной зависимости выживания раковых клеток от конкретных белков. Анализ профиля BH3 показывает, существует ли в данных раковых клетках такая зависимость от определенных белков, регулирующих апоптоз, и устанавливает, что это за белки. В раковых клетках можно, хотя и не всегда, предварительно увеличить вероятность запуска апоптоза, такая возможность определяется тем, насколько выживание этих клеток зависит от любого или всех антиапоптотических белков семейства Bcl-2. Это позволяет оценить вероятность ответа раковых клеток на лечение.
Не связываясь с какой-либо конкретной теорией отметим, что раковые клетки проявляют аномалии, такие как повреждение ДНК, генетическая нестабильность, аномальный уровень синтеза фактора роста и аномальное или отсутствующее взаимодействие с матриксом, любые из таких аномалий обычно должны индуцировать апоптоз через внутренний (митохондриальный) путь апоптоза. Однако вместо того, чтобы реагировать на эти апоптотические сигналы раковые клетки выживают. Часто при этом эти клетки становятся сильно зависящими от некоторых блоков апоптоза из-за хронических сигналов апоптоза. Такая адаптация обеспечивает механизм выживания раковых клеток; однако эта же адаптация может сделать раковые клетки восприимчивыми к некоторым способам лечения, индуцирующим апоптоз. Критическим событием, приводящим к клеточной гибели по пути внутреннего апоптоза, является пермеабилизация внешней митохондриальной мембраны (MOMP) и высвобождение молекул, активирующих эффекторные каспазы. Во многих случаях MOMP является точкой невозврата в развитии внутреннего пути апоптоза. Белки семейства Bcl-2 являются ключевыми регуляторами MOMP и их активность связана с развитием лимфоидных и некоторых солидных опухолей, кроме того считается, что у многих видов рака они являются ключевыми участниками формирования устойчивости к химиотерапии.
Белки семейства Bcl-2 регулируются различными белок-белковыми взаимодействиями между способствующими выживанию (антиапоптическими) и проапоптотическими членами семейства. Эти взаимодействия происходят в основном через опосредованное доменом BH3 (Bcl-2 homology domain-3) связывание. Инициация апоптоза происходит в основном вне митохондрий и вызывает перенос коротких членов семейства Bcl-2, содержащих только домен BH3, в митохондрии, где они активируют или снижают устойчивость к MOMP. Содержащие только домен BH3 белки-активаторы Bim и Bid связываются и непосредственно активируют эффекторные проапоптотические белки Bax и Bak, а также связываются и ингибируют антиапоптотические белки семейства Bcl-2, такие как Bcl-2, MCL1, Bfl-1, Bcl-w и Bcl-xL. Сенсибилизирующие BH3 белки, Bad, Bik, Noxa, Hrk, Bmf и Puma, связываются только с антиапоптотическими белками семейства Bcl-2, такими как Bcl-2, MCL1, Bfl-1, Bcl-w и Bcl-xL, блокируя их антиапоптотическое действие. Не связываясь с какой-либо конкретной теорией отметим, что каждый сенсибилизирующий белок обладает уникальным профилем специфичности. Например, Noxa (A и B) обладает высоким сродством к MCL1, Bad связывается с Bcl-xL и Bcl-2, но обладает слабым сродством к MCL1, а Puma хорошо связывается со всеми тремя мишенями. Антиапоптотическое действие этих белков заключается в блокировании активаторных BH3 белков Bim и Bid. Освобождение этих активаторов с помощью сенсибилизирующих пептидов приводит к Bax/Bak-опосредованной готовности к апоптозу. Эти взаимодействия могут привести к различным результатам, включая, без ограничения, гомеостаз, клеточную гибель, снижение устойчивости к апоптозу и блок апоптоза.
Отличительной особенностью раковых клеток, в которых блокирован сигнальный путь апоптоза, является скопление содержащих только домен BH3 белков-активаторов на поверхности митохондрий, в результате связывания этих белков антиапоптотическими белками. Такое скопление и близость к их белкам-мишеням обусловливает повышенную чувствительность к антагонистам антиапоптотических белков семейства Bcl-2 у клетки в состоянии "готовности ответа на BH3".
В некоторых вариантах осуществления клетка, дающая высокий апоптотический ответ на Noxa (A или B), является зависящей от MCL1, в то время как высокий ответ на пептид Bad указывает, что Bcl-xL или Bcl-2 формируют апоптотический блок. В некоторых вариантах осуществления Puma характеризует зависимость от ряда белков семейства Bcl-2. Таким образом, можно легко отличить клетки, которые зависят от MCL1, или Bcl-xL, или от обоих белков, или от нескольких членов семейства Bcl-2, и, следовательно, можно соответствующим способом адаптировать лечение. Различия в митохондриальном ответе на эти пептиды могут регулировать применение способов лечения, про которые известно, что они действуют через пути, которым в итоге будет препятствовать воздействие MCL1 или Bcl-xL на собственный сигнальный путь апоптоза. В таких случаях может рекомендоваться применение соединений, ингибирующих Bcl-2 или MCL1. В некоторых вариантах осуществления настоящие способы также указывают возможность или невозможность применения способов лечения, воздействующих на элементы сигнального пути, расположенные в этом пути выше MCL1 или Bcl-xL.
Анализ профиля BH3 показывает, находится ли раковая клетка в состоянии готовности ответа, а также на какие BH3 пептиды наблюдается ответ, и это имеет прогностическое значение.
Примеры клинических факторов и дополнительных биомаркеров
В некоторых вариантах осуществления изобретение содержит оценку клинических факторов. В некоторых вариантах осуществления изобретение содержит оценку профиля BH3 и/или клинических факторов для оценки ответа пациента. В некоторых вариантах осуществления клинический фактор, который в сочетании с анализом профиля BH3 дает информацию об ответе пациента, может быть не связан с апоптозом. В некоторых вариантах осуществления клинический фактор является не влияющим на апоптоз.
В варианте осуществления изобретения клинический фактор представляет собой клинические факторы, показанные в таблице 3.
В одном варианте осуществления клинический фактор представляет собой один или более фактор, выбранный из возраста, цитогенетического статуса, состояние пациента, гистологического подкласса, пола и стадии заболевания.
В одном варианте осуществления клинический фактор представляет собой возраст. В одном варианте осуществления возрастной профиль пациентов разбивается на группы, такие как старше примерно 10, или старше примерно 20, или старше примерно 30, или старше примерно 40, или старше примерно 50, или старше примерно 60, или старше примерно 70, или старше примерно 80 лет.
В одном варианте осуществления клинический фактор представляет собой цитогенетический статус. В некоторых раковых опухолях, таких как, например, опухоль Вильмса и ретинобластома, делеция или инактивация генов ответственны за инициирование развития рака, поскольку в этих случаях обычно удаляются или мутируют хромосомные области, связанные с опухолевыми супрессорами. Например, делеции, инверсии и транслокации в хромосомной области 9p21 часто наблюдаются в глиомах, немелкоклеточных раках легкого, лейкозах и меланомах. Не связываясь с какой-либо конкретной теорией, отметим, что такие хромосомные изменения могут инактивировать опухолевый супрессор, такой как ингибитор циклинзависимой киназы 2А. Наряду с делециями конкретных генов также могут быть потеряны большие части хромосом. Например, хромосомы 1p и 16q часто теряются в клетках солидных опухолей. Дупликация генов и увеличение числа копий генов также могут способствовать развитию рака и их можно обнаружить с помощью транскрипционного анализа или анализа вариации числа копий генов. Например, во многих саркомах амплифицируется хромосомная область 12q13-q14. Эта хромосомная область содержит ген, кодирующий связывающий белок MDM2, про который известно, что он связывается с опухолевым супрессором p53. В случае амплификации MDM2, он начинает препятствовать нормальной регуляции роста клеток с помощью p53, что может привести к образованию опухоли. Кроме того, некоторые раки молочной железы ассоциированы с повышенной экспрессией и увеличением числа копий гена ERBB2, который кодирует рецептор человеческого эпидермального фактора роста 2 типа. Кроме того, увеличение числа хромосом, например хромосом 1q и 3q, также ассоциировано с повышенным риском рака.
Цитогенетический статус можно оценить различными способами, известными в данной области. Например, можно использовать FISH, традиционное кариотипирование и виртуальное кариотипирование (например, сравнительную геномную гибридизацию на микрочипе, сравнительную геномную гибридизацию и анализ одиночных нуклеотидных полиморфизмов на микрочипе). Например, FISH можно использовать для анализа перестроек хромосом в определенных локусах, так как такие перестройки связаны с категорией риска заболевания. В некоторых вариантах осуществления цитогенетический статус может быть благоприятным, промежуточным или неблагоприятным.
В одном варианте осуществления клинический фактор представляет собой состояние пациента. Состояние пациента можно количественно оценить с использованием любой системы и способа оценки состояния пациента, известных в данной области. Такую оценку часто используют для определения того, может ли пациент получать химиотерапию, для корректирования дозы и определения интенсивности паллиативной терапии. Существует множество систем оценки, в том числе шкала Карновского и шкала Зуброда. Аналогичные системы оценки включают шкалу общей оценки функционального статуса (GAF), которая входит в пятую ось в Диагностическом и статистическом руководстве по психическим расстройствам (DSM). Более высокий уровень состояния пациента (например, по меньшей мере 80% или, по меньшей мере 70% по шкале Карновского) может указывать способ лечения для предотвращения прогрессирования заболевания и соответствует более высокой способности пациента принимать химиотерапию и/или лучевую терапию. Например, в таких вариантах осуществления пациент является амбулаторным и способен ухаживать за собой. В других вариантах осуществления оценка указывает пациентов с слишком низким уровнем состояния (например, менее 50%, менее 30%, или менее 20% по шкале Карновского), чтобы перенести обычную лучевую терапию и/или химиотерапию. В этих вариантах осуществления пациент в основном прикован к постели или креслу и не способен ухаживать за собой.
Шкала Карновского оценивает состояние по шкале от 100 до 0, где 100 соответствует "идеальному" здоровью, а 0 соответствует смерти. Данную шкалу можно использовать с интервалом в 10 баллов, при этом: 100% обозначает нормальное состояние, нет никаких жалоб и никаких признаков заболевания; 90% обозначает
нормальную активность, незначительное количество симптомов или признаков заболевания, 80% обозначает нормальную активность, поддерживаемую с усилием, некоторое количество симптомов или признаков заболевания; 70% обозначает наличие способности к уходу за собой, отсутствие способность к нормальной деятельности или работе; 60% обозначает потребность в некоторой помощи, способность в большинстве случаев к уходу за собой; 50% обозначает потребность в частой помощи, потребность в частой медицинской помощи; 40% обозначает потребность в особом уходе и помощи; 30% обозначает тяжелую потерю трудоспособности, потребность в госпитализации, но нет риска смерти; 20% обозначает тяжелое заболевание, необходима срочная госпитализацию, требуются поддерживающие меры или способы лечения; и 10% обозначает терминальный период, быструю прогрессию смертельной болезни.
Шкала Зуброда для оценки состояния включает в себя: 0, полностью активен, способен без ограничений выполнять те же активности, что и до заболевания; 1, ограничение физически тяжелой деятельности, но пациент является амбулаторным и способным выполнять работу легкого или сидячего характера, например, легкую работу по дому, работу в офисе; 2, пациент является амбулаторным и способным к уходу за собой, но неспособным выполнять какую-либо работу вплоть до более 50% от времени бодрствования; 3, пациент способен только к ограниченному уходу за собой, прикован к постели или креслу более 50% времени бодрствования; 4, полная потеря трудоспособности, пациент не способен к уходу за собой, все время прикован к кровати или креслу; 5, пациент мертв.
В одном варианте клинический фактор представляет собой гистологический подкласс. В некоторых вариантах осуществления гистологические образцы опухолей классифицируют согласно работе Elston & Ellis, Histopathology, 1991, 19: 403-10, содержание которой включено в настоящее описание посредством ссылки во всей полноте.
В одном варианте осуществления изобретения клинический фактор представляет собой пол. В одном варианте осуществления изобретения пол является мужским. В одном варианте осуществления изобретения пол является женским.
В одном варианте осуществления изобретения клинический фактор представляет собой стадию заболевания. В качестве неограничивающего примера можно использовать общее разбиение на стадии, при этом раки Стадии I локализованы в одной части тела; раки Стадии II являются местно распространенными, как и раки Стадии III. Относиться ли рак к Стадии II или Стадии III может зависеть от конкретного типа рака. В одном неограничивающем примере Стадия II болезни Ходжкина указывает на пораженные лимфатических узлов только с одной стороны диафрагмы, тогда как на Стадия III указывает на поражение лимфатических узлов и с нижней и с верхней сторон диафрагмы. Поэтому конкретные критерии разделения Стадий II и III различаются в зависимости от диагноза. Раки Стадии IV часто дают метастазы или распространяются на другие органы или по всему телу.
В некоторых вариантах осуществления изобретения клинический фактор представляет собой Франко-американско-британскую классификационную (FAB) систему гематологических заболеваний (например, указание наличия дисмиелопоэза и количественная оценка миелобластов и эритробластов). В одном варианте осуществления FAB для острых лимфобластных лейкозов представляет собой шкалу L1-L3, а для острых миелоидных лейкозов представляет собой шкалу M0-M7. В другом варианте осуществления способ дополнительно содержит измерение дополнительного биомаркера, выбранного из мутационного статуса, однонуклеотидных полиморфизмов, стационарных уровней белков и динамических уровней белков. В другом варианте осуществления способ дополнительно содержит прогнозирование клинического ответа пациента. В другом варианте осуществления клинический ответ обозначает примерно 1, примерно 2, примерно 3 или примерно 5 лет выживаемости без прогрессирования заболевания/бессобытийной выживаемости.
Определено множество различных клинических факторов, таких как возрастной профиль и состояние пациента. Также используется ряд статических измерений, таких как оценка цитогенетических и молекулярных событий, включая, без ограничения, мутации в генах MLL, AML/ETO, Flt3-ITD, NPM1 (NPMc+), CEBPĮ, IDH1, IDH2, RUNX1, ras и WT1, а также в генах TET2 и ASXL, участвующих в эпигенетической регуляции, а также изменения в профиле сигнальных белков клетки.
В некоторых вариантах осуществления профилактические способы содержат назначение лечения пациенту, имеющему высокую вероятность развития рака, согласно описанным здесь способам. В некоторых вариантах осуществления субъект имеет высокую вероятность развития рака, если у субъекта имеется один или более факторов высокого риска развития рака, охватывающих генетическую предрасположенность к раку (например, генетические факторы риска), наличие рака в предшествующем анамнезе (например, новый рак и/или рецидив), наличие рака в семейном анамнезе, воздействие веществ, вызывающих рак (например, факторы окружающей среды) и фармакогеномную информацию (влияние генотипа на фармакокинетику, фармакодинамику, или на профиль эффективности терапевтического средства).
В некоторых вариантах осуществления субъект имеет высокую вероятность развития рака, если у субъекта имеется высокий риск развития рака. В некоторых вариантах осуществления субъект имеет высокую вероятность развития рака, если у субъекта имеется генетическая предрасположенностью к раку. В некоторых вариантах осуществления генетическая предрасположенность к раку представляет собой генетический клинический фактор, известный в данной области. Такие клинические факторы могут включать, например, гены HNPCC, MLH1, MSH2, MSH6, PMS1, PMS2 по меньшей мере в случае раков толстой кишки, матки, тонкой кишки, желудка и мочевых путей. В некоторых вариантах осуществления субъект имеет высокую вероятность развития рака, если у субъекта имеется рак в предшествующем анамнезе. В некоторых вариантах осуществления субъект мог иметь 1, или 2, или 3, или 4, или 5, или 6 предшествующих эпизодов рака. В некоторых вариантах осуществления субъект имеет высокую вероятность развития рака, если у субъекта имеется рак в семейном анамнезе. В некоторых вариантах осуществления родитель и/или дед/бабушка, и/или родной брат/сестра, и/или тетя/дядя, и/или двоюродная бабушка/двоюродный дед, и/или двоюродный брат/сестра страдали или страдают от рака. В некоторых вариантах осуществления субъект имеет высокую вероятность развития рака, если субъект подвергается воздействию вещества, вызывающего рак (например, фактора окружающей среды). Например, воздействие на кожу интенсивного солнечного света является клиническим фактором риска рака кожи. Например, курение является клиническим фактором риска рака легких, рта, гортани, мочевого пузыря, почек и ряда других органов.
Кроме того, в некоторых вариантах осуществления изобретения любой из следующих клинических факторов можно использовать в описанных здесь способах: пол; генетические факторы риска; семейный анамнез; личный анамнез; раса и этническая принадлежность; особенности определенных тканей; различные доброкачественные состояния (например, непролиферативные поражения); предыдущее облучение грудной клетки; воздействие канцерогенов и тому подобное.
Кроме того, в некоторых вариантах осуществления изобретения любой из следующих клинических факторов можно использовать в описанных здесь способах: один или несколько факторов, таких как маркер клеточной поверхности CD33, маркер клеточной поверхности CD34, мутационный статус FLT3, мутационный статус p53, статус фосфорилирования MEK-1 киназы и фосфорилирование серина в положении 70 белка Bcl-2.
В некоторых вариантах осуществления изобретения клинический фактор представляет собой уровни экспрессии цитокинов, включая, без ограничения, интерлейкин-6. В некоторых вариантах осуществления изобретения уровень экспрессии интерлейкина-6 сопоставляют с вероятностью ответа у пациентов с ММ, включая определение плохого прогноза или хорошего прогноза для пациента.
В некоторых вариантах осуществления вероятность ответа на лечение определяют путем оценки процента ответа на обработку (priming). В некоторых вариантах осуществления ответ клеток определяют с помощью следующего уравнения:

в котором AUC обозначает либо площадь под кривой, либо интенсивность сигнала; DMSO относится к характеризующему базовое значение отрицательному контролю; и CCCP (карбонил цианид м-хлорфенил гидразон) относится к положительному контролю, так как CCCP нарушает синтез белка, выступая в качестве разобщающего агента, нарушающего протонный градиент, возникающий при нормальном функционировании переносчиков электронов в электронно-транспортной цепи в митохондрии. В некоторых вариантах осуществления область под кривой определяют из измерений гомогенной флуоресценции с временным разрешением (HTRF). В некоторых вариантах осуществления время наблюдения попадает в промежутки, варьирующие от промежутка от примерно 0 до примерно 300 мин до промежутка от примерно 0 до примерно 30 мин. В некоторых вариантах осуществления область под кривой определяют с помощью сортировки клеток с активированной флуоресценцией (FACS). В некоторых вариантах осуществления интенсивность сигнала представляет собой результат измерения в одной временной точке, попадающей в интервал от примерно 5 мин до примерно 300 мин.
В другом варианте осуществления способ содержит измерение профиля BH3 и одного или нескольких факторов, таких как маркер клеточной поверхности CD33, маркер клеточной поверхности CD34, мутационный статус FLT3, мутационный статус p53, статус фосфорилирования MEK-1 киназы и фосфорилирование серина в положении 70 белка Bcl-2; и сопоставление результатов измерения с эффективностью лечения пациентов с ОМЛ с помощью химиотерапии на основе цитарабина, или цитарабина и/или азацитидина.
В другом варианте осуществления способ содержит измерение профиля BH3 и одного или нескольких факторов, таких как маркер клеточной поверхности CD33, маркер клеточной поверхности CD34, мутационный статус FLT3, мутационный статус p53, статус фосфорилирования MEK-1 киназы и фосфорилирование серина в положении 70 белка Bcl-2; и сопоставление результатов измерения с эффективностью лечения пациентов с MM с помощью химиотерапии.
В еще одном варианте осуществления рак представляет собой ОМЛ и/или MM, а клиническим фактором является возрастной профиль и/или цитогенетический статус; или рак представляет собой ОМЛ и/или MM, а лечение рака представляет собой химиотерапию на основе цитарабина, или цитарабина и/или азацитидина, или лечение рака представляет собой химиотерапию на основе цитарабина, или цитарабина и/или азацитидина, а клиническим фактором является возрастной профиль и/или цитогенетический статус, или лечение рака представляет собой химиотерапию на основе цитарабина, или цитарабина и/или азацитидина; рак представляет собой ОМЛ и/или MM; и клиническим фактором является возрастной профиль и/или цитогенетический статус.
В настоящем изобретении также предусмотрены наборы, которые могут упростить оценку опухолей или образцов раковых клеток. Типичный набор по изобретению содержит различные реагенты, включая, например, одно или несколько средств для обнаружения BH3 пептида. Набор может также содержать один или несколько реагентов для обнаружения, включая используемые в различных способах обнаружения, такие как, например, антитела. Набор может дополнительно содержать материалы, необходимые для оценки, включая луночные планшеты, шприцы и т.п. Набор может дополнительно содержать этикетку или печатные инструкции, поясняющие как использовать описанные реагенты. Набор может дополнительно содержать лекарственное средство, подлежащее тестированию.
Термин «приблизительно», в случае использования по отношению к числовому значению, обозначает собственно числовое значение, а также интервал плюс-минус 10% от указанного числового значения. Например, формулировка «приблизительно 50» охватывает диапазон от 45 до 55.
Используемый здесь термин «включая» и его варианты являются неограничивающими, так что явное перечисление списка предметов не исключает других подобных предметов, которые также можно использовать в материалах, композициях, устройствах и способах по настоящему изобретению. Аналогичным образом, термины «может» и «возможно», и их варианты являются неограничивающими, так что упоминание о том, что вариант осуществления может содержать или возможно содержит определенные элементы или особенности, не исключает других вариантов осуществления настоящего изобретения, не содержащих этих элементов или особенностей. Хотя неограничивающий термин «содержащий» в качестве синонима терминов, таких как включает или имеет, применяется в настоящем документе для описания и в формуле изобретения, настоящее изобретение или варианты его осуществления могут альтернативно описываться с использованием более ограниченных терминов таких как «состоящий из» или «состоящий в основном из» перечисленных компонентов.
Если не указано иное, то все технические и научные термины здесь имеют то же значение, которое обычно понимается специалистом в данной области техники, к которому относится настоящее изобретение. В настоящем документе описаны предпочтительные способы и материалы, тем не менее любые способы и материалы аналогичные или эквивалентные описанным здесь также можно использовать в практическом или тестовом варианте осуществления настоящего изобретения. Все публикации, патенты и патентные публикации включены в настоящее описание посредством ссылки во всей их полноте во всех отношениях.
Варианты осуществления настоящего изобретения дополнительно иллюстрируются следующими неограничивающими примерами.
ПРИМЕРЫ
Пример 1
Исследования на группах пациентов с ОМЛ
Больницы и клиники Университета Джонса Хопкинса располагают в своем хранилище тканей прижизненно замороженными образцами пациентов с ОМЛ из двух ранее проведенных клинических исследований. 63 образца периферической крови и костного мозга пациентов с впервые диагностированными ОМЛ или МДС, зарегистрированных по протоколам NCT00795002 (J0856), NCT00407966 (J0669) или NCT01349972 (J1101) получили из Университета Джона Хопкинса и проанализировали. Пациентов лечили с помощью схемы FLAM: альвоцидиб (флавопиридол), Ara-C и Митоксантрон (n=54), или схемы 7+3 (Ara C и Даунорубицин, n=9). Полный ответ, характеризуется содержанием менее 5% миелобластов, нормальным созреванием всех клеточных линий, абсолютным числом нейтрофилов (АЧН) 1000/мкл и количеством тромбоцитов 100000/мкл, отсутствием бластных клеток в периферической крови, отсутствием лейкозных клеток в костном мозге, исчезновением цитогенетических признаков заболевания и исчезновением признаков предыдущего экстрамедуллярного заболевания. Общие характеристики пациентов были предоставлены Университетом Джона Хопкинса после завершения анализа профилей BH3 и приведены в таблице 1, характеристики включают возраст пациентов, группу цитогенетического риска, наличие мутаций FLT-3, наличие мутаций NPM1, наличие в анамнезе МДС/заболеваний костного мозга, предысторию химиотерапии, процент бластных клеток в костном мозге, количество лейкоцитов на момент постановки диагноза и ответ на лечение. Индивидуальные особенности пациентов приведены в таблице 2.
Таблица 1: Общая информация о пациентах
Таблица 2: Характеристики пациента
Анализ профиля митохондрий
Вкратце, замороженные образцы выделенных лейкоцитов быстро размораживали и определяли жизнеспособность клеток с помощью окрашивания трипановым синим. Клетки промывали в буфере для FACS (1x фосфатно-солевой буфер с 2% фетальной бычьей сыворотки) и иммунофенотипировали с помощью флуоресцентно меченных моноклональных антител к CD45, CD3 и CD20. Затем клетки ресуспендировали в буфере Ньюмейера (10 мМ трегалозы, 10 мМ HEPES, 80 мМ KCl, 20 мкМ ЭГТА, 20 мкМ ЭДТА, 5 мМ сукцината, рН 7,4) для проведения последующей обработки. BH3 пептиды разводили в буфере Ньюмейера для получения рабочих растворов с конечными концентрациями: BIM (100 мкМ), BIM (0,1 мкМ), NOXA (100 мкМ), Puma (10 мкМ), HRK (100 мкМ), BAD (100 мкМ) и BID (1,0 мкМ). DMSO и CCCP использовали в качестве отрицательного и положительного контролей. Дигитонин и олигомицин добавляли в отдельные пробирки для FACS, после чего туда добавляли BH3 пептиды. Затем в пробирки для FACS добавляли клетки и инкубировали в течение 2 часов и 15 минут при комнатной температуре, чтобы обеспечить достаточное количество времени для пермеабилизации клеток, попадания в них пептидов или соединений, и деполяризации митохондрий. После инкубации краситель JC-1 готовили в буфере Ньюмейера и добавляли непосредственно к обработанным клеткам. Клетки в дополнительной пробирке, не обработанные пептидом или соединением, окрашивали с помощью пропидиум иодида (PI), чтобы убедиться в эффективной пермеабилизации клеток дигитонином. После 45 минут инкубации с JC-1 клетки анализировали на проточном цитофлуориметре с тремя лазерами BD FACSCanto II. Бластные клетки ОМЛ отбирали на основе четырех параметров: 1) пермеабилизация (определяемая окрашиванием PI), 2) отделение единичных клеток на основании SSC, 3) CD45-dim и CD3/CD20 отрицательный фенотип и 4) SSC-low. Среднюю интенсивность флуоресценции JC-1 в красной области у отобранных клеток затем использовали для определения % деполяризации в сравнении с контролями с DMSO (отрицательный) и с CCCP (положительный). Результаты цитогенетического анализа, устанавливающего группу цитогенетического риска, предоставил Университет Джона Хопкинса. Группа цитогенетического риска (благоприятная, промежуточная и неблагоприятная) для каждого пациента была определена согласно рекомендациям Группы Б по исследованию рака и лейкозов (CALGB): Благоприятная=inv16, t(8:21), T(15;17), Промежуточная=диплоидное состояние, Неблагоприятная=-5, -7, +8, t(6;9), 11q, PH1+, 3 несвязанные цитогенетические аномалии и т.д.
Статистический анализ: Для каждого пептида процент ответа на обработку рассчитывали, используя следующую формулу, согласно которой процент ответа определяется в сравнении с отрицательным контролем с DMSO, характеризующим полное отсутствие ответа, и с положительным контролем с CCCP, характеризующим 100% ответ:
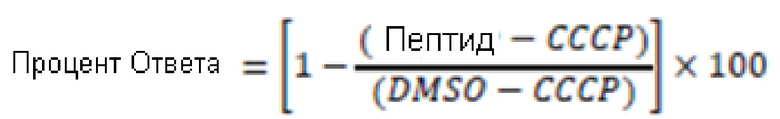
В рамках анализа все пациенты, не классифицированные как CR, рассматривались как не ответившие [Минимальная остаточная болезнь (MRD), частичная ремиссия (PR) и TF (неэффективность лечения)]. Статистические тесты, такие как T-Критерий Стьюдента, непараметрический критерий Манна-Уитни, множественная логистическая регрессия и анализ ROC-кривой для оценки корреляции между ответом на обработку пептидами BH3 (и другими особенностями опухолей, такими как цитогенетика и т.д.) и ответом на лечение проводили с использованием программ GraphPad Prism Version 5.04 и MedCalc Version 14.8.1.
В рамках анализа профилей митохондрий в образцах пациентов с ОМЛ, зарегистрированных по протоколам FLAM, всего получили и обработали 63 образца пациентов, характеристики этих образцов суммированы в таблицах 1 и 2. Полные профили получили для 43 образцов, а для еще девяти (9) получили неполные профили (из-за недостаточного количества клеток для выполнения всего анализа). Оставшиеся одиннадцать (11) образцов были недостаточного качества для проведения какого-либо анализа профиля BH3, либо из-за плохого отношения сигнал/шум (клетки уже до начала анализа были апоптотическими), либо из-за недостаточного количества клеток. Все последующие анализы проводили только на тех образцах, для которых были успешно получены какие-либо профили BH3 (итоговое количество n=52).
Значения клинических переменных, оцененные у пациентов, сравнивали с ответом на лечение, чтобы определить, какие из этих переменных связаны с тем, ответит ли пациент на лечение или нет (таблица 3). Единственной переменной, для которой нашли значимую корреляцию с CR, является группа цитогенетического риска, а именно, пациенты, отнесенные к неблагоприятной группе, реже реагировали на лечение. Корреляции с ответом на лечение количества лейкоцитов, наличия в анамнезе МДС и того, какой протокол соблюдался, были близки к значимым, при этом большее количество лейкоцитов и наличие в анамнезе МДС коррелировали с демонстрацией ответа на лечение. В протоколе J0856 наблюдали более высокий показатель CR (13 CR у 25 пациентов), чем в J1101 (8 из 25), а в протоколе J0669 было только два пациента, для которых были успешно получены профили BH3. Возраст, процент бластных клеток в костном мозге и мутационный статус NPM/FLT-3 не проявляли значимых корреляций с ответом на лечение в этом наборе данных.
Таблица 3: Корреляция клинических характеристик с ответом на лечение
Все данные о профилях BH3 отдельных пациентов суммированы в таблицах 4 и 5, в которых подробно показана способность каждого пептида BH3 индуцировать деполяризацию митохондрий в бластных клетках. Из показанных ответов на обработку видно, что пептид BIM 100 мкМ показывает самое высокое медианное значения процента деполяризации (99,2%), а NOXA показывает самое низкое значение (16,0%). Профили отдельных BH3 пептидов сравнивали между пациентами, ответившими на лечение (CR), и не ответившими (NR), результаты сравнения показаны в таблице 6. Ни один из пептидов не показал значимой корреляции с ответом на лечение; однако p-значение корреляции пептида BAD достигло 0,09, но при этом значение AUC составило только 0,65. Это указывает на то, что при использовании всего набора пациентов ни один из BH3 пептидов по отдельности не является достаточным для определения пациентов, которые ответят на схему лечения, включающую прием альвоцидиба, такую как схема FLAM.
Таблица 4: Данные профилей BH3
Таблица 5: Корреляция профилей отдельных BH3 пептидов с CR
Таблица 6: Многофакторный анализ профилей BH3 пептидов и других клинических переменных
Группа цитогенетичес-кого риска
Группа цитогенетичес-кого риска+Наличие в анамнезе МДС
Затем проводили многофакторный анализ для сравнения пептидов BH3 с профилями других пептидов BH3 и с клиническими переменными (таблица 7). Этот анализ показал наличие корреляции с высоким уровнем значимости между BIM 100 мкМ плюс BAD плюс PUMA и ответом на лечение, c p-значением 0,009 и AUC 0,732 (фиг. 1). Если эти три пептида объединить с группой цитогенетического риска, то p-значение становится 0,0001, а AUC достигает 0,84. Дальнейшее добавление наличия в анамнезе MDS к анализу дополнительно увеличивает значимость, с p-значением 0,0001 и AUC 0,85. Использование только группы цитогенетического риска дает значение AUC 0,60 (группа цитогенетического риска плюс наличие в анамнезе МДС дают AUC 0,72). Это указывает на то, что добавление профиля BH3 пептида в анализ значительно увеличивает способность идентифицировать тех пациентов, которые ответят на альвоцидиб (например, FLAM). При идеальном пороге (индекс Юдена) при использовании данных о профиле BH3 пептида вместе с группой цитогенетического риска и наличием в анамнезе МДС анализ показывает чувствительность 89,5% и специфичность 76% в определении пациентов, которые ответили на лечение в данном исследовании. Это указывает на то, что использование данных об ответе на обработку BH3 пептидами для этих трех пептидов вместе с клинической информацией может быть полезным для прогноза лечения альвоцидибом.
Таблица 7: Корреляция профилей отдельных BH3 пептидов в образцах костного мозга с CR
В ходе данного исследования также оценили другие факторы, которые могут влиять на ответ на обработку BH3 пептидами. Поскольку из источников лейкемических клеток (то есть периферической крови или костного мозга) могут потенциально выделяться различные популяции клеток, то мы провели отдельный анализ только тех образцов, которые были получены из костного мозга пациентов. В таблице 8 показана корреляция каждого BH3 пептида с ответом на лечение при анализе только образцов костного мозга. В этом подмножестве образцов ответ на обработку NOXA значимо (p=0,006) выше у пациентов, отвечающих на лечение, по сравнению с пациентами, не отвечающими на лечение, (44,5% и 5,2% соответственно), при этом значение AUC достигает 0,805 (фиг. 2 и фиг. 3). Ни один из других пептидов по отдельности не показал значимую связь с ответом на лечение в образцах костного мозга. При выборе порогового значения ответа на обработку NOXA в 10,78% тест демонстрирует чувствительность 92% и специфичность 67%. Ответ на обработку NOXA 15% или более показывает корреляцию с высокой вероятностью ответа на лечение альвоцидибом (например, FLAM), в то время как ответ на обработку NOXA около 30% или более предсказывает почти 100% ответ на схемы лечения, включающие прием альвоцидиба. Добавление ответа на обработку NOXA к группе цитогенетического риска и наличию в анамнезе МДС увеличивает способность теста прогнозировать ответ на лечение и дает значение AUC 0,92 с чувствительностью 92% и специфичностью 80% при идеальном пороговом значении (таблица 8 и фиг. 3).
Таблица 8: Статистический анализ BH3 пептидов, выполненный только для образцов, полученных из костного мозга
Результаты этого исследования показывают, что профилирование BH3 может оказаться полезным при идентификации пациентов, которые могут реагировать на лечение альвоцидибом, такое как схема лечения FLAM. При анализе всего набора данных видно, что хотя BH3 пептиды по отдельности не коррелируют с ответом на лечение, комбинации нескольких пептидов (BIM, BAD и PUMA) демонстрируют сильную корреляцию с ответом на альвоцидиб. Эти несколько пептидов в данном исследовании показали корреляцию с ответом на лечение как в образцах костного мозга, так и в образцах периферической крови. То, что эти данные являются аддитивными по отношению к известным факторам риска пациентов, является очень благоприятным для задания алгоритма, переводящего цитогенетический статус, вместе с наличием у пациента в анамнезе МДС в единую метрику, которую можно использовать для прогнозирования ответа пациента на лечение.
Еще один интересный вывод этого исследования заключается в том, что хотя ответ на NOXA не показал значимой корреляции с ответом на схему FLAM в анализе всего набора данных, в анализе только образцов костного мозга он показал очень сильную корреляцию с ответом на лечение. Поскольку нишей опухолевых клеток ОМЛ является костный мозг, неудивительно, что профили BH3 в периферической крови отличаются от таковых в костном мозге, поскольку фенотипические маркеры бластных клеток могут различаться в периферической крови и в костном мозге (1,2). Кроме того, ранее было показано, что строма костного мозга придает клеткам ОМЛ устойчивость к различным методам лечения посредством непосредственного контакта с клеткой и посредством растворимых факторов, присутствующих в костном мозге (3). Так как при взятии образца костного мозга потенциально отбираются бластные клетки ОМЛ, растворимые факторы и, возможно, подлинные стромальные клетки, то анализ ответа на обработку BH3 пептидами в костном мозге может представлять собой более прямой тест лейкемических клеток в их нормальном контексте. Ранее в исследованиях наблюдались функциональные различия при лечении ОМЛ монотерапией ингибитором FLT3-киназы, заключающиеся в том, что лечение приводило к исчезновению циркулирующих бластных клеток в перефирической крови, в то время как воздействие на бластные клетки костного мозга было минимальным (4). Ответ на NOXA возможно демонстрирует сходные функциональные различия, при этом обработка NOXA приводит к освобождению соединений, связанных Mcl-1, и приводит к апоптозу, что позволят идентифицировать раковые опухоли, способные отвечать на FLAM.
Оба алгоритма, сформулированных в настоящем исследовании, а именно, учитывающий ответ на NOXA и учитывающий ответ на [BAD+BIM 100+PUMA], могут идентифицировать раковые клетки, зависящие от Mcl-1. Клетка, дающая сильный апоптотический ответ на обработку NOXA, считается зависящей от Mcl-1, в то время как сильный ответ на пептид Bad указывает на то, что Bcl-xL или Bcl-2 обеспечивают апоптотический блок в клетке. Поскольку PUMA может отражать зависимость от ряда белков семейства Bcl-2, то алгоритм, лежащий в основе [BAD+BIM 100+PUMA], на самом деле представляет собой PUMA - BAD - BIM100; на самом деле оба этих показания могут эффективно измерять степень зависимости от Mcl-1 и пациенты, реагирующие на схему лечения, включающую прием альвоцидиба, такую как схема FLAM, могут быть зависимыми от Mcl-1. Соответственно, повышенный уровень экспрессии MCL-1 в раковых клетках пациента предположительно связан с высокой вероятностью ответа на альвоцидиб.
Пример 2
Алгоритм для выбора между схемой лечения FLAM, и традиционной схемой лечения 7+3.
Ответ на обработку BIM 0.1 в образах костного мозга или периферической крови пациентов с ОМЛ сравнивали с ответом на схему лечения 7+3 (цитрабин плюс антрациклин); См. Pierceall, et al. ʺBH3 Profiling Discriminates Response to Cytarabine-based Treatment of Acute Myelogenous Leukemiaʺ Molecular Cancer Therapeutics. Как обсуждалось выше, ответ на обработку NOXA в образцах костного мозга коррелирует с ответом на схему лечения FLAM (альвоцидиб, ara-C, митоксантрон). Мы исследовали, какой алгоритм способен определить какую схему лечения лучше использовать FLAM или 7+3 для пациентов, ранее не получавших лечения.
Используя ответ на BIM 0.1 можно прогнозировать ответ на 7+3 при анализе набора образцов BM с значением AUC 0,80 и чувствительностью и специфичностью равными 64,3% и 100% соответственно. Однако в тех же образцах ответ на NOXA по существу не имеет прогностической способности и дает величину AUC 0,54, с чувствительностью 42,9% и специфичностью 100%. См. фиг 5. (по сравнению с AUC 0,81 и 92%/67% чувствительности/специфичности в случае лечения FLAM). Это указывает на то, что ответ на обработку NOXA, измеренный в клетках костного мозга, взятых у пациентов с ОМЛ, не получавших лечение, коррелирует с ответом на FLAM и не коррелирует с ответом на 7+3, и что ответ на обработку BIM 0.1 в образцах периферической крови пациентов с ОМЛ, протестированых до начала лечения, коррелирует с ответом на 7+3 и не коррелирует с ответом на FLAM.
Дальнейшее исследование ответа на обработку NOXA в сравнении с ответом на обработку BIM 0.1 показало, что существуют подклассы пациентов с значениями ответов на обработку, указывающими, что пациент вряд ли ответит на лечение одним средством, но вероятно ответит на лечение другим. На фиг. 6 показан ответ на обработку NOXA в сравнении с ответом на обработку BIM 0,1 в образцах костного мозга из исходного исследования 7+3 (n=23). Данные, показанные на на фиг. 6, обеспечивают способ выбора между стратегиями лечения рака для пациента с ОМЛ, проходящего подготовку к лечению, путем сравнения ответа на обработку NOXA в образце костного мозга с ответом на обработку BIM 0,1 в образце периферической крови (PB) пациента. Если BM NOXA > 10,8% и BM/PB BIM 0,1<35%, то пациент является кандидатом на лечение FLAM. Если BM NOXA составляет < 10,8%, а BM/PB BIM 0,1 > 15%, то пациент является кандидатом на лечение 7+3. Пациент также является кандидатом на лечение 7+3 если BM NOXA < 10,8% и BM/PB BIM 0,1 > 35%. Наконец, если BM NOXA < 10,8% и BM/PB BIM 0,1<15%, то пациент не является кандидатом ни для лечения FLAM, ни для лечения 7+3.
Пример 3
Альвоцидиб снижает уровень экспрессии мРНК MCL-1 в клетках MV-411 времязависимым и дозазависимым образом
Клеточная линия ОМЛ, MV-4-11, экспрессирует MCL-1. MCL-1 является ключевым антиапоптотическим белком в клетках MV-4-11. Альвоцидиб, ингибитор CDK9, снижает уровень экспрессии мРНК MCL-1, что уже хорошо описано в литературе. Альвоцидиб снижает уровень экспрессии мРНК MCL-1 в клетках MV-4-11 дозозависимым образом (фиг. 7A). Зависимость от дозы наблюдали путем мониторинга относительного уровня экспрессии мРНК MCL-1 по сравнению с контролем в клетках, обрабатываемых альвоцидибом в концентрациях 0-8 мкМ. Клетки MV-4-11 обрабатывали альвоцидибом в течение 2 часов in vitro. После обработки клетки собирали и обрабатывали, используя стандартный анализ ПЦР в реальном времени (РВ-ПЦР), для определения изменения количества мРНК MCL-1 относительно контролей.
Кроме того, альвоцидиб также снижает уровень экспрессии мРНК MCL-1 в клетках MV-4-11 времязависимым образом (рисунок 7B). Зависимость от времени наблюдали путем мониторинга относительного уровня экспрессии мРНК MCL-1 по сравнению с контролем в течении некоторого времени. Относительный уровень экспрессии мРНК MCL-1 измеряли в диапазоне времени 0,5-16 часов после введения дозы 100 нМ альвоцидиба.
Клетки MV-4-11 обрабатывали 100 нМ альвоцидиба in vitro в течение времени, указанного на фиг.7В. После обработки клетки собирали и обрабатывали, используя стандартный анализ РВ-ПЦР, для определения уровня экспрессии мРНК MCL-1. Альвоцидиб уменьшал уровень экспрессию мРНК MCL-1 уже через 30 минут после обработки. Анализ относительного уровня экспрессии мРНК MCL-1 показал, что альвоцидиб снижает уровень экспрессии мРНК MCL-1 в клетках MV-4-11.
Пример 4
Альвоцидиб снижает уровень экспрессии мРНК MCL-1 в клетках A549 дозозависимым образом и уровень экспрессии онкогенных белков времязависимым образом
Линия клеток A549 представляет собой клеточную линию аденокарциномы человека, экспрессирующую MCL-1. Альвоцидиб снижает уровень экспрессии мРНК MCL-1 в клетках A549 дозозависимым образом (фиг. 8). Зависимость от дозы наблюдали путем мониторинга относительного уровня экспрессии мРНК MCL-1 по сравнению с контролем в клетках, обработанных альвоцидибом в концентрациях 0-8 мкМ. Клетки A549 обрабатывали альвоцидибом в течение 2 часов in vitro. После обработки клетки собирали и обрабатывали, используя стандартный анализ РВ-ПЦР, для определения изменения уровня экспрессии мРНК MCL-1 относительно контролей.
Кроме того, альвоцидиб также снижает уровень экспрессии MCL-1 в клетках A549 времязависимым образом (рис. 9A-B). Временную зависимость наблюдали, измеряя изменение относительного уровня экспрессии MCL-1, Bcl-xL и Bcl-2 по сравнению с β-актином с течением времени. Относительный уровень экспрессии MCL-1, Bcl-xL и Bcl-2 измеряли в промежутке времени 0-96 часов после обработки дозой 350 нМ альвоцидиба. В одной группе после 24 часов обработки среду удаляли и заменяли свежей средой, содержащей 350 нМ альвоцидиба (то есть, проводили стадию промывки, см. фиг. 9А).
Клетки A549 обрабатывали 350 нМ альвоцидиба in vitro в течение времени, указанного на фиг.9А-В. После обработки (и стадии промывки, в соответствующих случаях) клетки собирали и обрабатывали, используя стандартные способы иммуноблоттинга, для обнаружения экспрессии MCL-1, Bcl-xL и Bcl-2. Анализ относительного уровня экспрессия MCL-1, Bcl-xL и Bcl-2 по сравнению с β-актином показал, что альвоцидиб снизил уровень экспрессии онкогенных белков в клетках A549.
Пример 5
Альвоцидиб снижает уровень экспрессии онкогенного белка в клетках MV-4-11 в зависимости от времени и дозы
Альвоцидиб снижает уровень экспрессии MCL-1 в клетках MV-4-11 дозозависимым образом (фиг. 10А). Зависимость от дозы наблюдали путем мониторинга относительного уровня экспрессии мРНК MCL-1 по сравнению с β-актином в клетках, обработанных альвоцидибом в концентрациях 0-8 мкМ. Клетки MV4-11 обрабатывали альвоцидибом в течение 2 часов in vitro. После обработки клетки собирали и обрабатывали, используя стандартный анализ РВ-ПЦР, для определения изменения уровня экспрессии мРНК MCL-1 относительно β-актина.
Кроме того, альвоцидиб также снижает уровень экспрессии MCL-1 в клетках MV4-11 времязависимым образом (рис. 10B). Временную зависимость наблюдали, измеряя изменение относительного уровня экспрессии MCL-1, Bcl-xL и Bcl-2 по сравнению с β-актином с течением времени. Относительный уровень экспрессии MCL-1, Bcl-xL и Bcl-2 измеряли в диапазоне времени 1-96 часов после обработки дозой 80 нМ альвоцидиба.
MV4-11 обрабатывали 80 нМ альвоцидиба in vitro в течение времени, указанного на фиг. 10B. После обработки клетки отбирали и подготавливали с использованием стандартных способов иммуноблоттинга для обнаружения экспрессии MCL-1, Bcl-xL и Bcl-2. Анализ относительного уровня экспрессии MCL-1, Bcl-xL и Bcl-2 по сравнению с β-актином показал, что альвоцидиб снизил уровень экспрессии онкогенных белков в клетках MV-4-11.
Пример 6
Альвоцидиб снижает уровень экспрессии N-Myc в клетках SK-N-AS времязависимым образом
Клетки SK-N-AS представляют собой клеточную линию нейробластомы человека, экспрессирующую N-Myc, являющийся ключевым онкогенным белком. Альвоцидиб снижает уровень экспрессии N-Myc в клетках SK-N-AS времязависимым образом (фиг. 11). Временную зависимость наблюдали, измеряя изменение относительной экспрессии N-Myc по сравнению с β-актином с течением времени. Относительный уровень экспрессии N-Myc измеряли в диапазоне времени 1-24 часа после обработки дозой 300 нМ альвоцидиба.
Клетки SK-N-AS обрабатывали 300 нМ альвоцидиба in vitro в течение времени, указанного на фиг. 11. После обработки клетки отбирали и подготавливали с использованием стандартных способов иммуноблоттинга для обнаружения экспрессии N-Myc. Анализ относительного уровня экспрессии N-Myc показал, что альвоцидиб снизил уровень экспрессии N-Myc в клетках SK-N-AS.
Пример 7
Альвоцидиб снижает уровень экспрессии MCL-1 времязависимым образом в клетках A549 при использовании схемы с повторным дозированием
Альвоцидиб снижает уровень экспрессии MCL-1 в клетках A549 времязависимым образом (фиг. 12). Временную зависимость наблюдали, измеряя изменение относительного уровня экспрессии MCL-1, Bcl-xL и Bcl-2 по сравнению с β-актином с течением времени. Относительный уровень экспрессии MCL-1, Bcl-xL и Bcl-2 измеряли в промежутке времени 0-96 часов после обработки дозой 350 нМ альвоцидиба.
Клетки обрабатывали 3 раза (три периода по 24 часа, разбитые двумя 24 часовыми перерывами) дозой 350 нМ альвоцидиба in vitro. После обработки клетки отбирали и подготавливали с использованием стандартных способов иммуноблоттинга для обнаружения экспрессии MCL-1, Bcl-xL и Bcl-2. Анализ относительного уровня экспрессии MCL-1, Bcl-xL и Bcl-2 по сравнению с β-актином показал, что альвоцидиб снизил уровень экспрессии онкогенных белков в клетках A549.
Пример 8
Альвоцидиб снижает уровень экспрессии онкогенного белка в клетках Panc-1 времязависимым образом
Линия клеток Panc-1 представляет собой клеточную линию рака поджелудочной железы человека, экспрессирующую MCL-1. Альвоцидиб снижает уровень экспрессии онкогенного белка в клетках Panc-1 времязависимым образом. Временную зависимость наблюдали, измеряя изменение относительного уровня экспрессии MCL-1, Bcl-xL и Bcl-2 по сравнению с β-актином с течением времени. Относительный уровень экспрессии MCL-1, Bcl-xL и Bcl-2 измеряли в промежутке времени 0-96 часов после обработки дозой 730 нМ альвоцидиба. В одной группе после 24 часов обработки среду удаляли и заменяли свежей средой, содержащей 730 нМ альвоцидиба (то есть, проводили стадию промывки, см. фиг. 13А).
Клетки Panc-1 обрабатывали 730 нМ альвоцидиба in vitro в течение времени, указанного на фиг. 13А-В. После обработки (и стадии промывки, в соответствующих случаях) клетки собирали и обрабатывали, используя стандартные способы иммуноблоттинга, для обнаружения экспрессии MCL-1, Bcl-xL и Bcl-2. Анализ относительного уровня экспрессии MCL-1, Bcl-xL и Bcl-2 по сравнению с β-актином показал, что альвоцидиб снизил уровень экспрессии онкогенного белка в клетках Panc-1.
Пример 9
Альвоцидиб снижает уровень экспрессии онкогенных белков времязависимым образом в клетках Panc-1 при использовании схемы с повторным дозированием
Альвоцидиб снижает уровень экспрессии MCL-1 в клетках Panc-1 времязависимым образом (фиг. 14) при использовании схемы с повторным дозированием. Временную зависимость наблюдали, измеряя изменение относительного уровня экспрессии MCL-1, Bcl-xL и Bcl-2 по сравнению с β-актином с течением времени. Относительный уровень экспрессии MCL-1, Bcl-xL и Bcl-2 измеряли в промежутке времени 0-96 часов после обработки дозой 730 нМ альвоцидиба.
Клетки обрабатывали 3 раза (три периода по 24 часа, разбитые двумя 24 часовыми перерывами) дозой 730 нМ альвоцидиба in vitro. После обработки клетки отбирали и подготавливали с использованием стандартных способов иммуноблоттинга для обнаружения экспрессии MCL-1, Bcl-xL и Bcl-2. Анализ относительного уровня экспрессии MCL-1, Bcl-xL и Bcl-2 по сравнению с β-актином показал, что альвоцидиб снизил уровень экспрессии онкогенных белков в клетках Panc-1.
Пример 10
Альвоцидиб снижает уровень экспрессии онкогенного белка в клетках Yugen8 времязависимым образом
Линия клеток Yugen8 представляет собой клеточную линию рака кожи человека, экспрессирующую MCL-1. Альвоцидиб снижает уровень экспрессии MCL-1 в клетках Yugen8 зависящим от времени образом. Временную зависимость наблюдали, измеряя изменение относительного уровня экспрессии MCL-1, Bcl-xL и Bcl-2 по сравнению с β-актином с течением времени. Относительный уровень экспрессии MCL-1, Bcl-xL и Bcl-2 измеряли в промежутке времени 0-96 часов после обработки дозой 280 нМ альвоцидиба. В одной группе после 24 часов обработки среду удаляли и заменяли свежей средой, содержащей 280 нМ альвоцидиба (то есть, проводили стадию промывки, см. фиг. 15А).
Клетки Yugen8 обрабатывали 280 нМ альвоцидиба in vitro в течение времени, указанного на фиг. 15А-В. После обработки (и стадии промывки, в соответствующих случаях) клетки собирали и обрабатывали, используя стандартные способы иммуноблоттинга, для обнаружения экспрессии MCL-1, Bcl-xL и Bcl-2. Анализ относительного уровня экспрессии MCL-1, Bcl-xL и Bcl-2 по сравнению с β-актином показал, что альвоцидиб снизил уровень экспрессии онкогенных белков в клетках Yugen8.
Пример 11
Альвоцидиб снижает уровень экспрессии онкогенного белка в клетках Yugen8 времязависимым образом при использовании схемы с повторным дозированием
Альвоцидиб снижает уровень экспрессии MCL-1 в клетках Yugen8 времязависимым образом (фиг. 16) при использовании схемы с повторным дозированием. Временную зависимость наблюдали, измеряя изменение относительного уровня экспрессии MCL-1, Bcl-xL и Bcl-2 по сравнению с β-актином с течением времени. Относительный уровень экспрессии MCL-1, Bcl-xL и Bcl-2 измеряли в промежутке времени 0-96 часов после обработки дозой 280 нМ альвоцидиба.
Клетки обрабатывали 3 раза (три периода по 24 часа, разбитые двумя 24 часовыми перерывами) дозой 280 нМ альвоцидиба in vitro. После обработки клетки отбирали и подготавливали с использованием стандартных способов иммуноблоттинга для обнаружения экспрессии MCL-1, Bcl-xL и Bcl-2. Анализ относительного уровня экспрессии MCL-1, Bcl-xL и Bcl-2 по сравнению с β-актином показал, что альвоцидиб снизил уровень экспрессии онкогенных белков в клетках Yugen8.
Пример 12
Альвоцидиб подавляет экспрессию MCL-1 при использовании в комбинации ACM (или FLAM)
Альвоцидиб подавляет гены, регулируемые суперэнхансерным комплексом, включая снижение экспрессии MCL-1, при применении схемы ACM (или FLAM), как следует из моделей in vitro (фиг. 17A).
Клетки MV-4-11 обрабатывали 80 нМ альвоцидиба, 1 мкМ палбоциклиба или 50 нМ динациклиба in vitro. Каждую обработку дозировали для достижения средней эффективной концентрации EC 50 на 24-х часовых интервалах, как показано на фиг. 17A. После обработки клетки отбирали и подготавливали с использованием стандартных способов иммуноблоттинга для обнаружения MCL-1. Анализ относительного уровня экспрессии MCL-1 по сравнению с β-актином показал как различные способы лечения снижают уровень экспрессии MCL-1 в клетках MV-4-11 (фиг. 17B).
Специалистам в данной области техники будут понятны, или они смогут выявить, используя не более чем рутинные эксперименты, многочисленные эквиваленты конкретным вариантам осуществления, описанным в настоящем документе. Такие эквиваленты подразумеваются входящими в объем вариантов осуществления настоящего изобретения.
Список литературы
1 Rezaei, A., et al. "Leukemia Markers Expression of Peripheral Blood Vs Bone Marrow Blasts Using Flow Cytometry." Med Sci Monit. 9.8 (2003): 359-362.2.
2 Almarzooqi, S., et al. ʺComparison of Peripheral Blood versus Bone Marrow Blasts Immunophenotype in Pediatric Acute Leukemias." Ibnosina J Med BS 195-204.
3 Zeng, Z., et al. "Targeting the Leukemia Microenvironment by CXCR4 Inhibition Overcomes Resistance to Kinase Inhibitors and Chemotherapy in AML." Blood 113.24 (2009): 6215-6224.
4 Yang, X. "Bone Marrow Stroma-mediated Resistance to FLT3 Inhibitors in FLT3-ITD AML Is Mediated by Persistent Activation of Extracellular Regulated Kinase." Br. J Haematol. 164.1 (2014): 61-72.
Содержания всех патентов США, патентных публикаций США, заявок на патент США, иностранных патентов, заявок на иностранные патенты и непатентных публикаций, упомянутых в настоящем описании, или в прилагаемом информационном листке заявки, включены в настоящее описание посредством ссылки во всей их полноте в той степени, которая не противоречит настоящему описанию.
Из вышесказанного следует понимать, что, хотя в иллюстративных целях в настоящем документе описаны конкретные варианты осуществления изобретения, тем не менее могут быть сделаны различные модификации без отклонения от сущности и объема изобретения. Соответственно, изобретение не ограничено ничем, кроме прилагаемой формулы изобретения.
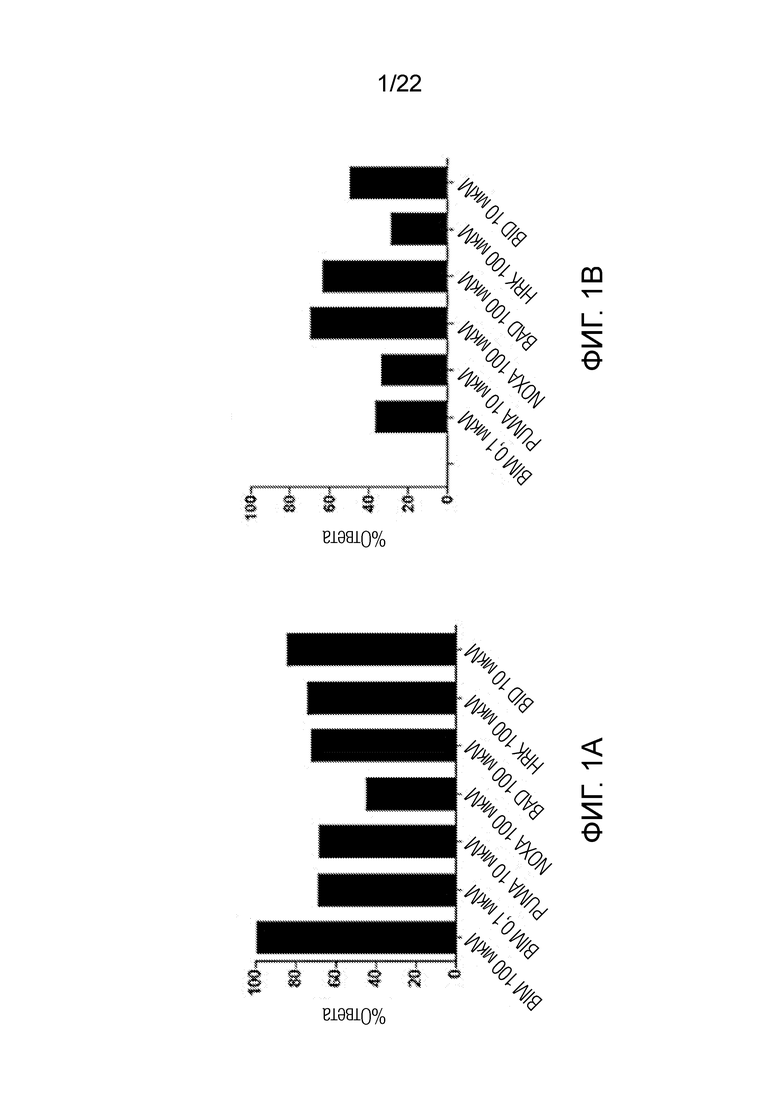
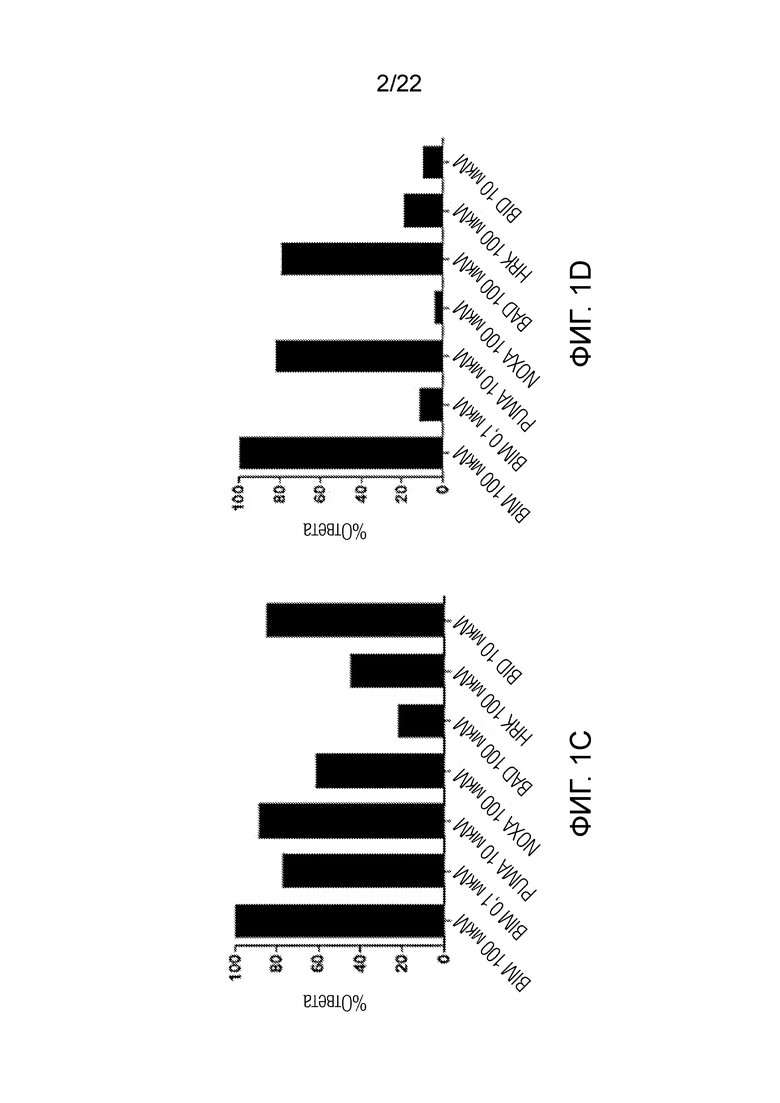
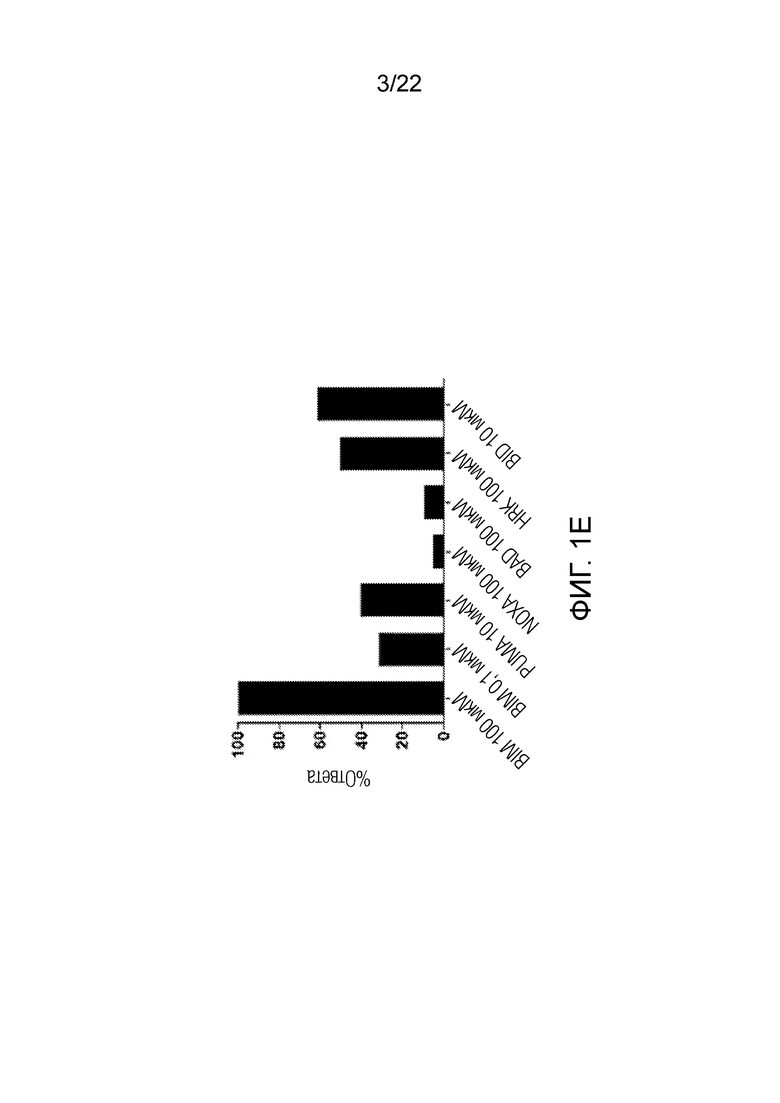

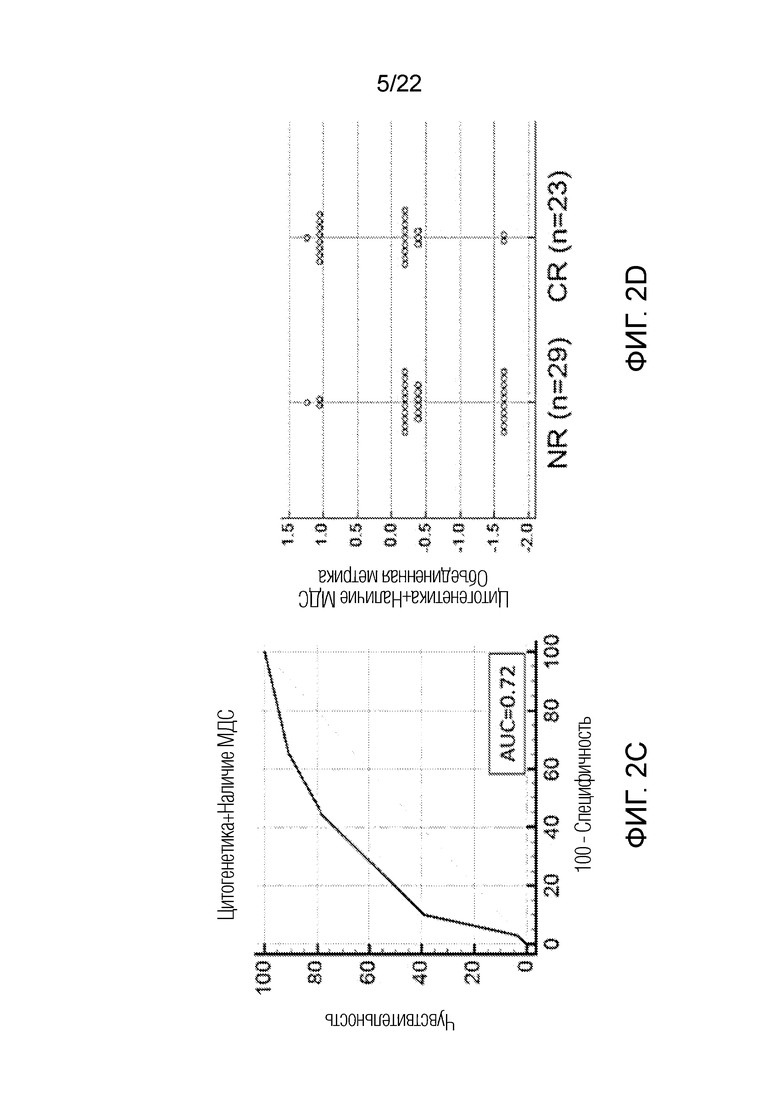
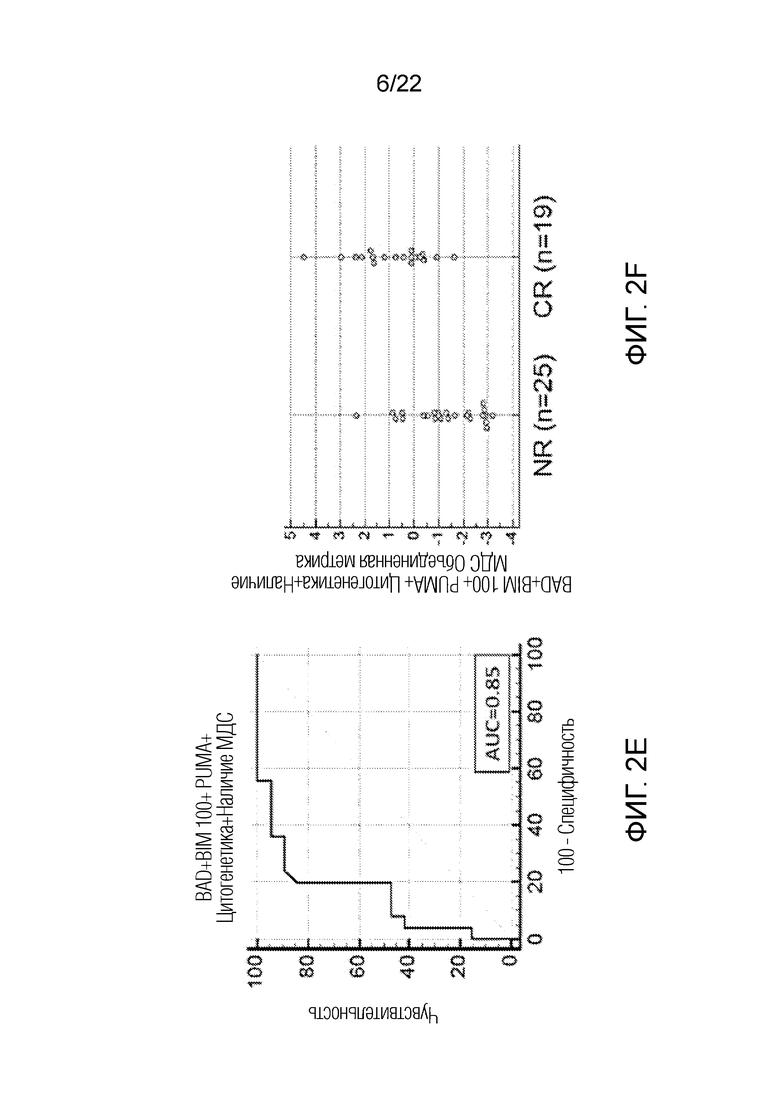

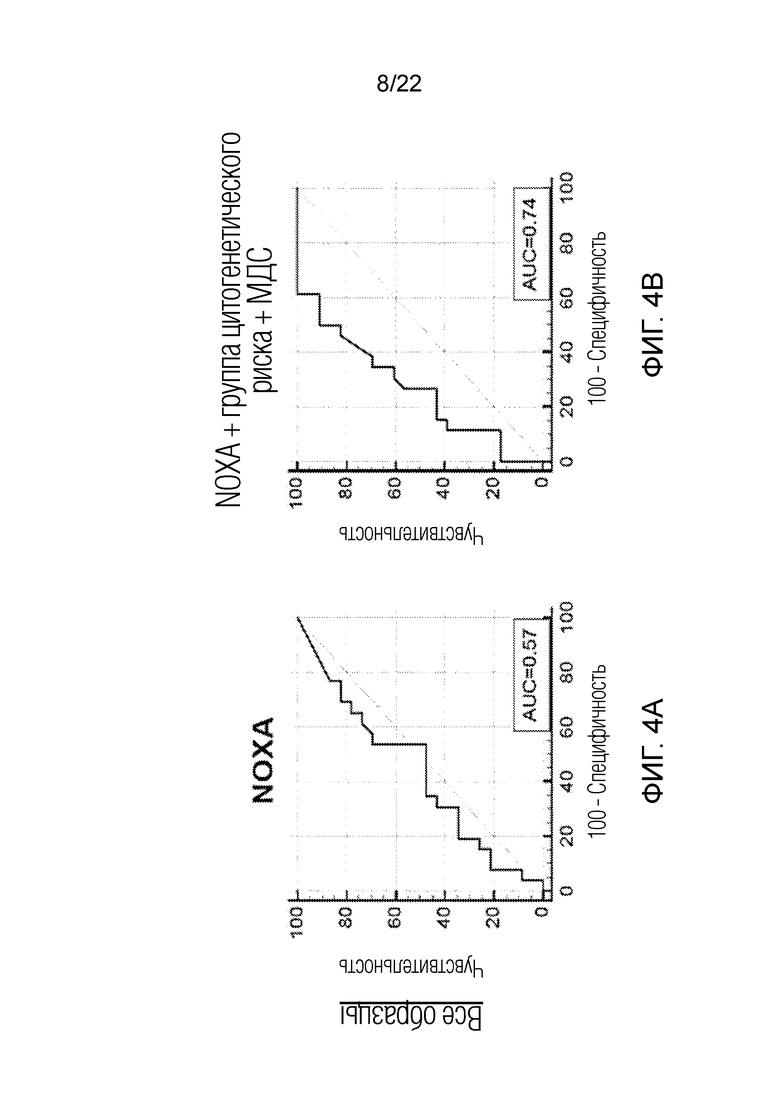
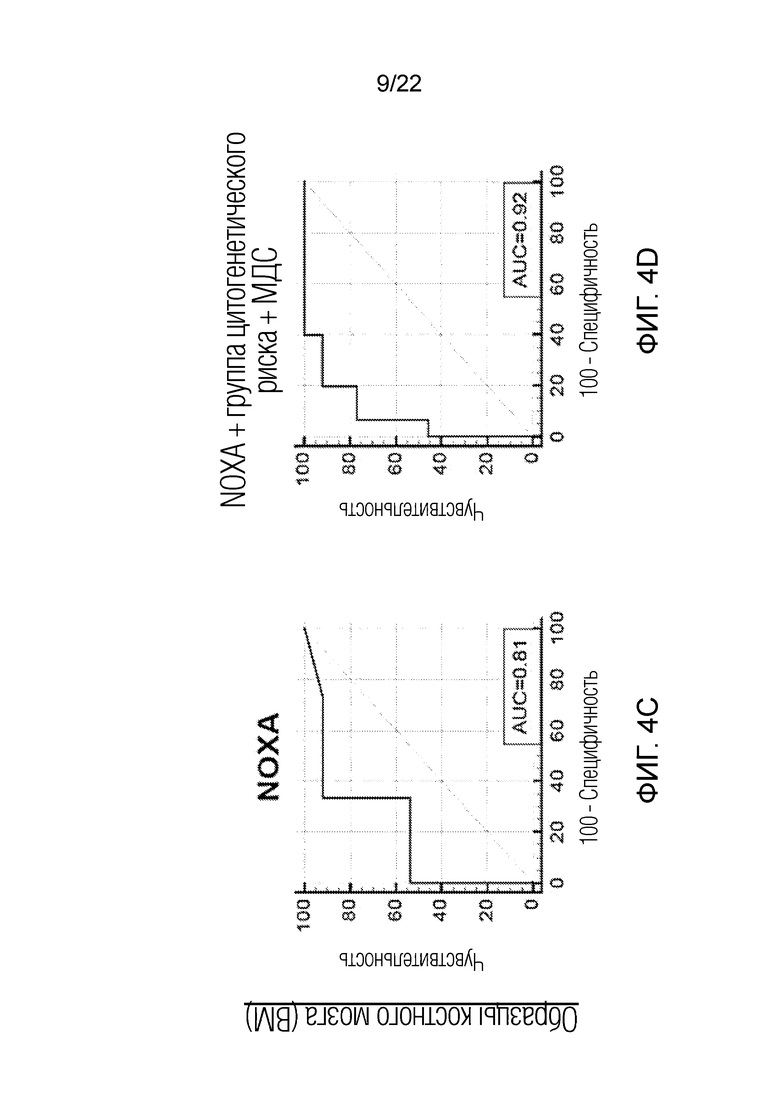
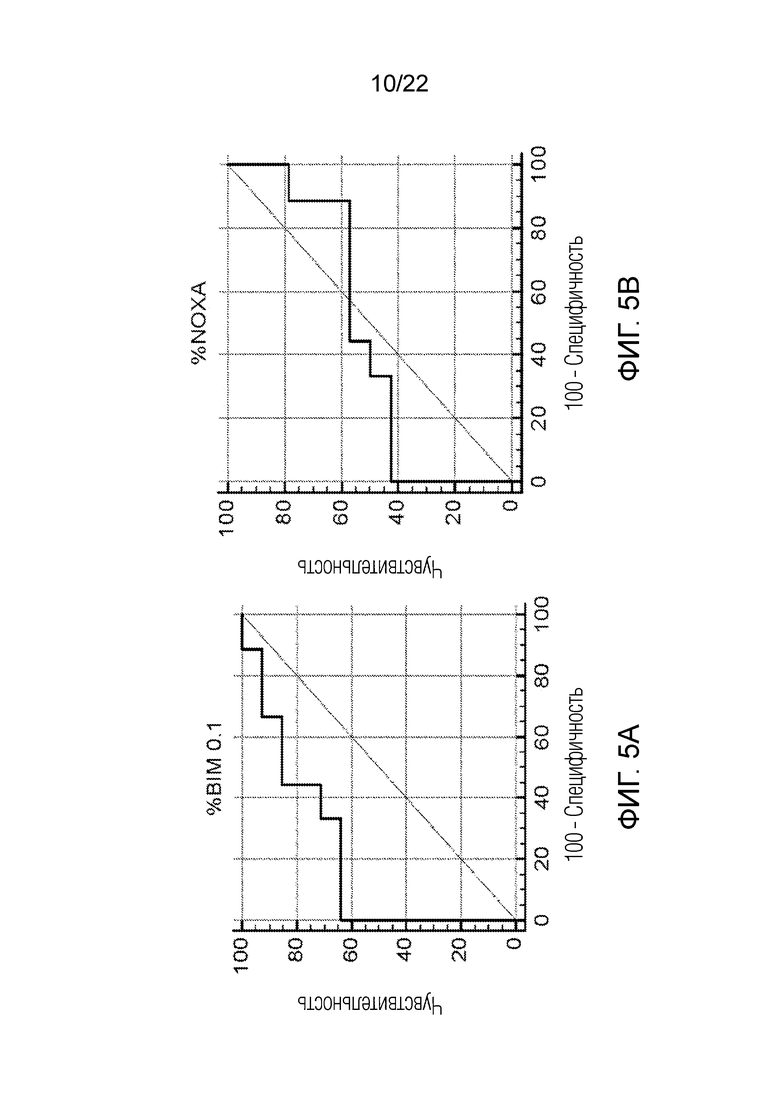
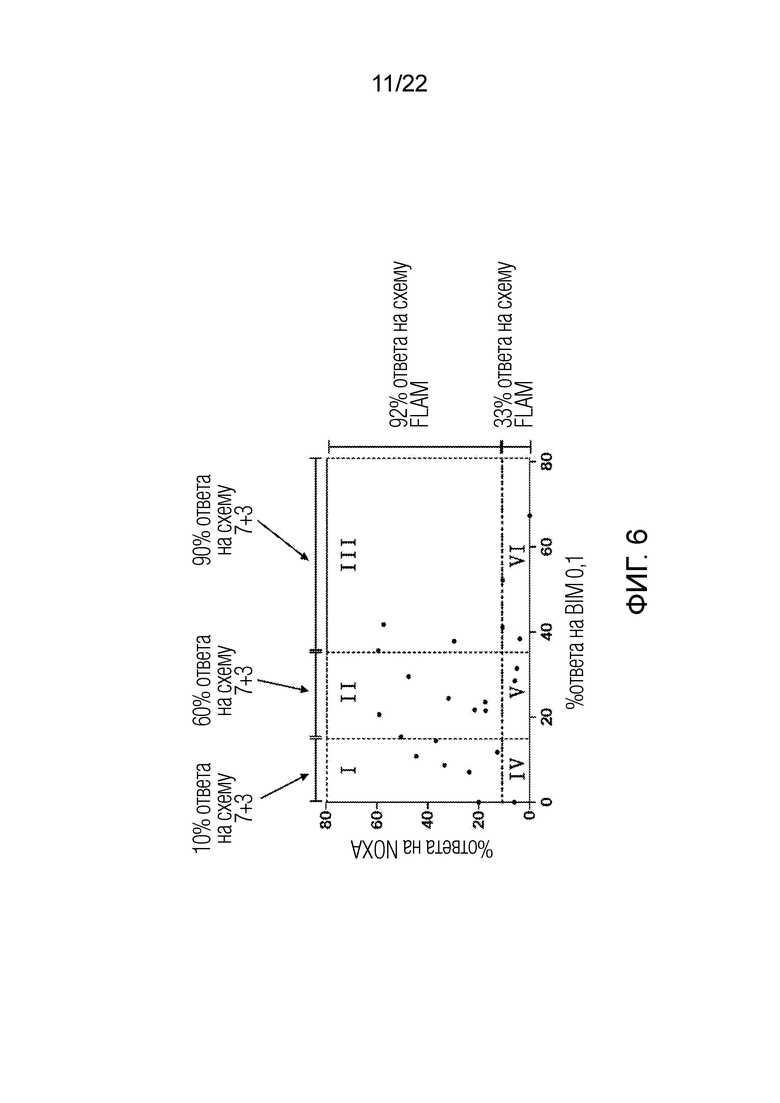
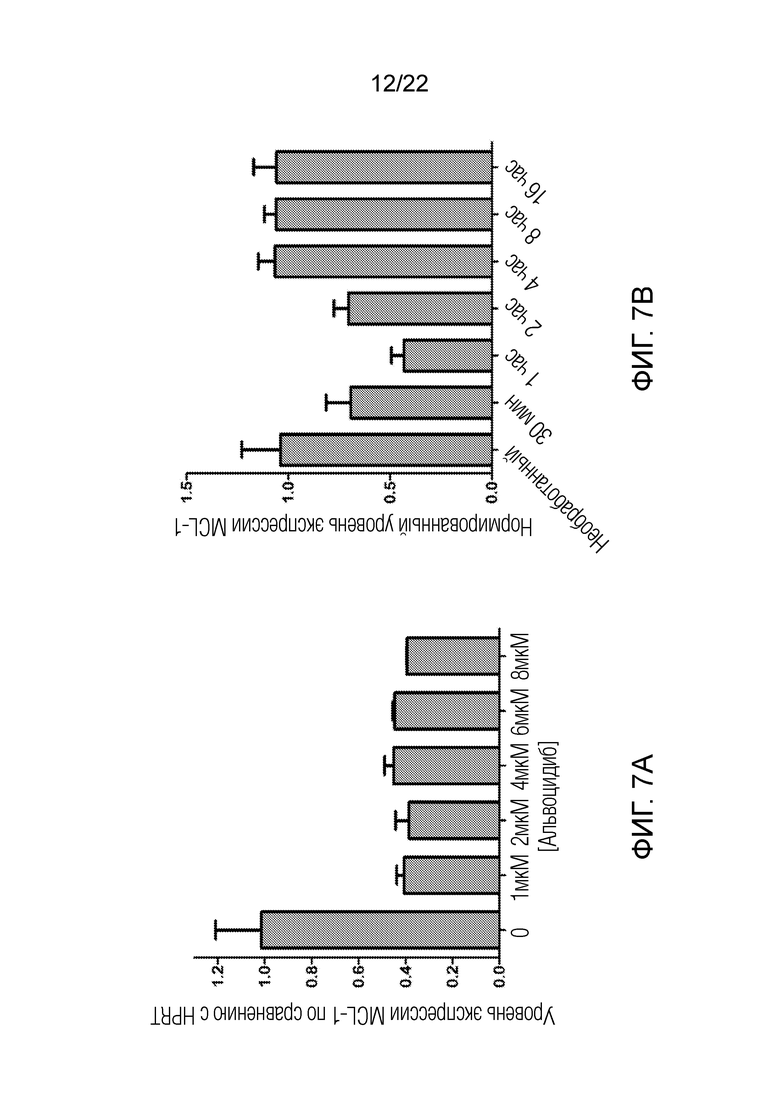
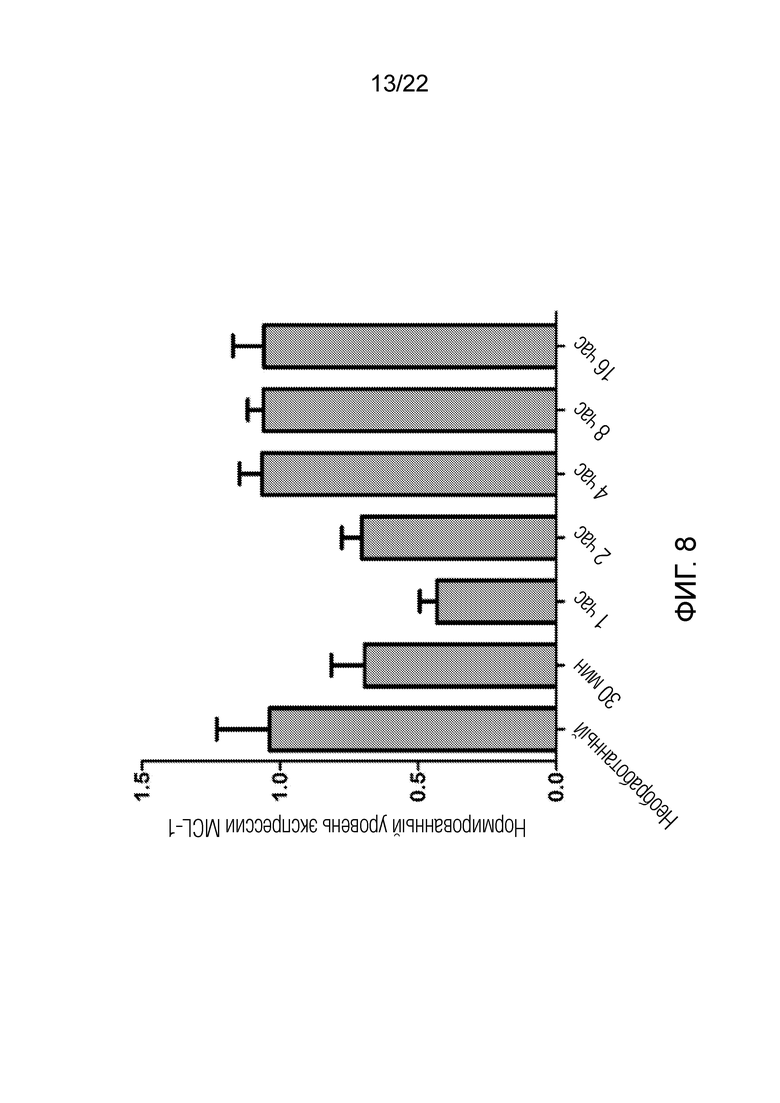

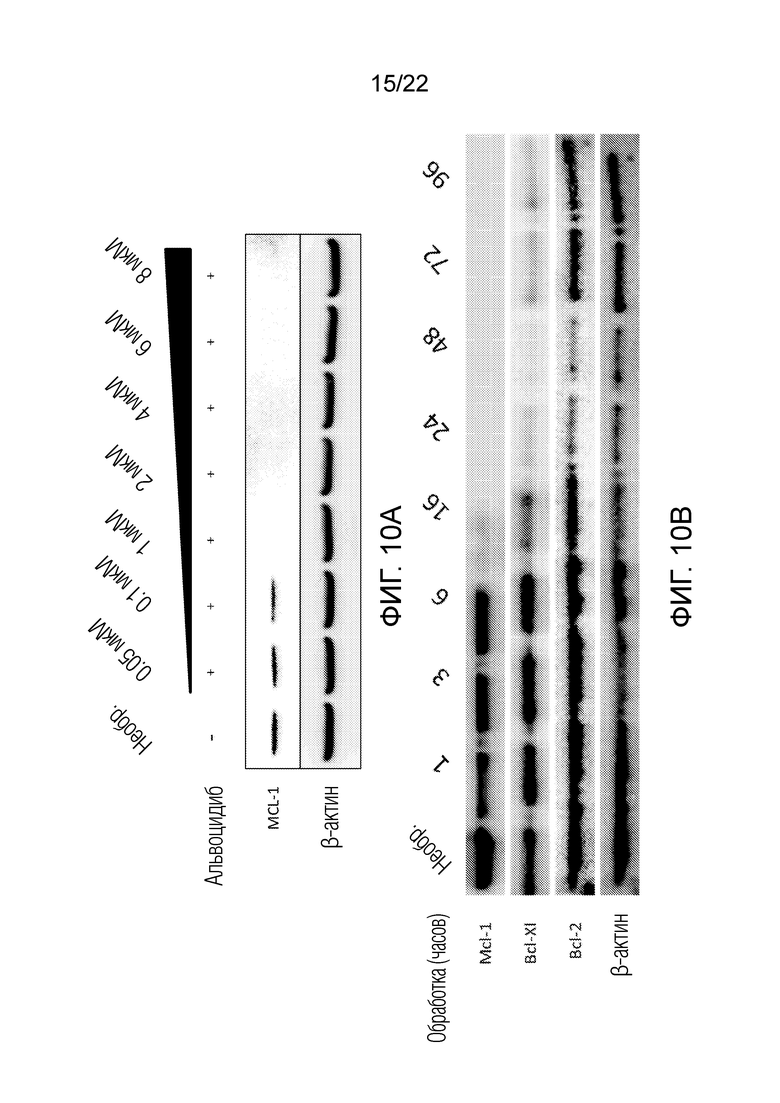
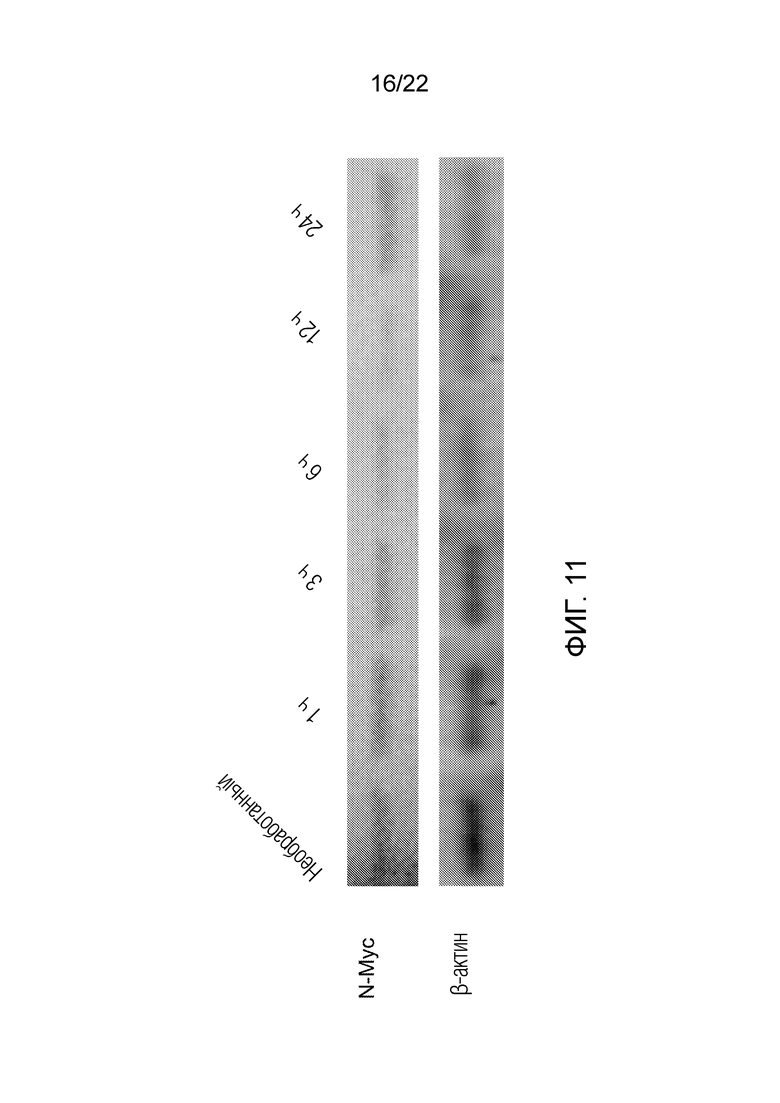



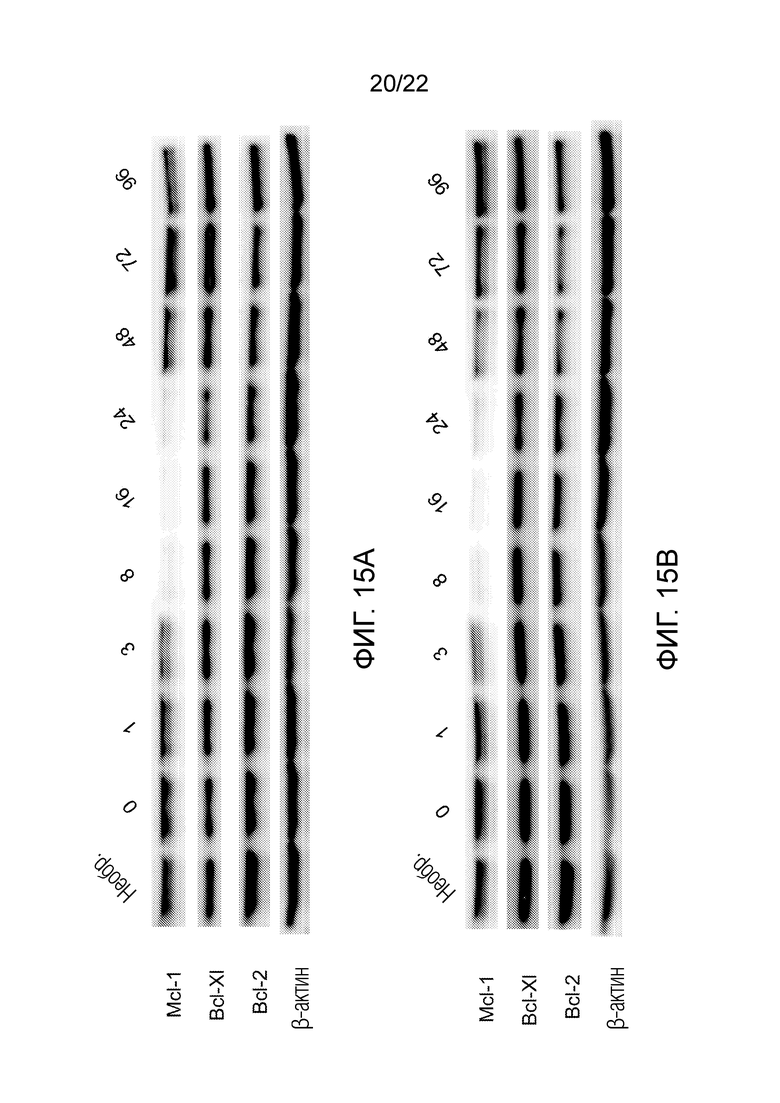
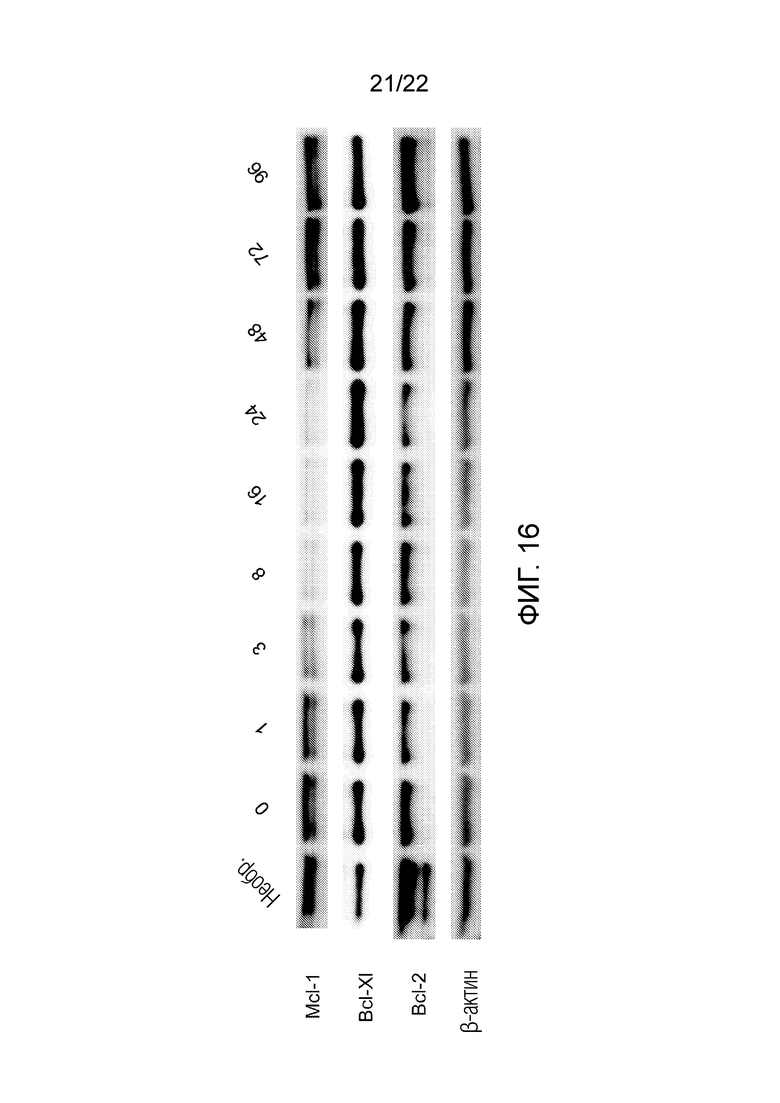

Группа изобретений относится к медицине и касается лечения млекопитающего с острым миелоидным лейкозом (ОМЛ), заболевание которого зависит от MCL-1. Способ включает введение альвоцидиба, цитарабина и митоксантрона млекопитающему с клетками костного мозга, имеющими примирование MCL-1 по меньшей мере 15%, определенное посредством воздействия на клетки из костного мозга млекопитающего миметика BH3, селективного для MCL-1, и определения процентного изменения митохондриальной поляризации, которое соответствует примированию MCL-1. Также предложен способ лечения пациента с ОМЛ, включающий предварительное определение примирования MCL-1 клеток костного мозга. Группа изобретений обеспечивает эффективность лечения пациентов с ОМЛ за счет предварительного прогнозирования ответа пациента на альвоцидиб и принятия врачом решения о назначении альвоцидиба пациенту. 2 н. и 16 з.п. ф-лы, 17 ил., 8 табл., 12 пр.
1. Способ лечения млекопитающего с острым миелоидным лейкозом (ОМЛ), заболевание которого зависит от MCL-1, включающий введение альвоцидиба, цитарабина и митоксантрона млекопитающему с клетками костного мозга, имеющими примирование MCL-1 по меньшей мере 15%, определенное посредством воздействия на клетки из костного мозга млекопитающего миметика BH3, селективного для MCL-1, и определения процентного изменения митохондриальной поляризации, которое соответствует примированию MCL-1.
2. Способ по п. 1, в котором определение примирования MCL-1 включает пермеабилизацию клеток костного мозга.
3. Способ по п. 1, в котором ОМЛ является рефрактерным.
4. Способ по п. 1, в котором ОМЛ является рецидивирующим или рефрактерным.
5. Способ по п. 1, в котором примирование MCL-1 составляет по меньшей мере 20%.
6. Способ по п. 1, в котором примирование MCL-1 составляет по меньшей мере 25%.
7. Способ по п. 1, в котором примирование MCL-1 составляет по меньшей мере 30%.
8. Способ по п.1, в котором примирование MCL-1 составляет по меньшей мере 35%.
9. Способ по п. 1, в котором примирование MCL-1 составляет по меньшей мере 40%.
10. Способ лечения млекопитающего с острым миелоидным лейкозом (ОМЛ), заболевание которого зависит от MCL-1, включающий:
получение множества клеток костного мозга от млекопитающего;
определение примирования MCL-1 клеток костного мозга, которое определяют посредством воздействия на клетки из костного мозга млекопитающего миметика BH3, селективного для MCL-1, и определения процентного изменения митохондриальной деполяризации, которое соответствует примированию MCL-1; и
введение альвоцидиба, цитарабина и митоксантрона млекопитающему, если клетки костного мозга имеют примирование MCL-1 по меньшей мере 15%.
11. Способ по п. 10, в котором определение примирования MCL-1 включает пермеабилизацию клеток костного мозга.
12. Способ по п. 10, в котором ОМЛ является рефрактерным.
13. Способ по п. 10, в котором ОМЛ является рецидивирующим или рефрактерным.
14. Способ по п. 10, в котором примирование MCL-1 составляет по меньшей мере 20%.
15. Способ по п. 10, в котором примирование MCL-1 составляет по меньшей мере 25%.
16. Способ по п. 10, в котором примирование MCL-1 составляет по меньшей мере 30%.
17. Способ по п. 10, в котором примирование MCL-1 составляет по меньшей мере 35%.
18. Способ по п. 10, в котором примирование MCL-1 составляет по меньшей мере 40%.
| WO 2013170176 А2, 14.11.2013 | |||
| BOSE P et al., Mcl-1 as a therapeutic target in acute myelogenous leukemia (AML) // LEUKEMIA RESEARCH REPORTS, ELSEVIER LTD, GB, vol | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| WILLIAM E | |||
| PIERCEALL et al., Mcl-1 dependence predicts response to vorinostat and gemtuzumab ozogamicin in acute myeloid leukemia// LEUKEMIA RESEARCH, US, | |||
Авторы
Даты
2020-03-26—Публикация
2016-04-20—Подача