[Область техники]
Настоящее изобретение относится к композиции для поддержания функции тромбоцитов, способу получения тромбоцитов, препарату крови, содержащему тромбоциты, и к способу поддержания функции тромбоцитов в препарате крови, где используют производное N-гидроксиформамида.
[Предшествующий уровень техники]
Для лечения связанных с кровью заболеваний, примером которых является лейкоз, крайне важным является стабилизация размножения и поддержания клеток крови в количестве, необходимом для такого лечения. Таким образом, к настоящему времени многие исследователи пытались эффективно размножать гемопоэтические стволовые клетки или гемопоэтические клетки-предшественники.
Среди клеток крови мегакариоциты представляют собой клетки-предшественники тромбоцитов, т.е., клетки, продуцирующие тромбоциты, и известно, что они для продукции тромбоцитов формируют структуру протромбоцитов (цитоплазматическое образование) и играют важную роль в терапевтических приложениях. Тромбоциты необходимы для свертывания кровь (гемостаза). Таким образом, потребность в тромбоцитах при лейкозе, трансплантации костного мозга, противоопухолевой терапии и т.д. является крайне высокой.
Кроме способа сбора крови у доноров, используемого до настоящего времени, тромбоциты пробовали получать посредством введения тромбопоэтина (TPO) и посредством дифференцировки клеток пуповинной крови или костного мозга клетки в мегакариоциты. Также недавно был опробован способ, в котором ex vivo размножают гемопоэтические клетки-предшественники с получением из таких клеток-предшественников тромбоцитов. Например, авторы настоящего изобретения опубликовали способ эффективного получения тромбоцитов в относительно большом количестве из капсулообразной структуры, включающей гемопоэтические клетки-предшественники после получения капсулообразной структуры из эмбриональных стволовых клеток (ES клетки) человека (PTL 1); способ эффективного получения зрелых мегакариоцитов и тромбоцитов из индуцированных плюрипотентных стволовых клеток (iPS клетки) в культуральной системе in vitro (PTL 2) и т.д.
Как описано выше, достигнут прогресс в исследованиях способов получения тромбоцитов по существу экзогенно. Однако функционирование получаемых тромбоцитов является недостаточно стабильным. По этой причине необходимо разработать способ, позволяющий получать большое количество функциональных тромбоцитов, поддающихся хранению в течение длительного периода времени.
Связывание тромбоцитов и внеклеточного матрикса является важным процессом для индукции свертывания крови (гемостаз, формирование тромба и т.п.). Полагают, что этот процесс инициируется, когда рецептор тромбоцита GPIb связывается с фактором фон Виллебранда (VWF) посредством α-субъединицы (GPIbα). Однако опубликовано, что в условиях при температуре приблизительно 37°C, металлопротеиназа ADAM17 (дезинтегриновый и металлопептидазный домен 17) отщепляет внеклеточную область GPIbα (высвобождение посредством расщепления), таким образом, ингибируя ассоциацию между GPIbα и VWF, и тромбоциты теряют способность к коагуляции крови (NPL 1 и 2).
Таким образом, полагают, что для поддержания функции тромбоцитов, получаемых in vitro, необходимо подавлять по меньшей мере активность ADAM17. Фактически, авторы настоящего изобретения сообщили, что функцию тромбоцитов, получаемых in vitro, можно поддерживать, добавляя ингибитор (такой как GM6001), непосредственно ингибирующий металлопротеиназную активность, или ингибитор MAP-киназы p38, опосредованно ингибирующий стимуляцию активности металлопротеиназы, такой как ADAM17 (PTL 3), при соответствующем расписании.
Однако ингибиторы, такие как GM6001, ингибируют активность не только ADAM17, но также и других металлопротеиназ (в частности, MMP9 и MMP14, важных для гемопоэтической функции). Таким образом, когда такие ингибиторы используют для получения тромбоцитов in vitro, ингибиторы следует добавлять в определенный период, когда наблюдают наиболее обильную продукцию тромбоцитов. Поскольку решение такой сложной задачи, как выбор правильного расписания, требуется при культивировании клеток с плохой однородностью и репродуктивностью, способ получения тромбоцитов с применением этих ингибиторов пока еще является неудовлетворительным для получения большого количества функциональных тромбоцитов и, в частности, для организации предприятия для системы получения тромбоцитов.
Кроме того, неселективные ингибиторы металлопротеиназ ингибируют активность всех металлопротеиназ, таких как металлопротеиназы мембранного типа, секретируемые металлопротеиназы и ADAM. Таким образом, полагают, что применение in vivo приводит к риску различных побочных эффектов (вредные воздействия, вызываемые ингибированием важных MMP или ADAM, действующих на другие органы). Фактически, так как неселективные ингибиторы металлопротеиназ вызывают тяжелый побочный эффект, называемый скелетно-мышечным синдромом, множество разработок этих ингибиторов остановлено (NPL 3). Кроме того, полагают, что ингибитор со структурой гидроксамовой кислоты, такой как GM6001, должен обладать мутагенностью (NPL 4). Таким образом, тромбоциты, получаемые способом с применением указанного выше ингибитора, неудовлетворительны даже с точки зрения безопасности.
При этом в настоящее время не существует эффективного способа хранения тромбоцитов, получаемых у живых доноров, отличного от способа, где тромбоциты хранят с перемешиванием при температуре от 20°C до 24°C. Таким образом, для поддержания функции тромбоцитов эффективным полагают получение тромбоцитов в условиях комнатной температуры (от 20°C до 24°C), даже когда используют способ с подавлением металлопротеиназной активности ADAM17. Однако в условиях комнатной температуры до настоящего времени вообще не производилось проверки возможности или невозможности получения клеток пуповинной крови или костного мозга, дифференцированных в мегакариоциты, возможности или невозможности получения тромбоцитов из гемопоэтических клеток-предшественников, получаемых из ES клеток, или т.п.
Как описано выше, соединение практически пригодное к применению в качестве активного ингредиента композиции для поддержания функции тромбоцитов все еще не открыто. Таким образом, способ получения функционально стабильных тромбоцитов in vitro и, в частности, способ, подходящий для массового получения высокобезопасных тромбоцитов до настоящего времени не разработан.
[Список цитируемых ссылок]
[Патентная литература]
[PTL 1] Международная публикация № WO2008/041370
[PTL 2] Международная публикация № WO2009/122747
[PTL 3] Международная публикация № WO2009/119105
[Непатентная литература]
[NPL 1] Bergmeier et al., Circulation Research, 2004, vol. 95, pp. 677-683
[NPL 2] Bergmeier et al., Blood, 2003, vol. 102, pp. 4229 to 4235
[NPL 3] Peterson et al., Cardiovasc. Res., 2006, vol. 69, pp. 677 to 687
[NPL 4] Skipper et al., Cancer Res., 1980, vol. 40, pp. 4704 to 4708
[Сущность изобретения]
[Техническая задача]
Настоящее изобретение осуществлено с учетом описанных выше проблем традиционных способов. Задачей настоящего изобретения является идентификация соединения, способного поддерживать функцию тромбоцитов посредством специфического ингибирования металлопротеиназной активности ADAM17 с супрессией отщепления GPIbα. Другими задачами настоящего изобретения является предоставление композиции для поддержания функции тромбоцитов, для эффективного получения тромбоцитов и для улучшения качества хранения препарата крови, которые все достигаются использованием идентифицированного соединения.
[Решение задачи]
Для решения указанных выше задач авторы настоящего изобретения провели серьезные исследования. В результате авторы изобретения выявили, что культивирование в условиях комнатной температуры 25° не приводит к дифференцировке гемопоэтических клеток-предшественников, получаемых из ES клеток, iPS клеток или т.п., в мегакариоциты или к получению тромбоцитов из мегакариоцитов, а предпочтительны условия культивирования при температуре приблизительно 37°C. Таким образом, далее авторы настоящего изобретения проводили поиск соединения, способного к специфическому ингибированию опосредованного ADAM17 отщепления GPIbα при культивировании при температуре приблизительно 37°C. В результате, найдено следующее. Производные N-гидроксиформамида с конкретной структурой обладают ингибирующим действием, специфичным для ADAM17. Когда к культуральной системе для получения тромбоцитов или к получаемым из периферической крови человека тромбоцитам добавляли производные N-гидроксиформамида, отщепление GPIbα было подавлено, и функция тромбоцитов в температурных условиях при приблизительно 37°C также сохранялась. Авторы настоящего изобретения выявили, что вследствие такого действия идентифицированных производных N-гидроксиформамида, эти производные очень подходят для эффективного получения тромбоцитов, улучшения качества хранения препарата крови, содержащего тромбоциты, и т.д. Эти открытия привели к осуществлению настоящего изобретения.
Настоящее изобретение более конкретно относится к указанным ниже открытиям.
(1) Композиция для поддержания функции тромбоцитов, где композиция в качестве активного ингредиента содержит соединение, представленное приведенной ниже общей формулой (I), или его соль, или его сольват:
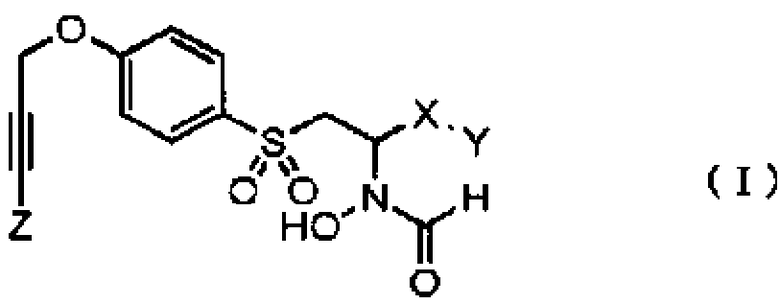
где
X представляет собой фениленовую группу;
Y представляет собой любой из атома водорода и -(CH2)mR1;
где
m представляет собой любое целое число от 0 до 4; и
R1 представляет собой любой из
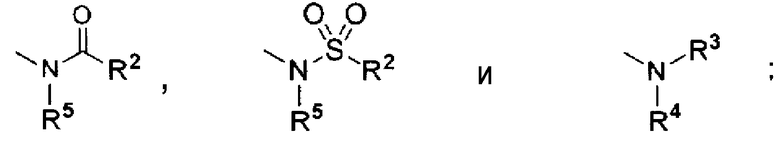
где R2 представляет собой любую алкильную группу от C1 до C6, которая может быть замещенной, арильную группу, которая может быть замещенной, и алкоксигруппу от C1 до C6;
каждый из R3 и R4 независимо представляет собой любой из атома водорода и алкильной группы от C1 до C6, или R3 и R4 вместе с соседним атомом азота могут формировать азотсодержащий гетероцикл; и
R5 представляет собой любой из атома водорода, алкильной группы от C1 до C6 и алкилсульфонильной группы от C1 до C6; и
Z представляет собой любой из атома водорода и алкильной группы от C1 до C6.
(2) Композиция по (1), где соединение, представленное общей формулой (I), представляет собой любое из
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамида и
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}метансульфонамида.
(3) Композиция по любому из (1) и (2) в форме любого из реагента для поддержания функции тромбоцитов и добавки к препарату крови, содержащему тромбоциты.
(4) Способ получения тромбоцитов, где способ включает добавление к культуральной системе для дифференцировки мегакариоцитов из клеток, способных к дифференцировке в мегакариоциты, и получения тромбоцитов из мегакариоцитов, соединения, представленного приведенной ниже общей формулой (I), или его соли, или его сольвата:

где
X представляет собой фениленовую группу;
Y представляет собой любой из атома водорода и -(CH2)mR1;
где
m представляет собой любое целое число от 0 до 4; и
R1 представляет собой любой из

где R2 представляет собой любую алкильную группу от C1 до C6, которая может быть замещенной, арильную группу, которая может быть замещенной, и алкоксигруппу от C1 до C6;
каждый из R3 и R4 независимо представляет собой любой из атома водорода и алкильной группы от C1 до C6, или R3 и R4 вместе с соседним атомом азота могут формировать азотсодержащий гетероцикл; и
R5 представляет собой любой из атома водорода, алкильной группы от C1 до C6 и алкилсульфонильной группы от C1 до C6; и
Z представляет собой любой из атома водорода и алкильной группы от C1 до C6.
(5) Способ по (4), где соединение, представленное общей формулой (I), представляет собой любое из
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамида и
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}метансульфонамида.
(6) Способ по любому из (4) и (5), где температура культивирования в культуральной системе составляет от 35 до 38°C.
(7) Культура, которая представляет собой культуральную систему для дифференцировки мегакариоцитов из клеток, способных к дифференцировке в мегакариоциты, и для получения тромбоцитов из мегакариоцитов, и которую добавляют к системе с соединением, представленным приведенной ниже общей формулой (I), или с его солью, или с его сольватом:

где
X представляет собой фениленовую группу;
Y представляет собой любой из атома водорода и -(CH2)mR1;
где
m представляет собой любое целое число от 0 до 4; и
R1 представляет собой любой из

где R2 представляет собой любую алкильную группу от C1 до C6, которая может быть замещенной, арильную группу, которая может быть замещенной, и алкоксигруппу от C1 до C6;
каждый из R3 и R4 независимо представляет собой любой из атома водорода и алкильной группы от C1 до C6, или R3 и R4 вместе с соседним атомом азота могут формировать азотсодержащий гетероцикл; и
R5 представляет собой любой из атома водорода, алкильной группы от C1 до C6 и алкилсульфонильной группы от C1 до C6; и
Z представляет собой любой из атома водорода и алкильной группы от C1 до C6.
(8) Культура по (7), где соединение, представленное общей формулой (I), представляет собой любое из
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамида и
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}метансульфонамида.
(9) Препарат крови, содержащий тромбоциты и соединение, представленное приведенной ниже общей формулой (I), или его соль, или его сольват:

где
X представляет собой фениленовую группу;
Y представляет собой любой из атома водорода и -(CH2)mR1;
где
m представляет собой любое целое число от 0 до 4; и
R1 представляет собой любой из

где R2 представляет собой любую алкильную группу от C1 до C6, которая может быть замещенной, арильную группу, которая может быть замещенной, и алкоксигруппу от C1 до C6;
каждый из R3 и R4 независимо представляет собой любой из атома водорода и алкильной группы от C1 до C6, или R3 и R4 вместе с соседним атомом азота могут формировать азотсодержащий гетероцикл; и
R5 представляет собой любой из атома водорода, алкильной группы от C1 до C6 и алкилсульфонильной группы от C1 до C6; и
Z представляет собой любой из атома водорода и алкильной группы от C1 до C6.
(10) Препарат крови по (9), где соединение, представленное общей формулой (I), представляет собой любое из
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамида и
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}метансульфонамида.
(11) Способ поддержания функции тромбоцитов в препарате крови, где способ включает добавление в препарат крови, содержащий тромбоциты, соединения, представленного приведенной ниже общей формулой (I), или его соли, или его сольвата:

где
X представляет собой фениленовую группу;
Y представляет собой любой из атома водорода и -(CH2)mR1;
где
m представляет собой любое целое число от 0 до 4; и
R1 представляет собой любой из

где R2 представляет собой любую алкильную группу от C1 до C6, которая может быть замещенной, арильную группу, которая может быть замещенной, и алкоксигруппу от C1 до C6;
каждый из R3 и R4 независимо представляет собой любой из атома водорода и алкильной группы от C1 до C6, или R3 и R4 вместе с соседним атомом азота могут формировать азотсодержащий гетероцикл; и
R5 представляет собой любой из атома водорода, алкильной группы от C1 до C6 и алкилсульфонильной группы от C1 до C6; и
Z представляет собой любой из атома водорода и алкильной группы от C1 до C6.
(12) Способ по (11), где соединение, представленное общей формулой (I), представляет собой любое из
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамида и
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}метансульфонамида.
[Полезные эффекты изобретения]
Производные N-гидроксиформамида, раскрываемые в настоящем изобретении, способны к поддержанию функции тромбоцитов даже в температурных условиях приблизительно при 37°C посредством специфического ингибирования металлопротеиназной активности ADAM17 с супрессией отщепления GPIbα. Таким образом, производные делают возможным получение большого количества функционально стабильных тромбоцитов in vitro, и поддержание качества препарата крови, содержащего тромбоциты.
[Краткое описание чертежей]
[Фиг.1] Фиг.1 представляет собой схематическое изображение для иллюстрации способа индукции мегакариоцитов/тромбоцитов из гемопоэтических клеток-предшественников, получаемых из ES клеток или т.п., в условиях комнатной температуры.
[Фиг.2] Фиг.2 представляет собой диаграмму, демонстрирующую количество мегакариоцитов, продуцируемых из получаемых из ES клеток гемопоэтических клеток-предшественников посредством культивирования в условиях комнатной температуры. Единицы по вертикальной оси представляют собой количество клеток/лунку.
[Фиг.3] Фиг.3 представляет собой диаграмму, демонстрирующую общее количество тромбоцитов, продуцируемых из получаемых из ES клеток гемопоэтических клеток-предшественников посредством культивирования в условиях комнатной температуры. Единицы по вертикальной оси представляют собой количество клеток/лунку.
[Фиг.4] Фиг.4 представляет собой диаграмму, демонстрирующую количество мегакариоцитов, продуцируемых из получаемых из пуповинной крови CD34(+) клеток посредством культивирования в условиях комнатной температуры. Единицы по вертикальной оси представляют собой количество клеток/лунку.
[Фиг.5] Фиг.5 представляет собой диаграмму, демонстрирующую общее количество тромбоцитов, продуцируем из получаемых из пуповинной крови CD34(+) клеток посредством культивирования в условиях комнатной температуры. Единицы по вертикальной оси представляют собой количество клеток/лунку.
[Фиг.6] <Протокол 1> иллюстрирует применение расписания введения соединения (S-45282 или S-45457) по настоящему изобретению в процессе индукции дифференцировки из получаемых из ES клеток- или iPS клеток гемопоэтических клеток-предшественников в мегакариоциты/тромбоциты. <Протокол 2> иллюстрирует, что отмытые тромбоциты получали из периферической крови человека и к ним добавляли соединение (S-45282 или S-45457) по настоящему изобретению.
[Фиг.7] Фиг.7 представляет собой диаграмму для иллюстрации результатов подтверждения поддерживающего функцию действия GM6001 и S-45282 на получаемые из ES клеток тромбоциты, когда каждое из соединений добавляли к культуральной система в течение 2 суток (2 суток). Вертикальная ось представляет собой проценты (%) CD42b (GPIbα)(+) и CD42b (GPIbα)(-), где общее количество тромбоцитов (CD41(+)) принимают за 100.
[Фиг.8] Фиг.8 представляет собой диаграмму, демонстрирующую общее количество получаемых из ES клеток тромбоцитов, получаемых при добавлении к культуральной системе GM6001 или S-45282 в течение 2 суток (2 суток). Единицы по вертикальной оси представляют собой количество клеток/лунку.
[Фиг.9] Фиг.9 представляет собой диаграмму для иллюстрации результата подтверждения эффектов поддержания GM6001 и S-45282 функции получаемых из ES клеток тромбоцитов, когда каждое из соединений добавляли к культуральной системе в течение 8 суток (8 суток). Вертикальная ось представляет собой проценты (%) CD42b (GPIbα)(+) и CD42b (GPIbα)(-), где общее количество тромбоцитов (CD41(+)) принимают за 100.
[Фиг.10] Фиг.10 представляет собой диаграмму, демонстрирующую общее количество получаемых из ES клеток тромбоцитов, получаемых, когда к культуральной системе добавляли GM6001 или S-45282 в течение 8 суток (8 суток). Единицы по вертикальной оси представляют собой количество клеток/лунку.
[Фиг.11] Фиг.11 представляет собой диаграмму, демонстрирующую количество получаемых из ES клеток тромбоцитов (количество CD41(+)CD42b(+) и CD41(+)CD42b(-)), получаемых, когда к культуральной системе добавляли GM6001, S-45282 или S-45457 в течение 8 суток. Единицы по вертикальной оси представляют собой количество клеток/лунку.
[Фиг.12] Фиг.12 представляет собой диаграмму для иллюстрации результата подтверждения поддерживающего функцию действия GM6001, S-45282 и S-45457 на получаемые из ES клеток тромбоциты, когда каждое из соединений добавляли к культуральной системе в течение 8 суток. Вертикальная ось представляет собой процент (%) CD42b (GPIbα)(+), где общее количество тромбоцитов (CD41(+)) принимают за 100.
[Фиг.13] Фиг.13 представляет собой диаграмму, демонстрирующую общее количество получаемых из ES клеток тромбоцитов, получаемых, когда к культуральной системе добавляли GM6001 или S-45457 в течение 8 суток. Единицы по вертикальной оси представляют собой количество клеток/лунку. Значение представляет собой среднее + стандартная ошибка (n=4).
[Фиг.14] Фиг.14 представляет собой диаграмму для иллюстрации зависимости поддерживающего функцию действия S-45457 на получаемые из ES клеток тромбоциты от концентрации. Вертикальная ось представляет собой процент (%) CD42b (GPIbα)(+), где общее количество тромбоцитов принимают за 100%. Значение представляет собой среднее + стандартная ошибка (n=4). # (знак решетки) означает p<0,1.
[Фиг.15] Фиг.15 представляет собой диаграмму, демонстрирующую общее количество получаемых из iPS клеток тромбоцитов, получаемых, когда к культуральной системе добавляли GM6001 или S-45457 в течение 8 суток. Единицы по вертикальной оси представляют собой количество клеток/лунку. Значение представляет собой среднее + стандартная ошибка (n=4).
[Фиг.16] Фиг.16 представляет собой диаграмму для иллюстрации зависимости поддерживающего функцию действия S-45457 на получаемые из iPS клеток тромбоциты от концентрации. Вертикальная ось представляет собой процент (%) CD42b (GPIbα)(+), где общее количество тромбоцитов принимают за 100. * (звездочка) и ** (две звездочки) означают p<0,05 и p<0,01, соответственно.
[Фиг.17] Фиг.17 представляет собой диаграмму для иллюстрации зависимости поддерживающего функцию действия S-45457 на получаемые из периферической крови тромбоциты от концентрации. Вертикальная ось представляет собой процент CD41(+)CD42b (GPIbα)(+), где общее количество тромбоцитов принимают за 1,00. Значение представляет собой среднее значение + стандартная ошибка (n=4). ** (две звездочки) означают p<0,01.
[Фиг.18] На фиг.18 представлены точечные диаграммы для иллюстрации поддерживающего функцию действия S-45457 и ингибиторов p38 на получаемые из периферической крови тромбоциты.
[Фиг.19] Фиг.19 представляет собой диаграмму для иллюстрации поддерживающего функцию действия GM6001, S-45457 и ингибиторов p38 на получаемые из периферической крови тромбоциты. Вертикальная ось представляет собой процент CD41(+)CD42b(GPIbα)(+) относительно общего количества тромбоцитов, которое принимают за 1,00. Значение представляет собой среднее значение + стандартная ошибка (n=4).
[Фиг.20] Фиг.20 представляет собой диаграмму, демонстрирующую общее количество получаемых из ES клеток тромбоцитов, получаемых, когда к культуральной системе добавляли GM6001, S-45457 или ингибиторы p38 в течение 8 суток. Единицы по вертикальной оси представляют собой количество клеток/лунку.
[Фиг.21] Фиг.21 представляет собой диаграмму для иллюстрации результата подтверждения поддерживающего функцию действия GM6001, S-45457 и ингибиторов p38 на получаемые из ES клеток тромбоциты, когда каждое из соединений добавляли к культуральной системе в течение 8 суток. Вертикальная ось представляет собой процент (%) CD42b (GPIbα)(+), где общее количество тромбоцитов принимают за 100.
[Фиг.22] Фиг.22 представляет собой диаграмму для иллюстрации результата подтверждения поддерживающего функцию действия GM6001, S-45457 и S-45282 на получаемые из периферической крови тромбоциты. Вертикальная ось представляет собой процент (%) CD42b (GPIbα)(+), где общее количество тромбоцитов принимают за 100.
[Фиг.23] На фиг.23 представлены диаграммы для иллюстрации результата подтверждения поддерживающего функцию действия GM6001, S-45457, S-45282 и ингибиторов p38 в получаемой из периферической крови PRP. Вертикальная ось представляет собой проценты (%) CD41(+)CD42b(+) и CD41(+)CD42b(-), где общее количество тромбоцитов (CD41(+)) принимают за 100%.
[Фиг.24] На фиг.24 представлены точечные диаграммы для иллюстрации поддерживающего функцию действия GM6001, S-45457, S-45282 и ингибитора p38 на получаемые из периферической крови тромбоциты.
[Фиг.25] На фиг.25 представлены точечные диаграммы для иллюстрации зависимости поддерживающего функцию действия S-45457 на получаемые из периферической крови тромбоциты от концентрации.
[Фиг.26] Фиг.26 представляет собой диаграмму для иллюстрации результата хронологической оценки адгезионной способности тромбоцитов, получаемых в присутствии S-45457.
[Фиг.27] Фиг.27 представляет собой диаграмму для иллюстрации результата оценки адгезионной способности тромбоцитов, получаемых в присутствии S-45457.
[Фиг.28] На фиг.28 представлены микрофотографии во время лазерного облучения (0 секунд) и через 20 секунд, демонстрирующие формирование тромба у мышей, которым инъецировали тромбоциты, получаемые в присутствии S-45457.
[Фиг.29] Фиг.29 представляет собой диаграмму для иллюстрации вклада тромбоцитов, получаемых в присутствии S-45457 в формирование тромба. Вертикальная ось представляет собой процент (%) количества тромбоцитов человека относительно общего количества тромбоцитов (мышь + человек), вовлеченных в формирование тромба, которое получали, исследуя обтурирующие тромбы, индуцируемые в капилляры брыжейки мышей, которым проводили переливание каждого из образцов. Значение представляет собой среднее процентов + стандартная ошибка, получаемые при исследовании 20 кровеносных сосудов.
[Описание вариантов осуществления]
Композиция по настоящему изобретению представляет собой композицию для поддержания функции тромбоцитов, где композиция в качестве активного ингредиента содержит соединение, представленное приведенной ниже общей формулой (I), или его соль, или его сольват:

где
X представляет собой фениленовую группу;
Y представляет собой любой из атома водорода и -(CH2)mR1;
где
m представляет собой любое целое число от 0 до 4; и
R1 представляет собой любой из

где R2 представляет собой любую алкильную группу от C1 до C6, которая может быть замещенной, арильную группу, которая может быть замещенной, и алкоксигруппу от C1 до C6;
каждый из R3 и R4 независимо представляет собой любой из атома водорода и алкильной группы от C1 до C6, или R3 и R4 вместе с соседним атомом азота могут формировать азотсодержащий гетероцикл; и
R5 представляет собой любой из атома водорода, алкильной группы от C1 до C6 и алкилсульфонильной группы от C1 до C6; и
Z представляет собой любой из атома водорода и алкильной группы от C1 до C6.
В соединении, представленном указанной выше общей формулой (I), каждое из "от C1 до C6" и "от C6 до C14" означает, что количество атомов углерода находится в диапазоне от 1 до 6 и от 6 до 14, соответственно.
"Алкильная группа от C1 до C6" из "алкильной группы от C1 до C6, которая может быть замещенной" в R2, R3, R4, R5 и Z, означает неразветвленную или разветвленную алкильную группу от C1 до C6, и ее конкретные примеры включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, трет-бутильную группу, втор-бутильную группу, н-пентильную группу, трет-амильную группу, 3-метилбутильную группу, неопентильную группу, н-гексильную группу и т.д.
Заместитель в указанной выше "алкильной группе от C1 до C6, которая может быть замещенной" включает гидроксильную группу, атом галогена, цианогруппу, нитрогруппу, алкоксигруппу от C1 до C6, карбоксильную группу, алкоксикарбонильную группу от C1 до C6 и т.д. По меньшей мере одна или несколько из них могут быть замещенными по любому и каждому замещаемому положениям. В случае, когда соединение содержит несколько заместителей, заместители могут быть одинаковыми или различными и замещать на одном и том же атоме углерода или на различных атомах углерода.
"Атом галогена" означает атом фтора, атом хлора, атом брома, атом йода.
"Алкоксигруппа от C1 до C6" означает алкоксигруппу, в которой алкильная группа имеет то же значение, как указанная выше "алкильная группа от C1 до C6", для которой, например, существует указываемая неразветвленная или разветвленная алкоксигруппа, такую как метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, изобутоксигруппа, трет-бутоксигруппа, втор-бутоксигруппа, н-пентилоксигруппа, трет-амилоксигруппа, 3-метилбутоксигруппа, неопентилоксигруппа, н-гексилоксигруппа и т.д.
"Алкоксикарбонильная группа от C1 до C6" означает группу, в которой алкильная группа, исключая ее оксикарбонильную группу, представляет собой неразветвленную или разветвленную алкильную группа от C1 до C6, включая, например, метоксикарбонильную группу, этоксикарбонильную группу, н-пропоксикарбонильную группу, изопропоксикарбонильную группу, н-бутоксикарбонильную группу, изобутоксикарбонильную группу, трет-бутоксикарбонильную группу, втор-бутоксикарбонильную группу, н-пентилоксикарбонильную группу, трет-амилоксикарбонильную группу, 3-метилбутоксикарбонильную группу, неопентилоксикарбонильную группу, н-гексилоксикарбонильную группу и т.д.
"Азотсодержащий гетероцикл", который формируют R3 и R4 вместе с соседним атомом азота, включает, например, азотсодержащий гетероцикл с количеством членов от 5 до 7, содержащий в дополнение к атомам углерода по меньшей мере один атом азота в качестве составляющего цикл атома, и может дополнительно содержать один или два гетероатома, выбранных из атома кислорода, атома серы и атома азота. Предпочтительные примеры азотсодержащего гетероцикла включают пиперидиновый цикл, пиперазиновый цикл, морфолиновый цикл, тиоморфолиновый цикл, пирролидиновый цикл, имидазолидиновый цикл и т.д.
"Арильная группа" из "арильной группы, которая может быть замещенной" в R2 означает ароматический углеродный цикл, предпочтительно ароматический углеродный цикл от C6 до C14, и включает, например, фенильную группу, нафтильную группу и т.д.
Заместитель на ароматическом цикле в указанной выше "арильной группе, которая может быть замещенной" включает гидроксильную группу, атом галогена, цианогруппу, нитрогруппу, трифторметильную группу, алкильную группу от C1 до C6, которая может быть замещенной, алкоксигруппу от C1 до C6, карбоксильную группу, алкоксикарбонильную группу от C1 до C6 и т.д. По меньшей мере одна или несколько из них могут быть замещенными по любому или каждому из замещаемых положений. В случае, когда соединение содержит несколько заместителей, заместители могут быть одинаковыми или различными, и могут замещать на одном и том же атоме углерода или на различных атомах углерода. В них "атом галогена", "алкильная группа от C1 до C6, которая может быть замещенной", "алкоксигруппа от C1 до C6" и "алкоксикарбонильная группа от C1 до C6" имеют те же значения, как указано выше.
"Алкилсульфонильная группа от C1 до C6" в R5 означает алкилсульфонильную группу, в которой алкильная группа имеет то же значение, как значение указанной выше "алкильной группы от C1 до C6", включая, например, метансульфонильную группу, этансульфонильную группу и т.д.
В случае, когда соединение, представленное общей формулой (I), содержит ассиметричный атом углерода, в изобретение включены все его рацематы и диастереомеры, а также индивидуальные оптически активные формы соединения. В случае, когда соединение включает геометрический изомер, в изобретение включены все из его (E) формы и (Z) формы, а также их смеси.
Конкретно не определяя, соль соединения, представленного общей формулой (I), может представлять собой его любую фармацевтически приемлемую соль, включая, например, соли с неорганическим основанием, соли с органическим основанием, соли с органической кислотой, соли c неорганической кислотой, соли с аминокислотой и т.д. Примеры солей с неорганическим основанием включают соли щелочных металлов и соли щелочноземельных металлов, такие как литиевые соли, натриевые соли, калиевые соли, кальциевые соли, магниевые соли и т.д. Примеры солей с органическим основанием включают триэтиламиновые соли, пиридиновые соли, этаноламиновые соли, циклогексиламиновые соли, дициклогексиламиновые соли, дибензилэтаноламиновые соли и т.д. Примеры солей c органической кислотой включают формиаты, ацетаты, тартраты, малеаты, сукцинаты, лактаты, малаты, аскорбаты, оксалаты, гликолаты, фенилацетаты, метансульфонаты и т.д. Примеры солей с неорганической кислотой включают гидрохлориды, гидробромиды, фосфаты, сульфаматы, нитраты и т.д. Примеры солей с аминокислотой включают соли с глицином, соли с аланином, соли с аргинином, глутаминаты, аспартаты и т.д.
Соединение, представленное общей формулой (I), может иметь форму пролекарственного средства. Примеры пролекарственного средства включают сложный метиловый эфир, сложный этиловый эфир и аминоалкиловые сложноэфирные производные карбоксильной группы соединения общей формулы (I), ацетатные, формиатные и бензоатные производные гидроксильной группы и функциональной аминогруппы соединения общей формулы (I) и т.д., однако которыми изобретение не ограничено.
Соединение, представленное указанной выше общей формулой (I), можно получать различными способами, но его эффективно можно получать способом, указанным ниже. Следует отметить, что конкретные примеры "защитной группы" для применения в способе получения, указанном ниже, включают трет-бутильную группу, бензильную группу, o-метилбензильную группу, п-нитробензильную группу, п-метоксибензильную группу, o-хлорбензильную группу, 2,4-дихлорбензильную группу, п-бромбензильную группу, аллильную группу, трет-бутоксикарбонильную группу, бензилоксикарбонильную группу, о-метилбензилоксикарбонильную группу, п-нитробензилоксикарбонильную группу, п-метоксибензилоксикарбонильную группу, o-хлорбензилоксикарбонильную группу, 2,4-дихлорбензилоксикарбонильную группу, п-бромбензилоксикарбонильную группу, аллилоксикарбонильную группу, трет-бутилдиметилсилильную группу, трет-бутилдифенилсилильную группу, триэтилсилильную группу, триметилсилильную группу, триизопропилсилильную группу, метоксиметильную группу, тетрагидропиранильную группу, карбонильные защитные группы (например, защитные группы с этандиолом, пропандиолом, меркаптоэтанолом, меркаптопропанолом, этандитиолом, пропандитиолом и т.д.) и т.д.
Соединение, представленное общей формулой (I), можно получать, например, посредством реакции из представленных ниже стадии 1 и стадии 2.
Схема 1:
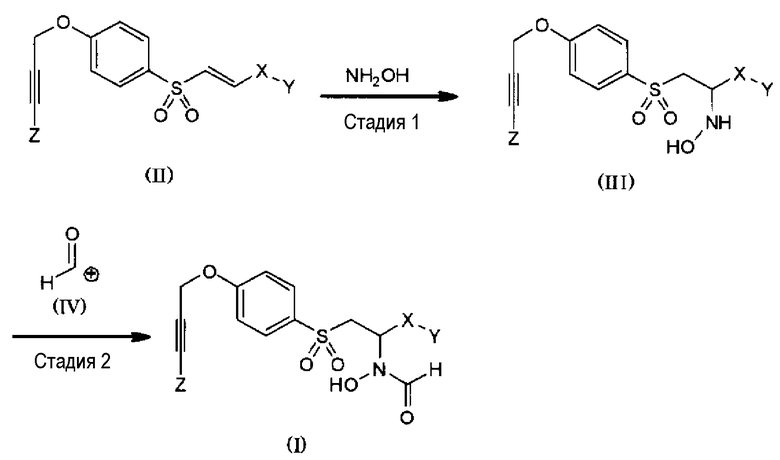
(В формулах X, Y и Z имеют те же значения, как указано выше).
<Стадия 1>
На стадии 1 к соединению (II) добавляют гидроксиламин или его соль с получением соединения, представленного общей формулой (III). В случае, когда гидроксиламин представляет собой соль (гидрохлорид, ацетат и т.д.), реакцию присоединения проводят в присутствии неорганического основания, такого как карбонат калия, карбонат натрия, гидрокарбонат натрий, гидроксид натрия, гидроксид калия, гидроксид лития и т.д. Конкретно не определяя, реакционный растворитель может представлять собой любой растворитель, не препятствующий реакции в значительной степени, но предпочтительно представляет собой воду, тетрагидрофуран, простой циклопентилметиловый эфир, ацетонитрил, 1,4-диоксан, простой диэтиловый эфир или смешанный из них растворитель и т.д.
Конкретно не определяя, температура реакции, как правило, может составлять от 0 до 100°C, а время реакции предпочтительно составляет от 2 часов до 1 недели.
<Стадия 2>
На стадии 2, соединение (III), полученное на стадии 1, конденсируют с промежуточным соединением, представленным общей формулой (IV), с получением соединения, представленного общей формулой (I). Промежуточное соединение (IV) представляет собой реакционноспособное промежуточное соединения, получаемое из смешанного кислотного ангидрида с муравьиной кислотой (смешанный ангидрид муравьиной кислоты и уксусной кислоты и т.д.), пентафторфенилформиата или муравьиной кислоты и карбодиимида (дициклогексилкарбодиимид, диизопропилкарбодиимид или водорастворимый карбодиимид). Для плавного протекания реакции в систему можно добавлять органическое основание, такое как триэтиламин, диизопропилэтиламин, пиридин, лутидин, коллидин, диметиламинопиридин или т.п. В некоторых из этих случаев реакции может способствовать добавление 1-гидроксибензотриазола и/или 4-диметиламинопиридина (особенно, когда реакционноспособное промежуточное соединение получают из карбодиимида). Конкретно не определяя, реакционный растворитель может представлять собой любой растворитель, не препятствующий реакции в значительной степени, но предпочтительно он представляет собой хлороформ, метиленхлорид, тетрагидрофуран, ацетонитрил, простой циклопентилметиловый эфир, 1,4-диоксан, диметилформамид, диметилсульфоксид, пиридин и т.д. Конкретно не определяя, температура реакции, как правило, может составлять от 0 до 100°C, а время реакции предпочтительно представляет собой от 1 до 24 часов. На этой стадии, в зависимости от химических свойств исходных веществ, к гидроксильной группе гидроксиламиногруппы также можно добавлять группу CHO; но в таком случае для конвертации в намеченный продукт, соединение (I), продукт можно обрабатывать низшим спиртом в кислых, основных или нейтральных условиях. Низший спирт предпочтительно представляет собой метанол, этанол, пропанол и т.д. В данной реакции можно использовать вспомогательный растворитель, и когда его используют, вспомогательный растворитель конкретно не определен.
Понятно, что в зависимости от свойств X, Y и Z в реакциях указанных выше стадии 1 и стадии 2 необходимо предварительно использовать соответствующую защитную группу и удалять защитную группу после реакция. В случае, когда группа является незащищенной, выход на следующей стадии и далее на стадии, следующей после этой следующей стадии, может снижаться и может быть затруднительным получать промежуточное соединение.
Указанное выше соединение (II) можно получать способом из стадий 3-5, как указано ниже.
Схема 2:
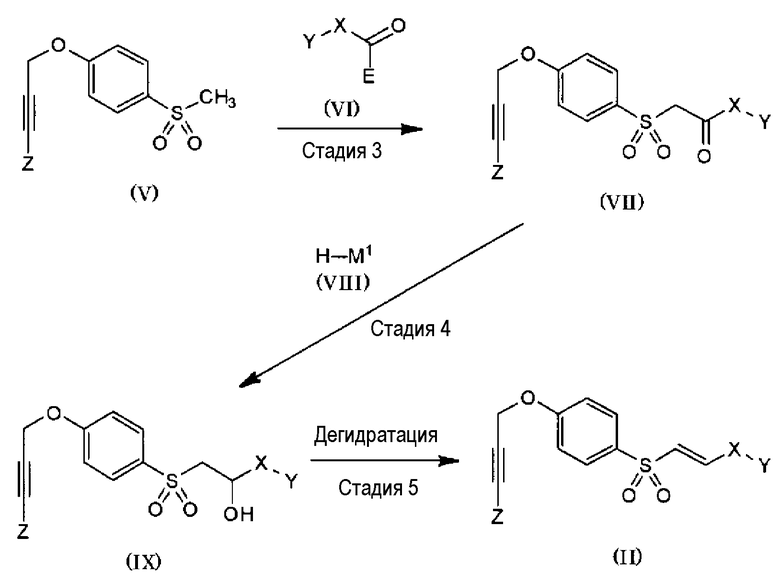
(В формулах X, Y и Z имеют те же значения, как указано выше; E представляет собой высвобождающуюся функциональную группу, такую как алкоксигруппа от C1 до C6, атом галогена, N,O-диметилгидроксиаминогруппа или т.п.; M1 представляет собой Li, CeCl2, NaBH3, LiBH3, LiBEt3, KBEt3, LiB[CH(CH3)C2H5]3, KB[CH(CH3)C2H5]3, Al[CH(CH3)C2H5]2 или т.п.; Et представляет собой этильную группу.)
<Стадия 3>
На стадии 3, соединение, представленное общей формулой (V), преобразуют в анион основанием, а затем подвергают реакции с соединением, представленным общей формулой (VI), с получением соединения (VII). Основание для использования включает диизопропиламид лития, (бистриметилсилил)амид лития, тетраметилпиперазид лития, (бистриметилсилил)амид натрия, (бистриметилсилил)амид калия, н-бутиллитий, втор-бутиллитий, трет-бутиллитий и т.д. Один отдельно или, соответственно, два или более из них можно использовать самостоятельно или в комбинации. Конкретно не определяя, реакционный растворитель может представлять собой любой растворитель, не препятствующий реакции в значительной степени, но предпочтительно он представляет собой тетрагидрофуран, простой циклопентилметиловый эфир, тетрагидрофуран, простой диэтиловый эфир, простой трет-бутилметиловый эфир или смешанный из них растворитель и т.д.
Как правило, температура реакции может составлять от -100 до 40°C, а время реакции предпочтительно составляет от 1 до 12 часов. На этой стадии соединение (II) можно получать в зависимости от химических свойств соединения (VI), что, однако, не создает проблем, учитывая намеченный объект получения.
<Стадия 4>
На стадии 4 соединение (VII), полученное на стадии 3, подвергают реакции с соединением, представленным общей формулой (VIII), с получением соединения, представленного общей формулой (IX). Когда соединение (VIII) представляет собой борогидрид натрия или литий борогидрид, реакционный растворитель предпочтительно представляет собой метанол, этанол, изопропанол, тетрагидрофуран, простой циклопентилметиловый эфир, дихлорметан, хлороформ или их смесь и т.д.; но, когда соединение (VIII) отлично от этих двух, реакционный растворитель предпочтительно представляет собой тетрагидрофуран, простой циклопентилметиловый эфир, тетрагидропиран, простой диэтиловый эфир, простой трет-бутилметиловый эфир или смешанный из них растворитель и т.д. Как правило, температура реакции может составлять от -100 до 30°C, и время реакции предпочтительно составляет от 1 до 12 часов.
В течение или после реакции стадии 4 от образуемого соединения (IX) может спонтанно отщепляться гидроксильная группа, вследствие чего соединение может частично или полностью преобразовываться в соединение (II). В случае частичного преобразования стадию 5 можно проводить без отделения преобразуемого соединения; а в случае полного преобразования стадию 5 можно пропустить.
<Стадия 5>
На стадии 5 соединение (IX), полученное на стадии 4, можно подвергать дегидратации с получением соединения (II). Реакцию дегидратации проводят посредством комбинации активатора гидроксильной группы и органического основания. Активатор гидроксильной группы включает метансульфонилхлорид, п-толуолсульфонилхлорид, бензолсульфонилхлорид, метансульфонилхлорид, тионилхлорид, сульфурилхлорид, пентахлорид фосфора и т.д. Органическое основание включает триэтиламин, диизопропилэтиламин, диазабициклоундецен, диазабициклононен, пиридин, диметиламинопиридин, лутидин, коллидин и т.д. Предпочтительна комбинация метансульфонилхлорида и триэтиламина. В качестве других реагентов для дегидратации можно указать трифенилфосфин-диэтилазодикарбоксилат, трифенилфосфин-диизопропилазокарбоксилат, три-н-бутилфосфин-диэтилазодикарбоксилат, три-н-бутилфосфин-диизопропилазокарбоксилат и т.д. Реакционный растворитель может представлять собой любой растворитель, не препятствующий реакции в значительной степени, но предпочтительно он представляет собой хлороформ, метиленхлорид, тетрагидрофуран, простой циклопентилметиловый эфир, ацетонитрил, 1,4-диоксан, диметилформамид и т.д. Конкретно не определяя, температура реакции, как правило, может составлять от 0 до 100°C, а время реакции предпочтительно составляет от 1 до 24 часов.
Понятно, что в зависимости от свойств X, Y и Z в реакциях указанных выше стадий 3-5 необходимо предварительно использовать соответствующую защитную группу и удалять защитную группу после реакции.
Соединение (V) можно получать на стадии 6, указанной ниже.
Схема 3:
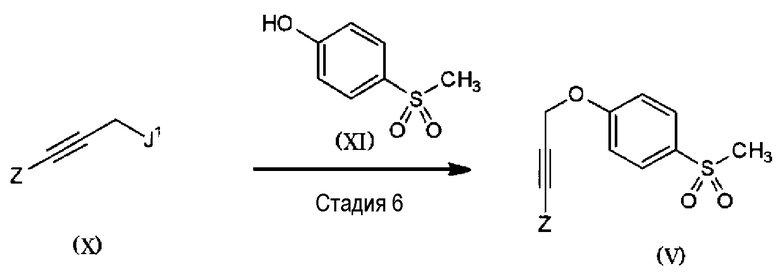
(В формулах, Z имеет то же значение, как и выше; J1 представляет собой атом галогена, метансульфонилоксигруппу, п-толуолсульфонилоксигруппу, бензолсульфонилоксигруппу, трифторметансульфонилоксигруппу или гидроксильную группу).
<Стадия 6>
На стадии 6, соединение, представленное общей формулой (X), или его соль конденсируют с соединением, представленным общей формулой (XI), в присутствии неорганического основания с получением соединения (V). Предпочтительные неорганические основания включают гидроксид натрия, гидроксид калия, гидроксид лития, карбонат натрия, карбонат калия, карбонат цезия, карбонат кальция и т.д. Однако когда J1 представляет собой гидроксильную группу, гидроксильную группу соединения, представленного общей формулой (X), или его соли активируют реагентом, а затем полученное соединение конденсируют соединением, представленным общей формулой (XI), с получением соединения (V). В качестве реагента, подходящего для активации гидроксильной группы, можно указать диэтилазодикарбоксилат (DEAD)-трифенилфосфин, диизопропилазодикарбоксилаттрифенилфосфин, цианометилентрибутилфосфоран, цианометилентриметилфосфоран, бутиллитийхлордифенилфосфин и т.д. В случае активации группы бутиллитийхлордифенилфосфином в систему добавляют хиноновое соединение, такое как 2,6-диметил-1,4-бензохинон, тетрафтор-1,4-бензохинон или т.п.
Конкретно не определяя, реакционный растворитель может представлять собой любой растворитель, не препятствующий реакции в значительной степени, но предпочтительно он представляет собой воду, метанол, этанол, трет-бутанол, тетрагидрофуран, простой циклопентилметиловый эфир, ацетонитрил, простой диэтиловый эфир, простой диметиловый эфир, дихлорметан, 1,4-диоксан, 2-метоксиэтанол, N,N-диметилформамид или смешанный из них растворитель и т.д. Конкретно не определяя, температура реакции, как правило, может составлять от -80 до 120°C, а время реакции предпочтительно составляет от 1 до 24 часов.
Указанное выше соединение (II) также можно получать посредством реакции из стадий 7-11, как указано ниже.
Схема 4:
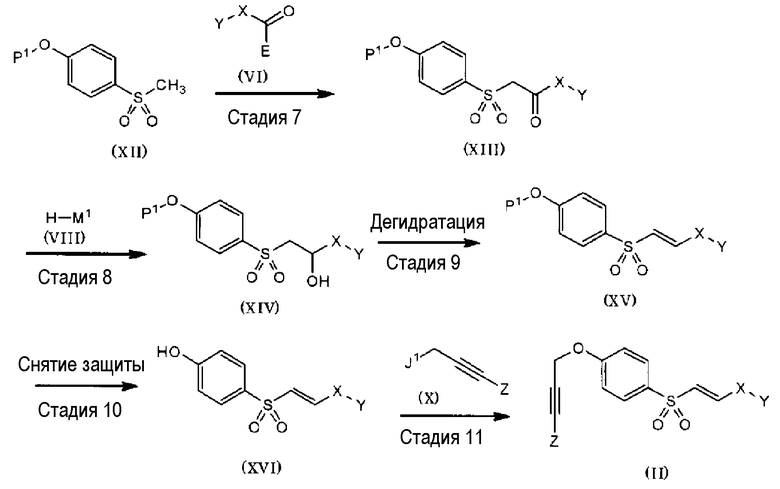
(В формулах, X, Y, Z, E, M1 и J1 являются такими, как указано выше; а P1 представляет собой гидроксильную защитную группу).
<Стадия 7>
На стадии 7 соединение, представленное общей формулой (XII), преобразуют в анион основанием, а затем подвергают реакции с соединением (VI) с получением соединения (XIII), так же, как на стадии 3.
<Стадия 8>
На стадии 8 соединение, представленное общей формулой (XIII), подвергают реакции с соединением, представленным общей формулой (VIII), с получением соединения (XIV), так же, как на стадии 4.
Понятно, что в зависимости от свойств X и Y, в реакции указанных выше стадии 7 и стадии 8 необходимо предварительно использовать соответствующую защитную группу и удалять защитную группу после реакции.
<Стадия 9>
На стадии 9 соединение (XIV) подвергают дегидратации с получением соединения (XV), так же, как на стадии 5.
На стадии 9 защитная группа P1 может спонтанно отщепляться от образуемого соединения, вследствие чего соединение может частично или полностью преобразовываться в соединение (XVI). В случае частичного преобразования стадию 10 можно проводить без отделения преобразуемого соединение; а в случае полного преобразования стадию 10 можно пропустить.
<Стадия 10>
На стадии 10 у соединения, представленного общей формулой (XV), снимают защиту любым известным способом в зависимости от типа защитной группы P1 в нем, таким образом, получая соединение, представленное общей формулой (XVI).
<Стадия 11>
На стадии 11 соединение (XVI) преобразуют соединением, представленным общей формулой (X), или его солью с получением соединения (II), так же, как на стадии 6.
Производное N-гидроксиформамида по изобретению, полученное, таким образом, указанным выше способом, можно выделять и очищать в виде его свободного соединения или в виде его соли, его гидрата или его сольватов различных типов, таких как его этанолат, или в виде его полиморфной формы. Фармацевтически приемлемую соль соединения общей формулы (I) можно получать посредством общепринятой реакции получения солей. Выделение и очистку можно проводить посредством химического способа экстрактивного фракционирования, кристаллизации, различных типов фракционирующей хроматографии и т.д. Оптический изомер можно получать в виде стереохимически чистого изомера посредством отбора подходящих исходных веществ или посредством оптического разрешения рацемических соединений.
Композиция по настоящему изобретению представляет собой композицию для поддержания функции тромбоцитов, где композиция в качестве активного ингредиента содержит описанное выше соединение, или его соль, или его сольват (далее в настоящем документе также обозначаемое как "соединение, представленное общей формулой (I), или т.п."). В настоящем изобретении фраза "поддержание функции тромбоцитов" в основном означает поддержание функции, связанной со свертыванием крови, такой как гемостаз и формирование тромба тромбоцитами. Композиция по настоящему изобретению способна обеспечивать эту функцию, подавляя опосредованное ADAM17 отщепление GPIbα (высвобождение посредством расщепления).
"Поддержание функции тромбоцитов" можно оценивать, например, способом, в котором оценивают адгезионную способность тромбоцитов с VWF с использованием системы с проточной камерой, как описано в международной публикации № WO2009/119105 и тестовом примере 15, описанным ниже, способом, в котором оценивают продолжительность жизни тромбоцитов in vivo с использованием мыши с тромбоцитопенией, способом, в котором наблюдают за формой тромбоцитов на покрытом фибриногеном покровном стекле в присутствии тромбина, способом биомолекулярной визуализации, как описано в тестовом примере 16 ниже, где модельное для формирование тромба животное получают с использованием лазерного облучения совместно с гематопорфирином и т.д. для наблюдения за кинетикой тромбоцитов на индивидуальном уровне у модельного животного, или посредством других подходов.
ADAM17 (дезинтегриновый и металлопептидазный домен 17) представляет собой белок со структурой, содержащей дезинтегриновый домен и обладающий металлопротеиназной активностью. ADAM17 представляет собой белок, также называемый TACE (фермент, конвертирующий TNF-альфа), так как ADAM17, кроме GPIbα, отщепляет мембраносвязанный TNF-α (фактор некроза опухоли-альфа) с получением свободного TNF-α. Как правило, получаемый у человека ADAM17 представляет собой белок (ген), указанный под номером доступа NP_003174.3 (№ NM_003183.4).
GPIbα (гликопротеин Ib альфа) представляет собой мембранный белок тромбоцитов и функционирует в качестве рецептора фактора фон Виллебранда (VWF). Кроме того, так как GPIbα в организме человека экспрессируется только на тромбоцитах, GPIbα также называют антигеном CD42b и используют в качестве поверхностного маркера тромбоцитов. Как правило, получаемый у человека GPIbα представляет собой белок (ген), указанный под номером доступа NP_000164.5 (№ NM_000173.5).
Хотя эталонные последовательности, зарегистрированные в GenBank, приводятся в качестве типичных примеров ADAM17 и GPIbα, аминокислотные последовательности белков в природе (т.е., не искусственно) могут быть мутантными. Таким образом, следует понимать, что ADAM17 и GPIbα вовлеченные в механизм действия композиции по настоящему изобретению, включают такие природные мутанты.
В настоящем изобретении фраза "подавление опосредованного ADAM17 отщепления GPIbα" включает полное подавление (ингибирование) и частичное подавление отщепления посредством ADAM17. Кроме того, как описано в примеры ниже, композицию по настоящему изобретению можно оценивать, как подавляющую опосредованное ADAM17 отщепление GPIbα, когда рассчитанный процент количества тромбоциты CD42b (GPIbα)(+) относительно общего количества тромбоцитов в присутствии композиции по настоящему изобретению представляет собой большее значение по сравнению с процентом, получаемым в отсутствие композиции по настоящему изобретению. Как степень отщепления GPIbα, подавляемого композицией по настоящему изобретению, процент количества CD42b(+) тромбоцитов в присутствии композиция по настоящему изобретению предпочтительно представляет собой 80% или более, а более предпочтителен еще более высокий процент (например, 85% или более, 90% или более, 95% или более).
Следует отметить, что когда способность композиции по настоящему изобретению к подавлению отщепления GPIbα оценивают способом, описываемым в тестовом примере 3 ниже, концентрация 50% ингибирования (IC50) предпочтительно представляет собой от 0,01 нмоль/л до 100 нмоль/л.
Примеры соединения, представленного общей формулой (I), в качестве активного ингредиента композиции по настоящему изобретению включают N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамид,
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диметиламинометилфенил)этил]-N-гидроксиформамид,
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}-2-метоксиацетамид,
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}метансульфонамид,
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}бензамид,
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-морфолин-4-илметилфенил)этил]-N-гидроксиформамид,
N-гидрокси-N-[1-(4-морфолин-4-илметилфенил)-2-(4-пент-2-инилоксибензолсульфонил)этил]формамид,
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диметиламинофенил)этил]-N-гидроксиформамид,
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(3-диметиламинофенил)этил]-N-гидроксиформамид,
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(2-диметиламинофенил)этил]-N-гидроксиформамид,
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-пиперидин-1-илметилфенил)этил]-N-гидроксиформамид,
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(3-пиперидин-1-илметилфенил)этил]гидроксиформамид,
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(3-морфолин-4-илметилфенил)этил]-N-гидроксиформамид,
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-{4-[(этилметиламино)метил]фенил]этил}-N-гидроксиформамид,
N-(2-(4-бут-2-инилоксибензолсульфонил)-1-{3-[(этилметиламино)метил]фенил}этил)-N-гидроксиформамид,
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}-N-метилметансульфонамид,
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}-4-метилбензолсульфонамид,
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}-4,N-диметилбензолсульфонамид,
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}-N-метилсульфонилметансульфонамид,
N-{2-(4-бут-2-инилоксибензолсульфонил)-1-[4-(2-диметиламиноэтил)фенил]этил}-N-гидроксиформамид,
N-{2-(4-бут-2-инилоксибензолсульфонил)-1-[4-(2-морфолин-4-илэтил)фенил]этил}-N-гидроксиформамид,
N-(2-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]фенил}этил)метансульфонамид,
N-{2-(4-бут-2-инилоксибензолсульфонил)-1-[4-(3-диметиламинопропил)фенил]этил}-N-гидроксиформамид,
N-{2-(4-бут-2-инилоксибензолсульфонил)-1-[4-(3-диэтиламинопропил)фенил]этил}-N-гидроксиформамид,
N-{2-(4-бут-2-инилоксибензолсульфонил)-1-[4-(3-морфолин-4-илпропил)фенил]этил}-N-гидроксиформамид,
N-{2-(4-бут-2-инилоксибензолсульфонил)-1-[4-(4-морфолин-4-илбутил)фенил]этил}-N-гидроксиформамид,
N-{4-[1-(формилгидроксиамино)-2-(4-пент-2-инилоксибензолсульфонил)этил]бензил}метансульфонамид и
N-{4-[1-(формилгидроксиамино)-2-(4-окт-2-инилоксибензолсульфонил)этил]бензил}метансульфонамид. Как описано в тестовом примере 4 ниже, с точки зрения наличия высокой специфичности к ADAM17, предпочтительными являются N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамид или N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}метансульфонамид.
Следует отметить, что N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамид в примерах, описанных ниже, представляет собой "I-1" или "S-45282", и N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}метансульфонамид в примерах, описанных ниже, представляет собой "I-4" или "S-45457".
Примеры формы композиции по настоящему изобретению включают лекарственную добавку и реагент, используемый с целью исследования и разработки (например, исследования и разработки in vitro и in vivo).
Композиция по настоящему изобретению обладает действием поддержания функции тромбоцитов посредством подавления опосредованного ADAM17 отщепления GPIbα. Таким образом, композицию по настоящему изобретению можно соответственно использовать в качестве реагента для поддержания функции тромбоцитов (например, реагента, используемого в культуральной системе для дифференцировки мегакариоцитов из клеток, способных к дифференцировке в мегакариоциты, а затем получения тромбоцитов из мегакариоцитов, или реагента для поддержания функции получаемых тромбоцитов, посредством добавления реагента) или в качестве лекарственной добавки, добавляемой к препарату крови, содержащему тромбоциты после донорства и т.п. Когда ее используют в качестве описанных выше добавок или реагентов, композиция по настоящему изобретению в дополнение к соединению, представленному общей формулой (I), или т.п. в качестве активного ингредиента, может содержать, например, стабилизатор, растворитель или т.п.
Продукт (например, реагент, лекарственная добавка) композиции по настоящему изобретению или его протокол можно маркировать с указанием того, что применение предназначено для поддержания функции тромбоцитов. В настоящем документе, фраза "продукт или протокол маркированы" означает, что тело продукта, его контейнер или упаковка или т.п. маркированы, или что маркированы протокол, приложенный документ, рекламное сообщение, другие печатные материалы или т.п., описывающие информацию о продукте. Этикетка, указывающая на то, что применение предназначено для поддержания функции тромбоцитов, может содержать информацию о механизме, посредством которого соединение, представленное общей формулой (I), или т.п. в качестве активного ингредиента композиции по настоящему изобретению демонстрирует эффект поддержания функции тромбоцитов. Пример информации об организме включает информацию о том, что функцию тромбоцитов поддерживают посредством подавления опосредованного ADAM17 отщепления GPIbα. Кроме того, этикетка, указывающая на то, что применение предназначено для поддержания функции тромбоцитов, может содержать информацию о том, что применение предназначено для получения или хранения тромбоцитов или для других целей.
Соединение, представленное общей формулой (I), или т.п. служит в качестве активного ингредиента для получения композиции по настоящему изобретению. Таким образом, настоящее изобретение также относится к: применению соединения, представленного общей формулой (I), или т.п. для получения композиции по настоящему изобретению и к способу получения композиции по настоящему изобретению, содержащей соединение, представленное общей формулой (I), или т.п.
Кроме того, настоящее изобретение относится к культуре, которая представляет собой культуральную систему для дифференцировки мегакариоцитов из клеток, способных к дифференцировке в мегакариоциты, и для получения тромбоцитов из мегакариоцитов, и которую добавляют к системе с соединением, представленным общей формулой (I), или т.п. Кроме того, настоящее изобретение относится к способу получения тромбоцитов, где способ включает добавление, соединения, представленного общей формулой (I), или т.п. в культуральную систему для дифференцировки мегакариоцитов из клеток, способных к дифференцировке в мегакариоциты, и получение тромбоцитов из мегакариоцитов.
В настоящем изобретении "мегакариоциты" представляют собой клетки, также называемые клетки-предшественники тромбоцитов или мегакариоцитарные клетки, и они делят цитоплазму с получением тромбоцитов.
В настоящем изобретении "клетки, способные к дифференцировке в мегакариоциты" конкретно не ограничены при условии, что клетки способны к дифференцировке в мегакариоциты. Их примеры включают оплодотворенные яйцеклетки, плюрипотентные стволовые клетки, такие как эмбриональные стволовые клетки (ES клетки), индуцированные плюрипотентные стволовые клетки (iPS клетки), эмбриональные половые клетки (EG клетки), гемопоэтические стволовые клетки, гемопоэтические клетки-предшественники, мегакариобласты и адипоциты. Гемопоэтические стволовые клетки и гемопоэтические клетки-предшественники можно получать из костного мозга, пуповинной крови или т.п. Кроме того, среди них предпочтительны iPS клетки с точки зрения отсутствия этических проблем вследствие того, что не происходит разрушения эмбриона, и простоты приведения в соответствие с типом лейкоцитарного антигена человека (HLA) у пациента, которому производят трансфузию тромбоцитов, получаемых по настоящему изобретению. Кроме того, iPS клетки, получаемые с использованием 4 факторов (Oct3/4, Sox2, Klf4 и c-Myc), являются более предпочтительными с точки зрения того, что количество мегакариоцитов, получаемых из iPS клеток, может продолжать увеличиваться до суток от 25 до 35 после начала культивирования iPS клеток, и что количество тромбоцитов, продуцируемых из мегакариоцитов, в 2-10 раз больше, чем количество тромбоцитов из iPS клеток, получаемых с использованием 3 факторов (Oct3/4, Sox2 и Klf4). Следует отметить, что авторы настоящего изобретения подтвердили, что такое увеличение количества количество получаемых мегакариоцитов и тромбоцитов вызвано реактивацией гена c-Myc.
Кроме того, вид животного, у которого получают описанные выше клетки, используемые в способе по настоящему изобретению, конкретно не ограничен. Его примеры включают человека, мышь, крысу, собаку, кошку, крупный рогатый скот, лошадь, овцу и т.п. Предпочтительными являются мышь, крыса и человек, более предпочтительными являются мышь и человек, а особенно предпочтительным является человек.
Примеры "культуральной системы для дифференцировки мегакариоцитов из клеток, способных к дифференцировке в мегакариоциты, и получения тромбоцитов из мегакариоцитов" в настоящем изобретении включают культуральную систему для формирования эмбриоидных телец (клеточная популяция, содержащая индуцированные к дифференцировке, недифференцированные мезодермальные клетки) в середине процесса получения тромбоцитов (Eto et al., Proc. Natl. Acad. Sci. USA, 2002, vol. 99, pp. 12819-12824 и т.д.), культуральную систему для формирования капсулообразной структуры (капсульной структуры), содержащей гемопоэтические клетки-предшественники (см. PTL с 1 по 3 и т.д.), культуральную систему для получения тромбоцитов из получаемых из пуповинной крови гемопоэтических клеток-предшественников (см. Robert et al., "Glycoprotein Ibalpha receptor instability is associated with loss of quality of platelets produced in culture"., Stem Cells and Development, опубликованную онлайн 26 мая 2010 года и т.д.) и т.п. (для информации о других см. Fujimoto et al., Blood, 2003, vol. 102, pp. 4044-4051: Hiroyama et al., Exp. Hematol., 2006, vol. 34, pp. 760-769: Gaur et al., J. Thromb. Haemost., 2005, vol. 4, pp. 436-442; и т.д.). Среди них предпочтительной является культуральная система для формирования капсулообразной структуры, так как гемопоэтические клетки-предшественники концентрируются в капсулообразной структуре, обеспечивая эффективное получение мегакариоцитов, тромбоцитов и т.п. ex vivo.
Условия культивирования культуральной системы по настоящему изобретению конкретно не ограничены, при условии, что условия подходят для культивирования мегакариоцитов и получение тромбоцитов. Температура культивирования предпочтительно составляет от 35 до 38°C, более предпочтительно 37°C. Если температура культивирования не достигает нижнего предела, количества получаемых мегакариоцитов и тромбоцитов, как правило, являются низкими. Если температура культивирования превосходит верхний предел, культивирование и поддержание клеток, как правило, является сложным.
Кроме того, когда "клетки, способные к дифференцировке в мегакариоциты" по настоящему изобретению культивируют (в частности, в процессе индукции дифференцировки в мегакариоциты), клетки предпочтительно совместно культивируют с фидерными клетками. "Фидерные клетки", применяемые в настоящем документе, конкретно не ограничены при условии, что фидерные клетки способствуют индукции дифференцировки "клеток, способных к дифференцировке в мегакариоциты". Например, можно использовать эмбриональные фибробласты мыши, предпочтительно клеточную линию 10T1/2, клетки OP9 и т.п. Пример клеток, отличных от иммортализованных клеточных линий включает получаемые из костного мозга мезенхимальные стволовые клетки человека (культивируемые клетки, непосредственно получаемые из костного мозга человека). Даже когда в качестве фидерных клеток используют мезенхимальные стволовые клетки, возможно созревание мегакариоцитов и получение тромбоцитов из ES клеток или iPS клеток человека. Тромбоциты также можно индуцировать посредством культивирования на внеклеточном субстрате, таком как матригель, но эффективность является низкой. Когда используют "фидерные клетки", предпочтительно подавлять рост клеток посредством радиоактивного излучения или т.п.
Количество (концентрация) соединения, представленного общей формулой (I), или т.п., добавляемого к культуральной системе, предпочтительно составляет от 0,01 до 100 мкМ. Если добавляемое количество не достигает нижнего предела, как правило, это приводит к трудностям в подавлении расщепления GPIbα на тромбоцитах. Если количество превосходит верхний предел, как правило, подавлен рост клеток. Кроме того, период добавления соединения, представленного общей формулой (I), или т.п. к культуральной системе предпочтительно составляет всю продолжительность периода продукции из гемопоэтических клеток-предшественников в тромбоциты, с точки зрения обеспечения однородности в процессе культивирования и обеспечения однородности продукции вне зависимости от неоднородного состояния для дифференцировки клеток крови. Это сильно отличается от периода добавления GM6001, который ограничен периодом продукции из мегакариоцитов в тромбоциты.
Далее в настоящем документе способ получения тромбоцитов по настоящему изобретению будет более конкретно описан на основании примера способа формирования капсулообразной структуры соответственно используемой для культуральной системы по настоящему изобретению.
Во-первых, приведено описание способа формирования капсулообразной структуры (капсульной структуры). Условия культивирования подходящие для получения капсулообразной структуры, варьируют в зависимости от используемых ES клеток или iPS клеток. Однако, например, в качестве среды используют модифицированную по способу Исков среду Дульбекко (IMDM), дополненную FBS до конечной концентрации 15%. При этом даже в случае не содержащей сыворотки среды в нее при необходимости в использовании можно добавлять фактор роста, добавку или т.п. Кроме того, для эффективного формирования капсулообразной структуры следует добавлять фактор роста эндотелия сосудов (VEGF) при концентрации приблизительно от 0 до 300 нг/мл, более предпочтительно приблизительно 20 нг/мл. Условия культивирования варьируют в зависимости от типа используемых ES клеток или iPS клеток. Однако предпочтительно условия составляют 5% CO2 при температуре от 35 до 38°C, более предпочтительно 37°C. Период культивирования до формирования капсулообразной структуры варьирует в зависимости от типа ES клеток или iPS клеток, но ее наличие можно наблюдать приблизительно на сутки 15 (от 14 до 16 суток позже) после посева на фидерные клетки.
Формируемая капсулообразная структура обладает фолликулярной структурой. В этой структуре гемопоэтические клетки-предшественники, в частности CD34-позитивные клетки, присутствуют в концентрированном состоянии. Гемопоэтические клетки-предшественники, находящиеся внутри капсулообразной структуры, можно разделять физическими способами, например, пропуская клетки через стерилизованное ситоподобное устройство (например, клеточный фильтр или т.п.).
Далее приведено описание способа получения тромбоцитов из гемопоэтических клеток-предшественников, разделяемых из капсулообразной структуры. Гемопоэтические клетки-предшественники, получаемые посредством разделения, высевают на фидерные клетки и культивируют в условиях, подходящих для получения мегакариоцитов и тромбоцитов. В настоящем документе, примеры "условий, подходящих для получения мегакариоцитов и тромбоцитов" включают культивирование в течение периода приблизительно от 7 до 15 суток в присутствии тромбопоэтина (TPO, приблизительно от 10 до 200 нг/мл, предпочтительно 100 нг/мл) или в присутствии фактора стволовых клеток (SCF, приблизительно от 10 до 200 нг/мл, предпочтительно 50 нг/мл), гепарина (приблизительно от 10 до 100 Ед/мл, предпочтительно 25 Ед/мл) и TPO (приблизительно от 10 до 200 нг/мл, предпочтительно 100 нг/мл). В качестве условий культивирования предпочтительны условия 5% CO2 при температуре от 35 до 38°C, более предпочтительно 37°C.
Кроме того, в такой культуральной системе расписание добавление соединения, представленного общей формулой (I), или т.п. в эту культуральную систему предпочтительно представляет собой период, когда гемопоэтические клетки-предшественники пересевают на фидерные клетки. Более предпочтительно добавлять соединение, представленное общей формулой (I), или т.п. приблизительно на сутки 22 от начала культивирования (на сутки от 20 до 23 или на сутки от 6 до 10 после пересевания капсулообразной структуры).
Кроме того, в способе по настоящему изобретению тромбоциты можно получать посредством: сбора фракции раствора культуры (например, в способе формирования капсулообразной структуры фракция присутствует приблизительно на сутки от 22 до 28 после культивирования iPS клеток или ES клеток человека), богатую высвобождающимися из мегакариоцитов тромбоцитами; а затем удаляя компоненты, отличные от тромбоцитов (т.е., мегакариоциты и другие клетки крови) с использованием фильтра для снижения количества лейкоцитов (например, доступного в Terumo Corporation, Asahi Kasei Medical Co., Ltd. и т.д.) или т.п.
Как описано выше, соединение, представленное общей формулой (I), или т.п. подавляет опосредованное ADAM17 отщепление GPIbα и влияет на поддержание функции тромбоцитов. Таким образом, настоящее изобретение также относится к препарату крови, содержащему тромбоциты и соединение, представленное общей формулой (I), или т.п.; оно также относится к способу поддержания функции тромбоцитов в препарате крови, где способ включает добавление в препарат крови, содержащий тромбоциты, соединения, представленного общей формулой (I), или т.п.
Кроме того, соединение, представленное общей формулой (I), или т.п. служит в качестве активного ингредиента для получения препарата крови, содержащего тромбоциты. Таким образом, настоящее изобретение также относится к соединению, представленному общей формулой (I), или т.п. в качестве лекарственной добавки, используемой для получения препарата крови по настоящему изобретению.
Тромбоциты, содержащиеся в препарате крови по настоящему изобретению, конкретно не ограничены и могут представлять собой тромбоциты, полученные описанным выше способом получения тромбоцитов по настоящему изобретению, или могут представлять собой тромбоциты, получаемые из периферической крови или т.п. получаемые посредством сбора крови. Когда получают такой препарат крови, препарат крови также может содержать другие ингредиенты, используемые для стабилизации тромбоцитов, принимая в расчет нестабильность тромбоцитов и т.п. при хранении. Условия для стабилизации тромбоцитов можно выбирать из числа способов, хорошо известных специалистам в данной области. Например, продукт можно получать, суспендируя тромбоциты в растворе, необходимом для функционирования тромбоцитов (например, раствор ACD-A (раствор, получаемый из цитрата натрия/лимонной кислоты/глюкозы) и т.п.; в некоторых случаях, при необходимости, можно добавлять замороженную плазму или т.п.) в подходящей концентрации (например, приблизительно от 1×108 до 1×1010 тромбоцитов/мл, предпочтительно приблизительно 1×109 тромбоцитов/мл). Следует отметить, что в качестве контейнера для хранения продукта, содержащего тромбоциты, предпочтительно избегать использования материала, активирующего тромбоциты, такого как стекло. Количество (концентрация) добавляемого соединения, представленного общей формулой (I), или т.п. предпочтительно составляет от 0,01 до 100 мкмоль/л. Если добавляемое количество не достигает нижнего предела, тромбоциты, как правило, не сохраняют функцию адгезии. Даже если количество превосходит верхний предел, эффекты находятся на плато.
[Примеры]
Далее в настоящем документе настоящее изобретение будет описано более конкретно на основе примеров и тестовых примеров. Однако настоящее изобретение не ограничено приведенными ниже примерами. Следует отметить, что мегакариоциты и тромбоциты, используемые в тестовых примерах, описанных ниже, получали и анализировали способами, описанными ниже.
<Получение ES клеток человека, iPS клеток человека и фидерных клеток>
В качестве ES клеток человека (hES клетки), использовали клеточную линию KhES (KhES-3), разработанную и поставляемую Institute for Frontier Medical Sciences, Kyoto University.
В качестве iPS клеток человека (hiPS клетки) также использовали клеточную линию iPS (TkDA3-4), разработанную в University of Tokyo посредством внесения Oct4, Klf4, Sox2 и c-Myc в получаемые у человека клетки кожи. Кроме того, культивировали клетки TkDA3-4 на подвергнутых радиоактивному облучению фибробластах мыши в смеси модифицированной Дульбекко среды Игла и среды Хама F-12 (произведенной Sigma-Aldrich Co.) (коэффициент смешения 1:1), дополненной 0,1 мМ не являющейся незаменимой аминокислотой (произведенной Invitrogen Corp.), 2 мМ L-глутамином (произведенным Invitrogen Corp.), 20% добавкой заменителя сыворотки KnockOut (KSR, произведенной Invitrogen Corp.), 0,1 мМ 2-меркаптоэтанолом и 5 нг/мл основного фактора роста фибробластов (bFGF, произведенного Upstate). Клетки пересевали в течение каждых 3 суток и использовали клетки, сохраняющие недифференцированное состояние.
Кроме того, в минимальной среде Игла (BME, произведенной Invitrogen Corp.), дополненной 10% эмбриональной телячьей сывороткой (FBS) и 2 мМ L-глутамином, культивировали получаемые из эмбрионов мыши фибробласты, клеточную линию C3H10T1/2 (далее в настоящем документе также обозначаемая как "клетки 10T1/2"), приобретенную в RIKEN BioResource Center. Затем, клетки 10T1/2 доводили до количества клеток 8 × 106/10 см чашку, и подвергали радиоактивному облучению 50 Гр для применения в качестве фидерных клеток.
<Получение и анализ мегакариоцитов и тромбоцитов>
ES клетки человека или iPS клетки человека высевали на фидерные клетки так, чтобы количество клеток составляло от 5×104 до 1×105/10 см чашку. Клетки культивировали в модифицированной по способу Исков среде Дульбекко (IMDM, произведенной Invitrogen Corp/GIBCO), дополненной 15% FBS (название продукта: CELLect(TM) GOLD, произведенной ICN Biomedicals Inc.), 2 мМ L-глутамином (произведенным Invitrogen Corp.), добавкой ITS (10 мкг/мл инсулина, 5,5 мг/мл трансферрина человека, 5 нг/мл селенита натрия) (произведенной Sigma-Aldrich Co.), 50 мкг/мл аскорбиновой кислоты (Sigma-Aldrich Co.), 0,45 мМ α-монотиоглицерином (MTG, произведенным Sigma-Aldrich Co.) и 20 нг/мл фактора роста эндотелия сосудов (VEGF, произведенного R&D Systems, Inc.). Кроме того, это культивирование проводили при 37°C в 5% CO2 и 21% O2 (атмосферный кислород) с использованием CO2 инкубатора (название продукта: HERA CELL 150i, произведенного Thermo Fisher Scientific K. K.). Затем среду заменяли каждые 3 суток и культивирование продолжали в этих условиях до суток 15, когда наблюдали большое количество капсульных структур (капсулообразных структур), содержащих в них гемопоэтические клетки-предшественники.
Затем после отделения от чашки капсульные структуры разрушали и суспендировали в содержащем 3% FBS фосфатно-солевом буфере (PBS). Затем суспензию пропускали через 40 мкм клеточный фильтр (произведенный BD). Профильтрованный таким образом раствор центрифугировали при 440×g в течение 10 минут для сбора гемопоэтических клеток-предшественников и клетки подсчитывали. Гемопоэтические клетки-предшественники высевали на свежеполученные в 6-луночном планшете (6×105 клеток/планшет) клетки 10T1/2, подвергнутые радиоактивному излучению 50 Гр, так, что количество гемопоэтических клеток-предшественников составляло 2-3×104/лунку. Затем гемопоэтические клетки-предшественники культивировали в течение 8 суток в IMDM (произведенной Invitrogen Corp/GIBCO), дополненной 15% FBS (название продукта: CELLect(TM) GOLD, произведенной ICN Biomedicals Inc.), 2 мМ L-глутамином (произведенным Invitrogen Corp.), добавкой ITS (10 мкг/мл инсулина, 5,5 мг/мл трансферрина, 5 нг/мл селенита натрия) (произведенной Sigma-Aldrich Co.), 50 мкг/мл аскорбиновой кислоты (произведенной Sigma-Aldrich Co.), 0,45 мМ MTG (произведенной Sigma-Aldrich Co.), 100 нг/мл тромбопоэтина человека (TPO человека, произведенного PeproTech, Inc.), 50 нг/мл фактора стволовых клеток человек (SCF, произведенного PeproTech, Inc.) и 25 Ед/мл гепарина. Таким образом индуцировали мегакариоциты/тромбоциты.
Затем индуцированные мегакариоциты/тромбоциты собирали раствором антикоагулянта (кислый цитрат декстрозы, ACD), с последующим центрифугированием при 900 об./мин. в течение 10 минут без перерыва. Супернатант, полученный центрифугированием, дополнительно центрифугировали при 1500 об./мин. в течение 10 минут без перерыва с удалением супернатанта. Затем анализировали количества мегакариоцитов и тромбоцитов в полученном таким образом осадке посредством проточной цитометрии с использованием антител для окрашивания.
Следует отметить, что при проточной цитометрии использовали FACS Aria, произведенное Becton, Dickinson and Company. В качестве антител, используемых для окраски мегакариоцитов и тромбоцитов, использовали модифицированное фикоэритрином(PE) антитело к CD42a (GPIX) человека, модифицированное PE антитело к CD42b (GPIbα) человека и меченное аллофикоцианином (APC) антитело к CD41a (интегриновый комплекс αIIbbeta3, клон HIP8) (произведенные BD Bioscience). Кроме того, для точного измерения абсолютных количеств мегакариоцитов и тромбоцитов клетки окрашивали этими антителами и анализ также проводили посредством проточной цитометрии с использованием гранул TruCount (произведенных BD Bioscience).
(Тестовый пример 1) Индукция мегакариоцитов/тромбоцитов из получаемых из ES клеток гемопоэтических клеток-предшественников в условиях комнатной температуры
Для проверки того, возможно или нет индуцировать мегакариоциты/тромбоциты посредством культивирования в условиях комнатной температуры (культивирование при 25°C), индукцию мегакариоцитов/тромбоцитов из полученных из ES клеток гемопоэтических клеток-предшественников, полученных, как описано выше, проводили в условиях, проиллюстрированных на фиг.1. В частности, в описанном выше 8-суточном процессе культивирования для индукции гемопоэтических клеток-предшественников в мегакариоциты/тромбоциты каждое культивирование проводили в следующих условиях:
Контроль: культивирование при 37°C в течение 8 суток
Культивирование при комнатной температуре в течение 2 суток: культивирование при 37°C в течение 6 суток с последующим культивированием при 25°C в течение 2 суток, и
Культивирование при комнатной температуре: культивирование при 25°C в течение 8 суток.
Затем посредством проточной цитометрии определяли количества мегакариоцитов и тромбоцитов, собранных, как описано выше. Полученные результаты представлены на фиг.2 и 3.
Как видно из результатов, представленных на фиг.2 и 3, мегакариоциты и тромбоциты посредством культивирования при 25°C в течение 8 суток получали в незначительных количествах. Кроме того, при культивировании при 25°C в течение 2 суток перед анализом проточной цитометрией мегакариоциты и тромбоциты получали, но количества составляли только приблизительно половину от количеств в контроле.
(Тестовый пример 2) Индукция мегакариоцитов/тромбоцитов из получаемых из пуповинной крови клеток CD34(+) в условиях комнатной температуры
Проводили проверку того, возможно или нет индуцировать тромбоциты из полученных из пуповинной крови клеток CD34(+) посредством культивирования в условиях комнатной температуры (культивирование при температуре от 24 до 25°C).
Сначала отбирали 106 клеток CD45низк CD34+ и выделяли из пуповинной крови (CB) с использованием колонки с гранулами. Из полученных получаемых из пуповинной крови клеток CD34(+) 4×104 клеток высевали на фидерные клетки, описанные выше, и культивировали в течение 4 суток в среде A (IMDM (произведенной Invitrogen Corp/GIBCO), дополненной 15% FBS (название продукта: CELLect(TM) GOLD, произведенной ICN Biomedicals Inc.), 2 мМ L-глутамином (произведенным Invitrogen Corp.), добавкой ITS (10 мкг/мл инсулина, 5,5 мг/мл трансферрина, 5 нг/мл селенита натрия) (произведенной Sigma-Aldrich Co.), 50 мкг/мл аскорбиновой кислоты (произведенной Sigma-Aldrich Co.), 0,45 мМ MTG (произведенной Sigma-Aldrich Co.) и смесью цитокинов (2 нг/мл TPO (произведенной PeproTech, Inc.), 7,5 нг/мл SCF (произведенной PeproTech, Inc.), 11 нг/мл FLT-3)). На сутки 4 после культивирования к получаемым из пуповинной крови клеткам CD34(+) добавляли среду B в том же количестве, как и среду A. Следует отметить, что среда B отличается от среды A тем, что среду B в качестве смеси цитокинов дополняли 30 нг/мл TPO, 1 нг/мл SCF, 7,5 нг/мл IL-6 и 13,5 нг/мл IL-9. При этом среда A и среда B имеют тот же состав, за исключением того, что отличаются смеси цитокинов.
Затем культивируемые таким образом получаемые из пуповинной крови клетки CD34(+) на сутки 7 доводили до количества 4×105 клеток/мл среды B. Клетки дополнительно культивировали в течение 7 суток при 37°C (контроль) или дополнительно культивировали в течение 7 суток при температуре от 24 до 25°C (культивирование при комнатной температуре). На сутки 14 после начала культивирования, подсчитывали количества мегакариоцитов и тромбоцитов посредством проточной цитометрии. Полученные результаты представлены на фиг.4 и 5.
Как видно из результатов, представленных на фиг.4 и 5, мегакариоциты и тромбоциты посредством культивирования при приблизительно 25°C в течение 7 суток получали в незначительных количествах, как в случае получаемых из ES клеток гемопоэтических клеток-предшественников, описанных выше. Таким образом, результаты, представленные в тестовых примерах 1 и 2, демонстрируют, что в культуральной системе для дифференцировки мегакариоцитов из клеток, способных к дифференцировке в мегакариоциты, таких как ES клетки и получаемые из пуповинной крови клетки CD34(+), для получения тромбоцитов из мегакариоцитов, температура культивирования предпочтительно составляет приблизительно 37°C, при этом мегакариоциты и тромбоциты посредством культивирования в условиях комнатной температуры приблизительно 25°C получать невозможно.
Однако, если температура культивирования в культуральной системе для получения тромбоцитов составляет приблизительно 37°C, ADAM17 отщепляет GPIbα, который является важным фактором свертывания крови, расположенным на поверхности тромбоцитов. Это приводит к проблеме трудности получения тромбоцитов, не демонстрирующих функцию гемостаза. При этом для подавления отщепления GPIbα к культуральной системе можно добавлять ингибиторы (например, GM6001), направленные на металлопротеиназы, включая ADAM17. Однако в таком случае также будут ингибированы металлопротеиназы, существенные для гемопоэтической функции (MMP-9, MMP-14), отличные от ADAM17. Таким образом, такие ингибиторы необходимо добавлять только в определенный период, когда наблюдают наиболее обильную продукцию тромбоцитов, и они не являются предпочтительными для организации предприятия или т.п. для культуральной системы, продуцирующей тромбоциты. Кроме того, когда in vivo вводят неспецифические ингибиторы металлопротеиназ, такие как GM6001, существуют опасения относительно безопасности. Таким образом, по любой из этих причин использование тромбоцитов, смешанных с такими ингибиторами в качестве препарата крови, не является предпочтительным.
По этим причинам, разработаны и синтезированы соединения, специфически ингибирующие ADAM17, описанные в примерах ниже. Следует отметить, спектры 1H-ЯМР, описанные ниже, измеряли с применением спектрометра ECA400 (400 МГц, произведенного JEOL Ltd.) с использованием в качестве растворителя дейтерированного хлороформа (CDCl3) или дейтерированного диметилсульфоксида (ДМСО-d6), и тетраметилсилана (TMS) в качестве внутреннего стандарта. При измерении результата химических сдвигов, значения δ выражали в м.д., и значения константы взаимодействия J выражали в Гц. Сокращение с означает синглет; д, дублет; т, триплет; к, квартет; дд, двойной дублет; м, мультиплет; и ушир., уширенный. Для определения масс-спектров низкого разрешения (быстрая бомбардировка атомов: FAB-МС), использовали модель JEOL Ltd. JMS-HX-110A, а для определения масс-спектров (ионизация распылением в электрическом поле: ESI-МС), использовали Exactive произведенный Thermo Fisher Scientific K. K.
(Пример 1)
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамид (I-1)
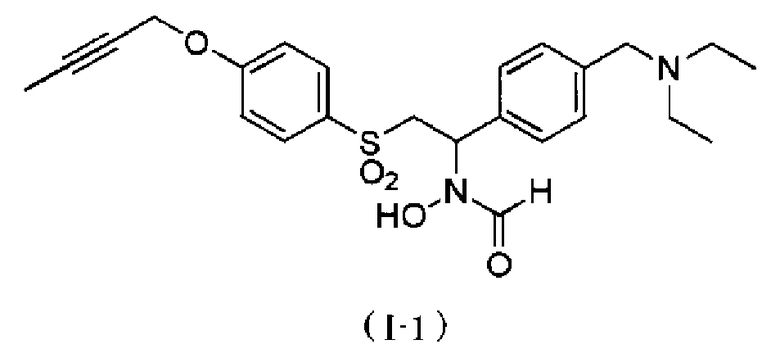
(1-1): 1-бут-2-инилокси-4-метансульфонилбензол (V-1)
В раствор 2,12 г (15,9 ммоль) 1-бром-2-бутина в диметилсульфоксиде (30 мл) добавляли 2,88 г (15,9 ммоль) 4-метилсульфонилфенола и растворяли в нем, а затем в него добавляли 2,64 г (19,1 ммоль) карбоната калия. После перемешивания в течение 6 часов, в него добавляли насыщенный солевой раствор и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Получали 3,39 г (15,11 ммоль) 1-бут-2-инилокси-4-метансульфонилбензола (V-1) в виде плохоочищенного продукта (выход 95%). Его физические свойства приведены ниже.
МС (FAB) m/z: 225 (M+H)+.
1H-ЯМР(CDCl3): δ 7,88 (2H, м), 7,10 (2H, м), 4,73 (2H, м), 3,04 (3H, с), 1,87 (3H, т, J=2,3 Гц).
(1-2): трет-бутил-{4-[2-(4-бут-2-инилоксибензолсульфонил)ацетил]бензил}карбамат (VII-1)
К раствору 1,36 г (6,08 ммоль) соединения (V-1), полученного в указанном выше (1-1), в тетрагидрофуране (70 мл) в атмосфере аргона при -78°C добавляли 3,65 мл (7,29 ммоль) раствора 2,0 M диизопропиламида лития в гексане-гептане-этилбензоле, перемешивали в течение 30 минут, а затем в него добавляли 12,16 мл (12,16 ммоль) раствора 1,0 M гексаметилдисилазида лития в тетрагидрофуране и 5 мл раствора 1,61 г (6,08 ммоль) метил-4-(трет-бутоксикарбониламинометил)бензоата в тетрагидрофуране. После перемешивания при -78°C в течение 5 минут, его постепенно нагревали до комнатной температуры и перемешивали в течение 1 часа. После добавления в него насыщенного солевого раствора, его экстрагировали этилацетатом, и насыщенным солевым раствором промывали органический слой. После сушки над безводным сульфатом магния, при пониженном давлении выпаривали растворитель. После очистки посредством хроматографии на колонке с силикагелем (гексан/этилацетат=2/1→1/1) получали 2,02 г (4,41 ммоль) трет-бутил-{4-[2-(4-бут-2-инилоксибензолсульфонил)ацетил]бензил}карбамата (VII-1) в виде бесцветного расплавленного карамелеобразного вещества (выход 72%). Его физические свойства приведены ниже.
МС (FAB) m/z: 480 (M+Na)+.
1H-ЯМР (CDCl3): δ 7,93 (2H, ушир.д, J=8,2 Гц), 7,81 (2H, м), 7,40 (2H, ушир.д, J=8,2 Гц), 7,07 (2H, м), 4,72 (2H, м), 4,70 (2H, с), 4,39 (2H, м), 1,87 (3H, т, J=2,3 Гц), 1,57 (9H, с).
(1-3): трет-бутил-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-гидроксиэтил]бензил}карбамат (IX-1)
В раствор 2,02 г (4,41 ммоль) соединения (VII-1), полученного в указанном выше (1-2), в метаноле (50 мл) при 0°C добавляли 167 мг (4,41 ммоль) борогидрида натрия. После перемешивания в течение 2 часов и 30 минут, в него добавляли насыщенный солевой раствор и водный насыщенный раствор хлорида аммония. Метанол выпаривали при пониженном давлении, затем остаток экстрагировали этилацетатом, и органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении с получением 2,04 г (4,41 ммоль) трет-бутил-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-гидроксиэтил]бензил}карбамата (IX-1) в виде плохоочищенного аморфного твердого вещества (выход 99%). Его физические свойства приведены ниже.
МС (FAB) m/z: 482 (M+Na)+.
(1-4): трет-бутил {4-[2-(4-бут-2-инилоксибензолсульфонил)винил]бензил}карбамат (II-1a)
К раствору 2,04 г (4,41 ммоль) соединения (IX-1), полученного в указанном выше (1-3), в дихлорметане (45 мл) и 3,1 мл (22,1 ммоль) триэтиламина при 0°C добавляли 0,7 мл (8,8 ммоль) метансульфонилхлорида. После перемешивания в течение 3 часов и 30 минут в него добавляли насыщенный солевой раствор и экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении, и остаток очищали посредством хроматографии на колонке с силикагелем (хлороформ/этилацетат=3/1) с получением 1,77 г (4,00 ммоль) трет-бутил-{4-[2-(4-бут-2-инилоксибензолсульфонил)винил]бензил}карбамата (II-1a) в виде бесцветного аморфного твердого вещества (выход 91%). Его физические свойства приведены ниже.
1H-ЯМР (CDCl3): δ 7,87 (2H, д, J=8,7 Гц), 7,61 (1H, д, J=15 Гц), 7,43 (2H, J=8,2 Гц), 7,30 (2H, д, J=8,2 Гц), 7,10 (2H, д, J=8,7 Гц), 6,82 (1H, д, J=15 Гц), 4,88 (1H, м), 4,71 (2H, м), 4,33 (2H, м), 1,86 (3H, м), 1,45 (9H, с).
(1-5): гидрохлорид 4-[(E)-2-(4-бут-2-инилоксибензолсульфонил)винил]бензиламина (II-1b)
К раствору 295 мг (0,67 ммоль) соединения (II-1a), полученного в указанном выше (1-4), в метаноле (5 мл) при 0°C добавляли 2 мл 4 M соляной кислоты/диоксана, перемешивали в течение 10 минут, нагревали до комнатной температуры и перемешивали в течение 2 часов. Растворитель выпаривали при пониженном давлении, затем в него добавляли 20 мл метанола, и растворитель снова выпаривали при пониженном давлении с получением гидрохлорида 4-[(E)-2-(4-бут-2-инилоксибензолсульфонил)винил]бензиламина (II-1b) в виде бесцветного твердого вещества. Его физические свойства приведены ниже.
1H-ЯМР (ДМСО-d6): δ 7,85 (2H, д, J=8,7 Гц), 7,78 (2H, д, J=8,2 Гц), 7,52 (2H, д, J=8,2 Гц), 7,20 (2H, д, J=8,7 Гц), 4,87 (2H, м), 4,05 (2H, м), 1,83 (3H, м).
(1-6): {4-[(E)-2-(4-бут-2-инилоксибензолсульфонил)винил]бензил}диэтиламин (II-1c)
К раствору соединения (II-1b), полученного в указанном выше (1-5), в метаноле (6 мл) при 0°C добавляли 1 мл уксусного альдегида, 212 мг (1,00 ммоль) триацетоксигидробората натрия и 3 капли уксусной кислоты, а затем перемешивали при комнатной температуре в течение 1 часа и 30 минут. Затем в него добавляли насыщенный солевой раствор и насыщенный водный раствор бикарбоната натрия, и растворитель выпаривали при пониженном давлении. Его экстрагировали хлороформом, органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и остаток очищали посредством хроматографии на колонке с силикагелем (хлороформ/метанол=20/1→10/1) с получением 111,7 мг (0,28 ммоль) {4-[(E)-2-(4-бут-2-инилоксибензолсульфонил)винил]бензил}диэтиламина (II-1c) в виде бледно-желтого аморфного твердого вещества (двухстадийный выход 42%). Его физические свойства приведены ниже.
МС (FAB) m/z: 398 (M+H)+.
(1-7): N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]гидроксиламин (III-1)
К раствору 108 мг (0,27 ммоль) соединения (II-1c), полученного в указанном выше (1-6), в тетрагидрофуране (8 мл) добавляли 50% раствор гидроксиламина (3 мл) и перемешивали при комнатной температуре в течение 25 часов. Реакционный раствор выпаривали при пониженном давлении, а затем в него добавляли воду и экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Получали 92,9 мг (0,22 ммоль) N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]гидроксиламина (III-1) в виде бледно-желтого аморфного твердого вещества (выход 81%). Его физические свойства приведены ниже.
1H-ЯМР (CDCl3): δ 7,84 (2H, м), 7,27 (2H, м), 7,20 (2H, м), 7,07 (2H, м), 4,72 (2H, м), 3,75 (1H, м), 3,51 (2H, с), 3,33 (1H, м), 2,49 (4H, м), 1,87 (3H, с), 1,03 (6H, м).
(1-8): N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамид (I-1)
1 мл муравьиной кислоты охлаждали при 0°C, затем в нее капельно добавляли 0,3 мл уксусного ангидрида и перемешивали в течение 30 минут с получение смешанного раствора муравьиной кислоты/уксусного ангидрида. 0,6 мл смешанного раствора муравьиной кислоты/уксусного ангидрида, полученного ранее, при 0°C добавляли раствор 92 мг (0,21 ммоль) соединения (III-1), полученного в указанном выше (1-7), в тетрагидрофуране (3 мл) и перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении, а затем делали азеотропной с толуолом. Полученное маслянистое вещество растворяли в 2 мл хлороформа и 10 мл метанола и перемешивали в течение 12 часов. Раствор концентрировали при пониженном давлении, и полученное маслянистое вещество растворяли в хлороформе и нейтрализовали насыщенным водным раствором бикарбоната натрия, добавляемым в него. После экстракции хлороформом экстракт промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Очищая посредством хроматографии на колонке с силикагелем при среднем давлении (хлороформ/метанол=95/5→75/25) получали 53,9 мг (0,11 ммоль) N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамида (I-1) в виде бледно-желтого аморфного твердого вещества (выход 52%). Его физические свойства приведены ниже.
МС (FAB) m/z: 459 (M+H)+.
1H-ЯМР (CDCl3): δ 8,32 (0,6H, с), 8,10 (0,4H, с), 7,80-7,86 (2H, м), 7,21-7,30 (4H, м), 7,06-7,14 (2H, м), 5,65 (0,6H, м), 5,36 (0,4H, м), 4,74 (2H, ушир.с), 4,20 (0,4H, м), 4,05 (0,6H, ушир.т, J=13 Гц), 3,48-3,57 (3H, м), 2,46 (4H, м), 1,87 (3H, ушир.с), 0,99 (6H, м).
(Пример 2)
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диметиламинометилфенил)этил]-N-гидроксиформамид (I-2)
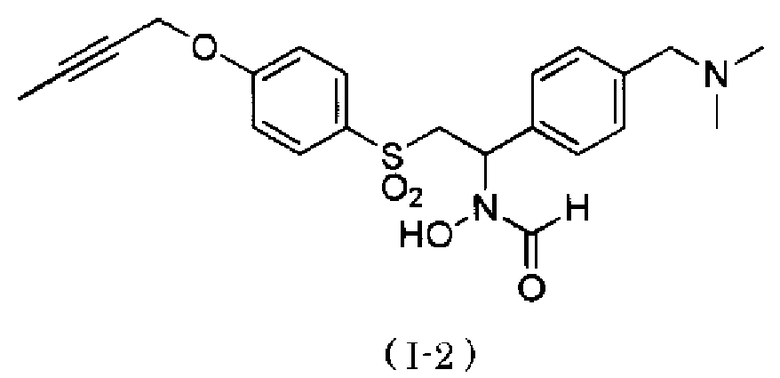
Тем же способом, что и в примере 1, получали указанное выше соединение (I-2).
МС (FAB) m/z: 431 (M+H)+.
1H-ЯМР (CDCl3): δ 8,28 (0,6H, с), 8,14 (0,4H, с), 7,79-7,91 (2H, м), 7,04-7,32 (6H, м), 5,69 (0,6H, м), 5,35 (0,4H, м), 4,74 (2H, ушир.с), 4,18 (0,4H, м), 4,07 (0,6H, м), 3,47 (1H, м), 3,33 (2H, м), 2,11 (6H, с), 1,87 (3H, с).
(Пример 3)
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}-2-метоксиацетамид (I-3)
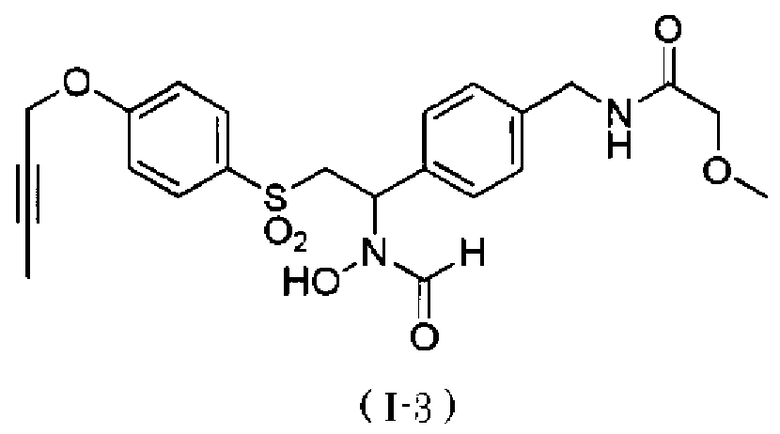
(3-1): N-{4-[2-(4-бут-2-инилоксибензолсульфонил)винил]бензил}-2-метоксиацетамид (II-3)
При комнатной температуре 0,2 мл (1,85 ммоль) метоксиацетилхлорида капельно добавляли к раствору 283 мг (0,75 ммоль) соединения (II-1b), полученного в указанном выше примере 1 (1-5), в пиридине (5 мл). Через 2 суток в него добавляли насыщенный солевой раствор, экстрагировали этилацетатом, и промывали насыщенным солевым раствором. Его сушили над безводным сульфатом магния, растворитель выпаривали при пониженном давлении и остаток очищали посредством хроматографии на колонке с силикагелем (хлороформ/метанол=20/1→10/1) с получением 296 мг (0,71 ммоль) соединения (II-3) в виде бледно-желтого твердого вещества (выход 94%). Его физические свойства приведены ниже.
МС (FAB) m/z: 414 (M+H)+.
(3-2): N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}-2-метоксиацетамид (I-3)
Тем же способом, что и в указанном выше примере 1 (1-7 и 1-8), но с использованием соединения (II-3), полученного в указанном выше (3-1), получали N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}-2-метоксиацетамид (I-3). Его физические свойства приведены ниже.
1H-ЯМР (CDCl3): δ 8,32 (0,6H, с), 8,09 (0,4H, с), 7,77-7,88 (2H, м), 7,20-7,31 (4H, м), 7,06-7,16 (2H, м), 5,65 (0,6H, м), 5,37 (0,4H, м), 4,75 (2H, ушир.с), 4,39-4,47 (2H, м), 4,16 (0,4H, м), 4,03 (0,6H, ушир.т), 3,93 (0,8H, ушир.с), 3,90 (1,2H, ушир.с), 3,46 (1H, м), 3,40 (3H, ушир.с), 1,87 (3H, ушир.с).
(Пример 4)
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}метансульфонамид (I-4)
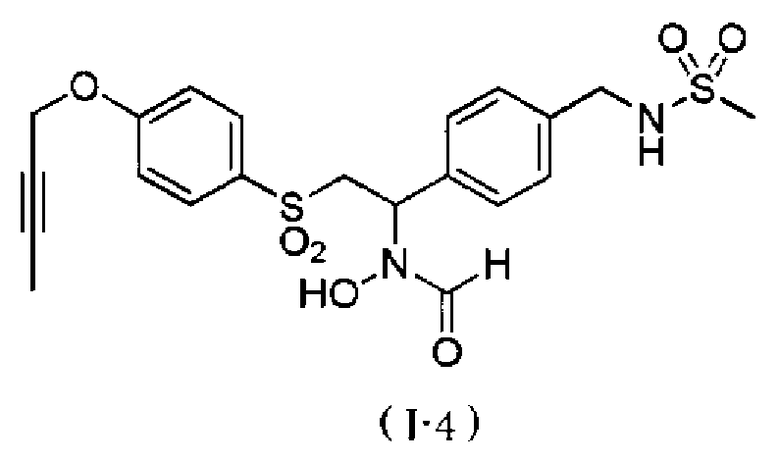
Тем же способом, что и в примере 3, получали указанное выше соединение (I-4).
МС (FAB) m/z: 481 (M+H)+.
1H-ЯМР (CDCl3): δ 8,42 (0,6H, с), 7,87 (0,4H, с), 7,78-7,88 (2H, м), 7,30-7,35 (4H, м), 7,06-7,17 (2H, м), 5,65 (0,6H, м), 5,39 (0,4H, м), 4,75 (2H, м), 4,28 (2H, м), 4,15 (0,4H, м), 4,00 (0,6H, ушир.т, J=12 Гц), 3,45 (1H, м), 2,91 (1,2H, с), 2,89 (1,8H, с), 1,87 (3H, м).
(Пример 5)
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}бензамид (I-5)
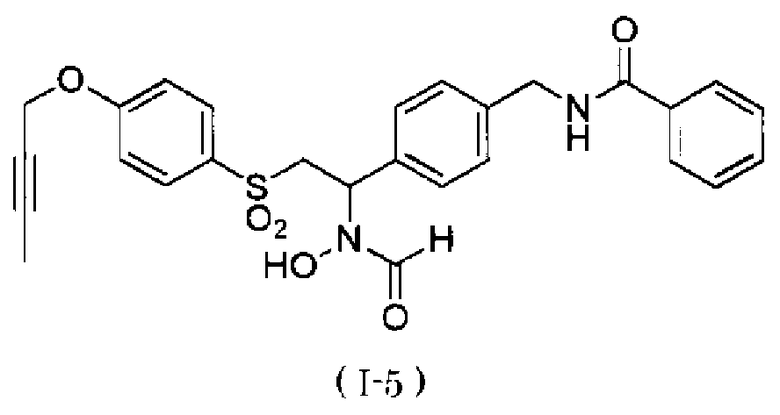
Тем же способом, что и в примере 3, получали указанное выше соединение (I-5).
МС (FAB) m/z: 507 (M+H)+.
1H-ЯМР (CDCl3): δ 8,31 (0,6H, с), 8,08 (0,4H, с), 7,73-7,87 (4H, м), 7,51 (1H, м), 7,42 (2H, м), 7,27-7,33 (3H, м), 7,07-7,14 (2H, м), 5,65 (0,6H, м), 5,37 (0,4H, м), 4,73 (2H, м), 4,54-4,62 (2H, м), 4,15 (0,4H, м), 4,00 (0,6H, м), 3,45 (1H, м), 1,86 (3H, ушир.с).
(Пример 6)
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-морфолин-4-илметилфенил)этил]-N-гидроксиформамид (I-6)
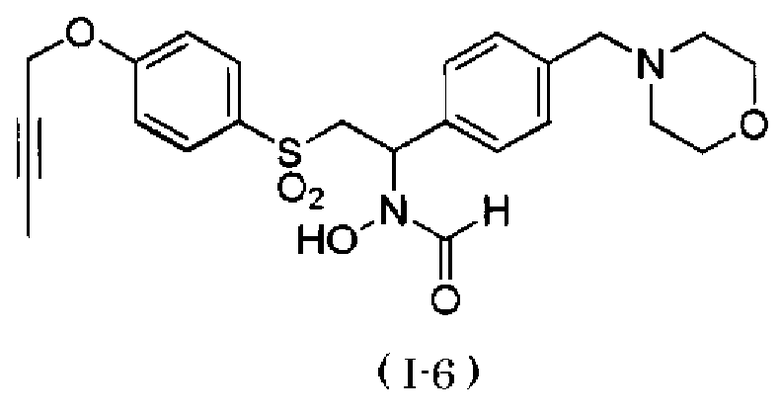
(6-1): трет-бутил-(4-метансульфонилфенокси)диметилсилан (XII-6)
В раствор 10 г (58,07 ммоль) 4-метилсульфонилфенола в N,N-диметилформамиде (150 мл) добавляли 9,9 г (145,18 ммоль) имидазола и растворяли в нем, а затем в него добавляли 10,5 г (69,7 ммоль) трет-бутилдиметилхлорсилана и перемешивали. После реакции в него добавляли насыщенный солевой раствор и экстрагировали этилацетатом. Органический слой три раза промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Очищая посредством хроматографии на колонке с силикагелем (гексан/этилацетат=5/1→3/1), получали 15,97 г (55,75 ммоль) трет-бутил-(4-метансульфонилфенокси)диметилсилана (XII-6) (выход 96%). Его физические свойства приведены ниже.
1H-ЯМР (CDCl3): δ 7,83 (1H, м), 7,81 (1H, м), 6,97 (1H, м), 6,95 (1H, м), 3,04 (1H, с), 1,56 (9H, с), 0,25 (6H, с).
(6-2): 2-[4-(трет-бутилдиметилсиланилокси)бензолсульфонил]-1-(4-морфолин-4-илметилфенил)этанон (XIII-6)
В атмосфере аргона при -78°C, 4,19 мл (8,37 ммоль) раствора 2,0 M диизопропиламида лития в гексане-гептане-этилбензоле добавляли в раствор 2,6 г (6,98 ммоль) трет-бутил-(4-метансульфонилфенокси)диметилсилана (XII-6), полученного в указанном выше (6-1), в тетрагидрофуране и в него добавляли 6,98 мл (6,98 ммоль) раствора 1,0 M гексаметилдисилазида лития в тетрагидрофуране и 5 мл раствора 1,6 г (6,98 ммоль) метил-4-морфолин-4-илметилбензоата (IX-6) в тетрагидрофуране. Затем его постепенно нагревали до комнатной температуры с перемешиванием. После реакции в него добавляли насыщенный солевой раствор, экстрагировали этилацетатом, и органический слой промывали насыщенным солевым раствором. После сушки над безводным сульфатом магния растворитель выпаривали при пониженном давлении. Получали 3,74 г 2-[4-(трет-бутилдиметилсиланилокси)бензолсульфонил]-1-(4-морфолин-4-илметилфенил)этанона (XIII-6) в виде плохоочищенного продукта.
(6-3): 2-[4-(трет-бутилдиметилсиланилокси)бензолсульфонил]-1-(4-морфолин-4-илметилфенил)этанол (XIV-6)
264 мг (6,98 ммоль) борогидрида натрия при 0°C добавляли в раствор 3,74 г (6,98 ммоль) соединения (XIII-6), полученного в указанном выше (6-2), в метаноле (50 мл). После перемешивания в течение 1 часа в него добавляли насыщенный солевой раствор. Метанол выпаривали при пониженном давлении, и остаток экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении, и остаток очищали посредством хроматографии на колонке с силикагелем (этилацетат→этилацетат/метанол=10/1) с получением 2,19 г (4,48 ммоль) 2-[4-(трет-бутилдиметилсиланилокси)бензолсульфонил]-1-(4-морфолин-4-илметилфенил)этанола (XIV-6). Его физические свойства приведены ниже.
1H-ЯМР (CDCl3): δ 7,83 (2H, м), 7,25-7,30 (4H, м), 6,98 (2H, м), 5,22 (1H, д, J=7,7 Гц), 3,68 (4H, м), 3,46 (3H, м), 3,30 (1H, дд, J=1,5, 14 Гц), 2,40 (4H, м), 0,99 (9H, с), 0,25 (6H, с).
(6-4): 4-[(E)-2-(4-морфолин-4-илметилфенил)этенсульфонил]фенол (XVI-6)
3,10 мл триэтиламина добавляли в раствор (45 мл) 2,19 г (4,48 ммоль) 2-[4-(трет-бутилдиметилсиланилокси)бензолсульфонил]-1-(4-морфолин-4-илметилфенил)этанола (XIV-6), полученного в указанном выше (6-3), в дихлорметане и перемешивали при 0°C. В него добавляли 0,61 мл (8,91 ммоль) метансульфонилхлорида и перемешивали при комнатной температуре в течение 8 часов. Затем в него добавляли 3,10 мл триэтиламина и 0,61 мл метансульфонилхлорида и перемешивали в течение 4 часов. Добавляли насыщенный солевой раствор и экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении, и остаток очищали посредством хроматографии на колонке с силикагелем (гексан/этилацетат=1/2→этилацетат→этилацетат/метанол=10/1) с получением 0,757 г (2,11 ммоль) 4-[(E)-2-(4-морфолин-4-илметилфенил)этенсульфонил]фенола (XVI-6) (выход 47%). Его физические свойства приведены ниже.
1H-ЯМР (CDCl3): δ 8,01 (1H, д, J=8,7 Гц), 7,81 (1H, д, J=8,7 Гц), 7,61 (1H, д, J=15 Гц), 7,35-7,47 (5H, м), 6,92 (1H, д, J=6,9 Гц), 6,81 (1H, д, J=15 Гц), 3,71 (4H, м), 3,51 (2H, м), 2,44 (4H, м).
(6-5): 4-[4-[(E)-2-(4-бут-2-инилоксибензолсульфонил)винил]бензил]морфолин (II-6)
108 мг (0,780 ммоль) карбоната калия и 0,094 мл (1,04 ммоль) 1-бром-2-бутина добавляли в раствор 187 мг (0,520 ммоль) 4-[(E)-2-(4-морфолин-4-илметилфенил)этенсульфонил]фенола (XVI-6), полученного в указанном выше (6-4), в N,N-диметилформамиде и перемешивали в течение 4 часов. В него добавляли насыщенный солевой раствор и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении, и остаток очищали посредством хроматографии на колонке с силикагелем (этилацетат/хлороформ=1/1→1/2→этилацетат) с получением 0,0238 г (0,0578 ммоль) 4-[4-[(E)-2-(4-бут-2-инилоксибензолсульфонил)винил]бензил]морфолина (II-6) (выход 11%). Его физические свойства приведены ниже.
1H-ЯМР (CDCl3): δ 7,87 (2H, д, J=8,7 Гц), 7,63 (1H, д, J=15,5 Гц), 7,35-7,44 (4H, м), 7,07 (2H, д, J=8,7 Гц), 6,83 (1H, д, J=15,5 Гц), 4,71 (2H, м), 3,69 (4H, м), 3,50 (2H, с), 2,43 (4H, м), 1,86 (3H, с).
(6-6): N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-морфолин-4-илметилфенил)этил]-N-гидроксиформамид (I-6)
Тем же способом, как в указанных выше (1-7 и 1-8), но с использованием соединения (II-6), полученного в указанном выше (6-5), получали N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-морфолин-4-илметилфенил)этил]-N-гидроксиформамид (I-6). Его физические свойства приведены ниже.
МС (FAB) m/z: 473 (M+H)+.
1H-ЯМР (CDCl3): δ 8,45 (0,6H, с), 8,11 (0,4H, с), 7,80-7,88 (2H, м), 7,23-7,32 (4H, м), 7,07-7,16 (2H, м), 5,63 (0,6H, м), 5,38 (0,4H, м), 4,75 (2H, м), 4,19 (0,4H, м), 4,03 (0,6H, м), 3,64-3,71 (4H, м), 3,40-3,51 (2H, м), 2,39 (4H, м), 1,87 (3H, м).
(Пример 7)
N-гидрокси-N-[1-(4-морфолин-4-илметилфенил)-2-(4-пент-2-инилоксибензолсульфонил)этил]формамид (I-7)
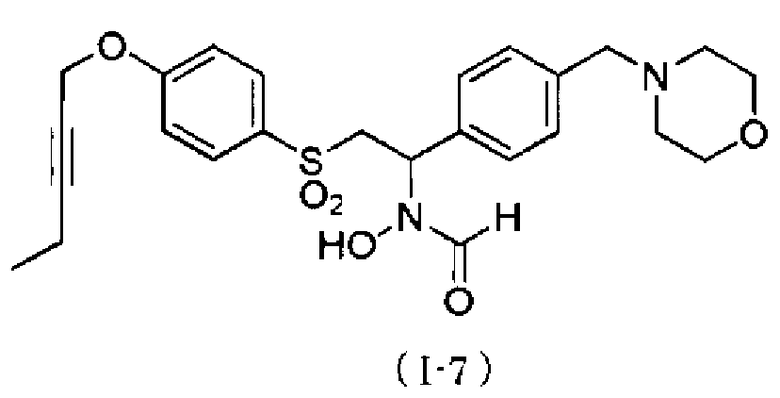
Тем же способом, что и в примере 6, получали указанное выше соединение (I-7).
МС (FAB) m/z: 487 (M+H)+.
1H-ЯМР (CDCl3): δ 8,44 (0,6H, с), 8,11 (0,4H, с), 7,78-7,88 (2H, м), 7,26-7,32 (4H, м), 7,06-7,16 (2H, м), 5,63 (0,6H, дд, J=3,6, 12,3 Гц), 5,38 (0,4H, дд, J=3,0, 10,1 Гц), 4,75 (2H, м), 4,18 (0,4H, дд, J=10,1, 15,7 Гц), 4,03 (0,6H, дд, J=12,3, 14,6 Гц), 3,72 (2H, кв, J=6,9 Гц), 3,64-3,70 (4H, м), 3,41-3,48 (3H, м), 2,36-2,43 (4H, м), 1,24 (3H, т, J=6,9 Гц).
В соответствии со схемами 1-4 и тем же способом, как в примерах 1-7, получали приведенные ниже соединения (с I-8 по I-28).
(Пример 8)
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диметиламинофенил)этил]-N-гидроксиформамид (I-8)
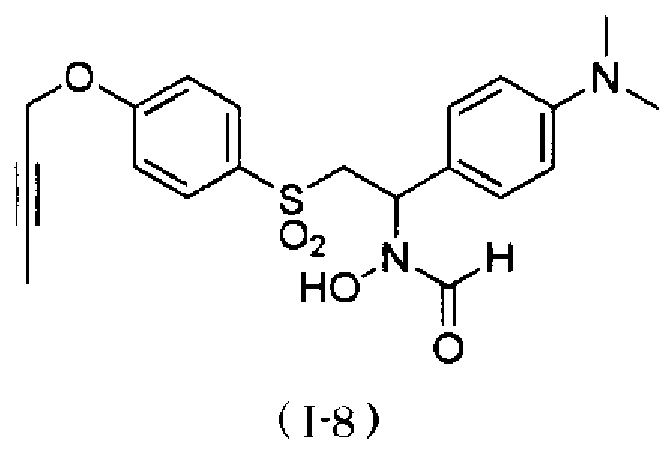
МС (ESI) m/z: 417 (M+H)+.
1H-ЯМР (CDCl3): δ 8,40 (0,5H, с), 8,04 (0,5H, с), 7,73-7,89 (2H, м), 7,02-7,22 (4H, м), 6,62 (2H, д, J=8,7 Гц), 5,49-5,58 (0,5H, м), 5,22-5,31 (0,5H, м), 4,73 (2H, д, J=9,2 Гц), 3,98-4,23 (1H, м), 3,37-3,55 (1H, м), 2,93 (3H, с), 2,91 (3H, с), 1,87 (3H, т, J=2,3 Гц).
(Пример 9)
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(3-диметиламинофенил)этил]-N-гидроксиформамид (I-9)
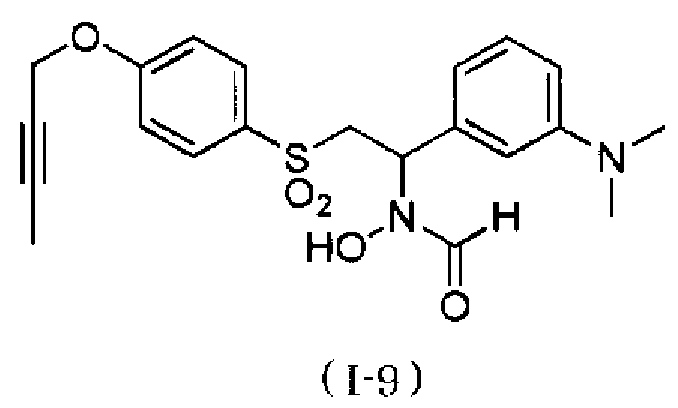
МС (ESI) m/z: 417 (M+H)+.
1H-ЯМР (CDCl3): δ 8,45 (0,5H, с), 8,07 (0,5H, с), 7,77-7,89 (2H, м), 7,04-7,21 (4H, м), 6,57-6,68 (2H, м), 5,54-5,62 (0,5H, м), 5,27-5,34 (0,5H, м), 4,69-4,77 (2H, м), 4,00-4,25 (1H, м), 3,41-3,54 (1H, м), 2,90-2,95 (6H, м), 1,87 (3H, т, J=2,3 Гц).
(Пример 10)
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(2-диметиламинофенил)этил]-N-гидроксиформамид (I-10)
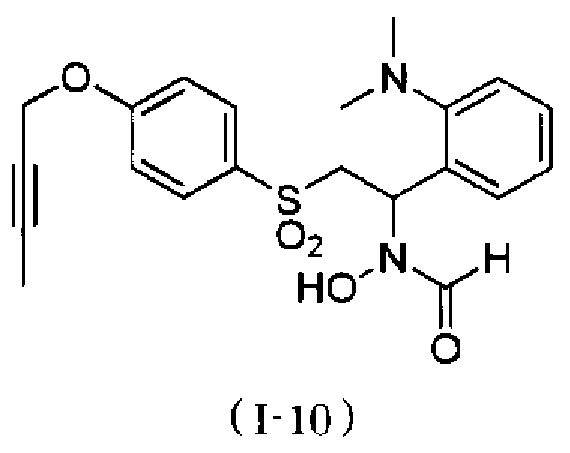
МС (ESI) m/z: 417 (M+H)+.
1H-ЯМР (CDCl3): δ 8,31 (0,6H, с), 8,08 (0,4H, с), 7,88 (0,6H, д, J=9,2 Гц), 7,83 (0,4H, д, J=8,7 Гц), 7,07-7,42 (6H, м), 6,57-6,68 (2H, м), 6,04 (0,4H, дд, J=2,7, 10 Гц), 5,88 (0,6H, дд, J=2,7, 11 Гц), 4,71-4,78 (2H, м), 3,99-4,08 (1H, м), 3,39-3,51 (1H, м), 2,61 (2,4H, с), 2,54 (3,6H, с), 1,86 (3H, т, J=2,3 Гц).
(Пример 11)
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-пиперидин-1-илметилфенил)этил]-N-гидроксиформамид (I-11)
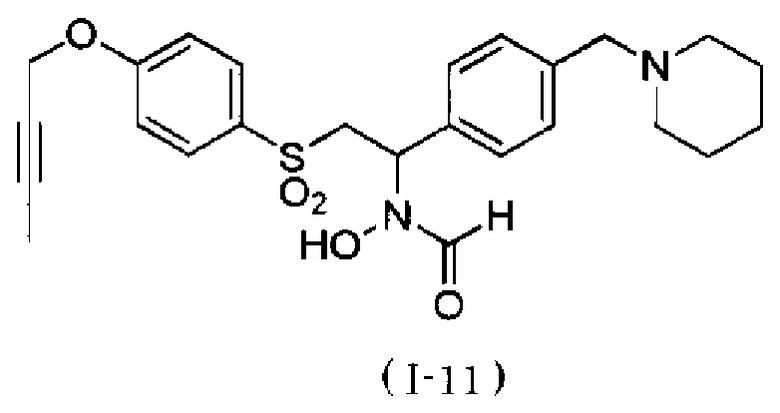
МС (ESI) m/z: 471 (M+H)+.
1H-ЯМР (CDCl3): δ 8,28 (0,6H, с), 8,10 (0,4H, с), 7,77-7,89 (2H, м), 7,04-7,30 (6H, м), 5,61-5,69 (0,6H, м), 5,31-5,39 (0,4H, м), 4,69-4,78 (2H, м), 3,99-4,26 (1H, м), 3,35-3,53 (3H, м), 2,37 (4H, ушир.с), 1,87 (3H, ушир.с), 1,35-1,59 (6H, м).
(Пример 12)
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(3-пиперидин-1-илметилфенил)этил]гидроксиформамид (I-12)
МС (ESI) m/z: 471 (M+H)+.
1H-ЯМР (CDCl3): δ 8,38 (0,5H, с), 8,10 (0,5H, с), 7,77-7,89 (2H, м), 7,04-7,30 (6H, м), 5,70 (0,5H, дд, J=3,7, 11 Гц), 5,30-5,38 (0,5H, м), 4,69-4,77 (2H, м), 4,01-4,27 (1H, м), 3,23-3,60 (3H, м), 2,30 (4H, ушир.с), 1,87 (3H, т, J=2,3 Гц), 1,31-1,55 (6H, м).
(Пример 13)
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(3-морфолин-4-илметилфенил)этил]-N-гидроксиформамид (I-13)
МС (ESI) m/z: 473 (M+H)+.
1H-ЯМР (CDCl3): δ 8,46 (0,5H, с), 8,10 (0,5H, с), 7,78-7,90 (2H, м), 7,06-7,31 (6H, м), 5,65 (0,5H, дд, J=3,7, 12 Гц), 5,35-5,42 (0,5H, м), 4,70-4,78 (2H, м), 3,98-4,26 (1H, м), 3,68 (4H, дд, J=4,6, 4,6 Гц), 3,39-3,54 (3H, м), 2,36-2,44 (4H, м), 1,87 (3H, т, J=2,3 Гц).
(Пример 14)
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-{4-[(этилметиламино)метил]фенил]этил}-N-гидроксиформамид (I-14)
МС (ESI) m/z: 445 (M+H)+.
1H-ЯМР (CDCl3): δ 8,35 (0,5H, с), 8,11 (0,5H, с), 7,78-7,89 (2H, м), 7,06-7,28 (6H, м), 5,65 (0,5H, дд, J=3,7, 12 Гц), 5,32-5,40 (0,5H, м), 4,71-4,77 (2H, м), 3,99-4,24 (1H, м), 3,38-3,53 (3H, м), 2,38 (3H, кв, J=7,3 Гц), 1,87 (3H, т, J=2,3 Гц), 1,05 (3H, т, J=7,3 Гц).
(Пример 15)
N-(2-(4-бут-2-инилоксибензолсульфонил)-1-{3-[(этилметиламино)метил]фенил}этил)-N-гидроксиформамид (I-15)
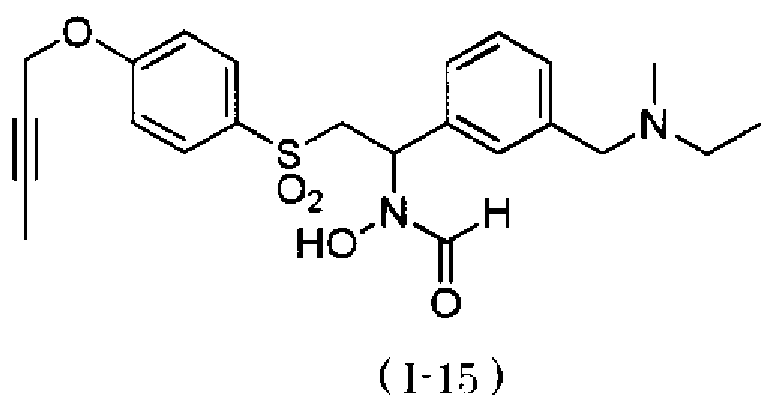
МС (ESI) m/z: 445 (M+H)+.
1H-ЯМР (CDCl3): δ 8,37 (0,5H, с), 8,11 (0,5H, с), 7,78-7,90 (2H, м), 7,06-7,34 (6H, м), 5,70 (0,5H, дд, J=3,7, 12 Гц), 5,32-5,40 (0,5H, м), 4,70-4,78 (2H, м), 4,00-4,22 (1H, м), 3,29-3,59 (3H, м), 2,38 (3H, кв, J=6,9 Гц), 1,87 (3H, т, J=2,3 Гц), 1,03 (3H, т, J=6,9 Гц).
(Пример 16)
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}-N-метилметансульфонамид (I-16)
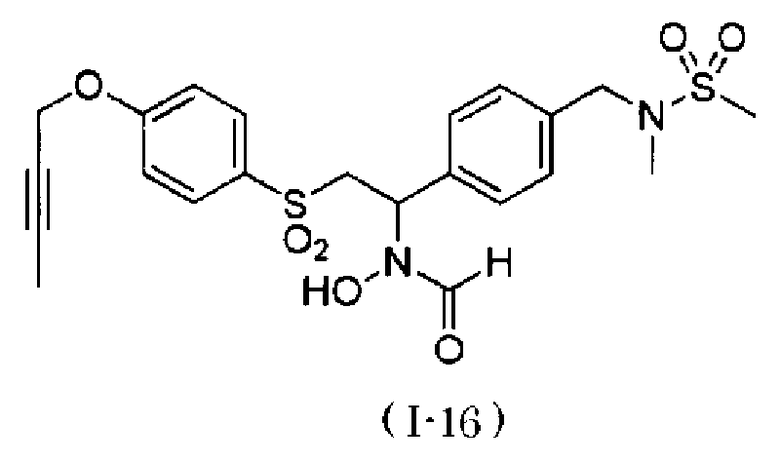
МС (ESI) m/z: 495 (M+H)+.
1H-ЯМР (ДМСО-d6): δ 8,22 (0,5H, ушир.с), 8,11 (0,5H, ушир.с), 7,75-7,86 (2H, м), 7,09-7,42 (4H, м), 7,13 (2H, д, J=9,2 Гц), 5,70 (0,5H, ушир.с), 5,40 (0,5H, ушир.с), 4,83-4,89 (2H, м), 4,18 (2H, с), 3,86-4,16 (2H, м), 2,94 (3H, с), 2,63 (3H, с), 1,84 (3H, т, J=2,3 Гц).
(Пример 17)
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}-N-метилбензолсульфонамид (I-17)
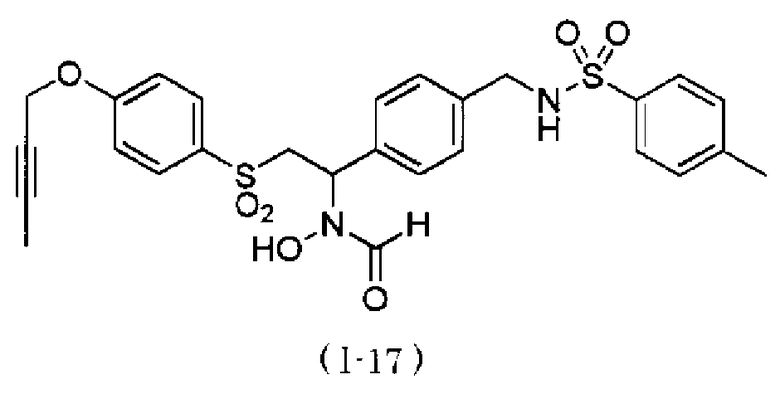
МС (ESI) m/z: 557 (M+H)+.
1H-ЯМР (CDCl3): δ 8,37 (0,6H, ушир.с), 8,03 (0,4H, ушир.с), 7,69-7,88 (4H, м), 7,04-7,33 (8H, м), 5,61 (0,6H, дд, J=3,6, 12 Гц), 5,31-5,39 (0,4H, м), 4,70-4,83 (2H, м), 3,92-4,17 (3H, м), 3,36-3,51 (1H, м), 2,43 (3H, с), 1,87 (3H, т, J=2,3 Гц).
(Пример 18)
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}-4,N-диметилбензолсульфонамид (I-18)
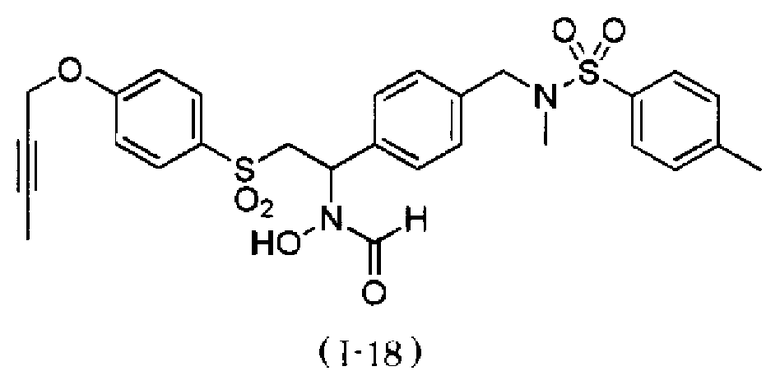
МС (ESI) m/z: 571 (M+H)+.
1H-ЯМР (CDCl3): δ 8,47 (0,6H, ушир.с), 8,11 (0,4H, ушир.с), 7,78-7,89 (2H, м), 7,70 (2H, д, J=8,2 Гц), 7,35 (2H, д, J=8,2 Гц), 7,23-7,32 (4H, м), 7,06-7,17 (2H, м), 5,64 (0,6H, дд, J=3,6, 12 Гц), 5,36-5,43 (0,4H, м), 4,71-4,78 (2H, м), 3,96-4,22 (3H, м), 3,38-3,52 (1H, м), 2,58 (1,2H, с), 2,54 (1,8H, с), 2,45 (3H, с), 1,87 (3H, т, J=2,3 Гц).
(Пример 19)
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}-N-метилсульфонилметансульфонамид (I-19)
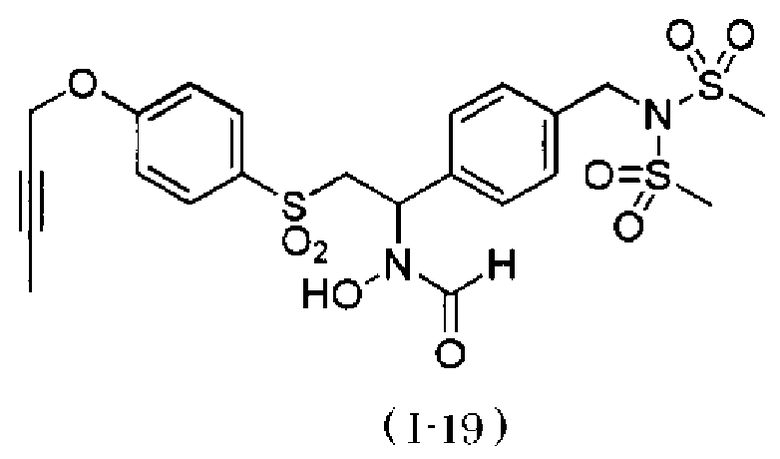
МС (ESI) m/z: 559 (M+H)+.
1H-ЯМР (ДМСО-d6): δ 8,12 (0,5H, ушир.с), 8,21 (0,5H, ушир.с), 7,80 (2H, ушир.с), 7,35-7,44 (1H, м), 7,32 (2H, д, J=9,2 Гц), 7,31 (1H, с), 7,14 (2H, д, J=9,2 Гц), 5,41 (0,5H, ушир.с), 5,71 (0,5H, ушир.с), 4,87 (2H, кв, J=2,3 Гц), 4,83 (2H, с), 4,00-4,16 (1H, м), 3,84-3,98 (1H, м), 3,25 (6H, с), 1,84 (3H, т, J=2,3 Гц).
(Пример 20)
N-{2-(4-бут-2-инилоксибензолсульфонил)-1-[4-(2-диметиламиноэтил)фенил]этил}-N-гидроксиформамид (I-20)
МС (ESI) m/z: 445 (M+H)+.
1H-ЯМР (CDCl3): δ 8,30 (0,5H, с), 8,14 (0,5H, с), 7,76-7,89 (2H, м), 7,00-7,24 (6H, м), 5,71 (0,5H, дд, J=3,7, 11 Гц), 5,29-5,36 (0,5H, м), 4,69-4,76 (2H, м), 4,02-4,21 (1H, м), 3,42-3,59 (1H, м), 2,43-2,54 (2H, м), 2,10-2,28 (2H, м), 2,19 (6H, с), 1,87 (3H, т, J=2,3 Гц).
(Пример 21)
N-{2-(4-бут-2-инилоксибензолсульфонил)-1-[4-(2-морфолин-4-илэтил)фенил]этил}-N-гидроксиформамид (I-21)
МС (ESI) m/z: 487 (M+H)+.
1H-ЯМР (CDCl3): δ 8,44 (0,5H, с), 8,10 (0,5H, с), 7,77-7,89 (2H, м), 7,05-7,27 (6H, м), 5,62 (0,5H, дд, J=3,7, 12 Гц), 5,32-5,39 (0,5H, м), 4,69-4,78 (2H, м), 3,96-4,23 (1H, м), 3,71 (4H, дд, J=4,1, 4,6 Гц), 3,39-3,53 (1H, м), 2,69-2,77 (2H, м), 2,43-2,56 (6H, м), 1,87 (3H, т, J=2,3 Гц).
(Пример 22)
N-(2-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]фенил}этил)метансульфонамид (I-22)
МС (ESI) m/z: 495 (M+H)+.
1H-ЯМР (CDCl3): δ 8,39 (0,5H, с), 8,07 (0,5H, с), 7,78-7,89 (2H, м), 7,05-7,30 (6H, м), 5,65 (0,5H, дд, J=3,7, 12 Гц), 5,33-5,41 (0,5H, м), 4,70-4,78 (2H, м), 3,95-4,21 (1H, м), 3,31-3,52 (3H, м), 2,80-2,91 (5H, м), 1,87 (3H, т, J=2,3 Гц).
(Пример 23)
N-{2-(4-бут-2-инилоксибензолсульфонил)-1-[4-(3-диметиламинопропил)фенил]этил}-N-гидроксиформамид (I-23)
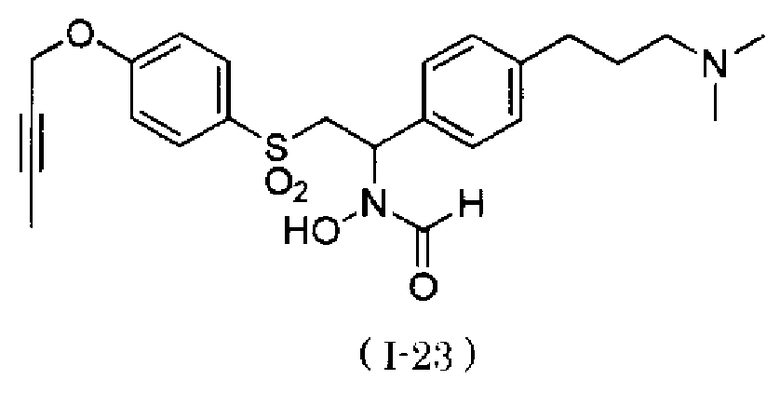
МС (ESI) m/z: 459 (M+H)+.
1H-ЯМР (CDCl3): δ 8,06-8,13 (1H, м), 7,74-7,88 (2H, м), 7,02-7,24 (6H, м), 5,64-5,75 (0,5H, м), 5,22-5,32 (0,5H, м), 4,68-4,76 (2H, м), 4,02-4,22 (1H, м), 3,40-3,58 (1H, м), 2,51 (2H, дд, J=7,3, 7,8 Гц), 2,17 (2H, дд, J=7,3, 7,8 Гц), 2,08 (3H, с), 2,06 (3H, с), 1,87 (3H, т, J=2,3 Гц), 1,52-1,66 (2H, м).
(Пример 24)
N-{2-(4-бут-2-инилоксибензолсульфонил)-1-[4-(3-диэтиламинопропил)фенил]этил}-N-гидроксиформамид (I-24)
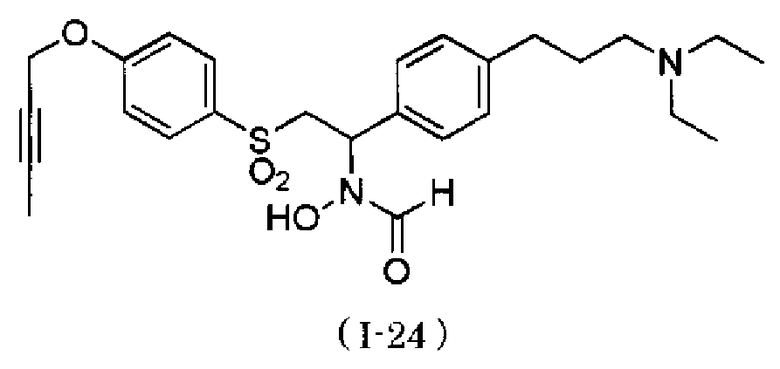
МС (ESI) m/z: 487 (M+H)+.
1H-ЯМР (CDCl3): δ 8,29 (0,5H, с), 8,07 (0,5H, м), 7,75-7,89 (2H, м), 7,04-7,24 (6H, м), 5,64 (0,5H, дд, J=3,7, 11 Гц), 5,28-5,37 (0,5H, м), 4,69-4,77 (2H, м), 4,00-4,23 (1H, м), 3,41-3,55 (1H, м), 2,33-2,60 (6H, м), 1,87 (3H, т, J=2,3 Гц), 1,61-1,72 (2H, м), 0,91-1,01 (6H, м).
(Пример 25)
N-{2-(4-бут-2-инилоксибензолсульфонил)-1-[4-(3-морфолин-4-илпропил)фенил]этил}-N-гидроксиформамид (I-25)
МС (ESI) m/z: 501 (M+H)+.
1H-ЯМР (CDCl3): δ 8,37 (0,5H, с), 8,08 (0,5H, с), 7,76-7,89 (2H, м), 7,04-7,24 (6H, м), 5,64 (0,5H, дд, J=3,7, 12 Гц), 5,29-5,38 (0,5H, м), 4,68-4,77 (2H, м), 3,98-4,23 (1H, м), 3,67 (4H, ушир.с), 3,40-3,53 (1H, м), 2,52-2,63 (2H, м), 2,24-2,46 (6H, м), 1,87 (3H, т, J=2,3 Гц), 1,65-1,76 (2H, м).
(Пример 26)
N-{2-(4-бут-2-инилоксибензолсульфонил)-1-[4-(4-морфолин-4-илбутил)фенил]этил}-N-гидроксиформамид (I-26)
МС (ESI) m/z: 515 (M+H)+.
1H-ЯМР (CDCl3): δ 8,41 (0,5H, с), 8,10 (0,5H, с), 7,77-7,89 (2H, м), 7,05-7,24 (6H, м), 5,57-5,66 (0,5H, м), 5,31-5,38 (0,5H, м), 4,69-4,77 (2H, м), 3,97-4,23 (1H, м), 3,67 (4H, дд, J=4,1, 4,6 Гц), 3,40-3,53 (1H, м), 2,52-2,63 (2H, м), 2,24-2,46 (6H, м), 1,87 (3H, т, J=2,3 Гц), 1,39-1,63 (4H, м).
(Пример 27)
N-{4-[1-(формилгидроксиамино)-2-(4-пент-2-инилоксибензолсульфонил)этил]бензил}метансульфонамид (I-27)
МС (ESI) m/z: 495 (M+H)+.
1H-ЯМР (CDCl3): δ 8,29 (0,6H, с), 8,00 (0,4H, с), 7,75-7,88 (2H, м), 7,23-7,35 (4H, м), 7,05-7,16 (2H, м), 5,66 (0,6H, дд, J=3,7, 12 Гц), 5,31-5,41 (0,4H, м), 4,71-4,80 (2H, м), 4,26 (2H, ушир.с), 3,95-4,18 (1H, м), 3,39-3,50 (1H, м), 2,89 (3H, ушир.с), 2,24 (2H, т.кв, J=1,8, 7,3 Гц), 1,14 (3H, т, J=7,3 Гц).
(Пример 28)
N-{4-[1-(формилгидроксиамино)-2-(4-окт-2-инилоксибензолсульфонил)этил]бензил}метансульфонамид (I-28)
МС (ESI) m/z: 537 (M+H)+.
1H-ЯМР (CDCl3): δ 8,35 (0,6H, с), 8,03 (0,4H, с), 7,76-7,88 (2H, м), 7,27-7,36 (4H, м), 7,06-7,17 (2H, м), 5,66 (0,6H, дд, J=3,7, 12 Гц), 5,34-5,42 (0,4H, м), 4,72-4,82 (2H, м), 4,23-4,33 (2H, м), 3,94-4,18 (1H, м), 3,38-3,51 (1H, м), 2,90 (1,2H, с), 2,89 (1,8H, с), 2,22 (2H, тт, J=2,3, 7,3 Гц), 1,45-1,55 (2H, м), 1,23-1,38 (4H, м), 0,87 (3H, т, J=7,3 Гц).
(Тестовый пример 3) Эксперимент по ингибированию ADAM17
Производные N-гидроксиформамида, полученные в примерах 1-7, исследовали для определения наличия или отсутствия у них ингибирующего ADAM17 действия.
В частности, сначала, так как нуклеотидная последовательность, кодирующая ADAM17, опубликована Moss et al. (см. Moss et al., Nature, 1997, vol. 385, pp. 733-736), из моноцитарной клеточной линии человека, клеток THP-1, стандартным способом получали кДНК ADAM-17. кДНК встраивали в экспрессирующий вектор. Затем этот вектор трансфицировали в клетки млекопитающих или клетки насекомых, и экспрессировали и получали ADAM17.
Затем измеряли активность ADAM17, указанным ниже способом в присутствии или отсутствие тестируемых веществ, где полученный ADAM17 использовали в качестве фермента, и флуоресцентный синтетический субстрат Nma(N-метилантранилат)-Leu-Ala-Gln-Ala-Val-Arg-Ser-Ser-Lys-Dnp(динитрофенил)-D-Arg-NH2, содержащий расщепляемую ADAM17 последовательность мембраносвязанного TNF использовали в качестве субстрата.
В частности, 90 мкл раствора фермента 14 единиц (1 единица определена как количество фермента, расщепляющего 1 пмоль субстрата в 1 минуту при 25°C), полученного в буфере для анализа A (50 ммоль/л буфера Tris-HCl (pH 7,5), содержащего 200 ммоль/л хлорида натрия, 5 ммоль/л хлорида кальция, 10 мкмоль/л сульфата цинка и 2 мг/мл бычьего сывороточного альбумина), смешивали с 90 мкл синтетического флуоресцентного субстрата, доведенного до 20 мкмоль/л буфером для анализа B (50 ммоль/л буфера Tris-HCl (pH 7,5), содержащего 200 ммоль/л хлорида натрия, 5 ммоль/л хлорида кальция, 10 мкмоль/л сульфата цинка и 0,05% плюроника F-68) и проводили реакцию при 37°C в течение 1,5 часов. Затем определяли ферментативную активность посредством измерений с использованием флуориметра (Fluoroskan Ascent) в условиях длины волны возбуждения 355 нм и измерения длины волны 460 нм. Затем определяли коэффициент ингибирования на основе ферментативной активности в присутствии и в отсутствие тестируемых соединений и рассчитывали концентрацию 50% ингибирования (IC50). Полученный результат представлен в таблице 1.
Как видно из результата, представленного в таблице 1, подтверждено, что любое из соединений от I-1 до I-7 (производные N-гидроксиформамида) по настоящему изобретению ингибирует ферментативную активность ADAM17 при низких концентрациях.
(Тестовый пример 4) Различные оценочные эксперименты
Далее, соединения I-1 (далее в настоящем документе также обозначаемое как "S-45282") и I-4 (далее в настоящем документе также обозначаемое как "S-45457"), обладающие сильным ингибирующим действием в отношении ADAM17 из производных N-гидроксиформамида, полученных в примерах 1-7, исследовали на специфичность в качестве ингибитора и на ингибирующую TACE активность в клетках приведенными ниже способами. Для сравнения также оценивали неселективную ингибирующую металлопротеиназу GM6001 (EMD/Calbiochem, номер продукта 364205).
<Эксперимент по ингибированию ферментов>
Используемые в этом тесте ферменты представляли собой следующие:
Матриксная металлопротеиназа 1 (MMP-1) (произведенная Calbiochem, номер продукта: 444208)
Матриксная металлопротеиназа 2 (MMP-2) (произведенная Calbiochem, номер продукта: 444213)
Матриксная металлопротеиназа 3 (MMP-3) (произведенная Calbiochem, номер продукта: 444217)
Матриксная металлопротеиназа 8 (MMP-8) (произведенная Calbiochem, номер продукта: 444229)
Матриксная металлопротеиназа 9 (MMP-9) (произведенная Calbiochem, номер продукта: 444231)
Матриксная металлопротеиназа 13 (MMP-13) (произведенная Chemicon, номер продукта: CC068)
Матриксная металлопротеиназа 14 (MMP-14) (произведенная Calbiochem, номер продукта: 475935)
Матриксная металлопротеиназа 17 (MMP-17) (произведенная Calbiochem, номер продукта: 475940)
Дезинтегрин и металлопротеиназа 10 (ADAM10) (произведенная Funakoshi Co., Ltd., кол продукта: 936-AD-020) и
Дезинтегрин и металлопротеиназа 17 (ADAM17, TACE) (использовали фермент, полученный Kaken Pharmaceutical Co., Ltd. с использованием генетическй рекомбинации таким же способом, как в тестовом примере 3. Следует отметить, что также как в тестовом примере 3, 1 единицу определяют как количество фермента, расщепляющего 1 пмоль субстрата в 1 минуту при 25°C).
Кроме того, используемые в этом тесте субстраты представляли собой следующие:
Субстрат 444221 (DNP-Pro-Cha-Gly-Cys(Me)-His-Ala-Lys(Nma)-NH2, собственный синтез): длина волны возбуждения 355 нм, длина волны испускания 460 нм
Субстрат TACE (тот же, что использовали в тестовом примере 3): длина волны возбуждения 355 нм, длина волны испускания 460 нм
Субстрат 3168 (MOCAc-Arg-Pro-Lys-Pro-Val-Glu-Nva-Trp-Arg-Lys(Dnp)-NH2, произведенный Peptide Institute, Inc.): длина волны возбуждения 320 нм, длина волны испускания 405 нм, и
Субстрат 3163 (MOCAc-Pro-Leu-Gly-Leu-A2pr(Dnp)-Ala-Arg-NH2, произведенный Peptide Institute, Inc.): длина волны возбуждения 320 нм, длина волны испускания 405 нм.
Ферментативную реакцию проводили с использованием ферментов и субстраты. В частности, если необходимо, фермент предварительно активировали APMA (конечная концентрация 1 ммоль/л, ацетат п-аминофенилртути, произведенной Sigma-Aldrich Co., A9563) по инструкции производителя. Затем в 96-луночном планшете для измерения флуоресценции смешивали 90 мкл раствора фермента, полученного с использованием буфера для анализа A (50 ммоль/л буфера Tris-HCl (pH 7,5), содержащего 200 ммоль/л хлорида натрия, 5 ммоль/л хлорида кальция, 10 мкмоль/л сульфата цинка и 2 мг/мл бычьего сывороточного альбумина), с 90 мкл субстрата, доводимого до 20 мкмоль/л буфером для анализа B (50 ммоль/л буфера Tris-HCl (pH 7,5), содержащего 200 ммоль/л хлорида натрия, 5 ммоль/л хлорида кальция, 10 мкмоль/л сульфата цинка и 0,05% ПЛЮРОНИК F-68) и инкубировали для прохождения реакции при 25°C или 37°C в течение нескольких часов. Кроме того, для определения ферментативной активности измеряли интенсивности флуоресценции до и после реакции с использованием флуориметра. Коэффициент ингибирования получали на основе ферментативной активности в присутствии и в отсутствие тестируемых веществ и рассчитывали концентрацию 50% ингибирования (IC50). В таблице 2 приведены условия реакции для каждого фермента.
<Эксперимент по ингибированию клеточного TACE>
Клетки THP-1 (клетки, получаемые из клеток острого моноцитарного лейкоза человека, каталожный номер ATCC: TIB202) суспендировали в содержащей 10 об./об.% FBS RPMI 1640, помещали в объеме 200 мкл/лунку (1×105 клеток) в 96-луночный культуральный планшет, обрабатывали PMA (конечная концентрация 50 нмоль/л) и культивировали при 37°C в 5% CO2 в течение периода от 40 до 48 часов так, что клетки THP-1 дифференцировались в макрофагоподобные клетки. После дифференцировки среду удаляли и клетки отмывали отмывочным буфером THP-1 (RPMI 1640, 20 мМ HEPES-NaOH (pH 7,4)). После отмывки клеток к ним добавляли буфер для анализа THP-1 (RPMI 1640, 20 ммоль/л HEPES-NaOH (pH 7,4), 0,01 масс./об.% PF-68, 10 об./об.% FBS) при 100 мкл/лунку. Затем дополнительно добавляли буфер для анализа THP-1, содержащий тестируемое вещество (I-1 или I-4), при 50 мкл/лунку и перемешивали постукиванием. После инкубации в CO2-инкубаторе в течение периода от 30 до 45 минут добавляли буфер для анализа THP-1, содержащий LPS, при 50 мкл/лунку (конечная концентрация LPS составляла 1 мкг/мл). Затем по планшету постукивали для перемешивания с последующей инкубацией в CO2-инкубаторе в течение 6 часов. После завершения инкубации в супернатанте культуры измеряли концентрацию TNF-α человека посредством коммерчески доступного набора (Human TNF-α CytoSet (произведенного BIOSOURCE) или Human TNF-α Ready-Set-Go! (произведенного eBioscience, Inc.)).
Результаты, полученные этими экспериментальными способами, приведены в таблице 3.
Как видно из результата, представленного в таблице 3, подтверждено, что оба соединения I-1 и I-4 по настоящему изобретению обладают высокой специфичностью к ADAM17 по сравнению с металлопротеиназами, отличными от ADAM17. Их ингибирующую активность также подтверждали на TACE, экспрессированном на макрофагоподобных клетках. Кроме того, эти два соединения также подавляли ADAM10, хотя степень подавления по сравнению с ADAM17 была несколько меньшей. ADAM10 представляет собой фермент, который может расщеплять субстрат как ADAM17 (см. Caescu et al., Biochemical J., 2009, vol. 424, pp. 79-88). Полагают, что ингибирование пригодно для поддержания функции тромбоцитов (см. Bender et al., "Differentially regulated GPVI ectodomain shedding by multiple platelet-expressed proteinases", Blood, July 19, 2010, публикация онлайн). На основании указанного выше, соединения I-1 и I-4 по настоящему изобретению представляют собой специфичные к ADAM17 ингибиторы, что указывает на то, что другие соединения с той же основной структурой (например, I-2, I-3, I-5, I-6) по настоящему изобретению также являются специфичными к ADAM17 ингибиторами. При этом GM6001 со структурой гидроксамовой кислоты неспецифически и сильно ингибировал металлопротеиназы, как это общеизвестно, но ингибирующая активность в отношении ADAM17 была слабой.
(Тестовый пример 5) Проверка поддерживающего функцию действия GM6001 и S-45282 на получаемые из ES клеток тромбоциты
В условиях (протокол 1), проиллюстрированных на фиг.6, проводили индукцию тромбоцитов из получаемых из ES клеток гемопоэтических клеток-предшественников, полученных, как описано выше. В частности, в описанном выше процессе культивирования длительностью 8 суток для индукции гемопоэтических клеток-предшественников в мегакариоциты/тромбоциты, культивирование проводили в следующих условиях:
2 суток: культивирование с добавлением GM6001, S-45282 или ДМСО за 2 суток до анализа проточной цитометрией (на "d22", представленные на фиг.6), или
8 суток: культивирование в течение 8 суток при добавлении GM6001 (50 мкМ), S-45282 (5 мкМ или 50 мкМ) или ДМСО после пересевания получаемых из ES клеток гемопоэтических клеток-предшественников (после "d15", представленных на фиг.6).
После сбора, как описано выше, посредством проточной цитометрии подсчитывали количество CD41(+)CD42b(+), количество CD41(+)CD42b(-) и общее количество тромбоцитов. Полученные результаты представлены на фиг.7-10. Следует отметить, что так как CD41 (интегрин αIIb) представляет собой поверхностный маркер тромбоцитов, CD41(+) указывает на тромбоциты. Кроме того, CD42b (GPIbα)(+) указывает на то, что тромбоциты на поверхности содержат GPIbα, тогда как CD42b (GPIbα)(-) означает тромбоциты, у которых GPIbα отщеплен ADAM17. Кроме того, на диаграммах "GM" означает результат добавления 50 мкМ GM6001 (растворитель: ДМСО), а "45282" означает результат добавления S-45282 (растворитель: ДМСО) в каждой концентрации.
Как видно из результатов, представленных на фиг.7 и 9, они подтверждают, что каждый из GM6001 и S-45282 ингибирует опосредованное ADAM17 отщепление GPIbα. Кроме того, выявлено, что S-45282 даже в концентрации 5 мкМ обладает ингибирующим действием, эквивалентным 50 мкМ GM6001.
Кроме того, как видно из результатов, представленных на фиг.8 и 10, количество полученных тромбоцитов при добавлении 50 мкМ GM6001 и 5 мкМ S-45282 в течение 2 суток приблизительно являлось одинаковым; тогда как при добавлении в течение 8 суток при GM6001 образовывалось меньше тромбоцитов, чем при 5 мкМ S-45282, что демонстрирует то, что 50 мкМ GM6001 обладает цитотоксичностью.
(Тестовый пример 6) Проверка поддерживающего функцию действия S-45457 и S-45282 на получаемые из ES клеток тромбоциты
В условиях (протокол 1), проиллюстрированных на фиг.6, проводили индукцию тромбоцитов из получаемых из ES клеток гемопоэтических клеток-предшественников, полученных, как описано выше. В частности, после пересева получаемых из ES клеток гемопоэтических клеток-предшественников (после "d15", представленных на фиг.6) добавляли одно из GM6001 (50 мкМ), S-45457 (5 мкМ или 50 мкМ), S-45282 (5 мкМ) или ДМСО с последующим культивированием в течение 8 суток. После сбора, как описано выше, посредством проточной цитометрии подсчитывали количество CD41(+)CD42b(+), количество CD41(+)CD42b(-) и общее количество тромбоцитов. Полученные результаты представлены на фиг.11 и 12. Следует отметить, что на диаграммах, "45457" означает результат добавления S-45457 (растворитель: ДМСО) в каждой концентрации.
Как видно из результатов, представленных на фиг.11 и 12, они подтверждают, что S-45457, подобно GM6001 и S-45282, также ингибирует опосредованное ADAM17 отщепление GPIbα.
(Тестовый пример 7) Проверка зависимости поддерживающего функцию действия S-45457 у тромбоцитов от концентрации
В условиях, иллюстрируемых на фиг.6, проводили индукцию тромбоцитов из получаемых из ES клеток или из iPS клеток гемопоэтических клеток-предшественников, полученных, как описано выше. В частности, после пересевания получаемых из ES клеток или из iPS клеток гемопоэтических клеток-предшественников (после "d15", представленных на фиг.6) добавляли GM6001 (50 мкМ), S-45457 (от 1,5 до 50 мкМ) или ДМСО с последующим культивированием в течение 8 суток. После сбора, как описано выше, посредством проточной цитометрии подсчитывали количество CD41(+)CD42b(+), количество CD41(+)CD42b(-) и общее количество тромбоцитов. На фиг.13-16 представлены результаты, полученные при проведении описанного выше способа 4 раза. Следует отметить, что статистический анализ отношений CD42b(+) к общему количеству тромбоцитов проводили посредством ANOVA с подвергнутыми угловому преобразованию значениями с последующими множественными сравнениями по критерию Даннета на группе различий между группой с ДМСО и группами с тестируемыми веществами.
Как видно из результатов, представленных на фиг.14 и 16, они подтверждают, что в культуральной системе с использованием ES клеток (фиг.14), а также в культуральной системе с использованием iPS клеток (фиг.16) добавление соединения S-45457 по настоящему изобретению ингибирует опосредованное ADAM17 отщепление GPIbα в зависимости от добавляемой концентрации. Кроме того, как видно из результатов, представленных на фиг.13 и 15, они также подтверждают, что соединение S-45457 по настоящему изобретению обладает низкой токсичностью для ES клеток, iPS клеток и дифференцировавшихся из них клеток.
(Тестовый пример 8) Проверка зависимости поддерживающего функцию действия S-45457 на получаемые из периферической крови человека тромбоциты от концентрации
Таким же способом, как для тромбоцитов, получаемых с использованием культуральной системы, как описано выше, проводили проверку того, демонстрируют ли соединения по настоящему изобретению поддерживающее функцию действие на получаемые из периферической крови тромбоциты, получаемых посредством сбора крови. В частности, в соответствии с <протоколом 2>, иллюстрируемым на фиг.6, сначала в периферическую кровь человека, получаемую посредством забора крови, добавляли ACD в отношении 1:10 и центрифугировали при 900 об./мин. в течение 10 минут без перерыва. Супернатант, полученный посредством центрифугирования, дополнительно центрифугировали при 1500 об./мин в течение 10 минут без перерыва, а затем супернатант удаляли. Полученный таким образом осадок суспендировали в буфере Tyrode-HEPES (не содержащем кальций). Подсчитывали количество тромбоцитов в суспензии и суспензию (отмытых тромбоцитов) доводили до содержания от 5×107 до 1×108 тромбоцитов/200 мкл буфера Tyrode-HEPES (не содержащего кальций). Затем к отмытым тромбоцитам добавляли один из 50 мкМ GM6001, от 1,5 до 50 мкМ S-45457 или ДМСО вместе со 100 мкМ CCCP (карбонилцианид-м-хлорфенилгидразон). После инкубации при 37°C в течение 24 часов посредством проточной цитометрии подсчитывали количества CD41(+)CD42b(+) и CD41(+)CD42b(-). В частности, известно, что добавление CCCP усиливает отщепление GPIbα от поверхности тромбоцитов (см. Bergmeier et al, Blood, 2003, vol. 102, pp. 4229-4235). Полученный результат представлен на фиг.17 Статистическая обработка была такой же, как в тестовом примере 7.
Как видно из результатов, представленных на фиг.17, они подтверждают, что подобно GM6001 соединение по настоящему изобретению обладает на получаемые из периферической крови человека тромбоциты поддерживающим функцию действием, в частности поддерживающим функцию действием при 37°C.
(Тестовый пример 9) Проверка поддерживающего функцию действия S-45457 и ингибиторов p38 на получаемые из периферической крови человека тромбоциты
Известно, что ингибирование p38 подавляет отщепление GPIbα (см. Matthias C. et al., TRANSFUSION MEDICINE, BLOOD, March 4, 2010, vol. 115, No. 9, pp. 1835-1842). По этой причине у ингибиторов p38 и соединения по настоящему изобретению сравнивали поддерживающее функцию действие на получаемые из периферической крови человека тромбоциты. В частности, к отмытым тромбоцитам, полученным таким же способом, как в тестовом примере 8, совместно с 100 мкМ CCCP добавляли один из двух 40 мкМ ингибиторов p38 (ингибиторы MAP-киназы p38, произведенные Calbiochem, номера продуктов: SB202190 и SB203580), 50 мкМ S-45457 или ДМСО. После инкубации при 37°C в течение 24 часов посредством проточной цитометрии проводили анализ точечной диаграммы у CD41(+) и CD42b(+). Полученный результат представлен на фиг.18. Следует отметить, что на фиг.18, ось X представляет собой CD41, а ось Y представляет собой CD42b. Кроме того, на диаграммах "202190" и "203580" означают результат добавления каждого из ингибиторов p38 при 40 мкМ (растворитель: ДМСО).
Кроме того, к отмытым тромбоцитам, полученным таким же способом, как в тестовом примере 8, вместе с 100 мкМ CCCP добавляли один из двух 40 мкМ ингибиторов p38, 50 мкМ GM6001, от 0,5 до 50 мкМ S-45457 или ДМСО. После инкубации при 37°C в течение 24 часов и анализа проточной цитометрией, рассчитывали процент CD41(+)CD42b(+) у тромбоцитов. Полученный результат представлен на фиг.19.
Как видно из результатов, представленных на фиг.18 и 19, так как количества (CD42b)(+) клеток с GPIbα при добавлении ингибиторов p38 были большими, чем при ДМСО, они подтверждают, что ингибиторы p38 также обладают поддерживающим функцию действием на получаемые из периферической крови человека тромбоциты. Однако эффект, производимый добавлением соединения по настоящему изобретению, превосходил эффект, производимый добавлением ингибиторов p38.
(Тестовый пример 10) Проверка поддерживающего функцию действия S-45457 и ингибиторов p38 на получаемые из ES клеток тромбоциты
В условиях (протокол 1), иллюстрируемых на фиг.6, проводили индукцию тромбоцитов из получаемых из ES клеток гемопоэтических клеток-предшественников, полученных, как описано выше. В частности, после пересева получаемых из ES клеток гемопоэтических клеток-предшественников (после "d15", представленных на фиг.6), добавляли один из 50 мкМ GM6001, от 0,15 до 50 мкМ S-45457, каждый из двух 40 мкМ ингибиторов p38, 50 мкМ GM6001 или ДМСО с последующим культивированием в течение 8 суток. После сбора, как описано выше, посредством проточной цитометрии определяли и подсчитывали общее количество тромбоцитов и процент CD41(+)CD42b(+) у тромбоцитов. Полученные результаты представлены на фиг.20 и 21.
Как видно из результатов, представленных на фиг.20, количество тромбоцитов, получаемых при добавлении ингибиторов p38, было значительно меньшим, и подтверждали существенную токсичность. Кроме того, как видно из результатов, представленных на фиг.21, при добавлении соединения по настоящему изобретению наблюдали поддерживающее функцию действие на получаемые из ES клеток тромбоциты, тогда как при добавлении ингибиторов p38 эффекта не наблюдали.
(Тестовый пример 11) Проверка поддерживающего функцию действия S-45457 и S-45282 на получаемые из периферической крови человека тромбоциты
Для проверки поддерживающего функцию действия S-45457 и S-45282 на получаемые из периферической крови человека тромбоциты, к отмытым тромбоцитам таким же способом, как в тестовом примере 8, вместе с 100 мкМ CCCP добавляли один из 50 мкМ GM6001, 5 мкМ или 50 мкМ S-45457, 50 мкМ S-45282 или ДМСО. После инкубации при 37°C в течение 24 часов посредством проточной цитометрии подсчитывали общее количество тромбоцитов и количество CD42b(+) и рассчитывали процент CD42b(+) у тромбоцитов. Полученный результат представлен на фиг.22.
Как видно из результатов, представленных на фиг.22, они подтверждают, что подобно GM6001, соединения по настоящему изобретению обладают поддерживающим функцию действием, в частности, поддерживающим функцию действием при 37°C на получаемые из периферической крови человека тромбоциты.
(Тестовый пример 12) Проверка поддерживающего функцию действия в PRP периферической крови человека
Устойчивость поддерживающего функцию действия каждого из соединений на тромбоциты исследовали с использованием PRP (богатой тромбоцитами плазмы) периферической крови человека. В частности, сначала к периферической крови человека, полученной посредством забора крови, добавляли ACD в отношении 1:10, и кровь центрифугировали при комнатной температуре при 900 об./мин в течение 10 минут без перерыва. Затем к полученному таким образом супернатанту (PRP) добавляли один из 50 мкМ GM6001, 50 мкМ S-45457, 5 мкМ S-45282, двух 40 мкМ ингибиторов p38 или ДМСО. После инкубации при 37°C в течение 24 часов или 72 часов, посредством проточной цитометрии подсчитывали количество CD41(+)CD42b(+) и количество CD41(+)CD42b(-), рассчитывали процент CD41(+)CD42b(-) или CD41(+)CD42b(+) в тромбоцитах. Полученный результат представлен на фиг.23. На фиг.23, "свежий" означает результат анализа проточной цитометрией в PRP периферической крови человека, не подвергнутой инкубации.
Результат, представленный на фиг.23, позволил выявить, что соединение S-45457 по настоящему изобретению способно длительно подавлять опосредованное ADAM17 отщепление GPIbα (CD42b) даже при инкубации в течение 72 часов. Кроме того, выявлено что соединение S-45282 по настоящему изобретению также обладает сильным действием на поддержание функции PRP периферической крови человека с учетом добавляемой концентрации 5 мкМ. При этом наблюдали, что действие ингибиторов p38 было меньшим или почти не наблюдаемым.
(Тестовый пример 13) Проверка поддерживающего функцию действия на получаемые из периферической крови человека тромбоциты
К отмытым тромбоцитам, полученным таким же способом, как в тестовом примере 8, вместе со 100 мкМ CCCP добавляли один из 50 мкМ GM6001, 50 мкМ S-45457, 5 мкМ S-45282, двух 40 мкМ ингибиторов p38 или ДМСО. После инкубации при 37°C в течение 24 часов посредством проточной цитометрии проводили анализ точечной диаграммы у CD41(+) и CD42b(+). Полученный результат представлен на фиг.24 Следует отметить, что на фиг.24, ось X представляет собой CD41, а ось Y представляет собой CD42b. Кроме того, на фиг.24, "свежий" означает результат анализа проточной цитометрией отмытых тромбоцитов, не подвергнутых инкубации.
Как видно из результатов, представленных на фиг.24, они подтверждают, что соединение S-45457 по настоящему изобретению подавляет опосредованное ADAM17 отщепление GPIbα (CD42b). Кроме того, они подтверждают, что соединение S-45282 по настоящему изобретению также обладает сильным поддерживающим функцию действием на получаемые из периферической крови человека тромбоциты, но не таким сильным как S-45457. Кроме того, они подтверждают, что действие ингибиторов p38 является низким.
(Тестовый пример 14) Проверка зависимости поддерживающего функцию действия S-45457 на получаемые из периферической крови человека тромбоциты от концентрации
К отмытым тромбоцитам с 100 мкМ CCCP добавляли один из 50 мкМ GM6001, от 0,5 до 50 мкМ S-45457 или ДМСО как в тестовом примере 8. После инкубации при 37°C в течение 24 часов, посредством проточной цитометрии проводили анализ точечной диаграммы для CD41(+) и CD42b(+) для проверки поддерживающего функцию действия S-45457 на получаемые из периферической крови человека тромбоциты. Полученный результат представлен на фиг.25. Следует отметить, что на фиг.25, ось X представляет собой CD41, а ось Y представляет собой CD42b.
Как видно из результатов, представленных на фиг.25, они подтверждают, что соединение по настоящему изобретению подавляет опосредованное ADAM17 отщепление GPIbα (CD42b) зависимым от концентрации способом.
(Тестовый пример 15) Проверка поддерживающего действия S-45457 на адгезионную способность тромбоцитов с использованием проточной камеры
Выявлено, что в норме, когда стенка кровеносного сосуда повреждена, экспонируются коллагеновые ткани под эндотелиальными клетками сосуда, фактор фон Виллебранда (VWF) в плазме связывается с коллагеновой тканью; затем к кровеносному сосуду прикрепляются тромбоциты посредством взаимодействия между VWF и GPIbα (CD42b) и взаимодействия между VWF и интегрином α2bβ3. Кроме того, выявлено, что тромбоцит, прикрепляющийся к кровеносному сосуду, начинает прикрепление тромбоцита к тромбоциту посредством взаимодействия между VWF и GPIbα и взаимодействия между VWF и интегрином α2bβ3, и развивается тромб (см. Ruggeri ZM., Nature Medicine, November 2002, vol. 8, No. 11, pp. 1227-1234).
Таким образом, поддерживает ли действие соединений (таких как S-45457) по настоящему изобретению, подавляющее отщепление GPIbα, демонстрируемое в тестовых примерах 1-14 взаимодействие между VWF и GPIbα (CD42b) и вносит ли оно вклад в поддержание адгезионной способности тромбоцитов или нет, оценивали с использованием проточной камеры, обеспечивающей количественную оценку хода формирования тромба.
В частности, сначала посредством забора крови получали периферическую кровь человека, добавляли ACD и центрифугировали при 900 об./мин. в течение 10 минут без перерыва для получения супернатанта. В супернатант добавляли 1 мкМ простагландин E1 (PGE1) и центрифугировали при 1500 об./мин. в течение 10 минут без перерыва. Затем супернатант удаляли. Полученный таким образом осадок суспендировали в буфере Tyrode HEPES Ca(-), к нему добавляли 100 мкМ CCCP и одновременно добавляли один из ДМСО или 15 мкМ S-45457 с последующей инкубацией при 37°C в течение 24 часов. Следует отметить, что в этом эксперименте, часть, получаемую посредством добавления CCCP и ДМСО и последующей инкубации, получали в качестве отрицательного контроля, тогда как часть, получаемую без добавления или инкубации, получали в качестве положительного контроля.
Затем после инкубации (в случае положительного контроля без инкубации), в суспензию добавляли TMRE (перхлорат этилового эфира тетраметилродамина), разведенный до 1/2000, и инкубировали при комнатной температуре в течение 15 минут для флуоресцентного мечения тромбоцитов. Затем в суспензию добавляли буфер Tyrode HEPES Ca(-) и центрифугировали при 1500 об./мин. в течение 8 минут без перерыва для отмывки тромбоцитов.
Затем каждый из флуоресцентно меченных образцов тромбоцитов добавляли к образцу цельной крови собранной периферической крови человека, обработанному антикоагулянтом аргатробаном (ингибитор тромбина), и смешивали с ним так, что количество тромбоцитов флуоресцентно меченного образца тромбоцитов составляло 10% от тромбоцитов цельной крови. Затем, полученный таким образом образец крови инъецировали в камеру при постоянной скорости касательного напряжения у стенки (1500S-1) посредством шприцевого насоса (произведенного Harvard Apparatus). Поверхность камеры покрывали VWF, и тромбоциты в образце крови прикреплялись к поверхности посредством VWF. Флуоресцентно меченные тромбоциты, формировавшие тромб, визуализировали с использованием инвертированной эпифлуоресцентной микроскопической видеосистемы (DM IRB, произведенной Leica). Микроскопическое изображение оцифровывали с использованием светочувствительной цветной CCD-камеры (L-600, произведенной Leica). Затем рассчитывали процент площади поверхности, покрытой тромбоцитами, с использованием программного обеспечения Image-J (NIH Image). Следует отметить, что этот эксперимент проводили дважды для каждого образца, исходные данные для каждого образца конвертировали в процент с максимальным значением процента площади поверхности, покрываемой положительным контролем (свежие тромбоциты), взятым за 100% для каждого раза, и рассчитывали среднее значение двух тестов. Полученные результаты представлены на фиг.26 и 27. Следует отметить, что на фиг.26 и 27, вертикальная ось представляет собой среднее значение, "S-45457" означает результат тромбоцитов, получаемых посредством добавления 15 мкМ S-45457, "ДМСО" означает результат отрицательного контроля, а "свежие" означает результат положительного контроля (свежие тромбоциты). Кроме того, на фиг.26, горизонтальная ось представляет собой период измерения (единица: минута) от впрыска в камеру.
Как видно из результатов, представленных на фиг.26 и 27, соединение (S-45457) по настоящему изобретению обладает высоким процентом площади поверхности, покрываемой тромбоцитами, по сравнению с результатами отрицательного контроля, где добавляли ДМСО и инкубировали с ними CCCP. Таким образом, выявлено, что соединение по настоящему изобретению подавляет опосредованное ADAM17 отщепление GPIbα и таким образом обеспечивает ассоциацию GPIbα и VWF, т.е., способно сохранять адгезионную способность тромбоцитов.
(Тестовый пример 16) Проверка поддерживающего действия S-45457 на адгезионную способность тромбоцитов способом биомолекулярной визуализации
Поддерживающее действие соединения (такого как S-45457) по настоящему изобретению на адгезионную способность тромбоцитов, в частности, способность тромбоцитов к адгезии к кровеносному сосуду in vivo оценивали способом биомолекулярной визуализации и модели формирования тромба, разработанной авторами настоящего изобретения.
Следует отметить, что модель формирования тромба, используемая в этом тестовом примере, индуцирует формирование тромба приведенным ниже способом. В частности, в кровеносном сосуде, используя лазерное облучение совместно с гематопорфирином и т.д., локально получают активные формы кислорода (ROS). Это приводит к повреждению эндотелиальных клеток сосудов, и, таким образом, тромбоциты прикрепляются к кровеносному сосуду так, что формируется тромб. Кроме того, в способе биомолекулярной визуализации, используемом в этом тестовом примере, используют высокочастотный конфокальный лазерный микроскоп и многолучевой конфокальный блок, и, таким образом, можно получать высокочастотное изображение посредством фокусировки на экстремально маленькой области, параллельной направлению кровотока. Таким образом, наблюдение посредством фокусировки на тромбоцитах или т.п., протекающих через кровеносный сосуд при изменении формы, обеспечивает изображение in vivo на уровне отдельных тромбоцитов (см. Takizawa et al., The Journal of Clinical Investigation, January, 2010, vol. 120, iss. 1, pp. 179-190). Далее описаны модель формирования тромба и способ биомолекулярной визуализации, используемый в этом тестовом примере.
Сначала получали тромбоциты для инъекции мышам, используемым в качестве модели формирования тромба. В частности, посредством забора крови получали периферическую кровь человека, добавляли ACD при 10 об./об.% и центрифугировали при 900 об./мин. в течение 10 минут без перерыва для получения супернатанта. В супернатант добавляли 1 мкМ PGE1 и центрифугировали при 1500 об./мин. в течение 10 минут без перерыва. Затем супернатант удаляли. Полученный таким образом осадок суспендировали в буфере Tyrode HEPES Ca(-), в который добавляли 100 мкМ CCCP и ДМСО или 15 мкМ S-45457 с последующей инкубацией при 37°C в течение 24 часов. Следует отметить, что в этом эксперименте часть, получаемую добавлением CCCP и ДМСО и последующей инкубацией, получали в качестве отрицательного контроля, тогда как часть, получаемую без добавления и инкубации, получали в качестве положительного контроля. После инкубации (в случае положительного контроля без инкубации) подсчитывали количество тромбоцитов в осадке. Осадок суспендировали в 2 мл буфера Tyrode HEPES Ca(-) (содержащего 1 мкМ PGE1) и добавляли 5 мкМ TMRE. Затем суспензию инкубировали при комнатной температуре в течение 15 минут с флуоресцентным мечением тромбоцитов. Затем в суспензию добавляли буфер Tyrode HEPES Ca(-) и центрифугировали при 1500 об./мин. в течение 8 минут без перерыва для отмывки тромбоцитов.
Затем получали модель формирования тромба на мышах. В частности, мышь NOG (мышь с тяжелым комбинированным иммунодефицитом), предварительно подвергнутую радиоактивной обработке 2 Гр для уменьшения количества тромбоцитов, анестезировали и делали небольшой разрез в брюшной стенке для обеспечения визуального анализа микроциркуляции и формирования тромба в брыжейке. Затем, для визуализации кинетики получаемых у мыши NOG клеток крови, в хвостовую вену мыши инъецировали FITC-декстран (20 мг/кг массы тела). Затем, мыши NOG инъецировали флуоресцентно меченные, как описано выше, тромбоциты так, чтобы количество тромбоцитов составляло 15% от количества циркулирующих тромбоцитов. Затем для индукции формирования тромба мыши NOG вводили гематопорфирин (1,8 мг/кг массы тела). Следует отметить, что, обрабатывая таким образом мышь, при лазерном облучении и продукции ROS визуализировали кинетику клеток крови и формирования тромба.
Затем, визуализированные изображения (последовательные изображения) при лазерном облучении получали посредством наблюдения и фотографирования через предварительно полученный небольшой участок разреза (приблизительно 3 мм) с применением конфокального микроскопа с вращающимся диском (произведенного Yokogawa Electric Corporation, CSU-X1) и EM (электронноумножающей) CCD-камеры (iXon, произведенной Andor Technology plc.) при 30 кадрах/секунду в течение 20 секунд. Следует отметить, что такое наблюдение проводили на 20 независимых кровеносных сосудах, где формировались обтурирующие тромбы, у каждой из мышей, которым инъецировали тромбоциты, получаемые добавлением S-45457, отрицательного контроля или положительного контроля. Полученные результаты представлены на фиг.28 и 29. Следует отметить, что на фиг.28 и 29 "S-45457" означает формирование тромба у мыши, которой инъецировали тромбоциты, получаемые добавлением 15 мкМ S-45457, "ДМСО" означает результат формирования тромба у отрицательного контроля, и "свежие" означает результат формирования тромба у положительного контроля. Кроме того, на фиг.28, где представлены типичные примеры, белая стрелка указывает направление кровотока, а участок, указанный белым треугольником, представляет собой участок, где получаемые у человека тромбоциты прикрепляются к кровеносному сосуду. Масштабная шкала составляет 10 мкм. Кроме того, на фиг.29, вертикальная ось представляет собой процент (%) количества тромбоцитов человека относительно общего количества тромбоцитов, вовлеченных в формирование тромба, а значение представляет собой среднее 20 кровеносных сосудов + стандартная ошибка.
Как видно из результатов, представленных на фиг.28 и 29, у мышей, которым инъецировали тромбоциты, получаемые посредством добавления соединения (S-45457) по настоящему изобретению, процент получаемых у человека тромбоцитов, вносящих вклад в формирование тромба, был выше, чем процент у отрицательного контроля. Таким образом, выявлено, что соединение по настоящему изобретению подавляет опосредованное ADAM17 отщепление GPIbα и, таким образом, обеспечивает поддержание способности адгезии тромбоцитов к кровеносному сосуду.
[Промышленная применимость]
Как описано выше, настоящее изобретение делает возможным поддержание функции тромбоцитов посредством специфического ингибирования металлопротеиназной активности ADAM17, подавляя отщепление GPIbα. Таким образом, настоящее изобретение пригодно в качестве реагента для эффективного получения большого количества функционально стабильных и высокобезопасных тромбоцитов без необходимости сложных действий, лекарственной добавки для поддержания функции тромбоцитов в препарате крови, для стабилизации их качества и других целей.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ N-ГИДРОКСИФОРМАМИДА И СОДЕРЖАЩЕЕ ЕГО ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2011 |
|
RU2569851C2 |
| ПИПЕРИДИН- И ПИПЕРАЗИНЗАМЕЩЕННЫЕ N-ГИДРОКСИФОРМАМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ МЕТАЛЛОПРОТЕИНАЗ | 2001 |
|
RU2283306C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКОФУНКЦИОНАЛЬНЫХ ТРОМБОЦИТОВ | 2016 |
|
RU2724533C2 |
| НОВОЕ СОЕДИНЕНИЕ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПОВЫШЕНИЯ ПРОТИВОРАКОВОЙ АКТИВНОСТИ | 2019 |
|
RU2781282C1 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ В КАЧЕСТВЕ МИМЕТИКОВ ТРО | 2006 |
|
RU2385865C2 |
| НОВОЕ СОЕДИНЕНИЕ И СОДЕРЖАЩАЯ ЭТО СОЕДИНЕНИЕ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ РАКА | 2020 |
|
RU2801811C1 |
| АНТИБАКТЕРИАЛЬНЫЕ АГЕНТЫ | 2000 |
|
RU2269525C2 |
| СОДЕРЖАЩИЕ КАРБАЗОЛ АМИДЫ, КАРБАМАТЫ И КАРБАМИДЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ КРИПТОХРОМОВ | 2015 |
|
RU2705094C2 |
| ЗАМЕЩЕННЫЕ ПУРИНОВЫЕ И 7-ДЕАЗАПУРИНОВЫЕ СОЕДИНЕНИЯ | 2011 |
|
RU2606514C2 |
| СПОСОБ ПРОИЗВОДСТВА ТРОМБОЦИТОВ СПОСОБОМ РОТАЦИОННОГО ПЕРЕМЕШИВАНИЯ КУЛЬТУРЫ | 2016 |
|
RU2756000C2 |
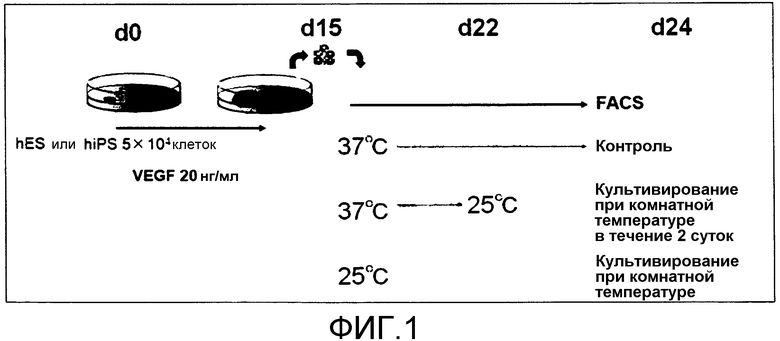
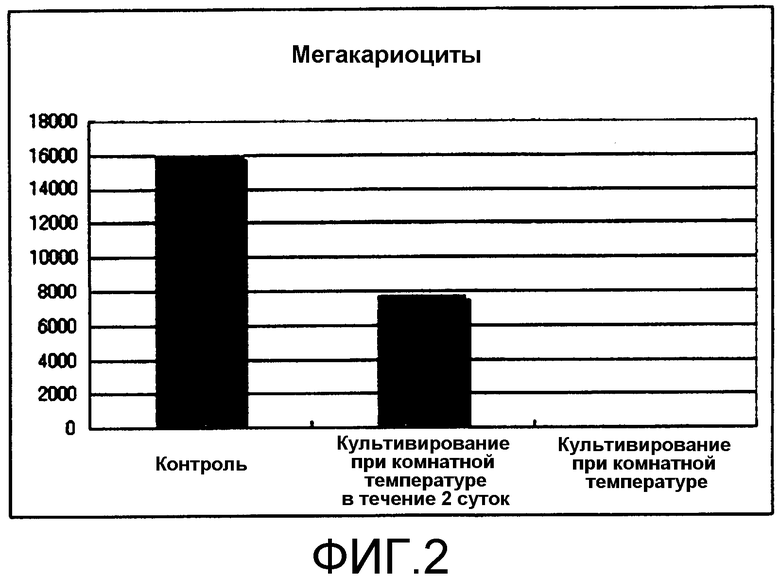
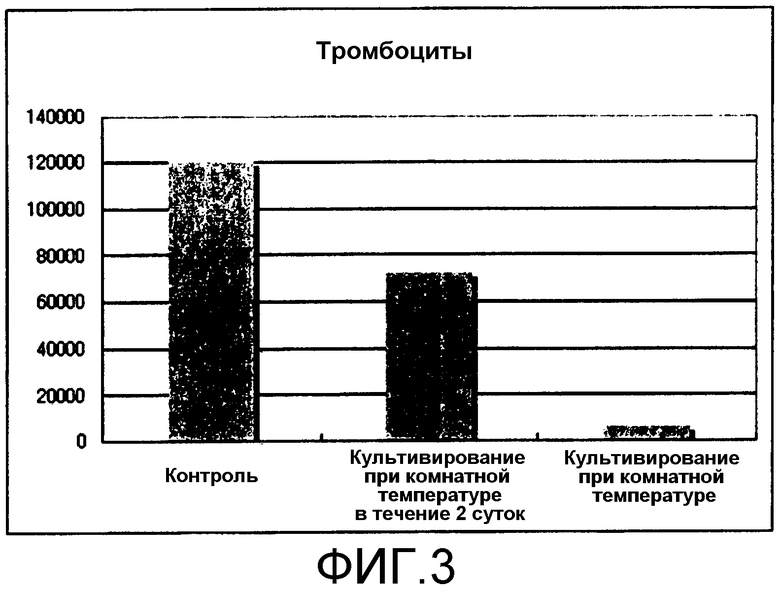
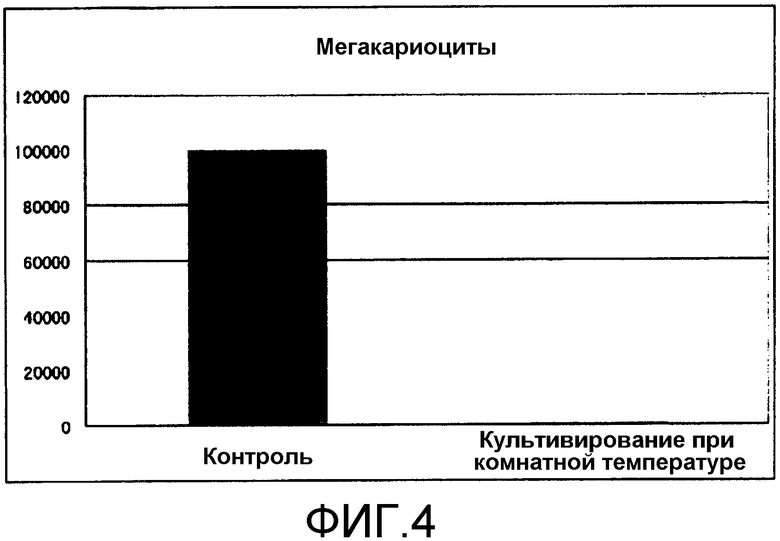
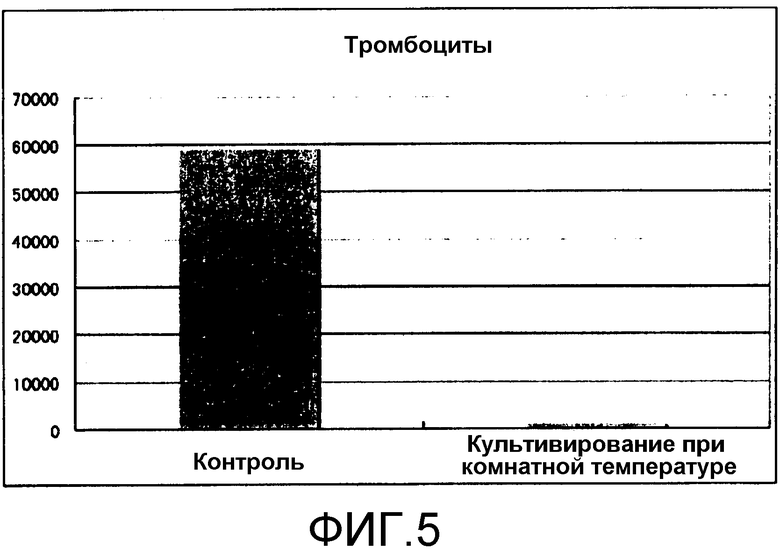
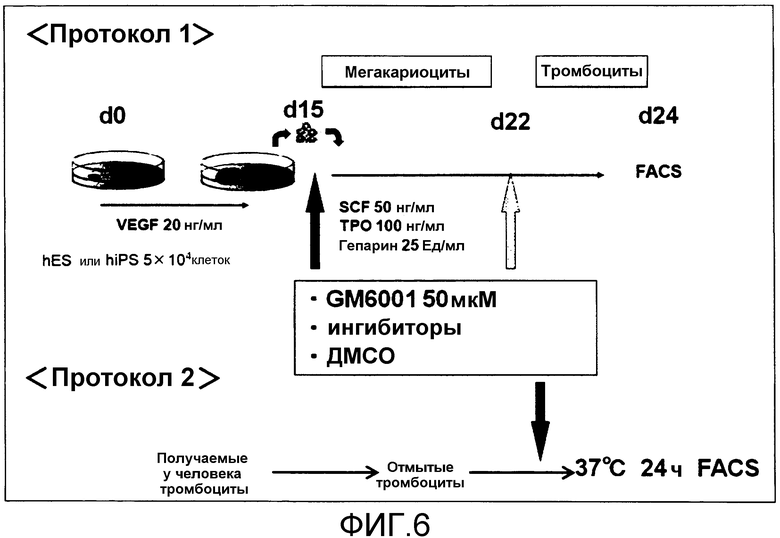
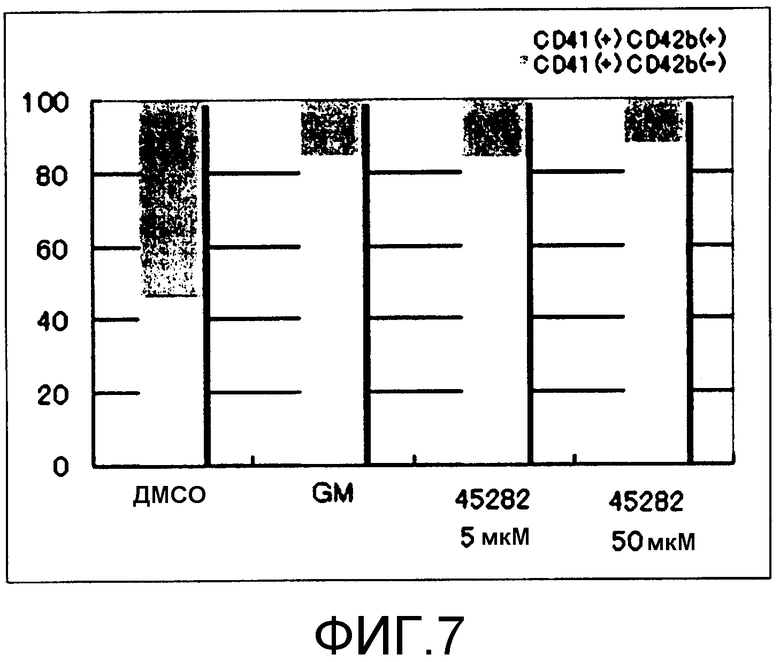
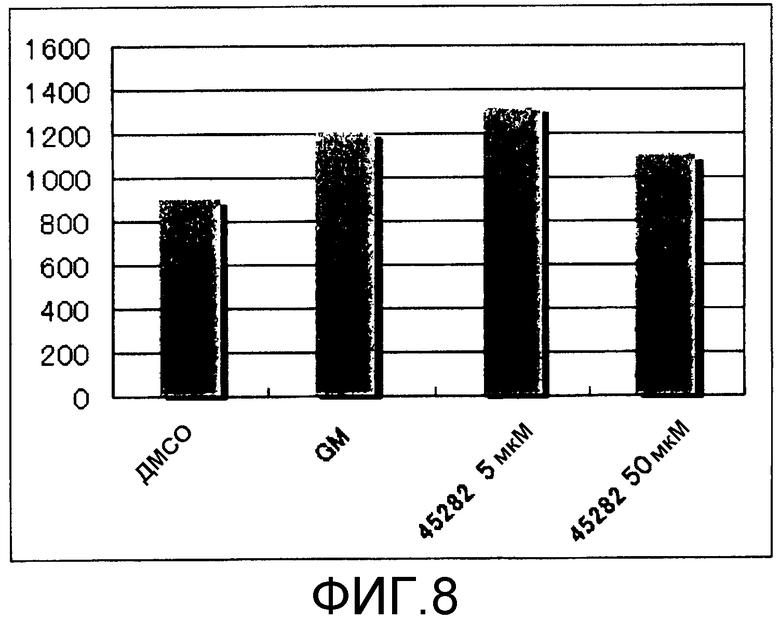
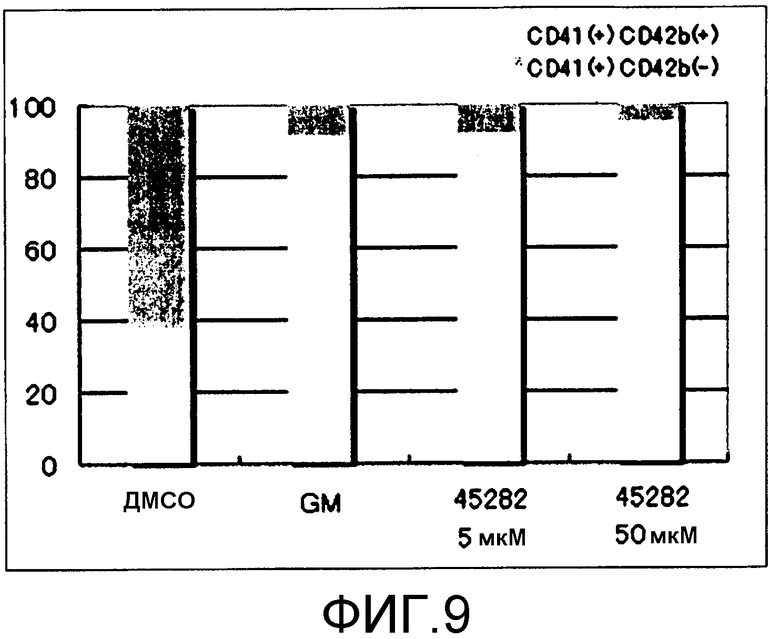
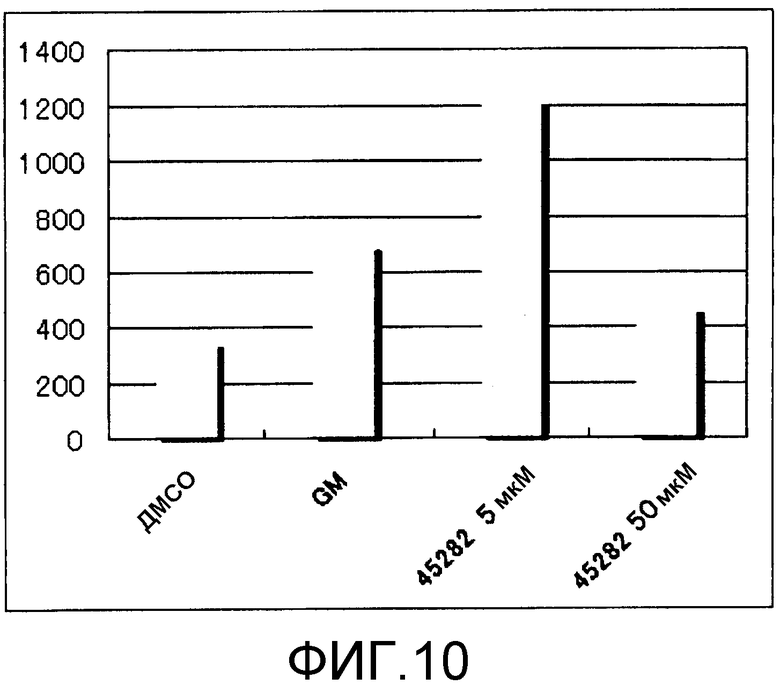
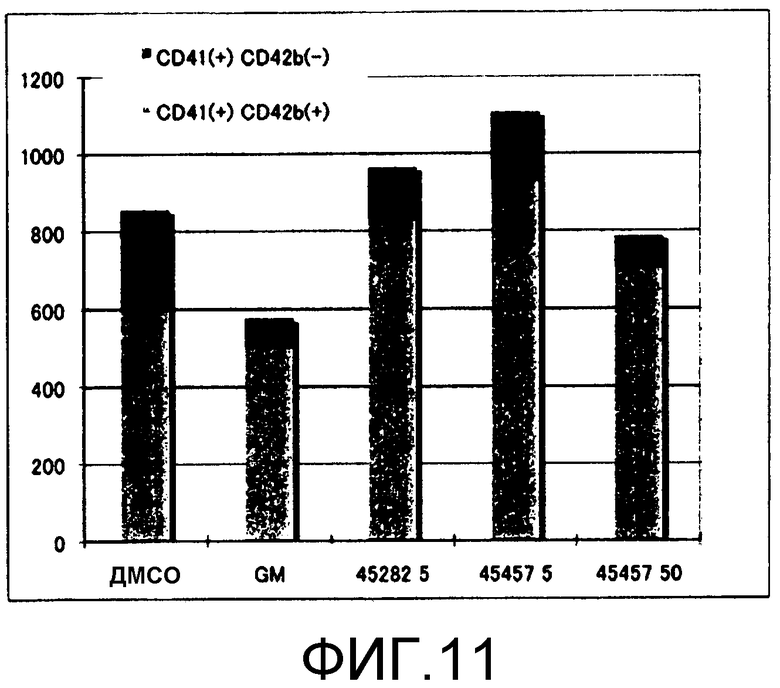
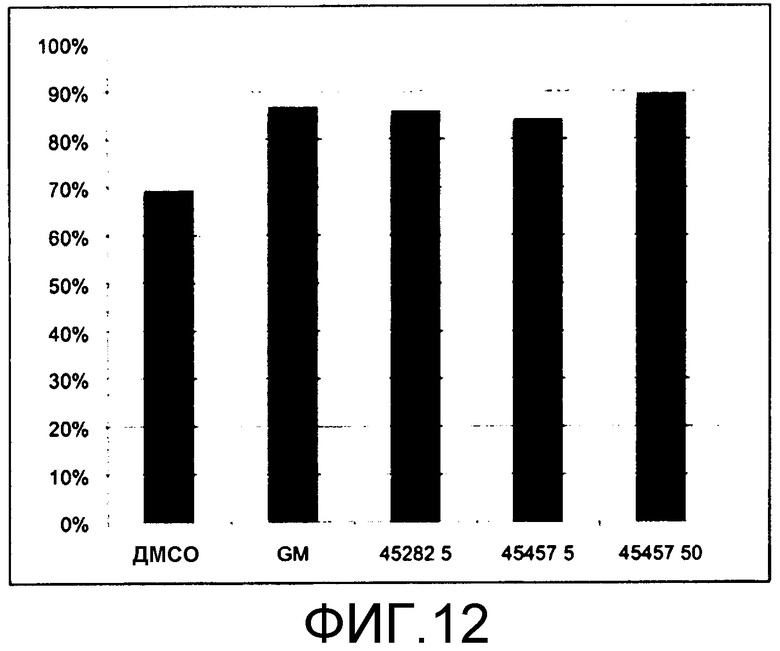
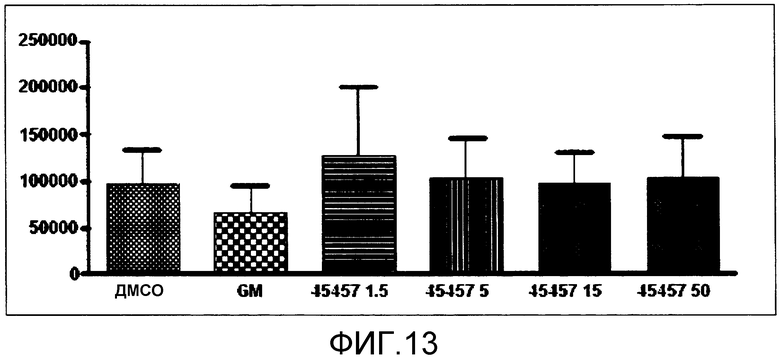
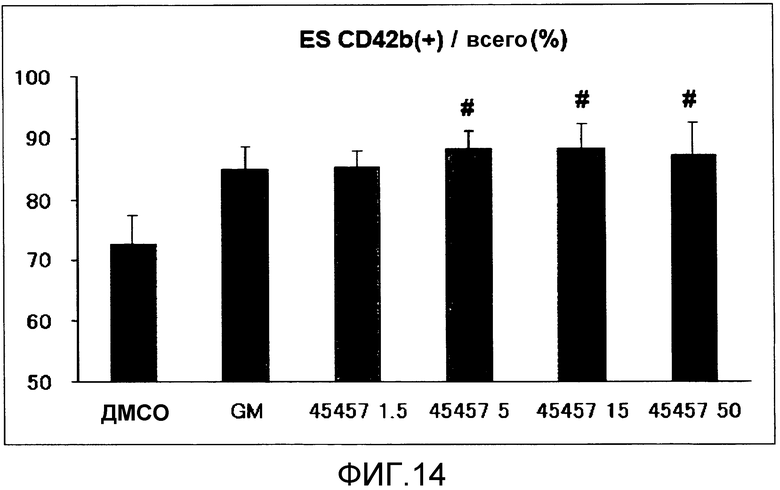
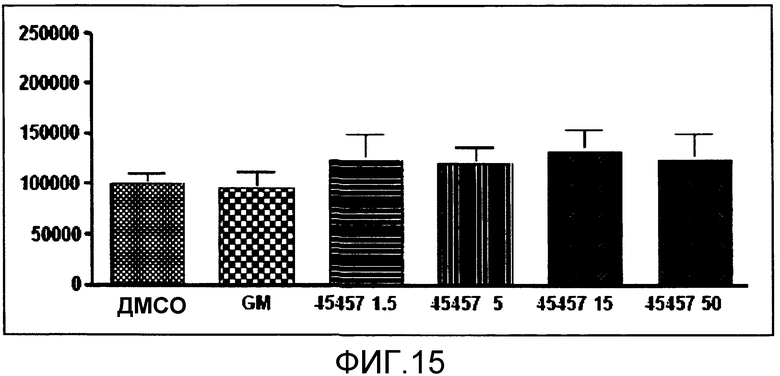
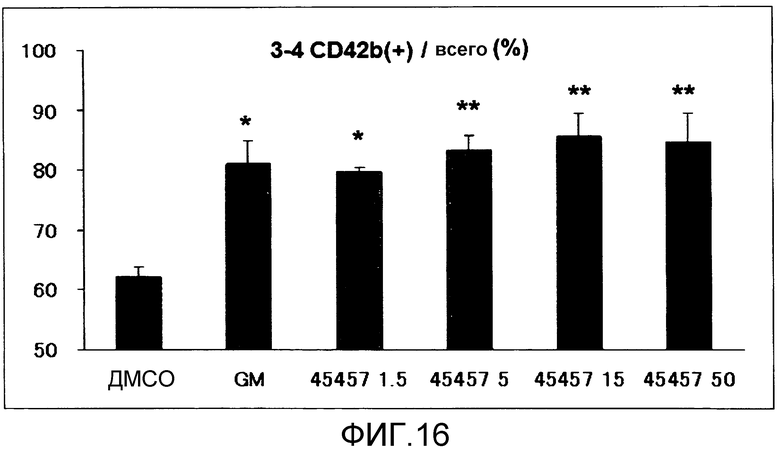
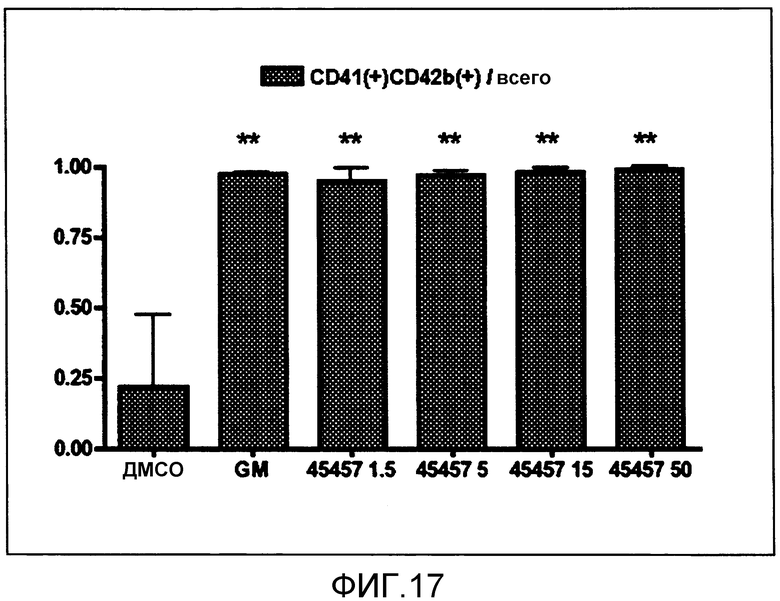
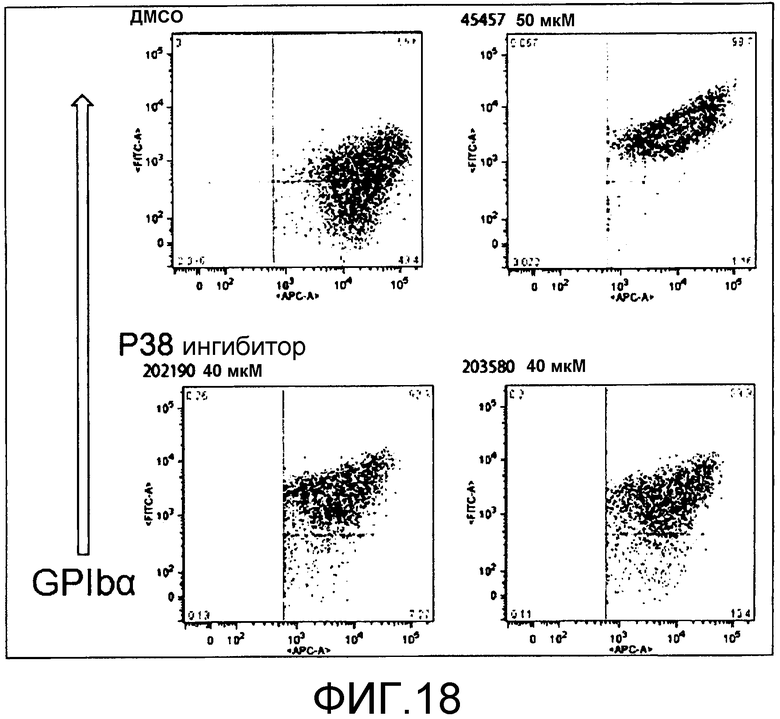
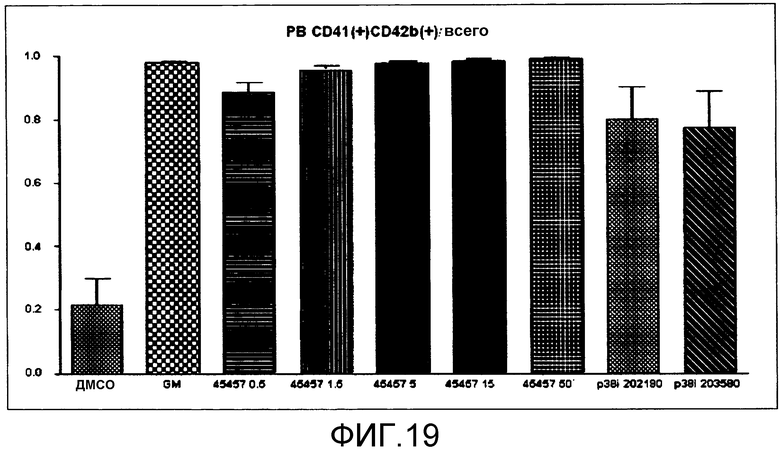
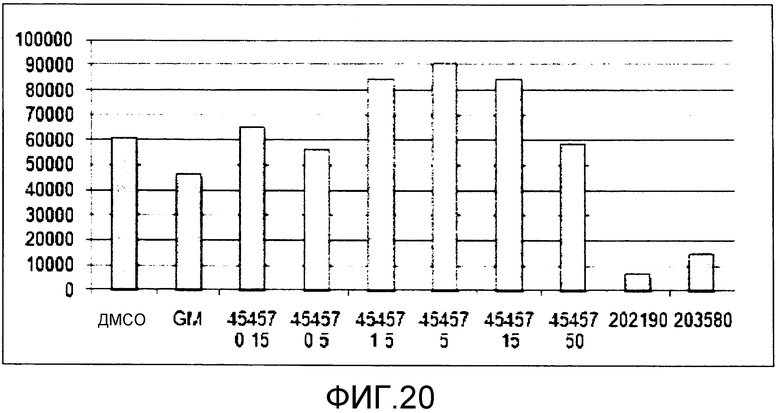
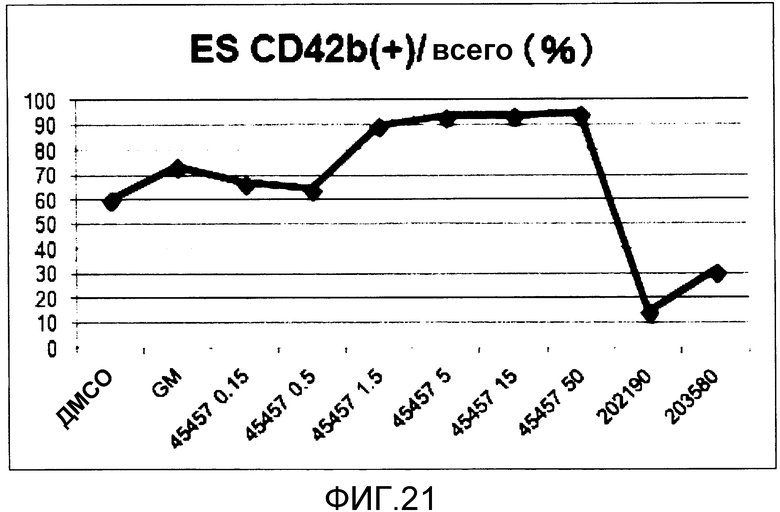
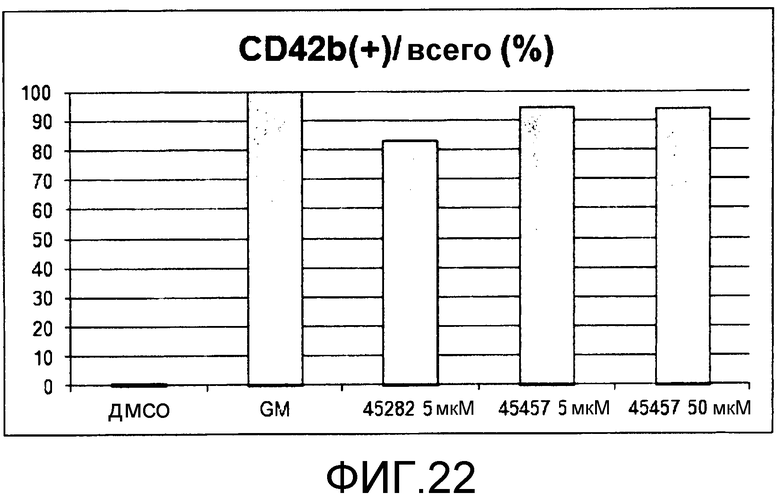
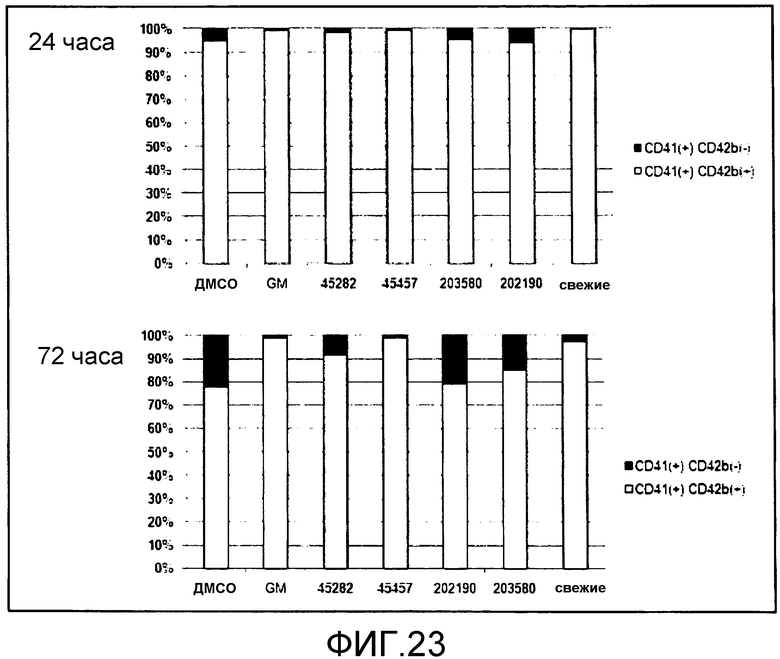
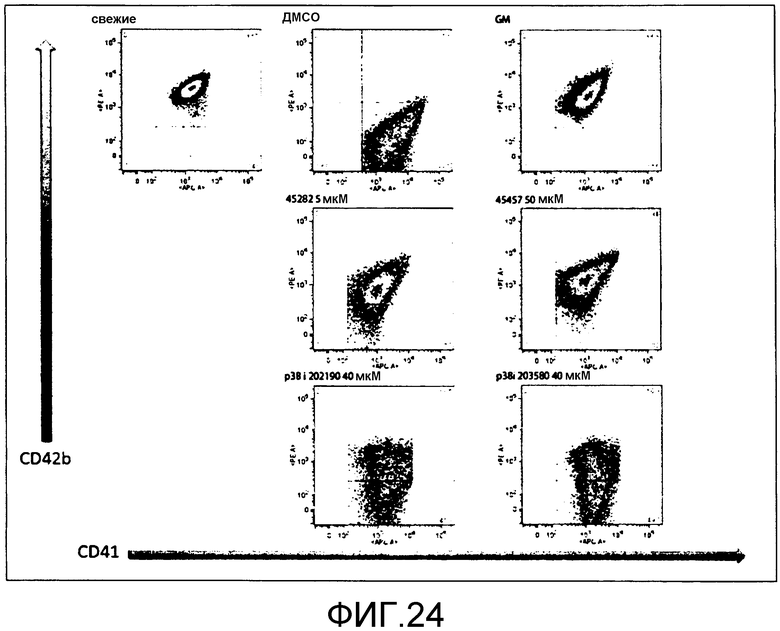
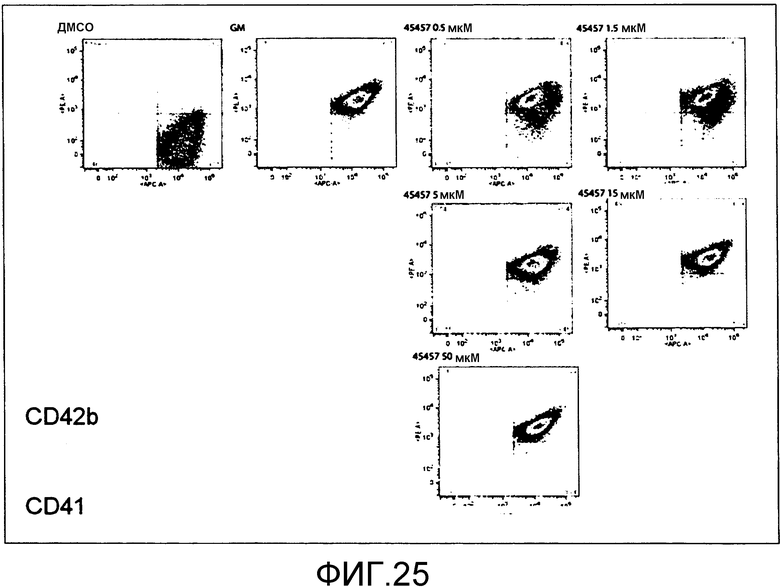
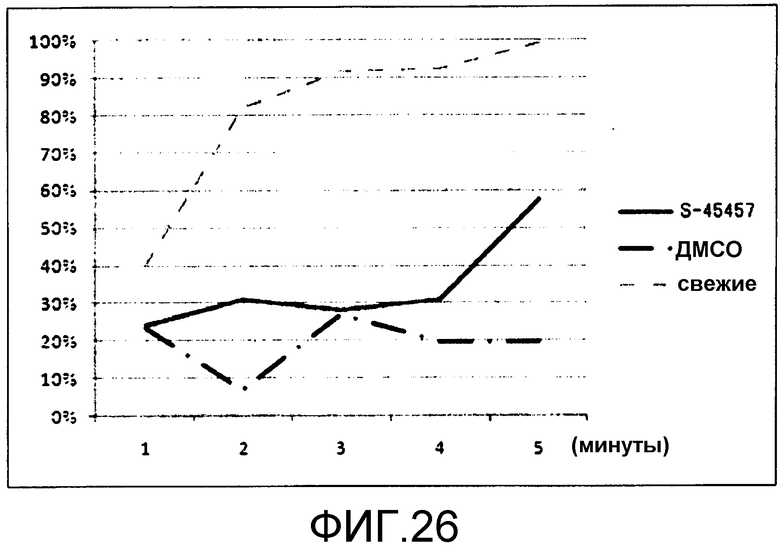
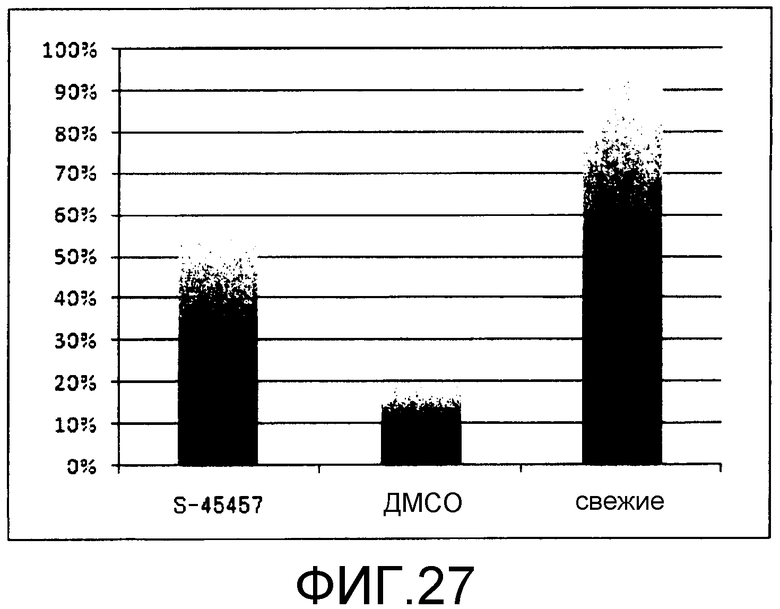
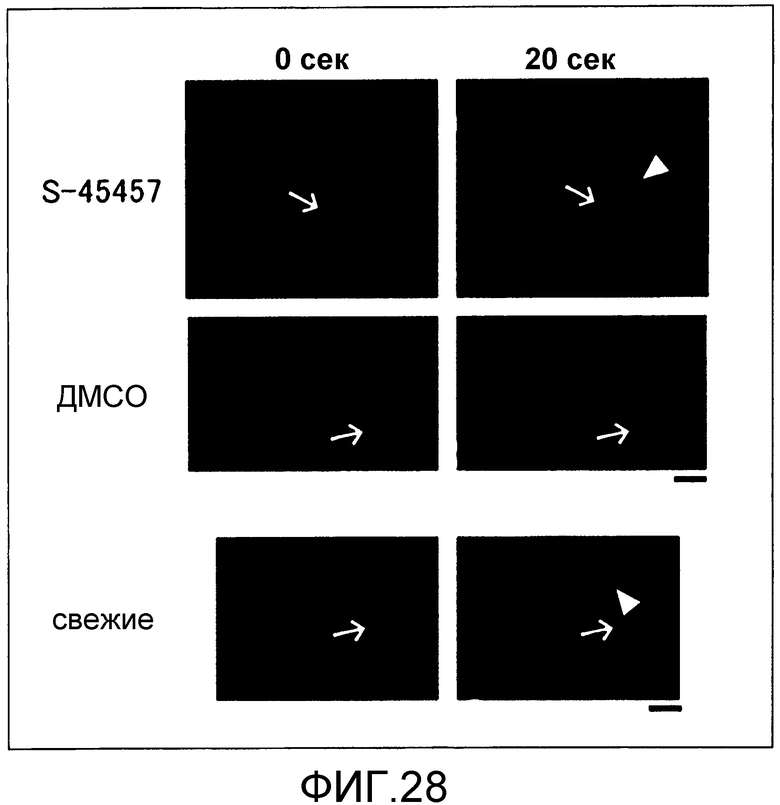
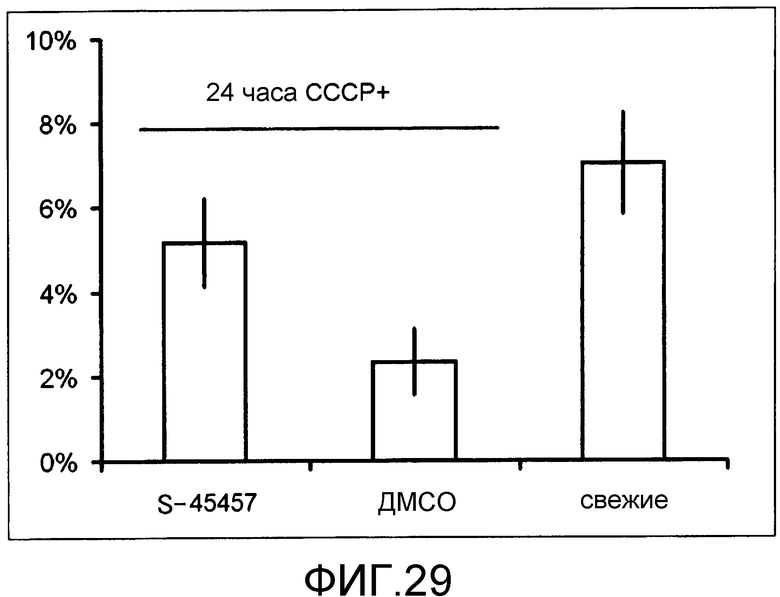
Изобретение относится к композиции для поддержания функции тромбоцитов, где композиция в качестве активного ингредиента содержит соединение, представленное общей формулой (I), или его фармацевтически приемлемую соль:

где соединение, представленное общей формулой (I), представляет собой любое из N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамида и N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}метансульфонамида. Изобретение также относится к способу получения тромбоцитов, культуральной среде, препарату крови и к способу поддержания функции тромбоцитов в препарате крови. Технический результат: получена композиция для поддержания функции тромбоцитов посредством специфического ингибирования металлопротеиназной активности ADAM17. 5 н. и 2 з.п. ф-лы, 3 табл., 29 ил., 44 пр.
1. Композиция для поддержания функции тромбоцитов, где композиция в качестве активного ингредиента содержит соединение, представленное приведенной ниже общей формулой (I), или его фармацевтически приемлемую соль:

где соединение, представленное общей формулой (I), представляет собой любое из
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамида и
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}метансульфонамида.
2. Композиция по п. 1 в форме любого из реагента для поддержания функции тромбоцитов и добавки к препарату крови, содержащему тромбоциты.
3. Способ получения тромбоцитов, где способ включает добавление в культуральную систему для дифференцировки мегакариоцитов из клеток, способных к дифференцировке в мегакариоциты, и для получения тромбоцитов из мегакариоцитов соединения, представленного приведенной ниже общей формулой (I), или его фармацевтически приемлемой соли:

где соединение, представленное общей формулой (I), представляет собой любое из
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамида и
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}метансульфонамида.
4. Способ по п. 3, где температура культивирования в культуральной системе составляет от 35 до 38°C.
5. Культуральная среда, представляющая собой культуральную систему для дифференцировки мегакариоцитов из клеток, способных к дифференцировке в мегакариоциты, и для получения тромбоцитов из мегакариоцитов, содержащая соединение, представленное приведенной ниже общей формулой (I), или его фармацевтически приемлемую соль:

где соединение, представленное общей формулой (I), представляет собой любое из
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамида и
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}метансульфонамида.
6. Препарат крови, содержащий тромбоциты и соединение, представленное приведенной ниже общей формулой (I), или его фармацевтически приемлемую соль:

где соединение, представленное общей формулой (I), представляет собой любое из
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамида и
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}метансульфонамида.
7. Способ поддержания функции тромбоцитов в препарате крови, где способ включает добавление в препарат крови, содержащий тромбоциты, соединения, представленного приведенной ниже общей формулой (I), или его фармацевтически приемлемой соли:

где соединение, представленное общей формулой (I), представляет собой любое из
N-[2-(4-бут-2-инилоксибензолсульфонил)-1-(4-диэтиламинометилфенил)этил]-N-гидроксиформамида и
N-{4-[2-(4-бут-2-инилоксибензолсульфонил)-1-(формилгидроксиамино)этил]бензил}метансульфонамида.
| ПРИСПОСОБЛЕНИЕ К ТКАЦКОМУ СТАНКУ ДЛЯ КИДКИ ЧЕЛНОКА | 1925 |
|
SU3836A1 |
| Прибор для определения продолжительности и дальности полета на воздушных судах | 1925 |
|
SU4883A1 |
| Устройство для изготовления литейных стержней | 1980 |
|
SU994104A1 |
| Приспособление для облегчения наблюдения мениска жидкостей в лабораторных сосудах | 1934 |
|
SU44712A1 |
| WO 2004006927 A2, 22.01.2004 | |||
| EP 1431285 A1, 23.06.2004 | |||
| WO 2004056766 A1, 08.07.2004. | |||
Авторы
Даты
2016-03-27—Публикация
2011-09-16—Подача