Изобретение относится к области вирусологии и медицинской биотехнологии и может найти применение в производстве ассоциированных препаратов для профилактики кори, эпидемического паротита и краснухи.
Известен метод определения содержания РНК вирусов методом ПЦР [Аммур Ю.И. Разработка методов количественного определения вакцинных штаммов вирусов кори, эпидемического паротита (ЭП) и краснухи на основе ПЦР с детекцией в режиме реального времени: автореф. …канд. биол. наук / Аммур Юлия Игоревна. - Москва, 2013. - 24 с.]. Однако этот метод пригоден лишь для количественного определения генетического материала вирусов, но не дает представления об их инфекционной активности, что чрезвычайно важно для формирования полноценного многофакторного иммунитета при иммунизации живыми аттенуированными вакцинами.
Наиболее близким к заявляемому изобретению является способ определения биологической (инфекционной) активности вирусов кори и ЭП, описанный в регламенте производства и технических условиях производства дивакцины корь-паротит (производитель ООО «Микроген»). Однако недостатком этого способа является необходимость осуществления целого комплекса предварительных методик: многократной иммунизации животных для получения гипериммунных сывороток, предварительной обработки смеси вирусов для нейтрализации одного из компонентов смеси, предшествующей титрованию смеси вирусов на культурах клеток, что делает контроль биологической активности вирусных компонентов дорогостоящей и трудоемкой процедурой.
Изобретение направлено на разработку способа (его вариантов) определения биологической активности вирусов кори, эпидемического паротита и краснухи при производстве ассоциированных препаратов ди- и тривакцины, который позволяет исключить получение гипериммунных сывороток для процедуры предварительной нейтрализации одного (нескольких) компонентов смеси.
Сокультивирование разных вирусов в одной системе клеток не применяется из-за возможной интерференции между ними и, следовательно, подавления репродукции одних вирусов другими [Isaacs A., Effect of interferon on the growth of viruses on chick chorion / Issacs A., Burke D., Padecva L. - Brit. J. Exp. Path., 1958. - V. 39. - P. 447].
Показано, что продукция интерферона в зараженных клетках обратно пропорциональна уровню вирулентности вирусов, то есть в максимальной степени феномен интерференции (ингибирующего действия) может проявляться при сокультивировании аттенуированных вакцинных штаммов [Дехтярева Н.Н. Дифференцирующие признаки вирулентных и аттенуированных (холодоадаптированных) штаммов вируса гриппа / Н.Н. Дегтярева, Т.Е. Медведева, Ю.М. Поляков и др. - Вопр. вирусологии, 1977. - №2. - С. 173-177]. В связи с этим для титрования жидких полуфабрикатов ассоциированных вакцин проводится процедура инактивации одного (или нескольких) компонентов смеси для определения инфекционного титра другого вирусного компонента.
Сущность изобретения состоит в способе сокультивирования аттенуированных штаммов вирусов кори, штамм Л-16 (семейство Paramyxoviridae, род Morbillivirus) и эпидемического паротита, штамм Л-3 (семейство Paramyxoviridae, род Rubulavirus) в чувствительных к ним перевиваемых культурах клеток Vero (перевиваемая линия клеток почки африканской зеленой мартышки. Коллекции: НИИ вирусологии РАМН; НИИ гриппа РАМН; ИНЦ РАН; http://www.sevin.ru/collections/cellcolls/rcccm/animal_uv.html) или МА-104 (перевиваемая культура клеток почки эмбриона макаки-резуса коллекции НИИ вирусологии РАМН, НИИ гриппа РАМН; http://www.sevin.ru/collections/cellcolls/rcccm/animal_uv.html), без угнетения репродукции каждого штамма, что подтверждается совпадением инфекционных титров вирусов как при индивидуальном культивировании, так и при сокультивировании, с целью определения инфекционного титра каждого из компонентов смеси без предварительной нейтрализации гипериммунной сывороткой другого компонента. И напротив, в избирательной тропности вирусов к определенной системе клеток, что используется в данном изобретении для сокультивирования штаммов вирусов кори, штамм Л-16, и краснухи, штамм «Орлов» (семейство Togaviridae, род Rubivirus), в клеточных линиях L-41 (перевиваемая линия клеток костного мозга человека, больного лейкемией. Коллекции: НИИ гриппа РАМН, ИНЦ РАН; http://www.sevin.ru/collections/cellcolls/rcccm/animal_uv.html) и Rk-13 (перевиваемая линия клеток почки кролика. Коллекции: НИИ вирусологии РАМН; НИИ гриппа РАМН, ИНЦ РАН; http://www.sevin.ru/collections/cellcolls/rcccm/animal_uv.html), избирательно чувствительных к одному из них (L-41 - к вирусу кори, Rk-13 - к вирусу краснухи), для определения инфекционного титра каждого из компонентов смеси без предварительной нейтрализации гипериммунной сывороткой другого компонента. При этом также отсутствует интерферирующее действие штаммов друг на друга, что доказано однотипными показателями инфекционных титров каждого из вирусных компонентов как при индивидуальном культивировании, так и при сокультивировании.
Технический результат от использования изобретения - упрощение процедуры контроля ассоциированных вакцинных препаратов при обеспечении необходимой точности определения концентрации вирусов.
Согласно первому варианту способ предусматривает определение в дивакцине корь-паротит инфекционного титра производственных штаммов вирусов кори и ЭП в культурах клеток Vero или МА-104; при этом определение инфекционного титра вируса кори проводят по прямому цитопатогенному действию вируса на клетки, а вируса эпидемического паротита - методом гемадсорбции с эритроцитами морской свинки, которые не агглютинируются вирусом кори. Как следует из таблицы 1, реализация способа возможна вследствие унифицированной чувствительности клеток Vero или МА-104 как к вирусу кори, так и к вирусу эпидемического паротита. Учитывая более высокую чувствительность клеток Vero как к вирусу кори, так и к вирусу ЭП и более однородные показатели инфекционной активности обоих вирусов, предпочтение следует отдавать линии клеток Vero.

Согласно второму варианту способ предусматривает определение в дивакцине корь-краснуха инфекционного титра производственных штаммов вируса краснухи или кори в клеточных линиях Rk-13 или L-41, соответственно. Как следует из таблицы 2, реализация способа возможна вследствие «селективной» чувствительности клеток Rk-13 к вирусу краснухи, a L-41 - к вирусу кори.

Согласно третьему варианту способ предусматривает определение в тривакцине корь-паротит-краснуха инфекционного титра компонентов. При этом титр производственного штамма вируса краснухи определяют в клеточной линии Rk-13 по прямому цитопатогенному действию вируса на клетки; титр производственных штаммов вирусов кори и ЭП регистрируют в клеточной линии Vero, обеспечивающей возможность определения инфекционного титра вируса кори по прямому цитопатогенному действию вируса на клетки, а вируса эпидемического паротита - методом гемадсорбции с эритроцитами морской свинки, которые не агглютинируются вирусами кори и краснухи.
Изобретение реализуется следующим образом.
Пример 1. Определение инфекционного титра производственных штаммов вирусов кори или краснухи в препарате дивакцины корь-краснуха
Для выявления возможного взаимного ингибирующего действия вирусов при одновременном их введении в одну систему клеток, наряду с титрованием дивакцины, определяется инфекционная активность каждого из компонентов смеси по отдельности.
Для этого в жидком полуфабрикате краснушной моновакцины, полученном объединением индивидуальных вирусных сборов при культивировании штамма «Орлов-В» вируса краснухи в чувствительной линии клеток, определяют биологическую (инфекционную) активность производственного штамма путем титрования вируссодержащей культуральной жидкости (ВСЖ) на культуре клеток RK-13. При этом используют микрометод титрования ВСЖ. Суспензию клеток RK-13 выращивают в лунках полистироловых планшетов, маркированных «для работы с культурой клеток», помещая в каждую лунку планшета по 0,1 мл суспензии клеток. После формирования монослоя в клетки вносят ВСЖ в разведении от 1:10 до 1:1000000 с коэффициентом 0,51 g в ростовой среде и помещают по 0,1 мл каждого разведения в 4 лунки планшета. Шесть лунок оставляют в качестве контроля клеток, внося в них по 0,1 мл среды. Зараженные и контрольные клетки инкубируют в термостате с 5% CO2 в стационарном положении при 34,5±0,5°C, с однократной сменой среды на 4-5 сутки. Учет результатов титрования проводят через 12 суток по наличию прямого цитопатогенного действия (ЦПД) вируса на клетки.
В жидком полуфабрикате коревой моновакцины, полученном объединением индивидуальных вирусных сборов при культивировании штамма Л-16 вируса кори в чувствительной линии клеток, определяют биологическую (инфекционную) активность производственного штамма путем титрования вируссодержащей культуральной жидкости (ВСЖ) на культуре клеток L-41. Для этого используют микрометод титрования ВСЖ по методике, описанной выше.
Планшеты (микрометод) с зараженными и контрольными клетками инкубируют в термостате при температуре 34,5±0,5°C. Учет результатов титрования проводят через 10 суток культивирования по прямому ЦПД вируса на клетки.
Жидкие полуфабрикаты моновакцин кори и краснухи объединяют в соотношении 1:1. При определении биологической (инфекционной активности) каждого из компонентов в ассоциированной дивакцине корь-краснуха не проводят предварительной нейтрализации ВКЖ гипериммунной сывороткой против кори (для определения активности вируса краснухи) или против краснухи (для определения активности вируса кори). Вместо этого используют «селективные» клеточные культуры, чувствительные только к одному из компонентов смеси. Для этого в одном из двух полистироловых планшетов, маркированных «для работы с культурой клеток», выращивают клетки Rk-13, а в другом полистироловом планшете - клетки L-41. Образцы ВКЖ дивакцины вносят в каждый из планшетов и титруют, как описано выше. Через 10 суток культивирования при 34,5±0,5°C в планшете с культурой клеток L-41 по прямому цитодеструктивному действию на клетки учитывают инфекционный титр вируса кори, а через 12 суток культивирования в планшете с культурой клеток Rk-13 по прямому цитодеструктивному действию на клетки учитывают инфекционный титр вируса краснухи. Результаты представлены в таблице 3.
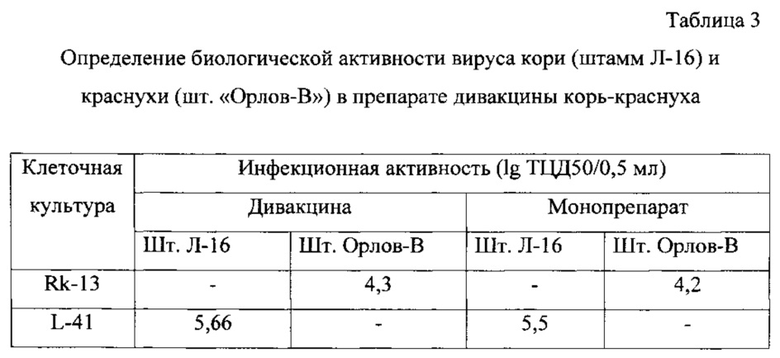
Как видно из таблицы, использование «селективных» клеточных культур Rk-13 и L-41 для титрования дивакцины корь-краснуха не снижает точности измерения, что подтверждается аналогичными показателями биологической (инфекционной) активности штаммов Л-16 и Орлов-В, полученными как при титровании дивакцины, так и соответствующих монопрепаратов.
Пример 2. Определение инфекционного титра вирусов кори и эпидемического паротита в препарате дивакцины корь-паротит
Для выявления возможного взаимного ингибирующего действия вирусов при одновременном их введении в одну систему клеток, наряду с титрованием дивакцины, определяется инфекционная активность каждого из компонентов смеси по отдельности.
При этом биологическая (инфекционная) активность вируса эпидемического паротита определяется титрованием образцов ВСЖ на перевиваемой культуре клеток Vero микрометодом. Учет результатов производится через 7 суток культивирования зараженных и контрольных клеток при температуре 34,5±0,5°C методом гемадсорбции с 1%-ными эритроцитами морской свинки.
Биологическая (инфекционная) активность вируса кори определяется титрованием образцов ВСЖ на той же культуре клеток по методике, описанной выше. Планшеты с зараженными и контрольными клетками инкубируются в термостате при температуре 34,5±0,5°C. Учет результатов титрования проводится через 10 суток культивирования по прямому ЦПД вируса на клетки.
Жидкие полуфабрикаты моновакцин кори и паротита объединяют в соотношении 1:2. При определении биологической (инфекционной активности) каждого из компонентов в ассоциированной дивакцине корь-паротит не проводят предварительной нейтрализации ВКЖ гипериммунной сывороткой против кори (для определения активности вируса ЭП) или против паротита (для определения активности вируса кори). Вместо этого используют клеточную культуру Vero, чувствительную к обоим компонентам смеси. При этом в два полистироловых планшета, маркированных «для работы с культурой клеток», с клетками Vero вносят образцы ВКЖ дивакцины и титруют, как описано выше. Спустя 7 суток культивирования при 34,5±0,5°C в одном из планшетов учитывают инфекционный титр вируса ЭП по реакции гемадсорбции с 1%-ными эритроцитами морской свинки, а в другом планшете через 10 суток культивирования учитывают инфекционный титр вируса кори по прямому цитодеструктивному действию на клетки. Результаты представлены в таблице 4.
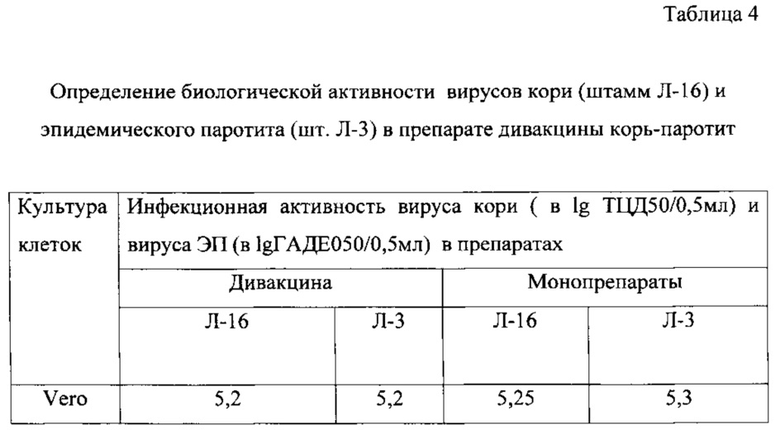
Как видно из таблицы, использование клеточной культуры Vero для титрования дивакцины корь-паротит не снижает точности измерения, что подтверждается аналогичными показателями биологической (инфекционной) активности штаммов Л-16 и Л-3, полученными как при титровании дивакцины, так и соответствующих монопрепаратов.
Пример 3. Определение инфекционного титра вируса кори, ЭП и краснухи в препарате тривакцины корь-паротит-краснуха
Для выявления возможного взаимного ингибирующего действия вирусов при одновременном их введении в одну систему клеток, наряду с титрованием тривакцины, определяется инфекционная активность каждого из компонентов смеси по отдельности.
Для этого в жидком полуфабрикате краснушной моновакцины определяют биологическую (инфекционную) активность производственного штамма «Орлов-В» титрованием ВСЖ в культуре клеток RK-13, как описано выше; в жидком полуфабрикате моновакцин против кори и паротита определяют биологическую (инфекционную) активность производственных штаммов вируса кори или вируса ЭП титрованием образцов ВСЖ в культуре клеток Vero, как описано выше.
Жидкие полуфабрикаты моновакцин кори, паротита и краснухи объединяют в соотношении 1:2:1. При определении биологической (инфекционной) активности каждого из компонентов в ассоциированной тривакцине корь-паротит-краснуха не проводят предварительной нейтрализации ВКЖ гипериммунной сывороткой против вирусов кори и краснухи (для определения активности вируса ЭП), или паротита и краснухи (для определения активности вируса кори), или кори и паротита (для определения активности вируса краснухи). Вместо этого образцы ВКЖ тривакцины вносят в три полистироловых планшета, маркированных «для работы с культурой клеток», с клетками Rk-13 в одном и с клетками Vero в двух других. Планшеты культивируют при температуре 34,5±0,5°C. Учет результатов проводят следующим образом: в одном из планшетов с клетками Vero через 7 суток культивирования регистрируют инфекционный титр вируса ЭП по реакции гемадсорбции с эритроцитами морской свинки, которые не агглютинируются вирусами кори и краснухи; в другом планшете с клетками Vero через 10 суток культивирования регистрируют инфекционный титр вируса кори по прямому ЦПД вируса на клетки; в планшете с клетками Rk-13, селективно чувствительными только к вирусу краснухи, через 12 суток культивирования учитывают инфекционный титр вируса по прямому ЦПД вируса на клетки. Результаты представлены в таблице 5.
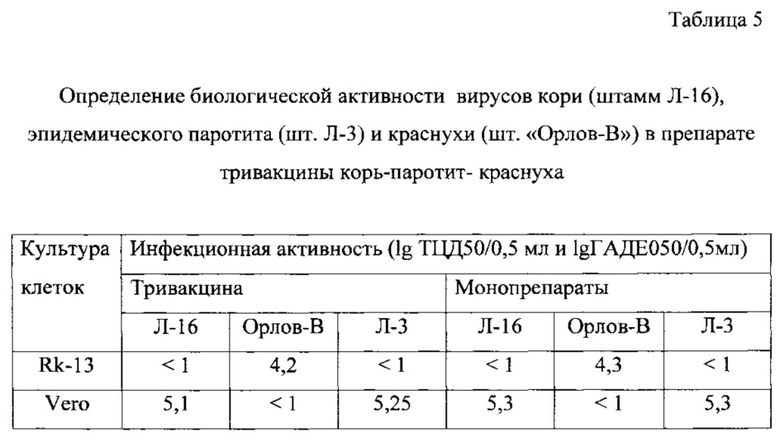
Как видно из таблицы, использование предложенного способа для титрования ассоциированной вакцины корь-паротит-краснуха не снижает точности измерения, что подтверждается аналогичными показателями биологической (инфекционной) активности штаммов Л-16, Орлов-В и Л-3, полученными как при титровании тривакцины, так и соответствующих монопрепаратов.
Таким образом, могут быть использованы следующие модификации способа определения биологической активности ассоциированных препаратов:
1) исключение процедуры нейтрализации коревого или паротитного компонентов при титровании препаратов дивакцины корь-краснуха или паротит-краснуха в клетках Rk-13 вследствие избирательной чувствительности этой линии к вирусу краснухи;
2) исключение процедуры нейтрализации краснушного компонента при титровании препаратов дивакцины корь-краснуха в клетках L-41 вследствие избирательной чувствительности этой линии к вирусу кори;
3) исключение процедуры нейтрализации при титровании препарата тривакцины. При этом биологическую активность краснушного компонента следует определять в культуре клеток Rk-13, а коревого и паротитного - в культуре клеток Vero (или MA-104), используя разные методы учета результатов.
Предложенный способ существенно упрощает определение инфекционной активности компонентов ассоциированных вакцин для профилактики кори, ЭП и краснухи, снижает себестоимость проведения контроля вакцинных препаратов за счет исключения технологии получения дорогостоящих гипериммунных сывороток, необходимых для проведения классической методики титрования вирусных смесей, и сокращения количества необходимых для этих работ культур клеток.
| название | год | авторы | номер документа |
|---|---|---|---|
| Комбинированная вакцина для иммунопрофилактики кори, эпидемического паротита и краснухи | 2016 |
|
RU2657801C1 |
| Способ получения четырехкомпонентной культуральной живой вакцины против кори, ветряной оспы, эпидемического паротита, краснухи | 2019 |
|
RU2717769C1 |
| ЛИНИЯ ДИПЛОИДНЫХ КЛЕТОК ФИБРОБЛАСТОВ ЛЕГКОГО ЭМБРИОНА ЧЕЛОВЕКА ДЛЯ ВЫДЕЛЕНИЯ, ИДЕНТИФИКАЦИИ ВИРУСОВ И ПОЛУЧЕНИЯ ДИАГНОСТИЧЕСКИХ И ВАКЦИННЫХ ПРЕПАРАТОВ | 2006 |
|
RU2343194C2 |
| ШТАММ ВИРУСА КОРИ ДЛЯ ПРИГОТОВЛЕНИЯ ИММУНОБИОЛОГИЧЕСКИХ ПРЕПАРАТОВ | 1992 |
|
RU2035509C1 |
| ВАКЦИННЫЙ ШТАММ ВИРУСА КРАСНУХИ "ОРЛОВ-Д" И СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ ПРОТИВ КРАСНУХИ | 1999 |
|
RU2173344C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФРАКЦИИ АНТИГЕНОВ ВИРУСА КОРИ | 2000 |
|
RU2205022C2 |
| ШТАММ ВИРУСА КРАСНУХИ ДЛЯ ПОЛУЧЕНИЯ МЕДИЦИНСКИХ ИММУНОБИОЛОГИЧЕСКИХ ПРЕПАРАТОВ (МИБП) | 2012 |
|
RU2492235C1 |
| Способ получения живой культуральной аттенуированной вакцины для профилактики ветряной оспы | 2016 |
|
RU2637093C1 |
| ШТАММ ВИРУСА КРАСНУХИ "ОРЛОВ-В" ДЛЯ ПОЛУЧЕНИЯ ВАКЦИНЫ | 1995 |
|
RU2081912C1 |
| ШТАММ ВИРУСА ПАРОТИТА ДРАГУН ДЛЯ ПОЛУЧЕНИЯ АНТИГЕНА-КОМПОНЕНТА ТЕСТ-СИСТЕМЫ И ИММУНОФЕРМЕНТНАЯ ТЕСТ-СИСТЕМА ДЛЯ ДИАГНОСТИКИ АНТИТЕЛ К ВИРУСУ ПАРОТИТА | 2007 |
|
RU2348691C1 |
Изобретение относится к области медицинской биотехнологии. Предложены способы определения биологической активности монокомпонентов в ассоциированных комбинированных ди- и тривакцинах, содержащих вакцинные штаммы вируса кори (Л-16), эпидемического паротита (Л-3) и/или краснухи (Орлов). Предложенные способы позволяют упростить технологию контроля вакцинных препаратов и снизить себестоимость производства вакцин. 3 н.п. ф-лы, 5 табл., 3 пр.
1. Способ определения биологической активности вирусов кори и краснухи при производстве ассоциированных препаратов, предусматривающий определение инфекционного титра производственных штаммов, отличающийся тем, что для определения инфекционного титра вируса краснухи или вируса кори используют клеточные линии Rk-13 (перевиваемая линия клеток почки кролика. Коллекции: НИИ вирусологии РАН; НИИ гриппа РАН, ИНЦ РАН) или L-41 (перевиваемая линия клеток костного мозга человека, больного лейкемией. Коллекции: НИИ гриппа РАН, ИНЦ РАН), соответственно. При этом определение инфекционной активности вируса краснухи проводят по прямому цитодеструктивному действию вируса на клетки Rk-13, а определение инфекционной активности вируса кори проводят по прямому цитодеструктивному действию вируса на клетки L-41.
2. Способ определения биологической активности вирусов кори и эпидемического паротита при производстве ассоциированных препаратов, отличающийся тем, что для определения инфекционного титра производственных штаммов используют клеточную линию Vero (перевиваемая линия клеток почки африканской зеленой мартышки. Коллекции: НИИ вирусологии РАН; НИИ гриппа РАН; ИНЦ РАН) или МА-104 (перевиваемая культура клеток почки эмбриона макаки-резуса. Коллекции: НИИ вирусологии РАН, НИИ гриппа РАН), при этом определение инфекционного титра вируса кори проводят по прямому цитопатогенному действию вируса на клетки, а вируса эпидемического паротита - методом гемадсорбции.
3. Способ определения биологической активности вирусов кори, эпидемического паротита и краснухи, отличающийся тем, что для определения инфекционного титра производственного штамма вируса краснухи используют клеточную линию Rk-13, а для определения инфекционного титра производственных штаммов вирусов кори и эпидемического паротита используют клеточную линию Vero или МА-104, при этом определение инфекционного титра вируса кори проводят по прямому цитопатогенному действию вируса на клетки, а вируса эпидемического паротита - методом гемадсорбции.
| ШТАММ ВИРУСА ПАРОТИТА ДРАГУН ДЛЯ ПОЛУЧЕНИЯ АНТИГЕНА-КОМПОНЕНТА ТЕСТ-СИСТЕМЫ И ИММУНОФЕРМЕНТНАЯ ТЕСТ-СИСТЕМА ДЛЯ ДИАГНОСТИКИ АНТИТЕЛ К ВИРУСУ ПАРОТИТА | 2007 |
|
RU2348691C1 |
| ШТАММ ВИРУСА КОРИ NOVO/96 ДЛЯ ПОЛУЧЕНИЯ АНТИГЕНА - КОМПОНЕНТА ТЕСТ-СИСТЕМЫ И ИММУНОФЕРМЕНТНАЯ ТЕСТ-СИСТЕМА ДЛЯ ДИАГНОСТИКИ АНТИТЕЛ К ВИРУСУ КОРИ | 2002 |
|
RU2230785C2 |
| ШТАММ ВИРУСА КРАСНУХИ "ОРЛОВ-В" ДЛЯ ПОЛУЧЕНИЯ ВАКЦИНЫ | 1995 |
|
RU2081912C1 |
Авторы
Даты
2017-01-10—Публикация
2015-05-21—Подача