Изобретение относится к области биотехнологии, тканевой инженерии и может быть использовано в трансплантологии, офтальмологии, пластической хирургии, косметологии для лечения широкого круга заболеваний и возрастных изменений и касается способа выделения стволовых клеток взрослого человека, а именно мезенхимных стволовых клеток орбитальной жировой ткани.
Ближайшим аналогом является способ выделения мезенхимных стволовых клеток из орбитальной жировой ткани, описанный в статье B.S. Korn (Korn B.S., Kikkawa D.O., Hicok K.C. Identification and Characterization of Adult Stem Cells From Human Orbital Adipose Tissue / Ophthal Plast Reconstr Surg. 2009; 25 (1): 27-32), заключающийся в измельчении свежевыделенного фрагмента орбитальной жировой ткани ножницами, промывке физиологическим раствором, ферментативном расщеплении коллагеназой, аспирации плавающих на поверхности адипоцитов, фильтрации оставшихся клеток последовательно через фильтр с порами 100 мкм и 40 мкм и осаждении клеток путем центрифугирования в течение 5 мин со скоростью 400g. После ресуспендирования осажденные центрифугированием клетки помещают в культуральные флаконы с питательной средой (среда F12 с добавлением 10% эмбриональной телячьей сыворотки и антибиотиков), смену которой проводят каждые 3-4 дня.
Недостатками приведенного способа являются:
- трудоемкость выполнения вследствие большого количества этапов;
- снижение количества выделенных мезенхимных стволовых клеток, по сравнению с потенциально возможным, вследствие того, что выделяются только клетки, освободившиеся из ткани в результате ферментативного расщепления; мезенхимные стволовые клетки, оставшиеся в мельчайших фрагментах жировой ткани, не используется для культивирования;
- нерациональность использования первичного материала с учетом особенностей орбитальной жировой ткани: ограниченный объем, доступный для резекции, и меньшее содержание стволовых клеток в единице объема, по сравнению с жировой тканью туловища.
Таким образом, оптимизация способа выделения мезенхимных стволовых клеток из орбитальной жировой ткани актуальна в связи с необходимостью получения максимального количества стволовых клеток из минимального объема первичного материала.
Задачей изобретения является разработка более эффективного метода выделения мезенхимных стволовых клеток из орбитальной жировой ткани.
Технический результат изобретения, получаемый в результате решения этой задачи, состоит в увеличении числа первичных клеточных колоний и, следовательно, увеличении количества выделенных мезенхимных стволовых клеток, меньшей трудоемкости способа, более эффективном использовании исходного тканевого материала, получении чистой культуры за счет использования способности к адгезии мезенхимных стволовых клеток.
Указанный технический результат достигается тем, что в способе выделения мезенхимных стволовых клеток из орбитальной жировой ткани, включающем ее измельчение на фрагменты, расщепление их раствором коллагеназы, осаждение клеток путем центрифугирования в течение 5 минут, перенос их в пластиковый культуральный флакон, согласно изобретению расщепление фрагментов орбитальной жировой ткани проводят раствором коллагеназы второго типа в сбалансированном растворе Хэнкса в соотношении 1 мг/мл на 0,1 г жировой ткани при температуре 37°С в шейкере в течение 60 минут, полученную суспензию центрифугируют со скоростью 1300 оборотов в минуту, после чего жировую фракцию, а также клетки, осажденные на дно, переносят в пластиковый культуральный флакон, который заполняют 5 мл питательной среды следующего состава: 45 мл среды DMEM/F12, 5 мл эмбриональной телячьей сыворотки, 2 ммоль L-глутамина, 100 мкл смеси антибиотиков, состоящей из 10000 МЕ/мл пенициллина, 10000 мкг/мл стрептомицина, 25 мкг/мл амфотерицина, и культивируют в CO2-инкубаторе при 37°С и 5% CO2 в атмосфере, на вторые сутки при замене питательной среды на свежую того же состава проводят удаление эритроцитов и других клеток стромально-сосудистой фракции, не прикрепившихся к поверхности флакона, а также плавающих на поверхности фрагментов жировой ткани.
Между совокупностью существенных признаков и достигаемым техническим результатом существует причинно-следственная связь.
Помещение верхней жировой фракции, образовавшейся в результате центрифугирования, в пластиковый культуральный флакон с последующим заполнением его питательной средой и культивированием в течение суток создает условие для активной миграции дополнительных фракций мезенхимных стволовых клеток из мельчайших фрагментов жировой ткани, осевших на дно пластикового культурального флакона. Выход дополнительных фракций мезенхимных стволовых клеток из нерасщепленных фрагментов жировой ткани, наряду с освобождением мезенхимных стволовых клеток в результате ферментативного расщепления и центрифугирования, обусловливает увеличение общего количества первичных клеточных колоний и, следовательно, достижение технического результата.
Среди существенных признаков, характеризующих способ, отличительными являются:
- ферментативное расщепление проводят раствором коллагеназы второго типа в сбалансированном растворе Хэнкса в соотношении 1 мг/мл на 0,1 г жировой ткани при температуре 37°С в шейкере в течение 60 минут;
- центрифугирование проводят в течение 5 минут со скоростью 1300 оборотов в минуту;
- после центрифугирования мельчайшие фрагменты жировой ткани, образующие жировую фракцию в верхней части пробирки, не удаляют, а переносят в пластиковый культуральный флакон, наряду с клетками, осажденными на дно пробирки;
- чистую культуру мезенхимных стволовых клеток получают не путем фильтрования, а в результате смены среды на вторые сутки культивирования, т.к. мезенхимные стволовые клетки, в отличие от других клеток стромально-сосудистой фракции, обладают адгезией к поверхности пластикового культурального флакона.
Заявленный технический результат может быть получен только при использовании всей совокупности предложенного способа, при этом:
- сокращается трудоемкость за счет сокращения количества этапов выделения;
- более эффективно используется исходный тканевой материал, т.к. помещение мельчайших фрагментов жировой ткани в культуральный флакон дает возможность выделить фракцию клеток, не освободившихся из ткани при ферментативном расщеплении;
- чистота первичной культуры достигается за счет использования способности к адгезии мезенхимных стволовых клеток, а не за счет фильтрования;
- для выделения дополнительного количества мезенхимных клеток используется верхняя жировая фракция, полученная при центрифугировании.
Существенные признаки, характеризующие изобретение, проявили в заявляемой совокупности новые свойства, явным образом не вытекающие из уровня техники в данной области и не являющиеся очевидными для специалиста.
Способ осуществляется следующим образом.
Образец орбитальной жировой ткани, резецированный в ходе хирургического вмешательства, измельчают ножницами на фрагменты размером 1-2 мм. Полученную массу заливают раствором коллагеназы второго типа в сбалансированном растворе Хэнкса в соотношении 1 мг/мл на 0,1 г жировой ткани. Инкубируют при температуре 37°С в шейкере в течение 60 минут. После этого полученную суспензию переливают в пластиковую центрифужную пробирку, добавляют 5 мл питательной среды (на 45 мл DMEM/F12 добавить 5 мл эмбриональной телячьей сыворотки, 2 ммоль L-глутамина, 100 мкл смеси антибиотиков (пенициллин 10000 МЕ/мл, стрептомицин 10000 мкг/мл, амфотерицин 25 мкг/мл)) и центрифугируют со скоростью 1300 оборотов в минуту в течение пяти минут. После этого верхнюю жировую фракцию (мельчайшие нерасщепленные фрагменты жировой ткани, адипоциты и свободные липиды) собирают пипеткой и переносят в пластиковый культуральный флакон. Среднюю часть (раствор коллагеназы, питательная среда) из пробирки удаляют, а осадок (эритроциты, клетки стромально-сосудистой фракции) переносят в тот же культуральный флакон и добавляют 5 мл вышеописанной питательной среды. Культивирование проводят в стандартных условиях в CO2-инкубаторе при 37°С и 5% CO2 в атмосфере. Смену питательной среды проводят на вторые сутки культивирования. В процессе смены среды удаляются осевшие на дно пластикового культурального флакона эритроциты и другие, не прикрепившиеся клетки стромально-сосудистой фракции, а также плавающие на поверхности фрагменты жировой ткани. Это позволяет получить чистую культуру мезенхимных стволовых клеток, адгезивных к поверхности пластикового культурального флакона.
Данное изобретение может быть использовано в трансплантологии (для пересадки стволовых клеток орбитальной жировой ткани как свободных, так и размещенных на матриксе), офтальмологии (для изучения патогенеза и лечения глазных болезней), пластической хирургии (для липофилинга с обогащением стволовыми клетками), косметологии (для стимуляции репаративных процессов и коррекции возрастных изменений кожи).
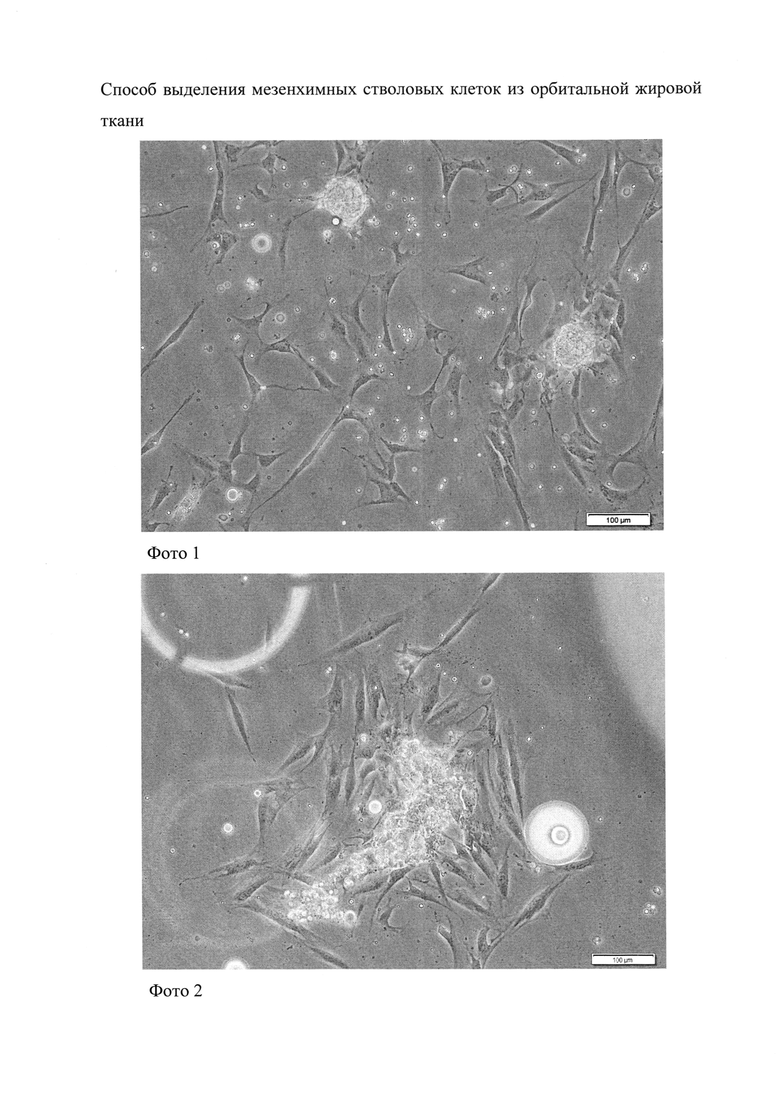
Изобретение поясняется фотографиями 1 и 2, на которых видна миграция мезенхимных стволовых клеток из мельчайших фрагментов орбитальной жировой ткани, резецированной у пациентов Т. и С. соответственно.
Пример 1. Пациентка Т., 5 лет, фрагмент орбитальной жировой ткани объемом 0,3 мл резецирован в ходе операции по устранению птоза верхнего века правого глаза. Выделение мезенхимных стволовых клеток из орбитальной жировой ткани проводили согласно заявляемому способу. Миграция дополнительной фракции мезенхимных стволовых клеток из мельчайших фрагментов жировой ткани в первичной культуре демонстрируется на фотографии 1. Количество клеток, выделенных из данного фрагмента, на вторые сутки культивирования составило 1,9×102.
Пример 2. Пациентка С., 84 года, фрагмент орбитальной жировой ткани объемом 0,3 мл резецирован в ходе энуклеации правого глаза. Выделение мезенхимных стволовых клеток из орбитальной жировой ткани проводили согласно заявляемому способу. Миграция дополнительной фракции мезенхимных стволовых клеток из мельчайших фрагментов жировой ткани в первичной культуре демонстрируется на фотографии 2. Количество клеток, выделенных из данного фрагмента, на вторые сутки культивирования составило 1,7×102.
Заявляемым способом проводилось выделение мезенхимных стволовых клеток из орбитальной жировой ткани, резецированной интраоперационно у 14 пациентов. Критерием отбора явилось отсутствие у пациентов сопутствующей атрофии орбитальной жировой ткани. Во всех случаях наблюдалась миграция дополнительных фракций мезенхимных стволовых клеток из мельчайших фрагментов жировой ткани, за счет чего увеличивалось число первичных клеточных колоний.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫДЕЛЕНИЯ ФИБРОБЛАСТОВ, СПОСОБ СОЗДАНИЯ БИОТРАНСПЛАНТАТА НА ИХ ОСНОВЕ (ВАРИАНТЫ) И СПОСОБ РЕГЕНЕРАЦИИ ТКАНЕЙ ЧЕЛОВЕКА (ВАРИАНТЫ) | 2013 |
|
RU2567004C2 |
| СПОСОБ ИЗВЛЕЧЕНИЯ ПУЛЬПЫ ЗУБА ДЛЯ ПОЛУЧЕНИЯ КУЛЬТУРЫ СТВОЛОВЫХ КЛЕТОК | 2017 |
|
RU2679082C1 |
| КОСМЕТИЧЕСКОЕ СРЕДСТВО НА ОСНОВЕ ПРОДУКТОВ СЕКРЕЦИИ МЕЗЕНХИМНЫХ СТВОЛОВЫХ/СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ ЧЕЛОВЕКА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2016 |
|
RU2620342C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА ДЛЯ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ НА ОСНОВЕ ПРОДУКТОВ СЕКРЕЦИИ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК ЧЕЛОВЕКА | 2015 |
|
RU2620167C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ МЕЗЕНХИМНЫХ СТВОЛОВЫХ КЛЕТОК, ВЫДЕЛЕННЫХ ИЗ КОСТНОГО МОЗГА | 2011 |
|
RU2517112C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЕКРЕТОМА МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК, СОДЕРЖАЩЕГО ФРАКЦИЮ ЭКЗОСОМ | 2023 |
|
RU2827355C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ОЦЕНКИ СТИМУЛЯЦИИ СЕКРЕТОРНОЙ АКТИВНОСТИ МОДЕЛЬНЫХ КЛЕТОК ТЕРАПЕВТИЧЕСКИМИ АГЕНТАМИ, НАПРАВЛЕННЫМИ НА ВОССТАНОВЛЕНИЕ СПЕРМАТОГЕНЕЗА | 2023 |
|
RU2825785C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОЖОГОВ И РАН НА ОСНОВЕ ЦИТОКИНОВ И ФАКТОРОВ РОСТА, СЕКРЕТИРУЕМЫХ МЕЗЕНХИМНЫМИ КЛЕТКАМИ ЧЕЛОВЕКА, СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА И СПОСОБ ЛЕЧЕНИЯ ОЖОГОВ И РАН | 2014 |
|
RU2574017C1 |
| БИОМАТЕРИАЛ НА ОСНОВЕ БЕСКЛЕТОЧНОГО МАТРИКСА, ПРОИЗВОДИМОГО МЕЗЕНХИМНЫМИ СТРОМАЛЬНЫМИ КЛЕТКАМИ ЧЕЛОВЕКА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ПРИМЕНЕНИЯ ДЛЯ СТИМУЛЯЦИИ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ | 2018 |
|
RU2718907C1 |
| Способ биофабрикации трансплантата в виде клеточных сфероидов для регенеративных технологий восстановления хряща субъекта на основе надхрящницы собственного реберного хряща субъекта и мультипотентных мезенхимальных стромальных клеток костного мозга этого же субъекта | 2022 |
|
RU2800991C2 |
Изобретение относится к области биотехнологии, тканевой инженерии, конкретно к выделению мезенхимных стволовых клеток (МСК) из орбитальной жировой ткани (ОЖТ), и может быть использовано в медицине. Способ включает измельчение ОЖТ на фрагменты, расщепление фрагментов раствором коллагеназы, осаждение клеток путем центрифугирования в течение 5 минут, перенос их в пластиковый культуральный флакон. Расщепление фрагментов ОЖТ проводят раствором коллагеназы второго типа в сбалансированном растворе Хэнкса в соотношении 1 мг/мл на 0,1 г жировой ткани при температуре 37°С в шейкере в течение 60 минут. Полученную суспензию центрифугируют со скоростью 1300 оборотов в минуту, после чего жировую фракцию вместе с клетками, осажденными на дно, переносят в пластиковый культуральный флакон, который заполняют 5 мл питательной среды следующего состава: 45 мл среды DMEM/F12, 5 мл эмбриональной телячьей сыворотки, 2 ммоль L-глутамина, 100 мкл смеси антибиотиков, состоящей из 10000 МЕ/мл пенициллина, 10000 мкг/мл стрептомицина, 25 мкг/мл амфотерицина, и культивируют в CO2-инкубаторе при 37°С и 5% CO2 в атмосфере, на вторые сутки при замене питательной среды на свежую того же состава проводят удаление эритроцитов и других клеток стромально-сосудистой фракции, а также плавающих на поверхности фрагментов жировой ткани. Изобретение позволяет повысить однородность и качество получения популяции МСК с улучшением их чистоты, эффективно использовать исходный тканевой материал. 2 ил., 2 пр.
Способ выделения мезенхимных стволовых клеток из орбитальной жировой ткани, включающий ее измельчение на фрагменты, расщепление их раствором коллагеназы, осаждение клеток путем центрифугирования в течение 5 минут, перенос их в пластиковый культуральный флакон, отличающийся тем, что расщепление фрагментов орбитальной жировой ткани проводят раствором коллагеназы второго типа в сбалансированном растворе Хэнкса в соотношении 1 мг/мл на 0,1 г жировой ткани при температуре 37°С в шейкере в течение 60 минут, полученную суспензию центрифугируют со скоростью 1300 оборотов в минуту, после чего жировую фракцию, а также клетки, осажденные на дно, переносят в пластиковый культуральный флакон, который заполняют 5 мл питательной среды следующего состава: 45 мл среды DMEM/F12, 5 мл эмбриональной телячьей сыворотки, 2 ммоль L-глутамина, 100 мкл смеси антибиотиков, состоящей из 10000 МЕ/мл пенициллина, 10000 мкг/мл стрептомицина, 25 мкг/мл амфотерицина, и культивируют в CO2-инкубаторе при 37°С и 5% CO2 в атмосфере, на вторые сутки при замене питательной среды на свежую того же состава проводят удаление эритроцитов и других клеток стромально-сосудистой фракции, не прикрепившихся к поверхности флакона, а также плавающих на поверхности фрагментов жировой ткани.
| WESTER S.T | |||
| "Orbital Stem Cells", Curr Ophthalmol Rep | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| СПОСОБ ВЫДЕЛЕНИЯ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК | 2004 |
|
RU2252252C1 |
| US 20120288480 A1, 15.11.2012 | |||
| ZUK P.A | |||
| et all "Human adipose tissue is a source of multipotent stem cells", Molecular Biology of the Cell | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| ПОДВЕСНОЙ ПОРОГ ДЛЯ МЕХАНИЧЕСКИХ КОЛОСНИКОВЫХ РЕШЕТОК С ПОСЛЕДОВАТЕЛЬНОЙ ПОДАЧЕЙ ТОПЛИВА ОТ ПЕРЕДНЕГО ИХ КОНЦА К ЗАДНЕМУ | 1926 |
|
SU4280A1 |
| SZU-YU Ch | |||
| et all "Isolation and Characterization of Mesenchymal Progenitor Cells From Human Orbital Adipose Tissue", Invest Ophthalmol Vis Sci | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
Авторы
Даты
2017-02-02—Публикация
2015-10-22—Подача