Изобретение относится к области медицины, в частности к медицинским, токсикологическим исследованиям, и может быть использовано при диагностике экологически обусловленной патологии, вызванной формальдегидом, в лабораториях биохимии, специализированных учреждениях и клинико-диагностических лабораториях медицинских учреждений.
Известный способ определения формальдегида, а также и других альдегидов основан на дериватизации 2,4-динитрофенилгидразином (ДНФГ) в кислой среде, экстракцией гексаном с последующим упариванием экстракта до сухого остатка и реэкстракции ацетонитрилом [МУК 4.1.2110 - 06. Определение вредных веществ в биологических средах. Сборник методических указаний. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2008. С. 96 - 109]. Анализ ацетонитрильного экстракта осуществляется методом высокоэффективной жидкостной хроматографии (ВЭЖХ) на колонке С18 с ультрафиолетовым (УФ) детектированием. Предел обнаружения составляет 1 мкг/дм3 при объеме пробы 50 см3. К недостаткам данной пробоподготовки можно отнести большой объем пробы, трудоемкость и длительность процедур дериватизации, экстракции, концентрирования экстракта, низкие степени извлечения 2,4-динитрофенилгидразон формальдегида. В литературе нет данных по определению формальдегида в моче методом газовой (газожидкостной) хроматографией с этой же пробоподготовкой.
Среди других дериватизирующих реагентов особое внимание заслуживает фторсодержащее соединение о-замещенного гидроксиламина, а именно о-(2,3,4,5,6-пентафторбензил) гидроксиламин гидрохлорид (ПФБГА). Это соединение используется в качестве дериватизирующего реагента для карбонильных соединений в самых разнообразных биомедицинских и экологических исследованиях [Cancilla D.A, Que Нее S. o-(2,3,4,5,6-pentafluorophenyl)methyl hydroxylamine hydrochloride: a versatile reagent for the determination of carbonyl-containing compounds. // J. Chromatography. -1992. -V. 627. - P. 1-16]. ПФБГА, как гидроксиламин, реагирует с карбонильными функциональными группами с образованием соответствующих оксимов. Образование оксима легко протекает в водных и органических растворах в широком интервале рН. Оксимы легко экстрагируются в органические растворители, и не прореагировавший ПФБГА удаляется через кислотные промывки. Оксимы могут быть разделены с помощью газовой хроматографии (ГХ) с различными детекторами в виде симметричных пиков. Электронно-захватное детектирование (ЭЗД) является особенно чувствительным для определения этих пентафторированных производных.
Существует стандартизованный ЕРА метод определения карбонильных соединений в питьевой воде газожидкостной хроматографией с использованием реагента ПФБГА [Method 556. Determination of carbonyl compounds in drinking water by pentafluorobenzylhydroxylamine derivatization and capillary gas chromatography with electron capture detection. Cincinnati: EPA, 1998. 37 р.]. Суть метода заключается в дериватизации определяемых соединений ПФБГА, экстракции гексаном, промывки экстракта с последующим газохроматографическим анализом на неполярной капиллярной колонке с электронно-захватным детектированием. Недостатком указанного способа является трудоемкость пробоподготовки за счет проведения процедур жидкостной экстракции с последующей промывкой экстракта.
Технической задачей предлагаемого способа является упрощение процедуры пробоподготовки, за счет использования реагента ПФБГА и газохроматографического анализа равновесного пара.
Указанная техническая задача достигается путем обработки пробы 0,1 см3 0,1% водного раствора пентафторбензилгидроксиламина (ПФБГА), нагревания ее в виале вместимостью 20 см3 при 60°С 30 мин и проведении газохроматографического анализа паровой фазы на капиллярной колонке с пламенно-ионизационным детектором.
По сравнению с прототипом в предлагаемом способе пробоподготовка включает обработку пробы реагентом ПФБГА с последующим нагреванием для получения паровой фазы, использование пламенно-ионизационного детектора вместо электронно-захватного детектора.
Из патентной и научно-технической литературы нам не известны способы количественного определения формальдегида в моче, содержащие совокупность предложенных нами признаков, что позволяет сделать вывод о новизне заявляемого технического решения.
Кроме того, из существующего уровня техники нам неизвестно использование существенных признаков, характеризующих предлагаемый способ, для достижения описываемого технического результата.
Краткое описание чертежей.
На рисунке 1 приведен график зависимости площади пика ПФБОФ от температуры и продолжительности нагрева. На рисунке 2 приведена диаграмма зависимости сигнала детектора от количества ПФБГА.
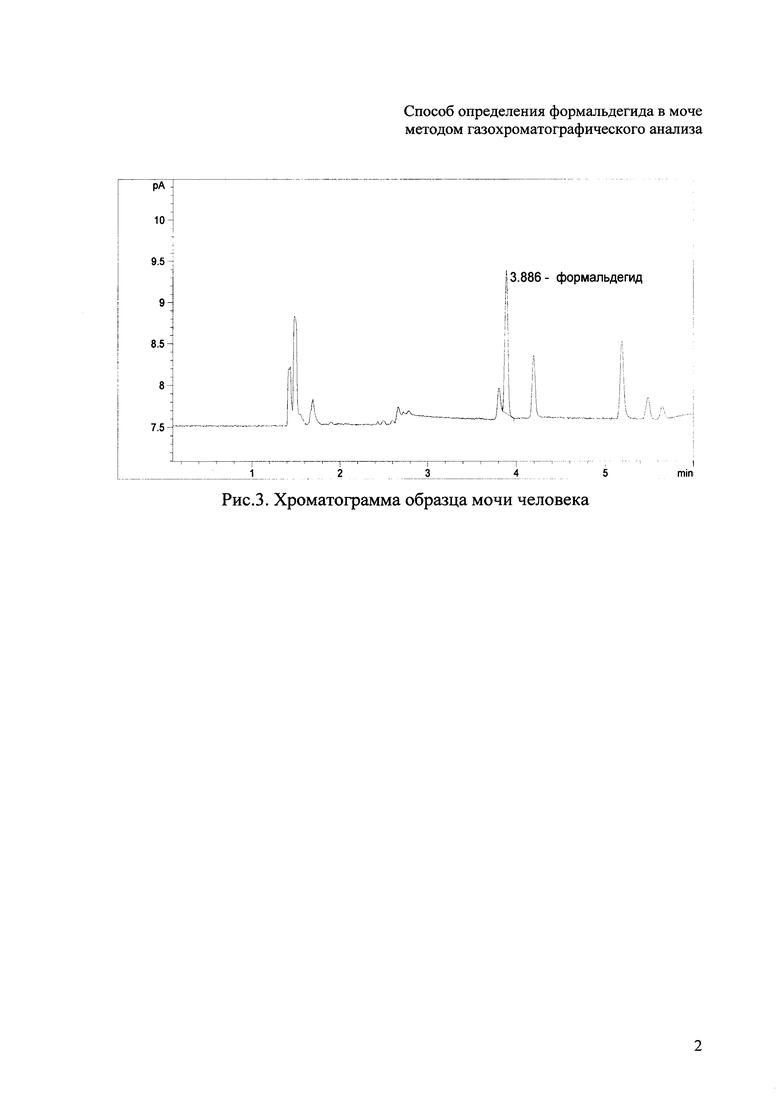
На рисунке 3 приведена хроматограмма образца мочи человека. Способ осуществляют следующим образом:
пробу мочи объемом 1 см3 помещают во флакон, вносят 0,1 см3 0,1% водного раствора пентафторбензилгидроксиламина, запечатывают флакон алюминиевой крышкой с тефлоновой мембраной и помещают в парофазный пробоотборник. Отбор перовой фазы и газохроматографический анализ осуществляют в следующих условиях (табл. 1). 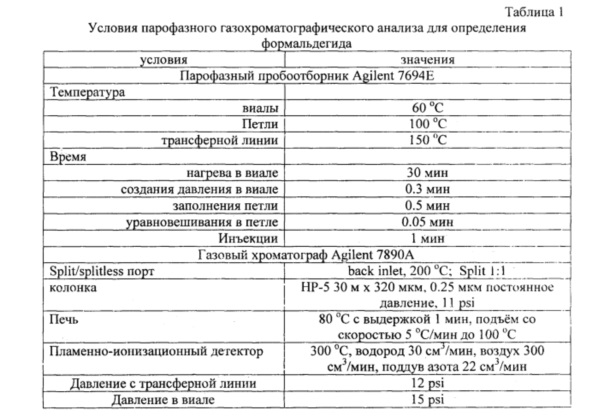
Количественное определение по предлагаемому способу проводят методом абсолютной калибровки по стандартным растворам формальдегида в моче, предварительно обработанным аналогично анализируемым пробам. В связи с тем фактом, что формальдегид присутствует в моче любого человека, градуировочный график не идет от начала координат нуля, поэтому обязательно площадь пика определяемого вещества в моче, используемой для приготовления градуировочного образца, вычитают из площади пика каждого градуировочного образца. Таким путем градуировочный график приводят к началу координат.
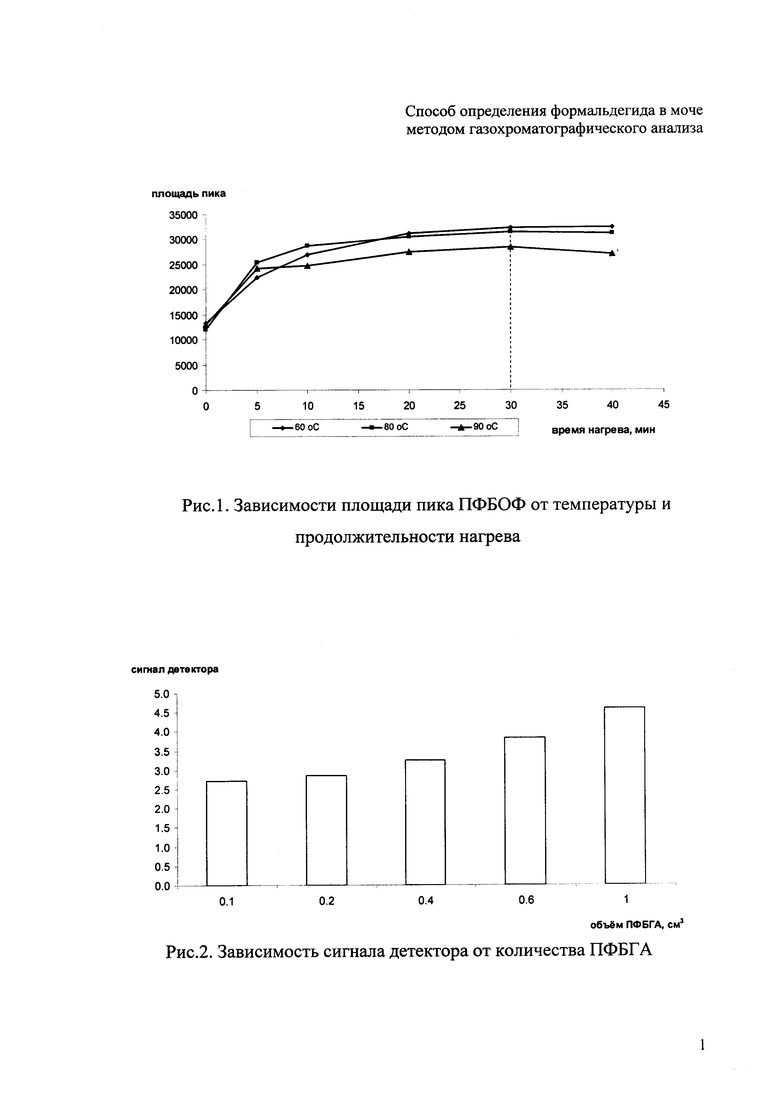
Экспериментальным путем получены зависимости площади пика формальдегида от температуры и времени нагрева. Парофазный газохроматографический анализ (ПФА-ГХ) стандартной смеси (1 см3) производного формальдегида (пентафторбензилоксима формальдегида ПФБОФ) в моче с концентрацией 90 мкг/дм3 осуществляли в закрытых флаконах емкостью 20 см3 при однократном отборе паровоздушной фазы (1 см3) с последующим ее газохроматографическим анализом. Зависимость площади пика (сигнал ЭЗД) от продолжительности при разных температурах отражена на рис. 1.
Как показывают кривые, рост площади пика идет с увеличением продолжительности нагрева, зато с ростом температуры от 60 до 90°С площадь пика падает. Таким образом, максимум сигнала наблюдается при следующих оптимальных условиях парофазного извлечения: температура 60°С и продолжительность нагрева 30 мин.
При выборе условий хроматографирования были опробованы капиллярные колонки разной полярности (НР-5-(5% фенил)-метилполисилокеан, HP-INNOWAX-полиэтиленгликоль); различные температурные режимы (изотермический и с программированием температуры), два детектора (пламенно-ионизационный и электронно-захватный). В результате опробования установлено, что оптимальное разделение осуществляется в режиме программирования температуры, а наилучшая чувствительность на ЭЗД. Несмотря на такую высокую чувствительность детектора, хроматографирование о-пентафторбензилоксима формальдегида (ПФБОФ) с ЭЗД дает повышенное содержание его в дериватизирующем реагенте - 0.1% водном растворе ПФБГА. (табл. 2).
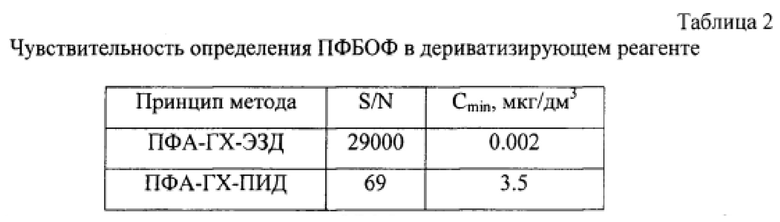
S/N - отношение сигнала к шуму ПФБОФ в дериватизирующем реагенте, Cmin - предел обнаружения.
Как видно из табл. 2, при хроматографировании с пламенно-ионизационным детектором значительно снижается содержание ПФБОФ в дериватизирующем реагенте ПФБГА. Присутствие ПФБОФ в дериватизирующем реагенте объясняется абсорбцией формальдегида из воздушной среды водным раствором ПФБГА, и в результате реакции образуется ПФБОФ, который и дает дополнительный сигнал в исследуемых пробах (градуировочный образец, реальная проба мочи). Это также подтверждается зависимостью сигнала детектора от объема 0.1% водного раствора ПФБГА (рис. 2).
Как видно из зависимости, содержание ПФБОФ растет с увеличением количества дериватизирующего реагента. Поэтому раствор ПФБГА лучше использовать в объеме 0.1 см3 и каждый результат анализа пробы мочи необходимо корректировать содержанием формальдегида в холостом образце (дистиллированная вода + 0.1 см3 0.1% водного раствора ПФБГА), т.е. вычитать его.
Оценены метрологические характеристики способа количественного определения формальдегида в моче: повторяемость, воспроизводимость, правильность (границы неисключенной систематической погрешности) и точность (границы относительной погрешности), представленные в табл. 3.

Пример. Брали 1 см3 пробы мочи, помещали во флакон вместимостью 20 см3, вносили 0,1 см3 0,1% водного раствора ПФБГА, запечатывали флакон алюминиевой крышкой с тефлоновой мембраной и помещали в парофазный пробоотборник. Анализ осуществляли в соответствие с табл. 1. На полученной хроматограмме проводили идентификацию определяемого компонента по абсолютному времени удерживания (Рис. 3). Количественный расчет делали по градуировочному графику. Содержание (концентрация) формальдегида в моче корректировали вычетом результата анализа 1 см3 дистиллированной воды с 0.1 см3 0.1% водного раствора ПФБГА. Таким образом, концентрация формальдегида составила 38 мкг/дм3. В других образцах мочи содержание формальдегида лежит в интервале 30-83 мкг/дм3, что намного выше предела обнаружения.
Таким образом, предлагаемым способом с удовлетворительным пределом обнаружения 3.5 мкг/дм3 можно определять формальдегид в моче при использовании малого объема анализируемой проб 1 см3. Применение данного способа позволяет уменьшить продолжительность анализа за счет упрощенной пробоподготовки по сравнению с аналогами. Более дорогой метод высокоэффективной жидкостной хроматографии заменен газохроматографическим анализом равновесного пара.
Изобретение относится к области медицины, в частности к токсикологическим исследованиям и может быть использовано для определения формальдегида в моче. Для этого в пробу мочи объемом 1 см3 добавляют 0,1 см3 0,1% водного раствора пентафторбензилгидроксиламина (ПФБГА). Полученный раствор нагревают в виале для парофазного анализа 30 минут при 60°C. Затем проводят газохроматографический анализ паровой фазы на капиллярной колонке с пламенно-ионизационным детектором. Содержание формальдегида определяют по калибровочному графику. Изобретение обеспечивает упрощение процедуры пробоподготовки, сокращение продолжительности анализа, малые объемы анализируемой пробы, низкий расход реагента ПФБГА, возможность применения газохроматографического анализа равновесного пара вместо метода ВЭЖХ. 1 з.п. ф-лы, 3 табл., 3 ил., 1 пр.
1. Способ определения формальдегида в моче методом газохроматографического анализа, включающий обработку пробы пентафторбензилгидроксил-амином (ПФБГА), определение содержания формальдегида по калибровочному графику, отличающийся тем, что в пробу мочи объемом 1 см3 добавляют 0,1 см3 0,1% водного раствора ПФБГА, полученный раствор нагревают в виале для парофазного анализа при 60°C 30 минут и проводят газохроматографический анализ паровой фазы на капиллярной колонке с пламенно-ионизационным детектором.
2. Способ по п. 1, отличающийся тем, что результат анализа корректируют вычетом результата анализа 1 см3 дистиллированной воды с 0,1 см3 0.1% водного раствора ПФБГА.
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ФОРМАЛЬДЕГИДА, АЦЕТАЛЬДЕГИДА, ПРОПИОНОВОГО И МАСЛЯНОГО АЛЬДЕГИДОВ В МОЧЕ МЕТОДОМ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ | 2001 |
|
RU2189596C1 |
| Способ определения формальдегида | 1986 |
|
SU1352349A1 |
| Приспособление для блокировки ведущих полуосей автомобиля и тому подобных повозок | 1938 |
|
SU55227A1 |
| Методы определения содержания формальдегида, М, 01.01.2014, найдено 21.11.2016 в Интернете [on-line] на сайте http://www.internet-law.ru/gosts/gost/53381/ | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| ТАРАНЕНКО Л.А., Научно-методические основы гигиенического и клинического анализа влияния факторов риска производственной среды химического предприятия на организм работающих и оптимизация лечебно- профилактических мероприятий, дисс | |||
| дмн, Пермь, 2014, стр | |||
| Аппарат, предназначенный для летания | 0 |
|
SU76A1 |
Авторы
Даты
2017-03-15—Публикация
2016-03-03—Подача