Предлагаемое изобретение относится к области органической химии, в частности к новому способу получения 1-фенил-4-оксаспиро[2.4]гептана формулы (1):
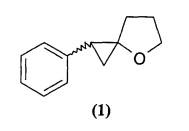
Спиролактоны входят в состав большого количества природных соединений, таких как стероиды и терпеноиды. Кроме того, являются важными синтонами для создания биологически активных соединений медицинского и сельскохозяйственного назначения. ([1] P.S. Kendrekar, Y. Yamomoto, A. Dhiman, Н. Maekawa, and I. Nishiguchij. Electrochemistry, 2007, 10, 813-818. [2] X.L.Hou, Z. Yang, H.N.C. Wong. Progress in Heterocyclic Chemistry, 2003, 15, 167-205).
Известен способ ([3] P. Binger, A. Brinkmann, P. Wedemann. Catalytic [2π+2π] cycloaddition of a methylenecyclopropane to methyl acrylate yielding methyl tetramethylspiro[2.3]hexanecarboxylate. Chem. Ber., 1983, 116, 2920-2930) совместного получения 1,1,2,2-тетраметилспиро[2,3]гексан-5-метилкарбоксилата (2), 1,5-циклооктадиена (3) и 2,3,3-триметил-1,4-пентадиена (4) путем циклоприсоединения 1,1,2,2-тетраметилметиленциклопропана к метилакрилату в присутствии катализатора Ni(cod)2, с общим выходом 96,5% по схеме:
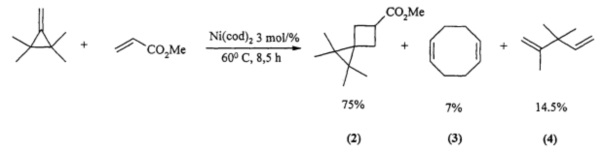
Известным способом не может быть получен 1-фенил-4-оксаспиро[2.4]гептан формулы (1).
Известен способ ([4] Е.М. Ferreira, В.М. Stoltz. Kulinkovich-type cyclopropanation of a vinylogous ester. J. Am. Chem. Soc, 2003, 125, 9578-9584) получения 1-этилспиро[2,5]октан-5-она (5), реакцией 3-метокси-2-циклогексен-1-она с BuMgBr в присутствии Ti(i-PrO)4 с выходом до 77% по схеме:
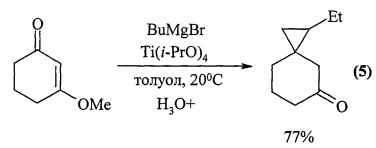
Известным способом не может быть получен 1-фенил-4-оксаспиро[2.4]гептан формулы (1).
Известен способ ([5] P.S. Kendrekar, Y. Yamomoto, A. Dhiman, Н. Maekawa, and I. Nishiguchij. Stereoselective synthesis of spiro-lactones possessing cyclopropane rings through electroreductive cross coupling of styrene derivatives with diphenyl succinate or glutarate. Electrochemistry, 2007, 10, 813-818) получения спиролактонов (6) электрохимическим α-алкилированием стиролов дибензиловыми эфирами дикарбоновых кислот в индивидуальных ячейках, оборудованных цинковыми платами, выступающими в роли катода и анода, с выходом 28-72%.
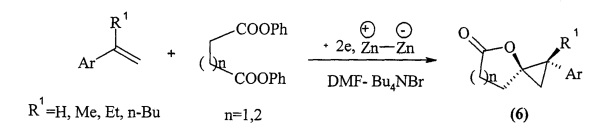
Известным способом не может быть получен 1-фенил-4-оксаспиро[2.4]гептан формулы (1).
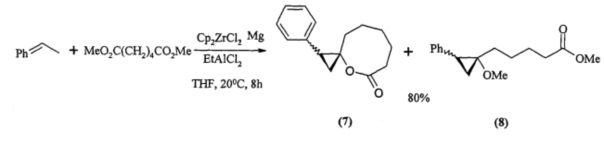
Известен способ ([6] L.O. Khafizova, R.R. Gubaidullin, N.R. Popod'ko, E.S. Meshcheryakova, L.M. Khalilov and U.M. Dzhemilev. Zirconium-catalyzed one-pot synthesis of ее ε-spirocyclopropyl-ee ε-caprolactones. Mendeleev Commun., 2014, 24, 226-228) совместного получения 1-фенил-4-оксоспиро[2,6]нонан-5-онов (7) и метил 5-(1-метокси-2-фенилциклопропилпентаноата (8) реакцией стирола с EtAlCl2 и диметиловым эфиром адипиновой кислоты, катализируемой Cp2ZrCl2 с общим выходом 80% в соотношении 3:1 по схеме:
Известным способом не может быть получен 1-фенил-4-оксаспиро[2.4]гептан формулы (1).
Предлагается новый способ синтеза 1-фенил-4-оксаспиро[2.4]гептана.
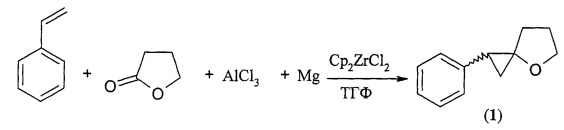
Сущность способа заключается во взаимодействии стирола с полуторакратным избытком. γ-бутиролактона в присутствии хлорида алюминия, магния (Mg, порошок) и катализатора Cp2ZrCl2, взятых в мольном соотношении стирол:γ-бутиролактон:AlCl3:Mg:Cp2ZrCl2=10:15:(20-30):(10-14):(1.8-2.2), предпочтительно 10:15:25:12:2.0 ммоль. Реакцию проводят в тетрагидрофуране, в атмосфере аргона при температуре 20-22°C и атмосферном давлении. Время реакции 6-10 ч. Целевой продукт 1-фенил-4-оксаспиро[2.4]гептан образуется в виде смеси цис- и транс- изомеров в соотношении 1:1 с общим выходом 78-92%. Реакция протекает по схеме:
Целевой продукт (1) образуется только лишь с участием стирола, хлорида алюминия, γ-бутиролактона и магния. В присутствии других кислот Льюиса (например, SnCl4, ZrCl4, ZnCl2, TiCl4), других непредельных соединений (например, линейные α-олефины, дизамещенные олефины) или других металлов (например, Al, Cu, Fe) целевые продукты (1) не образуются. Изменение соотношения исходных реагентов в сторону увеличения их содержания по отношению к стиролу не приводит к существенному повышению выхода целевого продукта (1). Снижение количества AlCl3 или Mg по отношению к стиролу уменьшает выход 1-фенил-4-оксаспиро[2.4]гептана (1).
Проведение указанной реакции в присутствии катализатора Cp2ZrCl2 больше 2.2 ммолей приводит к образованию побочных продуктов (димеров стирола) и существенному уменьшению выхода целевого продукта (1). Использование катализатора Cp2ZrCl2 менее 1.8 ммолей снижает выход 1-фенил-4-оксаспиро[2.4]гептана (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 20-22°C. При более высокой температуре (например, 40°C) увеличиваются энергозатраты на проведение процесса, при меньшей температуре (например, 0°C) снижается скорость реакции.
Существенные отличия предлагаемого способа.
В известном способе в качестве исходных реагентов используются EtAlCl2, диметиловый эфир адипиновой кислоты, стирол, катализатор Cp2ZrCl2.
Предлагаемый способ базируется на использовании в качестве исходных реагентов стирола, AlCl3, γ-бутиролактона, магния (Mg, порошок) и катализатора Cp2ZrCl2.
Предлагаемый способ обладает следующими преимуществами.
В отличие от известного способа предлагаемый способ опирается на использование вместо EtAlCl2 более доступного и безопасного AlCl3 и позволяет получать с высокими выходами 1-фенил-4-оксаспиро[2.4]гептан формулы (1).
Способ поясняется следующими примерами.
ПРИМЕР 1. В стеклянный реактор, установленный на магнитной мешалке, при охлаждении до 0°C, в атмосфере аргона помещают 20 мл тетрагидрофурана, 3,32 г (25 ммолей) AlCl3, 0,28 г (12 ммоль) магния, 0,5 г (2,0 ммоль) катализатора Cp2ZrCl2. Перемешивают при 0°C в течение 20 минут, после чего добавляют (1,05 г) 10 ммоль стирола и 1,29 г (15 ммоль) γ-бутиролактона. Температуру доводят до комнатной 20-22°C и перемешивают в течение 8 часов. В реакционную массу добавляют 15 мл диэтилового эфира и обрабатывают 5М раствором H2SO4. Продукты реакции экстрагируют диэтиловым эфиром, сушат над прокаленным MgSO4 и упаривают растворитель. Целевой продукт выделяют колоночной хроматографией, элюент гексан: этилацетат - 100:1. Получают 1-фенил-4-оксаспиро[2.4]гептан формулы (1) в виде смеси цис- и транс- изомеров в соотношении 1:1 с выходом 87%.
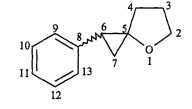
Спектральные характеристики цис-1-фенил-4-оксаспиро[2.4]гептана.
Спектр ЯМР lH, CDCl3, δ, м.д.: 1.23 дд (1Н, CH2а, циклопропан, Jцис=8 Гц, Jтранс=4 Гц), 1.36 т (1H, CH2в циклопропан, J=8 Гц), 1.95-1.99 м (1H, CH циклопропан), 1.96-2.0 м (1H, CH2а), 2.05-2.07 м (2H, CH2), 2.15-2.18 м (1H, CH2в), 3.58 кв (1H, CH2а, 1=8 Гц), 4,14 кв (1H, CH2в, J=8 Гц), 7.09-7.32 м (5H, аром.).
Спектр ЯМР 13C, δ, м.д.: 16.75 (C7), 25.69 (C3), 28.91 (C6), 33.07 (C4), 68.35 (C2), 68.57 (C5), 125.68 (C11), 128.04 (C10,12), 128.09 (C9,13), 138.98 (C8). Найдено, (%): C 82.72; Н 8.10; C12H14O. Вычислено, (%): C 81.96; Н 8.15; О 9.01
Спектральные характеристики транс-1-фенил-4-оксаспиро[2.4]гептана.
Спектр ЯМР 1H, CDCl3, δ, м.д.: 1.10 т (1H, CH2а, циклопропан, J=8 Гц), 1.45 дд (1H, CH2б циклопропан, J2=12 Гц, J3=8 Гц), 1.63-1.70 м (1H, CH2а), 1.75-1.82 м (1H, CH2в), 1.89-2.09 м (2H, CH2), 2.35 дд (1H, CH циклопропан, Jцис=8 Гц, Jтранс=4 Гц), 3.88 м (1H, CH2а), 3.96 м (1H, CH 2в), 7.09-7.32 м (5H, аром.).
Спектр ЯМР 13C, δ, м.д.: 15.56 (C7), 26.34 (C3), 26.92 (C6), 27.89 (C4), 68.12 (C5), 68.19 (C2), 125.83 (C11), 127.76 (C 10,12), 128.41 (C9,13), 139,39 (C8).
Другие примеры, подтверждающие способ, приведены в табл. 1.
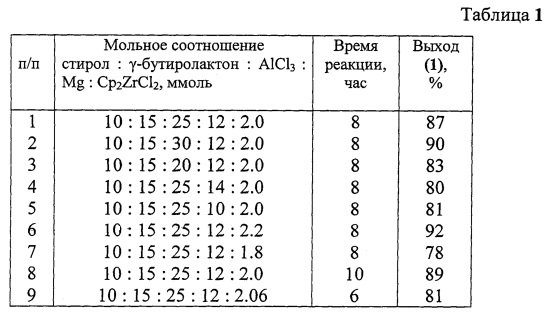
Реакции проводили при температуре 20-22°C в тетрагидрофуране.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 3-АЛКИЛ-3-МЕТИЛ-1-ФЕНИЛ-3-ОЛОВ | 2014 |
|
RU2596878C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРЕТИЧНЫХ СПИРТОВ РЕАКЦИЕЙ АРИЛОЛЕФИНОВ С AlCl3 И КЕТОНАМИ ПОД ДЕЙСТВИЕМ КАТАЛИЗАТОРА Cp2ZrCl2 | 2023 |
|
RU2813640C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-АЛКИЛ-2-АЛКИЛ(ЦИКЛОАЛКЕНИЛ, БЕНЗИЛ)ЦИКЛОПРОПАНОЛОВ | 2009 |
|
RU2433990C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОР-3,4-ДИАЛКИЛ-2,5-БИС[3-(1-АЛКИНИЛ)ФЕНИЛ]-1Н-АЛЮМИНОЛОВ | 2007 |
|
RU2348639C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОР-3,4-ДИАЛКИЛ-2,5-БИС(ТРИМЕТИЛСИЛИЛ) АЛЮМИНАЦИКЛОПЕНТА-2,4-ДИЕНОВ | 2005 |
|
RU2295528C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,6-ДИЭТИЛ-5,7-ДИФЕНИЛ-1,2,3,3a,4,6,8,8a-ОКТАГИДРОАЛЮМАЦИКЛОПЕНТАДИЕНО[3,4-f]ИЗОАЛЮМАИНДОЛА | 2004 |
|
RU2280037C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АЛКИЛ(ФЕНИЛ)-2,5-ДИФЕНИЛ-1Н-ПИРРОЛОВ | 2017 |
|
RU2677470C2 |
| СПОСОБ ПОЛУЧЕНИЯ 11-ЭТИЛ-11-АЛЮМИНАТЕТРАЦИКЛО[11.2.1.0.0]ГЕКСАДЕЦ-3( 10 )-ЕНА | 2008 |
|
RU2375366C2 |
| Способ получения 1,2-диарилэтан-1,2-дионов | 2024 |
|
RU2841326C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-ЭТИЛ-3-АЛЮМИНАТЕТРАЦИКЛО[12.2.1.0.0]ГЕПТАДЕЦ-4-ЕНА | 2008 |
|
RU2375367C2 |
Изобретение относится к способу получения 1-фенил-4-оксаспиро[2.4]гептана (1), характеризующемуся тем, что стирол подвергают взаимодействию с γ-бутиролактоном и хлоридом алюминия (АlСl3) в присутствии магния (Mg, порошок) и катализатора Cp2ZrCl2 в мольном соотношении стирол : γ-бутиролактон : АlСl3 : Mg : Cp2ZrCl2 = 10 : 15 : (20-30) : (10-14) : (1.8-2.2), в тетрагидрофуране в атмосфере аргона при 20-22°C и атмосферном давлении в течение 6-10 ч. Выход 1-фенил-4-оксаспиро[2.4]гептана (1) составляет 78-92%. Это соединение представляет интерес в качестве исходных синтонов для создания биологически активных соединений медицинского и сельскохозяйственного назначения, которые могут найти применение для синтеза лекарственных препаратов, проявляющих антибактериальные, противовирусные, противовоспалительные, противогрибковые, обезболивающие свойства. 1 табл., 1 пр.
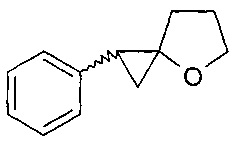 (I)
(I)
Способ получения 1-фенил-4-оксаспиро[2.4]гептана (1)
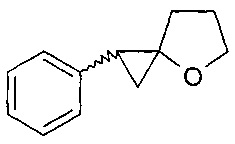
характеризующийся тем, что стирол подвергают взаимодействию с γ-бутиролактоном и хлоридом алюминия (АlСl3) в присутствии магния (Mg, порошок) и катализатора Cp2ZrCl2 в мольном соотношении стирол : γ-бутиролактон : АlСl3 : Mg : Cp2ZrCl2 = 10 : 15 : (20-30) : (10-14) : (1.8-2.2), в тетрагидрофуране в атмосфере аргона при 20-22°C и атмосферном давлении в течение 6-10 ч.
| Leila O.Khafizova et al, "Zirconium-catalyzed one-pot synthesis of e-spiroceclopropil -e-caprolactones", Mendeleev Commun., 2014,v.24,226-228 | |||
| P.S.Kendrekar ey al, "Stereoselective synthesis of spiro-lactones possesing ceclopropan rings through electroreductive cross coupling of styren derivative with diphenyl succinate or glutarate", Electrochemistry, 2007,v.10,p.813-818 | |||
| Способ получения 7-ацетилспиро(бензо) ( @ )-фуран-2-( @ ),1-циклопропан-3-она | 1981 |
|
SU1205770A3 |
Авторы
Даты
2017-03-31—Публикация
2015-07-06—Подача