Предлагаемое изобретение относится к области органической химии, а в частности, к новому способу получения третичных спиртов общей формулы (1):
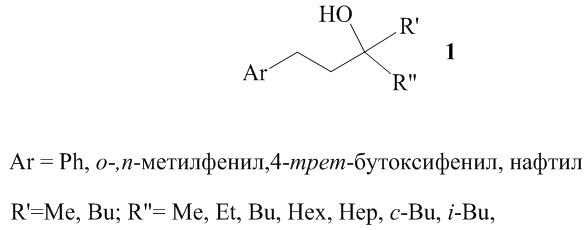
Третичные спирты могут найти применение в тонком органическом синтезе в качестве исходных синтонов для синтеза биологически активных соединений медицинского назначения, создания фотоустойчивых покрытий (C. García, V. S. Martín, Curr. Org. Chem. 2006, Vol. 10, P. 1849; O. Riant Hannedouche, J. Org. Biomol. Chem. 2007, Vol. 5, P. 873; P. G. Cozzi, R. Hilgraf, N. Zimmermann, Eur. J. Org. Chem. 2007, P. 5969; M. Hatano, T. Miyamoto, K. Ishihara, Curr. Org. Chem., 2007, Vol. 11, P. 127; M. Hatano, K. Ishihara. Synthesis 2008, p. 1647).
Известен способ (M. Lauren Fleury and L. Ashfeld Brandon. Org. Leтт., 2009, Vol. 11, P. 5670-5673), получения третичных спиртов, основанный на взаимодействии енонов с аллилбромидами в присутствии катализатора Cp2ТiCl2 и порошкообразного цинка по схеме :
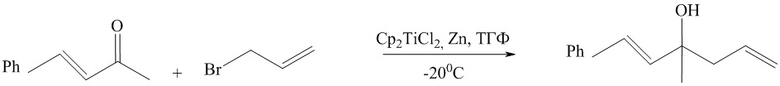
Известным способом не могут быть получены третичные спирты общей формулы (1).
Известен способ (M. Lauren Fleury and L. Ashfeld Brandon. Org. Lett., 2009, Vol. 11, P. 5670-5673), получения третичных спиртов, путем взаимодействия α,β-ненасыщенных кетонов с цирконоцен-этиленовым комплексом (2) с выходом 42-70% по схеме:
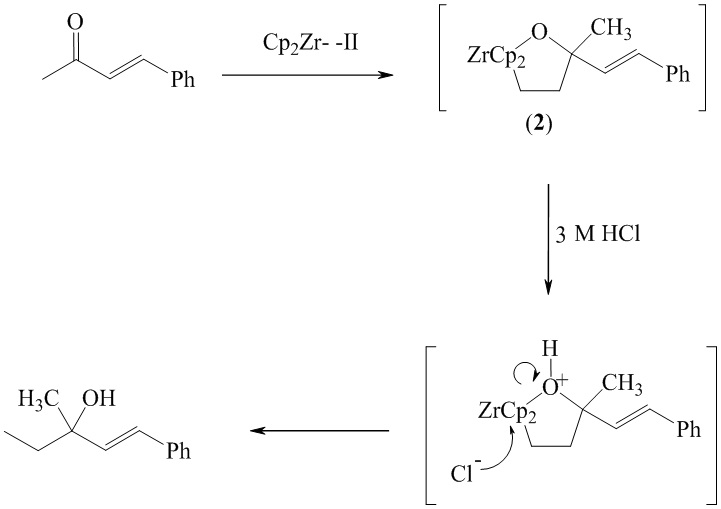
Известным способом не могут быть получены третичные спирты общей формулы (1).
Известен способ (Л.О. Хафизова, М.Г Шайбакова, Н.М. Чобанов, У. М. Джемилев. Способ получения 3-алкил-3-метил-1-фенил-3-олов. Патент РФ 2016, №2596878С2), получения третичных спиртов из стиролов и кетонов, общей формулы МеCOR, где R=СН3, С2Н5, С4Н9, С6Н12, этилалюминий-дихлорида (EtAlCl2) в присутствии магния (Mg, порошок) и катализатора Cp2ZrCl2 в мольном соотношении PhCH=CH2 : [Al] : МеCOR : Mg : Cp2ZrCl2 = 1:2:1:2:0.1 в тетрагидрофуране в атмосфере аргона при 20оС и атмосфер-ном давлении в течение 8 ч.
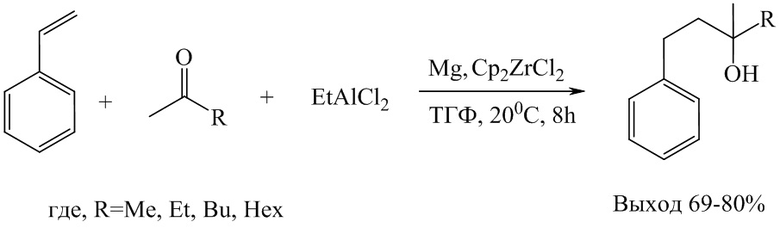
Известным способом не могут быть получены третичные спирты общей формулы (1).
Недостатком способа является использование менее удобного в применении, пожароопасного этилалюминийдихлорида (EtAlCl2). Задачей настоящего изобретения является разработка способа получения третичных спиртов общей формулы (1) с использованием удобного в применении и пожаробезопасного хлорида алюминия AlCl3.
Сущность заявляемого способа заключается во взаимодействии арилолефинов с AlCl3 и алифатическими кетонами под действием катализатора Cp2ZrCl2 (10 мол %) в присутствии металлического Mg, играющего роль акцептора ионов хлора, в условиях: арилолефин : [Al] : R'COR'' : Mg : [Zr] = 1:2:1:2:0.1.
Реакцию проводят в тетрагидрофуране, в атмосфере аргона при температуре 20 оС и атмосферном давлении. Время реакции 8 ч. Выход целевых продуктов 66-83 %. Реакция протекает по схеме:
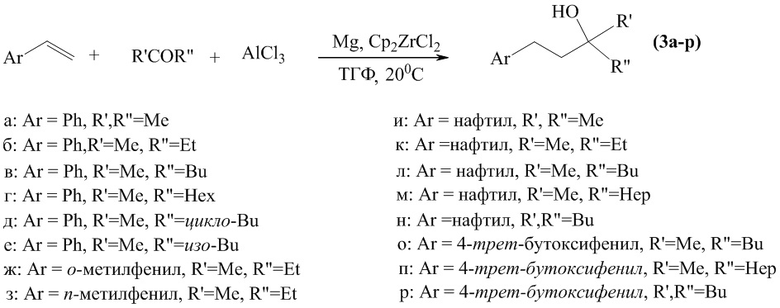
Целевой продукт (1) образуется только лишь с участием арилолефинов, хлорида алюминия (AlCl3), кетонов (R'COR'') и магния. В присутствии других соединений алюминия (например, Et2AlCl, Et3Al, i-Bu3Al, i-Bu2AlH),), других непредельных соединений (например, алкилолефины, ацетилены) или других металлов (например, Co, Cu, Fe) целевые продукты (1) не образуются.
Изменение соотношения исходных реагентов в сторону увеличения их содержания по отношению к арилолефину не приводит к существенному повышению выхода целевого продукта (1). Снижение количества AlCl3, R'COR'' или Mg по отношению к арилолефинам уменьшает выход третичных спиртов (1).
Проведение указанной реакции в присутствии катализатора Cp2ZrCl2, взятого в количестве более 1,2 ммолей, приводит к образованию побочных продуктов (димеров арилолефинов) и существенному уменьшению выхода целевого продукта (1). Использование катализатора Cp2ZrCl2, взятого в количестве менее 0.8 ммолей, снижает выход целевого продукта (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 20оС. При более высокой температуре (например, 40оС) увеличиваются энергозатраты на проведение процесса, а при меньшей температуре (например, 0оС) снижается скорость реакции.
Существенные отличия предлагаемого способа:
Предлагаемый каталитический способ, базируется на использовании коммерчески доступного и значительно упрощающего экспериментальное оформление пожаробезопасного хлорида алюминия (AlCl3).
Предлагаемый способ обладает следующими преимуществами:
В отличие от известного способа предлагаемый способ подразумевает использование дешевого, удобного в практическом применении AlCl3, что позволяет снизить пожароопасность, связанную с применением EtAlСl2, и получать с высокими выходами третичные спирты общей формулы (1), предлагаемый способ позволяет расширить линейку синтезируемых третичных спиртов общей формулы (1), а также в некоторых случаях повысить выход целевых продуктов на 1-3%.
Способ поясняется следующими примерами:
ПРИМЕР. В стеклянный реактор в атмосфере сухого аргона при 0 оС и перемешивании на магнитной мешалке помещали 50 мл ТГФ, 20 ммоль AlCl3, 20 ммоль Mg (порошок), 1 ммоль Cp2ZrCl2, перемешивали до бурого окрашивания реакционной массы, затем добавляли 10 ммоль кетона и 10 ммоль арилолефина. Температуру доводили до комнатной 20оС и перемешивали 8 ч. Реакционную массу обрабатывали 5%-ным водным раствором HCl, продукты реакции экстрагировали эфиром или дихлорметаном, сушили над прокаленным MgSO4, растворитель упаривали на роторном испарителе и выделяли колоночной хроматографией (cиликагель L, 180/250 μ; элюент - гексан: этилацетат (100:1→ 10:1→ 5:1 →1:1)). Структуру выделенных соединений устанавливали анализом спектров ЯМР 13С и 1Н.
Другие примеры, подтверждающие способ, приведены в табл.
Таблица. Синтез третичных спиртов общей формулы (1)
α-олефин
R'COR''
Ar : [AlCl3] : R'COR'' : Mg : Cp2ТiCl2 = 1:2:1:2:0.1 ммоль
час
%
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
-//-
-//-
-//-
-//-
-//-
о-метилфенил
p-метилфенил
нафтил-
нафтил-
нафтил-
нафтил-
нафтил-
4-трет-бутоксифенил
4-трет-бутоксифенил
4-трет-бутоксифенил
R'= Ме, R''= Et
R'= Ме, R''= Bu
R'= Ме, R''= Hex
R'= Ме, R''= c-Bu
R'= Ме, R''= i-Bu
R'= Ме, R''= Et
R'=Ме, R''= Et R'= R''= Me
R'= Ме, R''= Et
R'= Ме, R''= Bu
R'= Ме, R''= Hep
R'= R''= Bu
R'= Ме, R''= Bu
R'= Ме, R''= Hep R'= R''= Bu
1:2:1:2:0.1
1:2:1:2:0.1
1:2:1:2:0.1
1:2:1:2:0.1
1:2:1:2:0.1
1:2:1:2:0.1
1:2:1:2:0.1
1:2:1:2:0.1
1:2:1:2:0.1
1:2:1:2:0.1
1:2:1:2:0.1
1:2:1:2:0.1
1:2:1:2:0.1
1:2:1:2:0.1
1:2:1:2:0.1
8
8
8
8
8
8
8
8
8
8
8
8
8
8
8
83
77
73
67
71
66
70
81
79
78
72
74
71
68
70
Реакции проводили при температуре 20оС в тетрагидрофуране.
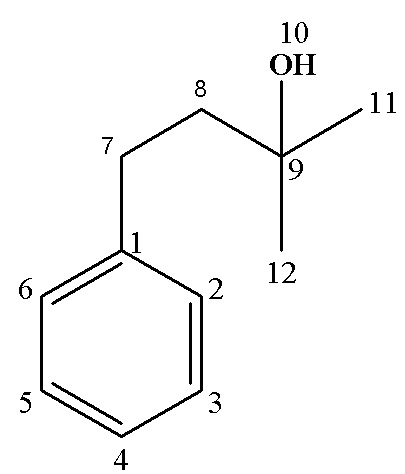
Выход 69 %. Rf (гексан : этилацетат, 1:1) 0.61
УФ λmax: 261.04
ИК (ν, cm-1): 3376; 3011; 2916; 2902; 1466; 1359; 1131; 828; 744.
Молек. масса: 164.2441
HRMS, m/z: 187.0274 [M+Na+]
Рассч. для C11H16O (%): C, 80.44; H, 9.82.
13С ЯМР (CDCl3), δ: 29.35 (С12,11), 30.76 (С7), 45.75 (С8), 70.92 (С9), 125.76 (С4), 128.32 (С2,6), 128.42 (С3,5), 142.53 (С1). 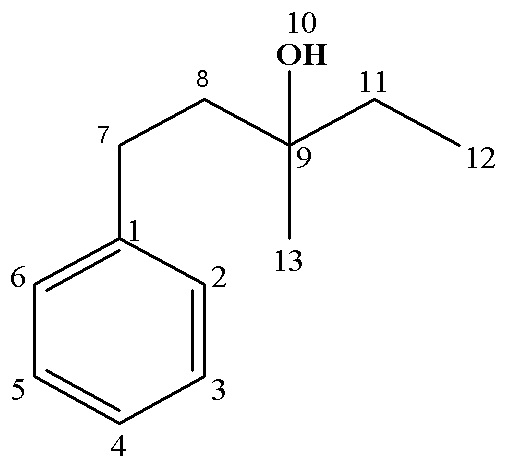
Выход 83 %. Rf (гексан: этилацетат,1:1) 0.61
УФ λmax: 262.10.
ИК (ν, cm-1): 3375; 3027; 2930; 2873; 1454; 1379; 1137; 1026; 752.
Молек. масса: 178.2707
HRMS, m/z: 201.0618 [M+Na+]
Рассч. для C12H18O (%): C, 80.85; H, 10.18.
13С ЯМР (CDCl3), δ: 8.29 (С12), 26.24 (С13), 30.28 (С7), 34.31 (С11), 43.20 (С8), 72.68 (С9), 125.65 (С4), 128.30 (С2,6),128.35(С3,5), 142.69 (С1).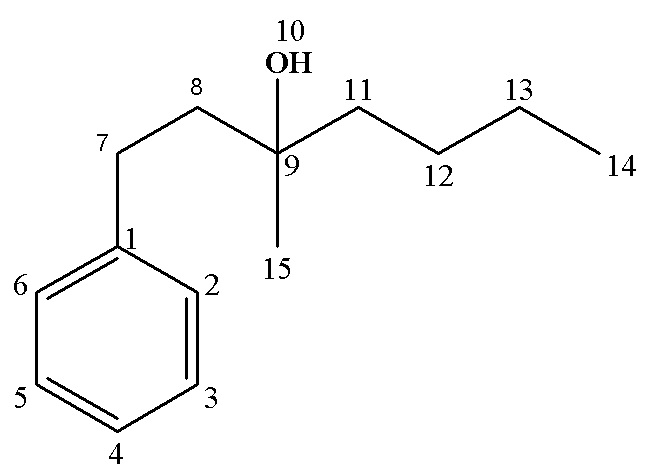
Выход 77 %. Rf (гексан: этилацетат, 1:1) 0.61
УФ λmax: 270.26.
ИК (ν, сm-1): 3432; 3055; 2925; 2870; 1675; 1455; 1061; 700.
Молек.масса: 206.3238
HRMS, m/z: 229.1023 [M+Na+]
Рассч. для C12H18O (%): C, 81.50; H, 10.75.
13С ЯМР (CDCl3), δ: 14.13 (С14), 23.30 (С13), 26.20 (С12), 26.95 (С15), 30.36 (С7), 41.80 (С8), 43.74 (С11), 72.72 (С9), 125.74 (С4), 128.34 (С2,6), 128.42 (С3,5), 142.67 (С1). 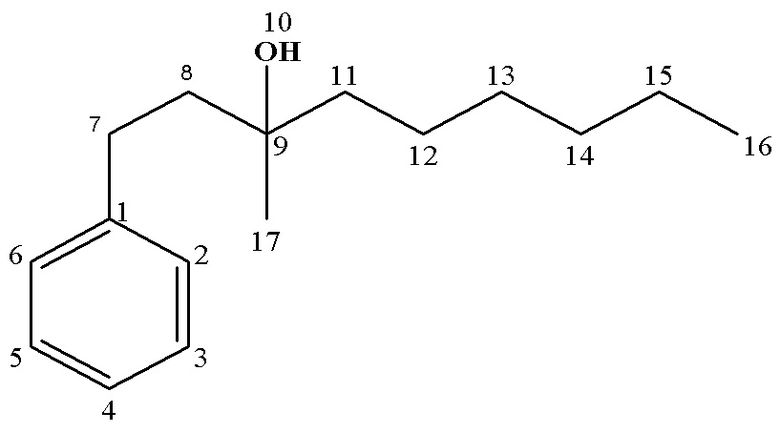
Выход 73 %. Rf (гексан:этилацетат,1:1) 0.61
УФ λmax: 253.53; 267.12.
ИК (ν, сm-1): 3390; 33026; 2930; 2858; 1603; 1496; 1455; 1375; 918; 741; 698.
Молек. масса: 234.3770
HRMS, m/z: 257.1290 [M+Na+]
Рассч. для C16H26O (%): C, 81.99; H, 11.18.
13С ЯМР (CDCl3), δ: 14.08 (С16), 22.63 (С15), 23.94(С12), 26.95 (С17), 29.88 (С13), 30.37 (С7), 31.85 (С14), 42.10 (С11), 43.74 (С8), 72.72(С9), 125.73 (С4), 128.33 (С2,6), 128.40 (С3,5), 142.67 (С1). 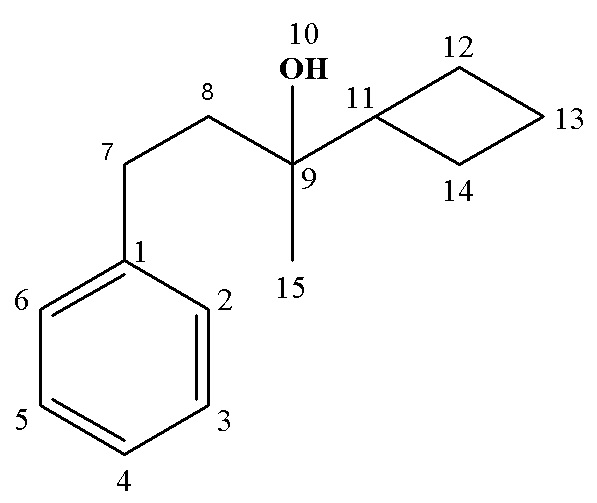
Выход 67 %. Rf (гексан : этилацетат, 1:1) 0.61
УФ λmax: 268.10
ИК (ν, сm-1): 3404; 3065; 2930; 2889; 1457; 1366; 1143; 1011; 745.
Молек. масса: 204.3080
HRMS, m/z: 227.1861 [M+Na+]
Рассч. для C14H20O (%): C, 82.30; H, 9.87.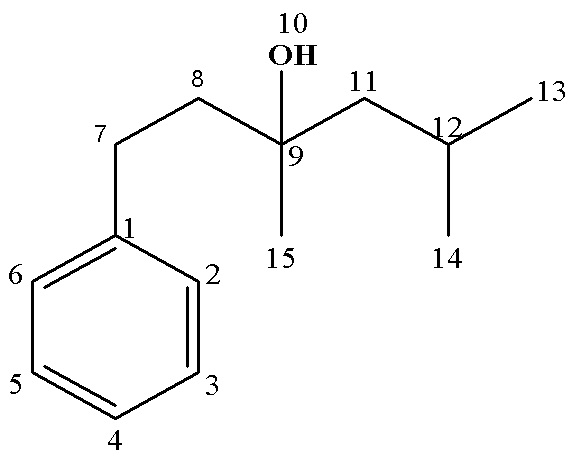
Выход 71 %. Rf (гексан : этилацетат, 1:1) 0.61
УФ λmax: 270.19.
ИК (ν, сm-1): 3298; 3062; 2975; 2871; 1605; 1378; 1060; 752.
Молек. масса: 206.3238
HRMS, m/z: 229.1023 [M+Na+]
Рассч. для C14H22O (%): C, 81.50; H, 10.75.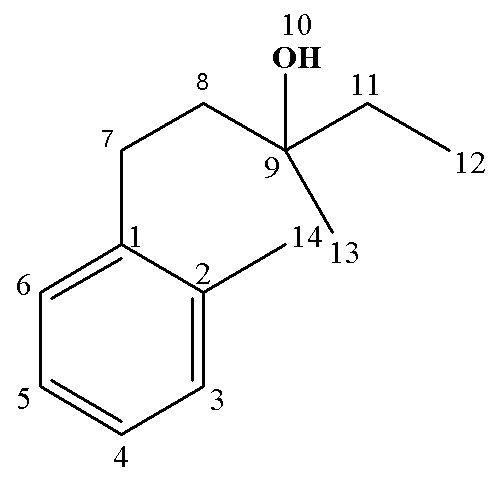
Выход 66 %. Rf (гексан : этилацетат, 1:1) 0.61
УФ λmax: 272.17.
ИК (ν, сm-1): 3301; 3037; 2902; 1647; 1359; 1016; 746
Молек. масса: 192.2973
HRMS, m/z: 215.0726 [M+Na+].
Рассч. для C13H20O (%): C, 81.20; H, 10.48
13С ЯМР (CDCl3), δ: 8.28 (С12), 19.23 (С14), 26.28 (С13), 27.67 (С7), 34.37 (С11), 41.98 (С8), 72.90 (С9), 125.92 (С5), 126.09 (С4), 128.75 (С6), 130.23 (С3), 135.81 (С2), 140.79 (С1).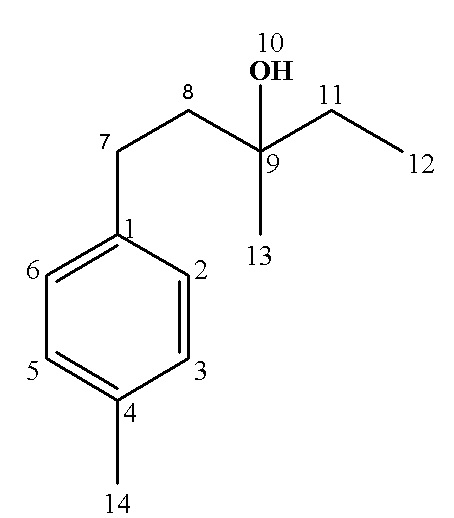
Выход 70 %. Rf (гексан : этилацетат, 1:1) 0.61
УФ λmax: 272.13.
ИК (ν, сm-1): 3309; 3063; 2935; 1674; 1386; 1081; 753
Молек. масса: 192.2973
HRMS, m/z: 215.0735 [M+Na+].
Рассч. для C13H20O (%): C, 81.20; H, 10.48
13С ЯМР (CDCl3), δ: 8.39 (С12), 21.11 (С14), 26.47 (С13), 29.97 (С7), 34.53 (С11), 43.52 (С8), 72.98 (С9), 128.32 (С3,6), 129.22 (С2,5), 135.31 (С4), 139.67 (С1).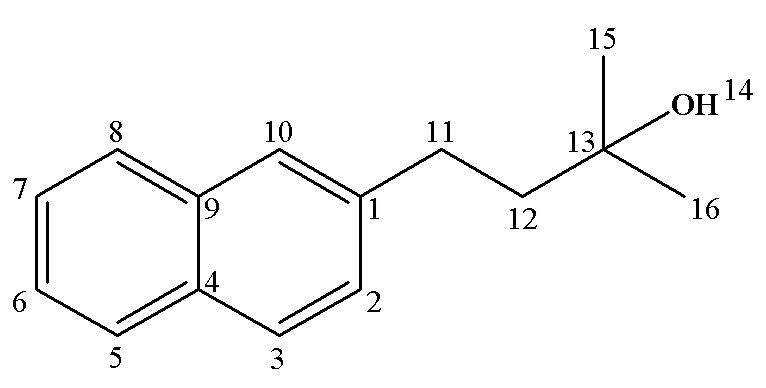
Выход 81 %. Rf (гексан : этилацетат, 1:1) 0.6
УФ λmax: 250.04; 275.61; 319.05.
ИК (ν, cm-1): 3381; 3052; 2922; 1598; 1468; 1365; 1144; 860; 745; 479.
Молек. масса: 214.3028
HRMS, m/z: 237.1242 [M+Na+].
Рассч. для C15H18O (%): C, 84.07; H, 8.47.
13С ЯМР (CDCl3) δ: 29.44 (С15,16), 31.00 (С11), 45.66 (С12), 71.02 (С13), 125.21 (С6), 126.01 (C7), 126.27 (C10), 127.41 (С2), 127.47 (C8), 127.70 (С5), 128.02 (С3), 132.04 (С4), 133.78 (С9), 140.18 (C1).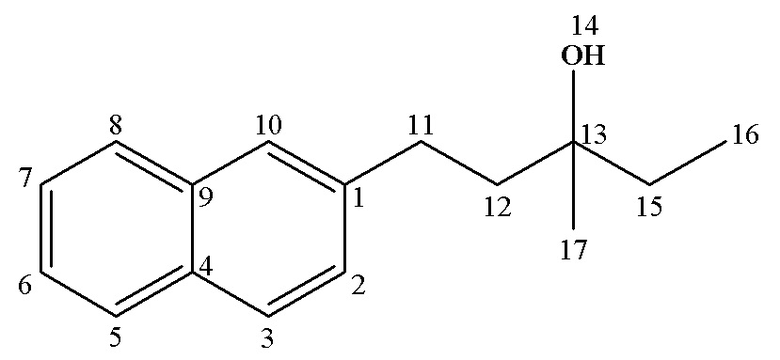
Выход 79 %. Rf (гексан: этилацетат, 1:1) 0.6
УФ λmax: 319.75.
ИК (ν, cm-1): 3402; 3058; 2928; 1601; 1451; 1365; 1139; 888; 746; 475.
Молек. масса: 228.3294
HRMS, m/z: 251.1252 [M+Na+].
Рассч. для C16H20O (%): C, 84.16; H, 8.83.
13С ЯМР (CDCl3), δ: 8.33 (С16), 26.41 (С17), 30.51 (С11), 34.49 (С15), 43.15 (С12), 73.61(С13), 125.13 (С6), 125.93 (С7), 126.20 (С10), 127.39 (С2,8), 127.63 (С5), 127.96 (С3), 131.98 (С4), 133.81(C9), 141.00 (С1).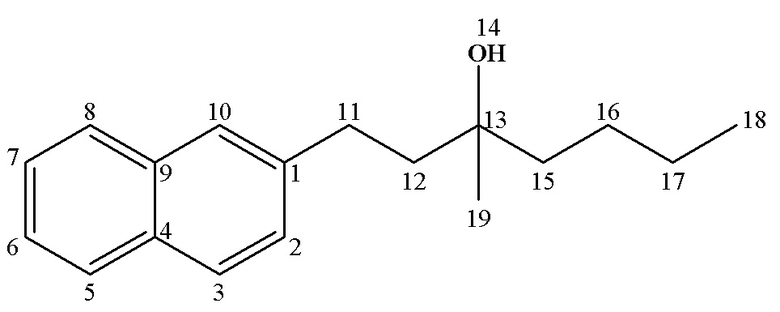
Выход 78 %. Rf (гексан : этилацетат, 1:1) 0.6
УФ λmax: 224.37; 249.66; 275.58; 319.04.
ИК (ν, cm-1): 3411; 3053; 2956; 2932; 2862; 1600; 1465; 1376; 1125; 818; 745; 476.
Молек. масса: 256.3825.
HRMS, m/z: 279.1708 [M+Na+].
Рассч. для C18H24O (%): C, 84.32; H, 9.44.
13С ЯМР (CDCl3) δ: 14.19 (C18), 23.34 (С17), 26.24 (C16), 26.92 (C19), 30.53 (С11), 41.82 (C15), 43.59 (С12), 72.69 (С13), 125.12 (С6), 125.92 (C7), 126.20 (C10), 127.40 (С2,8), 127.64 (С5), 127.94 (С3), 131.99 (С4), 133.73 (С9), 140.27 (C1).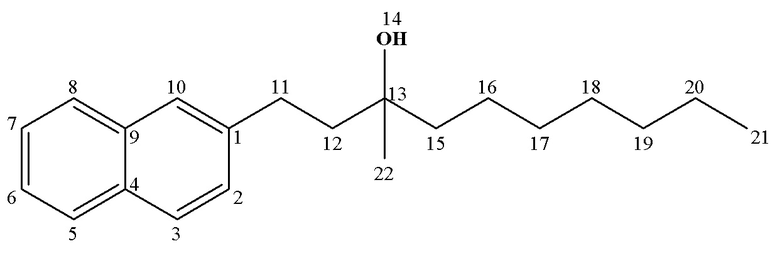
Выход 72 %. Rf (гексан : этилацетат, 1:1) 0.6
УФ λmax: 225.12; 249.17; 275.81; 319.16.
ИК (ν, cm-1): 3423; 3054; 2928; 2855; 1696; 1600; 1465; 1375; 1126; 818; 745; 476.
Молек. масса: 298.4623
HRMS, m/z: 321.2198 [M+Na+].
Рассч. для C21H30O (%): C, 84.51; H, 10.13.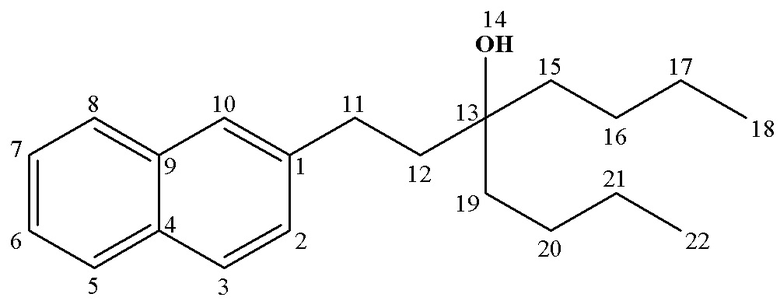
Выход 74 %. Rf (гексан : этилацетат, 1:1) 0.6
УФ λmax,: 224.99; 267.86; 319.11.
ИК (ν, cm-1): 3411; 3054; 2927; 2861; 1600; 1465; 1378; 1128; 856; 819; 746; 477.
Молек. масса: 298.4623
HRMS, m/z: 321.2213 [M+Na+], 337.2164 [M+K+]
Рассч. для C21H30O (%): C, 84.51; H, 10.13.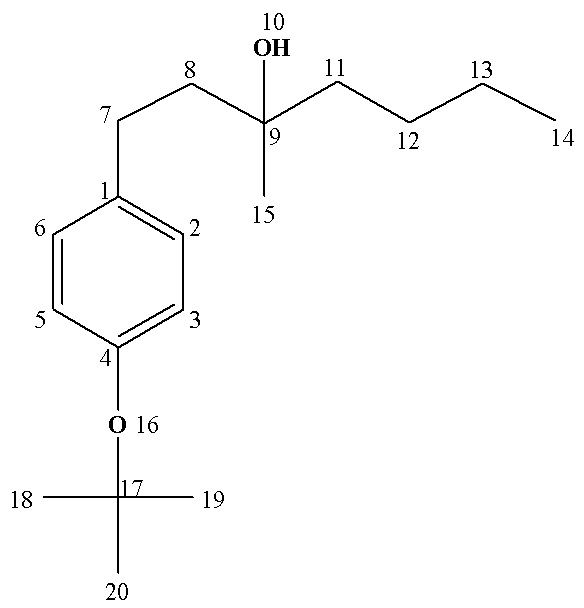
Выход 71 %. Rf (гексан : этилацетат, 1:1) 0.6
УФ λmax,: 224.98; 275.56.
ИК (ν, cm-1): 3412; 2974; 2931; 2871; 1607; 1505; 1366; 1236; 1162; 898.
Молек. масса: 278.4296
HRMS, m/z: 301.2144 [M+Na+], 317.2093 [M+K+]
Рассч. для C21H30O2 (%): C, 77.65; H, 10.86.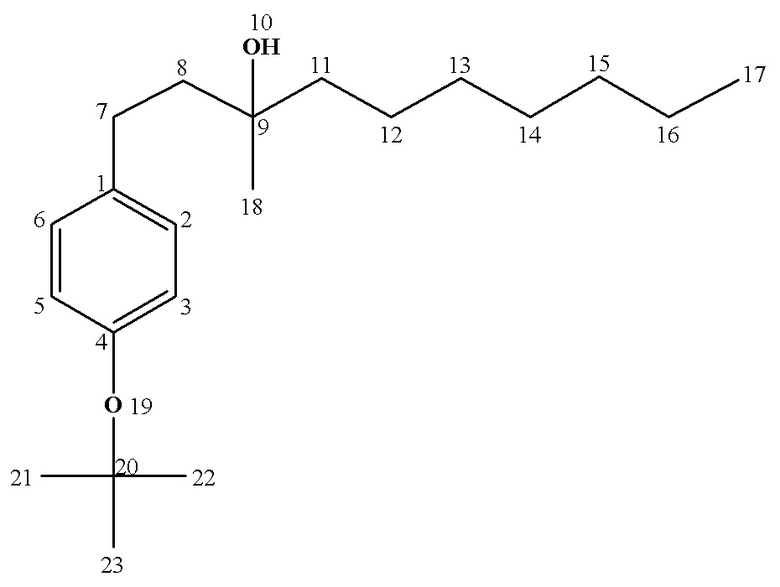
Выход 68 %. Rf (гексан : этилацетат, 1:1) 0.6
УФ λmax,: 221.41; 267.65.
ИК (ν, cm-1): 3409; 2928; 2856; 1505; 1366; 1237; 1163; 898.
Молек. масса: 320.5093.
HRMS, m/z: 338.3053 [M-H2O]+, 343.2608 [M+Na+].
Рассч. для C21H36O2 (%): C, 78.70; H, 11.32.
13С ЯМР (CDCl3) δ: 14.17 (C17), 22.72 (С16), 24.06 (C12), 26.95 (C18), 28.89 (C21,22,23), 29.37 (C13), 29.66 (С7), 30.26 (C14), 31.91 (C15), 42.08 (C11), 43.68 (С8), 72.88 (С9), 78.24 (C20), 124.28 (С3,5), 128.64 (С2,6), 137.61 (С1), 153.14 (C4).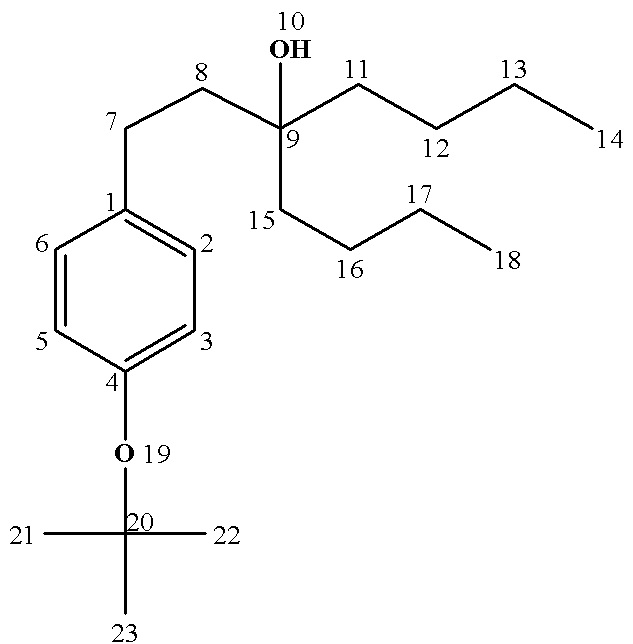
Выход 70 %. Rf (гексан : этилацетат, 1:1) 0.6
УФ λmax,: 224.57; 271.19.
ИК (ν, cm-1): 3436; 2924; 2854; 1730; 1505; 1463; 1365; 1162; 899; 804.
Молек. масса: 320.5093.
HRMS, m/z: 338.3079 [M-H2O]+, 343.2633 [M+Na+].
Рассч. для C21H36O2 (%): C, 78.70; H, 11.32.
13С ЯМР (CDCl3) δ: 14.27 (C14,18), 23.47 (C13,17), 25.89 (C12,16), 28.97 (C21,22,23), 29.85 (C7), 39.09 (C11,15), 41.40 (С8), 74.53 (С9), 78.24 (C20), 124.35 (С3,5), 128.70 (С2,6), 137.69 (С1), 153.33 (C4).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 4-ЗАМЕЩЕННЫХ ТИОМОРФОЛИНОВ | 2013 |
|
RU2551658C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФАНИЛПРОИЗВОДНЫХ АНТИПИРИНА | 2020 |
|
RU2740911C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АЛКИЛ(ФЕНИЛ)-2,5-ДИФЕНИЛ-1Н-ПИРРОЛОВ | 2017 |
|
RU2677470C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТИОМЕТИЛИРОВАННЫХ ПРОИЗВОДНЫХ ПИРРОЛА И 2-(БЕНЗПИРРОЛ-3-ИЛ)УКСУСНОЙ КИСЛОТЫ | 2023 |
|
RU2819608C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АЛКИЛ-3-АЗАБИЦИКЛО[3.3.1]НОНА-1(9),5,7-ТРИЕН-9-ОЛОВ ИЛИ 3-АЛКИЛ-3,4-ДИГИДРО-2Н-1,3-БЕНЗОКСАЗИНОВ | 2016 |
|
RU2654054C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСОВ 1-ХЛОР-2-АЛКИЛ(ФЕНИЛ)БОРИРЕНОВ с SMe | 2016 |
|
RU2654806C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСОВ 1-ХЛОР-2-АЛКИЛ(ФЕНИЛ)БОРИРАНОВ с SMe | 2016 |
|
RU2640209C2 |
| ИСПОЛЬЗОВАНИЕ ТРИЦИКЛИЧЕСКИХ ПРИЗВОДНЫХ 1,4-ДИГИДРО-1,4-ДИОКСО-1Н-НАФТАЛИНА И НОВЫЕ ЕГО СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРОИЗВОДНЫЕ ЗАМЕЩЕННЫХ НАФТАЛИНОВ В КАЧЕСТВЕ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 1996 |
|
RU2178791C2 |
| СПОСОБЫ СИНТЕЗА АПЛИДИНА И НОВЫХ ПРОТИВООПУХОЛЕВЫХ ПРОИЗВОДНЫХ, СПОСОБЫ ИХ ПРОМЫШЛЕННОГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2001 |
|
RU2299887C2 |
| ОБЩИЙ СИНТЕЗ МИРИАПОРОНОВ | 2003 |
|
RU2328492C2 |
Предлагаемое изобретение относится к области органической химии, а именно к способу получения третичных спиртов общей формулы (1):
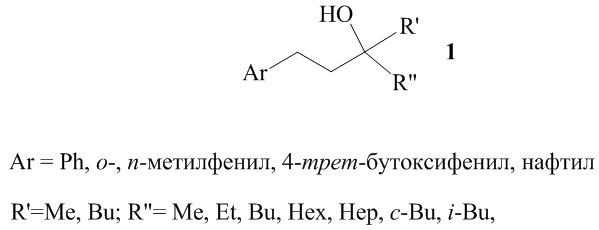
представляющих интерес в качестве исходных синтонов для создания биологически активных соединений медицинского назначения, создания фотоустойчивых покрытий. Способ заключается во взаимодействии арилолефинов с кетонами в атмосфере аргона в присутствии катализатора Cp2ZrCl2, производного алюминия, порошка магния, в тетрагидрофуране, при 20°С, атмосферном давлении, в течение 8 ч. При этом в качестве производного алюминия используют хлорид алюминия AlCl3, в качестве арилолефинов соединения Ar-CH=CH2 (Ar = Ph, о-, п-метилфенил, 4-трет-бутоксифенил, нафтил), а в качестве кетонов соединения R'COR'', (где R'=Me, Bu, R''= Me, Et, Bu, Hex, Hep, c-Bu, i-Bu). Мольное соотношение арилолефин : AlСl3 : R'COR'' : Mg : [Zr] = 1:2:1:2:0,1. Технический результат – получение целевых продуктов с высоким выходом при использовании дешевого, удобного в практическом применении AlCl3. 1 табл., 16 пр.
Способ получения третичных спиртов общей формулы (1):
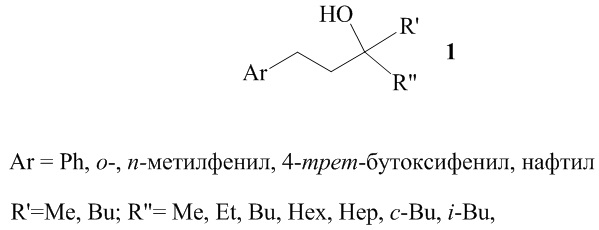
взаимодействием арилолефинов с кетонами в присутствии катализатора Cp2ZrCl2, производного алюминия, порошка магния, в тетрагидрофуране, в атмосфере аргона, при 20°С, атмосферном давлении, в течение 8 ч, отличающийся тем, что в качестве производного алюминия используют хлорид алюминия AlCl3, в качестве арилолефинов соединения Ar-CH=CH2 (Ar = Ph, о-, п-метилфенил, 4-трет-бутоксифенил, нафтил), в качестве кетонов соединения R'COR'', (где R'=Me, Bu, R''= Me, Et, Bu, Hex, Hep, c-Bu, i-Bu) в мольном соотношении арилолефин : AlСl3 : R'COR'' : Mg : [Zr] = 1:2:1:2:0,1.
| СПОСОБ ПОЛУЧЕНИЯ 3-АЛКИЛ-3-МЕТИЛ-1-ФЕНИЛ-3-ОЛОВ | 2014 |
|
RU2596878C2 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 1,1,3-ТРИАЛКИЛ-1,5-ПЕНТАДИОЛОВ И 1,1,4-ТРИАЛКИЛ-1,5-ПЕНТАНДИОЛОВ | 2002 |
|
RU2235711C2 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 1,3-ДИАЛКИЛ-1,5-ПЕНТАНДИОЛА И 1,4-ДИАЛКИЛ-1,5-ПЕНТАНДИОЛА | 2002 |
|
RU2221767C1 |
| US 20140073819 A1, 13.03.2014 | |||
| US 20110237684 A1, 29.09.2011. | |||
Авторы
Даты
2024-02-14—Публикация
2023-05-17—Подача