Изобретение относится к областям биотехнологии, иммунохимии, ветеринарии и медицины, может быть использовано в решении задач диагностики различных инфекционных и соматических заболеваний человека и животных. При таких заболеваниях в организме возникают антитела, комплиментарные антигенам, лежащим в основе патогенеза заболевания. Данные антигены и антитела могут обнаруживаться в крови и являться маркерами конкретной нозологии. Однако до настоящего времени не созданы диагностические препараты, отличающиеся стабильностью и воспроизводимостью иммунохимических свойств и позволяющие проводить такие реакции бесприборно, в практически полевых условиях. Отсутствуют надежные и простые методы для скрининговых исследований животных и населения, относящихся к группам риска, что важно для коррекции терапии и определения прогноза заболевания. Цель изобретения - разработка бесприборного экспресс-метода для определения наличия специфических антигенов и антител, удаление ложноположительных результатов иммунохимического анализа.
Аналогом данного способа является способ определения различных антигенов и антител путем мечения одного из этих компонентов, именуемых в дальнейшем биолигандами, различными метками - радиоактивными, ферментными, флуоресцентными, эритроцитарными [1 - Ройт А. Основы иммунологии. М. 1991. - С. 91-93.], [2 - Покровский В.И. Руководство по иммунологии инфекционного процесса. - М. 1994. - С. 230], [3 - Никитин В.М. Справочник методов иммунологии. Кишинев, 1982. - 304 с.]. Данные способы выявления антигенов и антител отличаются длительным временем постановки, значительными материальными затратами, опасностью для персонала при работе со специфическими метками. Кроме того, они требуют для своего исполнения наличия дорогих и сложных в эксплуатации приборов.
Известны коллоидные растворы неорганической природы, на поверхности которых адсорбированы специфические биолиганды. К таковым относят препараты коллоидного золота с адсорбированными биолигандами [4 - Ред. Жданов В.М. Методы исследования в молекулярной, общей и медицинской вирусологии. - М. 1987. - С. 80-89] и препараты коллоидных растворов гексацианферрата железа (берлинской лазури) [5 - Попова С.В., Мешандин А.Г., Куклина С.А. Российский биомедицинский журнал. С-Петербург. - 2009, т. 10. – С. 478-491]. Данные способы выявления специфических биолигандов не требуют каких-либо специальных приборов, однако дороги (золото - драгоценный металл) имеют при своем исполнении определенное количество ложноположительных результатов.
Наиболее близко к поставленной цели изобретения является способ, описанный в [6 - Мешандин А.Г. Патент РФ №2485516 от 02.02.2012 г.]. Согласно известному способу, постановка реакций агглютинационного иммунологического анализа включает разведение гидрозольных препаратов в подлежащих тестированию образцах биологического материала в водном солевом растворе, в качестве раствора используют раствор хлорида лития. Согласно данному способу, взятому заявителем за прототип, гидрозольный препарат разводят в подлежащих тестированию образцах биологического материала в водном растворе хлорида лития.
Однако данный способ приводит к появлению ложноположительных результатов и длителен по времени постановки. Целью настоящего изобретения являются снижение количества ложноположительных результатов и уменьшение времени постановки анализа. Поставленная цель достигается описанным ниже способом - коллоидные растворы гексацианферрата железа (II) (III) с адсорбированными на их поверхности биоспецифическими лигандами вводят во взаимодействие с подлежащими тестированию биологическими материалами в водном солевом растворе, отличающийся тем, что в качестве раствора используют водный раствор или хлорида рубидия, или хлорида цезия. Использование водного раствора или хлорида рубидия, или хлорида цезия является отличительным признаком заявляемого решения. Благодаря реализации данного способа уменьшается процент ложнопозитивных иммунологических реакций, уменьшается время постановки реакции.
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример №1. Осуществляют нагружение коллоидного раствора гексацианферрата железа (II) (III) генно-инженерным антигеном туберкулезным по известным методам [8 - Мешандин А.Г. Патент РФ №2169924, 12.09.1996 г.]. В качестве модификатора поверхности частиц используют катион ртути в виде раствора хлорида ртути (II). Далее осуществляют постановку иммунологической реакции в 1% растворе хлорида лития (прототип) и в заявляемом варианте-растворе хлорида цезия разной концентрации. Сыворотки получают путем взятия небольшого количества (не более 0,1 мл) объема крови. Полученная кровь центрифугируется для осаждения форменных элементов. Допускается получение крови венопункцией, либо капиллярным взятием. Далее производят разведение сывороток в титрах 1:10. в 1% растворе хлорида лития (прототип) и в растворе хлорида цезия разной концентрации (заявляемое техническое решение). После осуществления разведения сывороток в указанных водных растворах, соединяют их с исходным коллоидным раствором гексацианферрата железа (гидрозолем), и осуществляют учет результатов реакции. Результаты реакции представлены в таблице 1.
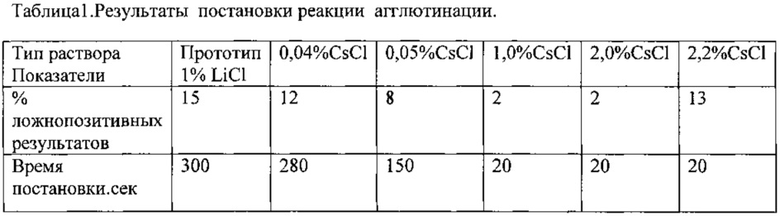
Из представленных данных видны преимущества предлагаемого решения по сравнению с прототипом по позициям время постановки и % ложнопозитивных результатов. Вместе с тем, чувствительность реакции была аналогичной как у прототипа, так и в заявляемом техническом решении. Выход за оптимальные концентрации в заявляемом решении приводит к ухудшению результатов - в нижнем пределе концентрации хлорида цезия нет преимуществ перед прототипом, в верхнем пределе сокращается время постановки, однако недопустимо увеличивается % ложноположительных результатов.
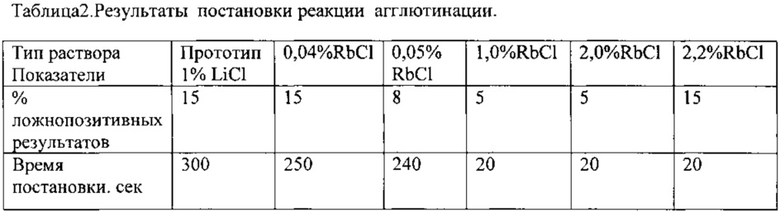
Пример №2. Осуществляют нагружение коллоидного раствора гексацианферрата железа (II) (III) генно-инженерным антигеном туберкулезным по известным методам [8 - Мешандин А.Г. Патент РФ №2169924, 12.09.1996 г.]. В качестве модификатора поверхности частиц используют катион ртути в виде раствора хлорида ртути (II). Далее осуществляют постановку иммунологической реакции в 1% растворе хлорида лития (прототип) и в заявляемом варианте-растворе хлорида рубидия разной концентрации. Сыворотки получают аналогично примеры №1. Далее производят разведение сывороток в титрах 1:10. в 1% растворе хлорида лития (прототип) и в растворе хлорида рубидия разной концентрации (заявляемое техническое решение). После осуществления разведения сывороток в указанных водных растворах, соединяют их с исходным коллоидным раствором гексацианферрата железа (II) (III) (гидрозолем), и осуществляют учет результатов реакции. Результаты реакции представлены в таблице 2.
Пример №3. Осуществляют нагружение раствора коллоидного гексацианферрата железа (II) (III) антителами к хорионическому гонадотропину человека (ХГЧ) по известным методам [8]. Далее осуществляют постановку иммунологической реакции в 1% растворе хлорида лития (прототип) и в заявляемом варианте-растворе хлорида рубидия разной концентрации. Использовали в качестве биоматериала мочу как беременных женщин (положительный контроль), так и женщин не беременных (отрицательный контроль). Разведение использовали в соотношении 1:5., в остальном постановка была аналогична примеру №1. Результаты реакции представлены в таблице 3.
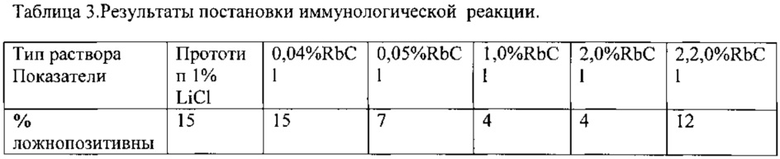

Из представленных данных видны преимущества предлагаемого решения по сравнению с прототипом по позициям время постановки и % ложнопозитивных результатов. Вместе с тем, чувствительность реакции была аналогичной как у прототипа, так и в заявляемом техническом решении. Выход за оптимальные концентрации в заявляемом решении приводит к ухудшению результатов - в нижнем пределе концентрации хлорида рубидия нет преимуществ перед прототипом, в верхнем пределе сокращается время постановки, однако недопустимо увеличивается % ложноположительных результатов.
Пример №4. Осуществляют нагружение раствора коллоидного гексацианферрата железа (II) (III) антителами к хорионическому гонадотропину человека (ХГЧ) по известным методам [8]. Далее осуществляют постановку иммунологической реакции в 1% растворе хлорида лития (прототип) и в заявляемом варианте-растворе хлорида цезия разной концентрации. Использовали в качестве биоматериала мочу как беременных женщин (положительный контроль), так и женщин не беременных (отрицательный контроль). Разведение использовали в соотношении 1:5., в остальном постановка была аналогична примеру №1. Результаты реакции представлены в таблице 4.
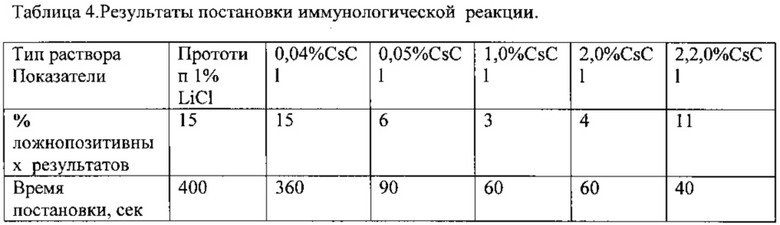
Из представленных данных видны преимущества предлагаемого решения по сравнению с прототипом по позициям время постановки и % ложнопозитивных результатов. Вместе с тем, чувствительность реакции была аналогичной как у прототипа, так и в заявляемом техническом решении. Выход за оптимальные концентрации в заявляемом решении приводит к ухудшению результатов - в нижнем пределе концентрации хлорида цезия нет преимуществ перед прототипом, в верхнем пределе сокращается время постановки, однако недопустимо увеличивается % ложноположительных результатов.
Пример №5. Осуществляют нагружение коллоидного раствора гексацианферрата железа (II) (III) антигенами к вирусу птичьего гриппа по известным методам [4]. Далее осуществляют постановку иммунологической реакции в 1% растворе хлорида лития (прототип) и в заявляемом варианте-растворе хлорида рубидия разной концентрации. Использовали в качестве биоматериала сыворотки крови птиц иммунизированных (положительный контроль), так и неиммунизированных (отрицательный контроль). Разведение использовали в соотношении 1:20, в остальном постановка была аналогична примерам №1-2. Результаты реакции представлены в таблице 5.

Из представленных данных видны преимущества предлагаемого решения по сравнению с прототипом по позициям время постановки и % ложнопозитивных результатов. Вместе с тем, чувствительность реакции была аналогичной как у прототипа, так и в заявляемом техническом решении. Выход за оптимальные концентрации в заявляемом решении приводит к ухудшению результатов - в нижнем пределе концентрации хлорида рубидия нет преимуществ перед прототипом, в верхнем пределе сокращается время постановки, однако недопустимо увеличивается % ложноположительных результатов.
Пример №6. Осуществляют нагружение коллоидного раствора гексацианферрата железа (II) (III) антигенами к вирусу птичьего гриппа по известным методам [4]. Далее осуществляют постановку иммунологической реакции в 1% растворе хлорида лития (прототип) и в заявляемом варианте-растворе хлорида цезия разной концентрации. Использовали в качестве биоматериала сыворотки крови птиц иммунизированных (положительный контроль), так и неиммунизированных (отрицательный контроль). Разведение использовали в соотношении 1:20, в остальном постановка была аналогична примерам №1-2. Результаты реакции представлены в таблице 6.

Из представленных данных видны преимущества предлагаемого решения по сравнению с прототипом по позициям время постановки и % ложнопозитивных результатов. Вместе с тем, чувствительность реакции была аналогичной как у прототипа, так и в заявляемом техническом решении. Выход за оптимальные концентрации в заявляемом решении приводит к ухудшению результатов - в нижнем пределе концентрации хлорида цезия нет преимуществ перед прототипом, в верхнем пределе сокращается время постановки, однако недопустимо увеличивается % ложноположительных результатов.
Пример №7. Осуществляют нагружение коллоидного раствора гексацианферрата железа (II) (III) антителами к поверхностному антигену вируса гепатита B (HbsAg) по известным методам [8]. В качестве модификатора поверхности коллоидных частиц используют катион двухвалентной ртути в виде раствора хлорида ртути (II). Далее осуществляют постановку иммунологической реакции в 1% растворе хлорида лития (прототип) и в заявляемом варианте-растворе хлорида цезия разной концентрации. Разведение использовали в соотношении 1:2, в остальном постановка была аналогична примеру №1. Результаты реакции представлены в таблице 7.

Из представленных данных видны преимущества предлагаемого решения по сравнению с прототипом по позициям время постановки и % ложнопозитивных результатов. Вместе с тем, чувствительность реакции была аналогичной как у прототипа, так и в заявляемом техническом решении. Выход за оптимальные концентрации в заявляемом решении приводит к ухудшению результатов - в нижнем пределе концентрации хлорида цезия нет преимуществ перед прототипом, в верхнем пределе сокращается время постановки, однако недопустимо увеличивается % ложноположительных результатов, превышающий таковой даже в прототипе.
Пример №8. Осуществляют нагружение раствора коллоидного раствора гексацианферрата железа (II) (III) антителами к поверхностному антигену вируса гепатита B (HbsAg) по известным методам [8]. В качестве модификатора поверхности коллоидных частиц используют катион двухвалентной ртути в виде раствора хлорида ртути (II). Далее осуществляют постановку иммунологической реакции в 1% растворе хлорида лития (прототип) и в заявляемом варианте-растворе хлорида рубидия разной концентрации. Разведение использовали в соотношении 1:2, в остальном постановка была аналогична примеру №1. Результаты реакции представлены в таблице 8.

Из представленных данных видны преимущества предлагаемого решения по сравнению с прототипом по позициям время постановки и % ложнопозитивных результатов. Вместе с тем, чувствительность реакции была аналогичной как у прототипа, так и в заявляемом техническом решении. Выход за оптимальные концентрации в заявляемом решении приводит к ухудшению результатов - в нижнем пределе концентрации хлорида рубидия нет преимуществ перед прототипом, в верхнем пределе сокращается время постановки, однако недопустимо увеличивается % ложноположительных результатов, превышающий таковой даже в прототипе.
Таким образом, из приведенных примеров конкретного выполнения видны преимущества заявляемого изобретения в сравнении с прототипом по снижению времени постановки анализа и уменьшению количества ложноположительных результатов анализа.
Изобретение относится к медицине и касается способа иммунологического анализа, включающего адсорбцию биоспецифических лигандов на поверхность частиц коллоидных растворов гексацианферрата железа (II) (III), последующее их соединение с подлежащим тестированию биоматериалом в разведенном водном солевом растворе, где в качестве водного солевого раствора используют или водный раствор хлорида рубидия, или водный раствор хлорида цезия. Изобретение обеспечивает уменьшение времени постановки реакции и уменьшение процента ложнопозитивных результатов. 8 пр., 8 табл.
Способ иммунологического анализа, включающий адсорбцию биоспецифических лигандов на поверхность частиц коллоидных растворов гексацианферрата железа (II) (III), последующее их соединение с подлежащим тестированию биоматериалом в разведенном водном солевом растворе, отличающийся тем, что в качестве водного солевого раствора используют или водный раствор хлорида рубидия, или водный раствор хлорида цезия.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| GUO M., et al., Expression and self-assembly in baculovirus of porcine enteric calicivirus capsids into virus-like particles and their use in an enzyme-linked immunosorbent assay for antibody detection in swine.J Clin Microbiol | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
Авторы
Даты
2017-04-13—Публикация
2016-04-13—Подача