Область техники
Настоящее изобретение относится к генной инженерии, биотехнологии, микробиологической и медицинской промышленности, в частности к способу получения альфа-фетопротеина (АФП) человека с использованием штаммов дрожжей Saccharomyces cerevisiae, содержащих рекомбинантный ген АФП, содержащий так называемые "медленные" (редкие) кодоны, кодирующие лейцин.
Описание предшествующего уровня техники
Альфа-фетопротеин (АФП) - основной компонент эмбриональной сыворотки крови млекопитающих, который синтезируется висцеральной эндодермой желточного мешка и клетками эмбриональной печени. Сразу после рождения уровень АФП в сыворотке резко снижается, и его экспрессия практически не определяется у взрослых здоровых особей (Deutsch, H.F. (1991) Adv. Canс. Res. 56, 253-312). Синтез АФП возобновляется при возникновении опухолей печени и герминогенных тератобластом и в меньшей степени - при химических и механических повреждениях печени, сопровождающихся регенерацией, например при остром вирусном гепатите или циррозе (Mizejewsky G.J. (2002) Expert Rev. Anticancer. Ther. 2: 89-115).
АФП человека - гликопротеин, состоящий из 590 аминокислот и содержащий около 4% углеводного компонента (Morinaga, T., et al. (1983) Рrос. Natl. Acad. Sci. U.S.A. 80, 4604-4608; Pucci, P. et al., (1991) Biochemistry 30, 5061-5066). Одно из основных свойств АФП - нековалентная сорбция различных низкомолекулярных химических веществ, таких как полиненасыщенные жирные кислоты, стероидные гормоны, металлы, ретиноиды, гидрофобные антибиотики и другие (Aussel, С. & Masseyeff, R. (1994) Biochem. Biophys. Res. Commun. 119: 1122-1127; Deutsch H.F. (1994) J. Tumor Marker Oncol. 9: 11-14.). На ранних стадиях эмбрионального развития АФП заменяет альбумин в качестве транспортного средства для жирных кислот и других низкомолекулярных веществ (Deutsch, H.F. (1991) Adv. Canс. Res. 56, 253-312).
Молекула АФП состоит из трех глобулярных структурных доменов, скрепленных 15 межцепьевыми дисульфидными связями, что существенно затрудняет процесс сборки третичной структуры белка (Morinaga, T., et al. (1983) Proc. Natl. Acad. Sci. U.S.A. 80, 4604-4608; Pucci, P. et al. (1991) Biochemistry 30, 5061-5066). Кроме того, важным структурным элементом молекулы АФП является карбогидратный компонент, который обеспечивает правильную рецепцию и функционирование молекулы (Deutsch, H.F. (1991) Adv. Canс. Res. 56, 253-312).
Кроме полипептидной цепи, состоящей из 590 аминокислотных остатков, в структуру молекулы сывороточного эмбрионального АФП или секретируемого клетками гепатокарциномы входит одна олигосахаридная группа, связанная с аспарагином по N-типу гликозилирования (Yamashita К. et al. (1993) Cancer Res. 53: 2970-2975). Структура олигосахаридной цепи АФП гетерогенна и зависит от различных факторов: стадии развития гепатокарциномы или стадии развития эмбриона. Олигосахариды влияют на структурные свойства молекулы АФП, входят в состав антигенных детерминант и рецептор-связывающих центров (Deutsch, H.F. (1991) Adv. Canс. Res. 56, 253-312). В отличие от сывороточного АФП, рекомбинантный АФП, экспрессированный в бактериальных клетках, негликозилирован, что является характерным отличием продукта, охарактеризованного в работах Murgita (US Patents 6,331,611; 6,627,440; 6,416,734), и, следовательно, обладает структурными и функциональными свойствами, отличающими его от сывороточного аналога и также от рекомбинантного АФП, экспрессированного в дрожжевых системах. Известно, что при экспрессии геторологичных белков в дрожжах осуществляется их гликозилирование по тем же аминокислотным остаткам, как и у сывороточного аналога, но структура самих олигосахаридов сильно различается по составу, длине и разветвленности цепи, что также предопределяет определенные различия в структурных и функциональных свойствах соответствующих белков (Hard К. et al. (1989) FEBS Lett. 248:111).
АФП обладает рядом функциональных свойств, которые в настоящее время интенсивно исследуются. Классические представления об АФП как об аналоге эмбрионального сывороточного альбумина в настоящее время дополняются данными о способности АФП осуществлять регуляцию роста, развития и запрограммированной гибели клеток (Mizejewsky G.J. (2002) Expert Rev. Anticancer. Ther. 2: 89-115). В частности, было показано, что рекомбинантный АФП, аналогично сывороточному и культуральному аналогу, способен подавлять рост эстроген-зависимых опухолевых и нормальных тканей (Bennett, J.A. et al., (1997) Breast Cancer Res. Treat. 45, 169-179; Bennet, J.A. et al., (1998) Clinical Cancer Research, 4, 2877-2884). Недавно было установлено, что онкосуппрессивная активность АФП осуществляется по механизму активации апоптоза, характеризующегося типичными морфологическими изменениями, арестом роста, цитотоксичностью и ДНК-фрагментацией (Semenkova, L.N. (1997) Tumor Biol. 18, 261-274; Dudich E.I., et al. (1998) Tumor Biol. 19, 30-40; Dudich E.I. et al. (1999) Eur. J. Biochem. 266: 1-13; Semenkova, L., et al. (2003) Eur. J. Biochem. 70: 4388-4399).
Более ранние исследования показали способность АФП регулировать дифференцировку и активацию иммунных клеток. В частности, АФП способен оказывать подавляющее действие на активированные алло- или аутоантигенами иммунные клетки и ингибировать экспрессию генов ряда цитокинов (Yamashita, К. et al. (1993) Cancer Res. 53, 2970-2975; Патент США №5,965,528). С другой стороны, АФП оказывает выраженное стимулирующее действие на рост незрелых клеток костного мозга, стволовых клеток и эмбриональных клеток (Dudich E.I., et al. (1998) Tumor Biol. 19, 30-40; Патент США №6,627,440).
Эти свойства АФП, а также повышенная селективность поглощения АФП раковыми клетками (in vivo) (Uriel J. et al. (1989) in Mizejewsky G.I., Jakobson H.I. (eds): Biological Properties of Alpha-Fetoprotein. Boca Raton, CRC Press, vol. 2:103-117) являются основой для использования АФП в медицине в качестве терапевтического препарата при лечении аутоиммунных (Патент США №5,965,528) и онкологических заболеваний (Патент США №6,416,734; Mizejewsky G.J. (2002) Expert Rev. Anticancer. Ther. 2: 89-115). Кроме того, традиционно АФП выступает в качестве онкоэмбрионального маркера, который используется при диагностике онкологических заболеваний и патологии эмбрионального развития (Deutsch, H.F. (1991) Adv. Canс. Res. 56, 253-312). Однако применение природного АФП в качестве лекарственного средства технологически невозможно из-за дефицита сырья и ограничения по применению продуктов животного происхождения в Фарминдустрии. Ранее были опубликованы данные об экспрессии и очистке рекомбинантного АФП (рАФП), полученного при культивировании различных микроорганизмов (Yamamoto R., et al. (1990) LifeSciences, 46:1679-1686; NishiS., et al. (1988) J. Biochem. 104: 968-972 Патент США №5,206,153; Патент США №6,331,611). Так, внутриклеточная продукция рАФП человека была получена в Saccharomyces cerevisiae (Yamamoto R., et al. (1990) LifeSciences, 46:1679-1686; Патент США №5,206,153) и Escherichiacoli (Патент США №6,331,611; Boismenu R., et al. (1997) Protein Expression and Purification. 10:10-26). Было показано, что рекомбинантный АФП, экспрессированный в Escherichia coli, сохраняет иммунорегуляторную и онкосуппрессивную активность эмбрионального аналога (Boismenu R., et al. (1997) Protein Expression and Purification. 10:10-26; Bennett, J.A. et al. (1997) Breast Cancer Res. Treat. 45, 169-179). Основным недостатком этих экспрессионных систем является неспособность к секреции гетерологичного белка и крайне низкий уровень его продукции. Кроме того, получение целевого продукта из биомассы рекомбинантных штаммов-продуцентов требовало проведения дополнительных процедур денатурации и ренатурации, что приводило к значительному снижению выхода продукта и, как следствие, значительно повышало его себестоимость. Также в случае использования бактериальных экспрессионных систем немаловажной является проблема загрязнения продукта липополисахаридами оболочки, обладающими известной эндотоксической активностью.
Наиболее близким техническим решением для данного изобретения является штамм-продуцент АФП человека, описанный авторами настоящего изобретения в следующей работе: Dudich E. et al. (2012) Protein Expression and Purification. 84:94-107. В статье описано создание высокоэффективных штаммов Saccharomyces cerevisiae YBS247+/AFP и YBS247+/AFPmut - продуцентов рекомбинантного АФП человека в секретируемой форме с нативным типом гликозилирования или в виде негликозилированного мутанта, трансформированных плазмидой, содержащей ген АФП человека, в котором все кодоны оптимизированы для экспрессии в клетках Saccharomyces cerevisiae. Было также показано, что введение дополнительных шаперонов - белка Bip, участвующего в корректном замыкании S-S связей, и дисульфид изомеразы (PDI) значительно увеличивают выход АФП человека при гетерологичной экспрессии в дрожжах Saccharomyces cerevisiae. Также было показано, что негликозилированный мутант АФП человека продемонстрировал более низкую активность в подавлении опухоли в сравнении с нативным АФП, но при этом он обладает более высокой статистически значимой способностью индуцировать подавление (invitro) пролиферации лимфоцитов в сравнении с гликозилированными рекомбинантным и нативным АФП человека. Также было показано, что гликозилирование рекомбинантного АФП человека необходимо для его эффективного фолдинга и секреции. При этом присутствие олигосахарида несущественно для активности по подавлению опухоли, однако существенно для его иммунорегуляторной активности, что свидетельствует о вовлечении различных молекулярных механизмов в эти типы биологической активности АФП человека.
Однако в настоящее время существует убедительная необходимость в разработке новых рекомбинантных штаммов, обладающих способностью к повышенной продукции рекомбинантного АФП человека за счет повышенной экспрессии гетерологичного белка с обеспечением внутриклеточной сборки нативной третичной структуры и последующей секреции целевого продукта в культуральную жидкость.
Краткое описание настоящего изобретения
Целью настоящего изобретения является дальнейшее совершенствование технологии систем экспрессии и секреции рекомбинантного АФП человека и получение новых рекомбинантных штаммов, обладающих способностью к повышенной продукции рекомбинантного АФП человека.
Эта цель была достигнута за счет создания рекомбинантного гена АФП человека, в котором все кодоны оптимизированы для экспрессии в клетках Saccharomyces cerevisiae, за исключением так называемых "медленных" кодонов, кодирующих лейцин. Использование такого гена в клетках Saccharomyces cerevisiae - продуцентах АФП человека позволило увеличить уровень продукции указанного целевого белка как в случае негликозилированного варианта АФП, так и в случае гликозилированного варианта АФП. Таким образом, было совершено настоящее изобретение.
Одним аспектом настоящего изобретения является предоставление рекомбинантного фрагмента ДНК, кодирующего белок, обладающий активностью альфа-фетопротеина (АФП) человека, оптимизированного для экспрессии в клетках дрожжей Saccharomyces cerevisiae, в котором указанный фрагмент ДНК содержит "медленные" кодоны, кодирующие L-аминокислотные остатки лейцина, соответствующие положениям 13, 24, 52, 68, 72, 79, 86, 107, 119, 160, 161, 194, 199, 200, 239, 307, 311, 315, 332, 346, 352, 361, 362, 372, 382, 392, 399, 403, 408, 445, 450, 451, 465, 496, 534, 537, 549, 560, 588 в нативной последовательности АФП человека.
Еще одним аспектом настоящего изобретения является предоставление описанного выше фрагмента ДНК, который кодирует АФП с нативным сайтом гликозилирования, соответствующим положению 232 в нативной последовательности АФП человека, представляющим собой L-аминокислотный остаток аспарагина, либо без него.
Еще одним аспектом настоящего изобретения является предоставление описанного выше фрагмента ДНК, который характеризуется последовательностью нуклеотидов, представленной в Перечне последовательностей под номером SEQ ID NO: 9 или 10.
Еще одним аспектом настоящего изобретения является предоставление рекомбинантной плазмиды для экспрессии рекомбинантного АФП человека в клетках Saccharomyces cerevisiae, в следующей последовательности содержащей промотор GAL1, пре-про участок секреции MFα, описанный фрагмент ДНК, участок терминации транскрипции гена CYC1 дрожжей, фрагмент Ту8 гена ТуА, ген устойчивости к ампициллину, фрагмент Ту8 гена ТуА и маркер селекции URA3 дрожжей.
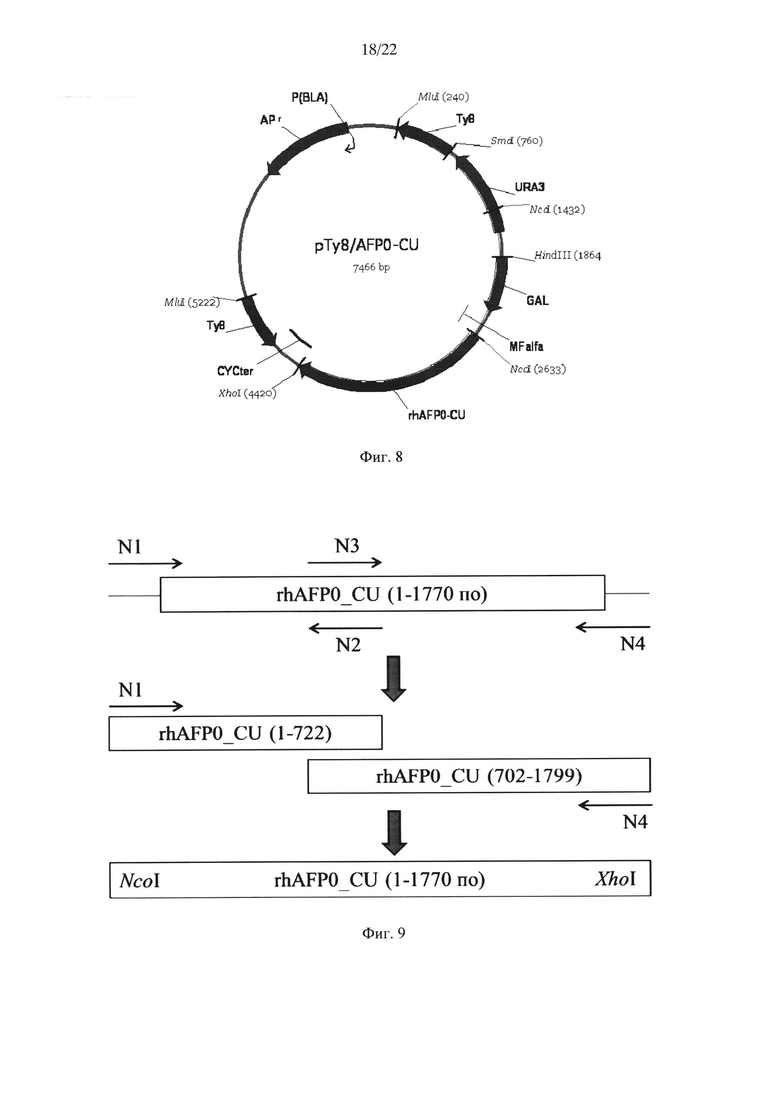
Еще одним аспектом настоящего изобретения является предоставление описанной выше плазмиды, которая является плазмидой pTy8/rhAFPmut_CU или pTy8/rhAFP_CU, представленной на Фиг. 8 и 10 соответственно.
Еще одним аспектом настоящего изобретения является предоставление клетки Saccharomyces cerevisiae, трансформированной описанной выше плазмидой и обладающей способностью к секреции рекомбинантного АФП человека в культуральную жидкость.
Еще одним аспектом настоящего изобретения является предоставление описанной выше клетки, при этом указанной клеткой является клетка штамма Saccharomyces cerevisiae YBS247+/AFPmut_CU или клетка штамма Saccharomyces cerevisiae YBS247+/AFP_CU.
Еще одним аспектом настоящего изобретения является предоставление способа получения рекомбинантного АФП человека, содержащего стадии культивирования описанных выше клеток в питательной среде и выделения рекомбинантного АФП человека из культуральной жидкости.
Еще одним аспектом настоящего изобретения является предоставление описанного выше способа, в котором используют клетки штамма Saccharomyces cerevisiae YBS247+/AFPmut_CU или клетки штамма Saccharomyces cerevisiae YBS247+/AFP_CU.
Краткое описание фигур
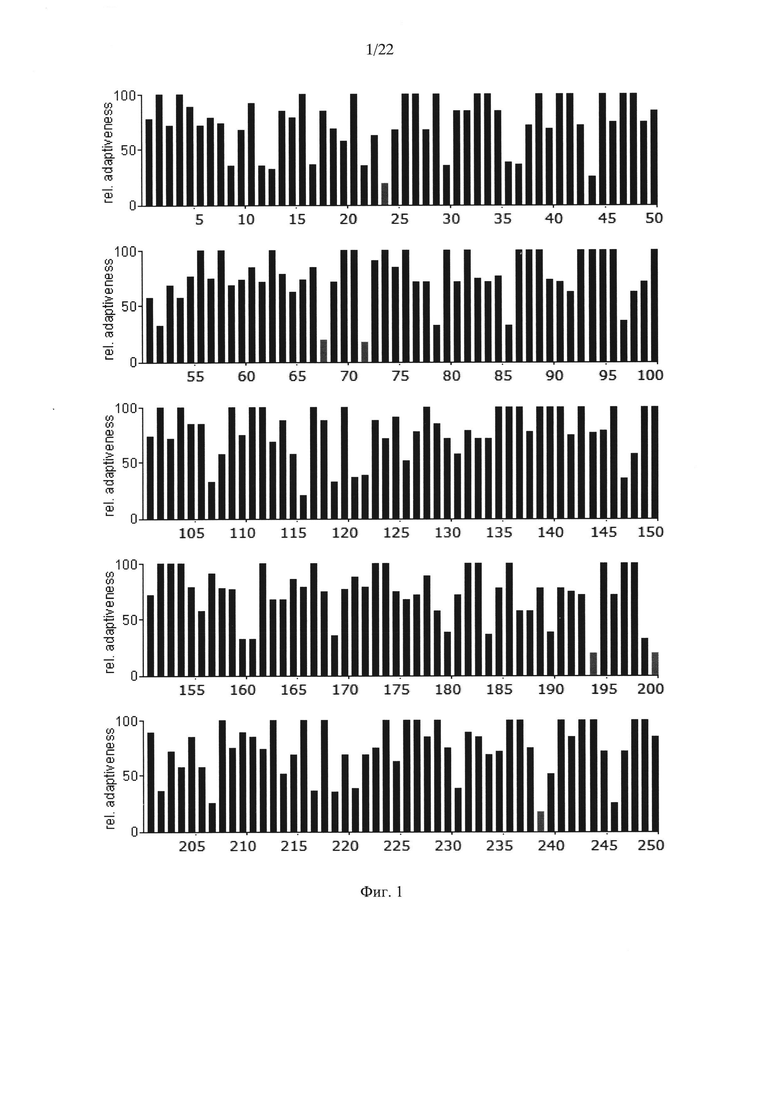
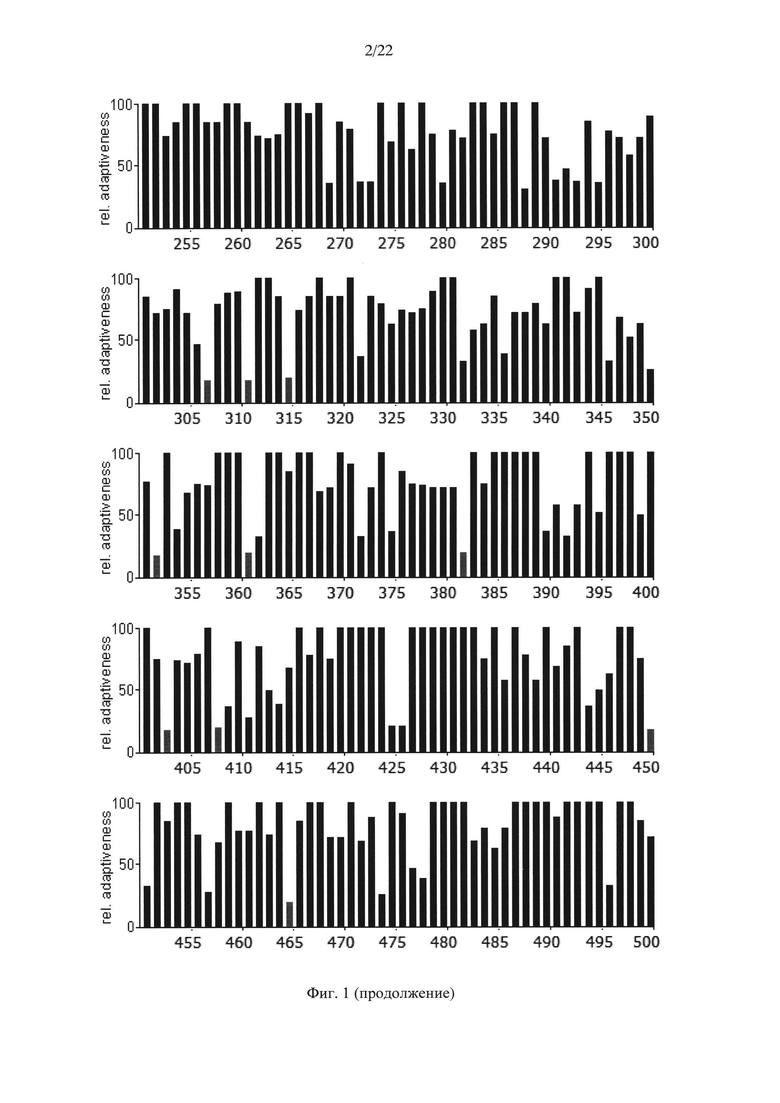
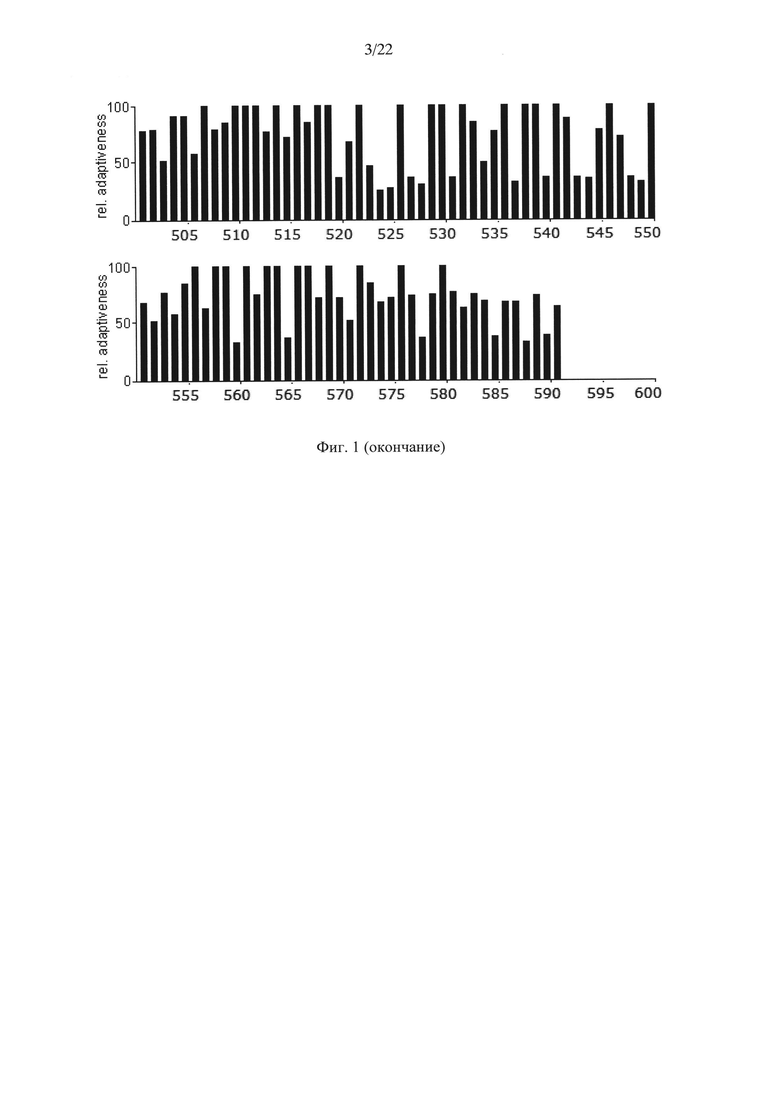
На Фиг. 1 показаны результаты анализа кодонов нуклеотидной последовательности гена АФП человека по частоте встречаемости "быстрых" и "медленных" кодонов для клеток человека. Серые столбики соответствуют частоте встречаемости кодонов ниже 20%.
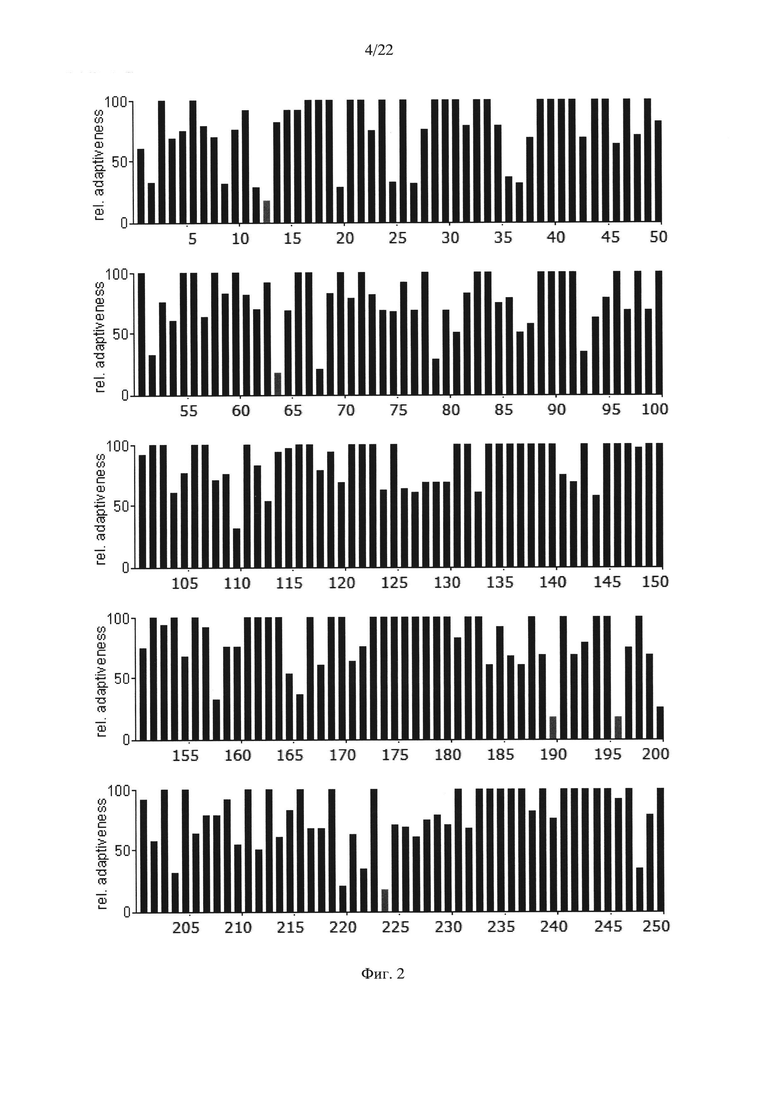
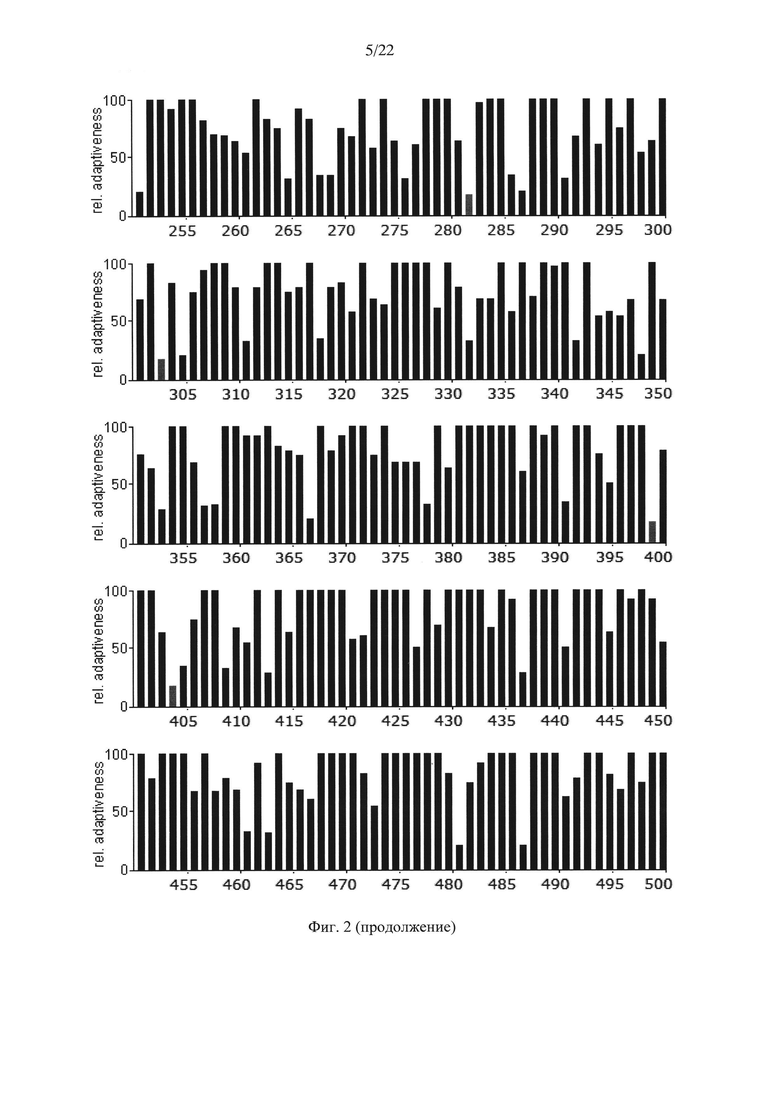
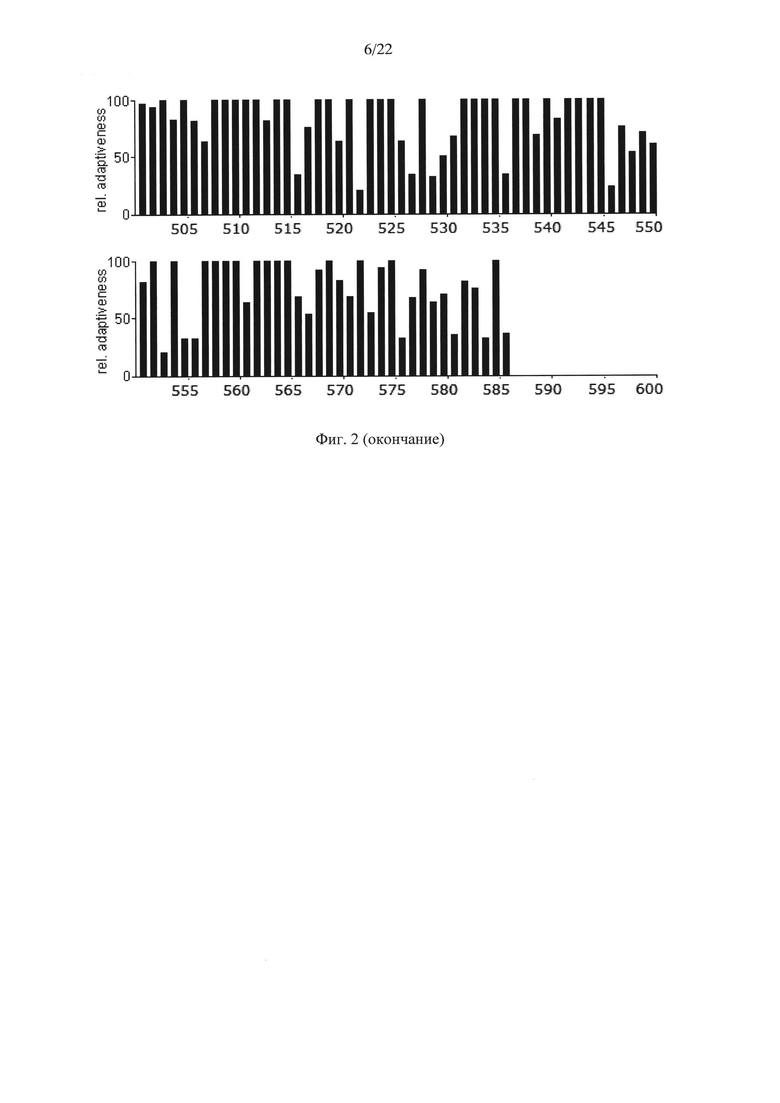
На Фиг. 2 показаны результаты анализа кодонов нуклеотидной последовательности гена АФП мыши Мus. musculus по частоте встречаемости "быстрых" и "медленных" кодонов для клеток мыши. Серые столбики соответствуют частоте встречаемости кодонов ниже 20%.
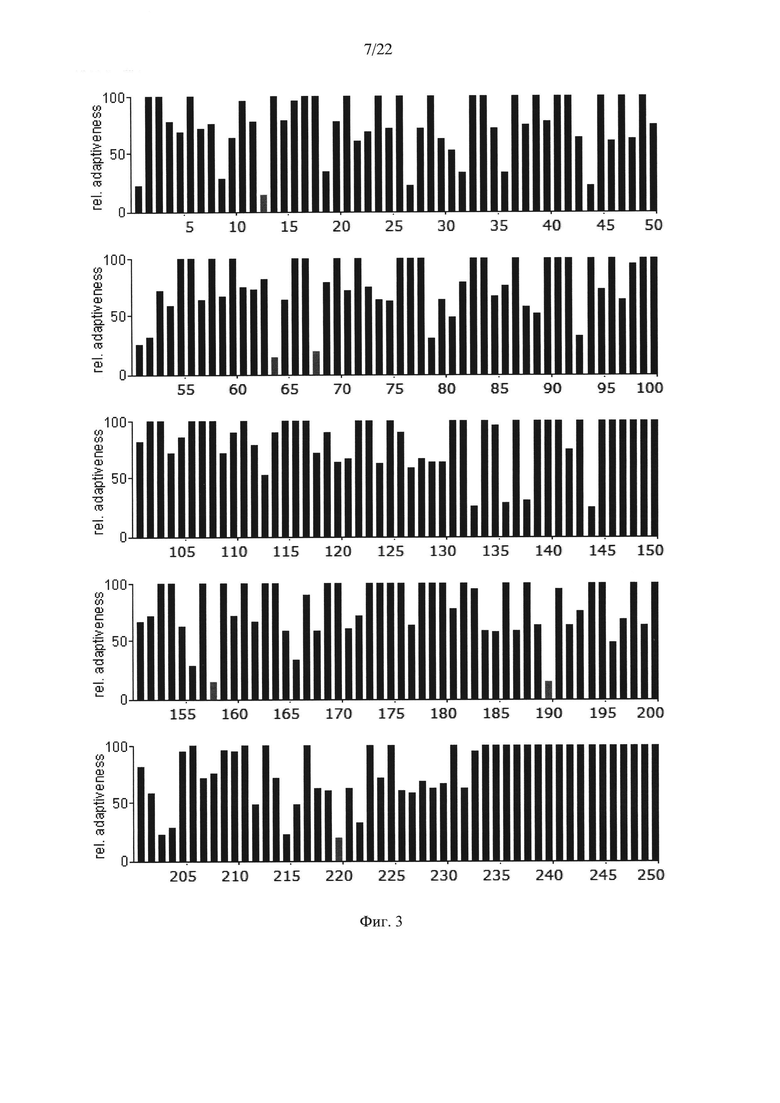
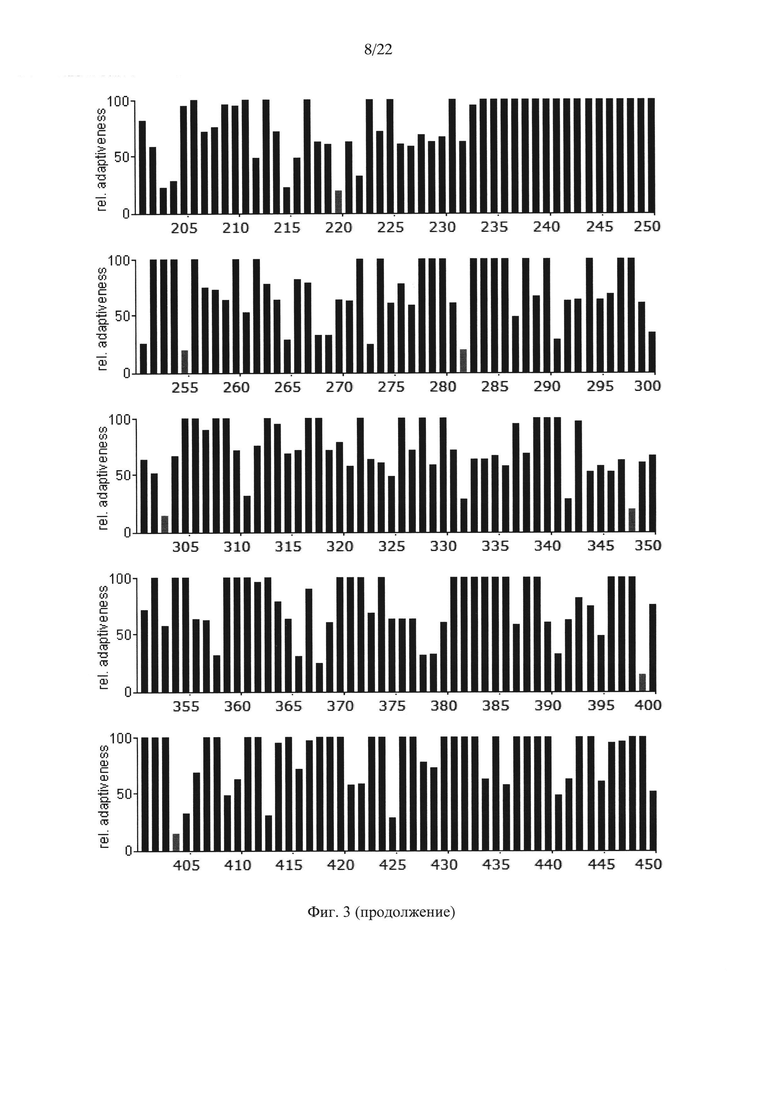
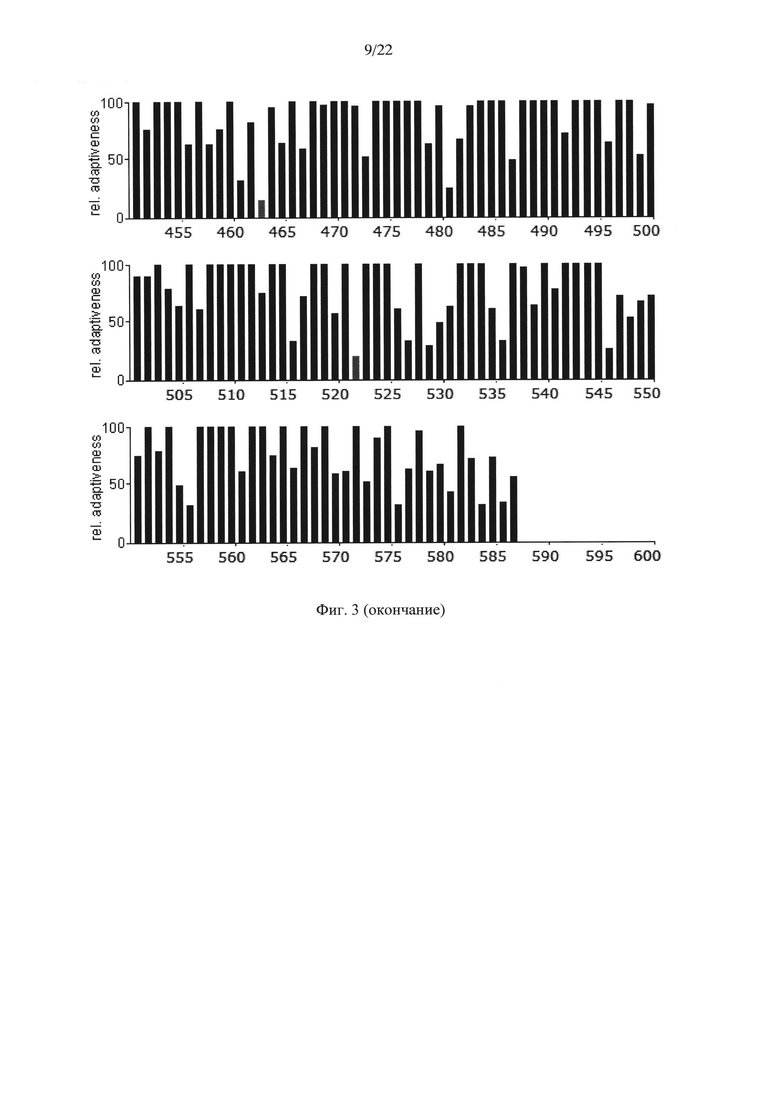
На Фиг. 3 показаны результаты анализа кодонов нуклеотидной последовательности гена АФП крысы Rattusnorvegicus по частоте встречаемости "быстрых" и "медленных" кодонов для клеток крысы. Серые столбики соответствуют частоте встречаемости кодонов ниже 20%.
На Фиг. 4 показаны результаты анализа аминокислотных последовательностей белка АФП человека, мыши и крысы. В рамках указаны аминокислоты, представленные "медленными" кодонами с частотой встречаемости ниже 40%, знаком ✖ помечены аминокислоты, представленные "медленными" кодонами с частотой встречаемости ниже 20%.
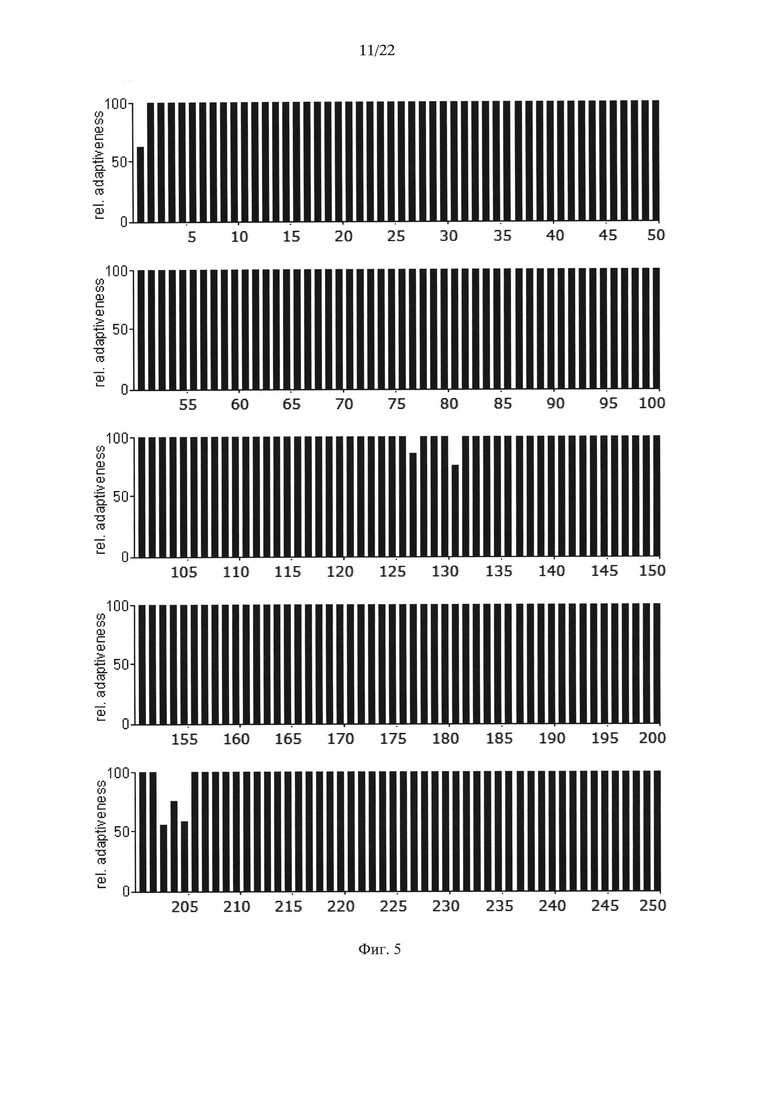
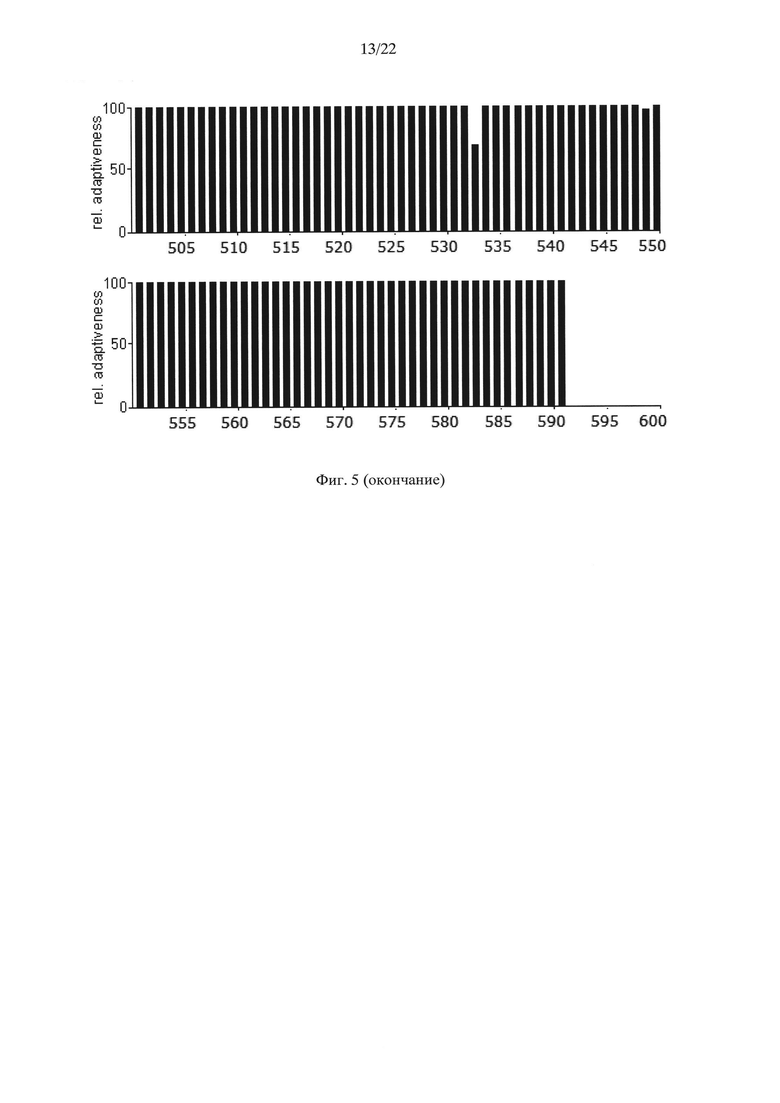
На Фиг. 5 показаны результаты анализа нуклеотидной последовательности гена АФП человека (rhAFP0), содержащей оптимальные для его экспрессии в клетках дрожжей Saccharomyces cerevisiae кодоны, по частоте встречаемости "быстрых" и "медленных" кодонов для клеток дрожжей Saccharomyces cerevisiae.
На Фиг. 6 показаны последовательность аминокислот дегликозилированного (замена N232Q, отмечено подчеркиванием) АФП человека (rbAFP0_CU) и соответствующая последовательность нуклеотидов гена АФП, содержащая оптимальные ("быстрые") для экспрессии в клетках дрожжей Saccharomyces cerevisiae кодоны с заменами на "медленные" кодоны лейцина. Произведенные замены выделены темным фоном.
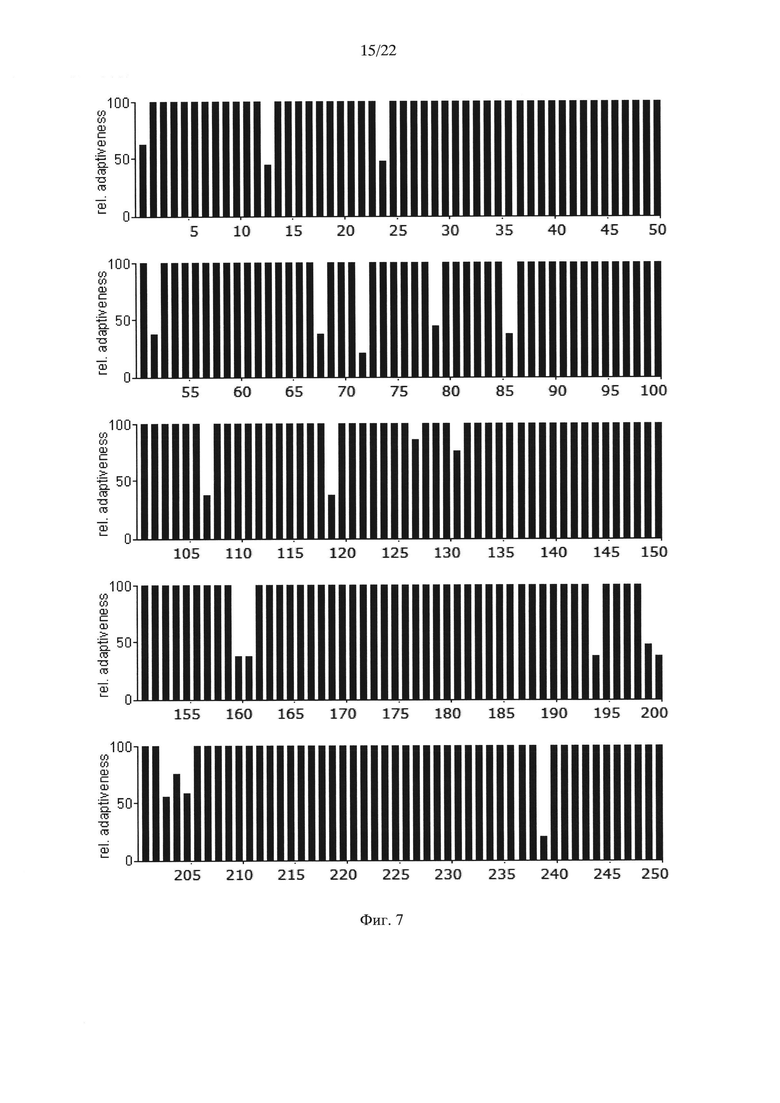
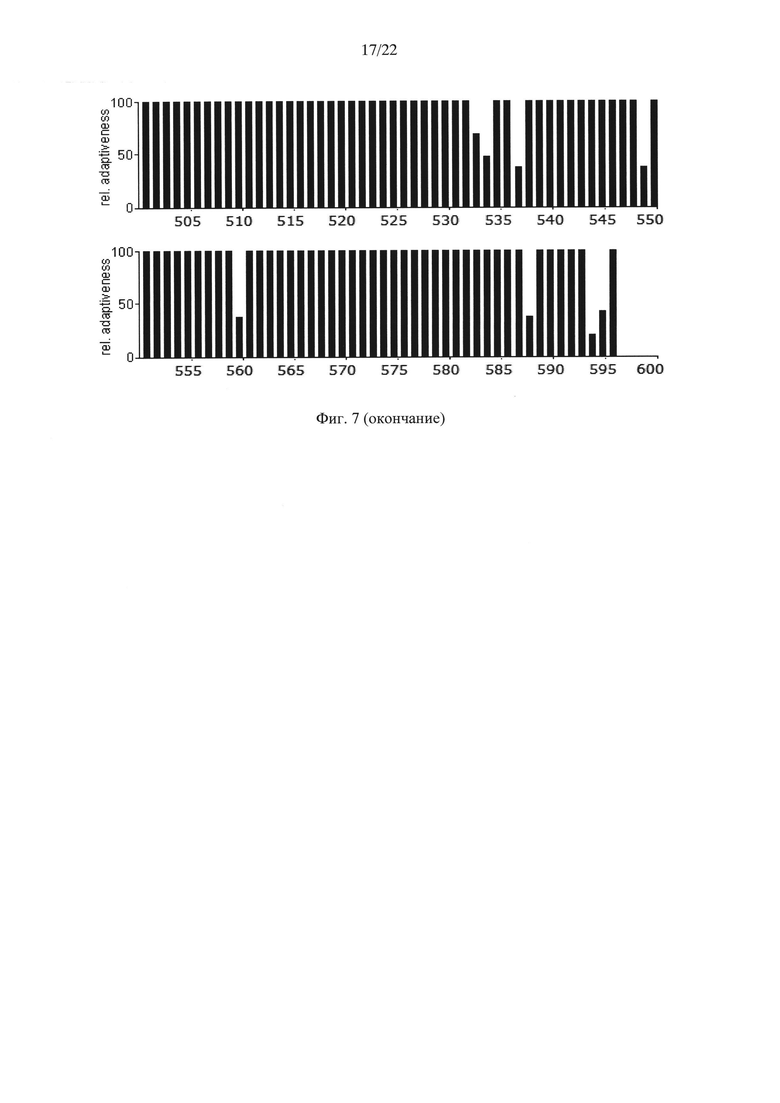
На Фиг. 7 показаны результаты анализа нуклеотидной последовательности гена АФП человека, содержащей оптимальные для его экспрессии в клетках дрожжей Saccharomyces cerevisiae кодоны с заменами на "медленные" кодоны лейцина, по частоте встречаемости "быстрых" и "медленных" кодонов для клеток дрожжей Saccharomyces cerevisiae.
На Фиг. 8 показана структура экспрессионной плазмиды pTy8/rhAFP0_CU. Условные обозначения: GAL1 - промотор гена GAL дрожжей, MFalfa - пре-про участок секреции MFα, CYC1 - участок терминации транскрипции гена CYC1 дрожжей, Ту8 - фрагмент Ту8 гена ТуА, APR - ген устойчивости к ампициллину, URA3 - маркер селекции URA3 дрожжей.
На Фиг. 9 показана стратегия сайт-направленного мутагенеза для восстановления сайта гликозилирования Q→N в положении 232. В качестве матрицы использован ген рекомбинантного дегликозилированного АФП (rhAFP0_CU).
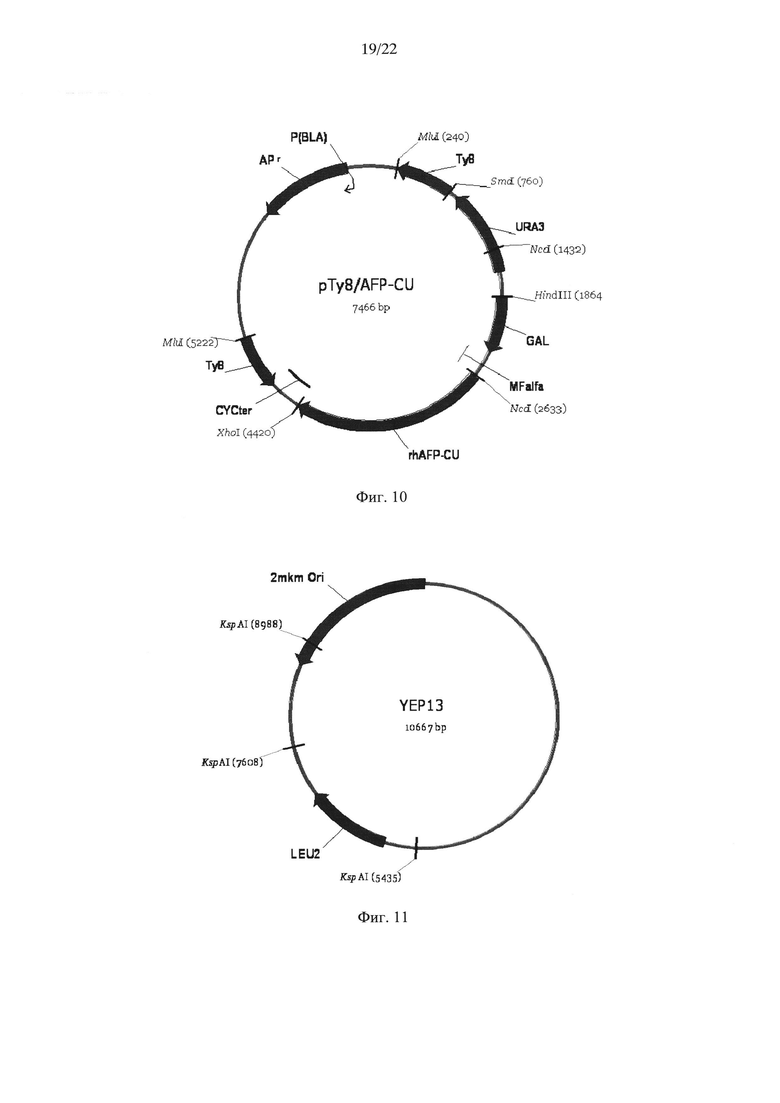
На Фиг. 10 показана структура экспрессионной плазмиды pTy8/rhAFP_CU. Условные обозначения аналогичны обозначениям на Фиг. 8.
На Фиг. 11 показана структура плазмиды Yepl3.
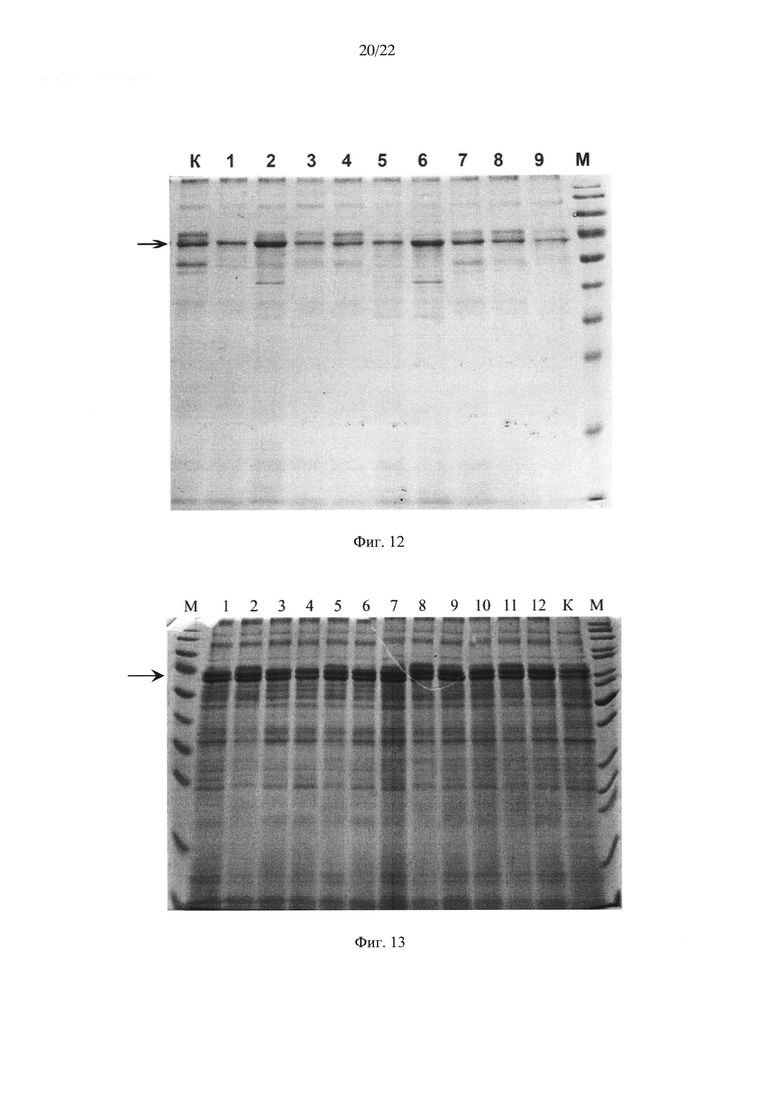
На Фиг. 12 показан электрофорез в денатурирующих условиях культуральной жидкости дрожжей Saccharomyces cerevisiae. К (контроль) - штамм YBS247+/AFPmut, содержащий ген дегликозилированного АФП со всеми оптимизированными кодонами; 1-9 - штаммы-трансформанты YBS247+/AFPmut_CU, содержащие ген дегликозилированного АФП с "медленными" кодонами, кодирующими лейцин, М - маркеры молекулярного веса Fermentas #SM0671, стрелкой обозначена молекулярная масса АФП.
На Фиг. 13 показан электрофорез в денатурирующих условиях культуральной жидкости дрожжей Saccharomyces cerevisiae (К (контроль) - штамм YBS247+/AFP, содержащий ген гликозилированного АФП со всеми оптимизированными кодонами; 1-12 - штаммы-трансформанты YBS247+/AFP CU, содержащие ген гликозилированного АФП с "медленными" кодонами, кодирующими лейцин, М-маркеры молекулярного веса Fermentas #SM0671, стрелкой обозначена молекулярная масса АФП.
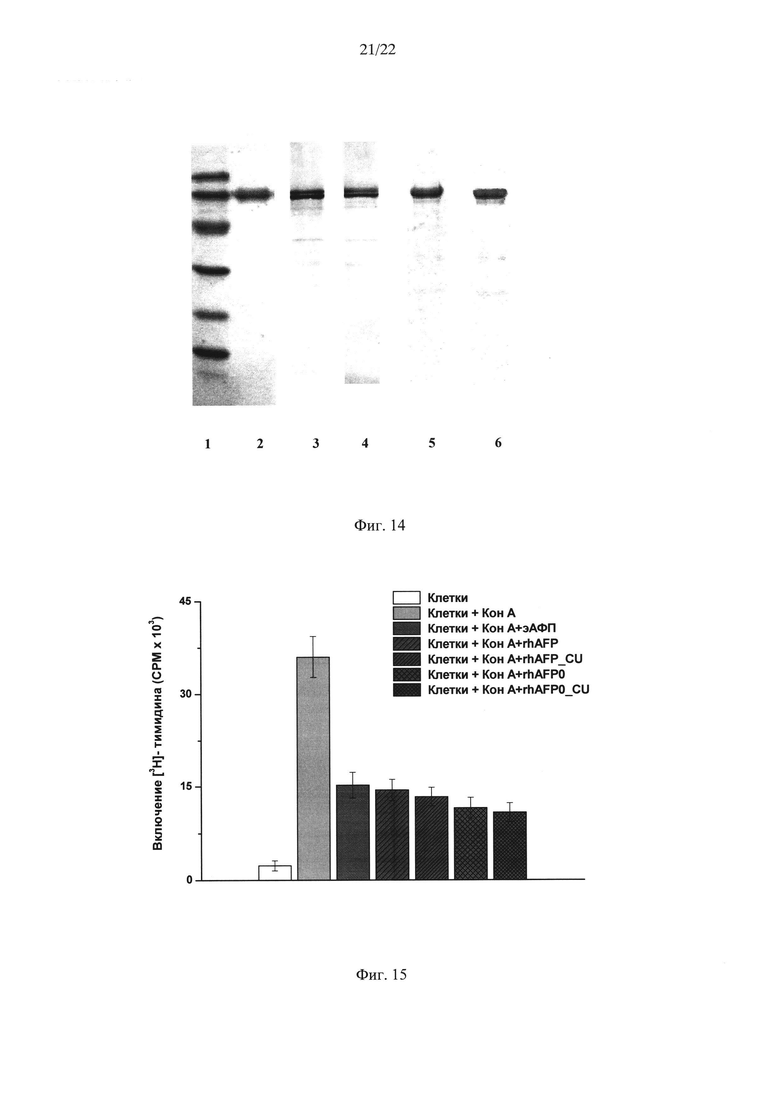
На Фиг. 14 показан электрофорез в денатурирующих условиях различных образцов АФП человека. Маркерные белки (94, 67, 43, 30, 20 кД). 1 - эмбриональный АФП (эАФП); 2 - гликозилированный рекомбинантный человеческий АФП (rhAFP), выделенный из культуральной жидкости продуцента Saccharomyces cerevisiae YBS247+/AFP; 3 - гликозилированный рекомбинантный человеческий АФП (rhAFP_CU), выделенный из культуральной жидкости продуцента Saccharomyces cerevisiae YBS247+/AFP_CU; 4 - дегликолизированный рекомбинантный человеческий АФП (rhAFPO), выделенный из культуральной жидкости продуцента Saccharomyces cerevisiae YBS247+/AFPmut; 5 - дегликолизированный рекомбинантный человеческий АФП (rhАFР0_СU), выделенный из культуральной жидкости продуцента Saccharomyces cerevisiae YBS247+/AFPmut_CU.
На Фиг. 15 показано влияние различных образцов АФП на конканавалин А -индуцированную пролиферацию Т-клеток селезенки мыши. Т-клетки инкубировали с эмбриональным АФП (эАФП); гликозилированным рекомбинантным человеческим АФП (rhAFP), выделенным из культуральной жидкости продуцента Saccharomyces cerevisiae YBS247+/AFP; гликозилированным рекомбинантным человеческим АФП (rhAFPCU), выделенным из культуральной жидкости продуцента Saccharomyces cerevisiae YBS247+/AFPCU; дегликолизированным рекомбинантным человеческим АФП (rhAFPO), выделенным из культуральной жидкости продуцента Saccharomyces cerevisiae YBS247+/AFPmut, и дегликолизированным рекомбинантным человеческим АФП (rhAFPOCU), выделенным из культуральной жидкости продуцента Saccharomyces cerevisiae YBS247+/AFPmut_CU. Концентрация каждого из образцов АФП в культуральной среде соответствовала 300 мкг/мл, пролиферацию клеток определяли по включению [3Н]-тимидина. Данные представлены в виде среднего значения ± среднеквадратичное отклонение одного из экспериментов.
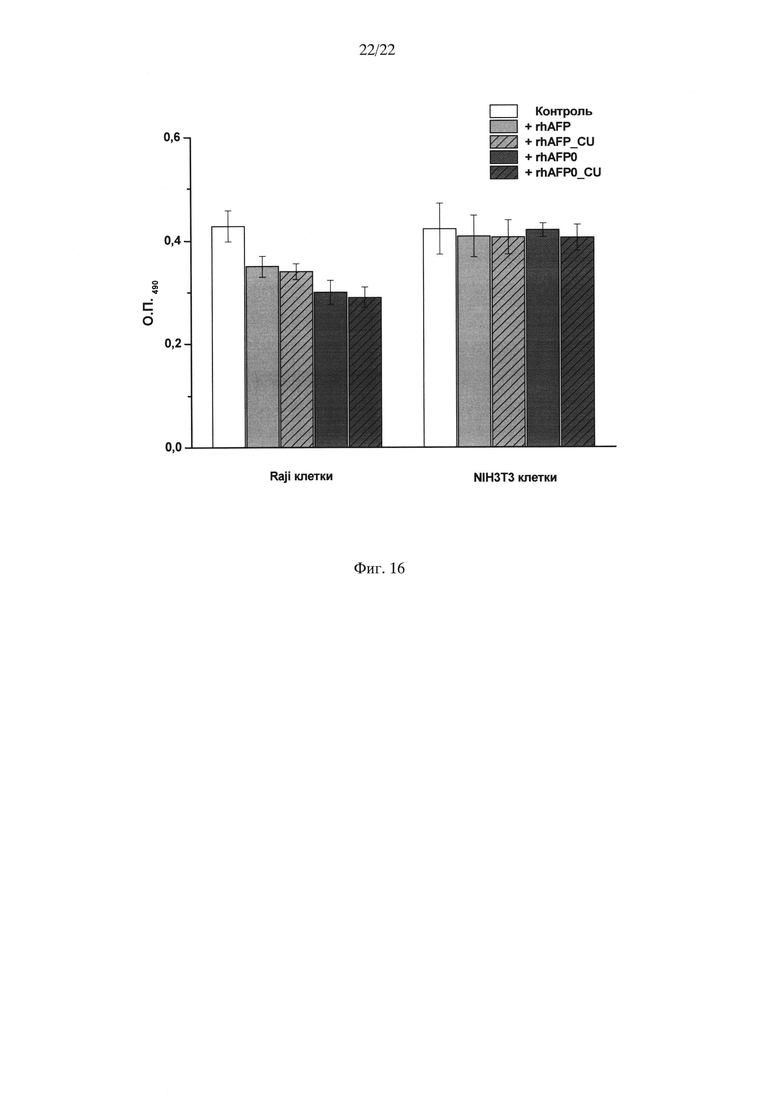
На Фиг. 16 показано влияние различных образцов рчАФП на пролиферацию опухолевых и нормальных клеток. Клетки Raji и NIH3T3 инкубировали с гликозилированным рекомбинантным человеческим АФП (rhAFP), выделенным из культуральной жидкости продуцента Saccharomyces cerevisiae YBS247+/AFP; гликозилированным рекомбинантным человеческим АФП (rhAFP CU), выделенным из культуральной жидкости продуцента Saccharomyces cerevisiae YBS247+/AFP_CU; дегликолизированным рекомбинантным человеческим АФП (rhAFPO), выделенным из культуральной жидкости продуцента Saccharomyces cerevisiae YBS247+/AFPmut, и дегликолизированным рекомбинантным человеческим АФП (rhAFPOCU), выделенным из культуральной жидкости продуцента Saccharomyces cerevisiae YBS247+/AFPmut_CU. Концентрация каждого из образцов рчАФП в культуральной среде соответствовала 300 мкг/мл. Клетки инкубировали с рчАФП в течение 48 часов, пролиферативную активность клеток определяли с помощью коммерческого набора CellTiter 96 Aqueous Non-Radioactive Cell Proliferation Assay (Promega). Данные представлены в виде среднего значения ± среднеквадратичное отклонение одного из экспериментов.
Подробное описание настоящего изобретения
Известно, что в большинстве организмов эффективность синтеза белков хорошо коррелирует с частотами встречаемости кодонов в открытых рамках считывания. Этот феномен считается следствием накопления в генах, кодирующих эффективно синтезируемые белки, наиболее быстро «читаемых» кодонов. Скорость считывания кодона связывается с концентрацией соответствующих фракций тРНК. В результате анализа динамических моделей, описывающих процесс трансляции мРНК с учетом данной гипотезы, учеными был выявлен ряд закономерностей кодонного состава генов, которые должны формироваться в ходе эволюции. Одним из следствий являлся вывод о закономерности разделения кодонов по скоростям считывания их рибосомой и повышения доли «быстрых» кодонов в составе генов по мере возрастания эффективности их экспрессии (James F Kane. Current Opinion in Biotechnology 1995, 6:494-500).
Несмотря на это авторами настоящего изобретения было высказано предположение о том, что в случае гетерологичной экспрессии белков со сложной структурой может быть оправдано воссоздание профиля кодонов нуклеотидной последовательности гена дикого типа. С этой целью авторами настоящего изобретения был произведен анализ последовательностей нуклеотидов нативного гена АФП человека (SEQ ID NO: 1), мыши (SEQ ID NO: 3) и крысы (SEQ ID NO: 5) с точки зрения "оптимальности" их состава (Фиг. 1-3). Последовательности аминокислот АФП человека, мыши и крысы приведены в SEQ ID NO: 2, SEQ ID NO: 4 и SEQ ID NO: 6 соответственно.
Анализ представленных данных (Фиг. 1-4) подтверждает ранее выдвинутую гипотезу о важности "медленных" кодонов, поскольку профиль распределения кодонов совпадает у разных организмов. На основании проведенного исследования были выявлены следующие закономерности:
- несмотря на невысокую степень гомологии представленных последовательностей (для мыши - 65,8%, для крысы - 65,1%) подавляющее большинство аминокислот, представленных "медленными" кодонами (с частотой встречаемости менее 25%), являются лейцином;
- практически все лейцины располагаются в консервативных участках аминокислотных последовательностей (Фиг. 4);
- часто встречаются кластеры, состоящие из нескольких лейцинов, расположенных подряд на незначительном удалении друг от друга, кодируемых "медленными" кодонами (распространенность кодонов 20-25%) [graphical codon usage analyser, http://gcua.schoedl.de/]. В частности, лейцины в положениях 68-72; 194-199-200; 307-311-315; 399-403-408; 450-451 с частотой встречаемости менее 20% и 160-161; 361-362, 534-537 с частотой встречаемости менее 25-30%;
- расположение "медленных" кодонов в 90% случаев дублируется у разных организмов.
Из литературных данных известно, что белок АФП обладает довольно сложной структурой - доменная организация, наличие множественных цистеиновых связей, обуславливающей сложный фолдинг данного белка. В статье Dudich E. et al. (2012) Protein Expression and Purification. 84:94-107, показано, что введение дополнительных шаперонов - белка Bip, участвующего в корректном замыкании S-S связей и дисульфид изомеразы (PDI), значительно увеличивают выход АФП человека при гетерологичной экспрессии в дрожжах Saccharomyces cerevisiae. Таким образом, наличие кластеров аминокислот, содержащих редко встречающиеся кодоны, по-видимому, необходимо для замедления скорости трансляции мРНК, кодирующей белок АФП в различных организмах.
Для подтверждения этого предположения в ранее синтезированный ген дегликозилированного (замена Ν232Q) ΑΦΠ человека rhAFP0 (Dudich E. et al. (2012) Protein Expression and Purification. 84:94-107; GenBank KP966106; SEQ ID NO: 7), содержащий оптимальные для дрожжей Saccharomyces cerevisiae "быстрые" кодоны (Фиг. 5), были внесены следующие замены "быстрых" кодонов "медленными" кодонами, кодирующими лейцин в местах, соответствующих лейцину в положениях 13, 24, 52, 68, 72, 79, 86, 107, 119, 160, 161, 194, 199, 200, 239, 307, 311, 315, 332, 346, 352, 361, 362, 372, 382, 392, 399, 403, 408, 445, 450, 451, 465, 496, 534, 537, 549, 560, 588 АФП человека. Последовательность нуклеотидов полученного гена дегликозилированного АФП человека (rhАfР0_СU), оптимизированного для экспрессии в дрожжах Saccharomyces cerevisiae, но содержащего "медленные" кодоны, кодирующие лейцин в указанных выше положениях, приведена в SEQ ID NO: 9 и на Фиг. 6. Результаты анализа последовательности нуклеотидов полученного гена с точки зрения "оптимальности" его состава для экспрессии в клетках дрожжей Saccharomyces cerevisiae приведены на Фиг. 7.
Также с целью увеличения продукции рекомбинантного гликозилированного АФП (rhAFP CU) в полученном ранее гене (SEQ ID NO: 9), содержащем оптимальные для экспрессии в клетках дрожжей Saccharomyces cerevisiae кодоны с заменами на "медленные" кодоны лейцина, была произведена замена Q на N в 232 положении, для возвращения нативного сайта гликозилирования. Стратегия сайт-направленного мутагенеза для восстановления сайта гликозилирования Q→N в положении 232АФП человека показана на Фиг. 9. В качестве матрицы использован ген рекомбинантного дегликозилированного АФП (rhAFP0_CU). Последовательность нуклеотидов полученного гена гликозилированного АФП человека, оптимизированного для экспрессии в дрожжах Saccharomyces cerevisiae, но содержащего "медленные" кодоны, кодирующие лейцин, приведена в SEQ ID NO: 10.
В рамках настоящего изобретения АФП человека как гликозилированный вариант, последовательность аминокислот которого приведена в SEQ ID NO: 2, таки дегликозилированный вариант, последовательность аминокислот которого приведена в SEQ ID NO: 8, может включать делецию, замену, вставку или добавление одной или нескольких аминокислот в одном или во множестве положений, при условии, что активность АФП человека не нарушена. Термин "активность АФП человека" означает активность белка по нековалентной сорбции различных низкомолекулярных химических веществ, таких как полиненасыщенные жирные кислоты, стероидные гормоны, металлы, ретиноиды, гидрофобные антибиотики и другие. Также известно, что натуральный АФП и его рекомбинантные аналоги проявляют свойства избирательного иммуносупрессора. Указанная иммунорегуляторная активность образцов рчАФП, выделенных из культуральной жидкости, может быть измерена с использованием классической реакции бласттрансформации лимфоцитов (Wang G.L. et al. (2006) Acta Pharmacol Sin., 27(4):437-46 или см. Пример 5).
Количество "несколько" аминокислот различается в зависимости от положения или типа аминокислотных остатков в третичной структуре белка. Это связано со следующими причинами. Некоторые аминокислоты имеют высокую степень гомологии друг с другом и поэтому такие изменения не очень влияют на третичную структуру белка. Следовательно, мутантный вариант АФП человека согласно настоящему изобретению может быть белком с гомологией не менее 30-50%, предпочтительно 50-70% по отношению к полной аминокислотной последовательности нативного АФП человека, обладающим активностью АФП человека.
В настоящем изобретении "остаток L-аминокислоты, соответствующий какому-либо положению, обозначенному некоторым числом, означает остаток аминокислоты, соответствующий положению, обозначенному этим числом в аминокислотной последовательности SEQ ID NO: 2.
Для определения остатка L-аминокислоты, соответствующего какому-либо положению, обозначенному некоторым числом, необходимо выполнить выравнивание последовательности аминокислот нативного АФП человека и последовательности аминокислот представляющего интерес АФП человека.
Замена, делеция, вставка или добавление одного или нескольких остатков аминокислот должны быть консервативными мутациями с тем, чтобы сохранялась активность белка. Консервативные замены являются типичными консервативными мутациями. Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gin, His или Lys, замену Asn на Glu, Gin, Lys, His или Asp, замену Asp на Asn, Glu или Gin, замену Cys на Ser или Ala, замену Gin на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gin, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gin, Arg или Tyr, замену Не на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val или Phe, замену Lys на Asn, Glu, Gin, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Туr, Met, Ile или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Туr, замену Туr на His, Phe или Trp, и замену Val на Met, Ile или Leu.
ДНК, кодирующая по существу такой же белок, как описанный выше АФП человека, получают, например, путем модификации последовательности нуклеотидов, например, посредством метода сайт-направленного мутагенеза таким образом, что один или несколько остатков аминокислот в определенном сайте предполагают делецию, замену, вставку или добавление.
Для оценки степени гомологии белков или ДНК можно использовать такие методы расчета как BLAST исследование, FASTA исследование и ClustalW.
BLAST (Basic Local Alignment Search Tool) - эвристический поисковый алгоритм, используемый программами blаstр, blastn, blastx, megablast, tblastn и tblastx; эти программы приписывают значения показателям с использованием статистических методов Karlin, Samuel и Stephen F. Altschul ("Methods for assessing the statistical significance of molecular sequence features by using generals coring schemes". Proc. Natl. Acad. Sci. USA, 1990, 87: 2264-68; "Applications and statistics for multiple high-scoring segments in molecular sequences". Proc. Natl. Acad. Sci. USA, 1993, 90:5873-7). FASTA метод описан W.R. Pearson ("Rapid and Sensitive Sequence Comparison with FASTP and FASTA", Methods in Enzymology, 1990, 183: 63-98). Clustal W метод описан Thompson J.D., Higgins D.G. and Gibson T.J. ("CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice", Nucleic Acids Res. 1994, 22: 4673-4680).
Рекомбинантная плазмида согласно настоящему изобретению содержит фрагмент ДНК, кодирующий рекомбинантный АФП человека или его вариант, под контролем промотора, функционирующего в эукариотической клетке, в частности в клетках дрожжей Saccharomyces cerevisiae. В качестве рекомбинантных плазмид согласно настоящему изобретению могут быть использованы любые плазмиды, обладающие способностью к экспрессии целевого белка в таких клетках. Конкретными примерами рекомбинантных плазмид согласно настоящему изобретению являются плазмиды pTy8/rhAFPmut_CU и pTy8/rhAFP_CU. Указанные плазмиды содержат целевой ген с пре-про участком секреции MFα, фрагмент бактериальной плазмиды pUC18c геном устойчивости к ампициллину, селективный маркер дрожжей URA3, терминатор транскрипции CYC1 и Ту8 фрагмент гена ТуА дрожжей Saccharomyces cerevisiae, необходимый для множественной интеграции целевого гена (около 30 копий) в хромосому дрожжей.
Указанные рекомбинантные плазмиды были сконструированы путем клонирования гена, кодирующего рекомбинантный АФП человека, в плазмиду рТу8 (Dudich E. et al. (2012) Protein Expression and Purification. 84:94-107). При введении данных плазмид в клетку достигается высокий уровень транскрипции целевых генов.
При помощи созданных плазмид можно трансформировать любую эукариотическую клетку, в частности клетку дрожжей Saccharomyces cerevisiae, восприимчивую к подобной трансформации указанными плазмидами. Выбор клетки не является критическим, поскольку методология и приемы трансформации хорошо известны специалисту в данной области техники. И хотя в зависимости от вида клетки и условий культивирования полученного трансформанта уровень экспрессии целевого белка может варьироваться, факт экспрессии целевого белка будет иметь место при условии успешной трансформации клетки-реципиента.
Клетками дрожжей согласно настоящему изобретению являются клетки дрожжей, трансформированные фрагментом ДНК, описанным выше, и обладающие способностью к продукции и секреции рекомбинантного АФП человека в культуральную жидкость.
Фраза «клетки дрожжей, трансформированные фрагментом ДНК» означает, что желаемый фрагмент ДНК был введен в клетку дрожжей с использованием методов, известных специалисту в данной области техники. Трансформация клетки дрожжей фрагментом ДНК приводит к увеличению экспрессии фрагмента ДНК, кодирующего рекомбинантный АФП человека согласно настоящему изобретению. Присутствие сигнальной последовательности MFα приводит к секреции произведенного антитела в культуральную жидкость. Методы трансформации клеток дрожжей включают в себя все известные методы, например модифицированная версия процедуры, описанной для S. cerevisiae (GietzandSchiestl, 1996).
Фраза "дрожжи Saccharomyces cerevisiae" означает, что указанные дрожжи классифицируют как Saccharomyces cerevisiae (S. cerevisiae) в соответствии с классификацией, известной специалисту в данной области микробиологии. Примерами дрожжей Saccharomyces cerevisiae, пригодных для трансформации плазмидами согласно настоящему изобретению, являются, но не ограничиваются ими, дрожжи Saccharomyces cerevisiae YBS247+ (Dudich E. Et al. (2012)Protein Expression and Purification. 84:94-107). B указанном штамме при использовании возобновляемого маркера URA3 были делетированы гены GAL80 и PRB1 и введены дополнительные копии генов KAR2 и PDI1, кодирующих белок Bip, участвующий в корректном замыкании S-S связей, и дисульфид изомеразу (PDI), что значительно увеличило выход АФП человека при гетерологичной экспрессии в дрожжах Saccharomyces cerevisiae. Конкретными примерами клеток, трансформированных плазмидами, согласно настоящему изобретению являются клетки штамма Saccharomyces cerevisiae YBS247+/AFPmut_CU или штамма Saccharomyces cerevisiae YBS247+/AFP_CU.
Способом согласно настоящему изобретению является способ получения рекомбинантного АФП человека, включающий выращивание дрожжей в питательной среде и выделение полученного рекомбинантного АФП человека из культуральной жидкости.
Примером клетки дрожжей, пригодных для продукции рекомбинантного АФП человека согласно настоящему изобретению, являются, но не ограничивается ими, клетки дрожжей Saccharomyces cerevisiae. Конкретными примерами клеток, пригодных для продукции рекомбинантного АФП человека согласно настоящему изобретению, являются клетки штамма Saccharomyces cerevisiae YBS247+/AFPmut_CU или штамма Saccharomyces cerevisiae YBS247+/AFP_CU.
В настоящем изобретении выращивание клеток, накопление и очистка рекомбинантного АФП человека согласно настоящему изобретению из культуральной жидкости и других жидкостей могут быть осуществлены методом, сходным с традиционными методами ферментации, когда некий белок производится с использованием микроорганизмов.
Питательная среда для выращивания может быть как синтетической, так и натуральной при условии, что указанная среда содержит источник углерода, источник азота, минералы и, если это необходимо, подходящее количество питательных веществ, в которых нуждаются дрожжи для их роста. К источникам углерода относятся углеводы, такие как глюкоза и сахароза, и различные органические кислоты. В зависимости от способа ассимиляции у указанного микроорганизма может быть использован спирт, включая метанол, этанол, глицерин. В качестве источника азота могут быть использованы различные соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, источники природного азота, такие как пептон, гидролизат соевых бобов, расщепленные ферментированные микроорганизмы. В качестве источника минералов могут быть использованы монофосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. В качестве витаминов могут быть использованы тиамин, дрожжевой экстракт и подобные им соединения.
Выращивание предпочтительно осуществляют в аэробных условиях, таких как культивирование с перемешиванием, взбалтывание с аэрацией, при температуре от 20 до 37°С, предпочтительно от 28 до 30°С. рН среды обычно поддерживают в диапазоне от 3 до 8, предпочтительно в диапазоне от 6 до 7.5. рН среды может быть скорректирована с помощью аммиака, карбоната кальция, различных оснований и буферов. Обычно выращивание в течение от 2 до 5 дней приводит к накоплению рекомбинантного АФП человека согласно настоящему изобретению в культуральной жидкости.
После выращивания твердые компоненты, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрации с использованием мембраны, а затем рекомбинантный АФП человека согласно настоящему изобретению может быть выделен и очищен методом осаждения с солями, с использованием сульфата натрия или сульфата аммония, аффинной хроматографии, ионообменной хроматографии и т.п.
Примеры
Настоящее изобретение будет более подробно описано ниже со ссылкой на следующие не ограничивающие настоящее изобретение примеры.
Пример 1. Получение экспрессионных плазмид, содержащих гены дегликозилированного и гликозилированного АФП человека, содержащих замены на "медленные"кодоны лейцина.
Синтетический ген дегликозилированного АФП человека (rhAFP0_CU), содержащий замены на "медленные" кодоны лейцина, фланкированный сайтами рестрикции Ncol и Xhol для последующей интеграции в экспрессионную плазмиду, получали методом ПЦР с использованием праймеров Dir (SEQ ID NO: 11) и Rev (SEQ ID NO: 12). Последовательность нуклеотидов гена rhAFP0_CU секвенировали для исключения ошибок, полученных в ходе ПЦР.
Полученный в результате ПЦР фрагмент переносили по сайтам рестрикции NcoI -XhoI в плазмиду pUC18/GAL1-pp, плазмида была названа pUC18/GAL1-pp/ rhAFP0_CU. Нуклеотидная последовательность гена rhAFP0_CU была секвенирована для исключения ошибок, полученных в ходе ПЦР. Для получения экспрессионной кассеты ген АФП с заменами лейцина (rhAFP0_CU) под контролем высокоэффективного GAL1 промотора и областью секреции дрожжей MFal по сайтам рестрикции HindIII - XhoI переносили на вектор рТу8 аналогично синтетическому гену rhAFP0, содержащему только оптимальные дрожжевые кодоны (Dudich E. et al. (2012) Protein Expression and Purification. 84:94-107).
Полученный экспрессионный вектор pTy8/rhAFP0_CU содержит целевой ген rhAFP0_CU, фрагмент бактериальной плазмиды pUC18, селективный маркер URA3, терминатор транскрипции CYC1 и Ту8 фрагмент гена ТуА дрожжей Saccharomyces cerevisiae, необходимый для множественной интеграции целевого гена (около 30 копий) в хромосому дрожжей (Фиг. 8).
С целью увеличения продукции рекомбинантного гликозилированного АФП (rhAFP_CU) в полученном ранее гене, содержащем оптимальные для экспрессии в клетках дрожжей S. cerevisiae кодонах с "медленными" кодонами, кодирующими лейцин, была произведена замена Q на N в 232 положении для возвращения сайта гликозилирования. Восстановление сайта гликозилирования (замена Q232→N232) осуществляли методом ПЦР в 2 этапа, как показано на Фиг. 9.
В качестве матрицы на 1 этапе ПЦР использовали ген рекомбинантного дегликозилированного АФП (rhAFP0_CU). Полученные в результате ПЦР фрагменты были выделены, очищены и использованы в качестве матрицы на 2 этапе. При проведении ПЦР использовали следующие праймеры: N1 (SEQ ID NO: 13), N2 (SEQ ID NO: 14), N3 (SEQ ID NO: 15) и N4 (SEQ ID NO: 16).
В результате был получен синтетический ген АФП человека с "медленными" кодонами, кодирующими лейцин в указанных положениях, и сайтом гликозилирования (rhAFP_CU). Последовательность нуклеотидов гена rhAFP-CU секвенировали для исключения ошибок, полученных в ходе ПЦР. Полученный ген (rhAFP_CU) переносили по сайтам рестрикции NcoI - XhoI в плазмиду pUC18/GAL1-pp, плазмида была названа pUC 18/GAL1-рр/rhAFP_CU.
Для получения экспрессионной кассеты ген АФП с заменами кодонов лейцина (rhAFP_CU) под контролем высокоэффективного GAL1 промотора и областью секреции дрожжей MFα1 по сайтам рестрикции HindIII - XhoI переносили на вектор рТу8 (из коллекции лаборатории) аналогично синтетическому гену rhAFP, содержащему только оптимальные дрожжевые кодоны (Dudich E. et al. (2012) Protein Expression and Purification. 84:94-107).
Полученный экспрессионный вектор pTy8/rhAFP_CU содержит целевой ген rhAFP_CU, фрагмент бактериальной плазмиды pUC18, селективный маркер URA3, терминатор транскрипции CYC1 и Ту8 фрагмент гена ТуА дрожжей Saccharomyces cerevisiae, необходимый для множественной интеграции целевого гена (около 30 копий) в хромосому дрожжей (Фиг. 10).
Пример 2. Получение штаммов S. Cerevisiae - продуцентов дегликозилированного и гликозилированного АФП человека.
В качестве штамма-реципиента использовали штамм дрожжей S. cerevisiae YBS247 (МАТа lеu2 urа3), зарегистрированный во Всероссийской коллекции микроорганизмов (ВКПМ), с небольшими модификациями - при использовании возобновляемого маркера URA3 были делетированы гены GAL80 и PRB1 и введены дополнительные копии генов KAR2 и PDI1, кодирующих белок Bip, участвующий в корректном замыкании S-S связей, и дисульфид изомеразу (PDI) соответственно (Dudich E. et al. (2012) Protein Expression and Purification. 84:94-107).
Полученный в результате этих модификаций штамм-реципиент YBS247+(MATa Δgal80 Δprbl KAR2+PDI+leu2 urа3), содержащий 3-5 копий генов KAR2 и PDI1, был трансформирован либо плазмидой pTy8/rhAFP0_CU, либо плазмидой pTy8/rhAFP_CU, линеаризованной эндонуклеазой рестрикции МluI, и KspАI-фрагментом плазмиды Yepl3, содержащим ген Leu2 дрожжей S. cerevisiae (Фиг. 11).
Отбор трансформантов осуществляли на минимальной среде (SD) следующего состава (г/л): КН2РO4 - 1,0, MgSO4⋅7H2O - 0,5, СаСl2 - 0,1, NaCl - 0,1, (NH4)2SO4 - 3,5, глюкоза - 20,0, YNB(Difco) - 1,7. Полученные клоны (9 клонов YBS247+/AFPmut_CU в случае трансформации плазмидой pTy8/rhAFP0_CU и 12 клонов YBS247+/AFP_CU в случае трансформации плазмидой pTy8/rhAFP_CU) выращивали в пробирках при 30°С на качалке (250 об/мин) в течение 72 ч на среде следующего состава: дрожжевой экстракт - 1%, пептон - 2%, глюкоза - 1,0%, этанол - 1,5%, 0,05 М натрий-фосфатный буфер (рН 7,0). В качестве положительного контроля использовали штамм-продуцент рекомбинантного АФП человека YBS247+/AFPmut, созданный ранее на основании оптимизированного гена негликозилированного АФП человека - rhAFP0 (Dudich E. et al. (2012) Protein Expression and Purification. 84:94-107). Анализ культуральной жидкости дрожжей и оценку количества рекомбинантного АФП человека проводили методами SDS электрофореза и ELISA. Полученные данные представлены в таблицах 1 и 2, а также на Фиг. 12 и 13.
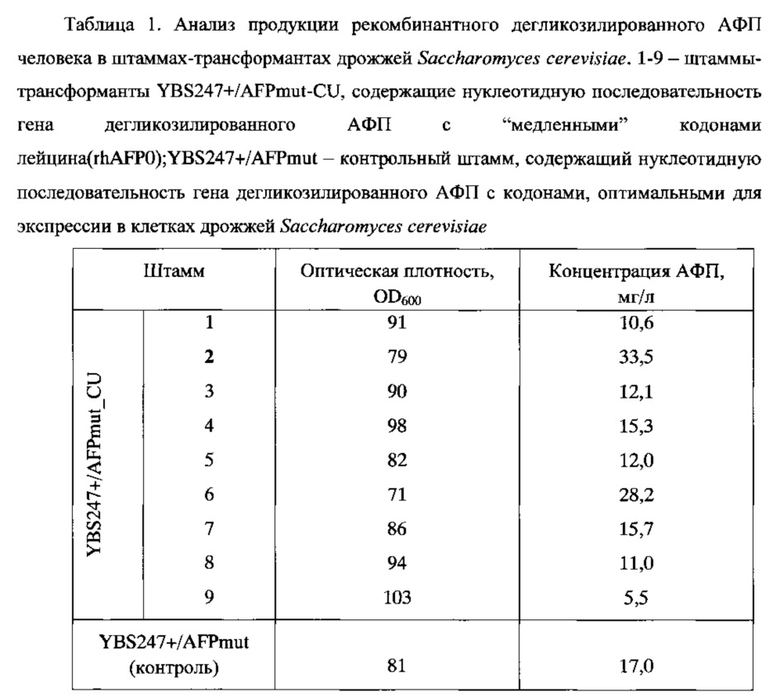
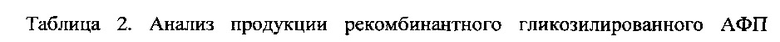
Для дальнейшей работы был выбран штамм-трансформант YBS247+/AFPmut_CU-2, обнаруживший при культивировании в пробирках максимальную продукцию белка дегликозилированного АФП и его секрецию в культуральную жидкость дрожжей при культивировании в пробирках. Таким образом, введение в оптимизированную последовательность гена АФП участков с "медленными" кодонами лейцина позволило увеличить выход целевого продукта и достигнуть выхода 33,5 мг/л.
Также для дальнейшей работы был выбран штамм YBS247+/AFP_CU-7, обнаруживший максимальную продукцию белка гликозилированного АФП и его секрецию в культуральную жидкость дрожжей при культивировании в пробирках. При этом все трансформаты оказались более продуктивными, чем контрольный штамм. Таким образом, введение в оптимизированную последовательность гена АФП участков с "медленными" кодонами лейцина позволило увеличить выход целевого продукта и достигнуть выхода 50,1 мг/л.
Пример 3. Определение выхода целевого продукта (рчАФП) из культуральных жидкостей штаммов-продуцентов Saccharomyces cerevisiae YBS247+/AFP, YBS247+/AFP_CU, YBS247+/AFPmut и YBS247+/AFPmut_CU.
Для анализа выхода целевого продукта (рчАФП) проводили процедуру выделения рчАФП из одного литра образцов культуральной жидкости по методике, описанной в статье Dudich E. et al. (2012) Prot. Exp. Purif., 84: 94-107. Образцы культуральной жидкости получали при культивировании штаммов Saccharomyces cerevisiae: YBS247+/AFP, YBS247+/AFP_CU, YBS247+/AFPmut и YBS247+/AFPmut_CU, как описано в Примере 2. Процесс выделения рчАФП включал три этапа: на первом этапе выделение белков проводили с применением катион-обменного сорбента CM-Sepharose (GEHealthcare, Германия), на втором этапе использовали анион-обменный сорбент DEAE-SepharoseFF (GEHealthcare, Германия) и на третьем этапе проводили гель-хроматографию, используя сорбент SephacrylS-200 HR (AmershamPharmacia, США).
Этап 1.
Один литр культуральной жидкости разводили 3-мя литрами деионизованной воды, доводили рН до 5.2 титрованием 5 mMHCl и наносили на колонку (2.5 × 10 cm) с CM-SepharoseFF, уравновешенной стартовым буфером 1 (20 тМ натрий ацетатный буфер, рН 5.2). Колонку промывали стартовым буфером и целевой продукт смывали при добавлении 0,14 M NaCl.
Этап 2.
Целевой продукт, полученный на первой стадии при элюции с CM-SepharoseFF, разводили равным объемом деионизованной воды, доводили рН до 7.5 титрованием раствором 2 MTrispH 8.0 и наносили на колонку (2.5 × 10 cm) с DEAE-Sepharose FF, уравновешенной буфером 2 (20 тМ натрий фосфатный буфер, рН 7.5). Колонку промывали стартовым буфером 2 для удаления несвязавшихся с сорбентом компонентов и целевой продукт, содержащий рчАФП, элюировали стартовым буфером 2 с добавлением 0.3 MNaCl
Этап 3.
Фракции, содержащие рчАФП, полученные на этапе 2, концентрировали в ячейке "Amicon" (мембрана YM-30). Концентрированные фракции (150 мг) наносили на колонку (2,5×100 см), содержащую SephacrylS-200 HR и уравновешенную 10мМ натрий-фосфатным буфером, рН 7.4. Целевой продукт, содержащий рчАФП, который выходил в виде основного пика (мол. вес. 70 кДа), собирали.
Для определения количества выделенного белка из культуральной жидкости каждого из анализируемых штаммов Saccharomyces cerevisiae: YBS247+/AFP, YBS247+/AFP_CU, YBS247+/AFPmut и YBS247+/AFPmut_CU, измеряли объем основного пика, полученного на этапе 3, и определяли концентрацию белка в этом пике.
Определение концентрации белка в растворах проводили по методу Брэлфорд (Bradford M. M. (1976) Anal Biochem; 72:248-54), используя в качестве контроля раствор эмбрионального АФП, а также спектрофотометрически при 278 нм, учитывая коэффициент экстинкции Ε1%, 278 нм=0,53(Dudich I. et al. (1999) Biochemistry; 38(32): 10406-14.
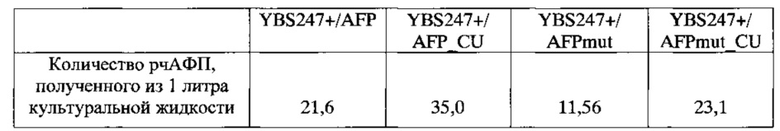
Количество рчАФП, полученного с литра культуральной жидкости каждого из анализируемых штаммов, представлено в Таблице 3. По результатам анализа из одного литра культуральной жидкости штамма-продуцента S. cerevisiae YBS2A7+/AFP был получен 21,6 мг целевого продукта rhAFP и 35 мг целевого продукта rhAFP_CU было получено из одного литра культуральной жидкости штамма-продуцента S. cerevisiae YBS247+/AFP_CU. Из одного литра культуральной жидкости штамма-продуцента S. cerevisiae YBS247+/AFPmut было получено 11,36 мг целевого продукта phAFP0,h 23,1 мг целевого продукта phAFP_CU было получено из одного литра культуральной жидкости штамма S. cerevisiae YBS247+/AFPmut_CU. Таким образом, при культивировании штаммов - продуцентов S. cerevisiae YBS247+/AFP_CU и S. cerevisiae YBS247+/AFPmut_CU, содержащих "медленный" кодон лейцина в гене АФП человека, выход целевого продукта (рчАФП) из культуральной жидкости достоверно превышал выход целевого продукта, получаемого из одного литра культуральной жидкости штаммов-продуцентов S. cerevisiae YBS247+/AFP и S. cerevisiae YBS247+/AFPmut, содержащих оптимизированный ген АФП.

Пример 4. Электрофоретическая характеризация образцов рчАФП, выделенных из культуральных жидкостей штаммов Saccharomyces cerevisiae YBS247+/AFP, YBS247+/AFP_CU, YBS247+/AFPmut и YBS247+/AFPmut_CU.
Образцы рчАФП получали из культуральной жидкости штаммов Saccharomyces cerevisiae: YBS247+/AFP, YBS247+/AFP_CU, YBS247+/AFPmut и YBS247+/AFPmut_CU как описано в Примере 3. Эмбриональный АФП (эАФП) выделяли из пуповинной сыворотки человека, согласно описанной методике (Dudich I. et al. (1999) Biochemistry; 38(32): 10406-14). Сыворотку наносили на DEAE-Sepharose Fast Flow (Pharmacia, 27×4 см), уравновешенную стартовым буфером (0,01М Трис-НСl, рН 7,5, 0,1М NaCl). Несвязавшиеся с сорбентом компоненты смывали стартовым буфером, целевой продукт элюировали 0,2 М NaCl в стартовом буфере. Фракции, содержащие АФП, объединяли, доводили концентрацию NaCl до 0,5М и наносили на последовательно соединенные аффинные колонки с Sepharose CL-4B, конъюгированной с поликлональными анти-АФП антителами кролика, поликлональными антителами кролика к белкам сыворотки человека и поликлональными антителами крысы против иммуноглобулинов кролика, уравновешенные 0,05М Трис-HCl, рН 7,5 и 0,5М NaCl. После выхода несвязавшихся с антителами белков адсорбированный рчАФП элюировали 0,005М НСl. Раствор АФП доводили до рН 7,5 добавлением 2М раствора Трис-HCl, рН 7,5. Для получения мономерной формы АФП, раствор АФП, полученный после аффинной хроматографии, наносили на колонку с Sephacryl S-200 (1,8×70 см) в 0,01М фосфатном буфере, рН 7,0; 0,15М NaCl. Природный АФП выходил виде основного пика (мол. вес. 70 кДа). Для анализа образцов рчАФП использовали метод гель-электрофореза по Лэммли в 12,5% ДСН-ПААГ с β-меркаптоэтанолом с последующим окрашиванием Кумасси. Как видно на Фиг. 14, природный эмбриональный АФП (эАФП), который использовался в качестве стандарта, представлен одной белковой полосой с мол. весом ≈ 69 кДа, соответствующей полностью гликозилированному белку. Образцы гликозилированного рчАФП, выделенные из культуральной жидкости продуцентов Saccharomyces cerevisiae YBS247+/AFP и Saccharomyces cerevisiae YBS247+/AFP_CU - (rhAFP) и (rhAFP_CU) соответственно, имеют характерный профиль в виде 2-х полос с мол. весом ≈ 70 кДа и 68 кДа. Как отмечалось ранее в статье Dudich E. et al. (2012) Prot. Exp. Purif., 84: 94-107, наличие двух полос является особенностью рчАФП, продуцируемого Saccharomyces cerevisiae YBS241+/AFP, и связано с особенностью гликозилирования рчАФП. Аналогичный электрофоретический профиль рчАФП, полученного из культуральной жидкости продуцента Saccharomyces cerevisiae YBS247+/AFP_CU, свидетельствует об идентичности молекул АФП. Образцы дегликозилированного рчАФП, полученные из культуральной жидкости продуцентов Saccharomyces cerevisiae YBS247+/AFPmut и YBS247+/AFPmut_CU - (rhAFPO) и (rhAFP0_CU) соответственно, также имеют тождественный электрофоретический профиль и характеризуются наличием одной полосы с мол. весом ≈68 кДа. Представленные данные позволяют заключить, что образцы рчАФП, полученные из культуральной жидкости дрожжевых продуцентов, содержащих оптимизированный ген и ген с заменами лейцина, имеют идентичный электрофоретический профиль.
Пример 5. Сравнительный анализ биологической активности образцов рчАФП, выделенных из культуральной(ых) жидкости(ей) штаммов-продуцентов Saccharomyces cerevisiae YBS247+/AFP, YBS247+/AFP_CU, YBS247+/AFPmut и YBS247+/AFPmut_CU.
Известно, что натуральный АФП и его рекомбинантные аналоги проявляют свойства избирательного иммуносупрессора (Deutsch H.F. (1991) Adv. Cancer Res. 56, 253-312; Peck A.B. et al. (1978) J. Exp. Med. 148, 360-372, Патент США №6,774,108). Анализ иммунорегуляторной активности образцов рчАФП, выделенных из культуральной жидкости штаммов Saccharomyces cerevisiae YВ8247+/АFР, YBS247+/AFP_CU, YBS247+/AFPmut и YBS247+/AFPmut_CU проводили, используя классическую реакцию бласттрансформации лимфоцитов (Wang G.L. et al. (2006) ActaPharmacolSin. 27(4):437-46). Лимфоциты выделяли из селезенки СВА мышей, извлеченной с применением стерильной техники. Для получения суспензии клеток селезенку мыши пропускали через нейлоновый фильтр с диаметром пор 40 мкм. Эритроциты удаляли при обработке клеточной суспензии Tрис-NH4Cl - лизирующим буфером (0,144 моль/л NH4Cl, 0,017 моль/л Трис-HCl). Клетки отмывали центрифугированием и помещали в лунки 96-луночного планшета (Costar, США) по 5×105 клеток на лунку в объеме 200 мкл. Клетки инкубировали в среде RPMI 1640 с добавлением 10% эмбриональной сыворотки теленка (ЭСТ), пенициллина (100 Ед/мл), стрептомицина (100 мкг/мл) при 37°С в атмосфере, содержащей 5% СО2 в инкубаторе. Стимуляцию пролиферации лимфоцитов вызывали добавлением 3 мкг/мл КонА (конканавалина А). Образцы рчАФП выделяли из культуральной жидкости штаммов Saccharomyces cerevisiae YBS247+/AFP, YBS247+/AFP_CU, YBS247+/AFPmut и YBS247+/AFPmut_CU, как описано в Примере 3. Природный АФП выделяли из сыворотки пуповинной крови, как описано в Примере 3.
Образцы природного АФП и рчАФП вносили в суспензию КонА-активированных лимфоцитов и клетки инкубировали в течение 72 часов. В качестве контроля использовались клетки, которые инкубировали без добавления образцов АФП. [3Н]-тимидин (1 мкКи/лунку) вносили в реакционную смесь в последние 18 часов. Клетки собирали на стеклянные фильтры, используя клеточный харвестр Фильтермат 196 (Packard, США). Уровень включения 3Н-тимидина измеряли с помощью β-сцинтилляционного счетчика (BeckmanLS6500, США).
На Фиг. 15 представлены результаты анализа влияния образцов АФП, на пролиферативную активность КонА-активированных лимфоцитов мыши.
Как видно из представленных данных, все анализируемые образцы АФП в концентрации 300 мкг/мл вызывают значительное ингибирование включения [3Н]-тимидина КонА-активированными лимфоцитами мыши. Наиболее выраженную способность ингибировать пролиферацию КонА-активированных спленоцитов демонстрировали образцы дегликозилированного рчАФП (rhAFP0 и rhAFP0_CU). Характерно, что специфическая активность образцов дегликозилированного рчАФП, выделенных из культуральной жидкости продуцентов YBS247+/AFPmut и YBS247+/AFPmut_CU, была практически идентична, так образец rhAFP0 вызывал 68% ингибиции клеток, а образец rhAFP0_CU индуцировал 70% ингибиции в реакции. Образцы гликозилированного рчАФП (rhAFP и rhAFP_CU) также ингибировали пролиферативную активность КонА-активированных спленоцитов на 65 и 60% соответственно. Исходя из представленных данных, можно заключить, что образцы рчАФП, выделенные из культуральной жидкости дрожжевых продуцентов, содержащих оптимизированный штамм и штамм с заменами лейцина, проявляют идентичную биологическую активность и эта активность соответствует активности природного АФП человека.
Пример 6. Сравнительный анализ влияния образцов рчАФП, выделенных из культуральной жидкости штаммов-продуцентов Saccharomyces cerevisiae YBS247+/AFP, YBS247+/AFP_CU, YBS247+/AFPmut и YBS247+/AFPmut_CU на пролиферативную активность опухолевых и нормальных клеток invitro.
Функциональную активность различных образцов рчАФП определяли по их способности влиять на пролиферативную активность Raji (клетки В-клеточной лимфомы человека) и NIH3T3 (клетки эмбриональных фибробластов мыши). Ранее авторами настоящего изобретения было показано, что рчАФП человека, полученный из культуральной жидкости дрожжевого продуцента Saccharomyces cerevisiae, обладает способностью подавлять пролиферацию опухолевых клеток человека и млекопитающих и в то же время стимулирует или не оказывает влияния на нормальные неактивированные клетки человека и мыши (Dudich E.I. et al. (1998) Tumor Biol. 1:30-40; Dudich E. et al. (2012) Prot. Exp. Purif., 84: 94-107). Авторы настоящего изобретения использовали эти invitro модели для проведения сравнительного анализа биологической активности различных образцов рчАФП.
Клетки NIH3T3 культивировали на среде DMEM с добавлением 10% 3CT (Sigma, США) в 5% атмосфере СО2 при 37°С. Для пересева использовали раствор ЭДТА/0,25% трипсина (ПанЭко, Россия). Для эксперимента клеточную суспензию в среде DMEM, содержащей 10% ЭСТ, вносили в лунки 96-луночного планшета (5×103 клеток/лунка в объеме 100 мкл) и помещали в инкубатор на 18-24 часа. В день эксперимента среду заменяли средой DMEM, содержащей 2% ЭСТ, и помещали клетки в инкубатор на 2 часа. Клетки Raji культивировали на среде RPMI с добавлением 10% ЭСТ. Перед экспериментом клетки отмывали в среде RPMI, содержащей 2% ЭСТ, вносили в этой среде в лунки 96-луночного планшета (1×104 клеток/лунка в объеме 200 мкл) и инкубировали 2 часа. Затем вносили в лунки по 10 мкл растворов разных образцов рчАФП, выделенных из культуральной жидкости штаммов-продуцентов Saccharomyces cerevisiae YBS247+/AFP, YBS247+/AFP_CU, YBS247+/AFPmut и YBS247+/AFPmut_CU, как описано в Примере 3. Концентрация всех образцов рчАФП в культуральной среде соответствовала 300 мкг/мл. Клетки инкубировали в течение 48 часов, контрольные (лунки) клетки инкубировали без добавления рчАФП. Для определения пролиферативной активности клеток использовали коммерческий реактив Cell Titer 96 Aqueous Non-Radioactive Cell Proliferation Assay (Promega, США). Оптическую плотность реакционной среды измеряли при длине волны 490 нм с использованием полифункционального счетчика Victor2 (Wallack 1420, Финляндия).
Как видно из Фиг. 16, образцы рчАФП, выделенные из культуральной(ых) жидкости(ей) штаммов продуцентов, содержащих оптимизированный ген, и штаммов-продуцентов, содержащих оптимизированный ген с "медленными" кодонами лейцина, демонстрируют идентичную биологическую активность, подавляя пролиферативную активность опухолевых клеток. В экспериментах с использованием клеточной культуры фибробластов мыши NIH3T3 (Фиг. 16, NIH3T3 клетки) также показано, что образцы рчАФП, выделенные из культуральной жидкости штаммов продуцентов, содержащих оптимизированный ген, и штаммов-продуцентов, содержащих оптимизированный ген с "медленными" кодонами лейцина не влияют на пролиферативную активность NIH3T3 клеток.
Таким образом, видно, что образцы гликозилированного рчАФП (rhAFP и rhAFP_CU) и дегликозилированного рчАФП (rhAFP0 и rhAFP0_CU), выделенные из культуральной жидкости штаммов-продуцентов Saccharomyces cerevisiae YBS247+/AFP, YBS247+/AFP_CU, YBS247+/AFPmut и YBS247+/AFPmut_CU, обладают схожей биологической активностью, аналогичной ранее показанной для природного (Dudich E.I. et al. (1998) Tumor Biol. 1:30-40).
Хотя настоящее изобретение описано в деталях выше, для специалиста в указанной области техники очевидно, что могут быть сделаны изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения, определяемые приложенной формулой изобретения.





























Изобретение относится к области биотехнологии, может быть использовано для получения альфа-фетопротеина (АФП) человека с использованием штаммов дрожжей Saccharomyces cerevisiae, содержащих рекомбинантный ген АФП. Получают рекомбинантный АФП человека, содержащий так называемые "медленные" кодоны, кодирующие лейцин в консервативных участках АФП, рекомбинантную плазмиду и клетку Saccharomyces cerevisiae для экспрессии и секреции указанного рекомбинантного АФП соответственно. Изобретение позволяет повысить продукцию активного АФП. 4 н. и 5 з.п. ф-лы, 16 ил., 3 табл., 6 пр.
1. Рекомбинантный фрагмент ДНК, кодирующий белок, обладающий активностью альфа-фетопротеина (АФП) человека, оптимизированный для экспрессии в клетках дрожжей Saccharomyces cerevisiae, отличающийся тем, что указанный фрагмент ДНК содержит "медленные" кодоны, кодирующие L-аминокислотные остатки лейцина, соответствующие положениям 13, 24, 52, 68, 72, 79, 86, 107, 119, 160, 161, 194, 199, 200, 239, 307, 311, 315, 332, 346, 352, 361, 362, 372, 382, 392, 399, 403, 408, 445, 450, 451, 465, 496, 534, 537, 549, 560 и 588 в нативной последовательности АФП человека.
2. Рекомбинантный фрагмент ДНК по п. 1, отличающийся тем, что указанный фрагмент ДНК кодирует АФП с нативным сайтом гликозилирования, соответствующим положению 232 в нативной последовательности АФП человека, представляющим собой L-аминокислотный остаток аспарагина, либо без него.
3. Рекомбинантный фрагмент ДНК по п. 1 или 2, отличающийся тем, что указанный фрагмент ДНК характеризуется последовательностью нуклеотидов, представленной в Перечне последовательностей под номером SEQ ID NO: 9 или 10.
4. Рекомбинантная плазмида для экспрессии рекомбинантного АФП человека в клетках Saccharomyces cerevisiae, в следующей последовательности по существу состоящая из промотора GAL1, пре-про участка секреции MFα, фрагмента ДНК по п. 1, участка терминации транскрипции гена CYC1 дрожжей, фрагмента Ty8 гена TyA, гена устойчивости к ампициллину, фрагмента Ty8 гена TyA и маркера селекции URA3 дрожжей.
5. Рекомбинантная плазмида по п. 4, отличающаяся тем, что указанной плазмидой является плазмида pTy8/rhAFPmut_CU или pTy8/rhAFP_CU, представленные на Фиг. 8 и 10 соответственно.
6. Клетка Saccharomyces cerevisiae, трансформированная плазмидой по п. 4 и обладающая способностью к секреции рекомбинантного АФП человека в культуральную жидкость.
7. Клетка по п. 6, отличающаяся тем, что указанной клеткой является клетка штамма Saccharomyces cerevisiae YBS247+/AFPmut_CU или клетка штамма Saccharomyces cerevisiae YBS247+/AFP_CU.
8. Способ получения рекомбинантного АФП человека, содержащий стадии культивирования клеток по п. 6 в питательной среде и выделения рекомбинантного АФП человека из культуральной жидкости.
9. Способ по п. 8, отличающийся тем, что используют клетки штамма Saccharomyces cerevisiae YBS247+/AFPmut_CU или клетки штамма Saccharomyces cerevisiae YBS247+/AFP_CU.
| DUDICH E., Engineering of the Saccharomyces cerevisiae yeast strain with multiple chromosome-integrated genes of human alpha-fetoprotein and its high-yield secretory production, purification, structural and functional characterization, Protein Expr | |||
| Purif., 2012, v.84, is.1, p.94-107 | |||
| PONNALA L., Detecting slow-translating regions in E.coli, Int | |||
| J | |||
| Bioinform | |||
| Res | |||
| Appl., 2010, v.6, is.5, p.522-530 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Трепальная машина для льна, пеньки и других лубовых растений | 1928 |
|
SU11606A1 |
Авторы
Даты
2017-04-28—Публикация
2015-07-17—Подача