ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к производному фактора свертывания крови VII, производному фактора свертывания крови VIIa, конъюгатам Fac VII и Fac VIIa, каждый из которых получен путем присоединения полимера, способного увеличивать время полувыведения производного из кровотока, к Fac VII и VIIa комплексам, каждый из которых получен путем присоединения носителя к конъюгату, к генам, кодирующим производные Fac VII и Fac VIIa, к экспрессирующим векторам, содержащим гены, к трансформантам с введенными экспрессирующими векторами, к способу получения производных Fac VII и Fac VIIa с использованием этих трансформантов, к способу получения конъюгата и комплекса Fac VIIa, к комплексу Fac VIIa. полученному посредством этого способа, к фармацевтической композиции для предупреждения или лечения гемофилии, содержащей это производное, конъюгат или комплекс в качестве активного ингредиента, и к фармацевтической композиции для улучшения свертывания крови, содержащей это производное, конъюгат или комплекс в качестве активного ингредиента. Кроме того, настоящее изобретение относится к способу предупреждения или лечения гемофилии или улучшения свертывания крови, включающему введение субъекту терапевтически эффективного количества композиции.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В настоящее время по всему миру насчитывается 140 тысяч человек с гемофилией, при этом ежегодный прирост составляет 20%. Генетически гемофилия имеет место у одного из десяти тысяч субъектов, но диагностику или лечение осуществляют только у примерно 25% всех пациентов. На основании этиологии гемофилию в основном делят на два типа: один представляет собой гемофилию А, которая вызвана отсутствием фактора свертывания крови VII (Фактор VII, Fac VII) и составляет 80% от общего числа пациентов с гемофилией, а другой представляет собой гемофилию В, которая вызвана отсутствием фактора свертывания крови XI (Фактор XI) и составляет 20% от общего числа пациентов с гемофилией. Для лечения гемофилии осуществляют внешнее введение факторов свертывания крови, но этот способ лечения является проблематичным, так как у 10-15% всех пациентов с гемофилией А вырабатываются антитела против фактора свертывания крови и у 1-3% всех пациентов с гемофилией В вырабатываются антитела против фактора свертывания крови.
С другой стороны, Fac VII, который является причиной гемофилии А у более чем половины пациентов с гемофилией, представляет собой фермент, который продуцируется главным образом печенью, и состоит из 406 аминокислот, и включает гамма-карбоксилирование глутаминовой кислоты в положении 10, N-гликозилирование аспарагинов в положениях 145 и 322 и O-гликозилирование серинов в положениях 52 и 60. Кроме того, Fac VII имеет два EGF-подобных домена и один сериновый протеазный домен, и одноцепочечный Fac VII активируется посредством разрыва между аргинином в положении 152 и изолейцином в положении 153 с образованием двухцепочечного Fac VIIa, состоящего из легкой цепи и тяжелой цепи. Так как активированный Fac VIIa действует посредством вспомогательного механизма свертывания крови в отличие от других факторов свертывания крови, антитела не продуцируются даже при инъекции высоких доз Fac VIIa. Следовательно, его можно использовать для лечения пациентов с гемофилией А, а также пациентов, имеющих антитела против Fac VII вследствие обычной терапии, и известен как средство решения вышеописанных проблем.
Хотя антитела против Fac VIIa не продуцируются, существует другая проблема необходимости высокодозового и частого введения из-за короткого времени полувыведения из кровотока. Из-за короткого времени полувыведения Fac VIIa следует вводить 2-3 раза в сутки для лечения гемофилии, и такое частое введение также становится серьезным препятствием для профилактики гемофилии. Чтобы решить проблему короткого времени полувыведения из кровотока, в исследованиях предлагались известные способы микрокапсулирования, инкапсуляции в липосомы, а также ряд химических модификаций, но до сих пор не сообщалось об успешных результатах. В частности, были предприняты химические модификации, такие как химическая модификация остатка лизина или N-конца на поверхности Fac VIIa или присоединение к нему носителя, способного увеличивать время полувыведения из кровотока, такого как полиэтиленгликоль, альбумин, трансферрин и фрагмент иммуноглобулина, или остаток цистеина вставляют в область, которая непосредственно не влияет на активность Fac VIIa, чтобы содействовать связыванию с носителем. Однако химическая модификация остатка лизина или N-конца на поверхности Fac VIIa снижает способность Fac VIIa связываться с мембраной тромбоцита. При связывании с другим носителем, этот носитель является помехой ферментативным активностям. Введение остатка цистеина индуцирует образование неспецифической дисульфидной связи, что впоследствии ведет к уменьшению ферментативных активностей. По существу, многие исследования были осуществлены с целью разработки производных, имеющих улучшенное время полувыведения из кровотока без снижения активности Fac VIIa, но до сих пор не сообщалось об успешных результатах.
rVIIa-FP (CSL Behring), полученный посредством слияния альбумина с С-концом Fac VIIa, находится в доклинической фазе исследования и его время полувыведения из кровотока у крыс увеличено в 6,7 раз по сравнению с нативным Fac VIIa. Однако он все еще имеет очень короткое время полувыведения, составляющее 4,38 ч, и, таким образом, не подходит для лечения и профилактики гемофилии. PEGLip-FVIIa (Omri), полученный с использованием пэгилированной липосомной композиции, также находится в доклинической фазе исследования, но его время полувыведения из кровотока было только в два раза выше, чем у нативного Fac VIIa.
Два продукта, MAXY-VII (Bayer/Maxygen), полученный путем мутации домена Gla и гипергликозилирования Fac VIIa с получением пролонгированного времени полувыведения из кровотока, и NN7128 (Novo/Neose), полученный посредством 40K PEG-гликозилирования с получением пролонгированного времени полувыведения из кровотока, подвергаются клиническим исследованиям, но их время полувыведения из кровотока было только в 5 раз выше, чем время полувыведения из кровотока нативного Fac VIIa. Таким образом, они не подходят для эффективного лечения и профилактики гемофилии.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
На основании предшествующего уровня техники авторы настоящего изобретения предпринимали многочисленные попытки получить производные с улучшенным временем полувыведения из кровотока при сохранении максимальных активностей Fac VII и Fac VIIa. В результате, они обнаружили, что производное, полученное посредством слияния части последовательности SOD1 (Супероксиддисмутазы 1) с С-концом Fac VII, способно легко связываться с носителем, способным увеличивать время полувыведения из кровотока, таким как полиэтиленгликоль, альбумин, трансферрин и иммуноглобулиновый фрагмент, без снижения активности Fac VII или Fac VIIa, и, в частности, Fc-область иммуноглобулина, непептидильный полимер, и производное Fac VII или Fac VIIa сайт-специфически связывается посредством ковалентной связи для миниминизации снижения активности и для значительного увеличения времени полувыведения конъюгата из кровотока, завершая тем самым настоящее изобретение.
РЕШЕНИЕ ПРОБЛЕМЫ
Задачей настоящего изобретения является предложение производного Fac VII или его активной формы Fac VIIa, которые имеют аминокислотную последовательность фактора свертывания крови VII (Фактор VII, Fac VII) или его активной формы, фактора свертывания крови VIIa (Фактор VIIa, Fac VIIa) и пептидный линкер на С-конце.
Другая задача настоящего изобретения заключается в предложении полинуклеотида. кодирующего производное Fac VII или его активную форму Fac VIIa.
Еще одной задачей настоящего изобретения является предложение экспрессирующего вектора, содержащего полинуклеотид.
Еще одной задачей настоящего изобретения является предложение трансформанта с введенным экспрессирующим вектором.
Еще одной задачей настоящего изобретения является предложение способа получения производного Fac VII или его активной формы Fac VIIa с использованием трансформанта.
Еще одной задачей настоящего изобретения является предложение конъюгата Fac VII или его активной формы Fac VIIa, который получают путем связывания полимера, способного увеличивать время полувыведения из кровотока, с пептидным линкером производного.
Еще одной задачей настоящего изобретения является предложение комплекса Fac VII или его активной формы Fac VIIa, который получают путем связывания носителя, способного увеличивать время полувыведения из кровотока, с одним концом конъюгата.
Еще одной задачей настоящего изобретения является предложение способа получения комплекса Fac VIIa, включающего стадию активации комплекса Fac VII.
Еще одной задачей настоящего изобретения является предложение комплекса Fac VIIa, полученного посредством вышеприведенного способа.
Еще одной задачей настоящего изобретения является предложение фармацевтической композиции для предупреждения или лечения гемофилии, содержащей производное, конъюгат или комплекс в качестве активного ингредиента.
Еще одной задачей настоящего изобретения является предложение фармацевтической композиции для свертывания крови, содержащей производное, конъюгат или комплекс в качестве активного ингредиента.
Еще одной задачей настоящего изобретения является предложение способа предупреждения или лечения гемофилии, включающего стадию введения субъекту терапевтически эффективного количества фармацевтической композиции для предупреждения или лечения гемофилии.
Еще одной задачей настоящего изобретения является предложение способа повышения свертывания крови, включающего стадию введения субъекту терапевтически эффективного количества фармацевтической композиции для свертывания крови.
ПОЛЕЗНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Производные Fac VII или Fac VIIa по настоящему изобретению способны связываться с носителем, способным улучшать время полувыведения из кровотока при сохранении активности Fac VII или Fac VIIa, и их можно широко использовать в разработке эффективного профилактического или терапевтического агента для гемофилии.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг. 1а представлена фотография, демонстрирующая результат вестерн-блоттинга Fac VII-ATKAVC, экспрессируемого в клеточной линии 293F;
На Фиг. 1b представлена фотография, показывающая результат вестерн-блоттинга контрольной группы и FVII-GGGGSC (FVII-G4SC), экспрессируемого в клеточной линии 293F;
на Фиг. 1c представлена фотография результата вестерн-блоттинга, демонстрирующая различие молекулярной массы Fc VII-ATKAVC и Fac VII-SOD11-149, экспрессируемых в клеточной линии 293F;
на Фиг. 2 представлена фотография, показывающая результат электрофореза очищенного Fac VII-ATKAVC;
на Фиг. 3 представлена фотография, показывающая результат электрофореза конъюгата Fac VII-ATKAVC-PEG;
на Фиг. 4а представлена фотография, показывающая результат электрофореза конъюгата Fac VIIa-ATKAVC-PEG-Fc;
на Фиг. 4b представлена фотография, показывающая результат вестерн-блоттинга конъюгата Fac VIIa-ATKAVC-PEG-Fc;
на Фиг. 5 представлен график зависимого от концентрации поглощения, демонстрирующий in vitro активность Fac VII и Fac VII-ATKAVC.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В одном аспекте для достижения вышеуказанных задач в настоящем изобретении предлагаются производные Fac VII или его активной формы Fac VIIa с аминокислотной последовательностью (SEQ ID NO: 4) фактора свертывания крови VII (Фактор VII, Fac VII) и пептидным линкером на его С-конце.
В данном контексте термин "фактор свертывания крови VII (Фактор VII, Fac VII)", который также называется проконвертин, представляет собой один из факторов, вовлеченных в свертываемость крови, имеет размер 48 кДа и кодируется геном, имеющим размер 12,8 т.п.н., преимущественно продуцируется печенью и представляет один из витамин K-зависимых белков плазмы. Известно, что Fac VII связывается с фактором свертывания крови III на поверхности внесосудистых тканей, например как предшественник сериновой протеазы и гладкомышечные клетки, опухолевые ткани или активированные лейкоциты, и таким образом активирует факторы свертывания крови IX и X, что приводит к инициации внешнего пути свертывания крови. В настоящем изобретении, Fac VII может включать нативный Fac VII, химически модифицированные производные Fac VII, которые сохраняют нормальную активность нативного Fac VII, и варианты, которые имеют по меньшей мере 80%-ную гомологию аминокислотной последовательности, предпочтительно 85%, 90% или 95%-ную гомологию аминокислотной последовательности и более предпочтительно 98% или 99% гомологию аминокислотной последовательности с нативным Fac VII при сохранении нормальной активности нативного Fac VII. Однако гомология последовательности не ограничивается вышеуказанными значениями до тех пор, пока они проявляют активность нативного Fac VII.
В данном контексте термин ʺфактор свертывания крови VIIa (Фактор VIIa, Fac VIIa)ʺ означает активную форму фактора свертывания крови VII (Фактор VII, Fac VII), и одноцепочечный Fac VII активируется в результате разрыва между аргинином в положении 152 и изолейцином в положении 153 с образованием двухцепочечного Fac VIIa, состоящего из легкой цепи и тяжелой цепи. Поскольку активированный Fac VIIa действует через вспомогательный механизм свертывания крови, в отличие от других факторов свертывания крови, антитела не продуцируются даже при инъекции высокой дозы Fac VIIa. В настоящем изобретении Fac VIIa может включать нативный Fac VIIa, химически модифицированные производные Fac VIIa, которые сохраняют нормальную активность нативного Fac VIIa и варианты, которые имеют по меньшей мере 80%-ную гомологию аминокислотной последовательности, предпочтительно 85%, 90% или 95%-ную гомологию аминокислотной последовательности и более предпочтительно 98% или 99% гомологию аминокислотной последовательности по сравнению с нативным Fac VII при сохранении нормальной активности нативного Fac VIIa. Однако гомология последовательности не ограничена вышеуказанными значениями до тех пор, пока они проявляют активность нативного Fac VII.
В данном контексте термин ʺлинкерʺ в основном относится к средству, способному соединить два разных партнера слияния (например биологические полимеры) с использованием водородной связи, электростатического взаимодействия, ван-дер-ваальсовой силы, дисульфидной связи, солевого мостика, гидрофобного взаимодействия, ковалентной связи и т.п. Предпочтительно, он может иметь по меньшей мере один цистеин, вовлеченный по меньшей мере в одну дисульфидную связь в физиологических условиях или других стандартных пептидных условиях (например в условиях очистки пептида, условиях хранения пептида). Можно использовать цистеин в качестве реакционно-способной группы, связывающей партнера слияния, а также дисульфидную связь. Кроме того, линкер обеспечивает заданный промежуток между носителями или выполняет функции шарнира, обеспечивающего гибкость или жесткость слитого белка, а также просто осуществляет функцию связывания каждого из партнеров слияния. В настоящем изобретении линкер представляет собой, но конкретно не ограничен ими, пептидный линкер, который связывает С-конец Fac VII или Fac VIIa с носителем, способным увеличивать время полувыведения из кровотока, и, предпочтительно, С-концевой остаток цистеина пептидного линкера. Предпочтительной может быть частичная последовательность (SEQ ID NO: 30) SOD1 (супероксиддисмутазы 1), более предпочтительно частичная последовательность (SEQ ID NO: 31), выбранная из области от 1 до 149 последовательности SOD1, еще более предпочтительно от 1 до 90 последовательности SOD1 (SEQ ID NO: 32), гораздо более предпочтительно от 1 до 25 последовательности SOD1 (SEQ ID NO: 33) и наиболее предпочтительно от 1 до 6 последовательности SOD1 (SEQ ID NO: 5).
В данном контексте термин ʺSOD1 (супероксиддисмутаза 1)ʺ означает фермент, который катализирует дисмутацию реактивного кислорода, супероксидного иона до кислорода и перекиси водорода и, как известно, представляет собой важную антиоксидантную защиту во всех клетках, подвергнутых воздействию кислорода. В настоящем изобретении SOD1 используется в качестве пептидного линкера, способного связывать Fac VII с носителем, способным увеличивать время полувыведения из кровотока. SOD1, обычно встречающуюся в организме, используют в качестве линкера, тем самым снижая иммуногенность линкера. VLKG (валин-лейцин-лизин-глицин) в рамках последовательности пептидного линкера SOD1 может быть заменен на сайт саморасщепления последовательности IPRI (изолейцин-пролин-аргинин-изолейцин), который узнается и расщепляется производным Fac VIIa. Благодаря такой замене на саморасщепляющуюся последовательность, область линкера, ненужная для активации, может быть удалена при помощи производного Fac VIIa при активации.
В настоящем изобретении, сайт саморасщепления представляет собой сайт, содержащий определенную последовательность, где полипептид имеет соответствующую определенную последовательность в своей собственной последовательности и узнает и расщепляет его.
В данном контексте термин ʺпроизводное Fac VIIʺ означает модифицированный Fac VII, который содержит аминокислотную последовательность, полученную путем связывания пептидного линкера с С-концом Fac VII. Производное Fac VII по настоящему изобретению означает форму до активации и превращается в производное Fac VIIa при активации посредством определенного способа. В настоящем изобретении производное Fac VII и производное Fac VIIa могут иметь одинаковое значение, за исключением конкретной стадии, например процесса получения конъюгата или тому подобного. В настоящем изобретении производное Fac VII представляет собой, но конкретно не ограничено ими, полипептид (SEQ ID NO: 9), полученный посредством связывания ATKAVC (SEQ ID NO: 5), 1-6 аминокислот из последовательности SOD1, с С-концом производного Fac VII, полипептид (SEQ ID NO: 13), полученный путем связывания GGGGSC (SEQ ID NO: 10) с С-концом производного Fac VII, полипептид (SEQ ID NO: 14), полученный путем связывания аминокислотной последовательности из 1-149 аминокислот последовательности SOD1 с С-концом производного Fac VII, полипептид (SEQ ID NO: 34), полученный путем связывания аминокислотной последовательности из 1-90 аминокислот последовательности SOD1 с С-концом производного Fac VII, полипептид (SEQ ID NO: 35), полученный путем связывания аминокислотной последовательности из 1-25 аминокислот последовательности SOD1 с С-концом производного Fac VII, полипептид (SEQ ID NO: 20), полученный путем связывания аминокислотной последовательности из 1-149 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VII, полипептид (SEQ ID NO: 27), полученный путем связывания аминокислотной последовательности из 1-90 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VII или полипептид (SEQ ID NO: 24). полученный путем связывания аминокислотной последовательности из 1-25 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VII.
В данном контексте термин ʺпроизводное Fac VIIaʺ означает активную форму производного Fac VII, которая имеет аминокислотную последовательность, идентичную аминокислотной последовательности производного Fac VII, но активируется посредством расщепления между аминокислотами в положениях 152 и 153. В настоящем изобретении производное Fac VIIa представляет собой, но конкретно не ограничено ими, полипептид (SEQ ID NO: 9), полученный путем связывания ATKAVC (SEQ ID NO: 5), 1-6 аминокислот последовательности SOD1 с С-концом производного Fac VIIa, полипептид (SEQ ID NO: 13) полученный путем связывания GGGGSC (SEQ ID NO: 10) с С-концом производного Fac VIIa, полипептид (SEQ ID NO: 14), полученный путем связывания аминокислотной последовательности из 1-149 аминокислот последовательности SOD1 с С-концом производного Fac VIIa, полипептид (SEQ ID NO: 34), полученный путем связывания аминокислотной последовательности из 1-90 аминокислот последовательности SOD1 с С-концом производного Fac VII, полипептид (SEQ ID NO: 35) полученный путем связывания аминокислотной последовательности из 1-25 аминокислот последовательности SOD1 с С-концом производного Fac VII, полипептид (SEQ ID NO: 20), полученный путем связывания аминокислотной последовательности из 1-149 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VIIa, полипептид (SEQ ID NO: 27), полученный путем связывания аминокислотной последовательности из 1-90 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VII, или полипептид (SEQ ID NO: 24), полученный путем связывания аминокислотной последовательности из 1-25 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VIIa.
Авторы настоящего изобретения исследовали характеристики активированного Fac VII и запланировали разработать производное, имеющее улучшенное время полувыведения из кровотока без снижения активности Fac VIIa. Неактивированный Fac VII представляет собой одноцепочечный Fac VII, полученный посредством соединения легкой и тяжелой цепей и открытым является только N-конец легкой цепи. Однако когда он превращается в Fac VIIa, активный сайт тяжелой цепи становится открытым при расщеплении между аргинином в положении 152 и изолейцином в положении 153, и открытый изолейцин в положении 153 становится N-концом тяжелой цепи. N-конец тяжелой и легкой цепей играет важную роль в активации Fac VIIa и, таким образом, конъюгация на N-конце может снизить активность Fac VII по сравнению с нативным Fac VII.
По этой причине авторы настоящего изобретения предлагают производное Fac VII, полученное с использованием фрагмента пептидной последовательности SOD1 в качестве линкера, где пептидный фрагмент, содержащий цистеин, не открыт структурно наружу и поэтому не включен в дисульфидную связь. Кроме того, в пептидный фрагмент, присоединенный в качестве линкера, вставлена последовательность сайта саморасщепления, которую может узнать и расщепить производное Fac VIIa и, таким образом, линкер, ненужный для активации, может быть удален. В настоящем изобретении предлагается производное Fac VII, которое имеет фрагмент, содержащий свободный цистеин пептида SOD1 на С-конце. Было обнаружено, что димерная форма производного Fac VII образуется на самом низком уровне во время инкубации, и производное Fac VII способно легко образовывать конъюгат с носителем, способным увеличивать время полувыведения из кровотока, тем самым компенсируя недостатки нативного Fac VII и производных, полученных простой вставкой цистеина в Fac VIIa.
Следовательно, конъюгат получают путем связывания с С-концом Fac VII или производного Fac VIIa по настоящему изобретению вещества, способного в значительной степени улучшать время полувыведения из кровотока с сохранением функции свертывания крови и значительно улучшать соблюдение схемы приема лекарственного средства, тем самым получая продукт, являющийся более эффективным в улучшении свертывания крови и предупреждении или лечении гемофилии, чем известные продукты.
В другом аспекте настоящего изобретения предлагает полинуклеотид, кодирующий производное Fac VII, экспрессирующий вектор, содержащий полинуклеотид, трансформант с введенным экспрессирующим вектором для экспрессии производного Fac VII, а также способ получения производного Fac VII с использованием трансформанта.
Полинуклеотид, кодирующий производное Fac VII, предложенный в настоящем изобретении, представляет собой, но конкретно не ограничен им, полинуклеотид, который получен путем связывания Fac VII-кодирующей области с областью, кодирующей пептидный линкер и, предпочтительно, полинуклеотид (SEQ ID NO: 8), кодирующий полипептид (SEQ ID NO: 9), который получен путем связывания ATKAVC (SEQ ID NO: 5) из 1-6 аминокислот последовательности SOD1 с С-концом производного Fac VII, полинуклеотид (SEQ ID NO: 12), кодирующий полипептид (SEQ ID NO: 13), который получен путем связывания GGGGSC (SEQ ID NO: 10) с С-концом производного Fac VII, полинуклеотид (SEQ ID NO: 15), кодирующий полипептид (SEQ ID NO: 14), который получен путем связывания 1-149 аминокислот последовательности SOD1 с С-концом производного Fac VII, полинуклеотид (SEQ ID NO: 21), кодирующий полипептид (SEQ ID NO: 20), который получен путем связывания 1-149 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VII, полинуклеотид (SEQ ID NO: 28) кодирующий полипептид (SEQ ID NO: 27), который получен путем связывания 1-90 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VII или полинуклеотид (SEQ ID NO: 25), кодирующий полипептид (SEQ ID NO: 24), который получен путем связывания 1-25 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VII.
Экспрессирующий вектор, содержащий полинуклеотид, кодирующий производное Fac VII, предложенный в настоящем изобретении, представляет собой, но конкретно не ограничен им, вектор, способный к репликации и/или экспрессии полинуклеотида в эукариотических или прокариотических клетках, включая клетки млекопитающих (например клетки человека, обезьяны, кролика, крысы, хомяка, мыши и т.д.), растительные клетки, дрожжевые клетки, клетки насекомых или бактериальные клетки (например Е.coli и т.д.) и, предпочтительно, вектор, который функционально связан с подходящим промотором для экспрессии полинуклеотида в клетке-хозяине и содержит по меньшей мере один селективный маркер. Более предпочтительно, это может быть экспрессирующий вектор, полученный путем введения полинуклеотида в фаг, плазмиду, космиду, мини-хромосому, вирусный вектор или ретровирусный вектор. Наиболее предпочтительно, это может быть экспрессирующий вектор pX0GC-FVII-ATKAVC, включающий полинуклеотид, кодирующий производное Fac VII, который получен путем связывания полинуклеотида, кодирующего ATKAVC (SEQ ID NO: 5), 1-6 аминокислот последовательности SOD1 с 3'-концом гена Fac VII, экспрессирующий вектор pX0GC-FVII-GGGGSC, включающий полинуклеотид, кодирующий производное Fac VII, который получен путем связывания полинуклеотида, кодирующего GGGGSC (SEQ ID NO: 10) с 3'-концом гена Fac VII, экспрессирующий вектор pX0GC-FVII-SOD1 1-149, включающий полинуклеотид, кодирующий производное Fac VII, который получен путем связывания полинуклеотида, кодирующего аминокислотную последовательность (SEQ ID NO: 14) из 1-149 аминокислот последовательности SOD1 с 3'-концом гена Fac VII, экспрессирующий вектор pX0GC-FVII-SOD1 IPRI, включающий полинуклеотид, кодирующий производное Fac VII (SEQ ID NO: 21). который получен путем связывания полинуклеотида, кодирующего 1-149 аминокислоты мутантной последовательности SOD1 с 3'-концом гена Fac VII, экспрессирующий вектор pX0GC-FVII-SOD1 1-90 IPRI, включающий полинуклеотид, кодирующий производное Fac VII (SEQ ID NO: 28), который получен путем связывания полинуклеотида, кодирующего 1-90 аминокислоты мутантной последовательности SOD1 с 3'-концом гена Fac VII или экспрессирующий вектор pX0GC-FVII-SOD1 1-25 IPRI, включающий полинуклеотид, кодирующий производное Fac VII (SEQ ID NO: 25), который получен путем связывания полинуклеотида, кодирующего 1-25 аминокислоты мутантной последовательности SOD1 с 3'-концом гена Fac VII.
Трансформант с введенным экспрессирующим вектором, предложенный в настоящем изобретении, представляет собой, но конкретно не ограничен ими, бактериальные клетки, такие как Е.coli, Streptomyces и Salmonella typhimurium; дрожжевые клетки, такие как Pichia pastoris; клетки насекомых, такие как клетки Drosophila и Spodoptera Sf9; клетки животных, такие как СНО (клетки яичника китайского хомячка), COS (клетки почки обезьяны, трансформированные вирусом SV-40), NSO, 293, и клетки меланомы Боуэса (Bowes); или растительные клетки, которые трансформированы путем введения экспрессирующего вектора. Предпочтительно это может быть трансформант, получен путем введения экспрессирующего вектора в клеточные линии 293F или СНО, и наиболее предпочтительно HMF709, полученный путем введения экспрессирующего вектора pX0GC-FVII-ATKAVC в клеточную линию СНО.
Способ получения производного Fac VII, предложенного в настоящем изобретении, включают стадии (1) культивирования трансформанта с получением раствора культуры; и (2) выделения производного Fac VII из раствора культуры.
Способ, кроме того, включает стадию активации выделенного производного Fac VII, посредством чего получают производное Fac VIIa из полученного производного Fac VII. Способ активации такой же, как описан выше.
Авторы настоящего изобретения получили экспрессирующий вектор pX0GC-FVII-ATKAVC, включающий полинуклеотид, кодирующий производное Fac VII, который получен путем связывания полинуклеотида, кодирующего ATKAVC (SEQ ID NO: 5) из 1-6 аминокислот последовательности SOD1 с 3'-концом гена Fac VII (Пример 2-1), и экспрессирующий вектор был введен в клеточную линию 293F (Пример 3-1) или клеточную линию СНО (Пример 3-2) с получением трансформанта. Затем производное Fac VII экспрессировалось в этом трансформанте, и экспрессированное производное Fac VII подвергали очистке (Пример 4, Фиг. 2). Экспрессированное производное Fac VII активировали с получением производного Fac VIIa с последующим сравнением его активности с активностью нативного Fac VIIa (Пример 6 и Фиг. 4). В результате было обнаружено, что производное Fac VIIa, полученное из производного Fac VII по настоящему изобретению, демонстрирует активность, эквивалентную нативному Fac VIIa. Таким образом, из трансформантов, полученных посредством введения экспрессирующего вектора pX0GC-FVII-ATKAVC в СНО клетки, выбирали клон, демонстрирующий самый высокий уровень экспрессии производного Fac VII, и он были обозначен ʺHMF709ʺ и депонирован в Корейской коллекции типовых культур, Корейский исследовательский институт биологических наук и биотехнологии (111 Gwahangno, Yuseong-gu, Daejeon, Korea) под регистрационным номером ʺKCTC12022BPʺ.
В еще одном аспекте настоящего изобретения предлагается конъюгат Fac VII или его активная форма Fac VIIa, которую получают путем связывания полимера, способного увеличивать время полувыведения из кровотока, с пептидным линкером производного Fac VII.
Полимер по настоящему изобретению может представлять собой такой полимер, как полиэтиленгликоль, способный увеличивать время полувыведения из кровотока, и может быть выбран из белковых носителей, таких как фрагмент иммуноглобулина, трансферрин, антитело и альбумин.
В настоящем изобретении предлагается конъюгат, который получают путем связывания производного Fac VII с белковым носителем, используя непептидильный полимер в качестве линкера, in vitro, не используя метод генетической рекомбинации.
Непептидильный полимер по настоящему изобретению относится к непептидильному полимеру, предназначенному противостоять расщеплению различными ферментами или иммунными молекулами в крови или сыворотке. Непептидильный полимер, который не ограничивается следующими, может быть выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимера этиленгликоля-пропиленгликоля, полиоксиэтилированных полиолов, поливиниловых спиртов, полисахаридов, декстранов, поливинилэтиловых эфиров, биоразлагаемых полимеров, липидных полимеров, хитинов, гиалуроновых кислот и их комбинации. Непептидильные полимеры могут быть соединены друг с другом посредством ковалентной связи любого типа, за исключением пептидной связи. Кроме того, их производные, известные в данной области, и производные, легко получаемые любым известным в данной области способом, также входят в объем настоящего изобретения. В настоящем изобретении непептидильный полимер может быть связан с пептидным линкером производного Fac VII или производного Fac VIIa. Непептидильный полимер может быть связан с различными сайтами связывания пептидного линкера. Предпочтительно, непептидильный полимер может быть связан с С-концом пептидного линкера, присутствующего у производного Fac VII или производного Fac VIIa.
Непептидильный полимер может содержать реакционно-способную группу, которая может включать, но не ограничивается ими, альдегид, пропиональдегид, бутиральдегид, малеимид или сукцинимид (сукцинимидилпропионат, сукцинимидилкарбоксиметил, гидроксисукцинимидил или сукцинимидилкарбонат). Кроме того, непептидильный полимер может иметь одну реакционно-способную группу или две реакционно-способные группы. Если непептидильный полимер содержит две или более реакционно-способных групп, он может быть соединен с линкером производного Fac VII с помощью одной реакционно-способной группы, а также соединен с другим носителем, таким как антитела, иммуноглобулиновые фрагменты, альбумин или трансферрин, с помощью другой реакционно-способной группы. Например, когда непептидильный полимер имеет реакционно-способную альдегидную группу на одном конце и малеимидную, орто-пиридилдисульфидную или тиольную реакционно-способную группу на другом конце, неспецифическая реакция может быть минимизирована, и это является эффективным в селективном связывании производного Fac VII или производного Fac VIIa и носителя на обоих концах непептидильного полимера. Конечный продукт, полученный посредством восстановительного алкилирования, за счет альдегидной связи может быть более стабильным, чем в случае амидной связи. Кроме того, альдегидная реакционно-способная группа селективно взаимодействует с аминным концом носителя при низком рН и может образовывать ковалентную связь с остатком лизина при высоком рН, например рН 9,0.
В еще одном аспекте в настоящем изобретении предлагается комплекс Fac VII или его активной формы Fac VIIa, который получают путем соединения производного Fac VII или его активной формы Fac VIIa с Fc-областью иммуноглобулина посредством непептидильного полимера.
Комплекс Fac VII, который соединен с носителем, таким как антитело. фрагмент иммуноглобулина, альбумин и трансферрин, в частности Fc иммуноглобулина, посредством непептидильного полимера, может быть получен посредством стадий (1) ковалентного связывания непептидильного полимера, имеющего реакционно-способную группу в виде альдегида или сукцинимидного производного на его одном конце, с аминогруппой Fc иммуноглобулина; (2) извлечения конъюгата, содержащего Fc-область иммуноглобулина, ковалентно связанную с непептидильным полимером по аминогруппе, из реакционной смеси со стадии (1); (3) ковалентного связывания производного Fac VII с другим концом непептидильного полимера, имеющего малеимидную, орто-пиридилдисульфидную или тиольную реакционную группу в выделенном конъюгате, с получением комплекса Fac VII, имеющего Fc-область иммуноглобулина и производное Fac VII на каждом конце непептидильного полимера; и (4) активации конъюгата Fac VII, полученного на стадии (3), с получением комплекса Fac VII, имеющего Fac VIIa и Fc-область иммуноглобулина, связанные посредством непептидильного полимера.
Кроме того, комплекс Fac VII может быть получен посредством стадий (1) ковалентного связывания непептидильного полимера, имеющего малеимидную, орто-пиридилдисульфидную или тиольную реакционную группу на одном его конце, с С-концевой тиольной группой производного Fac VII; (2) выделения конъюгата, который включает производное Fac VII, ковалентно связанное с непептидильным полимером, из реакционной смеси со стадии (1); (3) ковалентного связывания Fc-области иммуноглобулина с другим концом непептидильного полимера, имеющего реакционно-способную группу в виде альдегида или сукцинимидного производного в выделенном конъюгате, с получением комплекса Fac VII, имеющего Fc-область иммуноглобулина и производное Fac VII на каждом конце непептидильного полимера; и (4) активации конъюгата Fac VII, полученного на стадии (3) с получением комплекса Fac VII, имеющего Fac VIIa и Fc-область иммуноглобулина, связанные посредством непептидильного полимера.
Кроме того, комплекс Fac VII можно получить посредством стадий (1) ковалентного связывания непептидильного полимера, имеющего малеимидную, орто-пиридилдисульфидную или тиольную реакционную группу на одном конце, с С-концевой тиольной группой производного Fac VIIa; (2) выделение конъюгата, который включает производное Fac VII, ковалентно связанное с непептидильным полимером, из реакционной смеси со стадии (1); и (3) ковалентное связывание Fc-области иммуноглобулина с другим концом непептидильного полимера, имеющего реакционно-способную группу в виде альдегида или сукцинимидного производного в выделенном конъюгате, с получением комплекса Fac VII, имеющего Fc-область иммуноглобулина и производное Fac VIIa на каждом конце непептидильного полимера.
С другой стороны, непептидильный полимер может включать две или три реакционно-способных концевые группы, и эти две или три реакционно-способные концевые группы могут быть одинаковыми или отличными друг от друга. Например, он может иметь малеимидную группу на одном конце и альдегидную группу, пропиональдегидную группу или бутиральдегидную группу на другом конце. Когда поли(этиленгликоль), имеющий гидроксильные реакционно-способные группы на обоих концах, используется в качестве непептидильного полимера, гидроксильная группа может быть активирована в различные реакционно-способные группы посредством известных химических реакций, или поли(этиленгликоль), имеющий имеющуюся в продаже модифицированную реакционно-способную группу, можно использовать для того, чтобы получить конъюгат и комплекс Fac VII по настоящему изобретению.
Таким образом, непептидильный полимер, включенный в конъюгат и комплекс Fac VII по настоящему изобретению, предпочтительно может представлять собой непептидильный полимер, имеющий метильную группу на одном конце и малеимидную, орто-пиридилдисульфидную или тиольную реакционно-способную группу на другом конце, и более предпочтительно непептидильный полимер, имеющий малеимидную, орто-пиридилдисульфидную или тиольную реакционно-способную группу на одном конце и реакционно-способную группу в виде альдегида или сукцинимидного производного на другом конце, и наиболее предпочтительно непептидильный полимер, имеющий малеимидную реакционно-способную группу и альдегидную реакционно-способную группу на обоих концах соответственно.
Производное Fac VII, которое используют в получении конъюгата или комплекса с использованием производного Fac VII по настоящему изобретению, может представлять собой неактивную форму или активированное производное Fac VIIa. Однако применение Fac VII является предпочтительным, чтобы предотвратить расщепления, связанного с активированным Fac VIIa, при получении конъюгата с использованием производного Fac VIIa.
В качестве носителя Fc-области могут быть получены из нативных форм, выделенных из людей и других животных, включающих коров, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок. Кроме того, Fc-область иммуноглобулина может быть Fc-областью, которая происходит из IgG, IgA, IgD, IgE и IgM или которая создана посредством их комбинирования или является их гибридами. Предпочтительно, она происходит из IgG или IgM, которые входят в число самых распространенных белков в человеческой крови, и наиболее предпочтительно из IgG, который, как известно, увеличивает время полувыведения лиганд-связывающих белков. Fc иммуноглобулина может быть получен из нативного иммуноглобулина путем выделения целых иммуноглобулинов из организмов человека или животных и их обработки определенным протеолитическим ферментом, а также может быть получен из трансформированных клеток рекомбинантными методами. Предпочтительно, он представляет собой рекомбинантную человеческую Fc-область иммуноглобулина из E.coli. С другой стороны, IgG подразделяется на подклассы IgG1, IgG2, IgG3 и IgG4, и настоящее изобретение включает их комбинации и гибриды. Предпочтительными являются подклассы IgG2 и IgG4, и наиболее предпочтительной является Fc-область из IgG4, редко имеющая эффекторные функции, такие как CDC (комплемент-зависимая цитотоксичность).
Таким образом, в качестве носителя лекарственного средства по настоящему изобретению наиболее предпочтительной Fc-областью иммуноглобулина является человеческая, происходящая из IgG4, негликозилированная Fc-область. Полученная из человека Fc-область является более предпочтительной, чем Fc-область, полученная не из человека, которая может действовать в качестве антигена в организме человека и вызывать нежелательные иммунные реакции, такие как продуцирование нового антитела против антигена.
Недостатками пептидного линкера, который используется в слитом белке, полученном с помощью традиционного метода слияния в пределах рамки считывания, является то, что он легко расщепляется in vivo протеолитическим ферментом и, таким образом, не может быть получен ожидаемый достаточный эффект увеличения при помощи носителя времени полувыведения активного лекарственного средства из сыворотки. Однако в настоящем изобретении можно использовать полимер, имеющий устойчивость к протеолитическому ферменту, для сохранения времени полувыведения пептида из сыворотки, подобного времени полувыведения носителя. Следовательно, любой непептидильный полимер можно использовать без ограничения, пока он представляет собой полимер, имеющий вышеприведенную функцию, то есть полимер, устойчивый к in vivo протеолитическому ферменту. Непептидильный полимер имеет молекулярную массу в диапазоне от 1 до 100 кДа и предпочтительно от 1 до 40 кДа. Непептидильный полимер по настоящему изобретению, соединенный с Fc-областью иммуноглобулина, может представлять собой один полимер или комбинацию разных типов полимеров.
В одном воплощении настоящего изобретения определяли in vitro активность конъюгата Fac VII. Настоящее изобретение предназначено миниминизировать снижение активности посредством сайт-специфической конъюгации Fac VII и непептидильного полимера. Таким образом, активности Fac VII-ATKAVC и Fac VII-ATKAVC-40 кДа PEG определяли с использованием нативного Fac VII и Fac VII-40 кДа PEG в качестве контрольной группы (Пример 7). В результате было обнаружено, что in vitro активность N-концевого пегилированного Fac VII-40 кДа PEG составляла примерно 11%, по сравнению с активностью Fac VII, и in vitro активность С-концевого пегилированного Fac VII-ATKAVC-40 кДа PEG составляла примерно 29%, по сравнению с активностью Fac VII-ATKAVC. Таким образом, С-концевой пегилированный Fac VII-ATKAVC-40 кДа PEG сохраняет активность примерно в 2,5 раза выше, чем EC50 N-концевого пегилированного Fac VII-40 кДа PEG, указывая, что активность Fac VII может сохраняться на более высоком уровне посредством сайт-специфической конъюгации с использованием ATKAVC (Таблица 2).
В другом воплощении определяли in vitro активность комплекса, полученного путем соединения непептидильного полимера и Fc-области иммуноглобулина с конъюгатом Fac VII (Пример 8). В результате было обнаружено, что in vitro активность Fac VIIa-ATKAVC-PEG-Fc составляла примерно 45%, по сравнению с активностью Fac VIIa-ATKAVC (Таблица 3), указывая, что комплекс, соединенный с непептидильным полимером и Fc-областью иммуноглобулина, имеет носитель, способный улучшать время полувыведения из кровотока при сохранении активности Fac VII, вследствие этого широко используемый в разработке более эффективного профилактического и терапевтического агента для гемофилии.
В еще одном аспекте настоящее изобретение предлагает способ получения конъюгат Fac VIIaa, включающий стадию активации конъюгата Fac VII и конъюгат Fac VIIa, полученный посредством этого способа. Более подробно, способ получения конъюгата Fac VIIa может включать стадии (1) ковалентного связывания непептидильного полимера, способного увеличивать время полувыведения из кровотока, с С-концевой тиольной группой производного Fac VII; (2) выделения конъюгата Fac VII, который содержит непептидильный полимер, связанный с Fac VII производным; и (3) активацию выделенного конъюгата Fac VII с получением конъюгата Fac VIIa, имеющего непептидильный полимер, связанный с областью Fac VIIa.
Кроме того, способ включает стадии (1) ковалентного связывания непептидильного полимера, способного увеличивать время полувыведения из кровотока, с С-концевой тиольной группой производного Fac VIIa; и (2) выделение конъюгата Fac VIIa, который содержит непептидильный полимер, связанный с Fac VIIa производным, с получением конъюгата Fac VIIa, имеющего непептидильный полимер, связанный с областью Fac VIIa.
Непептидильный полимер, способный увеличивать время полувыведения из кровотока, используемый в способе, является таким, как описано выше, и способ активации Fac VII или конъюгата Fac VII представляет собой, но конкретно не ограничен ею, активацию на колонке (автоактивацию) активируемого Fac VII или конъюгата Fac VII путем присоединения его к анионообменной колонке или активацию в растворе активируемого Fac VII или конъюгата Fac VII посредством его взаимодействия в фазе раствора. В частности, активация на колонке также называется твердофазной активацией и выполняется посредством ʺавтоактивацииʺ после присоединения Fac VII или конъюгата Fac VII к анионообменной колонке без дополнительных компонентов. Напротив, активация в растворе представляет собой способ индукции активации Fac VII с учетом различных факторов, необходимых для активации Fac VII, например концентрации ионов кальция, рН, температуры и концентрации Fac VII.
Авторы настоящего изобретения показали, что время полувыведения из кровотока конъюгата, полученного путем связывания иммуноглобулинового фрагмента с нативным Fac VII посредством непептидильного линкера увеличивалось примерно в 200 раз по сравнению с нативным Fac VII, не имеющим иммуноглобулинового фрагмента (Корейская патентная заявка 2010-0062860). Хорошо известно, что увеличенное время полувыведения не является отличительным свойством Fac VII, но является отличительным свойством непептидильного линкера и иммуноглобулинового фрагмента. Следовательно, также ожидается, что конъюгат, полученный с использованием полученного производного Fac VII, будет иметь увеличенное время полувыведения.
В еще одном аспекте настоящего изобретения предлагается фармацевтическая композиция для предупреждения или лечения гемофилии или фармацевтическая композиция для свертывания крови, содержащая производное Fac VII или его активную форму Fac VIIa, конъюгат Fac VII или его активную форму Fac VIIa, комплекс Fac VII или его активную форму Fac VIIa в качестве активного ингредиента.
Кроме того, в настоящем изобретении предлагается способ предупреждения или лечения гемофилии или улучшения свертывания крови, включающий введение субъекту терапевтически эффективного количества фармацевтической композиции.
В данном контексте термин ʺпредупреждениеʺ означает все действия, которые подавляют или замедляют возникновение гемофилии посредством сопутствующего введения композиции по настоящему изобретению, а термин ʺлечениеʺ означает все действия, с помощью которых симптомы диабета меняются к лучшему или благоприятно изменяются посредством сопутствующего введения композиции по настоящему изобретению.
В настоящем изобретении способ улучшения свертывания крови представляет собой стимулирование действия фактора свертывания крови путем получения производных, конъюгатов или комплексов, имеющих значительно увеличенное время полувыведения из кровотока фактора свертывания крови Fac VII или его активной формы Fac VIIa, имеющей короткое время полувыведения.
Кроме того, фармацевтическая композиция по настоящему изобретению может включать фармацевтически приемлемый носитель. В данном контексте термин ʺфармацевтически приемлемый носительʺ относится к носителю или растворителю, который не вызывает значительного раздражения в организме и не подавляет биологическую активность и свойства введенного компонента. Для перорального введения фармацевтически приемлемый носитель может включать связующее вещество, смазывающее вещество, разрыхлитель, наполнитель, солюбилизатор, диспергирующий агент, стабилизатор, суспендирующий агент, краситель и ароматизатор. Для инъецируемых препаратов фармацевтически приемлемый носитель может включать буферный агент, консервант, анальгетик, солюбилизатор, изотонический агент и стабилизатор. Для препаратов для местного введения фармацевтически приемлемый носитель может включать основу, наполнитель, смазывающее вещество и консервант. Фармацевтическая композиция по настоящему изобретению может быть приготовлена в виде различных лекарственных форм в комбинации с вышеуказанными фармацевтически приемлемыми носителями. Например, для перорального введения фармацевтическая композиция может быть приготовлена в виде таблеток, пастилок, капсул, эликсиров, суспензий, сиропов или пластинок. Для инъецируемых препаратов фармацевтическая композиция может быть приготовлена в виде стандартной лекарственной формы, такой как многодозовый контейнер или ампула в качестве лекарственной формы для однократного введения. Фармацевтические композиции также могут быть изготовлены в виде растворов, суспензий, таблеток, пилюль, капсул и препаратов длительного действия.
С другой стороны, примеры носителя, эксципиента и растворителя, подходящие для фармацевтических композиций, включают лактозу, декстрозу. сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмал, гуммиарабик, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния и минеральные масла. Кроме того, фармацевтические композиции также могут включать наполнители, антикоагулянты, смазывающие вещества, увлажнители, ароматизаторы и антисептики.
В еще одном аспекте настоящего изобретения предлагается способ лечения гемофилии, включающий введение субъекту с гемофилией терапевтически эффективного количества фармацевтической композиции для предупреждения или лечения гемофилии, содержащей производное, конъюгат или комплекс в качестве активного ингредиента. При этом фармацевтическую композицию можно вводить отдельно или в комбинации с другими терапевтическими агентами одновременно или последовательно.
В данном контексте термин ʺвведениеʺ означает введение заранее определенного количества вещества пациенту определенным подходящим способом. Композицию можно вводить посредством любого из обычных способов, если она способна достичь нужной ткани. Рассматриваются разнообразные способы введения, включая внутрибрюшинное, внутривенное, внутримышечное, подкожное, внутрикожное, пероральное, местное, интраназальное, внутрилегочное и ректальное, но настоящее изобретение не ограничено этими, приведенными в качестве примера, способами введения. Однако поскольку пептиды перевариваются при пероральном введении, активные ингредиенты композиции для перорального введения должны быть покрыты оболочкой или изготовлены с защитой против разрушения в желудке. Предпочтительно, мультимер можно вводить в инъекционной форме. Кроме того, фармацевтическую композицию можно вводить с использованием определенного аппарата, способного транспортировать активные ингредиенты в клетку-мишень.
Кроме того, фармацевтическая композиция по настоящему изобретению может определяться несколькими сопутствующими факторами, включающими типы заболеваний, подвергаемых лечению, пути введения, возраст, пол, массу пациента и тяжесть заболевания, а также типами лекарственного средства, используемого в качестве активного компонента.
Фармацевтическая композиция по настоящему изобретению показывает превосходную in vivo продолжительность эффективности и титра, тем самым значительно сокращая число и частоту ее введения для предупреждения или лечения гемофилии или для улучшения свертывания крови.
Осуществление изобретения
Ниже настоящее изобретение будет описано более подробно со ссылкой на примеры. Однако эти примеры приведены только с целью иллюстрации и не предполагается ограничивать изобретение этими примерами.
Пример 1: Получение экспрессирующего вектора, содержащего ген Fac VII
Во-первых, ген человеческого Фактора VII, содержащий сигнальную последовательность, получали с использованием метода полимеразной цепной реакции (ПЦР). Для амплификации гена Фактора VII (Fac VII) использовали в качестве матрицы библиотеку кДНК печени эмбриона человека (TAKARA BIO USA), и прямые и обратные праймеры со следующими последовательностями SEQ ID NO: 1 и 2 использовали для осуществления ПЦР (95°С 1-минутная денатурации; 30 циклов (95°С 30 секунд, 60°С 30 секунд and 68°C 90 секунд); 68°С 5 минут). В это время для облегчения клонирования, сайт узнавания для фермента рестрикции BamHI был вставлен в праймер с последовательностью SEQ ID NO: 1, а сайт узнавания для фермента рестрикции XhoI был вставлен в праймер с последовательностью SEQ ID NO: 2. Затем анализировали нуклеотидную последовательность (SEQ ID NO: 3 и 4) ПЦР-продукта из примерно 1,3 т.п.н., полученного посредством ПЦР.
VIIBHISS F: 5'-cccggatccatggtctcccaggccctcaggctcc-3' (SEQ ID NO: 1)
VIIXhoIAS R: 5'-gggctcgagctagggaaatggggctcgcagg-3 (SEQ ID NO: 2)
Для экспрессии полученного ПЦР-продукта под контролем CMV(цитомеголавирус)-промотора, его клонировали в экспрессирующий вектор pX0GC для клетки животного. Вектор pX0GC представляет собой экспрессирующий вектор, включающий один или более DHFR(дигидрофолатредуктаза)-промотор с удаленной последовательностью повтора CCGCCC и DHFR-кодирующую нуклеотидную последовательность, функционально связанную с ним (Корейский патент 880509). В частности, ПЦР-продукт расщепляли с помощью рестриктаз BamHI и XhoI при 37°С в течение 2 часов и применяли ПЦР-набор для очистки (Qiagen, USA), чтобы получить расщепленный фрагмент ДНК. Фрагмент ДНК смешивали с вектором pX0GC, обработанным рестрикционными ферментами BamHI и XhoI, и клонировали с использованием ДНК-лигазы Т4, тем самым получая экспрессирующий вектор, включающий Fac VII ген.
Пример 2: Получение экспрессирующего вектора для экспрессии различных рекомбинантных производных Fac VII.
Экспрессирующий вектор (pX0GC-FVII), содержащий ген Fac VII, полученный в Примере 1, использовали для получения полинуклеотида, кодирующего производное Fac VII, которое имело частичную последовательность SOD1 (супероксиддисмутаза 1, SEQ ID NO: 30) на С-конце Fac VII, и получали экспрессирующий вектор, способный экспрессировать это производное.
Пример 2-1: Получение рекомбинантного вектора pX0GC-FVII-ATKAVC, экспрессирующего производное Fac VII
Получали рекомбинантный вектор pX0GC-FVII-ATKAVC, экспрессирующий производное Fac VII, который содержит полинуклеотид, дополнительно имеющий полинуклеотид, кодирующий последовательность из 1-6 аминокислот последовательности SOD1 на 3'-конце гена Fac VII, включенный в экспрессирующий вектор pX0GC-FVII, полученный в Примере 1. Более подробно, в качестве матрицы использовали экспрессирующий вектор pX0GC-FVII, и прямые и обратные праймеры со следующими последовательностями SEQ ID NO: 6 и 7 использовали для осуществления ПЦР (95°С 1 минутная денатурация; 30 циклов (95°С 60 секунд, 60°С 60 секунд и 68°С 90 секунд); 68°С 5 минут). В это время для облегчения клонирования сайт узнавания рестриктазой EcoRI был вставлен в праймер с SEQ ID NO: 6 и сайт узнавания рестриктазой XhoI был вставлен в праймер с SEQ ID NO: 7. Затем анализировали нуклеотидную последовательность (SEQ ID NO: 8) ПЦР-продукта из примерно 1,4 т.п.н., полученного посредством ПЦР.
FVIIEcoRISS F (SEQ ID NO: 6):
5'-ccggaattcatggccaacgcgttcctggaggagctgcggccgggc-3'
FVII#1XhoIAS R (SEQ ID NO: 7):
5'-ccgctcgagtcagcacacggccttcgtcgcgggaaatggggctcgcaggaggactcctgggc-3'
Для того чтобы экспрессировать ПЦР-продукт под контролем CMV-промотора, его клонировали в экспрессирующий вектор pX0GC для клетки животного. В частности, ПЦР-продукт расщепляли с помощью рестриктаз EcoRI и XhoI при 37°С в течение 2 часов и использовали ПЦР-набор для очистки с целью получения расщепленного фрагмента ДНК. Фрагмент ДНК смешивали с вектором pX0GC, обработанным рестриктазами EcoRI и XhoI, и клонировали с использованием Т4 ДНК-лигазы, получая, таким образом, экспрессирующий вектор (pX0GC-FVII-ATKAVC), имеющий полинуклеотид, кодирующий производное Fac VII, который содержит полинуклеотид, кодирующий последовательность ATKAVC (SEQ ID NO: 5) из 1-6 аминокислот последовательности SOD1, соединенный с 3'-концом гена Fac VII.
Пример 2-2: Получение рекомбинантного вектора pX0GC-FVII-GGGGSC, экспрессирующего производное Fac VII
Получали рекомбинантный вектор pX0GC-FVII-GGGGSC, экспрессирующий производное Fac VII, содержащий полинуклеотид, дополнительно имеющий полинуклеотид, кодирующий 6 аминокислот (GGGGSC, SEQ ID NO: 10) на 3'-конце гена Fac VII, включенный в экспрессирующий вектор pX0GC-FVII, полученный в Примере 1. Чтобы достичь этого, выполняли ПЦР таким же образом, что и в Примере 2-1, за исключением того, что использовали прямые и обратные праймеры SEQ ID NO: 6 и 11 и анализировали нуклеотидную последовательность (SEQ ID NO: 12) продукта ПЦР из примерно 1.4 т.п.н. Затем экспрессирующий вектор (pX0GC-FVII-GGGGSC), содержащий полинуклеотид, кодирующий производное Fac VII, имеющий полинуклеотид, кодирующий GGGGSC (SEQ ID NO: 10) на 3'-конце гена Fac VII, получали таким же способом, что и в Примере 2-1, за исключением использования продукта ПЦР.
FVII#2XhoIAS R (SEQ ID NO: 11):
5'-ccgctcgagtcagcaggagccgccgccgccgggaaatggggctcgcaggaggactcctgggc-3'
Пример 2-3: Получение рекомбинантного вектора pX0GC-FVII-SOD1 1-149, экспрессирующего производное Fac VII
Получали рекомбинантный вектор pX0GC-FVII-SOD1 1-149, экспрессирующий производное Fac VII, который содержал полинуклеотид (SEQ ID NO: 15), дополнительно имеющий полинуклеотид, кодирующий 1-149 аминокислоты последовательности SOD1 (супероксиддисмутаза 1) на 3'-конце гена Fac VII, включенный в экспрессирующий вектор pX0GC-FVII, полученный в Примере 1.
Более подробно, последовательность ДНК Fac VII (SEQ ID NO: 3) использовали в качестве матрицы и для осуществления ПЦР использовали прямой праймер Fac VII (SEQ ID NO: 16) и обратный праймер Fac VII (SEQ ID NO: 17) (95°С 1 минутная денатурация; 30 циклов (95°С 60 секунд, 60°С 60 секунд и 68°С 90 секунд); 68°С 5 минут). В это время для облегчения клонирования сайт узнавания для рестриктазы EcoRI был вставлен в праймер с SEQ ID NO: 16 и частичная последовательность 5ʺ-конца SOD1 содержалась в праймере с SEQ ID NO: 17. В результате был получен первый ПЦР-фрагмент.
FVIIEcoRISS F: 5'-ccggaattcatggtctcccaggccctcaggctcc-3' (SEQ ID NO: 16)
FVIISODInfAS R: 5'-cggccttcgtcgcgggaaatggggctcgcaggag-3' (SEQ ID NO: 17)
Затем кДНК SOD1 (RC200725, OriGene, USA) использовали в качестве матрицы и прямой праймер SOD1 (SEQ ID NO: 18) и обратный праймер SOD1 (SEQ ID NO: 19) использовали для осуществления ПЦР (95°С 1 минутная денатурация; 30 циклов (95°С 60 секунд, 60°С 60 секунд и 68°С 40 секунд); 68°С 5 минут). В это время для облегчения ʺлокирования частичная последовательность 3'-конца Fac VII содержалась в праймере SEQ ID NO: 18, а сайт узнавания для рестриктазы XhoI был вставлен в праймер SEQ ID NO: 19. В результате получали второй ПЦР-фрагмент.
FVIISODInfSS F: 5'-gagccccatttcccgcgacgaaggccgtgtgcgt-3' (SEQ ID NO: 18)
SODXhoIAS R: 5'-ccgctcgagtcaaattacaccacaagccaaacga-3' (SEQ ID NO: 19)
Первый и второй ПЦР-фрагменты, полученные таким образом, использовали в качестве матрицы, и прямой праймер Fac VII (SEQ ID NO: 16) и обратный праймер SOD1 (SEQ ID NO: 19) использовали для осуществления второй ПЦР. В результате получали третий фрагмент ПЦР (95°С 1 минутная денатурация; 30 циклов (95°С 60 секунд, 60°С 60 секунд и 68°С 120 секунд); 68°С 5 минут).
Для экспрессии полученного третьего ПЦР-продукта под контролем CMV-промотора, его клонировали в экспрессирующий вектор pX0GC животной клетки. Более конкретно, третий ПЦР-продукт расщепляли с помощью рестриктаз EcoRI и XhoI при 37°С в течение 2 часов, и использовали набор для очистки ПЦР-продуктов с получением расщепленного фрагмента ДНК. Фрагмент ДНК смешивали с вектором pX0GC, обработанным рестриктазами EcoRI и XhoI, и клонировали с использованием Т4 ДНК-лигазы, тем самым получая экспрессирующий вектор (pX0GC-FVII-SOD1 1-149), имеющий полинуклеотид, кодирующий производное Fac VII, который содержит полинуклеотид, кодирующий аминокислоты 1-149 последовательности SOD1, соединенные с 3'-концом гена Fac VII.
Пример 2-4: Получение рекомбинантного вектора pX0GC-FVII-SOD1 IPRI, экспрессирующего производное Fac VII
Предполагалось вставить сайт саморасщепления Fac VII в SOD1 ген, включенный в экспрессирующий вектор pX0GC-FVII-SOD1 1-149, полученный в Примере 2-3. Чтобы достичь этого, получали рекомбинантный вектор pX0GC-FVII-SOD1 (PRI, экспрессирующий производное Fac VII, который содержит полинуклеотид (SEQ ID NO: 21), кодирующий аминокислотную последовательность (SEQ ID NO: 20), полученную путем соединения 1-149 аминокислот SOD1, измененных путем замены 7-10 аминокислот (VLKG) из SOD1 в 451-454 аминокислотах Fac VII-SOD1 1-149 (SEQ ID NO: 14) на IPRI, с С-концом Fac VII.
Более подробно, третий ПЦР-фрагмент, полученный в Примере 2-3, использовали в качестве матрицы, и прямые и обратные праймеры (SEQ ID NO: 22 и 23) использовали для осуществления ПЦР. В заключение был получен четвертый ПЦР-фрагмент (95°С 30 секундная денатурация; 18 циклов (95°С 30 секунд, 55°С 60 секунд и 68°С 9 минут); 68°С 9 минут).
Была рассмотрена нуклеотидная последовательность (SEQ ID NO: 21) четвертого ПЦР-продукта из примерно 9 т.п.н.
VIISOD1mutSS F: (SEQ ID NO: 22)
5'-cccgcgacgaaggccgtgtgcattccgaggatcgacggcccagtgcagggcatc-3'
FVIISOD1mutAS R: (SEQ ID NO: 23)
5'-gatgccctgcactgggccgtcgatcctcggaatgcacacggccttcgtcgcggg-3'
Затем четвертый ПЦР-продукт расщепляли с помощью рестриктазы Dpnl при 37°С в течение 1 часа с выделением неизмененной последовательности и клонировали путем трансформации в Е.coli с получением экспрессирующего вектора (pX0GC-FVII-SOD1 IPRI), который содержит полинуклеотид, кодирующий производное Fac VII, имеющее 1-149 аминокислот мутантной SOD1 на С-конце Fac VII.
Пример 2-5: Получение рекомбинантного вектора pX0GC-FVII-SOD1 1-25 IPRI, экспрессирующего производное Fac VII
Был получен рекомбинантный вектор pX0GC-FVII-SOD1 1-25 IPRI, экспрессирующий производное Fac VII, который содержит полинуклеотид (SEQ ID NO: 25), кодирующий аминокислотную последовательность (SEQ ID NO: 24), полученную путем соединения 1-25 аминокислот из SOD1, измененной путем замены 7-10 аминокислот (VLKG) из SOD1 на IPRI, с С-концом Fac VII.
Более подробно, экспрессирующий вектор pX0GC-FVII-SOD1 IPRI, полученный в Примере 2-4, использовали в качестве матрицы, и прямые и обратные праймеры (SEQ ID NO: 16 и 26) использовали для осуществления ПЦР (95°С 1 минутная денатурация; 30 циклов (95°С 60 секунд, 60°С 60 секунд и 68°С 90 секунд); 68°С 5 минут). В заключение был получен пятый ПЦР-фрагмент.
SOD1-25XhoIAS R: 5'-ccgctcgagtcaactttccttctgctcgaaattg-3'(SEQ ID NO: 26)
Затем пятый ПЦР-продукт расщепляли с помощью рестриктаз EcoRI и XhoI при 37°С в течение 2 часов и использовали набор для очистки ПЦР-продуктов с целью получения расщепленного фрагмента ДНК. Фрагмент ДНК смешивали с вектором pX0GC, обработанным рестриктазами EcoRI и XhoI, и клонировали с использованием Т4 ДНК-лигазы, получая, таким образом, экспрессирующий вектор (pX0GC-FVII-SOD1 1-25 IPRI), содержащий полинуклеотид, кодирующий производное Fac VII, имеющее 1-25 аминокислот мутантной последовательности SOD1, соединенные с С-концом гена Fac VII.
Пример 2-6: Получение рекомбинантного вектора pX0GC-FVII-SOD1 1-90 IPRI, экспрессирующего производное Fac VII
Был получен рекомбинантный вектор pX0GC-FVII-SOD1 1-90 IPRI, экспрессирующий производное Fac VII, который содержал полинуклеотид (SEQ ID NO: 28), кодирующий аминокислотную последовательность (SEQ ID NO: 27), полученную путем соединения 1-90 аминокислот из SOD1, измененной путем замены 7-10 аминокислот из SOD1, с IPRI на С-конце Fac VII.
Более подробно, экспрессирующий вектор pX0GC-FVII-SOD1 IPRI, полученный в Примере 2-4, использовали в качестве матрицы, а прямые и обратные праймеры (SEQ ID NO: 16 и 29) использовали для осуществления ПЦР (95°С 1 минутная денатурация; 30 циклов (95°С 60 секунд, 60°С 60 секунд и 68°С 100 секунд); 68°С 5 минут). В заключение был получен пятый ПЦР-фрагмент.
SOD1-90XhoIAS R: 5'-ccgctcgagtcagtcagcagtcacattgcccaag-3'(SEQ ID NO: 29)
Затем пятый ПЦР-продукт расщепляли с помощью рестриктаз EcoRI и XhoI при 37°С в течение 2 часов, и использовали набор для очистки ПЦР-продуктов с целью получения расщепленного фрагмента ДНК. Фрагмент ДНК смешивали с вектором pX0GC, обработанным рестриктазами EcoRI и XhoI, и клонировали с использованием Т4 ДНК-лигазы, тем самым получая экспрессирующий вектор (pX0GC-FVII-SOD1 1-90 IPRI), содержащий полинуклеотид, кодирующий производное Fac VII, имеющее 1-90 аминокислот из мутантной последовательности SOD1, соединенный с С-концом гена Fac VII.
Пример 3: Экспрессия производных Fac VII
Разные производные Fac VII экспрессировали с использованием каждого экспрессирующего вектора, полученного в Примере 2.
Пример 3-1: Экспрессия производных Fac VII в клеточной линии 293F
Экспрессирующий вектор, ничего не имеющий на С-конце Fac VII (контроль), и экспрессирующие векторы (pX0GC-FVII-SOD1 1-149, pX0GC-FVII-SOD1 1-25 IPRI, pX0GC-FVII-SOD1 1-90 IPRI, pX0GC-FVII-ATKAVC или pX0GC-FVII-GGGGSC), где каждый экспрессирующий вектор имеет полинуклеотид, полученный посредством слияния последовательности SOD1 1-149, мутантной последовательности SOD1 1-25, мутантной последовательности SOD1 1-90, последовательности SOD1 1-6 или последовательности GGGGSC с С-концом Fac VII, были введены в клеточную линию Freestyle™ 293 F (Invitrogen, каталожный номер R79007) с получением каждого трансформанта. Каждым трансформантом экспрессировались разные производные Fac VII.
Чтобы достичь этого, клеточную линию 293F пассировали через сутки, с культивированием при 37°С и 8% CO2 при встряхивании со скоростью 120 оборотов в минуту или выше. Когда количество культивируемых клеток достигало 10×105 клеток/мл, и жизнеспособность составляла 85% или более, каждый экспрессирующий вектор, полученный в Примере 2, вводили в клетки с получением трансформантов. Более подробно, 500 мкл реагента Freestyle™ max, 500 мкг каждого экспрессирующего вектора и 10 мл Optipro™ SFM (Invitrogen, каталожный номер 12309-050) добавляли к 500 мл среды для экспрессии Freestyle™ 293 (Invitrogen, каталожный номер 12338-018), имеющей 10×105 клеток/мл, смешивали и оставляли при комнатной температуре на 10 минут для внедрения каждого экспрессирующего вектора в клеточную линию 293F. Затем 50 мкг витамина K, необходимого для активации Fac VII, добавляли к клеткам и культивировали при 37°С и 8% CO2 при встряхивании со скоростью 120 оборотов в минуту или выше в течение 3 суток. После завершения культивирования клетки центрифугировали при 3000 оборотах в минуту в течение 5 минут с получением супернатантов. Каждое производное Fac VII, включенное в супернатант, собирали и очищали. Затем выполняли вестерн-блоттинг с использованием анти-FacVII антител для выявления каждого экспрессированного производного Fac VII (Фиг. 1а-1c).
На Фиг. 1а представлена фотография, показывающая результат вестерн-блоттинга Fac VII-ATKAVC, экспрессированного в клеточной линии 293F, где М является маркером размера (предварительно окрашенный белковый лэддер, Fermentas), на дорожке 1 представлен результат вестерн-блоттинга Fac VII-ATKAVC в восстанавливающих условиях, и на дорожке 2 представлен результат вестерн-блоттинга Fac VII-ATKAVC в невосстанавливающих условиях. Как показано на Фиг. 1а, в невосстанавливающих условиях было обнаружено примерно 20-30% димерных форм, а в восстанавливающих условиях не было обнаружено димерных форм.
Кроме того, на Фиг. 1b представлена фотография, показывающая результат вестерн-блоттинга контрольной группы и FVII-GGGGSC (FVII-G4SC), экспрессированного в клеточной линии 293F, а на Фиг. 1c представлена фотография, показывающая результат вестерн-блоттинга, демонстрирующий различие молекулярной массы Fac VII-ATKAVC и FacVII-SOD1 1-149, экспрессированных в клеточной линии 293F.
Как показано на Фиг. 1b и 1c, было обнаружено, что в клеточной линии 293F могут нормально продуцироваться различные производные Fac VII.
Пример 3-2: Экспрессия производного Fac VII (pX0GC-FVII-ATKAVC) в клеточной линии СНО
Экспрессирующий вектор pX0GC-FVII-ATKAVC, полученный в Примере 2-1, вводили в клеточную линию DG44/CHO (CHO/dhfr-), дефицитную по DHFR, чтобы получить неполный синтез ДНК (Urlaub et al., Somat. Cell. Mol. Genet., 12, 555-566, 1986), с получением трансформанта, и с этого трансформанта экспрессировали производное Fac VII-ATKAVC.
Более подробно, клеточную линию DG44/CHO культивировали до достижения 80-90%-ной конфлюентности и клетки промывали Opti-MEM (Gibco, каталожный номер 51985034) три раза.
С другой стороны, смесь 3 мл Opti-MEM и 5 мкг экспрессирующего вектора pX0GC-FVII-ATKAVC, и смесь 3 мл Opti-MEM и 20 мкп липофектамина (Gibco, каталожный номер 18324-012) оставляли при комнатной температуре в течение 30 минут, соответственно. Затем эти смеси смешивали и добавляли к культивируемой клеточной линии DG44/CHO. Затем клетки культивировали при 37°С и 5% CO2 в течение примерно 18 часов, в результате чего экспрессирующий вектор pX0GC-FVII-ATKAVC был введен в клеточную линию DG44/CHO. Затем культивируемые клетки промывали с помощью дополненной 10% FBS (эмбриональная телячья сыворотка) DMEM-F12 (Gibco, каталожный номер 11330) три раза, и затем туда добавляли среду с последующим культивированием в течение 48 часов. Культивируемые клетки отделяли посредством обработки трипсином и их вносили в среду МЕМ-α (WELGENE. каталожный номер LM008-02)), содержащую 10% FBS и 1 мг/мл G418 (Cellgro, каталожный номер 61-234-RG) без селективной среды (НТ-добавка (гипоксантин-тимидин)). До тех пор, пока выжившие трансформированные клетки не образовывали колонии, среду заменяли селективной средой каждые 2 или 3 дня. Таким образом, из отделенных клеток выделяли трансформированные клетки. В это время для увеличения уровня экспрессия производного Fac VII-ATKAVC в выбранных трансформированных клетках, к селективной среде добавляли 10 нМ МТХ (метотрексат) (Sigma, каталожный номер М8407), постепенно увеличивая концентрацию, и через 2-3 недели содержание МТХ было увеличено до 30 нМ.
Кроме того, с целью снижения гетерогенности трансформированных клеток, для получения отдельных клонов осуществляли метод серийных разведении. Более подробно, трансформированные клетки разбавляли до соотношения 0,7 клетки в каждой лунке 96-луночного планшета и культивировали в течение 2-3 недель, чтобы проверить, будут ли наблюдаться отдельные клоны. Когда наблюдалось образование кластеров из отдельных клонов в лунках, единичные клоны переносили в 24-луночный планшет, и скорость клеточного роста каждого клона и уровень экспрессии производного Fac VII анализировали с помощью ELISA, чтобы выбрать клон с самым высоким уровнем экспрессии производного Fac VII. Этот клон был обозначен как ʺHMF709ʺ и депонирован в Корейской коллекции типовых культур, Корейский исследовательский институт биологических наук и биотехнологии (111 Gwahangno, Yuseong-gu, Daejeon, Korea) 23 сентября, 2011 под регистрационным номером ʺKCTC12022 ВРʺ.
Пример 4: Очистка Fac VII-ATKAVC
Трансформант, полученный в Примере 3-2, культивировали для экспрессии Fac VII-ATKAVC, и культуральный раствор центрифугировали при 3000 об/мин в течение 5 минут с получением супернатанта.
Супернатант фильтровали, используя 0,2 мкм микрофильтрационную мембрану, и к нему добавляли 0,6 М сульфата аммония, и смесь наносили на бутил-НР(высокоэффективную) колонку. Элюирование проводили с использованием буферного раствора с градиентом концентрации (20 мМ Tris-HCl, pH 7,5), содержащего 0,6-0 М сульфата аммония, с получением активной фракции, содержащей Fac VII-ATKAVC.
Буферный раствор полученной активной фракции заменяли на 10 мМ натрий-фосфатным буфером (pH 7,0), который наносили на Гепарин-НР колонку и элюировали, используя буферный раствор (10 мМ фосфата натрия, pH 7,0) с градиентом концентрации 0-1,0 М NaCl, с получением активной фракции, содержащей Fac VII-ATKAVC.
Активную фракцию концентрировали и наносили на колонку Superdex75, а затем элюировали, используя 150 мМ NaCl, 20 мМ Трис-HCl (pH 7,5) буферный раствор, с получением активной фракции, содержащей Fac VII-ATKAVC. Буферный раствор полученной активной фракции заменяли на 2 мМ бензамидин, 20 мМ Трис-HCl (pH 7,5) буферный раствор, который наносили на колонку Q FF. Затем выполняли промывание (2 мМ бензамидин, 0,2 М NaCl, 20 мМ Tris-HCl (pH 8,0) буфер), повторное уравновешивание (2 мМ бензамидин, 0,1 М NaCl, 20 мМ Tris-HCl (pH 8,0) буфер) и элюирование в градиенте концентрации (2 мМ бензамидин, 25 мМ NaCl, 35 мМ CaCl2, 20 мМ Tris-HCl (pH 8,0) буфер) для очистки Fac VII-ATKAVC.
Чистоту очищенного Fac VII-ATKAVC оценивали с помощью SDS PAGE (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия) (Фиг. 2). На Фиг. 2 представлена фотография, показывающая результат электрофореза очищенного Fac VII-ATKAVC, где М представляет собой маркер размера, на дорожке 1 представлен Fac VIII в восстанавливающих условиях, на дорожке 2 представлен Fac VII-ATKAVC в восстанавливающих условиях, на дорожке 3 представлен Fac VII в невосстанавливающих условиях, и на дорожке 4 представлен Fac VII-ATKAVC в невосстанавливающих условиях.
Пример 5: Получение конъюгатов Fac VII-ATKAVC и PEG
Fac VII-ATKAVC, очищенный в Примере 4, конъюгировали с PEG, имеющим разные молекулярные массы, с получением конъюгатов.
Пример 5-1: Получение Fac VII-ATKAVC-40 кДа PEG-конъюгата
Для пегилирования С-конца Fac VII-ATKAVC с помощью 40 кДа мРЕG-малеимида (NOF, Japan) Fac VII-ATKAVC (1 мг/мл) и 40 кДа мPEG-малеимид смешивали d молярном соотношении 1:20 в присутствии 100 мМ фосфатного буфера (рН 5,5), к смеси добавляли восстанавливающий агент, 2 мМ триарилфосфин, и проводили реакцию при 25°С в течение 2 часов. В результате получали моно-пегилированный Fac VII-ATKAVC (Fac VII-ATKAVC-40k PEG-конъюгат) (Фиг. 3). На Фиг. 3 представлена фотография, показывающая результат электрофореза конъюгата Fac VII-ATKAVC и PEG, где М представляет собой маркер размера, на дорожке 1 представлен Fac VII-ATKAVC-40 кДа PEG конъюгат в невосстанавливающих условиях и на дорожке 2 представлен Fac VII-ATKAVC-5 кДа PEG конъюгат в невосстанавливающих условиях.
Пример 5-2: Получение Fac VII-ATKAVC-5 кДа PEG конъюгата
Пегилирование С-конца Fac VII-ATKAVC с помощью альдегид-5 кДа PEG-малеимида (NOF, Japan) выполняли аналогично Примеру 5-1, за исключением использования альдегид-5 кДа PEG-малеимида вместо 40 кДа MPEG-малеимида с получением пегилированного Fac VII-ATKAVC (Fac VII-ATKAVC-5 кДа PEG-конъюгат) (Фиг. 3).
Пример 5-3: Получение комплекса Fac VIIa-ATKAVC-PEG-Fc
Для связывания альдегидной реакционно-способной группы малеимид-10 кДа PEG-альдегида (NOF, Japan) с N-концом Fc-области иммуноглобулина, Fc-область иммуноглобулина и малеимид-10 кДа PEG-альдегид смешивали в молярном соотношении 1:1 в присутствии 100 мМ фосфатного буфера (рН 6,0) и восстанавливающий агент, 20 мМ Na-CNBH3, добавляли в условиях концентрации белка 10 мг/мл. Смесь взаимодействовала при низкой температуре (4~8°С) в течение 2 часов. Чтобы получить монопегилированную Fc-область иммуноглобулина (малеимид-10 кДа PEG-Fc), осуществляли катионообменную хроматографию, используя Source 15Q, и элюирование проводили в 20 мМ Tris буфере (рН 7,5) с использованием градиента концентрации хлорида натрия.
С другой стороны, С-конец Fac VII-ATKAVC восстанавливали в 10 мМ глицил-глицинового буферного раствора (рН 5,5), используя восстанавливающий агент, 0,5~2 мМ трифенилфосфин-3,3',3ʺ-трисульфоновой кислоты тринатриевой соли гидрат, при комнатной температуре в течение 2 часов.
Fac VII-ATKAVC с восстановленным С-концом и монопегилированную Fc-область иммуноглобулина (малеимид-10 кДа PEG-Fc) смешивали в молярном соотношении 1:4-1:20, и проводили реакцию при комнатной температуре в течение 2 часов в присутствии 50 мМ Tris буферного раствора (рН 7,5) при общей концентрации белка 1~2 мг/мл. Сначала выполняли катионообменную хроматографию, используя Source 15Q, и комплекс Fac VII-ATKAVC-10k PEG-Fc элюировали в 20 мМ Tris буфере (рН 7,5), используя градиент концентрации хлорида натрия.
Для активации Fac VII в комплекс Fac VII-ATKAVC-PEG-Fc, осуществляли реакцию в растворе в 0,1 М Tris-HCl буферном растворе (рН 8,0) примерно при 4 мг/мл в пересчете на Fac VII, при низкой температуре (4~8°С) в течение 18 часов.
Для очистки конечного Fac VIIa-ATKAVC-PEG-Fc проводили гель-хроматографию с использованием Superdex200 и 10 мМ глицил-глицинового буфера (рН 5,5).
Чистоту очищенного Fac VIIa-ATKAVC-PEG-Fc оценивали с помощью SDS PAGE и вестерн-блоттинга (Фиг. 4). На Фиг. 4а представлена фотография, показывающая результат электрофореза очищенного Fac VIIa-ATKAVC-PEG-Fc конъюгата, где М представляет собой маркер размера, на дорожке 1 представлен Fac VIIa-ATKAVC-PEG-Fc в восстанавливающих условиях и на дорожке 2 представлен Fac VIIa-ATKAVC-PEG-Fc в невосстанавливающих условиях. На Фиг. 4b представлена фотография, показывающая результат вестерн-блоттинга очищенного Fac VIIa-ATKAVC-PEG-Fc, где на дорожке 1 представлен Fac VIIa-ATKAVC-PEG-Fc в восстанавливающих условиях и на дорожке 2 представлен Fac VIIa-ATKAVC-PEG-Fc в невосстанавливающих условиях.
Пример 6: In vitro активность (ЕС50) Fac VII и Fac VII-ATKAVC
Чтобы определить in vitro активность Fac VII и Fac VII-ATKAVC. использовали имеющийся в продаже набор (Chromogenjx, COASET) для выполнения хромогенного анализа. Анализ активности выполняли в соответствии с Европейской фармакопеей ʺ2.7.10. АНАЛИЗ ЧЕЛОВЕЧЕСКОГО ФАКТОРА СВЕРТЫВАНИЯ КРОВИ VIIʺ.
Разбавленные Fac VII и Fac VII-ATKAVC активируют с помощью тромбопластина и ионов Са2+, FX активируют до FXa посредством активированного Fac VIIa и Fac VIIa-ATKAVC, и субстрат S-2765 (N-a-Cbo-D-Arg-Gly-Arg-pNA) гидролизуется и диссоциирует на пептид и хромофорную группу pNA с помощью активированного FXa. Для определения in vitro активности Fac VIIa и Fac VIIa-ATKAVC оценивали поглощение диссоциированного pNA при 405 нм
Изменения в поглощении в соответствии с концентрацией Fac VII и Fac VII-ATKAVC исследовали с помощью регрессионного анализа, используя 4-параметрическую модель программы Softmax Pro 4.0, а активности двух веществ сравнивали, используя полученные значения EC50.
Результаты испытаний (Фиг. 5 и Таблица 1) показали, что in vitro активность Fac VII-ATKAVC демонстрирует титр, равный или более высокий, чем у нативного Fac VII.

Как показано в Таблице 1 и на Фиг. 5, было обнаружено, что Fac VII и Fac VII-ATKAVC демонстрируют равные активности in vitro, указывая на то, что Fac VII или производное Fac VII по настоящему изобретению имеет активность, эквивалентную активности нативной формы, и добавление пептидного линкера к С-концу не влияет на его активность.
Пример 7: In vitro активность (EC50) Fac VII-ATKAVC и Fac VII-ATKAVC-40 кДа PEG
Для того чтобы оценить активность в соответствии с сайт-специфической конъюгацией, определяли in vitro активности Fac VII-40 кДа PEG, Fac VU-ATKAVC и С-концевого пегилированного Fac VII-ATKAVC-40 кДа PEG. Для выполнения хромогенного анализа использовали имеющийся в продаже набор (Chromogenix, COASET), и способ осуществляли таким же образом, как в Примере 6. Изменения в поглощении в соответствии с концентрацией тестируемых образцов изучали с использованием 4-параметрической модели программы Softmax Pro 4.0, и относительные активности после пегилирования изучали, используя полученные значения EC50.
Результаты испытаний (Таблица 2) показали, что in vitro активность N-концевого пегилированного Fac VII-40 кДа PEG демонстрирует титр примерно 11% по сравнению с Fac VII, a in vitro активность С-концевого пегилированного Fac VII-ATKAVC-40 кДа PEG демонстрирует титр примерно 29% по сравнению с Fac VII-ATKAVC.
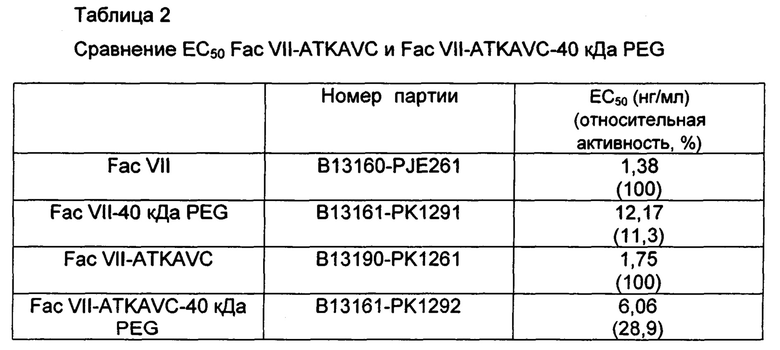
Активность конъюгата PEG и производного Fac VII по настоящему изобретению демонстрировала титр примерно 29% по сравнению с производным Fac VII. Напротив, активность конъюгата PEG и Fac VII демонстрировала титр примерно 11% по сравнению с Fac VII. Эти результаты показывают, что С-концевой пегилированный Fac VII-ATKAVC-40 кДа PEG сохраняет примерно в 2,5 раза более высокую относительную активность по сравнению с EC50 N-концевого пегилированного Fac VII-40 кДа PEG и активность Fac VII может в значительной степени поддерживаться посредством сайт-специфической конъюгации с использованием ATKAVC.
Пример 8: In vitro активность Fac VIIa-ATKAVC-PEG-Fc
In vitro активность Fac VIIa-ATKAVC-PEG-Fc определяли, используя имеющийся в продаже набор (StaclotVIIa-rTF, Stago) и Фактор VIIa, соответствующий международному стандарту NIBSC (Национальный институт биологических стандартов и контроля) (656 МЕ/флакон, кодовый номер 07/228), в качестве стандартного вещества. Этот способ основан на коагуляции в результате специфической реакции rsTF (рекомбинантного растворимого тканевого фактора) и Фактора VIIa. NIBSC фактор VIIa, Fac VIIa-ATKAVC и Fac VIIa-ATKAVC-PEG-Fc разбавляли человеческой плазмой, лишенной Fac VII, в соотношении 1:1 и они взаимодействовали со смесью rsTF и фосфолипида в течение примерно 180 секунд. После этого к смеси добавляли 25 мМ CaCl2 для измерения времени коагуляции. По мере увеличения количества фактора VIIa время коагуляции уменьшалось.
Чтобы рассчитать удельную активность (МЕ/мг) Fac VIIa-ATKAVC и Fac VIIa-ATKAVC-PEG-Fc, сначала анализировали, с использованием PLA 2.0, эффективности (МЕ/мл) Fac VIIa-ATKAVC и Fac VIIa-ATKAVC-PEG-Fc по сравнению с эффективностью (МЕ/мл) NIBSC Фактора VIIa. Затем рассчитанную эффективность (МЕ/мл) делили на концентрацию белка (мг/мл), чтобы рассчитать удельную активность.
Результаты испытаний (Таблица 3) показали, что in vitro активность Fac VIIa-ATKAVC-PEG-Fc составляла примерно 20632 МЕ/мг, указывая на то, что он сохраняет примерно 45%-ную активность по сравнению с Fac VIIa-ATKAVC.

| название | год | авторы | номер документа |
|---|---|---|---|
| ХИМЕРНЫЕ МОЛЕКУЛЫ ФАКТОРА VII | 2010 |
|
RU2563231C2 |
| МОДИФИЦИРОВАННЫЕ ВИТАМИН К-ЗАВИСИМЫЕ ПОЛИПЕПТИДЫ | 2005 |
|
RU2396347C2 |
| ПРОИЗВОДНЫЕ ФАКТОРА VII СВЕРТЫВАНИЯ КРОВИ | 2002 |
|
RU2338752C2 |
| ВАРИАНТЫ ДОМЕНА GLA ФАКТОРА VII ИЛИ VIIa | 2004 |
|
RU2373282C2 |
| МОДИФИЦИРОВАННЫЙ КОАГУЛИРУЮЩИЙ ФАКТОР VIIa С ПРОДЛЕННЫМ ВРЕМЕНЕМ ПОЛУЖИЗНИ | 2007 |
|
RU2466141C2 |
| МОЛЕКУЛЫ, ПОДОБНЫЕ ФАКТОРУ VII ИЛИ VIIA | 2001 |
|
RU2278123C2 |
| ПОЛИПЕПТИД ФАКТОРА VII СВЕРТЫВАНИЯ КРОВИ, ЕГО ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2001 |
|
RU2326126C2 |
| FC-фрагмент IGG4, содержащий модифицированную шарнирную область | 2014 |
|
RU2696973C2 |
| ПОЛИПЕПТИДЫ НА ОСНОВЕ МОДИФИЦИРОВАННОГО ФАКТОРА VII И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2571931C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВИТАМИН К-ЗАВИСИМЫХ БЕЛКОВ | 2001 |
|
RU2321633C2 |




























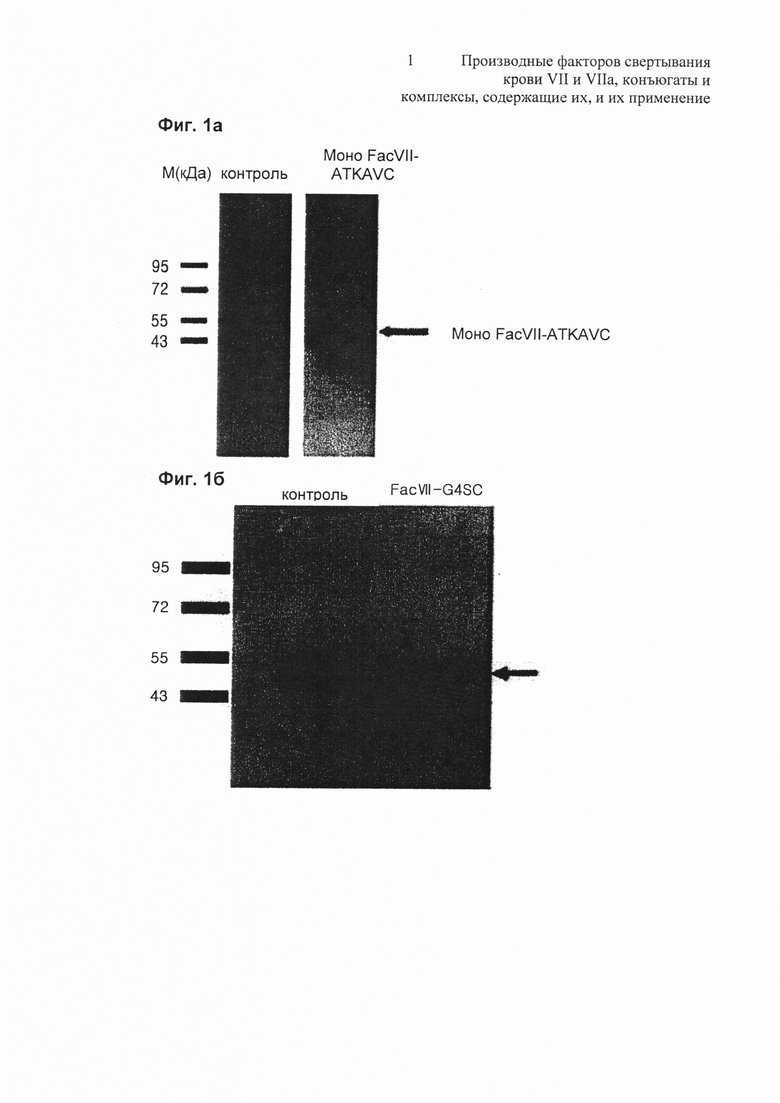
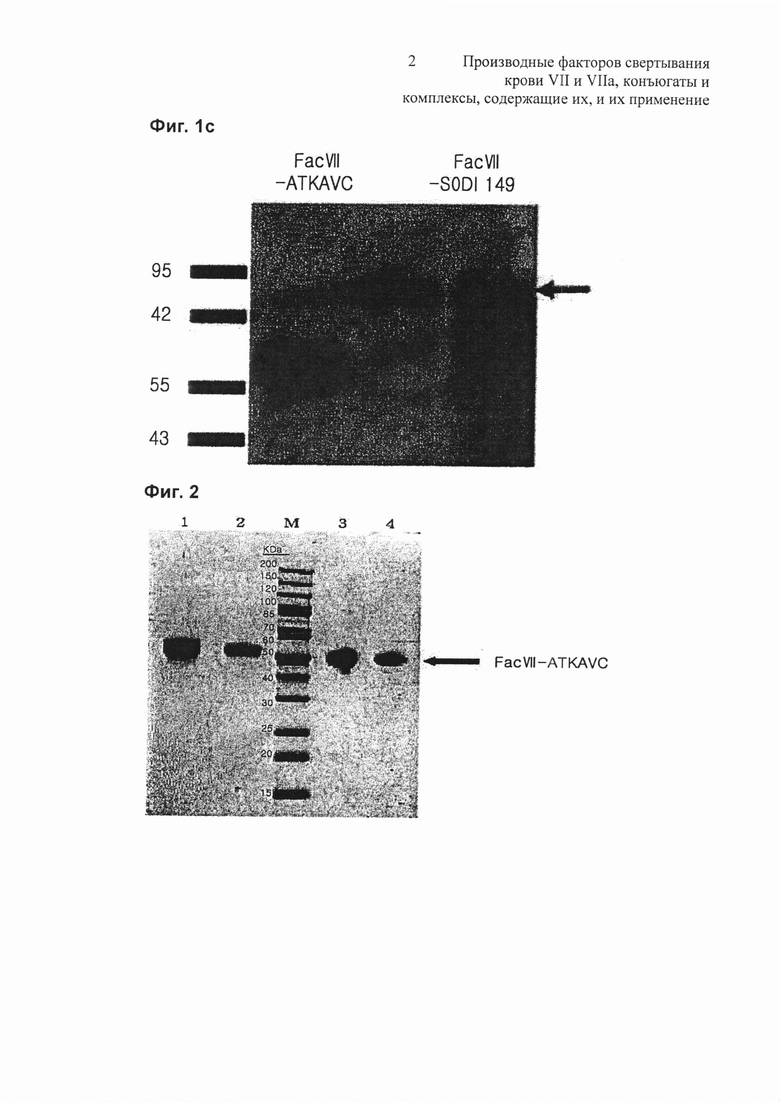
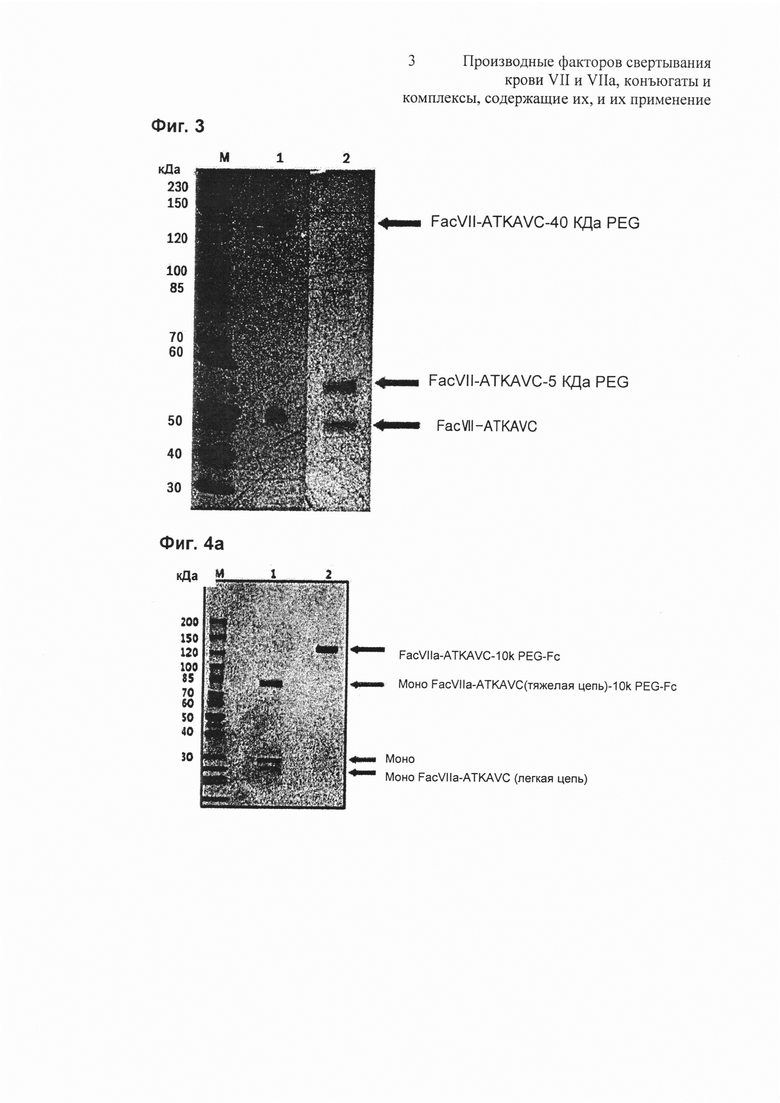
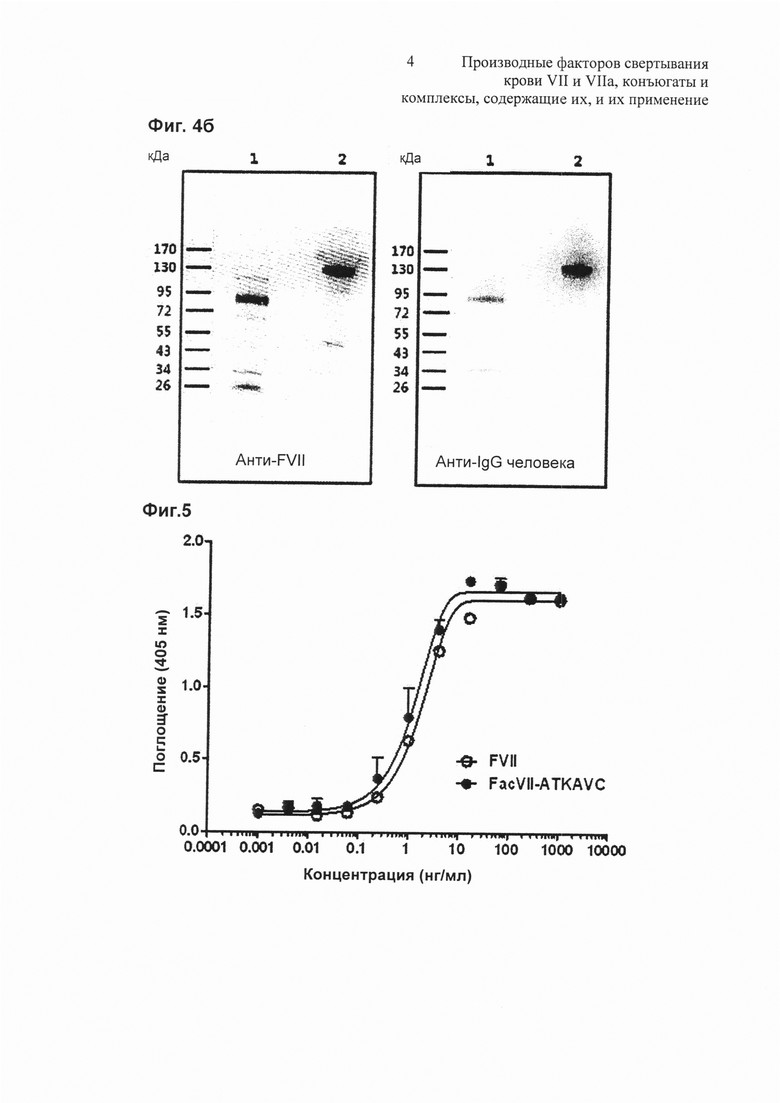
Изобретение относится к области биотехнологии, конкретно к получению производных фактора свертывания крови VII и VIIa, их конъюгатов с полимерами, способными увеличивать время полувыведения из кровотока, комплексов с ними, полученных путем связывания носителя с конъюгатом, к генам, кодирующим производные, к экспрессирующим векторам, содержащим эти гены, трансформантам с введенными экспрессирующими векторами, к способам их получения, фармацевтическим композициям и способам лечения, и может быть использовано в медицине для предупреждения или лечения гемофилии или улучшения свертываемости крови. Получают производное FVII, соединенное по своему С-концу с пептидным линкером для связи с непептидильным полимером, способным увеличивать время полувыведения FVII или FVIIa из кровотока. При этом пептидный линкер представляет собой частичную последовательность супероксиддисмутазы SOD1, ее мутированную последовательность или последовательность GGGGSC. Изобретение позволяет получить производное FVII, способное связываться с носителем, увеличивающим время полувыведения из кровотока при сохранении активности FVII. 17 н. и 25 з.п. ф-лы, 8 ил., 3 табл., 8 пр.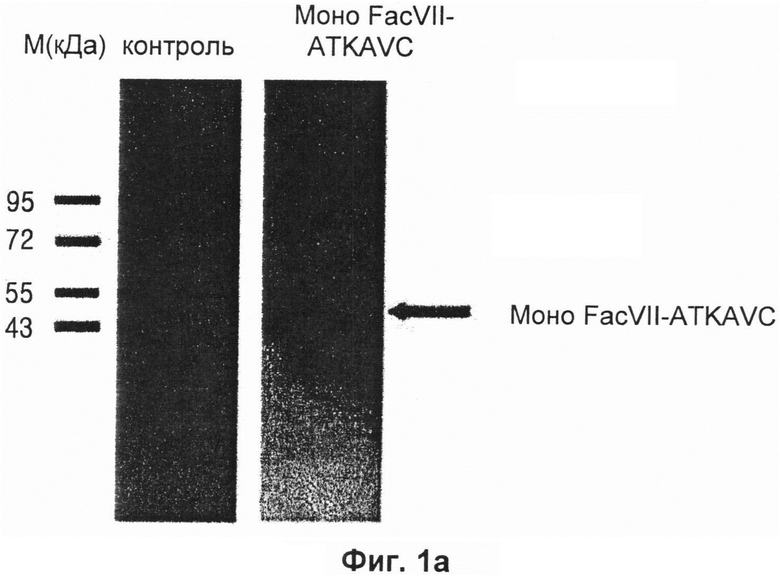
1. Производное фактора свертывания крови VII (FVII) или его активной формы (FVIIa),
где FVII, имеющий аминокислотную последовательность SEQ ID NO: 4, соединен по своему С-концу с пептидным линкером для связи FVII или FVIIa с непептидильным полимером, способным увеличивать время полувыведения FVII или FVIIa из кровотока,
где пептидный линкер представляет собой частичную последовательность SOD1 (супероксиддисмутаза), или ее мутированную последовательность, или GGGGSC,
где частичная последовательность SOD1 состоит из 6-149 последовательных аминокислотных остатков, начиная с аминокислотного остатка в положении 1, из SEQ ID NO: 30, и
где мутированная последовательность мутирована путем замены VLKG (валин-лейцин-лизин-глицин) в этой частичной последовательности последовательностью сайта саморасщепления IPRI (изолейцин-пролин-аргинин-изолейцин).
2. Производное по п. 1, где С-концевой аминокислотный остаток пептидного линкера представляет собой цистеин.
3. Производное по п. 1, где пептидный линкер представляет собой частичную последовательность SOD1.
4. Производное по п. 1, где пептидный линкер представляет собой мутированную последовательность.
5. Производное по п. 1, состоящее из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 9, 13, 14, 20, 24, 27, 34 и 35.
6. Полинуклеотид, кодирующий производное FVII,
где FVII, имеющий аминокислотную последовательность SEQ ID NO: 4, соединен по своему С-концу с пептидным линкером для связи FVII с непептидильным полимером, способным увеличивать время полувыведения FVII из кровотока,
где пептидный линкер представляет собой частичную последовательность SOD1 (супероксиддисмутаза), или ее мутированную последовательность, или GGGGSC,
где частичная последовательность SOD1 состоит из 6-149 последовательных аминокислотных остатков, начиная с аминокислотного остатка в положении 1, из SEQ ID NO: 30, и
где мутированная последовательность мутирована путем замены VLKG (валин-лейцин-лизин-глицин) в этой частичной последовательности последовательностью сайта саморасщепления IPRI (изолейцин-пролин-аргинин-изолейцин).
7. Полинуклеотид по п. 6, состоящий из нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 8, 12, 15, 21, 25 и 28.
8. Экспрессирующий вектор, содержащий полинуклеотид по п. 6.
9. Экспрессирующий вектор по п. 8, содержащий нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 8, 12, 15, 21, 25 и 28.
10. Клетка-хозяин, за исключением эмбриональной клетки человека, для продукции производного FVII, трансформированная экспрессирующим вектором по п. 8.
11. Клетка-хозяин по п. 10, которая представляет собой клетку клеточной линии CHO/dhfr-, депонированной под регистрационным номером КСТС12022 ВР в Корейской коллекции типовых культур Корейского исследовательского института биологических наук и биотехнологии.
12. Способ получения производного FVII по любому из пп. 1-5, включающий стадии:
(1) культивирования клетки-хозяина по п. 10 с получением культурального раствора, и
(2) выделения производного FVII из этого культурального раствора.
13. Способ получения производного FVIIa по любому из пп. 1-5, включающий стадии:
(1) культивирования клетки-хозяина по п. 10 с получением культурального раствора,
(2) выделения производного FVII из этого культурального раствора, и
(3) активации выделенного производного FVII.
14. Конъюгат фактора свертывания крови VII (FVII) или его активной формы (FVIIa) с непептидильным полимером, обладающий увеличенным временем полувыведения из кровотока, где с С-концом производного FVII или FVIIa по любому из пп. 1-5 соединен непептидильный полимер, способный увеличивать время полувыведения из кровотока.
15. Конъюгат по п. 14, где непептидильный полимер имеет одну или более реакционно-способных групп, выбранных из группы, состоящей из альдегидной группы, пропиональдегидной группы, бутиральдегидной группы, малеимидной группы, орто-пиридилдисульфидных, тиольных и сукцинимидных производных.
16. Конъюгат по п. 15, где сукцинимидное производное представляет собой сукцинимидилпропионат, сукцинимидилкарбоксиметил, гидроксисукцинимидил или сукцинимидилкарбонат.
17. Конъюгат по п. 14, где непептидильный полимер имеет два или три реакционно-способных конца.
18. Конъюгат по п. 14, где реакционно-способные группы на обоих концах непептидильного полимера имеют малеимидную реакционно-способную группу, или альдегидную реакционно-способную группу, или обе из них.
19. Конъюгат по п. 14, где непептидильный полимер выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, непептидильных сополимеров этиленгликоля-пропиленгликоля, полиоксиэтилированных полиолов, поливиниловых спиртов, полисахаридов, декстранов, поливинилэтиловых эфиров, биоразлагаемых полимеров, липидных непептидильных полимеров, хитинов, гиалуроновых кислот и их комбинации.
20. Комплекс фактора свертывания крови VII (FVII) или его активной формы (FVIIa) с непептидильным полимером и Fc-областью иммуноглобулина, обладающий увеличенным временем полувыведения из кровотока, где производное FVII или FVIIa по любому из пп. 1-5 ковалентно соединено с указанной Fc-областью иммуноглобулина при помощи непептидильного полимера, способного увеличивать время полувыведения из кровотока, ковалентно соединенного с С-концом производного FVII или FVIIa.
21. Комплекс по п. 20, где непептидильный полимер выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимеров этиленгликоля-пропиленгликоля, полиоксиэтилированных полиолов, поливиниловых спиртов, полисахаридов, декстранов, поливинилэтиловых эфиров, биоразлагаемых полимеров, липидных полимеров, хитинов, гиалуроновых кислот и их комбинации.
22. Комплекс по п. 20, где непептидильный полимер имеет два или три реакционно-способных конца.
23. Комплекс по п. 20, где реакционно-способные группы на обоих концах непептидильного полимера имеют малеимидную реакционно-способную группу, или альдегидную реакционно-способную группу, или обе из них.
24. Комплекс по п. 20, где Fc-область иммуноглобулина состоит из 1-4 доменов, выбранных из группы, состоящей из доменов СН1, СН2, СН3 и СН4.
25. Комплекс по п. 20, где Fc-область иммуноглобулина также содержит шарнирную область.
26. Комплекс по п. 20, где Fc-область иммуноглобулина происходит из IgG, IgA, IgD, IgE или IgM.
27. Комплекс по п. 20, где Fc-область иммуноглобулина представляет собой Fc-область IgG4.
28. Комплекс по п. 20, где Fc-область иммуноглобулина представляет собой агликозилированную Fc-область IgG4 человека.
29. Способ получения комплекса FVIIa по любому из пп. 20-28, включающий стадии:
(1) ковалентного связывания непептидильного полимера, имеющего сукцинимидное производное или альдегидную реакционно-способную группу на одном конце, с аминогруппой Fc иммуноглобулина при рН 5,0 ~ рН 9,0;
(2) выделения конъюгата, который включает Fc-область иммуноглобулина, ковалентно связанную с непептидильным полимером по аминогруппе, из реакционной смеси со стадии (1);
(3) ковалентного связывания С-концевой тиольной группы производного FVII по любому из пп. 1-5 с другим концом непептидильного полимера в выделенном конъюгате с получением комплекса FVII, имеющего Fc-область иммуноглобулина и производное FVII на каждом конце непептидильного полимера; и
(4) активации комплекса FVII, полученного на стадии (3), с получением комплекса FVIIa, имеющего производное FVIIa и Fc-область иммуноглобулина, связанные посредством непептидильного полимера.
30. Способ получения комплекса FVIIa по любому из пп. 20-28, включающий стадии:
(1) ковалентного связывания непептидильного полимера, имеющего реакционно-способную группу в виде сукцинимидного производного или альдегидную реакционно-способную группу на одном конце, с аминогруппой Fc иммуноглобулина при рН 5,0 - рН 9,0;
(2) выделения конъюгата, который включает Fc-область иммуноглобулина, ковалентно соединенную с непептидильным полимером по аминогруппе, из реакционной смеси со стадии (1); и
(3) ковалентного связывания С-концевой тиольной группы производного FVIIa по любому из пп. 1-5 с другим концом непептидильного полимера в выделенном конъюгате с получением комплекса FVIIa, имеющего Fc-область иммуноглобулина и производное FVIIa на каждом конце непептидильного полимера.
31. Способ получения конъюгата FVIIa по любому из пп. 14-19, включающий стадии:
(1) ковалентного связывания непептидильного полимера, имеющего реакционно-способную группу, выбранную из группы, состоящей из альдегидной группы, пропиональдегидной группы, бутиральдегидной группы, малеимидной группы, орто-пиридилдисульфидных, тиольных и сукцинимидных производных, с С-концевой тиольной группой производного FVII по любому из пп. 1-5;
(2) выделения конъюгата FVII, полученного посредством ковалентного связывания непептидильного полимера с производным FVII; и
(3) активации выделенного конъюгата FVII с получением конъюгата FVIIa, имеющего непептидильный полимер, связанный с областью FVIIa.
32. Способ получения конъюгата FVIIa по любому из пп. 14-19, включающий стадии:
(1) ковалентного связывания непептидильного полимера, имеющего реакционно-способную группу, выбранную из группы, состоящей из альдегидной группы, пропиональдегидной группы, бутиральдегидной группы, малеимидной группы, орто-пиридилдисульфидных, тиольных и сукцинимидных производных, с С-концевой тиольной группой производного FVIIa по любому из пп. 1-5; и
(2) выделения конъюгата FVIIa, полученного посредством ковалентного связывания непептидильного полимера с производным FVIIa.
33. Способ по любому из пп. 29-32, где активацию производного FVII, конъюгата FVII или комплекса FVII выполняют путем активации на колонке или активации в растворе.
34. Способ по любому из пп. 29-32, где непептидильный полимер представляет собой полиэтиленгликоль.
35. Комплекс фактора свертывания крови VII (FVII) или его активной формы (FVIIa) с непептидильным полимером и носителем, обладающий увеличенным временем полувыведения из кровотока, где производное FVII или FVIIa по любому из пп. 1-5 ковалентно соединено с указанным носителем при помощи непептидильного полимера, ковалентно соединенного с С-концом производного FVII или FVIIa,
где непептидильный полимер выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимеров этиленгликоля-пропиленгликоля, полиоксиэтилированных полиолов, поливиниловых спиртов, полисахаридов, декстранов, поливинилэтиловых эфиров, биоразлагаемых полимеров, липидных полимеров, хитинов, гиалуроновых кислот и их комбинации, и
где носитель выбран из группы, состоящей из антитела, альбумина и трансферрина.
36. Комплекс по п. 35, где один конец непептидильного полимера, составляющего конъюгат FVII или конъюгат FVIIa, соединен с указанным носителем.
37. Комплекс по п. 35, где непептидильный полимер имеет два или три реакционно-способных конца.
38. Комплекс по п. 35, где непептидильный полимер имеет малеимидную реакционно-способную группу или альдегидную реакционно-способную группу на обоих концах соответственно.
39. Фармацевтическая композиция для предупреждения или лечения гемофилии, содержащая эффективное количество производного FVII или производного FVIIa по любому из пп. 1-5, конъюгата FVII или конъюгата FVIIa по любому из пп. 14-19, или комплекса FVII или комплекса FVIIa по любому из пп. 20-28 в качестве активного ингредиента.
40. Фармацевтическая композиция для улучшения свертывания крови, содержащая эффективное количество производного FVII или производного FVIIa по любому из пп. 1-5, конъюгата FVII или конъюгата FVIIa по любому из пп. 14-19, или комплекса FVII или комплекса FVIIa по любому из пп. 20-28 в качестве активного ингредиента.
41. Способ предупреждения или лечения гемофилии, включающий стадию введения субъекту терапевтически эффективного количества фармацевтической композиции для предупреждения или лечения гемофилии по п. 39.
42. Способ улучшения свертывания крови, включающий стадию введения субъекту терапевтически эффективного количества фармацевтической композиции для улучшения свертывания крови по п. 40.
| ПРОИЗВОДНЫЕ ФАКТОРА VII СВЕРТЫВАНИЯ КРОВИ | 2002 |
|
RU2338752C2 |
| БЕЛКОВЫЙ КОМПЛЕКС, ПОЛУЧЕННЫЙ С ИСПОЛЬЗОВАНИЕМ ФРАГМЕНТА ИММУНОГЛОБУЛИНА, И СПОСОБ ПОЛУЧЕНИЯ ТАКОГО КОМПЛЕКСА | 2004 |
|
RU2356909C2 |
| US 2009298760 A1, 03.12.2009 | |||
| МАКСИМЕНКО А | |||
| и др | |||
| Биофармакология ферментных конъюгатов: вазопротекторная активность супрамолекулярного производного супероксиддисмутаза-хондроитинсульфат- каталаза, ACTA NATURAE, 2010, т.2, н.4 (7), стр | |||
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| МОЛЕКУЛЫ, ПОДОБНЫЕ ФАКТОРУ VII ИЛИ VIIA | 2001 |
|
RU2278123C2 |
Авторы
Даты
2017-05-22—Публикация
2012-10-05—Подача