Область техники
Изобретение относится к области медицины и вирусологии, в частности к аттенуированному химерному вирусу группы А, аттенуированному гриппозному вектору на основе указанного вируса и их применению для профилактики и/или лечения заболеваний инфекционной природы, а также для лечения онкологических заболеваний.
Уровень техники
На сегодняшний день важнейшей мерой защиты от вирусной инфекции и ограничения ее распространения является вакцинопрофилактика. Современные вакцины, как правило, индуцируют образование антител к поверхностным антигенам вирусов. Эффективность вакцин прямо зависит от степени соответствия антигенной структуры штаммов вируса, входящих в состав вакцины, и штаммов, циркулирующих среди популяции. Поверхностные белки большинства вирусов подвергаются постоянной антигенной вариации (антигенный дрейф), что требует регулярного обновления штаммового состава вакцин. Разработка высокоиммуногенных и безопасных вакцин, индуцирующих иммунный ответ широкого спектра действия, является на сегодняшний день одной из основных проблем эффективной профилактики вирусных заболеваний.
Существующие вакцины можно разделить на два вида: аттенуированные (живые, содержащие цельные и активные вирусы, проявляющие низкую патогенность в полевых условиях) и инактивированные (содержащие фрагменты вирусных частиц или цельные неактивные вирусы). Живые вирусы, способные реплицироваться в инфицированном хозяине, вызывают сильный и длительный иммунный ответ против экспрессирующихся антигенов этих вирусов. Они эффективно вызывают как гуморальный, так и клеточный иммунный ответы, а также стимулируют биохимические пути, опосредуемые цитокинами и хемокинами. Поэтому, живые аттенуированные вирусы обладают определенными преимуществами по сравнению с композициями вакцин, основанными либо на инактивированных иммуногенах, либо на отдельных субъединицах иммуногенов, которые, как правило, стимулируют лишь гуморальную часть иммунной системы.
Для вакцинации животных и людей от различных инфекционных заболеваний вирусы различных семейств могут использоваться в качестве векторов, экспрессирующих чужеродные геномные последовательности. Применение векторов возможно в тех случаях, когда традиционные убитые или живые вакцины не могут быть получены или их эффективность не позволяет контролировать то или иное заболевание. Среди существующих систем доставки антигенов вирусные векторы занимают особое место, поскольку обладают следующими свойствами: имеют природный механизм взаимодействия с клеткой и проникновения в нее, переносят чужеродный генетический материал в ядро клетки, способны обеспечивать длительную экспрессию антигена, вирусная оболочка защищает генетический материал, кодирующий антиген.
Не все вирусы обладают свойствами, необходимыми для создания векторов для получения эффективных аттенуированных рекомбинантных вакцин. Для создания вакцин на основе вирусных векторов в настоящее время наиболее широко используются поксвирусы (Poxviridae) [J. Gen. Virol. 2005. V. 86. № 11. P. 2925–2936], вирус болезни Ньюкасла (NDV) [Virol. 2001. V. 75. № 23. P. 11868–11873] и аденовирусы (Adenoviridae) [Биотехнология. 2007. Т.5. С. 38–44]. Среди поксвирусов, используемых в качестве вирусного вектора, наиболее популярен вирус осповакцины, к преимуществам которого относятся простота и дешевизна получения, а также высокая пакующая емкость (до 25 т.п.н.) [J. Gen. Virol. 2005. V. 86. № 11. P. 2925–2936]. Серьезный недостаток векторов на основе вируса осповакцины – предсуществующий иммунитет к этому вирусу, который сформировался в человеческой популяции в результате иммунизации против оспы. Поэтому целесообразно использовать векторы на основе таких поксвирусов, как вирус оспы канарейки (Canarypox) и вирус оспы домашней птицы (Flowpox). Однако Canarypox и Flowpox индуцируют более слабый иммунный ответ на целевые антигены, чем вирус осповакцины, и требуют многократного введения или использования адъювантов [Vaccine. 1991. V.9. № 5. P. 303–308]. Существенным недостатком вакцинного вектора NDV является то, что последствия введения рекомбинантных NDV недостаточно изучены, и не ясно, безопасны ли вакцины на основе NDV для человека. Кроме того, NDV характеризуется низкой пакующей емкостью и сложностью получения векторов, несущих несколько целевых антигенов [Chem. Biodivers. 2010. V 7. № 3. P.677–689]. Аденовирусы также имеют ряд недостатков ограничивающих их применение в качестве векторов для переноса генов. Основными недостатками аденовирусных векторов считаются: (1) неоднородность распределения вирусных рецепторов на поверхности клеток в организме, что делает множество клеток нечувствительными к аденовирусной инфекции (2) наличие мощного защитного популяционного иммунитета к известным аденовирусным векторам (3) теоретическая возможность интеграции ДНК-вого генома аденовирусов в хромосомы человека (Stephen SL, Montini E, Sivanandam VG, Al-Dhalimy M, Kestler HA, Finegold M, Grompe M, Kochanek S. Chromosomal integration of adenoviral vector DNA in vivo. J Virol. 2010 Oct;84(19):9987-94. doi: 10.1128/JVI.00751-10. Epub 2010 Aug 4).
Векторы, полученные на основе вируса гриппа, имеют ряд преимуществ по сравнению с другими вирусными векторами, поскольку:
- Вирусы гриппа не имеют ДНК-вой фазы в своем репликационном цикле и не могут встраиваться в геном человека или животного.
- Вирус гриппа вызывает системный и мукозальный В и Т клеточный ответ к своим антигенам при заражении клеток респираторного тракта человека.
- Множество различных подтипов вируса гриппа является доступным. Поскольку антитела против разновидности указанных подтипов не обладают перекрестной реактивностью, предсуществующий иммунитет к вирусному вектору у хозяина, что зачастую является проблемой в случае других живых векторов, можно обойти. Возможны также эффективные бустерные иммунизации различными подтипами вирусов гриппа, экспрессирующими одни и те же антигены.
- Существует несколько типов живых гриппозных вакцин для интраназального введения (УЛЬТРАВАК® ВАКЦИНА ГРИППОЗНАЯ АЛЛАНТОИСНАЯ ЖИВАЯ (РФ) и Flumist® (USA)) и индустриальная технология их производства с применением 10-дневных куриных эмбрионов (Guideline on Influenza Vaccines – Quality Module, European Medicines Acency, 25 April 2014 [Электронный ресурс]. URL: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2014/06/WC500167817.pdf (дата обращения 01.11.2015)).
Вирусы гриппа относятся к семейству Ortomyxoviridae, которое включает роды Influenza A, B, С. Геномы вирусов гриппа А и В имеют схожую структуру, состоящую из 8 геномных фрагментов РНК негативной полярности: PB2,PB1,PA,HA,NA,NP,M и NS. Полимеразный комплекс PB2,PB1,PA транскрибирует одну матричную РНК (мРНК) с каждого геномного фрагмента, транслируемую в одноименный белок. У геномных фрагментов M и NS матричные РНК могут быть альтернативно сплайсированы, образуя мРНК, кодирующие белки M2 и NEP, соответственно. Все белки, за исключением белка NS и PB1-f2 (имеется не у всех штаммов), являются структурными компонентами вирусных частиц. Неструктурный белок NS1 накапливается в цитоплазме зараженных клеток и имеет функцию ингибитора системы интерферона.
Фрагментированная природа генома вируса гриппа дает возможность образования реассортантов вируса гриппа – вирусов, имеющих фрагменты генома смешанного происхождения от разных штаммов. Это является одним из механизмов антигенного разнообразия вирусов гриппа в природе и причиной возникновения пандемий вируса гриппа. Антигенные свойства вируса гриппа определяются поверхностными гликопротеинами НА и NA. В соответствии с антигенной специфичностью поверхностных гликопротеидов HA и NA в настоящее время известно 18 подтипов HA и 9 подтипов нейраминидазы (NA) К настоящему моменту для вируса гриппа А известно 18 сероподтипов, которые подразделяются на две группы. К первой группе относятся подтипы НА H1, H2, H5, H6, H8, H9, H11, H12, H13, H16, H17, H18, тогда как H3, H4, H7, H10, H14 и H15 относятся ко второй. При этом только сероподтипы Н1, Н2 и Н3 вируса гриппа А и различные антигенные варианты вируса гриппа В способны к распространению в человеческой популяции, вызывая пандемии или сезонные эпидемии гриппа.
Специфический иммунитет, вырабатываемый после переболевания или вакцинации одним сероподтипом, слабо защищает от инфекции другим сероподтипом вируса гриппа А. Иммунитет к любому сероподтипу вируса гриппа А не защищает от вируса гриппа В и наоборот, иммунизация против гриппа В не эффективна в отношении вируса гриппа А. В связи с этим существует настоятельная необходимость создания универсальной гриппозной вакцины, эффективной по отношению ко всем известным антигенным разновидностям вируса гриппа А и В.
Известно, что экспрессия антигенов в носовой полости приводит к индукции системного и локального мукозального В- и Т-клеточного иммунного ответа. Были осуществлены многочисленные попытки использования вирусов гриппа в качестве векторов для доставки и экспрессии посторонних геномных последовательностей в клетках респираторного тракта животных. Среди 8 геномных фрагментов вирусов гриппа А или В только NS геномный фрагмент способен стабильно удерживать геномные вставки более 800 нуклеотидов в составе рамки считывания неструктурного белка NS1, без нарушения структуры образующихся вирионов (Kittel C, Sereinig S, Ferko B, Stasakova J, Romanova J, Wolkerstorfer A, Katinger H, Egorov A. Rescue of influenza virus expressing GFP from the NS1 reading frame. Virology. 2004 Jun 20;324(1):67-73. PubMed PMID: 15183054). Более того, из всех белков вируса гриппа, только NS1 белок, в норме содержащий 230-237 аминокислотных остатков, может быть подвергнут 50% укорочению с карбоксильного конца без существенного нарушения репродукционной активности вируса в культуре клеток, куриных эмбрионах или в респираторном тракте животных (Egorov A, Brandt S, Sereinig S, Romanova J, Ferko B, Katinger D, Grassauer A, Alexandrova G, Katinger H, Muster T. Transfectant influenza A viruses with long deletions in the NS1 protein grow efficiently in Vero cells. J Virol. 1998 Aug;72(8):6437-41. PubMed PMID: 9658085; PubMed Central PMCID: PMC109801). Такое укорочение NS1 белка создает пространство для имплементации продолжительных вставок чужеродных геномных последовательностей без нарушения морфологии и основных функций вируса, что позволяет конструировать генетически стабильные векторы. В связи с этим были получены гриппозные векторы на основе вируса гриппа А, которые кодировали укороченную рамку считывания от 80 до 126 аминокислотных остатков NS1 белка, которая могла быть продолжена вставками последовательностей антигенов различных патогенов бактериальной и вирусной природы, например последовательности белков микобактерии туберкулеза, бруцеллы абортус или вируса иммунодефицита человека (Tabynov K, Sansyzbay A, Kydyrbayev Z, Yespembetov B, Ryskeldinova S, Zinina N, Assanzhanova N, Sultankulova K, Sandybayev N, Khairullin B, Kuznetsova I, Ferko B, Egorov A. Influenza viral vectors expressing the Brucella OMP16 or L7/L12 proteins as vaccines against B. abortus infection. Virol J. 2014 Apr 10;11:69. doi: 10.1186/1743-422X-11-69. PubMed PMID: 24716528; PubMed Central PMCID: PMC3997475; Sereinig S, Stukova M, Zabolotnyh N, Ferko B, Kittel C, Romanova J, Vinogradova T, Katinger H, Kiselev O, Egorov A. Influenza virus NS vectors expressing the mycobacterium tuberculosis ESAT-6 protein induce CD4+ Th1 immune response and protect animals against tuberculosis challenge. Clin Vaccine Immunol. 2006 Aug;13(8):898-904. PubMed PMID: 16893990; PubMed Central PMCID: PMC1539114; Ferko B, Stasakova J, Sereinig S, Romanova J, Katinger D, Niebler B, Katinger H, Egorov A. Hyperattenuated recombinant influenza A virus nonstructural-protein-encoding vectors induce human immunodeficiency virus type 1 Nef-specific systemic and mucosal immune responses in mice. J Virol. 2001 Oct;75(19):8899-908. PubMed PMID: 11533153; PubMed Central PMCID: PMC114458). При этом оптимальными по параметрам репродукции в куриных эмбрионах и иммуногенности у животных оказались конструкции, несущие NS1 белок, укороченный до 124 аминокислотных остатков (далее - векторы NS1-124)(Ferko B, Stasakova J, Romanova J, Kittel C, Sereinig S, Katinger H, Egorov A. Immunogenicity and protection efficacy of replication-deficient influenza A viruses with altered NS1 genes. J Virol. 2004 Dec; 78(23):13037-45. PubMed PMID: 15542655; PubMed Central PMCID: PMC524997).
Конструкции с большим укорочением NS1 белка обладали сниженной способностью к росту в интерферон компетентных клетках (клетки MDCK, A549), включая 10-дневные куриные эмбрионы, и были пригодны для производства только в интерферон-дефицитных клетках Vero. С другой стороны, векторы с длиною NS1 в 124-126 аминокислотных остатков варьировали по уровню аттенуации и были недостаточно безопасны у животных. Например, уровень репродукции вирусных векторов, несущих в указанной позиции микобактериальный белок ESAT-6, в легких мышей мог достигать значений, близких к показателям патогенных вирусов гриппа (104 и более вирусных частиц на грамм ткани легкого). Более того, векторы NS1-124 при заражающей дозе >5.0 log/ мышь могли вызвать существенную репродукцию вируса в легочной ткани инфицированных мышей и образование видимой легочной патологии (Egorov A, Brandt S, Sereinig S, Romanova J, Ferko B, Katinger D, Grassauer A, Alexandrova G, Katinger H, Muster T. Transfectant influenza A viruses with long deletions in the NS1 protein grow efficiently in Vero cells. J Virol. 1998 Aug;72(8):6437-41. PubMed PMID: 9658085; PubMed Central PMCID: PMC109801; Stukova MA, Sereinig S, Zabolotnyh NV, Ferko B, Kittel C, Romanova J, Vinogradova TI, Katinger H, Kiselev OI, Egorov A. Vaccine potential of influenza vectors expressing Mycobacterium tuberculosis ESAT-6 protein. Tuberculosis (Edinb). 2006 May-Jul;86(3-4):236-46. PubMed PMID: 16677861). Таким образом, гриппозные векторы с укороченной рамкой считывания белка NS1 до 124 аминокислотных остатков не могут использоваться для вакцинации людей, поскольку не соответствуют параметрам безопасности, разработанным для живых гриппозных вакцин, где непременным условием является температурочувствительность вируса (сниженная способность размножаться при температуре 39°C) и отсутствие активной репродукции вируса в нижнем респираторном тракте животных (Maassab HF, Bryant ML. The development of live attenuated cold-adapted influenza virus vaccine for humans. Rev Med Virol. 1999 Oct-Dec;9(4):237-44. Review. PubMed PMID: 10578119; Gendon IuZ [Live cold-adapted influenza vaccine: state-of-the-art]. Vopr Virusol. 2011 Jan-Feb;56(1):4-17. Review. Russian. PubMed PMID: 21427948; Aleksandrova GI, Gushchina MI, Klimov AI, Iotov VV [Genetic basis for construction of the life influenza type A vaccine using temperature-sensitive mutants]. Mol Gen Mikrobiol Virusol. 1990 Mar;(3):3-8. Review. Russian. PubMed PMID: 2194119; Kendal AP. Cold-adapted live attenuated influenza vaccines developed in Russia: can they contribute to meeting the needs for influenza control in other countries? Eur J Epidemiol. 1997 Jul;13(5):591-609. Review. PubMed PMID: 9258574).
В отличие от лицензированных живых гриппозных вакцин (УЛЬТРАВАК® ВАКЦИНА ГРИППОЗНАЯ АЛЛАНТОИСНАЯ ЖИВАЯ (РФ) или Flumist® (USA)), известные гриппозные векторы NS1-124 и близкие к ним конструкции не обладали фенотипическим маркером температурочувствительности (ts фенотип) и имели уровень репродукции в легких мышей, близкий к уровню вируса дикого типа с полноразмерным NS1 белком.
Попытки использования вирусов гриппа с онколитическими целями предпринимались еще в 50-60-е года 20-го века и основывались на наблюдениях практических врачей об отдельных случаях ремиссии раковых заболеваний после переболевания гриппом (Lindenmann J, Klein PA. Viral oncolysis: increased immunogenicity of host cellantigen associated with influenza virus. J Exp Med. 1967 Jul 1;126(1):93-108).
С момента разработки генно-инженерных методов для вируса гриппа в конце 90-х годов появилась возможность создания онколитических гриппозных векторов с модифицированным NS1 белком. Было показано, что укорочение NS1 белка может приводить к усилению онколитического эффекта при введении рекомбинантного вируса в опухоль за счет стимуляции системы врожденного иммунитета, антагонистом которого NS1 белок является (Sturlan S, Stremitzer S, Bauman S, Sachet M, Wolschek M, Ruthsatz T, Egorov A,Bergmann M. Endogenous expression of proteases in colon cancer cells facilitate influenza A viruses mediated oncolysis. Cancer Biol Ther. 2010 Sep 15;10(6):592-9; Ogbomo H, Michaelis M, Geiler J, van Rikxoort M, Muster T, Egorov A, Doerr HW, Cinatl J Jr. Tumor cells infected with oncolytic influenza A virus prime natural killer cells for lysis of resistant tumor cells. Med Microbiol Immunol. 2010 May;199(2):93-101. doi: 10.1007/s00430-009-0139-0. Epub 2009 Dec 15. PubMed PMID: 20012989; Efferson CL, Tsuda N, Kawano K, Nistal-Villán E, Sellappan S, Yu D, Murray JL,García-Sastre A, Ioannides CG. Prostate tumor cells infected with a recombinant influenza virus expressing a truncated NS1 protein activate cytolytic CD8+ cells to recognize noninfected tumor cells. J Virol. 2006 Jan;80(1):383-94).
Более того, возможность генно-инженерных манипуляций с длиной NS1 белка вируса гриппа позволила создать векторы, эффективность которых усиливалась наличием экспрессии иммунопотенциирующего агента, например, интерлейкина-15 (van Rikxoort M, Michaelis M, Wolschek M, Muster T, Egorov A, Seipelt J, Doerr HW, Cinatl J Jr. Oncolytic effects of a novel influenza A virus expressing interleukin-15 from the NS reading frame. PLoS One. 2012;7(5):e36506).
К сожалению, в этих работах, использовались вирусы гриппа, способные к ограниченной репродукции в некоторых культурах клеток, не обладающие необходимой генетической стабильностью трансгена для широкомасштабного производства в куриных эмбрионах – субстрате, оптимальном для наработки гриппозных вакцинных препаратов.
Таким образом, сохраняется потребность в новых эффективных вирусных векторах, в частности, аттенуированных гриппозных векторах, характеризующихся отсутствием активной репродукции вируса в организмах животных и обладающих фенотипом температурочувствительности, которые могут быть использованы для профилактики и/или лечения инфекционных заболеваний, а также для лечения онкологических заболеваний.
Раскрытие изобретения
Настоящее изобретение относится к аттенуированному вирусу гриппа A, индуцирующему кросс-протективный ответ против вируса гриппа A и В, содержащему химерный NS фрагмент, включающий укороченную рамку считывания белка NS1 и гетерологичную последовательность гена белка Nep, происходящую от подтипа вируса гриппа А, отличающегося от подтипа указанного аттенуированного вируса гриппа А.
В частности, настоящее изобретение относится к аттенуированному вирусу гриппа А, в котором указанная укороченная рамка считывания кодирует белок NS1 размером 80-130 аминокислотных остатков, более предпочтительно, в котором указанная укороченная рамка считывания кодирует белок NS1 размером 124 аминокислотных остатка.
Один из вариантов осуществления настоящего изобретения относится к аттенуированному вирусу гриппа А, в котором указанная укороченная рамка считывания белка NS1 происходит от вируса гриппа подтипа H1N1, а гетeрологичная последовательность гена белка Nep происходит от вируса гриппа подтипа H2N2.
Еще один вариант осуществления настоящего изобретения относится к аттенуированному вирусу гриппа А, содержащему химерный NS фрагмент, включающий укороченную рамку считывания белка NS1 и гетерологичную последовательность гена белка Nep, причем указанная укороченная рамка считывания белка NS1 происходит от вируса гриппа подтипа H1N1, а гетeрологичная последовательность гена белка Nep происходит от вируса гриппа подтипа H2N2, и где указанная укороченная рамка считывания кодирует белок NS1 размером 124 аминокислотных остатка.
Изобретение относится также к аттенуированному гриппозному вектору, экспрессирующему антиген или его фрагмент, выбранный из группы, состоящей из антигенов или их фрагментов патогенных бактерий, вирусов или простейших, содержащему аттенуированный вирус гриппа А по изобретению, в котором укороченная рамка считывания гена белка NS1 продолжена вставкой последовательности по меньшей мере одного трансгена, кодирующего антиген или его фрагмент патогенных бактерий, вирусов или простейших.
Один из вариантов осуществления изобретения относится к аттенуированному гриппозному вектору, экспрессирующему антиген или его фрагмент, которые выбраны из группы, состоящей из антигенов вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, вируса герпеса, респираторно-синцитиального вируса, вируса иммунодефицита человека, гепатита С, малярийного плазмодия, трихомонады, трипаносомы, лейшмании, хламидий, возбудителя бруцеллеза или их комбинаций.
Следующим вариантом осуществления изобретения является аттенуированный гриппозный вектор, экспрессирующий антиген или его фрагмент патогенных бактерий, вирусов или простейших, где размер указанного антигена или его фрагмента составляет от 10 до 400 аминокислот.
Еще одним вариантом осуществления изобретения является аттенуированный гриппозный вектор, в котором вставка кодирует участок белка НА вируса гриппа, предпочтительно, где участок белка НА представляет собой участок субъединицы HA2, выбранный из группы, состоящей из 1-185 а.к. из вируса гриппа А, 1-186 а.к. из вируса гриппа В, 23-185 а.к. из вируса гриппа А или 65-222 а.к. из вируса гриппа А.
Следующим вариантом осуществления изобретения является аттенуированный гриппозный вектор, в котором вставка кодирует последовательность участка субъединицы НА2 вируса гриппа А или вируса гриппа В от 1 до 21 а.к. и последовательность участка белка NP вируса гриппа А от 243 до 251 а.к.
Еще одним вариантом осуществления изобретения является аттенуированный гриппозный вектор, где вставка кодирует белок микобактерии туберкулеза ESAT-6, Ag85A, Ag85B, Mpt64, HspX, Mtb8.4 или 10.4 или их фрагменты, в частности, где геномная последовательность вируса дополнительно содержит последовательность, кодирующую саморасщепляющийся 2А-пептид, между последовательностями, кодирующими NS1-124 и ESAT6.
Изобретение также относится к аттенуированному гриппозному вектору, экспрессирующему антиген или его фрагмент вируса гриппа, содержащему аттенуированный вирус гриппа А, содержащий химерный NS фрагмент, включающий укороченную рамку считывания белка NS1 и гетерологичную последовательность гена белка Nep, причем указанная укороченная рамка считывания белка NS1 происходит от вируса гриппа подтипа H1N1, а гетeрологичная последовательность гена белка Nep происходит от вируса гриппа подтипа H2N2, и где указанная укороченная рамка считывания кодирует белок NS1 размером 124 аминокислотных остатка, в котором укороченная рамка считывания гена белка NS1 продолжена вставкой последовательности, кодирующей 1-21 а.к. белка НА2 вируса гриппа В и 243-251 а.к. белка NP вируса гриппа А.
Другим объектом изобретения является аттенуированный гриппозный вектор, обладающий онколитической активностью, содержащий аттенуированный вирус гриппа А по изобретению, в котором укороченная рамка считывания гена белка NS1 продолжена вставкой последовательности по меньшей мере одного трансгена, кодирующего антиген или его фрагмент патогенных бактерий, вирусов или простейших.
Одним из вариантов осуществления изобретения является аттенуированный гриппозный вектор, имеющий онколитическую активность, в котором вставка кодирует антиген или его фрагмент, выбранные из группы, состоящей из антигенов или их фрагментов вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, вируса герпеса, респираторно-синцитиального вируса, вируса иммунодефицита человека, гепатита С, малярийного плазмодия, трихомонады, трипаносомы, лейшмании, хламидий или их комбинаций.
Следующим вариантом осуществления изобретения является аттенуированный гриппозный вектор, имеющий онколитическую активность, где размер кодируемого антигена или его фрагмента составляет от 10 до 400 аминокислот.
Предпочтительным вариантом осуществления изобретения является аттенуированный гриппозный вектор, имеющий онколитическую активность, где вставка кодирует белок микобактерии туберкулеза ESAT-6, Ag85A, Ag85B, Mpt64, HspX, Mtb8.4 или 10.4 или их фрагменты, в частности, где укороченная рамка считывания гена белка NS1 продолжена вставкой последовательности, кодирующей белок микобактерии туберкулеза ESAT-6, еще более предпочтительно, где укороченная рамка считывания гена белка NS1 продолжена вставкой последовательности, кодирующей саморасщепляющийся 2А-пептид, и последовательности, кодирующей белок микобактерии туберкулеза ESAT-6.
Еще одним объектом настоящего изобретения является фармацевтическая композиция для лечения и/или профилактики инфекционного заболевания у субъекта, содержащая в эффективном количестве аттенуированный вирус гриппа А по изобретению или аттенуированный гриппозный вектор по изобретению и фармацевтически приемлемый носитель.
Одним из вариантов осуществления изобретения является фармацевтическая композиция, содержащая 6–9,5 log ЭИД 50/мл аттенуированного вируса гриппа А по изобретению или аттенуированного гриппозного вектора по изобретению и буферный раствор, содержащий 0-1,5 масс.% моновалентной соли, 0-5 масс.% L-карнозина, 0-5 масс.% углеводного компонента, 0-2 масс.% белкового компонента, 0-2 масс.% аминокислотного компонента и 0-10 масс.% гидроксиэтилированного крахмала. Предпочтительным вариантом является фармацевтическая композиция, где буферный раствор содержит 0,5-1,5 масс.% моновалентной соли, 0,01-5 масс.% L-карнозина, 1-5 масс.% углеводного компонента, 0,1-2 масс.% белкового компонента, 0,01-2 масс. % аминокислотного компонента и 1-10 масс.% гидроксиэтилированного крахмала, предпочтительно, где моновалентная соль представляет собой хлорид натрия, углеводный компонент представляет собой сахарозу, трегалозу или лактозу, белковый компонент представляет собой человеческий рекомбинантный альбумин, казитон, гидролизат лактальбумина или желатин, аминокислотный компонент представляет собой аргинин, глицин или глутамат натрия.
Еще одним вариантом осуществления изобретения является фармацевтическая композиция для лечения и/или профилактики инфекционного заболевания, где инфекционное заболевание вызывается патогеном, выбранным из группы, состоящей из вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, вируса простого герпеса 1 и 2 типов, респираторно-синцитиального вируса, вируса иммунодефицита человека, вируса гепатита С, малярийного плазмодия, трихомонады, хламидии, трипаносомы, лейшмании или возбудителя бруцеллеза. В предпочтительном варианте осуществления изобретения субъект представляет собой млекопитающее или птицу, в частности, субъект представляет собой человека.
Изобретение также относится к вакцине против инфекционного заболевания, содержащей в эффективном количестве аттенуированный вирус гриппа А по изобретению или аттенуированный гриппозный вектор по изобретению и фармацевтически приемлемый носитель.
Одним из вариантов осуществления изобретения является вакцина, содержащая 6–9,5 log ЭИД 50/мл аттенуированного вируса гриппа А по изобретению или аттенуированного гриппозного вектора по изобретению и буферный раствор, содержащий 0-1,5 масс.% моновалентной соли, 0-5 масс.% L-карнозина, 0-5 масс.% углеводного компонента, 0-2 масс.% белкового компонента, 0-2 масс.% аминокислотного компонента и 0-10 масс.% гидроксиэтилированного крахмала, в частности, буферный раствор, содержащий 0,5-1,5 масс.% моновалентной соли, 0,01-5 масс.% L-карнозина, 1-5 масс.% углеводного компонента, 0,1-2 масс.% белкового компонента, 0,01-2 масс. % аминокислотного компонента и 1-10 масс.% гидроксиэтилированного крахмала. В предпочтительном варианте осуществления в указанном буферном растворе моновалентная соль представляет собой хлорид натрия, углеводный компонент представляет собой сахарозу, трегалозу или лактозу, белковый компонент представляет собой человеческий рекомбинантный альбумин, казитон, гидролизат лактальбумина или желатин, аминокислотный компонент представляет собой аргинин, глицин или глутамат натрия.
Один из вариантов осуществления изобретения относится к вакцине против инфекционного заболевания, где инфекционное заболевание вызывается патогеном, выбранным из группы, состоящей из вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, вируса простого герпеса 1 и 2 типов, респираторно-синцитиального вируса, вируса иммунодефицита человека, вируса гепатита С, малярийного плазмодия, трихомонады, хламидии, трипаносомы, лейшмании или возбудителя бруцеллеза.
Изобретение также относится к применению аттенуированного вируса гриппа А по изобретению, аттенуированного гриппозного вектора по изобретению или фармацевтической композиции по изобретению для профилактики и/или лечения инфекционных заболеваний у субъекта, в частности, для лечения и/или профилактики заболевания, вызванного патогеном, выбранным из группы, состоящей из вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, вируса простого герпеса 1 и 2 типов, респираторно-синцитиального вируса и вируса иммунодефицита человека, вируса гепатита С, малярийного плазмодия, трихомонады, хламидии, трипаносомы, лейшмании или возбудителя бруцеллеза. В предпочтительном варианте осуществления изобретения субъект представляет собой млекопитающее или птицу, в частности, субъект представляет собой человека.
Изобретение также относится к способу лечения и/или профилактики инфекционного заболевания у субъекта, нуждающегося в этом, включающему введение в эффективном количестве аттенуированного вируса гриппа А по изобретению, аттенуированного гриппозного вектора по изобретению или фармацевтической композиции по изобретению указанному субъекту, предпочтительно к способу лечения заболевания, которое вызывается патогеном, выбранным из группы, состоящей из вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, вируса простого герпеса 1 и 2 типов, респираторно-синцитиального вируса, вируса иммунодефицита человека, малярийного плазмодия, трихомонады, трипаносомы, лейшмании или возбудителя бруцеллеза. В предпочтительном варианте осуществления изобретения субъект представляет собой млекопитающее или птицу, в частности, субъект представляет собой человека.
Следующим объектом изобретения является фармацевтическая композиция для лечения онкологических заболеваний у субъекта, содержащая аттенуированный вирус гриппа А по изобретению или аттенуированный вектор по изобретению в эффективном количестве и фармацевтически приемлемый носитель.
Одним из вариантов осуществления изобретения является фармацевтическая композиция, содержащая 8,5-10,5 log ЭИД 50/мл аттенуированного вируса гриппа А по изобретению или аттенуированного гриппозного вектора по изобретению и буферный раствор, содержащий 0-1,5 масс. % моновалентной соли, 0-5 масс.% L-карнозина, 0-5 масс.% углеводного компонента, 0-2 масс.% белкового компонента, 0-2% аминокислотного компонента и 0-10 масс.% гидроксиэтилированного крахмала, причем в предпочтительном варианте осуществления изобретения буферный раствор содержит 0,5-1,5 масс.% раствора моновалентной соли, 0,01-5 масс.% L-карнозина, 1-5 масс.% углеводного компонента, 0,1-2 масс.% белкового компонента, 0,01-2% аминокислотного компонента и 1-10 масс.% гидроксиэтилированного крахмала.
Другим вариантом осуществления является фармацевтическая композиция, в которой в буферном растворе моновалентная соль представляет собой хлорид натрия, углеводный компонент представляет собой крахмал, белковый компонент представляет собой человеческий рекомбинантный альбумин, аминокислотный компонент представляет собой аргинин.
Следующим объектом настоящего изобретения является применение аттенуированного вектора по изобретению, аттенуированного гриппозного вектора по изобретению или фармацевтической композиции по изобретению для лечения онкологических заболеваний у субъекта, в частности, заболеваний, выбранных из группы, состоящей из колоректального рака, кардиоэзофагеального рака, панкреатического рака, холангиоцеллюлярного рака, глиомы, глиобластомы и меланомы. В предпочтительном варианте осуществления изобретения субъект представляет собой человека.
Настоящее изобретение также относится к способу лечения онкологических заболеваний у субъекта, нуждающегося в этом, включающему введение в эффективном количестве аттенуированного вируса гриппа А по изобретению, аттенуированного гриппозного вектора по изобретению или фармацевтической композиции по изобретению, предпочтительно, к способу лечения онкологического заболевания, выбранного из группы, состоящей из колоректального рака, кардиоэзофагеального рака, панкреатического рака, холангиоцеллюлярного рака, глиомы, глиобластомы и меланомы.
В одном из вариантов осуществления изобретения указанное введение представляет собой внутриопухолевое введение или введение в лакуну, образовавшуюся после хирургического удаления опухоли.
Техническим результатом настоящего изобретения является получение химерных вирусов гриппа по NS геномному фрагменту и соответствующих гриппозных векторов, обладающих высокой безопасностью для людей и животных, в частности, векторов, характеризующихся отсутствием активной репродукции вируса в организме животного и обладающих фенотипом температурочувствительности, и которые могут быть использованы для профилактики и/или лечения инфекционных заболеваний. Кроме того, техническим результатом является высокий потенциал роста полученных вирусов гриппа и гриппозных векторов в 10-дневных куриных эмбрионах. Еще одним техническим результатом является получение гриппозных векторов, которые обладают свойствами универсальной гриппозной вакцины. Также техническим результатом является получение вирусов гриппа и гриппозных векторов, обладающих онколитической активностью.
Краткое описание чертежей
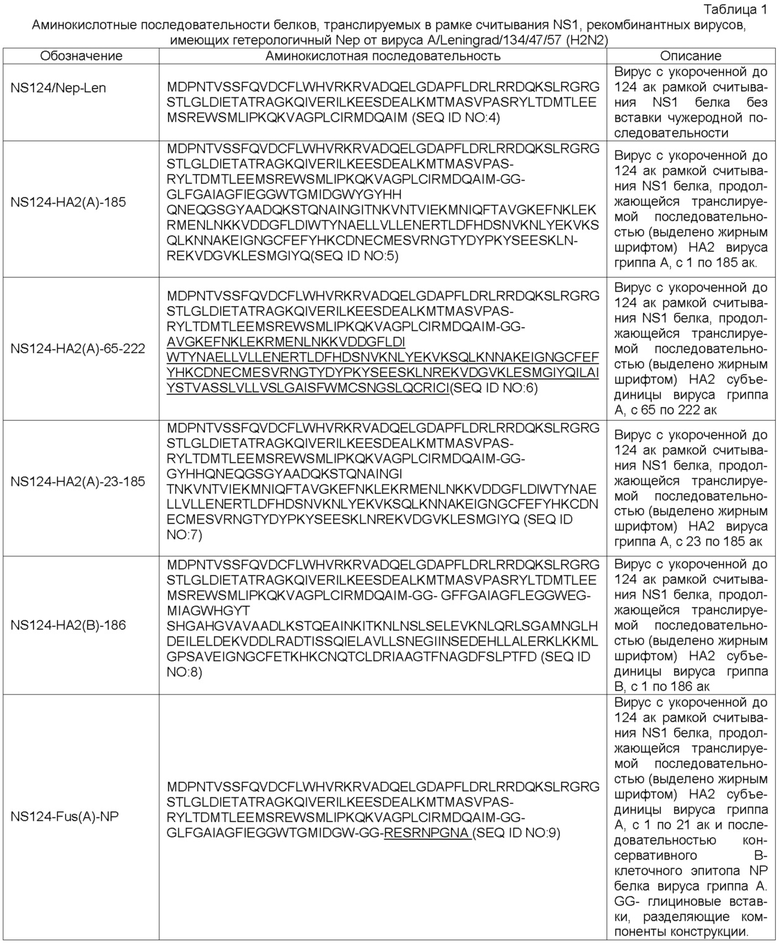
На Фиг.1 показан принцип конструирования гриппозного аттенуированного вектора. В А представлена схема NS геномного фрагмента вируса гриппа A/PR/8/34 (H1N1). В Б представлена схема генетически модифицированного химерного NS геномного фрагмента, где рамка считывания белка NS1 укорочена и может продолжаться вставкой чужеродной последовательности. Последовательность, кодирующая белок Nep, заменена на гетерологичную от другого подтипа вируса гриппа А.
На Фиг.2 представлены нуклеотидные последовательности геномных NS фрагментов вируса дикого типа и примеры двух генетических конструкций химерной природы. В А представлен NS фрагмент вируса гриппа А/PR/8/34 (H1N1). В Б представлен химерный NS фрагмент вируса гриппа А, где рамка считывания белка NS1 укорочена, а последовательность Nep, выделенная жирным шрифтом, заимствована от вируса А/Singapore/1/57 (H2N2).
В представлен химерный NS фрагмент вируса гриппа А, где рамка считывания белка NS1 укорочена, а последовательность Nep, выделенная жирным шрифтом, заимствована от вируса А/Leningrad/134/47/57 (H2N2).
На Фиг.3 представлены аминокислотные последовательности белков, транслируемых в рамке считывания NS1 химерных гриппозных векторов, содержащих гетерологичный Nep от вируса А/Leningrad/134/47/57 (H2N2).
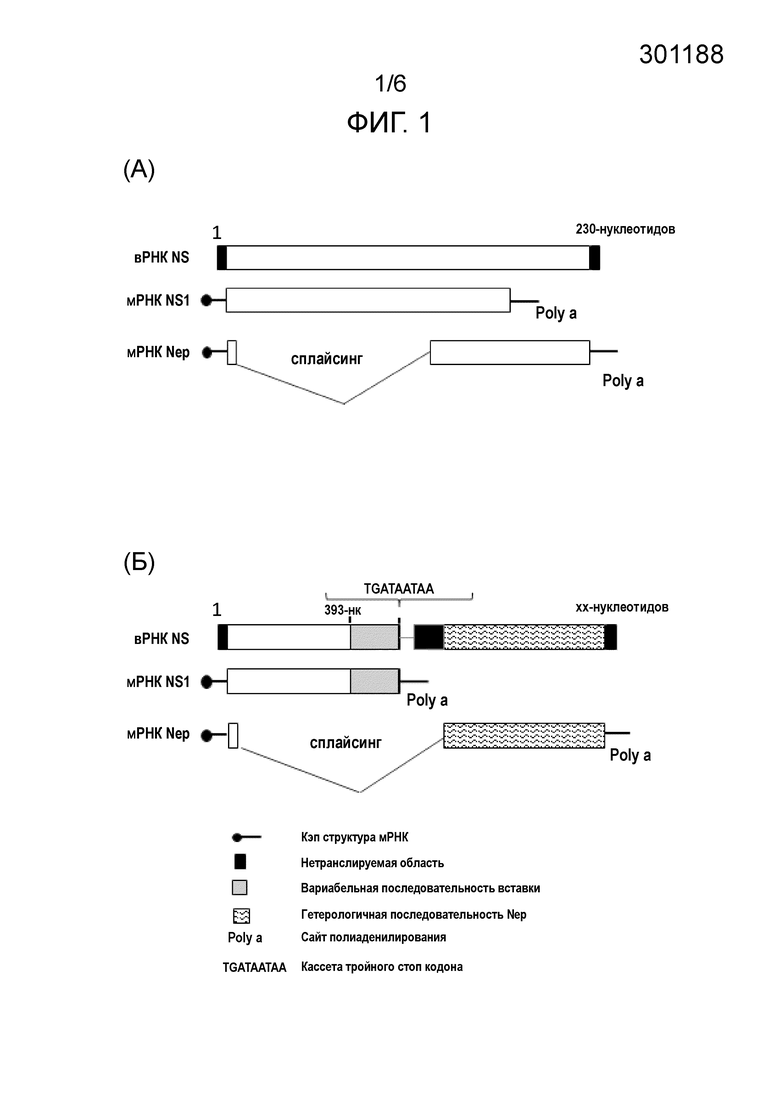
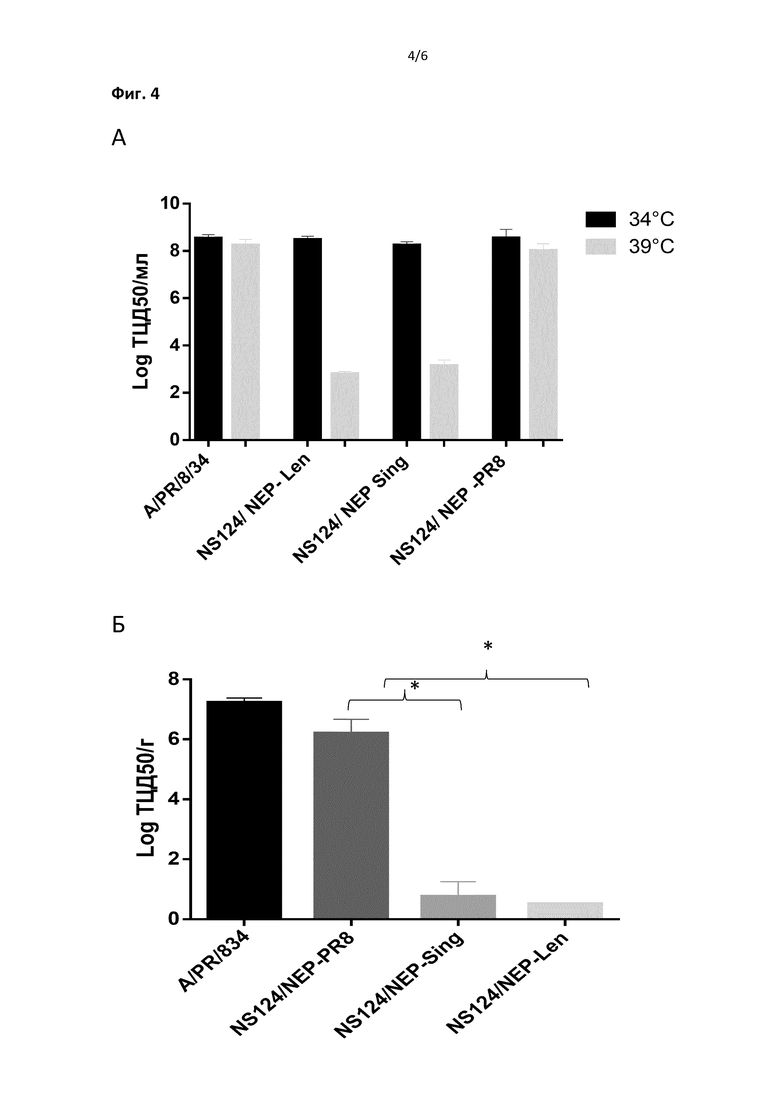
На Фиг.4 представлены данные, демонстрирующие патогенность и ts-фенотип вирусов с гетерологичным Nep геном. В А показаны данные репродукции вирусов при оптимальной 34°C и повышенной 39°C температуре в клетках Vero. В Б представлены данные репродукции вирусов в легких мышей на 2-е сутки после заражения.
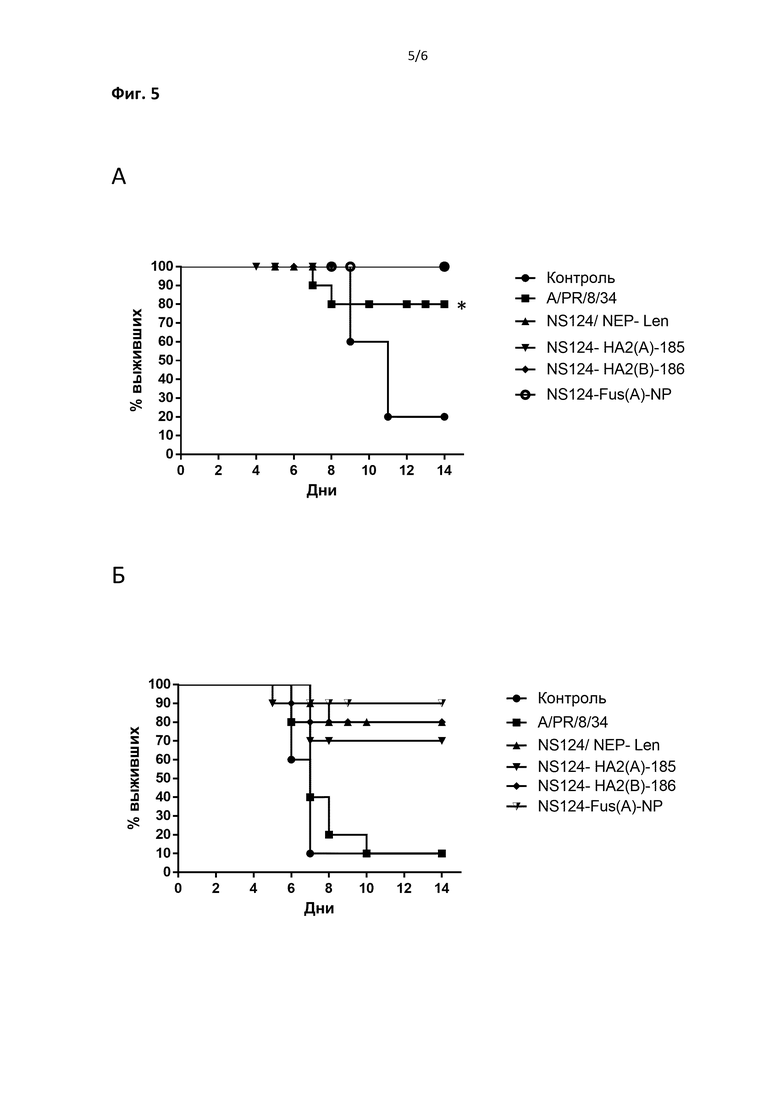
На Фиг.5 приведены графики, демонстрирующие летальность мышей после однократной иммунизации векторами, экспрессирующими части субъединицы НА2 с рамки считывания белка NS1, и контрольного заражения гетерологичными патогенными штаммами вируса гриппа. В А показана летальность при контрольном заражении вирусом A/Mississippi/85/1(H3N2), в В - летальность при контрольном заражении вирусом В/ Lee/40.
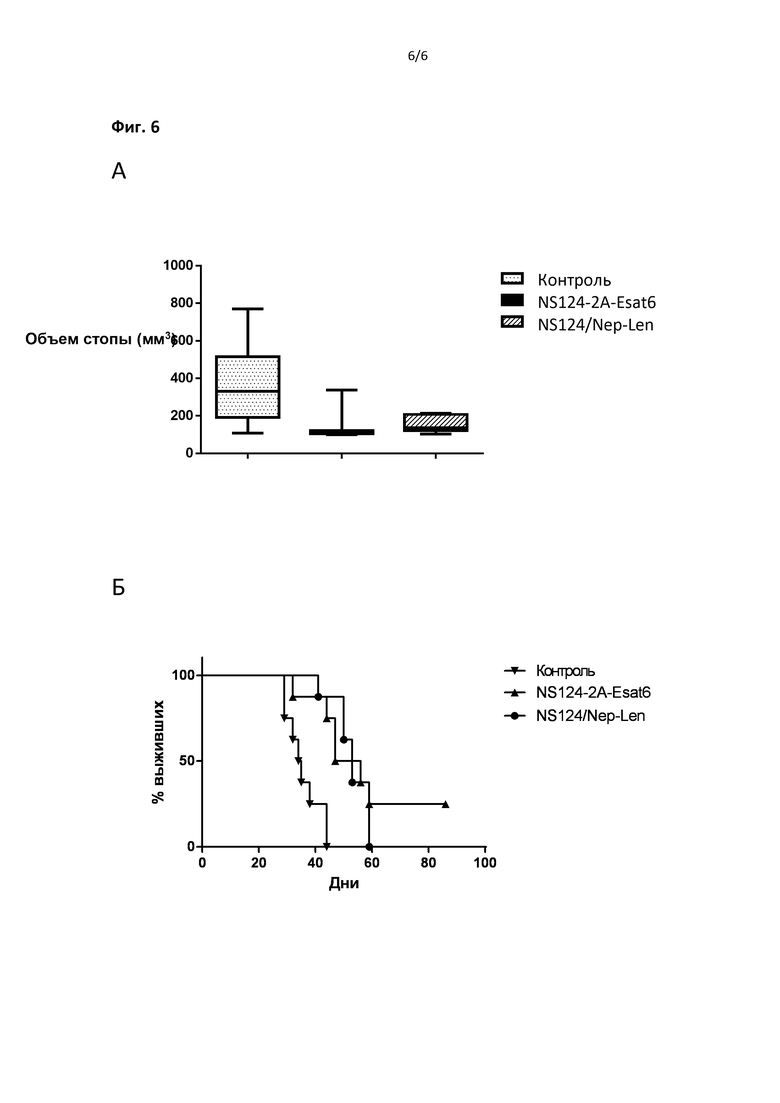
На Фиг.6 представлены данные по онколитическому действию рекомбинантных вирусов гриппа в отношении меланомы мышей, индуцированной введением 1х106 клеток В16 в стопу задней лапы. Терапия проводилась путем внутриопухолевого введения вируса на 5 день после имплементации опухоли. В А представлен средний размер стопы на 20 день после имплементации опухоли и 4х-кратной терапии онколитическими векторами, в Б - выживаемость мышей после проведенной 4х-кратной терапии онколитическими векторами.
Подробное описание изобретения
Настоящее изобретение относится к полученным генно-инженерными методами аттенуированным вирусам гриппа A, которые могут применяться для лечения и/или профилактики инфекционных заболеваний, а также для лечения онкологических заболеваний.
В частности, настоящее изобретение относится к аттенуированному вирусу гриппа А, индуцирующему кросс-протективный ответ против вируса гриппа A и В, содержащему химерный NS фрагмент, включающий укороченную рамку считывания белка NS1 и гетерологичную последовательность гена белка Nep, происходящую от подтипа вируса гриппа А, отличающегося от подтипа указанного аттенуированного вируса гриппа А. Таким образом, подтип вируса А для последовательности, кодирующей укороченный белок NS1, отличается от подтипа вируса А, из которого получена последовательность, кодирующая белок Nep. В частности, один из вариантов осуществления настоящего изобретения относится к аттенуированному вирусу гриппа А, в котором указанная укороченная рамка считывания белка NS1 происходит от вируса гриппа подтипа H1N1, а гетeрологичная последовательность гена белка Nep происходит от вируса гриппа подтипа от H2 до Н18 человеческого или животного происхождения.
Указанная укороченная рамка считывания кодирует белок NS1 размером 80-130 аминокислотных остатков, более предпочтительно, указанная укороченная рамка считывания кодирует белок NS1 размером 124 аминокислотных остатка.
Настоящее изобретение основано в частности на том, что авторы неожиданно обнаружили, что проблема недостаточной аттенуации (отсутствие температурочувствительности и высокий уровень репродукции в легких мышей) гриппозных векторов, в частности вектора NS1-124, может быть решена с помощью модификации второго сплайсированного белкового продукта NS геномного фрагмента вируса гриппа – белка Nep (NS2). Оказалось, что замена геномной последовательности Nep вируса гриппа А, в частности, вируса гриппа A/PR/8/34 (H1N1), на последовательности Nep, взятые от гетерологичных штаммов вируса гриппа, например, вируса А/Singapore/1/57 (H2N2) или A/Leningrad/134/47/57 (H2N2), приводит к появлению у штамма гриппа А, в частности A/PR/8/34 (H1N1), фенотипа температурочувствительности и аттенуации. Используя этот феномен, были сконструированы химерные NS-фрагменты вируса гриппа, кодирующие укороченную рамку считывания NS1-124 от вируса A/PR/8/34 (H1N1) в комбинации с рамкой считывания белка Nep, взятой от вируса сероподтипа H2N2. Реассортантные вирусы гриппа на основе вируса A/PR/8/34, независимо от происхождения поверхностных антигенов H1N1, H5N1 или H1N1pdm, несущие химерный NS геномный фрагмент, оказались неспособными к активной репродукции при 39°C и в легких мышей (фенотип аттенуации), но при этом по-прежнему репродуцировались до высоких титров в 10-дневных куриных эмбрионах.
Настоящее изобретение относится также к аттенуированному гриппозному вектору, экспрессирующему антиген или его фрагмент, выбранный из группы, состоящей из антигенов или их фрагментов патогенных бактерий, вирусов или простейших, содержащий аттенуированный вирус гриппа А согласно настоящему изобретению, в котором укороченная рамка считывания гена белка NS1 продолжена вставкой последовательности по меньшей мере одного трансгена, кодирующего антиген или его фрагмент патогенных бактерий, вирусов или простейших. В общем, в аттенуированный вирус согласно настоящему изобретению может быть вставлен трансген, кодирующий антиген или его фрагмент из любых бактерий, вирусов или простейших, патогенных в отношении животных, в частности, антиген может быть выбран из группы, состоящей из антигенов или их фрагментов вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, бруцеллы абортус, вируса герпеса, респираторно-синцитиального вируса, вируса иммунодефицита человека, гепатита С, малярийного плазмодия, трихомонады, трипаносомы, лейшмании, хламидий, возбудителя бруцеллеза или их комбинаций. В частности, последовательность вставки может кодировать участок белка НА вируса гриппа, белок микобактерии туберкулеза ESAT-6, Ag85A, Ag85B, Mpt64, HspX, Mtb8.4 или 10.4 или их фрагменты. При этом геномная последовательность аттенуированного вектора согласно настоящему изобретению может дополнительно содержать последовательность, кодирующую саморасщепляющийся 2А-пептид, между последовательностями, кодирующими NS1-124 и ESAT6.
Размер антигена или его фрагмента, кодируемого последовательностью вставки, может иметь любой размер, который ограничен лишь способностью геномного фрагмента «принимать» нуклеотидную последовательность, кодирующую антиген или его фрагмент. Предпочтительно, размер антигена составляет от 10 до 400 аминокислот. Например, вставка может кодировать участок белка НА, представляющий собой участок субъединицы HA2, выбранный из группы, состоящей из 1-185 аминокислот из вируса гриппа А, 1-186 аминокислот из вируса гриппа В, 23-185 аинокислот из вируса гриппа А или 65-222 аминокислот из вируса гриппа А. Нумерация аминокислот дана в соответствии с положениями аминокислот в участке субъединицы HA2 вируса гриппа, из которого происходит трансген.
Еще одним частным случаем аттенуированного гриппозного вектора согласно настоящему изобретению является вектор, в котором вставка кодирует последовательность участка субъединицы НА2 вируса гриппа А или вируса гриппа В от 1 до 21 аминокислот и последовательность участка белка NP вируса гриппа А от 243 до 251 аминокислот. Неожиданно было обнаружено, что эти варианты векторов, несмотря на короткую продолжительность вставки, проявили наилучшую защитную эффективность в отношении вируса гриппа В и гетерологчных атигенных подтипов вируса гриппа А, после однократной иммунизации мышей, т.е. проявляли свойства универсальной гриппозной вакцины.
Авторы обнаружили, что вставки чужеродных антигенных последовательностей в рамку считывания белка NS1, например, после аминокислотной позиции 124 не оказывали существенного влияния на фенотип аттенуации химерного вируса, полученного согласно настоящему изобретению. Таким образом, были получены разнообразные гриппозные векторы, обладающие необходимыми производственными характеристиками и выраженными фенотипическими и генотипическими маркерами аттенуации в соответствии с требованиями, предъявляемыми к живым гриппозным вакцинам. Независимо от природы вставок, вирусы показали свою безвредность для лабораторных животных и схожесть проявления фенотипического маркера аттенуации – наличие ts фенотипа. Общность их генетических маркеров аттенуации определялась наличием укороченной рамки считывания белка NS1 и наличием гетерологичной последовательности гена Nep, взятой от другого субтипа вируса гриппа А. В зависимости от вставки, полученные векторы проявляли свойства универсальной гриппозной вакцины, вакцины против туберкулеза т.д.
Настоящее изобретение относится также к аттенуированному гриппозному вектору, обладающему онколитической активностью, содержащему аттенуированный вирус гриппа А согласно настоящему изобретению, в котором укороченная рамка считывания гена белка NS1 продолжена вставкой последовательности по меньшей мере одного трансгена, кодирующего антиген или его фрагмент патогенных бактерий, вирусов или простейших. Указанный антиген может происходить из любых бактерий, вирусов или простейших, патогенных в отношении животных, в частности, антиген может быть выбран из группы, состоящей из антигенов вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, вируса герпеса, респираторно-синтициального вируса, вируса иммунодефицита человека, гепатита С, малярийного плазмодия, трихомонады, трипаносомы, лейшмании, хламидий или их комбинаций. В частности, вставленный трансген может кодировать белок микобактерии туберкулеза ESAT-6, Ag85A, Ag85B, Mpt64, HspX, Mtb8.4 или 10.4 или их фрагменты, дополнительно, укороченная рамка считывания гена белка NS1 может быть продолжена вставкой последовательности, кодирующей белок микобактерии туберкулеза ESAT-6.
Размер антигена или его фрагмента, кодируемого последовательностью вставки, может иметь любой размер, который ограничен лишь способностью геномного NS фрагмента «принимать» нуклеотидную последовательность, кодирующую антиген или его фрагмент. Предпочтительно, размер антигена составляет от 10 до 400 аминокислот.
Авторы неожиданно обнаружили, что аттенуированные гриппозные векторы, несущие химерный NS геномный фрагмент за счет включения гетерологичного Nep гена, обладают повышенной онколитической активностью при условии экспрессии антигена патогена, в частности, бактериального антигена с рамки считывания белка NS1. Например, вирусный вектор, кодирующий белок Esat6 микобактерии туберкулеза имел более высокую активность, по сравнению с известным рекомбинантным вирусом с укороченным NS1 белком, но без вставки. Не привязываясь к какой-либо теории, можно предположить, что наличие у млекопитающих напряженного противотуберкулезного иммунитета вносит вклад в иммунную атаку опухоли, зараженной вирусом, экспрессирующим туберкулезный белок.
Настоящее изобретение также относится к фармацевтическим композициям, которые содержат в эффективном количестве аттенуированный вирус гриппа А согласно настоящему изобретению или аттенуированный гриппозный вектор согласно настоящему изобретению и фармацевтически приемлемый носитель. Фармацевтические композиции согласно настоящему изобретению предназначены для лечения и/или профилактики инфекционного заболевания у субъекта, в частности, инфекционного заболевания, вызываемого патогеном, выбранным из группы, состоящей из вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, вируса простого герпеса 1 и 2 типов, респираторно-синцитиального вируса, вируса иммунодефицита человека, вируса гепатита С, малярийного плазмодия, трихомонады, хламидии, трипаносомы или лейшмании.
Кроме того, фармацевтические композиции согласно настоящему изобретению предназначены для лечения онкологических заболеваний различной этиологии, в частности, онкологическое заболевание может быть выбрано из группы, состоящей из колоректального рака, кардиоэзофагеального рака, панкреатического рака, холангиоцеллюлярного рака, глиомы, глиобластомы и меланомы.
Фармацевтическая композиция согласно настоящему изобретению может быть составлена в виде вакцины, содержащей в эффективном количестве аттенуированный вирус гриппа А согласно настоящему изобретению или аттенуированный гриппозный вектор согласно настоящему изобретению и фармацевтически приемлемый носитель.
Термин «субъект» или «животное» в контексте настоящего описания означает позвоночных, которые подвержены инфекции, вызываемой патогенными бактериями, вирусами или простейшими, включая птиц (водоплавающие, куры и т.д.) и представителей различных видов млекопитающих, таких как псовые, кошачьи, волки, хорьки, грызуны (крысы, мыши и т.д.), лошади, коровы, овцы, козы, свиньи и приматы. В одном из вариантов осуществления изобретения субъект представляет собой человека.
Под «эффективным количеством» подразумевается такое количество вируса или вектора, которое при введении субъекту, в однократной дозе или в качестве части цикла лечения, является эффективным для лечения и/или профилактики с получением терапевтического результата. Это количество может варьироваться в зависимости от состояния здоровья и физического состояния пациента, возраста, таксономической группы индивида, подвергаемого лечению, препаративной формы, оценки медицинской ситуации лечащим врачом и других важных факторов. Полагают, что количество может варьировать в относительно широком диапазоне, который специалист в данной области может определить стандартными способами. В частности, фармацевтическая композиция может содержать 6–9,5 log ЭИД 50/мл химерного вируса гриппа А согласно изобретению или гриппозного вектора согласно изобретению.
Термин «фармацевтически приемлемый носитель» в контексте настоящего изобретения означает любой носитель, используемый в данной области, в частности, воду, физиологический раствор, буферный раствор и т.п. В одном из вариантов осуществления фармацевтически приемлемый носитель представляет собой буферный раствор, содержащий 0-1,5 масс.% моновалентной соли, 0-5 масс.% L-карнозина, 0-5 масс.% углеводного компонента, 0-2 масс.% белкового компонента, 0-2 масс.% аминокислотного компонента и 0-10 масс.% гидроксиэтилированного крахмала, предпочтительно, указанный буферный раствор содержит 0,5-1,5 масс.% моновалентной соли, 0,01-5 масс.% L-карнозина, 1-5 масс.% углеводного компонента, 0,1-2 масс.% белкового компонента, 0,01-2 масс. % аминокислотного компонента и 1-10 масс.% гидроксиэтилированного крахмала, в наиболее предпочтительном варианте, моновалентная соль представляет собой хлорид натрия, углеводный компонент представляет собой сахарозу, трегалозу или лактозу, белковый компонент представляет собой человеческий рекомбинантный альбумин, казитон, гидролизат лактальбумина или желатин, аминокислотный компонент представляет собой аргинин, глицин или глутамат натрия.
Настоящее изобретение относится также к применению аттенуированного вируса гриппа А, аттенуированного гриппозного вектора или фармацевтической композиции согласно настоящему изобретению для профилактики и/или лечения инфекционных заболеваний у субъекта, в частности, инфекционного заболевания, вызываемого патогеном, выбранным из группы, состоящей из вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, вируса простого герпеса 1 и 2 типов, респираторно-синцитиального вируса, вируса иммунодефицита человека, вируса гепатита С, малярийного плазмодия, трихомонады, хламидии, трипаносомы или лейшмании.
Дополнительно, настоящее изобретение также относится к способам лечения, в которых для введения субъекту используют аттенуированный вирус гриппа А, аттенуированный гриппозный вектор или фармацевтическую композицию согласно настоящему изобретению. Способы предназначены для лечения и/или профилактики инфекционных заболеваний, вызываемых патогенными вирусами, бактериями или простейшими, в частности, инфекционных заболеваний, вызываемых патогеном, выбранным из группы, состоящей из вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, вируса простого герпеса 1 и 2 типов, респираторно-синцитиального вируса, вируса иммунодефицита человека, вируса гепатита С, малярийного плазмодия, трихомонады, хламидии, трипаносомы или лейшмании. Кроме того, способы предназначены для лечения онкологических заболеваний у субъекта, в частности, онкологическое заболевание может быть выбрано из группы, состоящей из колоректального рака, кардиоэзофагеального рака, панкреатического рака, холангиоцеллюлярного рака, глиомы, глиобластомы и меланомы.
Введение субъекту может осуществляться любыми стандартными методами, в частности, внутримышечно, внутривенно, перорально, сублингвально, ингаляционно или интраназально. Дополнительно, в случае лечения онкологических заболеваний введение может представлять собой внутриопухолевое введение или введение в лакуну, образовавшуюся после хирургического удаления опухоли.
Далее изобретение проиллюстрировано примерами осуществления, не ограничивающими объем изобретения.
ПРИМЕРЫ
Пример 1
Получение гриппозных векторов с модифицированным NS геномным фрагментом
Сборка рекомбинантных вирусов осуществлялась в несколько этапов. На первом этапе синтетическим путем были получены комплементарные ДНК (кДНК) копии всех восьми геномных фрагментов вируса гриппа A/PR/8/34 (H1N1), используя данные генетического банка (pHW-PR8-HA (Genbank accession number: EF467821.1), pHW-PR8-NA (Genbank accession number: AF389120.1), pHW-PR8-PB2 (Genbank accession number: AB671295), pHW-PR8-PB1 (Genbank accession number: CY033583), pHW-PR8-PA (Genbank accession number: AF389117), pHW-PR8-NP (Genbank accession number: AF389119), pHW-PR8-M (Genbank accession number: AF389121), pHW-PR8-NS (Genbank accession number: J02150.1)). На втором этапе синтезированные последовательности были клонированы в двунаправленный вектор на основе плазмиды pHW2000 (Hoffmann E, Neumann G, Kawaoka Y, Hobom G, Webster RG. A DNA transfection system for generation of influenza A virus from eight plasmids. Proc Natl Acad Sci USA. 2000; 97(11):6108-13.). Указанный плазмидный вектор благодаря наличию Pol I и Pol II промоторов обеспечивает одновременную внутриклеточную транскрипцию вирусных и соответствующих матричных РНК при трансфекции клеток млекопитающих.
Было получено 7 плазмидных клонов, кодирующих PB1, PB2, PA, HA, NA, NP, M без модификаций, и набор вариантов NS геномного фрагмента с модификациями, принцип которых представлен на Фиг.1.
На Фиг.1А представлена схема NS геномного фрагмента вируса гриппа A/PR/8/34 (H1N1). Полноразмерный геномный фрагмент вирусной РНК (вРНК) негативной полярности имеет длину 230 нуклеотидов (нт). Транскрипция NS фрагмента, полимеразным комплексом вируса гриппа, приводит к образованию 2 типов матричных РНК: 1. Прямого транскрипта - мРНК белка NS1, кодирующую белок NS1 длиной в 230 аминокислотных остатков (ак) и сплайсированную мРНК белка Nep, кодирующую белок длиной в 121 ак. На Фиг.1Б представлена схема генетически модифицированного химерного NS геномного фрагмента, где рамка считывания белка NS1 до 398 нт и может продолжаться вставкой чужеродной последовательности, заканчивающаяся тройным стоп кодоном. Последовательность, кодирующая белок Nep заменена на гетерологичную от другого подтипа вируса гриппа А. В результате модификации, химерный геномный NS фрагмент имеет неопределенную длину, в зависимости от длины вставки чужеродной последовательности в рамку считывания NS1.
В качестве основы для создания химерной конструкции геномного сегмента NS была использована нуклеотидная последовательность вируса гриппа A/PR/8/34 (H1N1), включая кодирующую, а также 5’и 3’ некодирующие концевые участки (номер последовательности в базе GenBank J02150). В зависимости от цели, были сконструированы различные варианты химерных конструкций NS геномного фрагмента, где общими признаками являлись: 1) замена кодирующей белок Nep последовательности вируса A/PR/8/34 (H1N1) на последовательность, имеющую происхождение от вирусов гриппа подтипа H2N2 (штаммы: A/Singapore/1/57 и A/Leningrad/134/47/57) (Фиг. 2Б и 2В); 2) делеция последовательности из 30 нуклеотидов (позиции 499-428 нт) в участке, кодирующем NS1, до сайта сплайсирования Nep; 3) ограничение рамки считывания белка NS1 до 124 аминокислотных остатков путем внедрения кассеты из трех последовательных стоп-кодонов (TGATAATAA) после нуклеотидной позиции 399 (Фиг.2А и Фиг.2Б); 4) наличие или отсутствие последовательности чужеродной генетической последовательности, введенной в рамку считывания NS1 после нуклеотидной позиции 398, непосредственно перед кассетой стоп-кодонов.
На Фиг.2А приведена последовательность SEQ ID NO:1 NS фрагмент вируса гриппа А/PR/8/34 (H1N1), в которой выделена и подчеркнута последовательность из 30 нт, подлежащая делеции при конструировании Б и В. Жирным шрифтом выделена последовательность Nep гена, подлежащая замене на гетерологичный аналог от другого подтипа вируса гриппа А. На Фиг.2Б приведена последовательность SEQ ID NO:2 рекомбинантного NS фрагмента вируса гриппа А, где рамка считывания белка NS1 укорочена до 398 нт, с помощью вставки, состоящей из трех последовательных стоп-кодонов(подчеркнуто); последовательность Nep, выделенная жирным шрифтом, заимствована от вируса А/Singapore/1/57 (H2N2). На Фиг.2В приведена последовательность SEQ ID NO: 3 рекомбинантного NS фрагмента вируса гриппа А, где рамка считывания белка NS1 укорочена до 398 нт, с помощью вставки, состоящей из трех последовательных стоп-кодонов(подчеркнуто); последовательность Nep, выделенная жирным шрифтом, заимствована от вируса А/Leningrad/134/47/57 (H2N2).
AGCAAAAGCAGGGTGACAAAGACATAATGGATCCAAACACTGTGTCAAGCTTTCAGGTAGATTGCTTTCTTTGGCATGTCCGCAAACGAGTTGCAGACCAAGAACTAGGTGATGCCCCATTCCTTGATCGGCTTCGCCGAGATCAGAAATCCCTAAGAGGAAGGGGCAGCACTCTTGGTCTGGACATCGAGACAGCCACACGTGCTGGAAAGCAGATAGTGGAGCGGATTCTGAAAGAAGAATCCGATGAGGCACTTAAAATGACCATGGCCTCTGTACCTGCGTCGCGTTACCTAACCGACATGACTCTTGAGGAAATGTCAAGGGAATGGTCCATGCTCATACCCAAGCAGAAAGTGGCAGGCCCTCTTTGTATCAGAATGGACCAGGCGATCATGGATAAAAACATCATACTGAAAGCGAACTTCAGTGTGATTTTTGACCGGCTGGAGACTCTAATATTGCTAAGGGCTTTCACCGAAGAGGGAGCAATTGTTGGCGAAATTTCACCATTGCCTTCTCTTCCAGGACATACTGCTGAGGATGTCAAAAATGCAGTTGGAGTCCTCATCGGAGGACTTGAATGGAATGATAACACAGTTCGAGTCTCTGAAACTCTACAGAGATTCGCTTGGAGAAGCAGTAATGAGAATGGGAGACCTCCACTCACTCCAAAACAGAAACGAGAAATGGCGGGAACAATTAGGTCAGAAGTTTGAAGAAATAAGATGGTTGATTGAAGAAGTGAGACACAAACTGAAGGTAACAGAGAATAGTTTTGAGCAAATAACATTTATGCAAGCCTTACATCTATTGCTTGAAGTGGAGCAAGAGATAAGAACTTTCTCATTTCAGCTTATTTAATAATAAAAAACACCCTTGTTTCTACT (SEQ ID NO:1)
AGCAAAAGCAGGGTGACAAAGACATAATGGATCCAAACACTGTGTCAAGCTTTCAGGTAGATTGCTTTCTTTGGCATGTCCGCAAACGAGTTGCAGACCAAGAACTAGGTGATGCCCCATTCCTTGATCGGCTTCGCCGAGATCAGAAATCCCTAAGAGGAAGGGGCAGCACTCTTGGTCTGGACATCGAGACAGCCACACGTGCTGGAAAGCAGATAGTGGAGCGGATTCTGAAAGAAGAATCCGATGAGGCACTTAAAATGACCATGGCCTCTGTACCTGCGTCGCGTTACCTAACCGACATGACTCTTGAGGAAATGTCAAGGGAATGGTCCATGCTCATACCCAAGCAGAAAGTGGCAGGCCCTCTTTGTATCAGAATGGACCAGGCGATCATGTGATAATAAAGTGTGATTTTTGACCGGCTGGAGACTCTAATATTGCTAAGGGCTTTCACCGAAGAGGGAGCAATTGTTGGCGAAATTTCACCATTGCCTTCTCTTCCAGGACATACTAATGAGGATGTCAAAAATGCAATTGGGGTCCTCATCGGAGGACTTGAATGGAATGATAACACAGTTCGAGTCTCTAAAACTCTACAGAGATTCGCTTGGTGAAACAGTAATGAGAATGGGAGACCTCCACTCACTCCAAAACAGAAACGGAAAATGGCGAGAACAATTAGGTCAAAAGTTCGAAGAAATAAGATGGCTGATTGAAGAAGTGAGACACAAATTGAAGATAACAGAGAATAGTTTTGAGCAAATAACATTTATGCAAGCCTTACAGCTACTATTTGAAGTGGAACAAGAGATAAGAACTTTCTCGTTTCAGCTTATTTAATAATAAAAAACACCCTTGTTTCTACT (SEQ ID NO:2)
AGCAAAAGCAGGGTGACAAAGACATAATGGATCCAAACACTGTGTCAAGCTTTCAGGTAGATTGCTTTCTTTGGCATGTCCGCAAACGAGTTGCAGACCAAGAACTAGGTGATGCCCCATTCCTTGATCGGCTTCGCCGAGATCAGAAATCCCTAAGAGGAAGGGGCAGCACTCTTGGTCTGGACATCGAGACAGCCACACGTGCTGGAAAGCAGATAGTGGAGCGGATTCTGAAAGAAGAATCCGATGAGGCACTTAAAATGACCATGGCCTCTGTACCTGCGTCGCGTTACCTAACCGACATGACTCTTGAGGAAATGTCAAGGGAATGGTCCATGCTCATACCCAAGCAGAAAGTGGCAGGCCCTCTTTGTATCAGAATGGACCAGGCGATCATGTGATAATAAAGTGTGATTTTTGACCGGCTGGAGACTCTAATATTGCTAAGGGCTTTCACCGAAGAGGGAGCAATTGTTGGCGAAATTTCACCATTGCCTTCTCTTCCAGGACATACTAATGAGGATGTCAAAAATGCAATTGGGGTCCTCATCGGAGGACTTGAATGGAATGATAACACAGTTCGAGTCTCTAAAACTCTACAGAGATTCGCTTGGAGAAGCAGTAATGAGAATGGGAGACCTCCACTCACTCCAAAACAGAAACGGAAAATGGCGAGAACAATTAGGTCAAAAGTTCGAAGAAATAAGATGGCTGATTGAAGAAGTGAGACACAAATTGAAGATAACAGAGAATAGTTTTGAGCAAATAACATTTATACAAGCCTTACAGCTACTATTTGAAGTGGAACAAGAGATAAGAACTTTCTCGTTTCAGCTTATTTAATAATAAAAAACACCCTTGTTTCTACT (SEQ ID NO:3)
Таким образом, сконструированные химерные NS геномные фрагменты, при их транскрипции полимеразным комплексом вируса гриппа, формировали два типа матричной РНК: 1) NS1 мРНК, транслируемая в форме укороченного до 124 аминокислотных остатков NS1 белка, ограниченного стоп-кодонами или продолжающегося вставкой последовательностей трансгенов различного происхождения, трансляция которых ограничивается кассетой из стоп-кодонов; 2) Nep мРНК гетерологичного происхождения от вируса гриппа А другого антигенного подтипа. Варианты трансляции рекомбинантного NS1 белка со вставками представлены на Фиг.3 и в Таблице 1 ниже.
Сборка рекомбинантных вирусов осуществлялась путем трансфекции клеток VERO семью плазмидами, кодирующими геномные немодифицированные фрагменты вируса гриппа, и одним из вариантов NS геномного фрагмента химерной природы, используя метод электропорации плазмидной ДНК (Cell Line Nucleofector® Kit V (Lonza)) в соответствии с инструкцией к применению. После трансфекции клетки инкубировались в среде Optipro (Invitrogen) в течение 96 часов при 34°C c добавлением трипсина 1 мкг/мл для обеспечения пост-трансляционного расщепления предшественника гемагглютинина на субъединицы НА1 и НА2. Вирусный урожай с клеток Vero использовался для заражения 10-дневных куриных эмбрионов (SPF). Эмбрионы инкубировались в течение 48 часов при 34°C, после чего аллантоисные жидкости, имеющие положительный титр в реакции гемагглютинации, использовались для проведения второго пассажа на куриных эмбрионах. Аллантоисные жидкости второго пассажа аликвотировались и хранились при -80°C. Материал второго пассажа использовался для контроля генетической структуры химерного NS фрагмента и присутствия трансгена путем получения РТ-ПЦР продукта и его секвенирования. Кроме того, материал второго пассажа использовался для определения фенотипических маркеров рекомбинантных вирусных штаммов и векторов и определения генетической стабильности трансгена в течение 5 пассажей на куриных эмбрионах.
Пример 2
Определение фенотипа температурочувствительности и аттенуации рекомбинантных вирусов, несущих гетерологичный Nep
Температурочувствительность вирусов определяли путем сравнительного титрования инфекционной активности вирусов на клетках Vero при оптимальной 34°C и повышенной 39°C температурах, в 96-луночных планшетах. Титры вирусов подсчитывали методом Рида и Мюнча после инкубации в течение 96 часов с учетом развития цитопатического эффекта в лунках планшета (Reed, L.J.; Muench, H. (1938). "A simple method of estimating fifty percent endpoints". The American Journal of Hygiene 27: 493–497). На Фиг.4А представлены титры вирусов, при указанных температурах, выраженные в тканевых 50% цитопатических дозах (log ТЦД 50/мл). Неожиданно оказалось, что у обоих вирусов, несущих гетерологичный Nep, от штаммов A/Singapore/1/57 (H2N2) или A/Leningrad/134/47/57 (H2N2), наблюдается существенное > 4log снижение инфекционных титров при температуре 39°C, по сравнению оптимальной температурой 34°C. Контрольные штаммы – вирус дикого типа A/PR/8/34 (H1N1) и рекомбинантный вирус NS124/Nep PR8 с укороченным NS1 белком и гомологичным Nep не имели признака температурочувствительности, эффективно размножаясь при высокой температуре. Таким образом, замена Nep приводила к появлению у вирусов ts фенотипа.
Более того, при интраназальном заражении мышей под легкой анестезией указанными вирусами, взятыми в дозе 6 log/мышь, у вирусов – носителей гетерологичного гена Nep, наблюдалась сниженная способность репродукции в тканях легкого (p<0.002), по сравнению с вирусом дикого типа или вирусом NS124/Nep PR8, имеющим гомологичный Nep (Фиг.4Б). Титры вирусов в легких оценивались через 2-е суток после заражения животных путем титрования в клетках Vero осветленных гомогенатов легкого. Легочные титры выражали в log ТЦД 50/г ткани легкого. Таким образом, интродукция химерного NS геномного фрагмента в штамм вируса гриппа A/PR/8/34 (H1N1) приводила к аттенуации вируса, выражающейся в снижении его способности к размножению в нижнем респираторном тракте животных.
Пример 3
Определение ts фенотипа и аттенуации векторов, несущих химерный NS геномный фрагмент и различные вставки в рамке считывания белка NS1
Для определения влияния вставок чужеродных последовательностей в рамку считывания белка NS1 на ts фенотип вирусов, химерных по гену Nep, был получен широкий набор векторов, кодирующих вставки различной природы. Были изучены вирусы со вставками, отображенными на Фиг.3. ts-Фенотип изучался путем титрования инфекционной активности вирусов при температурах 34 и 39°C в 10-дневных куриных эмбрионах, путем определения гемагглютинирующей активности аллантоисных жидкостей, собранных через 48 часов инкубации. Титр подсчитывался методом Рида и Мюнча и выражался в log Эмбриональных 50% инфекционных доз (log ЭИД 50/мл). Как видно из данных, представленных в Таблице 2, все векторы, в отличие от вируса дикого типа A/PR/8/34 (H1N1), отличались существенно сниженной способностью к репродукции при высокой температуре и соответствовали по фенотипическому маркеру ts прототипным химерным штаммам, не имеющим вставки, но несущим гетерологичный Nep.
***
Для определения влияния вставок на аттенуацию (att) векторных штаммов для животных мышей заражали интраназально, под легкой анестезией, вируссодержащими аллантоисными жидкостями куриных эмбрионов, зараженных вирусами или векторами представленными на Фиг.3. Аллантоисные жидкости были предварительно охарактеризованы по содержанию в них инфекционных титров вирусов. Титры выражали в log ЭИД 50/ мл. Мышам вводили по 0,05 мл каждой вирусной пробы. Каждая группа мышей содержала 8 животных. В течение 12 дней оценивалась летальная активность вирусов. Оказалось, что в отличие от вируса дикого типа A/PR/8/34 (H1N1), который вызывал 50% летальный эффект при использовании материала с титром 3,2 log ЭИД 50/ мл, ни один из векторов не демонстрировал 50% летальной активности у мышей при использовании доз заражения >7,5 log. Таким образом, все векторы, c химерной природой NS геномного фрагмента, независимо от вставки, были высоко аттенуированными для мышей (Таблица 3).
Значение летальной дозы для мышей вирусов
Пример 4
Протективный ответ в отношении гетерологичных штаммов вируса гриппа А и В при контрольном заражении мышей
С целью определения протективной активности в отношении гетерологичных антигенных вариантов вируса гриппа для иммунизации мышей были использованы вирусы с поверхностными антигенами от вируса A/PR/8/34 (H1N1), несущие химерный NS геномный фрагмент с последовательностью Nep от вируса A/Leningrad/134/47/57 (H2N2). Были использованы следующие рекомбинантные вирусы, кодирующие, в рамке считывания NS1, участки субъединицы гемагглютинина НА2: 1) вектор NS124-HA2(A)-185 экспрессирующий полный эктодомен НА2 вируса гриппа А, длиною в 185 аминокислотных остатков (Фиг.3, SEQ ID NO:5), 2) вектор NS124-HA2(A)-185 экспрессирующий полный эктодомен НА2 вируса гриппа В, длиною в 186 аминокислотных остатков (Фиг.3, SEQ ID NO:8) 3) вектор NS124-Fus(A)-NP, экспрессирующий последовательность, состоящую из N – терминальных 21 аминокислотных остатков НА2 (фьюжн-домен) в комбинации с последовательностью консервативного В-клеточного эпитопа NP белка вируса гриппа А (Фиг.3, SEQ ID NO:9), и 4) вирус NS124/Nep-Len, имеющий кассету из стоп-кодонов в позиции 399 нуклеотидой последовательности NS геномного фрагмента, ограничивающую трансляцию NS1 белка 124 аминокислотными остатками (Фиг.3, SEQ ID NO:4). Для формирования контрольных групп использовался вирус дикого типа A/PR/8/34 (H1N1), не имеющий генетических модификаций, или мыши получали фосфатный буферный раствор, не содержащий активный ингредиент. Мыши были иммунизированы интраназально, под легкой анестезией, дозой вирусов 6,5 log/мышь, однократно. Через 28 дней животные были подвергнуты контрольному заражению патогенными для мышей гетерологичными штаммами вируса гриппа: A/Mississippi/85/1(H3N2) или В/Lee/40, взятыми в дозе, соответствующей 3-5 ЛД50, соответственно.
Как видно из Фиг.5А, контрольное заражение не иммунных мышей вирусом (H3N2) приводило к их гибели в 80% случаев. В тоже время, мыши, иммунизированные вирусными препаратами, были в полностью защищены от гибели, вызываемой инфекцией гетерологичным штаммом вируса гриппа А (H3N2). Иммунизация вирусом дикого типа также приводила к статистически достоверному уровню защиты от инфекции гетерологичным штаммом. При использовании для контрольного заражения вируса гриппа В/Lee/40, иммунизация мышей вирусом дикого типа A/PR/8/34 (H1N1) не приводила к защите животных от гибели наряду с мышами, получившими при иммунизации фосфатный буферный раствор (Фиг.5Б). Неожиданно, рекомбинантные вирусы, несущие вставки в рамке считывания белка NS1, оказались протективными по отношению к вирусу гриппа В. При этом наилучшим показателем протективности отличался вектор NS124-Fus(A)-NP. Таким образом, векторные штаммы, несущие химерный NS геномный фрагмент, при однократной интраназальной иммунизации мышей, проявили признаки универсальной гриппозной вакцины, эффективной в отношении как гетерологичных антигенных подтипов вируса гриппа А, так и в отношении вируса гриппа В.
Пример 5
Онколитический эффект гриппозного вектора, кодирующего микобактериальный белок Esat6
С целью определения онколитического потенциала аттенуированных гриппозных векторов, несущих химерный NS геномный фрагмент с гетерологичным геном Nep, вирусы были использованы для терапии меланомы мышей, индуцированной путем введением 106 клеток В16 в объеме 30 мкл в подкожное пространство правой задней стопы. Использовалось 10 животных на группу. Терапия проводилась на 5 день после введения опухолевых клеток путем инъекции 30 мкл вирусного препарата или фосфатного буферного раствора непосредственно в зону опухолевого роста. Инъекции проводились 4 раза каждый третий день, после чего оценивались скорость увеличения объема пораженной стопы и выживаемость животных на протяжении 85 дней. Животные с опухолями, достигшими 2000 мм3, усыплялись по этическим соображениям и считались погибшими.
Для лечения меланомы был использован вектор, экспрессирующий микобактериальный антиген Esat6 в дизайне, предусматривающим, 2A опосредованное посттрансляционное отщепление белка Esat-6 от C- терминальной части укороченного NS1 белка вируса гриппа 9)NS124-2A-Esat6 (Фиг.3, SEQ ID NO:12). В качестве контрольного терапевтического агента использовался вирус NS124/Nep-Len, не имеющий вставки микобактериального белка.
На Фиг.6А представлены результаты измерения объема стопы на 19 день после введения опухолевых клеток. Неожиданно оказалось, что наименьшим средним объемом обладали стопы мышей, получавших терапию вектором, экспрессирующим белок Esat6. Этот результат оказался в корреляции с выживаемостью мышей на протяжении длительного срока наблюдения 85 дней. (Фиг.6Б). 3 из 10 животных группы NS124-2A-Esat6 оказались в стадии ремиссии опухолевого роста, в то время как животные в других группах погибли к 60 дню. Таким образом, полученные данные свидетельствуют о преимуществе онколитического вектора, кодирующего бактериальный антиген.
Пример 6
Состав вакцины на основе гриппозного вектора для интраназальной иммунизации
Фармацевтическая композиция, где буферный стабилизирующий раствор содержит 0,9 масс.% раствора хлорида натрия, 0,5 масс.% L-карнозина, 2,5 масс.% сахарозы, 1 масс.% рекомбинантного альбумина, 1 масс.% L-аргинина и 3 масс.% гидроксиэтилированного крахмала 130/0,4 (молекулярная масса – 130 кДа, степень молярного замещения 0,4).
Пример 7
Состав вакцины на основе гриппозного вектора для онколитических целей
Фармацевтическая композиция, где буферный стабилизирующий раствор содержит 1,35 масс.% раствора хлорида натрия, 0,5 масс.% L-карнозина, 1 масс.% рекомбинантного альбумина, 1 масс. % L-аргинина и 3 масс.% гидроксиэтилированного крахмала 130/0,4 (молекулярная масса – 130 кДа, степень молярного замещения 0,4).
| название | год | авторы | номер документа |
|---|---|---|---|
| Рекомбинантный штамм вируса гриппа A/PR8-NS124-TB10.4-2A-HspX и способ специфической профилактики туберкулеза легких с использованием вакцины мукозального применения на его основе | 2019 |
|
RU2726106C1 |
| РЕКОМБИНАНТНЫЙ ВИРУС ГРИППА, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ПРОФИЛАКТИКИ COVID-19 И ГРИППА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2022 |
|
RU2802058C1 |
| АТТЕНУИРОВАННЫЙ ГРИППОЗНЫЙ ВЕКТОР И МУКОЗАЛЬНАЯ УНИВЕРСАЛЬНАЯ ГРИППОЗНАЯ ВАКЦИНА НА ЕГО ОСНОВЕ | 2016 |
|
RU2660562C2 |
| Рекомбинантный штамм вируса гриппа A/PR8/HK-NS80E85A, экспрессирующий фрагменты антигенов ESAT-6 и Ag85A M.tuberculosis, для получения векторной вакцины против туберкулеза | 2018 |
|
RU2678175C1 |
| Рекомбинантный штамм вируса гриппа A/PR8-NS124-Luc и способ оценки поствакцинальных нейтрализующих антител с использованием биолюминесцентной детекции | 2019 |
|
RU2759054C2 |
| РЕКОМБИНАНТНЫЕ ШТАММЫ ВИРУСА ГРИППА, ЭКСПРЕССИРУЮЩИЕ МИКОБАКТЕРИАЛЬНЫЙ ПРОТЕКТИВНЫЙ АНТИГЕН ESAT-6, И ИХ ИСПОЛЬЗОВАНИЕ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2005 |
|
RU2318872C2 |
| РЕКОМБИНАНТНЫЕ ВИРУСЫ ГРИППА А | 2001 |
|
RU2280690C2 |
| АТТЕНУИРОВАННЫЕ ВИРУСЫ С МИНУС-ЦЕПЬЮ С ИЗМЕНЕННОЙ АНТАГОНИСТИЧЕСКОЙ В ОТНОШЕНИИ ИНТЕРФЕРОНА АКТИВНОСТЬЮ ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ВАКЦИН И ФАРМАЦЕВТИЧЕСКИХ ВЕЩЕСТВ | 1999 |
|
RU2236252C2 |
| Рекомбинантный вакцинный штамм для живой интраназальной вакцины, обеспечивающей сочетанную профилактику гриппозной и коронавирусной инфекций | 2022 |
|
RU2782531C1 |
| Штамм вируса гриппа ИнфлюБакт-H7/PspA для производства комбинированной вакцины против вируса гриппа А и бактериальной пневмонии, вызываемой Streptococcus pneumoniae | 2021 |
|
RU2776196C1 |


Изобретения относятся к области медицины и вирусологии. Представлены аттенуированные вирусы гриппа А, векторы на их основе и содержащие их фармацевтические композиции. Охарактеризованный аттенуированный вирус гриппа А, индуцирующий кросс-протективный ответ против вируса гриппа А и В, содержит химерный NS фрагмент, включающий укороченную рамку считывания белка NS1 и гетерологичную последовательность гена белка Nep, происходящую от подтипа вируса гриппа А, отличающегося от подтипа указанного аттенуированного вируса гриппа А. Изобретения могут применяться для профилактики и/или лечения инфекционных заболеваний, в частности гриппа, а также для лечения онкологических заболеваний.12 н. и 36 з.п. ф-лы, 6 ил., 3 табл., 7 пр.
1. Аттенуированный вирус гриппа А, индуцирующий кросс-протективный ответ против вируса гриппа А и В, содержащий химерный NS фрагмент, включающий укороченную рамку считывания белка NS1 и гетерологичную последовательность гена белка Nep, происходящую от подтипа вируса гриппа А, отличающегося от подтипа указанного аттенуированного вируса гриппа А, где указанная укороченная рамка считывания кодирует белок NS1 размером 80-130 аминокислотных остатков.
2. Аттенуированный вирус гриппа по п. 1, где указанная укороченная рамка считывания кодирует белок NS1 размером 124 аминокислотных остатков.
3. Аттенуированный вирус гриппа по п. 1 или 2, в котором указанная укороченная рамка считывания белка NS1 происходит от вируса гриппа подтипа H1N1, а гетерологичная последовательность гена белка Nep происходит от вируса гриппа подтипа H2N2.
4. Аттенуированный вирус гриппа А, индуцирующий кросс-протективный ответ против вируса гриппа А и В, содержащий химерный NS фрагмент, включающий укороченную рамку считывания белка NS1 и гетерологичную последовательность гена белка Nep, причем указанная укороченная рамка считывания белка NS1 происходит от вируса гриппа подтипа H1N1, а гетерологичная последовательность гена белка Nep происходит от вируса гриппа подтипа H2N2, и где указанная укороченная рамка считывания кодирует белок NS1 размером 124 аминокислотных остатка.
5. Аттенуированный гриппозный вектор, экспрессирующий антиген или его фрагмент, выбранный из группы, состоящей из антигенов или их фрагментов патогенных бактерий, вирусов или простейших, представляющий собой аттенуированный вирус гриппа А по любому из пп. 1-4, в котором укороченная рамка считывания гена белка NS1 продолжена вставкой последовательности по меньшей мере одного трансгена, кодирующего антиген или его фрагмент патогенных бактерий, вирусов или простейших.
6. Аттенуированный гриппозный вектор по п. 5, где антиген или его фрагмент выбран из группы, состоящей из антигенов вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, вируса герпеса, респираторно-синтициального вируса, вируса иммунодефицита человека, гепатита С, малярийного плазмодия, трихомонады, трипаносомы, лейшмании, хламидий, возбудителя бруцеллеза или их комбинаций.
7. Аттенуированный гриппозный вектор по п. 5 или 6, где размер антигена или его фрагмента составляет от 10 до 400 а.к.
8. Аттенуированный гриппозный вектор по п. 5 или 6, где вставка кодирует участок белка НА вируса гриппа.
9. Аттенуированный гриппозный вектор по п. 8, где участок белка НА представляет собой участок субъединицы НА2, выбранный из группы, состоящей из 1-185 а.к. из вируса гриппа А, 1-186 а.к. из вируса гриппа В, 23-185 а.к. из вируса гриппа А или 65-222 а.к. из вируса гриппа А.
10. Аттенуированный гриппозный вектор по п. 5 или 6, где вставка кодирует последовательность участка субъединицы НА2 вируса гриппа А или вируса гриппа В от 1 до 21 а.к. и последовательность участка белка NP вируса гриппа А от 243 до 251 а.к.
11. Аттенуированный гриппозный вектор по п. 5 или 6, где вставка кодирует белок микобактерии туберкулеза ESAT-6, Ag85A, Ag85 В, Mpt64, HspX, Mtb8.4 или 10.4 или их фрагменты.
12. Аттенуированный гриппозный вектор по п. 11, где геномная последовательность вируса дополнительно содержит последовательность, кодирующую саморасщепляющийся 2А-пептид, между последовательностями, кодирующими NS1-124 и ESAT6.
13. Аттенуированный гриппозный вектор, экспрессирующий антиген или его фрагмент вируса гриппа, представляющий собой аттенуированный вирус гриппа по п. 4, в котором укороченная рамка считывания гена белка NS1 продолжена вставкой последовательности, кодирующей 1-21 а.к. белка НА2 вируса гриппа В и 243-251 а.к. белка NP вируса гриппа А.
14. Аттенуированный гриппозный вектор, обладающий онколитической активностью, представляющий собой аттенуированный вирус гриппа А по любому из пп. 1-4, в котором укороченная рамка считывания гена белка NS1 продолжена вставкой последовательности по меньшей мере одного трансгена, кодирующего антиген или его фрагмент патогенных бактерий, вирусов или простейших.
15. Аттенуированный гриппозный вектор по п. 14, где антиген или его фрагмент выбран из группы, состоящей из антигенов или их фрагментов вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, вируса герпеса, респираторно-синтициального вируса, вируса иммунодефицита человека, гепатита С, малярийного плазмодия, трихомонады, трипаносомы, лейшмании, хламидий или их комбинаций.
16. Аттенуированный гриппозный вектор по п. 14 или 15, где размер антигена или его фрагмента составляет от 10 до 400 а.к.
17. Аттенуированный гриппозный вектор по п. 14 или 15, где вставка кодирует белок микобактерии туберкулеза ESAT-6, Ag85A, Ag85 В, Mpt64, HspX, Mtb8.4 или 10.4 или их фрагменты.
18. Аттенуированный гриппозный вектор по п. 17, в котором укороченная рамка считывания гена белка NS1 продолжена вставкой последовательности, кодирующей белок микобактерии туберкулеза ESAT-6.
19. Аттенуированный гриппозный вектор по п. 17, в котором укороченная рамка считывания гена белка NS1 продолжена вставкой последовательности, кодирующей саморасщепляющийся 2А-пептид, и последовательности, кодирующей белок микобактерии туберкулеза ESAT-6.
20. Фармацевтическая композиция для лечения и/или профилактики инфекционного заболевания у субъекта, содержащая в эффективном количестве аттенуированный гриппозный вектор по любому из пп. 5-13 и фармацевтически приемлемый носитель.
21. Фармацевтическая композиция по п. 20, содержащая 6-9,5 log ЭИД 50/мл аттенуированного гриппозного вектора по любому из пп. 6-14 и буферный раствор, содержащий 0-1,5 масс. % моновалентной соли, 0-5 масс. % L-карнозина, 0-5 масс. % углеводного компонента, 0-2 масс. % белкового компонента, 0-2 масс. % аминокислотного компонента и 0-10 масс. % гидроксиэтилированного крахмала.
22. Фармацевтическая композиция по п. 21, где буферный раствор содержит 0,5-1,5 масс. % моновалентной соли, 0,01-5 масс. % L-карнозина, 1-5 масс. % углеводного компонента, 0,1-2 масс. % белкового компонента, 0,01-2 масс. % аминокислотного компонента и 1-10 масс. % гидроксиэтилированного крахмала.
23. Фармацевтическая композиция по п. 22, где моновалентная соль представляет собой хлорид натрия, углеводный компонент представляет собой сахарозу, трегалозу или лактозу, белковый компонент представляет собой человеческий рекомбинантный альбумин, казитон, гидролизат лактальбумина или желатин, аминокислотный компонент представляет собой аргинин, глицин или глутамат натрия.
24. Фармацевтическая композиция по п. 20, где инфекционное заболевание вызывается патогеном, выбранным из группы, состоящей из вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, вируса простого герпеса 1 и 2 типов, респираторно-синтициального вируса, вируса иммунодефицита человека, вируса гепатита С, малярийного плазмодия, трихомонады, хламидии, трипаносомы, лейшмании или возбудителя бруцеллеза.
25. Фармацевтическая композиция по любому из пп. 20-23, где субъект представляет собой млекопитающее или птицу.
26. Фармацевтическая композиция по п. 25, где субъект представляет собой человека.
27. Вакцина против инфекционного заболевания, содержащая в эффективном количестве аттенуированный гриппозный вектор по любому из пп. 6-14 и фармацевтически приемлемый носитель.
28. Вакцина по п. 27, содержащая 6-9,5 log ЭИД 50/мл аттенуированного гриппозного вектора по любому из пп. 5-13 и буферный раствор, содержащий 0-1,5 масс. % моновалентной соли, 0-5 масс. % L-карнозина, 0-5 масс. % углеводного компонента, 0-2 масс. % белкового компонента, 0-2 масс. % аминокислотного компонента и 0-10 масс. % гидроксиэтилированного крахмала.
29. Вакцина по п. 28, где буферный раствор содержит 0,5-1,5 масс. % моновалентной соли, 0,01-5 масс. % L-карнозина, 1-5 масс. % углеводного компонента, 0,1-2 масс. % белкового компонента, 0,01-2 масс. % аминокислотного компонента и 1-10 масс. % гидроксиэтилированного крахмала.
30. Вакцина по п. 29, где моновалентная соль представляет собой хлорид натрия, углеводный компонент представляет собой сахарозу, трегалозу или лактозу, белковый компонент представляет собой человеческий рекомбинантный альбумин, казитон, гидролизат лактальбумина или желатин, аминокислотный компонент представляет собой аргинин, глицин или глутамат натрия.
31. Вакцина по любому из пп. 27-30, где инфекционное заболевание вызывается патогеном, выбранным из группы, состоящей из вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, вируса простого герпеса 1 и 2 типов, респираторно-синтициального вируса, вируса иммунодефицита человека, вируса гепатита С, малярийного плазмодия, трихомонады, хламидии, трипаносомы, лейшмании или возбудителя бруцеллеза.
32. Применение аттенуированного гриппозного вектора по любому из пп. 5-13 или фармацевтической композиции по любому из пп. 20-26 для профилактики и/или лечения инфекционных заболеваний у субъекта.
33. Применение по п. 32, где инфекционное заболевание вызывается патогеном, выбранным из группы, состоящей из вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, вируса простого герпеса 1 и 2 типов, респираторно-синтициального вируса и вируса иммунодефицита человека, вируса гепатита С, малярийного плазмодия, трихомонады, хламидии, трипаносомы, лейшмании или возбудителя бруцеллеза.
34. Применение по п. 32, где субъект представляет собой млекопитающее или птицу.
35. Применение по п. 34, где субъект представляет собой человека.
36. Способ лечения и/или профилактики инфекционного заболевания у субъекта, нуждающегося в этом, включающий введение в эффективном количестве аттенуированного гриппозного вектора по любому из пп. 5-13 или фармацевтической композиции по одному из пп. 20-26 указанному субъекту.
37. Способ по п. 36, где инфекционное заболевание вызывается патогеном, выбранным из группы, состоящей из вируса гриппа А, вируса гриппа В, микобактерии туберкулеза, вируса простого герпеса 1 и 2 типов, респираторно-синтициального вируса, вируса иммунодефицита человека, малярийного плазмодия, трихомонады, трипаносомы, лейшмании или возбудителя бруцеллеза.
38. Способ по п. 36, где субъект представляет собой млекопитающее или птицу.
39. Способ по п. 38, где субъект представляет собой человека.
40. Фармацевтическая композиция для лечения онкологических заболеваний у субъекта, содержащая аттенуированный вектор по любому из пп. 14-19 в эффективном количестве и фармацевтически приемлемый носитель.
41. Фармацевтическая композиция по п. 40, содержащая 8,5-10,5 log ЭИД 50/мл аттенуированного гриппозного вектора по любому из пп. 6-14 и буферный раствор, содержащий 0-1,5 масс. % моновалентной соли, 0-5 масс. % L-карнозина, 0-5 масс. % углеводного компонента, 0-2 масс. % белкового компонента, 0-2% аминокислотного компонента и 0-10 масс. % гидроксиэтилированного крахмала.
42. Фармацевтическая композиция по п. 41, где буферный раствор содержит 0,5-1,5 масс. % раствора моновалентной соли, 0,01-5 масс. % L-карнозина, 1-5 масс. % углеводного компонента, 0,1-2 масс. % белкового компонента, 0,01-2% аминокислотного компонента и 1-10 масс. % гидроксиэтилированного крахмала.
43. Фармацевтическая композиция по п. 41 или 42, где моновалентная соль представляет собой хлорид натрия, углеводный компонент представляет собой крахмал, белковый компонент представляет собой человеческий рекомбинантный альбумин, аминокислотный компонент представляет собой аргинин.
44. Применение аттенуированного гриппозного вектора по любому из пп. 15-20 или фармацевтической композиции по любому из пп. 41-44 для лечения онкологических заболеваний у субъекта.
45. Применение по п. 44, где онкологическое заболевание выбрано из группы, состоящей из колоректального рака, кардиоэзофагеального рака, панкреатического рака, холангиоцеллюлярного рака, глиомы, глиобластомы и меланомы.
46. Способ лечения онкологических заболеваний у субъекта, нуждающегося в этом, включающий введение в эффективном количестве аттенуированного гриппозного вектора по пп. 14-19 или фармацевтической композиции по любому из пп. 40-43 указанному субъекту.
47. Способ лечения по п. 46, где введение представляет собой внутриопухолевое введение или введение в лакуну, образовавшуюся после хирургического удаления опухоли.
48. Способ по п. 46 или 47, где онкологическое заболевание выбрано из группы, состоящей из колоректального рака, кардиоэзофагеального рака, панкреатического рака, холангиоцеллюлярного рака, глиомы, глиобластомы и меланомы.
| US 20090053264 A1, 26.02.2009 | |||
| US 0007037707 B2, 02.05.2006 | |||
| US 0006800288 B2, 05.10.2004 | |||
| Видоизменение ударного приспособления | 1928 |
|
SU18174A1 |
| BORIS FERKO et al., Hyperattenuated Recombinant Influenza A Virus Nonstructural-Protein-Encoding Vectors Induce Human Immunodeficiency Virus Type 1 Nef-Specific Systemic and Mucosal Immune Responses in Mice, JOURNAL OF VIROLOGY, Oct | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Трамвайный контролер | 1925 |
|
SU8899A1 |
Авторы
Даты
2017-08-21—Публикация
2015-11-06—Подача